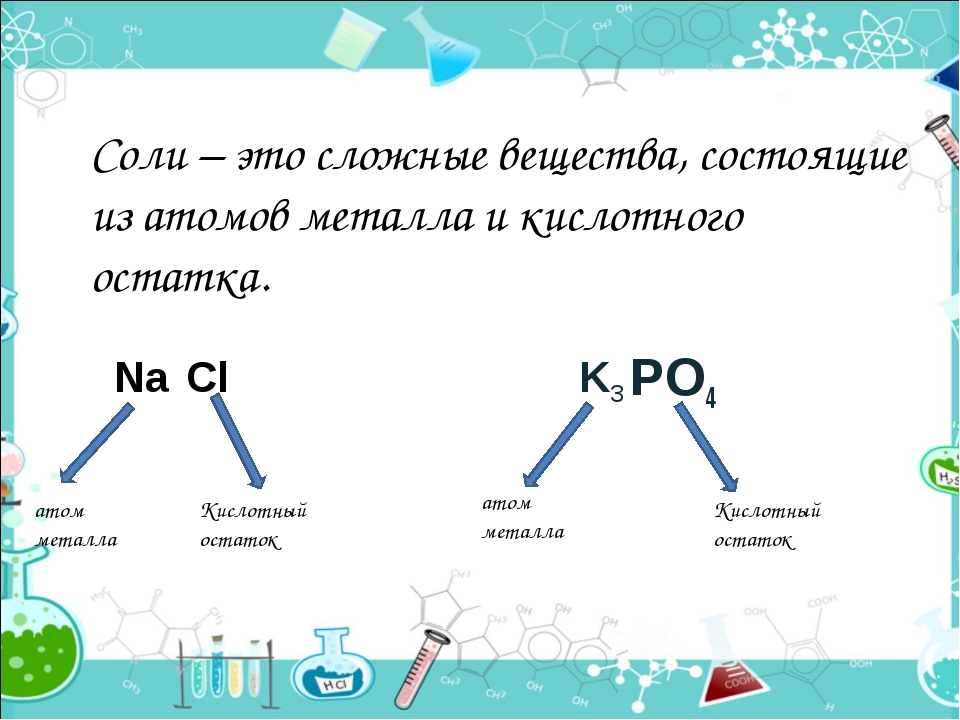
Соли средние, кислые, основные | Решаем химию: вопросы и ответы
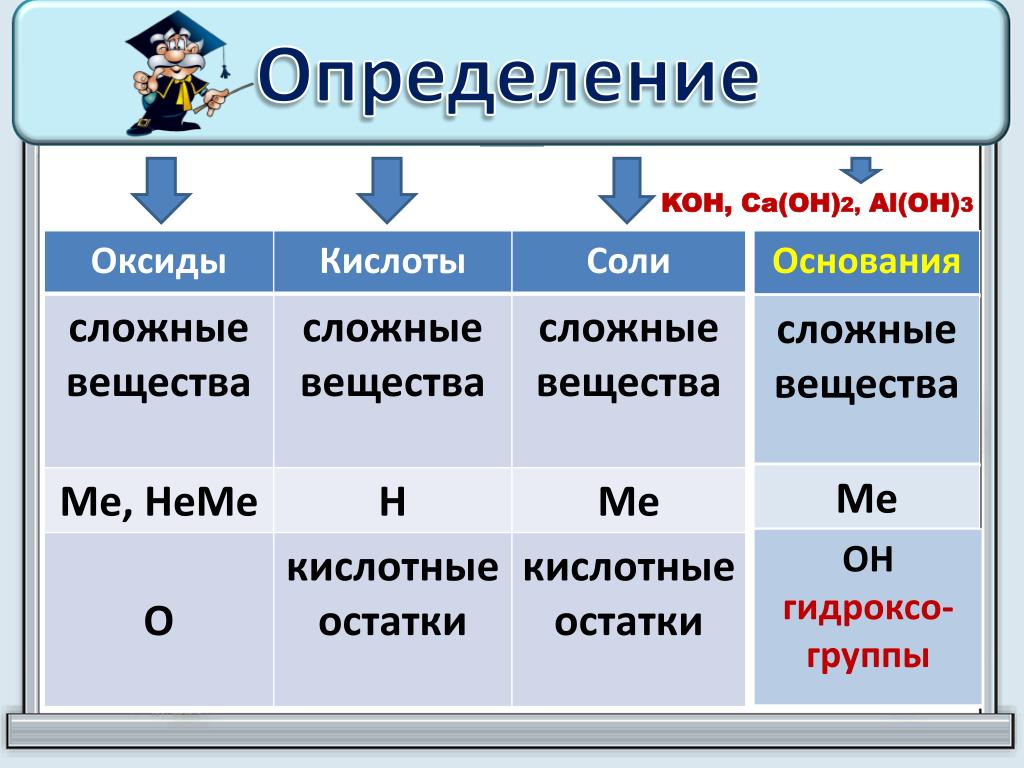
Соли встречаются в химии очень часто. Состоят они из металла и кислотного остатка, образуются чаще всего в реакции нейтрализации, то есть реакции между основанием и кислотой, хотя получить соли можно и другими способами. Изучение химии в школе предполагает знакомство со средними солями, но иногда в школьной химии встречаются кислые и основные соли. О них и пойдёт речь.
Фото: shutterstock.comФото: shutterstock.com
Классификация солей
Средние соли
Итак, средние соли образуются, когда в кислоте все атомы водорода замещены металлом. Примеры средних солей: КCl, Li2SO4, Na3PO4.
Из примеров как раз видно, что в кислотах, использованных для получения солей, все атомы водорода заместились на металл. Посмотрите, например, на фосфат натрия Na3PO4. Эта соль фосфорной кислоты h4PO4. Видно, что все три атома водорода заместились на атомы натрия.
Средние соли. Номенклатура
Здесь нет никакой сложности:
в названии используется название кислотного остатка и металл.
Примеры:
Ca(NO3)2 – нитрат кальция (нитрат – соль азотной кислоты),
MgSO4 – сульфат магния (сульфат – соль серной кислоты),
К3PO4 – фосфат калия (фосфат – соль фосфорной кислоты).
Кислые соли
Кислые соли – продукт неполного замещения атомов водорода в кислоте атомами металла. Примеры кислых солей: NaHCO3, KHSO3.
При составлении формул кислых солей важно понимать, как они образуются, иначе будет путаница с индексами. Давайте разберём это на примере гидрокарбоната натрия NaHCO3. Для начала вспомним о карбонате натрия Na2CO3. Это соль угольной кислоты Н2СО3. При образовании карбоната натрия заместились оба атома водорода на два атома натрия, то есть вместо двух атомов водорода в кислоте h3CO3 встали два атома натрия, образовав карбонат натрия Na2CO3:
в h3CO3 заместились 2 атома водорода на 2 атома натрия с образованием Na2CO3
А вот если атомов натрия не хватило, то атом натрия заместит лишь один атом водорода, второй при этом останется, то есть:
в h3CO3 заместился 1 атом водорода на 1 атом натрия с образованием NaHCO3
Обратите внимание, что все валентности учтены! Это важно! Вы знаете, что валентность кислотного остатка угольной кислоты СО3 равна II (потому что угольная кислота двухосновная, в ней два атома водорода). Валентность атома натрия I, валентность атома водорода I, поэтому и формула гидрокарбоната выглядят так: NaHCO3.
Валентность атома натрия I, валентность атома водорода I, поэтому и формула гидрокарбоната выглядят так: NaHCO3.
Чтобы назвать кислую соль правильно,
нужно к кислотному остатку добавить часть «гидро» (если в соли два атома водорода, то нужно добавить «дигидро»).
Примеры:
NaHSO3 – гидросульфит натрия (сульфит – соль сернистой кислоты h3SO3, но у нас соль кислая, поэтому добавляем «гидро»),
Na2HPO4 – гидрофосфат натрия (фосфат – соль фосфорной кислоты h4PO4, но у нас соль кислая, поэтому добавляем «гидро»),
Nah3PO4 – дигидрофосфат натрия (фосфат – соль фосфорной кислоты h4PO4, но у нас соль кислая, причём в ней два атома водорода, поэтому добавляем «дигидро»).
Запомните, что одноосновные кислоты не образуют кислых солей. Это довольно очевидно, ведь в одноосновных кислотах всего один атом водорода, и если он не заместится, то кислота так и останется кислотой, не превратившись в соль.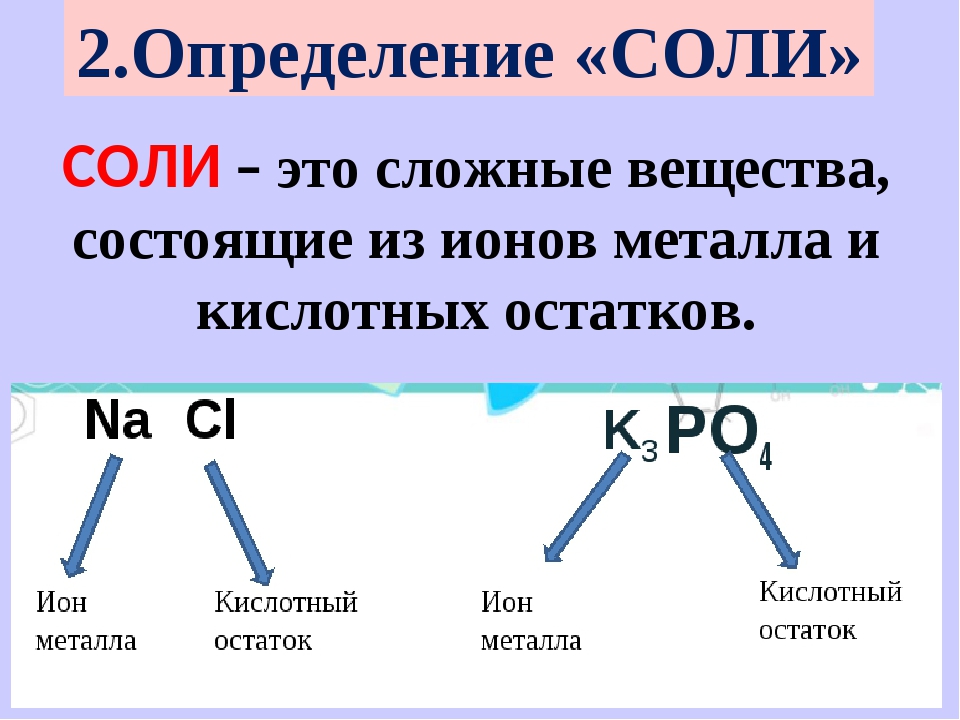 Например, в соляной кислоте (одноосновной) HCl атом водорода в любом случае должен заместиться на атом металла, иначе соли не получится.
Например, в соляной кислоте (одноосновной) HCl атом водорода в любом случае должен заместиться на атом металла, иначе соли не получится.
Основные соли
Основные соли получаются, когда не все гидроксильные группы в основании заместились кислотным остатком. Примеры основных солей: Zn(OH)Cl, Al(OH)SO4, Fe(OH)(NO3)2.
Здесь ситуация обратна той, что имеется при образовании кислых солей. Но если в кислых солях частично замещаются атомы водорода, то в основных — частично замещаются гидроксогруппы. Давайте рассмотрим это на примере гидроксохлорида цинка Zn(OH)Cl.
В гидроксиде цинка Zn(OH)2 заместились две группы ОН на два кислотных остатка соляной кислоты Cl с получением хлорида цинка ZnCl2 (средней соли).
Но бывает, что в гидроксиде цинка Zn(OH)2 заместилась одна группа ОН на один кислотный остаток соляной кислоты Cl с получением гидроксохлорида цинка Zn(ОН)Cl (средней соли).
Составление формул основных солей тоже требует внимательности. Здесь нужно учитывать число гидроксильных групп ОН и валентность кислотного остатка. Например, в Zn(OH)Cl валентность цинка II, валентность гидроксогруппы I, валентность кислотного остатка Cl – I.
Основные соли. НоменклатураЧтобы правильно назвать основную соль,
нужно к кислотному остатку прибавить «гидроксо» (если в соли две гидроксильные группы, то добавляют «дигидроксо»).
Al(OH)SO4 – гидроксосульфат алюминия (сульфат – соль серной кислоты h3SO4, но у нас соль основная, поэтому добавляем «гидроксо»),
Fe(OH)2(NO3) – дигидроксонитрат железа (III) (нитрат – соль азотной кислоты HNO3, но у нас соль основная, причём в ней две гидроксильные группы ОН, поэтому добавляем «дигидроксо»),
Mg(ОН)Cl – гидроксохлорид магния (хлорид – соль соляной кислоты HCl, но у нас основная соль, поэтому добавляем «гидроксо»).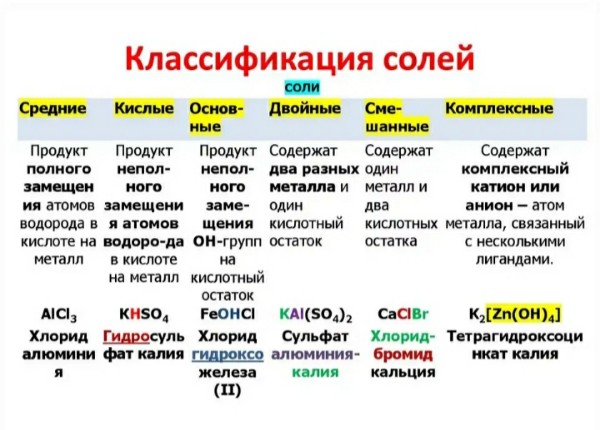
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Как добиться наилучшего результата мойки в посудомоечной машине
Содержание
Мытье посуды – не самое любимое занятие для большинства из нас. Посудомоечные машины избавляют нас от этой ежедневной рутинной работы, но всегда ли мы довольны результатом? Рекомендации, собранные в статье, помогут использовать посудомоечную машину самым эффективным образом.
Важность изучения инструкции производителя
Перед началом эксплуатации следует внимательно прочесть инструкцию. Казалось бы, очевидное правило, но тем не менее им часто пренебрегают.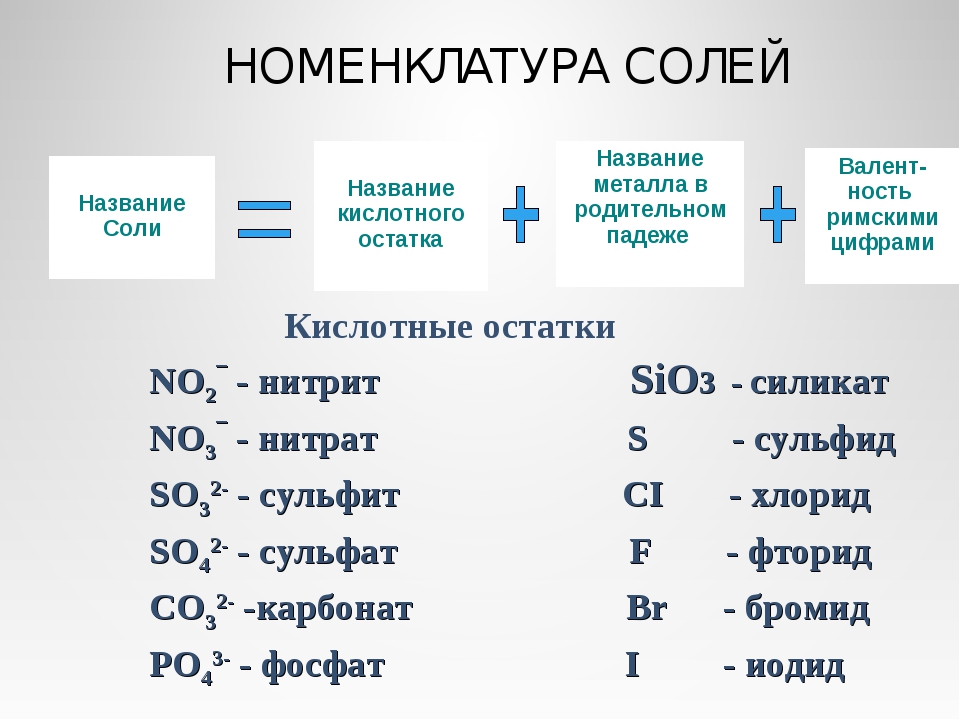 Результатом становится некачественная работа или даже поломка техники. В инструкции подробно объясняется, какую посуду и столовые приборы можно мыть в посудомоечной машине. Рекомендации производителя охватывают все аспекты использования посудомоечной машины – от ее установки до выбора моющих средств. Их соблюдение поможет добиться оптимальной работы кухонной техники и качественного мытья посуды.
Результатом становится некачественная работа или даже поломка техники. В инструкции подробно объясняется, какую посуду и столовые приборы можно мыть в посудомоечной машине. Рекомендации производителя охватывают все аспекты использования посудомоечной машины – от ее установки до выбора моющих средств. Их соблюдение поможет добиться оптимальной работы кухонной техники и качественного мытья посуды.
Размещение посуды
Чистота мытья зависит от правильности расстановки посуды внутри посудомойки. Большинство посудомоечных машин Korting оснащены тремя корзинами. Верхняя, переносная, предназначена для столовых приборов и мелких кухонных аксессуаров. В средней корзине размещают тарелки, блюдца, чашки, стаканы и другую сервировочную посуду, в нижней – большие тарелки, блюда, кастрюли, сковородки и прочую крупную утварь. Нижняя корзина может быть оборудована специальными складывающимися держателями для равномерного распределения предметов.
Подготовка посуды
Обязательное правило – предварительная очистка от крупных остатков пищи. Грязную и жирную утварь можно ополоснуть горячей водой. Такая подготовка защитит от засорения фильтр рециркуляции воды и облегчит работу техники, повышая качество мытья.
Правила расстановки
Правила размещения посуды внутри ПММ подробно описаны в инструкции производителя, но есть несколько общих рекомендаций. Посуда расставляется так, чтобы между поверхностями обязательно оставался зазор для свободного доступа воды. Сначала загружается нижняя корзина, затем верхняя. Чашки и стаканы ставятся на специальные держатели вверх дном, тарелки и блюдца разворачиваются углублением к центру корзины. Большие тарелки ставятся по краям, мелкие – ближе к центру. Кастрюли, сковородки, глубокие миски переворачиваются вверх дном и ставятся под углом. Противни ставят боком, чтобы вода могла проникнуть в верхнюю корзину. Столовые приборы рекомендуется равномерно распределять по всей площади корзины. Особого внимания требуют хрупкие стеклянные бокалы, они не должны соприкасаться с другими предметами. Большинство моделей Korting оснащено специальной корзиной, в которой надежно фиксируется до 6 бокалов. Это облегчает их размещение и позволяет качественно отмыть, не опасаясь за сохранность.
Столовые приборы рекомендуется равномерно распределять по всей площади корзины. Особого внимания требуют хрупкие стеклянные бокалы, они не должны соприкасаться с другими предметами. Большинство моделей Korting оснащено специальной корзиной, в которой надежно фиксируется до 6 бокалов. Это облегчает их размещение и позволяет качественно отмыть, не опасаясь за сохранность.
Определение жесткости воды
Жесткость воды определяется количеством растворенных в ней солей металлов, в основном магния и кальция. Чем больше солей, тем выше показатели жесткости. Избыток примесей вызывает появление накипи на нагревательном элементе и снижает качество мытья. В комплект поставки ПММ Korting входят специальные полоски-маркеры, определяющие показатели жесткости. После их выявления нужно выставить требуемый уровень на приборе посудомоечной машины.
Выбор бытовой химии
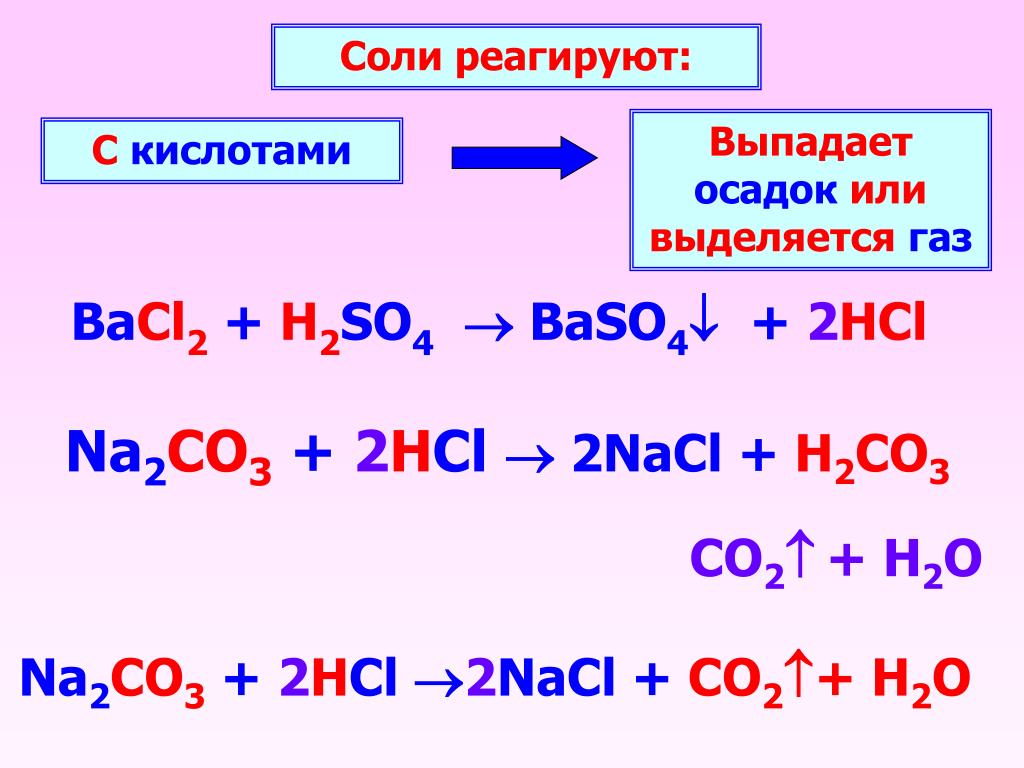
В посудомоечной машине можно использовать только специализированные моющие средства.
Регенерирующая соль
Она необходима для смягчения жесткой воды, которая снижает эффективность моющего средства, вызывает появление накипи и оставляет разводы на чистой посуде. Поэтому вода в посудомойку подается через специальный фильтр, заполненный смягчающей смолой. Регенерирующая соль необходима для восстановления свойств этого фильтра. Расход соли на цикл мытья зависит от уровня жесткости, поэтому необходимо обратить внимание на настройки потребления соли и выставить подходящий уровень.
Моющее средство
Современный рынок предлагает большой выбор специальной химии для ПММ в разных формах – таблетки, порошки, гели. Многослойные таблетки содержат все три типа средств, необходимых для мытья посуды, а также дополнительные компоненты – для улучшения качества сушки стекла, для защиты уплотнителей от высыхания и другие.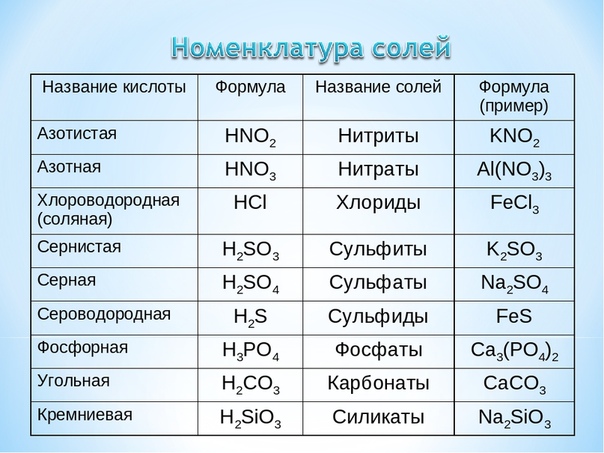
Ополаскиватель
Ополаскиватель ускоряет скатывание воды с чистой посуды, предотвращая образование следов от высохших капель. Его наливают в специальную емкость на дверце машины, откуда он подается в воду для последнего ополаскивания. Благодаря его применению значительно улучшается процесс сушки посуды.
Уход за посудомоечной машиной
Процесс мытья – это серьезная нагрузка для посудомоечной машины. Примеси в жесткой воде, высокая температура, остатки пищи подвергают механизм испытаниям. Поэтому эта кухонная техника нуждается в регулярном уходе. После каждого цикла желательно протереть стенки камеры сухой салфеткой, или оставить ее просохнуть с открытой дверцей. Периодически необходимо извлекать со дна камеры сетчатый фильтр и тщательно промывать его под струей воды. Два-три раза в год нужно проводить полную чистку с использованием специальных средств.
Периодически необходимо извлекать со дна камеры сетчатый фильтр и тщательно промывать его под струей воды. Два-три раза в год нужно проводить полную чистку с использованием специальных средств.
Выполнение несложных рекомендаций обеспечит долгую и эффективную работу посудомоечной машины. Компания Korting предлагает большой выбор посудомоечных машин разных параметров, отличающихся высокой надежностью и стильным дизайном. Кроме этого, бренд выпускает таблетки для мытья и средства для ухода за посудомойкой.
|
|
| |||||||||
Salt Analysis — Introduction, Shortcuts to Identify Ions and FAQ
Разделение различных анионов и катионов и их идентификация в неорганических солях известно как солевой анализ. Этот процесс известен под разными названиями, такими как качественный анализ неорганических солей или систематический качественный анализ. Неорганические соли разделяются на разные ионы с помощью различных видов экспериментов, проводимых в лабораторных условиях, и подвергая соединения различным различным тестам, которые подтверждают, присутствуют ли определенные ионы в растворе.
Этот процесс известен под разными названиями, такими как качественный анализ неорганических солей или систематический качественный анализ. Неорганические соли разделяются на разные ионы с помощью различных видов экспериментов, проводимых в лабораторных условиях, и подвергая соединения различным различным тестам, которые подтверждают, присутствуют ли определенные ионы в растворе.
Как для теоретических, так и для практических экзаменов, в 12 классе химический анализ практических солей является очень важной темой. Если до сегодняшнего дня вас мучили такие вопросы, как «как провести эксперимент с анализом соли, класс 12», продолжайте читать эту статью, чтобы получить все ответы.
Пошаговое руководство для анализа солей
Приобретите значительное количество соли, с которой вы хотите провести эксперимент.
Попытайтесь выяснить, какая анионная группа присутствует внутри соли.
 Для большей части этого эксперимента найти более широкую группу ионов легче, потому что для групп существует общий реагент, относительно которого получается положительный результат теста.
Для большей части этого эксперимента найти более широкую группу ионов легче, потому что для групп существует общий реагент, относительно которого получается положительный результат теста.Как только вы найдете группу, возьмите каждый анион из этой группы и выполните тесты на положительность.
Проделайте тот же групповой эксперимент для катионов, что и для анионов.
Как только вы найдете группу, возьмите каждый катион этой группы и выполните тесты на положительность.
Когда и катион, и анион получены и идентифицированы, составьте химическую формулу, учитывая валентности каждого иона.Например, если найденный катион — это Fe3 +, а найденный анион — это Cl-, то конечным результатом неорганической соли будет FeCl3.
Не обязательно сначала находить анионы.
 Порядок нахождения каждого иона также можно поменять местами.
Порядок нахождения каждого иона также можно поменять местами.
Формат образца ответа
Ниже мы приводим таблицу, которая поможет вам с легкостью провести и записать любой практический эксперимент, относящийся к классу 12 солевого анализа.
Цель: разделить и идентифицировать катион и анион, присутствующие в данной неорганической соли.
Необходимый прибор: Выполняется учениками.
Процедура:
1. Тест на анионную группу — предварительный
2. Окончательный тест на анионную группу — подтверждающий
3. Тест на группу катионов — предварительный
4. Окончательный тест на катионную группу — подтверждающий
Быстрые пути для идентификации ионов
Есть тысячи катионов и анионов, которые существуют в природе и регулярно обнаруживаются. По этой причине ученики не могут тестировать каждого из них. Кроме того, по академическим причинам существует определенный набор популярных ионов, над которыми предлагается поэкспериментировать. Мы предлагаем здесь небольшой контрольный список и таблицу, которые помогут вам идентифицировать катионы намного легче, чем вашим сверстникам.
Кроме того, по академическим причинам существует определенный набор популярных ионов, над которыми предлагается поэкспериментировать. Мы предлагаем здесь небольшой контрольный список и таблицу, которые помогут вам идентифицировать катионы намного легче, чем вашим сверстникам.
Убедитесь, что вы правильно определили цвет катиона.
Большинство катионов выделяют определенный цвет при смешивании с другими соединениями. Если катион окрашен, вы можете пропустить промежуточные шаги и сразу перейти к подтверждающему тесту.
Цвет соли | Присутствие катионов | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Глубокий зеленый или фиолетовый | Cr3 + | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Беловато-розовый | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Темно-красный | Co2 + или HgI2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Зеленый | Fe2 + | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Коричневый или желтый | Co2 + | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Зеленый | Ni2 + | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Правильный голубой | Cu2 + | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Зеленый или синий | 7209 Не путайте, если сал т бесцветен. Если даже после этого цветного катиона не видно, переходите к предварительному тесту для определения группы катионов, а не отдельных катионов. Помните, что есть определенные катионы, которые не вступают в реакцию с определенными анионами. Например, Sr2 +, Pb2 +, Ca2 + и Ba2 + не имеют какой-либо известной неорганической соли с ионом сульфата (SO42-). Другим таким примером является ион фосфата (PO43-), который образует соли только с ионами группы 0, группы 1 и группы 2. Есть определенные соли, которые обычно задают на экзаменах в 12 классе. Pop Quiz 1
A Руководство по общим катионам для помощи в анализе соли
Имейте в виду что несколько катионов одной и той же группы должны будут пройти один и тот же предварительный тест, но пройти различные подтверждающие тесты. Справочник по общим анионам в анализе солей
Предварительные тесты (анионы и кислотные радикалы)Анализ соли на анионы включает в себя проведение предварительных тестов и групповое определение аниона соли.Если тест дает положительные результаты, необходимо провести подтверждающий тест, чтобы подтвердить, присутствует ли анион в соли или нет. Предварительные испытания (анионы группы 1) Процедура: Возьмите небольшое количество солевого раствора в пробирку и добавьте в него несколько капель серной кислоты (h3SO4).
Предварительные испытания (анионы группы 2) Процедура: Возьмите несколько капель концентрированной серной кислоты (h3SO4) в пробирку и добавьте к ней небольшое количество соли.
Предварительные тесты (анионы 3-й группы) Важно отметить, что для анионов 3-й группы нет каких-либо заметных предварительных тестов. Это фосфатные и сульфатные ионные группы, и если положительные результаты не получены, вы должны непосредственно провести подтверждающие тесты для них.
Анализ солей является неотъемлемой частью программы химии CBSE для класса 12. Чтобы узнать больше о предварительных тестах на катионы, основные радикалы и неорганические соли, ознакомьтесь с нашим диапазоном интересных учебных материалов и содержания имеется на сайте.Загрузите наше приложение Vedantu и зарегистрируйтесь для участия в наших бесплатных демо-классах. Анализ соли, определение содержания соли в пищевых продуктах в Campden BRIВведение В 2003 г. Речь идет о натриевой части соли (хлорид натрия), которая, как считается, ответственна за неблагоприятное воздействие на здоровье. Многие компании переоценили содержание натрия и соли в своих продуктах питания в результате деятельности FSA, и теперь многие продукты маркируются как содержащие меньше соли, чем раньше. Законодательство о маркировке пищевых продуктов требует, чтобы соль указывалась в списке ингредиентов, в которых она используется. Новый Регламент информации о пищевых продуктах ужесточает требования к маркировке продуктов с содержанием соли. Кроме того, существуют определенные ограничения на использование заявлений о натрии, таких как «с низким содержанием натрия» и «с пониженным содержанием натрия». Определение содержания соли в пищевых продуктахАнализ солей (с помощью определения натрия и хлоридов) — одна из многих услуг химического анализа, доступных в Campden BRI. Соль в пищевых продуктах обычно определяют аналитически одним из двух способов:
Также доступны альтернативные процедуры и оборудование, в которых используются электрохимические методы. На основании этих анализов содержание соли оценивается расчетным путем с использованием атомных масс натрия (22,99) и хлорида (35,45). Молекулярная масса хлорида натрия составляет 58,44 (то есть 22,99 + 35,45), а 58,44 грамма чистого хлорида натрия будут содержать 22,99 г натрия и 35,45 г хлорида.Эти цифры можно использовать для соотнесения уровней натрия, хлорида и соли. Например: Содержание натрия (%) x 2,54 (т.е. 58,44 / 22,99) = Эквивалентное содержание соли (%) и Содержание хлоридов (%) x 1,65 (т.е. 58,44 / 35,45) = Эквивалентное содержание соли ( %) Наличие других соединений натрия и хлоридов Ошибка в этих расчетах состоит в том, что в пище могут присутствовать соединения натрия и хлорида, кроме соли.
Компании, получающие аналитические результаты, нередко спрашивают, почему концентрации натрия и хлорида не совпадают, и это часто связано с присутствием в пище разрыхлителей или аналогичных добавок. Поэтому компаниям необходимо рассмотреть цель таких данных, прежде чем запрашивать анализ, и запросить наиболее подходящий анализ. Уровень квалификацииРезультаты раундов внешней проверки квалификации (FAPAS) с участием аналитов натрия и хлорида демонстрируют, что определение натрия более точное и точное, чем определение хлорида.Многие лаборатории очень плохо справляются с просьбой проанализировать пищу на содержание хлоридов — есть подозрение, что хлорид теряется во время анализа на стадии озоления, где он подвержен улетучиванию. Переход от одного аналита к другому В последнее время лаборатории несколько раз переходили с анализа хлоридов на анализ натрия для определения содержания натрия и эквивалентной соли. Рекомендации1. Компании должны четко представлять, какие данные им нужны — натрий, хлорид, соль или их комбинация. 2. Компании должны гарантировать, что их контрактные лаборатории используют анализы натрия для определения уровней соли и натрия, поскольку это, вероятно, даст более значимые результаты, чем оценки содержания натрия по уровням хлоридов. 3. Компании должны знать, что не весь натрий может быть получен из соли и что другие ингредиенты могут содержать натрий. То же самое и с хлоридом. 4. Хлорид может быть лучшим средством оценки одной только соли, если присутствуют другие соединения натрия, но анализ хлоридов менее точен, чем анализ натрия. Анализ соли: Центральная таможенная лаборатория Соли незаменимы в нашей жизни. [Давайте попробуем сжечь основные ингредиенты солей:]Давайте сожжем натрий и калий (элементы), два компонента многих солей, чтобы посмотреть, какого цвета их пламя. [Цвета пламени совершенно разные. ] Натрий горит оранжевым пламенем и калий горит розовым пламенем. Разные цвета пламени означают, что длины волн света различаются. Проверка соответствующих длин волн проясняет содержание (натрий, калий и т. Д.). Кроме того, сила света пропорциональна количеству присутствующего элемента. Другими словами, измерение интенсивности света проясняет уровень содержания элемента. [Для измерения длины волны и интенсивности света:] Для проведения такого рода измерений используется атомно-эмиссионный спектрометр с индуктивно связанной плазмой. ICP-AES используется для одновременного измерения длины волны и интенсивности пламени. Используя источники света, зависящие от элементов (длины волн), этот прибор измеряет типы и количество элементов, содержащихся в веществе. Поскольку излучается яркий свет, окно машины оснащено зеленым фильтром для защиты глаз любого, кто может заглянуть внутрь. Этот зеленый фильтр блокирует истинный цвет пламени. Однако измеренная длина волны соответствует истинному цвету горящего натрия и калия на платиновых проволоках. [Посмотрим данные измерений. ]
Соленость — обзор | Темы ScienceDirect8.2 Сенсорные эффекты соли Соленость — это один из основных вкусов соли, который также используется для изменения вкуса и усиления ее вкусовых качеств в еде и напитках. Классический соленый вкус также придает хлорид лития (LiCl) и некоторые другие неорганические соли. Химически кажется, что катионы вызывают соленый привкус, а анионы видоизменяют его. Тем не менее, калий и другие щелочноземельные катионы вызывают как соленый, так и горький вкус. Среди анионов, обычно встречающихся в пище и напитках, ион хлорида не влияет на вкус и наименее подавляет соленый вкус, в то время как анион цитрата более подавляет, чем анионы ортофосфата (Lindsay, 1996).
На практике большинство или все эти атрибуты перекрываются в процессе восприятия, и поэтому очень трудно оценивать их по отдельности и независимо. В пикантных закусочных продуктах, таких как картофельные чипсы и аналогичные продукты, которые потребляются в первую очередь для удовольствия, а не из-за их пищевой ценности, вкус соли, по-видимому, является одной из ключевых сенсорных характеристик, определяющих принятие потребителями. Было обнаружено, что проанализированное содержание соли коррелирует с общим приемом сыров Эдам с пониженным содержанием жира и полножирных сыров типа Эмменталь в финском исследовании, целью которого было установить связь между сенсорными характеристиками и предпочтениями потребителей в сырах с различным содержанием жира (Ritvanen et al. Как и следовало ожидать, сенсорная соленость оказалась сильно коррелированной с содержанием соли в исследовании с участием 14 различных сухих ферментированных колбас из баранины в Норвегии (Helgesen and Naes, 1995). Уровень засоления имеет решающее значение для получения удовлетворительного продукта при производстве квашеной капусты (Binstead et al., 1971). Помимо облегчения и обеспечения желаемого брожения, соль помогает поддерживать хрустящую текстуру капусты за счет удаления воды из овоща и ингибирования эндогенных пектолитических ферментов, которые в противном случае вызывают размягчение продукта. Соль играет роль усиления вкуса в категории продуктов, таких как готовые к употреблению сухие завтраки, поскольку соленый вкус обычно не ощущается во вкусе.В таблице 8.2 указано заявленное содержание соли в некоторых популярных в Великобритании сухих завтраках, которые содержат добавленную соль. Для некоторых из них на самом деле существуют версии, в которых нет «добавленной соли». Таблица 8.2. Содержание соли в некоторых популярных в Великобритании сухих завтраках, которые содержат добавленную соль
В консервированных пищевых продуктах соль используется в основном в целях придания вкуса в качестве соответствующего запланированного процесса нагрева, который либо обеспечивает коммерческую стерильность, либо стабильность окружающей среды, что имеет решающее значение для микробиологической безопасности и стабильности консервированных пищевых продуктов.Следовательно, есть возможности для снижения содержания соли в консервированных продуктах. В Великобритании супермаркет Asda объявил, что к концу 2006 года все овощные консервы собственной марки не будут содержать добавок соли ( Food Quality News , 2005). Потребители, которые используют консервированные овощи без соли при приготовлении собственных блюд, вероятно, не заметят разницы, или им придется добавить соль «по вкусу», если овощи будут использоваться сами по себе. Доступен исчерпывающий обзор сенсорных эффектов соли (Hutton, 2002), который охватывает с разной степенью детализации следующие типы продуктов: суп; подливка; масло и спреды; хлеб, пирожные и булочки; печенье; выпечка; сыр; Хлопья на завтрак; макароны и лапша; мясо и мясные продукты; пикантные закуски; шоколадные кондитерские изделия; готовые блюда; и рыбные продукты. Произошла ошибка при настройке пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт. Настройка вашего браузера для приема файлов cookieСуществует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Почему этому сайту требуются файлы cookie? Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Что сохраняется в файле cookie?Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется. Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать. Определение содержания натрия и соли в образцах пищевых продуктовПищевые продукты содержат различные количества соли (NaCl), в которой 40% натрия.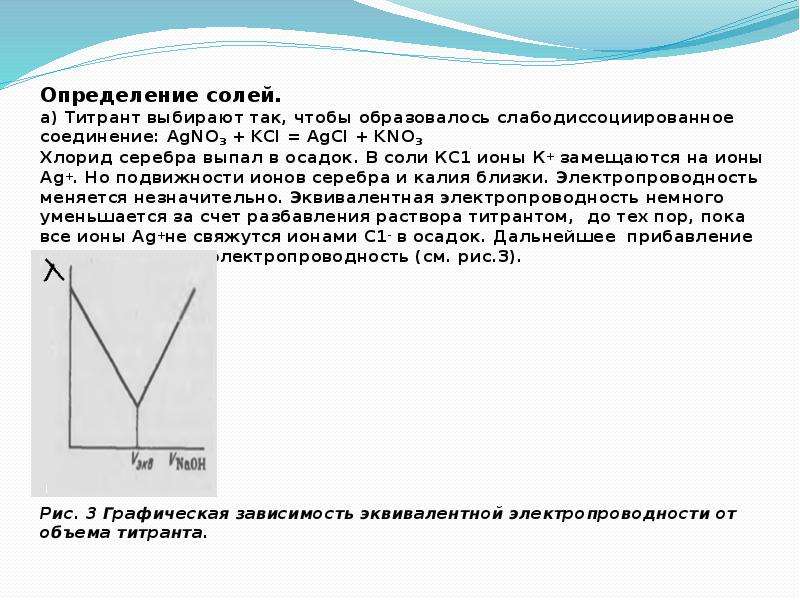 Точное определение содержания натрия в продуктах питания снижает риски для здоровья, связанные с этим. Американская кардиологическая ассоциация 1 рекомендует потреблять менее 1500 мг натрия в день для большинства взрослых американцев, что является уровнем, оказывающим наибольшее влияние на кровяное давление. Точное определение содержания натрия в продуктах питания снижает риски для здоровья, связанные с этим. Американская кардиологическая ассоциация 1 рекомендует потреблять менее 1500 мг натрия в день для большинства взрослых американцев, что является уровнем, оказывающим наибольшее влияние на кровяное давление.ВведениеБольшинство пищевых продуктов содержат натрий из растворенных солей, которые либо присутствуют в природе, либо добавляются при приготовлении пищи или переработке.Поваренная соль, известная как хлорид натрия (NaCl), является наиболее распространенным источником натрия. Он состоит из 40% натрия и 60% хлорида и часто используется в обработанных и упакованных пищевых продуктах в качестве усилителя вкуса или консерванта. Другими источниками натрия, добавляемого в пищу, являются глутамат натрия (MSG), нитрит натрия, сахарин натрия, пищевая сода (бикарбонат натрия) и бензоат натрия. (Источник: диетические рекомендации для американцев — http://health. Содержание натрия в пище влияет на наше здоровье. Натрий — важный минерал, который в небольшом количестве требуется организму для контроля артериального давления и помогает нервам и мышцам функционировать должным образом. Однако высокое потребление натрия может вызвать проблемы со здоровьем, такие как высокое кровяное давление и сердечно-сосудистые заболевания, в том числе сердце, инсульт и болезни кровеносных сосудов. Таким образом, знание содержания натрия в пище и контроль потребления чрезвычайно важны для предотвращения болезней. Для определения содержания натрия в образцах пищевых продуктов измеритель ионов натрия LAQUAtwin B-722 предлагает быстрое, простое и легкое измерение. Этот карманный измеритель имеет плоский датчик натрия, который измеряет концентрацию натрия в микрообъемных пробах, и настройку компенсации результатов (т. Е. Умножение / известный коэффициент), которые можно использовать для учета подготовки пробы (например, разбавления, холостого показания) в результатах. МетодНастройка и калибровка измерителя Перед калибровкой Подготовка и измерение образцовЖидкие образцы, такие как супы, соусы, рассолы, напитки и т. Д., Можно помещать непосредственно на датчик. Разбавьте образец дистиллированной или деионизированной водой, если результаты вышли за пределы диапазона калибровки или измерения измерителя (например, 5 мл образца разбавить до 100 мл деионизированной водой). Прочные образцы, такие как чипсы, сыр, ветчина и т. Д., должны быть готовы к высвобождению натрия. Измельчите или измельчите образец в блендере. Точно взвесьте измельченный образец, затем добавьте дистиллированную или деионизированную воду (например, 5 граммов образца в 100 мл деионизированной воды). После измерения промойте датчик моющим средством и водой (теплой, если измеряемый образец маслянистый).Если на сенсоре остались пятна от пробы, нанесите на сенсор несколько капель отбеливателя и оставьте на 5–30 минут. Промойте датчик водой и вытрите насухо мягкой тканью. Подготовьте датчик, пропитав его стандартом натрия 2000 ppm в течение от 10 минут до 1 часа перед следующим использованием. Для высокоточного измерения приготовьте раствор регулятора ионной силы (ISA), содержащий 4M Nh5Cl и 4M Nh5OH. Добавьте равный объем ISA ко всем образцам и стандартам (т. Е. 2 мл ISA в 100 мл образцов или стандартов) 2 . Результаты и преимущества Пища содержит различное количество соли. Для обработанных или упакованных пищевых продуктов натрий указан в миллиграммах (мг) на порцию на панели информации о питании на упаковке пищевых продуктов, а не в соли. Американская кардиологическая ассоциация1 рекомендует потреблять менее 1500 мг натрия в день для большинства взрослых американцев, что является уровнем, оказывающим наибольшее влияние на артериальное давление.Этот уровень не применяется к людям, которые теряют большое количество натрия с потом, например, к спортсменам, работающим в условиях сильного теплового стресса, или к тем, кто иным образом направлен их лечащим врачом. Рисунок 1: Пищевая ценность на этикетке томатного сока (Источник: содержание натрия, Medline Plus https: // www. Ссылки и рекомендуемая литература
REV 1.0, 6 ДЕКАБРЯ 2015 Качественный анализ солей — A Plus TopperКачественный анализ солейЧто такое качественный анализ?
Люди также спрашивают Изучение цвета и растворимости солей в воде
В таблице перечислены цвета некоторых распространенных солей.
В таблице показана растворимость некоторых распространенных соединения.
Пример: Предварительное исследование твердого X дало следующие наблюдения.
Раствор:
Испытание для газов
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 к. любая молекула электронейтральна:
к. любая молекула электронейтральна: Обычно ее добывают в солончаках, к числу которых относятся, например, высохшие соляные озера (рис. 1).
Обычно ее добывают в солончаках, к числу которых относятся, например, высохшие соляные озера (рис. 1). А вот фосфорная кислота способна давать две кислых соли, отщепляя поочередно по одному атому водорода: LiH2PO4, Li2HPO4.
А вот фосфорная кислота способна давать две кислых соли, отщепляя поочередно по одному атому водорода: LiH2PO4, Li2HPO4.
 Для большей части этого эксперимента найти более широкую группу ионов легче, потому что для групп существует общий реагент, относительно которого получается положительный результат теста.
Для большей части этого эксперимента найти более широкую группу ионов легче, потому что для групп существует общий реагент, относительно которого получается положительный результат теста. Порядок нахождения каждого иона также можно поменять местами.
Порядок нахождения каждого иона также можно поменять местами. Бесцветных солей присутствует больше, чем цветных. Для бесцветных солей наиболее плодотворным испытанием является испытание пламенем, которое доказывает наличие трех различных катионов. Самый эффективный способ выполнить испытание пламенем — взять щепотку данной соли и налить на нее небольшое количество концентрированной кислоты (скажем, соляной кислоты), а затем поставить на горелку.
Бесцветных солей присутствует больше, чем цветных. Для бесцветных солей наиболее плодотворным испытанием является испытание пламенем, которое доказывает наличие трех различных катионов. Самый эффективный способ выполнить испытание пламенем — взять щепотку данной соли и налить на нее небольшое количество концентрированной кислоты (скажем, соляной кислоты), а затем поставить на горелку. Например, Nh5Br и CaCl2 — две самые популярные соли, которые экзаменаторы задают студентам.Кроме того, такие соли, как карбонат кальция, имеют вид мела, который легко идентифицировать. Следовательно, даже если определить соли сложно, запоминание этих ярлыков поможет вам сэкономить много времени в экзаменационном зале.
Например, Nh5Br и CaCl2 — две самые популярные соли, которые экзаменаторы задают студентам.Кроме того, такие соли, как карбонат кальция, имеют вид мела, который легко идентифицировать. Следовательно, даже если определить соли сложно, запоминание этих ярлыков поможет вам сэкономить много времени в экзаменационном зале.
 Если вы не наблюдаете никаких изменений, вы можете провести предварительные тесты для анионов группы 2.
Если вы не наблюдаете никаких изменений, вы можете провести предварительные тесты для анионов группы 2. Если вы не заметили изменений, можно провести предварительные тесты на анионы группы 3.
Если вы не заметили изменений, можно провести предварительные тесты на анионы группы 3.

 «Соль и здоровье» — отчет Научно-консультативного комитета по питанию, который консультирует Агентство по пищевым стандартам Великобритании (FSA) и министерства здравоохранения Великобритании — рекомендовал целевые показатели по снижению потребления соли взрослыми и детьми.Это было основано на том, что высокое потребление соли может быть связано с высоким кровяным давлением, которое увеличивает риск сердечных заболеваний. В результате FSA инициировало ряд задач по снижению содержания соли в определенных группах продуктов.
«Соль и здоровье» — отчет Научно-консультативного комитета по питанию, который консультирует Агентство по пищевым стандартам Великобритании (FSA) и министерства здравоохранения Великобритании — рекомендовал целевые показатели по снижению потребления соли взрослыми и детьми.Это было основано на том, что высокое потребление соли может быть связано с высоким кровяным давлением, которое увеличивает риск сердечных заболеваний. В результате FSA инициировало ряд задач по снижению содержания соли в определенных группах продуктов. Независимо от того, сделано ли заявление относительно натрия или соли, информация о питании должна включать данные о содержании соли на сто граммов или ста миллилитров пищи.
Независимо от того, сделано ли заявление относительно натрия или соли, информация о питании должна включать данные о содержании соли на сто граммов или ста миллилитров пищи.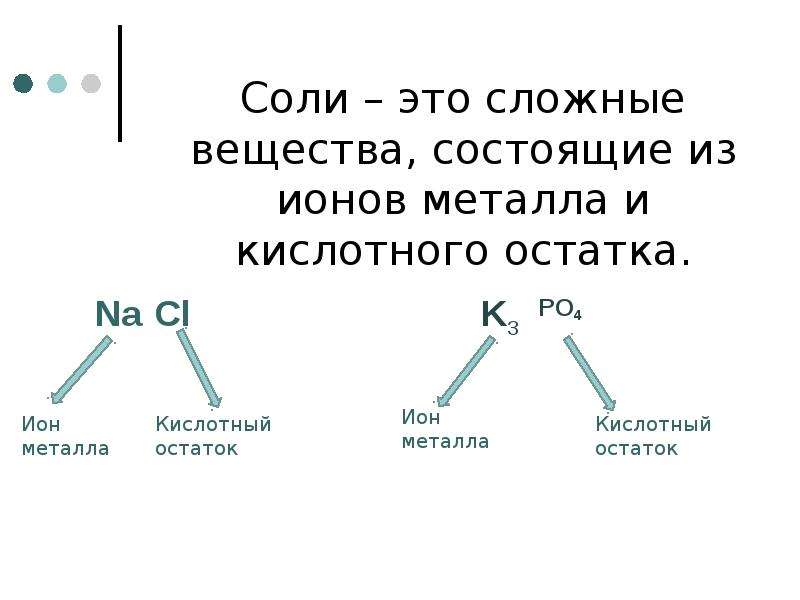
 Например, в случае натрия, бикарбонат натрия (разрыхлитель), нитрит натрия (консервант) и фосфат натрия (стабилизатор) могут все присутствовать в разумных количествах и вносить значительный вклад в содержание натрия, в то время как хлорид может присутствовать из калия. хлористый. Это важно по нескольким причинам:
Например, в случае натрия, бикарбонат натрия (разрыхлитель), нитрит натрия (консервант) и фосфат натрия (стабилизатор) могут все присутствовать в разумных количествах и вносить значительный вклад в содержание натрия, в то время как хлорид может присутствовать из калия. хлористый. Это важно по нескольким причинам:
 Это привело к тому, что очевидные уровни натрия выше ожидаемых и заявленных уровней.Как правило, это связано с тем, что натрий присутствует не из соли, как указано выше.
Это привело к тому, что очевидные уровни натрия выше ожидаемых и заявленных уровней.Как правило, это связано с тем, что натрий присутствует не из соли, как указано выше.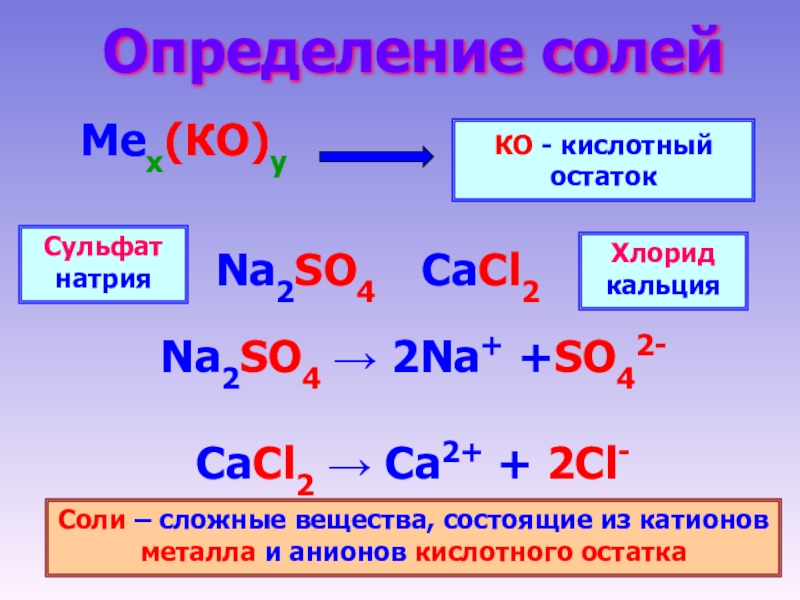 Чаще всего думают о хлориде натрия, но они также включают хлорид кальция и хлорид магния. Поскольку соли различаются по соотношению хлорида натрия к другим компонентам, важно измерить содержание хлорида натрия.
Чаще всего думают о хлориде натрия, но они также включают хлорид кальция и хлорид магния. Поскольку соли различаются по соотношению хлорида натрия к другим компонентам, важно измерить содержание хлорида натрия.

 Роль хлорида натрия в улучшении вкуса можно увидеть, когда ионы натрия были удалены из смеси аминокислот, нуклеотидов, сахаров, органических кислот и других соединений, которые, как известно, имитируют вкус крабового мяса, полученная смесь полностью отсутствовала в крабах. -подобный персонаж. Помимо этой тенденции к усилению мясного вкуса, также известно, что соль снижает сладость сахаров, чтобы придать более богатый и округлый вкус, который желателен для многих кондитерских изделий (Coultate, 2002). Сенсорные атрибуты еды или напитков обычно воспринимаются в следующем порядке (Meilgaard et al., 2000):
Роль хлорида натрия в улучшении вкуса можно увидеть, когда ионы натрия были удалены из смеси аминокислот, нуклеотидов, сахаров, органических кислот и других соединений, которые, как известно, имитируют вкус крабового мяса, полученная смесь полностью отсутствовала в крабах. -подобный персонаж. Помимо этой тенденции к усилению мясного вкуса, также известно, что соль снижает сладость сахаров, чтобы придать более богатый и округлый вкус, который желателен для многих кондитерских изделий (Coultate, 2002). Сенсорные атрибуты еды или напитков обычно воспринимаются в следующем порядке (Meilgaard et al., 2000): В исследовании, проведенном в США, изучалось моделирование потребительских предпочтений коммерческих жареных чипсов из тортильи из белой кукурузы с привлечением 80 потребителей в возрасте от 18 до 35 лет и сенсорной группы из девяти подготовленных экспертов (Meullenet, 2003). Модели пропорциональных шансов в сочетании с основными компонентами использовались для моделирования внутренних и внешних предпочтений в отношении общего признания потребителями чипсов тортильи. Исследование показало, что аромат является наиболее важным атрибутом общего принятия потребителем, за которым следует взаимодействие внешнего вида, вкуса и текстуры.Было показано, что один атрибут вкуса (соленость) и один атрибут текстуры (четкость), и в этом порядке важности, значительно способствовали увеличению общего принятия потребителем. Авторы предположили, что вкус (и соленость) были наиболее влиятельной переменной в намерении потребителей покупать чипсы из тортильи.
В исследовании, проведенном в США, изучалось моделирование потребительских предпочтений коммерческих жареных чипсов из тортильи из белой кукурузы с привлечением 80 потребителей в возрасте от 18 до 35 лет и сенсорной группы из девяти подготовленных экспертов (Meullenet, 2003). Модели пропорциональных шансов в сочетании с основными компонентами использовались для моделирования внутренних и внешних предпочтений в отношении общего признания потребителями чипсов тортильи. Исследование показало, что аромат является наиболее важным атрибутом общего принятия потребителем, за которым следует взаимодействие внешнего вида, вкуса и текстуры.Было показано, что один атрибут вкуса (соленость) и один атрибут текстуры (четкость), и в этом порядке важности, значительно способствовали увеличению общего принятия потребителем. Авторы предположили, что вкус (и соленость) были наиболее влиятельной переменной в намерении потребителей покупать чипсы из тортильи.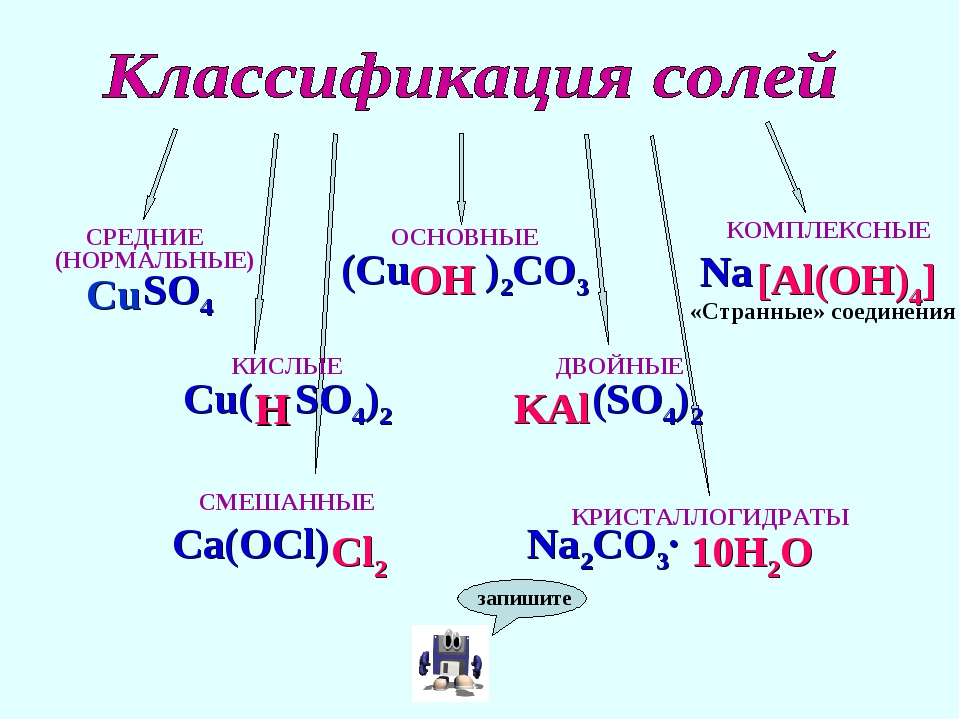 , al., 2005). Хотя результаты этого исследования нельзя обобщить, результаты действительно пролили некоторый свет на сенсорные эффекты соли в определенных типах сыра. В сырах типа Эмменталь общая привлекательность продукта достоверно коррелировала ( p <0,05) со степенью кислого и соленого вкуса. Сравнивая полножирные и обезжиренные сыры Эмменталь, было обнаружено, что содержание соли значительно коррелирует с приятным вкусом и ощущением во рту ( p <0,05) только в полножирной подгруппе, в то время как соленость значительно коррелирует с приятным ощущением во рту в обеих группах с пониженным содержанием жира. и полножирные сыры Эмменталь ( p <0.05). Авторы утверждали, что подобные результаты могут помочь выявить факторы, которые повлияют на выбор сыра.
, al., 2005). Хотя результаты этого исследования нельзя обобщить, результаты действительно пролили некоторый свет на сенсорные эффекты соли в определенных типах сыра. В сырах типа Эмменталь общая привлекательность продукта достоверно коррелировала ( p <0,05) со степенью кислого и соленого вкуса. Сравнивая полножирные и обезжиренные сыры Эмменталь, было обнаружено, что содержание соли значительно коррелирует с приятным вкусом и ощущением во рту ( p <0,05) только в полножирной подгруппе, в то время как соленость значительно коррелирует с приятным ощущением во рту в обеих группах с пониженным содержанием жира. и полножирные сыры Эмменталь ( p <0.05). Авторы утверждали, что подобные результаты могут помочь выявить факторы, которые повлияют на выбор сыра. Влажность продуктов колебалась от 34,4 до 49,6%, солесодержание от 4,1 до 7,0%, значения активности воды от 0,81 до 0,92. Колбасы с наивысшей степенью сочности имели высокое содержание воды, высокую активность воды и низкое содержание соли.По мере увеличения соли колбасы становились суше и тверже. Этот эффект на текстуру, несомненно, связан с влиянием соли на активность воды. Уровень соли в обработанном мясе с годами снижается. При их производстве использовались альтернативные соли, но хлорид калия, который оставляет горькое послевкусие, создает проблемы с рецептурой (Reddy and Marth, 1991). Основной причиной добавления соли во многие мясные продукты, конечно же, является ее консервирующий эффект.
Влажность продуктов колебалась от 34,4 до 49,6%, солесодержание от 4,1 до 7,0%, значения активности воды от 0,81 до 0,92. Колбасы с наивысшей степенью сочности имели высокое содержание воды, высокую активность воды и низкое содержание соли.По мере увеличения соли колбасы становились суше и тверже. Этот эффект на текстуру, несомненно, связан с влиянием соли на активность воды. Уровень соли в обработанном мясе с годами снижается. При их производстве использовались альтернативные соли, но хлорид калия, который оставляет горькое послевкусие, создает проблемы с рецептурой (Reddy and Marth, 1991). Основной причиной добавления соли во многие мясные продукты, конечно же, является ее консервирующий эффект. Соль также вносит свой вклад в аромат продукта. Точно так же, несмотря на развитие неферментационных технологий при производстве консервированных огурцов, традиционная молочнокислая ферментация после маринования в рассоле имеет ряд преимуществ по сравнению с более современными процессами.Ферментированные огурцы обладают вкусовыми и текстурными характеристиками, которых нет у других продуктов. Традиционное травление в рассоле — простой метод, не требующий специального оборудования и более экономичный по энергии, чем методы, основанные на прямом подкислении с последующей пастеризацией или охлаждением (Adams and Moss, 2000).
Соль также вносит свой вклад в аромат продукта. Точно так же, несмотря на развитие неферментационных технологий при производстве консервированных огурцов, традиционная молочнокислая ферментация после маринования в рассоле имеет ряд преимуществ по сравнению с более современными процессами.Ферментированные огурцы обладают вкусовыми и текстурными характеристиками, которых нет у других продуктов. Традиционное травление в рассоле — простой метод, не требующий специального оборудования и более экономичный по энергии, чем методы, основанные на прямом подкислении с последующей пастеризацией или охлаждением (Adams and Moss, 2000). Продукты на основе овса тоже не содержат добавок соли. Учитывая, что Агентство по пищевым стандартам Великобритании (FSA) считает 1,25 г соли или более на 100 г «с высоким содержанием соли» (FSA, 2005), у производителей хлопьев для завтрака есть возможность снизить содержание соли в некоторых из своих продуктов. продукты. Произойдет это или нет, будет зависеть от реакции потребителей в ходе маркетинговых исследований, поскольку ни один производитель не захочет видеть падение продаж после сокращения использования добавленной соли в своих продуктах (Brady, 2002).
Продукты на основе овса тоже не содержат добавок соли. Учитывая, что Агентство по пищевым стандартам Великобритании (FSA) считает 1,25 г соли или более на 100 г «с высоким содержанием соли» (FSA, 2005), у производителей хлопьев для завтрака есть возможность снизить содержание соли в некоторых из своих продуктов. продукты. Произойдет это или нет, будет зависеть от реакции потребителей в ходе маркетинговых исследований, поскольку ни один производитель не захочет видеть падение продаж после сокращения использования добавленной соли в своих продуктах (Brady, 2002). 0
0
 Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня. gov/dietaryguidelines/dga2005/document/html/chapter8.htm)
gov/dietaryguidelines/dga2005/document/html/chapter8.htm) . Результаты могут быть выражены в миллионных долях (ppm) или мг / л.
. Результаты могут быть выражены в миллионных долях (ppm) или мг / л. Тщательно перемешайте образец. Поместите несколько капель подготовленного образца на датчик и запишите показания. Для получения точных результатов необходимо поддерживать одинаковую температуру стандартных растворов и образцов.
Тщательно перемешайте образец. Поместите несколько капель подготовленного образца на датчик и запишите показания. Для получения точных результатов необходимо поддерживать одинаковую температуру стандартных растворов и образцов. Чтобы вычислить содержание натрия и соли (NaCl) в образцах пищевых продуктов по результатам, используйте формулы в таблице выше.
Чтобы вычислить содержание натрия и соли (NaCl) в образцах пищевых продуктов по результатам, используйте формулы в таблице выше.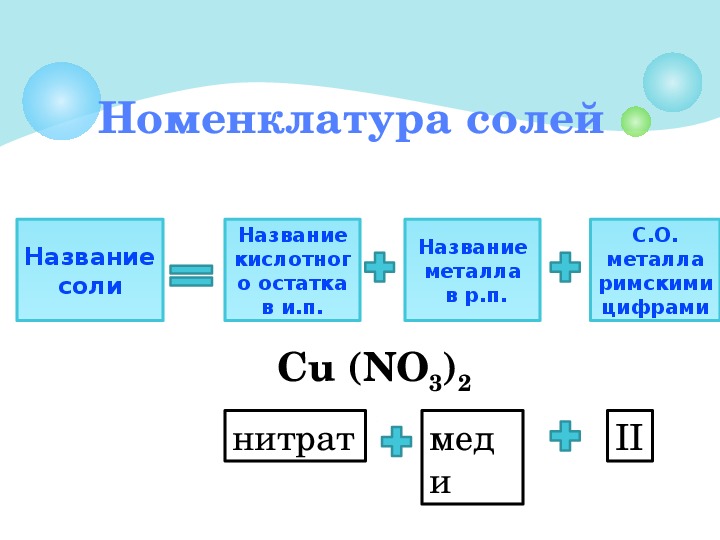 nlm.nih.gov/medlineplus/ency/imagepages/19703.htm)
nlm.nih.gov/medlineplus/ency/imagepages/19703.htm)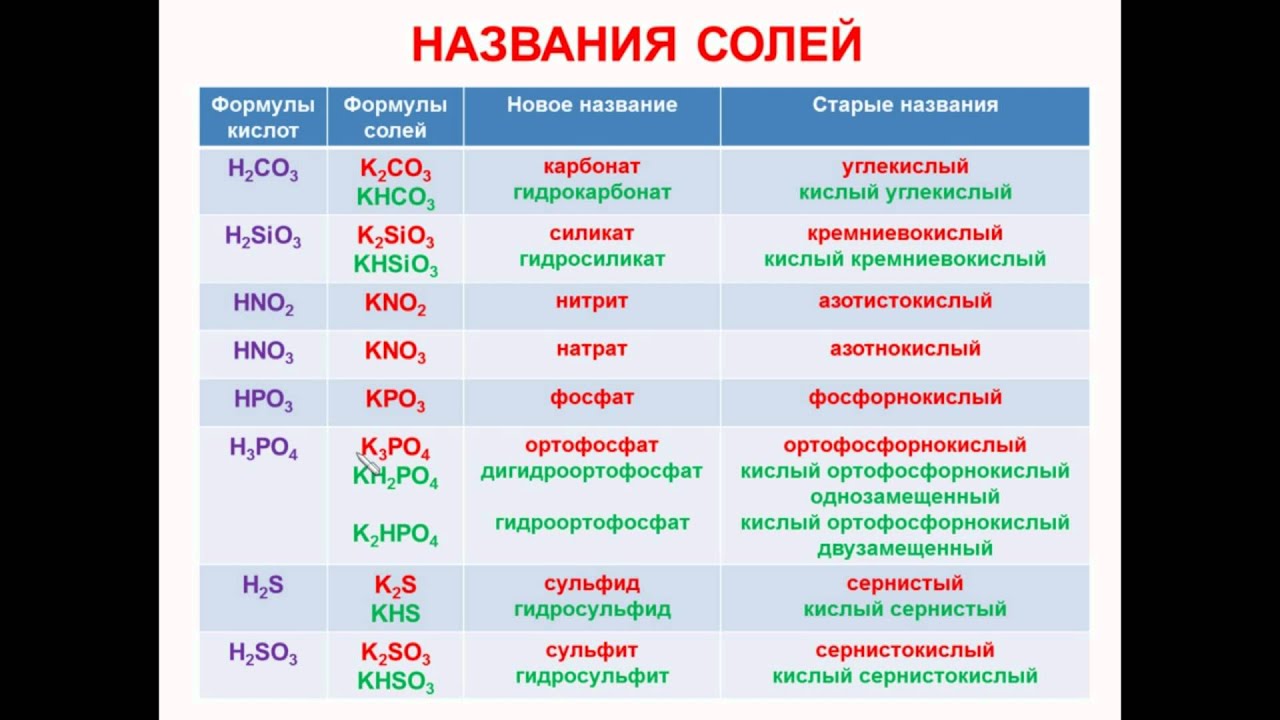
 Это потому, что возможно иметь более одной соли, обладающей одинаковыми физическими свойствами. Например:
Это потому, что возможно иметь более одной соли, обладающей одинаковыми физическими свойствами. Например: 
 Обозначьте твердый X. Объясните свой ответ.
Обозначьте твердый X. Объясните свой ответ.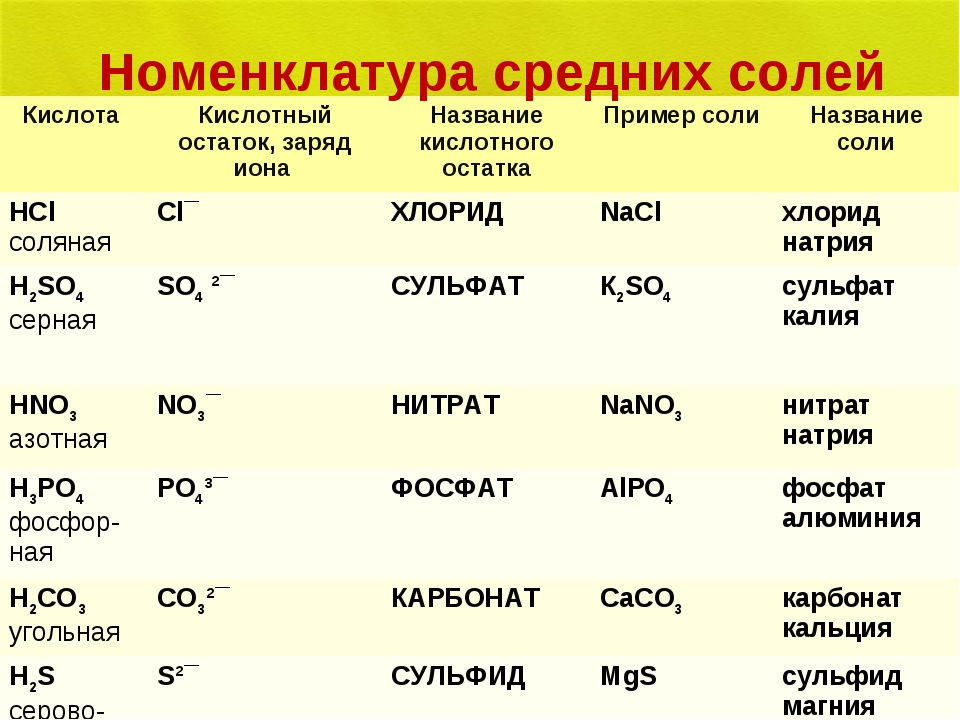
 Получается при нагревании смеси соли аммония и щелочи
Получается при нагревании смеси соли аммония и щелочи 

 ) → 2NaCl (водн.) + H 2 O (л) + SO 2 (г)
) → 2NaCl (водн.) + H 2 O (л) + SO 2 (г)