Как определить валентность и степень окисления?
Прежде, чем дать ответ на поставленный вопрос (как определить валентность и степень окисления элементов), нужно для начала разобраться с определениями понятий «валентность» и «степень окисления».
Валентность — это свойство атома химического элемента присоединять или замещать определенное число атомов другого элемента. Другими словами, это количество химических связей, которые атом данного химического элемента может образовывать с другими атомами.
Степень окисления — это величина, которая не имеет никакого физического смысла. Существует несколько определений понятия «степень окисления», однако, наиболее общее звучит следующим образом: степень окисления – это количественная оценка состояния атома химического элемента в соединении, основанная на его электроотрицательности.
Валентность химического элемента можно определить при помощи Периодической таблицы Д.И. Менделеева. Высшая валентность атома равна номеру группы, в которой он расположен, а низшая – разнице между числом восемь и номером группы.
Для углерода характерны валентности II и IV и степени окисления — 4 (), 0 (), +2 () и +4 ().
В своих соединениях азот может проявлять валентности I, II, III, IV и V и степени окисления: — 3 (), -2 (), -1 (), 0 (), +1 (), +2 (), +3 (), +4 () и +5 ().
ru.solverbook.com
Валентность и степень окисления, формулы и примеры
Валентность
Согласно обменному механизму метода валентных связей, валентность химических элементов определяется числом содержащихся в атоме неспаренных электронов. Для s- и p-элементов – это электроны внешнего уровня, для d-элементов – внешнего и предвнешнего уровней.
Значения высшей и низшей валентностей химического элемента можно определить при помощи Периодической таблицы Д.И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая – I.
Спаренные (расположенные по два на атомных орбиталях) электроны при возбуждении могут разъединяться при наличии свободных ячеек того же уровня (разъединение электронов в какой-либо уровень невозможно). Рассмотрим на примере элементов Iи II групп. Например, валентность элементов главной подгруппы I группы равна единице, так ка на внешнем уровне атомы этих элементов имеют один электрон:
3Li 1s22s1
Валентность элементов главной подгруппы II группы в основном (невозбужденном) состоянии равна нулю, так как на внешнем энергетическом уровне нет неспаренных электронов:
4Be 1s22s2
При возбуждении этих атомов спаренные s-электроны разъединяются в свободные ячейки p-подуровня этого же уровня и валентность становится равной двум (II):
Be*
Степень окисления
Для характеристики состояния элементов в соединениях введено понятие степени окисления.
Положительная степень окисления обозначает число электронов, которые смещаются от данного атома, а отрицательная – число электронов, которые смещаются к данному атому.
Из этого определения следует, что в соединениях с неполярными связями степень окисления элементов равна нулю. Примерами таких соединений могут служить молекулы, состоящие из одинаковых атомов (N2, H2, Cl2).
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому: Na+1I-1, Mg+2Cl-12, Al+3F-13, Zr+4Br-14.
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Понятие степени окисления для большинства соединений имеет условных характер, так как не отражает реальный заряд атома. Однако это понятие весьма широко используется в химии.
Большинство элементов могут проявлять разную степень окисления в соединениях. При определении их степени окисления пользуются правилом, согласно которому сумма степеней окисления элементов в электронейтральныхмолекуах равна нулю, а в сложных ионах – заряду этих ионов. В качестве примера рассчитаем степень окисления азота в соединениях состава KNO
KNO2 1+ x + 2 × (-2) = 0, x=+3.
HNO3 1+x+ x + 3 × (-2) = 0, x=+5.
Примеры решения задач
ru.solverbook.com
Задания «Степень окисления. Валентность».
СТЕПЕНЬ ОКИСЛЕНИЯ
Степень окисления (с. о.) — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все связи в молекуле ионные.
А. СТЕПЕНЬ ОКИСЛЕНИЯ В НЕОРГАНИЧЕСКИХ ВЕЩЕСТВАХ

7. Высшая степень окисления (имеет «+» значение и численно равна № группы. Исключения составляют фтор, кислород, медь, золото, элементы VIII группы А п/гр.),
8. Низшая степень окисления для неметаллов (имеет «-» значение и численно равна разности числа 8 и № группы).
Посмотрите видео «Определение степени окисления».
http://www.youtube.com/watch?v=x4wjfOexrsA
Ответь на вопросы (устно):
1. Что такое степень окисления?
2. Чему равна степень окисления свободных атомов и простых веществ?
3. Чему равна степень окисления атомов металлов в соединениях?
4. Чему равна степень окисления атома кислорода в соединениях?
6. Как найти степень окисления атома неметалла в бинарном соединении?
7. Какие соединения называются бинарными?
8. Какое значение имеет степень окисления следующих атомов: натрия, магния, кальция, алюминия, цинка, лития, бария, калия? Почему? Как называется с. о. этих элементов?
Выполните задание:
Определите степени окисления атомов в неорганических соединениях:
а) Na2S, Na3N, NaBr. MgCl2, MgS, Mg3N2. Al2S3, Al2O3.
б) N2O, NH3, NO2, N2O3, N2O5. SO3, SO2, H2S. Fe2O3, FeO.
в) H2SO4, CuSO4, H3PO4, NH4Cl, (NH4)2SO4, KMnO4.
г) N2, NF3, H2O2, OF2, O2F2.
Б. СТЕПЕНЬ ОКИСЛЕНИЯ В ОРГАНИЧЕСКИХ ВЕЩЕСТВАХ
Изучите материал видео http://www.youtube.com/watch?v=0T1WnqX0xjA&feature=youtu.be
Выполните задание:
Рассчитайте степень окисления атомов в органических соединениях:
пропан, 2-метилбутен-1, этиловый спирт, уксусная кислота, ацетальдегид, этиламин.
В. ВАЛЕНТНОСТЬ и СТЕПЕНЬ ОКИСЛЕНИЯ
Что между ними общего? Какие отличия?
http://www.youtube.com/watch?v=SM4BxoCoHzk
Г. ВАЛЕНТНОСТЬ/СТЕПЕНЬ ОКИСЛЕНИЯ И ПЕРИОДИЧЕСКАЯ СИСТЕМА Д.И. МЕНДЕЛЕЕВА
В высших оксидах значение ВАЛЕНТНОСТИ химического элемента равна номеру группы, СТЕПЕНИ ОКИСЛЕНИЯ – номеру группы со знаком «плюс».
Фтор не образует оксид!
Значение С.О. атомов химического элемента в водородных соединениях равна:
в гидридах (водородных соединениях металлов) номеру группы со знаком «плюс»;
в летучих водородных соединениях (водородных соединениях неметаллов) – разности числа 8 и номера группы со знаком «минус».
В периоде значение С.О. по водороду сначала возрастает от +1 до +3 и затем от -4 до -1.
Например,
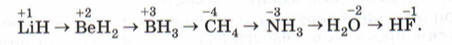
infourok.ru
Определение валентности и степени окисления
ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ НОВОСИБИРСКОЙ ОБЛАСТИ «КУПИНСКИЙ МЕДИЦИНСКИЙ ТЕХНИКУМ»Электронное пособие по дисциплине Химия Тема: «Валентность и степень окисления. Правила определения степеней окисления элементов» Раздел: Неорганическая химия Специальность: 34.02.01 «Сестринское дело» 1 курс Купино 2016 год Рассмотрено на заседании предметно — цикловой методической комиссии по общеобразовательным дисциплинам, общему гуманитарному и социально – экономическому, математическому и естественнонаучному циклу Протокол____ от___________________2016 г. Председатель ______________ /——————————-/ Автор — составитель: преподаватель химии высшей категории Веде Ирина Викторовна Пояснительная записка к электронному учебнику Электронное методическое пособие предназначено для углубленного изучения темы «Валентность и степень окисления. Правила определения степеней окисления элементов». Цель пособия: овладение основополагающими химическими понятиями и закономерностями; формирование умения давать количественные оценки и проводить расчеты по химическим формулам; уверенное пользование химической терминологией и символикой. Практика показывает, что многие обучающиеся при изучении темы «Валентность и степень окисления. Правила определения степеней окисления элементов» испытывают затруднения при определении валентности и степени окисления. Пособие направлено на овладение основополагающими химическими понятиями валентность и степень окисления, формирование умения давать количественные оценки и проводить расчеты валентности и степени окисления по химическим формулам в неорганических и органических соединениях, а также способствует подготовке студентов для сдачи ЕГЭ. Данное пособие рекомендовано для студентов 1 курса специальности 34.02.01 Сестринское дело. Пособие содержит теоретический материал по теме, таблицы для систематизации знаний, упражнения для самостоятельной работы. Пособие направлено на формирование навыков самостоятельной работы с учебным материалом, осуществления поиска и использования информации, формирование и развитие творческого потенциала, повышение интереса к дисциплине. Валентность и степень окисления. Правила определения степеней окисления элементов I. Валентность Валентность – это способность атомов присоединять к себе определенное число других атомов. Правила определения валентности 1. Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода. 2. Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV. 3. Высшая валентность равна номеру группы. 4. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 — Nгруппы. 5. У металлов, находящихся в «А» подгруппах, валентность равна номеру группы. 6. У неметаллов в основном проявляются две валентности: высшая и низшая. Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III. 7. Валентность может быть постоянной или переменной. Валентность элементов необходимо знать, чтобы составлять химические формулы соединений. Запомните! Особенности составления химических формул соединений. 1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И. Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже. Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO3. В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов. 2) Атом металла стоит в формуле на первое место. 2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид». Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца. Теперь вы сами можете написать формулы любых соединений металлов с неметаллами. 3) Атом металла ставится в формуле на первое место. II. Степень окисления Степень окисления – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные. Рассмотрим строение атомов фтора и натрия: F +9 )2)7 Na +11 )2)8)1 — Что можно сказать о завершённости внешнего уровня атомов фтора и натрия? — Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня? — Оба атома имеют незавершённый внешний уровень? — Атому натрия легче отдавать электроны, фтору – принять электроны до завершения внешнего уровня. F0 + 1ē → F-1 (нейтральный атом принимает один отрицательный электрон и приобретает степень окисления «-1», превращаясь в отрицательно заряженный ион — анион) Na0 – 1ē → Na+1 (нейтральный атом отдаёт один отрицательный электрон и приобретает степень окисления «+1», превращаясь в положительно заряженный ион — катион)
Как определить степень окисления атома в ПСХЭ Д.И. Менделеева? Правила определения степени окисления атома в ПСХЭ Д.И. Менделеева: 1. Водород обычно проявляет степень окисления (СО) +1 (исключение, соединения с металлами (гидриды) – у водорода СО равна (-1) Me+nHn-1) 2. Кислород обычно проявляет СО -2 (исключения: О+2F2, H2O2-1 – перекись водорода) 3. Металлы проявляют только +n положительную СО 4. Фтор проявляет всегда СО равную -1 (F-1) 5. Для элементов главных подгрупп: Высшая СО (+) = номеру группы Nгруппы Низшая СО (-) = Nгруппы–8 Правила определения степени окисления атома в соединении: I. Степень окисления свободных атомов и атомов в молекулах простых веществ равнанулю — Na0, P40, O20 II. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0, а в сложном ионе его заряду. Например, H+1N+5O3-2 : (+1)*1+(+5)*1+(-2)*3 = 0 [S+6O4 -2]2-: (+6)*1+(-2)*4 = -2 Задание 1 – определите степени окисления всех атомов в формуле серной кислоты H2SO4? 1. Проставим известные степени окисления у водорода и кислорода, а СО серы примем за «х» H+1SxO4-2 2. Составим и решим уравнение, согласно правилу (II): (+1)*1+(х)*1+(-2)*4=0 Х=6 или (+6), следовательно, у серы CО +6, т.е. S+6 Задание 2 – определите степени окисления всех атомов в формуле фосфорной кислоты H3PO4? 1. Проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х» H3+1PxO4-2 2. Составим и решим уравнение, согласно правилу (II): (+1)*3+(х)*1+(-2)*4=0 Х=5 или (+5), следовательно, у фосфора CО +5, т.е. P+5 Задание 3– определите степени окисления всех атомов в формуле иона аммония (NH4)+? 1. Проставим известную степень окисления у водорода, а СО азота примем за «х» (NхH4+1)+ 2. Составим и решим уравнение, согласно правилу (II): (х)*1+(+1)*4=+1 Х=-3, следовательно, у азота CО -3, т.е. N-3 Алгоритм составления формулы по степени окисления Составление названий бинарных соединений Сравним понятия «валентность» и «степень окисления»: |
Запомни!
Валентность —— это способность атома образовывать определенное количество связей с другими атомами.
Правила определения валентности
1. В молекулах простых веществ: H2, F2, Cl2, Br2, I2 равна единице.
2. В молекулах простых веществ: O2, S8 равна двум.
3. В молекулах простых веществ: N2, P4 и CO — оксиде углерода (II) — равна трем.
4. В молекулах простых веществ, которые образует углерод (алмаз, графит), а также в органических соединениях, которые он образует, валентность углерода равна четырем.
5. В составе сложных веществ водород одновалентен, кислород, в основном, двухвалентен. Для определения валентности атомов других элементов в составе сложных веществ надо знать строение этих веществ.
Степень окисления– это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (с ионной и ковалентной полярной связью) состоят только из ионов.
Высшая степень окисления элемента равна номеру группы.
Исключения:
фтор высшая степень окисления ноль в простом веществе F20
кислород высшая степень окисления +2 во фториде кислорода О+2F2
Низшая степень окисления элемента равна восемь минус номер группы (по числу электронов, которые атом элемента может принять до завершенного восьми электронного уровня)
Правила определения степени окисления (далее обозначим: ст.ок.)
Общее правило: Сумма всех степеней окисления элементов в молекуле с учетом количества атомов равна нулю (Молекула электронейтральна.), в ионе — равна заряду иона.
I. Степень окисления простых веществ равна нулю: Са0, O20, Cl20
II. ст.ок. в бинарных cоединениях:
Менее электроотрицательный элемент ставится на первое место. (Исключения: С-4Н4+ метан и N-3H3+аммиак)
Нужно помнить, что
— ст.ок. металла всегда положительна
— ст.ок. металлов I, II, III групп главных подгрупп постоянна и равна номеру группы
Для остальных ст.ок. вычисляется по общему правилу.
Более электроотрицательный элемент ставится на второе место, его ст.ок. равна восемь минус номер группы (по числу электронов, которые он принимает до завершенного восьми электронного уровня).
Исключения: пероксиды, например, Н2+1О2-1, Ba+2O2-1 и др. ; карбиды металлов I и II групп Ag2+1C2-1,Ca+2C2-1 и др. (В школьном курсе встречается соединение FeS2 — пирит. Это дисульфид железа. Степень окисления серы в нем (-1) Fe+2S2-1). Это происходит потому, что в этих соединениях есть связи между одинаковыми атомами -О-О-, -S-S-, тройная связь в карбидах между атомами углерода. Степень окисления и валентность элементов в этих соединениях не совпадают: у углерода валентность IV, у кислорода и серы II.
III. Степень окисления в основаниях Ме+n(ОН)n равна количеству гидроксогрупп.
1. в гидроксогруппе ст.ок. кислорода -2, водорода +1, заряд гидроксогруппы 1-
2. ст.ок. металла равна количеству гидроксогрупп
IV. Степень окисления в кислотах:
1. ст.ок. водорода +1, кислорода -2
2. ст.ок. центрального атома вычисляется по общему правилу путем решения простого уравнения
Например, Н3+1РхО4-2
3∙(+1) + х + 4∙(-2) = 0
3 + х – 8 = 0
х = +5 (не забудьте знак +)
Можно запомнить, что у кислот с высшей степени окисления центрального элемента, соответствующего номеру группы, название будет заканчиваться на –ная:
Н2СО3 угольная Н2С+4О3
Н2SiО3 кремниевая (искл.) Н2Si+4О3
НNО3 азотная НN+5О3
Н3PО4 фосфорная Н3P+5О4
Н2SО4 серная Н2S+6О4
НСlО4 хлорная НCl+7О4
НMnО4 марганцовая НMn+7О4
Останется запомнить:
НNО2 азотистая НN+3О2
Н2SО3 сернистая Н2S+4О3
НСlО3 хлорноватая НCl+5О3
НСlО2 хлористая НCl+3О2
НСlОхлорноватистая НCl+1О
V. Степень окисления в солях
у центрального атома такая же, как в кислотном остатке. Достаточно помнить или определить ст.ок. элемента в кислоте.
VI. Степень окисления элемента в сложном ионе равна заряду иона.
Например, NH4+Cl— : записываем ион NхН4+1
х + 4∙(+1) = +1
х= — 3;
ст.ок. азота -3
Например, определить ст.ок. элементов в гексацианоферрате(III) калия К3[Fe(CN)6]
— у калия +1 : К3+1[Fe(CN)6], отсюда заряд иона [Fe(CN)6] 3-
— у железа +3 (указано в названии) [Fe+3(CN)6] 3-, отсюда (CN)66-
— у одной группы (CN)—
— более электроотрицательный азот: у него -3, отсюда (CхN-3)—
х – 3 = — 1
х = +2
ст.ок. углерода +2
VII. Степень окисления углерода в органических соединениях разнообразна и вычисляется, исходя из учета того, что ст.ок. водорода равна +1, кислорода -2
Например, С3Н6
3∙х + 6∙1 = 0
3х = -6
х = -2
ст.ок. углерода -2 (при этом валентность углерода равна IV)
Задание. Определить степень окисления и валентность фосфора в фосфорноватистой кислоте h4PO2.
Вычислим степень окисления фосфора.
Обозначим её за х. Подставим степень окисления водорода +1, а кислорода -2, умножив на соответствующее количество атомов: (+1) ∙ 3 + х + (-2) ∙ 2 = 0, отсюда х = +1.

Определим валентность фосфора в этой кислоте.
Известно, что это — одноосновная кислота, поэтому только один атом водорода связан с атомом кислорода. Учитывая, что водород в соединениях одновалентен, а кислород — двухвалентен, получаем структурную формулу, из которой видно, что фосфор в этом соединении имеет валентность пять.
Графический метод определения степени окисления
в органических веществах
В органических веществах можно определять степени окисления элементов алгебраическим методом, при этом получается усредненное значение степени окисления. Этот метод наиболее применим в том случае, если все атомы углерода органического вещества по окончании реакции приобрели одинаковую степень окисления (реакции горения или полного окисления).
Рассмотрим такой случай:
Пример 1. Обугливание дезоксирибозы серной концентрированной кислотой с дальнейшим окислением:
С5Н10О4 + H2SO4 CO2 + H2O + SO2
Найдём степень окисления углерода х в дезоксирибозе: 5х + 10 – 8 = 0; х = — 2/5
В электронном балансе учитываем все 5 атомов углерода:
5
 С -2/5 – 22е 5С+4 2 1
С -2/5 – 22е 5С+4 2 1
Окисление
S+6 + 2е S+4 22 11
восстановление
С5Н10О4 + 11H2SO4 5CO2 + 16H2O + 11SO2
В большинстве случаев окислению подвергаются не все атомы органического вещества, а только некоторые. В этом случае в электронный баланс вносятся только атомы, изменившие степень окисления, а, следовательно, нужно знать степень окисления каждого атома.
Графическим методом:
1) изображается полная структурная формула вещества;
2) по каждой связи стрелкой показывается смещение электрона к наиболее электроотрицательному элементу;
3) все связи С – С считаются неполярными;
4) далее ведется подсчет: сколько стрелок направлено к атому, столько «–» , сколько от атома – столько «+». Сумма «–» и «+» определяет степень окисления атома. Рассмотрим несколько примеров:
 Н
Н
Н




 С С О
С С О
 Н О Н
Н О Н
Углерод карбоксильной группы смещает от себя 3 электрона, его степень окисления +3, углерод метильного радикала притягивает к себе 3 электрона от водорода, его степень окисления – 3.
 Cl
Cl
Н




 С С О
С С О
H H
Углерод альдегидной группы отдает 2 электрона (+2) и притягивает к себе 1 электрон ( — 1), итого степень окисления углерода альдегидной группы +1. Углерод радикала притягивает 2 электрона от водорода (-2) и отдает 1 электрон хлору (+1), итого степень окисления этого углерода -1.

 Н Н
Н Н
Н




 С С С ≡ С Н
С С С ≡ С Н
Н Н
У первого углерода (начинаем считать справа) степень окисления -1, у второго 0, так как мы считаем все связи углерод-углерод неполярными, у третьего – 2, у четвертого – 3.
Задание . Определите усредненную степень окисления атомов углерода алгебраическим методом и степень окисления каждого атома углерода графическим методом в следующих соединениях:
2-аминопропан
глицерин
1,2 – дихлорпропан
аланин
метилфенилкетон
Выполните тест:
Вопрос № 1
Степень окисления- это
 число химических связей, образуемых атомом химического элемента
число химических связей, образуемых атомом химического элемента условный заряд атома, вычисленный на основе предположения, что соединение построено по ионному типу
условный заряд атома, вычисленный на основе предположения, что соединение построено по ионному типу число, равное количеству электронов в атоме
число, равное количеству электронов в атоме число, равное количеству электронов внешнего уровня атома
число, равное количеству электронов внешнего уровня атома
Вопрос № 2
Максимальная валентность атома фосфора:
 +5
+5  V
V  +4
+4  IV
IV
Вопрос № 3
Минимальная валентность атома хлора:
 VI
VI  -6
-6  I
I  -1
-1
Вопрос № 4
Отрицательное значение степени окисления не может иметь атом химического элемента:
 Br
Br  N
N  Mg
Mg P
P
Вопрос № 5
Степень окисления -3 азот имеет в веществе:
 Nh4
Nh4  N2O3
N2O3  N2
N2  NF3
NF3
kopilkaurokov.ru
как определить валентность и степень окисления
Валентность (от лат. valens — имеющий силу) — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов. В соединениях, образованных при помощи ионных связей, валентность атомов определяется числом присоединённых или отданных электронов. В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся обобществленных электронных пар. Валентности некоторых химических элементов: Постоянная валентность H, F, Li, Na, K, Rb, Cs, Fr, Ag — I. Be, Mg, Ca, Ba, Zn, Ra, Cd, Sr, О — II. Al, B — III. Si — IV. Переменная валентность: Cu, Hg — I и II. Fe, Co, Ni — II и III. C, Sn, Pb — II и IV. P — III и V. Cr — II, III и VI. S — II, IV и VI. Mn — II, III, IV, VI и VII. N — 2, 3, 4, 5. Cl — 1, 4, 6, 7. Степень окисления — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов (см. wikipedia).
Посмотреть в таблице раствримости.
touch.otvet.mail.ru




