Основные положения органической химии | АЛХИМИК
Органическая химия – это химия углеводородов и их производных.
Углеводороды (УВ) – это простейшие органические вещества, молекулы которых состоят из атомов только двух элементов: С и Н. Например: СН4, С2Н6, С6Н6 и т.д.
Производные УВ – это продукты замещения атомов «Н» в молекулах УВ на другие или группы атомов. Например:

Название «органическая химия» появилось в начале XIX в., когда было установлено, что углеродсодержащие вещества являются основой растительных и животных организмов.
До 20-х годов XIX в. многие ученые считали, что органические вещества нельзя получить в лаборатории из неорганических веществ, что они образуются только в живой природе при участии особой «жизненной силы». Учение о «жизненной силе» называется витализмом
 А.М. Бутлеров
А.М. БутлеровЭто учение просуществовало недолго, потому что уже в начале и середине XIX в. были синтезированы многие органические вещества:
1828 г. – Велер синтезирует мочевину CO(NH2)2, которая является одним из продуктов, образующихся в организме;
1850-е гг. – Бертло синтезирует жиры;
1861 г. – Бутлеров синтезировал один из углеводов.
Сейчас известно более 10 млн органических веществ; многие из них не существуют в природе, а получены в лаборатории. Промышленный синтез различных органических веществ является одним из основных направлений химической промышленности.
Кроме С и Н, в состав многих органических веществ входят следующие элементы: O, N, S, P, Cl, Br и др.
Принципиального различия между органическими и неорганическими веществами нет. Однако типичные органические вещества имеют ряд свойств, которые отличают их от типичных неорганических веществ. Это объясняется различием в характере химической связи:

Основные положения теории химического строения органических соединений
Эту теорию разработал русский ученый А.М. Бутлеров (1858 – 1861).
I положение. Атомы в молекулах органических веществ соединяются друг с другом в определенной последовательности согласно их валентности.
Последовательность соединения атомов в молекуле называется химическим строением (структурой).

В органических соединениях атомы углерода могут соединяться друг с другом, образуя цепи (углеродный скелет). В зависимости от наличия тех или иных атомов углерода цепи бывают:
а) прямые (неразветвленные) – содержат два первичных атома углерода (крайние в цепи), остальные атомы – вторичные; например:

б) разветвленные – содержат хотя бы один третичный или хотя бы один четвертичный атом углерода; например:

в) замкнутые (циклы) – не содержат первичных атомов углерода; например:

II положение. Свойства веществ зависят не только от состава, но и от строения их молекул.
Например, существуют 2 различных вещества, которые имеют одинаковый состав, выражаемый эмпирической формулой С2Н6О:

Изомеры – это вещества, которые имеют одинаковый состав, но разное строение молекул и различные свойства.
Изомерия – явление существования изомеров.
Изомеры имеют одинаковую эмпирическую формулу и разные структурные формулы. С увеличением числа атомов углерода в молекуле число изомеров резко возрастает; например:
С4Н10 – 2 изомера,
С10Н22 – 75 изомеров.
Типы изомерии
1. Структурная изомерия

2. Пространственная изомерия (геометрическая изомерия, цис-транс-изомерия)

Порядок соединения атомов в этих изомерах одинаковый, но расположение атомов в пространстве различно.
3. Межклассовая изомерия – изомерия веществ, принадлежащих к разным классам органических соединений:

III положение. В молекулах органических веществ атомы и группы атомов влияют друг на друга. Это взаимное влияние определяет свойства веществ.
Рассмотрим, например, влияние ОН-группы на подвижность атомов «Н» в цикле бензола:

В бензольном ядре замещается один атом водорода.

При наличии группы – ОН в бензольном ядре замещаются три атома водорода.
С другой стороны, углеводородный радикал влияет на подвижность атома водорода в ОН-группе:

Если группа – ОН связана с бензольным кольцом, атом водорода в ней является подвижным и может замещаться на атом металла при взаимодействии со щелочью.

Если группа – ОН связана с алкильным радикалом, подвижность атома водорода в ней невелика, и он не может замещаться на металл при действии щелочи.
Гомологический ряд. Гомологи
Гомологический ряд – это ряд органических соединений, в котором каждый следующий член ряда отличается от предыдущего на группу СН2. Сходные по химическим свойствам соединения, образующие гомологический ряд, называются гомологами. Группа СН2 называется гомологической разностью.
Например: СН4, С2Н6, С3Н8, С4Н10 …CnH2n+2.
Состав всех членов гомологического ряда может быть выражен общей формулой.
Классификация органических веществ
Большинство органических соединений можно представить формулой: R – X, где R – углеводородный радикал; Х – функциональная группа.

Функциональные группы – это группы атомов, которые определяют наиболее характерные химические свойства органических соединений. Углеводородные радикалы – остатки УВ, связанные с функциональными группами.
1. Классификация органических веществ по строению углеводородного радикала (R)

2. Классификация органических веществ по функциональным группам (Х)

Типы органических реакций
1. Реакции присоединения

2. Реакции замещения

3. Реакции отщепления

4. Реакции разложения

5. Реакции изомеризации

6. Реакции окисления

Похожее
Предмет органической химии. Роль органических веществ в жизни человека
К изучению предлагается тема «Предмет органической химии. Роль органических веществ в жизни человека». Преподаватель освещает вопрос, почему возникла необходимость разделить вещества на органические и неорганические. Далее он рассказывает учащимся о круговороте углерода в природе, дает определение органическим веществам, поясняет, что такое производные углеводородов, органогены. В конце урока преподаватель раскроет роль органической химии в нашей жизни.
Тема: Введение в органическую химию
Урок: Предмет органической химии. Роль органических веществ в жизни человека
К началу XXI века химики выделили в чистом виде миллионы веществ. При этом известно более 18 миллионов соединений углерода и меньше миллиона соединений всех остальных элементов.
Рост числа известных органических соединений
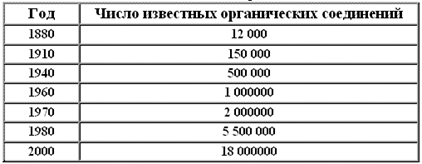
Соединения углерода в основном относят к органическим соединениям.
Вещества стали разделять на органические и неорганические с начала XIX века. Органическими называли тогда вещества, выделенные из животных и растений, а неорганическими – добытые из минералов. Именно через органический мир проходит основная часть круговорота углерода в природе.
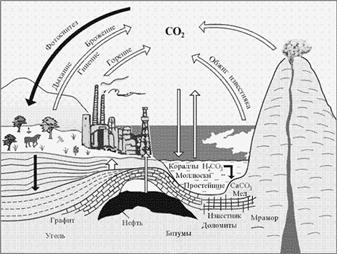
Круговорот углерода в природе
Из соединений, содержащих углерод, к неорганическим традиционно относят графит, алмаз, оксиды углерода (CO и CO2), угольную кислоту (H2CO3), карбонаты (например, карбонат натрия – сода Na2CO3), карбиды (карбид кальция CaC2), цианиды (цианистый калий KCN), роданиды (роданистый натрий NaSCN).
Более точное современное определение: органические соединения – это углеводороды и их производные.
Простейший углеводород – это метан. Атомы углерода способны соединяться друг с другом, образуя цепи любой длины. Если в таких цепях углерод связан еще и с водородом – соединения называются углеводородами. Известны десятки тысяч углеводородов.
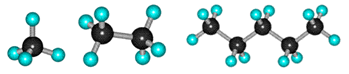
Модели молекул метана СН4, этана С2Н6, пентана С5Н12
Производные углеводородов – это углеводороды, в которых один или несколько атомов водорода замещены атомом или группой атомов других элементов. Например, один из атомов водорода в метане можно заместить на хлор, или на группу ОН, или на группу NH2.

Метан CH4, хлорметан CH3Cl, метиловый спирт CH3OH, метиламин CH3NH2
В состав органических соединений, кроме атомов углерода и водорода, могут входить атомы кислорода, азота, серы, фосфора, реже галогенов.
Чтобы оценить значение органических соединений, которые нас окружают, представим себе, что они вдруг исчезли. Нет деревянных предметов, книг и тетрадей, нет сумок для книг и шариковых ручек. Исчезли пластмассовые корпуса компьютеров, телевизоров и других бытовых приборов, нет телефонов и калькуляторов. Без бензина и дизельного топлива встал транспорт, нет большинства лекарств и просто нечего есть. Нет моющих средств, одежды, да и нас с вами…

Органических веществ так много из-за особенностей образования химических связей атомами углерода. Эти небольшие атомы способны образовывать прочные ковалентные связи друг с другом и с неметаллами-органогенами.
В молекуле этана С2Н6 друг с другом связаны 2 атома углерода, в молекуле пентана С5Н12 – 5 атомов, а в молекуле всем известного полиэтилена сотни тысяч атомов углерода.
Строение, свойства и реакции органических веществ изучает органическая химия.
Рекомендуемые учебники
Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. Учреждений / В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин. – М.: Дрофа, 2008. – 463 с.
ISBN 978-5-358-01584-5
Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. Учреждений / В.В. Еремин, Н.Е. Кузьменко, В.В.Лунин. – М.: Дрофа, 2010. – 462 с.
ISBN 978-5-358-07020-2
Рекомендуемый задачник
Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Учебник в Интернете
Самарский государственный университет.
Кафедра органической, биоорганической и медицинской химии
Г.И. Дерябина, Г.В. Кантария. Органическая химия: Web-учебник для средней школы: (Источник).
Краткий курс лекций по органической химии для подготовки к ОГЭ
Ароматические углеводороды — арены
Бензол — первый представитель класса аренов — ароматических углеводородов.
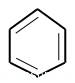
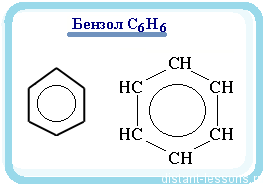
Бензол рисуют вот таким шестиугольником или пишут общую формулу: С6H6.
Кружок в шестиугольнике — это обозначение того, что все связи в молекуле одинаковые. Кроме того, бензол можно рисовать и по валентностям углерода (у каждого атома должно быть 4 связи), то надо было бы нарисовать с двойными связями.
Каждая связь имеет определенные физические характеристики: двойная связь короче одинарной.
В молекуле бензола:
все связи одинаковы, т.е. нет разделения на двойные и одинарные;
эти связи представляют собой промежуточный вариант между двойной и одинарной.
Поэтому рисуют кружок — обозначение одинаковых связей по всей молекуле.
Если рассмотреть строение молекулы более детально с точки зрения электронной плотности, то следует отметить, что между атомами углерода образуется общее π — электронное облако, которое распространено (= делокализовано) по всей молекуле:
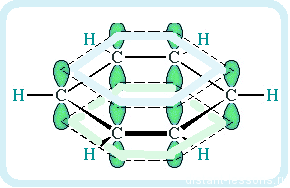
Общая формула аренов: CnH2n-6
Гомологический ряд: С6H6, C7H8, C8H10 и т.д.
Номенклатура гомологов бензола: название углеводорода складывается из двух частей:
(количество и указание места прикрепления) и название радикала + «бензол»
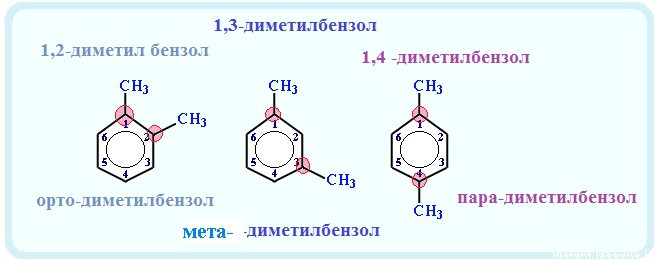
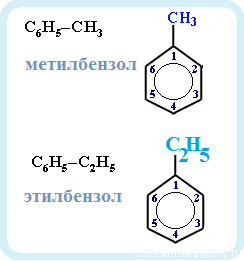
Физические свойства
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Химические свойства аренов
I. РЕАКЦИИ ОКИСЛЕНИЯ
1. Горение (коптящее пламя):
2C6H6 + 15O2t → 12CO2 + 6H2O + Q
Бензол при обычных условиях не обесцвечивает бромную воду и водный раствор марганцовки.
Гомологи бензола окисляются перманганатом калия (обесцвечивают марганцовку).
II. РЕАКЦИИ ПРИСОЕДИНЕНИЯ (труднее, чем у алкенов)
1. Галогенирование
C6H6 +3Cl2 hν → C6H6Cl6 (гексахлорциклогексан — гексахлоран)
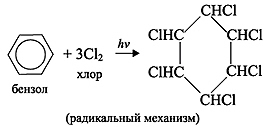
2. Гидрирование
C6H6 + 3H2 t,Pt или Ni → C6H12 (циклогексан)
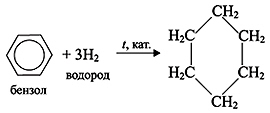
3. Полимеризация
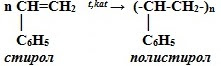
III. РЕАКЦИИ ЗАМЕЩЕНИЯ – ионный механизм (легче, чем у алканов)
Галогенирование 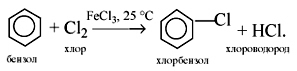
C6H6 + Cl2 AlCl3→ C6H5-Cl + HCl (хлорбензол)
C6H6 + 6Cl2 t ,AlCl3→ C6Cl6 + 6HCl (гексахлорбензол)
C6H6 + Br2 t,FeCl3→ C6H5-Br + HBr (бромбензол)
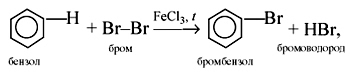
2. Нитрование (с азотной кислотой):
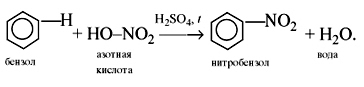
C6H6 + HO-NO2 t, H2SO4→ C6H5-NO2 + H2O
нитробензол — запах миндаля!
C6H5-CH3 + 3HO-NO2 t, h3SO4→ СH3-C6H2(NO2)3 + 3H2O
2,4,6-тринитротолуол (тол, тротил)
1. Предмет органической химии
ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
Органическая химия – наука, изучающая соединения углерода, называемые органическими веществами. В связи с этим органическую химию называют также химией соединений углерода.
Важнейшие причины выделения органической химии в отдельную науку заключаются в следующем.
1.Многочисленность органических соединений по сравнению с неорганическими.
Число известных органических соединений (около 6 млн.) значительно превышает число соединений всех остальных элементов периодической системы Менделеева. В настоящее время известно около 700 тыс. неорганических соединений, примерно 150 тыс. новых органических соединений получают сейчас в один год. Это объясняется не только тем, что химики особенно интенсивно занимаются синтезом и исследованием органических соединений, но и особой способностью элемента углерода давать соединения, содержащие практически неограниченное число атомов углерода, связанных в цепи и циклы.
2. Органические вещества имеют исключительное значение как вследствие их крайне многообразного практического применения, так и потому, что они играют важнейшую роль в процессах жизнедеятельности организмов.
3. Имеются существенные отличия в свойствах и реакционной способности органических соединений от неорганических, вследствие чего возникла необходимость в развитии многих специфических методов исследования органических соединений.
Предметом органической химии является изучение способов получения, состава, строения и областей применения важнейших классов органических соединений.
2. Краткий исторический обзор развития органической химии
Органическая химия как наука оформилась в начале XIX в., однако знакомство человека с органическими веществами и применение их для практических целей началось еще в глубокой древности. Первой известной кислотой был уксус, или водный раствор уксусной кислоты. Древним народам было известно брожение виноградного сока, они знали примитивный способ перегонки и применяли его для получения скипидара; галлы и германцы знали способы варки мыла; в Египте, Галлии и Германии умели варить пиво.
В Индии, Финикии и Египте было весьма развито искусство крашения при помощи органических веществ. Кроме того, древние народы пользовались такими органическими веществами, как масла, жиры, сахар, крахмал, камедь, смолы, индиго и т. д.
Период развития химических знаний в средние века (приблизительно до XVI в.) получил название периода алхимии. Однако изучение неорганических веществ было значительно более успешным, чем изучение веществ органических. Сведения о последних остались почти столь же ограниченными, как и в более древние века. Некоторый шаг вперед был сделан благодаря совершенствованию методов перегонки. Таким путем, в частности, было выделено несколько эфирных масел и получен крепкий винный спирт, считавшийся одним из веществ, с помощью которых можно приготовить философский камень.
Конец XVIII в. ознаменовался заметными успехами в изучении органических веществ, причем органические вещества начали исследовать с чисто научной точки зрения. В этот период был выделен из растений и описан ряд важнейших органических кислот (щавелевая, лимонная, яблочная, галловая) и установлено, что масла и жиры содержат в качестве общей составной части «сладкое начало масел» (глицерин) и т. д.
Постепенно начали развиваться исследования органических веществ — продуктов жизнедеятельности животных организмов. Так, например, из мочи человека были выделены мочевина и мочевая кислота, а из мочи коровы и лошади — гиппуровая кислота.
Накопление значительного фактического материала явилось сильным толчком к более глубокому изучению органического вещества.
Впервые понятия об органических веществах и об органической химии ввел шведский ученый Берцелиус (1827). В учебнике химии, выдержавшем много изданий, Берцелиус высказывает убеждение, что «в живой природе элементы повинуются иным законам, чем в безжизненной» и что органические вещества не могут образовываться под влиянием обычных физических и химических сил, но требуют для своего образования особой «жизненной силы». Органическую химию он и определял как «химию растительных и животных веществ, или веществ, образующихся под влиянием жизненной силы». Последующее развитие органической химии доказало ошибочность этих взглядов.
В 1828 г. Вёлер показал, что неорганическое вещество — циановокислый аммоний — при нагревании превращается в продукт жизнедеятельности животного организма — мочевину.
В 1845 г. Кольбе синтезировал типичное органическое вещество — уксусную кислоту, использовав в качестве исходных веществ древесный уголь, серу, хлор и воду. За сравнительно короткий период был синтезирован ряд других органических кислот, которые до этого выделялись только из растений.
В 1854 г. Бертло удалось синтезировать вещества, относящиеся к классу жиров.
В 1861 г. А. М, Бутлеров действием известковой воды на параформальдегид впервые осуществил синтез метиленитана — вещества, относящегося к классу Сахаров, которые, как известно, играют важную роль в процессах жизнедеятельности организмов.
Все эти научные открытия привели к краху витализма — идеалистического учения о «жизненной силе».
Органическая химия (конспект лекций): Учебное пособие
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
ГОУ ВПО “Уральский государственный технический университет – УПИ”
КАФЕДРА ОРГАНИЧЕСКОЙ ХИМИИ
ОРГАНИЧЕСКАЯ ХИМИЯ
КОНСПЕКТ ЛЕКЦИЙ
УЧЕБНОЕ ПОСОБИЕ
рекомендовано методическим Советом ГОУ ВПО УГТУ-УПИ
для направления 240100 «Химическая технология и биотехнология»
Екатеринбург
2007
Авторы:
Понизовский М.Г., к.х.н., доцент кафедры органической химии
Русинова Л.И., к.х.н., доцент кафедры органической химии
АННОТАЦИЯ
Учебное пособие является частью учебно-методического комплекса дисциплины «Органическая химия». Оно включает в себя краткий конспект 44 лекций, охватывающих все разделы читаемого курса. Пособие предназначено для организации самостоятельной работы студентов при подготовке к лекционным, практическим, лабораторным занятиям, промежуточному, итоговому контролю и выполнению домашних заданий и контрольных работ в курсе «Органическая химия». Пособие является учебным материалом для студентов II курса ХТФ, а также может быть полезно студентам I-III курсов ФСМ, ФТФ, МТФ РТФ.
Библиография 38 назв.
Подготовлено кафедрой «Органическая химия»
Лекция №1
· Предмет органической химии. Причины ее выделения в самостоятельную науку и основные этапы развития. Теория строения и ее роль в развитии органического синтеза.
· Эмпирические, молекулярные и структурные формулы. Изомерия. Изомеры строения. Гомологические ряды. Основные функциональные группы и классы органических соединений.
· Основные принципы номенклатуры органических веществ. Заместительная номенклатура, IUPAC. Основные правила составления названий органических соединений.
Предмет органической химии
Впервые понятие органическая химия ввел шведский химик Берцелиус в 1808 г. Он считал, что различие между неорганическими и органическими веществами состоит в том, что первые могут быть получены в лаборатории обычными препаративными методами, тогда как вторые могут образовываться исключительно в результате процессов жизнедеятельности.
В 1828 г. немецкий химик Ф. Вёлер осуществил превращение неорганического вещества циановокислого аммония в хорошо известное органическое соединение – мочевину:
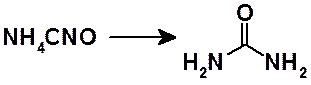
Открытие Ф. Вёлером органического синтеза стало мощнейшим толчком к развитию органической химии во второй половине XIX века. А. Кекуле и А. Купер независимо друг от друга открыли четырехвалентность углерода. Купер отметил способность атомов углерода образовывать цепи и предложил использовать формулы, в которых символы атомов связаны валентными черточками. В 1861 г. А.М. Бутлеров выдвинул теорию химического строения, согласно которой свойства вещества обусловлены природой, числом составляющих его атомов и способом их связывания друг с другом. Это было названо Бутлеровым химическим строением вещества. Кроме того, Бутлеров утверждал, что изучение свойств веществ позволит установить их строение, а знание строения позволит прогнозировать свойства. В 1874 г. одновременно Вант-Гофф и Ле-Бель предположили, что некоторые явления могут быть объяснены пространственной ориентацией валентностей атома углерода. Согласно Вант-Гоффу четыре валентности углерода идентичны и направлены к вершинам правильного тетраэдра, в центре которого находится атом углерода.
Среди элементов, входящих вместе с углеродом в состав органических веществ, исключительная роль принадлежит водороду, поскольку число органических соединений, не содержащих ни одного водородного атома, чрезвычайно мало в сравнении с общим числом известных сегодня химикам-органикам веществ.
Набор свойств, определяющих уникальную природу органических соединений, принадлежит не углероду или водороду в отдельности, а веществам, образованным этими двумя элементами – гидридам углерода, или углеводородам. Углеводороды являются основой классификации органических веществ, поскольку все органические соединения можно считать производными углеводородов, образующимися при замещении атомов водорода атомами других элементов. Поэтому органическая химия – химия углеводородов и их производных (К. Шорлеммер, 1889 г.).
Сам термин «органическая» сохраняет силу в связи с тем, что химия углеводородов и их производных более важна для жизни, чем химия любых других элементов.
Эмпирические, молекулярные и структурные формулы. Изомерия.
Объектом изучения химии являются индивидуальные соединения, т.е. вещества, состоящие из одинаковых молекул. В простейшем случае вещество считается чистым, если его температура плавления (для твердого) или температура кипения (для жидкости) не меняются.
Эмпирическая формула – химическая формула, отражающая качественный состав с указанием относительного количества атомов каждого элемента во всем образце (не в одной молекуле), с помощью целых чисел, не имеющих общего кратного. Например, СН – эмпирическая формула бензола.
Молекулярная формула (брутто-формула) показывает качественный и количественный состав молекулы. Молекулярная формула может быть тождественна эмпирической или быть ее целым кратным. С6Н6 – молекулярная формула бензола.
Структурная формула показывает взаимное расположение атомов и функциональных групп в молекуле. Структурная формула бензола:
Изомеры (isos – тот же, meros – часть) — вещества, имеющие одинаковую молекулярную формулу, но различающиеся по строению. Явление изомерии обусловлено существованием молекул, имеющих одинаковый качественный и количественный состав, но обладающих различными физическими и химическими свойствами из-за различного расположения атомов или функциональных групп или их ориентации в пространстве.
Структурная изомерия – два или более соединения, имеющие одну молекулярную формулу, отличающиеся между собой:
· строением углеродного скелета, например, для С5Н12:

· различным расположением одинаковых функциональных групп (при одинаковом углеродном скелете)

Другие виды изомерии будут рассмотрены в дальнейших лекциях.
Гомологический ряд – ряд соединений, в котором каждый член отличается от предыдущего на одинаковую структурную единицу (гомологическую разность). Гомологи – члены гомологического ряда.
Классификация органических веществ.
Основа классификации органических соединений — теория строения. Все органические вещества, содержащие разные радикалы R (где R – органический остаток) и одинаковые функциональные группы, могут быть разделены на соответствующие классы. Это позволяет классифицировать вещества по их химическим и физическим свойствам, характерным для определенного строения.

Рис. 1.1. Классификация органических веществ (фрагмент)
Химия (органическая химия)
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Хакасский государственный университет им. Н.Ф. Катанова»
(ХГУ им. Н.Ф. Катанова)
Институт естественных наук и математики
Конспект лекций по дисциплине для студентов,
обучающихся по специальностям и направлениям
050100.62–«Естественнонаучное образование» профиля «Химия»,
020400.62-«Биология» профиля « Биоэкология»,
280700. 62-профиль «Техносферная безопасность»
Абакан 2013
ББК 24.2
Ф 638
Ф 638 ХИМИЯ (ОРГАНИЧЕСКАЯ ХИМИЯ): конспект лекций по дисциплине для студентов,
обучающихся по специальностям и направлениям
050100.62 – «Естественнонаучное образование» профиля «Химия», 020400.62 — «Биология» профиля «Биоэкология», 280700. 62 — профиль «Техносферная безопасность» / Сост. Л.А. Фисун. – Абакан:
Учебное пособие является частью учебно-методического комплекса дисциплины «Химия (Органическая химия)».
Оно включает в себя конспект 17 лекций, охватывающий все разделы читаемого курса.Пособие предназначено для организации самостоятельной работы студентов при подготовке к лекционным, практическим занятиям, итоговому контролю и выполнению домашних заданий и контрольных работ по дисциплине.
Учебное пособие по органической химии предназначено для студентов по направлению подготовки 050100.62 – «Естественнонаучное образование» профиля «Химия», 020400.62 — «Биология» профиля «Биоэкология», 280700. 62 – профиль «Техносферная безопасность», а также может быть полезным студентам других специальностей и направлений.
ББК 24.2
Оглавление
ПРЕДИСЛОВИЕ
ЛЕКЦИЯ №1. Введение. Предмет органической химии. Основные этапы ее развития……………………………………………………
ЛЕКЦИЯ № 2. Классификация и номенклатура органических соединений………………………………….. ……………………………………….
ЛЕКЦИЯ №3. Химическая связь. Взаимное влияние атомов……
ЛЕКЦИЯ №4. Изомерия…………………………………………………………
ЛЕКЦИЯ №5. Классификация органических реакций и реагентов. Органические кислоты и основания…………………….
ЛЕКЦИЯ №6. Углеводороды. Алканы……………………………………..
ЛЕКЦИЯ №7. Непредельные углеводороды…………………………….
ЛЕКЦИЯ №8. Арены (ароматические углеводороды)……………..
ЛЕКЦИЯ №9. Галогенпроизводные углеводородов…………………
ЛЕКЦИЯ №10. Спирты. Фенолы……………………………………………
ЛЕКЦИЯ №11. Карбонильные соединения……………………………..
ЛЕКЦИЯ №12. Карбоновые кислоты и их производные…………..
ЛЕКЦИЯ №13. Гетерофункциональные соединения………………..
ЛЕКЦИЯ №14. Углеводы…………………………………………………………
ЛЕКЦИЯ №15. Амины…………………………………………………………..
ЛЕКЦИЯ №16. Аминокислоты. Пептиды……………………………….
ЛЕКЦИЯ №17. Гетероциклические соединения………………………