Органический электролит — Большая Энциклопедия Нефти и Газа, статья, страница 1
Органический электролит
Cтраница 1
Органические электролиты, обладающие противоэлектризационным действием, весьма многочисленны. [1]
Являясь сильными органическими электролитами, практически полностью диссоциирующими в водных растворах, синтетические моющие средства в отличие от мыл мало чувствительны к действию солей жесткости и влиянию рН среды и обладают гораздо большим разнообразием свойств. Поэтому синтетические поверхностно-активные вещества являются не заменителями обычного мыла, а самостоятельными продуктами, обладающими рядом преимуществ. [2]
Использование органических электролитов представляет возможности интенсификации процессов электроосаждения композиционных покрытий и получения их с высоким содержанием частиц второй фазы. Изучено формирование композиционных электрохимических покрытий ( КЭП) никеля и кобальта из неводных гальванических ванн на основе апротонных ( АН, кетоны, ДМФ, ДМСО, ЭА, ПК, ТГФ, трибутилфосфат, Ру) и протолитических ( алифатические спирты) растворителей. [3]
Применение органических электролитов алюминиррвания требует использования герметичных электролитических ванн. Кроме того, имеются ванны колокольного и барабанного типа, исключающие контакт электролита с окружающей атмосферой при загрузке и выгрузке деталей. [4]
Адсорбция — слабых органических электролитов ( фенолов, кислот, аминов) зависит, от рН раствора, поскольку при различных рН изменяется степень ионизации этих веществ в растворе. [5]
Низкомолекулярные неорганические или органические электролиты, приводящие к агрегации частиц, называют коагуляторами. К флокулянтам относятся неорганические или органические высокомолекулярные соединения, способствующие образованию агрегатов за счет объединения нескольких частиц через макромолекулы адсорбированного или химически связанного полимера. [6]
Рассматривая индикатор как слабый органический электролит, необходимо отметить, что добавление ионов Н и ОН — резке увеличивает или подавляет диссоциацию индикатора в зависимости от его кислотно-основных свойств, которые характеризуются степенью диссоциации индикатора. Например метилоранжевык значительно сильнее диссоциирует, чем фенолфталеин. [7]
Рассматривая индикатор как слабый органический электролит, необходимо отметить, что добавление ионов Н и ОН резко увеличивает или подавляет диссоциацию индикатора в зависимости от его кислотно-основных свойств, которые характеризуются степенью диссоциации индикатора. Например, метиловый оранжевый значительно сильнее диссоциирует, чем фенолфталеин. Если сопоставить значения констант диссоциации фенолфталеина / СЮ-9 и метилового оранжевого К 3 — 10 — 5 с константами диссоциации угольной кислоты / Ci 4ЗЫО-7 и уксусной кислоты / С 1 75 — 10 — 5, то увидим, что эти кислоты сильнее диссоциируют, чем фенолфталеин, и слабее метилового оранжевого. [8]
Ионообменной очистке от органических электролитов поддаются преимущественно маломинерализованные сточные воды. [10]
Ионообменной очистке от органических электролитов поддаются преимущественно мало минерализованные сточные воды. [11]
Осаждение этих металлов из органических электролитов может иметь определенное значение с точки зрения получения покрытий с определенным физико-химическими свойствами. Кроме того, в некоторых случаях гальванические процессы в органических средах могут быть более технологичны, чем в водных. [12]
Осаждение этих металлов из органических электролитов Может ИМЕТЬ определенное значение с точки з: ения получения покрытий с определиннь м физико-химическими свойствами. Кроме того, в некоторых случаях гальванические процессы в органических средах могут быть более технолет ичны, чем в водных. [13]
Электролит для суперконденсатора
Изобретение относится к электролиту для суперконденсатора, включающему соль тетрафторборат N-метил-N-н-пропил-пирролидиния и сульфолан при следующем соотношении названных компонентов, масс.%: соль тетрафторборат N-метил-N-н-пропил-пирролидиния — 20-80; сульфолан — 80-20. Предложенный электролит имеет температуру плавления ниже комнатной и одновременно увеличенную проводимость во всей температурной области стабильности жидкой фазы при сохранении термостойкости, электрохимической стабильности и низкой стоимости. 1 табл., 4 ил.
Изобретение относится к электролитам для химических источников тока и может использоваться в упомянутых химических источниках тока, преимущественно в суперконденсаторах.
Для создания суперконденсаторов с большими удельной мощностью, удельной запасаемой энергией и надежностью необходимо, чтобы используемый в них электролит обладал высокой проводимостью, высоким значением напряжения разложения и выдерживал локальные перегревы, которые происходят при разрядке большими токами. А при применении суперконденсаторов в силовых устройствах гибридных или электрических автомобилей, когда требуется обеспечить высокую энергоемкость и мощность двигателя, необходимо также использовать электролиты, стойкие к воздействию электрического поля.
Электролиты — водные растворы — характеризуются низкими значениями напряжения пробоя. Кроме того, они не выдерживают сильного перегрева вследствие низкой температуры кипения. Поэтому для применения в электролитических конденсаторах и суперконденсаторах предпочтительны органические электролиты, обладающие более высокими значениями напряжения разложения.
Примером таких органических электролитов являются растворы неорганических солей в ацетонитриле, которые обладают хорошей растворимостью и высокой ионной проводимостью. Недостатком этих растворов является низкая температура кипения ацетонитрила (82°C) и относительно низкое напряжение его электрохимического разложения ~3 В, ширина электрохимического окна ~6 В [1]. Кроме того, при низкой температуре происходит выпадение соли в осадок, что приводит к резкому падению проводимости электролита.
Для увеличения растворимости, а следовательно, и проводимости электролита необходимо использовать растворитель с высокой диэлектрической проницаемостью. К таким растворителям относятся: пропиленкарбонат, этиленкарбонат, гамма-бутиролактон и другие. Эти растворители имеет более высокую температуру кипения, однако напряжение их электрохимического разложения не превышает 2.5 В [1], а растворимость солей в этом электролите гораздо ниже, чем в ацетонитриле.
В качестве электролитов предложено использовать асимметричные четвертичные соли аммония, растворенные в полярных органических растворителях [2, 3]. Четвертичные соли аммония с фторосодержащими анионами, например тетрафторборат тетраэтиламмония, тетрафторборат триэтилметиламмония и т.д., обладают высокой электрохимической стабильностью [4] и наиболее хорошо подходят для применения в суперконденсаторах. Однако растворимость этих солей в органических солях невелика.
В качестве электролитов для суперконденсаторов могут использоваться ионные жидкости — расплавы ионных солей, которые совмещают свойства растворителя и электролита, обладают широкими областями термической стабильности и существования жидкого состояния. Ионные жидкости способны растворить большее количество соли по сравнению с обычными растворителями, они обладают низким давлением паров, не являются легковоспламеняющимися, поэтому могут служить в качестве антипиренов в составе электролита.
В настоящее время известно большое количество ионных жидкостей [4-6]. Среди них наиболее широкое применение нашли соли имидазолиния, в частности тетрафторборат 1-этил-3-метилимидазолия ([EMI]BF4). Эта соль имеет высокую проводимость и может быть использована в суперконденсаторах, устойчивых к нагреву. Однако в целом соли имидазолия обладают относительно низкой электрохимической стабильностью с напряжением разложения ниже 2,5 В (электрохимическое окно не превышает 5 В).
Известны ионные жидкости, содержащие катион четырехзамещенного аммония с алифатическими заместителями [7], имеющие ширину электрохимического окна до 5.8 В и напряжение разложения 2.9 В. Недостатками этих солей являются высокие температуры плавления, высокая вязкость и низкая ионная проводимость. И хотя проводимость можно увеличить при их смешивании с органическим растворителем, величина электропроводности остается относительно низкой. Предложены различные варианты заместителей четвертичного катиона аммония, среди которых следует отметить электролиты с алкокси-алкильными заместителями [8, 9]. Эти соли имеют пониженные температуры плавления и сохраняют высокую электрохимическую стабильность (напряжение разложения выше 3.2 В). Недостатками этих электролитов являются относительно низкая проводимость и сложность синтеза.
Известна соль тетрафторборат N-метил-N-н-пропил-пирролидиния [(СН3)-(н-С3Н7)-NC4H8]BF4 (далее [MPPy]BF4), которая может использоваться как электролит [10]. Эта соль имеет температуру плавления около 60°C, а в расплавленном состоянии — относительно высокую проводимость и высокое значение напряжения электрохимического разложения, что могло бы позволить использовать ее в суперконденсаторах в качестве электролита. Соль [MPPy]BF4 легко синтезируется с высоким выходом, т.е. при массовом производстве она будет дешевле солей имидазолия и солей замещенного аммония с алкоксиалькильными заместителями.
Электролит из соли [MPPy]BF4 выбран за прототип изобретения. Недостатком прототипа является его сравнительно высокая температура плавления, что снижает диапазон использования его по температуре и дополнительно увеличивает энергозатраты на приведение его в рабочее состояние.
Изобретение решает задачу создания электролита на основе соли тетрафторборат N-метил-N-н-пропил-пирролидиния [(СН3)-(н-С3Н7)-NC4H8]BF4, имеющего температуру плавления ниже комнатной температуры (25°C), с одновременным увеличением проводимости во всей температурной области стабильности жидкой фазы при сохранении термостойкости, электрохимической стабильности и низкой стоимости электролита.
Поставленная задача решается тем, что предлагается электролит, содержащий, масс.%:
| соль тетрафторборат N-метил-N-н-пропил-пирролидиния [(СН | 20-80 |
| сульфолан C4H8SO2 | 80-20 |
Чистый сульфолан — твердое вещество с температурой плавления 75°C. Отличительной чертой сульфолана является то, что в расплавленном состоянии он представляет собой сильно полярное вещество-растворитель с относительной диэлектрической проницаемостью 44, температурой кипения 285°C, химически устойчивое в окислительных и восстановительных средах и обладающее высоким напряжением электрохимического разложения — выше 2.5 В [11].
На фиг.1 приведена диаграмма плавкости системы [MPPy]BF4 — сульфолан. Светлыми точками обозначены температуры стеклования.
На фиг.2 приведены температурные зависимости проводимости системы [MPPy]BF4 — сульфолан. Цифрами указаны значения массовой доли сульфолана в электролите.
На фиг.3 приведен график зависимости проводимости от состава системы [MPPy]BF4 — сульфолан при 25 и 100°C.
На фиг.4 приведены вольтамперные кривые электролитов [MPPy]BF4 — сульфолан, полученные по симметричной схеме с углеродными электродами при 25 и 100°C. Съемка проводилась при скорости развертки напряжения 10 мВ/с. Напряжение разложения определяли как точку наиболее резкого измерения наклона вольтамперной кривой, электрохимическое окно — как расстояния между этими точками.
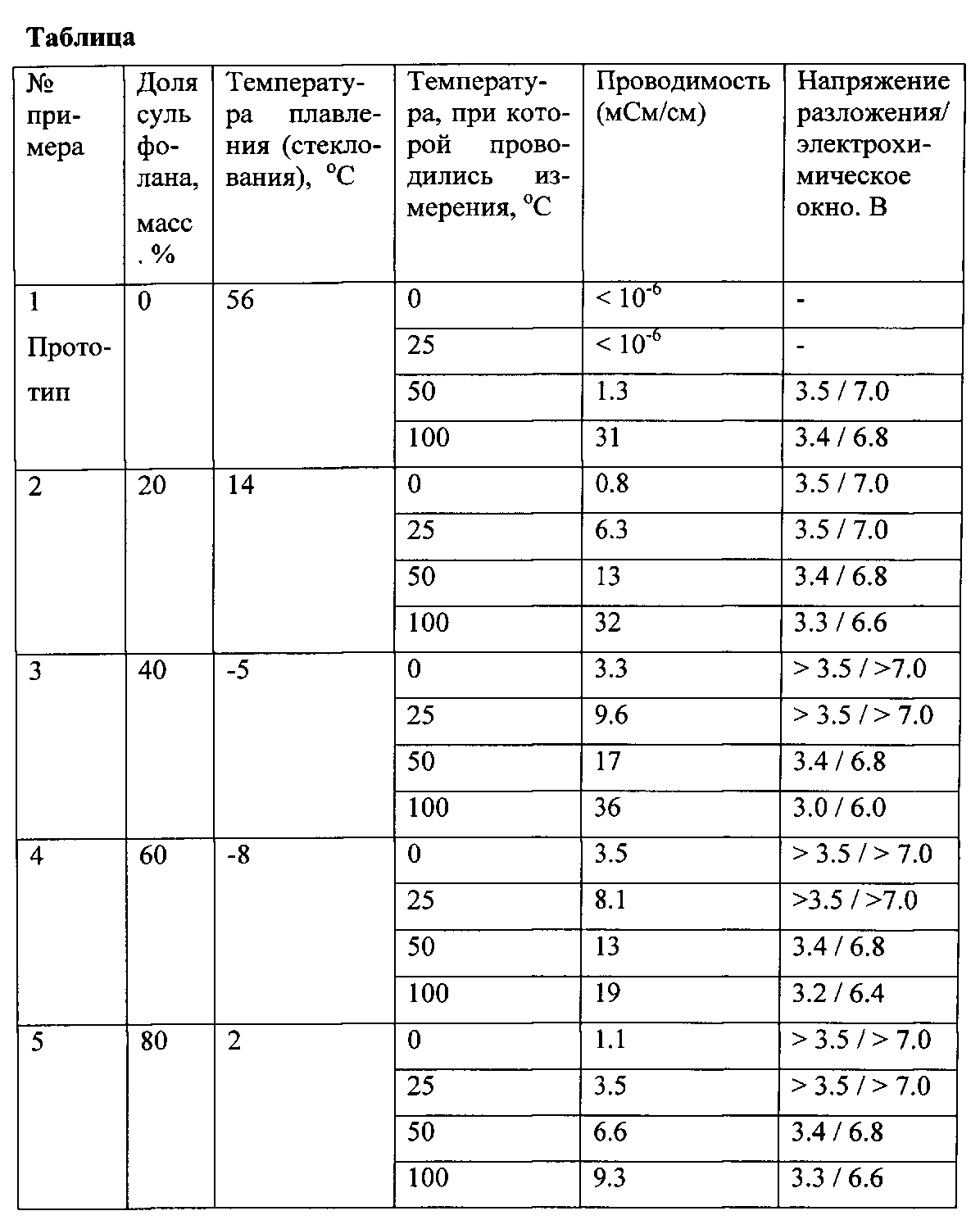
Как следует из диаграммы плавкости системы [MPPy]BF4 — сульфолан, представленной на фиг.1, названные вещества образуют низкоплавкую эвтектику, температуру плавления которой установить не удается вследствие стеклования образцов. Температура стеклования образцов, содержащих 40-60 масс.% сульфолана, обозначена серыми точками и составляет — 8±2°C. При комнатной температуре составы, содержащие менее 20 масс.% сульфолана, остаются твердыми.
Как следует из температурных зависимостей проводимости системы [MPPy]BF4 — сульфолан, представленных на фиг.2, в области концентрации сульфолана 20-60 масс.% составы представляют собой жидкие электролиты с проводимостью 3.5-9.6 мСм/см, которая близка к проводимости ионной жидкостей на основе солей имидазолия [4-6].
Кривая зависимости проводимости системы [MPPy]BF4 — сульфолан от ее массового состава имеет максимум при 40 масс.% сульфолана, как показано на фиг.3. Возможной причиной появления упомянутого максимума является уменьшение вязкости расплава соли [MPPy]BF4 при добавлении сульфолана, который обладает пониженной вязкостью. При увеличении содержания сульфолана выше 40 масс.% проводимость начинает уменьшаться вследствие увеличения общего содержания диэлектрической фазы сульфолана, а при содержании сульфолана более 80 масс.% составы становятся твердыми.
Все жидкие составы системы [MPPy]BF4 — сульфолан характеризуются высокой электрохимической стабильностью, как видно из фиг.4, напряжение разложения этих электролитов при комнатной температуре превышает 3.5 В, а ширина электрохимического окна превышает 7 В, что сравнимо с лучшими известными электролитами, перспективными для применения в суперконденсаторах. При 100°C ширина электрохимического окна снижается до 6 В, оставаясь выше, чем у солей имидазолия. Электролиты термически стабильны до температур не ниже 200°C на воздухе и не ниже 150°C в вакууме.
Оба компонента эвтектики [MPPy]BF4 и сульфолан легко синтезируются и очищаются от примесей влаги вакуумным прогревом или перегонкой. Сульфолан — серийно выпускаемый промышленный реагент — высокотемпературный растворитель, широко используемый в нефтяной и лакокрасочной промышленности. Исходя из этого, можно утверждать, что предлагаемый электролит дешевле аналогов, не уступая им по иным параметрам.
Пример 1. Берут соль [MPPy]BF4, дважды рекристаллизованную из сухого этанола, осушенную в вакууме при 100°C в течение 3 час, и исследуют ее термические свойства, проводимость и электрохимическую стабильность при различных температурах. Результаты исследований представлены на фиг.1-3 и в таблице.
Пример 2. Берут 80 мг соли [MPPy]BF4 и 20 мг сульфолана, смешивают в стеклянной чашке и прогревают смесь в вакууме при 120°C в течение 6 час для полной гомогенизации и осушки от следов влаги. Жидкий горячий расплав охлаждают до комнатной температуры и исследуют термические свойства, проводимость и электрохимическую стабильность полученного образца при различных температурах. Результаты исследований представлены на фиг.1-3 и в таблице.
Пример 3. В условиях Примера 2 берут 60 мг соли [MPPy]BF4 и 40 мг сульфолана. Результаты исследований представлены на фиг.1-3 и в таблице.
Пример 4. В условиях Примера 2 берут 40 мг соли [MPPy]BF4 и 60 мг сульфолана. Результаты исследований представлены на фиг.1-3 и в таблице.
Пример 5. В условиях Примера 2 берут 20 мг соли [MPPy]BF4 и 80 мг сульфолана. Результаты исследований представлены на фиг.1-3 и в таблице.
Как видно из данных таблицы, предлагаемый состав обеспечивает работу электролита при температурах ниже комнатной.
Литература:
1. H.J. Gores, J.M.G. Barthel, Nonaqueous electrolyte solutions: New materials for devices and processes based on recent applied research. Pure Appl. Chern., Vol.67, №6, p.919-930.
2. M. Ue, K. Ida, S. Mori. Electrochemical Properties of Organic Liquid Electrolytes Based on Quaternary Onium Salts for Electrical Double-Layer Capacitors. J. Electrochem. Soc. 1994. V.141. №11. Р.2989-2996.
3. Patent US 5418682 Capacitor having an electrolyte containing a mixture of dinitriles. 23.05.1995.
4. M. Galinski, A. Lewandowski, I. Stepniak, Electrochimica Acta 51 (2006) 5567-5580.
5. S. Zhang, X. Lu, Q. Zhou, X. Li, X. Zhang, S. Li. Ionic Liquids. Physicochemical properties. Elsevier. 2009.
6. W.R. Pitner, P. Kirsch, K. Kawata, H. Shinohara. Applications of Ionic Liquids in Electrolyte Systems. In: Handbook of Green Chemistry, Volume 6: Ionic Liquids (Ed. by P. Wasserscheid, A. Stark, Wiley-VCH, 2010, Weinheim), p.191-201.
7. Патент EP №1642894. Quaternary ammonium salt, electrolyte, and electrochemical device.
8. Заявка WO 2002/076924, Ionic liquid, electrolyte salt for storage device, electrolytic solution for storage device, electric double layer capacitor, and secondary battery. 03.10.2002.
9. Патент 2329257. Электролит, электролитический состав и раствор, конденсатор, вторичный литиевый элемент и способ получения соли четвертичного аммония.
10. S. Forsyth, J. Golding, D.R. MacFarlane, M. Forsyth N-methyl-N-alkylpyrrolidinium tetrafluoroborate salts: ionic solvents and solid electrolytes Electrochimica Acta, Volume 46, Issues 10-11, 15 March 2001, Pages 1753-1757 http://www.sciencedirect.com/science/article/pii/S0013468600007817.
11. X. Sun, C.A. Angell. Doped sulfone electrolytes for high voltage Li-ion cell applications. Electrochemistry Communications 11 (2009) 1418-1421.
Электролит для суперконденсатора, включающий соль тетрафторборат N-метил-N-н-пропил-пирролидиния, отличающийся тем, что он содержит также сульфолан при следующем соотношении названных компонентов, масс.%:
| соль тетрафторборат N-метил-N-н-пропил-пирролидиния | 20-80 |
| сульфолан | 80-20 |
Электролиты и неэлектролиты — Электролитическая диссоциация — Физико-химическая теория растворов электролитов и неэлектролитов — Теоретические основы химии
9 января 2007
Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. Это можно наблюдать с помощью простого прибора  . Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия.
. Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия.
Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам – большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Электролиты – проводники второго рода. В растворе или расплаве они распадаются на ионы, благодаря чему и протекает ток. Очевидно, чем больше ионов в растворе, тем лучше он проводит электрический ток. Чистая вода электрический ток проводит очень плохо.
Распад электролитов на ионы при растворении их в воде называется элекролитической диссоциацией.
Так, хлорид натрия NaСl при растворении в воде полностью распадается на ионы натрия Na+ и хлорид–ионы Cl–. Вода образует ионы водорода Н+ и гидроксид–ионы ОН– лишь в очень незначительных количествах.
Различают сильные и слабые электролиты.
Сильные электролиты при растворении в воде диссоциируют на/> ионы.
1) почти все соли;
2) многие минеральные кислоты, например Н2SO4, HNO3, НСl, HBr, HI, НМnО4, НСlО3, НСlО4;
3) основания щелочных и щелочноземельных металлов.
Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы./>
К ним относятся:
1) почти все органические кислоты;
2) некоторые минеральные кислоты, например H2СО3, Н2S, НNO2, HClO, H2SiO3;
3) многие основания металлов (кроме оснований щелочных и щелочноземельных металлов), а также NH4OH, который можно изображать как гидрат аммиака NH3∙H2O.
К слабым электролитам относится вода.
Слабые электролиты не могут дать большой концентрации ионов в растворе.
К ним относятся:
ЭЛЕКТРОЛИТЫ — Большая Медицинская Энциклопедия
ЭЛЕКТРОЛИТЫ — вещества, электропроводность которых в твердом, расплавленном или растворенном состоянии частично или полностью обусловлена переносом положительно и отрицательно заряженных ионов — катионов и анионов. Элекролиты являются непременными составными частями всех растительных и животных организмов, где они участвуют в функционировании большинства жизненно важных систем. Электролиты создают мембранные потенциалы (см. Биоэлектрические потенциалы), обеспечивают проведение нервного импульса (см. Нервный импульс), электропроводность биологических систем (см.), поддерживают тургор (см.) клеток и др. Совокупность процессов поступления в организм воды и электролитов, их распределения во внутренней среде и выведения из организма определяет состояние водно-солевого обмена (см.) и кислотно-щелочного равновесия (см.), а также объем и качественный состав жидкостей организма. Концентрация отдельных электролитов в сыворотке крови, моче и других биологических жидкостях является важным диагностическим тестом при ряде заболеваний сердечно-сосудистой системы, эндокринных заболеваниях, болезнях почек и др. Дефицит электролитов при сахарном диабете (см. Диабет сахарный) и несахарном диабете (см. Диабет несахарный), нефропатиях, сопровождающихся полиурией, недостаточности коры надпочечников, профузных поносах, неукротимой рвоте, длительном применении салурических мочегонных средств, гиперсекреции паратгормона (см.), гипервитаминозе D (см. Кальциферолы) и др. ведет к тяжелым нарушениям водно-солевого обмена, сопровождающимся сильной головной болью и судорогами; в тяжелых случаях при дефиците электролитов может развиться коллапс (см.). Избыток электролитов при нарушении выделительной функции почек, обезвоживании организма и при других патологических состояниях приводит к ангидремии (см.), гиперкалиемии (см.), гиперкальциемии (см.).
К электролитам, распадающимся на ионы (см.) в растворах (см.), относятся низкомолекулярные соли (см.), кислоты и основания (см.), высокомолекулярные соединения (полиэлектролиты), содержащие множественные ионогенные группировки — белки (см.), нуклеиновые кислоты (см.), гиалуроновые кислоты (см.), полиглутаминовые кислоты (см. Глутаминовая кислота), фосфатиды (см.) и вещества, при растворении дающие коллоидные растворы (см. Коллоиды),— мыла (см.), детергенты (см.).
Твердыми электролитами являются в основном вещества, образующие ионные кристаллы (см.). Ионной проводимостью обладают некоторые кристаллы другой природы, а также аморфные тела — ионообменные смолы (см. Иониты), некоторые стекла и полимеры (см. Высокомолекулярные соединения).
Распад электролитов на ионы происходит вследствие взаимодействия растворенного вещества с растворителем и называется электролитической диссоциацией. Если при диссоциации из молекулы электролита образуется по одному катиону и аниону с равными зарядами, то такие электролиты называют симметричными, или бинарными, а в зависимости от величины заряда 1—1-, 2—2-валентными и т. д. Если при диссоциации молекулы электролита образуется разное число катионов _и анионов, например  , то электролиты называют несимметричными, 1—2-, 1—3-валентными и т. д. По числу ионов несимметричные электролиты подразделяют на тернарные (3 иона), квартернарные (4 иона) и т. д.
, то электролиты называют несимметричными, 1—2-, 1—3-валентными и т. д. По числу ионов несимметричные электролиты подразделяют на тернарные (3 иона), квартернарные (4 иона) и т. д.
В случае неполной диссоциации электролитов степень диссоциации (а) — отношение числа диссоциированных молекул электролитов к исходному числу недиссоциированных молекул — определяют в соответствии с классической теорией электролитической диссоциации по уравнению а = (i-1)/(n-1) где i — так наз. коэффициент Вант-Гоффа, n — число ионов, на которые диссоциирует молекула электролита. В бесконечно разбавленных растворах а = ~1. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс (см. Действующих масс закон):  , где К — константа диссоциации, Ак, Аа, Ам — эффективные концентрации катионов, анионов и недиссоциированных молекул соответственно. Значения а и Кd зависят от природы электролита, растворителя и температуры, однако величина в отличие от а не зависит от концентрации вещества. Связь между а и Кd бинарного электролита описывается законом Оствальда и выражается уравнением
, где К — константа диссоциации, Ак, Аа, Ам — эффективные концентрации катионов, анионов и недиссоциированных молекул соответственно. Значения а и Кd зависят от природы электролита, растворителя и температуры, однако величина в отличие от а не зависит от концентрации вещества. Связь между а и Кd бинарного электролита описывается законом Оствальда и выражается уравнением  .
.
Макромолекулы полимеров, содержащих ионогенные группы, являются полиэлектролитами. Различают поликислоты, полиоснования и полиамфолиты, которые содержат как кислотные, так и основные группы (см. Амфолиты). В растворе макромолекула полиэлектролита существует в форме полииона, окруженного эквивалентным числом малых противоионов. Константа диссоциации К слабых полиэлектролитов уменьшается при увеличении степени диссоциации а, так как при этом возрастает суммарный заряд полииона и для последующей диссоциации ионов необходимо совершить большую работу. В растворах, содержащих низко молекулярные электролиты, наблюдается эффект их исключения из областей, занятых полиионом (так называемое доннановское распределение).
Степень диссоциации является важным фактором, определяющим эффективность физиологического действия биологически активных электролитов, таких как алкалоиды (см.), амины (см.), ауксины (см.), угольная кислота (см.) и др. Как правило, чем выше значение а, тем меньше эти вещества способны проникать в клетки, в результате чего их физиологический и фармакологический эффекты ослабевают.
Обычно в растворах электролитов эффективная концентрация ионов (активность) меньше их действительной концентрации, в основном из-за взаимодействия ионов с молекулами-диполями растворителя, то есть из-за сольватации (см.) и электростатического взаимодействия ионов между собой, которое зависит от расстояния между ионами (концентрации) и величины их зарядов (валентности). Мерой напряженности электростатического поля, создаваемого находящимися в растворе ионами, служит ионная сила (μ) раствора, которая рассчитывается по уравнению:  , где Z — валентность ионов данного вида, С — их концентрация, n —число ионов, образующихся при диссоциации электролитов. Величина активности (А) электролита определяется концентрацией (С) и коэффициентом активности (f), зависящим от заряда и радиуса иона, диэлектрической проницаемости (см.) растворителя и температуры, а также от концентрации (см.) вещества: А = f*С. В случае концентрированных растворов f зависит также от природы электролитов и растворителя. В ряде случаев ионы электролитов благодаря электростатическому притяжению разноименных зарядов ассоциируют и образуют в растворе ассоциаты — так называемые ионные пары, тройники, квадруполи и т. д., в целом лишенные заряда. При этом ионы могут вступать в непосредственный контакт друг с другом или быть разделенными молекулами растворителя, то есть составлять контактные или разделенные растворителем (сольваторазделенные) ионные пары. В отличие от недиссоциированных молекул ионные пары не являются изолированными частицами, а связаны с молекулами растворителя, то есть представляют собой весьма сложные образования. Равновесие между отдельными ионами и ионными парами характеризуется константой ассоциации или диссоциации, аналогичной Кd. Ионные пары обычно возникают в растворах несимметричных электролитов, образованных многозарядными анионами и одновалентными катионами (или наоборот).
, где Z — валентность ионов данного вида, С — их концентрация, n —число ионов, образующихся при диссоциации электролитов. Величина активности (А) электролита определяется концентрацией (С) и коэффициентом активности (f), зависящим от заряда и радиуса иона, диэлектрической проницаемости (см.) растворителя и температуры, а также от концентрации (см.) вещества: А = f*С. В случае концентрированных растворов f зависит также от природы электролитов и растворителя. В ряде случаев ионы электролитов благодаря электростатическому притяжению разноименных зарядов ассоциируют и образуют в растворе ассоциаты — так называемые ионные пары, тройники, квадруполи и т. д., в целом лишенные заряда. При этом ионы могут вступать в непосредственный контакт друг с другом или быть разделенными молекулами растворителя, то есть составлять контактные или разделенные растворителем (сольваторазделенные) ионные пары. В отличие от недиссоциированных молекул ионные пары не являются изолированными частицами, а связаны с молекулами растворителя, то есть представляют собой весьма сложные образования. Равновесие между отдельными ионами и ионными парами характеризуется константой ассоциации или диссоциации, аналогичной Кd. Ионные пары обычно возникают в растворах несимметричных электролитов, образованных многозарядными анионами и одновалентными катионами (или наоборот).
По степени диссоциации электролитов условно делят на слабые и сильные. Группа слабых электролитов включает почти все органические соли, кислоты и основания (см. Органические соединения), а также вещества, образующие многозарядные ионы. К сильным электролитам относят вещества, полностью диссоциирующие на ионы и не образующие ассоциатов, например минеральные соли щелочных металлов (см.) и щелочноземельных металлов (см.), галогениды, перхлораты и нитраты некоторых переходных металлов.
См. также Калий, Магний, Натрий, Угольная кислота, Фосфорные кислоты, Хлор.
Библиогр.: Боголюбов В. М. Патогенез и клиника водно-электролитных расстройств, Л., 1968, библиогр.; Измайлов Н. А. Электрохимия растворов, М., 1976; Крохалев А. А. Водный и электролитный обмен (острые расстройства), М., 1972, библиогр.; Уилкинсон А. У. Водно-электролитный обмен в хирургии, пер. с англ., М., 1974, библиогр.; Xладик Д ж. и др. Физика электролитов: Процессы переноса в твердых электролитах и электродах, пер. с англ., М., 1978.
В. А. Пеккель.
ТВЕРДЫЕ ОКСИДНЫЕ ЭЛЕКТРОЛИТЫ — НОВЫЕ ГОРИЗОНТЫ ЭЛЕКТРОХИМИИ
В 1820 году Ханс Кристиан Эрстед обнаружил магнитное действие электрического тока.
Растворы кислот, щелочей и солей образуют электролит — смесь положительных катионов (черные кружки) и отрицательных анионов (белые).
Двумерная решетка соединения типа MG<sub>2</sub>(например, ZrО<sub>2</sub>)(А).
Модель типичного ионного кристалла — знакомой всем поваренной соли NaCl (А).
Схема электрохимического устройства.
На основе твердых оксидных электролитов можно создавать разные электрохимические устройства.
‹
›
Жидкие электролиты — водные растворы, или расплавы, солей, кислот и оснований — известны давно. Они работают в аккумуляторах и «сухих» батарейках, применяются для получения и очистки металлов, щелочей, органических соединений, для никелирования и анодирования. Свойства жидких электролитов знакомы многим — их изучают даже в школе. Но есть еще один класс подобных веществ — так называемые твердые электролиты. Знают о них в основном только специалисты-химики, история их изучения коротка, широкое применение только начинается. Твердые электролиты связывают в основном с надеждой создать легкий и емкий аккумулятор для электромобиля. Сегодня аккумулятор массой 50-60 килограммов способен запасти гораздо меньше энергии, чем ее «хранится» в бензобаке. Источник тока на твердом электролите, над созданием которого работают ведущие компании мира, по удельной энергоемкости обещает сравняться с топливом.
Спектр применения твердых электролитов очень широк. На их основе можно делать «вечные» печи и источники света, анализаторы газов, устройства для получения чистого кислорода, генераторы электричества и многое другое. Будущее твердых электролитов представляется весьма многообещающим, поэтому знать о них следует.
Электролиты
В конце прошлого века Вальтер Нернст, известный немецкий исследователь, много сделавший для развития электрохимии, использовал в осветительных лампах спресованную смесь оксидов циркония и кальция. Электрический ток, проходя через стерженек из этой «массы Нернста», нагревал его до белого каления. Так нашел свое первое практическое применение твердый электролит.
Как известно, в металлах электрический ток создают покинувшие свои атомы, то есть свободные, электроны. В электролитах это делают другие заряженные частицы — ионы — целые атомы с недостающими электронами (положительные ионы, катионы) или с лишними (отрицательные ионы, анионы).
Если в жидкий электролит погрузить два электрода и приложить напряжение, то в электролите возникнет ток, направленное движение ионов: катионы пойдут к отрицательному («-«) электроду, к катоду; анионы — к положительному («+»), к аноду.
Возможен и обратный процесс: если погрузить в жидкий электролит два электрода из определенным образом подобранных металлов, то на одном из них в результате химических реакций появится избыток электронов («-«), а на другом - недостаток («+»). Между электродами будет действовать электродвижущая сила, и, значит, вся система электроды -электролит превратится в химический генератор электрического тока. Так работал первый химический источник тока - гальванический элемент из медной и цинковой пластин, погруженных в раствор поваренной соли или серной кислоты. Так работают все нынешние гальванические элементы, батарейки и аккумуляторы.
В принципе то же самое происходит в химических электрогенераторах с твердыми электролитами.
Особенности твердых электролитов
Твердых электролитов известно великое множество — это оксиды, соли, кислоты и даже полимеры. В твердых растворах оксидов металлов разной валентности ток создается отрицательными ионами (анионами) кислорода.
Большинство этих твердых растворов — ионные кристаллы: в узлах кристаллической решетки находятся не нейтральные атомы, а заряженные ионы. Они образуют две подрешетки — катионную и анионную. Ионы совершают колебательные движения, но перемещаться по кристаллу, как в жидкости, не могут. Как же тогда в твердых электролитах возникает ток — движение заряженных частиц?
Ситуация меняется, если основное вещество «разбавить» другим похожим соединением, в котором анионов меньше, а катионов — столько же. Тогда катионная решетка этого твердого раствора остается прежней, а в анионной появляются свободные места — вакансии. Пустые места в отрицательно заряженной решетке можно рассматривать как положительные заряды. Под действием внешнего напряжения в них начнут переходить анионы с достаточно большой энергией, а вакансии «побегут» в противоположном направлении — к катоду. Возникнет электрический ток, обусловленный движением ионов только одного сорта. Это одна из особенностей твердых электролитов.
Ионная проводимость тем выше, чем больше в кристалле вакансий. Однако с ростом их количества уменьшается подвижность анионов, причем довольно быстро, поэтому проводимость сначала достигает максимума, а потом начинает падать. Для твердых оксидных электролитов на основе ZrO2, например, максимум электропроводности соответствует концентрации катионов 10-15%.
Свойства твердых оксидных электролитов
Анионы с достаточной кинетической энергией есть всегда, но при комнатной температуре их очень мало, и твердые оксидные электролиты ведут себя как хороший изолятор. По мере нагрева подвижность анионов увеличивается очень быстро, и при 150оС проводимость электролитов становится уже вполне ощутимой. Но основная их рабочая температура лежит между 700 и 1000оС, в связи с чем они и называются высокотемпературными электролитами.
Твердые электролиты всегда находятся в атмосфере определенных газов, состав которой меняет их свойства. Чтобы понять, в чем тут дело, вспомним, что такое динамическое равновесие. В жидкости, например, всегда есть «быстрые» молекулы, которые с ее поверхности переходят в пар. Но и из пара молекулы возвращаются в жидкость — между ними происходит непрерывный обмен молекулами. Пар находится в равновесии с жидкостью, и, чтобы подчеркнуть, что оно сопряжено с движением на молекулярном уровне, его называют динамическим.
Характер обмена между твердым телом и газом сложнее. Ион кислорода в поверхностном слое превращается в нейтральный атом. Два атома соединяются в молекулу кислорода, которая отрывается от поверхности и переходит в газ. Возвращение кислорода из газа в твердое тело происходит в обратном порядке. Обе эти реакции идут одновременно: между электролитом и газом, содержащим определенное количество кислорода, существует динамическое равновесие. Оно нарушается, когда концентрация кислорода в газе меняется.
Немного истории
Итак, твердый электролит в виде смеси оксидов циркония и кальция проводит ток только при высоких температурах. Поэтому лампы Нернста включали, предварительно сильно прогрев их стержень. И появление в 1905 году лампы «немедленного действия» с вольфрамовой нитью предопределило ее абсолютный успех. Однако известно, что кое-где и сегодня можно встретить странный электрический фонарь, который нужно поджигать спичкой. Это, судя по всему, лампы Нернста, дожившие до наших дней: твердые растворы на основе диоксида циркония — исключительно стойкие вещества, они могут работать на воздухе десятилетиями, не окисляясь. Кстати, вполне современные печи с такими нагревателями были разработаны в свердловском Восточном институте огнеупоров в начале 80-х годов.
Главное предназначение твердых оксидных электролитов виделось в создании топливных элементов — химических источников тока, в которых энергия газа непосредственно превращается в электрическую. Топливные элементы — близкие родственники гальванических элементов. Но те служат, пока в их электролите и электродах есть активные вещества, а топливные элементы могут работать сколь угодно долго, пока к ним подводится горючее. Систематические исследования твердых оксидных электролитов начались в Германии в начале 50-х годов, а с конца 50-х развернулись в СССР, США и Канаде. В нашей стране эти работы с самого начала вел Институт химии Уральского филиала АН СССР (Свердловск, ныне Екатеринбург), и школа высокотемпературной электрохимии твердых электролитов, созданная на Урале, стала уникальной по широте охвата проблемы и глубине ее изучения.
Устройства с твердыми оксидными электролитами
Конструкций, в основе которых лежат твердые оксидные электролиты, запатентовано очень много, но принцип их действия одинаков и довольно прост. Это пробирка с парой электродов на стенке, снаружи и внутри. Она помещена в нагреватель; внутрь пробирки и в пространство, ее окружающее, можно подводить газ. Посмотрим, какие функции могут выполнять такие устройства.
Потенциометрические датчики состава газа. Наверное, они наиболее просты. Мы уже знаем, что электроды в разных газах приобретают разные потенциалы. Если, скажем, внутри пробирки находится чистый кислород, а снаружи — газ с неизвестной его концентрацией, то по разности потенциалов электродов можно эту концентрацию определить.
Потенциометрические датчики позволяют определять состав и более сложных газовых смесей, содержащих углекислый и угарный газы, водород и водяной пар. Если стерженек из твердого электролита с электродами на торцах нагрет неравномерно, он начнет терять кислород и между электродами возникнет разность потенциалов. По ее величине можно определить, например, состав выхлопных газов автомобильного двигателя. На Западе, где требования к чистоте выхлопных газов очень строги, такие датчики выпускаются миллионами. У нас же на такие «пустяки» пока не обращают внимания.
Кислородные датчики пока единственные устройства с твердыми оксидными электролитами, нашедшие практическое применение.
Кислородные насосы. Пусть во внешнее пространство пробирки подается воздух или газ, содержащий кислород. Если внешний электрод стал анодом, а внутренний — катодом, то из газа в пробирку пойдет чистый кислород. Подобные устройства — кислородные насосы — могут найти применение там, где потребление кислорода невелико или требуется его высокая чистота.
В медицине, например, используется и чистый кислород, и воздух с пониженным содержанием кислорода — так называемая «гипоксическая смесь», или «горный воздух». Электрохимические насосы наряду с мембранными оксигенаторами (см. «Наука и жизнь» № 2, 1999 г.) позволят решить массу проблем, особенно в медицинских учреждениях, удаленных от промышленных центров. В атмосфере с пониженным содержанием кислорода значительно дольше хранятся продукты питания, и устройства с кислородными насосами могут стать экономичней привычных холодильников.
Электролизеры. Теперь к внешнему электроду - катоду — подводят водяной пар или углекислый газ. На катоде будет происходить разложение пара или углекислого газа, а на аноде в обоих случаях выделяется кислород. Уникальная способность этого высокотемпературного электролизера одновременно разлагать водяной пар и углекислый газ позволяет создать систему жизнеобеспечения, скажем, на космических объектах.
Теплоэлектрогенераторы . Человек сделал первый шаг к независимости от природы, научившись сохранять огонь, поистине универсальный источник энергии. Костер давал тепло и свет, на нем готовили пищу, он расходовал ровно столько топлива, сколько было необходимо. Костер тысячелетиями оставался главной энергетической установкой человека, и неудивительно, что мы испытываем какую-то ностальгию по очагу с горящими дровами.
Еще в конце прошлого века свет давали свечи и керосиновые лампы, а тепло — печи. Лишь немногим более ста лет назад на человека начало работать электричество, которое могло давать свет, тепло, механическую работу. Одно время казалось, что достаточно подвести к жилищу только электрическую энергию, а уж там преобразовывать ее во что угодно. Но сказала свое слово экономика: кпд электростанции менее 40%, потери при передаче и обратном превращении электричества в другие виды энергии тоже значительны. Ясно, что там, где нужно только тепло, его целесообразно получать прямо из топлива. И не случайно сегодня обсуждается простая идея: вернуть «очаг» в дом в виде электрохимического генератора с топливным элементом, преобразующим энергию топлива в электричество и тепло.
Топливные элементы. Пусть к внешним стенкам пробирки подается водород, а внутрь ее — кислород. Между электродами возникнет напряжение около вольта, по соединяющей их цепи потечет ток, и на электродах пойдут реакции, обратные тем, что проходят в электролизере. Внешний электрод станет анодом, внутренний — катодом, а устройство превратится в источник тока — твердооксидный топливный элемент.
Одно и то же устройство может служить и топливным элементом, и электролизером, позволяя аккумулировать электрическую энергию. В период низкого ее потребления невостребованная мощность электростанций используется для получения водорода. В пике потребления электролизер начинает работать как топливный элемент, производя электричество из водорода.
Топливом в элементе может быть и угарный газ. В него нетрудно превратить уголь, нефть, различные газы и спирты (которые, например, в Бразилии используют как горючее для автомобилей). Элемент послужит основой электрохимического генератора, способного существенно изменить концепцию снабжения жилища энергией. Наиболее прост в техническом отношении генератор на природном газе — метане или пропане.
Как показывают исследования, его электрический кпд достигает 70%. Остальные 30% энергии топлива выделяются в виде тепла, которое можно использовать в паровых турбинах. Кпд такой комбинированной установки способно превысить 80% — столь высокой эффективности нет ни у одного генератора.
Восемь лет назад в Институте высокотемпературной электрохимии Уральского отделения РАН был изготовлен демонстрационный генератор на метане мощностью один киловатт. Но до практической реализации дело никак не дойдет. Опытно-конструкторские работы, которые уже начинались, до конца так и не доведены. Задача очень сложна, ее необходимо решать в рамках национальной программы, попытки разработать которую оказались пока безуспешными.
Электролиты: что это и зачем они нужны организму?
Электролитами называют ионные растворы (соли), которые в природе существуют в виде минералов. Электролиты несут важную функцию гидратации организма для поддержания функции мышц и нервов. Поскольку тело человека в основном состоит из воды, важно получать эти минералы в достаточном количестве. Когда организм хорошо увлажнен, он лучше избавляется от внутренних токсинов, таких как мочевина и аммиак.
Эфирные электролиты, присутствующие в теле человека – это натрий, калий, бикарбонат, хлорид, кальций и фосфаты.
Почему электролиты так необходимы?
Когда почки функционируют в обычном режиме, они регулируют концентрацию перечисленных выше минералов в жидкости организма. В других условиях, например, при усиленной тренировке, большая часть жидкости (и минеральных электролитов) теряется. Это же может происходить при мочеиспускании, рвоте, поносе или через открытые раны.
Когда мы потеем, из нас выходит натрий, калий и хлорид. Именно поэтому спортсмены уделяют такое большое внимание поступлению электролитов после тренировки. Калий является жизненно важным минералом, ведь 90% калия находится в клеточных стенках. Важно ежедневно пополнять электролиты из жидкостей и пищевых продуктов.
Теряя жидкость, нужно не только пить воду, но и получать электролиты. Так организм быстрее увлажняется. Прием таких электролитов, как натрий, уменьшает потерю жидкости через мочеиспускание, питая мышцы, нервы и другие ткани.
Как получить электролиты естественным путем?
Стало модно восстанавливать баланс электролитов с помощью спортивных напитков, но лучший способ все-таки получать их с пищей. Сладкие спортивные напитки приводят только к быстрому пополнению минералов, но истощают организм в долгосрочной перспективе.
Продукты, которые дают организму электролиты:
Фрукты и овощи
Яблоки, кукуруза, свекла, морковь – все они насыщены электролитами. Также следует включить в рацион лаймы, лимоны, апельсины, сладкий картофель, артишоки, все виды кабачков и томатов. При возможности, лучше выбирать местные органические овощи.
Орехи и семена
Ешьте больше орехов – миндаль, кешью, грецкие орехи, арахис, фундук, фисташки содержат много электролитов. Добавьте в утреннюю кашу из овсяных хлопьев семена подсолнечника, тыквы, кунжута.
Бобовые
Фасоль, чечевица, маш являются отличным источником электролитов. Но следует помнить, что бобовые щедро сдабривают специями, чтобы избежать образования газов.
Темно-зеленые листовые овощи
Большинство зелени хорошо справляется с задачей наполнения организма минералами. Это может быть шпинат, зелень горчицы, мангольд. Все эти листовые овощи удерживают натрий, кальций, магний и также «пребиотики», которые отвечают за нормальную флору кишечника и пищеварение.
Бананы
Бананы содержат много различных минералов. Особенно богаты они калием, гораздо больше, чем любой другой продукт.
Совет: добавьте в питьевую воду щепотку гималайской соли и чайную ложку органического яблочного уксуса – и вы получите здоровую альтернативу спортивному напитку.
Органический электролит — Большая Энциклопедия Нефти и Газа, статья, страница 2
Органический электролит
Cтраница 2
Характерные особенности железных покрытий из органических электролитов: более дисперсная структура; небольшие внутренние напряжения, меняющиеся в зависимости от режима электролиза; более высокая твердость ( 700 — 900 кГ / мм2) и большая износостойкость осадков. [16]
Обычно при синтезе исходят из мономерных органических электролитов и путем, поликонденсации или полимеризации создают вещество с сетчатой структурой. В другом варианте ионогенные группы вводят в готовое высокополимерное соединение. [18]
Загрязнители, представленные неорганическими или органическими электролитами в водонасыщенных грунтах, диффундируют в диссоциированной форме. При этом коэффициенты диффузии катионов и анионов будут различны в силу различий у них массы и радиуса. Как известно, размеры ионов закономерно связаны с положением элементов в периодической системе и в пределах групп растут с увеличением порядкового номера элемента. В рядах радиусы уменьшаются с увеличением валентности. Размеры таких ионов часто весьма значительны, их форма особенно далека от шаровой и коэффициенты диффузии намного меньше, чем простых ионов. Кроме того, следует иметь в виду, что катионы и анионы загрязнителей в поровом растворе грунтов диффундируют в гидратированной форме. Гидратация ионов ( положительная или отрицательная в зависимости от вида иона) изменяет эффективный радиус диффундирующего иона, что сказывается на его коэффициенте диффузии. [19]
Различные ХИТ с литиевым анодом и органическим электролитом нашли применение в метеорологических зондах, медицинском электронном оборудовании, вычислительных машинах и даже в бытовой технике благодаря их высокой удельной энергии. Однако эти источники не могут работать в интенсивном режиме ввиду невысокой электропроводимости электролита. [20]
Поскольку в элементе фторированный графит — литий используются органический электролит, температура плавления которого ниже температуры плавления водных электролитов, температурные характеристики этих элементов, как показано на рис. 2.42 гораз-до лучше характеристик элементов на водных электролитах. [22]
Способность глин адсорбировать воду заметно ослабевала от присутствия органического электролита. Влажность глин особенно сильно уменьшалась под действием додецилаце-тата. Адсорбированные ионы занимают более значительную часть поверхности монтмориллонита, чем каолинита. О значении таких исследований для отлиики керамических пластинок будет сказано ниже, в § 370 настоящей главы А. [23]
Тем самым было показано, что изменение электропроводности органических электролитов при различных температурах сильно зависит от химического строения молекул электролитов. [24]
Использование неводных или смешанных сред в технологии получения органических электролитов особенно перспективно при десорбции последних, когда элюируемый электролит оказывается в элюате в форме, обладающей высокой растворимостью и низкой способностью к диссоциации, т.е. когда создаются условия для сдвига ионообменной реакции в сторону, наименее благоприятную для сорбции выделяемого иона. [25]
Реакции ионов в объеме фазы и противоионов с органическими электролитами, распределенными между объемом и мицеллярной фазой [ системы (3.62) ], были исследованы кинетически в присутствии анионных, катионных и неионных мицелл. [26]
Нежелательно анализировать растворы с высоким содержанием органических веществ и органиче