Химические свойства оснований — урок. Химия, 8–9 класс.
Химические свойства гидроксида металла во многом зависят от того, к какой группе он принадлежит — к щелочам или к нерастворимым основаниям.
Общие химические свойства щелочей
1. Кристаллы щелочей при растворении в воде полностью диссоциируют, то есть распадаются на положительно заряженные ионы металла и отрицательно заряженные гидроксид-ионы.
A) Например, при диссоциации гидроксида натрия образуются положительно заряженные ионы натрия и отрицательно заряженные гидроксид-ионы:
NaOH→Na++OH−.
Б) Процесс диссоциации гидроксида кальция отображается следующим уравнением:
Ca(OH)2→Ca2++2OH−.
2. Растворы щелочей изменяют окраску индикаторов.
Фактически с индикатором взаимодействуют гидроксид-ионы, содержащиеся в растворе любой щёлочи. При этом протекает химическая реакция с образованием нового продукта, признаком протекания которой является изменение окраски вещества.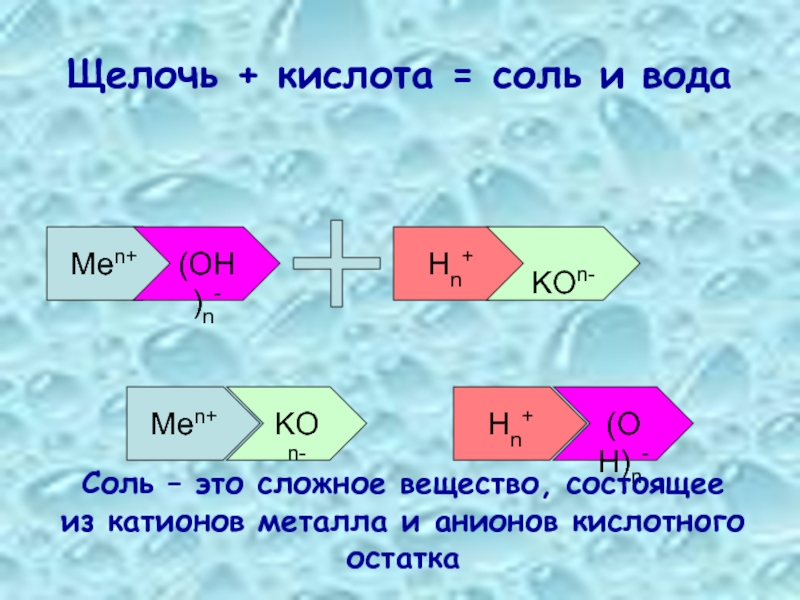
Изменение окраски индикаторов в растворах щелочей
Индикатор | Изменение окраски индикатора |
| Лакмус | Фиолетовый лакмус становится синим |
| Фенолфталеин | Беcцветный фенолфталеин становится малиновым |
Универсальный индикатор | Универсальный индикатор становится синим |
Видеофрагмент:
Действие щелочей на индикаторы |
3. Щёлочи взаимодействуют с кислотами, образуя соль и воду.
Реакция нейтрализации — частный случай реакции обмена: при взаимодействии щелочи и кислоты образуются соль и вода.
А) Например, при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия и вода: NaOH+HCl→NaCl+h3O.
Видеофрагмент:
Взаимодействие гидроксида натрия с соляной кислотой |
Б) Если нейтрализовать гидроксид кальция азотной кислотой, образуются нитрат кальция и вода:
Ca(OH)2+2HNO3→Ca(NO3)2+2h3O.
4. Щёлочи взаимодействуют с кислотными оксидами, образуя соль и воду.
А) Например, при взаимодействии гидроксида кальция с оксидом углерода(\(IV\)) т. е. углекислым газом, образуются карбонат кальция и вода:
Ca(OH)2+CO2→CaCO3↓+h3O.
Обрати внимание!
При помощи этой химической реакции можно доказать присутствие оксида углерода(\(IV\)): при пропускании углекислого газа через известковую воду (насыщенный раствор гидроксида кальция) раствор мутнеет, поскольку выпадает осадок белого цвета — образуется нерастворимый карбонат кальция.
Б) При взаимодействии гидроксида натрия с оксидом фосфора(\(V\)) образуются фосфат натрия и вода:
6NaOH+P2O5→2Na3PO4+3h3O.
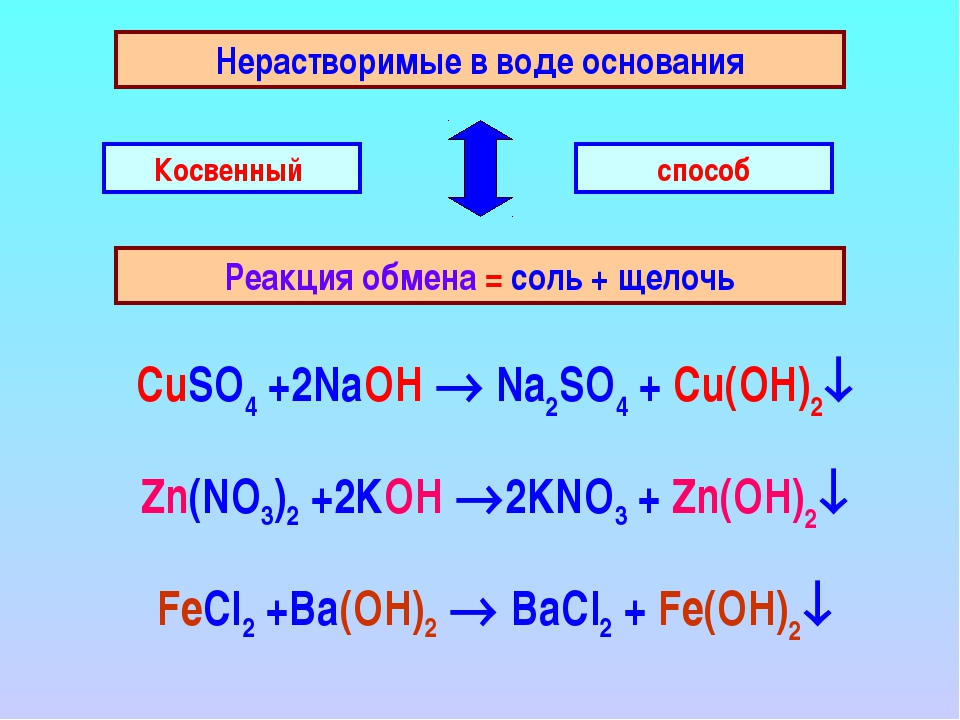
5. Щёлочи могут взаимодействовать с растворимыми в воде солями.
Обрати внимание!
Реакция обмена между основанием и солью возможна в том случае, если оба исходных вещества растворимы, а в результате образуется хотя бы одно нерастворимое вещество (выпадает осадок).
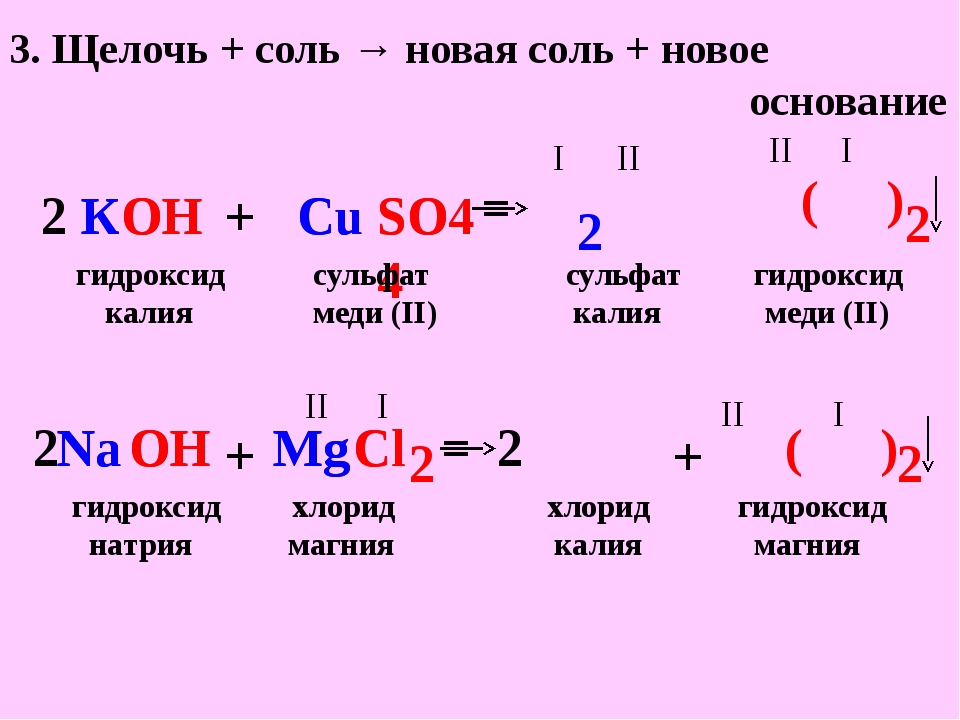
А) Например, при взаимодействии гидроксида натрия с сульфатом меди(\(II\)) образуются сульфат натрия и гидроксид меди(\(II\)):
2NaOH+CuSO4→Na2SO4+Cu(OH)2↓.
Б) При взаимодействии гидроксида кальция с карбонатом натрия образуются карбонат кальция и гидроксид натрия:
Ca(OH)2+Na2CO3→CaCO3↓+2NaOH.
6. Малорастворимые щёлочи при нагревании разлагаются на оксид металла и воду.
Например, если нагреть гидроксид кальция, образуются оксид кальция и водяной пар:
Ca(OH)2⟶t°CaO+h3O↑.
Общие химические свойства нерастворимых оснований
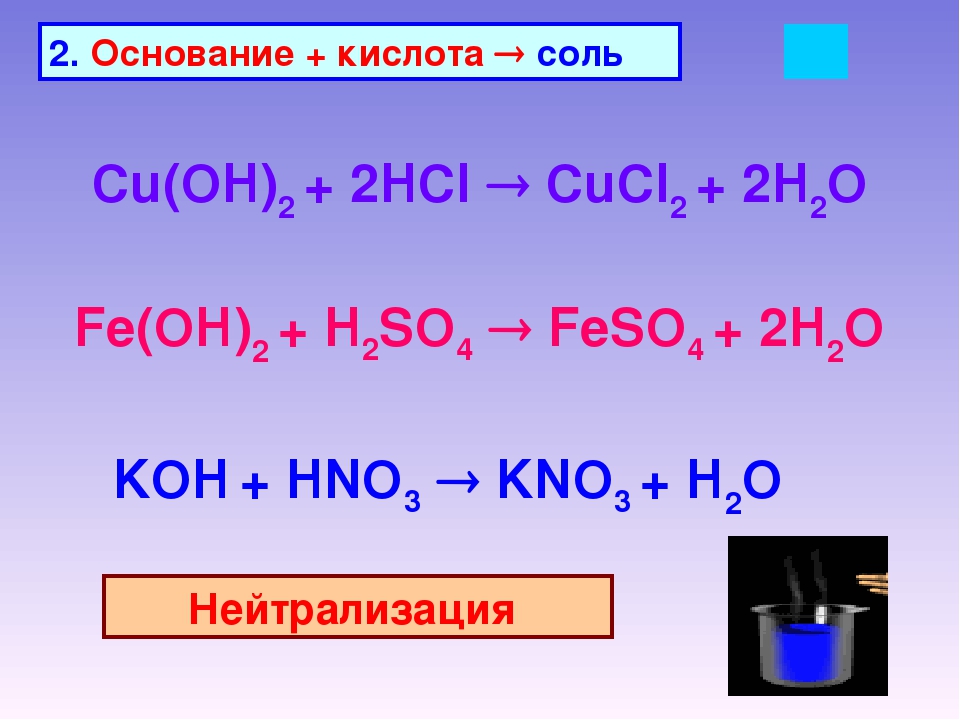
1. Нерастворимые основания взаимодействуют с кислотами, образуя соль и воду.
А) Например, при взаимодействии гидроксида меди(\(II\)) с серной кислотой образуются сульфат меди(\(II\)) и вода:
Cu(OH)2+h3SO4→CuSO4+2h3O.
Б) При взаимодействии гидроксида железа(\(III\)) с соляной (хлороводородной) кислотой образуются хлорид железа(\(III\)) и вода:
Fe(OH)3+3HCl→FeCl3+3h3O.
Видеофрагмент:
Взаимодействие гидроксида железа(\(III\)) с соляной кислотой |
2. Некоторые нерастворимые основания могут взаимодействовать с некоторыми кислотными оксидами, образуя соль и воду.
Например, при взаимодействии гидроксида меди(\(II\)) с оксидом серы(\(VI\)) образуются сульфат меди(\(II\)) и вода:
Cu(OH)2+SO3⟶t°CuSO4+h3O.
3. Нерастворимые основания при нагревании разлагаются на оксид металла и воду.
А) Например, при нагревании гидроксида меди(\(II\)) образуются оксид меди(\(II\)) и вода:
Cu(OH)2⟶t°CuO+h3O.
Видеофрагмент:
Разложение гидроксида меди(\(II\)) |
Б) Гидроксид железа(\(III\)) при нагревании разлагается на оксид железа(\(III\)) и воду:
2Fe(OH)3⟶t°Fe2O3+3h3O.
Щёлочи – наши помощники
Основания состоят из положительно заряженных ионов металла и гидроксид-ионов ОН-. Щёлочи — это основания, которые хорошо растворимы в воде.
Сведения о растворимости в воде можно брать из таблицы растворимости. Р – растворимые основания, то есть щёлочи, м – малорастворимые, н – нерастворимые, черта «–» означает, что такого основания не существует.
Р – растворимые основания, то есть щёлочи, м – малорастворимые, н – нерастворимые, черта «–» означает, что такого основания не существует.
В обычных условиях являются твёрдыми веществами. Имеют вид белых порошков, легко впитывающих влагу. Требуют хранения в банках из толстого стекла с широким горлышком или полиэтиленовых емкостях.
Получение оснований
Щёлочь образуется в результате реакции металла и воды с большим выделением теплоты.
CaO + h3O>Ca(OH)2.
Гидроксиды натрия и калия образуются при воздействии на раствор электрического тока:
KCl + 2h3O>2KOH + h3 + Cl2.
Свойства оснований
Щёлочи реагируют
1. С кислотными оксидами:
2КОН+SO3>K2SO4+h3O.
Щёлочи способны растворять оксидную плёнку алюминия (амфотерного оксида):
https://www. youtube.com/watch?v=5RvUC-3uY6c
youtube.com/watch?v=5RvUC-3uY6c
2. С кислотами:
NaOH+HCl>NaCl+HOH.
Можно определить, осталась ли щёлочь, если добавить 1-2 капли раствора фенолфталеина. Щёлочь прореагировала полностью, если малиновый цвет окрашивания раствора не появился.
Реакция между основанием и кислотой – реакция нейтрализации. Подобные реакции часто применяют с целью очищения сточных вод промышленных предприятий от щелочей и кислот. Продукты таких реакций – соли, которые более безопасны для окружающей среды. Очень эффективной и экономически выгодной является нейтрализация стоков различных производств.
3. С солями. Это реакции обмена. Происходят в растворе, при этом исходная соль должна быть водорастворимой. А получаемое вещество – нерастворимым:
2NaOH+Mn(NO3)2=Mn(OH)2v+2NaNO3
4. С галогенами.
На холоде: Cl2 + 2NaOH = NaClO+NaCl+h3O.
При нагревании: 3Cl2+6NaOH = NaClO3+5NaCl+3h3O.
Расплавить можно только гидроксиды натрия и калия (температуры плавления соединений составляют 322о и 405о соответственно).
Безопасность в работе со щелочами
Химические ожоги, причиняемые щелочами, в том числе едким натром и едким кали, намного опаснее, чем химические ожоги от кислот. Ожог усугубляется, если кусочек кристаллического вещества прилипает к коже.
Щёлочи способны разъедать много материалов, вызывать серьёзные ожоги на коже и слизистых оболочках, поражать глаза. Поэтому гидроксид натрия называют «едким натром», а гидроксид калия – «едким кали». При работе со щелочами и их растворами, нужно соблюдать осторожность. При попадании раствора щелочи на кожу, нужно сразу смыть его большим количеством воды. Затем обработать это место слабым раствором уксусной или борной кислоты. И опять промыть водой.
Что за вещество «нашатырный спирт»?
Жидкость с названием «нашатырный спирт» — это водный раствор газа аммиака Nh4.
Nh4+h3O- Nh5OH.
Во взаимодействие вступает небольшое количество растворённого аммиака и одновременно распадается на исходные вещества, на что указывает знак «-» в уравнении. Гидроксид аммония, подобно щелочам, изменяет окрашивание индикатора, взаимодействует с кислотными оксидами, кислотами и солями.
2Nh5OH+СО2>(Nh5)2СО3+h3O
Nh5OH+HCl>Nh5Cl+h3O
Nh5OH+Pb(NO3)2>Pb(OH)2v+2Nh5NO3.
Применение оснований
Нашатырный спирт используют не только для того, чтобы привести человека в сознание. С его помощью можно отлично вымыть окна, используя 1 столовую ложку препарата на 1 литр воды. Затем нужно вытереть поверхность бумажными полотенцами.
 Но не стоит думать, что получится мгновенный эффект. Поверхность нужно аккуратно потереть.
Но не стоит думать, что получится мгновенный эффект. Поверхность нужно аккуратно потереть.Широко применяют, прежде всего, гидроксиды кальция и натрия. Гашёная известь – это гидроксид кальция Сa(OH)2. Её используют, как вяжущий материал в строительстве. Смешивают с песком и водой. Полученную смесь наносят на кирпич, штукатурят стены. В результате взаимодействия основания с углекислым газом и оксидом силициума (IV), смесь твердеет. Известь способна поглощать кислые газы. Также может впитывать токсичные вещества, поэтому для здоровья жильцов белить комнату предпочтительнее, чем красить.
Также гидроксид кальция используют в сахарной промышленности, сельском хозяйстве, при изготовлении зубных паст, получении многих веществ.
Гидроксид натрия (каустическую соду) используют при производстве мыла в реакции щёлочи с жиром, при изготовлении лекарств, в кожной промышленности, для очищения нефти. Каустическая сода применяется для чистки масляных пятен. Всем известный «Крот» для труб представляет собой раствор гидроксида натрия, способный растворять жиры и даже волосы.
Всем известный «Крот» для труб представляет собой раствор гидроксида натрия, способный растворять жиры и даже волосы.
Щёлочи разъедают стекло и фарфор. Растворяют белковые вещества.
Применяются в медицине в качестве антисептиков, раздражающих и прижигающих препаратов. При заболеваниях пищеварительной системы щелочные минеральные воды действуют оздоравливающе. Эффективны в лечении подагры, стоматита, в лечении заболеваний дыхательной системы. Являются мочегонным средством. Нейтрализуют отравление кислотами.
Немаловажно участие щелочей в изготовлении каучука, искусственного волокна, красителей, очищения предметов из металла, обработки деревянных поверхностей. Являются хладагентом холодильных установок. Используются в сельском хозяйстве, лёгкой промышленности и металлургии.
Щелочные продукты питания
Различают кислые, щелочные и нейтральные продукты питания. Среди щелочных продуктов можно перечислить зелень, репу, огурцы, хрен, сельдерей, лимоны, свеклу, морковь, капусту, цитрусовые, смородину, виноград, вишню, сухофрукты, картофель, перец, помидоры, чеснок.
Среди щелочных продуктов можно перечислить зелень, репу, огурцы, хрен, сельдерей, лимоны, свеклу, морковь, капусту, цитрусовые, смородину, виноград, вишню, сухофрукты, картофель, перец, помидоры, чеснок.
Примечательно, что в составе нейтральных продуктов содержатся и кислоты, и щёлочи. Это растительное, сливочное масло.
Интересно, что молоко — это щелочной продукт. Но тёплое или кипячёное молоко – кислый продукт.
Щёлочи активно используются человеком. При этом следует помнить и в обязательном порядке соблюдать правила техники безопасности.
Химия
ОСНОВАНИЯ
Оглавление:
1. Определение
2. Классификация
3. Электролитическая
диссоциация
4. Получение
5. Важнейшие химические
свойства
6. Задания
7. Ответы
Ответы
| Основания – это сложные вещества, состоящие из катионов металлов и одного или нескольких гидроксид-анионов (ОН—) |
КЛАССИФИКАЦИЯ
1. По растворимости в воде различают растворимые основания (щёлочи) и нерастворимые основания.
2. По числу гидроксид-анионов различают однокислотные, двухкислотные и трёхкислотные основания.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Растворимые основания при растворении в воде
диссоциируют на катионы металлов и гидроксид-анионы.
NaOH → Na+ +
OH—
KOH → K+ + OH—
Ba(OH)2 → Ba2+
+ 2OH—
ПОЛУЧЕНИЕ
Соль + щёлочь = основание + другая соль
CuSO4 + 2NaOH = Cu(OH)2 +
Na2SO4
K2CO3
+ Ba(OH)2 = 2КОН+BaCO3
Получение щелочей:
1. Активный металл + вода = щёлочь + водород
Активный металл + вода = щёлочь + водород
2Na+2H2O = 2NaOH + H2↑
2. Основный оксид + вода = щёлочь
Li2O + H2O = 2LiOH
ВАЖНЕЙШИЕ ХИМИЧЕСКИЕ СВОЙСТВА
1. Реакция нейтрализации: основание +
кислота = соль + вода
NaOH +
HCl = NaCl + H2O
2. Щёлочь + соль = основание + другая соль
2NaOH + CuSO4 = Cu(OH)2 +
Na2SO4
3. Щёлочь + кислотный оксид = соль + вода
2NaOH +
SO3 = Na2SO4
+ H2O
4. Нерастворимые основания разлагаются при нагревании:
основание = оксид металла + вода
Cu(OH)2
= CuO + H2O
5. Растворы щелочей (благодаря диссоциации на ионы) изменяют
окраску индикаторов:
Лакмус: синий→розовый
ЗАДАНИЯ
Задание 1. Из приведённого перечня выберите
основания, назовите их, определите тип.
Из приведённого перечня выберите
основания, назовите их, определите тип.
1) NaOH 2)
Li2O 3) Ba(OH)2 4)
CuSO4 5) P2O5 6) Al(OH)3
7) HCl 8) C2H5OH
Задание 2. С какими из перечисленных веществ
может реагировать а) NaOH б)
Cu(OH)2
1)Na2O 2)SO3 3)H2O
4)NaOH 5)H2SO4 6)Na2SO4
7) HCl 8) AlCl3
ОТВЕТЫ.
Наверх
Новости школы -Подготовка к ЕГЭ по химии. Часть А-3.
Неорганические вещества, их номенклатура, классификация.
Характерные химические свойства неорганических веществ
различных классов
Обязательный минимум знаний
Схема 2
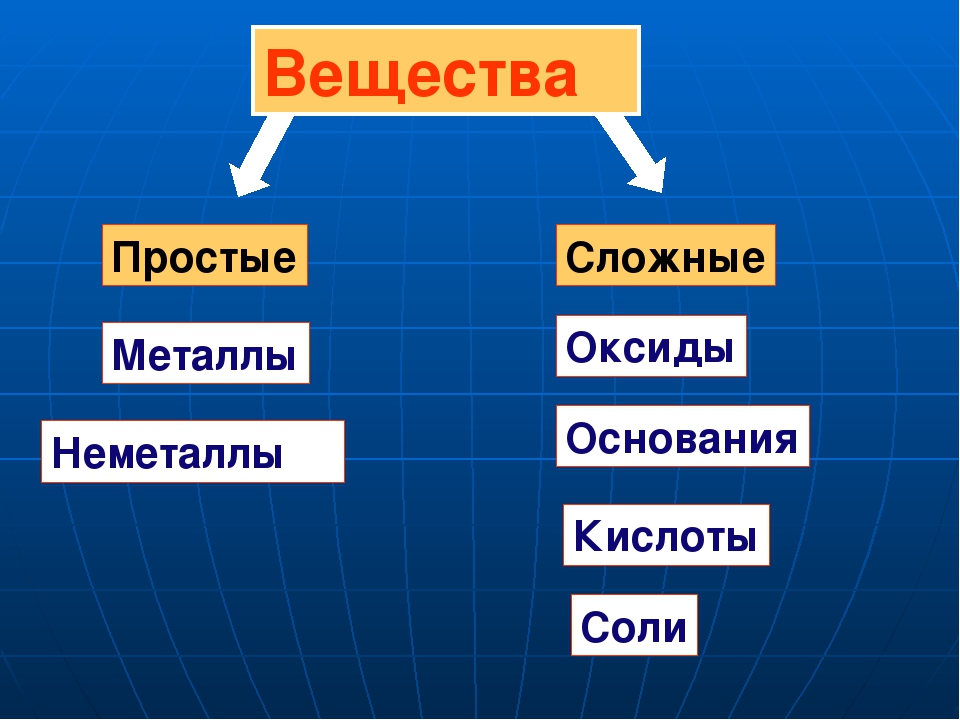
Классификация неорганических веществ
Вещества
Простые Сложные
Металлы Благородные Оксиды Соли
газы
Неметаллы Кислоты Основания
Схема 3
Оксиды и их классификация
Оксиды – бинарные соединения с кислородом в с. о. – 2
о. – 2
Несолеобразующие Солеобразующие
N2O, NO, CO 1. Основные – оксиды металлов в с.о. +1, +2
(оксиды металлов IА и IIА групп но не ZnO,
BeO), оксиды металлов в низших с.о. (СrO, FeO)
2. Кислотные – оксиды неметаллов (N2O5, SO2,
SO3) и металлов с высокой с.о. +5,+6,+7, (CrO3, Mn2O7).
3. Амфотерные — ZnO, BeO, Al2O3,
оксиды металлов в промежуточных с.о. (Cr2O3, Fe2O3).
Таблица 2
Характерные химические свойства солеобразующих оксидов
Гр. Свойства | Основные оксиды | Кислотные оксиды | Амфотерные оксиды |
Образуют соль и воду в реакции обмена при взаимодействии | с кислотами | с основаниями | и с кислотами, и с основаниями |
Образуют соль в реакции соединения при взаимодействии | с кислотными и амфотерными оксидами | с основными и амфотерными оксидами | с основными и кислотными оксидами |
Образуют растворимый гидроксид при взаимодействии с водой | щелочи | кислородсодержащие кислоты | не взаимодействуют с водой |
Основания
Основания (в свете атомно-молекулярного учения) – сложные вещества, состоящие из металла и гидроксогрупп.
Основания (в свете теории электролитической диссоциации) – электролиты, диссоциирующие на катионы металла и анионы гидроксогрупп.
Основания (в свете протонной теории) – акцепторы катионов водорода.
Таблица 3
Классификация оснований
Характерные химические свойства оснований
и амфотерных гидроксидов
1. 1) Основание (или амфотерный гидроксид) + кислота = соль + вода
2) Бескилородное основание (аммиак, амины) + кислота = соль
2. Основание + кислотный оксид = соль + вода
3. Щелочь + растворимая соль = новая соль + новое основание (если образуется осадок или газ)
4. Щелочь + амфотерный гидроксид = соль + вода
t
5. Нерастворимые основания (или амфотерный гидроксид) =
= оксид металла + вода
Кислоты
Кислоты (в свете атомно-молекулярного учения) – сложные вещества, состоящие из атомов водорода и кислотного остатка.
Кислоты (в свете теории электролитической диссоциации) – электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка.
Кислоты (в свете протонной теории) – доноры катионов водорода.
Характерные химические свойства кислот
1. Кислота + металл = соль + водород, если:
— металл находится в ряду напряжений до водорода,
— образуется растворимая соль,
— кислота растворима,
Примечания:
· щелочные металлы для реакций с растворами кислот не берут, так как они взаимодействуют, в первую очередь, с водой,
· азотная кислота любой концентрации и концентрированная серная кислота взаимодействует с простыми веществами по-особому (см. табл. 5)
2. Кислота + оксид металла (основный или амфотерный) = соль + вода
3. Кислота + основание (гидроксид или бескислородное основание) = соль +
+ вода (для бескилородных оснований — только соль).
4. Кислота + соль = новая кислота + новая соль (если образуется осадок, газ или слабый электролит).
Таблица 4
Классификация кислот
Соли
Соли (в свете атомно-молекулярного учения) – сложные вещества, состоящие из ионов металла и кислотного остатка.
Соли (в свете теории электролитической диссоциации) – электролиты, диссоциирующие на катионы металла и анионы кислотного остатка.
Примечание. Эти определения справедливы только для нормальных или средних солей.
Схема 4
Классификация солей
Соли
Средние Кислые Основные Двойные Комплексные
или нормальные Сa (HCO3)2, (CuOH)CO3, (NH4)2Fe (SO4)2, K3[Fe (CN)6]
NaCl, K2SO4, NaHSO4, Al (OH)2Cl, KAl (SO4)2, K4[Fe (CN)6]
CaCO3, RCOONa KH2PO4 Fe (OH)SO4 KCl∙NaCl
Характерные химические свойства солей
1. Соль + кислота = новая кислота + новая соль (если образуется осадок или газ).
Соль + кислота = новая кислота + новая соль (если образуется осадок или газ).
2. Растворимая соль + щелочь = новая соль + новое основание (если образуется осадок или газ)
3. Соль1 (раствор) + соль2 (раствор) = соль3 + соль4 (если образуется осадок)
4. Соль (раствор) + металл = новая соль + новый металл, если:
· металл находится в ряду напряжений до металла соли,
· образуется растворимая соль.
Примечание: щелочные металлы для реакций с растворами солей не берут, так как они взаимодействуют, в первую очередь, с водой.
Примеры тестовых заданий и
рекомендации к их выполнению
1. Только солеобразующие оксиды находятся в ряду
1) P2O5, ZnO, NO
2) CO, N2O5, Na2O
3) Al2O3, N2O, N2O3
4) SiO2, BeO, CaO
Это задание следует выполнить методом исключения тех рядов веществ, в которых содержаться формулы несолеобразующих оксидов, так как таких оксидов немного и их нужно знать. Исключаются варианты ответов 1-3. Ответ 4.
Исключаются варианты ответов 1-3. Ответ 4.
2. Амфотерными гидроксидами являются вещества, формулы которых
1) CsOH и Cr (OH)2
2) KOH и Ca (OH)2
3) Be (OH)2и Cr (OH)3
4) NaOH и Mg (OH)2
Это задание также следует выполнить методом исключения тех пар веществ, в которых содержатся формулы щелочей, так как таких веществ в школьном курсе изучается немного и их следует знать. Ответ 3.
3. Кислотными оксидами являются вещества, формулы которых
1) N2O3, N2O5, CrO3
2) Cr2O3, CrO, N2O
3) NO, Na2O, P2O5
4) SiO2, BeO, CaO
Для быстрого определения верного ответа из предложенных вариантов необходимо исключить те, в которых встречаются оксиды металлов в с. о. +1, +2, +3, т.е. варианты 2, 3, 4. В первом варианте также встречается оксид металла CrO3, но в с.о. +6, т.е. кислотный оксид. Ответ 1.
о. +1, +2, +3, т.е. варианты 2, 3, 4. В первом варианте также встречается оксид металла CrO3, но в с.о. +6, т.е. кислотный оксид. Ответ 1.
4. Содержит все три типа гидроксидов ряд веществ, формулы которых
1) H2SO4, Ca (OH)2, NaOH
2) Cr (OH)3, Cr (OH)2, H2CrO4
3) NaOH, HNO3, Mg (OH)2
4) KOH, HClO4, Ba (OH)2
Достаточно сложное, многофакторное задание, которое требует знания ряда химических понятий: гидрооксиды (это понятие объединяет основания, амфотерные гидрооксиды и кислородсодержащие кислоты), зависимость свойств оксидов и гидроксидов металлов от величины с.о. (как правило, оксид и гидроксид с низшей с. о. проявляют основные свойства, с высшей – кислотные, с промежуточной — амфотерные), а, следовательно, и знание понятия с.о. Экзаменующийся должен найти ряд формул, в котором будут записаны основание, кислота и амфотерный гидроксид. Следовательно, можно исключить те ряды, в которых содержится два гидроксида одного типа: 1,3,4, — т.к. они содержат по два основания каждый. Ответ 2.
о. проявляют основные свойства, с высшей – кислотные, с промежуточной — амфотерные), а, следовательно, и знание понятия с.о. Экзаменующийся должен найти ряд формул, в котором будут записаны основание, кислота и амфотерный гидроксид. Следовательно, можно исключить те ряды, в которых содержится два гидроксида одного типа: 1,3,4, — т.к. они содержат по два основания каждый. Ответ 2.
5. Формулы только кислых солей записаны в ряду
1) K2SO4, KOH, H2SO4, NaHCO3
2) Fe (HSO4)2, CaHPO4, CaCO3, Ca (OH)NO3
3) NH4HSO4, NH4NO3, (NH4)2HPO4, (NH4)2 CO3
4) NaH2PO4, Na2HPO4, NaHCO3, NaHS
Для быстрого определения верного ответа нужно ориентироваться на ключевое словосочетание «кислая соль», т. е. соль, содержащая атом водорода в составе кислотного остатка. Все четыре соли должны отвечать этому требованию. Ответ 4.
е. соль, содержащая атом водорода в составе кислотного остатка. Все четыре соли должны отвечать этому требованию. Ответ 4.
6. Двухосновная, растворимая, кислородсодержащая, сильная и стабильная кислота имеет формулу
1) H2SO3 2) H2S 3) H2SO4 4) H2S2O3
Условию задания отвечает вариант 3, т.к. любому школьнику известно, что сернистая кислота нестабильна, а сероводородная – слабая. Тиосерная кислота для обычного школьника представляет собой «экзотику», поэтому необходимо остановиться на привычной и хорошо известной серной кислоте. Ответ 3.
7. Средняя соль, амфотерный гидроксид и основная соль соответственно расположены в ряду
1) Сa (НСO3)2, Be (OH)2, Fe (OH)Cl2
2) K2CO3, Н3AlO3, Cu (OH)NO3
3) NaHSO3, H3CrO3, Fe (OH)SO4
4) ZnSO4, H3PO4, Cr (OH)Cl2
Для успешного выполнения этого задания необходимо мысленно разделить предложенные ответы на три подстолбика. Анализируя первый столбик, приходим к выводу, что условию задания не соответствуют ответ 3. При анализе второго подстолбика исключаем варианты ответов 1 и 4, следовательно, верный ответ – 2 (обращаем внимание, что амфотерный гидроксид может быть записан как Аl (OH)3, так и Н3AlO3 или HAlO2∙H2O). Ответ 2.
Анализируя первый столбик, приходим к выводу, что условию задания не соответствуют ответ 3. При анализе второго подстолбика исключаем варианты ответов 1 и 4, следовательно, верный ответ – 2 (обращаем внимание, что амфотерный гидроксид может быть записан как Аl (OH)3, так и Н3AlO3 или HAlO2∙H2O). Ответ 2.
8. Формулы средней, кислой и основной солей соответственно записаны в ряду
1) Cu (HSO4)2, Cu (OH)NO3, CuCl2
2) CaCO3, Ca (HCO3)2, Ca (OH)Cl
3)FeSO4, Fe (OH) Cl, Fe (OH)2Cl
4) BaSO4, Ba (OH)NO3, Ba (H2PO4)2
Успешное выполнение этого задания зависит от ключевого слова «соответственно», которое задает порядок поиска верного ответа: средняя, кислая и основная соли. Методика поиска может строиться на нахождении средней соли в первом вертикальном подстолбике (основной соли в последнем подстолбике, или кислой соли в среднем подстолбике). Ответ 2.
Методика поиска может строиться на нахождении средней соли в первом вертикальном подстолбике (основной соли в последнем подстолбике, или кислой соли в среднем подстолбике). Ответ 2.
9. В следующей характеристике гидроксида бария неверно положение
1) кислородсодержащее основание, щелочь
2) сильное двухкислотное основание
3) способно образовать два ряда солей – средние и основные
4) летучее, непрочное соединение
Ключевым словосочетанием к выполнению задания является «неверно положение», оно и позволит определить искомый ответ. Ответ 4.
10. Оксиду фосфора (V) не соответствует кислота, формула которой
1) H3PO4 2) H4P2O7 3)H3PO3 4) HPO3
Ключом к решению этого задания является положение о том, что с. о. элемента, образующего оксид и соответствующий ему гидроксид (в нашем случае – фосфорные кислоты), должны быть одинаковы. Этому условию не отвечает ответ 3, который и будет правильным. Ответ 3.
о. элемента, образующего оксид и соответствующий ему гидроксид (в нашем случае – фосфорные кислоты), должны быть одинаковы. Этому условию не отвечает ответ 3, который и будет правильным. Ответ 3.
11. Соль и водород образуются при взаимодействии разбавленной серной кислоты с каждым из металлов ряда
1) Al, Zn, Cu 2) Zn, Fe, Pb 3) Mg, Zn, Fe 4) Pb, Cu, Ag
Разбавленная серная кислота проявляет характерные свойства кислот, а потому не будет реагировать с металлами, стоящими в ряду напряжений после водорода, что автоматически исключает ответы 1 и 4. Варианты 2 и 3 предлагают металлы, стоящие в ряду напряжений до водорода. Какой выбрать? Очевидно, следует исключить из числа вероятных ответ 2, так как он содержит свинец, а сульфат свинца (II) – практически нерастворимая соль, о чем свидетельствует соответствующая клеточка в таблице растворимости. Ответ 3.
Ответ 3.
12. При термическом разложении нерастворимых оснований образуются
1) оксид неметалла и вода
2) водород и оксид металла
3) вода и оксид металла
4) металл и вода
Как неверные, должны быть исключены ответы 1, 2 и 4. Ответ 3.
13. С раствором хлорида меди (II) не реагирует
1) Mg 2) Zn 3) Fe 4) Ag
Легкое заданий на знание ряда напряжений металлов. Ответ 4.
14. С раствором сульфата меди (II) не реагирует
1)Pb 2)Zn 3) Fe 4) Mg
Задание аналогично предыдущему, но с учетом условий протекания реакций между раствором соли и металлом. Реакция идет, если образующаяся соль растворима в воде. Следовательно, верный ответ 1, так как сульфат свинца (II) практически не растворим. Ответ 1.
Реакция идет, если образующаяся соль растворима в воде. Следовательно, верный ответ 1, так как сульфат свинца (II) практически не растворим. Ответ 1.
15. Основание образуется при взаимодействии с водой оксида, формула которого
1) Fe2O3 2) CuO 3) CaO 4) FeO
В основе поиска верного ответа лежит знание о том, что оксиды металлов взаимодействуют с водой лишь в случае образования растворимого гидроксида – щелочи. Следовательно, это должен быть оксид щелочного или щелочноземельного металла. Ответ 3.
16. Серебро из раствора нитрата серебра вытесняют все металлы ряда
1) Na, Cr, Zn 2) K, Fe, Cu 3) Fe, Zn, Cu 4) Zn, Fe, Au
Задание на знание свойств солей и ряда напряжений металлов. Обратите внимание на тот факт, что медь в ряду напряжений стоит после водорода, но перед серебром. Ответ 3.
Обратите внимание на тот факт, что медь в ряду напряжений стоит после водорода, но перед серебром. Ответ 3.
17. При взаимодействии меди с концентрированной серной кислотой образуются
1) CuSO4, SO2, H2O
2) CuSO4, H2
3) CuO, SO2, H2O
4) Cu2SO4, SO2, H2O
Задание на знание свойств концентрированной серной кислоты, которая при взаимодействии с металлами, стоящими в ряду напряжений до и после водорода, образует соль, воду и один из продуктов восстановления сульфат-иона (SO2, S или H2S). Это знание позволит выбрать ответы 1 и 4. Более вероятен ответ 1, так как серная кислота – сильный окислитель и образование Cu2SO4 неневозможно. Ответ 1.
Ответ 1.
18. Железо способно вытеснять из растворимых солей – нитратов магния, свинца (II), меди (II), ртути (II), серебра – металлы
1) Mg, Pb, Cu, Hg, Ag
2) Pb, Cu, Hg, Ag
3) Cu, Hg, Ag
4) Hg, Ag
Задание на знание свойств солей и ряда напряжений металлов. Ответ 2.
19. Медь не взаимодействует с
1) разбавленной серной кислотой
2) концентрированной серной кислотой
3) разбавленной азотной кислотой
4) концентрированной азотной кислотой
Так как разбавленная серная кислота проявляет характерные свойства растворов кислот, то она не взаимодействует с металлами, стоящими в ряду напряжений металлов после водорода. Верный ответ, записанный в вариантах первым, позволит другие ответы не рассматривать. Ответ 1.
20. И с гидроксидом натрия, и с соляной кислотой реагирует
И с гидроксидом натрия, и с соляной кислотой реагирует
1) СaO 2) BeO 3) SiO2 4) P2O5
И с кислотой, и со щелочью взаимодействует амфотерный оксид. Ответ 2.
21. С гидроксидом бария реагирует ряд веществ, имеющих формулы
1) NaCl, Na2SO4, Na2CO3
2) HNO3, NaOH, K2SO4
3) ZnO, K2O, CO2
4) Al (OH)3, CuSO4, HCl
Так как Ba (OH)2 – щелочь, то знание свойств растворимых оснований и особенностей протекания реакций с их участием позволит определить верный ответ – 4. К такому результату можно прийти, исключив варианты 2 (он включает щелочь) и 3 (он, кроме амфотерного и кислотного, включает основный оксид). Остаются варианты 1 и 4. Все соединения первого варианта – соли, но если две последние соли образуют осадок с гидроксидом бария, то первая – нет. Ответ 4.
Остаются варианты 1 и 4. Все соединения первого варианта – соли, но если две последние соли образуют осадок с гидроксидом бария, то первая – нет. Ответ 4.
22. Сульфат железа (II) не может быть получен взаимодействием
1) железа с разбавленной серной кислотой
2) железа с раствором медного купороса
3) железа с раствором сульфата магния
4) гидроксида железа (II) с разбавленной серной кислотой
Задание на знание свойств классов неорганических соединений: кислот, солей, гидроксидов. Это знание позволит определить верный ответ. Ответ 3.
23. Веществами, при взаимодействии которых образуется соль, являются
1) щелочь и основный оксид
2) основный оксид и вода
3) кислотный оксид и щелочь
4) кислотный оксид и вода
Несложное задание на знание химических свойств оксидов.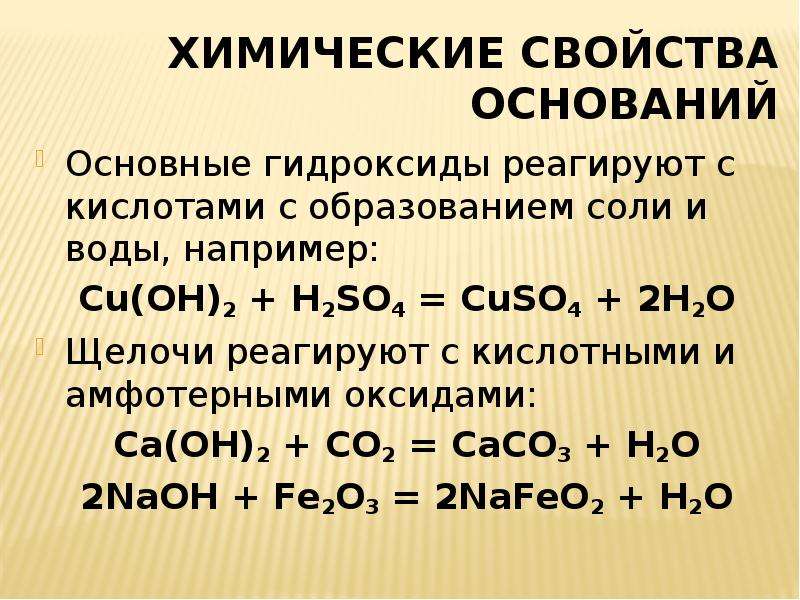 Ответ 3.
Ответ 3.
24. В цепочке превращений
S →X1→SO3→X2→CuSO4→X3→CuO→Cu
веществами X1,X2 и X3 являются соответственно
1) H2S, H2SO4, Cu (OH)2
2) FeS, H2SO4, Cu (OH)2
3) SO2, H2SO4, CuCl2
4) SO2, H2SO4, Cu (OH)2
Ответы 1 и 2 следует отбросить, так как при окислении сероводорода и сульфида железа (II) образуется не SO3, а SO2. В варианте 3 первые два искомых вещества указаны верно, а CuCl2 — нет, поскольку эту соль превратить в оксид в одну стадию нельзя. Ответ 4.
В варианте 3 первые два искомых вещества указаны верно, а CuCl2 — нет, поскольку эту соль превратить в оксид в одну стадию нельзя. Ответ 4.
25. В цепочке превращений
Сa → X1 → Ca (OH)2 →X2 →Ca (HCO3)2 → X2 → CaO
веществами X1, X2 являются соответственно
1) CaCl2, СaCO3,
2) CaO, Ca (NO3)2
3) CaО, СaCO3
4) CaО, Ca3 (PO4)2
Вещество X1 определить несложно – это CaO. Вещество X2 – не может быть никакой другой солью, кроме карбоната, так как следующее звено представляет собой кислую соль угольной кислоты – гидрокарбонат кальция. Ответ 3.
Вещество X2 – не может быть никакой другой солью, кроме карбоната, так как следующее звено представляет собой кислую соль угольной кислоты – гидрокарбонат кальция. Ответ 3.
26. В цепочке превращений
Zn → X1 → Zn (NO3)2 → X2 → Na2ZnO2 →ZnCl2→AgCl→X3
веществами X1, X2 и X3 являются соответственно
1) ZnCl2, ZnO, Ag
2) ZnO, Zn (OH)2, Ag
3) ZnSO4, Zn (OH)2, PbCl2
4) ZnO, Zn (OH)2, AgNO3
Рассуждения, аналогичные приведенным выше, но с учетом амфотерности гидроксида цинка, позволят определить вещества X1, X2 — ZnO, Zn (OH)2 соответственно.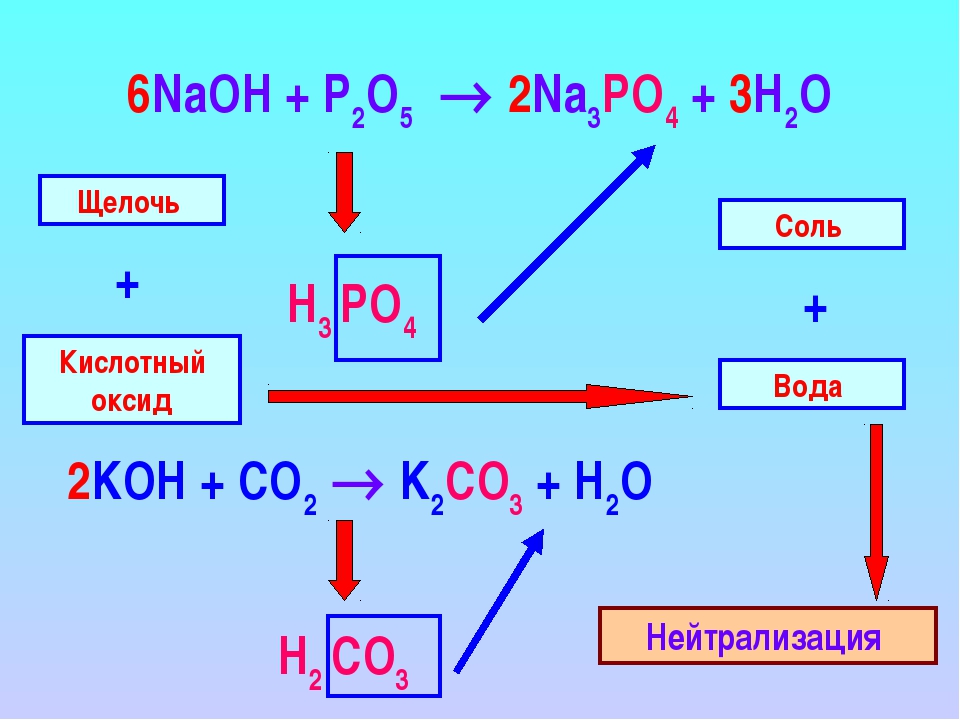 Вещество X3 средней солью быть не может, так как AgCl нерастворим. Это даст возможность исключить ответы 3 и 4. Теперь, даже не зная способности хлорида серебра к разложению, нетрудно выбрать верный ответ. Ответ 2.
Вещество X3 средней солью быть не может, так как AgCl нерастворим. Это даст возможность исключить ответы 3 и 4. Теперь, даже не зная способности хлорида серебра к разложению, нетрудно выбрать верный ответ. Ответ 2.
27. В схеме превращений
X1 X2 X3
AlCl3 → Al (OH)3 → NaAlO2 → AlCl3
веществами X1,X2 и X3 являются соответственно
1) H2O, NaOH, NaCl
2) H2O, Cu (OH)2, HCl
3) NaOH, NaCl, HCl
4) NaOH, Na2O, HCl
Непростое задание на знание свойств солей и амфотерных гидроксидов. Для выпускников определение X2 представляет сложность, т. к.существует стереотип, что амфотерные гидрооксиды выступают в роли кислот при взаимодействии со щелочами – т.е. NaAlO2 можно получить взаимодействием Al (OH)3 с NaOH. Однако автор тестового задания уже использовал это соединение для X1 и в качестве X2 предложил Na2O. Ответ 4.
к.существует стереотип, что амфотерные гидрооксиды выступают в роли кислот при взаимодействии со щелочами – т.е. NaAlO2 можно получить взаимодействием Al (OH)3 с NaOH. Однако автор тестового задания уже использовал это соединение для X1 и в качестве X2 предложил Na2O. Ответ 4.
28. Вещество, которое может реагировать с фосфорной кислотой, гидроксидом натрия и цинком, имеет формулу
1) Al (OH)3 2) Ba (NO3)2 3) CuCl2 4) NaHCO3
Для решения этого задания необходимо отнести каждое из предложенных веществ к соответствующей группе: амфотерный нерастворимый гидроксид, две средние соли, кислая соль. Со всеми перечисленными в условии веществами реагирует только CuCl2. Ответ 3.
Ответ 3.
29. Веществу, которое может реагировать с хлором, нитратом серебра и ацетатом свинца, соответствует формула
1) KI 2) Cu 3) K2SO4 4) NaF
Задание более сложное, чем 28, так как требует знания о «ряде активности галогенов» (каждый предыдущий галоген вытесняет каждый последующий из растворов галогеноводородных кислот и их солей), а также знание номенклатуры солей органических кислот: ацетату свинца соответствует формула (CH3COO)2Pb. Обращение к таблице растворимости и учет условий взаимодействия растворов солей между собой позволят прийти к правильному решениию. Ответ 1.
30. Верны ли следующие суждения применительно к солям
А) В результате взаимодействия кислых солей со щелочами образуются средние соли
Б) В результате взаимодействия средних солей с основаниями образуются кислые соли
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Второе утверждение неверно, т. к. результатом взаимодействия средних солей с основаниями образуются не кислые соли, а основные. Первое суждение верно. Ответ 1.
к. результатом взаимодействия средних солей с основаниями образуются не кислые соли, а основные. Первое суждение верно. Ответ 1.
Задания для самостоятельной работы
1. В перечне веществ
1) N2O
2) N2O5
3) N2O3
4) CO2
5) NO
6) CO
к несолеобразующим оксидам относятся вещества, формулы которых обозначены цифрами:
1) 1,4,6 2) 3,5,6 3) 1,5,6 4) 4,5,6
2. Амфотерными оксидами являются вещества
1) оксид серы (IV), оксид железа (III)
2) оксид цинка, оксид кальция
3) оксид хрома (III), оксид бериллия
4) оксид алюминия, оксид магния
3. Основными оксидами являются вещества
1) оксид кальция, оксид хрома (II)
2) оксид калия, оксид олова (IV)
3) оксид меди (I), оксид алюминия
4) оксид бериллия, оксид железа (П)
4. Содержит все три типа гидроксидов ряд веществ
Содержит все три типа гидроксидов ряд веществ
1) H3AlO3, Fe (OH)3, H2SO4
2) H2ZnO2, H3PO4, Ba (OH)2
3) H2BeO2, HCI, Cu (OH)2
4) H2CO3, H2CrO4, NaOH
5. Формулы только основных солей записаны в ряду
1) (CaOH)2SO4, Ca (OH)2, CaOHCl
2) Fe (OH)3, Fe (OH)2NO3, [Fe (OH)2]SO4
3) MnOHNO3, CuOHCl2, Mg (OH)2
4) FeOHCl2, FeOHCl, [Fe (OH)2]SO4
6. Двухкислотное, растворимое, нелетучее и стабильное основание имеет формулу
1) Mg (OH)2 2) NH3 3) NaOH 4) Ва (ОН)2
7. Кислая соль, амфотерный гидроксид и основная соль соответственно расположены в ряду
Кислая соль, амфотерный гидроксид и основная соль соответственно расположены в ряду
1) Na2SO4, Be (OH)2, Fe (OH)Cl2
2) K2CO3, Н3AlO3, Cu (OH)NO3
3) NaHSO3, H3CrO3, Fe (OH)SO4
4) ZnSO4, H3PO4, Cr (OH)Cl2
8. Формулы средней, кислой и основной солей соответственно записаны в ряду
1) Cu (HSO4)2, Cu (OH)NO3, CuCl2
2) CaCO3, Ca (HCO3)2, Ca (OH)Cl
3) FeSO4, Fe (OH) Cl, Fe (OH)2Cl
4) BaSO4, Ba (OH)NO3, Ba (H2PO4)2
9. Гидроксид алюминия – это
1) амфотерный гидроксид
2) трехкислотное основание
3) щелочь
4) летучее основание
10. Оксиду марганца (VII) соответствует гидроксид, формула которого
Оксиду марганца (VII) соответствует гидроксид, формула которого
1) Mn (OH)2 2) MnO (OH) 3) H2MnO4 4) HMnO4
11. Водород можно получить при взаимодействии
1) меди с разбавленной азотной кислотой
2) свинца с концентрированной азотной кислотой
3) цинка с концентрированной серной кислотой
4) алюминия с концентрированным раствором гидроксида калия
12. При термическом разложении нитрата серебра образуются
1) оксид серебра и оксид азота (V)
2) серебро, оксид азота (IV) и кислород
3) серебро, азот и кислород
4) оксид серебра, оксид азота (II) и кислород
13. С раствором щелочи не реагирует
1) Mg 2) Zn 3) Al 4) Be
14. С раствором сульфата меди (II) взаимодействует
1) Pb 2) Hg 3) Fe 4) Ag
15. Взаимодействием соответствующего оксида с водой нельзя получить
Взаимодействием соответствующего оксида с водой нельзя получить
1) Cu (OH)2 2) Ba (OH)2 3) H2SO4 4) NaOH
16. Медь из раствора сульфата меди (II) вытесняет все металлы ряда
1) Na, Cr, Zn
2) K, Fe, Cu
3) Fe, Zn, Al
4) Zn, Fe, Au
17. При взаимодействии меди с концентрированной азотной кислотой образуются
1) CuO, NO2, H2O
2) Cu (NO3)2, H2
3) Cu (NO3)2, NO, H2O
4) Cu (NO3)2, NO2, H2O
18. Окислительно-восстановительная реакция протекает при разложении соли, формула которой
1) NH4Cl 2) KMnO4 3) CaCO3 4) (CuOH)2CO3
19. C концентрированной азотной кислотой при комнатной температуре не взаимодействует
C концентрированной азотной кислотой при комнатной температуре не взаимодействует
1) медь
2) железо
3) серебро
4) цинк
20. С раствором серной кислоты реагируют все три вещества набора
1) СaO, NaOH, KCl
2) Cu (OH)2, HCl, CH3COONa
3) BaCl2, Zn, SiO2
4) MgCO3, Fe, Al (OH)3
21. И с соляной кислотой, и с водой реагирует
1) аммиак 2) хлор 3) никель 4) карбонат кальция
22. Сульфат железа (III) может быть получен взаимодействием железа с
1) разбавленной серной кислотой
2) раствором сульфата меди (II)
3) хлором
4) серой
23. Веществами, при взаимодействии которых не образуется соль, являются
1) кислотный оксид и щелочь
2) кислотный оксид и вода
3) основный оксид и кислота
4) кислота и основание
24. В цепочке превращений
В цепочке превращений
Ca →X1→Ca (OH)2 → X2→ CaO → X3→ AgCl
веществами X1,X2 и X3 являются соответственно
1) CaO, CaCO3, CaCl2
2) CaSO4, CaCO3, CaCl2
3) CaO, CaSO4, CaCl2
4) CaO, Ca (HCO3), CaCO3
25. В цепочке превращений
N2 → X1 → NO →X2 → HNO3
веществами X1, X2 являются соответственно
1) N2O, NO2
2) NO2, NH3
3) N2O3, N2O
4) NH3, NO2
26. В цепочке превращений
Al → X1 → Al2 (SO4)3 → X2 → KAlO2 →AlCl3→X2®Al2O3
веществами X1 и X2 являются соответственно
1) AlCl3, AlN
2) Al (OH)3, KAl (SO4)2
3) Al2O3, Al2S3
4) Al2O3, Al (OH)3
27. В схеме превращений
В схеме превращений
X1 X2 X3
SO2 → SO3 → H2SO4 → (NH4)2SO4
веществами X1,X2 и X3 являются соответственно
1) O2, H2O, NH3
2) NO2, H2, NH3
3) O2, H2O, N2
4) O2, H2, NH3∙H2O
28. Вещество, которое может реагировать с соляной кислотой, гидроксидом калия и алюминием, имеет формулу
1) Cl2 2) H2SO4 3) Сr2O3 4) Na2CO3
29. При нагревании не разлагается на простые вещества
1) аммиак 2) хлорид натрия 3) оксид ртути (II) 4) иодоводород
30. Верны ли следующие суждения применительно к кислотам
Верны ли следующие суждения применительно к кислотам
А) Любую кислоту можно получить растворением соответствующего кислотного оксида в воде
Б) Кислоты способны взаимодействовать со щелочами
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
03 Октябрь 2011, 15993 просмотра.
Комментарии
Шпаргалка для решения химических уравнений » 4ЕГЭ
Определения основных классов соединений1. Оксид – это сложное вещество, состоящее из двух элементов, один из которых кислород с валентностью II
Примеры оксидов: Na2O – оксид натрия, Al2O3 –оксид алюминия, H2O –оксид водорода (вода), CO2 – оксид углерода, P2O5 –оксид фосфора и т.д.
2. Кислота – это сложное вещество, состоящее из водорода и кислотного остатка. (Кислоты вы учили и знаете их)
3. Основание (щёлочь) – это сложное вещество, состоящее из металла и OH (гидрокси) группы. Например, NaOH-гидроксид натрия, Al(OH)3 –гидроксид алюминия и т.д.
Например, NaOH-гидроксид натрия, Al(OH)3 –гидроксид алюминия и т.д.
4. Соль – это сложное вещество, состоящее из металла и кислотного остатка. Например, NaCl –хлорид натрия, CaCO3 – карбонат кальция (мел).
Свойства кислот, солей, оснований и оксидов
1. Кислота +металл = соль + водород
2. Кислота + оксид металла = соль + вода
3. Кислота + щелочь (основание) = соль + вода
4. Кислота + соль = другая соль +другая кислота
5. Соль +кислота = другая соль + другая кислота
6. Соль + щелочь = основание + другая соль
7. Соль 1 + соль 2 = соль 3 + соль 4
8. Соль + металл = другая соль + другой металл
9. Щелочь + оксид неметалла = соль + вода
10. Щелочь + соль = Основание +новая соль (основание нерастворимое, выпадает в осадок)
11. Щелочь (основание) + кислота = соль + вода (уже знакомая реакция, в свойствах кислот)
12. Нерастворимое основание =(t) оксид металла и вода (реакция разложения)
13. Оксид металла + вода = щелочь
14. Оксид металла + кислота = соль + вода (уже встречали это свойство в кислотах)
Оксид металла + кислота = соль + вода (уже встречали это свойство в кислотах)
15. Оксид металла + оксид неметалла = соль
16. Оксид неметалла + щелочь = соль + вода
17. Оксид неметалла + вода = кислота
В каких случаях идёт реакция
1. Если металл в электрохимическом ряду напряжения стоит до водорода.
2. Металлы не должны взаимодействовать с водой, I и II группы ПСХЭ с водой реагируют.
3. В ходе реакции должна получится растворимая соль. (иначе образуется защитная пленка)
4. Реакция характерна для растворимых кислот. (кремниевая кислота не вступает в реакцию)
5. Концентрированные серная и растворы азотной кислоты реагируют иначе
6. Реакция идет до конца, если образуется осадок или газ.
7. Металл вытесняет из растворов солей все другие металлы расположенные правее его в электрохимическом ряду напряжений металлов
8. Обе соли должны быть растворимые
9. Металлы не должны взаимодействовать с водой (Металлы I и II группы, главной подгруппы с водой реагируют)
10. Оксид металла НЕ растворяется в воде (т.е. должно образоваться растворимое основание – щелочь)
Оксид металла НЕ растворяется в воде (т.е. должно образоваться растворимое основание – щелочь)
11. Оксид неметалла нерастворим в воде.
Гидроксиды, щелочи и основания — Справочник химика 21
Кислотам противостоит группа веществ, называемых основани ями. (Сильные основания получили название щелочей.) Эти вещества имеют горький вкус, химически активны, меняют цвета-красителей, но на противоположные по сравнению с кислотами и т. д. Растворы кислот нейтрализуют растворы оснований. Другими словами, смесь кислоты и основания, взятых в определенной соотношении, не проявляет свойств ни кислоты, ни основания. Эта смесь представляет собой раствор соли, которая обычно химически значительно менее активна, чем кислота или основание. Таким образом, при смешении соответствующих количеств раство- ров сильной и едкой кислоты (соляной кислоты) с сильной и едкой щелочью (гидроксидом натрия) получается раствор хлорида натрия, т. е. обыкновенной поваренной соли. [c. 53]
53]
Свойства гидроксида церия (IV). К 1 мл раствора сульфата церия (IV) прилейте разбавленный раствор щелочи до получения желеобразного желтого осадка гидроксида церия (IV). Часть осадка перенесите в другую пробирку. В одну из них добавьте разбавленную серную кислоту, а в другую — концентрированный раствор гидроксида натрия или калия. На основании проведенных опытов сделайте вывод об амфотерных свойствах Се (ОН) 4. Какие свойства у Се (ОН) 4 преобладают кислотные или основные Напишите уравнения соответствующих реакций. Можно ли вместо серной кислоты использовать соляную, если редокс-потен-циал пары Се +/Се + равен -f-1,61 В Что произойдет, если к осадку Се (ОН) 4 прибавить концентрированную соляную кислоту [c.243]
Гидроксиды щелочных металлов МеОН — кристаллические вещества, растворимые в воде и спиртах. Их водные растворы — едкие щелочи — самые сильные основания. Гидроксиды получают электролизом водных растворов хлоридов .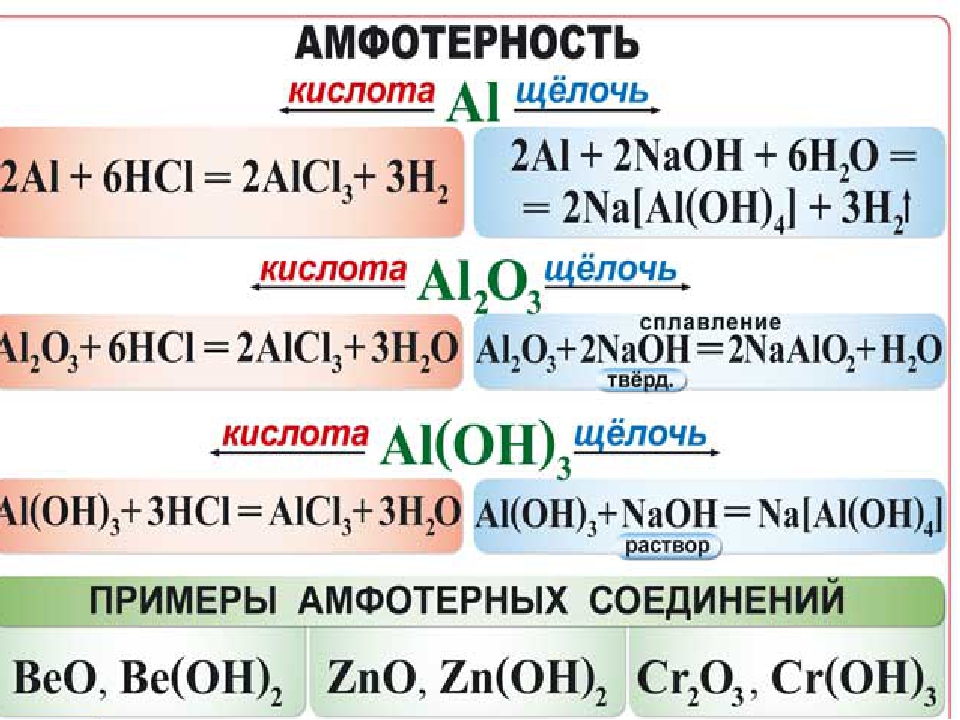 При этом в катодном пространстве выделяется водород и образуется гидроксид щелочного металла. Побочными продуктами производства являются водород и хлор (на аноде). При нейтрализации растворов гидроксидов щелоч- [c.116]
При этом в катодном пространстве выделяется водород и образуется гидроксид щелочного металла. Побочными продуктами производства являются водород и хлор (на аноде). При нейтрализации растворов гидроксидов щелоч- [c.116]
Наиболее простой механизм МФК в присутствии сильных щелочей (например, механизмы Н/В-обмена и изомеризации), по всей видимости, включают экстракцию гидроксида. Многие другие механизмы глубоко не изучены. В случае МФК механизмы могут сильно изменяться в зависимости от характера субстрата и условий реакции. Так, например, р-элиминирование может проходить межфазно, если катализатор облегчает стадию депротонирования. В то же время, если в органической фазе присутствуют малые количества ионов гидроксида четвертичного аммония, то и депротонирование будет осуществляться в этой же фазе. Однако известен еще и третий механизм. Он наблюдается в отсутствие оснований при повышенных температурах. В неполярных средах относительно несольватированные ионы галогенидов ведут себя как основания (см.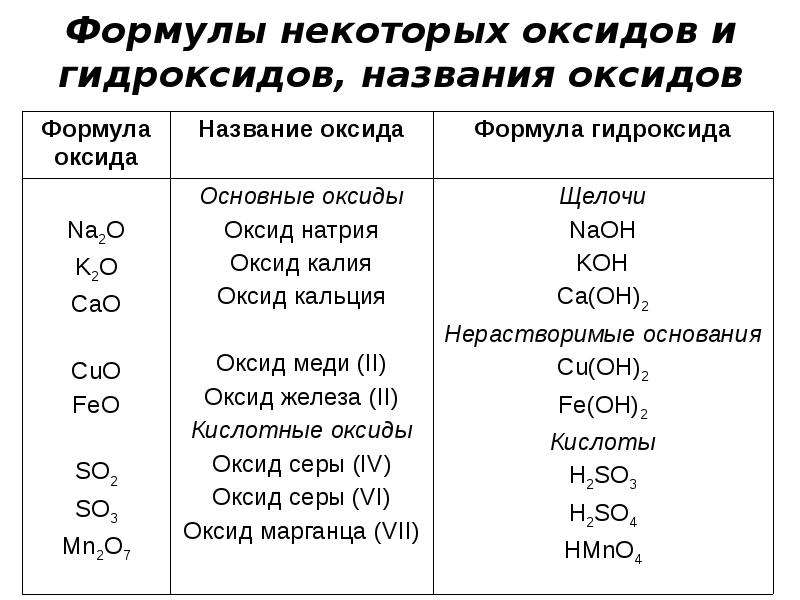 гл. 1) на-лример, пентахлорэтан дегидрохлорируется галогенидами аммония в условиях запатентованного промышленного процесса [c.64]
гл. 1) на-лример, пентахлорэтан дегидрохлорируется галогенидами аммония в условиях запатентованного промышленного процесса [c.64]
Обсудим вначале возможную роль размеров молекулы основания в приведенном выше случае-гидроксид-аниона. При рассмотрении элиминирования по Зайцеву было показано, что с увеличением объема молекулы основания увеличивается выход а-алкена и что наименьший выход последнего получают при использовании спиртовых растворов щелочей (основание-гидроксид-анион). При распаде четвертичных аммониевых оснований роль основания играет гидроксид-анион, но несмотря на это, главным продуктом реакции является а-алкен. Следовательно, объем молекулы основания не играет решающей роли в обсуждаемом превращении. [c.422]
Поскольку при обратимом гидролизе устанавливается динамическое равновесие, то в соответствии с законом действующих масс можно сместить это равновесие в ту или иную сторону за счет введения в раствор кислоты или основания.
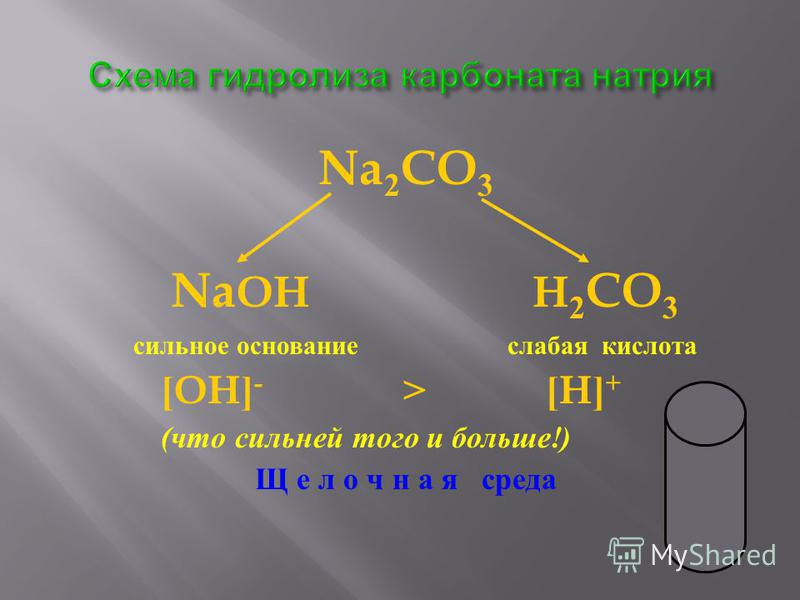
 Этим часто пользуются для усиления или подавления процесса гидролиза, в частности, с целью поддержания постоянной концентрации ионов водорода в растворе. Прибавление кислоты вызывает усиление гидролиза по аниону (смещение равновесия вправо в результате связывания ионов в воду) гидролиз по катнсну усиливается в присутствии щелочи. Таи, если к раствору буры N32840, добавить кислоту, т. е. связать гидроксид-ионы, то гидролиз [c.214]
Этим часто пользуются для усиления или подавления процесса гидролиза, в частности, с целью поддержания постоянной концентрации ионов водорода в растворе. Прибавление кислоты вызывает усиление гидролиза по аниону (смещение равновесия вправо в результате связывания ионов в воду) гидролиз по катнсну усиливается в присутствии щелочи. Таи, если к раствору буры N32840, добавить кислоту, т. е. связать гидроксид-ионы, то гидролиз [c.214]Гидроксиды, щелочи и основания [c.174]
Гидроксид магния Mg(0H)2 получается в виде малорастворимого белого осадка при действии щелочей на растворимые соли магния. В отличие от гидроксида бериллия гидроксид магния обладает только основными свойствами, представляя собой основание средней силы. [c.391]
Примеры сильных оснований гидроксиды щелочных металлов (LiOH, NaOH, КОН и др.). Их называют также щелочами. Гидроксиды щелочноземельных металлов (Са(ОН) , Ba(OH) и др.) тоже можно считать сильными основаниями. Их растворимость меньше, чем растворимость гидроксидов щелочных металлов, но намного больше растворимости гидроксидов остальных металлов. [c.126]
Их растворимость меньше, чем растворимость гидроксидов щелочных металлов, но намного больше растворимости гидроксидов остальных металлов. [c.126]
Гидроксиды — соединения, содержащие одну или несколько гидроксогрупп ОН. Гидроксиды щелочных и щелочно-земельных металлов имеют явно выраженный оснбвный характер, их называют щелочами. Гидроксиды других металлов являются слабыми основаниями или амфотерными соединениями. Основания при электролитической диссоциации в качестве анионов образуют только гидроксид-ионы. [c.26]
Гидроксиды элементов подгруппы ИА Э (ОН) 2 более слабые основания, чем гидроксиды щелочных металлов. Основные свой-, ства гидроксидов увеличиваются от Ве(0Н)2 к Ва(ОН)г Ве(0Н)2 и Mg(0H)2 — слабые основания, Ва(0Н)5 — щелочь. Усиление основных свойств от Ве(0Н)2 к,Ва(0Н)2 проявляется и в том, что для реакции [c.315]
Как основание гидроксид натрия сильнее, чем гидроксид кальция. Однако равновесие реакции сдвинуто вправо из-за образования нерастворимого карбоната кальция. Щелочи идут на приготовление электролитов щелочных аккумуляторов, на производство мыла, красок, целлюлозы. [c.145]
Щелочи идут на приготовление электролитов щелочных аккумуляторов, на производство мыла, красок, целлюлозы. [c.145]
К амфотерным гидроксидам относят те гидроксиды, которые взаимодействуют и с растворами щелочей, и с растворами кислот с образованием соли и воды, т. е. проявляют свойства, характерные как для кислот, так и для оснований. [c.157]
На кривой титрования слабой кислоты сильным основанием,, например уксусной кйслоты гидроксидом калия (см. рис. 6.3),. иижняя ветвь кривой располагается в области высоких значений pH. По мере прибавления раствора КОН pH титруемого раствора сначала возрастает медленно, и только после того как будет исчерпана буферная емкость раствора, дальнейшее прибавление раствора щелочи вызывает быстрое увеличение pH. Интервал медленного возрастания pH отвечает состоянию системы, при котором концентрации свободной слабой кислоты и образовав шейся в результате нейтрализации соли примерно одинаковы [c.322]
В то время как гидроксид бериллия Ве(0Н)2 — типичное амфо-терное соединение, Mg(0H)2 — слабое основание, Са(0И)2, 5г(ОН)2, Ва(ОН)2 — щелочи. [c.264]
[c.264]
Гидроксиды ЭОН неустойчивы, являются слабыми основаниями. Аммиачные же комплексы типа Э1 (ЫНз)21 (ОН) значительно устойчивее и по силе приближаются к щелочам. [c.415]
Сегодня большинство людей покупают коммерческие мыла и чистяшие средства. А в XIX в. часто делали мыло сами — из щелочи (гидроксида натрия NaOH) и животного жира. Глицерилтрипальмитат реагирует со щелочью (основанием) и образует мыло — пальмитат натрия. Поэтому такое мыло содержит непрореагировавшую щелочь, которая может повредить коже. [c.467]
ЦИКлогёксай Превращается в трихлорбензол. Главным продуктом реакции является 1,2,4-трихлорбензол (выход 75—95 %), изомеры 1,2,3-трихлорбензол и 1,3,5-трихлорбензол получаются с выходом соответственно 3—20% и О— 7,6%. На различной скорости реакции изомеров гексахлорциклогексана с щелочами основан кинетический метод определения — зомера в смеси. Аналогичная реакция с отщеплением НС1 происходит при взаимодействии с гидроксидом кальция, аммиаком, органическими аминами и другими основаниями, а также при повышенной температуре (250—350 °С) в присутствии инициирующих веществ (хлор, железо, алюминий, их соли и др. ). При использовании в качестве инициатора хлора часть трихлорбензо-ла хлорируется, поэтому, кроме трихлорбензЬла, получаются продукты его хлорирования. При избытке хлора с хорошим выходом образуется гексахлорбензол. Эту реакцию используют в промышленности для получения из нетоксичных изомеров гексахлорциклогексана три-, тетра- и гексахлорбензолов. [c.58]
). При использовании в качестве инициатора хлора часть трихлорбензо-ла хлорируется, поэтому, кроме трихлорбензЬла, получаются продукты его хлорирования. При избытке хлора с хорошим выходом образуется гексахлорбензол. Эту реакцию используют в промышленности для получения из нетоксичных изомеров гексахлорциклогексана три-, тетра- и гексахлорбензолов. [c.58]
Калий и натрий, относятся к I группе системы элементов Д.И,Менделеева, их гидроксиды — сильные основания (щелочи). НН4 близок по свойствам к катиону К и образует несколько аиа/югичных малорастворимых солей. Очень важно, что соли аммония в отличие от солей 120 [c.120]
Основания классифицируют по их растворимости в воде и по их силе. По растворимости основания делятся на растворимые, или щелочи, и на нерастворимые. Важнейшие щелочи — это гидроксид натрия NaOH, гидроксид калия КОН м гидроксид кальция Са(0Н)2. По силе основания делятся на сильные и слабые ( 84).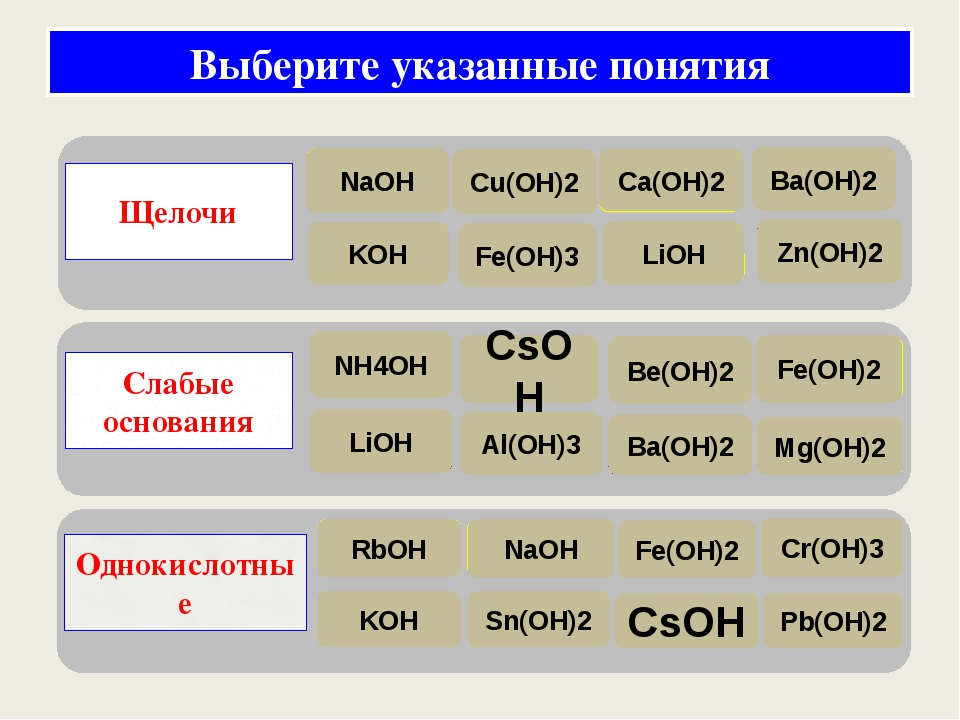 К сильным основаниям относятся все и1,елочи, кроме гидроксида аммония. Согласно международной поменклатуре, соединения, содержащие в своем составе гидроксогруппы, па.зывают г ид роке идам и. В случае металлов переменной валентности в скобках указывают валентность металла в данном основании. Так, Са(ОН)2—гидроксид кальция, Ре(ОН)2—гидроксид железа(П), Ре(ОН)з— гидроксид железа(III), [c.41]
К сильным основаниям относятся все и1,елочи, кроме гидроксида аммония. Согласно международной поменклатуре, соединения, содержащие в своем составе гидроксогруппы, па.зывают г ид роке идам и. В случае металлов переменной валентности в скобках указывают валентность металла в данном основании. Так, Са(ОН)2—гидроксид кальция, Ре(ОН)2—гидроксид железа(П), Ре(ОН)з— гидроксид железа(III), [c.41]
С водой Са и 1п не реагируют. Т1 медленно взаимодействует с ней, при этом образуется Т10Н и выделяется водород. Гидроксиды Оа(ОН)з, 1п(0Н)з, Т1(0Н)з получают, действуя щелочами на растворы солей Э+ . Гидроксиды Оа, 1п, Т1 — не растворимые в воде, слабые основания. Оа (ОН) з и 1п(0Н)з амфотерны, основная и кислотная диссоциация 0а(0Н)з происходят почти в одинаковой степени, у 1п(0Н)з преобладают основные свойства. соответствии со значениями Л0° для реакций [c.346]
Гидроксид Мп(0Н)2 выпадает в виде белого осадка при действии щелочей на растворы солей Мп +. Это основание средней силы, немного растворимое в воде (ПР 10 ). Поэтому реакция Мп » + 2ЫН40Н Мп(ОН)2 + 2МН [c.547]
Это основание средней силы, немного растворимое в воде (ПР 10 ). Поэтому реакция Мп » + 2ЫН40Н Мп(ОН)2 + 2МН [c.547]
При действии щелочей на растворы солей Си+ осаждается еиний гидроксид Си (ОН) 2. Это слабое основание, обладающее в небольшой степени амфотерными свойствами — оно растворяется в концентрированных растворах щелочей с образованием ярко-синих растворов гидроксокупратов М2[Си(ОН)4]. Гидроксид меди(П) легко разлагается при нагревании [c.586]
Гидроксиды лантаноидов Э(ОН)з практически неамфотерны, их основные свойства медленно уменьшаются при переходе от Се(ОН)з к Ьи(ОН)з (в связи с уменьшением г,). Гидроксид Се (ОН) 4 значительно более слабое основание, чем Се(ОН)з, и он слабо амфотерен цераты получают сплавлением СеОа со щелочами [c.605]
В пять пробирок налейте по 0,5—1 мл растворов солей АЬ(804)3, Сг2( 04)з, 2п804, РЬ(ЫОз)г, ЗЬСЦ. К каждому раствору прибавьте по каплям, при перемешивании, разбавленный раствор гидроксида натрия до получения обильного осадка гидроксида. Разделите содержимое каждой пробирки на две части. К одной прибавьте разбавленной серной или азотной кислоты, а ко второй — раствор щелочи до полного растворения осадков. На основании проделанных опытов, наблюдений запишите уравнения реакций. [c.59]
Разделите содержимое каждой пробирки на две части. К одной прибавьте разбавленной серной или азотной кислоты, а ко второй — раствор щелочи до полного растворения осадков. На основании проделанных опытов, наблюдений запишите уравнения реакций. [c.59]
Запись данных опыта. На основании результатов опыта сделать вывод о свойствах гидроксида свинца. Написать уравнения реакций получения гидроксида свинца, его диссоциации и растворения в кислоте и в щелочи, учитывая образование в щелочной среде комплексного аниона РЬ[(ОН)в] —гексагидроксоплюм-бата (И). Почему в данном опыте следует пользоваться азотной кислотой, а не хлороводородной или серной [c.177]
Гидроксиды содержат атом элемента и связанные с ним гидроксильные группы ОН. Гидроксильная группа ОН одновалентна. Гидроксиды металлов называют основаниями. Растворимые в воде основания называют щелочами. Чем ярче выражены металлические свойства элемента, тем выше основные свойства его гидроксида. Чем ярче выражены неметаллические свойства элемента, тем сильнее выражены кислотные свойства его гидроксида. [c.14]
Чем ярче выражены неметаллические свойства элемента, тем сильнее выражены кислотные свойства его гидроксида. [c.14]
Сложные вещества, при диссоциации которых в водных растворах отщепляются в качестве анионов только гидроксид-ионы, назыеаю гся основаниями. Хорошо растворимые в воде основания (щелочи) являются сильными основаниями, а плохо растворимые -слабыми, [c.129]
Оксид серебра(I) незначительно растворяется в воде (0,017 г/л). Получающийся раствор имеет щелочную реакцию и, подобно щелочам, осаждает гидроксиды некоторых металлов из растворов их солей. Очевидно, в растворе содержится гидроксид серебра AgOH, представляющий собой довольно сильное основание. Последнее подтверждается тем, что соли серебра не гидролизуются. [c.538]
Гидроксиды. Соединения щелочных металлов МОН — твердые бесцветные, очень гигроскопичные вещества, хорошо растворяются в воде, при этом выделяется большое количество теплоты. Растворимость гидроксидов в ряду LiOH— sOH повышается. В водных растворах они диссоциируют почти нацело, являются самыми сильными основаниями и носят название едких щелочей. По подгруппе щелочных металлов сверху вниз основные свойства щелочей увеличиваются. [c.255]
В водных растворах они диссоциируют почти нацело, являются самыми сильными основаниями и носят название едких щелочей. По подгруппе щелочных металлов сверху вниз основные свойства щелочей увеличиваются. [c.255]
Образование малорастворимого гидроксида меди. Растворы едких щелочен осаждают из pa i ворон солей меди (II) голубой осадок основания Си (ОН) 2, легко растворимый в кислотах и обладающий весьма слабо выраженными кислотными свойствами. В сильно концентрированных растворах щелочей свежеосажденный гидроксид меди заметно растворим, образуя темно-синие растворы, [c.291]
ЩЕЛОЧНЫЕ МЕТАЛЛЫ — химические элементы главной подгруппы I группы периодической системы элементов Д. И. Менделеева 11, Ыа, К1 Р1), Сз и радиоактианый элемент Рг. Гидроксиды Щ. м.— сильные основания (щелочи). Щ. м.— химически активные элементы — активность их возрастает от кРг. [c.288]
В растворах сильных кислот и оснований типа НС1, HNO3, КОН или NaOH мольная концентрация ионов водорода и (или) гидроксид-ионов совпадает с мольной концентрацией кислоты или щелочи. Поэтому, например, в 0,01 М растворе НС1 концентрация ионов водорода равна [Н+]=0,01 моль/л и рН = = —Ig 1 10-2, а также [ОН-] = 1 lO- Vl 10-2= 1 10->2 и рОН = = —Ig Ы0- 2=12 или рОН = 14 —рН=14—2=12. [c.160]
Поэтому, например, в 0,01 М растворе НС1 концентрация ионов водорода равна [Н+]=0,01 моль/л и рН = = —Ig 1 10-2, а также [ОН-] = 1 lO- Vl 10-2= 1 10->2 и рОН = = —Ig Ы0- 2=12 или рОН = 14 —рН=14—2=12. [c.160]
Определите pH 0,1 М растворов НС1, HNO3, КОН и NaOH. Можно ли на основании проведенных экспериментов сделать вывод, что концентрация ионов водорода или гидроксид-ионов совпадает с концентрацией сильных кислот или оснований (щелочей), т. е. [c.165]
С аодой галлий и индий не реагируют таллий медленно взаимодействует с ней, при этом образуется гидроксид таллия Т10П и выделяется водород. Гидроксиды Са(011)з, 1п(011)з, Т1(0Н)) получают, действуя щелочами на растворы солей Э . Гидроксиды Са(ОН)з, 1л(011)з, и Т1(011)з-не растворимые в воде, слабые основания Са(ОП)з и 1п(011)] амфотерны, основная и кислотная диссоциация Ga(OH)j происходят почти в одинаковой степени, у 1п(0П)з преобладают основные свойства. В соответствии со значениями Дс реакций [c. 358]
358]
Гидроксиды лантаноидо Э(ОН)з практически неамфотерны, их основные свойстаа постепенно ослабевают при переходе от Се(ОН)з к и (ОН)з (в связи с уменьшением ионного радиуса>. Гидроксид Се(0Н)4 — более слабое основание, чем Се(ОН)), и он слабо амфотерен цераты М СеО] получают сплавлением СеОг со щелочами [c.572]
Вторая группа. Для всех элементов этой группы характерна степень окисления — -2. Атомы элементов главной подгруппы (Ве, Mg, Са, 5г, Ва и На) имеют на внешнем слое два з-электрона. По восстановительной способности элементы этой подгруппы уступают щелочным металлам (атомы последних имеют б6льц1ие размеры), хотя в связи с возрастанием атомных радиусов Са, 8г, Ва и Ка являются сильными восстановителями. Ионы Ве2+, Са +, Зг — , Ва — и Ка — , будучи аналогами ионов подгруппы лития, имеют конфигурацию атомов благородных газов, но отличаются от зарядом и меньшими радиусами. Поэтому их гидроксиды слабее гидроксидов щелочных металлов. Рост радиусов ионов в ряду Ве +—Ка + приводит к тому, что если Ве(ОН)г — амфотерное соединение, а Mg(0H)2 — слабое основание, то Са(ОН)2 — сильное основание, а Ва(0Н)г — очень сильное основание, хорошо растворимое в воде это щелочь, что нашло отражение и в его названии (едкий барит). [c.90]
[c.90]
ЕГЭ. Химические свойства оснований
Химические свойства оснований
1. Щелочи (растворимые основания) из металлов реагируют только с Zn, Be и Al:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Cr + NaOH → реакция не идет
Fe + NaOH → реакция не идет
2. Щелочи из неметаллов реагируют только с S, P, Si и галогенами:
3S + 6NaOH → Na2SO3 + 2Na2S + 3H2O
P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2 (t°, гипофосфит натрия)
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2).
2F2 + 2NaOH → OF2 + 2NaF + H2O (продукты этой реакции на ЕГЭ не проверяются, но необходимо знать, что реакция протекает)
3. Основания взаимодействуют с кислотами с образованием средних, кислых или основных солей. Тип соли зависит от соотношения реагентов: например, в избытке кислоты образуются кислые соли.
Условие: один из реагентов должен быть растворимым.
H2SO4 + 2KOH → K2SO4 + 2H2O (соотношение реагентов 1:2)
H2SO4 + KOH → KHSO4 + H2O (соотношение реагентов 1:1)
HCl + Cu(OH)2 → CuOHCl + H2O или
2HCl + Cu(OH)2 → CuCl2 + 2H2O
H2SiO3 + Cu(OH)2 → реакция не идет, так как и H2SiO3 и Cu(OH)2 нерастворимые.
4. Основания взаимодействуют с солями
Основания взаимодействуют с солями
Условие: 1) оба реагента должны быть растворимыми; 2) должен выпадать осадок или выделяться газ.
2NaOH + ZnCl2 → Zn(OH)2 + 2NaCl
NaOH + NH4NO3 → NH3 + NaNO3 + H2O
Cu(OH)2 + NaNO3 → реакция не идет, так как гидроксид меди (II) нерастворим.
5. Основания реагируют с кислотными оксидами. Если оксид в избытке образуется кислая соль:
Ca(OH)2 + CO2 → CaCO3 + H2O
Ca(OH)2 + 2CO2 → Ca(HCO3)2
6. Щелочи реагируют с амфотерными оксидами:
1) реакции в растворе:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
BeO + 2NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
2) реакции при сплавлении:
ZnO + 2NaOH → Na2ZnO2 + H2O (цинкат натрия)
BeO + 2NaOH → Na2BeO2 + H2O (бериллат натрия)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (метаалюминат натрия)
7. Щелочи реагируют с амфотерными гидроксидами:
Щелочи реагируют с амфотерными гидроксидами:
1) реакции в растворе:
Zn(OH)2 + NaOH → Na2[Zn(OH)4]
Be(OH)2 + NaOH → Na2[Be(OH)4]
Al(OH)3 + NaOH → Na[Al(OH)4]
2) реакции при сплавлении:
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O (кислота: H2ZnO2)
Be(OH)2 + 2NaOH → Na2BeO2 + 2H2O (кислота: H2BeO2)
Al(OH)3 + NaOH → NaAlO2 + 2H2O (кислота: HAlO2)
8. Нерастворимые основания (а также Ca(OH)2 и LiOH) разлагаются при нагревании:
Ca(OH)2 → CaO + H2O
2LiOH → Li2O + H2O
Mg(OH)2 → MgO + H2O
Fe(OH)2 → FeO + H2O
Cu(OH)2 → CuO + H2O.
Основания и щелочи — Кислоты и щелочи — KS3 Chemistry Revision
Основания и щелочи
Основание — это вещество, которое может реагировать с кислотами и нейтрализовать их. Основания обычно:
- оксидов металлов, таких как оксид меди
- гидроксидов металлов, таких как гидроксид натрия, или
- карбонатов металлов, таких как карбонат кальция
Многие основания нерастворимы — они не растворяются в воде. Однако, если основание растворяется в воде, мы также называем его щелочью.
В таблице приведены два примера оснований:
Бытовые чистящие средства содержат сильные основания, такие как раствор гидроксида натрия.Как и кислоты, их бутылки снабжены символом, предупреждающим о том, что они могут вызвать покраснение кожи или образование волдырей, если вы не смываете пролитую жидкость большим количеством воды.
Щелочи кажутся мыльными, когда попадают на вашу кожу, поэтому легко определить, когда вы попали в аварию, и вы должны мыть руки.
Концентрированные щелочи, как и концентрированные кислоты, вызывают коррозию. Они могут атаковать металлы и повредить кожу, если их пролить, поэтому их контейнеры помечены предупреждающим знаком. Концентрированные щелочи так же опасны, как и концентрированные кислоты, иногда даже более опасны, но многие люди этого не осознают.
1dbdt4ou2jo.0.0.0.1:0.1.0.$0.$3.$0″> Основы в домеОснования вступают в реакцию с маслами и жирами, поэтому их часто используют в бытовых чистящих средствах. Например, очистители для слива и духовки обычно содержат гидроксид натрия. Аммиак также часто используется в чистящих средствах, и его можно узнать по удушающему запаху.
При использовании этих веществ рекомендуется надевать перчатки, иначе они вступят в реакцию с вашей кожей и обожгут ее.
Слабые основания и щелочи содержатся в зубной пасте, таблетках антацида (для лечения расстройства желудка) и разрыхлителе.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Есть много причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
 Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Что делает что-то кислым или щелочным?
pH происходит от термина «мощность водорода» или концентрации ионов водорода, присутствующих в данном растворе. Это помогает измерить кислотность или щелочность вещества. Щелочность или основность — это альтернативные термины для обозначения одной и той же химической характеристики.
Кредит изображения: Виктор Вонг / Shutterstock
Что такое pH?
pH — это отрицательная логарифмическая шкала, которая измеряет молярную концентрацию ионов водорода от 1 до 10 14 ионов.Следовательно, у него нет единицы измерения.
Числа в отрицательном логарифмическом масштабе уменьшаются по величине на порядок 10 по сравнению с предыдущим. При pH 1 концентрация ионов водорода в 10 раз выше, чем при 2.
.Таким образом, pH выражается как pH = log 1 / [H +] = −log [H +]. Квадратная скобка — символ концентрации вещества.
Чистая вода имеет pH 7, что считается совершенно нейтральным. Это означает, что в нем точно равное количество ионов водорода и гидроксила.Любое вещество, находящееся слева от этой точки шкалы, считается кислым. Все вещества, pH которых находится справа от 7 по шкале, являются основными.
Это означает, что в нем точно равное количество ионов водорода и гидроксила.Любое вещество, находящееся слева от этой точки шкалы, считается кислым. Все вещества, pH которых находится справа от 7 по шкале, являются основными.
В качестве примера, вещество с pH 4 по шкале находится на 3 пункта ниже, чем вода с pH 7. По логарифмической шкале это означает разницу в 10 3 или 1000. Таким образом, гипотетическое вещество в 1000 раз кислотнее чистой воды. В самой сильной из возможных кислот ионов водорода в сто триллионов раз больше, чем в самой слабой (самая слабая кислота — это самое сильное основание).
Щелочность определяет способность раствора нейтрализовать кислоту. Он также может описывать способность воды действовать в качестве буфера, поддерживая стабильный pH, несмотря на небольшие изменения химического состава воды за счет добавления небольших количеств кислот или оснований. В природной воде щелочность вызвана присутствующими в ней слабыми кислотными солями, такими как бикарбонаты.
pH в зависимости от общей щелочности в химическом составе воды | Доска Orenda Play
Что такое кислоты и щелочи
В чистой воде небольшая часть молекул теряет один водород из структуры H 2 O в процессе, называемом диссоциацией.Таким образом, вода содержит небольшое количество ионов водорода H + и остаточных гидроксильных ионов OH-.
Существует равновесие между постоянным образованием и диссоциацией небольшого процента молекул воды.
Ионы водорода (OH — ) в воде соединяются с другими молекулами воды с образованием ионов гидроксония, H 3 O + ионов, которые чаще всего называют ионами водорода. Поскольку эти ионы гидроксила и гидроксония находятся в равновесии, раствор не является ни кислым, ни щелочным.
Кислота — это вещество, которое отдает ионы водорода в раствор, а основание или щелочь — это вещество, которое поглощает ионы водорода.
Все вещества, содержащие водород, не являются кислотными, так как водород должен присутствовать в состоянии, которое легко выделяется, в отличие от большинства органических соединений, которые очень прочно связывают водород с атомами углерода. Таким образом, pH помогает количественно оценить силу кислоты, показывая, сколько ионов водорода она выделяет в раствор.
Таким образом, pH помогает количественно оценить силу кислоты, показывая, сколько ионов водорода она выделяет в раствор.
Соляная кислота — сильная кислота, потому что ионная связь между водородом и ионами хлора является полярной, которая легко растворяется в воде, генерируя много ионов водорода и делая раствор очень кислым.Вот почему у него очень низкий pH. Этот вид диссоциации в воде также очень благоприятен с точки зрения получения энергии, поэтому это происходит так легко.
Слабые кислоты — это соединения, которые действительно отдают водород, но не очень быстро, например, некоторые органические кислоты. Например, уксусная кислота, содержащаяся в уксусе, содержит много водорода, но в группе карбоновых кислот, которая удерживает ее ковалентными или неполярными связями.
В результате только один из атомов водорода может покинуть молекулу, и даже в этом случае, отдавая его, можно получить не так много стабильности.
Основание или щелочь принимает ионы водорода, а при добавлении в воду он впитывает ионы водорода, образованные при диссоциации воды, так что баланс смещается в пользу концентрации гидроксильных ионов, делая раствор щелочным или щелочным.
Примером обычного основания является гидроксид натрия или щелок, используемый для изготовления мыла. Когда кислота и щелочь присутствуют в точно равных молярных концентрациях, ионы водорода и гидроксила легко реагируют друг с другом, образуя соль и воду в реакции, называемой нейтрализацией.
Дополнительная литература
15.1: Классификация кислот и оснований
Цели обучения
- Чтобы понять различия между тремя определениями кислот и оснований
- Определение кислот, оснований и сопряженных кислотно-основных пар в соответствии с тремя определениями кислот и оснований
- Чтобы понять концепцию сопряженных кислотно-основных пар в кислотно-основных реакциях
- Напишите уравнение реакции переноса протона с участием кислоты или основания Бренстеда-Лоури и покажите, как его можно интерпретировать как реакцию переноса пары электронов , четко идентифицируя донор и акцептор.
- Приведите пример кислотно-основной реакции Льюиса , в которой не участвуют протоны.

Кислоты и основания известны давно. Когда Роберт Бойль охарактеризовал их в 1680 году, он отметил, что кислоты растворяют многие вещества, изменяют цвет некоторых природных красителей (например, они меняют лакмусовый лакмус с синего на красный) и теряют эти характерные свойства после контакта со щелочами (основаниями). . В восемнадцатом веке было признано, что кислоты имеют кислый вкус, реагируют с известняком с выделением газообразного вещества (теперь известно, как CO 2 ) и взаимодействуют со щелочами с образованием нейтральных веществ.В 1815 году Хамфри Дэви внес большой вклад в развитие современной кислотно-щелочной концепции, продемонстрировав, что водород является незаменимым компонентом кислот. Примерно в то же время Джозеф Луи Гей-Люссак пришел к выводу, что кислоты — это вещества, которые могут нейтрализовать основания, и что эти два класса веществ можно определить только в терминах друг друга. Значение водорода было еще раз подчеркнуто в 1884 году, когда Карл Аксель Аррениус определил кислоту как соединение, которое растворяется в воде с образованием катионов водорода (теперь это ионы гидроксония), и основание как соединение, которое растворяется в воде с образованием гидроксид-анионов.
Кислоты и щелочи — распространенные растворы, которые существуют повсюду. Почти каждая жидкость, с которой мы сталкиваемся в повседневной жизни, имеет кислотные и основные свойства, за исключением воды. Они обладают совершенно другими свойствами и способны нейтрализоваться с образованием H 2 O, который будет обсуждаться позже в подразделе. Кислоты и основания можно определить по их физическим и химическим наблюдениям (Таблица \ (\ PageIndex {1} \)).
| КИСЛОТ | ОСНОВЫ |
|---|---|
| вызывают колющую боль в ране. | дает ощущение скользкости. |
| кисловатый вкус. | горький вкус. |
бесцветны при помещении в фенолфталеин (индикатор). | — розовые при помещении в фенолфталеин (индикатор). |
| — красные на синей лакмусовой бумаге (индикатор pH). | — синие на красной лакмусовой бумаге (индикатор pH). |
| имеют pH <7. | имеют pH> 7. |
| образуют водород при взаимодействии с металлами. | |
| образует диоксид углерода при взаимодействии с карбонатами. | |
| Общие примеры: лимоны, апельсины, уксус, моча, серная кислота, соляная кислота | Общие примеры: мыло, зубная паста, отбеливатель, чистящие средства, известковая вода, аммиачная вода, гидроксид натрия. |
Кислоты и основания в водных растворах будут проводить электричество, потому что они содержат растворенные ионы. Следовательно, кислоты и основания , электролиты . Сильные кислоты и основания будут сильными электролитами . Слабые кислоты и основания будут слабыми электролитами. Это влияет на величину проводимости.
Следовательно, кислоты и основания , электролиты . Сильные кислоты и основания будут сильными электролитами . Слабые кислоты и основания будут слабыми электролитами. Это влияет на величину проводимости.
В химии кислоты и основания были определены по-разному в соответствии с тремя наборами теорий : Первая — это определение Аррениуса, определенное выше, которое вращается вокруг идеи, что кислоты — это вещества, которые ионизируются (отщепляются) в водном растворе с образованием водорода ( H + ), в то время как основания производят ионы гидроксида (OH — ) в растворе.Два других определения подробно обсуждаются, включая определение Бренстеда-Лоури , которое определяет кислоты как вещества, которые отдают протоны (H + ), тогда как основания — это вещества, которые принимают протоны, а теория Льюиса кислот и оснований утверждает, что кислоты являются акцепторами электронных пар, а основания — донорами электронных пар. {+}} \), которые присутствуют при добавлении в воду.{-} (aq)} \ label {eq3} \]
{+}} \), которые присутствуют при добавлении в воду.{-} (aq)} \ label {eq3} \]
Все кислоты Аррениуса содержат легко отделяемый водород, который образует ионы гидроксония в растворе, а все основания Аррениуса имеют легко отделяемые группы ОН, которые образуют ионы гидроксида в растворе.
Ограничение аррениусовского определения кислот и оснований
Аррениусовские определения кислотности и щелочности ограничиваются водными растворами и относятся к концентрации сольватированных ионов. Согласно этому определению, чистый \ (\ ce {h3SO4} \) или \ (\ ce {HCl} \), растворенный в толуоле, не является кислотным, несмотря на тот факт, что обе эти кислоты будут отдавать протон толуолу.{-}} \)) легко депротонирует аммиак. Таким образом, определение Аррениуса может описывать только кислоты и основания в водной среде. Определение Аррениуса может только описывать кислоты и основания в протонных растворителях и средах (например, вода, спирты, в белках и т. -} \), и сопряженную кислоту аммиака, \ (\ ce {Nh5 +} \):
-} \), и сопряженную кислоту аммиака, \ (\ ce {Nh5 +} \):
Реакция между кислотой Бренстеда-Лоури и водой называется кислотной ионизацией.{-}}]} {[\ ce {C5NH5}]} \ nonumber \]
Обратите внимание, что обе эти реакции ионизации представлены как равновесные процессы. Относительная степень протекания этих реакций кислотной и основной ионизации — важная тема, рассматриваемая в следующем разделе этой главы. В предыдущих абзацах мы видели, что вода может действовать как кислота или основание, в зависимости от природы растворенного в ней растворенного вещества. Фактически, в чистой воде или в любом водном растворе вода действует как кислота и основание.{−11} M \ nonumber \]
Амфотерные виды
Подобно воде, многие молекулы и ионы могут приобретать или терять протон в соответствующих условиях. Такие виды называют амфипротическими. Другой термин, используемый для описания таких видов, — амфотерный, который является более общим термином для видов, которые могут действовать как кислота или основание по любому определению (не только по определению Бренстеда-Лоури).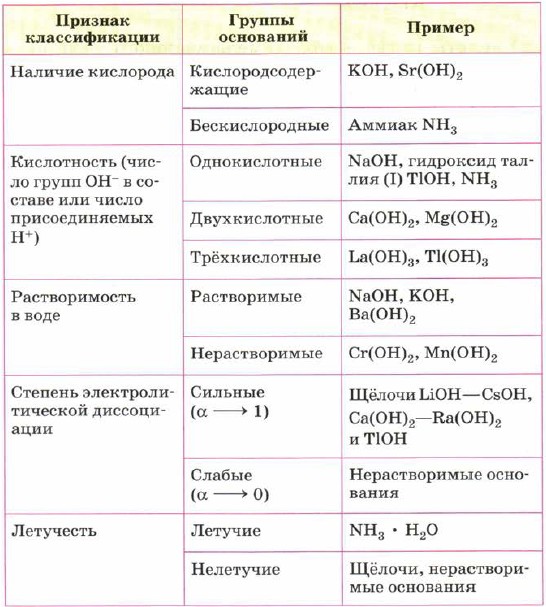 2 -} (водн.) + \ Ce {H_2O} _ {(l)} \)
2 -} (водн.) + \ Ce {H_2O} _ {(l)} \)
Кислоты и основания Льюиса
Концепция донора-акцептора протона Бренстеда-Лоури была одной из самых успешных теорий химии.Но, как и в случае с любой такой теорией, справедливо спросить, не является ли это частным случаем более общей теории, которая могла бы охватывать даже более широкий диапазон химической науки. В 1916 году Г. Льюис из Калифорнийского университета предположил, что электронная пара является доминирующим действующим лицом в кислотно-основной химии. Теория Льюиса была известна лишь в 1923 году (в том же году, когда Бронстед и Лоури опубликовали свою работу), но с тех пор она была признана очень мощным инструментом для описания самых разных химических реакций и широко используется в органическая и неорганическая химия.Концепция кислот и оснований Бренстеда – Лоури определяет основание как любое вещество, которое может принимать протон, а кислоту как любое вещество, которое может отдавать протон. Льюис предложил альтернативное определение, которое вместо этого фокусируется на пар электронов . По словам Льюиса:
Льюис предложил альтернативное определение, которое вместо этого фокусируется на пар электронов . По словам Льюиса:
- Кислота — это вещество, которое принимает пару электронов и при этом образует ковалентную связь с объектом, который поставляет электроны.
- Основание — это вещество, которое отдает неподеленную пару электронов принимающей части, с которой электроны могут быть разделены.
В современной химии доноры электронов часто называют нуклеофилами, а акцепторы — электрофилами.
Кислотно-щелочная нейтрализация Льюиса с переносом электронных пар
Подобно тому, как любая кислота Аррениуса также является кислотой Бренстеда, любая кислота Бренстеда также является кислотой Льюиса, поэтому все различные кислотно-основные концепции «совместимы снизу вверх». Хотя нам на самом деле не нужно думать о переносе электронных пар, когда мы имеем дело с обычными кислотно-основными реакциями в водном растворе, важно понимать, что это возможность обмена электронными парами, которая делает возможным перенос протона.
Это уравнение простой кислотно-щелочной нейтрализации показывает, что определения Бренстеда и Льюиса на самом деле представляют собой просто разные взгляды на один и тот же процесс. Обратите особое внимание на следующие моменты:
- Стрелка показывает движение протона от иона гидроксония к иону гидроксида.
- Обратите внимание, что сами электронные пары не двигаются; они остаются привязанными к своим центральным атомам. Электронная пара на основании «передается» акцептору (протону) только в том смысле, что в конечном итоге она разделяется с акцептором , а не является исключительной собственностью атома кислорода в ионе гидроксида.
- Хотя ион гидроксония здесь является номинальной кислотой Льюиса, он сам не принимает электронную пару, а действует просто как источник протона, который координируется с основанием Льюиса.
Примечание
Особенно важно иметь в виду, что электронная пара остается на донорной частице. Во-первых, он отличает кислотно-щелочную реакцию Льюиса от окислительно-восстановительной реакции , в которой действительно происходит физический перенос одного или нескольких электронов от донора к акцептору.
Во-первых, он отличает кислотно-щелочную реакцию Льюиса от окислительно-восстановительной реакции , в которой действительно происходит физический перенос одного или нескольких электронов от донора к акцептору.
Продукт кислотно-основной реакции Льюиса формально известен как «аддукт , » или «комплекс», хотя мы обычно не используем эти термины для простых реакций переноса протона, таких как реакция в приведенном выше примере. Здесь протон соединяется с гидроксид-ионом с образованием «аддукта» \ (\ ce {h3O} \). Следующие ниже примеры иллюстрируют эти моменты для некоторых других реакций переноса протона, с которыми вы уже должны быть знакомы.
Другой пример, показывающий автопротолиз воды.{+}} \) ион.
Кислотно-щелочная нейтрализация Льюиса без переноса протонов
Молекулы с дефицитом электронов, такие как BCl 3 , содержат менее октета электронов вокруг одного атома и имеют сильную тенденцию получать дополнительную пару электронов, вступая в реакцию с веществами, которые обладают неподеленной парой электронов.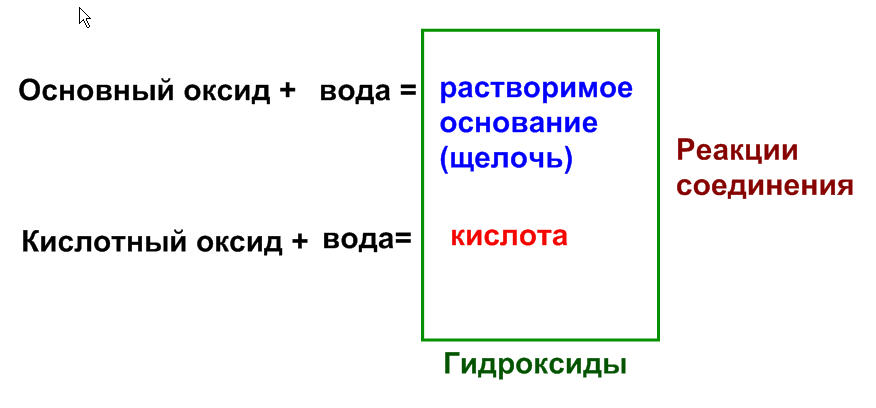 Определение Льюиса, которое менее ограничительно, чем определение Бронстеда – Лоури или определение Аррениуса, выросло из его наблюдения за этой тенденцией.Общая кислотно-основная реакция Бренстеда – Лоури может быть изображена электронными символами Льюиса следующим образом:
Определение Льюиса, которое менее ограничительно, чем определение Бронстеда – Лоури или определение Аррениуса, выросло из его наблюдения за этой тенденцией.Общая кислотно-основная реакция Бренстеда – Лоури может быть изображена электронными символами Льюиса следующим образом:
Протон (H + ), не имеющий валентных электронов, является кислотой Льюиса, потому что он принимает неподеленную пару электронов на основании для образования связи. Протон, однако, является лишь одним из многих электронодефицитных частиц, которые, как известно, реагируют с основаниями. Например, нейтральные соединения бора, алюминия и других элементов группы 13, которые обладают только шестью валентными электронами, имеют очень сильную тенденцию к получению дополнительной пары электронов.Таким образом, такие соединения являются сильнодействующими кислотами Льюиса, которые реагируют с донором электронных пар, таким как аммиак, с образованием кислотно-основного аддукта, новой ковалентной связи, как показано здесь для трифторида бора (BF 3 ):
Связь, образованная между кислотой Льюиса и основанием Льюиса, представляет собой координированную ковалентную связь , потому что оба электрона обеспечиваются только одним из атомов (N в случае F 3 B: NH 3 ). Однако после образования координированная ковалентная связь ведет себя как любая другая ковалентная одинарная связь.
Однако после образования координированная ковалентная связь ведет себя как любая другая ковалентная одинарная связь.
Виды с очень слабыми основаниями Бренстеда – Лоури могут быть относительно сильными основаниями Льюиса. Например, многие тригалогениды группы 13 хорошо растворимы в эфирах (R – O – R ‘), потому что атом кислорода в эфире содержит две неподеленные пары электронов, как и в H 2 O. Следовательно, преобладающие частицы в Растворы электронодефицитных тригалогенидов в эфирных растворителях представляет собой кислотно-основной аддукт Льюиса. Реакция этого типа показана на рисунке \ (\ PageIndex {1} \) для трихлорида бора и диэтилового эфира:
Рисунок \ (\ PageIndex {1} \): реакция кислоты Льюиса / основания треххлористого бора и реакция диэтилового эфира
Примечание
- Электронно-дефицитные молекулы (с менее чем одним октетом электронов) являются кислотами Льюиса.
- Кислотно-основное поведение многих соединений можно объяснить их электронными структурами Льюиса.

Многие молекулы с кратными связями могут действовать как кислоты Льюиса. В этих случаях основание Льюиса обычно отдает пару электронов для образования связи с центральным атомом молекулы, в то время как пара электронов, смещенных из кратной связи, становится неподеленной парой на конечном атоме.
Рисунок \ (\ PageIndex {2} \): Сильно электроотрицательные атомы кислорода оттягивают электронную плотность от углерода, поэтому атом углерода действует как кислота Льюиса.Стрелки указывают направление потока электронов.Рисунок \ (\ PageIndex {2} \): Кислота Льюиса / основная реакция гидроксид-иона с диоксидом углерода
Пример \ (\ PageIndex {4} \)
Определите кислоту и основание в каждой кислотно-основной реакции Льюиса.
- BH 3 + (CH 3 ) 2 S → H 3 B: S (CH 3 ) 2
- CaO + CO 2 → CaCO 3
- BeCl 2 + 2 Cl — → BeCl 4 2-
Дано: реактивы и продукты
Запрошено: идентичность кислоты Льюиса и основания Льюиса
Стратегия:
В каждом уравнении идентифицируйте реагент с дефицитом электронов и реагент, являющийся донором электронных пар. Электронодефицитным соединением является кислота Льюиса, а другим — основание Льюиса.
Электронодефицитным соединением является кислота Льюиса, а другим — основание Льюиса.
Раствор:
- В BH 3 бор имеет только шесть валентных электронов. Следовательно, в нем электронодефицит и он может принимать неподеленную пару. Подобно кислороду, атом серы в (CH 3 ) 2 S имеет две неподеленные пары. Таким образом, (CH 3 ) 2 S отдает электронную пару серы атому бора BH 3 . Основание Льюиса — (CH 3 ) 2 S, а кислота Льюиса — BH 3 .
- Как и в реакции, показанной в уравнении 8.21, CO 2 принимает пару электронов от иона O 2- в CaO с образованием карбонатного иона. Кислород в CaO является донором электронных пар, поэтому CaO является основанием Льюиса. Углерод принимает пару электронов, поэтому CO 2 — это кислота Льюиса.
- Хлорид-ион содержит четыре неподеленных пары.
 В этой реакции каждый хлорид-ион отдает одну неподеленную пару BeCl 2 , который имеет только четыре электрона вокруг Be.Таким образом, ионы хлора являются основаниями Льюиса, а BeCl 2 — кислотой Льюиса.
В этой реакции каждый хлорид-ион отдает одну неподеленную пару BeCl 2 , который имеет только четыре электрона вокруг Be.Таким образом, ионы хлора являются основаниями Льюиса, а BeCl 2 — кислотой Льюиса.
Упражнение \ (\ PageIndex {4A} \)
Определите кислоту и основание в каждой кислотно-основной реакции Льюиса.
- (канал 3 ) 2 O + BF 3 → (канал 3 ) 2 O: BF 3
- H 2 O + SO 3 → H 2 SO 4
- Ответьте на
Основание Льюиса: (CH 3 ) 2 O; Кислота Льюиса: BF 3
- Ответ б
Основание Льюиса: H 2 O; Кислота Льюиса: SO 3
Упражнение \ (\ PageIndex {4B} \)
Вот еще несколько примеров кислотно-основных реакций Льюиса, которые не могут быть учтены в моделях Бренстеда или Аррениуса. Соединение, которое может отдавать протон (ион водорода) другому соединению, называется кислотой Бренстеда-Лоури. Соединение, которое принимает протон, называется основанием Бренстеда-Лоури. Вид, остающийся после того, как кислота Бренстеда-Лоури потеряет протон, представляет собой сопряженное основание кислоты. Соединение, образующееся, когда основание Бронстеда-Лоури приобретает протон, представляет собой сопряженную кислоту основания. Таким образом, кислотно-основная реакция происходит, когда протон переносится от кислоты к основанию, с образованием сопряженного основания реагирующей кислоты и образованием сопряженной кислоты реагирующего основания.{−14} \; в\; 25 ° C} \ nonumber \] Кислоты и основания — это два широких класса соединений, которые имеют большое количество
важность как в химии, так и в биохимии. Кислоты и основания также часто встречаются в нашей повседневной жизни. Кислоты имеют кислый вкус,
и многие из знакомых нам продуктов с кислым вкусом являются кислыми. Уксус,
например, это разбавленная уксусная кислота (обычный бытовой уксус — это 3% раствор
уксусной кислоты) и придает заправкам для салатов и маринованным овощам их терпкий вкус. Хотя терпкий вкус некоторых кислот может быть приятным дополнением ко многим видам
пищевых продуктов основы имеют горький вкус и поэтому обычно не являются предпочтительными
для потребления человеком. Однако многие люди пристрастились к кофеину.
и никотин, оба из которых являются алкалоидами, классом азотсодержащих оснований.
Хинин, ингредиент, придающий тонику горький вкус, также
алкалоид. Антациды, включая бикарбонат натрия (пищевая сода) и карбонат кальция.
(Тумс), являются основными и действуют путем нейтрализации желудочного сока до воды и углерода.
диоксид (CO 2 ) газ.Основания кажутся скользкими, потому что они мыльные.
природа, поэтому они используются в чистящих средствах. Щелок (гидроксид натрия), крепкий
основа, может растворять жир и белок, используется в чистящих средствах для духовки, продуктах
для очистки сточных вод и в лосьонах для удаления волос. Кислоты и щелочи также необходимы для жизни.Например, без сильного
кислота, присутствующая в нашем желудке, мы не сможем переваривать пищу. Важнее,
Организм должен иметь возможность контролировать уровень кислоты в своих клетках для
жизнь быть возможной. Мировой океан частично может поддерживать жизнь
потому что уровень кислоты (или pH) воды поддерживается постоянным за счет кислотно-щелочного
химия. Таким же образом строго регулируется pH живых клеток, что позволяет
клетки для поддержания своей структурной целостности и для функционирования клеточных процессов. Для поддержания правильного pH в живых клетках или жидкостях организма используются специальные соединения, называемые буферов используются. Брат Грегори хочет, чтобы вы помогли ему найти ответы на различные вопросы.
о физической структуре вещества, атомов и связанных с ними предметов.В этих исследованиях он задаст вам вопрос и даст вам инструменты, чтобы найти ответ.
Затем вы становитесь его ассистентом-исследователем. Вы должны провести эксперимент,
соберите данные, проанализируйте свои результаты и дайте брату Грегори ответ, который он ищет. «Подойди и посмотри на это», — приказал герр Отто Грюневальд своему гостю, махнув ему рукой в кабинет, обшитый дубом. Брат Грегори сделал несколько шагов к столу, снял тонкие очки и осторожно протер в них стекло мягкой тканью. Он взглянул на своего хозяина, надеясь найти какую-нибудь подсказку, затем, не получив ответа, поправил корректирующие линзы на носу и внимательно всмотрелся в маленькие бутылочки. «Кто они такие?» — спросил он наконец, вставая и выпрямляя спину.Все, что он получил, — это разочарованное фырканье хозяина, известного брненского промышленника и производителя текстиля, господина Отто Грюневальда. Взяв первую бутылку в большую руку, немец ответил: «Это новый краситель для ткани, изобретенный Уильямом Генри Перкином», — гордо объявил он, выпячивая грудь и размахивая бутылкой перед испуганным носом Менделя. «Это первый образец, прибывший в Брно». «Впечатляет», — дипломатично сказал Мендель, сделав небольшой шаг назад от своего немецкого хозяина, крупного человека со склонностью к взрывным вспышкам энтузиазма. «Но я не уверен, почему вы попросили меня прийти и увидеть их». «Совершенно верно», — крикнул Грюневальд, который никогда не любил, чтобы кто-нибудь заканчивал за него предложения.«Они полностью искусственные, но никто особо не разбирается в их свойствах. Прежде чем я испорчу большое количество ткани, пытаясь раскрасить их этими красителями, я хочу узнать больше об их свойствах». «Просто какие-то их свойства, или вы что-то имеете в виду?» — спросил брат Грегори, хорошо зная своего хозяина по предыдущим встречам. «Думаю, что да, — медленно сказал Мендель, — я немедленно позову своих научных сотрудников по этой проблеме». и Типичные концентрации ионов гидроксония: чистая вода 1,0 x 10 -7 , сильная кислота 1,0 x 10 -2 , сильное основание 1,0 x 10 -13 . (Примечание: запись таких концентраций — 10 -2 — называется экспоненциальной записью ). По мере того, как вы добавляете все больше и больше кислоты, вы достигаете точки, когда все гидроксид-ионы эффективно нейтрализуются добавленными ионами гидроксония. Это точка нейтралитета . Затем, когда вы добавляете все больше и больше ионов гидроксония, раствор становится кислым. В какой-то момент индикаторный краситель изменит цвет. Запишите новый цвет и обратите внимание на концентрацию иона гидроксония, при которой происходит это изменение цвета. Поэкспериментируйте с изменением силы кислоты в разных точках титрования и попытайтесь найти точную точку, в которой индикаторный краситель меняет цвет с одного цвета на другой. На главную »Различия между» Щелочь и основание — определение, 7 основных различий, примеры Щелочь — это щелочной растворимый гидроксид щелочных или щелочноземельных металлов. Источник изображения: Walkerma and Ondřej Mangl. Основание — это химическое соединение, которое реагирует с кислотами с образованием солей. Определение баз различается в разных концепциях. {2 +} \) Видео \ (\ PageIndex {1} \): Обзор кислот и оснований Льюиса
{2 +} \) Видео \ (\ PageIndex {1} \): Обзор кислот и оснований Льюиса Сводка
Глоссарий
Авторы и авторство
Кислота и щелочь
ВВЕДЕНИЕ
Кислоты и основания в нашей жизни
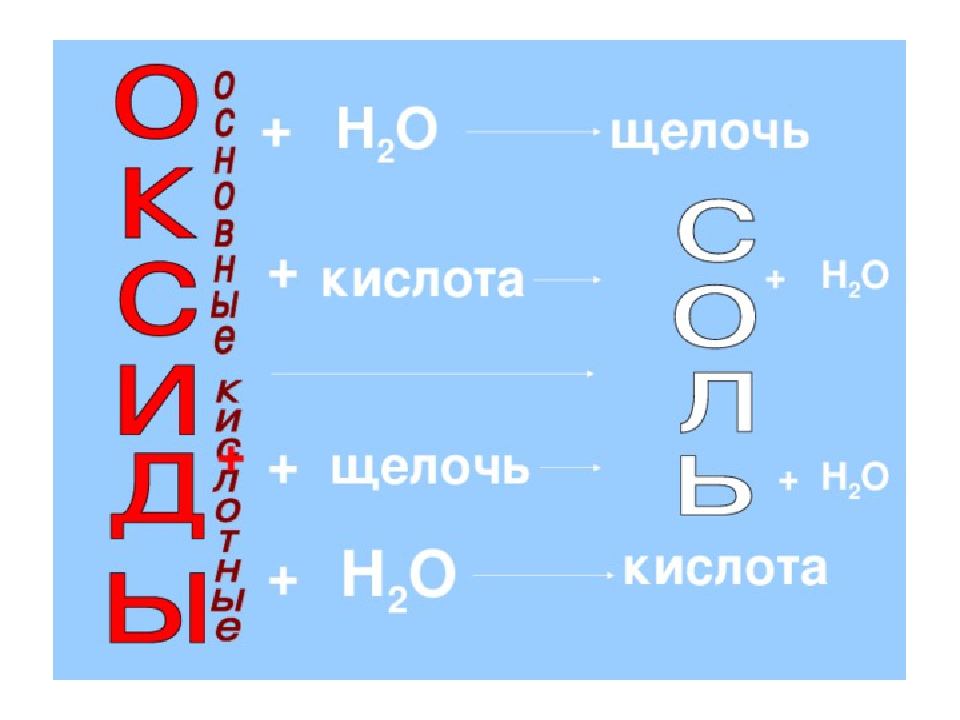 В промышленности кислоты и щелочи
используются в различных реакциях. Серная кислота, одна из важнейших промышленных
химикатов, используется для производства удобрений для сельского хозяйства, для производства искусственных
волокна, краски и красители, а также для очистки нефтепродуктов. Гидроксид натрия основной
(иногда называемый каустической содой или щелоком) используется для производства тканей,
бумага и чистящие средства.
В промышленности кислоты и щелочи
используются в различных реакциях. Серная кислота, одна из важнейших промышленных
химикатов, используется для производства удобрений для сельского хозяйства, для производства искусственных
волокна, краски и красители, а также для очистки нефтепродуктов. Гидроксид натрия основной
(иногда называемый каустической содой или щелоком) используется для производства тканей,
бумага и чистящие средства. Кислоты кислые или терпкие: уксус, сок лимона и апельсина, вино, аспирин.  Другие знакомые продукты с кислым вкусом получают свою терпкость из-за кислот: апельсины.
и лимоны содержат лимонную кислоту, вино содержит винную кислоту, а аспирин содержит
Ацетилсалициловая кислота.
Другие знакомые продукты с кислым вкусом получают свою терпкость из-за кислот: апельсины.
и лимоны содержат лимонную кислоту, вино содержит винную кислоту, а аспирин содержит
Ацетилсалициловая кислота.
Основы горькие: кофе, сигареты, тоник, сода пищевая, таблетки антацида, мыло.  Раствор, содержащий буферный агент, имеет тенденцию сопротивляться
изменения pH, так что биохимические реакции, которые часто производят или расходуют кислоты,
может продолжаться без резких колебаний клеточного pH. Таким образом,
целая клетка защищена от высоких концентраций кислоты, но критически важна кислотно-щелочная
реакции все еще могут протекать в клетке.Поскольку pH так важен для биологических
молекулы, любой биохимический эксперимент, включающий изучение белков или клеточных
системы должны выполняться в буферном растворе, чтобы молекулы оставались в
их естественное или исконное телосложение. Таким образом, понимание того, как буферы
может помочь регулировать pH, это важно для любого биохимика.
Раствор, содержащий буферный агент, имеет тенденцию сопротивляться
изменения pH, так что биохимические реакции, которые часто производят или расходуют кислоты,
может продолжаться без резких колебаний клеточного pH. Таким образом,
целая клетка защищена от высоких концентраций кислоты, но критически важна кислотно-щелочная
реакции все еще могут протекать в клетке.Поскольку pH так важен для биологических
молекулы, любой биохимический эксперимент, включающий изучение белков или клеточных
системы должны выполняться в буферном растворе, чтобы молекулы оставались в
их естественное или исконное телосложение. Таким образом, понимание того, как буферы
может помочь регулировать pH, это важно для любого биохимика. Цели обучения

Кислоты, щелочи и красители
Требуется научный сотрудник
 «Они только вчера прибыли». Он указал на ряд бутылок из прозрачного стекла, выстроившихся в ряд на его столе.Каждый был наполнен цветной жидкостью, которая улавливала и отражала свет. «Разве они не прекрасны?»
«Они только вчера прибыли». Он указал на ряд бутылок из прозрачного стекла, выстроившихся в ряд на его столе.Каждый был наполнен цветной жидкостью, которая улавливала и отражала свет. «Разве они не прекрасны?»
«Это просто, Мендель», — ответил ему Грюневальд, осторожно возвращая ценные флаконы с краской на свой стол.«Я только что заплатил много денег за эти новые синтетические красители для ткани. Я думаю, что они произведут революцию в текстильной промышленности. Через несколько лет все будут использовать их вместо старых, натуральных растительных красителей. Но я хочу, чтобы будь первым «. «И это, — продолжал он, хватая следующий контейнер, — единственный образец мадженты или фуксина где-либо в Богемии, поэтому он был обнаружен Вергином только четыре года назад (1859 г.  ).Я первый производитель текстиля здесь, которому принадлежит столько. Это стоит целое состояние, но я собираюсь использовать его, чтобы произвести целую новую линию крашеной ткани. Я считаю, что это намного лучше, чем Perkin’s Mauve ».
).Я первый производитель текстиля здесь, которому принадлежит столько. Это стоит целое состояние, но я собираюсь использовать его, чтобы произвести целую новую линию крашеной ткани. Я считаю, что это намного лучше, чем Perkin’s Mauve ».
«Мендель, вы меня несколько раз действительно удивляете, — проворчал Грюневальд, — меня интересует только одно свойство — цвет! Я хочу, чтобы вы узнали, как меняются цвета этих красителей в разных растворах, поэтому мы знать лучшие условия использования красильных чанов.Понятно? « «Замечательно, — пробормотал Мендель, его интерес наконец пробудился, — вы имеете в виду, что это новые химические вещества, созданные химиками, а они .  ..»
..» Вопросы
Брат Грегори хочет, чтобы вы исследовали свойства различных цветных красок. Он обнаружил, что все образцы, данные ему герром Грюневальдом, меняют цвет при воздействии различных концентраций ионов водорода. Он хочет, чтобы вы —
Он обнаружил, что все образцы, данные ему герром Грюневальдом, меняют цвет при воздействии различных концентраций ионов водорода. Он хочет, чтобы вы — Торговые инструменты
Чтобы провести это исследование, вы должны сначала определить взаимосвязь между концентрацией ионов водорода и pH жидкости или раствора. Определения
Ион водорода — атомный центр атома водорода; один протон; крошечная частица большой плотности и положительного заряда; написано H + — протон сам по себе не является стабильной сущностью. 
Ион гидроксония — в растворах в воде ионы водорода соединяются с молекулами воды с образованием стабильного иона гидроксония.
H + + H 2 O -> H 3 O + (ион гидроксония) Концентрация ионов гидроксония — это значение (также известное как концентрация ионов водорода), записывается как [H 3 O + ] или иногда [H + ] . Концентрация гидроксид-иона — это значение записывается [OH — ] . 
Кислота — соединение, доставляющее ионы водорода (H + ) к раствору в воде. Основание — соединение, доставляющее гидроксид-ионы (OH — ) к раствору в воде. Индикатор — химический краситель, меняющий цвет в зависимости от концентрации иона водорода или гидроксид-иона в одном растворе. Лакмус, например, имеет синий цвет в основном растворе (высокая концентрация гидроксид-иона) и красный цвет в кислом растворе (высокая концентрация ионов водорода). pH — числовое значение по шкале от 0 до 14 (обычно), которое выражает концентрацию ионов гидроксония (водорода) без использования экспоненциальной записи. 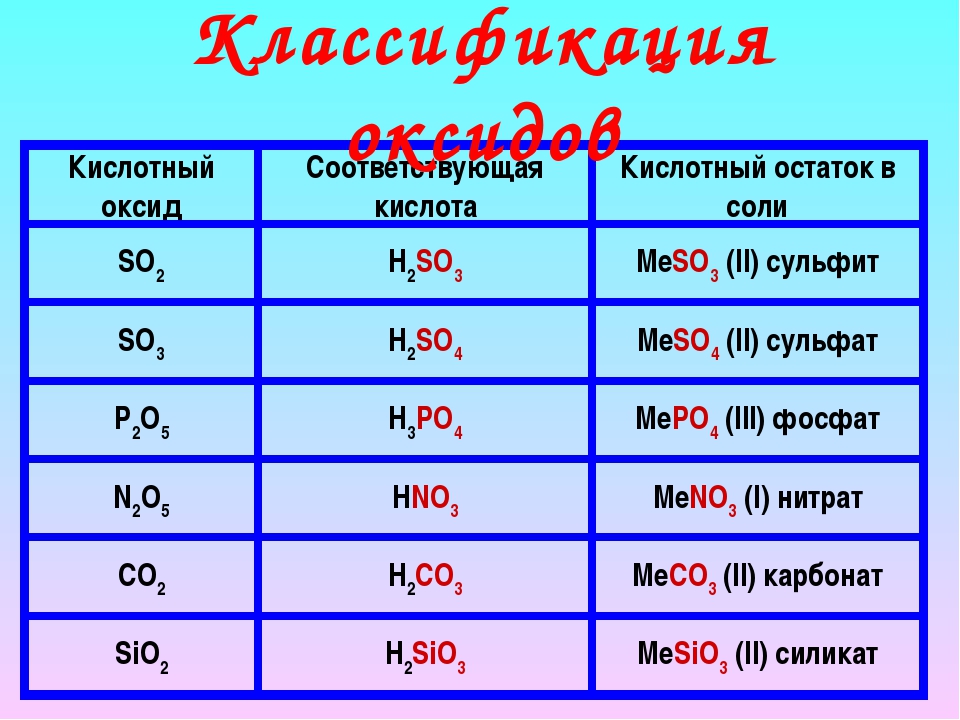
расследование — часть первая
Используйте калькулятор pH, чтобы определить значения pH для следующих распространенных веществ: Вещество [H 3 O + ] Желудочная кислота 3,1 х 10 -2 Уксус 1,26 х 10 -3 Томатный сок 6.3 х 10 -5 Кровь 5,0 х 10 -8 Раствор пищевой соды 3,0 х 10 -9 Аммиак 3,16 х 10 -12 расследование — часть вторая
Обратите внимание на цвет каждого индикатора в присутствии гидроксид-ионов. Брат Грегори хочет, чтобы вы добавили образцы каждого красителя, называемого индикатором , в стакан, содержащий раствор гидроксида натрия (основание).  Каждый краситель или индикатор приобретает характерный цвет в щелочном растворе, где он взаимодействует с гидроксид-ионами.
Каждый краситель или индикатор приобретает характерный цвет в щелочном растворе, где он взаимодействует с гидроксид-ионами.
Это происходит постоянно, и одновременно идут оба процесса. Соляную кислоту наливают в длинную тонкую бюретку, расположенную над стаканом, при закрытом дне крана. По каплям из бюретки в стакан, содержащий основу и индикаторный краситель, капают кислоту.Ионы водорода (на самом деле ионы гидроксония) из кислоты нейтрализуют ионы гидроксида в основе, чтобы произвести больше воды: H 3 O + + OH — -> H 2 O + H 2 O Также некоторые молекулы воды спонтанно распадаются на ионы гидроксония и гидроксид. H 2 O + H 2 O
-> H 3 O + + OH —  Однако обычно количество воды в химическом стакане настолько велико, что можно с уверенностью предположить, что количество воды постоянно, и единственное, что изменяется, — это количество (более известное как концентрация ) каждого иона.
Однако обычно количество воды в химическом стакане настолько велико, что можно с уверенностью предположить, что количество воды постоянно, и единственное, что изменяется, — это количество (более известное как концентрация ) каждого иона. В каждом растворе присутствуют ионы гидроксония и гидроксид-ионы. Иногда гидроксид-ионов больше, и раствор является основным, иногда есть равные количества гидроксония и гидроксид-ионов, и раствор нейтрален, а иногда больше ионов гидроксония и раствор кислый. 
Для каждого из индикаторных красителей вам следует титровать (это используемый термин) основание кислотой и выяснить как изменение цвета, так и диапазон концентрации ионов гидроксония (водорода), в котором это изменение происходит. ПРИМЕЧАНИЕ. У вас есть выбор, сколько кислоты добавляется в каждую каплю, а также концентрацию кислоты в бюретке. Вначале вам понадобится много кислоты, чтобы изменить концентрацию ионов гидроксония в стакане, но по мере приближения к нейтральности будьте осторожны! Концентрация ионов гидроксония будет меняться очень быстро, и вы можете пропустить момент изменения цвета. Щелочь и основание — определение, 7 основных различий, примеры


7 основных отличий (щелочь от основания)
Примеры щелочи Гидроксид натрия (NaOH) Характеристики Щелочь База Определение Щелочь — это щелочной растворимый гидроксид щелочных или щелочноземельных металлов. Основание — это химическое соединение, которое реагирует с кислотами с образованием солей. Растворимость Щелочи растворяются в воде с образованием ОН-. Основания не растворяются в воде. Отношение Все щелочи являются основаниями. Щелочь — это подмножество основы. Все основания не щелочные. Реакция с кислотой Щелочь реагирует с кислотами с образованием ионов ОН- и акцептирует протоны. Основания нейтрализуют кислоту с образованием соли и воды. Соединения Щелочи — это карбонаты и гидроксиды щелочных металлов. Основания в основном представляют собой соединения с гидроксидной группой или неподеленной парой электронов. Химическая категория Щелочь — это ионное соединение металлов I группы. Основания могут быть ионными или ковалентными из металлов разных групп. Примеры Гидроксид натрия и гидроксид калия являются примерами щелочей. Гидроксид цинка и оксид меди являются примерами оснований.
Примеры базы Гидроксид цинка (Zn (OH) 2 )
Ссылки и источники
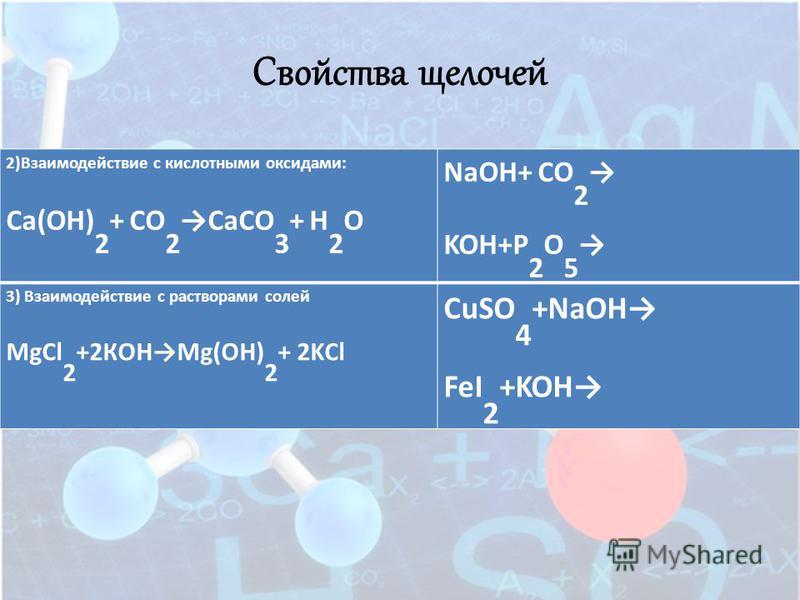 Оксидов
Оксидов Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
 В этой реакции каждый хлорид-ион отдает одну неподеленную пару BeCl 2 , который имеет только четыре электрона вокруг Be.Таким образом, ионы хлора являются основаниями Льюиса, а BeCl 2 — кислотой Льюиса.
В этой реакции каждый хлорид-ион отдает одну неподеленную пару BeCl 2 , который имеет только четыре электрона вокруг Be.Таким образом, ионы хлора являются основаниями Льюиса, а BeCl 2 — кислотой Льюиса.