Свойства оснований
Основания – сложные вещества, состоящие из атома металла и одной или нескольких гидроксильных групп. Общая формула оснований Ме(ОН)n. Основания (с точки зрения теории электролитической диссоциации) – это электролиты, диссоциирующие при растворении в воде с образованием катионов металла и гидроксид-ионов ОН–.
Классификация. По растворимости
в воде основания делят на щелочи
(растворимые в воде основания) и нерастворимые в воде основания.
Щелочи образуют щелочные и щелочно-земельные металлы, а также
некоторые другие элементы-металлы. По кислотности (числу ионов
ОН–,
образующихся при полной диссоциации, или количеству ступеней
диссоциации) основания подразделяют на
однокислотные (при полной диссоциации получается один ион
ОН Среди многокислотных оснований различают
двухкислотные (например,
Sn(OH)2),
трехкислотные (Fe(OH)3)
и четырехкислотные (Th(OH)4).
Однокислотным является, например, основание КОН.
Среди многокислотных оснований различают
двухкислотные (например,
Sn(OH)2),
трехкислотные (Fe(OH)3)
и четырехкислотные (Th(OH)4).
Однокислотным является, например, основание КОН.
Выделяют группу гидроксидов, которые проявляют химическую двойственность. Они взаимодействую как с основаниями, так и с кислотами. Это амфотерные гидроксиды (см. таблицу 1).
Таблица 1 — Амфотерные гидроксиды
| Амфотерный гидроксид (основная и кислотная форма) |
Комплексный ион |
|
|
Zn(OH)2 / H2ZnO2 |
ZnO2 (II) |
[Zn(OH)4]2– |
|
Al(OH)3 / HAlO2 |
AlO2 (I) |
[Al(OH)4]–, [Al(OH)6]3– |
|
|
BeO2 (II) |
[Be(OH)4]2– |
|
Sn(OH)2 / H2SnO2 |
SnO2 (II) |
[Sn(OH)4]2– |
|
Pb(OH)2 / H2PbO2 |
PbO2 (II) |
[Pb(OH)4]2– |
|
Fe(OH)3 / HFeO2 |
FeO2 (I) |
[Fe(OH)4]–, [Fe(OH)6]3– |
|
Cr(OH)3 / HCrO2 |
CrO2 (I) |
[Cr(OH)4]–, [Cr(OH)6]3– |
Физические свойства. Основания —
твердые вещества различных цветов и различной растворимости в воде.
Основания —
твердые вещества различных цветов и различной растворимости в воде.
Химические свойства оснований
1) Диссоциация: КОН + nН2О К+×mН2О + ОН–×dН2О или сокращенно: КОН К+ + ОН–.
Многокислотные основания диссоциируют по нескольким ступеням (в основном диссоциация протекает по первой ступени). Например, двухкислотное основание Fe(OH)2диссоциирует по двум ступеням:
Fe(OH)2FeOH+ + OH– (1 ступень);
FeOH+Fe2+ + OH– (2 ступень).
2) Взаимодействие с индикаторами (щелочи окрашивают фиолетовый лакмус в синий цвет, метилоранж – в желтый, а фенолфталеин – в малиновый):
индикатор + ОН– (щелочь) окрашенное
соединение.
3) Разложение с образованием оксида и воды (см. таблицу 2). Гидроксиды щелочных металлов устойчивы к нагреванию (плавятся без разложения). Гидроксиды щелочно-земельных и тяжелых металлов обычно легко разлагаются. Исключение составляет Ba(OH)2, у которого tразл достаточно высока (примерно 1000 °C).
Zn(OH)2 ZnO + H2O.
| Гидроксид | tразл, °C | Гидроксид | tразл, °C | Гидроксид | tразл, °C |
| LiOH | 925 | Cd(OH)2 | 130 | Au(OH)3 | 150 |
| Be(OH)2 | 130 | Pb(OH)2 | 145 | Al(OH)3 | >300 |
| Ca(OH)2 | 580 | Fe(OH)2 | 150 | Fe(OH)3 | 500 |
|
Sr(OH) |
535 | Zn(OH)2 | 125 | Bi(OH)3 | 100 |
| Ba(OH)2 | 1000 | Ni(OH)2 | 230 | In(OH)3 | 150 |
4) Взаимодействие щелочей с некоторыми металлами (например, Al и Zn):
В растворе: 2Al + 2NaOH + 6H2O ® 2Na[Al(OH) 4] + 3H2
2Al + 2OH–+
6H2О
®
2[Al(OH)4]– + 3H2.
При сплавлении: 2Al + 2NaOH + 2H2O 2NaAlО2 + 3H2.
5) Взаимодействие щелочей с неметаллами:
6NaOH + 3Cl2 5NaCl + NaClO3 + 3H2O.
6) Взаимодействие щелочей с кислотными и амфотерными оксидами:
2NaOH + СО2®
Na2CO3 + H2O
2OH–+
CO
В растворе: 2NaOH + ZnO
+ H2O
®
Na2[Zn(OH)4]
2OH–+ ZnO
+ H2О
®
[Zn(OH)4]2–.
При сплавлении с амфотерным оксидом: 2NaOH + ZnO Na2ZnO2 + H2O.
7) Взаимодействие оснований с кислотами:
H2SO4+ Ca(OH)2 ® CaSO4¯ + 2H2O 2H+ + SO42–+ Ca2+ +2OH– ® CaSO4¯ + 2H2O
H2SO4+ Zn(OH)2 ® ZnSO4 + 2H2O 2H+ + Zn(OH)2 ® Zn2+ + 2H2O.
8) Взаимодействие щелочей с амфотерными гидроксидами (см. таблицу 1):
В растворе: 2NaOH + Zn(OH)2 ® Na2[Zn(OH)4] 2OH– + Zn(OH)2 ® [Zn(OH)4]2–
При сплавлении: 2NaOH +
Zn(OH)2
Na2ZnO2 +
2H2O.
9) Взаимодействие щелочей с солями. В реакцию вступают соли, которым соответствует нерастворимое в воде основание:
CuSО4 + 2NaOH ® Na2SO4 + Cu(OH)2¯ Cu2++ 2OH– ® Cu(OH)2¯.
Получение. Нерастворимые в воде основания получают путем взаимодействия соответствующей соли со щелочью:
2NaOH + ZnSО4 ® Na2SO4 + Zn(OH)2¯ Zn2++ 2OH– ® Zn(OH)2¯.
Щелочи получают:
1) Взаимодействием оксида металла с водой:
Na2O + H2O
®
2NaOH
CaO + H2O
®
Ca(OH)2.
2) Взаимодействием щелочных и щелочно-земельных металлов с водой:
2Na + H2O ® 2NaOH + H2 Ca + 2H2O ® Ca(OH)2 + H2.
3) Электролизом растворов солей:
2NaCl + 2H2O H2 + 2NaOH + Cl2.
4) Обменным взаимодействием гидроксидов щелочно-земельных металлов с некоторыми солями. В ходе реакции должна обязательно получаться нерастворимая соль.
Ba(OH)2+ Na2CO3®
2NaOH + BaCO3¯
Ba2+
+ CO32–
®
BaCO3¯.
Л.А. Яковишин
Физические свойства оснований — урок. Химия, 8–9 класс.
При обычных условиях основания (гидроксиды металлов) являются твёрдыми кристаллическими веществами. Они нелетучи и не имеют запаха.
Растворимость оснований в воде
По растворимости в воде эти соединения делят на две группы: щёлочи и практически нерастворимые основания. В свою очередь щёлочи делят на хорошо растворимые в воде и малорастворимые основания.
Общеустановленных чётких границ между хорошо-, малорастворимыми и практически нерастворимыми в воде веществами не существует, поэтому справочные данные, взятые из разных источников, могут несколько отличаться друг от друга. Приведём сведения о растворимости щелочей, которых мы будем придерживаться.
Классификация щелочей по их растворимости в воде:
LiOH — гидроксид лития, NaOH — гидроксид натрия, KOH — гидроксид калия, RbOH — гидроксид рубидия, CsOH — гидроксид цезия, FrOH — гидроксид франция, Ba(OH)2 — гидроксид бария, Ra(OH)2 — гидроксид радия. | Ca(OH)2 — гидроксид кальция, Sr(OH)2 — гидроксид стронция.
|
Обрати внимание!
Почти все остальные основания (гидроксиды металлов) являются практически нерастворимыми.
Окраска оснований
Большинство оснований — вещества белого цвета. Но существуют гидроксиды металлов, которые имеют отличающуюся окраску.
Цвет основания | Примеры |
Белый
| LiOH — гидроксид лития, Mg(OH)2 — гидроксид магния, Ca(OH)2 — гидроксид кальция |
| Жёлтый | CuOH — гидроксид меди(\(I\)) |
Светло-розовый (при соприкосновении с кислородом воздуха окраска становится коричневой) | Mn(OH)2 — гидроксид марганца(\(II\)) |
| Красно-коричневый | Fe(OH)3 — гидроксид железа(\(III\)) |
Белый с зеленоватым оттенком (при соприкосновении с кислородом воздуха окраска становится темнее) | Fe(OH)2 — гидроксид железа(\(II\)) |
| Светло-зелёный | Ni(OH)2 — гидроксид никеля(\(II\)) |
| Синий | Cu(OH)2 — гидроксид меди(\(II\)) |
Основания: классификация и химические свойства
Основания (гидроксиды) – сложные вещества, молекулы которых в своём составе имеют одну или несколько гидрокси-групп OH. Чаще всего основания состоят из атома металла и группы OH. Например, NaOH – гидроксид натрия, Ca(OH)2 – гидроксид кальция и др.
Чаще всего основания состоят из атома металла и группы OH. Например, NaOH – гидроксид натрия, Ca(OH)2 – гидроксид кальция и др.
Существует основание – гидроксид аммония, в котором гидрокси-группа присоединена не к металлу, а к иону NH4+ (катиону аммония). Гидроксид аммония образуется при растворении аммиака в воде (реакции присоединения воды к аммиаку):
NH3 + H2O = NH4OH (гидроксид аммония).
Валентность гирокси-группы – 1. Число гидроксильных групп в молекуле основания зависит от валентности металла и равно ей. Например, NaOH, LiOH, Al (OH)3, Ca(OH)2, Fe(OH)3 и т.д.
Все основания – твёрдые вещества, которые имеют различную окраску. Некоторые основания хорошо растворимы в воде (NaOH, KOH и др.). Однако большинство из них в воде не растворяются.
Растворимые в воде основания называются щелочами. Растворы щелочей «мыльные», скользкие на ощупь и довольно едкие. К щелочам относят гидроксиды щелочных и щелочноземельных металлов (KOH, LiOH, RbOH, NaOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 и др.). Остальные являются нерастворимыми.
К щелочам относят гидроксиды щелочных и щелочноземельных металлов (KOH, LiOH, RbOH, NaOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 и др.). Остальные являются нерастворимыми.
Нерастворимые основания – это амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью ведут себя, как кислоты.
Разные основания отличаются разной способностью отщеплять гидрокси-группы, поэтому признаку они делятся на сильные и слабые основания.
Сильные основания | Слабые основания |
NaOH гидроксид натрия (едкий натр) KOH гидроксид калия (едкое кали) LiOH гидроксид лития Ba(OH)2 гидроксид бария Ca(OH)2 гидроксид кальция (гашеная известь) | Mg(OH)2 гидроксид магния Fe(OH)2 гидроксид железа (II) Zn(OH)2 гидроксид цинка NH4OH гидроксид аммония Fe(OH)3 гидроксид железа (III) и т. |
Сильные основания в водных растворах легко отдают свои гидрокси-группы, а слабые – нет.
Химические свойства оснований
Химические свойства оснований характеризуются отношением их к кислотам, ангидридам кислот и солям.
1. Действуют на индикаторы. Индикаторы меняют свою окраску в зависимости от взаимодействия с разными химическими веществами. В нейтральных растворах – они имеют одну окраску, в растворах кислот – другую. При взаимодействии с основаниями они меняют свою окраску: индикатор метиловый оранжевый окрашивается в жёлтый цвет, индикатор лакмус – в синий цвет, а фенолфталеин становится цвета фуксии.
2. Взаимодействуют с кислотными оксидами с образованием соли и воды:
2NaOH + SiO2 → Na2SiO3 + H2O.
3. Вступают в реакцию с кислотами, образуя соль и воду. Реакция взаимодействия основания с кислотой называется реакцией нейтрализации, так как после её окончания среда становится нейтральной:
Реакция взаимодействия основания с кислотой называется реакцией нейтрализации, так как после её окончания среда становится нейтральной:
2KOH + H2SO4 → K2SO4 + 2H2O.
4. Реагируют с солями, образуя новые соль и основание:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4.
5. Способны при нагревании разлагаться на воду и основной оксид:
Cu(OH)2 = CuO + H2O.
Остались вопросы? Хотите знать больше об основаниях?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Основания — классификация, получение и свойства » HimEge.
 ru
ruОснованиями называют гидроксиды, которые диссоциируют (распадаются) на гидроксильную группу и положительно заряженный катион.
Общая формула оснований — Э(OН)m, где m – степень окисления металла.
Классификация оснований
Взаимодействие активных металлов с водой (только щелочи)
2Na + 2H2O = 2NaOH + H2,
Ba + 2H2O = Ba(OH)2 + H2,
Взаимодействие основных оксидов с водой (только щелочи)
Na2O + H2O = 2NaOH,
Взаимодействие солей со щелочами (малорастворимые основания)
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4,
Cu2+ + 2OH— = Cu(OH)2,
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl,
Al3+ + 3OH— = Al(OH)3.
Электролиз водных растворов солей (промышленный способ)
2NaCl + 2H2O = 2NaOH + H2 + Cl2.
1) Растворы оснований мыльные на ощупь, изменяют окраску индикаторов: лакмуса – в синий цвет, бесцветного фенолфталеина – в малиновый.
В водном растворе растворимые основания диссоциируют, образуя катион металла и гидроксогруппу:
NaOH = Na+ + OH—.
Многоосновные основания диссоциируют ступенчато:
Ba(OH)2 = BaOH+ + OH—,
BaOH+ = Ba2+ + OH—,
суммарное уравнение:
Ba(OH)2 = Ba2+ + 2OH—.
2) Взаимодействие с кислотами (реакция нейтрализации)
NaOH + HCl = NaCl + H2O,
OH— + H+ = H2O.
При реакции нейтрализации взаимодействие сводится к взаимодействию ионов водорода и гидроксогруппы с образованием малодиссоциирующего вещества – воды.
Многоосновные основания образуют основные и средние соли:
Ba(OH)2 + HCl = BaOHCl + H2O,
Ba(OH)2 + 2HCl = BaCl2 + 2H2O.
3) Взаимодействие с кислотными оксидами
Ca(OH)2 + CO2 = CaCO3 + H2O,
4) Взаимодействие с солями
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4,
2Fe3+ + 6OH— = 2Fe(OH)3.
5) Термическое разложение
Cu(OH)2 = CuO + H2O,
2Fe(OH)3 = Fe2O3 + 3H2O .
Щелочи термическому разложению не подвергаются, например, гидроксид натрия кипит при 1400°С без разложения, из всех растворимых оснований разлагается только гидроксид лития:
2LiOH = Li2O + H2O.
6)Взаимодействие с неметаллами
6KOH + 3S = K2SO3 + 2K2S + 3H2O,
2NaOH + Cl2 = NaCl + NaOCl + H2O (на холоде).
Основания, их классификация.
 Химические свойства. Взаимодействие с оксидами неметаллов и кислотами. на Сёзнайке.ру
Химические свойства. Взаимодействие с оксидами неметаллов и кислотами. на Сёзнайке.ру
ПЛАН ОТВЕТА:
1) Определение оснований.
a) Исходя из состава,
b) Как электролита.
2) Классификация оснований.
a) По растворимости в воде,
b) По силе электролита
c) По числу гидроксильных групп,
3) Химические свойства оснований.
a) Действие на индикаторы,
b) Взаимодействие с кислотными оксидами,
c) Взаимодействие с кислотами,
d) Разложение при нагревании,
e) Взаимодействие с солями.
Основания – это сложные вещества, в молекулах которых атомы металла соединены с одной или несколькими гидроксильными группами.
Основания – это электролиты, которые при диссоциации образуют в качестве анионов только гидроксид-ионы.
NaOH ® Na+ + OH—
Ca(OH)2 ® CaOH+ + OH— ® Ca2+ + 2OH——
Существует несколько признаков классификации оснований:
- В зависимости от растворимости в воде основания делят на щёлочи и нерастворимые.
 Щелочами являются гидроксиды щелочных металлов ( Li, Na, K, Rb, Cs) и щелочноземельных металлов ( Ca, Sr, Ba ). Все остальные основания являются нерастворимыми.
Щелочами являются гидроксиды щелочных металлов ( Li, Na, K, Rb, Cs) и щелочноземельных металлов ( Ca, Sr, Ba ). Все остальные основания являются нерастворимыми. - В зависимости от степени диссоциации основания делятся на сильные электролиты ( все щёлочи ) и слабые электролиты ( нерастворимые основания ).
- В зависимости от числа гидроксильных групп в молекуле основания делятся на однокислотные ( 1 группа ОН ), например, гидроксид натрия, гидроксид калия, двухкислотные ( 2 группы ОН ), например, гидроксид кальция, гидроксид меди(2), и многокислотные.
Химические свойства.
Ионы ОН— в растворе определяют щелочную среду.
- Растворы щелочей изменяют окраску индикаторов:
Фенолфталеин: бесцветный ® малиновый,
Лакмус: фиолетовый ® синий,
Метилоранж : оранжевый ® жёлтый.
- Растворы щелочей взаимодействуют с кислотными оксидами с образованием солей тех кислот, которые соответствуют реагирующим кислотным оксидам. В зависимости от количества щёлочи образуются средние или кислые соли. Например, при взаимодействии гидроксида кальция с оксидом углерода(IV) образуются карбонат кальция и вода:
Ca(OH)2 + CO2 = CaCO3? + H2O
Ca2+ + 2OH— + CO2 = CaCO3 + H2O
А при взаимодействии гидроксида кальция с избытком оксида углерода(IV) образуется гидрокарбонат кальция:
Ca(OH)2 + CO2 = Ca(HCO3)2
Ca2+ + 2OH— + CO2 = Ca2+ + 2HCO32-
- Все основания взаимодействуют с кислотами с образованием соли и воды, например: при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия и вода:
NaOH + HCl = NaCl + H2O
Na+ + OH—+ H+ + Cl— = Na+ + Cl— + H2O
OH— + H+ = H2O.
Гидроксид меди(II) растворяется в соляной кислоте с образованием хлорида меди(II) и воды:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + 2H+ + 2Cl— = Cu2+ + 2Cl— + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2О.
Реакция между кислотой и основанием называется реакцией нейтрализации.
- Нерастворимые основания при нагревании разлагаются на воду и соответствующий основанию оксид металла, например:
t0 t0
Cu(OH)2 = CuO + H2 2Fe(OH)3 = Fe2O3 + 3H2O
- Щёлочи вступают во взаимодействие с растворами солей, если выполняется одно из условий протекания реакции ионного обмена до конца ( выпадает осадок), например: при взаимодействии гидроксида натрия с раствором сульфата меди(II) образуется осадок гидроксида меди(II).

2NaOH + CuSO4 = Cu(OH)2? + Na2SO4
2OH— + Cu2+ = Cu(OH)2
Реакция протекает за счёт связывания катионов меди с гидроксид-ионами.
При взаимодействии гидроксида бария с раствором сульфата натрия образуется осадок сульфата бария.
Ba(OH)2 + Na2SO4 = BaSO4? + 2NaOH
Ba2+ + SO42- = BaSO4
Реакция протекает за счёт связывания катионов бария и и сульфат-анионов.
Урок «Основания, их классификация и свойства»
Основания, их классификация и свойства.
Цель: познакомить учащихся с классификацией и химическими свойствами оснований.
Задачи:
Образовательные: рассмотреть классификацию оснований; выявить основные химические свойства оснований; отработать умения составлять химические формулы, уравнения химических реакций.
Развивающие: развивать интеллектуальные способности учащихся: анализировать полученную информацию, выделять главное, уметь сравнивать, делать выводы; развивать навыки работы с веществами; развивать познавательный интерес к предмету.
Воспитательные: воспитывать самостоятельность, чувства коллективизма и взаимопомощи.
Оборудование:оксид фосфора (V), гидроксид натрия, соляная кислота, фенолфталеин,сульфат железа (II), сульфат меди (II), хлорид калия, спиртовка, держатель, спички, 6 пробирок.
Ход урока.
Мы с вами изучаем вещества и их свойства. Вспомните, какие классы неорганических веществ вы знаете? (кислоты, соли, основания, оксиды)
Свойства какого класса вы уже изучили? (кислот)
Сегодня мы с вами рассмотрим следующий класс соединений – основания. Как вы считаете, что мы должны узнать на уроке? (какие бывают основания и какими свойствами обладают основания).
А чему мы сегодня должны научиться? (осуществлять химические реакции с участием оснований, составлять уравнения этих реакций).
Какие вещества называются основаниями? Выведите общую формулу оснований.
Задание: Подчеркните формулы оснований.
На какие две группы делятся основания? (растворимые и нерастворимые)
Задание: выделенные формулы распределите на два столбика на растворимые и нерастворимые основания.
По каким признакам еще можно классифицировать основания (учебник стр. 215 таб. 11).
Задание: заполните таблицу «Классификация оснований».
Физкультминутка. Карточки с формулами:
На формулу оксида – поднять руку, на формулу кислоты –необходимо встать.
Рассмотрим химические свойства оснований. Чтобы приступить к лабораторной работе, необходимо вспомнить правила по ТБ. В своих рабочих картах ознакомьтесь с правилами ТБ и поставьте свою подпись.
Рассмотрим химические свойства растворимых оснований.
Читаем, опыт №1Взаимодействие щелочей с оксидами неметаллов. Какие вещества берем для опыта?
Прошла ли данная реакция? Почему? Укажите признак данной реакции. Составим уравнение данной реакции (на доске учитель сам записывает уравнения реакций, все формулы и коэффициенты составляет и расставляет с помощью учеников)
Составим уравнение данной реакции (на доске учитель сам записывает уравнения реакций, все формулы и коэффициенты составляет и расставляет с помощью учеников)
Выполняем опыт №2 Взаимодействие щелочей с кислотами.Какие вещества берем для опыта?
Для чего используем фенолфталеин? Прошла ли данная реакция? Почему? Укажите признак данной реакции. Составим уравнение данной реакции.
Выполняем опыт № 3. Взаимодействие щелочей с солями.Какие вещества берем для опыта?
Что наблюдаем? Какой вывод сделаете о ходе реакции? Составим уравнение данной реакции.
Сделаем вывод, с какими веществами взаимодействуют щелочи.
Чтобы изучить свойства нерастворимых оснований, получим нерастворимое основание.
Выполняем опыт № 4. Получение нерастворимого основания.Какие вещества берем для опыта?
Что наблюдаем? Опишите полученный гидроксид меди.
Выполняем опыт № 5. Взаимодействие нерастворимых оснований с кислотами.
Какие вещества берем для опыта? Что наблюдаем? Какой вывод сделаете о ходе реакции? Составим уравнение данной реакции.
Выполняем опыт № 6. Взаимодействие нерастворимых оснований с солями.Какие вещества берем для опыта?
Что наблюдаете? Сделайте вывод о данном свойстве оснований.
Выполняем опыт № 7Разложение нерастворимых оснований при нагревании. Что будем делать? Что наблюдаете?Составим уравнение данной реакции.
Сделаем вывод о химических свойствах нерастворимых оснований.
Выполните упражнения в вашей рабочей карте.
Рефлексия.
Что узнали нового?
Что понравилось на уроке?
Что не понравилось на уроке?
Поставьте себе оценку за урок.
Домашнее задание: параграф 39 упр.3а-г
Рабочая карта урока. _________
(дата урока)
Ученика 8 « » класса.
Тема урока:
Цель урока: _________________________________________________________________________
___________________________________________________________________________________
Ход урока:
Общая формула оснований _____________________________________________________
Подчеркните формулы оснований CaO, NaCl, KOH, SO2, h3SO4, Fe (OH)3, CuCl2, Mg(OH)2,
HCl, Cu(OH)2, Zn(NO3)2, NaOH, Ba(OH)2, HNO3, Al2O3, Ca(OH)2, CO2, Cr(OH)3
Основания
_________________________ ______________________
_________________________ _______________________
_________________________ _______________________
__________________________ ________________________
__________________________ _________________________
Заполните таблицу «Классификация оснований»
Признаки классификации | Гидроксид натрия ______________ | Гидроксид магния ______________ | Гидроксид алюминия ______________ |
Растворимость в воде | |||
Степень ЭД | |||
Кислотность |
Химические свойства оснований.
Правила техники безопасности
Не оставляйте открытые склянки с реактивами, закрывайте теми же пробками или крышками, какими они были закрыты.
Бережно обращайтесь с посудой, веществами и лабораторным оборудованием.
Проводите опыты лишь с теми веществами, которые указаны учителем. Не берите для опыта больше вещества, чем это необходимо.
Нагревайте сначала всю пробирку, затем, не вынимая ее из пламени, ту часть, где находится вещество.
Будьте аккуратнее – работаете с щелочью и кислотой!
С правилами техники безопасности ознакомлен:_____________________________
Опыт № 1. Взаимодействие щелочей с оксидами неметаллов.
Вам выдана пробирка с оксидом фосфора (V), налейте в нее 1-2 мл раствора гидроксида натрия. Перемешайте содержимое пробирки. Что наблюдаете? __________________________________
Составьте уравнение проведенной реакции _______________________________________________
_____________________________________________________________________________________
Опыт № 2. Взаимодействие щелочей с кислотами.
Взаимодействие щелочей с кислотами.
В пробирку налейте 1-2 мл щелочи и добавьте к нему 1-2 капли фенолфталеина. Что наблюдаете? ____________________________________________________________________________________
К полученному раствору добавляйте по каплям соляную кислоту, перемешивая содержимое пробирки. Что вы наблюдаете? _________________________________________________________
Составьте уравнение проведенной реакции _______________________________________________
_____________________________________________________________________________________
Опыт № 3. Взаимодействие щелочей с солями.
В пробирке смешайте по 1-2 мл гидроксида натрия и сульфата железа (II).
Что наблюдаете? _____________________________________________________________________
Составьте уравнение проведенной реакции _______________________________________________
_____________________________________________________________________________________
Таким образом, щелочи взаимодействуют с :____________________________________________
_____________________________________________________________________________________
Опыт № 4. Получение нерастворимого основания.
Получение нерастворимого основания.
В три пробирки налейте по 1 мл раствора сульфата меди (II) и добавьте по 3-4 капли раствора гидроксида натрия. Опишите образовавшийся гидроксид меди(II).
Опыт № 5. Взаимодействие нерастворимых оснований с кислотами.
Добавьте в одну из пробирок с полученным в предыдущем опыте гидроксидом меди (II) 1-2 мл соляной кислоты. Что наблюдаете? __________________________________
Составьте уравнение проведенной реакции _______________________________________________
_____________________________________________________________________________________
Опыт № 6. Взаимодействие нерастворимых оснований с солями.
Добавьте в одну из пробирок с полученным в предыдущем опыте гидроксидом меди (II) 1-2 мл хлорида калия. Что наблюдаете? ________________________________________________________
Сделайте вывод о данном свойстве оснований____________________________________________
_____________________________________________________________________________________
Опыт № 7. Разложение нерастворимых оснований при нагревании.
Разложение нерастворимых оснований при нагревании.
Нагрейте одну из пробирок с гидроксидом меди (II).
Что наблюдаете? _____________________________________________________________________
Составьте уравнение проведенной реакции _______________________________________________
_____________________________________________________________________________________
Таким образом, нерастворимые основания взаимодействуют с ______________________________
при нагревании ______________________________________________________________________
Упражнения.
Выберите один правильный ответ.
Гидроксид меди (II) взаимодействует с веществом, формула которого:
А)h3O Б) KOH В) h3SO4 Г)Na2O
Раствор серной кислоты реагирует с каждым из двух веществ:
А) с оксидом железа (II) и цинком
Б) с раствором нитрата калия и нитрата бария
В) с оксидом меди (II) и серебром
Г) с раствором гидроксида калия и оксидом азота(II)
Укажите группу, в которой все вещества реагируют с раствором гидроксида натрия
А) HCl, CO2, SO3 В) h3O, P2O5, CaO
Б) SO3 , P2O5,HNO3 Г) MgCl2, KOH, CO2
Рефлексия.
Что узнали нового?__________________________________________________
__________________________________________________________________
2. Что понравилось на уроке? __________________________________________
__________________________________________________________________
Что не понравилось на уроке? ________________________________________
__________________________________________________________________
4. Поставьте себе оценку за урок _______________________________________
Основания и их свойства — презентация онлайн
1. ОСНОВАНИЯ
Основания-это сложные вещества, состоящие из
ионов металлов и гидроксильных групп
(-ОН).
Me(OH)n
Общая формула
оснований
n — число ОН- групп, численно равное
значению заряда иона (степени
окисления) металла.
+1
NaOH
+2
Ca(OH)2
+3
Fe(OH)3
Названия оснований
NaОН
гидроксид
натрия
Ca(OH)2
гидроксид
кальция
Fe(OH)3
гидроксид
железа (III)
Тривиальные названия
КОН
едкое кали
NaOH
едкий натр
Ca(OH)2 гашеная известь,
в растворе — известковая
вода
Основаниям соответствуют оксиды
металлов в той же степени
окисления.

Например:
NaOH – Na2O
Ca(OH)2 – CaO
Fe(OH)3 – Fe2O3
Fe(OH)2 — FeO
Классификация оснований
Основания
Растворимые
(Щелочи)
NaOH, КОН, Ba(OH)2
Нерастворимые
Cr(OH)2, Mn(OH)2,
Fe(OH)3
Физические свойства
оснований
Основания — твердые вещества, различной
растворимости в воде и различного цвета.
Ba(OH)2
NaOH
Ca(OH)2
Cu(OH)2
LiOH
Co(OH)2
9. Химические свойства щелочей
1. Действие щелочей на индикаторыИндикаторы — вещества, изменяющие цвет в зависимости
от среды.
лакмус
метилоранж
фенолфталеин
Диссоциация оснований.
1) NaOH ↔ Na+ + Oh3) Ba(OH)2 ↔ Ba2+ + 2OHOH- определяют щелочную
среду раствора.
2. Взаимодействие с кислотами.
NaOH + HCl = NaCl + h3O
реакция нейтрализации взаимодействие щелочей с кислотами
3. Взаимодействие щелочей с
кислотными оксидами.
2NaOH + SO3 = Na2SO4 + h3O
Ca(OH)2 + CO2 = CaCO3↓ + h3O
3.
 Разложение нерастворимых
Разложение нерастворимыхоснований при нагревании.
t
Cu(OH)2 = CuO + h3O
Качественная реакция на СО2 известковая вода мутнеет при
пропускании углекислого газа:
Са(ОН)2 + СО2 = СаСО3↓ + Н2О
Получение оснований
Получение
оснований
растворимых
нерастворимых
1. Активный металл + вода 1. Соль (в растворе)+ щелочь =
= щелочь + водород
= нерастворимое основание +
+ другая соль
2Na + 2h3O= 2NaOH + h3↑
2. Оксид активного
металла + вода = щелочь
CaO + h3O = Ca(OH)2
FeCl3 + 3NaOH =
=Fe(OH)3↓ + 3NaCl
14.3: Основы — Свойства и примеры
Цели обучения
- Изучите свойства оснований.
Возможно, вы съели слишком много пиццы и через несколько часов почувствовали себя очень некомфортно. Это ощущение возникает из-за того, что вырабатывается избыток желудочной кислоты. С дискомфортом можно справиться с помощью антацида. Основа антацида вступит в реакцию с \ (\ ce {HCl} \) в желудке и нейтрализует его, избавившись от неприятного ощущения.
Базы
Основания обладают свойствами, которые больше всего контрастируют со свойствами кислот.
- Водные растворы оснований также являются электролитами. Основания могут быть сильными или слабыми, как и кислоты.
- Основания часто имеют горький вкус и встречаются в пищевых продуктах реже, чем кислоты. Многие основы, например мыло, скользкие на ощупь.
- Базы также меняют цвет индикаторов. Лакмус становится синим в присутствии основания, а фенолфталеин становится розовым.
- Основания не реагируют с металлами так, как кислоты.
- Основания реагируют с кислотами с образованием соли и воды.
Предупреждение!
Пробовать химические вещества и прикасаться к ним НЕ являются хорошей лабораторной практикой, и их следует избегать, другими словами, не делайте этого дома.
Основы менее распространены в качестве пищевых продуктов, но, тем не менее, они присутствуют во многих домашних продуктах. Многие чистящие средства содержат в качестве основы аммиак. Гидроксид натрия содержится в очистителе канализации. Антациды , которые борются с избытком желудочной кислоты, состоят из оснований, таких как гидроксид магния или гидрокарбонат натрия.Различные общие основы и соответствующие применения приведены в Таблице \ (\ PageIndex {2} \).
Многие чистящие средства содержат в качестве основы аммиак. Гидроксид натрия содержится в очистителе канализации. Антациды , которые борются с избытком желудочной кислоты, состоят из оснований, таких как гидроксид магния или гидрокарбонат натрия.Различные общие основы и соответствующие применения приведены в Таблице \ (\ PageIndex {2} \).
Некоторые общие базы | Использует |
|---|---|
| гидроксид натрия, NaOH (щелочь или каустическая сода) | Используется при производстве мыла и моющих средств, а также в качестве основного ингредиента в средствах для чистки духовок и сливов.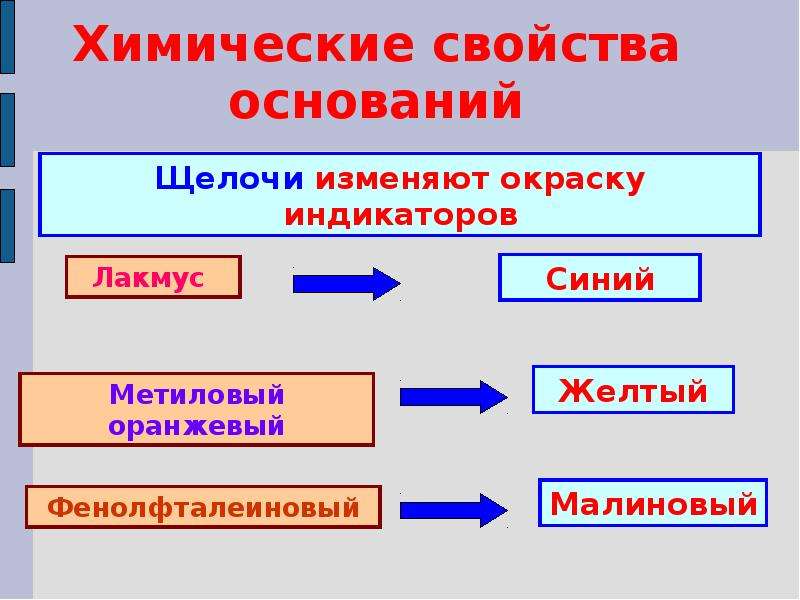 |
| гидроксид калия, КОН (щелочь или едкий калий) | Используется в производстве жидкого и мягкого мыла. Используется в щелочных батареях. |
| гидроксид магния, Mg (OH) 2 (магнезиальное молоко) | Используется в качестве ингредиента слабительных, антацидов и дезодорантов. Также используется для нейтрализации кислых сточных вод. |
| гидроксид кальция, Ca (OH) 2 (гашеная известь) | Используется при производстве цемента и известковой воды.Также добавлен для нейтрализации кислой почвы. |
| гидроксид алюминия | Используется для очистки воды и в качестве ингредиента антацидов. |
| аммиак, NH 3 | Используется в качестве строительного блока для синтеза многих фармацевтических продуктов и многих коммерческих чистящих средств. Используется при производстве удобрений. Используется при производстве удобрений. |
Гидроксид натрия
Гидроксид натрия, также известный как щелочь и каустическая сода, представляет собой неорганическое соединение с формулой \ (\ ce {NaOH} \).{-} (водн.)} \]
Полученный раствор обычно бесцветен и не имеет запаха и кажется скользким при контакте с кожей.
Гидроксид калия
Гидроксид калия — это неорганическое соединение с формулой \ (\ ce {KOH} \), обычно называемое едким калием. Наряду с гидроксидом натрия (NaOH) это бесцветное твердое вещество является прототипом сильного основания. Он имеет множество промышленных и нишевых применений, большинство из которых связано с его коррозийной природой и реакционной способностью по отношению к кислотам.{-} (водн.)} \]
Концентрированные водные растворы иногда называют щелочами калия .
Гидроксид магния
Гидроксид магния — это неорганическое соединение с химической формулой \ (\ ce {Mg (OH) 2} \).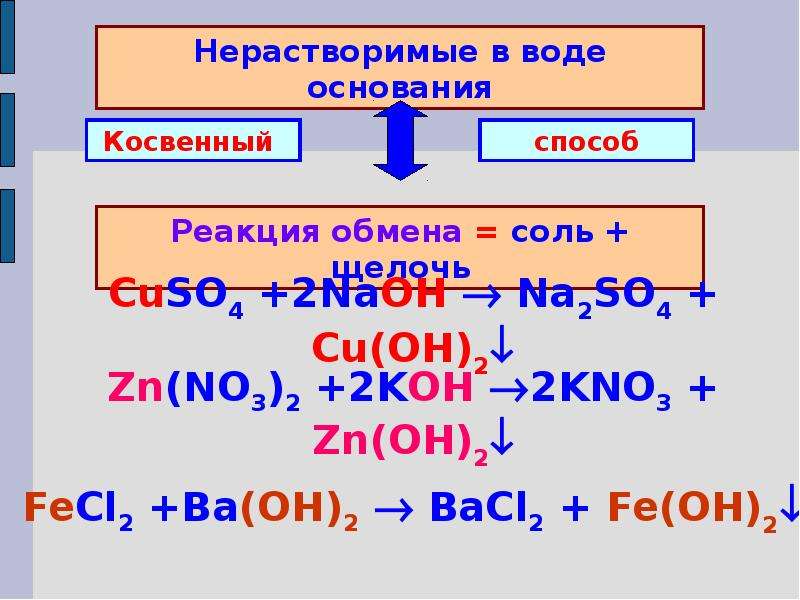 Гидроксид магния является обычным компонентом антацидов, таких как молоко магнезии, а также слабительных средств.
Гидроксид магния является обычным компонентом антацидов, таких как молоко магнезии, а также слабительных средств.
Это белое твердое вещество с низкой растворимостью в воде. Объединение раствора многих солей магния с основной водой вызывает осаждение твердого вещества \ (\ ce {Mg (OH) 2} \).{-} (водн.)} \]
Гидроксид кальция
Гидроксид кальция (традиционно называемый гашеной известью) — неорганическое соединение с химической формулой \ (\ ce {Ca (OH) 2} \). Это бесцветный кристалл или белый порошок. У него много названий, в том числе гашеная известь, каустическая известь, строительная известь, гашеная известь, каловая известь или травильная известь. Гидроксид кальция используется во многих областях, включая приготовление пищи. Известковая вода — это общее название насыщенного раствора гидроксида кальция.
Гидроксид кальция относительно нерастворим в воде, но имеет достаточно большие размеры, чтобы его растворы были основными в соответствии со следующей реакцией:
\ [\ ce {Ca (OH) 2 (s) <=> Ca ^ {2 +} (водн. {-} (водн.)} \]
{-} (водн.)} \]
Аммиак также является строительным материалом для синтеза многих фармацевтических продуктов и используется во многих коммерческих чистящих средствах.
Сводка
- Дано краткое описание свойств баз.
- Свойства оснований больше всего отличаются от кислот.
- Базы имеют множество разнообразных применений.
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или широко) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Кислоты и основания — Викиверситет
В химии соединение может быть кислотой или основанием.Кислоты и основания очень важны в химии. Они описывают большой класс веществ. Понимание их свойств позволяет нам рационализировать закономерности, встречающиеся в химии.
Контрастные свойства кислот и щелочей [править | править источник]
Вот список, который противопоставляет их свойства:
- Кислоты превращаются в синюю лакмусовую бумажку в красный цвет.
 Основания окрашиваются в красный цвет лакмусовой бумаги в синий цвет.
Основания окрашиваются в красный цвет лакмусовой бумаги в синий цвет. - Кислоты выделяют ионы H + (водорода) в воде; основания выделяют ионы OH- (гидроксид) в воде.
- Кислоты обычно имеют кислый привкус из-за кислых ионов H +; основы горькие на вкус из-за иона ОН-; но у них могут быть другие вкусы в зависимости от другой части молекулы.
- Основания обычно мыльные.
- Кислоты разъедают активные металлы; Основы денатурируют белок.
- Кислоты имеют pH менее 7; Основания имеют pH больше 7
Подобные свойства кислот и щелочей [править | править источник]
Вот список свойств, общих для кислот и оснований.
- Когда вы растворяете кислоту или основание в воде, они образуют ионы.Благодаря этому вода лучше проводит электричество.
- Чем сильнее кислота (или основание), тем больше образуется ионов, поэтому проводимость раствора увеличивается.
- Оба они могут проводить электричество.
- Когда кислота реагирует с основанием, образуется соль
- Они оба могут переносить и делить ионы
Кислоты реагируют с металлами 1 и 2 групп с образованием газообразного водорода.
Кислоты с pH менее 3 взорвутся при взаимодействии с раствором Дойера.
Примеры обычных кислых веществ [править | править источник]
- Цитрусовые (апельсины, лимоны, лаймы)
- Яблоки
- Ананасы
- Манго
- Вода и безалкогольные напитки (диоксид углерода реагирует в воде с образованием углекислоты)
- Желудочная кислота
- Уксус
- Жидкие очистители для дренажа, содержащие серную кислоту (Rooto)
Уникальные свойства щелочей (оснований) [править | править источник]
Основания кажутся скользкими и мыльными, потому что они гидролизуют эфир жирных кислот кожи (реакция омыления).
Примеры обычных вещей, которыми являются щелочи [править | править источник]
- Мыло для рук
- Щелок
- Пищевая сода
- Отбеливатель
- Шпинат
- Мойщик окон
- Укус осы
- Очиститель дренажа (Drano, Red Devil)
- Зубная паста
Кислоты и Основания
Кислоты, основания и шкала pH Термины кислота и основание описывают химические характеристики многих веществ, которые мы используем ежедневно. Кислые вещи на вкус кислые. Обычные или щелочные вещества имеют мыльный вкус. Сильные кислоты вызывают коррозию, а сильные основания — едкие; оба могут вызвать серьезные повреждения кожи, похожие на ожог. Однако слабые кислоты и основания обычны и относительно безвредны для нас. Что делает вещество кислым или основным? Следующее уравнение — хорошее место для начала:
Кислые вещи на вкус кислые. Обычные или щелочные вещества имеют мыльный вкус. Сильные кислоты вызывают коррозию, а сильные основания — едкие; оба могут вызвать серьезные повреждения кожи, похожие на ожог. Однако слабые кислоты и основания обычны и относительно безвредны для нас. Что делает вещество кислым или основным? Следующее уравнение — хорошее место для начала:
Начнем с двух молекул воды и переместим несколько атомов водорода.Одна молекула воды приобретает водород и, следовательно, принимает положительный заряд, в то время как другая молекула воды теряет атом водорода и, следовательно, становится отрицательно заряженной. H 3 O + называется ионом гидроксония, и он делает вещи кислыми. OH — называется гидроксил-ионом, и он делает вещи основными. Однако в воде существует баланс между гидроксонием и гидроксилами, поэтому они нейтрализуют заряды друг друга. Чистая вода не является ни кислой, ни щелочной; он нейтрален.
Чистая вода не является ни кислой, ни щелочной; он нейтрален.
Так как же что-то становится кислым или щелочным? Это происходит, когда гидроксоний и гидроксилы не сбалансированы.Если положительно заряженных гидроксониев больше, чем отрицательно заряженных гидроксилов, то вещество кислое. Если отрицательно заряженных гидроксилов больше, чем положительно заряженных гидроксониев, то вещество становится основным. pH фактически означает «потенциал (или мощность) водорода».
Примечание : Иногда люди пишут H + как сокращение от H 3 O + , и это может вызвать путаницу, потому что иногда, когда люди пишут H + , они действительно имеют в виду только H + и не H 3 O + .Следите за этим и просите разъяснений!
Когда мы растворяем кислоты в воде, мы создаем избыток гидроксония. Когда мы растворяем основания в воде, мы создаем избыток гидроксилов. Вот два примера. Уксус, слабая кислота, имеет химическую формулу CH 3 COOH. При растворении в воде он превращается в CH 3 COO — и H + . Ионы H + соединяются с молекулами воды с образованием H 3 O + , поэтому раствор становится кислым.Теперь давайте посмотрим на щелок, сильное основание с химической формулой NaOH (гидроксид натрия). Если мы добавим NaOH в воду, он диссоциирует на Na + и OH — . Натрий не делает ничего важного, но гидроксилы делают раствор более щелочным.
Вот два примера. Уксус, слабая кислота, имеет химическую формулу CH 3 COOH. При растворении в воде он превращается в CH 3 COO — и H + . Ионы H + соединяются с молекулами воды с образованием H 3 O + , поэтому раствор становится кислым.Теперь давайте посмотрим на щелок, сильное основание с химической формулой NaOH (гидроксид натрия). Если мы добавим NaOH в воду, он диссоциирует на Na + и OH — . Натрий не делает ничего важного, но гидроксилы делают раствор более щелочным.
Последний вопрос: почему сильные кислоты и сильные основания такие противные? Это потому, что они не сбалансированы. У них либо слишком много положительных зарядов, и они ищут отрицательные, чтобы восстановить баланс, либо у них слишком много отрицательных зарядов, и они ищут положительные, чтобы восстановить баланс.Это заставляет их очень быстро реагировать на все, с чем они контактируют. Когда положительные и отрицательные стороны равны, они нейтрализуют друг друга.
Что такое pH ?: pH — это шкала, по которой мы измеряем силу кислот и оснований. pH обозначает потенциал водорода и является приблизительно отрицательным значением логарифма молярной концентрации ионов водорода по основанию 10, поэтому pH = -log 10 [H + ]
Шкала pH — это показатель кислотности по 14-балльной шкале, где 7 — нейтральная средняя точка.pH — это логарифмическая шкала (как шкала Рихтера для землетрясений), поэтому pH 4 в 10 раз более кислый, чем pH 5, и в 100 раз более кислый, чем pH 6. Вы можете купить электронные pH-метры или pH-индикатор. бумага от любой биологической или лабораторной компании-поставщика, которая может быть использована для точного измерения кислотного или основного качества веществ, которые вы хотите проверить. Попробуйте это моделирование, чтобы определить pH некоторых распространенных веществ.
Дополнительный мини-эксперимент : Сделайте свой собственный индикатор pH, используя сок красной капусты. Смешайте 2 стакана нарезанных листьев красной капусты и 1 стакан воды в кухонном комбайне или электрическом блендере, пока кусочки не станут крошечными и однородными. Процедите твердые частицы и оставьте жидкость. Если у вас нет блендера, вы также можете крупно нарезать капусту и варить ее в воде около 5 минут, пока жидкость не станет темно-фиолетовой. Эта фиолетовая жидкость изменит цвет в зависимости от кислотности или щелочности веществ, которые вы хотите проверить. Добавьте около 10 капустного сока к 1 столовой ложке исследуемого вещества.Какого цвета капустный сок превращается в кислоту, такую как белый уксус? Какого цвета капустный сок превращается в основу, такую как пищевая сода и водный раствор?
Смешайте 2 стакана нарезанных листьев красной капусты и 1 стакан воды в кухонном комбайне или электрическом блендере, пока кусочки не станут крошечными и однородными. Процедите твердые частицы и оставьте жидкость. Если у вас нет блендера, вы также можете крупно нарезать капусту и варить ее в воде около 5 минут, пока жидкость не станет темно-фиолетовой. Эта фиолетовая жидкость изменит цвет в зависимости от кислотности или щелочности веществ, которые вы хотите проверить. Добавьте около 10 капустного сока к 1 столовой ложке исследуемого вещества.Какого цвета капустный сок превращается в кислоту, такую как белый уксус? Какого цвета капустный сок превращается в основу, такую как пищевая сода и водный раствор?
Проверьте pH различных веществ и создайте соответствующую цветовую шкалу pH. Сравните свои результаты с таблицей здесь.
Вы также можете сделать индикаторную бумагу, окунув полоски белого бумажного полотенца, кофейные фильтры или белый картон в капустный сок до пурпурного цвета. Когда фиолетовые полоски высохнут, используйте зубочистку, соломинку с содой или пипетку, чтобы нанести на полоски каплю тестового раствора.Как результаты соотносятся с вашей диаграммой pH?
Когда фиолетовые полоски высохнут, используйте зубочистку, соломинку с содой или пипетку, чтобы нанести на полоски каплю тестового раствора.Как результаты соотносятся с вашей диаграммой pH?
Свойства кислот и оснований [Видео]
Привет, и добро пожаловать в это видео о кислотах и основаниях !
Давайте начнем с небольшой истории, глубокого погружения в то, как были впервые классифицированы кислоты и основания.
Еще в 17 веке, до того, как ученые узнали что-либо о молекулярной структуре кислот и оснований, они дали им определения, основанные исключительно на их наблюдаемых свойствах. Итак, кислота — это любое вещество, которое
- было кислым на вкус
- реагировало с металлами с образованием газообразного водорода
- и изменяло цвет некоторых органических соединений (теперь известных как индикаторы).
С другой стороны, оснований было любое вещество, которое
- было горьким на вкус
- чувствовалось скользким
- и окрашивало те же самые органические соединения в другой цвет.

Химики начали изучать кислотно-щелочную химию и далее добавили к своему определению, что при смешивании кислоты и основания нейтрализуются, сводя на нет свойства друг друга.
Хотя эти ранние определения все еще применимы ко многим кислотам и основаниям, теперь у нас есть определение кислотно-основного состава Бренстеда-Лоури, более широкое описание, основанное на их молекулярной структуре.
Бренстед-Лоури определяет кислоту как любую разновидность, которая отдает протон, и основание как любую разновидность, которая принимает протон. Итак, теперь, следуя этому определению, вместо того, чтобы рассматривать только наблюдаемые свойства, химики могут оценивать силу кислот и оснований по тому, насколько вероятно, что они будут отдавать или получать протон. Этот подход намного лучше объясняет явления всех кислот и оснований.
Итак, давайте углубимся в это немного подробнее, начиная с кислот.
Когда обычная кислота добавляется в воду, кислота диссоциирует, высвобождая протон в воду с образованием сопряженного основания кислоты и иона гидроксония. {+} \)
{+} \)
Как вы заметите по двойной стрелке, это равновесный процесс. Сила кислоты определяется тем, какая часть кислоты фактически диссоциирует при добавлении в воду. Сильные кислоты полностью диссоциируют при добавлении, тогда как диссоциирует только часть слабой кислоты, что означает, что некоторая общая кислота всегда остается в растворе.
Сила кислоты также может быть оценена по стабильности ее сопряженного основания. Когда сопряженное основание хорошо стабилизирует отрицательный заряд (что означает, что оно имеет более низкую энергию), больше кислоты будет диссоциировать.{2} \)
Это в первую очередь происходит потому, что две этильные группы вносят вклад в электронную плотность азота, что делает его более подходящим для стабилизации положительного заряда.
Однако диэтиламин все еще является слабым основанием. Гораздо более сильные основания — это анионы солей, таких как гидроксид натрия, которые, конечно, отлично стабилизируют протон, потому что они реагируют с образованием воды.
Так же, как \ (K_ {a} \), прочность основания также может быть определена количественно с помощью константы равновесия, в данном случае константы диссоциации оснований, \ (K_ {b} \).{-} \ right \ rceil} {\ left \ lceil B \ right \ rceil} \)
Хотя они и не используются в повседневных реакциях, существуют даже более сильные кислоты и основания, известные как суперкислоты и супероснования. Эти соединения обладают высокой реакционной способностью, потому что одно чрезвычайно мотивировано высвобождать протон, а другое — получать протон. По сути, им очень выгодно подвергнуться реакции с энергетической точки зрения.
Трифликовая кислота , сокращение от трифторметансульфоновой кислоты, является примером суперкислоты.Он заменяет трифторметан на один из атомов кислорода и второй водород на серную кислоту, что помогает стабилизировать сопряженное основание, делая его еще более сильной кислотой, чем серная.
Диизопропиламид лития , LDA, является примером суперосновы. Неподеленная пара на азоте является очень основной и полезна в органическом синтезе, когда очень слабые кислоты необходимо депротонировать для механизма реакции.
Неподеленная пара на азоте является очень основной и полезна в органическом синтезе, когда очень слабые кислоты необходимо депротонировать для механизма реакции.
Теперь, когда у нас есть молекулярное понимание кислот и оснований, давайте вернемся к некоторым наблюдаемым свойствам, которые идентифицировали ученые 17 века, и попытаемся понять их на более глубоком уровне.{+} \)
И когда кислотные и основные растворы меняют цвет индикаторов, например, когда лакмусовая бумага используется для проверки pH раствора, это потому, что органическое соединение на этой лакмусовой бумаге протонируется кислотой или депротонируется основанием, и это молекулярное изменение приводит к изменению цвета.
Мы также можем понять, почему кислотные и щелочные растворы проводят электричество. Электричество — это движение заряда. Когда кислоты и основания реагируют с водой, образуются заряженные частицы, которые затем обеспечивают проводимость электричества.И, как и следовало ожидать, проводимость увеличивается с увеличением силы кислоты и основания, потому что концентрации ионов также увеличиваются.
Еще одно из наблюдаемых свойств — кисловатый вкус кислоты. Кислоты, такие как лимонная и уксусная, имеют кислый вкус, потому что рецепторы кислого вкуса на нашем языке запускаются ионами гидроксония.
Наконец, было замечено, что некоторые базы кажутся скользкими. Это потому, что, когда они реагируют с макромолекулами на вашей коже (например, жирными кислотами), они производят молекулы с той же структурой, что и мыло.
Итак, как вы можете видеть, с определением Бренстеда-Лоури мы действительно можем понять лежащую в основе химию, которая производит свойства, наблюдаемые химиками 17-го века.
Хорошо, давайте подведем итоги быстрым обзором.
Еще в 17 веке определения кислот и оснований в значительной степени основывались на их наблюдаемых свойствах. Сегодня мы используем определение Бренстеда-Лоури, в котором кислоты — это соединения, которые отдают протоны, а основания — это соединения, которые принимают протоны.Эти определения являются широкими и могут использоваться для объяснения разницы между сильными и слабыми кислотами и основаниями. Наконец, силу кислот и оснований можно оценить по стабильности их сопряженного основания и сопряженной кислоты, соответственно.
Наконец, силу кислот и оснований можно оценить по стабильности их сопряженного основания и сопряженной кислоты, соответственно.
Вот и все! Спасибо за просмотр и удачной учебы!
исследований в области поверхностных исследований и катализа | Новые твердые кислоты и основания — их каталитические свойства
выбрать статью Отредактировано
https: // doi.org / 10.1016 / S0167-2991 (08) 61041-1
- Полнотекстовый доступ
Под редакцией
- Страница iii
- Скачать PDF
выберите статью Copyright page
https: // doi .org / 10.1016 / S0167-2991 (08) 61042-3
- Нет доступа
Copyright page
- Page iv
- Купить PDF
выберите статью Предисловие
https: // doi. org / 10.1016 / S0167-2991 (08) 61043-5
- От редакции Нет доступа
Предисловие
Кодзо Танабэ, Макото Мисоно, Йошио Оно, Хидеши Хаттори
- Выбрать PDF статья 1 Определение и классификация твердых кислот и оснований
https://doi.
 org/10.1016/S0167-2991(08)61044-7
org/10.1016/S0167-2991(08)61044-7- Только реферат
1 Определение и классификация твердых кислот и оснований
- Страницы 1-3
- Купить PDFChapter preview
4 Страница v
выберите статью 2 Определение кислотных и основных свойств твердых поверхностей
https: // doi.org / 10.1016 / S0167-2991 (08) 61045-9
- Только аннотация
2 Определение кислотных и основных свойств твердых поверхностей
- Страницы 5-25
- Купить PDFChapter preview
https://doi.org/10.1016/S0167-2991(08)61046-0
- Только реферат
3 Кислотные и основные центры: структура и Кислотно-основное свойство
- Страницы 27-213
- Купить PDFChapter preview
выберите статью 4 Каталитическая активность и селективность
https: // doi. org / 10.1016 / S0167-2991 (08) 61047-2
org / 10.1016 / S0167-2991 (08) 61047-2
- Только аннотация
4 Каталитическая активность и селективность
- Страницы 215-337
- Приобрести PDF
https://doi.org/10.1016/S0167-2991(08)61048-4
- Только аннотация
5 Деактивация и регенерация
- Страницы 339-346
- Купить PDF
выберите статью 6 Связанные темы
https: // doi.org / 10.1016 / S0167-2991 (08) 61049-6
- Только аннотация
6 Связанные темы
- Страницы 347-354
- Купить PDF //doi.org/10.1016/S0167-2991(08)61050-2
- Полнотекстовый доступ
Предметный указатель
- Страницы 355-360
- Скачать PDF
выберите статью Указатель катализаторов
https: // doi.org / 10.1016 / S0167-2991 (08) 61051-4
- Полнотекстовый доступ
Указатель катализаторов
- Страницы 361-365
- Скачать PDF
Каковы общие свойства баз?
Титрование сильной кислоты или сильного основания
В кислотно-щелочной химии титрование можно использовать для определения концентрации неизвестного раствора. Узнайте о титровании, титранте, реакции нейтрализации и точке эквивалентности, а также о том, как выполнять титрование и интерпретировать кривую титрования.
Узнайте о титровании, титранте, реакции нейтрализации и точке эквивалентности, а также о том, как выполнять титрование и интерпретировать кривую титрования.
Энтальпия: передача энергии в физических и химических процессах
Когда энергия передается во время химической реакции, это называется энтальпией.Изучите происходящие изменения, связь с энергией, теплом и температурой, экзотермическими и эндотермическими процессами, а также физическими и химическими изменениями во время энтальпии.
Типы энергии | Что такое энергия?
Какое определение для энергии? Прочтите простое определение энергии вместе с двумя основными типами энергии. Затем узнайте о формах определения энергии.
Затем узнайте о формах определения энергии.
Химические реакции и уравновешивание химических уравнений
Закон сохранения материи позволяет ученым сбалансировать химическое уравнение.Изучите шаги по уравновешиванию химических уравнений, изучите химические реакции и используйте сбалансированные химические уравнения, чтобы показать, что материя сохраняется.
Основание конъюгата: определение и обзор
Конъюгированные основания — это частицы, оставшиеся после того, как кислота потеряла атом водорода. Изучите типы этих оснований и посмотрите, как они соотносятся с кислотами на примерах реакций.
Изучите типы этих оснований и посмотрите, как они соотносятся с кислотами на примерах реакций.
Кислоты и основания: Урок для детей
Узнайте о кислотах и щелочах.Откройте для себя разницу между кислотами и основаниями, как их измерить по шкале pH и как они влияют на вкус, а также исследуйте, как водород образует кислоты, а гидроксид — основания.
Константа диссоциации и автоионизация воды
Константа автоионизации используется для определения концентрации гидроксида или ионов гидроксония в растворе. Изучите автоионизацию воды, константу Kw и способы определения концентрации ионов.
Изучите автоионизацию воды, константу Kw и способы определения концентрации ионов.
Урок фотосинтеза для детей: процесс и шаги
Фотосинтез — это процесс, при котором растения сами производят пищу.Узнайте о фотосинтезе и о том, как он работает, и откройте для себя три ингредиента, которые необходимы растениям для приготовления пищи.
Что такое кислота в химии? — Определение и обзор
Кислота в химии относится к химическим веществам, которые выделяют ионы водорода при добавлении в воду. Узнайте, как действуют кислоты, их характеристики, определения слабых и сильных кислот, а также различные типы кислот в организме человека.
Узнайте, как действуют кислоты, их характеристики, определения слабых и сильных кислот, а также различные типы кислот в организме человека.
Урок отражения и преломления для детей
Отражение — это то, как свет отражается от поверхностей, а преломление — это отклонение света.Просмотрите примеры каждого типа явлений и изучите объяснения того, как они работают.
Урок клеточного дыхания для детей: определение и шаги
Узнайте о клеточном дыхании. Откройте для себя ключевые ингредиенты клеточного дыхания, такие как углекислый газ и энергия. Наконец, исследуйте этапы клеточного дыхания, известные как гликолиз, цикл Кребса и цепь переноса электронов.
Откройте для себя ключевые ингредиенты клеточного дыхания, такие как углекислый газ и энергия. Наконец, исследуйте этапы клеточного дыхания, известные как гликолиз, цикл Кребса и цепь переноса электронов.
: определение и понятие
Кислотно-основные индикаторы, также известные как индикаторы pH, меняют цвет в ответ на изменение концентрации ионов водорода.Узнайте больше об определении кислотно-основных индикаторов и о том, как они используются, чтобы определить, является ли раствор кислотным или основным.
База (химия) — Энциклопедия Нового Света
В химии основание рассматривается как вещество, которое может принимать протоны или любое химическое соединение, которое дает ионы гидроксида (OH — ) в растворе. Его также обычно называют любым веществом, которое может реагировать с кислотой для уменьшения или нейтрализации ее кислотных свойств, изменения цвета индикаторов (например,г. превращается в красную лакмусовую бумажку в синий цвет), становится скользким на ощупь в растворе, имеет горький вкус, вступает в реакцию с кислотами с образованием солей и способствует определенным химическим реакциям (например, щелочному катализу). Примеры простых оснований — гидроксид натрия и аммиак. Гидроксид натрия (NaOH), также известный как каустическая сода или щелочь, диссоциирует в воде с образованием ионов гидроксида (OH — ) и ионов натрия (Na + ).
Его также обычно называют любым веществом, которое может реагировать с кислотой для уменьшения или нейтрализации ее кислотных свойств, изменения цвета индикаторов (например,г. превращается в красную лакмусовую бумажку в синий цвет), становится скользким на ощупь в растворе, имеет горький вкус, вступает в реакцию с кислотами с образованием солей и способствует определенным химическим реакциям (например, щелочному катализу). Примеры простых оснований — гидроксид натрия и аммиак. Гидроксид натрия (NaOH), также известный как каустическая сода или щелочь, диссоциирует в воде с образованием ионов гидроксида (OH — ) и ионов натрия (Na + ).
Базы имеют множество практических применений, и некоторые из них обычно используются в домашних условиях.Бытовой аммиак — привычное чистящее средство. Щелок используется для чистки засоров и сточных вод в раковинах. Гидроксид калия, также называемый едким калием, используется для изготовления мягкого мыла, легко растворяющегося в воде. Гидроксид магния в воде (также называемый молоком магнезии) используется как антацидное или слабительное средство.
Гидроксид магния в воде (также называемый молоком магнезии) используется как антацидное или слабительное средство.
Щелочь и основа
Истоки концепции
Термин «щелочь» происходит от арабского слова al qalīy , что означает «кальцинированный пепел». Считалось, что зола растений обладает такими свойствами, как способность обращать вспять действие кислот и моющими свойствами.Таким образом, щелочь изначально считалась антитезой кислоты. Образование солей в результате реакции кислоты и щелочи привело к мнению, что соли могут быть получены из двух компонентов противоположной природы.
Однако не все некислотные компоненты обладают щелочными свойствами. Примерами являются оксиды и гидроксиды тяжелых металлов. Так родилось понятие «база». Эта концепция была впервые введена французским химиком Гийомом Франсуа Руэлем в 1754 году. Он заметил, что кислоты, которые в то время были в основном летучими жидкостями, такими как уксусная кислота, превращались в твердые соли только в сочетании с определенными веществами. Эти вещества сформировали бетонную основу , для соли, [1], и отсюда и название.
Эти вещества сформировали бетонную основу , для соли, [1], и отсюда и название.
Путаница между основанием и щелочью
Термины «основание» и «щелочь» часто используются взаимозаменяемо, поскольку наиболее распространенными основаниями являются щелочи. Обычно говорят об «измерении щелочности почвы», когда на самом деле имеется в виду измерение pH (основного свойства). Точно так же основания, не являющиеся щелочами, такие как аммиак, иногда ошибочно называют щелочными.
Обратите внимание, что не все или даже большинство солей, образованных щелочными металлами, являются щелочными; это обозначение применяется только к тем солям, которые являются основными.
В то время как большинство электроположительных оксидов металлов являются основными, только растворимые оксиды щелочных и щелочноземельных металлов можно правильно назвать щелочами.
Это определение щелочи как основной соли щелочного или щелочноземельного металла действительно является наиболее распространенным, исходя из словарных определений, [2] , однако, существуют противоречивые определения термина щелочь. К ним относятся:
К ним относятся:
- Любая водорастворимая основа [3] Alkali, Farlex, 2008. Получено 8 апреля 2008 г. Это более точно называется основанием Аррениуса.
- Раствор основы в воде. [4]
Определения кислот и оснований
Кислоты и основания образуют дополнительные пары, поэтому их определения следует рассматривать вместе. Есть три общие группы определений: определения Аррениуса , Бронстеда-Лоури и Льюиса , в порядке возрастания общности.
- Аррениус : Согласно этому определению, кислота — это вещество, которое увеличивает концентрацию иона гидроксония (H 3 O + ) при растворении в воде, а основания — это вещества, увеличивающие концентрацию гидроксид-ионов ( ОН —). Это определение ограничивает кислоты и основания веществами, которые могут растворяться в воде. Около 1800 года многие французские химики, в том числе Антуан Лавуазье, ошибочно полагали, что все кислоты содержат кислород.
 Действительно, современное немецкое слово для обозначения кислорода — Sauerstoff (букв. Кислое вещество). Английские химики, в том числе сэр Хэмфри Дэви, в то же время считали, что все кислоты содержат водород. Шведский химик Сванте Аррениус использовал это убеждение, чтобы разработать определение кислоты.
Действительно, современное немецкое слово для обозначения кислорода — Sauerstoff (букв. Кислое вещество). Английские химики, в том числе сэр Хэмфри Дэви, в то же время считали, что все кислоты содержат водород. Шведский химик Сванте Аррениус использовал это убеждение, чтобы разработать определение кислоты. - Brønsted-Lowry : Согласно этому определению, кислота является донором протона (ядро водорода), а основание — акцептором протона (ядро водорода). Говорят, что кислота диссоциирует после передачи протона.Кислота и соответствующее основание называются сопряженными парами кислота-основание. Бренстед и Лоури сформулировали это определение, которое включает нерастворимые в воде вещества, которых нет в определении Аррениуса.
- Льюис : Согласно этому определению, кислота является акцептором электронной пары, а основание — донором электронной пары. (Их часто называют «кислоты Льюиса [5] » и «основания Льюиса [6] », и в органической химии они являются электрофилами [7] и нуклеофилами [8] , соответственно; Lewis основания также являются лигандами в координационной химии.
 ) Кислоты Льюиса включают вещества без переносимых протонов (например, H + ионов водорода), такие как хлорид железа (III), и, следовательно, определение кислоты Льюиса имеет более широкое применение, чем определение Бренстеда-Лоури. Определение Льюиса также можно объяснить с помощью теории молекулярных орбиталей. В общем, кислота может получить пару электронов на своей самой низкой незанятой орбитали (НСМО) с самой высокой занятой орбитали (ВЗМО) основания. То есть ВЗМО из основания и НСМО из кислоты объединяются в связывающую молекулярную орбиталь.Это определение разработал Гилберт Н. Льюис.
) Кислоты Льюиса включают вещества без переносимых протонов (например, H + ионов водорода), такие как хлорид железа (III), и, следовательно, определение кислоты Льюиса имеет более широкое применение, чем определение Бренстеда-Лоури. Определение Льюиса также можно объяснить с помощью теории молекулярных орбиталей. В общем, кислота может получить пару электронов на своей самой низкой незанятой орбитали (НСМО) с самой высокой занятой орбитали (ВЗМО) основания. То есть ВЗМО из основания и НСМО из кислоты объединяются в связывающую молекулярную орбиталь.Это определение разработал Гилберт Н. Льюис.
Общая недвижимость
Некоторые общие свойства баз включают:
- Вкус : Горький вкус (в отличие от кислого вкуса кислот и сладости альдегидов и кетонов)
- Touch : Склизкие или мыльные ощущения на пальцах
- Реакционная способность : Каустик [9] на органических веществах, бурно реагирует с кислотными или восстанавливаемыми веществами
- Электропроводность : водные растворы или расплавленные основания диссоциируют на ионы и проводят электричество
- Лакмусовая бумажка : основы окрашиваются в красный цвет лакмусовой бумаги в синий цвет.
 {-}] \ over [BH]}}
{-}] \ over [BH]}}
Константа равновесия Kb также называется базовой константой ионизации. Это относится к реакции, в которой основание образует сопряженную кислоту путем удаления иона H + из воды.pH (нечистой) воды является мерой ее кислотности. В чистой воде примерно одна из десяти миллионов молекул диссоциирует на ионы гидроксония (H 3 O + ) и ионы гидроксида (OH —) в соответствии со следующим уравнением:
- 2H 2 O (l) ⇌ H 3 O + (водн.) + OH — (водн.)
Основание принимает (удаляет) ионы гидроксония [10] (H 3 O + ) из раствора или отдает в раствор гидроксид-ионы [11] (OH — ).Оба действия снизят концентрацию ионов гидроксония и, таким образом, повысят pH. Напротив, кислота отдает раствору ионы H 3 O + или принимает OH —, тем самым понижая pH.

Например, если 1 моль гидроксида натрия (40 г) растворить в 1 литре воды, концентрация гидроксид-ионов станет [OH — ] = 1 моль / л. Следовательно, [H + ] = 10 -14 моль / л, а pH = -log 10 -14 = 14.
Константа основности или pK b является мерой основности и связана с pKa простым соотношением pK a + pK b = 14.
Базовая прочность
A «Сильное основание» — это соединение, которое полностью гидролизует, депротонируя кислоты в кислотно-основной реакции, следовательно, повышая pH раствора до 14. Соединения с pH более чем примерно 13 называются сильными основаниями. Сильные основания, такие как сильные кислоты, атакуют живые ткани и вызывают серьезные ожоги. Они по-разному реагируют на кожу, чем кислоты, в то время как сильные кислоты вызывают коррозию, мы говорим, что сильные основания являются едкими. Обычными примерами сильных оснований являются гидроксиды щелочных и щелочноземельных металлов, таких как NaOH и Ca (OH) 2 .
 Очень сильные основания способны даже депротонировать очень слабокислые C-H-группы в отсутствие воды.
Супероснования — это класс особо основных соединений, а гарпунные основания — это особый класс сильных оснований с плохой нуклеофильностью.
Очень сильные основания способны даже депротонировать очень слабокислые C-H-группы в отсутствие воды.
Супероснования — это класс особо основных соединений, а гарпунные основания — это особый класс сильных оснований с плохой нуклеофильностью.Примеры сильных оснований (гидроксидных соединений) по нисходящей силе:
- Гидроксид калия (КОН)
- Гидроксид бария (Ba (OH) 2 )
- Гидроксид цезия (CsOH)
- Гидроксид натрия (NaOH)
- Гидроксид стронция (Sr (OH) 2 )
- Гидроксид кальция (Ca (OH) 2 )
- Гидроксид лития (LiOH)
- Гидроксид рубидия (RbOH)
Катионы этих сильных оснований входят в группы 1 и 2 периодической таблицы (щелочные и щелочноземельные металлы).
Еще более сильными основаниями являются:
- Натрия гидрид (NaH)
- Диизопропиламид лития (LDA) (C 6 H 14 LiN)
- Амид натрия (NaNH 2 )
A «Слабое основание» — это вещество, которое не полностью ионизируется в растворе. Когда основание ионизируется, оно забирает ион водорода из окружающей воды, оставляя после себя ион ОН-. Слабые основания имеют более высокую концентрацию H + , чем сильные основания. Слабые основания существуют в химическом равновесии так же, как и слабые кислоты.Константа ионизации основания K b указывает на прочность основания. Большие K b s относятся к более прочным основаниям. PH основания больше 7 (где 7 — нейтральное число; ниже 7 — кислота), обычно до 14.
Типичным примером слабого основания является аммиак, который используется для очистки.
Когда основание ионизируется, оно забирает ион водорода из окружающей воды, оставляя после себя ион ОН-. Слабые основания имеют более высокую концентрацию H + , чем сильные основания. Слабые основания существуют в химическом равновесии так же, как и слабые кислоты.Константа ионизации основания K b указывает на прочность основания. Большие K b s относятся к более прочным основаниям. PH основания больше 7 (где 7 — нейтральное число; ниже 7 — кислота), обычно до 14.
Типичным примером слабого основания является аммиак, который используется для очистки.Примеры слабых оснований:
- Аланин (C 3 H 5 O 2 NH 2 )
- Аммиак (вода) (NH 3 (NH 4 OH))
- Диметиламин ((CH 3 ) 2 NH)
- Этиламин (C 2 H 5 NH 2 )
- Глицин (C 2 H 3 O 2 NH 2 )
- Гидразин (N 2 H 4 )
- Метиламин (CH 3 NH 2 )
- Триметиламин ((CH 3 ) 3 N)
Кислотно-щелочная нейтрализация
Основания можно рассматривать как химическую противоположность кислот.
 Реакция между кислотой и основанием называется нейтрализацией. Основания и кислоты рассматриваются как противоположности, потому что действие кислоты заключается в увеличении концентрации иона гидроксония (H 3 O + ) в воде, тогда как основания уменьшают эту концентрацию. Основания реагируют с кислотами с образованием солей и воды.
Реакция между кислотой и основанием называется нейтрализацией. Основания и кислоты рассматриваются как противоположности, потому что действие кислоты заключается в увеличении концентрации иона гидроксония (H 3 O + ) в воде, тогда как основания уменьшают эту концентрацию. Основания реагируют с кислотами с образованием солей и воды.Положительный ион соли происходит от основания, а отрицательный ион — от кислоты. Если рассматривать гидроксид металла в качестве основания, то общая реакция выглядит так:
- HX (водн.) + MOH (водн.) → MX (водн.) + HOH (l)
- кислотно-основная соленая вода
Соли сильных оснований и сильных кислотСильная кислота HCl (соляная кислота) реагирует с сильным основанием NaOH (гидроксид натрия) с образованием NaCl (соль = хлорид натрия) и воды.Если количества кислоты и основания находятся в правильном стехиометрическом соотношении, тогда реакция подвергнется полной нейтрализации, при которой кислота и основание потеряют свои соответствующие свойства.

- HCL (водн.) + NaOH (водн.) → NaCl (водн.) + H 2 O (л)
- сильная соленая вода
- кислотное основание
соли сильных оснований и слабых кислотыСильное основание NaOH (гидроксид натрия) добавляют к слабой кислоте CH 3 COOH (уксусная кислота) в 1 л раствора, образуя NaCH 3 COO (ацетат натрия) и воду.
- CH 3 COOH (водн.) + NaOH (водн.) → NaCH 3 COO (водн.) + H 2 O (l)
- слабая соленая вода
- кислотное основание
Соли слабых оснований и сильных кислотСлабые основания реагируют с сильными кислотами с образованием кислых солевых растворов. Конъюгированная кислота слабого основания определяет его pH. Например, NH 3 (аммиак) добавляют к HCl (соляной кислоте) с образованием NH 4 Cl (хлорид аммония).
- NH 3 (водн.
 ) + HCl (водн.) → NH 4 Cl (водн.)
) + HCl (водн.) → NH 4 Cl (водн.)
- слабая сильная соль
- основная кислота
Как только соль образуется, она вступает в реакцию с водой , в результате чего получается слабокислый раствор.
Соли слабых оснований и слабых кислотСолевые растворы, содержащие кислотные катионы и основные анионы, такие как NH 4 F (фторид аммония), имеют две возможные реакции:
- NH 4 + (водн.) + H 2 O (л) ↔ H 3 O + (водн.) + NH 3 (водн.) K a (NH 4 + ) = 5.6 x 10-10
- F — (водн.) + H 2 O (л) ↔ HF (водн.) + OH — (водн.) K b (F — ) = 1,4 x 10-11
Поскольку K a (NH 4 + )> K b (F — ), реакция аммиака с водой более благоприятна.
 Поэтому полученный раствор слабокислый.
Поэтому полученный раствор слабокислый.Щелочи
Щелочные соли
Большинство основных солей являются щелочными солями, распространенными примерами которых являются:
- гидроксид натрия (часто называемый каустической содой)
- гидроксид калия (обычно называемый «поташ»)
- щелок (общий термин для любого из двух предыдущих или даже для смеси)
- карбонат кальция (иногда называемый «свободная известь») Гидроксид магния
- является примером атипичной щелочи: это слабое основание (не может быть обнаружено фенолфталеином) и имеет низкую растворимость в воде.
Щелочная почва
Почва со значением pH выше 7,4 обычно считается щелочной. Это свойство почвы может возникнуть естественным образом из-за присутствия солей щелочных металлов. Хотя некоторые растения предпочитают слегка щелочную почву (включая овощи, такие как капуста, и корм, например, буйволин), большинство растений предпочитают умеренно кислую почву (pH от 6,0 до 6,8), и щелочные почвы могут вызывать проблемы.

Озера щелочные
В щелочных озерах (разновидность соленых озер) испарение концентрирует встречающиеся в природе щелочные соли, часто образуя корку слабощелочной соли на большой площади.
Примеры щелочных озер:
Щелочность негидроксидов
И карбонат натрия, и аммиак являются основаниями, хотя ни одно из этих веществ не содержит групп ОН — . Это потому, что оба соединения принимают H + при растворении в воде:
- Na 2 CO 3 + H 2 O → 2 Na + + HCO 3 — + OH —
- NH 3 + H 2 O → NH 4 + + OH —
Основания как гетерогенные катализаторы
Основные вещества могут использоваться как нерастворимые гетерогенные катализаторы химических реакций.Примерами являются оксиды металлов, такие как оксид магния, оксид кальция и оксид бария, а также фторид калия на оксиде алюминия и некоторые цеолиты.
 Многие переходные металлы являются хорошими катализаторами, многие из которых образуют основные вещества. Основные катализаторы использовались для гидрирования, миграции двойных связей, в восстановлении Меервейна-Понндорфа-Верли, реакции Михаэля и многих других реакциях.
Многие переходные металлы являются хорошими катализаторами, многие из которых образуют основные вещества. Основные катализаторы использовались для гидрирования, миграции двойных связей, в восстановлении Меервейна-Понндорфа-Верли, реакции Михаэля и многих других реакциях.Практические основы химии
Базы могут использоваться не только в промышленности, но и дома.Антациды используются для нейтрализации кислотности желудка; садовники используют основы, такие как лайм (CaO), чтобы сделать почву более простой. Мягкие основы используются для очистки всего: от посуды и одежды до транспортных средств и домашних собак.
Нейтрализует кислотность желудка
Антацид — это основа, которая используется для нейтрализации избытка желудочной кислоты. Рекомендуемая доза — это количество основания, необходимое для нейтрализации , , но не всей желудочной кислоты.
Кислотно-основной химический состав некоторых антацидов:
Соединение Химическая формула Химическая реакция Гидроксид алюминия Al (OH) 3 Al (OH) 3 (т.  ) + 3 HCl (водн.) ——> AlCl 3 (водн.) + 3 H 2 O (л)
) + 3 HCl (водн.) ——> AlCl 3 (водн.) + 3 H 2 O (л)Карбонат кальция CaCO 3 CaCO 3 (т) + 2 HCl (водн.) ——> CaCl 2 (водн.) + H 2 O (л) + CO 2 (г) Карбонат магния MgCO 3 MgCO 3 (т) + 2 HCl (водн.) ——> MgCl 2 (водн.) + H 2 O (л) + CO 2 (г) Гидроксид магния Мг (OH) 2 Mg (OH) 2 (т.) + 2 HCl (водн.) ——> MgCl 2 (водн.) + 2 H 2 O (л) Бикарбонат натрия NaHCO 3 NaHCO 3 (водн.) + HCl (водн.) ——> NaCl (водн.) + H 2 O (l) + CO 2 (г) Бытовые чистящие средства
Большинство чистящих средств, таких как средства для мытья посуды, чистящие порошки, средства для стирки и чистящие средства для духовки, являются простыми.
 Много десятилетий назад домашнее щелочное мыло использовалось для чистки одежды и кожи людей. Самое близкое к щелочному мылу, которое мы видим сегодня, — это средство для мытья посуды. Для действительно сложных работ по уборке дома требуются химически агрессивные чистящие средства. Для избавления от грязи, жира или пятен используются чистящие средства с высокой степенью очистки. Очистители слива и духовки находятся на другом конце спектра pH, имея pH 12 или выше. Обычно они содержат сильное основание, такое как NaOH, которое вступает в реакцию с жирами и жиром с образованием растворимого мыла.Все базовые растворы как в лаборатории, так и дома опасны, и с ними всегда следует обращаться с осторожностью. [12]
Много десятилетий назад домашнее щелочное мыло использовалось для чистки одежды и кожи людей. Самое близкое к щелочному мылу, которое мы видим сегодня, — это средство для мытья посуды. Для действительно сложных работ по уборке дома требуются химически агрессивные чистящие средства. Для избавления от грязи, жира или пятен используются чистящие средства с высокой степенью очистки. Очистители слива и духовки находятся на другом конце спектра pH, имея pH 12 или выше. Обычно они содержат сильное основание, такое как NaOH, которое вступает в реакцию с жирами и жиром с образованием растворимого мыла.Все базовые растворы как в лаборатории, так и дома опасны, и с ними всегда следует обращаться с осторожностью. [12] См. Также
- Теории кислотно-основных реакций
- Кислота
Банкноты
- ↑ Уильям Б. Дженсен, «Происхождение терминологической базы», , Журнал химического образования, , 1130 83 (8) (август 2006 г.).
- ↑ Щелочь, Лексико Паблишинг Груп, ООО.
 Проверено 8 апреля 2008 года.
Проверено 8 апреля 2008 года. - ↑ Щелочь, Тискали, 2008.Проверено 8 апреля 2008 года.
- ↑ Кислоты, основания и соли, КрыссТал, 2005. Проверено 8 апреля 2008 г.
- ↑ Вещество, которое может принимать пару электронов для образования новой связи.
- ↑ Вещество, которое может отдавать пару электронов для образования новой связи.
- ↑ Химическое соединение или группа, которые притягиваются к электронам и склонны принимать электроны.
- ↑ Химическое соединение или группа, которую привлекают ядра и которая имеет тенденцию отдавать или делиться электронами.
- ↑ Способен гореть, разъедать, растворять или разъедать химическим действием.
- ↑ Ион гидратированного водорода, h4O + . Также называется ион гидроксония.
- ↑ Ион ОН — , характерный для основных гидроксидов. Также называется гидроксил-ион.
- ↑ Дж. У. Мур, К. Л. Станицки и П. К. Юрс, 2002, Chemistry The Molecular Science , New York: Harcourt College.

Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Браун, Теодор Э., Х. Юджин Лемей и Брюс Э. Бурстен. Химия: Центральная наука (10-е издание). Верхняя река Сэдл, Нью-Джерси: Prentice Hall, 2005. ISBN 0131096869
- Корвин, К. Х. Введение в химические концепции и связи (3-е изд.). Река Аппер Сэдл, Нью-Джерси: Прентис-Холл, 2001. ISBN 0130874701
- Макмерри Дж. И Р. К. Фэй. Химия (4-е изд.). Река Аппер Сэдл, Нью-Джерси: Prentice Hall, 2004. ISBN 0131402080
- Мур, Дж. У., К. Л. Станицкий и П. К. Юрс. Химия Молекулярная наука . Нью-Йорк: Harcourt College, 2002. ISBN 0030320119
- Oxlade, Крис. Кислоты и основания (Химические вещества в действии). Библиотека Heinemann, 2002. ISBN 1588101940
Внешние ссылки
Все ссылки получены 13 мая 2016 г.
- CurTiPot — Диаграммы кислотно-основного равновесия, расчет pH, моделирование и анализ кривых титрования — бесплатное ПО
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia .
 Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:История этой статьи с момента ее импорта в энциклопедию Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
.

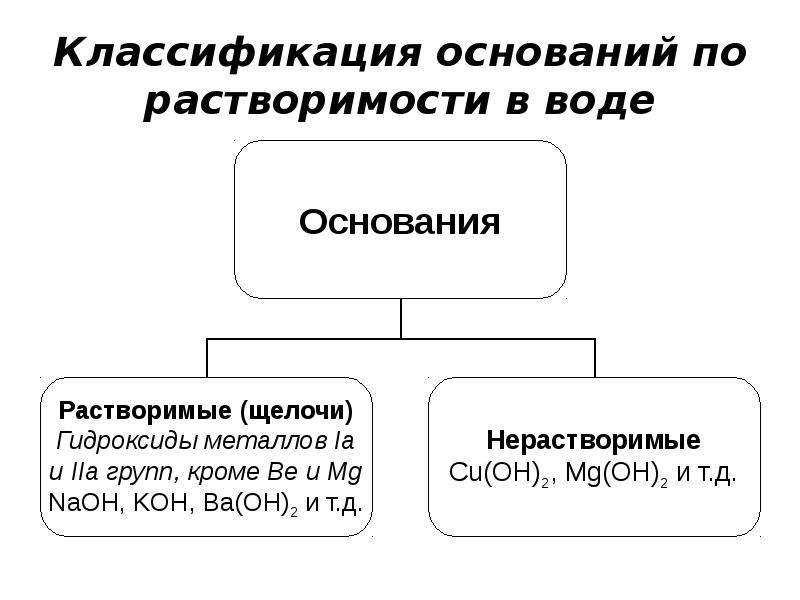 д. (большинство гидроксидов металлов)
д. (большинство гидроксидов металлов) Щелочами являются гидроксиды щелочных металлов ( Li, Na, K, Rb, Cs) и щелочноземельных металлов ( Ca, Sr, Ba ). Все остальные основания являются нерастворимыми.
Щелочами являются гидроксиды щелочных металлов ( Li, Na, K, Rb, Cs) и щелочноземельных металлов ( Ca, Sr, Ba ). Все остальные основания являются нерастворимыми.
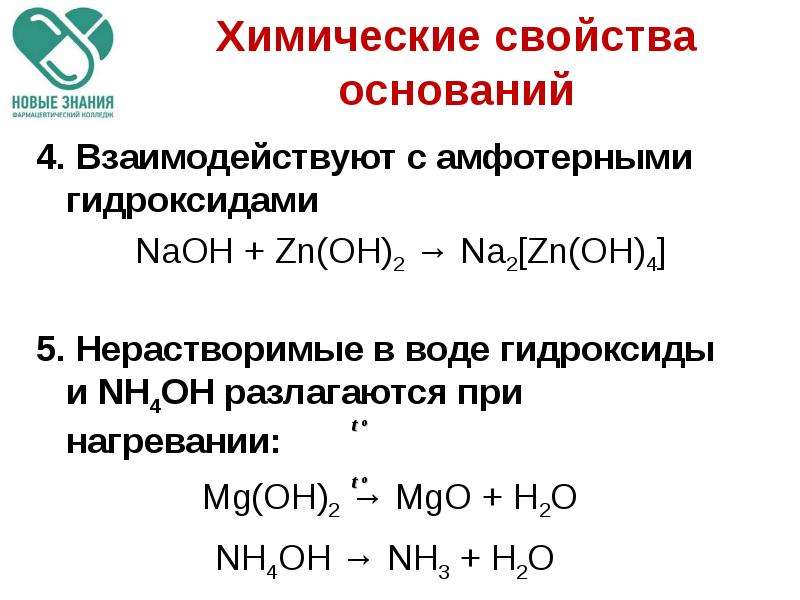 Основания окрашиваются в красный цвет лакмусовой бумаги в синий цвет.
Основания окрашиваются в красный цвет лакмусовой бумаги в синий цвет.
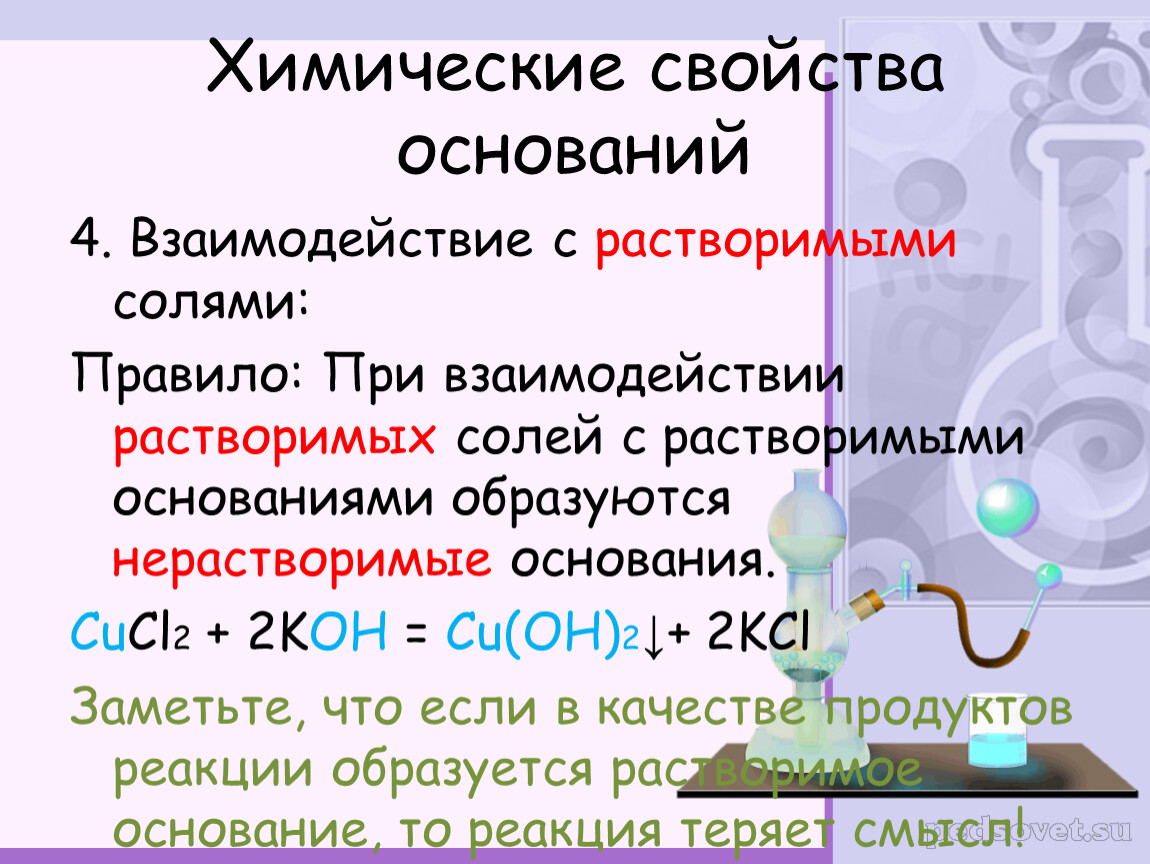 org/10.1016/S0167-2991(08)61044-7
org/10.1016/S0167-2991(08)61044-7 Действительно, современное немецкое слово для обозначения кислорода — Sauerstoff (букв. Кислое вещество). Английские химики, в том числе сэр Хэмфри Дэви, в то же время считали, что все кислоты содержат водород. Шведский химик Сванте Аррениус использовал это убеждение, чтобы разработать определение кислоты.
Действительно, современное немецкое слово для обозначения кислорода — Sauerstoff (букв. Кислое вещество). Английские химики, в том числе сэр Хэмфри Дэви, в то же время считали, что все кислоты содержат водород. Шведский химик Сванте Аррениус использовал это убеждение, чтобы разработать определение кислоты. ) Кислоты Льюиса включают вещества без переносимых протонов (например, H + ионов водорода), такие как хлорид железа (III), и, следовательно, определение кислоты Льюиса имеет более широкое применение, чем определение Бренстеда-Лоури. Определение Льюиса также можно объяснить с помощью теории молекулярных орбиталей. В общем, кислота может получить пару электронов на своей самой низкой незанятой орбитали (НСМО) с самой высокой занятой орбитали (ВЗМО) основания. То есть ВЗМО из основания и НСМО из кислоты объединяются в связывающую молекулярную орбиталь.Это определение разработал Гилберт Н. Льюис.
) Кислоты Льюиса включают вещества без переносимых протонов (например, H + ионов водорода), такие как хлорид железа (III), и, следовательно, определение кислоты Льюиса имеет более широкое применение, чем определение Бренстеда-Лоури. Определение Льюиса также можно объяснить с помощью теории молекулярных орбиталей. В общем, кислота может получить пару электронов на своей самой низкой незанятой орбитали (НСМО) с самой высокой занятой орбитали (ВЗМО) основания. То есть ВЗМО из основания и НСМО из кислоты объединяются в связывающую молекулярную орбиталь.Это определение разработал Гилберт Н. Льюис. {-}] \ over [BH]}}
{-}] \ over [BH]}}
 Очень сильные основания способны даже депротонировать очень слабокислые C-H-группы в отсутствие воды.
Супероснования — это класс особо основных соединений, а гарпунные основания — это особый класс сильных оснований с плохой нуклеофильностью.
Очень сильные основания способны даже депротонировать очень слабокислые C-H-группы в отсутствие воды.
Супероснования — это класс особо основных соединений, а гарпунные основания — это особый класс сильных оснований с плохой нуклеофильностью. Когда основание ионизируется, оно забирает ион водорода из окружающей воды, оставляя после себя ион ОН-. Слабые основания имеют более высокую концентрацию H + , чем сильные основания. Слабые основания существуют в химическом равновесии так же, как и слабые кислоты.Константа ионизации основания K b указывает на прочность основания. Большие K b s относятся к более прочным основаниям. PH основания больше 7 (где 7 — нейтральное число; ниже 7 — кислота), обычно до 14.
Типичным примером слабого основания является аммиак, который используется для очистки.
Когда основание ионизируется, оно забирает ион водорода из окружающей воды, оставляя после себя ион ОН-. Слабые основания имеют более высокую концентрацию H + , чем сильные основания. Слабые основания существуют в химическом равновесии так же, как и слабые кислоты.Константа ионизации основания K b указывает на прочность основания. Большие K b s относятся к более прочным основаниям. PH основания больше 7 (где 7 — нейтральное число; ниже 7 — кислота), обычно до 14.
Типичным примером слабого основания является аммиак, который используется для очистки. Реакция между кислотой и основанием называется нейтрализацией. Основания и кислоты рассматриваются как противоположности, потому что действие кислоты заключается в увеличении концентрации иона гидроксония (H 3 O + ) в воде, тогда как основания уменьшают эту концентрацию. Основания реагируют с кислотами с образованием солей и воды.
Реакция между кислотой и основанием называется нейтрализацией. Основания и кислоты рассматриваются как противоположности, потому что действие кислоты заключается в увеличении концентрации иона гидроксония (H 3 O + ) в воде, тогда как основания уменьшают эту концентрацию. Основания реагируют с кислотами с образованием солей и воды.
 ) + HCl (водн.) → NH 4 Cl (водн.)
) + HCl (водн.) → NH 4 Cl (водн.) Поэтому полученный раствор слабокислый.
Поэтому полученный раствор слабокислый.
 Многие переходные металлы являются хорошими катализаторами, многие из которых образуют основные вещества. Основные катализаторы использовались для гидрирования, миграции двойных связей, в восстановлении Меервейна-Понндорфа-Верли, реакции Михаэля и многих других реакциях.
Многие переходные металлы являются хорошими катализаторами, многие из которых образуют основные вещества. Основные катализаторы использовались для гидрирования, миграции двойных связей, в восстановлении Меервейна-Понндорфа-Верли, реакции Михаэля и многих других реакциях. ) + 3 HCl (водн.) ——> AlCl 3 (водн.) + 3 H 2 O (л)
) + 3 HCl (водн.) ——> AlCl 3 (водн.) + 3 H 2 O (л) Много десятилетий назад домашнее щелочное мыло использовалось для чистки одежды и кожи людей. Самое близкое к щелочному мылу, которое мы видим сегодня, — это средство для мытья посуды. Для действительно сложных работ по уборке дома требуются химически агрессивные чистящие средства. Для избавления от грязи, жира или пятен используются чистящие средства с высокой степенью очистки. Очистители слива и духовки находятся на другом конце спектра pH, имея pH 12 или выше. Обычно они содержат сильное основание, такое как NaOH, которое вступает в реакцию с жирами и жиром с образованием растворимого мыла.Все базовые растворы как в лаборатории, так и дома опасны, и с ними всегда следует обращаться с осторожностью. [12]
Много десятилетий назад домашнее щелочное мыло использовалось для чистки одежды и кожи людей. Самое близкое к щелочному мылу, которое мы видим сегодня, — это средство для мытья посуды. Для действительно сложных работ по уборке дома требуются химически агрессивные чистящие средства. Для избавления от грязи, жира или пятен используются чистящие средства с высокой степенью очистки. Очистители слива и духовки находятся на другом конце спектра pH, имея pH 12 или выше. Обычно они содержат сильное основание, такое как NaOH, которое вступает в реакцию с жирами и жиром с образованием растворимого мыла.Все базовые растворы как в лаборатории, так и дома опасны, и с ними всегда следует обращаться с осторожностью. [12]  Проверено 8 апреля 2008 года.
Проверено 8 апреля 2008 года.
 Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь: