Основные классы неорганических соединений
6
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Неорганические соединения можно классифицировать по составу либо по свойствам. По составу они подразделяются на бинарные (двухэлементные) и многоэлементные.
К бинарным соединениям относятся соединения элементов с кислородом (оксиды), галогенами (галиды), серой (сульфиды), азотом (нитриды), фосфором (фосфиды), углеродом (карбиды), соединения активных металлов с водородом (гидриды) и т.д. Названия бинарных соединений образуются от латинского корня названия более электроотрицательного элемента суффиксом — ид и русского названия более электроположительного элемента в родительном падеже.
Например: Al
Например, FeCl3 — хлорид железа (III), FeCl2— хлорид железа (II) и т.д.
Вместо степени окисления более электроположительного элемента в названии бинарного соединения можно указать греческими числительными число атомов более электроотрицательного элемента, входящих в состав соединения.
Например: СО — монооксид углерода, СО2 — диоксид углерода, SO3 — триоксид серы, ССI4 — тетрахлорид углерода, РСI5
— пентахлорид фосфора, SF6 — гексафторид серы.Среди многоэлементных соединений большую группу составляют гидроксиды, т.е. вещества, содержащие в своем составе гидроксильную группу ОН— . Гидроксиды можно рассматривать как продукты прямого либо косвенного взаимодействия оксидов с водой.
К гидроксидам относятся основания (основные гидроксиды) — NaOH, KOH и др.; кислоты (кислотные гидроксиды) — H2SO4, HNO3 и др., а также вещества, способные проявлять свойства и кислот, и оснований (амфотерные гидроксиды) — Zn(OH)2, Al(OH)3 и др.
К многоэлементным соединениям относятся и соли.
По свойствам неорганические соединения можно разделить на оксиды.
Оксидами называются бинарные соединения, в состав которых входит кислород в степени окисления — 2.
1.1 КЛАССИФИКАЦИЯ ОКСИДОВ
Оксиды подразделяются на несолеобразующие (безразличные) и солеобразующие. Последние, в свою очередь, делятся на основные, кислотные и амфотерные.
Несолеобразующие оксиды образованы некоторыми неметаллами в промежуточной степени окисления, например: NO, CO. Они не взаимодействуют ни с кислотами, ни со щелочами.
Основными называются оксиды, которые образуют соли при взаимодействии с кислотами либо кислотными оксидами. Основные оксиды — это оксиды металлов с низкой степенью окисления +1 либо +2. Примеры: Na2O, Ag2O, CaO, FeO, BaO (кроме ВеО, ZnO, SnO и PbO).
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями и основными оксидами. Кислотные оксиды — это оксиды неметаллов и оксиды металлов с высокой степенью окисления(> +4). Например: P2O5, SO3, SO2,CO2, CrO3, MnO3, V2O5, Cl2O.
Амфотерными называют оксиды, которые образуют соли при взаимодействии как с кислотами, так и с основаниями. К ним относятся оксиды некоторых металлов в степенях окисления +2, +3, +4. Например: ZnO, BeO, SnO, PbO, Al2O3, TiO2, VO2, SnO2.
1.2 НОМЕНКЛАТУРА ОКСИДОВ
В русской терминалогии слово оксид стоит на первом месте, а название элемента употребляется в родительном падеже. Если элемент, образующий оксид, может находиться в различных степенях окисления, то в скобках римскими цифрами указывается его степень окисления.
Например: СО2 — оксид углерода (1V), SO3 — оксид серы (1V), P2O5 — оксид фосфора (V), Na2O — оксид натрия.
1.3 ПОЛУЧЕНИЕ ОКСИДОВ
Почти все элементы образуют соединения с кислородом (кроме гелия, неона и аргона). В одних случаях оксиды образуются при непосредственном соединении простых веществ с кислородом:
4Р + 5О2 = 2Р2О5
S + О2 = SО2
2Mg + О2 = 2MgО
в других — их получают косвенным путем: при разложении солей, оснований, кислот:
СаСО3 = СаО + СО2
Сu(OH)2 = CuO + H2O
2H3BO3 = B2
O3 + 3 H2Oлибо при горении сложных веществ
СН4 + 2О2 = СО2 + 2H2O
1.4 ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
Основным оксидом в качестве гидратов соответствуют основания, которые образуются либо при непосредственном взаимодействии основных оксидов с водой, либо косвенным путем. При непосредственном взаимодествии оксидов с водой образуются растворимые основания (щелочи).
Na2O + H2O = 2 NaOH
СаО + H2O = Ca(OH)2
Большинство оснований являются нерастворимыми и получаются косвенным путем. Основные оксиды взаимодействуют с кислотами и кислотными оксидами:
СаО + H2 SO4 = CaSO4 + H2O
Ag2O + 2НNO3
Na2O + SO3 = Na2 SO4
СаО + CO2 = CaCO3
Кислотные оксиды взаимодействуют с основаниями и основными оксидами:
///
Таблица 1
Важнейшие кислоты и кислотные остатки
Кислота | Кислотный остаток | ||
Формула | Название | Формула | Название |
HMnO4 | Марганцовая | MnO4— | Перманганат |
HNO3 | Азотная | NO3— | Нитрат |
HNO2 | Азотистая | NO2— | Нитрит |
H3 РO4 | Фосфорная | РO43- | Фосфат |
H3 РO3 | Фосфористая | Фосфит | |
H2SO4 | Серная | SO42- | Сульфат |
H2SO3 | Сернистая | SO32- | Сульфит |
H2S | Сероводородная | S2- | Сульфид |
HSCN | Родановодородная | SCN— | Роданид |
HVO3 | Ванадиевая | VO3— | Ванадат |
H2CO3 | Угольная | CO32- | Карбонат |
H2SiO3 | Кремниевая | CO32- | Силикат |
CH 3COOH | Уксусная | Ацетат | |
HCl | Хлороводородная (соляная) | Cl— | Хлорид |
HF | Фтороводородная (плавиковая) | F— | Фторид |
HBr | Бромоводородная | Br— | Бромид |
HI | Иодоводородная | I— | Иодид |
Названия кислых солей образуют так же, как и средних, но при этом к аниону добавляют приставку «гидро», указывающую на наличие незамещенных атомов водорода, число которых обозначают греческими числительными (ди, три и т.д.) Например, Ва(НСО3)2 — гидрокарбонат бария, NaH2PO4 — дигидрофосфат натрия, LiHS — гидросульфит лития.
Названия основных солей тоже образуют подобно названиям средних солей, но при этом к катиону добавляют приставку «гидроксо», указывающую на наличие незамещенных гидроксогрупп.
Например, FeOHCl — хлорид гидроксожелеза (II), (NiOH)2SO4 — cульфат гидроксоникеля (II), AL(OH)2NO3 — нитрат дигидроксоалюминия.
3.3 Получение солей
Соли могут быть получены разными способами. Отметим некоторые из них.
3.3.1 Взаимодействие металлов с неметаллами
2Al + 3S = Al2S3
3.3.2 Взаимодействие основных оксидов или их растворимых гидроксидов с кислотными оксидами или кислотами.
CaO + CO2 = CaCO3
2KOH + CO2 = KCO3 + H2O
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
Na2O + 2HCl = 2NaCl + H2O
3.3.3 Взаимодействие кислот с солями
Н2SO4 + Ba(NO3)2 = BaSO4 + 2HNO3
3.3.4 Взаимодействие растворимых гидроксидов с солями
2NaOH + Cu(NO3)2 = Cu(OH)2 + 2 NaNO3
3.3.5 Взаимодействие металлов с кислотами или солями
Zn + H2SO4 = Zn SO4 + H2
Zn + CuSO4 = Zn SO4 + Cu
3.3.6 Взаимодействие двух солей между собой
AgNO3 + NaCl = AgCl + NaNo3
4 Вопросы и упражнения для самопроверки
4.1 Охарактеризуйте основные классы неорганических соединений.
4.2 Охарактеризуйте химические свойства основных, кислотных и амфотерных оксидов.
4.3 Какие из перечисленных ниже оксидов способны взаимодействовать с кислотами : СаО, MgO, Fe2O3, Al2O3, Cr2O3, ZnO, N2O, P2O5 , CO2, SiO2 ?
Составьте соответствующие уравнения реакций их взаимодействимя с серной кислотой.
4.4 Какие из перечисленных ниже оксидов взаимодействуют со щелочами: NiO, BaO, ZnO, BeO, SO3, CrO3, P2O5, SiO2 ?
Составьте соответствующие уравнения реакций их взаимодействия с гидроксидом натрия.
4.5 Составьте уравнения реакций взаимодействия с водой следующих оксидов: P2O5, Na2O,
studfile.net
1. Основные классы неорганических соединений
Сложные неорганические вещества в свою очередь подразделяются на следующие основные классы: оксиды, основания, кислоты и соли.

Рис.2 Схема классификации неорганических веществ.
Основания и кислородсодержащие кислоты можно рассматривать как один класс — гидроксиды.
Ряд сложных неорганических соединений рассматривается как не основные классы неорганических соединений (см. раздел 2).
Оксиды
Оксидами называются сложные вещества, состоящие из двух элементов, один из которых кислород со степенью окисления -2.
Примером оксидов могут служить соединения:
Na2O, ZnO, P2O5, Mn2O7.
Большинство элементов периодической системы образуют соединения с кислородом, являющиеся оксидами.
1.1.1. Классификация оксидов
Оксиды подразделяются на солеобразующие и несолеобразующие (безразличные).
Солеобразующими называют такие оксиды, которые в результате химических реакций способны образовывать соли.
Несолеобразующие оксиды такой способностью не обладают. Примером несолеобразующих оксидов могут служить следующие вещества: СО, SiO, N2O, NO.
Солеобразующие оксиды, в свою очередь, подразделяются на основные, кислотные и амфотерные.

Рис.3 Схема классификации оксидов
Основными оксидами называются такие оксиды, которым в качестве гидратов (продуктов присоединения воды) соответствуют основания.
Например:
Na2O +H2O = 2NaOH
Формула основного оксида | Соответствующая гидратная форма (основание) |
Na2O | NaOH |
BaO | Ba(OH)2 |
CaO | Ca(OH)2 |
FeO | Fe(OH)2 |
Основные оксиды образуются металлами при проявлении ими невысокой валентности (обычно I или II).
Оксиды таких металлов, как Li, Na, К, Rb, Сs, Fr, Са, Sr, Ва непосредственно взаимодействуют с водой с образованием растворимых в воде оснований — щелочей.
Другие основные оксиды непосредственно с водой не взаимодействуют, а соответствующие им основания получают из солей (косвенным путем).
Кислотными оксидами называются такие оксиды, которым в качестве гидратов соответствуют кислоты. Кислотные оксиды называют также ангидридами кислот.
Например:
SO3 + H2O = H2SO4
Формула кислотного оксида
Соответствующая гидратная форма (кислота)
SO2
H2SO3
SO3
H2SO4
P2O5
H3PO4
CrO3
H2CrO4
Mn2O7
HMnO4
V2O5
HVO3
Кислотные оксиды образуются при окислении неметаллов и металлов, если последние имеют в полученном оксиде высокое значение валентности. Например, оксид марганца (VII) — кислотный оксид, так как это оксид металла с высокой валентностью (VII). В качестве гидрата этому оксиду будет соответствовать кислота — НMnО4.
Большинство кислотных оксидов могут непосредственно взаимодействовать с водой и при этом образовывать кислоты.
Например:
СО2 + Н2О = Н2СО3
P2O5 +3Н2О = 2Н3РO4
SO3 + Н2О = Н2SО4
Некоторые оксиды непосредственно с водой не взаимодействуют. Такого типа оксиды сами могут быть получены из кислот.
Например:
SiO2 + H2O реакция не идет
H2SiO3  SiO2 + H2O
SiO2 + H2O
Это подтверждает названия кислотных оксидов — ангидриды, то есть «не содержащие воду». Одно из названий SiO2– ангидрид кремниевой кислоты.
Амфотерные оксиды представляют собой оксиды, которые в зависимости от условий проявляют свойства как основных (в кислой среде), так и кислотных (в щелочной среде) оксидов.
К амфотерным оксидам относятся оксиды некоторых металлов. Например:
BeO, Al2O3, PbO, SnO, ZnO, PbO2, SnO2, Cr2O3.
При реакциях с кислотами амфотерные оксиды проявляют свойства основных оксидов:
РbО + 2НNО3 = Рb(NО3)2 + Н2О
При реакциях со щелочами амфотерные оксиды проявляют свойства кислотных оксидов:
РbО +2NaOН  Na2PbO2 + Н2О
Na2PbO2 + Н2О
Амфотерные оксиды с водой непосредственно не взаимодействуют, следовательно, их гидратные формы получают косвенно — из солей.
Несолеобразующие (индифферентные, или безразличные) оксиды — небольшая группа оксидов, которые не вступают в химические реакции с образованием солей.
К несолеобразующим оксидам относятся, например, СО, N2O, NO, SiO.
studfile.net
Классы неорганических соединений
Лабораторная работа №1
Неорганические вещества делятся на простые и сложные.
1. Классификация простых веществ.
Простые вещества состоят из атомов одного элемента. Все простые вещества условно делятся на металлы и неметаллы. К неметаллам относятся 22 элемента: H, B, C, Si, N, P, As, O, S, Se, Te, галогены (F, Br, Cl, J, At) и инертные газы (He, Ne, Ar, Kr, Xe, Rn), к металлам — все остальные, то есть большинство простых веществ — металлы. Металлы отличаются характерным блеском, ковкостью, тягучестью, могут прокатываться в листы и вытягиваться в проволоку, обладают хорошей тепло- и электропроводимостью. При комнатной температуре все металлы, кроме ртути, находятся в твёрдом состоянии.
Неметаллы не обладают характерным для металлов блеском, хрупкостью, очень плохо проводят тепло и электричество. Некоторые из них при нормальных условиях находятся в газообразном состоянии.
2. Классификация сложных веществ.
Из неорганических веществ, в практике чаще всего приходится иметь дело с оксидами, гидроксидами и солями.
Оксиды
Оксидами называются сложные химические соединения, состоящие из какого-либо элемента и кислорода: ЭmOn. Степень окисления кислорода в оксидах равна -2, поэтому для написания формулы оксида, то есть для определения индексов m и n, в формуле оксида надо степень окисления элементов и кислорода поставить «крест-накрест». Например, для железа со степенью окисления +3 формула оксида такова: Fe2+3 O3-2 , т.е. Fe2O3;
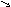
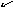 для
меди со степенью окисления +1:Cu2+1O-2;
для
меди со степенью окисления +1:Cu2+1O-2;
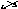 для
свинца со степенью окисления +4:Pb+4O2-2.
для
свинца со степенью окисления +4:Pb+4O2-2.
Название оксида составляют из слова «оксид» и названия элемента. Если элемент проявляет переменную степень окисления, то после названия оксида указывают в скобках римской цифрой степень окисления элемента.
Например: FeO-оксид железа (II), NO-оксид азота (II).
Оксиды делятся на солеобразующие и несолеобразующие (безразличные). Солеобразующие оксиды по химическим свойствам делятся на: а) кислотные, б) основные, в) амфотерные.
К кислотным оксидам относятся оксиды неметаллов, например: SiO2, SO3, P2O5 и оксиды металлов с высшей степенью окисления, например: Cr+6O3; Mn2+7O7 и др.
К основным оксидам относятся оксиды металлов со степенью окисления +1, +2, +3. Например: Na2+1O, Mg+2O, Sc2+3O3 и др.
К амфотерным оксидам относятся оксиды некоторых металлов, например: BeO, ZnO, SnO, PbO, Al2O3, Cr2O3 и др. Металлы, проявляющие переменную степень окисления, образуют несколько оксидов, характер которых изменяется закономерно; с повышением степени окисления металла основные свойства оксида убывают, а кислотные — усиливаются. Например: хром в соединениях проявляет степень окисления +2, +3, +6, образуя соответствующие оксиды: CrO — основной оксид, Cr2O3 — амфотерный оксид, CrO3 — кислотный оксид.
Несолеобразующие (безразличные) оксиды NO, N2O, CO.
Химические свойства оксидов
1. Растворимые оксиды взаимодействуют с водой с образованием щёлочи или кислоты:
BaO+H2O = Ba(OH)2 ;
SO3+H2O = H2SO4 .
2. Кислотные и основные оксиды реагируют между собой, образуя соли:
CO2+K2O = K2CO3;
SiO2+CaO = CaSiO3.
3. Кислотный оксид реагирует с основанием, а основной оксид вступает в реакцию с кислотой, образуя соль и воду:
CO2+Ba(OH)2 = BaCO3+H2O;
CuO+2HCl = CuCl2+H2O.
4. Амфотерные оксиды реагируют и с кислотами и со щелочами, образуя соль и воду.
ZnO+H2SO4 = ZnSO4+H2O;
tº
ZnO+2NaOH = Na2ZnO2+H2O.
Таким образом, кислотные и основные оксиды реагируют с веществами противоположного характера. Например, кислотные оксиды реагируют с основными оксидами и основаниями, но не реагируют с веществами кислотного характера. Амфотерные оксиды обладают двойственной природой.
Несолеобразующие оксиды (CO, NO, N2O) не вступают в реакцию с водой, другими оксидами, гидроксидами, не образуют солей.
studfile.net
Урок химии «Основные классы неорганических веществ»
Цель урока. Обобщить сведения о классификации веществ, составе основных классов сложных неорганических веществ, закрепить умения учащихся классифицировать неорганические вещества, осуществлять индуктивное и дедуктивное обобщения во процессе классификации веществ, довести эти умения до оптимального уровня.
Образовательные задачи:
- применение обобщения знаний, умений и навыков в новых условиях – создание проблемной ситуации;
- контроль и самоконтроль знаний, умений и навыков с помощью домашней работы;
- уметь устанавливать существенные признаки, являющиеся основой различных классификаций;
- уметь устанавливать причинно-следственные связи между «составом», «химическими свойствами», «класс вещества».
Развивающие задачи:
- развитие умений сравнивать, обобщать, правильно формулировать задачи и излагать мысли;
- развитие логического мышления, внимания и умения работать в проблемной ситуации.
Воспитательные задачи:
- формирование у учащихся познавательного интереса к химии;
- воспитание таких качеств характера, как настойчивость в достижении цели;
- воспитание интереса и любви к предмету через содержание учебного материала, умение работать в коллективе, взаимопомощи, культуры общения.
Оборудование: презентация, цифровые образовательные ресурсы: интерактив «Классификация кислот», интерактив «Классификация оснований», минилаборатория, оксиды фосфора, кальция, цинка, гидроксид натрия, меди, цинка, железа, азотная, серная, фосфорная, кремниевая кислоты, соли
Тип урока: урок обобщения и систематизации знаний
План урока
1. Организационный момент.
2. Промежуточный контроль знаний.
3. Систематизация и обобщение знаний.
4. Закрепление.
5. Домашнее задание.
6. Рефлексия
ХОД УРОКА
I. Организационный момент
Проверяется готовность к уроку, раздаются план
урока (Приложение 1),
инструкции для выполнения лабораторной работы,
лист наблюдений (Приложение
2), минилаборатория, объявляются этапы
урока.
Организовывается работа учащихся на начальном
этапе урока, вспоминаются советы учителя о том,
как лучше организовать работу на уроке, чтобы
сохранить свое здоровье и здоровье своих
одноклассников.
1. Как удобней и полезней для здоровья сидеть на
уроке?
2. Почему на уроке учитель просит тишины?
Вступительное слово учителя. (Презентация. Слайды 1-3).
Постановка цели с опорой на знания учащихся. Мы с
вами в течение учебного года узнали, какие бывают
классы неорганических соединений.
Скажите, пожалуйста, какие классы веществ мы
изучили на прошлых уроках? (Мы изучили
классификацию неорганических веществ. И знаем,
что бывают оксиды, кислоты, основания, соли).
И прежде чем перейти к самому уроку. Давайте
вместе подумаем, что мы будем сегодня делать на
уроке.
Как вы думаете, какова цель нашего урока?
(Цель урока – обобщить и систематизировать
сведения о классификации неорганических
веществ)
Для этого нам нужно вспомнить материал, который
мы уже прошли в темах «Оксиды», «Кислоты»,
«Основания», «Соли». Сейчас мы выполним тест по
этим темам.
II. Промежуточный контроль знаний по темам «Оксиды», «Кислоты», «Основания», «Соли» по технологии «Взаимопередачи заданий»
Учащиеся выполняют тест, в группах по 2 или 4
человека – 5 минут (Приложение 2).
После того, как учащиеся выполнят тест,
необходимо поставить оценку себе и проверить
работу соседа и поставить оценку соседу по парте.
Учитель просит класс поднять руки, кто написал
тест на 5 или 4 балла. На закрытой доске или на
экране медиапроектора открывают заранее
подготовленные ответы теста для самопроверки.
Для медиапроектора, правильные варианты (Слайд 4)
Тест по теме «Классификация неорганических веществ»
Время выполнения – 5 минут.
Расставьте коэффициенты в схемах реакций, укажите тип химической реакции по признаку «число и состав исходных веществ и продуктов реакции», определите простое или сложное вещество, если вещество сложное определите класс вещества
III. Изучение нового учебного материала
Учебная цель: закрепить знания, умения, навыки по классификации неорганических веществ.
Вывод цели данного этапа урока с помощью учеников
В результате этого урока мы с вами должны
непосредственно рассмотреть разделение оксидов,
кислот, оснований, солей на группы, признаки,
положенные в основу классификаций. В ходе урока
мы должны обобщить, систематизировать признаки
классификаций, закрепить эти умения и навыки.
Рассмотреть схему «Классификация веществ».
Моя цель на уроке рассказать вам об этом, помочь
вам запомнить эти классификации, и мы продолжим
учиться определять не только классы веществ, но и
разделение на группы внутри класса.
Сегодня эти части урока будут проходить в форме
игры. У вас будет 4 учителя. Они будут обобщать, и
систематизировать каждый по определенному
классу веществ. Они имеют право вас спрашивать, в
конце урока поставить вам оценки. После
объяснения ваших новых учителей. Мы проверим, как
вы вспомнили классификацию веществ и выясним,
кто у нас самый «классный» химик, и определим, кто
у нас самый «классный» учитель.
Основные положения учебного материала, который
вы сегодня должны освоить.
1. Классификация оксидов. Объяснение материала заранее подготовленным учеником.
Актуализация знаний: Фронтальный опрос. Что такое оксиды? (Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород со степенью окисления – 2)
Слайды 5-7
Оксиды делят на несолеобразующие – они не реагируют ни с кислотами, ни с щелочами, не образуют солей. Это всего четыре оксида: CO, SiO, N2O, NO
Остальные оксиды являются солеобразующими.
Среди них выделяют две группы. Кислотные
оксиды, этим оксидам соответствуют кислоты,
и, как правило – это оксиды неметаллов, или
металлов побочных подгрупп в высшей степени
окисления. Вторая группа основные оксиды –
это оксиды металлов в степени окисления +1, +2, +3
Заполнение таблицы с опорой на знания учеников
| Оксиды | Второй элемент металл или неметалл | Группа оксида | С чем реагирует: с кислотой, основанием или ни с чем |
SO3 |
неметалл |
кислотный |
с основанием |
SO2 |
|||
SiO2 |
|||
P2O5 |
|||
CrO3 |
|||
CO |
неметалл |
несолеобразующий |
– |
N2O |
|||
Na2O |
металл |
основный |
с кислотой |
FeO |
|||
Fe2O3 |
|||
CaO |
Закрепление:
1. Почему несолеобразующие оксиды так называются?
2. Классификация кислот
Актуализация знаний: Фронтальный опрос. Какие кислоты вы знаете?
Слайд 8
Учитель демонстрирует образцы кислот, ученик у
доски с помощью таблиц на слайдах объясняет, что
такое кислоты и на какие группы они делятся,
класс работает вместе с доской или
самостоятельно. В учебнике страница 210, таблица 10.
Кислоты – это сложные вещества, состоящие из
положительно заряженных ионов водорода и
отрицательно заряженных кислотных остатков
| Признак классификации | Типы кислот | Формулы кислот |
| Наличие кислорода | Кислородсодержащие | H2SO4 HNO3 H2CO3 |
| Бескислородные | HCl H2S | |
| Основность | Одноосновные | HCl HNO3 |
| Двухосновные | H2SO4 H2CO3 H2S | |
| Трехосновные | H3PO4 | |
| Растворимость | Нерастворимые | H2SiO3 |
| Растворимые | все остальные |
Закрепление:
1. Что такое трехосновная кислота?
3. Классификация оснований
Актуализация знаний: Фронтальный опрос. Что такое щелочи?
Слайд 10
Учитель демонстрирует образцы оснований,
ученик у доски с помощью таблиц на слайдах
объясняет, что такое основания и на какие группы
они делятся, класс работает вместе с доской или
самостоятельно. В учебнике страница 215, таблица 11.
Основания – это сложные вещества, состоящие из
положительно заряженных ионов металла и
отрицательно заряженных гидроксид-ионов
| Признак классификации | Типы оснований | Формулы оснований |
| Кислотность | Однокислотные | NaOH KOH |
| Двухкислотные | Ca(OH)2 Fe(OH)2 | |
| Трехкислотные | Al(OH)3 Fe(OH)3 | |
| Растворимость | Растворимые щелочи | NaOH KOH Ca(OH)2 |
| Нерастворимые | Al(OH)3 Fe(OH)2 Fe(OH)3 |
Закрепление:
1. Что такое щелочи?
4. Классификация солей
Актуализация знаний: Фронтальный опрос. Приведите примеры солей?
Слайды 11, 12
Учитель демонстрирует образцы солей, ученик у
доски с помощью таблиц на слайдах объясняет, что
такое соли и на какие группы они делятся, класс
работает вместе с доской или самостоятельно.
Соли – это сложные вещества, состоящие из
положительно заряженных ионов металла и
отрицательно заряженных кислотных остатков
| Признак классификации | Типы солей |
Формулы солей, названия |
| Состав, наличие ионов водорода или гидроксид-ионов | Средние | Na2SO4 сульфат натрия |
| Кислые | NaHSO4 гидросульфат натрия | |
| Основные | MgOHNO3 гидроксонитрат магния. | |
| Растворимость | Растворимые | заполнить самостоятельно по |
| Нерастворимые | таблице растворимости |
Закрепление, фронтальный опрос:
1. Что такое кислые соли?
2. Как меняется название кислых солей по
сравнению со средними?
IV. Закрепление учебного материала
Выполнение Лабораторной работы « Классификация неорганических веществ» (Приложение 2), работа в группах
Организация работы класса.
Класс делится на малые группы по 4 человека,
например, по скорости работы или по желанию
учащихся.
Определение самого «классного» химика, самого
«классного» учителя.
Фронтальный опрос: если будет время.
Какой класс веществ для вас показался самым
сложным и почему?
Во всех группах учащимся раздаются инструкции
лабораторной работы.
Использование ЦОР ( дополнительный материал,
если будет время)
Слайд 13
Интерактив. Классификация Кислот Упражнение 1
Интерактив. Классификация Оснований Упражнение 2
[1]
V. Домашнее задание
Представлено в рабочих листах.
Цель: закрепить навыки классификации веществ до оптимального уровня, уметь применять полученные знания в новой ситуации( проблемный вопрос)
Формулируется проблемный вопрос, для домашнего задания, выставляются оценки за урок
Проблемный вопрос. Почему и кислоты и
основания объединяются в группу гидроксиды? Что
у них общего и чем они отличаются?
Параграфы 38-41[3], написать по 2 типичных уравнения
реакций для каждого класса веществ Закончить
таблицу оксиды
Вы можете также сделать свое домашнее задание, по
выбору. Придумать свои упражнения или взять их из
других источников.
VI. Рефлексия
Фронтальное обсуждение результатов урока с
классом.
Понравился ли вам урок? Оцените, как изменились
за урок ваши знания.
Свои впечатления выразить рисунком.
Веселая рожица – понравился урок, знаний
прибавилось.
серьезная рожица – трудно сказать, но что-то
новое узнал и запомнил
и недовольная рожица – не понравился урок,
ничего не узнал
Список литературы
1. Химия 8, 9 класс. Мультимедийное приложение к
учебнику О.С.Габриеляна. Электронное учебное
издание. ООО «Дрофа» 2011.
2. Планирование
к учебнику «Химия», 8, 9 класс, Габриелян О.С.
Единая коллекция цифровых образовательных
ресурсов
3. Габриелян О.С. Химия 8 класс. Учебник , М.:
Дрофа, 2011.
urok.1sept.ru