Вопрос 1
Вопрос 1: Основные понятия и стехиометрические законы химии. Атомно-молекурное учение. Роль М.В.Ломоносова в создании основ атомно-молекулярного учения. Понятие о химическом элементе.
Химия — наука о веществах, закономерностях их превращений (физических и химических свойствах) и применении.
Молекула — наименьшая частица вещества, обладающая его химическими свойствами.
Атом — наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы.
Химический элемент — это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек.
Заряд ядра — положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A = Z + N.
Изотопы — химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
Электро́н — стабильная, отрицательно заряженная элементарная частица, одна из основных структурных единиц вещества
Стехиометрия — раздел химии, в котором рассматриваются массовые или объемные соотношения между реагирующими веществами
Закон сохранения массы : масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Закон постоянства состава: всякое чистое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав.
Закон эквивалентов: массы реагирующих друг с другом веществ, а также массы продуктов этой реакции пропорциональны молярным массам эквивалентов этих веществ.
Атомно — молекулярное учение.
1. Все вещества состоят из молекул.
2. Молекулы состоят из атомов.
3. Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания.
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый М. В. Ломоносов. Основные положения этого учения изложены в работе «Элементы математической химии» (1741) и ряде других. Сущность учения Ломоносова можно свести к следующим положениям: 1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы) . 2. Молекулы состоят из «элементов» (так Ломоносов называл атомы) . 3. Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц. 4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов.
studfile.net
Атомно-молекулярное учение — это… Что такое Атомно-молекулярное учение?
Атомно-молекулярное учение — совокупность теоретических представлений естествознания о дискретном строении веществ.
В развитие атомно-молекулярного учения большой вклад внесли М. В. Ломоносов, Дж. Дальтон, А. Лавуазье, Ж. Пруст, А. Авогадро, Й. Берцелиус, Д. И. Менделеев, А. М. Бутлеров.
История
Античная атомистика
Представление о том, что материя состоит из отдельных частиц — атомов возникло еще в древней Греции. Атомизм был создан представителями древнегреческой философии Левкиппом и его учеником Демокритом.
Становление атомистической гипотезы в XVI—XVIII веках
Атомистическая теория Дальтона
Перечень символов химических элементов и их атомных весов Дж. Дальтона (1808)Создание научной теории стало возможно только в XVIII-XIX веках, когда физика и химия стали базироваться на точных экспериментальных данных.
Экспериментальное подтверждение атомной гипотезы нашёл английский химик Джон Дальтон. В начале XIX века Дальтон открыл несколько новых эмпирических закономерностей: закон парциальных давлений (закон Дальтона), закон растворимости газов в жидкостях (закон Генри-Дальтона) и, наконец, закон кратных отношений (1803). Объяснить эти закономерности (прежде всего закон кратных отношений), не прибегая к предположению о дискретности материи, невозможно. В 1808 году Дальтон изложил свою атомистическую гипотезу в труде «Новая система химической философии».
Основные положения теории Дальтона состояли в следующем[1]:
1. Все вещества состоят из большого числа атомов (простых или сложных).
2. Атомы одного вещества полностью тождественны. Простые атомы абсолютно неизменны и неделимы.
3. Атомы различных элементов способны соединяться между собой в определённых соотношениях.
4. Важнейшим свойством атомов является атомный вес.
Уже в 1803 г. в лабораторном журнале Дальтона появилась первая таблица относительных атомных весов некоторых элементов и соединений (атомный вес водорода был принят равным единице). Дальтон ввёл символы химических элементов в виде окружностей с различными фигурами внутри. Впоследствии Дальтон неоднократно корректировал атомные веса элементов, однако для большинства элементов им приводились неверные значения.
Эпоха классической химии
Основные положения
Атомно-молекулярное теория базируется на следующих законах и утверждениях:
- Все вещества состоят из атомов
- Атомы одного химического вещества (химический элемент) обладают одинаковыми свойствами, но отличаются от атомов другого вещества
- При взаимодействии атомов образуются молекулы (гомоядерные — простые вещества, гетероядерные — сложные вещества)
- При физических явлениях молекулы не изменяются, при химических происходит изменение их состава
- Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества
- Закон сохранения массы — масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции
- Закон постоянства состава (закон кратных отношений) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами
- Аллотропия — существование одного и того же химического элемента в виде нескольких простых веществ, различных по строению и свойствам.
Вытекающие законы и положения
Примечания
См. также
dic.academic.ru
1.Атомно-молекулярная теория Ломоносова.
Лишь в середине ХVIII века великий русский учёный М.В. Ломоносов обосновал атомно-молекулярные представления в химии. Основные положения его учения изложены в работе «Элементы математической химии» (1741 г.) и ряде других. Ломоносов назвал теорию корпускулярно-кинетической теорией.
М.В. Ломоносов четко разграничивал две ступени в строении вещества: элементы (в современном понимании – атомы) и корпускулы (молекулы). В основе его корпускулярно-кинетической теории (современного атомно-молекулярного учения) лежит принцип прерывности строения (дискретности) вещества: любое вещество состоит из отдельных частиц.
Молекула является наименьшей частицей вещества, обладающей всеми его химическими свойствами. Вещества, имеющие молекулярную структуру,состоят из молекул (большинство неметаллов, органические вещества).Значительная часть неорганических веществ состоит из атомов (атомная решётка кристалла) или ионов (ионная структура). К таким веществам относятся оксиды, сульфиды, различные соли, алмаз, металлы, графит и др. Носителем химических свойств в этих веществах является комбинация элементарных частиц (ионы или атомы), то есть кристалл представляет собой гигантскую молекулу.
Молекулы состоят из атомов. Атом – мельчайшая, далее химически неделимая составная часть молекулы.
Получается, молекулярная теория объясняет физические явления, которые происходят с веществами. Учение об атомах приходит на помощь молекулярной теории при объяснении химических явлений. Обе эти теории – молекулярная и атомная – объединяются в атомно-молекулярное учение. Сущность этого учения можно сформулировать в виде нескольких законов и положений:
вещества состоят из атомов;
при взаимодействии атомов образуются простые и сложные молекулы;
при физических явлениях молекулы сохраняются, их состав не изменяется; при химических – разрушаются, их состав изменяется;
молекулы веществ состоят из атомов; при химических реакциях атомы в отличие от молекул сохраняются;
атомы одного элемента сходны друг с другом, но отличаются от атомов любого другого элемента;
химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества.
Благодаря своей атомно-молекулярной теории М.В. Ломоносов по праву считается родоначальником научной химии.
Относительная шкала атомных и молекулярных масс.Моль.
атомная (элементная) масса – среднее значение массы атома химического элемента, выраженное в атомных единицах массы. Молекулярная масса – масса молекулы, выраженная в атомных единицах массы; она равна сумме масс всех атомов, из которых состоит молекул
(молекулярная масса в действительности представляет собой среднюю массу молекулы с учетом изотопного состава элементов, образующих данное соединение).Закон постоянства состава. Состав молекулярного соединения остается постоянным независимо от способа его получения. В отсутствие молекулярной структуры его состав зависит от условий получения и предыдущей обработки. Возьмем, к примеру, аммиак (NH3). Независимо от способов получения (прямой синтез из простых веществ, разложение аммонийных солей, действие кислот на нитриды активных металлов и т.п.), состав молекулы аммиака всегда постоянен и неизменен: на атом азота приходится три атома водорода. А для оксида титана (+2) состав соединения зависит от условий получения и предыдущей обработки. В молекуле аммиака, состоящей лишь из четырех атомов, исключается изменчивость состава.
Оксид же титана (+2) представляет собой фазу, состоящую из огромного числа атомов (порядка постоянной Авогадро), которая и определяет свойства этого соединения. Это ярчайший пример перехода количества в качество: коллектив из колоссального числа частиц обладает уже новым качеством – непостоянством состава.
Закон эквивалентов. Вещества вступают в химические реакции в строго определенных массовых соотношениях, пропорциональных их эквивалентам.
Эквивалентом называется реальная или условная частица вещества, которая в кислотно-основных реакциях эквивалентна одному иону водорода, а в окислительно-восстановительных реакциях – одному электрону.
В химии обычно пользуются понятием эквивалентная масса (mэ), т.е. массой 1 эквивалента вещества. Размерность эквивалентной массы – г/моль. Эквивалентная масса элемента определяется как отношение атомной массы к его валентности:
 .
.
Так, эквивалентная масса серы в SO2 и в SO3 определяется как 32/4 и 32/6 г/моль.
Эквивалентная масса кислоты равна отношению молярной массы кислоты к числу атомов водорода в ней, которые она способна отдавать в раствор при диссоциации:
 =
98/2 = 49 г/моль;
=
98/2 = 49 г/моль;  =
36,5/1 = 36,5 г/моль.
=
36,5/1 = 36,5 г/моль.
 г/моль
(СН3СООН
↔СН3СОО— +
Н+).
г/моль
(СН3СООН
↔СН3СОО— +
Н+).
Эквивалентная масса гидроксида равна отношению молярной массы к числу гидроксильных групп:
 =
40/1 = 40 г/моль ;
=
40/1 = 40 г/моль ;  =
74 г/моль.
=
74 г/моль.
Эквивалентная масса оксида и соли определяется как отношение молярной массы соединения к произведению числа атомов элемента на его валентность:
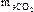 =
44/1×4 = 11 г/моль;
=
44/1×4 = 11 г/моль;  =
342/2×3 = 57 г/моль.
=
342/2×3 = 57 г/моль.
= 197,82/2×3 = 32,97 г/моль.
Эквивалент (эквивалентная масса) сложного вещества, как и эквивалент (эквивалентная масса) элемента, може т иметь различные значения и зависят от того, в какую реакцию вступает это вещества. Так, в реакции Са(ОН)2+HCl =СаOHCl+H2O участвует только один атом водорода, поэтому
 =
74/1 = 74 г/моль,
=
74/1 = 74 г/моль,
а в реакции 2NaOH + H3PO4=Na2HPO4 + 2H2O;
 =
98/2 = 49 г/моль, так как в ней участвует
только 2 катиона водорода из трех.
=
98/2 = 49 г/моль, так как в ней участвует
только 2 катиона водорода из трех.
Математические выражения закона эквивалентов записываются следующим образом:
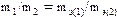 или
или  ,
,
где m1 и m2 – масса 1-го и 2-го вещества;
 –
эквивалентная
масса 1-го и 2-го вещества;
–
эквивалентная
масса 1-го и 2-го вещества;
studfile.net
Атомно-молекулярное учение. Все о химии
 Атомно-молекулярное учение впервые было разработано в 18 веке великим русским ученым М.В. Ломоносовым. В 1741 году он предоставил основные положения своего атомно-молекулярного учения научным кругам в сочинении «Элементы математической химии». После смерти М.В. Ломоносова и вплоть до наших дней учение претерпело ряд изменений по форме, но никогда — по содержанию.
Атомно-молекулярное учение впервые было разработано в 18 веке великим русским ученым М.В. Ломоносовым. В 1741 году он предоставил основные положения своего атомно-молекулярного учения научным кругам в сочинении «Элементы математической химии». После смерти М.В. Ломоносова и вплоть до наших дней учение претерпело ряд изменений по форме, но никогда — по содержанию.
В настоящее время основные положения атомно-молекулярное учение звучат следующим образом:
1. Все вещества на нашей планете состоят из молекул. Молекула – система или группа атомов, имеющая ярко выраженные химические свойства.
2. Все молекулы состоят из атомов. Атомы — конечные составные части химических элементов, обладающие химическими свойствами. Каждый химический элемент состоит из присущего только ему набору атомов.
3. Все молекулы и атомы за счет постоянного отталкивания и притяжения находятся в постоянном движении.
4. Молекулы простых веществ имеют в своем составе одинаковые атомы, молекулы сложных веществ – различные атомы.
Впервые атомно-молекулярное учение М.В. Ломоносова было применено английским химиком Дж. Дальтоном в 1808 году. В своей книге «Новая система химической философии» он попытался применить учение Ломоносова для осознания строения молекул и атомов. Но подлинное научное признание к атомно-молекулярному учению пришло спустя еще 50 лет. В 1860 году на Международном съезде химиков в городе Карлсруэ (Германия) основные положения учения были признаны и основными положениями химии.
В настоящее время атомно-молекулярное учение обрело свои границы. Оно действительно только для веществ в газообразном и парообразном состоянии. Для веществ в твердом состоянии оно действительно только в том случае, если кристаллическая решетка имеет молекулярную структуру. Большинство твердых веществ ее не имеют. К таким веществам относятся все соли, металлы, оксиды металлов, из отдельных веществ – алмаз и кремний.
Поделиться ссылкой
sitekid.ru
Основные положения атомно-молекулярной теории | Подготовка к ЦТ и ЕГЭ по химии
Основные положения атомно-молекулярной теории
Первый определил химию как науку М. В. Ломоносов. Он считал, что химия должна строиться на точных количественных данных –“на мере и весе”. Ломоносов создал учение о строении вещества, заложил основу атомно-молекулярной теории.
Оно сводится к следующим положениям, изложенным в работе “Элементы математической химии”:
- Каждое вещество состоит из мельчайших, далее физически неделимых частиц (Ломоносов называл их корпускулами, впоследствии они были названы молекулами).
- Молекулы находятся в постоянном, самопроизвольном движении.
- Молекулы состоят из атомов (Ломоносов назвал их элементами).
- Атомы характеризуются определенным размером и массой.
- Молекулы могут состоять как из одинаковых, так и различных атомов.
Молекула – это наименьшая частица вещества, сохраняющая его состав и химические свойства. Молекула не может дробиться дальше без изменения химических свойств вещества. Между молекулами вещества существует взаимное притяжение, различное у разных веществ. Молекулы в газах притягиваются друг к другу очень слабо, тогда как между молекулами жидких и твердых веществ силы притяжения относительно велики. Молекулы любого вещества находятся в непрерывном движении. Этим явлением объясняется, например, изменение объема веществ при нагревании.
Атомами называются мельчайшие, химически неделимые частицы, из которых состоят молекулы. Атом – это наименьшая частица элемента, сохраняющая его химические свойства. Атомы различаются зарядами ядер, массой и размерами.
При химических реакциях атомы не возникают и не исчезают, а образуют молекулы новых веществ. Элемент следует рассматривать как вид атомов с одинаковым зарядом ядра.
Химические свойства атомов одного и того же химического элемента одинаковы, такие атомы могут отличаться только массой. Разновидности атомов одного и того же элемента с различной массой, называются изотопами.
Поэтому, разновидностей атомов больше, чем химических элементов.
Необходимо различать понятия “химический элемент” и “простое вещество”.
Вещество – это определенная совокупность атомных и молекулярных частиц в любом из трех агрегатных состояний. Химический элемент – это общее понятие об атомах с одинаковым зарядом ядра и химическими свойствами. Физических свойств, характерных для простого вещества, химическому элементу приписать нельзя.
Простые вещества – это вещества, состоящие из атомов одного и того же химического элемента. Один и тот же элемент может образовывать несколько простых веществ.
Далее приведено современное изложение основных положений атомно-молекулярного учения:
- Все вещества состоят из атомов.
- Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов любого другого вида (элемента).
- При взаимодействии атомов образуются молекулы: гомоядерные (при взаимодействии атомов одного элемента) или гетероядерные (при взаимодействии атомов разных элементов).
- При физических явлениях молекулы сохраняются, при химических – разрушаются; при химических реакциях атомы в отличие от молекул сохраняются.
- Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества.
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ и РТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»www.yoursystemeducation.com
Ломоносов, атомно-молекулярное учение — Справочник химика 21
Основы атомно-молекулярного учения (Ломоносов, Дальтон), утвердившиеся на базе этих законов, позволили связать воедино состав, свойства и строение вещества. Тем не менее основоположники атомно-молекулярной теории (Гей-Люссак, Авогадро, Берцелиус, Либих, Бутлеров, Менделеев), считая, что дискретность в химии играет определяющую роль, тем не менее стремились устранить противоречия в точках зрения Пруста и Бертолле, интуитивно понимая прогрессивность взглядов последнего. Подход Бертолле к изучению химических явлений позволил рассматривать химическое взаимодействие в развитии, изменение свойств в процессе превращения, а не только конечный результат этого превращения, т. е. свойства образовавшегося объекта. [c.322]Творческая деятельность Ломоносова отличается исключительной широтой интересов и глубиной проникновения в тайны природы. Его исследования относятся к области физики, химии, астрономии и др. Результаты этих работ заложили основы современного естествознания. Ломоносов указал (1765) на основополагающее значение закона сохранения массы вещества в химических реакциях изложил (1741 —1750) основы корпускулярного (атомно-молекулярного) учения выдвинул (1744—1748) кинетическую теорию теплоты. Был зачинателем применения математических и физических методов исследования в химии и первым начал читать в Петербургской АН самостоятельный Курс истинно физической химии , заложил основы русского химического языка. [c.9]
Создание атомно-молекулярного учения относится к концу ХУИ — началу XIX в., т. е. к тому времени, когда в химию были введены количественные методы исследования. Огромный вклад в создание этой теории внес русский ученый М. В. Ломоносов. [c.8]
Во времена Лавуазье этот принцип считался само собой разумеющейся истиной и молчаливо, без деклараций, принимался большинством естествоиспытателей и философов. Однако при этом он странным образом уживался с признанием существования и роли в химических и жизненных процессах невесомых флюидов. Лишь весьма немногие естествоиспытатели в те времена вполне сознавали важное значение этого принципа и сознательно пользовались им, последовательно проводя его в жизнь. К числу таких ученых принадлежал М. В. Ломоносов, который еще в 1748 г., основываясь на своих исследованиях, считал необходимым положить этот принцип вместе с атомно-молекулярным учением в основу химии и физики ( корпускулярная философия ), Ломоносов был первым, кто отчетливо сформулировал этот всеобщий естественный закон сохранения веществ и движения. В своих исследованиях он применял этот принцип последовательно и безоговорочно. [c.359]
Атомно-молекулярное учение создали русский ученый М. В. Ломоносов (1741 г.) и английский ученый Дж. Дальтон (1808 г.). [c.8]
Атомно-молекулярное учение развил и впервые применил в химии М. В. Ломоносов. Основные положения его учения изложены в работе Элементы математической химии (1741) и ряде других . [c.4]
Ломоносов Михаил Васильевич (1711—1765)—первый русский ученый-естествоиспытатель мирового значения, человек энциклопедических знаний, разносторонних способностей. Один из основоположников физической химии, атомно-молекулярного учения. [c.8]
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый М. В. Ломоносов. Основные положения этого учения изложены в работе Элементы математической химии (1741) и ряде других. Сущность учения Ломоносова можно свести к следующим положениям. [c.10]
Большой вклад в развитие атомно-молекулярного учения внесли крупнейшие русские и зарубежные ученые М. В. Ломоносов, Лавуазье, Пруст, Дальтон, Авогадро, Канниццаро, Берцелиус, Д. И. Менделеев, А. М. Бутлеров. Окончательно атомно-молекулярное учение утвердилось как научная теория в середине XIX в. Рассмотрим его основные положения. [c.13]
В 1741 г. Ломоносов в своем труде Элементы математической химии изложил мысли, которые, по существу, являются основой современного атомно-молекулярного учения. Он писал, что все изменения тел происходят посредством движения. В основе этого движения лежат элементы (под этим термином следует понимать атомы), которые, соединяясь между собой, образуют корпускулы (молекулы). Элемент (атом) есть часть тела, не состоящая из каких-либо меньших и отличных между собой тел. В основе учения Ломоносова также лежали умозрительные заключения. [c.14]
Атомно-молекулярное учение помогает составить правильное представление о веществах и их превращениях. Во тьме должны находиться физики и особливо химики, не зная внутреннего частиц строения ,— писал М. В. Ломоносов. [c.11]
Ломоносов создал стройное атомно-молекулярное учение и впервые применил его в химии. [c.11]
Объяснение газовых законов базируется на атомно-молекулярном учении и кинетической теории. Основателями кинетической теории следует считать Д. Бернулли и М. В. Ломоносова. Д. Бернулли дал математическое выражение, связывающее давление газа с движением молекул. М. В. Ломоносов применил молекулярно-кинетические представления для объяснения различных явлений, в частности развил молекулярно-кинетическую теорию теплоты. Окончательную разработку кинетическая теория получила в исследованиях Дж. П. Джоуля , вычислившего в 1851 г. среднюю скорость движения частиц газа, Р. Клаузиуса (1822—1888), Дж. К. Максвелла (1831—1879). [c.160]
В другом месте Меншуткин, говоря о влиянии Ломоносова на формирование современного атомно-молекулярного учения, писал Но в выработке этих представлений труды Ломоносова не играли никакой роли, так как все названные диссертации остались при его жизни неопубликованными и были затем изданы в. моем переводе в 1904 году [И, стр. 76]. Такое утверждение нельзя считать вполне обоснованным. Действительно, часть диссертаций Ломоносова не была опубликована при его жизни. Однако основные физические диссертации были напечатаны, причем на латинском языке, в Новых Комментариях Петербургской Академии Наук в 1750 г. В этом же томе была опубликована и его химическая диссертация О действиях растворителей вообще . Кроме того, Слово о пользе химии , в котором Ломоносов развивает некоторые основные положения своих неопубликованных химических диссертаций, было напечатано не только на русском языке, но также и на латинском в 1758 г. Его физические диссертации, как известно, вызвали споры и возражения в иностранной научной литературе, а немецкий ученый Арнольд даже защитил диссертацию, в которой пытался опровергнуть молекулярно-кинетическую теорию Ломоносова. [c.22]
Творческая деятельность Ломоносова отличается как исключительной широтой интересов, так и глубиной проникновения в тайны природы. Его исследования относятся к математике, физике, химии, наукам о Земле, астрономии. Результаты этих исследований заложили основы современного естествознания. Ломоносов обратил внимание (1756) на основополагающее значение
www.chem21.info
Атомно-молекулярное учение — это… Что такое Атомно-молекулярное учение?
Атомно-молекулярное учение — совокупность теоретических представлений естествознания о дискретном строении веществ.
В развитие атомно-молекулярного учения большой вклад внесли М. В. Ломоносов, Дж. Дальтон, А. Лавуазье, Ж. Пруст, А. Авогадро, Й. Берцелиус, Д. И. Менделеев, А. М. Бутлеров.
История
Античная атомистика
Представление о том, что материя состоит из отдельных частиц — атомов возникло еще в древней Греции. Атомизм был создан представителями древнегреческой философии Левкиппом и его учеником Демокритом.
Становление атомистической гипотезы в XVI—XVIII веках
Атомистическая теория Дальтона
Перечень символов химических элементов и их атомных весов Дж. Дальтона (1808)Создание научной теории стало возможно только в XVIII-XIX веках, когда физика и химия стали базироваться на точных экспериментальных данных.
Экспериментальное подтверждение атомной гипотезы нашёл английский химик Джон Дальтон. В начале XIX века Дальтон открыл несколько новых эмпирических закономерностей: закон парциальных давлений (закон Дальтона), закон растворимости газов в жидкостях (закон Генри-Дальтона) и, наконец, закон кратных отношений (1803). Объяснить эти закономерности (прежде всего закон кратных отношений), не прибегая к предположению о дискретности материи, невозможно. В 1808 году Дальтон изложил свою атомистическую гипотезу в труде «Новая система химической философии».
Основные положения теории Дальтона состояли в следующем[1]:
1. Все вещества состоят из большого числа атомов (простых или сложных).
2. Атомы одного вещества полностью тождественны. Простые атомы абсолютно неизменны и неделимы.
3. Атомы различных элементов способны соединяться между собой в определённых соотношениях.
4. Важнейшим свойством атомов является атомный вес.
Уже в 1803 г. в лабораторном журнале Дальтона появилась первая таблица относительных атомных весов некоторых элементов и соединений (атомный вес водорода был принят равным единице). Дальтон ввёл символы химических элементов в виде окружностей с различными фигурами внутри. Впоследствии Дальтон неоднократно корректировал атомные веса элементов, однако для большинства элементов им приводились неверные значения.
Эпоха классической химии
Основные положения
Атомно-молекулярное теория базируется на следующих законах и утверждениях:
- Все вещества состоят из атомов
- Атомы одного химического вещества (химический элемент) обладают одинаковыми свойствами, но отличаются от атомов другого вещества
- При взаимодействии атомов образуются молекулы (гомоядерные — простые вещества, гетероядерные — сложные вещества)
- При физических явлениях молекулы не изменяются, при химических происходит изменение их состава
- Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества
- Закон сохранения массы — масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции
- Закон постоянства состава (закон кратных отношений) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами
- Аллотропия — существование одного и того же химического элемента в виде нескольких простых веществ, различных по строению и свойствам.
Вытекающие законы и положения
Примечания
См. также
partners.academic.ru