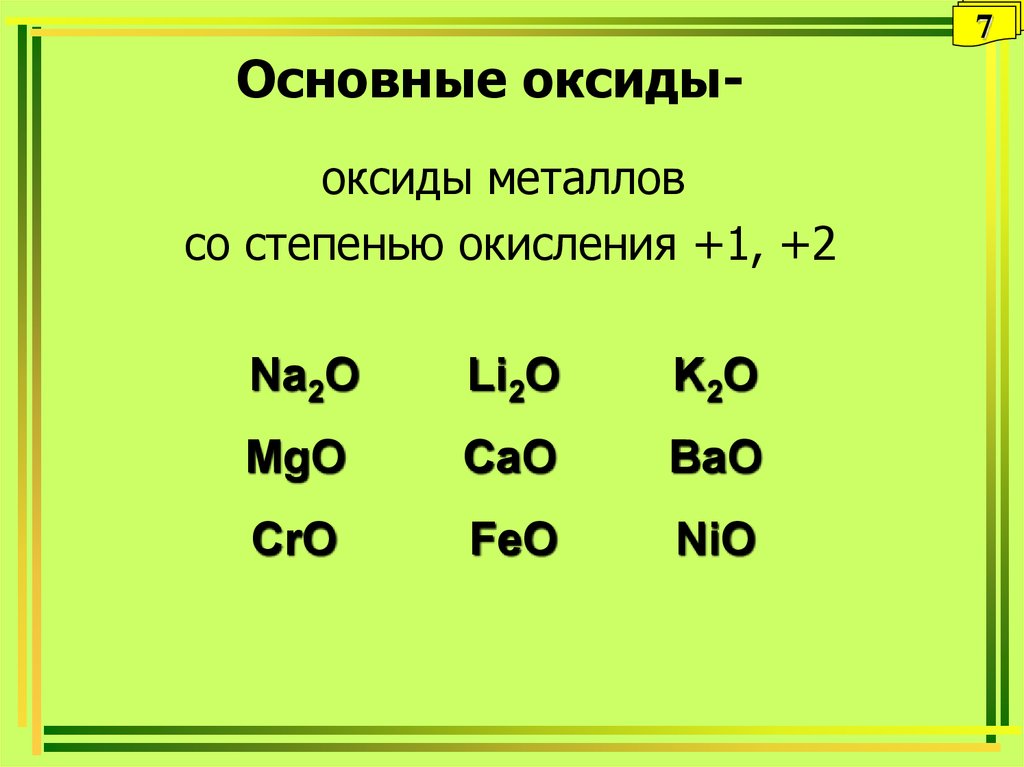
Оксиды основные — Справочник химика 21
Оксиды основные — оксиды, которым соответствуют основания. [c.375]Для солеобразующих оксидов (основных, кислотных, амфотерных) фактор эквивалентности определяется числом катионов соответствующего оксиду основания или анионов соответствующей оксиду кислоты и их зарядом. [c.13]
Другими весьма эффективными химическими методами глубокой очистки веществ являются методы избирательного окисления или восстановления по отношению к очищаемому веществу или примесям. В качестве окислителя используется кислород, галогены, в особенности хлор (метод избирательного хлорирования). При использовании кислорода обычно стремятся с его помощью химически связать и удалить примеси, находящиеся в очищаемом веществе. Но иногда лучшая очистка достигается переводом в оксид основного элемента с последующим его восстановлением. [c.12]
Поверхность АУ геометрически и химически неоднородна.

Характер оксида Основной Амфотерный Кислотный [c.94]
Различают основные, кислотные и амфотерные оксиды. Основные (или солеобразные) оксиды характеризуются ионной или [c.256]
Оксиды — это бинарные соединения, молекулы которых состоят из двух элементов, один из которых кислород. Различают основные, кислотные и амфотерные оксиды. Основным оксидам соответствуют основания, кислотным — кислоты, а амфотерные проявляют двойственность. [c.134]
Согласно первой теории малая добавка легирующего элемента должна окисляться с образованием ионов определенной степени окисления и, растворяясь в оксиде основного металла, уменьшать в нем число дефектов решетки. [c.364]
По химическим свойствам простые вещества, как известно, также подразделяются на металлы и неметаллы. С этими двумя классами генетически связаны соответствующие ряды характеристических соединений оксидов (основных и кислотных), гидроксидов (оснований и кислот). Отличительной особенностью этих рядов является способность к взаимодействию с образованием солей, т. е. к взаимной нейтрализации в широком смысле слова. Чем ярче выражены металлические и неметаллические свойства простых веществ, тем активнее взаимодействие между ними и их характеристическими соединениями. Таким образом, в химии ярко проявляется симметричность относительно кислотно-основного взаимодействия, причем каждый из генетических типов базируется на одном из двух классов простых веществ.
С этими двумя классами генетически связаны соответствующие ряды характеристических соединений оксидов (основных и кислотных), гидроксидов (оснований и кислот). Отличительной особенностью этих рядов является способность к взаимодействию с образованием солей, т. е. к взаимной нейтрализации в широком смысле слова. Чем ярче выражены металлические и неметаллические свойства простых веществ, тем активнее взаимодействие между ними и их характеристическими соединениями. Таким образом, в химии ярко проявляется симметричность относительно кислотно-основного взаимодействия, причем каждый из генетических типов базируется на одном из двух классов простых веществ.
Способы получения. Ре, Со и N1 в свободном виде — термическое восстановление их оксидов (основной способ) водородом, оксидом углерода (II), углеродом, алюминием и другими восстановителями [c.493]
Таким образом, амфотерным оксидам присущи свойства как основных, так и кислотных оксидов. Отметим, что у различных амфотерных оксидов двойственность свойств может быть выражена в различной степени. Например, оксид цинка одинаково легко растворяется и в кислотах, и в щелочах, т. е. у этого оксида основная и кислотная функции выражены примерно в одинаковой мере. Оксид железа (III) — РезОд — обладает преимущественно основными свойствами кислотные свойства проявляет, только взаимодействуя со щелочами при высоких температурах [c.196]
Отметим, что у различных амфотерных оксидов двойственность свойств может быть выражена в различной степени. Например, оксид цинка одинаково легко растворяется и в кислотах, и в щелочах, т. е. у этого оксида основная и кислотная функции выражены примерно в одинаковой мере. Оксид железа (III) — РезОд — обладает преимущественно основными свойствами кислотные свойства проявляет, только взаимодействуя со щелочами при высоких температурах [c.196]
Понятие об оксидах (основных и кислотных). [c.222]
Свойства основных оксидов. Основные оксиды при нагревании могут вступать в реакции с кислотными и ам-фотерными оксидами, с кислотами. Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой [c.166]
Оксиды лантаноидов Э.Рз характеризуются высокими энтальпиями и энергиями Гиббса образования (AG/ = —1600 кДж/моль) и тугоплавкостью (т. пл. порядка 2000°С). Оксиды—основные соединения. В воде они практически не растворяются, но взаимодействуют с ней, образуя гидроксиды и выделяя тепло. Оксиды Э2О3 хорошо растворяются в НС и HNO3, но, будучи прокалены, как и А1Рз, теряют химическую активность. Со щелочами не взаимодействуют. Окраска оксидов определяется электронной конфигурацией иона (см. выше). [c.645]
Оксиды—основные соединения. В воде они практически не растворяются, но взаимодействуют с ней, образуя гидроксиды и выделяя тепло. Оксиды Э2О3 хорошо растворяются в НС и HNO3, но, будучи прокалены, как и А1Рз, теряют химическую активность. Со щелочами не взаимодействуют. Окраска оксидов определяется электронной конфигурацией иона (см. выше). [c.645]
Оснбены.чи называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами. Основным оксидам отвечают основания. Например, оксиду кальция СаО отвечает основание гидроксид кальция Са(0Н)2 оксиду кадмия dO — гидроксид кадмия d(0H)2-
Получение из кристаллогидратов безводных галогенидов, не содб ржащих оксидов, основных солей и окси-галогенидов, является трудоемкой операцией. Объясняется это тем, что отщепляющиеся нары воды могут взаимодействовать с уже частично обезвоженной солью, например [c.58]
Оксиды лантаноидов лучше всего получать термическим разложением нитратов, карбонатов, оксалатов или гидроксидов. Все оксиды обладают высокой температурой плавления и очень устойчивы по отношению к кислороду и воздуху. При высоких температурах низшие оксиды СеаОз, РггОз и ТЬгОз переходят в высшие СеОа, Pг60 J и ТЬ40,. Все они энергично соединяются с водой, образуя нерастворимые гидроксиды. Являясь оксидами основного характера, они легко растворяются не только в растворах сильных, но и слабых кислот, таких, как уксусная, муравьиная, хромовая и т. п. [c.67]
Все оксиды обладают высокой температурой плавления и очень устойчивы по отношению к кислороду и воздуху. При высоких температурах низшие оксиды СеаОз, РггОз и ТЬгОз переходят в высшие СеОа, Pг60 J и ТЬ40,. Все они энергично соединяются с водой, образуя нерастворимые гидроксиды. Являясь оксидами основного характера, они легко растворяются не только в растворах сильных, но и слабых кислот, таких, как уксусная, муравьиная, хромовая и т. п. [c.67]
Например, подзолистые почвы, типичные для северных районов нашей страны, образуются в условиях малого содержания органических остатков (гуминовых веществ) и большой влажности, вымывающей оксиды основного характера (КО и К2О). Частицы оксидов типа К2О3, высокодисперсные и покрытые в этих условиях защитными коллоидами — гуминовыми кислотами, также вымываются. Остающиеся коагели характеризуются высоким содержанием 8102 и малым количеством питательных веществ, необходимых для растений. [c.283]
СцдО — оксид основного характера, но может проявлять и амфотерные свойства,- растворяясь в концентрированных растворах щелочей [c.
Например, подзолистые почвы, типичные для средних районов нашей страны, образуются в условиях малого содержания органического вещества и большой влажности, которая способствует вымыванию оксидов основного характера (МО и МаО). Частицы оксидов типа М2О3, защищенные гуминовыми кислотами, также вымываются в этих условиях. Остающиеся коагели характеризуются высоким содержанием ЗЮг и малым содержанием питательных веществ, необходимых для растений. [c.340]
Основные оксиды. Основными называются такие оксиды, которым соответствуют основания. Например, NajO, СаО, FeO, NiO являются основными оксидами, так как им соответствуют основания NaOH, a(OH)a, Fe(0H)2, Ni(OH)a. Некоторые основные оксиды при взаимодействии с водой образуют основания. Например [c.124]
Помимо оксидов основного, кислотного и амфотерпого типа, можно выделить так называемые несолеобразующие оксиды, которые не образуют с водой гидратных форм и не могут быть ни основными, ни кислотными.
Химические свойства. Ае20 — оксид основного характера [c.404]
Этилен- и пропиленгликоли продукты находят широкое применение в качестве растворителей, антифризов и др. Мировой объем их производства превышает 15 млн. тонн в год [1]. В настоящее время гликолю получают путем некаталитической гидратации а-оксидов, которую осуществляют при 140-200°С и 20-40 ат, с использованием 8-10 кратного массового избытка воды по отношению к а-оксиду. Основными недостатками этого процесса являются низкий выход моногликоля (менее 90%), а также высокие энергозатраты при вьщелении гликолей из разбавленных (12-15%) водных растворов. Одним из основных путей повышения эффективности процесса гидратации является использование гетерогенных катализаторов [2-6].
Этилен- и пропиленгликоль находят широкое применение в качестве полупродуктов для синтеза полимерных материалов и антифризов. Мировой объем их производства превышает 15 млн т в год [1]. В настояшее время в основным промышленным способом получения гликолей является гфоцесс некаталитической гидратации а-оксидов, осуществляемый при 140-200°С и 20-40 атм, с использованием 8-10 кратного массового избытка воды по отношению к а-оксиду. Основными недостатками этого процесса являются низкий выход моногликоля (менее 90%), а также высокие энергозатраты при выделении гликолей из разбавленных (12-15%-х) водных растворов. В связи с этим актуальной задачей является разработка про- [c.139]
Мировой объем их производства превышает 15 млн т в год [1]. В настояшее время в основным промышленным способом получения гликолей является гфоцесс некаталитической гидратации а-оксидов, осуществляемый при 140-200°С и 20-40 атм, с использованием 8-10 кратного массового избытка воды по отношению к а-оксиду. Основными недостатками этого процесса являются низкий выход моногликоля (менее 90%), а также высокие энергозатраты при выделении гликолей из разбавленных (12-15%-х) водных растворов. В связи с этим актуальной задачей является разработка про- [c.139]
Пигменты, используемые для получения красок и чернил, чаще всего состоят из различных солей и оксидов. Основной карбонат свинца (свинцовые белила) Pb(OH)j РЬСОз долгое время служил практически единственным белым пигментом, однако в настоящее время почти полностью вытеснен различными нетоксичными пигментами, например диоксидом титана ТЮз- Последний не только безвреден, но, кроме того, обладает приблизительно в 5— 10 раз больщей отражающей способностью (белизной), чем свинцовые белила. Среди других белых пигментов можно указать ZnO, ZnS и литопон (смесь BaS04 и ZnS). Многие современные пигменты состоят из органических комплексов и относятся к классу красителей, и все же некоторые традиционно употребляемые краски по-прежнему изготовляют на основе простых солей и оксидов. Кирпично-красную краску получают из пигмента оксида железа существуют также желтый, коричневый и черный оксиды железа, которые используют для изготовления других красок. Ранее широко применяли краски на основе таких пигментов, как желтый dS, желтый РЬСгО , голубой Ред [Ре(С№ ]з и красный HgS, но в настоящее время больщинство их исчезло из продажи из-за высокой стоимости и других недостатков. Наиболее распространенный черный пигмент, применяемый для изготовления красок и чернил,— это элементарный углерод в виде сажи.
Среди других белых пигментов можно указать ZnO, ZnS и литопон (смесь BaS04 и ZnS). Многие современные пигменты состоят из органических комплексов и относятся к классу красителей, и все же некоторые традиционно употребляемые краски по-прежнему изготовляют на основе простых солей и оксидов. Кирпично-красную краску получают из пигмента оксида железа существуют также желтый, коричневый и черный оксиды железа, которые используют для изготовления других красок. Ранее широко применяли краски на основе таких пигментов, как желтый dS, желтый РЬСгО , голубой Ред [Ре(С№ ]з и красный HgS, но в настоящее время больщинство их исчезло из продажи из-за высокой стоимости и других недостатков. Наиболее распространенный черный пигмент, применяемый для изготовления красок и чернил,— это элементарный углерод в виде сажи.
Химические свойства Ag20 — оксид основного характера [c.404]
Кислотно-основные свойства оксидов и гидроксидов изменяются в полном соответствии со схемой Косселя угольная Н2СО3 и кремниевые кислоты ЗЮг лНгО являются слабыми, у ОеОг пНгО кислотная диссоциация преобладает над основной, а в оксидах ЗпОг и РЬОг превалируют основные свойства, хотя оба оксида также образуют станнаты (КагЗпОз) и плюмбаты (ЫааРЬОз).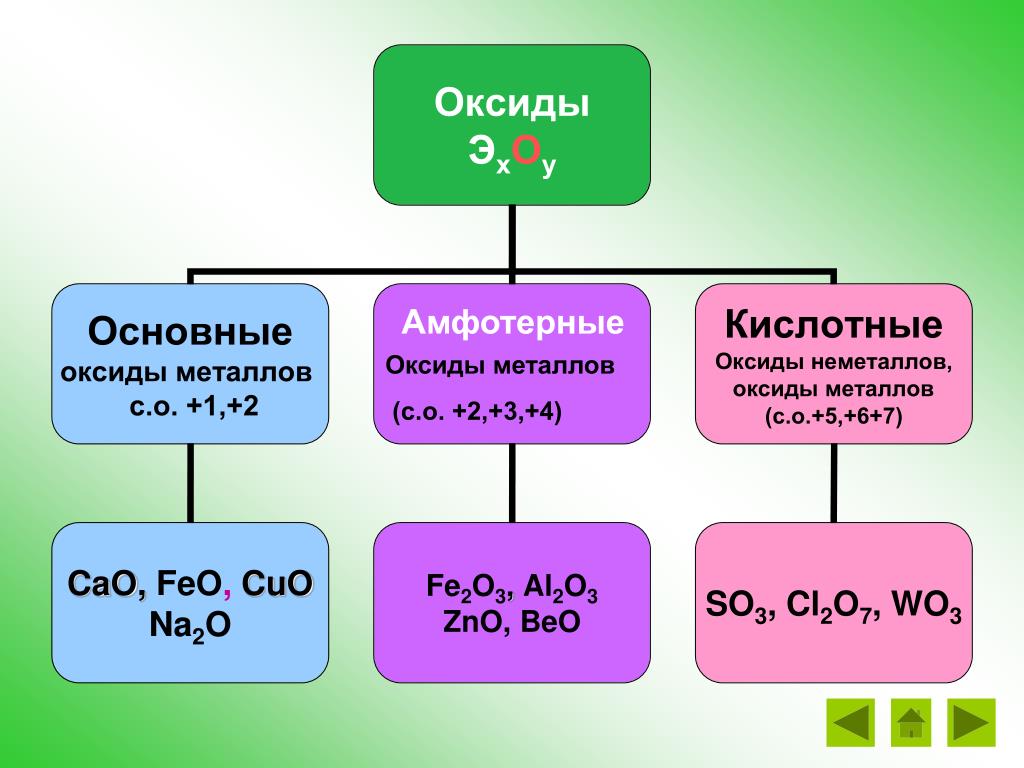 В двухвалентном состоянии у оксидов основные свойства гораздо сильнее и эта тенденция от Се и РЬ еще более заметна. [c.146]
В двухвалентном состоянии у оксидов основные свойства гораздо сильнее и эта тенденция от Се и РЬ еще более заметна. [c.146]
Оксид диметиланилина может быть конечным продуктом окисления или же интермедиантом в реакции метаболизма диметиланилина. Для ряда соединений, например импрамина, никотршамида и др., образование Л -оксидов — основной путь их метаболизма. [c.515]
основных, амфотерных, кислотных / Справочник :: Бингоскул
Почти все химические элементы образуют оксиды. Лишь инертные газы не могут образовывать данные соединения.
Оксиды – это сложные вещества, в состав которых входят 2 элемента, одним из которых является кислород. Таким образом, можно представить общую формулу данных соединений:
ЭmOn, где
- Э – химический элемент;
- m, n – индексы.
Номенклатура оксидов
Номенклатура этих веществ складывается из слова «оксид», названия химического элемента и валентности.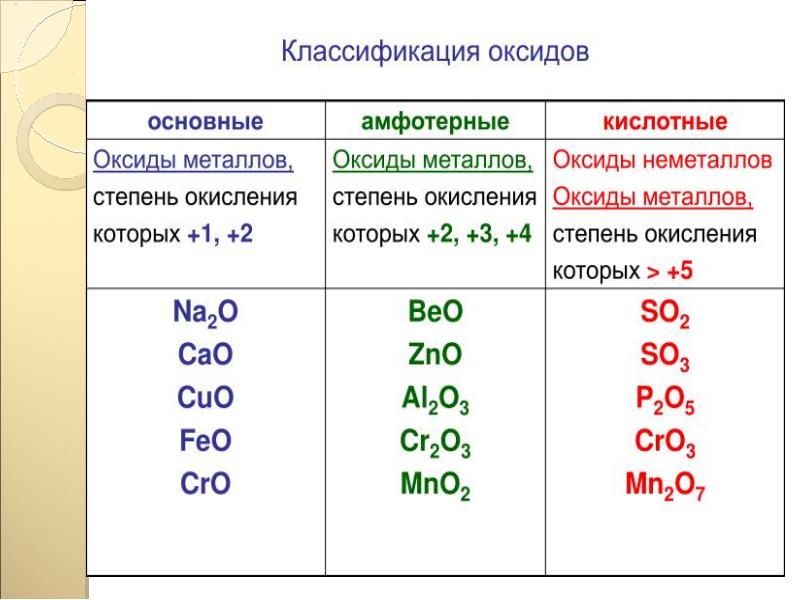 Более того, для элементов с постоянной валентностью она не указывается.
Более того, для элементов с постоянной валентностью она не указывается.
Название оксида = «Оксид» + название х.э. + валентность (в скобках)
Например:
- СO — оксид углерода (IV)
- Fe2O3 — оксид железа (III)
Классификация оксидов
Все оксиды подразделяются на две большие группы:
- Оксиды, которые при взаимодействии с кислотами и основаниями не образуют солей относят к несолеобразующим (CO, SiO, N2O, NO). В несолеобразующих оксидах элемент проявляет переменную (не постоянную) валентность.
- Солеобразующие оксиды – это оксиды, которые при взаимодействии с кислотами, либо с основаниями, образуют соли. Эти оксиды являются производными от соответствующих оснований и кислот, в которых элемент находится в высшей валентности.
Все солеобразующие оксиды разделяются на три типа:
- К основным оксидам относят оксиды, гидраты которых являются основаниями.
 Образуются металлами, валентность которых меньше IV. Например:
Образуются металлами, валентность которых меньше IV. Например:- Na2O → NaOH
- CaO → Ca(OH)2
- FeO → Fe(OH)2
В состав данных соединений входят металлы с I и II, исключение цинк, бериллий, свинец, олово.
- К кислотным оксидам относят оксиды, гидраты которых являются кислотами. Образованы неметаллами и металлами побочных подгрупп с валентностью V, VI, VII. Например:
- CO2 → h3CO3
- SO3 → h3SO4
- P2O5 → h4PO4
- Амфотерными оксидами называются оксиды, которым соответствуют амфотерные гидроксиды. Образованы металлами с валентностью III и IV. Например:
- ZnO → Zn(OH)2
- Al2O3 → Al(OH)3
Химические свойства оксидов
Все три группы оксидов обладают разными химическими свойствами. Амфотерные оксиды занимают промежуточное положение между основными и кислотными, поэтому для них характерны и кислотные, и щелочные химические свойства.
Свойства | Оксиды основные (ОО) | Оксиды амфотерные (АО) | Оксиды кислотные (КО) |
| ОО +к-та = соль(С) + вода(В) | АО + к-та = С + В | — |
| — | (только со щелочами) АО + щелочь = С + В | КО + основание = С + В |
| ОО + В = щелочь | — | КО + В = кислота |
| — | АО + ОО = С | ОО + КО = соль |
| ОО + КО = С | АО + КО = С | — |
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства кислот
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных ( на примере соединений алюминия и цинка)
- Взаимосвязь различных классов неорганических веществ
Тестовые задания для подготовки к ЕГЭ по теме «Оксилы»
Тест по теме «Классификация оксидов»
В каком ряду расположены соединения, являющиеся оксидами?
1) Nа2O, H2O, Al2O3, SO2 2) ВеО, Fe2O3, В2O3, ОF2
3) Nа2O 2, Р4О10, SiO2, Cl2O7 4) H2O2, FeO, Fe2O3, Fe3O4
Оксидами являются все вещества ряда
1) Al2O3, Nа2O2, N2O5 2) MnO2, H2O2, SO3
3) KO2, N2O, CaO 4) CO, Mn2O7, H2O
К основным оксидам относится
1) ZnO 2) SO2 3) FeO 4) H2O
Оксид серы (IV) проявляет свойства
1) основного оксида 2) амфотерного оксида
3) кислотного оксида 4) несолеобразующего оксида
Оксид хрома (III) относится к оксидам
1) кислотным 2) основным
3) амфотерным 4) несолеобразующим
Оксиды азота N2O и NO относятся к
1) кислотным 2) оснóвным
3) амфотерным 4) несолеобразующим
К оснóвным оксидам не относится
1) Mn2O7 2) MgO 3) Ag2O 4) CaO
К основным оксидам относится
1) ВаO 2) NO2 3) Al2O3 4) N2O
Кислотным является оксид, формула которого:
1) SiO2 2) Al2O3 3) СО 4) ВаО
К амфотерным оксидам относится
1) CrO3 2) SO3 3) СО2 4) Cr2O3
К амфотерным оксидам относится
1) CuO 2) Р2O3 3) Cr2O3 4) CrO3
Только кислотные оксиды содержатся в ряду:
1) NO, SiO2, P2O5 2) MgO, CO2, NO2
3) CO2, N2O5, P2O5 4) ZnO, Cl2O7, CaO
Высший оксид химического элемента с порядковым номером 16 относится к оксидам:
1) основным 2) кислотным
3) амфотерным 4) несолеобразующим.
К основным оксидам относится
1) NO 2) К2O 3) Fe2O3 4) СО
К амфотерным оксидам относится:
1) SO3 2) К2O 3) ZnO 4) N2O
Какой из оксидов является несолеобразующим?
1) Аl2O3 2) CO2 3) СО 4) Cl2O7
К несолеобразующим оксидам относится
1) N2O 2) NO2 3) N2O5 4) P2O3
Высшему оксиду элемента VI группы соответствует формула
1) Э4O6 2) ЭO4 3) ЭO2 4) ЭО3
Оксид серы (IV) проявляет свойства
1) только основного оксида 2) амфотерного оксида
3) кислотного оксида 4) несолеобразующего оксида
Кислотным и основным оксидом являются соответственно
1) SO2 и MgO 2) CO2 и Al2O3
3) Na2O и FeO 4) ZnO и SO3
К амфотерным оксидам относится
1) SO3 2) K2O 3) ZnO 4) N2O
Какие из приведенных утверждений верны?
А. Основным оксидам соответствуют основания.
Основным оксидам соответствуют основания.
Б. Основные оксиды образуют только металлы.
1) верно только А 2) верно только Б
3) верны оба утверждения 4) оба утверждения неверны
Кислотным и основным оксидом являются соответственно:
1) SO2 и MgO 2) CO2 и Al2O3
3) Nа2O и FeO 4) ZnO и SO3
Кислотными оксидами являются все вещества группы:
1) SiO2, Al2O3, SO2 2) СО2, СО, N2O3
3) NO, NO2, N2O5 4) SO3, CrO3, P2O5
Только кислотные оксиды расположены в ряду:
1) CO2, Mn2O7, SO3 2) Nа2O, SiO2, Cr2O3
3) CrO, SO2, СаО 4) CuO, Al2O3, FeO
Амфотерным и основным оксидами соответственно являются
1) BaO, К2О 2) Al2O3, СаО
3) SO2, Nа2O 4) Cr2O3, ZnO
Амфотерными оксидами являются все вещества ряда:
1) CrO, Al2O3, Fe2O3 2) ВаО, ZnO, Cu2O
3) Ag2O, Nа2O, PbO 4) ZnO, Al2O3, Cr2O3
Только кислотные оксиды указаны в ряду:
1) ZnO, CO2, N2O 2) CO, SiO2, SnO2
3) CrO3, N2O3, SiO2 4) N2O5, P2O3, Cs2O
Амфотерным и основным оксидами соответственно являются
1) ZnO, Nа2O 2) SO3, CaO
3) P2O5, Nа2O 4) Al2O3, ZnO
В перечне веществ:
ZnO, FeO, CrO3, CaO, Al2O3, Na2O, Cr2O3 – число оснόвных оксидов равно
1) 5 2) 2 3) 3 4) 4
Среди перечисленных веществ:
2O5к кислотным оксидам относятся
1) АВД 2) БГЕ 3) БВД 4) ГДЕ
Среди перечисленных веществ
А) CaO
Б) CrO3
В) FeO
Г) SiO2
Д) Cl2O
Е) Na2O
осно́вными оксидами являются
1) АГД 2) БВД 3) АВЕ 4) БДЕ
33. Среди перечисленных веществ:
Среди перечисленных веществ:
А) P2O3
Б) Al2O3
В) N2O3
Г) BeO
Д) CO
Е) Cr2O3
к амфотерным оксидам относятся
1) АБВ 2) ГДЕ 3) БГД 4) БГЕ
34. Среди перечисленных веществ:
А) N2O
Б) СO
В) СrO3
Г) Al2O3
Д) SO2
Е) SO3
к кислотным оксидам относят:
1) АБД 2) БДЕ 3) ВДЕ 4) ГДЕ
35. Среди перечисленных веществ:
А) Na2O
Б) Сr2O3
В) CaO
Г) Al2O3
Д) Rb2O
Е) ZnO
к амфотерным оксидам относят:
1) АВД 2) АВЕ 3) БГЕ 4) ВГЕ
36. Среди перечисленных веществ:
А) Al2O3
Б) Cr2O3
В) CO2
Г) Cl2O7
Д) SO2
Е) Nа2O
к кислотным оксидам относятся:
1) АБВ 2) БВД 3) ВГД 4) ГДЕ
37. Среди перечисленных веществ:
Среди перечисленных веществ:
А) BaO
Б) SO2
В) KOH
Г) N2О
Д) Cu2O
Е) MgO
к оснóвным оксидам относят:
1) АБГ 2) АДЕ 3) ВГЕ 4) ВДЕ
38. Установите соответствие между формулой вещества и классом (группой) неорганических соединений.
ФОРМУЛА ВЕЩЕСТВА КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
А) оксид азота (II) 1) кислотный оксид
Б) оксид кальция 2) основный оксид
В) оксид серы (IV) 3) несолеобразующий оксид
Г) оксид углерода (II) 4) амфотерный оксид
39. Установите соответствие между названием вещества и его принадлежностью к соответствующему классу (группе) неорганических соединений.
название вещества КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1) оксид азота (II) А) кислотный оксид
2) оксид кальция Б) основный оксид
3) оксид серы (IV) В) несолеобразующий оксид
4) оксид углерода (II) Г) амфотерный оксид
40. Установите соответствие между формулой оксида и характером его свойств.
Установите соответствие между формулой оксида и характером его свойств.
ФОРМУЛА ОКСИДА ХАРАКТЕР СВОЙСТВ ОКСИДА
А) CO 1) амфотерный оксид
Б) MnO 2) основный оксид
В) Р2О5 3) кислотный оксид
Г) ZnO 4) несолеобразующий оксид
41. Установите соответствие между классом (группой) неорганических веществ и химической формулой вещества, принадлежащего к этому классу.
КЛАСС (ГРУППА) ВЕЩЕСТВА ХИМИЧЕСКАЯ ФОРМУЛА
А) кислотные оксиды 1) NO
Б) оснóвные оксиды 2) Li2O
В) амфотерные оксиды 3) N2O5
Г) несолеобразующие оксиды 4) BeO
5) OF2
6) NH3
42. Установите соответствие между классом (группой) неорганических веществ и химической формулой вещества, принадлежащего к этому классу.
КЛАСС (ГРУППА) ВЕЩЕСТВА ХИМИЧЕСКАЯ ФОРМУЛА
А) оснóвные оксиды 1) CO
Б) несолеобразующие оксиды 2) CO2
В) амфотерные оксиды 3) Ag2O
Г) соли 4) Al2O3
5) Al(OH)3
6) KAlO2
Получение. Свойства — Оксиды — Важнейшие классы неорганических соединений — Неорганическая химия
Свойства — Оксиды — Важнейшие классы неорганических соединений — Неорганическая химия
9 января 2007
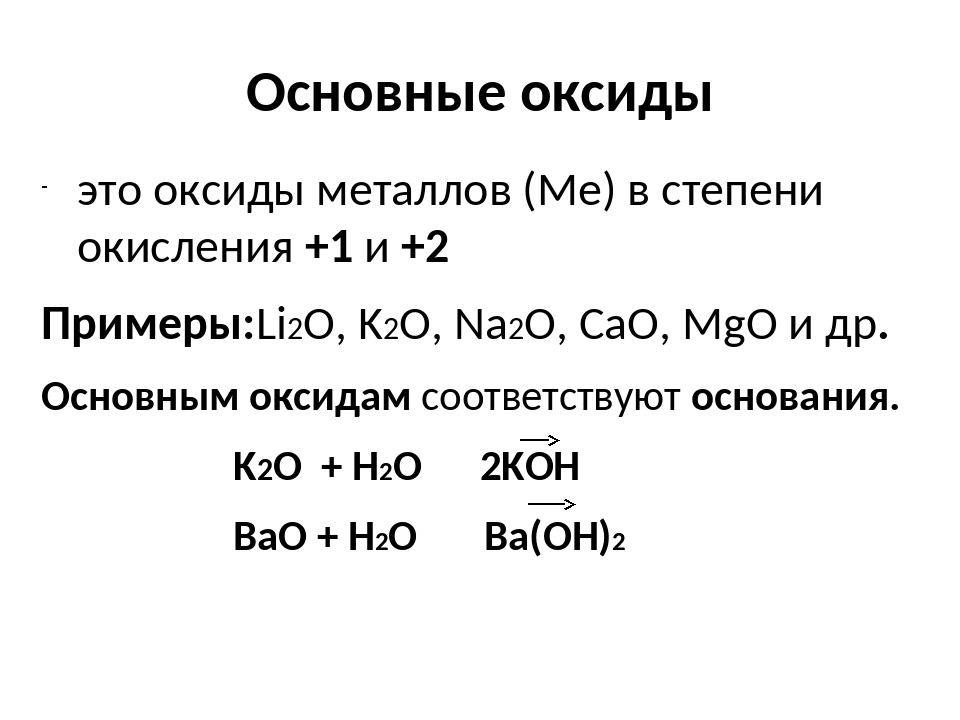
Основные оксиды. К основным относятся оксиды типичных металлов, им соответствуют гидроксиды, обладающие свойствами оснований.
Получение основных оксидов:
1. Окисление металлов при нагревании в атмосфере кислорода:
2Mg + О2 = 2МgО,
2Сu + О2 = 2СuО.
Этот метод практически неприменим для щелочных металлов, которые при окислении обычно дают пероксиды, поэтому оксиды Na2О, К2О крайне труднодоступны.
2. Обжиг сульфидов:
2CuS + ЗО2 = 2СuО + 2SО2,
4FeS2 + 11О2 = 2Fе2О3 + 8SО2.
Метод неприменим для сульфидов активных металлов, окисляющихся до сульфатов.
3. Разложение гидроксидов:
Этим методом нельзя получить оксиды щелочных металлов.
4. Разложение солей кислородсодержащих кислот:
| to | ||
| 2Рb(NО3)2 | = | 2PbО + 4NO2+O2 |
| to | ||
| 4FеSО4/> | = | 2Fe2O3 + 4SO4 + O2 |
Этот способ получения оксидов особенно легко осуществляется для нитратов и карбонатов, в том числе и для основных солей:
| to | ||
| [ZnOH]2 | = | 2ZnO + CO2 + H2 O |
Свойства основных оксидов. Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера, в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с оксид-ионами О2–, поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Отметим одну характерную для оксидов особенность. Близость ионных радиусов многих ионов металлов приводит к тому, что в кристаллической решетке оксидов часть ионов одного металла может быть заменена на ионы другого металла. Это приводит к тому, что для оксидов часто не выполняется закон постоянства состава и могут существовать смешанные оксиды переменного состава.
Большинство основных оксидов не распадается при нагревании, исключение составляют оксиды ртути и благородных металлов:
Основные оксиды при нагревании могут вступать в реакции кислотными и амфотерными оксидами, с кислотами:
ВаО + SiO2 = ВаSiO3,
МgО + Аl2О3 = Мg(AlO2)2,
ZnО + Н2SО4 = ZnSО4 + Н2О.
Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой:
Как и другие типы оксидов, основные оксиды могут вступать в окислительно-восстановительные реакции:
| to | ||
| Fe2O3+2Al/> | = | Al 2O3 + 2Fe |
| to | ||
| 3CuO+2NH3 | = | 3Cu + N2+3H2O |
Кислотные оксиды.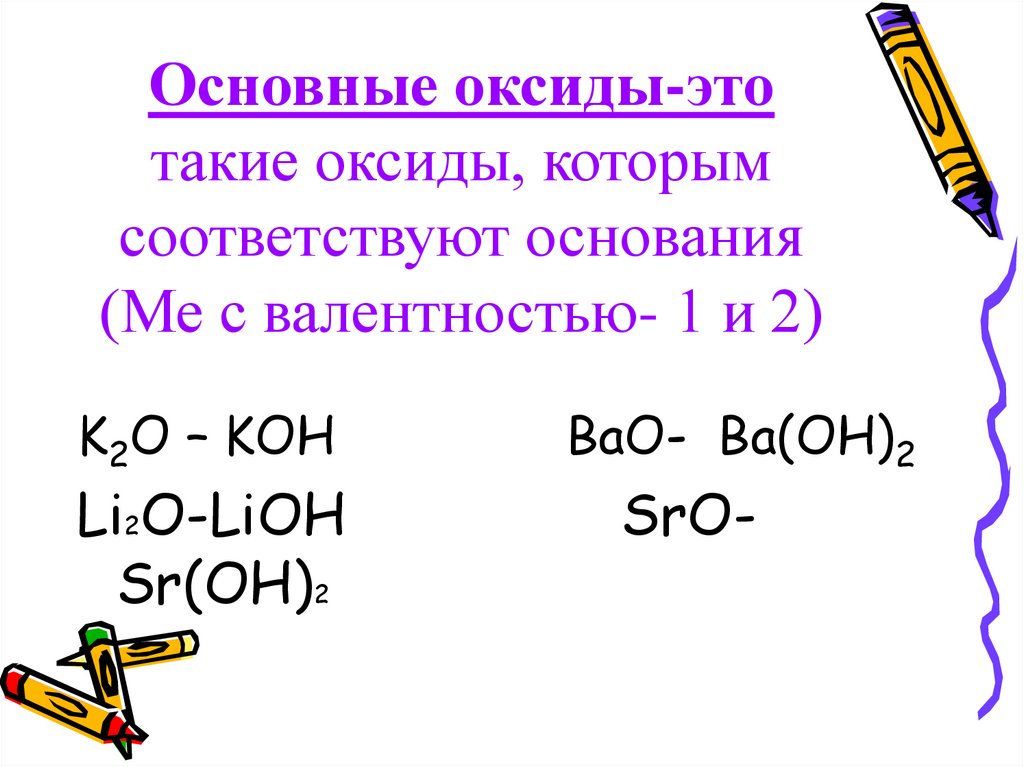 Кислотные оксиды представляют ее оксиды неметаллов или переходных металлов в высоких степенях окисления и могут быть получены методами, аналогичными методам получения основных оксидов, например:
Кислотные оксиды представляют ее оксиды неметаллов или переходных металлов в высоких степенях окисления и могут быть получены методами, аналогичными методам получения основных оксидов, например:
| to | ||
| 2ZnS+3O2 | = | 2ZnO + 2SO2 |
| to | ||
| K2Cr2O7+H2SO4 | = | 2CrO3↓+ K2So4+H2O |
| Nа2SiO3 + 2НСl | = | 2NаСl + SiO2↓ + Н2О |
Большинство кислотных оксидов непосредственно взаимодействует с водой с образованием кислот:
Наиболее типичными для кислотных оксидов являются их реакции с основными и амфотерными оксидами, с щелочами:
Са(ОН)2 + СО2 = СаСО3↓ + Н2О.
Выше упоминалось, что кислотные оксиды могут вступать в многочисленные окислительно-восстановительные реакции, например:
| 2SO2+O2 | to | 2SO3 |
SО2 + 2Н2S = 3S + 2Н2О,
4CrO3 + С2Н5ОН = 2Сr2О3 + 2СО2 + ЗН2О.
Амфотерные оксиды обладают двойственной природой: они одновременно способны к реакциям, в которые вступают как основные, так и кислотные оксиды, т.е. реагируют и с кислотами, и со щелочами:
Аl2О3 + 6НСl = 2АlСl3 + ЗН2О,
Аl2О3 + 2NаОН + ЗН2О = 2Nа[Аl(ОН)4].
К числу амфотерных оксидов относятся оксид алюминия Аl2О3, оксид хрома (III) Сr2О3, оксид бериллия ВеО, оксид цинка ZnО, оксид железа (III) Fe2О3 и ряд других.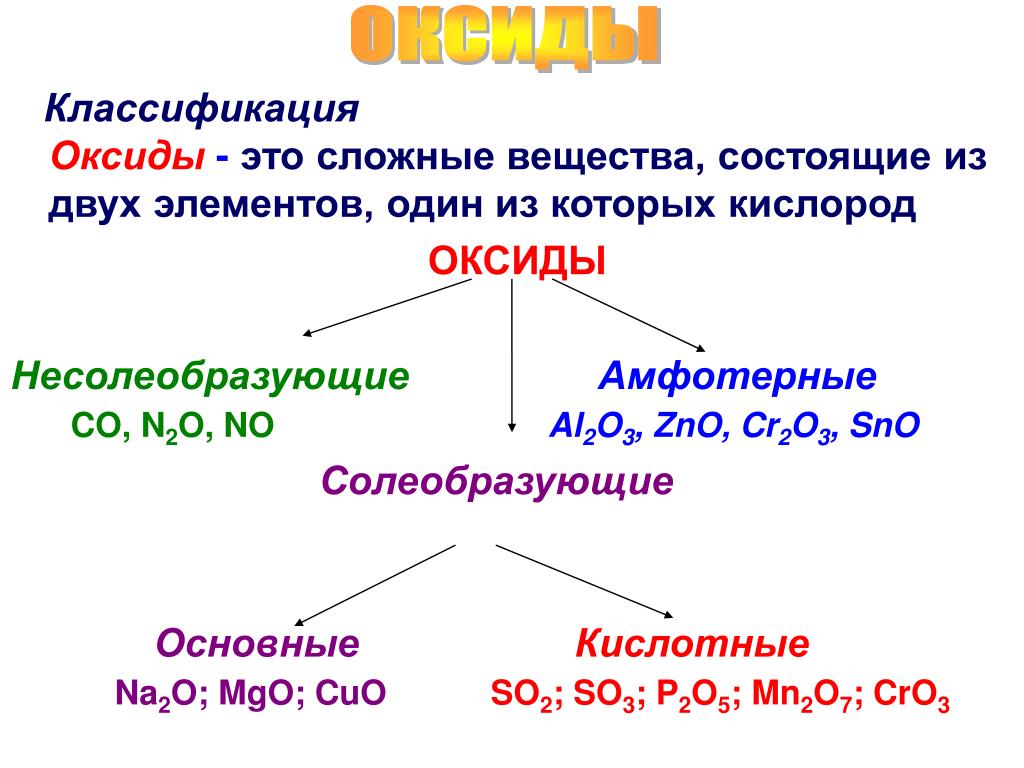
Идеально амфотерным оксидом является вода Н2О, которая диссоциирует с образованием одинаковых количеств ионов водорода (кислотные свойства) и гидроксид-иона (основные свойства). Амфотерные свойства воды ярко проявляются при гидролизе растворенных в ней солей:
Сu2+ + Н2О Сu(ОН)+ + Н+,
СО32- + Н2О НСО3– + ОН–.
ЕГЭ по химии. А 6. Классификация веществ. Ответы.
Многообразие неорганических веществ. Классификация неорганических веществ. Классификация органических веществ. Систематическая номенклатура.
1. Амфотерным и основным оксидами соответственно являются:
1) FeO и CaO
2) А12Оз и К2О
3) CO2 и NO
4) Fe2O3 и CO
2. Какой из элементов может образовать кислотный оксид?
1) стронций 2) марганец 3) кальций 4) магний
3. Только кислотные оксиды расположены в ряду:
Только кислотные оксиды расположены в ряду:
1) СО2, Mn2O7, SO2
2) Na2O, SiO2, Сг2Оз
3) CrO.SQ2, CaO
4) CuO, А12Оз, FeO
4. Какие из приведенных утверждений верны?
А. Основные оксиды — это оксиды, которым соответствуют основания.
Б. Основные оксиды образуют только металлы.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
5. Оксиды металлов со степенью окисления + 6 и выше являются
1) несолеобразующими
2) основными
3) амфотерными
4) кислотными
6. Формулы только кислотных оксидов записаны в ряду:
1) Na2O, MgO, AI2O3
2) ZnO, SnO РЬО2
3) CO2,SiO2,SO2
4) N2O,NO,CO
7. В каком ряду расположено вещество, которое не является кислотой?
1) Н2С2О4, HCN, HSCN
2) H2S,H2SO3,H2SO4
3) HC1O2,HC1O3,HC1O4 .
4) HNO3.HNO2, H3N
8. Только солеобразующие оксиды находятся в ряду:
1) SeO3,SiO2,Cl2O7
2) N2O5,CO, SiO2
3) P2O5,NO,CO2
4) N2O3,Na2O,NO
9. В каком ряду приведены формулы только гидроксидов неметаллов?
1) H2SO4, HC1, HNO3
2) Н3РО4, H2SiO3, HCIO4
3) Н3ВО3, НАlO2, H2S
4) НСlO3, НВг, Н3РО3
10. В каком ряду приведены формулы только основных оксидов?
1) А12О3, MgO, Na2O
2) N2O, CuO, ZnO
3) N2O5, CaO, K2O
4) FeO, Li2O, BaO
11. Кислотным является оксид, формула которого
1) СгО3
2) СаО
3) А12О3
4) NO
12. Только двухосновные кислоты расположены в ряду:
Только двухосновные кислоты расположены в ряду:
1) Н2СОз, Н3РО4, H3AsO3, HNO3
2) НС1O4, H2SeO4, HNO2, H3PO4
3) H2SO3, H2SiO,, H2SO4, H2Cr04
4) HMnO4, H3As04 H2BeO4, H2ZnO2
13. Только кислоты расположены в ряду
1) НNО3, Са(OH)2, NО2
2) КНСОз, Ba(HSO4)2, ZnOHCl
3) HNO2, HNO3, CH3COOH
4) H2S, Na2SO3, SO2
14. Несолеобразующим оксидом является
1} N2O5 2) NO2 3) N2O3 4) NO
15. Амфотерным оксидом является
1) оксид серы (IV)
2) оксид алюминия
3) оксид лития
4) оксид фосфора (V)
16. В перечне солей, формулы которых:
В перечне солей, формулы которых:
Mn(NO3)2, Mg(H2P04)2, A12(SO4)3, (NH4)2HP04, Na2SO3,
(NH4)2S, BaSiO3
число средних солей равно
1) 6 2) 5 3) 3 4) 4
17. Вещество СН3 — О — СН3 относится к
1) алканам
2) сложным эфирам
3) спиртам
4) простым эфирам
18. В перечне солей, формулы которых:
Ag2CO3, NaHS, Cu(NO3)2, Fe2(SO4)3, Ca(HCO3)2, KH2PO4, KMnO4, число кислых солей равно
1) 5 2) 2 3) 3 4) 4
19. Аминокислотой является
1) анилин
2) стирол
3) глицин
4) валериановая кислота
20. К кислым солям относится
К кислым солям относится
1) (NH4)2SO4 2) Fe(OH)SO4 3) KHSO4 4) HCOONa
21. К амфотерньм оксидам не относится
1) А12O3 2) ВеО 3) FeO 4) ZnO
22. Формулы кислотного оксида, кислоты и соли соответственно записаны в ряду:
1} CaO, HC1, СаСl2,
2) SO2, H2S, NaHSO4
3) SO2, A12(SO4)3, HNO3
4) ZnO, Zn(OH)2, H2S
23. Формулы кислоты, основания и основного оксида последовательно указаны в ряду:
1) Na2SiO3, КОН, К2O
2} Са(ОН)2, H2S, СаО
3) HF, Mg(OH)2, ВаО
4) H2S04, Ва(ОН)г, SiO2
24. Амфотерными соединениями являются
1) глюкоза и соляная кислота
2) бутанол-1 и гидроксид натрия
3) аминокислота и гидроксид цинка
4) муравьиная кислота и серная кислота
25. Амфотерным оксидом является
Амфотерным оксидом является
I) СаО 2) СгО3 3) FeO 4) Сr2О3
26. Какой из элементов может образовать кислотный оксид?
1)стронций
2)марганец
3)кальций
4)магний
| 27.Кислотой является |
1) NaH 2) Sih5 3) HI 4) NH3
28. Солью является
1) СаН2 2) РС1з 3) [CНзNНз]С1 4) СНзOH
29. Амфотерен оксид
1) бора 2) бериллия 3) цезия 4) кремния
30. Несолеобразующим является оксид
1) азота(I) 2) хрома(II) 3) хлора(III) 4) кремния(IV)
Ответы: 1-2, 2-2, 3-1, 4-3, 5-4, 6-3, 7-4, 8-1, 9-2, 10-4, 11-1, 12-3,
13-3, 14-4, 15-2, 16-2, 17-4, 18-3, 19-3, 20-3, 21-3, 22-2, 23-3, 24-3, 24-3, 25-4, 26-2, 27-3, 28-3, 29-2, 30-1.
Амфотерные металлы, что это в химии
Амфотерные тела – это такие вещества, которые напоминают своим строением, характеристиками металлические элементы. К тому же им свойственна и химическая двойственность.
Амфотерные тела – это не металлы, а их формы: оксиды, соли и т. д. Ряд оксидов может сочетать в себе 2 свойства и при определенных условиях проявлять параметры как кислот, так и щелочей.
Известными не понаслышке амфотерными материалами является алюминий, хром, цинк и т. д.
Впервые сам термин «амфотерность» появился в начале 19 столетия. На тот период химические компоненты классифицировали на основании их похожих свойств, которые можно наблюдать во время протекания реакций.
Амфотерные металлы: особенности, виды
Перечень амфотерных металлов немалый, причем далеко не все из них являются чистыми амфотерными, а лишь условными.
Вещества все обозначены в таблице Менделеева под определенными порядковыми номерами.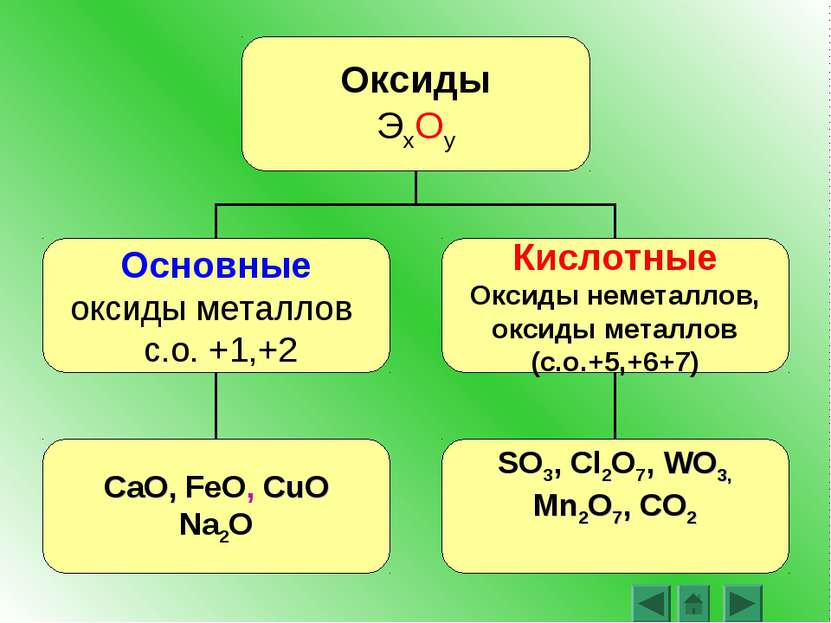 Так, железо, бериллий, хром и стронций считаются основными аморфными элементами. Также типичным и распространенным в природе представителем является алюминий.
Так, железо, бериллий, хром и стронций считаются основными аморфными элементами. Также типичным и распространенным в природе представителем является алюминий.
Металл алюминий повсеместно применяется в быту и промышленности в самых различных областях. Его используют для изготовления фюзеляжей самолетов, кухонной посуды, автомобильных кузовов, электрических приборов, электронной техники, приборов для тепловых сетей. Алюминий отличается от других металлов тем, что всегда остается химически активным. На поверхности стабильно располагается оксидная пленка, которая защищает материал от окисления. Благодаря этому при нормальных условиях и возникновении реакций металл с восстановительным веществом. Алюминий вступает в реакцию с кислородом, если предварительно был разделен на более мелкие фракции. Также для такой манипуляции потребуются повышенные температуры. Примечательно, что сама реакция продуцирует уйму тепловой энергии. Если повысить температуру до 200 ºC, то прореагировать алюминий может и с серой. При смешивании с различными металлами алюминий может давать различные функциональные сплавы с получением дополнительных свойств.
При смешивании с различными металлами алюминий может давать различные функциональные сплавы с получением дополнительных свойств.
Не при всех условиях вещество вступает с реакцию с водородом.
Еще один типичный представитель амфотерных металлов – железо, который располагается под номером 26 в Таблице и находится между марганцем и кобальтом.
Железо считается одним из самых доступных элементов, залежи которого расположены в земной коре. Он одновременно является компонентом бело-серебристого цвета с хорошей ковкостью при высоких температурах. В то же время вещество может быть коррозировать при сильном нагревании. А в случае помещения его в среду чистого кислорода можно ожидать воспламенения и даже перегорания железа. Также, находясь на открытом воздухе, железо под воздействием высокой влажности начинает стремительно окисляться и даже ржаветь. А в процессе горения в массе с кислородом железо дает определенную окалину – это и есть его оксид.
Свойства амфотерных веществ
Главные характеристики этих веществ заключены в самом понятии амфотерности. Так, в своем обычном состоянии при подходящих условиях внешней среды большинство металлов являются твердыми веществами. При этом ни один металл не растворим в обычной воде. А щелочные же основания могут выделяться только после начала некоторых химических реакций. И тогда в процессе соли в составе метала начинают реагировать. Необходимо обратить внимание, что правила безопасности требуют повышенной осторожности во время наблюдения за такими реакциями.
Так, в своем обычном состоянии при подходящих условиях внешней среды большинство металлов являются твердыми веществами. При этом ни один металл не растворим в обычной воде. А щелочные же основания могут выделяться только после начала некоторых химических реакций. И тогда в процессе соли в составе метала начинают реагировать. Необходимо обратить внимание, что правила безопасности требуют повышенной осторожности во время наблюдения за такими реакциями.
В процессе соединения амфотерных материалов с кислотными реагентами или оксидами они показывают химическую реакцию, характерную для оснований. В случае, когда металлы реагируют с основаниями, регистрируются, наоборот кислотные характеристики.
Если амфотерные гидроксиды подвергнуть нагреванию, то в результате они распадутся на оксид и воду.
Отметим, что амфотерные материалы обладают самыми различными свойствами, которые изучаются научными светилами до сих пор. Свойства также можно разобрать, сравнивая их с характеристиками обычных материалов. Так, многие металлы демонстрируют малый потенциал ионизации, что наделяет их свойствами восстановителя во время реакции.
Так, многие металлы демонстрируют малый потенциал ионизации, что наделяет их свойствами восстановителя во время реакции.
Амфотерные тела демонстрируют сразу 2 свойства: окислительное и восстановительное. При этом некоторые соединения имеют отрицательный уровень окисления.
Все металлы, представленные в таблице Менделеева, образуют основные оксиды и гидроксиды.
Интересный момент – металлы могут окисляться далеко не со всеми кислотами в реакциях. Само окисление может не давать взаимодействие с азотной кислотой.
Простые амфотерные материалы имеют различную структуру и характеристики.
Некоторые вещества имеют такие характеристики, что их принадлежность к определенному классу можно выявить даже визуально. Так, мы сразу понимаем, что медь и алюминий – это металл.
Неметалл и металл: в чем же разница
Известно, что металлы выделяют электроны со своего внешнего электронного поля (облака). В свою очередь неметаллы притягивают такие электроны.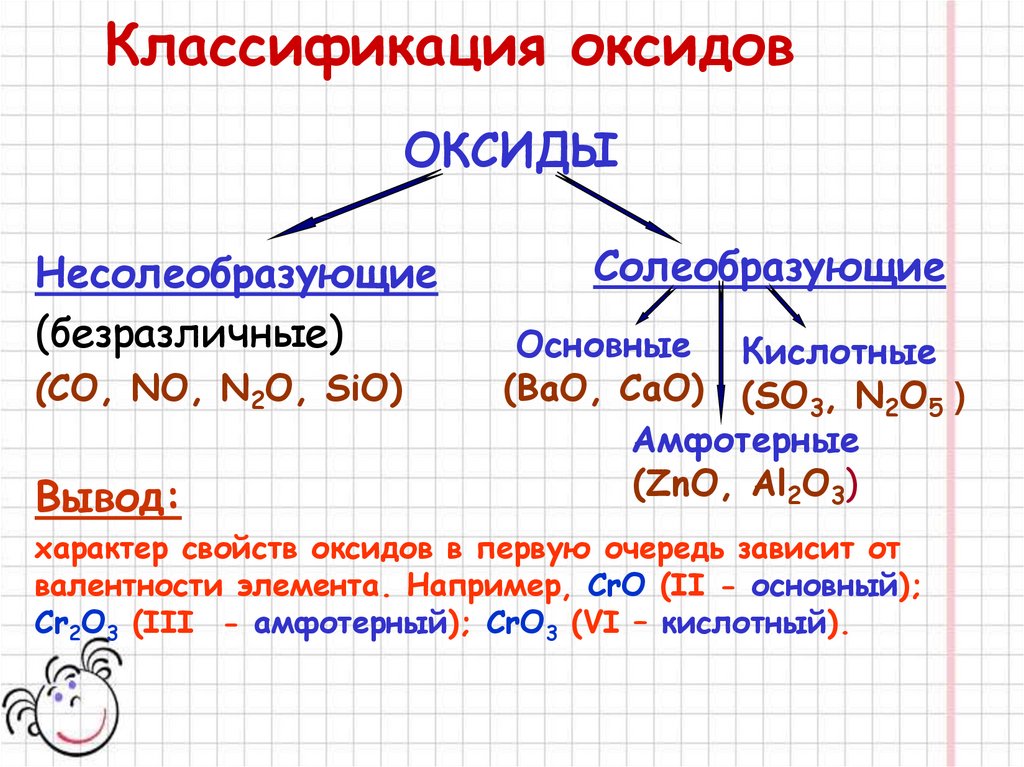
Также металлы хорошо проводят электроток и тепло, в отличие от неметаллов, полностью лишенных таких свойств.
Основания амфотерных маметиралов
При располагающих условиях основания нерастворимы в воде, можно сказать, являются довольно слабыми электролитами. Образуются они в результате химической реакции солей металла и щелочной жидкости. Такая химическая реакция опасна для лаборанта, поэтому для получения гидроксидов необходимо вводить едкие вещества осторожно, капля за каплей.
Амфотерные материалы реагируют с кислотами в роли оснований. В случае когда гидроксид цинка реагирует с соляной кислотой, то на выходе получится хлорид цинка. При реакции с основаниями материалы, напротив, выступают кислотами.
Физические и химические свойства оксидов
Физические и химические свойства оксидов очень отличаются. При комнатной температуре большинство оксидов являются твердыми веществами, например, меди (II) оксид CuO черного цвета, кальций оксид CaO белого цвета, хром (III) оксид Cr2O3 темно-зеленого цвета.
Некоторые оксиды являются жидкостями, например, водород оксид (вода) h3O и Cl2O7 являются бесцветными жидкостями, а некоторые — газообразными веществами, например карбон (IV) оксид CO2 является газом без цвета, а азот (IV) оксид NO2 являются бурым газом.
Некоторые оксиды являются веществами с молекулярным строением, другие имеют ионную строение.
Основные и кислотные оксиды проявляют разные свойства. Основные оксиды при нагревании могут вступать в реакции с кислотными и амфотерными оксидами, с кислотами.
С водой непосредственно реагируют оксиды щелочных металлов (оксиды лития, натрия, калия, рубидия и цезия) и окислы щелочноземельных металлов (оксиды кальция, стронция и бария).
Рассмотрим примеры уравнений типовых химических реакций, которые подтверждают указанные свойства основных оксидов.
1. Взаимодействие основного оксида с кислотным оксидом с образованием соли:
CaO + SiO2 CaSiO3
2. Взаимодействие основного оксида с амфотерными оксидом с образованием соли:
Na2O + Al2O3 2NaAlO2
3. Взаимодействие основного оксида с водой с образованием основания:
Взаимодействие основного оксида с водой с образованием основания:
BaO + h3O = Ba (OH) 2
4. Взаимодействие основного оксида с кислотой с образованием соли и воды:
MgO + 2HCl = MgCl2 + h3O
Кислотные оксиды могут вступать в реакции с основными и амфотерными оксидами, с растворимыми в воде основаниями (щелочами). Многие кислотных оксидов взаимодействуют с водой (исключением является кремний (IV) оксид SiO2.
Рассмотрим примеры уравнений типовых химических реакций, которые подтверждают указанные свойства кислотных оксидов.
1. Взаимодействие кислотного оксида с основным оксидом с образованием соли
CO2 + Na2O = Na2CO3
2. Взаимодействие кислотного оксида с амфотерными оксидом с образованием соли
SO3 + ZnO = ZnSO4
3. Взаимодействие кислотного оксида с водой с образованием кислоты:
P2O5 + 3h3O = 2h4PO4
4. Взаимодействие кислотного оксида со щелочью с образованием соли и воды:
SO2 + 2KOH = K2SO3 + h3O
Амфотерными оксидам присущи свойства как основных, так и кислотных оксидов. То есть они могут реагировать как с кислотными, так и с основными оксидами с образованием солей.
То есть они могут реагировать как с кислотными, так и с основными оксидами с образованием солей.
Кроме того, амфотерные оксиды могут взаимодействовать как с кислотами, так и со щелочами с образованием солей и воды.
Например:
ZnO + h3SO4 = ZnSO4 + h3O
Al2O3 + 2KOH 2KAlO2 + h3O
ЕГЭ по химии. А 6. Классификация веществ. Ответы.
Многообразие неорганических веществ. Классификация неорганических веществ. Классификация потенциальных веществ. Систематическая номенклатура.
1. Амфотерным и основным оксидами соответственно являются:
1) FeO и CaO
2) А1 2 Оз и К 2 О
3) CO 2 и NO
4) Fe 2 O 3 и CO
2.Какой из элементов может образовать кислотный оксид?
1) стронций 2) марганец 3) кальций 4) магний
3. Только кислотные оксиды расположены в ряду:
1) СО 2 , Mn 2 O 7 , SO 2
2) Na 2 O, SiO 2 , Сг 2 Оз
3) CrO. SQ 2 , CaO
SQ 2 , CaO
4) CuO, А1 2 Оз, FeO
4. Какие из приведенных утверждений верны?
А.Основные оксиды — это оксиды, соответствующие основания.
Б. Основные оксиды образуют только металлы.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
5. Оксиды металлов со степенью окисления + 6 и выше являются
1) несолеобразующими
2) с
3) амфотерными
4) кислотными
6. Формулы только кислотных оксидов записаны в ряду:
1) Na 2 O, MgO, AI 2 O 3
2) ZnO, SnO РЬО 2
3) CO 2 , SiO 2 , SO 2
4) N 2 O, NO, CO
7. В каком ряду расположено вещество, которое не является кислотой?
1) Н 2 С 2 О 4 , HCN, HSCN
2) H 2 S, H 2 SO 3 , H 2 SO 4
3) HC1O 2 , HC1O 3 , HC1O 4 .
4) HNO 3 .HNO 2 , H 3 N
8. Только солеобразующие оксиды находятся в ряду:
1) SeO 3 , SiO 2 , Cl 2 O 7
2) N 2 O 5 , CO, SiO 2
3) P 2 O 5 , NO, CO 2
4) N 2 O 3 , Na 2 O, NO
9.В каком ряду приведенных формулы только гидроксидов неметаллов?
1) H 2 SO 4 , HC1, HNO 3
2) Н 3 РО 4 , H 2 SiO 3 , HCIO 4
3) Н 3 ВО 3 , НАlO 2 , H 2 S
4) НСlO 3 , НВг, Н 3 РО 3
10. В каком ряду приведенных формулы только основных оксидов?
1) А1 2 О 3 , MgO, Na 2 O
2) N 2 O, CuO, ZnO
3) N 2 O 5 , CaO, K 2 O
4) FeO, Li 2 O, BaO
11. Кислотным является оксид, формула которого
Кислотным является оксид, формула которого
1) СгО 3
2) СаО
3) А1 2 О 3
4) НЕТ
12. Только двухосновные ключи расположены в ряду:
1) Н 2 СОз, Н 3 РО 4 , H 3 AsO 3 , HNO 3
2) НС1O 4 , H 2 SeO 4 , HNO 2 , H 3 PO 4
3) H 2 SO 3 , H 2 SiO« H 2 SO 4 , H 2 Cr0 4
4) HMnO 4 , H 3 As0 4 H 2 BeO 4 , H 2 ZnO 2
13.Только кислоты расположены в ряду
1) НNО 3 , Са (OH) 2 , NО 2
2) КНСОз, Ba (HSO 4 ) 2 , ZnOHCl
3) HNO 2 , HNO 3 , CH 3 COOH
4) H 2 S, Na 2 SO 3, SO 2
14. Несолеобразующим оксидом является
Несолеобразующим оксидом является
1} N 2 O 5 2) НЕТ 2 3) N 2 O 3 4) НЕТ
15.Амфотерным оксидом является
1) оксид серы (IV)
2) оксид алюминия
3) оксид лития
4) оксид фосфора (V)
16. В перечне солей, формулы которых:
Mn (NO 3 ) 2 , Mg (H 2 P0 4 ) 2 , A1 2 (SO 4 ) 3 , (NH 4 ) 2 HP0 4 , Na 2 SO 3 ,
(NH 4 ) 2 S, BaSiO 3
число средних солей равно
1) 6 2) 5 3) 3 4) 4
17.Вещество СН 3 — О — СН 3 относится к
1) алканам
2) сложным эфирам
3) спиртам
4) простого эфирам
18. В перечне солей, формулы которых:
Ag 2 CO 3 , NaHS, Cu (NO 3 ) 2 , Fe 2 (SO 4 ) 3 , Ca (HCO 3 ) 2 , KH 2 PO 4 , KMnO 4 , число кислых солей равно
1) 5 2) 2 3) 3 4) 4
19. Аминокислотой является
Аминокислотой является
1) анилин
2) стирол
3) глицин
4) валериановая кислота
20. К кислым солям относится
1) (NH 4 ) 2 SO 4 2) Fe (OH) SO 4 3) KHSO 4 4) HCOONa
21. К амфотерньм оксидам не относится
1) А1 2 O 3 2) ВеО 3) FeO 4) ZnO
22. Формулы кислотного оксида, кислоты и соли соответственно записаны в ряду:
1} CaO, HC1, СаСl 2 ,
2) SO 2 , H 2 S, NaHSO 4
3) SO 2 , A1 2 (SO 4 ) 3 , HNO 3
4) ZnO, Zn (OH) 2 , H 2 S
23.Формулы кислоты, основания и основного оксида последовательно указаны в ряду:
1) Na 2 SiO 3 , КОН, К 2 O
2} Са (ОН) 2 , H 2 S, СаО
3) HF, Mg (OH) 2 , ВаО
4) H 2 S0 4 , Ва (ОН) г , SiO 2
24. Амфотерными соединениями являются
Амфотерными соединениями являются
1) глюкоза и соляная кислота
2) бутанол-1 и гидроксид натрия
3) аминокислота и гидроксид цинка
4) муравьиная кислота и серная кислота
25.Амфотерным оксидом является
I) СаО 2) СгО 3 3) FeO 4) Сr 2 О 3
26. Какой из элементов может образовать кислотный оксид?
1) стронций
2) марганец
3) кальций
4) магний
| 27.Кислотой является | |
1) NaH 2) Sih5 3) HI 4) NH 3
28.Солью является
1) СаН 2 2) РС1з 3) [CНзNНз] С1 4) СНзOH
29. Амфотерен оксид
1) бора 2) бериллия 3) цезия 4) кремния
30. Несолеобразующим является оксид
Несолеобразующим является оксид
1) азот (I) 2) хрома (II) 3) хлора (III) 4) кремния (IV)
Ответы: 1-2, 2-2, 3-1, 4-3, 5-4, 6-3, 7-4, 8-1, 9-2, 10-4, 11-1, 12 -3,
13-3, 14-4, 15-2, 16-2, 17-4, 18-3, 19-3, 20-3, 21-3, 22-2, 23-3, 24-3, 24 -3, 25-4, 26-2, 27-3, 28-3, 29-2, 30-1.
Подготовка к ЦТ и ЕГЭ по химии
Классификация и свойства оксидов
Как вы уже знаете, все вещества делятся на простые и сложные. В свою очередь сложные вещества делятся на четыре класса: оксиды, основания, кислоты и соль. Каждое из неорганических соединений так или иначе является представителем какого-либо одного класса веществ, хотя есть и исключение.Так, например, пероксид бария BaO 2 хотя и относится к классу оксидов, проявляет свойства солей.
Оксидами же называются сложные вещества, состоящие из двух элементов, один из которых кислород, т.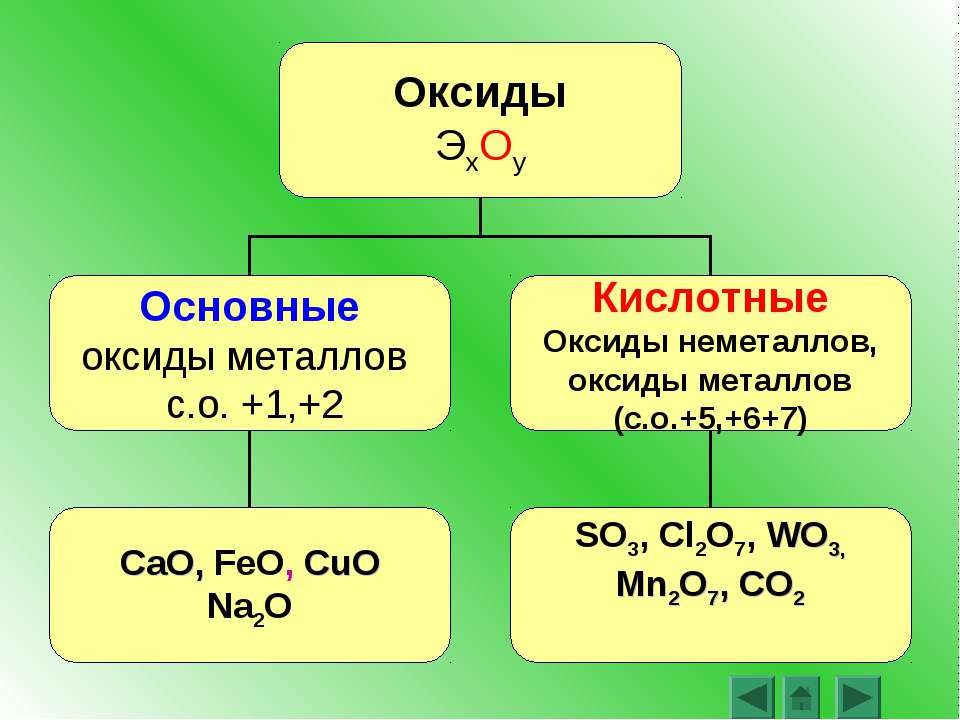 е. оксид — это соединение элемента с кислородом.
е. оксид — это соединение элемента с кислородом.
Название оксидов образует от названия элемента, входящего в состав оксида. Например, BaO — оксид бария. Если образующий оксид элемент имеет переменную валентность, то после названия элемента в скобках указывается его валентность римской цифрой.Например, FeO — оксид железа (I), Fe 2 О 3 — оксид железа (III).
Элементы, обладающие постоянной валентностью, образуют только основные, кислотные или амфотерные оксиды. Элементы с образующей валентностью могут образовывать различные оксиды.
Все оксиды делятся на солеобразующие и несолеобразующие. Немногочисленные несолеобразующие оксиды не взаимодействуют ни с кислотами, ни с основаниями. К ним относятся оксид азота N 2 O (I), оксид азота NO (II), оксид кремния (II) и оксид углерода (II).
По своим химическим свойствам оксиды делятся на основные, кислотные и амфотерные.
Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами:
CuO + H 2 SO 4 = CuSO 4 + H 2 O
Растворимые в воде основные оксиды (оксиды металлов I и IIA группы из периодической системы) вступают в реакцию с водой, образуя основания:
CaO + H 2 O = Ca (OH) 2
Большинство основных оксидов с водой взаимодействуют.
Основные оксиды реагируют с кислотными оксидами, образуя соли:
Na 2 O + SO 3 = Na 2 SO 4
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или вводящими оксидами. Кислотные оксиды также называются ангидридами кислот. Кислотными являются оксиды типичных неметаллов, а также оксиды ряда металлов в высших степенях окисления (B 2 O 3 ; Mn 2 O 7 ).
Многие кислотные оксиды соединяются с водой, образуя кислоты:
.N 2 O 3 + H 2 O = 2HNO 2
SO 3 + H 2 O = H 2 SO 4
Не все ангидриды реагируют с водой.
Кислотные оксиды реагируют с оксидами образование соли:
CO 2 + CaO = CaCO 3
Кислотные оксиды взаимодействуют с основаниями, образуя соль и воду:
CO 2 + Ba (ОН) 2 = BaCO 3 + H 2 O
Амфотерными называются оксиды, которые образуют соли при взаимодействии как с кислотами, так и с основаниями. Соединения этих оксидов могут иметь кислотные и основные свойства одновременно водой, например — Al 2 O 3 , Cr 2 O 3 , MnO 2 ; Fe 2 O 3 ZnO. Например, амфотерный характер оксида цинка проявляется при взаимодействии его как с соляной кислотой, так и с гидроксидом:
Соединения этих оксидов могут иметь кислотные и основные свойства одновременно водой, например — Al 2 O 3 , Cr 2 O 3 , MnO 2 ; Fe 2 O 3 ZnO. Например, амфотерный характер оксида цинка проявляется при взаимодействии его как с соляной кислотой, так и с гидроксидом:
ZnO + 2HCl = ZnCl 2 + H 2 O
ZnO + 2NaOH = Na 2 ZnO 2 + H 2 O (при нагревании)
ZnO + 2NaOH + H 2 O = Na 2 [Zn (OH) 4 ] (в растворе)
Так как далеко не все амфотерные оксиды растворимы в воде, доказать амфотерность оксидов заметно сложнее.Например, оксид алюминия (III) в реакции сплава его с дисатом калия проявляет основные свойства, а при сплавлении с гидроксидами — кислотные:
Al 2 O 3 + 3K 2 S 2 O 7 = 3K 2 SO 4 + A1 2 (SO 4 ) 3
Al 2 O 3 + 2KOH = 2KAlO 2 + H 2 O
У различных амфотерных оксидов двойственность может быть выражена в различной степени. Например, оксид цинка одинаково легко растворяется и в кислотах, и в щелочах, а оксид железа (III) — Fe 2 O 3 — обладает используемыми свойствами.
Например, оксид цинка одинаково легко растворяется и в кислотах, и в щелочах, а оксид железа (III) — Fe 2 O 3 — обладает используемыми свойствами.
Способы получения оксидов из простых веществ — это либо прямая реакция элемента с кислородом:
2Ca + O 2 = 2CaO
либо разложение сложных веществ:
а) оксидов
4CrO 3 = 2Cr 2 O 3 + 3O 2
б) гидроксидов
Ca (OH) 2 = CaO + H 2 O
в) кислот
H 2 CO 3 = H 2 O + CO 2
г) солей
CaCO 3 = CaO + CO 2
А также взаимодействие кислот — окислителей с металлами и неметаллами:
Cu + 4HNO 3 ( конц ) = Cu (NO 3 ) 2 + 2NO 2 + 2H 2 O
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
Самоподготовка к ЕГЭ и ЦТ по химии» src=»https://www.youtube.com/embed/fGY__5hOLZ8?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Самоподготовка к ЕГЭ и ЦТ по химии» src=»https://www.youtube.com/embed/MdQgO1HCWAY?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
И выполнить задание из ЦТ и ЕГЭ на эту тему вы можете здесь
А вы можете получить доступ ко всем видео-урокам, задания также реального ЕГЭ, ЦТ и РТ с подробными видео-объяснения, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»6.1 Важнейшие классы неорганических веществ
Раздел 6. Важнейшие классы неорганических веществ, их свойства и способы получение 6.1. Оксиды и основания, их свойства и способы Оксидами называют сложным веществом, состоящим из двух элементов, одним из которых является кислород, находящийся в степени окисления -2. Примерами оксидов являются Al 2 O 3 — оксид алюминия, SiO 2 — оксид кремния, NO — оксид азота (II).Согласно международной номенклатуре
рассматриваемые соединения называют оксидами
с указанием степени окисления элемента, если этот элемент образует несколько
оксидов . При написании названия степени окисления обозначается римскими
цифрами в скобках, например, FeO — оксид железа (II), Fe 2 O 3 — оксид железа (III), SO 2 — оксид серы (IV), SO 3 — оксид серы (VI) . Очень часто в
литературе встречаются и тривиальные названия оксидов — сурик (Pb 3 O 4 ),
веселящий газ (N 2 O), железная окалина (Fe 3 O 4 )
и многие др.Оксиды подразделяются на солеобразующие и
несолеобразующие . Солеобразующие оксиды принято делить на основные, амфотерные и
кислотные . От оксидов следует отличать пероксиды , например H 2 O 2 ,
Na 2 O 2 и надперокиды КО 2 , СsО 2 .
Примерами оксидов являются Al 2 O 3 — оксид алюминия, SiO 2 — оксид кремния, NO — оксид азота (II).Согласно международной номенклатуре
рассматриваемые соединения называют оксидами
с указанием степени окисления элемента, если этот элемент образует несколько
оксидов . При написании названия степени окисления обозначается римскими
цифрами в скобках, например, FeO — оксид железа (II), Fe 2 O 3 — оксид железа (III), SO 2 — оксид серы (IV), SO 3 — оксид серы (VI) . Очень часто в
литературе встречаются и тривиальные названия оксидов — сурик (Pb 3 O 4 ),
веселящий газ (N 2 O), железная окалина (Fe 3 O 4 )
и многие др.Оксиды подразделяются на солеобразующие и
несолеобразующие . Солеобразующие оксиды принято делить на основные, амфотерные и
кислотные . От оксидов следует отличать пероксиды , например H 2 O 2 ,
Na 2 O 2 и надперокиды КО 2 , СsО 2 . В
этих соединенийх степень окисления кислорода по абсолютной величине меньше двух
и может быть дробной. Основные оксиды Основные оксиды образуются только
металлами, им в гидратов соответствуют основания.Например, CaO, FeO,
CuO представляют собой оксидами, поскольку им соответствуют основания Ca (OH) 2 ,
Fe (OH) 2 , Cu (OH) 2 . Получение основных оксидов Основные оксиды получаются: ·
окислением
металлов кислородом: при окислении щелочных металлов кислородом
только ли образует Li 2 O. Натрий дает пероксид (Na 2 O 2 ),
остальные — надпероксиды (КО 2 ,
RbO 2 , CsO 2 ).·
разложением
при нагревании кислородных соединений: гидроксидов, нитратов, карбонатов: 2
Fe (OH) 3 → Fe 2 O 3 + 3 H 2 O, 2 Cu (NO 3 ) 2 → 2 CuO + 4 NO 2 + O 2 , CaCO 3 → CaO + CO 2 (кроме карбонатов щелочных металлов).
В
этих соединенийх степень окисления кислорода по абсолютной величине меньше двух
и может быть дробной. Основные оксиды Основные оксиды образуются только
металлами, им в гидратов соответствуют основания.Например, CaO, FeO,
CuO представляют собой оксидами, поскольку им соответствуют основания Ca (OH) 2 ,
Fe (OH) 2 , Cu (OH) 2 . Получение основных оксидов Основные оксиды получаются: ·
окислением
металлов кислородом: при окислении щелочных металлов кислородом
только ли образует Li 2 O. Натрий дает пероксид (Na 2 O 2 ),
остальные — надпероксиды (КО 2 ,
RbO 2 , CsO 2 ).·
разложением
при нагревании кислородных соединений: гидроксидов, нитратов, карбонатов: 2
Fe (OH) 3 → Fe 2 O 3 + 3 H 2 O, 2 Cu (NO 3 ) 2 → 2 CuO + 4 NO 2 + O 2 , CaCO 3 → CaO + CO 2 (кроме карбонатов щелочных металлов). ·
обжигом
сульфидов: 2 ZnS + 3 O 2 → 2 ZnO + 2 SO 2 . Химические свойства основных оксидов Оксиды щелочных и щелочноземельных металлов непосредственно
реагируют с водой: Na 2 O + H 2 O → 2 NaOH, Основные оксиды взаимодействуют с кислотами, образуя соль и воду,
например: FeO + 2 HCl → FeCl 2 + H 2 O; Основные оксиды реагируют также с кислотными оксидами: Основные оксиды могут также вступать в
окислительно – восстановительные реакции: Fe 2 O 3 + 3 C → 2 Fe + 3 CO, Кислотные оксиды Кислотные оксиды образуются неметаллами
(SO 2 , SO 3 , CO 2 , P 4 O 10 и т.д.) или переходными металлами,
находящимися окисления в высоких степенях (например, CrO 3 , Mn 2 O 7 ). Кислотные оксиды получают теми же
способами, что и основные оксиды.
·
обжигом
сульфидов: 2 ZnS + 3 O 2 → 2 ZnO + 2 SO 2 . Химические свойства основных оксидов Оксиды щелочных и щелочноземельных металлов непосредственно
реагируют с водой: Na 2 O + H 2 O → 2 NaOH, Основные оксиды взаимодействуют с кислотами, образуя соль и воду,
например: FeO + 2 HCl → FeCl 2 + H 2 O; Основные оксиды реагируют также с кислотными оксидами: Основные оксиды могут также вступать в
окислительно – восстановительные реакции: Fe 2 O 3 + 3 C → 2 Fe + 3 CO, Кислотные оксиды Кислотные оксиды образуются неметаллами
(SO 2 , SO 3 , CO 2 , P 4 O 10 и т.д.) или переходными металлами,
находящимися окисления в высоких степенях (например, CrO 3 , Mn 2 O 7 ). Кислотные оксиды получают теми же
способами, что и основные оксиды. Например: 4 FeS 2 + 11O 2 → 2 Fe 2 O 3 + 8 SO 2 , Zn 2 (OH) 2 CO 3 → 2 ZnO + CO 2 + H 2 O, а также
разложением кислот: H 2 SiO 3 → SiO 2 + H 2 O. Химические
свойства кислотных оксидов 1. Некоторые кислотные оксиды образуют кислоты при взаимодействии
с водой: N 2 O 5 + H 2 O → 2 HNO 3 . Некоторые кислотные оксиды являются ангидридами кислот. Например, SO 3 — ангидрид серной кислоты, SO 2 — ангидрид сернистой кислоты, CO 2 — ангидрид угольной кислоты, P 4 O 10 является ангидридом трех кислот
(метафосфорной НРО 3 , ортофосфорной Н 3 РО 4 ,
пирофосфорной Н 4 Р 2 О 7 ).
Например: 4 FeS 2 + 11O 2 → 2 Fe 2 O 3 + 8 SO 2 , Zn 2 (OH) 2 CO 3 → 2 ZnO + CO 2 + H 2 O, а также
разложением кислот: H 2 SiO 3 → SiO 2 + H 2 O. Химические
свойства кислотных оксидов 1. Некоторые кислотные оксиды образуют кислоты при взаимодействии
с водой: N 2 O 5 + H 2 O → 2 HNO 3 . Некоторые кислотные оксиды являются ангидридами кислот. Например, SO 3 — ангидрид серной кислоты, SO 2 — ангидрид сернистой кислоты, CO 2 — ангидрид угольной кислоты, P 4 O 10 является ангидридом трех кислот
(метафосфорной НРО 3 , ортофосфорной Н 3 РО 4 ,
пирофосфорной Н 4 Р 2 О 7 ). 2. Кислотные оксиды взаимодействуют с контактами, образуя соли: SO 3 + СаO → CaSO 4 . 3. Кислотные оксиды взаимодействуют с основаниями, образуя соль и
воду: CO 2 + 2 NaOH → Na 2 CO 3 + H 2 O. 4. Как и другие типы оксидов, кислотные оксиды вступать в
окислительно – восстановительные реакции: CO 2 + 2 Mg → C + 2 MgO, SO 2 + 2 H 2 S → 3 S + 2H 2 O. Амфотерные оксиды Амфотерные оксиды обладают двойственными
свойства, т.е. в зависимости от условий проявляют основные или кислотные
свойства. К ним относиться: ZnO, Al 2 O 3 , BeO, Cr 2 O 3 и т. д. Амфотерные оксиды с водой не
взаимодействуют, но реагируют и с кислотами, и с основаниями. Например: ZnO + H 2 SO 4 → ZnSO 4 + H 2 , ZnO + 2 NaOH + H 2 O → Na 2 [Zn (OH) 4 ].
2. Кислотные оксиды взаимодействуют с контактами, образуя соли: SO 3 + СаO → CaSO 4 . 3. Кислотные оксиды взаимодействуют с основаниями, образуя соль и
воду: CO 2 + 2 NaOH → Na 2 CO 3 + H 2 O. 4. Как и другие типы оксидов, кислотные оксиды вступать в
окислительно – восстановительные реакции: CO 2 + 2 Mg → C + 2 MgO, SO 2 + 2 H 2 S → 3 S + 2H 2 O. Амфотерные оксиды Амфотерные оксиды обладают двойственными
свойства, т.е. в зависимости от условий проявляют основные или кислотные
свойства. К ним относиться: ZnO, Al 2 O 3 , BeO, Cr 2 O 3 и т. д. Амфотерные оксиды с водой не
взаимодействуют, но реагируют и с кислотами, и с основаниями. Например: ZnO + H 2 SO 4 → ZnSO 4 + H 2 , ZnO + 2 NaOH + H 2 O → Na 2 [Zn (OH) 4 ]. Амфотерные оксиды могут взаимодействовать
как с воздействием, так и с кислотными оксидами: Амфотерные оксиды при сплавлении со
щелочами или карбонатами щелочных металлов образуют соль: ZnO + 2
NaOH → Na 2 ZnO 2 + H 2 O, Al 2 O 3 + 2 NaOH → 2 NaAlO 2 + H 2 O.Al 2 O 3 + Na 2 CO 3 → 2 NaAlO 2 + CO 2 Физические свойства оксидов очень
разнообразны. Все основные и амфотерные оксиды, а также некоторые кислотные
оксиды (SiO 2 , Р 4 О 10 и др.) являются твердыми веществами.
Многие кислотные оксиды при обычной температуре газами (SO 2 ,
CO 2 ) или жидкостей (Cl 2 O 7 , Mn 2 O 7 ).Свойства несолеобразующих
оксидов (СО, NO, N 2 O
и др.) будут использоваться в следующих разделах, которые посвящены химии
соответствующих элементов.
Амфотерные оксиды могут взаимодействовать
как с воздействием, так и с кислотными оксидами: Амфотерные оксиды при сплавлении со
щелочами или карбонатами щелочных металлов образуют соль: ZnO + 2
NaOH → Na 2 ZnO 2 + H 2 O, Al 2 O 3 + 2 NaOH → 2 NaAlO 2 + H 2 O.Al 2 O 3 + Na 2 CO 3 → 2 NaAlO 2 + CO 2 Физические свойства оксидов очень
разнообразны. Все основные и амфотерные оксиды, а также некоторые кислотные
оксиды (SiO 2 , Р 4 О 10 и др.) являются твердыми веществами.
Многие кислотные оксиды при обычной температуре газами (SO 2 ,
CO 2 ) или жидкостей (Cl 2 O 7 , Mn 2 O 7 ).Свойства несолеобразующих
оксидов (СО, NO, N 2 O
и др.) будут использоваться в следующих разделах, которые посвящены химии
соответствующих элементов. Следует упомянуть о смешанных оксидах (Pb 2 O 3 ,
Pb 3 O 4 и
др.), в которых один и тот же элемент (Pb) находится в различных степенях
окисления. Эти соединения можно также отнести к солям: Pb +2 Pb +4 O 3 ,
Pb 2 +2 Pb +4 O 2 .Основания
с точки зрения теории электролитической диссоциации являются соединения, при
диссоциации которых в качестве анионов образуются гидроксо-группы ОН — .
Получать не только гидроксиды металлов, но и
некоторые другие вещества, например, NH 3 , молекула которого может
присоединить протон: Номенклатура оснований По номенклатуре основания принято
называть гидроксидами
элементы: NaOH —
гидроксид натрия, CsOH — гидроксид цезия.Если элемент может образовывать несколько
оснований, то в названиях скобках римской цифрой указывается его степень
окисления.
Следует упомянуть о смешанных оксидах (Pb 2 O 3 ,
Pb 3 O 4 и
др.), в которых один и тот же элемент (Pb) находится в различных степенях
окисления. Эти соединения можно также отнести к солям: Pb +2 Pb +4 O 3 ,
Pb 2 +2 Pb +4 O 2 .Основания
с точки зрения теории электролитической диссоциации являются соединения, при
диссоциации которых в качестве анионов образуются гидроксо-группы ОН — .
Получать не только гидроксиды металлов, но и
некоторые другие вещества, например, NH 3 , молекула которого может
присоединить протон: Номенклатура оснований По номенклатуре основания принято
называть гидроксидами
элементы: NaOH —
гидроксид натрия, CsOH — гидроксид цезия.Если элемент может образовывать несколько
оснований, то в названиях скобках римской цифрой указывается его степень
окисления. Например, Fe (OH) 2 —
гидроксид железа (II), Fe (OH) 3 —
гидроксид железа (III). Большинство оснований мало растворимы в
воде. Растворимые в воде основания называются щелочами . Щелочами являются, например,
NaOH, КОН, Ba (OH) 2 . Получение
оснований Общим способом получения оснований является
реакция обмена между солью и щелочью: Cu (NO 3 ) 2 + 2 KOH → Cu (OH) 2 ↓ + 2KNO 3 , Na 2 CO 3 + Ba (OH) 2 → BaCO 3 ↓ + 2 NaOH.Щелочи образуются при взаимодействии
щелочных и щелочноземельных металлов, а также их оксидов с водой: 2 Na +
2 H 2 O → 2 NaOH + H 2 ↓, В промышленности щелочи обычно получают
электролизом водных растворов хлоридов: 2 KCl +
2 H 2 O → 2 KOH + H 2 ↓ + Cl 2 ↓. Свойства
оснований Растворы щелочей изменяют окраску
индикаторов: бесцветный фенолфталеин переходит в малиновый цвет, метилоранж — в
желтый, лакмус — в синий.
Например, Fe (OH) 2 —
гидроксид железа (II), Fe (OH) 3 —
гидроксид железа (III). Большинство оснований мало растворимы в
воде. Растворимые в воде основания называются щелочами . Щелочами являются, например,
NaOH, КОН, Ba (OH) 2 . Получение
оснований Общим способом получения оснований является
реакция обмена между солью и щелочью: Cu (NO 3 ) 2 + 2 KOH → Cu (OH) 2 ↓ + 2KNO 3 , Na 2 CO 3 + Ba (OH) 2 → BaCO 3 ↓ + 2 NaOH.Щелочи образуются при взаимодействии
щелочных и щелочноземельных металлов, а также их оксидов с водой: 2 Na +
2 H 2 O → 2 NaOH + H 2 ↓, В промышленности щелочи обычно получают
электролизом водных растворов хлоридов: 2 KCl +
2 H 2 O → 2 KOH + H 2 ↓ + Cl 2 ↓. Свойства
оснований Растворы щелочей изменяют окраску
индикаторов: бесцветный фенолфталеин переходит в малиновый цвет, метилоранж — в
желтый, лакмус — в синий. Большинство малорастворимых в воде
оснований при нагревании легко разлагаются: Щелочи термически устойчивы и плавятся без
разложения. Исключение составляет гидроксид лития, который также разлагается
при нагревании: Как щелочи, так и нерастворимые основания
могут реагировать с кислотами (реакция нейтрализации): NaOH +
2 HCl → NaCl + H 2 O, 2
Fe (OH) 3 + 3H 2 SO 4 → Fe 2 (SO 4 ) 3 + 6H 2 O.Взаимодействие оснований с кислотными и
амфотерными оксидами рассмотрено в разделе 8.1. Амфотерные гидроксиды взаимодействуют как
с кислотами, так и с основаниями. Например: Al (OH) 3 + 3 HCl → AlCl 3 + H 2 O Al (OH) 3 + 3 NaOH → Na 3 [Al (OH) 6 ] В водных растворах, щелочь,
наряду с [Al (OH) 6 ] 3– , существуют и другие ионы, в
в частности, [Al (OH) 5 ] 2–, [Al (OH) 4 ] — ,
[Al О (OH) 4 ] 3– и
др.
Большинство малорастворимых в воде
оснований при нагревании легко разлагаются: Щелочи термически устойчивы и плавятся без
разложения. Исключение составляет гидроксид лития, который также разлагается
при нагревании: Как щелочи, так и нерастворимые основания
могут реагировать с кислотами (реакция нейтрализации): NaOH +
2 HCl → NaCl + H 2 O, 2
Fe (OH) 3 + 3H 2 SO 4 → Fe 2 (SO 4 ) 3 + 6H 2 O.Взаимодействие оснований с кислотными и
амфотерными оксидами рассмотрено в разделе 8.1. Амфотерные гидроксиды взаимодействуют как
с кислотами, так и с основаниями. Например: Al (OH) 3 + 3 HCl → AlCl 3 + H 2 O Al (OH) 3 + 3 NaOH → Na 3 [Al (OH) 6 ] В водных растворах, щелочь,
наряду с [Al (OH) 6 ] 3– , существуют и другие ионы, в
в частности, [Al (OH) 5 ] 2–, [Al (OH) 4 ] — ,
[Al О (OH) 4 ] 3– и
др. В гидрооксокомплексах алюминия также молекулы Н 2 О,
которые в формулах обычно не указывают. К амфотерным гидроксидам класса Zn (OH) 2 ,
Al (OH) 3 , Cr (OH) 3 , Be (OH) 2 , Pb (OH) 2 и др. В заключение следует отметить способность
щелочей взаимодействовать с некоторыми неметаллами и оксидами: 6 КОН +
3 S → K 2 SO 3 + 2 K 2 S + 3 H 2 O, 6 NaOH
+ 3 Cl 2 → 5 NaCl + NaClO 3 + 3 H 2 O, 2 КОН +
NO 2 → KNO 2 + KNO 3 + H 2 O. 1. Из приведённого перечня
выберите оксиды, назовите их, определите тип.
В гидрооксокомплексах алюминия также молекулы Н 2 О,
которые в формулах обычно не указывают. К амфотерным гидроксидам класса Zn (OH) 2 ,
Al (OH) 3 , Cr (OH) 3 , Be (OH) 2 , Pb (OH) 2 и др. В заключение следует отметить способность
щелочей взаимодействовать с некоторыми неметаллами и оксидами: 6 КОН +
3 S → K 2 SO 3 + 2 K 2 S + 3 H 2 O, 6 NaOH
+ 3 Cl 2 → 5 NaCl + NaClO 3 + 3 H 2 O, 2 КОН +
NO 2 → KNO 2 + KNO 3 + H 2 O. 1. Из приведённого перечня
выберите оксиды, назовите их, определите тип. 1) Na 2 O 2 2) Li 2 O 909 909 909 909 2 O 3 4) FeO 5) P 2 O 5 909 909 CO 2 7) OF 2 8) MgO 2) Оксид лития (основный)
3) Оксид алюминия (амфотерный)
4) Оксид железа (II) (основный)
5) Оксид фосфора (V) (кислотный)
6) Оксид углерода (IV) (кислотный)
8) Оксид магния (основный) __________________________________________________________________ 2.
 С
какими из перечисленных веществ может реагировать а) Li 2 O б) CO 2 в) Al 14 3
С
какими из перечисленных веществ может реагировать а) Li 2 O б) CO 2 в) Al 14 3 1) Na 2 O 2) SO 3 3) H 909 900 9 900 4) NaOH 5) H 2 SO 4 6) Na 2 2 909 900 7) O 2 8) AlCl 3 Li 2 O реагирует с веществами 2,3,5
CO 2 реагирует с веществами 1,3,4
Al 2 O 3 реагирует с веществами 4,5 __________________________________________________________________ 3. Из приведённого перечня выбора основания, назовите их, определите тип.

1) NaOH 2) Li 2 O 3) Ba ( OH 66 ) 909 900 909 9009 900 4) CuSO 4 5) P 2 O 5 6) Al ( OH ) 3 7) HCl 8) C 2 H 65 944 944 1) Гидроксид натрия — однокислотное растворимое основание
3) Гидроксид бария — двухкислотное растворимое основание
6) Гидроксид алюминия — трёхкислотное нерастворимое основание __________________________________________________________________ 4. С любыми из перечисленных веществ может реагировать а) NaOH б) Cu ( OH ) 2
1) Na 2 O ) SO 3 3) H 2 O 4) NaOH 5) H 9909 4 6) Na 2 SO 4 7) HCl 8)
AlCl NaOH реагирует с веществами 2,5,7,8
Cu (OH) 2 реагирует с веществами 5,7 __________________________________________________________________ 5. На 47 г оксида
калия подействовали, содержащим 40 г азотной кислоты. Найдите массу образовавшегося
нитрата калия. Рассчитаем
относительные молекулярные массы интересующих нас веществ: M r (K 2 O) =
2 A r (K) + 1 A r (O) = 2 • 39 + 1 • 16 = 94, M r (HNO 3 ) =
1 A r (H) + 1 A r (N) + 3 A r (O)
= 1 • 1 + 1 • 14 + 3 • 16 = 63, M r (KNO 3 ) =
1 A r (K) + 1 A r (N) + 3 A r (O)
= 1 • 39 + 1 • 14 + 3 • 16 = 101.Для
удобства расчета за х 1 примем массы НNО 3 и найдем, какое из веществ, вступивших
в реакцию, дано в избытке, какое — в недостатке. 47/94
= х 1 /126, х 1 = 63 г.
На 47 г оксида
калия подействовали, содержащим 40 г азотной кислоты. Найдите массу образовавшегося
нитрата калия. Рассчитаем
относительные молекулярные массы интересующих нас веществ: M r (K 2 O) =
2 A r (K) + 1 A r (O) = 2 • 39 + 1 • 16 = 94, M r (HNO 3 ) =
1 A r (H) + 1 A r (N) + 3 A r (O)
= 1 • 1 + 1 • 14 + 3 • 16 = 63, M r (KNO 3 ) =
1 A r (K) + 1 A r (N) + 3 A r (O)
= 1 • 39 + 1 • 14 + 3 • 16 = 101.Для
удобства расчета за х 1 примем массы НNО 3 и найдем, какое из веществ, вступивших
в реакцию, дано в избытке, какое — в недостатке. 47/94
= х 1 /126, х 1 = 63 г. Следовательно,
азотная кислота дана в недостатке, т. к. по условию ее 40 г, а по условию расчету
необходимо 63 г, поэтому расчет ведем по HNO 3 : 40/126
= х /202, х = 64 г. Ответ . м (КНО 3 ) = 64 г.
Следовательно,
азотная кислота дана в недостатке, т. к. по условию ее 40 г, а по условию расчету
необходимо 63 г, поэтому расчет ведем по HNO 3 : 40/126
= х /202, х = 64 г. Ответ . м (КНО 3 ) = 64 г.
____________________________________________________________ ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Закончите уравнения в молекулярном и ионном виде:
2. Напишите уравнения двух вариантов получения: а) гидроксида цезия, б) гидроксида железа (III). 3. С помощью каких найти можно получить оксид никеля (II) NiO из сульфата никеля (II) NiSO 4 ? 4. Напишите уравнения всех способов получения оксида хрома (III), оксида углерода (IV), оксида кальция.
5. С какими из следующие вещества будут реагировать оксид углерода (IV):
Напишите уравнения соответсвия. 6. С какими из
следующие вещества будет реагировать гидроксид калия:
С какими из
следующие вещества будет реагировать гидроксид калия:
7. С какими из следующие вещества будут реагировать оксид цинка:
Напишите уравнения соответствующих параметров в молекулярном и ионном виде.8. Можно ли приготовить раствор, одновременно вместе следующие вещества:
9. Оксид натрия массой 12,4 г растворили в воде. Какой объем оксида углерода (IV), измеренный при нормальных условиях, потребуется для нейтрализации полученного гидроксида натрия, если при этом образует кислая соль? 10. Сколько граммов гидроксида железа (III) надо разложить, чтобы получить 0,95 г оксида железа (III)?
| 1. В каком ряду указаны формулы только кислотных оксидов: | |
| б) P 2 O 5 , Mn 2 O 7 , SiO 2 | |
2. Отметьте символ элемента, образующего как
кислотный, так и основной оксиды: Отметьте символ элемента, образующего как
кислотный, так и основной оксиды: | |
| 3. В каком ряду указаны формулы оксидов, все из которые реагируют с разбавленным разбавленным NaOH с образованием солей: | |
| 4. Все оксиды какого ряда реагируют с серной кислотой: | |
| а) оксид алюминия, оксид железа ( II ), оксид углерода ( IV ) | б) оксид бария, оксид азота ( V ), оксид кремния ( IV ) |
| в) оксид алюминия, оксид железа ( III ), оксид меди ( II ) | г) оксид цинка, оксид калия, оксид хлора ( VII ) |
5. В каком ряду указаны формулы основного, амфотерного
и кислотного оксидов: В каком ряду указаны формулы основного, амфотерного
и кислотного оксидов: | |
| 6. Оксиды фосфора ( V ) являются соответственно: | |
| а) кислотным и основным | б) основной и кислотным |
| в) кислотным и амфотерным | г) основным и амфотерным |
| 7. Оксид фосфора ( V ) не реагирует с: | |
| в) оксидами | |
| 8. В какой группе указаны формулы только щелочей: | |
| а ) NaOH, Ca (OH) 2 , Mg (OH) 2 | á ) KOH, NH 4 OH, Cu (OH) 2 |
| в ) NaOH, КОН, Ва (ОН) 2 | |
9. С какими веществами из перечисленных не реагируют щелочи: С какими веществами из перечисленных не реагируют щелочи: | |
| а) растворимыми солями меди | б) слабыми кислотами |
| в) оксидами | г) амфотерными гидроксидами |
| 10. Щелочь не может образоваться при взаимодействии: | |
| а) калия и воды | б) карбоната натрия и гидроксида бария (водные растворы) |
| в) хлорида алюминия и гидроксида аммония (водные растворы) | г) оксида натрия и воды |
Тестовые задания для подготовки к ЕГЭ по теме «Оксилы»
Тест по теме «Классификация оксидов»
В каком ряду расположенных соединений, являющихся оксидами?
1) Nа 2 O, H 2 O, Al 2 O 3 , SO 2 2) ВеО, Fe 2 O 3 , В 2 O 3 , ОF 2
3) Nа 2 O 2 , Р 4 О 10 , SiO 2 , Cl 2 O 7 4) H 2 O 2 , FeO, Fe 2 O 3 , Fe 3 O 4
Оксидами являются все вещества ряда
1) Al 2 O 3 , Nа 2 O 2 , N 2 O 5 2) MnO 2 , H 2 O 2 , SO 3
3) KO 2 , N 2 O, CaO 4 ) CO, Mn 2 O 7 , H 2 O
К амфетамин оксидам относится
1) ZnO 2) SO 2 3) FeO 4) H 9001 3 2
OОксид серы (IV) проявляет свойства
1) основной оксида 2) амфотерный оксида
3) кислотный оксида 4) несолеобразный оксида
Оксид хрома (III) относится к оксидам
1) кислотным 2) основным
3) амфотерным 4) несолеобразующим
Оксиды азота N 2 O и NO к
1) кислотным 2) оснувным
4) амфотерным
К основным оксидам не относится
1) Mn 2 O 7 2) MgO 3) Ag 2 O 4) CaO
К основным оксидам относится
) ВаO 2) NO 2 3) Al 2 O 3 4) N 2 O
Кислотным оксидом, формула которого:
1 ) SiO 2 2) Al 2 O 3 3) СО 4) ВаО
К амфотерным оксидам относится
1) CrO 3 2) SO 3 3) СО 2 4) Cr 2 O 3
К амфотерным оксидам относится
1) CuO 2) Р 2 O 3 3) Cr 2 O 3 4) CrO 3
Только кислотные оксиды присутствуют в ряду:
1) NO, SiO 2 , P 2 O 5 2) MgO, CO 2 , NO 2
3 ) CO 2 , N 2 O 5 , P 2 O 5 4) ZnO, Cl 2 O 7 , CaO
Высший оксид химического элемента с порядковым номером 16 относится к оксидам:
1) основной 2) кислотным
3) амфотерны м 4) несолеобразующим.
К амфотерным оксидам относится
1) NO 2) К 2 O 3) Fe 2 O 3 4) СО
К амфотерным оксидам:
) SO 3 2) К 2 O 3) ZnO 4) N 2 O
Какой из оксидов является несолеобразующим?
1) Аl 2 O 3 2) CO 2 3) СО 4) Cl 2 O 7
К несолеобразующим оксидам относится
1) N 2 O 2) NO 2 3) N 2 O 5 4) P 2 O 3
Высшему оксиду элемента VI группы соответствует формула
1) Э 4 O 6 2) ЭО 4 3) ЭО 2 4) ЭО 3
Оксид серы (IV) проявляет свойства
1) только основной оксида 2) амфотерный оксида
3) кислотного оксида 4) несолеобразующего оксида
Кислотным и свободным оксидом соответственно
1) SO 2 и MgO 2) CO 2 и Al 2 O 3
3) Na 2 O и FeO 4) Z nO и SO 3
К амфотерным оксидам относится
1) SO 3 2) K 2 O 3) ZnO 4) N 2 O
Какие из приведенных верны ?
А. Основным оксидам соответствуют основания.
Основным оксидам соответствуют основания.
Б. Основные оксиды образуют только металлы.
1) верно только А 2) верно только Б
3) верны оба утверждения 4) оба утверждения неверны
Кислотным и основным оксидом соответственно:
1) SO 2 и MgO 2) CO 2 и Al 2 O 3
3) Nа 2 O и FeO 4) ZnO и SO 3
Кислотными оксидами являются все группы веществ:
1) SiO 2 , Al 2 O 3 , SO 2 2) СО 2 , СО, N 2 O 3
3) NO, NO 2 , N 2 O 5 4) SO 3 , CrO 3 , P 2 O 5
Только кислотные оксиды расположены в ряд:
1) CO 2 , Mn 2 O 7 , SO 3 2) Nа 2 O, SiO 2 , Cr 2 O 3
3) CrO, SO 2 , СаО 4) CuO, Al 2 O 3 , FeO
Амфотерным и основным оксидами соответственно являются
1 ) BaO, К 2 О 2) Al 2 O 3 , СаО
3) SO 2 , Nа 2 O 4) Cr 2 O 3 , ZnO
Амфотерными оксидами являются все вещества ряда:
1) CrO, Al 2 O 3 , Fe 2 O 3 2) ВаО, ZnO, Cu 2 O
3) Ag 2 O, Nа 2 O, PbO 4) ZnO, Al 2 O 3 , Cr 2 O 3
Только кислотные оксиды указаны в ряду:
1) ZnO, CO 2 , N2O 2) CO, SiO 2 , SnO 2
3) CrO 3 , N 2 O 3 , SiO 2 4) N 2 O 5 , P 2 O 3 , Cs 2 O
Амфотерным и основным оксидами соответственно являются
1) ZnO, Nа 2 O 2) SO 3 , CaO
3) P 2 O 5 , Nа 2 O 4) Al 2 O 3 , ZnO
В перечне веществ :
ZnO, FeO, CrO 3 , CaO, Al 2 O 3 , Na 2 O, Cr 2 O 3 — число оснόвных оксидов равно
1) 5 2 ) 2 3) 3 4) 4
Среди перечисленных веществ:
2 O 5к кислотным оксидам класса
1) АВД 2) БГЕ 3) БВД 4) ГДЕ
Среди перечисленных веществ
А) CaO
Б) CrO 3
В) FeO 900 05
Г) SiO 2
Д) Cl 2 O
Е) Na 2 O
осно́вными оксидами являются
1) АГД 2) БВД 3) АВЕ 4) БДЕ
33. Среди перечисленных веществ:
Среди перечисленных веществ:
А) P 2 O 3
Б) Al 2 O 3
В) N 2 O 3
Г) BeO
Д) CO
Е) Cr 2 O 3
к амфотерным оксидам класса
1) АБВ 2) ГДЕ 3) БГД 4) БГЕ
34. Среди перечисленных веществ:
А) N 2 O
Б) СO
В) СrO 3
Г) Al 2 O 3
Д) SO 2
Е) SO 3
к кислотным оксидам Относительно:
1) АБД 2) БДЕ 3) ВДЕ 4) ГДЕ
35. Среди перечисленных веществ:
А) Na 2 O
Б) Cr 2 O 3
В) CaO
Г) Al 2 O 3
Г) Rb 2 O
Е) ZnO
к амфотерным оксидам относят:
1) АВД 2) АВЕ 3) БГЕ 4) ВГЕ
36. Среди перечисленных веществ:
А) Al 2 O 3
Б) Cr 2 O 3
В) CO 2
Г) Cl 2 O 7
Д) SO 2
Е) Nа 2 O
к кислотным оксидам класса:
1) АБВ 2) БВД 3) ВГД 4) ГДЕ
37. Среди перечисленных веществ:
Среди перечисленных веществ:
А) BaO
Б) SO 2
В) KOH
Г) N 2 О
Д) Cu 2 O
Е) MgO
к оснóвным оксидам относят:
1) АБГ 2) АДЕ 3) ВГЕ 4) ВДЕ
38. Соответствие между формулой вещества и классом (группой) неорганических соединений.
ФОРМУЛА ВЕЩЕСТВА КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
А) оксид азота (II) 1) кислотный оксид
Б) оксид кальция 2) основный оксид
В) оксид серы (IV) 3) Г) оксид углерода (II) 4) амфотерный оксид
39. Установите соответствие между веществом и его принадлежностью к соответствующей классу (группе) неорганических соединений.
название вещества КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1) оксид азота (II) А) кислотный оксид
2) оксид кальция Б) основный оксид
3) оксид серы (IV) В) несимметричный оксид
4) оксид углерода (II) Г) амфотерный оксид
40. Соответствие между формулой оксида и характером его свойств.
Соответствие между формулой оксида и характером его свойств.
ФОРМУЛА ОКСИДА ХАРАКТЕР СВОЙСТВ ОКСИДА
А) CO 1) амфотерный оксид
Б) MnO 2) основный оксид
В) Р 2 О 5 3) кислотный оксид
Г)
41. Соответствие между классом (группой) неорганических веществ и химической формулой этого вещества, принадлежащего к этому классу.
КЛАСС (ГРУППА) ВЕЩЕСТВА ХИМИЧЕСКАЯ ФОРМУЛА
А) кислотные оксиды 1) NO
Б) основные оксиды 2) Li 2 O
В) амфотерные оксиды 3) N 2 O 5 9 ) несолеобразующие оксиды 4) BeO
5) OF 2
6) NH 3
42. Установите соответствие между классом (группой) неорганических веществ и химической формулой вещества, принадлежащего этому классу.
КЛАСС (ГРУППА) ВЕЩЕСТВА ХИМИЧЕСКАЯ ФОРМУЛА
А) оснóвные оксиды 1) CO
Б) несолеобразующие оксиды 2) CO 2
В) амфотерные оксиды 3) Ag 2 O
9) Al 2 O 35) Al (OH) 3
6) KAlO 2
Microsoft Word — ПО занятие 4
% PDF-1. 3
%
48 0 объект
>
endobj
47 0 объект
> поток
PScript5.dll Версия 5.2.22010-11-14T14: 16: 02 + 03: 002010-11-14T14: 16: 02 + 03: 00application / pdf
3
%
48 0 объект
>
endobj
47 0 объект
> поток
PScript5.dll Версия 5.2.22010-11-14T14: 16: 02 + 03: 002010-11-14T14: 16: 02 + 03: 00application / pdf
 ; Wm5B
$ / 쭇} ΫD5̚uaw + I7 & ڇ] 9v
; Wm5B
$ / 쭇} ΫD5̚uaw + I7 & ڇ] 9vХиМиК.ru — ОКСИДЫ — Химическая энциклопедия
ОКСИДЫ , соединения
элементов с кислородом. В оксидах степень окисления атома кислорода —2. К оксидам защиты
все соед. элементов с кислородом, кроме соединенных атомы О, соединенные друг
с другом (пероксиды, надпероксиды, озо-ниды), и соед. фтора с кислородом (ОФ 2 и др.). Последние следует называть не оксидами, а фторидами кислорода, т. к.
степень окисления кислорода в них положительная.
При комнатной т-ре большинство
оксиды-твердые в-ва (СаО, Fe 2 O 3 и др.), нек-рые-жидкости (Н 2 О,
Сl 2 О 7 и др.) И газы (NO, SO 2 и др.). Хим. связь
в оксидах-ионная и ионно-ковалент-ная. Т-ры плавления и кипения оксидов понижаются с возрастанием
в них доли ковалентной связи.Многим оксидам в твердом состоянии присущ полиморфизм. Нек-рые оксиды элементов III, IV, V гр. (напр., В, Si, As, Р) образуют рентгеноаморфные
стекла. Оксиды s- и p-элементов (напр., MgO, Аl 2 О 3 ,
SiO 2 ) -диэлектрики, оксиды переходных металлов (Fe, Сг и др.) Часто обладают
св-вами полупроводников. Нек-рые оксиды-пьезоэлектрики (напр., Кварц), ферромагнетики
[оксиды Fe, Cr (IV) и др.]. Вследствие своей многочисленности, разнообразия св-в
и доступности оксиды исключительно важный класс неорг.в-в.
Нек-рые оксиды элементов III, IV, V гр. (напр., В, Si, As, Р) образуют рентгеноаморфные
стекла. Оксиды s- и p-элементов (напр., MgO, Аl 2 О 3 ,
SiO 2 ) -диэлектрики, оксиды переходных металлов (Fe, Сг и др.) Часто обладают
св-вами полупроводников. Нек-рые оксиды-пьезоэлектрики (напр., Кварц), ферромагнетики
[оксиды Fe, Cr (IV) и др.]. Вследствие своей многочисленности, разнообразия св-в
и доступности оксиды исключительно важный класс неорг.в-в.
Большинство оксидов-солеобразующие;
при солеобразовании, протекающем обычно при нагр. (напр., Na 2 O +
SiO 2 Na 2 SiO 3 ), степени окисления элементов не изменяются. Известно
неск. несолеобразующих оксидов (напр., NO), не вступающих в подобные р-ции. Солеобразующие
оксиды подразделяют на основные, кислотные и амфотерные. Элемент основного оксида (Li 2 O,
BaO и др.) при образовании соли (напр., ВаО + SO 3 BaSO 4 ) становится катионом, элемент кислотного оксида (напр. , SO 3 ,
NO 2 , P 2 O 5 ) входит в состав кислородсодержащего
аниона соли. Амфотерные оксиды (напр., ZnO, BeO, А1 2 О 3 ) могут
реагировать и как основные оксиды, и как кислотные, напр .:
, SO 3 ,
NO 2 , P 2 O 5 ) входит в состав кислородсодержащего
аниона соли. Амфотерные оксиды (напр., ZnO, BeO, А1 2 О 3 ) могут
реагировать и как основные оксиды, и как кислотные, напр .:
Уменьшение степени уменьшения
больше, наоборот, увеличение
степени окисления и уменьшения ионного радиуса-более кислотным (напр., МnО-
оксид, Мn 2 О 7 -кислотный). Многие оксиды, напр. Рb 3 О 4 ,
Fe 3 O 4 , основные элементы в разных степенях окисления,
являются двойными оксидами: (Pb II 2 , Pb IV ) O 4 ,
(Fe II , Fe III 2 ) O 4 . Среди оксидов, особенно
среди оксидов d-элементов, много нестехиометрич. соединения.
Оксиды щелочных и щел.-зем.
металлов активно реагируют с водой, образуя щелочи, напр . : К 2 О
+ Н 2 О
2КОН; нек-рые кислотные оксиды -ангидриды неорганических кислот-активно взаимодейств.
с водой, давая к-ты, напр .: SO 3 + Н 2 О H 2 SO 4 .
Большинство оксидов металлов в компактном состоянии при комнатной т-ре с водой не
реагируют. Основные оксиды обычно быстро реагируют с к-тами в р-ре с образованием
солей, напр.:
: К 2 О
+ Н 2 О
2КОН; нек-рые кислотные оксиды -ангидриды неорганических кислот-активно взаимодейств.
с водой, давая к-ты, напр .: SO 3 + Н 2 О H 2 SO 4 .
Большинство оксидов металлов в компактном состоянии при комнатной т-ре с водой не
реагируют. Основные оксиды обычно быстро реагируют с к-тами в р-ре с образованием
солей, напр.:
Восстановители (С, Н 2 ,
активные металлы, в частности Mg, Al) при нагр. восстанавливают многие оксиды до
металла, напр .:
При сильном нагревании
оксидов с углеродом часто образуются карбиды (напр., СаО + ЗС СаС 2 + СО), при хлорировании смесей оксидов с углем-хлориды (напр., В 2 О 3 + ЗС + + ЗСl 2 2ВСl 3 + 3СО).
Оксиды широко распространены
в природе. В очень больших кол-вах встречаются Н 2 О и SiO 2 . Мн. минералы являются оксидами (гематит Fe 2 O 3 , магнетит
Fe 3 O 4 , касситерит SnO 2 и др.).
Мн. минералы являются оксидами (гематит Fe 2 O 3 , магнетит
Fe 3 O 4 , касситерит SnO 2 и др.).
Многие оксиды образуются при
взаимод. в-в с кислородом (Li 2 O, СаО, La 2 O 3 ,
SO 2 и др.). Оксиды металлов обычно используют термич. разложением гидроксидов,
карбонатов, нитратов и др. солей кислородсодержащих к-т (напр., СаСО 3 СаО + СО 2 ), анодным окислением металлов, оксиды неметаллов — окислением
кислородом водородсодержащих соед. неметаллов (напр., 2H 2 S 4+ 3О 2 2SO 2 + 2H 2 O). В пром-сти в больших кол-вах получают СаО, Аl 2 О 3 ,
MgO, SO 3 , CO, CO 2 , NO и другие оксиды.Используют оксиды как огнеупоры
(SiO 2 , MgO, Al 2 O 3 и др.), Адсорбенты (SiO 2 -сшгака-гель,
Аl 2 О 3 и др.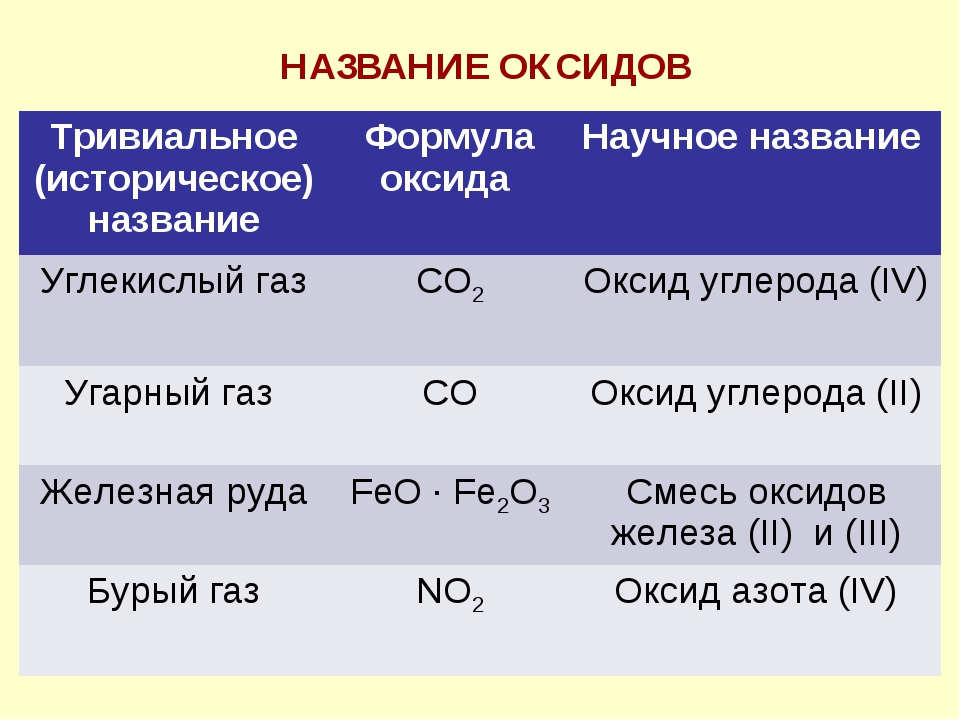 ), Катализаторы (V 2 O 5 ,
Al 2 O 3 и др.), В произ-ве строит. материалов, стекол, фарфора,
фаянса, магн. материалов, пьезоэлектриков и др. Оксиды металлов (Fe, Ni, Al, Sn
и др.) — сырье в произ-ве металлов, оксиды неметаллов (напр., S, Р, N) — в произ-ве
соответствующему к-т.
), Катализаторы (V 2 O 5 ,
Al 2 O 3 и др.), В произ-ве строит. материалов, стекол, фарфора,
фаянса, магн. материалов, пьезоэлектриков и др. Оксиды металлов (Fe, Ni, Al, Sn
и др.) — сырье в произ-ве металлов, оксиды неметаллов (напр., S, Р, N) — в произ-ве
соответствующему к-т.
С. И. Дракин.
Разница между кислотными и первыми оксидами — Разница Между
Оксид — это любое химическое соединение, которое содержит один или несколько атомов кислорода. Оксиды могут быть кислотными или контактными в зависимости от их химического состава, факторов и рН. Кислот
Основное отличие — кислотные атомы и оксиды
Оксид — это любое химическое соединение, которое содержит один или несколько кислорода.Оксиды могут быть кислотными или контактными в зависимости от их химического состава, факторов и рН. Кислотные оксиды реагируют с водой, образуя кислый раствор. Они могут реагировать с основанием с образованием соли. Основные оксиды реагируют с водой, образует основной раствор, и они могут реагировать с кислотой с образованием соли. Кислотные оксиды имеют низкий уровень рН, тогда как основные оксиды имеют высокий рН. Однако основное различие между кислотными оксидами и оксидами в том, что кислые оксиды образуют кислоты при растворении в воде, где основные оксиды образуют основания при растворении в воде.
Основные оксиды реагируют с водой, образует основной раствор, и они могут реагировать с кислотой с образованием соли. Кислотные оксиды имеют низкий уровень рН, тогда как основные оксиды имеют высокий рН. Однако основное различие между кислотными оксидами и оксидами в том, что кислые оксиды образуют кислоты при растворении в воде, где основные оксиды образуют основания при растворении в воде.
Ключевые области покрыты
1. Что такое кислый оксид
— определение, химические свойства, неметаллические оксиды, примеры
2. Что такое основной оксид
— определение, химические свойства, оксиды металлов, примеры
3. В чем разница между кислотными и оксидами
— Сравнение основных различий
Основные термины: кислота, ангидриды кислоты, оксид кислоты, основание, основные ангидриды, оксид, оксид неметалла, оксид металла, оксид, pH , соль
Что такое кислый оксид
Кислотные оксиды могут представлять собой соединения, которые образовывать кислотный раствор при растворении в воде. Кислотные оксиды образуются, когда неметалл реагирует с кислородом. Иногда кислые оксиды образуются, когда металлы (с более высокими степенями окисления) также реагируют с кислородом. Кислотные оксиды реагируют с водой и образуют водные кислоты.
Кислотные оксиды образуются, когда неметалл реагирует с кислородом. Иногда кислые оксиды образуются, когда металлы (с более высокими степенями окисления) также реагируют с кислородом. Кислотные оксиды реагируют с водой и образуют водные кислоты.
Кислотные оксиды подразделяются на ангидриды кислот , Это потому, что они производят кислотное соединение этого оксида при растворении в воде. Например, диоксид серы называют сернистым ангидридом, а триоксид серы называют серным ангидридом.Кислотные оксиды могут реагировать с основанием с образованием его соли.
Обычно кислые оксиды имеют низкие температуры плавления и низкие температуры кипения, за исключением оксидов, таких как диоксид кремния, которые имеют тенденцию образовывать гигантские молекулы. Эти оксиды растворяются в основаниях и образуют соль и воду. Когда кислый оксид растворяется в воде, он снижает рН пробы воды из-за образования Н + перв. Некоторыми распространенными примерами кислых оксидов являются СО 2 , П 2 О 5 НЕТ 2 , ТАК 3 , так далее.
Рисунок 1: SO3 представляет собой неметаллический оксид (кислый оксид)
Неметаллические оксиды
Неметаллические оксиды представляют собой оксидные соединения, образованные неметаллические элементы. Большинство элементов p-блока являются неметаллами. Они образуют различные оксидные соединения. Неметаллические оксиды являются ковалентными соединениями, поскольку они разделяют электроны с атомами кислорода, образуя молекулы оксида.Неметаллических оксидов дают реакции после реакции с водой. Следовательно, неметаллические оксиды являются кислотными соединениями. Например, когда ТАК 3 растворяется в воде, дает H 2 ТАК 4 раствор, который очень кислый. Неметаллические оксиды реагируют с основаниями с образованием солей.
Что такое основной оксид
Основные оксиды, также называемые основные ангидриды являются соединениями, которые могут образовывать основной раствор при растворении в воде. Основные оксиды образуются в результате реакции кислорода с металлами. Из-за разницы в электроотрицательности между кислородом и металлами основных оксидов имеют ионную природу. Таким образом, они имеют ионные связи между атомами.
Основные оксиды образуются в результате реакции кислорода с металлами. Из-за разницы в электроотрицательности между кислородом и металлами основных оксидов имеют ионную природу. Таким образом, они имеют ионные связи между атомами.
Основные оксиды активно реагируют с водой, образуя основные соединения. Эти оксиды реагируют с кислотами и образуют соль и воду. Когда основной оксид добавить в воду, pH воды увеличивается из-за гидроксильного первого (OH — ).Некоторые основные примеры основных оксидов, Na 2 O, CaO, MgO и т. Д. Поэтому оксиды металлов в основном представляют собой оксидами.
Рисунок 2: MgO является основным оксидом. Это оксид металла. 9
Оксиды металлов
Оксиды металлов представляют собой химические соединения, содержащие металл и один или несколько атомов кислорода. Здесь степень окисления кислорода составляет -2.Щелочные металлы (элементы группы 1), щелочноземельные металлы (элементы группы 2) и переходные металлы (некоторые элементы d-блока) образуют основные оксиды. Образовывать оксиды с ковалентной природой. Они более кислые, чем основные.
Образовывать оксиды с ковалентной природой. Они более кислые, чем основные.
Количество атомов кислорода, которые связываются с ионом металла, зависит от степени окисления иона металла. Щелочные металлы образуют только одновалентные катионы. Следовательно, они образуют только М 2 Оксиды типа O (где М — ион металла, а О — анион оксида).Щелочноземельные металлы образуют двухвалентные катионы. Следовательно, они образуют оксиды типа МО. Эти соединения вызываются.
Разница между кислотными и активными оксидами
Определение
Кислотные оксиды: Кислотные оксиды представляют собой соединения, которые могут образовывать кислотный раствор при растворении в воде.
Основные оксиды: Основные оксиды представляют собой соединения, которые могут образовывать основной раствор при растворении в воде.
формирование
Кислотные оксиды: Кислотные оксиды образуются, когда кислород реагирует с неметаллами.
Основные оксиды: Основные оксиды образуются, когда реагирует с металлами.
Реакция с водой
Кислотные оксиды: Кислотные оксиды реагируют с водой, образуя кислотные соединения.
Основные оксиды: Основные оксиды реагируют с водой, образуя основные соединения.
Реакция с кислотами
Кислотные оксиды: Кислотные оксиды не вступают в реакцию с кислотами.
Основные оксиды: Основные оксиды реагируют с кислотами, образуя соль.
Реакция с основами
Кислотные оксиды: Кислотные оксиды реагируют с основаниями, образуя соль.
оксиды: Основные оксиды не вступают в реакцию Основные с основаниями.
облигации
Кислотные оксиды: Кислые оксиды имеют ковалентные связи.
Основные оксиды: Основные оксиды имеют ионные связи.
Влияние на рН
Кислотные оксиды: Когда кислые оксиды растворяются в воде, это снижает рН.
Основные оксиды: Растворение основных оксидов в воде вызывает повышение рН.
Другие имена
Кислотные оксиды: Кислотные оксиды также известны как ангидриды кислот.
Основные оксиды: Основные оксиды также являются вызывающими ангидридами.
Заключение
Оксиды представляют собой соединения, имеющие по меньшей мере один атом кислорода, связанный с другими элементами. Этот элемент может быть металлическим или неметаллическим. Оксиды могут быть кислотными или контактами в зависимости от их свойств. Если конкретный оксид может реагировать с кислотой, но не с основанием, его называют основным оксидом. Если оксид реагирует с основанием, но не с кислотами, это кислый оксид. Основное различие между кислотными и вызывающими оксидами состоит в том, что кислые оксиды образуют кислоты при растворении в воде, тогда как основные оксиды образуют основания при растворении в воде.
Ссылка:
1.
 Образуются металлами, валентность которых меньше IV. Например:
Образуются металлами, валентность которых меньше IV. Например: Свойства — Оксиды — Важнейшие классы неорганических соединений — Неорганическая химия
Свойства — Оксиды — Важнейшие классы неорганических соединений — Неорганическая химия