Окислительно-восстановительный потенциал — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 20 августа 2013; проверки требуют 16 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 20 августа 2013; проверки требуют 16 правок.Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — reduction-oxidation reaction, Eh или Eh) — мера способности химического вещества присоединять электроны (восстанавливаться[1]). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода являются: Pt/Fe3+,Fe2+
Определение величины редокс-потенциала[править | править код]
Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение (A
Aox + n·e− → Ared,
то количественная зависимость окислительно-восстановительного потенциала от концентрации (точнее активностей) реагирующих веществ выражается уравнением Нернста.
Окислительно-восстановительный потенциал определяют электрохимическими методами с использованием стеклянного электрода с red-ox функцией[2] и выражают в милливольтах (мВ) относительно стандартного водородного электрода в стандартных условиях
В биохимии для обозначения передаваемого от донора к акцептору одного электронного эквивалента (электрона, либо электрона и протона и др.) часто используют термин восстановительный эквивалент. Этот термин ничего не говорит о том, что именно передается — электрон как таковой, водородный атом, гидрид-ион (Н
—) или же передача происходит в реакции с кислородом, приводящей к образованию окисленного продукта.Способность восстановителя отдавать электроны окислителю выражается величиной окислительно-восстановительного потенциала (стандартного восстановительного потенциала) или редокс-потенциала. Редокс-потенциал определяют измерением электродвижущей силы (э. д. с.) в вольтах, возникающей в полуэлементе, в котором восстановитель и окислитель, присутствующие в концентрациях равных 1 моль/литр при 25°С и рН 7,0, находятся в равновесии с электродом, способным принимать электроны от восстановителя и передавать их окислителю. В качестве стандарта принят редокс-потенциал реакции Н2 → 2Н+ + 2e−, который при давлении газообразного водорода в 1 атмосферу при концентрации ионов Н+ равной 1 моль/литр (что соответствует рН = 0) и при 25°С условно принят за нуль. В условиях значения рН, принятого в качестве стандарта при биохимических расчетах, то есть при рН 7,0 , редокс-потенциал (Е°´) водородного электрода (системы Н
Значения редокс-потенциала (Е°´) для некоторых окислительно-восстановительных пар, играющих важную роль при переносе электронов в биологических системах:
| Восстановитель | Окислитель | Ео´, В |
|---|---|---|
| Н2 | 2Н+ | -0,42 |
| НАД • Н + Н+ | НАД+ | -0,32 |
| НАДФ • Н + Н+ | НАДФ+ | -0,32 |
| Флавопротеин (восст.) | Флавопротеин (окисл.) | -0,12 |
| Кофермент Q • Н2 | Кофермент Q | +0,04 |
| Цитохром B (Fe2+) | Цитохром B (Fe3+) | +0,07 |
| Цитохром C1 (Fe2+) | Цитохром C1 (Fe3+) | +0,23 |
| Цитохром A (Fe2+) | Цитохром A(Fe3+) | +0,29 |
| Цитохром A3 (Fe2+) | Цитохром A3 (Fe3+) | +0,55 |
| H2O | ½ О2 | +0,82 |
Система с более отрицательным редокс-потенциалом обладает большей способностью отдавать электроны системе с более положительным редокс-потенциалом. Например, пара НАД • Н / НАД+ , редокс-потенциал которой равен −0,32 В будет отдавать свои электроны окислительно-восстановительной паре флавопротеин (восстановл.) / флавопротеин (окислен.), имеющей потенциал −0,12 В, то есть более положительный. Большая положительная величина редокс-потенциала окислительно-восстановительной пары вода/кислород (+0,82 В) указывает на то, что у этой пары способность отдавать электроны (то есть способность образовывать молекулярный кислород) выражена очень слабо. Иначе можно сказать, что у молекулярного кислорода очень велико сродство к электронам или водородным атомам.
- ↑ По-английски окислительно-восстановительный потенциал называется также reduction potential, то-есть, буквально, восстановительный потенциал.
- ↑ Шульц М. М., Белюстин А. А. Писаревский А. М., Никольский Б. П. Стеклянный электрод, чувствительный к изменению окислительного потенциала. // ДАН СССР. 1964. Т. 154. № 2. С. 404—406
Что такое ОВР в современной химии?
Поговорим о том, что такое ОВР в неорганическом и органическом синтезе.
Определение процесса
Под окислительно-восстановительными реакциями подразумевают такие процессы, в результате которых будет меняться степень окисления у двух или более химических элементов в сложных или простых веществах.

Что такое окисление
Под окислением подразумевается такая химическая реакция, в процессе которой атом либо определенный ион отдает электроны, при этом понижая свою первоначальную степень окисления. Данный процесс характерен для металлов.
Что такое восстановление
Под процессом восстановления подразумевается химическое превращение, в результате которого будет снижаться степень окисления у иона либо простого вещества, при этом происходит присоединение электронов. Данная реакция характерна для неметаллов и кислотных остатков.
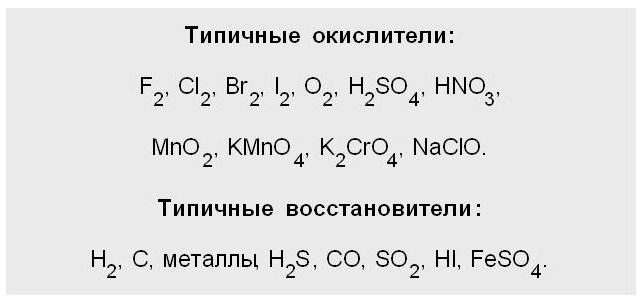
Характеристика восстановителя
Рассматривая вопрос о том, что такое ОВР, нельзя обойти вниманием такое понятие, как «восстановитель».
Под ним подразумевается нейтральная молекула или заряженный ион, который в результате химического взаимодействия будет отдавать другому иону либо атому электрон, при этом повышая свою степень окисления.
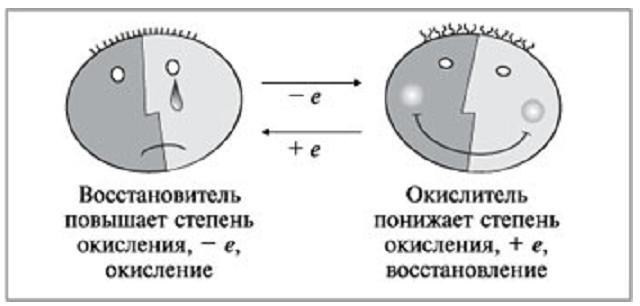
Определение окислителя
Рассуждая над тем, что такое ОВР, также важно упомянуть и такой термин, как «окислитель». Под ним принято подразумевать такие ионы либо нейтральные атомы, которые при химическом взаимодействии будут принимать отрицательные электроны от других атомов или нейтральных частиц. При этом его первоначальная степень окисления будет понижаться.
Типы ОВР
Рассуждая над тем, что такое ОВР, необходимо отметить о тех разновидностях данных процессов, которые чаще всего рассматриваются в неорганическом и органическом синтезе.
Межмолекулярные взаимодействия предполагают такие процессы, при которых атомы и восстановителя, и окислителя располагаются в разных исходных веществах, вступающих во взаимодействие. В качестве примера подобного типа превращения можно привести взаимодействие между оксидом марганца (4) и раствором соляной кислоты, в результате которого образуется газообразный хлор, хлорид двухвалентного марганца, а также вода.
В рассматриваемом химическом процессе в качестве восстановителя предстают анионы хлора, окисляющиеся по мере взаимодействия. Катион марганца (со степенью окисления +4) проявляет в реакции окислительные способности, принимая два электрона, восстанавливается.
Внутримолекулярное взаимодействие представляет собой такие химические превращения, по мере которых и атомы восстановителя, и атомы окислителя первоначально являются одним исходным веществом, а после завершения превращения они оказываются в различных продуктах реакции.
В качестве примера такого типа реакции можно представить разложение хлората калия. При нагревании данное вещество будет превращаться в хлорид калия и кислород. Окислительные свойства будут характерны для аниона хлората, который, принимая пять электронов в реакции, будет восстанавливаться, превращаясь в хлорид.
При этом анион кислорода будет проявлять восстановительные свойства, окисляясь до молекулярного кислорода. Так что такое ОВР в данном случае? Это процесс передачи электронов между ионами, приводящий к образованию двух продуктов реакции.
Также к данному виду химических превращений, происходящих с изменением степеней окисления у элементов, первоначально находящихся в одной формуле, относится процесс разложения нитрита аммония. Азот, стоящий в катионе аммония, имея степень окисления -3, в ходе процесса отдает шесть электронов и окисляется до молекулярного азота. А тот азот, который входит в состав нитрита, принимает шесть электронов, при этом является восстановителем, а в ходе реакции он окисляется.
Что такое ОВР в химии? Определение, рассмотренное нами выше, свидетельствует о том, что это превращения, связанные с изменениями у нескольких элементов степеней окисления.
Самоокисление и восстановление (диспропорция) предполагает такие процессы, при протекании которых в качестве восстановителя и окислителя выступает один исходный атом, который будет увеличивать, и одновременно уменьшать свою степень окисления после завершения взаимодействия. Рассуждая над тем, что такое ОВР в химии, примеры подобных превращений можно найти даже в курсе химии средней школы. Разложение сульфита калия при нагревании приводит к образованию двух солей этого металла: сульфида и сульфата. Сера со степенью окисления +4 проявляет и восстановительные, и окислительные свойства, повышая и понижая показатели степени окисления.

Чтобы понять, что означает ОВР в химии, назовем еще один вид таких химических превращений. Контрпропорционирование предполагает такие процессы, в результате которых атомы восстановителя и окислителя находятся в составе разных исходных компонентов, но в правой части они образуют один продукт реакции. Например, при взаимодействии оксида серы (4) с сероводородом будет образовываться сера и вода. Ион серы со степенью окисления +4 будет принимать четыре электрона, а ион серы с показателем -2 лишается двух электронов. В итоге оба они превращаются в простое вещество, у которого степень окисления равна нулю.

Заключение
Рассматривая вопрос о том, что такое ОВР в химии, отметим, что это многочисленные превращения, благодаря которым функционируют живые организмы, происходят разнообразные природные процессы и явления. Для того чтобы расставить в таких уравнениях коэффициенты, нужно составить электронный баланс.
Окислитель — Википедия
Материал из Википедии — свободной энциклопедии
Окисли́тель — вещество, в состав которого входят атомы, присоединяющие к себе во время химической реакции электроны. Иными словами, окислитель — это акцептор электронов.
В зависимости от поставленной задачи (окисление в жидкой или в газообразной фазе, окисление на поверхности) в качестве окислителя могут быть использованы самые разные вещества.
Распространённые окислители и их продукты[править | править код]
| Окислитель | Полуреакции | Продукт | Стандартный потенциал, В |
|---|---|---|---|
| O2кислород | O20+4e−→2O2−{\displaystyle {\mbox{O}}_{2}^{0}+4{\mbox{e}}^{-}\rightarrow 2{\mbox{O}}^{2-}} | Разные, включая оксиды, H2O и CO2 | +1,229 (в кислой среде) +0,401 (в щелочной среде) |
| O3озон | 2O30+2e−→2O20{\displaystyle 2{\mbox{O}}_{3}^{0}+2{\mbox{e}}^{-}\rightarrow 2{\mbox{O}}_{2}^{0}} | Разные, включая кетоны и альдегиды | +2,07 (в кислой среде) |
| Пероксиды | 2O−+2e−→2O2−{\displaystyle 2{\mbox{O}}^{-}+2{\mbox{e}}^{-}\rightarrow 2{\mbox{O}}^{2-}} | Разные, включая оксиды, окисляет сульфиды металлов до сульфатов H2O | |
| Hal2галогены | Hal20+2e−→2Hal−{\displaystyle {\mbox{Hal}}_{2}^{0}+2{\mbox{e}}^{-}\rightarrow 2{\mbox{Hal}}^{-}} | Hal−; окисляет металлы, P, C, S, Si до галогенидов | F2: +2,87 Cl2: +1,36 |
| ClO−гипохлориты | Cl− | ||
| ClO3−хлораты | Cl− | ||
| HNO3азотная кислота | с активными металлами, разбавленная N5++8e−→N3−{\displaystyle {\mbox{N}}^{5+}+8{\mbox{e}}^{-}\rightarrow {\mbox{N}}^{3-}} с активными металлами, концентрированная N5++3e−→N2+{\displaystyle {\mbox{N}}^{5+}+3{\mbox{e}}^{-}\rightarrow {\mbox{N}}^{2+}} с тяжёлыми металлами, разбавленная N5++3e−→N2+{\displaystyle {\mbox{N}}^{5+}+3{\mbox{e}}^{-}\rightarrow {\mbox{N}}^{2+}} c тяжёлыми металлами, концентрированная N5++e−→N4+{\displaystyle {\mbox{N}}^{5+}+{\mbox{e}}^{-}\rightarrow {\mbox{N}}^{4+}} | NH3, NH4+
NO2 | |
| H2SO4, конц. серная кислота | c неметаллами и тяжёлыми металлами S6++2e−→S4+{\displaystyle {\mbox{S}}^{6+}+2{\mbox{e}}^{-}\rightarrow {\mbox{S}}^{4+}} с активными металлами S6++6e−→S0↓{\displaystyle {\mbox{S}}^{6+}+6{\mbox{e}}^{-}\rightarrow {\mbox{S}}^{0}\downarrow } S6++8e−→S2−{\displaystyle {\mbox{S}}^{6+}+8{\mbox{e}}^{-}\rightarrow {\mbox{S}}^{2-}} | SO2; окисляет металлы до сульфатов с выделением сернистого газа или серы S
| |
| Шестивалентный хром | Cr6++6e−→2Cr3+{\displaystyle {\mbox{Cr}}^{6+}+6{\mbox{e}}^{-}\rightarrow 2{\mbox{Cr}}^{3+}} | Cr3+ | +1,33 |
| MnO2оксид марганца(IV) | Mn4++2e−→Mn2+{\displaystyle {\mbox{Mn}}^{4+}+2{\mbox{e}}^{-}\rightarrow {\mbox{Mn}}^{2+}} | Mn2+ | +1,23 |
| MnO4−перманганаты | кислая среда Mn7++5e−→Mn2+{\displaystyle {\mbox{Mn}}^{7+}+5{\mbox{e}}^{-}\rightarrow {\mbox{Mn}}^{2+}} нейтральная среда Mn7++3e−→Mn4+{\displaystyle {\mbox{Mn}}^{7+}+3{\mbox{e}}^{-}\rightarrow {\mbox{Mn}}^{4+}} сильнощелочная среда Mn7++e−→Mn6+{\displaystyle {\mbox{Mn}}^{7+}+{\mbox{e}}^{-}\rightarrow {\mbox{Mn}}^{6+}} | Mn2+
| +1,51
|
| Катионы металлов и H+ | Me2++2e−→Me0↓{\displaystyle {\mbox{Me}}^{2+}+2{\mbox{e}}^{-}\rightarrow {\mbox{Me}}^{0}\downarrow } 2H++2e−→h30↑{\displaystyle 2{\mbox{H}}^{+}+2{\mbox{e}}^{-}\rightarrow {\mbox{H}}_{2}^{0}\uparrow } | Me0 H2 | См. Электрохимический ряд активности металлов |
Зависимость степени окисления от концентрации окислителя[править | править код]
Чем активнее металл, реагирующий с кислотой, и чем более разбавлен её раствор, тем полнее протекает восстановление. В качестве примера — реакция азотной кислоты с цинком:
- Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2 + 2H2O
- 3Zn + 8HNO3(40 %) = 3Zn(NO3)2 + 2NO + 4H2O
- 4Zn + 10HNO3(20 %) = 4Zn(NO3)2 + N2O + 5H2O
- 5Zn + 12HNO3(6 %) = 5Zn(NO3)2 + N2 + 6H2O
- 4Zn + 10HNO3(0.5 %) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Сильными окислительными свойствами обладает «царская водка» — смесь одного объёма азотной кислоты и трёх объёмов соляной кислоты.
- HNO3 + 3HCl ↔ NOCl + 2Cl + 2H2O
Образующийся в нём хлористый нитрозил распадается на атомарный хлор и монооксид азота:
NOCl=NO + Cl
Царская водка является сильным окислителем благодаря атомарному хлору, который образуется в растворе. Царская водка окисляет даже благородные металлы — золото и платину.
Селеновая кислота — одна из немногих неорганических кислот, в концентрированном виде способная окислять золото. Более сильный окислитель даже в умеренно разбавленном растворе, чем серная кислота. Способна к окислению соляной кислоты по уравнению:
- h3SeO4+2HCl→h3SeO3+Cl2+h3O{\displaystyle {\mathsf {H_{2}SeO_{4}+2HCl\rightarrow H_{2}SeO_{3}+Cl_{2}+H_{2}O}}}
При этом продуктами реакции являются селенистая кислота, свободный хлор и вода. В то же время концентрированная серная кислота не способна окислять HCl.
Ещё один сильный окислитель — перманганат калия. Он способен окислять органические вещества и даже разрывать углеродные цепи:
- С6H5-CH2-CH3 + [O] → C6H5COOH + …
- C6H6 + [O] → HOOC-(CH2)4-COOH
Сила окислителя при реакции в разбавленном водном растворе может быть выражена стандартным электродным потенциалом: чем выше потенциал, тем сильнее окислитель.
К сильным окислителям относятся также оксид меди(III), озонид цезия, надпероксид цезия, все фториды ксенона.
Условно к «очень сильным окислителям» относят вещества, превышающие по окислительной активности молекулярный фтор. К ним, например, относятся: гексафторид платины, диоксидифторид, дифторид криптона, фторид серебра(II), катионная форма Ag2+, гексафтороникелат(IV) калия. Перечисленные вещества, к примеру, способны при комнатной температуре окислять инертный газ ксенон, что неспособен делать фтор (требуется давление и нагрев) и тем более ни один из кислородсодержащих окислителей.
Окисление — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 25 апреля 2019; проверки требуют 2 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 25 апреля 2019; проверки требуют 2 правки.Окисле́ние — химический процесс, сопровождающийся увеличением степени окисления атома окисляемого вещества посредством передачи электронов от атома восстановителя (донора электронов) к атому окислителя (акцептору электронов).
Данный термин был введен в конце XVIII — в начале XIX в. акад. В. М. Севергиным и использовался для обозначения реакций взаимодействия веществ с кислородом воздуха[1].
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и мелкие части. При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
При окислении вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В атмосфере воздуха (и в чистом кислороде) способны гореть различные вещества: простые элементы (металлы и неметаллы), неорганические (например, сероводород H2S, монооксид углерода CO, пирит FeS2) и органические вещества. Однако наибольшее практическое значение как горючие вещества (топливо) имеют: природный газ, нефть, уголь, торф и др. Эти вещества в основном состоят из сложных смесей углеводородов, с незначительным содержанием кислород-, серо- и азотсодержащих органических соединений и включением следовых количеств соединений других элементов.
- ↑ В. В. Виноградов. История слов (неопр.). wordhist.narod.ru. Дата обращения 18 июля 2016.
Окисление (рус.). StudFiles. Дата обращения 20 сентября 2019.
Окислительно-восстановительный элемент — Википедия
Материал из Википедии — свободной энциклопедии
Окисли́тельно-восстанови́тельный элеме́нт — это гальванический элемент, состоящий из двух инертных (обычно платиновых) электродов, опущенных в растворы солей с определенным окислительно-восстановительным потенциалом. Для этого элемента характерно то, что катионы и анионы, изменяя свой заряд, не выделяются на электродах и не появляются в растворе путём перехода вещества из электрода в раствор.
Например, одним из электродов окислительно-восстановительного элемента может служить платиновая пластинка, погруженная в раствор, содержащий ионы двух- и трехвалентного железа, другим электродом — платиновая пластинка в растворе, содержащем ионы двух- и четырёхвалентного олова. Схема этого элемента имеет вид: Pt|Fe3+,Fe2+||Sn4+,Sn2+|Pt{\displaystyle {\mathsf {Pt|Fe^{3+},Fe^{2+}||Sn^{4+},Sn^{2+}|Pt}}}
При этом электрод в системе Fe3+,Fe2+{\displaystyle {\mathsf {Fe^{3+},Fe^{2+}}}} получает положительный заряд и притягивает анионы из раствора, в результате на поверхности электрода образуется двойной электрический слой с определенным скачком потенциала. Этот электродный потенциал зависит от концентрации ионов Fe3+{\displaystyle {\mathsf {Fe^{3+}}}} и Fe2+{\displaystyle {\mathsf {Fe^{2+}}}}. Знак потенциала и его величина определяются относительно стандартного водородного потенциала.
Соединив электрод Fe3+,Fe2+|Pt{\displaystyle {\mathsf {Fe^{3+},Fe^{2+}|Pt}}} с электродом Sn4+,Sn2+|Pt{\displaystyle {\mathsf {Sn^{4+},Sn^{2+}|Pt}}}, имеющим меньший положительный потенциал, чем электрод Fe3+,Fe2+|Pt{\displaystyle {\mathsf {Fe^{3+},Fe^{2+}|Pt}}} получим окислительно-восстановительный элемент, при действии которого на электроде Fe3+,Fe2+|Pt{\displaystyle {\mathsf {Fe^{3+},Fe^{2+}|Pt}}} будет идти реакция восстановления и электроны будут поступать из электрода в раствор. На электроде Sn4+,Sn2+|Pt{\displaystyle {\mathsf {Sn^{4+},Sn^{2+}|Pt}}} идет реакция с отдачей электронов электроду и увеличением заряда катиона, то есть протекает реакция окисления (ЭДС этого элемента больше нуля).
Герасимов Я.И. Курс физической химии в 2-х томах: Том 2. — М.: Химия, 1973. — 624 с.