1.2. Периодический закон и Периодическая система химических элементов д.И. Менделеева
Одним из важнейших законов природы является периодический закон, открытый в 1869 г. Менделеевым, который он сформулировал так: «Свойства простых веществ, также формы и свойства соединений находятся в периодической зависимости от атомных весов элементов».
С развитием квантовой химии периодический закон получил строгое теоретическое обоснование, а с ним и новую формулировку: «Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины зарядов ядер их атомов».
До Менделеева многие пытались систематизировать элементы, наиболее близко подошел Майер (Германия). В 1864 г. в своей книге он привел таблицу, в которой элементы были также расположены в порядке возрастания их атомных масс, но в эту таблицу Майер поместил всего 27 элементов, меньше половины, известных в то время. Заслуга Менделеева, что в его таблице нашлось место не только всем известным элементам, но были оставлены пустые места для еще не открытых элементов (экабор – Sc, экаалюминий – Ga, экасилиций – Ge).


С точки зрения электронного строения атома:
Периодом называют горизонтальную последовательность элементов, начинающуюся со щелочного металла и заканчивающуюся благородным газом с тем же максимальным значением главного квантового числа, равного номеру периода.
Число элементов в периоде определяется емкостью подуровней.
| 1s2 | 2s22p6 | 3s23p6 | 4s23d104p6 | 5s24d105p6 | 6s24f145d106p6 | 7s25f146d107p6 |
I | II | III | IV | V | VI | VII периоды |
2 | 8 | 8 | 18 | 32 | 32 элемента. |
Группой элементов называют вертикальную совокупность элементов, обладающую однотипной электронной конфигурацией и определенным химическим сходством. Номер группы (за исключением I, II, VIII побочных подгрупп) равен сумме валентных электронов.
Кроме деления по периодам (определяемое главным квантовым числом) существует деление на семейства, определяемое орбитальным квантовым числом. Если у элемента заполняется s-подуровень, то s-семейство или s-элемент; p-подуровень – p‑элемент; d-подуровень – d-элемент; f-подуровень – f-элемент.
В короткопериодной форме периодической системы 8 групп, каждая из которых делится на главную и побочную подгруппы. I и II главные подгруппы заполняются s-элементами; III‑VIII главные подгруппы – р-элементами. d-элементы находятся в побочных подгруппах. f-элементы вынесены в отдельные группы.
Таким образом, каждый элемент в периодической системе элементов занимает строго определенное место, которое отмечается порядковым номером и связано со строением электронных оболочек атома.
1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
Экспериментальными исследованиями была установлена зависимость химических и физических свойств элементов от их положения в периодической системе.
Энергией ионизации называется энергия, которую надо затратить для отрыва и удаления электрона от атома, иона или молекулы. Она выражается в Дж или эВ (1эВ=1,6.10-19 Дж).
Энергия ионизации является мерой восстановительной способности атома. Чем ниже значение энергии ионизации, тем выше восстановительная способность атома. Атомы, теряя электрон, превращаются в положительно заряженные ионы.
Сродство к электрону
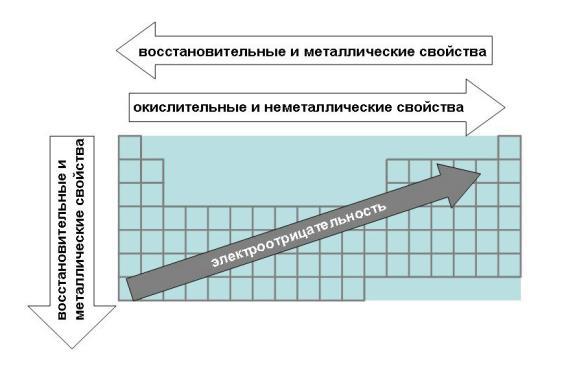
Энергия сродства к электрону атомов закономерно изменяется в соответствии с характером электронных структур атомов элементов. В периодах слева направо сродство к электрону и окислительные свойства элементов возрастают. В группах сверху вниз сродство к электрону, как правило, уменьшается.
Галогены отличаются самым высоким сродством к электрону, т.к. присоединяя один электрон к нейтральному атому, она приобретает законченную электронную конфигурацию благородного газа.
Характеристика о том, какой из атомов легче отдает или присоединяет электрон, называется электроотрицательностью которая равна полусумме энергии ионизации и сродства к электрону.
Электроотрицательность возрастает в направлении слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов одной и той же группы ПС.
Атомные и ионные радиусы
Атомы и ионы не имеют строго определенных границ вследствие волновой природы электронов. Поэтому определяют условные радиусы атомов и ионов, связанных друг с другом химической связью в кристаллах.
Радиусы атомов металлов в периодах с ростом порядкового номера элементов уменьшаются, т.к. при одинаковом числе электронных слоев возрастает заряд ядра, а, следовательно, и притяжение им электронов.
В пределах каждой группы элементов, как правило, радиусы атомов увеличиваются сверху вниз, т.к. возрастает число энергетических уровней. Радиусы ионов также находятся в периодической зависимости от порядкового номера элемента.
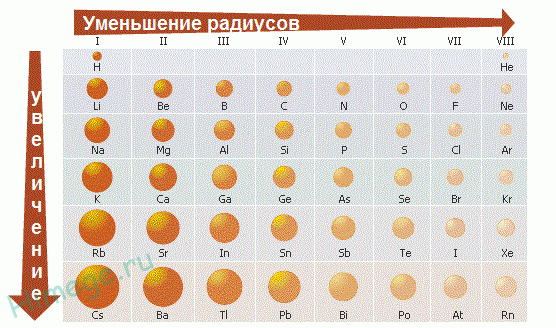
Пример. Как изменяются размеры атомов внутри периода, при переходе от одного периода к другому и в пределах одной группы? Какие элементы имеют минимальное и максимальное значения размера атома?
Решение.
Внутри периода (слева направо) размеры атомов уменьшаются, т.к. увеличивается заряд ядра и электроны сильнее притягиваются к ядру. В главных подгруппах размеры атомов увеличиваются, т.к. увеличивается число электронных слоев. В побочных подгруппах такие изменения меньше заметны, за счет d -сжатия, а при переходе из V в VI период происходит даже уменьшение уменьшение размеров атомов за счет f -сжатия.
Согласно этим правилам минимальное значение размера атома имеет гелий, а максимальное – цезий. Франций не имеет долгоживущих изотопов (природный изотоп радиоактивен, период полураспада 21 минута).
Металлы и неметаллы. Деление элементов и простых веществ на металлы и неметаллы в известной степени условно.
По физическим свойствам металлы характеризуются высокой теплопроводностью и электрической проводимостью, отрицательным температурным коэффициентом проводимости, специфическим металлическим блеском, ковкостью, пластичностью и т.п.По химическим свойствам металлы характеризуются основными свойствами оксидов и гидроксидов и восстановительными свойствами.
Подобные различия в свойствах простых веществ связаны с характером химической связи при их образовании. Металлическая связь в металлах образуется при дефиците валентных электронов, а ковалентная в неметаллах при их достаточном количестве. Исходя из этого, можно провести вертикальную границу между элементами IIIA и IV групп. Слева – элементы с дефицитом валентных электронов, справа – с избытком. Это граница Цинтля.
Пример. Чем отличаются типичные металлы от неметаллов? Почему и как изменяются металлические свойства с увеличением порядкового номера элементов?
Решение.
В периодической системе элементов в основном находятся металлы, неметаллов немного (всего 22). К металлам относятся все s -элементы. Это связано с наличием у них малого числа валентных электронов (1 или 2), в результате этого дефицита электронов образуется металлическая связь.
Все d — и f -элементы тоже являются металлами. При образовании химических связей в качестве валентных электронов у атомов d -элементов выступают s -электроны внешнего энергетического уровня и часть или все d -электроны предпоследнего уровня, причем d -электроны участвуют в образовании химических связей лишь после того, как будут связаны все внешние s -электроны. Кроме того, легкости удаления s -электронов способствует эффект экранирования заряда ядра. Он состоит в уменьшении воздействия на электрон положительного заряда ядра из-за наличия между рассматриваемым электроном и ядром других электронов (это d — или f -электроны).
У р-элементов происходит конкуренция между увеличением числа валентных электронов (неметаллические свойства) и экранированием заряда ядра (усиливаются металлические свойства). В связи с этим у р-элементов по подгруппе сверху вниз увеличивается устойчивость низших степеней окисления.
По периоду справа налево увеличиваются неметаллические свойства атомов, за счет увеличения заряда ядра атома и трудности отдачи электронов. По подгруппе сверху вниз увеличиваются металлические свойства, т. к. ослабевает связь внешних электронов с ядром.
Свойства соединений подразделяются на кислотно-основные и окислительно-восстановительные. Периодическая система элементов хорошо объясняет эти закономерности. Рассмотрим это на примере гидроксидов.
Если элемент имеет степень окисления маленькую (+1 или +2), например, Na—O—H, то связь Na—O менее прочная, чем O—H и разрыв связи происходит по менее прочной связи.
Na—O—H Na+ + OH—. Соединение обладает основными свойствами.
Если степень окисления элемента большая (от +5 до +7), то связь элемент – кислород прочнее, чем связь О—Н и соединение обладает кислотными свойствами. В азотной кислоте степень окисления азота большая (+5).

H+ + NO3—
Степень окисления элемента | +1 и +2 | +3 и +4 | +5, +6, +7 |
Кислотно- основные свойства | Основания | Амфотерные соединения | Кислоты |
Исключения | La3+, Bi3+, Tl3+ | Zn+2, Be+2, Sn+2, Pb+2, Ge+2 | Гидроксиды неметаллов в любой степени окисления образуют только кислоты |
Соединения в степени окисления +3 и +4 проявляют амфотерные свойства, т.е. в зависимости от партнера по реакции могут проявлять как кислотные, так и основные свойства. Но есть исключения Zn+2, Be+2, Sn+2, Pb+2, Ge+2 имеют степень окисления +2, но являются амфотерными соединениями.
По периоду справа налево увеличивается высшая степень окисления, равная номеру группы, поэтому увеличиваются неметаллические и кислотные свойства.
По подгруппе сверху вниз увеличиваются металлические и основные свойства, т.к. увеличивается размер атома и связь с соседним атомом ослабляется.
Таким образом, периодическая система позволяет проанализировать положение простых веществ в связи с особенностями их свойств (металлы, неметаллы).
Периодический закон Менделеева дает возможность определять и свойства простых веществ в химических соединениях. Впервые предсказание свойств было осуществлено самим Менделеевым. Он рассчитал свойства и тех элементов, которые еще не были открыты.
studfile.net
Периодический закон. Периодическая система химических элементов Д.И.Менделеева и строение атома
“Другого ничего в природе нет
Ни здесь, ни там, в космических глубинах:
Все: от песчинок малых до планет –
Из элементов состоит единых.
Как формула, как график трудовой,
Строй менделеевской системы строгий
Вокруг тебя творится мир живой,
Входи в него, вдыхай, руками трогай!”
“Периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает”.
Цель урока:
Обобщить знания учащихся по теме, проверить степень усвоения материала, стимулировать познавательную активность ребят, развить интерес к предмету, смекалку, эрудицию, умение быстро и четко формулировать и высказывать свои мысли, логически рассуждать, применять свои знания на практике, воспитывать чувство сопричастности общему делу, умение работать коллективно, работать с дополнительной литературой. Повторить, систематизировать и обобщить сведения о химических элементах в свете строения атомов.
Уметь давать характеристику S, P, d элементов, составлять схемы электронного строения, электронные и графические формулы; делать обобщения, выводы.
Практическая направленность урока.
Форма урока:
“Семинарное занятие смешанного вида”.
Оборудование: Периодическая система химических элементов Д.И.Менделеева, таблица для составления кроссворда, задания на карточках.
Особенности урока:
(Продолжительность урока семинара 2 часа, дифференцированный подход к учащимся, задания для докладов даны за неделю до урока.)
Ход урока
1. Вступительное слово учителя (тема урока, цель урока, стихи по теме).
2. Проверка умения написания учащимися схем электронного строения атомов, электронных формул (карточки-задания – Приложение 6). Выбор учащимися дифференцированного задания на оценку “3”, “4”, “5”.Выполнение взаимопроверки дифференцированных заданий.
3. Предпосылки открытия периодического закона: накопление фактологического
материала, работа предшественников (И.Я. Берцелиуса, И.В. Деберейнера, С.
Шанкуртуа, Д.А.Р.Ньюледса).
Съезд химиков в Карлсруэ, личностные качества Д.И.Менделеева).
(Приложение 2)
4. Открытие Д.И.Менделеевым периодического закона, его первая формулировка. Горизонтальные, вертикальные и диагональные периодические зависимости. (Приложение 3)
5. Кроссворд (задание: найти ключевое слово). Приложение 4, Приложение 5.
6. Периодический закон и строение атома. Изотопы. Современное понятие химического элемента. Закономерность Вен-ден-Брука. Мозли. Вторая формулировка периодического закона.
7. Программированное задание (найти код).
8. Периодическая система и строение атома. Физический смысл порядкового номера элемента, номера группы и периода. Причина изменения металлических и неметаллических свойств элементов в группах и периодах, в том числе больших и сверх больших.
- Путешествие в страну “Химический Элементарий”.
- Путешествие по периодам.
9. Значение периодического закона и периодической системы химических элементов Д.И.Менделеева для развития науки.
10. Закрепление материала.
11. Тестовые задания. Взаимопроверка. Учитель дает систему оценки результатов тестового задания, оценивает результаты. (Приложение 1)
12. Итоги урока.
13. Домашнее задание: Учебник О.С.Габриеляна и Г.Г.Лысовой, 1–5 повторить, ответить письменно на вопросы (1–7) на стр.42.
Основная схема урока.
| Инструкция для докладчика: | Инструкция для оппонента | Инструкция для рецензента: |
| 1. Строгое соблюдение соответствия выступления своей
теме. 2. Научность материала. 3. Последовательность и доказательность изложения. 4. Время изложения основных мыслей 5 минут. |
1. Определить соответствие ответа основного докладчика
с темой. 2. Дополнить материал в случае необходимости. |
1. Положительные, отрицательные стороны, выступления. 2. Обосновать свое заключение. 3. Рекомендации, оценки. |
Основные выводы на уроке-семинаре по теме: “Периодический закон и периодическая система химических элементов Д.И.Менделеева. Строение атома”.
Вывод по теме 1: В отличие от работ предшественников предложенная Д.И.Менделеевым таблица П.С. имела четкую структуру.
Вывод по теме 2: Открытие Д.И. Менделеевым П.З. позволило ученым предвидеть ряд фактов и явлений, предостерегающих развитие ученья о строении веществ.
Вывод по теме 3: Д.И.Менделеев, взяв за основу относительную атомную массу, сумел открыть периодическую зависимость свойств химических элементов и их соединений и предсказал, что, имея горизонтальную, вертикальную и диагональную зависимость, можно открыть новые химические элементы.
Вывод по теме 4: Изменение свойств в периодической системе объясняются знаниями строения атома
Вывод по теме 5: Периодическая система – графическое отображение периодического закона, где каждая величина имеет свой физический смысл и связана со строением атома.
Приложение 7.
Приложение 8.
Приложение 9.
urok.1sept.ru
периодический закон д и менделеева и строение атома – Рамблер/класс
Валентные электроны — электроны атома, которые могут принимать участие в образовании химических связей. У любого атома это все внешние электроны плюс те предвнешние электроны, энергия которых больше, чем у внешних. Например: у атома Ca внешние электроны — 4s2, они же и валентные; у атома Fe внешние электроны — 4s2, но у него есть 3d6, следовательно у атома железа 8 валентных электронов. Валентная электронная формула атома кальция — 4s2, а атома железа — 4s23d6.
Периодическая система химических элементов Д. И. Менделеева
(естественная система химических элементов)
Периодический закон химических элементов (современная формулировка): свойства химических элементов, а также простых и сложных веществ, ими образуемых, находятся в периодической зависимости от значения заряда из атомных ядер.
Периодическая система — графическое выражение периодического закона.
Естественный ряд химических элементов — ряд химических элементов, выстроенных по возрастанию числа протонов в ядрах их атомов, или, что то же самое, по возрастанию зарядов ядер этих атомов. Порядковый номер элемента в этом ряду равен числу протонов в ядре любого атома этого элемента.
Таблица химических элементов строится путем «разрезания» естественного ряда химических элементов на периоды (горизонтальные строки таблицы) и объединения в группы (вертикальные столбцы таблицы) элементов, со сходным электронным строением атомов.
В зависимости от способа объединения элементов в группы таблица может быть длиннопериодной (в группы собраны элементы с одинаковым числом и типом валентных электронов) и короткопериодной (в группы собраны элементы с одинаковым числом валентных электронов).
Группы короткопериодной таблицы делятся на подгруппы (главные и побочные), совпадающие с группами длиннопериодной таблицы.
У всех атомов элементов одного периода одинаковое число электронных слоев, равное номеру периода.
Число элементов в периодах: 2, 8, 8, 18, 18, 32, 32. Большинство элементов восьмого периода получены искусственно, последние элементы этого периода еще не синтезированы. Все периоды, кроме первого начинаются с элемента, образующего щелочной металл (Li, Na, K и т. д.), а заканчиваются элементом, образующим благородный газ (He, Ne, Ar, Kr и т. д.).
В короткопериодной таблице — восемь групп, каждая из которых делится на две подгруппы (главную и побочную), в длиннопериодной таблице — шестнадцать групп, которые нумеруются римскими цифрами с буквами А или В, например: IA, IIIB, VIA, VIIB. Группа IA длиннопериодной таблицы соответствует главной подгруппе первой группы короткопериодной таблицы; группа VIIB — побочной подгруппе седьмой группы: остальные — аналогично.
Характеристики химических элементов закономерно изменяются в группах и периодах.
В периодах (с увеличением порядкового номера)
увеличивается заряд ядра,
увеличивается число внешних электронов,
уменьшается радиус атомов,
увеличивается прочность связи электронов с ядром (энергия ионизации),
увеличивается электроотрицательность,
усиливаются окислительные свойства простых веществ («неметалличность»),
ослабевают восстановительные свойства простых веществ («металличность»),
ослабевает основный характер гидроксидов и соответствующих оксидов,
возрастает кислотный характер гидроксидов и соответствующих оксидов.
class.rambler.ru
Конспект урока «Периодический закон и периодическая система химических элементов Д.И.Менделеева»
Тема. Периодический закон и периодическая система Д.И. Менделеева
Цель:
Формировать у учащихся представления о том, что объективно существующая взаимосвязь между химическими элементами и образуемыми веществами подчинена периодическому закону и отражена в периодической системе; рассмотреть структуру периодической системы, сформировать понятие про периоды и группы;
Развивать умения анализировать информацию и делать выводы, навыки использования Периодической системы для поиска информации о химических элементах и их свойствах;
Воспитывать познавательный интерес к предмету.
Ход урока
І. Организационный момент
ІІ. Актуализация опорных знаний
Беседа
1. Что такое классификация?
2. Кто из ученых-химиков предпринимал попытки классификации химических элементов? Какие характеристики они брали за основу?
3. Какие группы химических элементов вам знакомы? Дайте их краткую характеристику. (Щелочные металлы, щелочноземельные металлы, галогены, инертные газы)
ІІІ. Изучение нового материала
1. История открытия Периодического закона
На прошлом уроке мы узнали, что середине XIX в. знаний о химических элементах стало достаточно, а число элементов возросло настолько, что в науке возникла естественная потребность в их классификации. Первые попытки классификации элементов оказались несостоятельными. Предшественники Д.И.Менделеева (И. В. Деберейнер, Дж. А. Ньюлендс, Л. Ю. Мейер) многое сделали для подготовки открытия периодического закона, но не смогли постичь истину.
Они использовали один из двух подходов к построению системы:
1. Объединение элементов в группы по сходству состава и свойств образованных ими веществ.
2. Расположение химических элементов в порядке увеличения их атомной массы.
Но ни один, ни другой подход не привели к созданию системы, объединяющей все элементы.
Проблема систематизации химических элементов заинтересовала и молодого 35-летнего профессора Педагогического университета Д.И. Менделеева. В 1869 году он работал над созданием учебника для студентов «Основы химии». Ученый хорошо понимал, что для того чтобы студенты лучше разобрались в разнообразии свойств химических элементов, эти свойства нужно систематизировать.
К 1869 году было известно 63 химических элемента, для многих из которых были неверно определены относительные атомные массы.
Менделеев расположил химические элементы в порядке возрастания их атомных масс и заметил, что свойства элементов повторяются через определенный промежуток – период, Дмитрий Иванович расположил периоды друг под другом, так, чтобы сходные элементы располагались друг под другом – на одной вертикали, так была построена периодическая система элементов.
В результате кропотливой работы в течение 15 лет по исправлению атомных масс и валентности элементов, а также по выяснению места еще не открытых химических элементов Д.И. Менделеев открыл закон, который назвал Периодическим законом.
Свойства химических элементов, простых веществ, а также состав и свойства соединений находятся в периодической зависимости от значений атомных масс.
1 марта 1869г. (18 февраля по старому стилю)- дата открытия Периодического закона.
К сожалению, сторонников периодического закона сначала было очень мало. Противников – много, особенно в Германии и Англии.
Открытие периодического закона – это блестящий образец научного предвидения: в 1870 г. Дмитрий Иванович предсказал существование трех еще неизвестных тогда элементов, которые назвал экасилицием, экаалюминием и экабором. Он сумел правильно предсказать и важнейшие свойства новых элементов. И вот через 5 лет, в 1875 г., французский ученый П.Э. Лекок де Буабодран, ничего не знавший о работах Дмитрия Ивановича, открыл новый металл, назвав его галлием. По ряду свойств и способу открытия галлий совпадал с экаалюминием, предсказанным Менделеевым. Но его вес оказался меньше предсказанного. Несмотря на это, Дмитрий Иванович послал во Францию письмо, настаивая на своем предсказании.
Ученый мир был ошеломлен тем, что предсказание Менделеевым свойств экаалюминия оказалось таким точным. С этого момента периодический закон начинает утверждаться в химии.
В 1879 г. Л. Нильсон в Швеции открыл скандий, в котором воплотился предсказанный Дмитрием Ивановичем экабор.
В 1886 г. К. Винклер в Германии открыл германий, который оказался экасилицием.
Но гениальность Дмитрия Ивановича Менделеева и его открытия — не только эти предсказания!
В четырёх местах периодической системы Д. И. Менделеев расположил элементы не в порядке возрастания атомных масс:
Ar – K, Co – Ni, Te – I, Th – Pa
Ещё в конце 19 века Д.И. Менделеев писал, что, по-видимому, атом состоит из других более мелких частиц. После его смерти в 1907 г. было доказано, что атом состоит из элементарных частиц. Теория строения атома подтвердила правоту Менделеева, перестановки данных элементов не в соответствии с ростом атомных масс полностью оправданы.
Графическим изображением периодического закона является периодическая система химических элементов. Это краткий конспект всей химии элементов и их соединений.
2. Структура Периодической системы
Существует длинный и короткий вариант таблицы
Каждый элемент находится в определённой клетке периодической системы.
Какую информацию она несёт? (символ элемента, порядковый номер, название элемента, название простого вещества, относительная атомная масса)
Составными частями таблицы являются периоды и группы.
Учитель показывает период в таблице и просит учащихся самих сформулировать определение. Потом сравниваем с определением в учебнике (стр. 140).
Период — это горизонтальный ряд химических элементов, который начинается щелочным металлом и заканчивается инертным элементом.
Учитель показывает группу в таблице и просит учащихся самих сформулировать определение. Потом сравниваем с определением в учебнике (стр. 140).
Периоды бывают большие и малые.
Какие периоды большие? Малые?
Как изменяются металлические свойства в периоде слева направо? Усиливаются или ослабевают? Почему вы так считаете?
Металлические свойства в периоде слева направо ослабевают, следовательно, неметаллические усиливаются. Причину этого мы узнаем, изучив строение атома на последующих уроках.
У какого элемента ярче выражены металлические свойства: Аg-Cd? Mg-Al?
У какого элемента ярче выражены неметаллические свойства: О-N? S-Cl?
Группа — это вертикальный столбик элементов, который содержит подобные по свойствам элементы. (записать в тетрадь)
Группа делится на главную (а)и побочную (в).
В главную подгруппу входят элементы как малых, так и больших периодов. В побочную- только больших. Побочные подгруппы содержат только металлические элементы (переходные металлы)
Назовите элементы второй группы, главной подгруппы.
Назовите элементы пятой группы, побочной подруппы.
Назовите элементы восьмой группы, главной подруппы. Как они называются?
IV. Обобщение и систематизация знаний
V.Подведение итогов урока, оценивание знаний учащихся
VІ. Домашнее задание
infourok.ru
Периодический закон и периодическая система химических элементов Д.И. Менделеева в свете теории строения атома
Методическая разработка
Автор: Мирошник Елена Васильевна
Тема № 2. Периодический закон и периодическая система химических элементов Д.И. Менделеева в свете теории строения атома
Урок № 5. Повторение и обобщение изученного материала
Тип урока: Урок контроля знаний и умений.
Формирование УУД:
Познавательные УУД
Продолжить формирование умения работать с периодической таблицей.
Продолжить формирование умения находить отличия, сравнивать и выделять признаки.
Коммуникативные УУД
Продолжить формирование умения самостоятельно организовывать учебное взаимодействие при работе в группе (паре).
Продолжить формирование умения слушать товарища и обосновывать свое мнение.
Продолжить формирование умения выражать свои мысли и идеи.
Регулятивные УУД
Продолжить формирование умения определять цель учебной деятельности.
Продолжить формирование умения определять взаимосвязь между строением и свойствами.
Продолжить формирование умения работать по плану, сверять свои действия с целью и при необходимости исправлять ошибки самостоятельно.
Продолжить обучение основам самоконтроля, самооценки и взаимооценки.
Личностные УУД
Создание условий (ДЗ) к саморазвитию и самообразованию на основе мотивации к обучению и самопознанию.
Осознавать неполноту знаний, проявлять интерес к новому содержанию.
Устанавливать связь между целью деятельности и ее результатом
Формы работы: индивидуальная, фронтальная.
Методы: частично-поисковый.
Информационно-технологические ресурсы: учебник, раздаточный материал, ПК.
Основные термины и понятия: периодический закон, периодическая таблица, строение атома, заряд ядра, протоны, электроны, нейтроны, изотопы.
Методы проведения.
1. Словесные (беседа, фронтальный устный опрос).
2. Наглядные (демонстрация).
3. Практические (фронтальный письменный опрос (тестовое задание), индивидуальный письменный опрос, лабораторный эксперимент).
Раздаточный материал: карточки с дидактическим материалом на каждый стол с индивидуальным заданием, с тестовым заданием.
Ход урока
I. Организация начала занятий.
Дидактическая задача. Подготовить учащихся к работе на уроке.
Проверить у учащихся готовность к уроку, на столах должны быть тетрадь, дневник, учебник, письменные принадлежности.
II. Подготовка к основному этапу занятий.
Дидактическая задача. Обеспечение мотивации и принятия учащимися цели учебно-познавательной деятельности, актуализация опорных знаний и умений.
На предыдущих уроках была рассмотрена тема «Периодический закон и периодическая система химических элементов Д.И. Менделеева в свете теории строения атома».
В своих дневниковых записях в 1905 г. Дмитрий Иванович отметил: «По видимости периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает…»
Совместно с учащимися формулируем цели урока.
Цель урока.
1. Обобщить знания периодического закона и периодической системы.
2. Систематизировать знания о важнейших закономерностях, заложенных в периодической системе.
3. Уметь применять знания о строении атомов, о периодичности изменения свойств элементов при решении химических задач.
К данному уроку вы должны были повторить изученный материал по плану.
План. (План повторения учебного материала к уроку.)
I. Краткие сведения о строении атома.
1. Распределение электронов по энергетическим уровням.
2. Строение ядра атома.
3. Изотопы.
II. Периодический закон и периодическая система.
1. Строение атомов и периодический закон.
2. Зависимость свойств элементов от строения атомов.
3. Зависимость свойств соединений элементов от величины заряда и радиуса ионов.
4. Значение периодического закона.
III. Обобщение и систематизация знаний.
Дидактическая задача. Формирование целостной системы ведущих знаний по теме.
IV. Контроль и самопроверка знаний.
Дидактическая задача. Выявление качества и уровня овладения знаниями и способами действия.
Фронтальный устный опрос. (на слайдах 4-9).
Вопросы к классу.
1. В каком году был открыт периодический закон? (1 марта 1869г.)
2. Дайте современную формулировку периодического закона. (Свойства химических элементов, а также их соединений находятся в периодической зависимости от зарядов ядер атомов.)
3. Чем отличается современная формулировка периодического закона от данной Менделеевым? (За основу Менделеев брал атомный вес элемента.)
4. При создании периодической системы Д.И. Менделеев расположил два соседних элемента (какие?) V периода не в порядке возрастания атомного веса. Почему это пришлось сделать? (Te, I)
5. Можете ли вы привести дополнительные примеры подобных несоответствий? (Ar-K, Co-Ni)
6. Фотографии Лекока де Буабодрана, Винклера и Нильсона Д.И. Менделеев заключил в общую рамку и озаглавил ее . . . . Почему?
Следующий этап нашей работы — фронтальный письменный опрос. (В тестовой форме.)
Вопросы фронтального письменного опроса.
1. Химические свойства вещества определяются тремя субатомными частицами. Две из них имеют одинаковый по величине, но противоположный по знаку заряд, а третья не имеет заряда.
Эти частицы называются______________, _________________ и _______________.
2. Из перечисленных ниже характеристик атомов элементов периодически изменяются:
а) заряд ядра атома;
б) относительная атомная масса;
в) число энергетических уровней в атоме;
г) число электронов на внешнем энергетическом уровне.
3. Атом какого из элементов легче всего отдает один электрон:
а) натрий, порядковый номер 11;
б) магний, порядковый номер 12;
в) алюминий, порядковый номер 13;
г) кремний, порядковый номер 14?
4. Число протонов в ядре равно:
а) числу нейтронов в ядре;
б) номеру группы;
в) числу электронов в атоме;
г) суммарному числу электронов и нейтронов?
5. Атом элемента имеет порядковый номер 13 и массовое число 27. Число валентных электронов у него равно:
а) 5; в) 3;
б) 2; г) 4.
6. Массовое число изотопа равно:
а) числу протонов в ядре;
б) числу нейтронов в ядре;
в) числу орбитальных электронов;
г) суммарному числу нейтронов и протонов.
7. Элемент с порядковым номером 38 должен обладать свойствами, сходными с:
а) платиной; в) кальцием;
б) свинцом; г) ртутью.
8. Неметаллические свойства элементов, расположенных в главных подгруппах периодической системы Д.И. Менделеева, наиболее ярко выражены у тех из них, которые находятся:
а) в верхней части подгруппы;
б) в нижней части подгруппы;
в) в середине подгруппы;
г) у всех элементов подгруппы выражены примерно в одинаковой степени.
9. Неизвестный элемент Э образует хлорид состава ЭCl3. Какая наиболее вероятная формула у его оксида:
а) ЭО2; в) Э2О3;
б) ЭО3; г) Э3О2.
10. Элементы IА группы периодической системы
а) называются щелочными металлами;
б) принимают электроны;
в) имеют атомы с числом электронов на один меньше, чем нужно для достижения электронной конфигурации инертного газа;
г) образуют высшие оксиды с общей формулой R2О3.
— Выполненные работы передаем соседу по столу и выполняем взаимопроверку. Оцениваем работы.
Ответы (на слайде 10):
электрон, протон и нейтрон
г
а
в
в
г
в
а
в
а
Следующий этап урока — лабораторный эксперимент (на слайдах 11-14).
Перед проведением эксперимента повторим правила техники безопасности.
1. При работе со спиртовкой соблюдайте следующие правила:
1) Пользуясь спиртовкой, нельзя зажигать ее от другой спиртовки.
2) Чтобы погасить пламя спиртовки, ее следует закрыть колпачком.
2. Особую осторожность соблюдайте при работе со щелочами. Если случайно щелочь попадет на руки или на одежду, немедленно смойте ее большим количеством воды.
Задача. Подтвердите закономерное изменение свойств элементов и их соединений по периодической системе в периоде на примере взаимодействия натрия, магния и алюминия с водой. Объяснить причину закономерности ослабления металлических свойств в периоде в ряду Na — Mg — Al.
Задание. Объясните химическую активность исследуемых металлов в свете строения их атомов (слайд 15).
Формулируем вывод (слайд 16):
В периодах слева направо металлические свойства ослабевают, а неметаллические усиливаются, т.к. заряд ядра и количество валентных электронов увеличивается и радиусы атомов уменьшаются.
Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Письменная работа по вариантам.
Задание. Работу выполняем на листочках, листы подписываем, отвечаем на предложенные вопросы.
Вопросы письменной работы. (3 варианта)
— 1 —
1. Определите элемент по указанному числу протонов, нейтронов и электронов:
протонов — 6, нейтронов — 6, электронов — 6. Элемент . . .
2. Изобразите схему строения атома кремния.
3. На основании положения элемента в периодической системе напишите его соединения, формы которых указаны ниже:
Элемент Гидрид Высший оксид Гидроксид
K … … …
— 2 —
1. Определите элемент по указанному числу протонов, нейтронов и электронов:
протонов — 10, нейтронов — 10, электронов — 10. Элемент . . .
2. Изобразите схему строения атома серы.
3. На основании положения элемента в периодической системе напишите его соединения, формы которых указаны ниже:
Элемент Гидрид Высший оксид Гидроксид
Cs … … …
— 3 —
1. Определите элемент по указанному числу протонов, нейтронов и электронов:
протонов — 15, нейтронов — 16, электронов — 15. Элемент . . .
2. Изобразите схему строения атома хлора.
3. На основании положения элемента в периодической системе напишите его соединения, формы которых указаны ниже:
Элемент Гидрид Высший оксид Гидроксид
Na … … …
(Ответы.
Вариант 1.
1. C.
2. 2е—, 8е—, 4е—.
3. KH, K2O, KOH.
Вариант 2.
1. Ne.
2. 2е—, 8е—, 6е—.
3. CsH, Cs2O, CsOH.
Вариант 3.
1. P.
2. 2е—, 8е—, 7е—.
3. NaH, Na2O, NaOH.)
Выполненные работы передаются на первый стол.
V. Информирование о домашнем задании, инструктаж по его выполнению.
Дидактическая задача. Обеспечение понимания цели, содержания и способов выполнения домашнего задания. Проверка соответствующих записей.
Д/з. Подготовить презентацию «Дмитрий Иванович Менделеев». Повторить термины: типы кристаллических решеток.
VI. Рефлексия. Подведение итогов занятия.
Дидактическая задача. Дать анализ и оценку успешности достижения цели и наметить перспективу последующей работы.
Итоговые вопросы.
1. Какой материал мы рассмотрели на уроке?
2. Каково значение периодического закона для развития науки и производства?
В завершение я прошу вас поделиться своими впечатлениями об уроке (на слайде 17).
Все ли вам было понятно в течение урока?
Какая часть урока показалась самой интересной?
Какая часть урока вызвала затруднение?
Какое у вас настроение после урока?
Учитель подводит итог урока.
Сегодня на уроке мы рассмотрели важные вопросы, которые послужат нам теоретической основой в процессе дальнейшего изучения химии.
Литература
Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учеб. для общеобразоват. учреждений с прил. на электрон. носителе : базовый уровень / Г.Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение.
Гара Н.Н. Химия: Программы общеобразовательных учреждений: 8-9 классы, 10-11 классы /Пособие для учителей общеобразовательных учреждений. Базовый уровень.– М.: Просвещение.
Гара Н.Н. Химия. Уроки в 11 классе: метод. пособие для учителей общеобразоват. учреждений. — М.: Просвещение.
Радецкий А.М. Химия. Дидактический материал. 10-11 классы: пособие для учителей общеобразовательных учреждений. – М.: Просвещение.
Габриелян О.С. Настольная книга учителя. Химия. 11 класс / О.С. Габриелян, Н.П. Воскобойникова, А.В. Яшукова. – М.: Дрофа.
Гольдфарб Я.Л., Ходаков Ю.В., Додонов Ю.Б. Сборник задач и упражнений по химии.
Габриелян О.С., Воскобойникова Н.П. Химия в тестах, задачах, упражнениях. 10-11 классы.
infourok.ru
Периодический закон и периодическая система химических элементов Д.И. Менделеева на основе представлений о строении атома. Значение периодического закона для развития науки
Билеты по химии.
Билет №1
1. Периодический закон и периодическая система химических элементов Д.И. Менделеева на основе представлений о строении атома. Значение периодического закона для развития науки.
2. Предельные углеводороды, общая формула гомологов данного ряда, электронное и пространственное строение. Свойства метана.
Билет №2
1. Виды химической связи в органических и неорганических соединениях: ионная, металическая, водородная, ковалентная (полярная, неполярная): простые и кратные связи.
2. Непредельные углеводороды ряда этилена, химические свойства этена.
Билет №3
1. Классификация химических реакций в неорганической и органической химии.
2. Диеновые углеводороды, их строение, свойства, получение и практическое значение.
Билет №4
1. Общие способы получения металлов. Практическое значение электролиза.
2. Ацетилен – представитель углеводородов с тройной связью в молекуле. Химические свойства, получение и применение ацетилена в органическом синтезе.
Билет №5
1. Скорость химических реакций. Зависимость скорости от природы, концентрации вещества, площади поверхности соприкосновения реагирующих веществ, температуры, катализатора.
2. Ароматические углеводороды. Бензол, структурная формула. Свойства и получение. Применение бензола и его гомологов.
Билет №6
1. Основные положения теории химического строения органических веществ А.М. Бутлерова. Химическое строение как порядок соединения и взаимного влияния в молекулах. Основные направления развития этой теории.
2. Реакция ионного обмена. Условия их необратимости
Билет №7
1. Циклопарафины, их строение, свойства, нахождение в природе.
2. Классификация неорганических веществ.
Билет №8
1. Металлы, их положение в периодической системе химических элементов Д.И. Менделеева, строение их атомов. Металлическая и химическая связь. Общие химические свойства металлов как восстановителей.
2. Охрана окружающей среды.
Билет №9
1. Неметаллы, их положение в периодической системе химических элементов Д.И. Менделеева, строение их атомов. Изменение окислительно-восстановительных свойств неметаллов на примере элементов подгруппы кислорода
2. Предельные одноатомные спирты, их строение, физические и химические свойства. Получение и применение этилового спирта.
Билет №10
1. Железо, положение в периодической системе химических элементов Д.И. Менделеева, строение атома, возможные степени окисления. Физические свойства, взаимодействие с кислородом, галогенами, растворами кислот и солей. Роль железа в современной технике.
2. Фенол, его строение, свойства, получение и применение.
Билет №11
1. Электрохимический ряд напряжений металлов. Вытеснение металлов из солей другими металлами.
2. Альдегиды, их строение и свойства. Получение, применение муравьиного и уксусного альдегидов.
Билет №12
1. Высшие оксиды химических элементов третьего периода. Закономерности в измерении их свойств в связи с положением химических элементов в периодической системе. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
2. Жиры, их свойства и состав. Жиры в природе, превращение жиров в организме. Продукты технической переработки жиров, понятие о синтетических моющих средствах. Защита природы от загрязнения СМС.
Билет №13
1. Кислоты, их классификация и свойства на основе представлений об электролитической диссоциации.
2. Общая характеристика высокомолекулярных соединений: состав, строение, реакции лежащие в основе их получения, на примере полиэтилена или синтетического каучука (Термопластичные и термореактивные пластмассы).
Билет №14
1. Основания, их классификация и свойства на основе представлений об электролитической диссоциации.
2. Глюкоза – представитель моносахаридов, строение, физические и химические свойства, применение.
Билет №15
1. Соли, их состав и названия, взаимодействие с металлами, кислотами, щелочами, друг с другом с учётом особенностей реакции окисления – восстановления и ионного обмена.
2. Крахмал, нахождение в природе, практическое значение, гидролиз крахмала.
Билет №16
1. Химическая и электрохимическая коррозия металлов. Условия, при которых происходит коррозия. Меры защиты металлов и сплавов от коррозии.
2. Аминокислоты, их строение и химические свойства: взаимодействие с соляной кислотой, щелочами, друг с другом. Биологическая роль аминокислот и их применение.
Билет №17
1. Взаимосвязь строения, свойства и применения на примере простых веществ.
2. Белки – как биополимеры. Первичная, вторичная и третичная структура белков. Свойства и биологические свойства белков.
Билет №1
Периодический закон и периодическая система химических элементов Д.И. Менделеева на основе представлений о строении атома. Значение периодического закона для развития науки.
В 1869 году Менделеев открыл периодический закон, который читается так:
Свойства химических элементов и образуемых ими соединений находятся в периодической зависимости от зарядов ядер атомов. Графическим отображением периодического закона является периодическая система, которая делится на семь периодов и восемь групп.
Периоды – это горизонтальные ряды, которые начинаются щелочным металлом и заканчиваются благородным газом, т.е. в периоде с слева на право увеличиваются окислительные свойства, периоды делятся на малые и большие.
Номер периода показывает количество энергетических уровней, которые делятся на S, P, D, F подуровни. Количество электронов на энергетическом уровне определяется по формуле N=2n2n–порядковый номер энергетического уровня.
Группы –вертикальные ряды, которые делятся на главные и побочные группы. Номер группы показывает количество электронов на внешнем энергетическом уровне элементов главных подгрупп. В побочных подгруппах находятся dэлементы и на внешнем уровне имеют два электрона.
Порядковый номер показывает количество протонов (заряд ядра атома) и количество электронов. Атомная масса – это масса протонов и нейтронов
megaobuchalka.ru