| | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Личная жизнь инженеров / / Инженеры и еда. Рецепты, полезности. Трюки для ресторанов. / / Плотность и масса в популярных объемах пищевых продуктов. Сколько крупы, соли, сахара в стакане, ложке и т.д. Вооружаемся для прочтения дебильных рецептов на упаковках. Поделиться:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Плотность солей. Температура плавления соли
В таблице представлена плотность расплава солей (жидкой соли) и элементов, образующих эти соли, а также их температура плавления. Плотность соли дана при температуре расплава, в размерности г/см3.
Рассмотрены следующие соли: бромид, хлорид, йодид, нитрат, сульфат, фторид, карбонат; соли следующих металлов: серебра, алюминия, мышьяка, золота, бора, бария, бериллия, висмута, кальция, кадмия, церия, кобальта, хрома, цезия, меди, диспрозия, эрбия, европия, железа, галлия, гадолиния, германия, гафния, ртути, гольмия, индия, иридия, калия, лантана, лития, лютеция, магния, марганца, молибдена, натрия, неодима, никеля, осмия, свинца, палладия, празеодима, платины, плутония, рубидия, рения, родия, рутения, сурьмы, скандия, селена, самария, олова, стронция, тантала, тербия, теллура, тория, титана, таллия, тулия, урана, ванадия, вольфрама, иттрия, иттербия, цинка, циркония.
Следует отметить, что наибольшей плотностью обладают жидкие соли таких тяжелых металлов, как свинец и уран. Например, плотность расплавов солей йодида свинца PbI2, по данным таблицы, равна 5,691 г/см3, а плотность тетрафторида урана UF4 составляет величину 6,485 г/см3. К легким солям, с малой плотностью относятся соли алюминия, бериллия, лития, калия и циркония.
Плотность большинства солей в жидком состоянии меньше, чем в твердом. Это объясняется увеличением объема соли при нагревании — жидкая соль всегда находится при высоких температурах. Например, плотность поваренной соли NaCl в кристаллическом состоянии при комнатной температуре равна 2,17 г/см3, а плотность жидкого хлорида натрия (при температуре 801°С) уменьшается и становится равной 1,556 г/см 3.
Наименьшая температура плавления соли в таблице соответствует хлориду олова SnCl4 — он плавится при температуре минус 33°С, то есть при комнатной температуре находится в жидком состоянии и на воздухе дымит из-за реакции с парами воды.
Самой тугоплавкой солью с максимальной температурой плавления, по данным таблицы, является фторид лантана LaF3 — фтористый лантан плавится при температуре 1493°С.
Источник:
Волков. А.И., Жарский. И.М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.
Изучите физические свойства: сахара, соли, лимонной кислоты
Изучите физические свойства: а) сахара и соли, б) лимонной кислоты и соды. Результаты проведённого анализа оформите в виде таблицы.
Ответа)
| Свойства вещества | Сахар | Поваренная соль |
|---|---|---|
| Агрегатное состояние | Твердое | Твердое |
| Цвет | Бесцветное | Бесцветное |
| Запах | Без запаха | Без запаха |
| Твердость | Хрупкое | Хрупкое |
| Растворимость | Растворимое в воде | Растворимое в воде |
| Температуры плавления и кипения | tплав. = 800.8°C, tкип. = 1465°C | tплав. = 186°C |
| Плотность | 1.59 г/см³ | 1.49 г/см³ |
| Тепло- и электропроводность | Плохой проводник тепла, не проводит электрический ток | Плохой проводник тепла, не проводит электрический ток (раствор и расплав проводят электрический ток) |
б)
| Свойства вещества | Лимонная кислота | Сода пищева |
|---|---|---|
| Агрегатное состояние | Твердое | Твердое |
| Цвет | Бесцветный | Бесцветный |
| Запах | Без запаха | Без запаха |
| Твердость | Хрупкое | Хрупкое |
| Растворимость | Растворимое | Растворимое |
| Температуры плавления и кипения | tплав. = 153°C | |
| Плотность | 1.67 г/см³ | 2.16 г/см³ |
| Тепло- и электропроводность | Плохой проводник тепла, не проводит электрический ток | Плохой проводник тепла, не проводит электрический ток |
gomolog.ru1https://gomolog.ru/reshebniki/8-klass/gabrielyan-2018/3/prim-1.html
gomolog.ru11https://gomolog.ru/reshebniki/8-klass/gabrielyan-2018/3/prim-1.html
Какова твердость соли по шкале твердости Мооса?
Поваренная соль — широко используемое в пищевой промышленности, медицине, животноводстве, косметологии и пр. с древних времен вещество. Получают этот белый кристаллический порошок разными методами. Это может быть, к примеру, выпаривание морской воды, добыча в карьерах, собирание со дна озер. Но в любом случае конечный продукт всегда имеет одинаковые физические характеристики. К примеру, какова твердость соли по шкале Мооса? Об и поговорим далее в статье. Также разберемся с тем, какие еще характеристики имеет этот очень популярный продукт.
Что такое шкала Мооса
Одним из отличительных признаков многих веществ на планете является степень твердости. Определять этот параметр принято по особой схеме, называемой шкалой Мооса. Для облегчения задачи по сравнению твердости разных веществ в эту систему включены 10 эталонных элементов. Твердость этих веществ при этом проверяется просто путем царапанья.
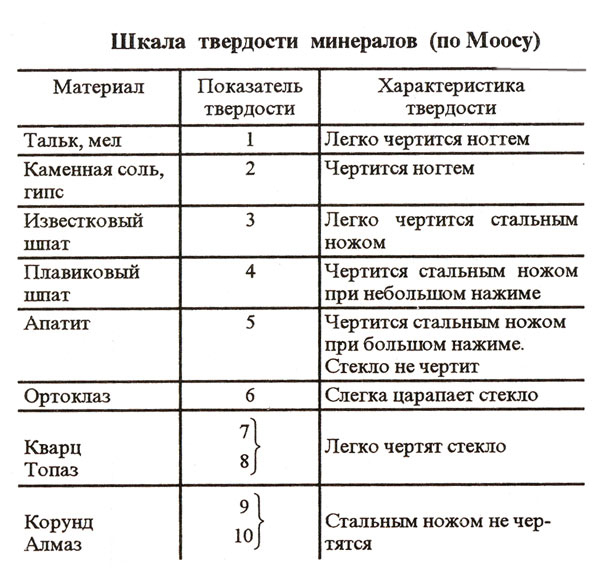
На первом месте в шкале Мооса находится самый твердый минерал на планете — алмаз. Этот драгоценный камень, как известно, не царапается даже прочным стальным ножом. Твердость алмаза по шкале Мооса, таким образом, равна 10. На втором месте в этой схеме находятся корунды — рубины и сапфиры. Их твердость равна 9. Самыми мягкими эталонными веществами шкалы Мооса являются тальк и мел. Их твердость в этой схеме определена как 1.
Что представляет собой соль
Химическая формула этого вещества выглядит следующим образом: NaCl. По-другому поваренную соль называют также хлористым натрием или каменной солью. В измельченном виде этот пищевой продукт представляет собой бесцветные кристаллы. Последние при этом могут иметь разные размеры. В любом случае в массе соль имеет белый цвет.
Основной особенностью хлористого натрия, как известно, является характерный вкус. В быту и в пищевой промышленности поваренная соль может добавляться в самые разные продукты. Как выяснили ученые, хлористый натрий является веществом, без которого жизнедеятельность человека невозможна вообще.
Какова твердость соли по шкале Мооса
В природе хлористый натрий является веществом очень распространенным. Поэтому каменная соль и была, помимо всего прочего, включена в качестве эталона в шкалу Мооса. Находится хлористый натрий в этой схеме на предпоследнем девятом месте. То есть твердость поваренной соли равна двум. Кристаллы хлористого натрия, как известно, отличаются хрупкостью и легко растворяются в воде. Выглядят соляные крупинки достаточно твердыми. Однако впечатление это по-большей мере обманчивое. На самом деле кристаллы соли легко царапаются даже просто ногтем.
Линейная твердость
Таким образом, как мы выяснили, занимает NaCl предпоследнее место в шкале твердости Мооса. Линейную твердость минералов по этой схеме также определять очень легко. Разумеется, и для эталонного хлористого натрия эта характеристика известна.

Относительный показатель для соли, как мы выяснили, равен 2. Какова же у соли твердость по шкале твердости Мооса абсолютная? Для NaCl этот показатель равен 3.
Минералы с аналогичной твердостью
Соль, таким образом — вещество достаточно мягкое. В природе подобных минералов существует множество. К примеру, такие же, как и у NaCl, показатели твердости абсолютной и относительной имеют гипс, слюда, хлорит. Все эти вещества легко царапаются ногтем.
Разумеется, есть свое место на относительной шкале твердости Мооса и у сахара. Соль на шкале используется как одно из эталонных веществ. Сахар, несмотря на то что он также является очень распространенным пищевым продуктом, на схеме Мооса изначально не отмечен. Однако твердость этого вещества, как и любого другого, конечно же, также известна. Сахар чуть мягче соли, но по шкале Мооса показатель его твердости также равен 2.
Другие физические характеристики
Итак, какова твердость соли по шкале твердости Мооса, мы выяснили. Но какие же еще свойства имеет это вещество?

В минералогии обычная пищевая или каменная поваренная соль называется галитом. История этого прозрачного камня насчитывает миллионы лет. Формируется галит в виде кубических кристаллов, цвет которых может варьироваться от бесцветного до розоватого или желтого. Окраска этого минерала бывает связана с видом имеющихся в его толще примесей.
Найти галит в дикой природе можно чаще всего в пластах хемогенных осадочных пород, а также в донных отложениях пересыхающих озер и лиманов.
Основными физическими свойствам соли являются:
- способность растворяться в воде;
- способность кристаллизоваться на предметах;
- соленый вкус;
- плотность — 2.165 г/см3 при температуре 20 °С;
- температура плавления — 801 °С;
- точка кипения — 1413 °С;
- растворимость в воде — 359 г/л при 20 °С.
Вкус NaCl имеет ярко выраженный. Но никто никогда не сможет почувствовать запах соли. Твердость по шкале Мооса у этого вещества небольшая, к тому же оно является хрупким. Мелкие частички соли, к примеру, в местах ее залегания, могут летать в воздухе и даже попадать в нос человека. Однако рецепторов, ответственных за восприятие этого вещества, у человека не имеется. Некоторые люди утверждают, что они могут чувствовать запах соли. Однако в данном случае речь идет все же не NaCl, а о разного рода примесях, содержащихся в этом веществе.
Степень растворимости
К особенностям соли, помимо всего прочего, можно отнести и то, что ее растворимость в воде мало зависит от температуры последней. Этот показатель у NaCl увеличивается на 7 г от 0 до 100 °С. Однако при этом растворимость соли значительно снижается в том случае, если в воде содержится MgCl2 или CaCl2. Резко же увеличивается этот показатель у NaCl при повышении давления. Протекает процесс растворения соли со значительным поглощением тепла. В спирте это вещество практически не растворяется.
Химические свойства
По своему составу NaCl относится к группе средних солей. Химический состав поваренной соли выглядит следующим образом:
- Na — 39.34;
- Cl – 60.66.
В чистом виде состав этого вещества полностью соответствует теоретическому. В виде изоморфной примеси поваренная соль содержит Br (до 0,098%). Также в состав галита могут входить: Nh4, Не, As, J, Pb и некоторые другие вещества. Атомы в структуре Na и Cl чередуются равномерно в узлах кристаллической кубической решетки.

Размеров кристаллы соли могут достигать значительных. Также для галита характерны скелетные образования — хрупкие, мутно-белы пирамидки-лодочки.
Прочие свойства соли
Твердость соли по шкале твердости Мооса, таким образом — 2. Вещество это достаточно хрупкое и хорошо растворяется в воде. Также особенностью NaCl является то, что он не проводит электричество. Кроме того, это вещество относится к группе демагнитов. Флуоресцирует соль красным светом в том случае, если в ней содержится Mn.
Способы искусственного получения
Получать каменную соль для пищевой промышленности или, к примеру, медицины могут с использованием разных технологий. В лабораториях для выделения NaCl обычно применяют рассолы подземного растворения каменной соли. Это позволяет получить максимально чистый продукт без примесей промышленных производств. Подземные рассолы в данном случае подвергаются обычному выпариванию. В этом случае получается чистая соль с твердостью по шкале твердости Мооса 2. Выпаривание рассолов при использовании такой методики производится в специальных многокорпусных установках.

Интересные факты
Твердость соли по шкале твердости Мооса определена точно. Этот показатель для NaCl равен 2. Задумались о физических и химических свойствах соли люди не так давно. Но само это вещество человек использовал для разных целей с глубокой древности. В первую очередь соль во все времена применялась, конечно же, прежде всего как пищевой продукт. Однако иногда она могла выполнять в обществе и другие функции. К примеру, в Эфиопии это вещество вплоть до XX века применялось в качестве валюты.
В Средние века соль была настолько дорогой, что ее иногда называли белым золотом. В Германии, к примеру, до сих пор существует особый «соляной тротуар», по которому этот ценный пищевой продукт когда-то перевозили между городами, расположенными на берегу Балтийского моря.
Для человеческого организма соль действительно является очень важным продуктом. Если выпить очень большое количество воды, это вещество вымоется из тканей. В этом случае у человека может наступить даже и летальная гипонатриемия.

Недостаток соли в организме человека, таким образом, очень опасен. Но и переизбыток этого вещества полезным быть, разумеется, не может. Есть слишком много соли за один прием ни в коем случае нельзя. К смерти может привести принятие этого вещества уже в количестве 1 г на 1 кг веса.
Плотность сахара, значение и примеры
Плотность сахара и другие его физические свойства
Сахароза – представляет собой бесцветные кристаллы (рис. 1), хорошо растворимые в воде. Молекула этого вещества построена из остатков α-глюкозы и фруктопиранозы, которые соединяются между собой посредством гликозидного гидроксила:
Эмпирическая формула сахарозы, отражающая её химический состав имеет вид C12H22O11.
Рис. 1. Сахароза. Внешний вид.
В зависимости от того, из какого сырья был получен сахар, различают тростниковый, свекловичный, кленовый и пальмовый сахар.
Данную величину обычно обозначают греческой буквой r или латинскими D и d. Единицей измерения плотности в системе СИ принято считать кг/м3, а в СГС – г/см3.
Плотность можно вычислить по формуле:
Для веществ, находящихся в твердом агрегатном состоянии зачастую используют понятие насыпной (удельной/кажущейся) плотности, которая рассчитывается как отношение массы вещества ко всему занимаемому объему, с учетом доли объема пустот.
Плотность сахара приведена в таблице ниже.
Таблица 1. Плотность сахара.
|
Вид сахара |
Плотность, кг/м3 |
Насыпная плотность, кг/м3 |
|
Коричневый |
— |
720 |
|
Сахарная пудра |
— |
800 |
|
Свекловичный сахар |
560 |
— |
|
Тростниковый сахар |
— |
270 |
|
Сахар-песок |
— |
850 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
§ 4. Вещества и их физические свойства — ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ — ГДЗ химия — Решение упражнений и задач к учебнику «Химия» А. В. Григорович 7 класс 2015 год
ТЕМА И. ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ
§ 4. Вещества и их физические свойства
ЛАБОРАТОРНЫЙ ОПЫТ № 1.
Ознакомление с физическими свойствами веществ
Оборудование: штатив для пробирок, пробирки.
Реактивы: образцы меди, железа, поваренной соли, вода, сахар, песок, алюминий, медный купорос и прочее.
Правила безопасности:
• при проведении опытов используйте небольшие количества реактивов;
• остерегайтесь попадания реактивов на одежду, кожу, в глаза.
1. Рассмотрели образцы выданных веществ. Определили, в каком агрегатном состоянии они находятся. Описали их цвет, запах, отметили наличие или отсутствие металлического блеска. Значения плотности, температур кипения и плавления определили с помощью справочника (Приложение 1).
2. Проверили, растворимые вещества в воде. Для определения способности растворяться в воде небольшое количество вещества поместили в пробирку, и перемешали. Заполнили таблицу и сделали выводы.
№ | Физические свойства веществ | Вещества | ||
Поваренная соль | Уксус | Сахар | ||
1 | Температура плавления | 801 °С | 16 °С | 185 °С |
2 | Температура кипения | 1465 °С | 118 °С | не существует (образуют. карамель) |
3 | Цвет | бело-серый | бесцветный | белый |
4 | Запах | нет | резкий | нет |
5 | Прозрачность | непрозрачный | прозрачный | непрозрачный |
6 | Твердость | твердая | жидкий | твердая |
7 | Плотность | 2,2 г/см3 | 1,05 г/см3 | 1,6 г/см3 |
8 | Теплопроводность | нет | нет | нет |
9 | Электропроводность | характерная | небольшая | отсутствует |
10 | Способность растворяться в воде | растворяется хорошо | растворяется | растворяется хорошо |
11 | Способность притягиваться магнитом | не привлекается | не привлекается | не привлекается |
Сгруппировали рассмотрены вещества за их общими физическими свойствами:
Растворимые в воде: сахар, поваренная соль;
Имеют запах — уксус, без запаха — сахар, соль;
Агрегатное состояние: жидкие — уксус, твердые, кристаллические — соль, сахар.
Выводы.
1. Знания о физических свойствах веществ имеют большое значение для использования этих веществ.
2. Вещества изучают с помощью методов: измерение, наблюдение, эксперимент.
Контрольные вопросы
№ 1.
Физическое тело — это все живое и неживое, что создали природа и человек на Земле. Физическое тело всегда имеет форму, ограниченную определенной, свойственной ему поверхностью, и массу.
Предмет — твердые тела, которые человек изготавливает дня своих потребностей.
На кухне такими предметами являются тарелки, ложки, вилки, кастрюли, сковородки и много других. Гостиную обустраивают столом, стульями. Понятие вещества не связывают с конкретной формой и размерами. Веществами называют то, из чего образованы физические тела.
Материалами называют вещества или смеси веществ, которые образовались в природе или были получены человеком и предназначенные для изготовления тел.
№ 2. Вещества имеют определенные признаки, которые называют свойствами веществ. Каждое вещество имеет свой собственный, присущий только ей набор физических свойств.
№ 3. К физическим свойствам веществ относят цвет, запах, вкус, температуру плавления, температуру кипения, плотность, способность проводить электрический ток и теплоту, растворимость в воде, пластичность и тому подобное.
№ 4. Агрегатное состояние — это характеристика вещества при определенных условиях. Различают твердое, жидкое и газообразное агрегатное состояния. Они отличаются возможностью сжатия и способностью течь.
Агрегатные состояния: жидкое, твердое, газообразное.
Изменения агрегатного состояния:
а) из твердого в жидкое — плавление;
б) из жидкого в газообразное — испарение;
в) из твердого в газообразное — сублимация;
г) из жидкого в твердое — кристаллизация;
д) из газообразного в жидкое — конденсация.
Задания для усвоения материала
№ 1. Ответ а).
№ 2.
Названия веществ | Названия тел |
б) стекло в) вода д) железо есть) алюминий | а) ножницы г) тетрадь есть) ложка |
№ 3.
а) тела одинаковой формы, изготовленные из разных веществ, отличающихся составом;
б) тела различной формы, изготовленные из одного вещества, отличаются формой.
№ 4. Смотри табл. в лабораторном опыте.
№ 5. Железо можно распознать среди других металлов по свойством притягиваться магнитом.
№ 6.
Вода | Бензин | |
Агрегатное состояние | Жидкая | Жидкий |
Запах | Без запаха | Имеет запах |
Цвет | Безцвітна | Желтоватый |
Способность растворяться В воде | Не растворяется | |
Способность притягиваться магнитом | Не привлекается | Не привлекается |
Мел | Угля | |
Агрегатное состояние | Твердый | Твердый |
Запах | Не имеет | Не имеет |
Цвет | Белый | Черный |
Способность растворяться В воде | Не растворяется | Не растворяется |
Способность притягиваться магнитом | Не привлекается | Не привлекается |
Медь | Алюминий | |
Агрегатное состояние | Твердый | Твердый |
Запах | Не имеет | Не имеет |
Цвет | Белый | Белый |
Плотность | 8,96 г/см3 | 2,7 г/см3 |
Температура правления | 1083 °С | 660 °С |
Температура кипения | 2543 °С | 2500 °С |
Способность растворяться В воде | Не растворяется | Не растворяется |
Способность притягиваться магнитом | Не привлекается | Не привлекается |
№ 7.
Свойства по которым можно отличить вещества:
а) соль от сахара отличается по вкусу;
б) медь от золота отличается притягуванням магнитом;
в) песок от железа отличаются притягуванням магнитом.
№ 8.
Тело | Материал | Вещество |
Памятник | Бронза | Медь и олово |
Стакан | Стекло | |
Тетрадь | Бумага | Целлюлоза |
Сковородка | Чугун | Железо |
Стул | Древесина | Целлюлоза |
Авторучка | Пластмасса |
№ 9.
а) плавления;
б) конденсация;
в) сублимация;
г) кристаллизация;
д) испарение.
№ 10.
Примеры | Свойства |
а) из меди изготавливают электрические провода | электропроводность |
б) из золота изготавливают ювелирные украшения | устойчивость |
в) ванилин добавляют к кондитерским изделиям | имеет запах |
г) из алюминия изготавливают фольгу | легкость и вытягивается в тонкую пленку |
д) из графита изготавливают стержни для карандашей | хрупкость |
№ 11. Гвозди изготавливают из железа, потому что железо имеет меньшую плотность, чем свинец.
Памятники изготавливают из бронзы или гранита, потому что эти материалы прочные.
№ 12.
Каждому веществу присущ определенный набор свойств. Некоторые свойства различных веществ могут быть подобными. Две разные вещества не могут быть подобны друг другу по всем свойствам. Вещества состоят из очень мелких частиц — атомов, молекул или ионов. Именно они определяют все свойства веществ. Молекулы различных веществ не подобные, часто они отличаются очень существенно, поэтому и образованные ими вещества отличаются по свойствам.
Сахароза, свойства, получение и применение
Сахароза, свойства, получение и применение.
Сахароза – дисахарид из группы олигосахаридов, состоящий из двух моносахаридов: α-глюкозы и β-фруктозы, имеющий формулу C12H22O11.
Сахароза, формула, молекула, строение, вещество
Физические свойства сахарозы
Химические свойства сахарозы. Химические реакции (уравнения) сахарозы
Получение и производство сахарозы: из сахарного тростника, сахарной свеклы и сахарного клена
Применение сахарозы
Сахароза, формула, молекула, строение, вещество:
Сахароза – дисахарид из группы олигосахаридов, состоящий из двух моносахаридов: α-глюкозы и β-фруктозы, имеющий формулу C12H22O11.
В быту сахароза именуется сахаром, тростниковым сахаром или свекловичным сахаром.
Олигосахариды – это углеводы, содержащие от 2 до 10 моносахаридных остатков. Дисахариды – углеводы, которые при нагревании с водой в присутствии минеральных кислот или под влиянием ферментов подвергаются гидролизу, расщепляясь на две молекулы моносахаридов.
Сахароза является весьма распространённым в природе дисахаридом. Она встречается во многих фруктах, плодах, ягодах, в стеблях и листьях растений, в соке деревьев. Особенно велико содержание сахарозы в сахарной свёкле, сахарном тростнике, сорго, сахарном клене, кокосовой пальме, финиковой пальме, аренге и иных пальмах, которые используются для промышленного производства пищевого сахара.
Химическая формула сахарозы C12H22O11.
Аналогичную общую химическую формулу имеют и другие дисахариды: лактоза, состоящая из остатков глюкозы и галактозы, и мальтоза, состоящая из остатков глюкозы.
Строение молекулы сахарозы, структурная формула сахарозы:

Молекула сахарозы образована из двух остатков моносахаридов – α-глюкозы и β-фруктозы, соединённых между собой атомом кислорода и связанных друг с другом за счёт взаимодействия гидроксильных групп (двух полуацетальных гидроксилов) – (1→2)-гликозидной связью.
Систематическое химическое наименование сахарозы: (2R,3R,4S,5S,6R)-2-[(2S,3S,4S,5R)-3,4-дигидрокси-2,5-бис(гидроксиметил)оксолан-2-ил]окси-6-(гидроксиметил)оксан-3,4,5-триол.
Используется также и другое химическое название сахарозы: α-D-глюкопиранозил-β-D-фруктофуранозид.
По внешнему виду сахароза представляет собой белое кристаллическое вещество. На вкус более сладкая, чем глюкоза.
Сахароза очень хорошо растворяется в воде. Малорастворима в этаноле и метаноле. Не растворима в диэтиловом эфире.
Сахароза, попадая в кишечник, под действием ферментов быстро гидролизуется на глюкозу и фруктозу, после чего всасывается и попадает в кровь.
Температура плавления сахарозы 160 °C. Расплавленная сахароза застывает, образуя аморфную прозрачную массу – карамель.
Если расплавленную сахарозу продолжить нагревать, то при температуре 186 °C сахароза разлагается с изменением окраски – с прозрачной на коричневую.
Сахароза служит источником глюкозы и важнейшим источником углеводов для организма человека.
Физические свойства сахарозы:
| Наименование параметра: | Значение: |
| Цвет | белый, бесцветный |
| Запах | без запаха |
| Вкус | сладкий |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое кристаллическое вещество |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), г/см3 | 1,587 |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м3 | 1587 |
| Температура разложения, °C | 186 |
| Температура плавления, °C | 160 |
| Температура кипения, °C | — |
| Молярная масса сахарозы, г/моль | 342,2965 ± 0,0144 |
Химические свойства сахарозы. Химические реакции (уравнения) сахарозы:
Основные химические реакции сахарозы следующие:
- 1. реакция сахарозы с водой (гидролиз сахарозы):
С12Н22О11 + Н2О → С6Н12O6 + С6Н12O6 (tо, kat = H2SO4, HCl).
При гидролизе (при нагревании в присутствии ионов водорода) сахароза расщепляется на составляющие ее моносахариды за счёт разрыва гликозидных связей между ними. Данная реакция является обратной процессу образования сахарозы из моносахаридов.
Аналогичная реакция происходит в кишечнике у живых организмов при попадании в него сахарозы. В кишечнике сахароза под действием ферментов быстро гидролизуется на глюкозу и фруктозу.
- 2. качественная реакция на сахарозу (реакция сахарозы с гидроксидом меди):
2С12Н22О11 + Cu(OH)2 → Cu(C12H21O11)2 + 2Н2О, или
2C12H20O9(OH)2+Cu(OH)2 → Cu(C12H20O9(O)(OH))2+2H2O.
В молекуле сахарозы имеется несколько гидроксильных групп. Для подтверждения их наличия используют реакцию с гидроксидами металлов, например, с гидроксидом меди.
Для этого к раствору сахарозы добавляют гидроксид меди. В результате образуется сахарат меди, а раствор окрашивается в ярко-синий цвет.
- 3. не дает реакцию «серебряного зеркала»:
Альдегидной группы в сахарозе нет. Поэтому она при нагревании с аммиачным раствором оксида серебра не дает реакцию «серебряного зеркала», т.к. сахароза не способна превращаться в открытую форму, содержащую альдегидную группу.
Кроме того, при нагревании с гидроксидом меди (II) сахароза не образует красного оксида меди (I).
Реакция «серебряного зеркала» и реакция с гидроксидом меди (II) с образованием красного оксида меди (I) характерны для лактозы и мальтозы.
Поэтому сахарозу еще именуют невосстанавливающим дисахаридом, т.к. она не восстанавливает Ag2O и Cu(OH)2.
Получение и производство сахарозы:
Сахароза содержится во многих фруктах, плодах, ягодах, в стеблях и листьях растений, в соке деревьев. Поэтому получение сахарозы связано с выделением ее из ее источников: сахарного тростника, сахарной свеклы и пр.
Получение сахарозы из сахарного тростника:
Сахарный тростник является основной мировой культурой для производства сахара. На его долю приходится до 65 % мирового производства сахара.
Сахарный тростник до начала цветения срезают. Срезанные стебли измельчают и размалывают. Из полученной массы отжимают сок, в котором содержится до 0,03 % белковых веществ, 0,1 % зернистых веществ (крахмала), 0,22 % азотосодержащей слизи, 0,29 % солей (большей частью органических кислот), 18,36 % сахара, 81 % воды и очень небольшое количество ароматических веществ, придающих сырому соку своеобразный запах.
Для очистки сока к нему добавляют свежегашеную известь – Са(ОН)2 и нагревают. Сахароза вступает в химическую реакцию с гидроксидом кальция, в результате чего образуется растворимый в воде сахарат кальция. Кроме того, другие вещества, содержащиеся в соке, также вступают в реакцию с гидроксидом кальция, образуя малорастворимые и нерастворимые соли, которые выпадают в осадок и отфильтровывают.
Затем через раствор, чтобы разложить сахарат кальция и нейтрализовать избыточный гидроксид кальция, пропускают углекислый газ – СО2. В итоге образуется карбонат кальция – СаСО3, который выпадает в осадок. Выпавший в осадок карбонат кальция отфильтровывают, а раствор выпаривают в вакуумных аппаратах до получения кристаллов сахарозы. На данной стадии производства сахароза все еще содержит примеси – мелассу и имеет коричневый цвет. Меласса придает сахарозе ярко выраженный естественный аромат и вкус. Полученный продукт именуется коричневым сахаром или тростниковым нерафинированным сахаром. Он (коричневый сахар) пригоден в пищу. Его можно использовать в пищу как есть либо подвергнуть дополнительной очистке.
На последней стадии производства сахарозу подвергают дополнительной очистке и обесцвечиванию. В конечном итоге получают рафинированный (очищенный) сахар, имеющий белый цвет.
Получение сахарозы из сахарной свеклы:
Сахарная свекла является двухлетним растением. В первый год собирают урожай корнеплодов и отправляют их на переработку.
На перерабатывающей фабрике корнеплоды промываются и измельчаются. Измельченные корнеплоды помещают в диффузоры (большие котлы) с горячей водой температурой 75 оС. Горячая вода вымывает из измельченных корнеплодов сахарозу и прочие компоненты. В итоге получается диффузионный сок, который в дальнейшем подвергается фильтрации от содержащихся в нем частичек мякоти.
На следующих стадиях производства сахара диффузионный сок очищают гидроксидом кальция и углекислым газом, уваривают, выпаривают на вакуумных аппаратах, подвергают дополнительной очистке, отбеливанию и центрифугированию. В итоге получают рафинированный сахар.
Получение сахарозы из сахарного клена:
Сахарозу из сахарного клена получают в восточных провинциях Канады.
В феврале-марте ствол сахарного клена просверливают. Из отверстий вытекает кленовый сок, который собирают. Он содержит до 3 % сахарозы.
Кленовый сок выпаривают, получая «кленовый сироп». Далее «кленовый сироп» очищают гидроксидом кальция и углекислым газом, выпаривают на вакуумных аппаратах, подвергают дополнительной очистке и отбеливанию, тем самым получая готовый продукт – сахар.
Применение сахарозы:
– в качестве продукта питания, а также для приготовления различных продуктов питания (кондитерских изделий, напитков, соусов и пр.)
– в кондитерской промышленности как консервант,
– используется для приготовления искусственного меда,
– в химической промышленности для производства этанола, бутанола, глицерина, лимонной кислоты, декстрана и пр.,
– в фармацевтической промышленности для изготовления различных лекарственных средств.
Примечание: © Фото //www.pexels.com, //pixabay.com.




карта сайта
(www.spb.aif.ru)
Коэффициент востребованности 680