Лекция на тему «Основные положения ТХС»
Основные положения теории химического строения органических веществ (ТХС ОВ)
1861 год А. М. Бутлеров – теория химического строения органических соединений

I Положение.
1. Органические вещества – соединения углерода.
2. В органических соединениях углерод IV-валентен, так как при взаимодействии с другими атомами он переходит в возбужденное состояние.
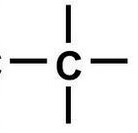
Валентность – это способность атомов образовывать определенное число химических связей.
C (IV), H (I), O (II), S (II), N (III)
3. Атомы углерода в органических веществах соединяются ПОСЛЕДОВАТЕЛЬНО, образуя цепи: открытые, разветвленные, неразветвленные, циклические.
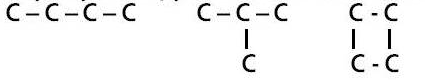
При этом между атомами углерода может быть одинарная, двойная или тройная связь (это ПОРЯДОК химической связи).
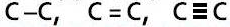
Последовательность соединения атомов углерода и порядок химических связей – это химическое строение.
II Положение.
Химическое строение познаваемо: оно может быть исследовано с помощью приборов (физические методы), либо путем изучения свойств вещества, характерных для него химических реакций (химические методы).
III Положение.
1. Химическое строение органических веществ отражается в структурной формуле.
Структурная формула может быть развернутой (полной) и сокращенной.
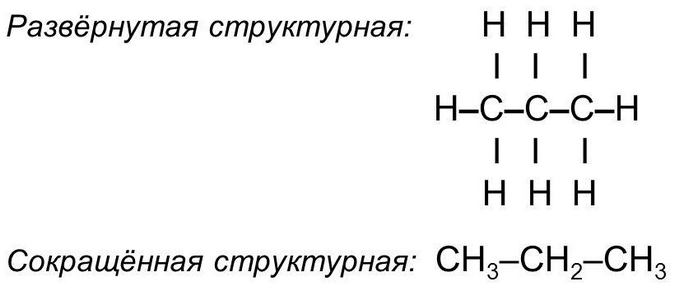
Cтруктурная формула отражает химическое строение органического вещества, то есть последовательность соединения атомов углерода и порядок химических связей.
2. Каждому веществу соответствует своя структурная формула.
C4H10
молекулярная формула
CH3 – CH2 – CH2 – CH3
н-бутан
CH3 – CH – CH3
CH3
изобутан
2 структурные формулы
2 разных вещества
ИЗОМЕРЫ
Вещества, имеющие одинаковую молекулярную формулу, но разные структурные формулы, называются
IV Положение.
1. По свойствам данного вещества можно определить строение его молекулы.
2. Зная химическое строение, можно предсказать свойства вещества.
V Положение. Свойства веществ зависят от:
состава (качественного и количественного),
химического строения,
а также от взаимного влияния атомов и групп атомов друг на друга.
2CH3-CH2-OH + 2Na 2CH3-CH2-ONa + H2
CH3-O-CH3 + Na реакция не идет
Выполните задание:
Задание. Какие из данных соединений являются изомерами?
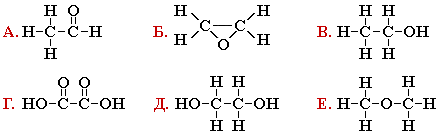
Основные положения теории А.М. Бутлерова. Виды изомерии
Вопросы к экзаменуОсновные положения теории А.М. Бутлерова. Виды изомерии
А. М.Бутлеров на основе анализа и обобщения отдельных фактов и положений создал стройную научную теорию химического строения органических соединений, которую можно сформулировать в виде следующих положений.
Главные положения этой теории следующие:
· атомы в молекулах веществ соединены друг с другом согласно их валентности, порядок распределения связей в молекуле называется химическим строением;
· изменение этой последовательности приводит к образованию нового вещества с новыми свойствами;
· свойства веществ зависят не только от их качественного и количественного состава, но и от «химического строения», то есть от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой;
· атомы в молекулах оказывают влияние друг на друга, и это влияние приводит к химическим изменениям поведения атома;
· определить состав и строение химического вещества можно по продуктам химических превращений.
1. Атомы и построенные из них молекулы существуют реально, их химическое строение можно определить экспериментальным путем.
2. Химическое строение — это порядок связи атомов в молекуле, который может быть выражен химической формулой.
Свойства веществ зависят не только от того, атомы каких элементов и в каком количестве входят в состав их молекул, но и от того, в каком порядке соединены атомы в молекулах.
Из одного и того же количества одних и тех же атомов могут образовываться различные вещества, т. е. молекулы вещества имеют одинаковые качественный и количественный составы, молекулярную
массу, но различное строение. Такое явление называется изомерией, а вещества — изомерами. Изомеры обладают различными свойствами. Изомерия присуща всем классам органических соединений. Явление изомерии очень распространено в органической химии.
Существуют два основных вида изомерии — структурная и пространственная (стереоизомерия). Наиболее распространенной и изученной является структурная изомерия.
В молекулах органических соединений существует определенный порядок химической связи между атомами, соединенными в соответствии с их валентностью, и они взаимно влияют друг на друга.
Раскрытие природы и механизма взаимного влияния атомов в молекулах является и сейчас одной из главных проблем теоретической органической химии.
Исходя из основных положений теории органических соединений А. М. Бутлерова, можно сказать, что основные причины многообразия органических веществ заключаются в способности атомов углерода соединяться друг с другом с образованием цепи и в явлении изомерии.
Изомерия – это такое явление, при котором могут существовать несколько веществ, имеющих один и тот же состав и одну ту же молекулярную массу, но различающихся строением молекул.
Виды изомерии
Структурная (изомерия углеродного скелета; изомерия положения; изомерия гомологических рядов) — изомерия, при которой вещества различаются порядком связи атомов в молекулах
Пространственная (цис -, трансизомерия)- изомерия, при которой молекулы веществ отличаются не порядком связи атомов, а положением их в пространстве: цис-, трансизомерия (геометрическая).
Реакции галогенирования
Алкины способны присоединять одну или две молекулы галогена с образованием соответствующих галогенпроизводных:
Галогенирование алкинов идет как транс-присоединение (как правило) и протекает по аналогии с галогенированием алкенов.
Вместе с тем, присоединение по тройной связи идет труднее, чем по двойной, в связи с чем при наличии в соединении как двойной, так и тройной связи, возможно провести избирательное присоединение:
Реакции гидрогалогенирования
Присоединение хлороводорода и бромоводорода к алкинам происходит по аналогии с алкенами. Реакция идет в две стадии: сперва образуется галогеналкен, который далее переходит в дигалогеналкан:
Несмотря на большую электроотрицательность галогенов, обе стадии реакции идут по правилу Марковникова. Это объясняется возникновением p-сопряжения между атомами галогена и водорода. Как видно из схемы, в результате реакции присоединения образуются транс- изомеры.
Кислотные свойства алкинов и реакции нуклеофильного замещения
Образование алкинидов
Алкины с концевой тройной связью являются С-H кислотами (сильнее чем аммиак и алкены, но слабее, чем спирты) которые с очень сильными основаниями могут образовывать соли — алкиниды:
(ацетиленид динатрия)
(ацетиленид калия)
(пропинилмагнийбромид)
Реакция алкинов с аммиакатами серебра или одновалентной меди является качественной на наличие концевой тройной связи:
Пропинид серебра представляет собой осадок белого цвета, пропинид меди — осадок жёлтого цвета, наконец, диацетиленид меди — осадок красного цвета.
Алкинид серебра легко растворяется при добавлении цианида натрия с выделением соответствующего алкина:
Смотри также статью: Ацетилениды.
Реакции нуклеофильного замещения алкинидов[править | править вики-текст]
Алкиниды являются сильными нуклеофилами и легко вступают в реакции нуклеофильного замещения:
Это, в частности, широко используется для синтеза гомологов ацетилена:
Получение алкингалогенидов
Действием галогена на монозамещенные ацетилены в щелочной среде можно получить галогеналкины:
Реакция нуклеофильного замещения алкинидов
В препаративном синтезе часто используют комплекс ацетиленида лития с этилендиамином как удобный источник ацетиленид-аниона.
Следует отметить, что в случае реакции с вторичными или третичными галогеналканами реакция во многом идет по альтернативному пути (элиминирование):
Прочие реакции
Хлорированием ацетилена хлоридом меди (II) в водных растворах CuCl можно получить дихлорацетилен:
Ацетиленовая конденсация
Ацетиленовая конденсация или иначе реакция Ходкевича-Кадио, заключается во взаимодействии ацетиленовых углеводородов с бром- или йодалкинами с образованием диацетиленов:
Аналогично протекает и реакция Куртца (катализатор — ацетиленид меди):
Получение ацетиленаминов[править | править вики-текст]
Реакция идет в присутствии солей меди (I).
Ацилирование
Реакцию ацилирования по Фриделю-Крафтсу проводят в случае фурана и пиррола, используя вместо AlCl3 более «мягкие» катализаторы (SnCl2, SnCl4, ZnCl2, BF3) и с помощью ангидридов кислот, а тиофен ацилируется (подобно бензолу) в более жестких условиях:
Вопросы к экзамену
Основные положения теории А.М. Бутлерова. Виды изомерии
А. М.Бутлеров на основе анализа и обобщения отдельных фактов и положений создал стройную научную теорию химического строения органических соединений, которую можно сформулировать в виде следующих положений.
Главные положения этой теории следующие:
· атомы в молекулах веществ соединены друг с другом согласно их валентности, порядок распределения связей в молекуле называется химическим строением;
· изменение этой последовательности приводит к образованию нового вещества с новыми свойствами;
· свойства веществ зависят не только от их качественного и количественного состава, но и от «химического строения», то есть от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой;
· атомы в молекулах оказывают влияние друг на друга, и это влияние приводит к химическим изменениям поведения атома;
· определить состав и строение химического вещества можно по продуктам химических превращений.
1. Атомы и построенные из них молекулы существуют реально, их химическое строение можно определить экспериментальным путем.
2. Химическое строение — это порядок связи атомов в молекуле, который может быть выражен химической формулой.
Свойства веществ зависят не только от того, атомы каких элементов и в каком количестве входят в состав их молекул, но и от того, в каком порядке соединены атомы в молекулах.
Из одного и того же количества одних и тех же атомов могут образовываться различные вещества, т. е. молекулы вещества имеют одинаковые качественный и количественный составы, молекулярную
массу, но различное строение. Такое явление называется изомерией, а вещества — изомерами. Изомеры обладают различными свойствами. Изомерия присуща всем классам органических соединений. Явление изомерии очень распространено в органической химии.
Существуют два основных вида изомерии — структурная и пространственная (стереоизомерия). Наиболее распространенной и изученной является структурная изомерия.
В молекулах органических соединений существует определенный порядок химической связи между атомами, соединенными в соответствии с их валентностью, и они взаимно влияют друг на друга.
Раскрытие природы и механизма взаимного влияния атомов в молекулах является и сейчас одной из главных проблем теоретической органической химии.
Исходя из основных положений теории органических соединений А. М. Бутлерова, можно сказать, что основные причины многообразия органических веществ заключаются в способности атомов углерода соединяться друг с другом с образованием цепи и в явлении изомерии.
Изомерия – это такое явление, при котором могут существовать несколько веществ, имеющих один и тот же состав и одну ту же молекулярную массу, но различающихся строением молекул.
Виды изомерии
Структурная (изомерия углеродного скелета; изомерия положения; изомерия гомологических рядов) — изомерия, при которой вещества различаются порядком связи атомов в молекулах
Пространственная (цис -, трансизомерия)- изомерия, при которой молекулы веществ отличаются не порядком связи атомов, а положением их в пространстве: цис-, трансизомерия (геометрическая).
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Основные положения теории Бутлерова А. М. Основные положения теории химического строения Бутлерова
Общепризнанные основные положения теории Бутлерова считаются фундаментом современной химии. Ученый первым объяснил особенности строения веществ. Он подробно изучил природу взаимосвязей атомов.
Предпосылки появления теории
Александр Бутлеров стал основоположником новой теории как раз тогда, когда в науке накопилось множество вопросов, на которые ученые не могли найти ответов. Например, объяснения требовали явления валентности и изомерии. Кроме того, химики продолжали спорить о том, как правильно записывать химические формулы. Бутлеров внес ясность в этот вопрос. Он доказал, что формулы должны отражать строение вещества.
Помимо этого, существовало несколько концепций, которые были противоположны взглядам, высказанным Бутлеровым. Это была теория радикалов. Ее основоположником стал Йенс Берцелиус. Он утверждал, что в молекулах есть особые элементы – радикалы, которые переходят из одного вещества в другое. Также существовала теория типов. Ее сторонники считали, что все сложные вещества являются производными простых неорганических веществ – воды, водорода, аммиака и т. д. Все эти концепции противоречили друг другу. Науке была необходима теория, которая поставила бы все на свои места.

Новые идеи Бутлерова
Александр Михайлович Бутлеров (1828–1886 гг.) был одним из выдающихся химиков своего времени. Он много занимался теоретическими вопросами своей науки. В 1858-м ученый выступил на одном из заседаний Парижского химического общества. Тогда же впервые из его уст прозвучали основные положения теории Бутлерова.
Исследователь употребил в своем докладе новые термины, которые позже закрепились в международной науке. Например, именно он стал автором понятия структуры соединений. Ученый считал, что строение разных веществ позволяет отнести их к одним группам (в частности, это метан, хлороформ, метиловый спирт и т. д.).
Исследование синтеза веществ
В 1861 году в опубликованном докладе «О химическом строении вещества» были сформулированы основные положения теории химического строения А. М. Бутлерова. Ученый подробно описал способы синтеза и использования разных реакций. Одним из самых важных тезисов химика было его утверждение о том, что каждому химическому веществу соответствует одна формула. Ее важность заключается в том, что она характеризует все свойства и показывает связь атомов внутри молекул.
Теория Бутлерова также предусматривала, что с помощью управляемых реакций можно производить новые вещества. В последующие годы знаменитый химик и его ученики провели множество экспериментов, чтобы доказать это предположение. Им удалось синтезировать такие новые вещества, как изомеры пентана, изобутилен и некоторые спирты. Для своей эпохи эти открытия имели колоссальную значимость, которую можно сравнить только с важностью определения других элементов Менделеевым (например, экабора).
Систематизация химии
В XIX веке основные положения теории Бутлерова полностью изменили представление ученых о строении химических элементов. В частности, исследователь первым предположил, что молекулы являются не хаотическим скоплением атомов. Наоборот, они обладают упорядоченной структурой. Атомы соединены друг с другом в определенной последовательности, от которой также зависит характер всего вещества.
Бутлеров, разрабатывая свою теорию, опирался на математические принципы и законы. С помощью этой науки он смог объяснить большинство процессов и взаимосвязей в химических веществах. Для современников это была настоящая революция. Дело было в том, что даже если ученые и знали некоторые факты о характере определенных веществ, они не могли выстроить свои знания в четкую систематизированную картинку. Основные положения теории строения Бутлерова разрешили эту проблему. Теперь химия была не разрозненной копилкой фактов, а стройной системой, где все подчинялось строгой математической логике.
Многообразие веществ
Знаменитая теория Бутлерова много внимания уделяет изомерии – явлению, заключающемуся в существовании изомеров – равных по молекулярной массе и атомному составу веществ, которые в то же время отличаются друг от друга расположением атомов и строением. Эта особенность объясняет многообразие свойств веществ в природе.
Бутлеров доказал свою теорию на примере бутана. Согласно идее ученого, в природе должно было существовать два вида этого вещества. Однако в то время наука знала только один бутан. Бутлеров провел множество экспериментов и все-таки получил новое вещество, похожее по составу, но отличное по свойствам. Оно было названо изобутаном.

Влияние атомов друг на друга
Бутлеров открыл и другую важную закономерность. С образованием химических связей начинается процесс перехода электронов от одних атомов к другим. При этом меняется их плотность. Возникают электронные пары, которые влияют на свойство нового образующегося вещества. Ученый изучал этот феномен на примере хлороводорода, где хлор меняет электронную плотность связей водорода.
Бутлеров и основные положения теории строения смогли объяснить природу трансформации веществ. В дальнейшем принцип, открытый русским химиком, подробно исследовался его последователями и учениками. Осознание механизма изменения веществ позволило ученым понять, как синтезировать новые элементы. Особенный всплеск этих открытий начался в конце XIX века. Тогда европейские и американские ученые в новых лабораториях с помощью методов, которые предложил Бутлеров, смогли произвести новые вещества.

Химические связи
Бутлеров считал, что строение веществ можно изучать химическими методами. Это положение подтвердилось благодаря множеству удачных экспериментов ученого. Также исследователь был сторонником идеи о том, что формулы могут быть правильными, только если они станут отражать порядок химических связей разных атомов. Бутлеров занимался анализом этого предположения на протяжении многих лет.
Он выделял три вида связей – простую, двойную и тройную. Ученый был прав, но дальнейшее развитие науки показало, что есть и другие химические связи. В частности, теперь специалисты могут характеризовать их еще и с помощью физических параметров.

Развитие Бутлеровской теории
Новая теория строения химических соединений А. М. Бутлерова по своему характеру была материалистической. Ученый первым смело заявил о том, что исследователям по силам изучить свойства атомов, из которых строятся все элементы. При этом сам Бутлеров относился к своей теории как к временной. Он считал, что его преемники должны развить ее, поскольку она не до конца объясняла некоторые факты химической науки.
Ученый оказался прав. Теория Бутлерова в дальнейшем развивалась в двух направлениях. Первое заключалось в том, что наука смогла определить не только порядок соединения, но и пространственное расположение атомов в молекуле. Так возникла стереохимия. Эта дисциплина стала подробно исследовать пространственное строение молекул. Об этом новом направлении говорил еще сам Бутлеров, хотя он при жизни так и не успел изучить этот теоретический вопрос.
Вторым направлением развития теории ученого стало появление учения, посвященного электронному строению атомов. Это не только химическая, но и физическая дисциплина. Была подробнее исследована сущность взаимного влияния атомов и объяснены причины проявления разных свойств. Именно основные положения теории Бутлерова позволили ученым добиться таких успехов.
Две ведущие теории химии — теория химического строения органических соединений А.М. Бутлерова и периодический закон Д.И. Менделеева
Презентация (слайд 1)
Цель: Обобщить сведения о строении органических веществ, показать универсальность теории химического строения, обобщить и расширить представления учащихся: об изомерии на примерах органических и неорганических соединений; о взаимном влиянии атомов в молекулах, взаимообусловленности строения и свойств веществ.
А.М. Бутлеров – один из величайших русских ученых, он русский и по ученому образованию, и по оригинальности трудов.
(Д.И.Менделеев) “… я люблю свою страну, как мать, а свою науку – как дух, который благословляет, освещает и объединяет все народы для блага и мирного развития духовных и материальных богатств”.
Оборудование: компьютер, слайд презентация, интерактивная доска.
Ход урока
Разбор положений теории химического строения
1) атомы в молекулах соединены не беспорядочно, а в строгой последовательности согласно их валентности. (слайд 3)
Какова валентность углерода в органических веществах?
(ответ- четыре).
Вопрос классу. Как соединяются атомы углерода в молекулах органических соединений?
Ответ. Атомы углерода, соединяясь друг с другом образуют неразветвленные, разветвленные цепи, циклы, простые, двойные, тройные связи.
Задание классу (слайд 4)
Построить структурные формулы пропена, бутина-1, изопентана, циклобутана.
Вопрос классу. Применимо ли данное положение для неорганических веществ?
Постройте структурные формулы для серной кислоты, оксида кальция, сульфата натрия, гидроксида кальция.
Второе положение теории А.М. Бутлерова.
2) Свойства веществ зависят не только от их качественного и количественного состава, но и от строения молекул.
Вопрос классу. Что понимают под строением молекул?
Ответ. А) порядок соединения атомов в молекуле
Б) взаимное расположение атомов и групп атомов в пространстве
Вопрос классу. Какое явление объясняет данное положение?
Ответ. Это положение объясняет явление – изомерии. (следует обсуждение всех видов изомерии)
Вопрос классу. Какие виды изомерии вам известны?
Ответ. Структурная, пространственная. (слайд 5)
Структурная изомерия:
1. Углеводородного скелета
2. Положения: заместителей, функциональных групп, кратных связей, радикалов (для аренов) (слайд 6)
3. Межклассовая (слайд 7)
4. Таутомерия
Пространственная
1. Геометрическая (слайд 8)
2. Оптическая (слайд 9, Приложение 2)
Заполнить таблицу (самостоятельная работа)
Виды изомерии органических веществ
Виды изомерии Примеры Структурная 1) Углеводородного скелета
2) положения
а) заместителей
б) функциональных групп
в) кратных связей
г) радикалов
3) межклассовая
Пространственная
1) геометрическая
2) оптическая
Изомерия неорганических веществ. (слайд 10)
Перечисленные пары кислот –таутомерны, в растворах существуют одновременно, переходя друг в друга.
Межклассовые изомеры у неорганических веществ
Пространственная изомерия неорганических веществ (слайд 12,13,14)
1. Геометрическая ( комплексные соединения)
цис- изомер (оранжевого цвета транс- изомер (желтого цвета)
Третье положение теории А.М. Бутлерова.
3. Свойства веществ зависят от взаимного влияния атомов в молекуле.
Задания классу с последующим обсуждением.
1. Сравните кислотные свойства этанола и фенола? Объясните причину увеличения кислотных свойств у фенола.
2. Спирты вступают в реакцию с галогеноводородами, а фенолы нет. Почему?
3. Сравните способность вступать в реакцию электрофильного замещения по бензольному кольцу у бензола и фенола. Объясните причину более высокой реакционной способности у фенола.
Вопрос классу. От чего зависят свойства неорганических веществ?
Объяснить с позиции периодического закона М.И. Менделеева, и строении атомов элементов в группах и периодах.
Задания классу с последующим обсуждением.
1. Сравните основные свойства аммиака и фосфина. Объясните уменьшение основных свойств у фосфина
2. Сравните кислотные свойства сероводорода и хлороводорода.
3. Сравните кислотные свойства хлороводородной и иодоводородной кислот.
Ответ. В главных подгруппах сверху вниз увеличиваются радиусы атомов элементов, атомы неметаллов слабее притягивают атомы водорода, уменьшается прочность соединений, они легко диссоциируют, и поэтому их кислотные свойства усиливаются.
Как и почему изменяются свойства гидроокисей в периоде и группе?
Ответ. Основные свойства гидроксидов убывают, а кислотные усиливаются в периоде слева направо, так как увеличивается степень окисления центрального атома, следовательно, растет энергия связи его с атомом кислорода и отталкивание им атома водорода.
Вывод:
Важнейшими причинами изменения химических свойств являются разница электроотрицательности элементов, наличие неподеленных электронных пар,
Смещение электронной плотности.
Можно ли по строению предположить свойства вещества?
Ответ. Да, можно.
Задание классу с последующим обсуждением. Предположите свойства следующих веществ. (подтвердите уравнениями химических реакций)
Ответ.
- Наличие полярной связи, способность отщеплять катион водорода – объясняет кислотные свойства.
- Способность вещества присоединять катион водорода и неподелнная электронная пара – основные свойства.
- Наличие простых связей- реакции замещения (обмена)
- Наличие кратных связей – реакции присоенинния
- Наличие элемента в высшей степени окисления- окислительные свойства, в низшей степени окисления- восстановительные, в промежуточной- окислительно- восстановительные.
Современными направлениями развития теории химического строения являются:
- стереохимия – учение о пространственном строении молекул
- электронное строение вещества (типы гибридизаций, смещение электронной плотности)
Смещение электронной плотности или электронные эффекты.(слайд 15)
Вопрос классу. Дайте определение индуктивному эффекту.
Ответ. Индуктивный – смещение электронной плотности по длине сигма связи
Рассмотреть реакцию взаимодействия бромоводорода с пропеном -1и реакцию взаимодействия бромоводорода с 3,3,3- трифторпропен-1
Вопрос классу. Дайте определение мезомерному эффекту.
Ответ. Мезомерный эффект- Смещение электронов -связи или неподеленных электронных пар при чередующихся простых и кратких связях.
Мезомерный эффект сильнее индуктивного.
Вопрос классу. На что влияют эффекты?
Ответ. 1. На реакционную способность вещества
CH4 – менее реакционноспособен т.к все связи малополярные
CH3CI – более реакционноспособно т.к связи более полярны.
На направления протекания процессов.
Задание классу с последующим обсуждением. Рассмотреть направления течения химических реакций.(рассмотреть влияние соответствующих эффектов на направление химической реакции)
Реакция по правилу Марковникова.
Взаимодействие пропена-1 с бромоводородом.
Реакция против правила Марковникова.
Взаимодействие пропеновой (акриловой) кислоты с бромоводородом.
Вывод по окончанию урока (слайд 16)
Теория строения создала предпосылки для объяснения и прогнозирования различных видов изомерии молекул органических соединений, а также направлений и механизмов протекания химических реакций.
Сравнивая две величайшие теории химии – теорию строения А.М. Бутлерова и теорию периодичности Д.И. Менделеева, можно заметить, что в обеих теориях много общего.
Домашнее задание: параграф 8, упр. 4,5. учебник О.С. Габриеляна.