Получение кислот
Бескислородные кислоты могут быть получены:
1 способ: Взаимодействие неметаллов с водородом, например:
H2 + Cl2 → 2HCl,
H2 + S → H2S.
2 способ: Взаимодействие растворов солей с более сильными кислотами, например:
FeS + 2HCl → FeCl2 + H2S,
NaCl
+ H2SO4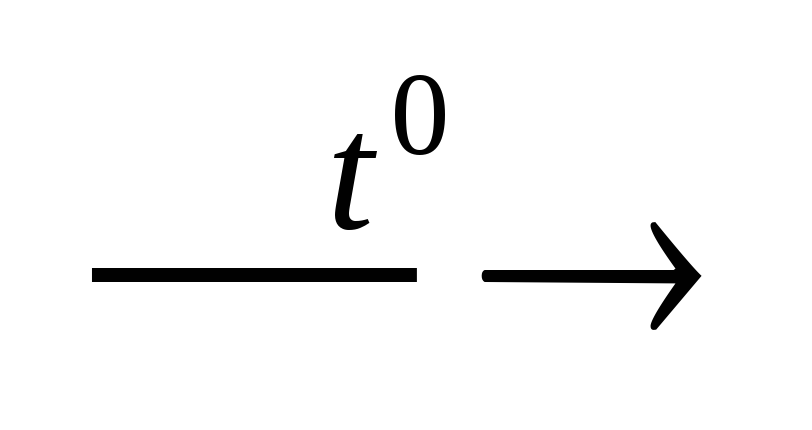 HCl↑ + NaНSO4.
HCl↑ + NaНSO4.
3 способ: Взаимодействием некоторых простых веществ с водой, например:
Cl2 + H2O → HCl + HClO.
Кислородные
1 способ: Взаимодействием растворимых кислотных оксидов с водой, например:
P2O5 + 3H2O → 2H3PO4,
SO3 + H2O → H2SO4.
Нужно помнить: при растворении некоторых оксидов с водой может образоваться несколько кислот, например:
P2O5 + 3H2O → 2H3PO4, | 2ClO2 + H2O → HClO2 + HClO3, |
P2O5 + H2O → 2HPO3, | 2NO2 + H 2O → HNO3 + HNO2, |
P2O5 + 2H2O → H4P2O7. | N2O4 + H2O → HNO3 + HNO2. |
2 способ: Реакцией обмена между раствором соли и более сильной кислотой, например:
Na2SiO3 + H2SO4 → H2SiO3↓ + Na2SO4.
При рассмотрении этого способа получения кислот нужно помнить, о ряде активности кислот:



 HCl,
HBr, HI
HCl,
HBr, HI H
 2SO4 H2SO3,
H2CO3,
HF, HNO2,
H2S,
2SO4 H2SO3,
H2CO3,
HF, HNO2,
H2S,
HNO3 , HClO4 H3PO4, CH3COOH и др.
Таким образом, сильная H2SO4 вытесняет безкислородные сильные кислоты, затем сильные кислородосодержащие, а они в свою очередь вытесняют слабые кислоты. Реакции протекают преимущественно в прямом направлении.
3 способ: Взаимодействием некоторых простых веществ с водой, например:
Cl2 + H2O → HClO + HCl.
4 способ: Гидролизом растворимых бинарных соединений, например:
Cl3N + 3HOH → 3HClO + NH3.
Химические свойства кислот
1) Водные растворы кислот изменяют окраску индикаторов (таблица 6).
Таблица 6 – Окраска индикаторов в растворах кислот
Индикатор | Цвет индикатора | Цвет индикатора в растворе кислоты(рН < 7) |
лакмус | фиолетовый | красный |
фенолфталеин | бесцветный | бесцветный |
метилоранж | оранжевый | розовый (красный) |
2) При растворении в воде кислоты диссоциируют.
Сильные одноосновные кислоты диссоциируют в водных растворах полностью (на 100%) на ионы водорода и кислотный остаток, например:
HCl
→ H+ + Cl ,
,
HClO4 → H+ + ClO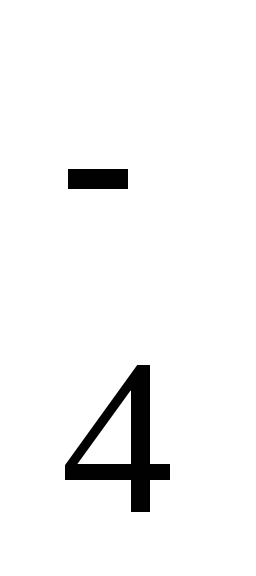 .
.
Слабые кислоты (HF, HNO2, CH3COOH, H2CO3, H2S, H3PO4 и др.) в водных растворах диссоциируют незначительно. Процесс диссоциации обратим. При этом устанавливается химическое равновесие между молекулами слабой кислоты и ионами, на которые идет диссоциация, например:
HCN
↔ H+ +CN .
.
Многоосновные кислоты в водных растворах диссоциируют по ступеням с постепенным отщеплением катионов водорода Н+.
Таким образом, сколько катионов водорода Н+ содержится в молекуле кислоты, столько будет ступеней диссоциации у этой кислоты.
Нужно помнить, что многоосновные сильные кислоты по первой ступени диссоциируют необратимо, а слабые кислоты по всем ступеням диссоциируют обратимо, например:
1 ступень: H2SO4 → H+ + HSO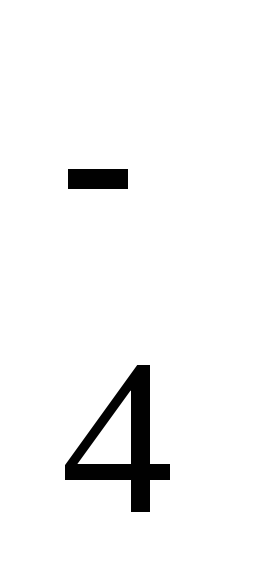 ,
,
2
ступень: HSO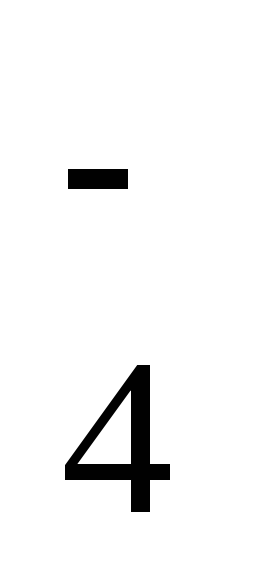
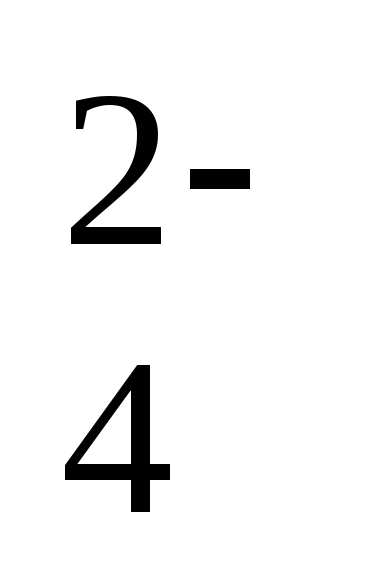 .
. 1 ступень: H2CO3 ↔ H+ + HCO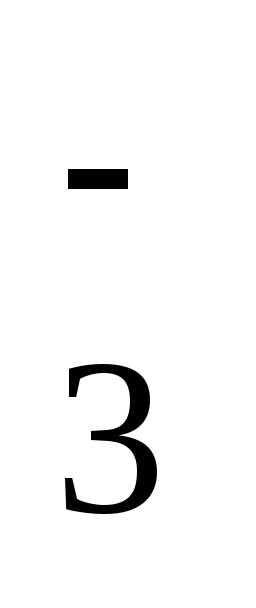 ,
,
2
ступень: HCO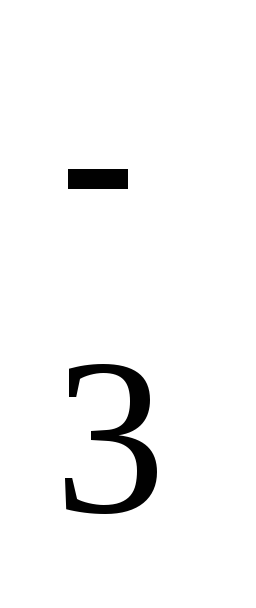 ↔ H+ + CO
↔ H+ + CO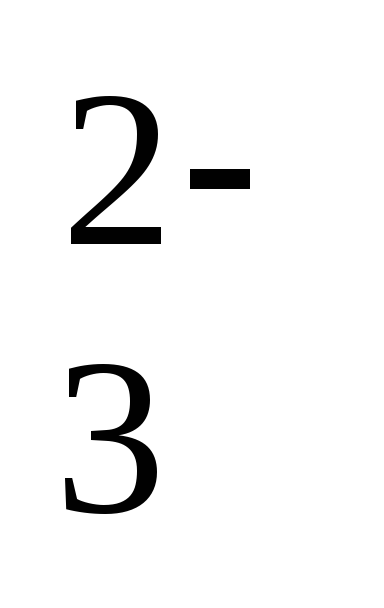 .
.
1
ступень: H2S
↔ H+ + HS ,
,
2
ступень: HS ↔ H+ + S2-.
↔ H+ + S2-.
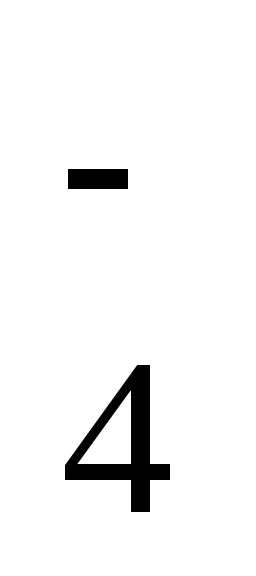 ,
, 2 ступень: H2PO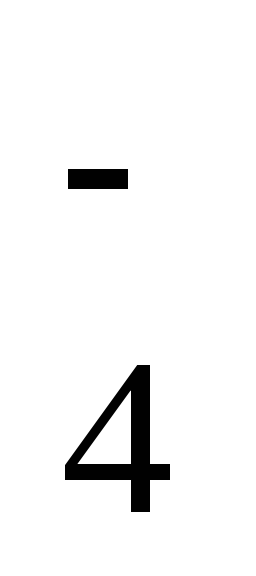 ↔ H+ + HPO
↔ H+ + HPO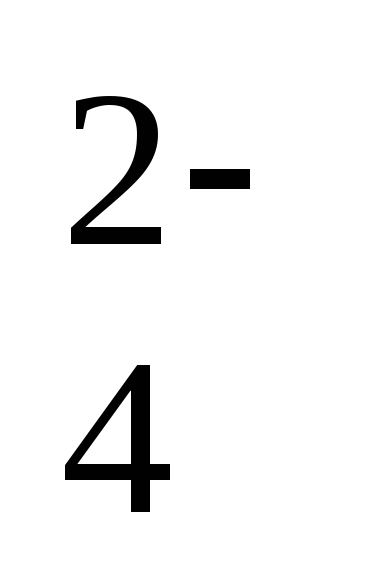 ,
,
3
ступень: HPO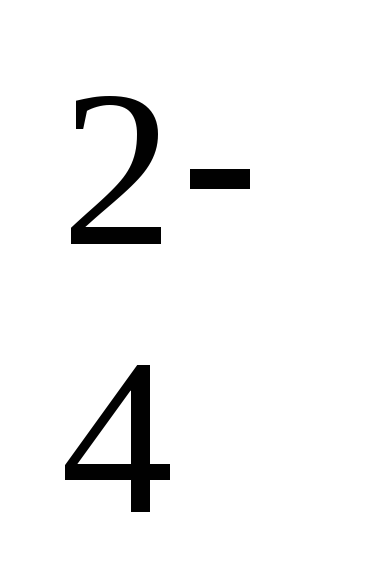 ↔ H+ + PO
↔ H+ + PO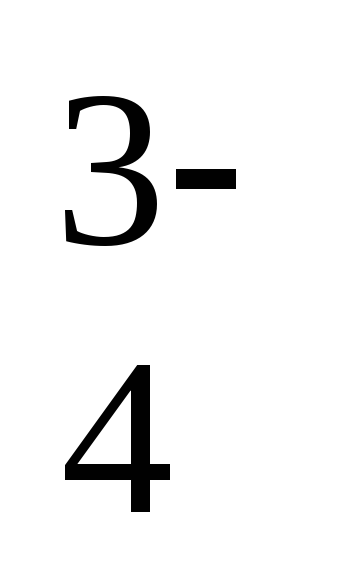 .
.
Ступенчатой диссоциацией многоосновных кислот объясняется образование кислых солей.
3) Взаимодействие с активными металлами разбавленных HCl, H2SO4 и некоторых других кислот (с образованием соли и выделением газообразного водорода), например:
Fe + 2HCl → FeCl2 + H2↑,
Zn + H2SO4 (разб.) → ZnSO4 + H2↑,
2Mg + CH3COOH → Mg(CH3COO)2 + H2↑.
М
 алоактивные
металлы в этих реакциях не участвуют,
например:
алоактивные
металлы в этих реакциях не участвуют,
например:
 Ag
+ HCl
Ag
+ HCl 
4) Взаимодействие металлов и неметаллов с концентрированной H2SO4
и разбавленной HNO3.а) Концентрированная H2SO4 взаимодействует как с активными, так с
малоактивными металлами и образуется смесь различных продуктов
2-
восстановления иона SO4 , например:
 ZnSO4 + H2O+ SO2 ↑,
ZnSO4 + H2O+ SO2 ↑,
Z n
+ H2SO4 (конц.)
ZnSO4 + H2O+ S
,
n
+ H2SO4 (конц.)
ZnSO4 + H2O+ S
,
Чем активнее металл, тем больше будет выделяться H2S ↑.
б) При взаимодействии с малоактивными металлами, реакция идёт в одном направлении, например:
Сu + H2SO4 (конц.) → CuSO4 + H2O+ SO2 ↑.
в) При взаимодействии разбавленной HNO3 реакция протекает с образованием одного
из четырех продуктов восстановления
аниона 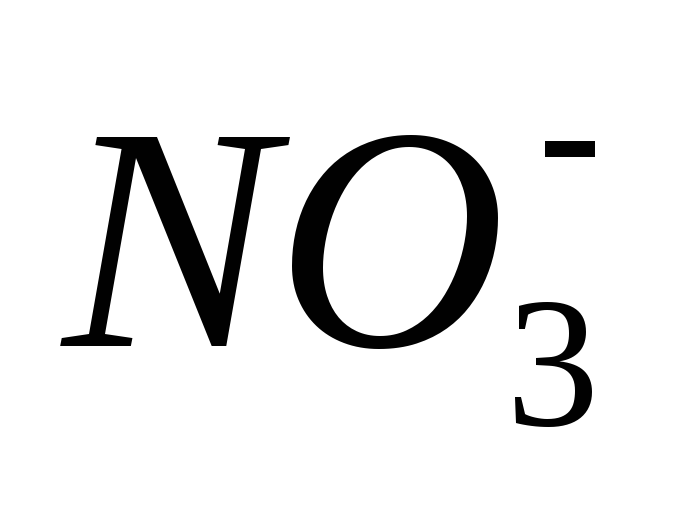 и образуется соль активного металла,
вода и различные продукты восстановления
иона
и образуется соль активного металла,
вода и различные продукты восстановления
иона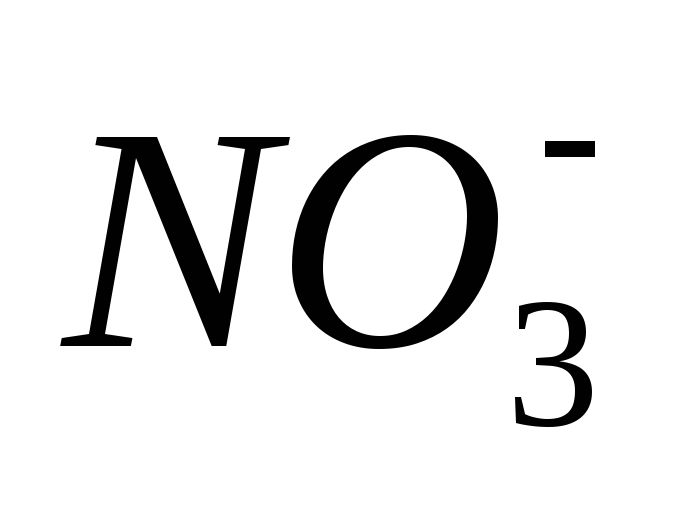 (аммиак или соль аммония, либо оксид
азота (І) и др.), например:
(аммиак или соль аммония, либо оксид
азота (І) и др.), например:
 Zn(NO3)2 + H2O+
NH3,
Zn(NO3)2 + H2O+
NH3,
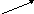 Zn(NO3)2 + H2O+ NH4NO3,
Zn(NO3)2 + H2O+ NH4NO3,
Z
 n
+ HNO3 (разбав.)
Zn(NO3)2 + H2O+
N2,
n
+ HNO3 (разбав.)
Zn(NO3)2 + H2O+
N2,
Zn(NO3)2 + H2O+ N2O.
Какой продукт
восстановления иона 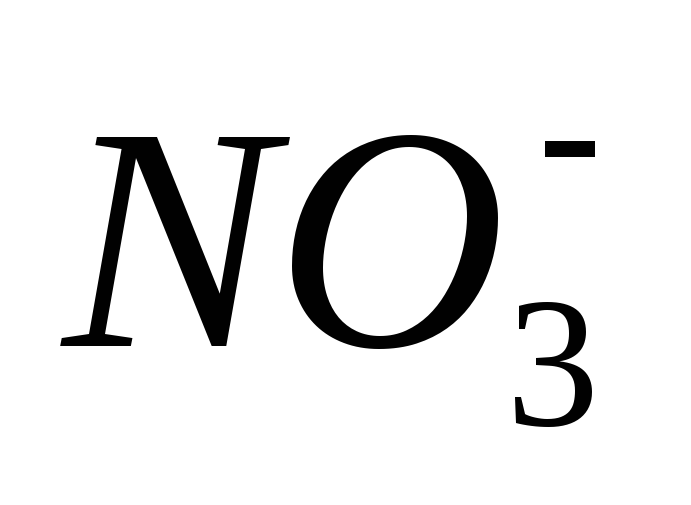 преобладает,
зависит от активности металла, площади
его соприкосновения с кислотой и
концентрации разбавленнойHNO3.
преобладает,
зависит от активности металла, площади
его соприкосновения с кислотой и
концентрации разбавленнойHNO3.
г) При взаимодействии разбавленной HNO3 с малоактивными металлами, реакция идёт преимущественно с образованием NO, например:
Cu + HNO3 (разбав.) → Cu(NO3)2 + H2O+ NO ↑.
д) Концентрированная H2SO4 и HNO3 кислоты взаимодействует с некоторыми неметаллами – активными восстановителями. При этих реакциях образуются оксиды неметаллов, оксиды серы или азота, например:
H2SO4 (конц.) + С → СO2 + SO2 + H2O,
HNO3 (конц.) + С → СO2 + NO2 + H2O.
5) Взаимодействие с основными и амфотерными оксидами, например:
MgO + H2SO4 → MgSO4 + H2O,
CaO + 2HCl → CaCl2 + H2O,
ZnO + 2HNO3 → Zn(NO3)2 + H2O,
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O.
6) Взаимодействие с основными и амфотерными гидроксидами, например:
KOH + HCl → KCl + H2O,
2NaOH + H2SO4 → Na2SO4 + 2H2O,
Al(OH)3 + 3HNO3 → Al(NO3)3 + 3H2O,
Cr(OH)3 + 3HCl → CrCl3 + 3H2O.
При взаимодействии с многокислотными основаниями и амфотерными гидроксидами реакции протекают по ступеням с образованием основных и средних солей, например:
1 ступень: Fe(OH)3 + HCl → Fe(OH)2Cl + H2O,
2 ступень: Fe(OH)3 + 2HCl → Fe(OH)Cl2 + 2H2O,
3 ступень: Fe(OH)3 + 3HCl → FeCl3 + 3H2O.
При взаимодействии многоосновных кислот с основаниями реакции протекают по ступеням с образованием кислых и средних солей, например:
1 ступень: Н3РО4 + КОН → КН2РО4 + H2O,
2 ступень: Н3РО4 + 2КОН → К2НРО4 + 2H2O,
3 ступень: Н3РО4 + 3КОН → К3РО4 + 3H2O.
7) Взаимодействие с некоторыми нормальными (или средними) солями с образованием новой соли и новой кислоты. Эти реакции возможны в том, случае, если образуется труднорастворимое или газообразное соединение, более слабая кислота, чем исходная, например:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl,
AgNO3 + HCl → AgCl↓ + HNO3,
K2SiO3 + 2HCl → H2SiO3↓ + 2KCl,
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O.
8) Термическое разложение кислородных кислот, например:
H2SiO3 H2O
+ SiO2,
H2O
+ SiO2,
H2CO3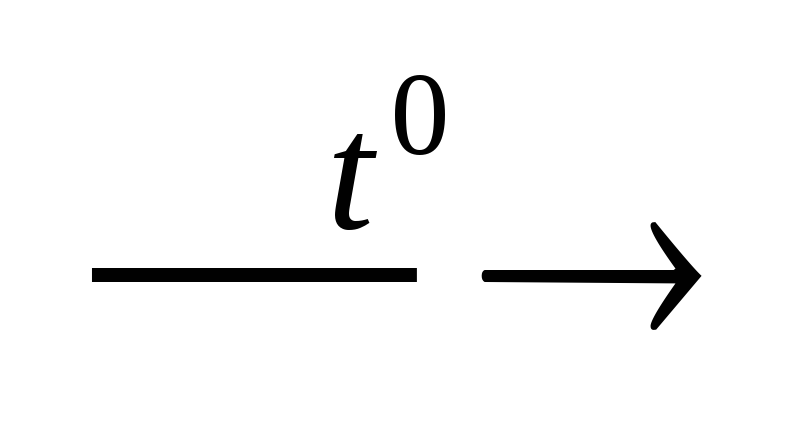 H2O
+ CO2↑,
H2O
+ CO2↑,
4HNO3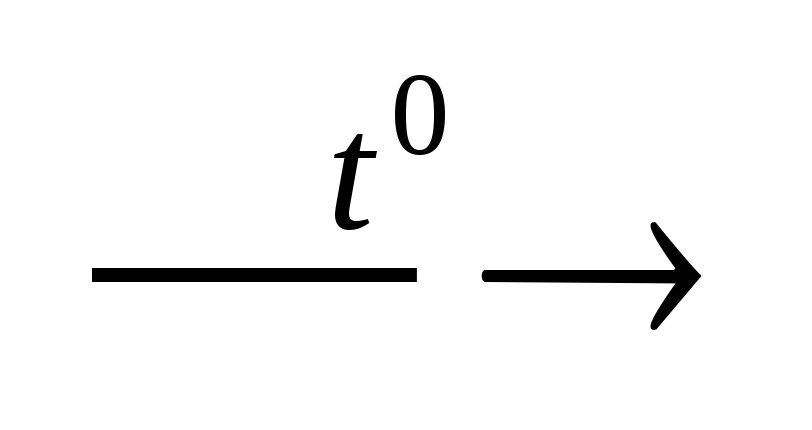 4NO2 + 2H2O
+ O2,
4NO2 + 2H2O
+ O2,
H2SO4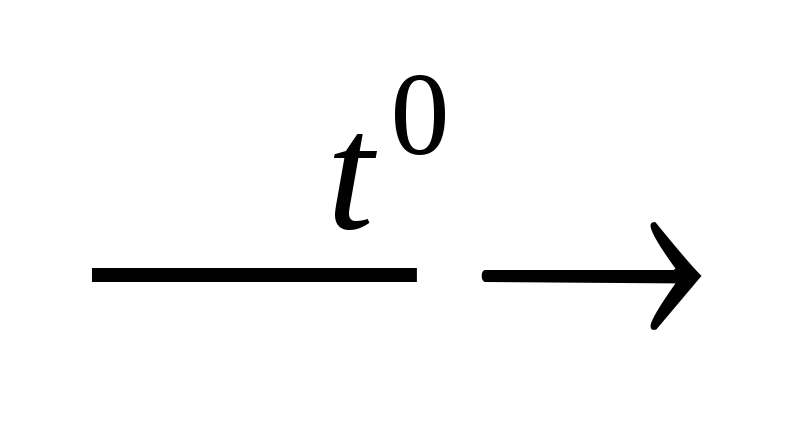 H2O
+ SO3.
H2O
+ SO3.
> 98,3%
9) Диспропорционирование некоторых кислот в низких степенях окисления атома, образующего кислоту, например:
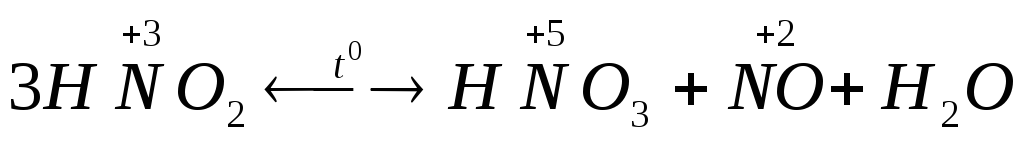 ,
,
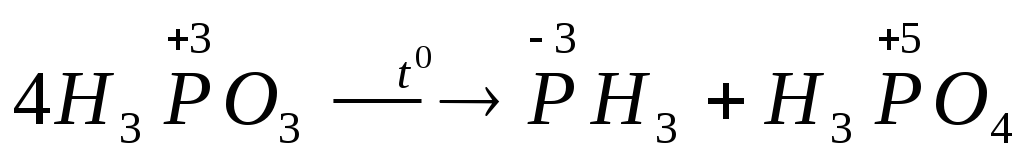 .
.
studfile.net
Свойства кислот, получение кислот
Свойства кислот
Кислоты — это сложные химические вещества, которые содержат атомы водорода, способные замещаться на атомы металлов и образовывать соли.

Кислоты различаются по основности: Основность определяется количеством атомов водорода, входящим в их состав. Например, серная — H2SO4 — двухосновная, так как в её состав входит 2 атома водорода.
Кислоты разделяют также на кислородосодержащие и не содержащие кислород. Например, соляная — HCl — не содержит атомов кислорода, а H2СO3 — угольная — содержит 3 атома кислорода и является кислородосодержащей.
Теперь разберём подробнее свойства кислот и их химическое взаимодействие c простыми и сложными веществами.
Основные химические свойства кислот:
— взаимодействие с металлами:
H2SO4 +Zn → ZnSO4 + H2 — Образуется соль и выделяется водород
В зависимости от концентрации самой кислоты получаются различные продукты химической реакции. Например,
2H2SO4 + Cu → CuSO4 + SO2 +2H2O — в этом случае серная кислота — концентрированная. Разбавленная — на медь (Cu) никак не действует.
— взаимодействие с основными оксидами и амфотерными оксидами:
CuO + H2SO4 → CuSO4 + H2O — образуется соль и вода;
SnO + HCl → SnCl2 + H2O (оксид олова — SnO — амфотерный оксид)
— взаимодействие с основаниями и щелочами:
HCl + KOH → KCl + H2O — эту реакцию ещё называют реакцией нейтрализации — образуется соль и вода;
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
— взаимодействие с солью:
При химических реакциях кислот с солью обязательно надо учитывать основные признаки химических реакций, а именно, химическая реакция пройдёт, если будет выделяться газ, выпадет осадок, и т.д.
N2CO3 + 2HCl → 2NaCl + CO2 + H2O — выделяется углекислый газ CO2. Конечно, если говорить точно, то образуется слабая угольная кислота (H2CO3), которая сразу же распадается на углекислый газ и воду. При этих реакциях образуется соль и другая кислота (более слабая, чем та, которая вступала в реакцию).
Теперь рассмотрим основным способы получения кислот
Получение кислот
Получение кислот производят с помощью следующих химических реакций:
— при взаимодействии кислотных оксидов с водой:
SO3 + H2O → H2SO4;
CO2 + H2O → H2CO3;
— при взаимодействии кислоты с солью:
NaCl + H2SO4(конц.) → HCl + Na2SO4 — при этой химической реакции образуется новая более слабая кислота (более слабая, чем серная, но тоже сильная) и другая соль;
— при взаимодействии неметаллов с водородом с последующим растворением их в воде:
H2 + Cl2 → HCl (Надо помнить, что само по себе данное химическое соединение — газ хлороводород HCl кислотой не является. Для её образования необходимо полученный газ HCl растворить в воде). Аналогичным образом поступают с газом сероводородом:
H2 + S → H2S;
— при окислении некоторых простых веществ:
P + 5HNO3 +2H2O → 3H3PO4 + 5NO (в этой химической реакции происходит окисление фосфора (P) азотной кислотой (HNO3) до ортофосфорной кислоты (H3PO4) с выделением оксида азота (NO)
www.kristallikov.net
Общие методы получения кислот
1. Бескислородные кислоты можно получить прямым взаимодействием соответствующего простого вещества с водородом:
H2 + Cl2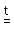 2HCl;
2HCl;
H2 + S 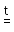 H2S
H2S
2. Кислородсодержащие кислоты обычно получают взаимодействием их ангидридов (кислотных оксидов) с водой:
SO3 + H2O = H2SO4
3. Кислородсодержащие кислоты можно получить окислением простого вещества энергичным окислителем в водном растворе (мокрое сожжение):
Sn
+ 4HNO3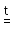 H2SnO3 + 4NO2
+ H2O
H2SnO3 + 4NO2
+ H2O
4. Летучие или слабые кислоты получают при действии на их соли сильной нелетучей кислоты (в первом случае при нагревании):
NaNO3
(кр.) + H2SO4
(конц.)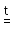 NaHSO4 + HNO3;
NaHSO4 + HNO3;
2NaNO2 + H2SO4 = Na2SO4 + 2HNO2
Нерастворимые в воде кислоты можно получить, действуя на растворы их солей более сильной растворимой кислотой:
Na2SiO3 + H2SO4 = H2SiO3 + Na2SO4
6. Водный раствор кислоты можно получить реакцией ионного обмена, идущей с образованием осадка:
Ba(ClO3)2 + H2SO4 = 2HClO3 + BaSO4
Общие химические свойства кислот. Большинство кислородсодержащих кислот термически неустойчивы и при нагревании, иногда незначительном, легко разлагаются, образуют при этом воду и соответствующий оксид (ангидрид кислоты):
H2SiO3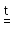 SiO2 + H2O;
SiO2 + H2O;
4HNO3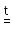 4NO2 + O2 + 2H2O
4NO2 + O2 + 2H2O
Кислоты, содержащие элемент в промежуточной степени окисления, могут быть окислены кислородом, галогенами, а также другими окислителями:
2H2SO3 + O2 = 2H2SO4;
H2SO3 + Cl2 + H2O = H2SO4 + 2HCl
Металлы, стоящие в ряду стандартных электродных потенциалов левее водорода, вытесняют его из водных растворов кислот:
Zn + 2HCl = ZnCl2 + H2
Кислоты, анионы которых являются окислителями, взаимодействуют с металлами без выделения водорода:
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
Окисляют кислоты-окислители также и неметаллы:
P
+ 5HNO3
(конц.)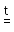 H3PO4 + 5NO2
+ H2O
H3PO4 + 5NO2
+ H2O
Взаимодействуя с основными и амфотерными оксидами, кислоты образуют соли.
Реакция кислот с основаниями (реакция нейтрализации) — один из основных методов получения солей.
Соли: определение, классификация и номенклатура. Общие методы получения и химические свойства солей
Cоли — это вещества, содержащие в своем составе любые катионы, кроме катиона водорода, связанные с анионом кислотного остатка. Соли можно рассматривать как продукты нейтрализации кислоты основанием или, наоборот, как продукты нейтрализации основания кислотой. Выделяют несколько типов солей:
Средние соли — это продукты полной нейтрализации кислоты основанием, например, Na2SO4 или Na3PO4. Название средних солей строится из названия кислотного остатка и названия металла с указанием его степени окисления, если это необходимо:
Na2SO4 — сульфат натрия, Na3PO4 — фосфат натрия, Cu(NO3)2 — нитрат меди(II)
Кислые соли — это продукты неполной нейтрализации кислот. При построении их названий перед названием аниона ставится приставка «гидро» с указанием числа атомов водорода, связанных с кислотным остатком (приставку «моно» обычно опускают), например:
Na2НPO4 — гидрофосфат натрия, NaН2РO4 — дигидрофосфат натрия
Основные соли — это продукты неполной нейтрализации оснований. При построении их названий перед названием аниона ставится приставка «гидроксо» с указанием числа гидроксид-анионов, связанных с катионом металла, например:
Al(OH)Cl2 — гидроксохлорид алюминия, Al(OH)2Cl — дигидроксохлорид алюминия
Двойные соли — это средние соли — продукты замещения атомов водорода атомами разных металлов. При построении их названий катионы металлов перечисляют в алфавитном порядке, например:
KNa2PO4 — фосфат калия-динатрия, KAl(SO4)2 — сульфат алюминия-калия.
Смешанные соли — это продукты замещения гидроксид-анионов анионами разных кислотных остатков. При построении их названий кислотные остатки перечисляют в алфавитном порядке, например:
Ca(ClO)Cl — гипохлорит-хлорид кальция, AlClBr2 — дибромид-хлорид алюминия.
studfile.net
Конспект «Кислоты: классификация, свойства, получение»
Кислоты: классификация, свойства, получение
КЛАССИФИКАЦИЯ КИСЛОТ
Кислоты – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид катионов – катионы водорода Н+ (точнее – катионы гидроксония H3O+):
НCl = Н+ + Cl– (НCl + H2O = H3O+ + Cl–)
HNO3 = Н+ + NO3– (HNO3 + H2O = H3O+ + NO3–)
Кислоты – вещества молекулярного строения. Атомы в молекулах кислот связаны ковалентными полярными химическими связями. Чем более поляризована связь между атомом водорода, способным отщепляться в виде катиона водорода, и атомом какого–либо другого элемента, тем легче происходит её распад с образованием ионов, тем сильнее кислота.
Классифицировать кислоты можно по разным признакам.
- По содержанию кислорода кислоты могут быть бескислородными (например, НCl, НВг, HI, H2S, HCN) и кислородсодержащими (например, H2SO4, HNO3, H3PO4).
- По числу атомов водорода в молекуле кислоты, способных замещаться атомами металлов (по основности), кислоты могут быть одноосновными (НCl, НВг, HI, HNO3), двухосновными (H2SO4, H2SO3, H2СО3, H2S), трёхосновными (H3PO4, H3AsO4) и т. д. Существуют и кислоты большей основности, например пирофосфорная Н4Р2O7 – четырёхосновная.
- По степени диссоциации кислоты могут быть сильными (НCl, НВг, HI, HNO3, H2SO4) и слабыми (H2S, H2SiO3, H2CO3, СH3СООН).
- По растворимости кислоты могут быть растворимыми в воде (H2SO4, HNO3, НCl, СH3СООН) и нерастворимыми в воде (H2SiO3, C17H35СООН).
- По стабильности кислоты могут быть стабильными (H2SO4, НCl, H3РO4) и нестабильными (H2CO3, H2SO3, HNO2). Нестабильные кислоты, как правило, невозможно выделить в свободном состоянии, они существуют только в растворах.
- По летучести кислоты могут быть летучими (НCl, HNO3, СH3СООН) и нелетучими (H2SO4, H3PO4, H2SiO3).
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
- Кислоты реагируют с металлами. Металлы, расположенные в электрохимическом ряду напряжений металлов до водорода H2, вытесняют водород из растворов кислот. Происходит реакция замещения, образуется соль и водород:
Zn + 2НCl = ZnCl2 + H2↑
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
Металлы, расположенные в ряду напряжений после водорода, с кислотами не реагируют.
Важное примечание: с серной концентрированной кислотой и с азотной кислотой любой концентрации реакции идут за счёт аниона кислотного остатка, водород в этих случаях не выделяется:
Cu+ 4HNO3 (конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Cu+ 2H2SO4 (конц.) = CuSO4 + SO2↑ + 2H2O
- Кислоты реагируют с основными и амфотерными оксидами с образованием соли и воды:

- Кислоты реагируют с основаниями и с амфотерными гидроксидами с образованием соли и воды:

(Взаимодействие сильных кислот с сильными основаниями – реакция нейтрализации.)
Al(ОН)3 + 3НCl = AlCl3 + 3H2O
Al(ОН)3 + 3Н+ = Al3+ + 3H2O
(Реакция амфотерного гидроксида с сильной кислотой.)
- Сильные кислоты реагируют с солями слабых кислот. Слабые кислоты при этом могут быть вытеснены из солей. Например, сильная соляная кислота НCl вытесняет слабую сероводородную кислоту H2S:
FeS + 2НCl = FeCl2 + H2S↑
FeS + 2Н+ = H2S↑ + Fe2+
Нелетучие кислоты могут вытеснить летучую из её соли. Например, нелетучая серная кислота H2SO4 вытесняет более летучую азотную HNO3. Обе кислоты – сильные. В растворе такая реакция не происходит. Она осуществима, если соль находится в кристаллическом виде (не в растворе), а серная кислота концентрированная:
Аналогично можно получить газообразный хлороводород, раствор которого – соляная кислота.
- Кислоты можно обнаружить индикаторами. Индикаторы реагируют на наличие в растворе ионов Н+ (H3O+). Лакмус в кислой среде приобретает красный цвет, метиловый оранжевый – красный, фенолфталеин – бесцветный. Для обнаружения кислот удобно использовать лакмус.
ПОЛУЧЕНИЕ КИСЛОТ
Бескислородные кислоты, состоящие из двух элементов, могут быть получены синтезом простых веществ:
Кислородсодержащие кислоты могут быть получены в результате взаимодействия с водой соответствующих кислотных оксидов:
Р2O5 + 3H2O = 2H3РO4
SO3 + H2O = H2SO4
Слабые или летучие кислоты могут быть вытеснены из солей более сильными или менее летучими кислотами. Например, сильная соляная кислота НCl вытесняет слабую уксусную кислоту СH3СООН:
CH3COONa + НCl = СH3СООН + NaCl
СH3СОО– + Н+ = СH3СООН
Летучие кислоты могут быть вытеснены из солей менее летучими кислотами. Например, нелетучая серная кислота H2SO4 может вытеснить более летучую соляную НCl. Но в растворе такая реакция не пойдёт (обе кислоты сильные). Она осуществима, если соль в кристаллическом состоянии (не в растворе) обработать серной концентрированной кислотой:
В результате этой реакции образуется газообразный хлороводород, при растворении которого в воде образуется соляная кислота.
Для получения слабых нелетучих кислот (например, ортофосфорной кислоты или сернистой кислоты) лучше воспользоваться концентрированной серной кислотой, причём образующаяся сернистая кислота H2SO3 разлагается на сернистый газ SO2 и воду:
Са3(РO4)2 (тв.) + 3H2SO4 (конц.) = 3CaSO4 + 2H3РO4
Na2SO3 (тв.) + H2SO4 (конц.) = Na2SO4 + SO2↑ + H2O
Всё о кислотах кратко в одной таблице

Всё о кислотах кратко в одной таблице
Конспект урока «Кислоты: классификация, свойства, получение».
Следующая тема: «».
uchitel.pro
получение, физические и химические свойства
Физические свойства
Низшие жирные кислоты – это легкоподвижные с резким запахом жидкости, средние члены – масла с неприятным прогорклым запахом, высшие – твердые кристаллические вещества без запаха.
Муравьиная, уксусная и пропионовая кислоты смешиваются с водой в любых соотношениях, с ростом молекулярной массы растворимость быстро уменьшается, для высших членов гомологического ряда она равна нулю.
Температуры кипения и плавления увеличиваются с ростом числа атомов углерода, но не равномерно. Кислоты с четным числом атомов углерода имеют более высокие температуры плавления, по сравнению со следующими за ними кислотами с нечетным числом атомов углерода. Жирные кислоты имеют два ряда температур плавления – один ряд охватывает кислоты с четным числом атомов углерода, другой – с нечетным. В обоих рядах разности температур плавления двух соседних кислот постепенно уменьшаются (см. табл.)
Такое своеобразное различие между карбоновыми кислотами с четным и нечетным числом атомов углерода отчасти проявляется и в химических и биологических свойствах.
Карбоновые кислоты сильно ассоциированы и показывают вдвое больший молекулярный вес, чем это следует из их простой молекулярной формулы даже при температурах, выше их температур кипения.
Как и у спиртов ассоциация обусловлена наличием ОН-группы, водородный атом которой связывается водородной связью с атомом кислорода другой молекулы кислоты.
Получение карбоновых кислот
- Присоединение натрий алкилов к двуокиси углерода:
СH3Na + CO2 = CH3COONa
- Присоединение алкилмагниевых солей (реактив Греньяра) к двуокиси углерода:
C2H5MgCl + CO2 = C2H5COOMgCl
C2H5COOMgCl + H2O = C2H5COOH + Mg(OH)Cl
- Способ Реппе. Нагревание олефинов, окиси углерода и воды в присутствии катализатора Ni(CO)4 при 200 атм и 270°С:
CH2=CH2 + CO + H2O = CH3-CH2COOH
- Окисление первичных спиртов и альдегидов кислородом воздуха в присутствии катализаторов или хромовой кислотой, KМnО4и K2Сr2О7:
- Окисление парафинов – промышленный способ:
RCH2Ch3R’ + 5/2O2 = RCOOH + R’COOH + H2O
Окисление осуществляют при катализе реакции солями кобальта или марганца.
- Гидролиз сложных эфиров:
R-COOR`+ КОН →R-COOK+R`OH
R-COOK + HCl → R-COOH + KCl
- Омыление жиров и масел:
- Гидролиз галоидных алкилов осуществляют основанием или водой при катализе апротонными кислотами, например, FeCl3
R-CCl3+ 3NaOH→ [R-C(OH)3] →R-COOH+ Н2О + 3NaCl
- Гидролиз нитрилов:
CH3CN+ 2Н2О →CH3COONH4.
CH3COONH4 + HCl → СН3СООН + NH4Cl
- Гидролиз ангидридов карбоновых кислот:
(RCO)2O + H2O = 2RCOOH
- Гидролиз галогенангидридов карбоновых кислот:
RCOHal + H2O = RCOOH + HHal
- Метод Арндта и Эйстерта основан на взаимодействии хлорангидрида кислоты с диазометаном. Образующийся диазокетон обрабатывают водой в присутствии серебра, платины или меди:
RCOCl + 2CH2N2 = RCONH2 + CH3Cl + N2
RCONH2 + HOH = RCH2СOOH + N2
Химические свойства одноосновных насыщенных карбоновых кислот
Одноосновные карбоновые кислоты обладают высокой реакционной способностью, причем в молекуле кислоты присутствуют одновременно несколько реакционных центров:
- О-Н-Кислотный центр. За счет подвижного водорода ОН группы характерно проявление кислотных свойств.
- Электрофильный центр – атом углерода карбоксильной группы. Благодаря этому центру кислоты и их производные вступают в реакции нуклеофильного замещения.
- Основный центр – оксогруппа (карбонильная группа), имеющая пару электронов. Способна к протонированию (присоединению водорода), в реакциях нуклеофильного замещения.
- С-Н – кислотный центр – возникает в алкильном радикале у α-углеродного атома благодаря индуктивному эффекту карбоксильной группы. При этом возникает возможность реакции конденсации, а также замещения водорода при этом центре.
I. Реакции с разрывом в карбоксильной группе связи O─H
- Диссоциация кислот в водных растворах происходит с отщеплением водорода:
R-COOH ↔ R-COO−+ Н+
Карбоновые кислоты в водных растворах частично подвергаются электролитической диссоциации, которая по сравнению с минеральными кислотами незначительна. Все органические кислоты являются слабыми, тем не менее, они имеют свойственные минеральным кислотам химические свойства. Самая сильная среди одноосновных кислот – муравьиная (Н-СООН).
Заместители в молекуле кислоты способствуют возникновению индукционного эффекта, вследствие чего кислотность кислоты, а значит и ее сила уменьшается или растет в зависимости от природы заместителя. Так, электронодонорые заместители (например, алкильные заместители) понижают кислотность (силу) кислот, а электроноакцепторные (например, Cl, Вr, I) – увеличивают кислотность (силу) кислот.
Это отражается в значениях их констант кислотности.
Водные растворы карбоновых кислот изменяют окраску индикаторов.
- Образование солей карбоновых кислот
а) Взаимодействие кислот с металлами, стоящими в ряду напряжения металлов до водорода, приводит к образованию соли и выделению водорода:
б) Взаимодействие кислот с основными и амфотерными оксидами приводит к образованию соли и воды:
2Н–СООН + СаО → (Н–СОО)2Са + Н2О
2С2Н5–СООН + ZnО → (С2Н5–СОО)2Zn + Н2О
в) Реакция нейтрализации — взаимодействие кислот с щелочами, нерастворимыми основаниями и амфотерными гидроксидами к образованию соли и воды:
2Н–СООН + Са(ОH)2 → (Н–СОО)2Сa + 2Н2О
2С2Н5–СООН + Zn(ОH)2 → (С2Н5–СОО)2Zn + 2Н2О
2СН3–СООН + КОН → Н–СООК + Н2О
г) Взаимодействие кислот с аммиаком NH3 и гидроксидом аммония NH4OH:
Н–СООН + NH3 → Н–СООNH4 (формиат аммония)
СН3–СООН + NH4OH → СН3–СООNH4 + Н2О
г) Взаимодействие кислот с солями, образованными более слабыми или летучими кислотами:
II. Реакции, протекающие с разрывом C─O связи (замещение OH-группы)
Гидроксильная группа карбоновых кислот очень реакционноспособна и может замещаться многими атомными группами или отдельными атомами, например, Сl, SH, NH2, NHNH2, N3, NHOH
- Реакция этерификации — взаимодействие кислот со спиртами с образованием сложных эфиров:
Механизм реакции этерификации:
- Взаимодействие с аммиаком с образованием амидов кислот. На первой стадии реакции образуется аммониевая соль, на второй стадии при нагревании соли происходит отщепление воды и образование амида кислоты:
- Взаимодействие с галогенирующими агентами. Чаще всего используют хлорсодержащие соединения (галогениды фосфора — PCl3, PCl5, тионилхлорид — SO2Cl):
- Межмолекулярная дегидратация. Реакция протекает под действием температуры, в присутствии водоотнимающего агента – Р2О5 с образованием ангидридов кислот:
Исключением является муравьиная кислота межмолекулярная дегидратация которой приводит к образованию окиси углерода СО:
III. Реакции с разрывом связей C─H у α-углеродного атома углеводородного радикала
Реакции замещения. В молекуле карбоновой кислоты атомы водорода при втором атоме углерода (α-углеродного атома) являются наиболее подвижными по сравнению с другими водородными атомами. Поэтому они способны замещаться, например, на атом галогена в присутствии красного фосфора с образованием α-галогенкарбоновых кислот:
IV. Восстановление карбоновых кислот
Карбоксильная группа восстанавливается с большим трудом. Чтобы восстановить ее до метильной группы, требуется длительное нагревание с концентрированной йодистоводородной кислотой и фосфором и даже в этом случае восстановление протекает не до конца. Прямое восстановление карбоновых кислот водородом достигается применением высоких давлений и температур в присутствии катализаторов (Cu, Co, Zn-Cr-Cu-Cd катализатор) по способу Шраута-Нормана. Этот способ используют в промышленности для получения из высших жирных кислот первичных спиртов, которые используют в получении моющих средств. Наиболее легко восстановление кислот происходит с помощью алюмогидрида лития (LiAlH4) или диборана (B2H6):
V. Окисление (горение) карбоновых кислот.
Карбоновые кислоты, в отличие от альдегидов, довольно устойчивы к действию окислителей. И только муравьиная кислота, благодаря особенностям своего строения может окисляться до углекислого газа.
Однако все кислоты могут гореть в кислороде (жесткое окисление), образуя углекислый газ (СО2) и воду:
VI Декарбоксилирование карбоновых кислот
- Одноосновные карбоновые кислоты довольно устойчивы, отщепление их карбоксильной группы в виде СО2 происходит при высокой температуре:
- Наличие в молекуле кислоты электроноакцепторных заместителей в α-положении облегчает процесс декарбоксилирования:
- При сплавлении натриевых солей карбоновых кислот с NaOH, также происходит декарбоксилирование:
- Синтез Кольбе. При электролизе растворов или расплавов карбоновых кислот или их солей происходит декарбоксилирование с образованием алканов:
Отличительные свойства муравьиной кислоты
В молекуле метановой (муравьиной) кислоты сочетаются две группы – карбонильная и карбоксильная. Поэтому наряду со всеми свойствами кислот она обладает свойствами альдегидов:
- Окисление муравьиной кислоты:
- Взаимодействие муравьиной кислоты с аммиачным раствором оксида серебра (I) (реакция «серебрянного зеркала») – качественная реакция:
- Взаимодействие муравьиной кислоты с раствором гидроксида меди(II):
- Дегидратация муравьиной кислоты при нагревании с концентрированной H2SO4:
- При нагревании солей муравьиной кислоты (формиатов), они переходят в соли двухосновной щавелевой кислоты (оксалаты):
zadachi-po-khimii.ru
Внеклассный урок — Кислоты: способы получения и химические свойства
Кислоты. Способы получения и химические свойства
Бескислородные кислоты получают:
1. Взаимодействием неметалла с водородом.
Например:
H2 + Cl = 2HCl
2. Действием на соль более сильной или менее летучей кислотой.
Например:
FeS + 2HCl = FeCl2 + H2S↑
NaCl + H2SO4 = NaHSO4 + HCl↑
Кислородсодержащие кислоты получают:
1. Взаимодействием кислотных оксидов с водой.
Например:
SO3 + H2O = H2SO4
N2O5 + H2O = 2HNO3
2. Действием на соль более сильной кислотой.
Например:
Na2SiO3 + H2SO4 = H2SiO3↓ + Na2SO4
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ.
Общие свойства кислот в водных растворах обусловлены присутствием катионов H+, которые образуются в процессе диссоциации кислот.
1. Растворы кислот изменяют окраску индикаторов.
2. Кислоты реагируют с основаниями, образуя соль и воду (реакция нейтрализации).
Например:
H2SO4 + 2KOH = K2SO4 + 2H2O
3. Кислоты взаимодействуют с основными и амфотерными оксидами, образуя соль и воду.
Например:
MgO + H2SO4 = MgSO4 + H2O
основный
оксид
ZnO + 2HNO3 = Zn(NO3)2 + H2O
амфотерный
оксид
4. Кислоты вступают в реакции обмена с солями согласно правилу: сильные кислоты вытесняют более слабые из их солей. При этом образуется новая соль и новая кислота.
5. При нагревании некоторые кислоты разлагаются, образуя кислотный оксид и воду.
Например: t
H2SiO = SiO2 + H2O
Реакции обмена кислот с солями возможны в том случае, если в результате реакций образуются осадок, более слабая, неусточивая или более летучая кислота.
По летучести, силе и растворимости кислоты можно расположить в той последовательности, в которой они вытесняют друг друга из солей:
H2SO4 HNO3, HCl, H3PO4 H2SO3 H2CO3 H2S H2SiO3
Летучие кислоты: сероводородная (H2S), азотная (HNO3), соляная (HCl)
Неустойчивые кислоты: H2CO3, H2SO3.
raal100.narod.ru
определение, классификация и номенклатура. Общие методы получения и химические свойства кислот
Кислотами называются соединения, содержащие подвижные атомы водорода, способные замещаться на металл. В водных растворах кислоты диссоциируют с отщеплением катиона водорода. Классификация кислот может быть проведена по нескольким признакам:
1. По элементному составу кислоты делят на кислородсодержащие — кислотные гидроксиды — (HNO3, H2SiO3) и бескислородные (HF, H2S).
2. По числу атомов водорода, способных замещаться на металл, кислоты делят на одноосновные (HCl), двухосновные (H2SO4) и трехосновные (H3PO4). Следует отметить, что по брутто-формуле не всегда можно правильно определить основность кислоты, поскольку не все атомы водорода способны замещаться на металл. Для этого лучше пользоваться графическими формулами, например:
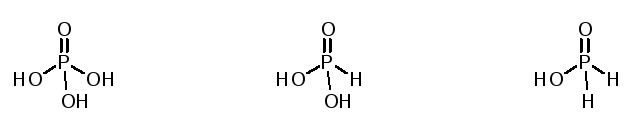
Фосфорная кислота
(трехосновная)
Фосфористая кислота
(двухосновная)
Фосфорноватистая кислота
(одноосновная)
3. По способности к электролитической диссоциации в водных растворах выделяют кислоты сильные (HCl, HNO3), кислоты средней силы (HNO2, HCOOH) и кислоты слабые (HF, H2SiO3).
Согласно правилам номенклатуры IUPAC для кислородсодержащих кислот допускается использование полусистематической номенклатуры, по которой название строится от названия элемента с добавлением соответствующего суффикса, который меняется при изменении степени окисления, например:
HCl+7O4 — хлорная | H3P+5O4 — фосфорная | H+5NO3 — азотная |
HCl+5O3 — хлорноватая | ||
HCl+3O2 — хлористая | H3P+3O3 — фосфористая | H+3NO2 — азотистая |
HCl+1O — хлорноватистая | H3P+1O2 — фосфорноватистая |
Кислоты с максимальным содержанием химически связанной (конституционной) воды называются ортокислотами. Кислоты с минимальным содержанием воды называются метакислотами. Например:
H3PO4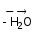 HPO3
HPO3
ортофосфорная метафосфорная
кислота кислота
Кислоты, полученные при межмолекулярной дегидратации (отщеплении воды) ортокислот, относятся к ряду пирокислот, например:
2H3PO4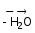 H4P2O7
H4P2O7
ортофосфорная пирофосфорная
кислота кислота
Бескислородные кислоты называются по названию соответствующего водородного соединения, например: HCl — хлороводородная кислота, H2S — сероводородная кислота.
Названия важнейших неорганических (минеральных) кислот и их анионов приведены в таблице 2.
Таблица 2.
Названия некоторых неорганических кислот
Формула | Название кислоты | Анион | Название аниона |
HF | Фтороводородная (плавиковая) | F— | Фторид |
HCl | Хлороводородная (соляная) | Cl— | Хлорид |
HBr | Бромоводородная | Br — | Бромид |
HI | Иодоводородная | I — | Иодид |
HClO4 | Хлорная | ClO4— | Перхлорат |
HClO | Хлорноватистая | ClO— | Гипохлорит |
H2S | Сероводородная | S2- | Сульфид |
H2SO3 | Сернистая | SO32- | Сульфит |
H2SO4 | Серная | SO42- | Сульфат |
HNO2 | Азотистая | NO2— | Нитрит |
HNO3 | Азотная | NO3— | Нитрат |
HPO3 | Метафосфорная | PO3— | Метафосфат |
H3PO4 | Ортофосфорная (фосфорная) | PO43- | Ортофосфат (фосфат) |
H2CO3 | Угольная | CO32- | Карбонат |
HCN | Циановодородная | CN— | Цианид |
H2SiO3 | Метакремниевая (кремниевая) | SiO32- | Метасиликат (силикат) |
studfile.net