ПОТЕНЦИАЛ НУЛЕВОГО ЗАРЯДА | Лако-красочные материалы
Поскольку первичным актом ингибирующего действия соединений является, несомненно, адсорбция, весьма важно уметь предсказать, какие вещества могут адсорбироваться на данном металле и в какой области потенциалов адсорбция будет проявляться. Если адсорбция носит электростатический характер, она зависит от заряда поверхности металла, т. е. адсорбата, и заряда адсор
бента, т. е. ингибитора. Поэтому знание электрических свойств обоих компонентов, участвующих в процессе, имеет очень важное значение. Оно позволяет предсказать, какой тип соединений будет преимущественно адсорбироваться на поверхности металла при потенциале коррозии. Если адсорбция носит специфический характер, эти предсказания менее определенны, ибо адсорбция перестает зависеть от заряда поверхности и может проявляться в довольно широкой области потенциалов.
В связи с этим особое значение имеет потенциал нулевого заряда, на что впервые указал Фрумкин.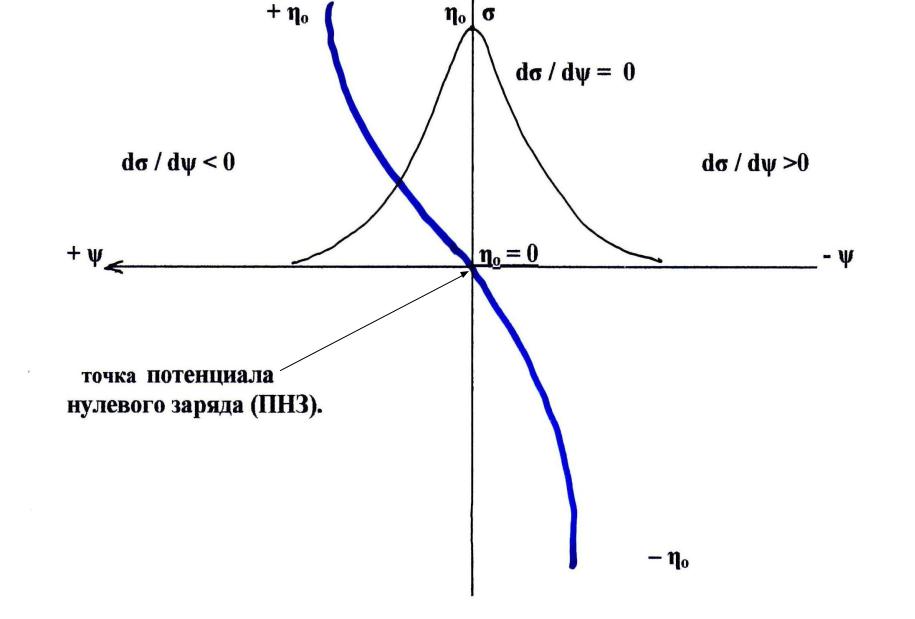
 По мнению Фрумкина, это объясняется тем, что поле втягивает молекулы воды, имеющие большую диэлектрическую проницаемость, вытесняя с поверхности органические молекулы. Поэтому адсорбционная способность электрода оказывается максимальной вблизи потенциала нулевого заряда, т. е. в тех условиях, когда отсутствует ионный слой. Введением в электролит поверхностно-активных ионов можно изменять знак и величину ионного слоя, а значит, и адсорбционную способность электрода.
По мнению Фрумкина, это объясняется тем, что поле втягивает молекулы воды, имеющие большую диэлектрическую проницаемость, вытесняя с поверхности органические молекулы. Поэтому адсорбционная способность электрода оказывается максимальной вблизи потенциала нулевого заряда, т. е. в тех условиях, когда отсутствует ионный слой. Введением в электролит поверхностно-активных ионов можно изменять знак и величину ионного слоя, а значит, и адсорбционную способность электрода.Процессы смачивания металлических поверхностей электролитами, играющие большую роль в развитии коррозии, а также процессы обезжиривания, широко применяемые в технологии противокоррозионной защиты, тоже зависят от строения двойного ионного слоя. Смачивание оказывается наименьшим при потенциале нулевого заряда. Изменением потенциала металла в отрицательную или положительную сторону можно изменить смачиваемость поверхности. Метод катодного обезжиривания металлов использует эффект воздействия поля двойного ионного слоя на адсорбционные процессы.
Задача, таким образом, состоит в том, чтобы иметь надежные данные о значениях потенциалов нулевого заряда металлов.
К сожалению, потенциал нулевого заряда не является абсолютной константой, характерной для данного металла, как это ранее предполагали. Он зависит от многих факторов и в особенности от содержания поверхностно-активных веществ в электролите. Кроме того, нет надежных методов определения точек нулевого заряда для твердых металлов, и в литературе часто встречаются различные значения для одного и того же металла. Наиболее достоверные значения потенциалов нулевого заряда для некоторых металлов приведены в табл. 4.3.
Особо следует остановиться на потенциале нулевого заряда железа, поскольку сплавы на его основе чаще всего приходится защищать ингибиторами. е—4,7). При этом допускалось, что скачок потенциала, возникающий при адсорбции воды на поверхности металла, и скачок потенциала внутри металлической фазы при потенциале нулевого заряда не зависят от природы металла.
е—4,7). При этом допускалось, что скачок потенциала, возникающий при адсорбции воды на поверхности металла, и скачок потенциала внутри металлической фазы при потенциале нулевого заряда не зависят от природы металла.
Таблица 4,3. Значения потенциала нулевого заряда некоторых металлов
|
В работе [66] отмечается, однако, что такое допущение является не совсем корректным, поскольку при адсорбции воды из растворов, не содержащих поверхностно-активных ионов, окачок потенциала изменяется при перехода от ртути к галлию насо0,3 В. Поэтому многие склоняются в пользу тех значений потенциалов нулевого заряда, которые были определены Аязяном по минимуму емкости и Дерягиным с сотр. по методу скрещенных нитей, а именно —0,4 В. В последнем сообщении Фрумкина указано, что потенциал нулевого заряда для железа лежит еще в более отрицательной области (—-0,7-:—0,8 В).
В пользу этого значения свидетельствуют и данные по адсорбции органических веществ катионного и анионного типа; в 1 н. h3SO4 стационарный потенциал железа равен —0,25 В; если принять потенциал незаряженной поверхности равным нулю, то поверхность железа следует считать заряженной отрицательно. Между тем катионоактивное соединение трибензиламин адсорбируется на железо слабо, в то время как анионоактивное вещество но — нанеульфокислота в этих условиях адсорбируется гораздо лучше. Если принять фн. з = —0,4 В, то поверхность железа должна быть заряжена положительно и эти экспериментальные результаты находят удовлетворительное объяснение.
Из изложенного видно, что определение потенциалов нулевого заряда имеет принципиальное значение при выяснении механизма ингибирования; оно дает возможность предсказать, какие соединения должны лучше всего адсорбироваться на железе.
К сожалению, отсутствие надежных данных о потенциале нулевого заряда железа создает предпосылки для достаточно вольных трактовок механизма действия ингибиторов, периодически появляющихся в литературе (исследователи часто выбирают тот потенциал, который им больше подходит).
Чтобы определить заряд поверхности обычно сравнивают равновесный потенциал металла с точкой нулевого заряда. Антропов [67] предложил сопоставлять потенциал нулевого заряда не с равновесным потенциалом, а со стационарным потенциалом металла в данной среде, т. е. использовать особую шкалу потенциалов, в которой за исходное значение принят потенциал нулевого заряда поверхности фн. 3. Тогда потенциал ф по этой шкале выражается как разность между стационарным потенциалом электрода фст и потенциалом нулевого заряда фн. 3
Ф = Фет — Фн.3 (4,42)
Поскольку фн. з соответствует тому состоянию, при котором поверхность металла свободна от зарядов, при ф>0 металл оказывается заряженным положительно по отношению к электролиту. В этом случае к поверхности металла примыкает со стороны раствора слой, состоящий преимущественно из анионов. При ф<0 металл оказывается заряженным отрицательно по отношению к раствору. В этом случае двойной слой со стороны раствора образован катионами.
Знание потенциалов нулевых зарядов металлов и стационарных потенциалов в данной среде может значительно облегчить отыскание ингибиторов коррозии. Если потенциал нулевого заряда больше стационарного потенциала металал в данном электролите фн. з>фст, т. е. поверхность металла в условиях коррозии заряжена отрицательно, то наиболее вероятна адсорбция катионов или положительно заряженных коллоидных частиц. При фн. з<фст, т. е. когда поверхность металла заряжена положительно, наиболее вероятна адсорбция анионов и отрицательно заряженных коллоидных частиц.
Поляризацией электрода от внешнего источника тока можно изменить заряд поверхности, а этим и адсорбцию. Так, Колотыр — кин и Медведева [68] показали, что в области потенциалов, близких к нулевой точке, катодная поляризация никеля (вследствие изменения знака заряда от положительного к отрицательному) приводит к десорбции анионов и резкому повышению перенапряжения водорода.
Для того чтобы сделать эффективной катионную добавку, необходимо увеличить разность между стационарным потенциалом и потенциалом нулевого заряда, что может быть достигнуто либо смещением потенциала нулевого заряда металла в положительную сторону, либо смещением стационарного потенциала в отрицательную сторону. Сместить потенциал нулевого заряда. в положительную сторону можно, как было выше показано, с помощью галогенид-ионов, вводимых в электролит совместно с ингибитором, а также окислением поверхности металла кислородом или другим окислителем, которое приводит к увеличению работы выхода электрона (вспомним, ЧТО <fs.3—We—4,7).
Сместить потенциал нулевого заряда. в положительную сторону можно, как было выше показано, с помощью галогенид-ионов, вводимых в электролит совместно с ингибитором, а также окислением поверхности металла кислородом или другим окислителем, которое приводит к увеличению работы выхода электрона (вспомним, ЧТО <fs.3—We—4,7).
Следует, однако, иметь в виду, что окисление поверхности сдвигает часто и стационарный потенциал металла в положительную сторону, поэтому предсказать, какой заряд приобретает металл, трудно. Все зависит от того, какой потенциал изменится при окислении металла сильнее — стационарный или потенциал нулевого заряда. Таким образом, влияние окислителей на абсорбцию органических веществ является неоднозначным. Швабе [69], например, отмечает, что появление окислов на поверхности металла приводит к изменению характера адсорбции органических веществ. Дибензилсульфооксид и нитрит дициклогексиламмония хорошо адсорбируются на неокисленной поверхности железа и являются хорошими ингибиторами коррозии. На окисленной же поверхности эти вещества не проявляют ингибирующих свойств. По мнению автора, это связано с тем, что в первом случае возникают хемосорбированные слои ингибитора с металлом, а во втором — на окисленной поверхности ингибиторы удерживаются лишь силами Ван-дер-Ваальса и легко вытесняются с поверхности молеку —
На окисленной же поверхности эти вещества не проявляют ингибирующих свойств. По мнению автора, это связано с тем, что в первом случае возникают хемосорбированные слои ингибитора с металлом, а во втором — на окисленной поверхности ингибиторы удерживаются лишь силами Ван-дер-Ваальса и легко вытесняются с поверхности молеку —
лами растворителя. Однако в литературе описаны и случаи, когда окислители облегчали адсорбцию органических веществ.
Следует также учесть, что окисление поверхности металла может влиять не только на его адсорбционные свойства, но и на другие, в частности на смачивание. Известно, что окисленная поверхность является более гидрофильной, чем восстановленная. В присутствии окислов увеличивается смачиваемость водой никеля, кадмия, хрома, меди, титана и других металлов, что, естественно, снижает адсорбцию органических соединений.
Изменение потенциала нулевого заряда металлов под влиянием галогенид-ионов является специфичным для каждого металла. На ртути адсорбция галогенид-ионов, по Фрумкину [70], является обратимой, она носит электростатический характер, а отчасти и специфический, обусловленный образованием связей, близких к ковалентным. Энергия активации адсорбции из раствороїв невелика. При адсорбции галогенид-ионов на ртути они участвуют в формировании ионной части двойного электрического слоя, поэтому смещают потенциал нулевого заряда в отрицательную сторону. Однако на железе характер адсорбции иной и адсорбция, по мнению многих исследователей, носит необратимый характер. Ионы галогенидов, адсорбируясь необратимо, входят в состав металлической обкладки двойного слоя, их заряды составляют часть заряда поверхности металла, поэтому возникающие на поверхности металла диполи смещают потенциал нулевого заряда в положительную сторону. Различный характер адсорбции галогенид — ионов на железе и ртути подтверждается емкостными и поляризационными измерениями; на ртути адсорбция анионов увеличивает емкость двойного электрического слоя и ускоряет разряд ионов водорода, а на железе емкость падает и разряд ионов водорода замедляется.
Энергия активации адсорбции из раствороїв невелика. При адсорбции галогенид-ионов на ртути они участвуют в формировании ионной части двойного электрического слоя, поэтому смещают потенциал нулевого заряда в отрицательную сторону. Однако на железе характер адсорбции иной и адсорбция, по мнению многих исследователей, носит необратимый характер. Ионы галогенидов, адсорбируясь необратимо, входят в состав металлической обкладки двойного слоя, их заряды составляют часть заряда поверхности металла, поэтому возникающие на поверхности металла диполи смещают потенциал нулевого заряда в положительную сторону. Различный характер адсорбции галогенид — ионов на железе и ртути подтверждается емкостными и поляризационными измерениями; на ртути адсорбция анионов увеличивает емкость двойного электрического слоя и ускоряет разряд ионов водорода, а на железе емкость падает и разряд ионов водорода замедляется.
Если потенциал незаряженной поверхности достаточно достоверен, то поскольку приведенная шкала потенциалов характеризует заряд поверхности в коррозионной среде, можно по значению этого потенциала предсказать, какое соединение будет преимущественно адсорбироваться на данном металле и окажется эффективным ингибитором. Если потенциал металла cp<0, то на нем преимущественно будут адсорбироваться добавки катионного типа, адсорбция анионов будет крайне слаба. Если потенциал металла по приведенной шкале ср>0, на нем преимущественно должны адсорбироваться ингибиторы анионного типа, ингибиторы катионного типа на этом металле адсорбироваться не будут.
Если потенциал металла cp<0, то на нем преимущественно будут адсорбироваться добавки катионного типа, адсорбция анионов будет крайне слаба. Если потенциал металла по приведенной шкале ср>0, на нем преимущественно должны адсорбироваться ингибиторы анионного типа, ингибиторы катионного типа на этом металле адсорбироваться не будут.
Ингибиторы молекулярного типа могут адсорбироваться как на первом, так и на втором металлах. Эта закономерность подтверждается тем, что для таких металлов, как железо, цинк, алюминий, характеризующихся отрицательными значениями потенциалов ср, наиболее высокие защитные свойства обнаружили соединения катионного типа (катапин К; КПИ-1; КПИ-7; КПИ-9). Эти же соединения не обнаруживают заметных защитных свойств при кор
розии — свинца, олова и кадмия, характеризующихся положительными значениями потенциалов. Для этих соединений наиболее эффективными оказываются ингибиторы анионного типа [59].
Следует, однако, заметить, что отмеченная выше закономерность соблюдается не всегда; многие ингибиторы адсорбируются — в широкой области потенциалов, в том числе и на одноименно заряженной с ингибитором поверхности.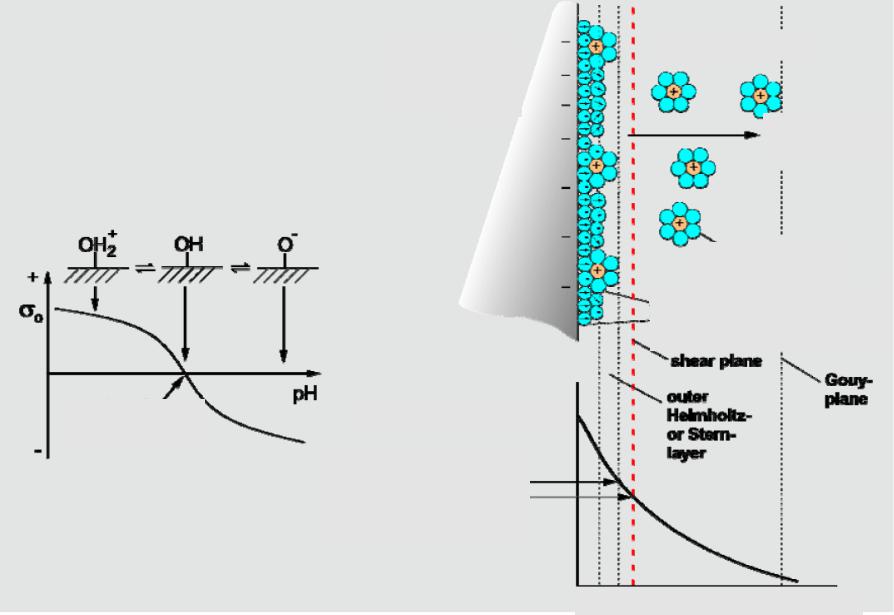 Изложенные выше теоретические соображения учитывают лишь электростатическую адсорбцию, в то время как многие ингибиторы адсорбируются за счет специфической адсорбции, а также химической. При наличии n-электронного взаимодействия между органическим веществом и поверхностью металла адсорбция возможна как при положительных, так и отрицательных зарядах поверхности, а при химической адсорбции электростатическое взаимодействие играет отнюдь не главную роль.
Изложенные выше теоретические соображения учитывают лишь электростатическую адсорбцию, в то время как многие ингибиторы адсорбируются за счет специфической адсорбции, а также химической. При наличии n-электронного взаимодействия между органическим веществом и поверхностью металла адсорбция возможна как при положительных, так и отрицательных зарядах поверхности, а при химической адсорбции электростатическое взаимодействие играет отнюдь не главную роль.
Комментирование и размещение ссылок запрещено.
Потенциал нулевого заряда — Энциклопедия по машиностроению XXL
ПОТЕНЦИАЛ НУЛЕВОГО ЗАРЯДА [c.161]Потенциал нулевого заряда металла зависит не только от природы металлов, но и от адсорбции поверхностно активных веществ, которые могут сдвигать потенциал нулевого заряда. Так, адсорбция анионов сдвигает его в сторону более отрицательных значений, а адсорбция катионов — в сторону более положительных значений.
 С этой точки зрения потенциал нулевого заряда как фактор электрохимической коррозии является переходным между внутренними и внешними факторами.
[c.165]
С этой точки зрения потенциал нулевого заряда как фактор электрохимической коррозии является переходным между внутренними и внешними факторами.
[c.165]Из рис. 118 следует, что потенциал нулевого заряда ртути (при котором = О и Уд = 0) в растворах КС1 и НС1 V (0) = —0,2 В. На кривой дифференциальной емкости при этом потенциале наблюдается минимум, а емкость при положительном заряде поверхности (слева от нулевой точки) значительно выше (36 мкФ/см ), чем при отрицательном заряде (18 мкФ/см ). [c.167]
Таким образом, адсорбция заряженных частиц (ионов) изменяет потенциал нулевого заряда металла. [c.170]
Влияние органических ингибиторов коррозии на кинетику электрохимического растворения металла возможно лишь в условиях адсорбции этих веществ на корродирующей поверхности. В зависимости от степени заполнения частицами ингибитора поверхности металла, подвергающейся коррозии, изменяется строение двойного слоя, а следовательно, и кинетика электрохимических реакций, т. е. может тормозиться стадия разряда или диффузии реагирующих частиц либо предшествующая разряду стадия проникновения этих частиц через адсорбированный слой молекул ингибиторов. В связи с этим особое значение имеет потенциал нулевого заряда , т.е. потенциал металла, измеренный по отношению к электроду сравнения в условиях, когда заряд металла равен нулю. При потенциалах вблизи потенциала нулевого заряда металл обладает наибольшей способностью адсорбировать растворенные в электролите вещества и хуже всего смачивается растворителем.
[c.143]
е. может тормозиться стадия разряда или диффузии реагирующих частиц либо предшествующая разряду стадия проникновения этих частиц через адсорбированный слой молекул ингибиторов. В связи с этим особое значение имеет потенциал нулевого заряда , т.е. потенциал металла, измеренный по отношению к электроду сравнения в условиях, когда заряд металла равен нулю. При потенциалах вблизи потенциала нулевого заряда металл обладает наибольшей способностью адсорбировать растворенные в электролите вещества и хуже всего смачивается растворителем.
[c.143]
А. Н. Фрумкин [841 сформулировал положение о пропорциональности нулевой точки (потенциала нулевого заряда) металла величине Вольта-потенциала, и многочисленные исследования подтвердили существование зависимости [c.98]
Следовательно, с ростом степени деформации и числа дислокаций в скоплениях происходит локализация деформационного сдвига потенциала нулевого заряда и изменяется работа выхода электрона так, что деформационное влияние на измеряемые параметры двойного электрохимического слоя и измеряемую работу выхода все более определяется поведением области одного дислокационного скопления. В частности, измеряемая средняя работа выхода образца в целом приближается к локальной величине работы выхода в окрестности дислокационного скопления (несмотря на уменьшение числа активируемых мест на поверхности).
[c.177]
В частности, измеряемая средняя работа выхода образца в целом приближается к локальной величине работы выхода в окрестности дислокационного скопления (несмотря на уменьшение числа активируемых мест на поверхности).
[c.177]
Локализация деформационного сдвига потенциала нулевого заряда и изменения работы выхода [c.177]
Вследствие тождественности деформационного сдвига потенциала нулевого заряда и деформационного изменения работы выхода электрона проанализируем нелокальные явления на примере измерения КРП. Интенсивность потока термоионной эмиссии характеризуется формулой Ричардсона [c.177]
Условия, пр и которых поверхность электрода остается незаряженной, проще. всего можно реализовать и определить соответствующее значение потенциала для жидких электродов — ртутного, амальгамного и т. д. Эти определения основываются на характерной особенности кривых зависимости пограничного натяжения от потенциала—так называемых электрокапиллярных кривых, проходящих через максимум, когда поверхность металла полностью свободна от избыточных электрических зарядов. Потенциал максимума электро-капиллярной кривой всегда будет отвечать состоянию незаряженной поверхности металла. На первый взгляд может показаться, что определенная выше нулевая точка , или потенциал нулевого заряда, должен совпадать с потенциалом максимума электрокапиллярной кривой.
[c.28]
Потенциал максимума электро-капиллярной кривой всегда будет отвечать состоянию незаряженной поверхности металла. На первый взгляд может показаться, что определенная выше нулевая точка , или потенциал нулевого заряда, должен совпадать с потенциалом максимума электрокапиллярной кривой.
[c.28]
Многочисленные исследования показали, что значение потенциала нулевой заряда зависит не только от природы металла, но и от других факторов со става раствора, природы растворителя, температуры, а для металлов хорош[c.20]
В рамках понятия потенциал нулевого заряда Л. И. Антропов предложил разграничивать такие понятия, как нулевая точка флг и потенциал незаряженной поверхности ф5=о, ранее употреблявшиеся как синонимы. По Л. И. Антропову, потенциал незаряженной поверхности соответствует максимуму электро-капиллярной кривой ртути (или другого металла) и может изменяться для данного металла в зависимости от природы и концентрации веществ в растворе. Нулевая точка — это частное значение потенциала незаряженной поверхности, полученное в растворе не содержащем поверхностно-активных веществ и которое является константой, характерной для данного металла и данного растворителя. [c.21]
[c.21]
Как было отмечено Л. И. Антроповым, потенциал нулевого заряда (нулевая точка) металлов адсорбирующих водород зависит от pH с ростом pH ф.л- смещается к более отрицательным значениям. Зависит от pH и область потенциалов адсорбции водорода, поэтому изменение pH оказывает заметное влияние на адсорбцию органических ингибиторов на таких металлах, как Fe, Ni, Со, Pt и мало влияет на адсорбцию органических ингибиторов на Hg, РЬ, Zn, d, которые не адсорбируют водород. [c.22]
По мнению А. Н. Фрумкина [19], повышение защитного действия многих органических катионов связано с изменением потенциала нулевого заряда. Адсорбция галогенид-ионов вызывает сдвиг потенциала нулевого заряда железа в сторону более положительных значений, приводит к отрицательному заряжению поверхности металла и к усилению адсорбции органических катионов. [c.42]
Наблюдаемое явление объясняется тем, что при взаимодействии галоидов с поверхностными атомами железа возникают особые поверхностные адсорбционные слои. Образующиеся диполи поверхностного соединения располагаются своим отрицательным концом в сторону раствора, что создает дополнительную разность потенциалов между металлом и раствором и является причиной сдвига потенциала нулевого заряда в положительную сторону. Смещение же потенциала нулевого заряда (потенциал, при котором на электроде отсутствует двойной электрический слой) в положительную сторону, как известно, делает заряд поверхности более отрицательным и облегчает адсорбцию положительного органического катиона.
[c.22]
Образующиеся диполи поверхностного соединения располагаются своим отрицательным концом в сторону раствора, что создает дополнительную разность потенциалов между металлом и раствором и является причиной сдвига потенциала нулевого заряда в положительную сторону. Смещение же потенциала нулевого заряда (потенциал, при котором на электроде отсутствует двойной электрический слой) в положительную сторону, как известно, делает заряд поверхности более отрицательным и облегчает адсорбцию положительного органического катиона.
[c.22]
Применительно к процессам коррозии целесообразно сопоставлять нулевые точки не с равновесным, а со стационарным потенциалом, т, е. использовать особую шкалу потенциалов, в которой за исходную величину принят потенциал нулевого заряда (pq=o. Величина потенциала в этой шкале (ср) выражается как разность между стационарным потенциалом электрода и потенциалом нулевого заряда [33, 40]. [c.24]
Знание нулевых точек металлов и стационарных потенциалов может значительно облегчить подбор замедлителей адсорбционного типа. Если потенциал нулевого заряда больше стационарного потенциала металла в данном электролите ( Ф5=о>Фст)> т. е. поверхность металла в условиях коррозии заряжена отрицательно, то наиболее вероятна адсорбция катионов или поло-
[c.25]
Если потенциал нулевого заряда больше стационарного потенциала металла в данном электролите ( Ф5=о>Фст)> т. е. поверхность металла в условиях коррозии заряжена отрицательно, то наиболее вероятна адсорбция катионов или поло-
[c.25]
Для того чтобы сделать эффективной катионную добавку, необходимо увеличить разность между стационарным потенциалом и потенциалом нулевого заряда, что может быть достигнуто либо смещением потенциала нулевого заряда в положительную сторону, либо смещением стационарного потенциала в отрицательную. Сместить точку нулевого заряда в положительную сторону, как было показано выше, можно при помощи галоидных ионов, вводимых в электролит совместно с замедлителем, а также частичным окислением поверхности железа кислородом или иным окислителем, приводящим к увеличению работы выхода электрона. [c.26]
Чем же можно объяснить различное влияние галоидов на ртуть и железо Было высказано предположение о том, что в кислых растворах, содержащих ионы галоидов, на поверхности железа возникают особые адсорбционные слои галоидов, обладающие пассивирующими свойствами как по отношению к реакции ионизации металла, так и реакции разряда ионов водорода. Диполи поверхностного соединения располагаются своим отрицательным концом в сторону раствора, что способствует сдвигу потенциала нулевого заряда в положительную сторону. Смещение же точек нулевого заряда в положительном направлении сопровождается повышением перенапряжения водорода и затруднением реакции ионизации металла.
[c.27]
Диполи поверхностного соединения располагаются своим отрицательным концом в сторону раствора, что способствует сдвигу потенциала нулевого заряда в положительную сторону. Смещение же точек нулевого заряда в положительном направлении сопровождается повышением перенапряжения водорода и затруднением реакции ионизации металла.
[c.27]
Х18Н9 в растворах НаSO4) обусловлено сдвигом потенциала нулевого заряда металла при хемосорбции с соответствующей неблагоприятной для коррозионного процесса перезарядкой поверхности металла. [c.350]
По данным И. Л. Розенфельда и Л. И. Антропова, катодная поляризация металла от внешнего источника тока может существенно изменить скорость его коррозии в результате десорбции анионов или адсорбции катионов, которые повышают поляризацию катодного процесса, особенно резко при переходе потенциала нулевого заряда данного металла. Таким образом, катодная поляризация повышает эффективность катионных ингибиторных добавок, а эти добавки могут повысить эффективность катодной электрохимической защиты металлов, снижая значение необходимого защитного тока. Так, защитный ток для железа в 1-н. h3SO4 в присутствии 0,1 г/л трибензиламина (СдНбСН2)зК уменьшается в 14 раз. При катодной поляризации замедляющее действие могут оказывать такие катионные добавки, которые обычно не являются ингибиторами коррозии.
[c.366]
Так, защитный ток для железа в 1-н. h3SO4 в присутствии 0,1 г/л трибензиламина (СдНбСН2)зК уменьшается в 14 раз. При катодной поляризации замедляющее действие могут оказывать такие катионные добавки, которые обычно не являются ингибиторами коррозии.
[c.366]
Если потенциал нулевого заряда больше стационарного потенциала металла в данном электролите 3 > т.е. поверхность металла в условиях коррозии заряжена отрицательно, то наиболее вероятна адсорбция ингибиторов катионного типа или положительно заряженных коллоидных частиц. При 1 4,3,. когда поверхность металла заряжена положительно, наиболее вероятна адсорбция ингибиторов анионного типа или отрицательно заряженных коллоидных частиц [38]. Эта закономерность подтверждается тем, что для железа, алюминия, цинка, которые характеризуются отрицательными значениями потенциалов 1 = наиболее высокие защитные свойства обнаруживают ингибиторы KaifHOHHoro типа. [c.143]
Изменить способность металла адсорбировать ингибиторы можно введением в среду композиций, состоящих из неорганических веществ (окислителей, солей металлов) и органических ингибиторов, а также изменяя заряд поверхности металла поляризацией. Однако окисление поверхности оказывает неоднозначное влияние на адсорбцию органических веществ. На окисленной поверхности ингибиторы удерживаются лишь силами Ван-дер-Ваальса и не образуют хемосорбироваиных слоев ингибитора с металлом. Благодаря изменению заряда корродирующего металла, вызванного смещением нулевой точки от ее положения для корродирующего металла до потенциала нулевого заряда для металла, вьщеляющегося из неорганического компонента, увеличение защитного действия комбинированных ингибиторов может быть весьма значительным.
[c.145]
Однако окисление поверхности оказывает неоднозначное влияние на адсорбцию органических веществ. На окисленной поверхности ингибиторы удерживаются лишь силами Ван-дер-Ваальса и не образуют хемосорбироваиных слоев ингибитора с металлом. Благодаря изменению заряда корродирующего металла, вызванного смещением нулевой точки от ее положения для корродирующего металла до потенциала нулевого заряда для металла, вьщеляющегося из неорганического компонента, увеличение защитного действия комбинированных ингибиторов может быть весьма значительным.
[c.145]
Начало щепевой коррозии и потенциал нулевого заряда 37 275 [c.31]
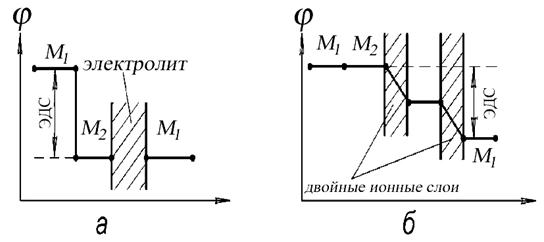
Рассмотрим цепь из двух разнородных металлов Mi и Мг, каждый из которых погружен в раствор собственных ионов, взятых.в такой концентрации Со и Со», какая необходима, чтобы поверхность обоих металлов оставалась незаряженной. Как легко видеть, э. д. с. цепи будет тогда равна разности потенциалов нулевого заряда металлов Mi и Мг. Величина этой э. д. с. зависит только от природы взятых металлов, так как потенциал нулевого заряда представляет для каждого металла индивидуальную константу. Предположим теперь, что концентрация раствора со изменена до произвольного значения с. Электродный потенциал металла Mi в таком растворе станет более или менее положительным, смотря по тому, увеличилась или уменьшилась концентрация его ионов в соавнении с концентрацией со Это изменение потенциала электрода вызывается образованием двойного ионного слоя. Электродный потенциал металлу в растворе с произвольной концентрацией потенциалопределяющих ионов поэтому можно представить в виде суммы двух слагаемых. Одним из них
[c.26]
Величина этой э. д. с. зависит только от природы взятых металлов, так как потенциал нулевого заряда представляет для каждого металла индивидуальную константу. Предположим теперь, что концентрация раствора со изменена до произвольного значения с. Электродный потенциал металла Mi в таком растворе станет более или менее положительным, смотря по тому, увеличилась или уменьшилась концентрация его ионов в соавнении с концентрацией со Это изменение потенциала электрода вызывается образованием двойного ионного слоя. Электродный потенциал металлу в растворе с произвольной концентрацией потенциалопределяющих ионов поэтому можно представить в виде суммы двух слагаемых. Одним из них
[c.26]Потенциал нулевого заряда поверхности, по А.Н. Фрумкину, характеризуется таким значением, при котором на поверхности металла отсутствует двойной ионный слой. В зарубежной лите >атуре он известен как потенциал максимума электрокапиллярной кривой или потенциал Липпма-на. Потенциал нулевого заряда легко получить путем поляризации электрода. При зтом признаком отсутствия заряда на поверхности металла может являться следующее максимумы поверхностного натяжения, ад-
[c.26]
При зтом признаком отсутствия заряда на поверхности металла может являться следующее максимумы поверхностного натяжения, ад-
[c.26]
Потенциал нулевого заряда и приведенная ф-шкала потенцилов Л. И. Антропова [c.20]
Понятие потенциала нулевого заряда ф .з впервые было введено А. Н. Фрумки-ным [19]. Под потенциалом нулевого заряда фн.з понимают такой потенциа металла, когда заряд его поверхности равен нулю. При этом двойной ионны слой отсутствует. Если в растворе отсутствуют поверхностно-активные вещества то потенциал нулевого заряда является характерной величиной для данногс металла и может характеризовать его поведение (адсорбционную способность смачивание, прочность, реакционную способность). Адсорбционная способность электрода при потенциале нулевого заряда максимальна и при удалении от этого потенциала как в катодную, так и анодную сторону адсорбция уменьг шается.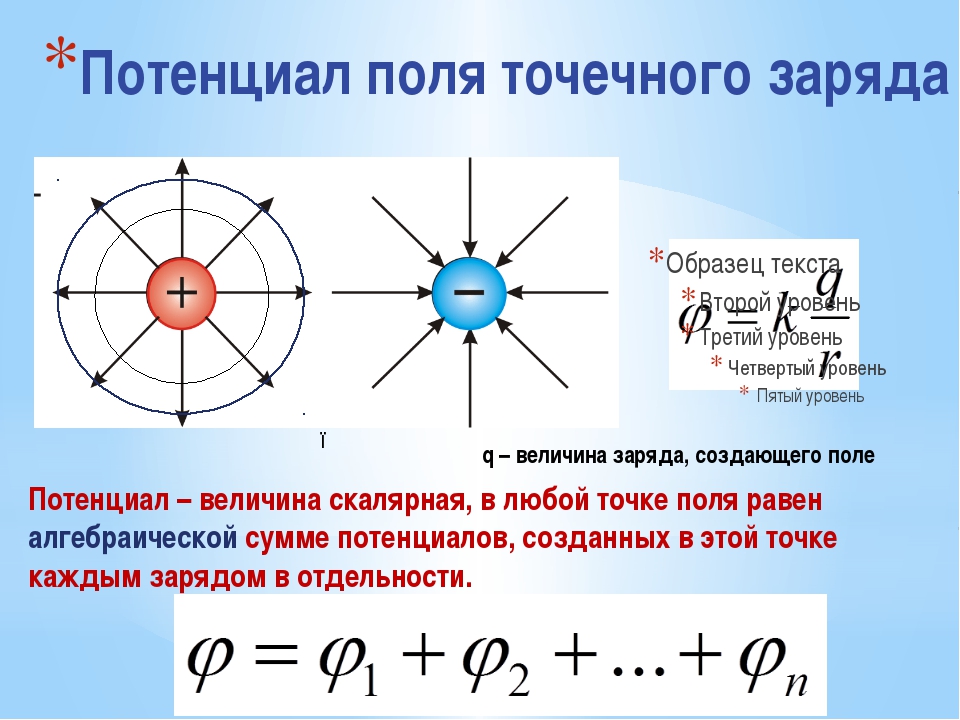 [c.20]
[c.20]
При наличии в растворе поверхностно-активных веществ потенциал нулевого заряда (а следовательно и адсорбционная способность металла) изменяется, что связано с изменением знака и величины скачка потенциала в плотно1 части двойного электрического слоя. [c.20]
Таким образом, точное знание потенциала нулевого заряда для данной металла дает возможность предсказать, какие соединения могут адсорбпроватьс на металле. К сожалению, в настоящее время существуют противоречивые све дения о значениях потенциалов нулевого заряда для различных металлов особенно для такого важного в практическом отношении, как железо. Согласш Л. И. Антропову [17], фн,3 = 0,00 согласно [38] фн.з=—0,37 В по данным [39 Фн.з=—0,7 В. [c.20]
Основной метод, наиболее широко применяемый для изучения ки.тетнки электродных процессов, заключается в исследовании зависимости потенциала от плотности тока. Существуют и другие вспомогательные методы, например, метод электрокапиллярных кривых, измерение емкости двойного электрического слот и т. п. При помощи этих методов определяют значение потенциала нулевого заряда различных металлов, а также область адсорбции катионов II анионов на электроде. Последние методы применяются главным образом для исследования электродных процессов, протекающих на ртути, так как последняя является идеально поляризуемым электродом в довольно широком интервале потенциалов. Применение этих методов для исследования катодных процессов, протекающих на твердых электродах, не дает точных результатов, так как процессы, протекающие на них, необратимы (59, 60).
[c.41]
п. При помощи этих методов определяют значение потенциала нулевого заряда различных металлов, а также область адсорбции катионов II анионов на электроде. Последние методы применяются главным образом для исследования электродных процессов, протекающих на ртути, так как последняя является идеально поляризуемым электродом в довольно широком интервале потенциалов. Применение этих методов для исследования катодных процессов, протекающих на твердых электродах, не дает точных результатов, так как процессы, протекающие на них, необратимы (59, 60).
[c.41]
При нанесении ПИНС на металл в виде эмульсий содержащиеся в составе быстродействующие ингибиторы коррозии экранирующего типа должны вытеснить с поверхности металла адсорбционную воду и совместно с эмульгаторами и солюбилизаторами не допустить внутреннюю собственную воду к поверхности металла. Образующаяся на поверхности металла ад-сорбционно-хемосорбционная пленка ингибиторов коррозии должна формироваться и противостоять большему содержанию электролита и, следовательно, мощным двойным — электрическим — слоям электролита при потенциалах, отличных от нулевой точки металла (от потенциала нулевого заряда металла) [59].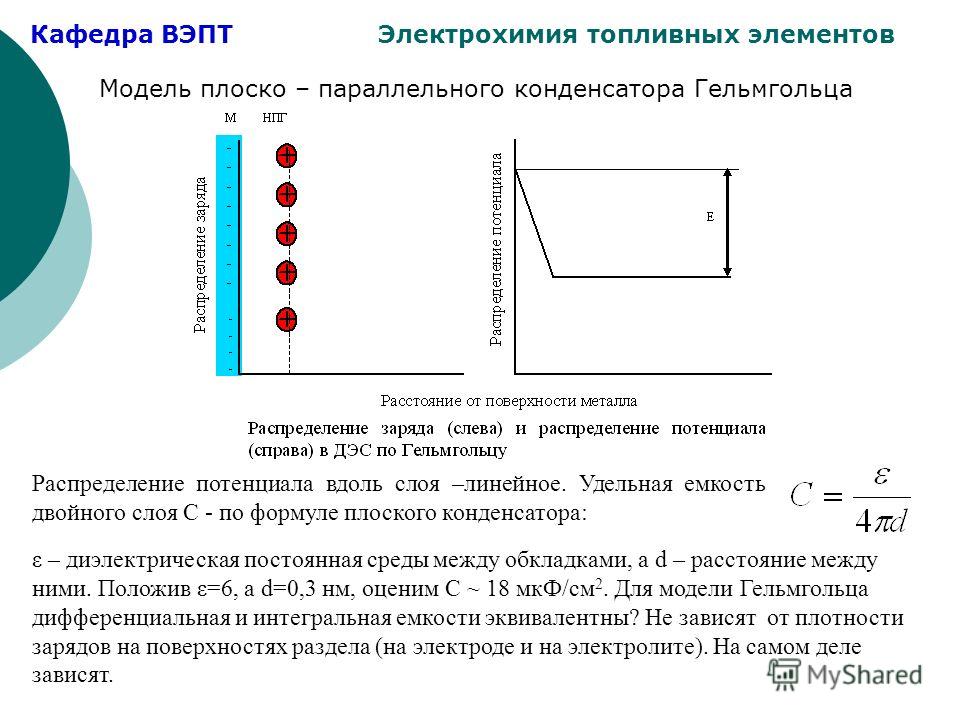 [c.215]
[c.215]
Двойной электрический слой на границе электрод
Наряду с
терминами: «нулевая точка» и «потенциал максимума электрокапиллярной кривой»
широко употребляются, как их синонимы, также «потенциал нулевого заряда» и
«потенциал незаряженной поверхности», что вносит большую путаницу в электрохимическую
литературу. Для того чтобы избежать возможных недоразумений, автор предложил
разграничить понятия «нулевая точка» (или «потенциал нулевого заряда») и
«потенциал незаряженной поверхности» (или «потенциал максимума
электрокапиллярной кривой»), каждому из них присвоить свой символ и употреблять
эти термины в соответствии с их содержанием. Основанием для такого
разграничения послужили следующие соображения. Потенциал максимума
электрокапиллярной кривой ртути (или другого металла) всегда отвечает ее
назаряженной поверхности; это значение потенциала целесообразно называть
«потенциалом незаряженной поверхности» и обозначать как еq=0. Положение максимума электрокапиллярной кривой и величина
отвечающего ему потенциала для данных металла и растворителя меняются в
широких пределах в зависимости от природы и концентрации веществ, присутствующих
в растворе. В то же время частное значение потенциала незаряженной поверхности,
полученное в растворе, не содержащем никаких поверхностно-активных частиц
(кроме молекул растворителя) является константой, характерной для данного
металла и данного растворителя; это частное значение потенциала незаряженной
поверхности целесообразно называть «нулевой точкой» и обозначать как εn. Нулевая точка и потенциал незаряженной
поверхности находятся между собой примерно в таком же соотношении, как равновесный
и стандартный потенциалы электрода. Последний, как известно, представляет собой
частный случай равновесного электродного потенциала εr, который реализуется в растворе с активностями всех участников
электродной реакции, равными единице. В обоих случаях необходимо
соответствующим образом задать состав раствора, чтобы получить величину,
являющуюся характерной константой для данной электродной системы.
Положение максимума электрокапиллярной кривой и величина
отвечающего ему потенциала для данных металла и растворителя меняются в
широких пределах в зависимости от природы и концентрации веществ, присутствующих
в растворе. В то же время частное значение потенциала незаряженной поверхности,
полученное в растворе, не содержащем никаких поверхностно-активных частиц
(кроме молекул растворителя) является константой, характерной для данного
металла и данного растворителя; это частное значение потенциала незаряженной
поверхности целесообразно называть «нулевой точкой» и обозначать как εn. Нулевая точка и потенциал незаряженной
поверхности находятся между собой примерно в таком же соотношении, как равновесный
и стандартный потенциалы электрода. Последний, как известно, представляет собой
частный случай равновесного электродного потенциала εr, который реализуется в растворе с активностями всех участников
электродной реакции, равными единице. В обоих случаях необходимо
соответствующим образом задать состав раствора, чтобы получить величину,
являющуюся характерной константой для данной электродной системы. Допустим, что
имеется цепь, составленная из металла, опущенного в раствор его ионов, и
стандартного водородного электрода. Э.д.с. этой цепи, равную электродному
потенциалу εLM металла Μ в условной водородной шкале, можно записать, в соответствии с
уравнением (IX-13), в следующем виде:
Допустим, что
имеется цепь, составленная из металла, опущенного в раствор его ионов, и
стандартного водородного электрода. Э.д.с. этой цепи, равную электродному
потенциалу εLM металла Μ в условной водородной шкале, можно записать, в соответствии с
уравнением (IX-13), в следующем виде:
В свою очередь, гальвани-потенциал на границе раствор—металл, можно представить, согласно уравнению (IX-23), как сумму четырех слагаемых
где индексы q, S, dip1 и dip2 относятся соответственно к потенциал-определяющим ионам, к специфически адсорбирующимся ионам, диполям растворителя и к диполям любого неионизированного органического вещества. Если gLM(q) = 0, то поверхность металла лишена заряда и потенциал электрода должен отвечать потенциалу незаряженной поверхности
В согласии со
сказанным ранее, потенциал незаряженной поверхности металла зависит от природы
этого металла, от примененного электрода сравнения, от природы растворителя и
от состава раствора. Для выбранных металла и растворителя величина LMεq=0 может
быть различной в зависимости от величины дия(8) (т· е· от
природы и концентрации поверхностно-активных ионов) и qLM(dip2) (т.е. от природы и концентрации поверхностно-активных
дипольных молекул). Если же, однако, не толькоqLM(q)=0,
но и qLM(S) =
0 и qLM(dip)2 = 0. т.е. если в растворе нет никаких
поверхностно-активных частиц, кроме молекул растворителя L, то вместо (Х-55) получим
Для выбранных металла и растворителя величина LMεq=0 может
быть различной в зависимости от величины дия(8) (т· е· от
природы и концентрации поверхностно-активных ионов) и qLM(dip2) (т.е. от природы и концентрации поверхностно-активных
дипольных молекул). Если же, однако, не толькоqLM(q)=0,
но и qLM(S) =
0 и qLM(dip)2 = 0. т.е. если в растворе нет никаких
поверхностно-активных частиц, кроме молекул растворителя L, то вместо (Х-55) получим
Как следует из (Х-56), это частное значение потенциала незаряженной поверхности (т. е. нулевая точка LMεN ) должно быть константой, так как оно равно сумме трех постоянных величин.
Нулевую точку можно выразить и через соответствующие вольта-потенциалы
Вольта-потенциал
между металлом и раствором должен быть при этом вполне определенной величиной (NψLM), отвечающей
разности внешних потенциалов межу металлом Μ и раствором, в котором потенциал металла равен его нулевой точке.
Определенная таким образом нулевая точка была выбрана за нуль в «приведенной» или «φ-шкале» потенциалов, предложенной автором в 1946—1951 гг. Потенциал φ в приведенной шкале определяется как разность между потенциалом электрода в данных условиях и его нулевой точкой
РАЗНИЦА МЕЖДУ ДЗЕТА-ПОТЕНЦИАЛОМ И ТОЧКОЙ НУЛЕВОГО ЗАРЯДА | СРАВНИТЕ РАЗНИЦУ МЕЖДУ ПОХОЖИМИ ТЕРМИНАМИ — НАУКА
В ключевое отличие между дзета-потенциалом и точкой нулевого заряда заключается в том, что дзета-потенциал — это разность потенциалов междудисперсионная среда и неподвижный слой жидкости коллоидной ди
В ключевое отличие между дзета-потенциалом и точкой нулевого заряда заключается в том, что дзета-потенциал — это разность потенциалов междудисперсионная среда и неподвижный слой жидкости коллоидной дисперсии, тогда как точка нулевого заряда — это pH коллоидной дисперсии, при котором общий заряд коллоидных частиц равен нулю.
Дзета-потенциал и точка нулевого заряда являются важными понятиями в электрохимии, касающимися свойств коллоидных дисперсий. Коллоидная дисперсия — это суспензия, в которой, как мы видим, растворимые или нерастворимые частицы диспергированы в жидкости.
1. Обзор и основные отличия
2. Что такое дзета-потенциал
3. Что такое точка нулевого заряда
4. Параллельное сравнение — дзета-потенциал и точка нулевого заряда в табличной форме
5. Резюме
Что такое дзета-потенциал?
Дзета-потенциал — это электрокинетический потенциал коллоидной дисперсии. Название этого термина происходит от греческой буквы «дзета», и мы обычно называем этот электрокинетический потенциал дзета-потенциалом. Другими словами, дзета-потенциал — это разность потенциалов между дисперсионной средой и неподвижным слоем жидкости, прикрепленной к диспергированной частице коллоидной дисперсии. Следовательно, этот термин указывает на заряд, присутствующий на поверхности частицы. Есть два типа дзета-потенциала: положительный и отрицательный. Более того, этот потенциал мы измеряем как скорость частиц в постоянном токе. электрическое поле.
Более того, этот потенциал мы измеряем как скорость частиц в постоянном токе. электрическое поле.
Положительный дзета-потенциал указывает на то, что диспергированные частицы в суспензии, в которой мы измеряем дзета-потенциал, имеют положительный заряд. Кроме того, учитывая значения, нет значительной разницы между положительным и отрицательным дзета-потенциалом. Отрицательный дзета-потенциал указывает на то, что диспергированные частицы в суспензии, в которой мы измеряем дзета-потенциал, имеют отрицательный заряд. Следовательно, заряд дисперсных частиц отрицательный.
Что такое точка нулевого заряда?
Точка нулевого заряда — это pH, при котором общий заряд частицы равен нулю. Эта концепция была разработана для объяснения коллоидной флокуляции. В электрохимии электрический потенциал — это термин, похожий на точку нулевого заряда.
В биохимии точка нулевого заряда — это изоэлектрическая точка. Как правило, эта точка определяется кислотно-основным титрованием, при котором происходит реакция нейтрализации. Аналитом для этого титрования является коллоидная дисперсия, и процедура проводится под контролем электрофоретической подвижности частиц в дисперсии.
Аналитом для этого титрования является коллоидная дисперсия, и процедура проводится под контролем электрофоретической подвижности частиц в дисперсии.
В чем разница между дзета-потенциалом и точкой нулевого заряда?
Ключевое различие между дзета-потенциалом и точкой нулевого заряда заключается в том, что дзета-потенциал — это разность потенциалов между дисперсионной средой и неподвижным слоем жидкости коллоидной дисперсии, тогда как точка нулевого заряда — это рН коллоидной дисперсии, при котором общий заряд коллоидных частиц равен нулю.
Более того, еще одно различие между дзета-потенциалом и точкой нулевого заряда заключается в том, что дзета-потенциал измеряет значение потенциала, а точка нулевого заряда измеряет значение pH.
Резюме — Дзета-потенциал против точки нулевого заряда
Дзета-потенциал и точка нулевого заряда являются важными понятиями в электрохимии, касающимися свойств коллоидных дисперсий. Ключевое различие между дзета-потенциалом и точкой нулевого заряда заключается в том, что дзета-потенциал — это разность потенциалов между дисперсионной средой и неподвижным слоем жидкости коллоидной дисперсии, тогда как точка нулевого заряда относится к рН коллоидной дисперсии, при котором общий заряд коллоидных частиц равен нулю.
Потенциал электрического поля — Основы электроники
В зависимости от количества зарядов и их величины изменяется энергия электрического поля, создаваемого этими зарядами. Очевидно, что величина энергии электрического поля, образованного одним ‘зарядом, будет отличаться от величины энергии поля, образованного двумя или тремя такими же зарядами.
В практике очень часто приходится сравнивать различные по величине поля. Это сравнение производится по действиям полей на единичный положительный заряд (так называемый пробный заряд). Поясним это.
Определение: Единичным называется заряд, величина которого равна одной единице заряда.
Пусть, например, поле образовано некоторым положительным зарядом. Чтобы внести в какую-то точку этого поля единичный положительный заряд, необходимо затратить определенную работу на преодоление силы отталкивания между основным и единичным зарядами. Величина потенциальной энергии поля при этом возрастает.
Величина потенциальной энергии поля при этом возрастает.
Попробуем теперь внести единичный заряд в другое поле, образованное в два раза большим электрическим зарядом. Очевидно, что при этом придется затратить большую работу, чем в первом случае. Следовательно, и потенциальная энергия поля возрастет больше, чем в первом случае.
В электротехнике для характеристики поля вводится специальное понятие — электрический потенциал.
Определение; Электрический потенциал некоторой точки поля численно равен работе, затрачиваемой при внесении единичного положительного заряда из-за пределов поля в данную точку.
Измеряется потенциал электрического поля в вольтах. Такое название единицы для измерения потенциала дано по имени итальянского физика Алессандро Вольта (1745—1827), открывшего закон взаимодействия электрических токов и предложившего первую гипотезу для объяснения магнитных свойств вещества.
Характеристика поля с помощью электрического потенциала очень удобна. Она позволяет сравнивать не только различные электрические поля, но и отдельные точки одного и того же поля. Вместо того, например, чтобы говорить «шар А наэлектризован более сильно, чем шар Б», можно сказать: «потенциал шара А выше потенциала шара Б». Потенциал точки поля обычно обозначается буквой φ.
Она позволяет сравнивать не только различные электрические поля, но и отдельные точки одного и того же поля. Вместо того, например, чтобы говорить «шар А наэлектризован более сильно, чем шар Б», можно сказать: «потенциал шара А выше потенциала шара Б». Потенциал точки поля обычно обозначается буквой φ.
Электрическое поле может создаваться не только положительным или отрицательным зарядом, но и их совокупностью. В таком поле отдельные точки могут иметь как отрицательные, так и положительные потенциалы. Чтобы в этом случае сравнивать потенциалы различных точек, ввели условное понятие о точке с нулевым потенциалом, т. е. стали считать, что одна из точек (или несколько точек) имеет потенциал, равный нулю. Потенциалы остальных точек поля определяются относительно точки нулевого потенциала. Этот метод аналогичен методу измерения температур. Там также определенная температура (температура тающего льда) принимается за нулевую точку и по отношению к ней определяется температура других тел.
В электротехнике условно считают, что нулевой потенциал имеет поверхность земли.
Если потенциал в данной точке выше потенциала земли, то мы говорим, что точка обладает положительным потенциалом. Если же, наоборот, потенциал точки ниже потенциала земли, то точка обладает отрицательным потенциалом.
Измеряя потенциалы различных точек электрического поля относительно земли, можно убедиться в том, что они неодинаковы. Значит, между отдельными точками может быть некоторая разность потенциалов.
Определение: Разность потенциалов между двумя точками электрического поля называется напряжением. Напряжение, так же как и потенциал, измеряется в вольтах.
Сказанное поясним примером.
На рис. 1 мы условно показали четыре точки: А—с потенциалом + 20 в, Б — с потенциалом +40 в, В — с нулевым потенциалом (земля) и Г — с потенциалом—15 в.
Рисунок 1. Разность потенциалов между различными точками электрического поля
Разность потенциалов между точками Б и А =40—20=20 в;
Разность потенциалов между точками А и В =20— 0=20 в;
Разность потенциалов между точками Б и В =40— 0=40 в;
Разность потенциалов между точками А и Г=20—(—15) =35 в.
Потенциал точки Б выше потенциалов точек А, В и Г. Потенциал точки А выше потенциалов точек В и Г, но ниже потенциала точки Б. Потенциал точки В ниже потенциалов точек А и Б, но выше потенциала точки Г.
Следует обратить внимание на то, что точки отрицательного потенциала имеют более низкий потенциал, чем тонки нулевого потенциала.
Можно и иначе определить напряжение между двумя точками. Для этого рассмотрим две точки А и Б электрического поля.
Допустим, что потенциал точки А равен φА потенциал точки Б равен φБ. Потенциал точки А (или Б) определяется той работой, которую необходимо затратить на перенос единичного положительного заряда из-за пределов поля в точку А (или Б). Если для переноса единичного положительного заряда из-за предела поля в точку А и в точку Б требуется затратить различную по величине работу, то φА не равно φБ и между точками А и Б существует некоторая разность потенциалов, или напряжение. Это напряжение определяется разностью φА — φБ т. е. работой, совершаемой силами поля при переносе единичного положительного заряда из точки А в точку Б.
Это напряжение определяется разностью φА — φБ т. е. работой, совершаемой силами поля при переносе единичного положительного заряда из точки А в точку Б.
ПОНРАВИЛАСЬ СТАТЬЯ? ПОДЕЛИСЬ С ДРУЗЬЯМИ В СОЦИАЛЬНЫХ СЕТЯХ!
Похожие материалы:
Добавить комментарий
Разность потенциалов
Потенциальная энергия определяется с точностью до фиксированной постоянной, зависящей от выбора нулевого уровня энергии. Точно также и потенциал зависит от выбора нулевого уровня. Во многих задачах электростатики при вычислении потенциалов за нулевой уровень принимают бесконечно удаленную точку. В этом случае понятие потенциала определяется однозначно:
|
|
Обычно оперируют разностью потенциалов φ1 — φ2, которую выражают через работу по перемещению заряда из одной точки поля в другую. Эта работа равна изменению потенциальной энергии заряда, но с противоположным знаком (поэтому необходимо следить за тем, чтобы правильно выбирать направление перемещения электрического заряда):
Эта работа равна изменению потенциальной энергии заряда, но с противоположным знаком (поэтому необходимо следить за тем, чтобы правильно выбирать направление перемещения электрического заряда):
|
|
где A12 — работа по перемещению заряда из начальной точки в конечную. Если оперировать разностью потенциалов, то выбор нулевого уровня не имеет значения. Под разностью потенциалов понимают разность значений потенциала в начальной и конечной точках:
U = φ1 — φ2.
Рассмотрим заряженную металлическую сферу радиуса R. Поле внутри сферы отсутствует потенциал внутри сферы
Вне сферы электрическое поле аналогично тому, как если бы в центре был точечный заряд q, потенциал
|
Рис. |
Разность потенциалов между проводниками можно измерить с помощью электрометра. Один провод соединяют с корпусом электрометра и заземляют. Вторым проводом проводят по исследуемой металлической поверхности сложной формы.
|
Рис. 2. Определение потенциала тела |
С помощью электрометра легко убедиться, что все точки исследуемого заряженного металлического тела имеют одинаковый потенциал относительно Земли.
Единицы разности потенциалов
В Международной системе единиц (СИ) единицей потенциала является вольт (В), 1 В = 1 Дж/1 Кл. Разность потенциалов между двумя точками равна единице, если при перемещении заряда в 1 Кл из одной точки в другую электрическое поле совершает работу в 1 Дж.
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.

- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
 Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Разница между дзета-потенциалом и точкой нулевого заряда
Размещено Мадху
Ключевое различие между дзета-потенциалом и точкой нулевого заряда состоит в том, что дзета-потенциал представляет собой разность потенциалов между диспергирующей средой , , , и неподвижным слоем жидкости. коллоидная дисперсия, тогда как точка нулевого заряда — это pH коллоидной дисперсии, при котором общий заряд коллоидных частиц равен нулю.
Дзета-потенциал и точка нулевого заряда являются важными понятиями в электрохимии, касающимися свойств коллоидных дисперсий. Коллоидная дисперсия — это суспензия, в которой мы видим, что растворимые или нерастворимые частицы диспергированы в жидкости.
СОДЕРЖАНИЕ
1. Обзор и основные отличия
2. Что такое дзета-потенциал
3. Что такое точка нулевого заряда
4. Сравнение бок о бок — дзета-потенциал и точка нулевого заряда в табличной форме
Сравнение бок о бок — дзета-потенциал и точка нулевого заряда в табличной форме
5.Резюме
Что такое дзета-потенциал?
Дзета-потенциал — это электрокинетический потенциал коллоидной дисперсии. Название этого термина происходит от греческой буквы «дзета», и мы обычно называем этот электрокинетический потенциал дзета-потенциалом. Другими словами, дзета-потенциал — это разность потенциалов между дисперсионной средой и неподвижным слоем жидкости, прикрепленной к диспергированной частице коллоидной дисперсии. Следовательно, этот термин указывает на заряд, присутствующий на поверхности частицы.Есть два типа дзета-потенциала: положительный и отрицательный. Более того, этот потенциал мы измеряем как скорость частиц в постоянном токе. электрическое поле.
Рис. 1. Изменение дзета-потенциала частицы в коллодальной суспензии в зависимости от расстояния от поверхности частицы
Положительный дзета-потенциал указывает на то, что диспергированные частицы в суспензии, в которой мы измеряем дзета-потенциал, имеют положительный заряд. Кроме того, учитывая значения, нет значительной разницы между положительным и отрицательным дзета-потенциалом.Отрицательный дзета-потенциал указывает на то, что диспергированные частицы в суспензии, в которой мы измеряем дзета-потенциал, имеют отрицательный заряд. Следовательно, заряд дисперсных частиц отрицательный.
Кроме того, учитывая значения, нет значительной разницы между положительным и отрицательным дзета-потенциалом.Отрицательный дзета-потенциал указывает на то, что диспергированные частицы в суспензии, в которой мы измеряем дзета-потенциал, имеют отрицательный заряд. Следовательно, заряд дисперсных частиц отрицательный.
Что такое точка нулевого заряда?
Точка нулевого заряда — это pH, при котором общий заряд частицы равен нулю. Эта концепция была разработана для объяснения коллоидной флокуляции. В электрохимии электрический потенциал — это термин, похожий на точку нулевого заряда.
Рисунок 02: Схема заряженной частицы в коллоидной суспензии
В биохимии точка нулевого заряда — это изоэлектрическая точка. Обычно эта точка определяется кислотно-основным титрованием, при котором происходит реакция нейтрализации. Аналитом для этого титрования является коллоидная дисперсия, и процедура проводится под контролем электрофоретической подвижности частиц в дисперсии.
В чем разница между дзета-потенциалом и точкой нулевого заряда?
Ключевое различие между дзета-потенциалом и точкой нулевого заряда состоит в том, что дзета-потенциал — это разность потенциалов между дисперсионной средой и неподвижным слоем жидкости коллоидной дисперсии, тогда как точка нулевого заряда — это рН коллоидной дисперсии, при котором общий заряд коллоидных частиц равен нулю.
Кроме того, еще одно различие между дзета-потенциалом и точкой нулевого заряда заключается в том, что дзета-потенциал измеряет значение потенциала, а точка нулевого заряда измеряет значение pH.
Резюме — Зета-потенциал в сравнении с точкой нулевого заряда
Дзета-потенциал и точка нулевого заряда являются важными понятиями в электрохимии, касающимися свойств коллоидных дисперсий. Ключевое различие между дзета-потенциалом и точкой нулевого заряда заключается в том, что дзета-потенциал — это разность потенциалов между дисперсионной средой и неподвижным слоем жидкости коллоидной дисперсии, тогда как точка нулевого заряда относится к рН коллоидной дисперсии, при котором общий заряд коллоидных частиц равен нулю.
Ссылка:
1. Шэнь, Сяньтао. «Молекулярно отпечатанные фотокатализаторы». Молекулярно импринтированные катализаторы , 2016, стр. 211–228., DOI: 10.1016 / b978-0-12-801301-4.00010-4.
Изображение предоставлено:
1. «Дзета-потенциал наночастиц золота» Ларрисгуд — собственная работа (CC BY-SA 3.0) через Commons Wikimedia
2. «Диаграмма дзета-потенциала и плоскости скольжения V2» Автор Изменен и преобразован в SVG Mjones1984. Оригинальная работа Ларрисгуда. — Измененное изображение на основе этого.(CC BY-SA 3.0) через Commons Wikimedia
Измерения потенциалов нулевого свободного заряда и нулевого общего заряда для 1-тио- ± bβ-D-глюкозы и модифицированной DPTL поверхности Au (111) в различных растворах электролитов
Су, Чжанфэй, Лейтч, Джей и Липковски, Яцек. «Измерение потенциалов нулевого свободного заряда и нулевого общего заряда для 1-тио- ± b β -D-глюкозы и модифицированной DPTL поверхности Au (111) в различных растворах электролитов» Zeitschrift für Physikalische Chemie , vol. 226, нет. 9-10, 2012, с. 995-1009. https://doi.org/10.1524/zpch.2012.0280
Су З., Лейтч Дж. И Липковски Дж. (2012). Измерения потенциалов нулевого свободного заряда и нулевого общего заряда для 1-тио- ± b β -D-глюкозы и модифицированной DPTL поверхности Au (111) в различных растворах электролитов. Zeitschrift für Physikalische Chemie , 226 (9-10), 995-1009. https://doi.org/10.1524/zpch.2012.0280
Вс, З., Лейтч, Дж. И Липковски, Дж. (2012) Измерения потенциалов нулевого свободного заряда и нулевого общего заряда для 1-тио- ± b β -D-глюкозы и модифицированной DPTL поверхности Au (111) в различных электролитах Решения. Zeitschrift für Physikalische Chemie, Vol. 226 (выпуск 9-10), стр. 995-1009. https://doi.org/10.1524/zpch.2012.0280
Су, Чжанфэй, Лейтч, Джей и Липковски, Яцек. «Измерение потенциалов нулевого свободного заряда и нулевого общего заряда для 1-тио- ± b β -D-глюкозы и модифицированной DPTL поверхности Au (111) в различных растворах электролитов» Zeitschrift für Physikalische Chemie 226, no.
226, нет. 9-10, 2012, с. 995-1009. https://doi.org/10.1524/zpch.2012.0280
Су З., Лейтч Дж. И Липковски Дж. (2012). Измерения потенциалов нулевого свободного заряда и нулевого общего заряда для 1-тио- ± b β -D-глюкозы и модифицированной DPTL поверхности Au (111) в различных растворах электролитов. Zeitschrift für Physikalische Chemie , 226 (9-10), 995-1009. https://doi.org/10.1524/zpch.2012.0280
Вс, З., Лейтч, Дж. И Липковски, Дж. (2012) Измерения потенциалов нулевого свободного заряда и нулевого общего заряда для 1-тио- ± b β -D-глюкозы и модифицированной DPTL поверхности Au (111) в различных электролитах Решения. Zeitschrift für Physikalische Chemie, Vol. 226 (выпуск 9-10), стр. 995-1009. https://doi.org/10.1524/zpch.2012.0280
Су, Чжанфэй, Лейтч, Джей и Липковски, Яцек. «Измерение потенциалов нулевого свободного заряда и нулевого общего заряда для 1-тио- ± b β -D-глюкозы и модифицированной DPTL поверхности Au (111) в различных растворах электролитов» Zeitschrift für Physikalische Chemie 226, no.
 HC104
HC104 Na2S04
Na2S04 1. Графики потенциала и напряженности заряженной сферы
1. Графики потенциала и напряженности заряженной сферы


 Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.