Теория химического строения — Википедия
Теория химического строения — учение о строении молекулы, описывающее все те её характеристики, которые в своей совокупности определяют химическое поведение (реакционную способность) данной молекулы. Сюда относятся: природа атомов, образующих молекулу, их валентное состояние, порядок и характер химической связи между ними, пространственное их расположение, характерное распределение электронной плотности, характер электронной поляризуемости электронного облака молекулы и т. д.[1]
Основные положения теории химического строения, являющейся фундаментом химии, были развиты русским химиком А. М. Бутлеровым.
Бутлеров определял понятие химического строения так:
Исходя от мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определённым количеством принадлежащей ему химической силы (сродства), я называю химическим строением распределение действия этой силы, вследствие которой химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу
[1].
Предпосылки создания теории химического строения
В 1812 году итальянский физик и химик Амедео Авогадро, изучая молекулярные веса газов (водорода, кислорода, азота, хлора), выдвинул молекулярную гипотезу строения вещества. Однако работа Авогадро долгое время не получала признания, что тормозило развитие основных идей в области химического строения молекул. Лишь после убедительного доклада Станислао Канниццаро на первом международном съезде химиков в Карлсруэ (1860) атомные веса, определённые с помощью закона Авогадро, стали общепринятыми[2]. На съезде разграничили понятия «атом», «молекула», утвердили атомно-молекулярное учение, основное положение которого «атомы при взаимодействии образуют молекулу».
Атомно-молекулярное учение послужило основой создания теории химического строения Бутлерова.
Теория химического строения Бутлерова
Термин «химическое строение» впервые ввёл А. М. Бутлеров 19 сентября 1861 года в докладе «О химическом строении веществ» на химической секции Съезда немецких естествоиспытателей и врачей в Шпейере (опубликованном в том же году на немецком
[3] и в следующем — на русском языках[4]). В том же докладе он заложил основы классической теории химического строения. Главные положения этой теории следующие:- атомы в молекулах веществ соединены друг с другом согласно их валентности, порядок распределения связей в молекуле называется химическим строением;
- изменение этой последовательности приводит к образованию нового вещества с новыми свойствами;
- свойства веществ зависят не только от их качественного и количественного состава, но и от «химического строения», то есть от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой;
- атомы в молекулах оказывают влияние друг на друга, и это влияние приводит к химическим изменениям поведения атома;
- определить состав и строение химического вещества можно по продуктам химических превращений.
Геометрия молекул
В 1864 году Бутлеров первым объясняет явление изомерии, показав что изомеры — это соединения, обладающие одинаковым элементным составом, но различным химическим строением. В 1874 году возникает стереохимия, или трёхмерная структурная химия в форме постулата Вант-Гоффа о тетраэдрической системе валентностей у атома углерода.
В настоящее время принято различать структурную и пространственную изомерию.
Структурную изомерию подразделяют на изомерию скелета, обусловленную различным порядком связи атомов, образующих скелет молекулы, например в Н-бутане и изобутане, и на изомерию положения одинаковых функциональных групп при одинаковом углеродном скелете молекулы, например в орто- , мета- и пара- изомерах ароматических соединений.
Пространственная изомерия обусловлена существованием стереоизомеров, соединений, имеющих одинаковый порядок связей атомов, но различное пространственное расположение. К видам пространственной изомерии относятся: оптическая изомерия, обусловливающая существование энантиомеров — пары стереоизомеров, представляющих собой зеркальные отражения друг от друга, не совмещаемые в пространстве; диастереомерия, обусловливающая существование изомеров, не являющихся энантиомерами; геометрическая изомерия, обусловливающая цис- и транс- изомеров, свойственных соединениям с двойными связями и малыми циклами.
Электронные интерпретации строения молекул
Строение молекулы H2 по БоруС открытием в 1897 году электрона (Дж. Томсоном, Э. Вихертом) появились электронные интерпретации строения молекул. Американский физикохимик Г. Льюис в 1912 году предложил электронную теорию химической связи, по которой связь между атомами в молекуле осуществляется обобществлённой электронной парой. Электронная теория химической связи Льюиса стала основой классической теории строения в органической химии, базирующейся на представлении о парной связи между атомами, образованной дублетом электронов. Валентный штрих между символами элементов в молекуле был заменён двумя точками, обозначающими связывающую электронную пару.
В 1913 году датский физик Нильс Бор предложил рассматривать электронную пару в форме вращающегося кольца, плоскость которого перпендикулярна оси молекулы и равноудалена от ядер атомов.
Динамическое равновесие молекулярной системы, по Бору, достигается за счёт баланса сил между силами взаимного отталкивания ядер и силами притяжения ядер к плоскости кольца электронов. Боровская интерпретация строения молекулы учитывала кулоновское отталкивание электронов, в кольце они находятся в диаметрально противоположном положении.
Молекулу метана Нильс Бор описывал следующим образом:
Ядро углерода, заключённое в очень маленькое кольцо из двух электронов, расположено в центре (тетраэдра), а ядро водорода по углам. Химические связи представляют собой четыре двухэлектронных кольца, вращающихся вокруг линий, соединяющих центр с углами
[5].
Квантовая природа межатомных сил
Схема диполь-дипольного взаимодействия двух атомов водорода по ЛондонуВ своём докладе, прочитанном в Королевском колледже в Лондоне в ознаменовании столетия опубликования трудов Дж. Максвелла по электромагнитному излучению, К. Коулсон дал анализ происхождения и сущности межатомных сил, приводящих к образованию молекулы[6]. Коулсон, ссылаясь на работу Лондона, на примере двух атомов водорода показывает «каким образом два нейтральных атома или молекулы могут оказывать притяжение друг к другу на значительном расстоянии».
Ядра A и B двух атомов водорода находятся на расстоянии r друг от друга (рис.). Каждый атом несёт по одном электрону (в P и Q соответственно). Совокупность зарядов +e в A и -e в P приблизительно эквивалентна электрическому диполю, имеющему величину e·AP. Подобным же образом совокупность +e в B и -e в Q приблизительно эквивалентна электрическому диполю e·BQ. Эти два диполя взаимодействуют друг с другом. Общая потенциальная энергия двух диполей, m и m’, находящихся на расстоянии r, равна:
mm′r3−3(mr)(m′r)r5{\displaystyle {\frac {mm’}{r^{3}}}-3{\frac {(mr)(m’r)}{r^{5}}}}[6]
На языке волновой механики это выражение рассматривается как возмущение, действующее на оба атома.
Природа межатомных сил имеет электромагнитный характер и называется диполь-дипольным взаимодействием. Существуют диполь-квадрупольные, квадруполь-квадрупольные и другие взаимодействия, при которых энергия изменяется в зависимости от более высоких степеней 1/r[6].
Распределение электронной плотности в химических соединениях
Рис. Радиальное распределение вероятности нахождения электрона в атоме водорода. Рис. Модель молекулы водорода и её осевая проекцияЭлектронная плотность — это плотность вероятности обнаружения электрона в данной точке пространства. Электронная плотность нормирована и, соответственно, указывает на вероятное число электронов в данном элементарном объёме.
Вероятностную (статистическую) интерпретацию волновой функции сформулировал М. Борн в 1926 году как только было опубликована волновое уравнение Шрёдингера. В 1954 году М. Борн удостоен Нобелевской премии по физике с формулировкой «За фундаментальное исследование в области квантовой механики, особенно за статистическую интерпретацию волновой функции».
Расчёт электронной плотности проводят с использованием уравнения Шрёдингера, которое решается аналитически точно для систем, содержащих только один электрон[7].
Получаемая радиальная функция распределения вероятности нахождения электрона в атоме водорода обладает максимумом при α0, как показано на рисунке. Этот наиболее вероятный радиус совпадает с боровским радиусом и принят в качестве атомной единицы для линейных размеров 1 а. е. (бор) = 0,529177·10−10м ≈ 0,529 Å. Более размытое облако плотности вероятности, полученное при решении уравнения Шрёдингера для атома водорода, значительно отличается от боровской модели атома и согласуется с принципами неопределённости Гейзенберга. С учётом статистической интерпретации волновой функции М. Борна и принципа неопределённости Гейзенберга длины диполей AP и BQ взаимодействующих атомов в расчётах Ф. Лондона достаточно размыты. Размыто и электронное кольцо в модели молекулы водорода по Н. Бору до состояния тороидального электронного облака с неопределёнными границами.
Наиболее вероятный радиус электронного кольца (тора) молекулы водорода (re) определяется боровским радиусом (α0) и длиной химической связи (d): re2 = α02 — (d/2)2; re = 0,374 Å.
Благодаря пространственной симметрии дипольный момент молекулы водорода равен нулю, что соответствует её низкой химической активности[8]. Пространственная симметрия электронной плотности сохраняется, если соединяющиеся в молекулу атомы имеют одинаковую энергию ионизации. В этом случае связывающее электронное кольцо располагается на равном расстоянии от каждого из ядер. Если же потенциалы ионизации различны электронная плотность смещается в сторону атома с большим первым потенциалом ионизации[9]. Смещение электронной плотности приводит к асимметрии распределения электрических зарядов в молекуле, молекула становится полярной системой с определённым дипольным моментом.
Приближённые квантовохимические методы расчёта
Поскольку точное решение уравнения Шрёдингера для атомно-молекулярных систем, содержащих два и более электрона, невозможно, предложены приближённые методы расчёта электронной плотности. Все они возникли в 1930-х годах, проделали значительный путь развития и долгое время дополняли друг друга. Наиболее важные из них — теория валентных связей, теория молекулярных орбиталей, теория кристаллического поля, теория функционала плотности.
В рамках теории валентных связей разработана концепция резонанса (Л. Полинг) и родственная ей концепция мезомерии (К. Ингольд). Концепция резонанса рассмотрена на примере молекулярного иона водорода. Л. Полинг показал, что стабильность молекулярного иона водорода:
вызвана резонансом электрона, то есть движением его «взад и вперёд» между двумя ядрами с «резонансной частотой», равной по величине энергии резонанса (50 ккал/моль), делённой на константу Планка h. Для молекулярного иона в основном состоянии эта частота равна 7.1014сек−1[10].
Концепция резонанса дополняла постулаты классической теории химического строения и утверждала, что если для данного соединения классическая теория допускает построение нескольких приемлемых структурных формул, то действительному состоянию молекул этого соединения отвечает не какая-либо одна отдельная формула, а некоторое их сочетание (наложение, резонанс структур)[11].
Мезомерия является теорией электронного строения химических соединений, согласно которой истинное распределение электронной плотности в молекуле является промежуточным между распределениями, представленными несколькими классическими формулами[12].
Обычно рассматривают положительный и отрицательный мезомерные эффекты:
Винилхлорид: +М-эффект
Аллил-катион: −М-эффект
Кампания идеологического вмешательства в теорию химического строения
Кампания началась в 1949 году с публикации статьи В. М. Татевского и М. М. Шахпаронова «Об одной махистской теории в химии и её пропагандистах»[13]. В качестве главного объекта нападения была выбрана теория резонанса Л. Полинга. Было объявлено, что «представления о реальной молекуле как о чём-то среднем между двумя (и более) крайними абстрактными структурами являются буржуазными и поэтому направленными против всего самого „святого“». Были указаны и пропагандисты теории Я. К. Сыркин и М. Е. Дяткина — авторы книги «Химическая связь и строение молекул», в которой нашла отражение теория резонанса.
В воздухе очередной раз запахло инквизицией. В этой тревожной обстановке ведущие химики страны собрались на Всесоюзное совещание по проблемам химического строения (1951 г., Москва). Стенограмма этого совещания — один из наиболее позорных документов, когда-либо созданных коллективными усилиями ученых, хранится в химических библиотеках всего мира, и от этого срама бог весть когда ещё удастся отмыться… До крови не дошло — спасла оттепель, начавшаяся весной следующего года. Я. К. Сыркин и М. Е. Дяткина, подготовленные недавними друзьями и коллегами к выдаче в качестве первых козлов отпущения, уцелели; более того Я. К. Сыркин в дальнейшем стал академиком[14].
Лайнус Полинг удостоен в 1954 году Нобелевской премии по химии «за исследование природы химической связи и её применение для определения структуры сложных соединений».
Однако консенсус в теории химического строения не был достигнут. В. М. Татевский в курсе «Строение молекул» (1977 г.) отмечал:
… полностью выпадают и «висят в воздухе» представления уходящих в прошлое, но всё ещё фигурирующих в литературе так называемых «теории резонанса» и «теории мезомерии», которые не имеют основы ни в классической теории химического строения, ни в законных приложениях классической физики к вопросам строения молекул, ни в квантовой механике[15].
Лишь в 1991 году проведён принципиальный анализ кампании по борьбе с теорией резонанса и было показано, что эта кампания «нанесла серьёзный ущерб престижу советской науки»[16].
Атомы в молекулах
В классической теории химического строения понятие атома в молекуле является изначальным. Интуитивно ясно, что атом в молекуле меняется, меняются и его свойства в зависимости от окружения этого атома, прежде всего ближайшего. Основным показателем является расстояние между атомами в молекуле, определяющее как длину химической связи, так и прочность химической связи.
В квантовой теории понятие атома вторично. Так, по утверждению В. М. Татевского, молекула не состоит из атомов: «С современной точки зрения ясно, что при образовании молекулы сохраняются не атомы, а только ядра атомов и электроны»[17]
.Было предпринято множество попыток сохранить понятие атома в молекуле, но, тем не менее, практически всегда они не удовлетворяли последующих исследователей по тем или иным причинам.
Одна из наиболее удачных попыток сохранения классической концепции атома в молекуле принадлежит Р. Бейдеру и его сотрудникам[18]. В рамках этой теории (QTAIM) электронная плотность «задаёт некоторое скалярное поле в трёхмерном пространстве, которое может быть охарактеризовано, например, его совокупностью экстремальных точек, линий и поверхностей, особых точек и т. п.»[19].
Таким образом, в квантовой теории атомов в молекулах Р. Бейдера оказывается возможным физическое обоснование ключевых понятий химии «атом», «молекула», «химическая связь» в терминах топологии функции электронной плотности в трёхмерном пространстве и описание химического строения молекул.
Электронная корреляция и конфигурация молекул
Электронная корреляция (взаимная обусловленность движения всех электронов атомной или молекулярной системы как целого определяется электростатическим отталкиванием электронов и статическим особенностями систем, в частности принципом Паули (фермиевская корреляция). Полный учёт электронной корреляции при расчёте энергии и определении электронной структуры системы достигается методом конфигурационного взаимодействия.
Простая и надёжная система правил для понимания и предсказания конфигурации молекул заложена в теории отталкивания электронных пар, наиболее важное правило которой достаточно эмпирично, хотя имеет квантовомеханическое обоснование, заключающееся в принципе Паули, а именно «электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга». При этом конфигурация молекулы будет определяться числом связывающих и неподелённых электронных пар у центрального атома:
- две связывающие электронные пары дают линейную конфигурацию молекулы;
- три — конфигурацию правильного треугольника;
- четыре — конфигурацию тетраэдра;
- пять — тригонально-бипирамидальную конфигурацию;
- шесть — конфигурацию октаэдра.
Наличие неподелённых электронных пар у центрального атома приводит к расширению типов конфигураций молекулы[20].
Строение соединений благородных газов
Молекула дифторида ксенона Молекула тетрафторида ксенона Молекула гексафторида ксенонаОткрытие Н. Бартлеттом в 1962 году первого соединения ксенона положило начало интенсивному развитию химии благородных газов, что привело к получению большого ряда соединений инертных газов и установлению их химического строения.
Оказалось, что все соединения благородных газов имеют обыкновенные ковалентные связи и общепринятые конфигурации молекул. Так, конфигурация молекулы дифторида ксенона линейна: связи ксенон—фтор являются аксиальными и взаимодействуют с тремя неподелёнными электронными парами, находящимися в экваториальных положениях.
В молекуле тетрафторида ксенона осуществляется конфигурация с плоским квадратным расположением лигандов. Неподелённые электронные пары ксенона максимально удалены друг от друга и расположены по разные стороны от этого квадрата.
Структура молекулы гексафторида ксенона представляет собой искажённый октаэдр. «Отклонение атомов фтора от вершин правильного октаэдра указывает на то, что неподелённая электронная пара занимает положение над центром одной из граней октаэдра, а атомы фтора, расположенные в углах этой грани, вынуждены раздвинуться»[20].
Открытие Бартлетта показало ошибочность популярного в то время правила октета,[как?] согласно которому при образовании молекул атомы удовлетворяют свою потребность в достижении 8-электронной валентной оболочки, подобной электронной конфигурации благородных газов за счёт попарного обобществления своих валентных электронов. Оказалось, что атомы благородных газов, имея полностью заполненную валентную оболочку, могут вступать в химические реакции и участвовать в химическом строении молекул.
Строение электронодефицитных соединений
Структурная проблема, связанная с электронодефицитными соединениями, довольно сложна. Фундаментальная трудность заключалась в том, что в молекулах нет достаточного числа валентных электронов для того, чтобы связать все атомы обычными двухэлектронными связями. Так, например, в молекуле диборана имеется двенадцать валентных электронов, все двенадцать нужны для образования ковалентных связей шести атомов водорода с бором, так что для связи атомов бора между собой электронов не остаётся. Сам Полинг допускал, что в диборане функционируют одноэлектронные связи, а молекула в основном состоянии резонирует между семью структурами льюисовского типа, а также между многочисленными структурами, содержащими одноэлектронные связи.
Однако заслуженное признание получили исследования природы химической связи в бороводородах, выполненные американским физикохимиком У. Липскомбом. В его интерпретации в диборане имеют место четыре двух- и две трёхцентровые связи.
Четыре концевые двухцентровые двухэлектронные связи HB лежат в одной плоскости. Два же центральных атома водорода расположены симметрично над этой плоскостью и под нею и объединены с атомами бора двумя трёхцентровыми связями.
В 1976 году Липскомб удостоен Нобелевской премии по химии с формулировкой «за исследование структуры боранов (боргидритов), проясняющих проблему химических связей».
Особенности строения сэндвичевых соединений
Молекула ферроценаДальнейшее развитие теории химического строения связано с открытием и установлением структуры ферроцена[21]. Оказалось, что при взаимодействии хлорида двухвалентного железа и циклопентадиена вместо ожидаемого соединения с двумя химическими связями железо-углерод образуется сэндвичеобразное соединение, в котором все 10 атомов углерода соединены с атомом железа.
Рентгеноструктурными исследованиями Э. Фишера установлено, что все атомы углерода в молекуле ферроцена структурно и химически эквивалентны. Атом металла взаимодействует не с одним или двумя конкретными атомами углерода, а со всеми атомами углерода двух циклопентадиенильных колец сразу. Атом металла как бы завис в пространстве между двумя циклами, представленных параллельными правильными пятиугольниками.
В настоящее время получены металлоцены — бициклопентадиенильные соединения переходных металлов для большинства d-элементов.
Сэндвичевые соединения образуются также с использованием в качестве органического фрагмента бензола или циклооктатетраена. Так, например, в ураноцене (см. рисунок) атом урана удерживает два восьмичленных кольца. Все 16 связей уран—углерод в ураноцене идентичны.
В 1973 году Э. Фишер и Дж. Уилкинсон удостоены Нобелевской премии по химии с формулировкой «За новаторскую, проделанную независимо друг от друга, работу в области металлорганических, так называемых сэндвичевых соединений».
Считается, что в сэндвичевых соединениях реализуется многоцентровая связь, тип химической связи, в которой в отличие от двухцентровой двухэлектронной связи, связывающие электронные пары распределены в пространстве трех или большего числа атомных центров молекулы, иона, радикала.[22]
Примечания
- ↑ 1 2 Совещание по теории химического строения в органической химии. Успехи физических наук.. — 1951, октябрь. — Т. XLV, вып. 2. — С. 277—392.
- ↑ Химический энциклопедический словарь / гл. ред. И. Л. Кнунянц. — Сов. энциклопедия, 1983. — С. 652. — 792 с.
- ↑ Butlerow A. Einiges über die chemische Structur der Körper. (Vorgetragen in der chemischen Section der 36. Versammlung deutscher Naturforscher und Aerzte zu Speyer am 19.Septbr.) (нем.) // Zeitschrift für Chemie und Pharmacie : magazin. — 1861. — Bd. 4. — S. 549—560.
- ↑ Бутлеров А. О химическом строении веществ // Учёные записки Казанского университета (отд. физ.-мат. и мед. наук). Вып.1, отд.1. — 1862. — С. 1—11.
- ↑ Бор Н. Избранные научные труды. — М.: «Наука», 1970. — Т. 1. — С. 147. — 584 с.
- ↑ 1 2 3 Коулсон К. Успехи физических наук (статья «Межатомные силы — от Максвелла до Шрёдингера»). — 1963, ноябрь. — Т. LXXXI, вып.3. — С. 545-556.
- ↑ Шусторович Е. М. Химическая связь. Сущность и проблемы.. — М.: «Наука», 1973. — С. 6. — 232 с.
- ↑ Потапов А. А. Ренессанс классического атома. — М.: «Наука», 2011. — С. 352. — 444 с.
- ↑ Ганкин В. Ю., Ганкин Ю. В. Как образуется химическая связь и протекают химические реакции. — М.: «Граница». — С. 65. — 320 с.
- ↑ Паулинг Л. Природа химической связи. — М.-Л.: Химическая литература, 1947. — С. 25—26. — 440 с.
- ↑ Новая иллюстрированная энциклопедия. Пр-Ро. Кн.15. — М.: Большая российская энциклопедия, 2002. — С. 169. — 255 с.
- ↑ Новая иллюстрированная энциклопедия. Ма-Мо. Кн.11. — М.: Большая российская энциклопедия, 2002. — С. 141. — 255 с.
- ↑ Вопросы философии. — 1949. — № 3. — С. 176—192.
- ↑ Охлобыстин О. Ю. Жизнь и смерть химических идей. Очерки по истории теоретической химии.. — М.: Наука, 1989. — С. 184. — 190 с.
- ↑ Татевский В. М. Строение молекул.. — М.: Химия, 1977. — С. 10. — 512 с.
- ↑ Сонин А. С. Печальный юбилей одной кампании. (рус.) // Вестник РАН. — 1991. — Т. 61, № 8. — С. 96—107. Архивировано 5 мая 2010 года.
- ↑ Татевский В. М. Квантовая механика и теория строения молекул. — М.: Издательство МГУ, 1965. — С. 17. — 162 с.
- ↑ Бейдер Р. Атомы в молекулах. Квантовая теория. — М.: Мир, 2001. — 532 с.
- ↑ Степанов Н. Ф. Квантовая механика и квантовая химия. — М.: Мир, 2001. — С. 487. — 519 с.
- ↑ 1 2 Р. Гиллеспи. Геометрия молекул. — М.: Мир, 1975. — 278 с.
- ↑ Несмеянов А.Н. Ферроцен и родственные соединения. Избранные труды 1969 — 1979. — М.: Советская энциклопедия, 1982.
- ↑ Химический Энциклопедический словарь. — М.: Советская энциклопедия, 1983. — 792 с.
Теория химического строения — Википедия
Теория химического строения — учение о строении молекулы, описывающее все те её характеристики, которые в своей совокупности определяют химическое поведение (реакционную способность) данной молекулы. Сюда относятся: природа атомов, образующих молекулу, их валентное состояние, порядок и характер химической связи между ними, пространственное их расположение, характерное распределение электронной плотности, характер электронной поляризуемости электронного облака молекулы и т. д.[1]
Основные положения теории химического строения, являющейся фундаментом химии, были развиты русским химиком А. М. Бутлеровым.
Бутлеров определял понятие химического строения так:
Исходя от мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определённым количеством принадлежащей ему химической силы (сродства), я называю химическим строением распределение действия этой силы, вследствие которой химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу[1].
Предпосылки создания теории химического строения
В 1812 году итальянский физик и химик Амедео Авогадро, изучая молекулярные веса газов (водорода, кислорода, азота, хлора), выдвинул молекулярную гипотезу строения вещества. Однако работа Авогадро долгое время не получала признания, что тормозило развитие основных идей в области химического строения молекул. Лишь после убедительного доклада Станислао Канниццаро на первом международном съезде химиков в Карлсруэ (1860) атомные веса, определённые с помощью закона Авогадро, стали общепринятыми[2]. На съезде разграничили понятия «атом», «молекула», утвердили атомно-молекулярное учение, основное положение которого «атомы при взаимодействии образуют молекулу».
Атомно-молекулярное учение послужило основой создания теории химического строения Бутлерова.
Видео по теме
Теория химического строения Бутлерова
Термин «химическое строение» впервые ввёл А. М. Бутлеров 19 сентября 1861 года в докладе «О химическом строении веществ» на химической секции Съезда немецких естествоиспытателей и врачей в Шпейере (опубликованном в том же году на немецком[3] и в следующем — на русском языках[4]). В том же докладе он заложил основы классической теории химического строения. Главные положения этой теории следующие:
- атомы в молекулах веществ соединены друг с другом согласно их валентности, порядок распределения связей в молекуле называется химическим строением;
- изменение этой последовательности приводит к образованию нового вещества с новыми свойствами;
- свойства веществ зависят не только от их качественного и количественного состава, но и от «химического строения», то есть от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой;
- атомы в молекулах оказывают влияние друг на друга, и это влияние приводит к химическим изменениям поведения атома;
- определить состав и строение химического вещества можно по продуктам химических превращений.
Геометрия молекул
В 1864 году Бутлеров первым объясняет явление изомерии, показав что изомеры — это соединения, обладающие одинаковым элементным составом, но различным химическим строением. В 1874 году возникает стереохимия, или трёхмерная структурная химия в форме постулата Вант-Гоффа о тетраэдрической системе валентностей у атома углерода.
В настоящее время принято различать структурную и пространственную изомерию.
Структурную изомерию подразделяют на изомерию скелета, обусловленную различным порядком связи атомов, образующих скелет молекулы, например в Н-бутане и изобутане, и на изомерию положения одинаковых функциональных групп при одинаковом углеродном скелете молекулы, например в орто- , мета- и пара- изомерах ароматических соединений.
Пространственная изомерия обусловлена существованием стереоизомеров, соединений, имеющих одинаковый порядок связей атомов, но различное пространственное расположение. К видам пространственной изомерии относятся: оптическая изомерия, обусловливающая существование энантиомеров — пары стереоизомеров, представляющих собой зеркальные отражения друг от друга, не совмещаемые в пространстве; диастереомерия, обусловливающая существование изомеров, не являющихся энантиомерами; геометрическая изомерия, обусловливающая цис- и транс- изомеров, свойственных соединениям с двойными связями и малыми циклами.
Электронные интерпретации строения молекул
Строение молекулы H2 по БоруС открытием в 1897 году электрона (Дж. Томсоном, Э. Вихертом) появились электронные интерпретации строения молекул. Американский физикохимик Г. Льюис в 1912 году предложил электронную теорию химической связи, по которой связь между атомами в молекуле осуществляется обобществлённой электронной парой. Электронная теория химической связи Льюиса стала основой классической теории строения в органической химии, базирующейся на представлении о парной связи между атомами, образованной дублетом электронов. Валентный штрих между символами элементов в молекуле был заменён двумя точками, обозначающими связывающую электронную пару.
В 1913 году датский физик Нильс Бор предложил рассматривать электронную пару в форме вращающегося кольца, плоскость которого перпендикулярна оси молекулы и равноудалена от ядер атомов.
Динамическое равновесие молекулярной системы, по Бору, достигается за счёт баланса сил между силами взаимного отталкивания ядер и силами притяжения ядер к плоскости кольца электронов. Боровская интерпретация строения молекулы учитывала кулоновское отталкивание электронов, в кольце они находятся в диаметрально противоположном положении.
Молекулу метана Нильс Бор описывал следующим образом:
Ядро углерода, заключённое в очень маленькое кольцо из двух электронов, расположено в центре (тетраэдра), а ядро водорода по углам. Химические связи представляют собой четыре двухэлектронных кольца, вращающихся вокруг линий, соединяющих центр с углами[5].
Квантовая природа межатомных сил
Схема диполь-дипольного взаимодействия двух атомов водорода по ЛондонуВ своём докладе, прочитанном в Королевском колледже в Лондоне в ознаменовании столетия опубликования трудов Дж. Максвелла по электромагнитному излучению, К. Коулсон дал анализ происхождения и сущности межатомных сил, приводящих к образованию молекулы[6]. Коулсон, ссылаясь на работу Лондона, на примере двух атомов водорода показывает «каким образом два нейтральных атома или молекулы могут оказывать притяжение друг к другу на значительном расстоянии».
Ядра A и B двух атомов водорода находятся на расстоянии r друг от друга (рис.). Каждый атом несёт по одном электрону (в P и Q соответственно). Совокупность зарядов +e в A и -e в P приблизительно эквивалентна электрическому диполю, имеющему величину e·AP. Подобным же образом совокупность +e в B и -e в Q приблизительно эквивалентна электрическому диполю e·BQ. Эти два диполя взаимодействуют друг с другом. Общая потенциальная энергия двух диполей, m и m’, находящихся на расстоянии r, равна:
mm′r3−3(mr)(m′r)r5{\displaystyle {\frac {mm’}{r^{3}}}-3{\frac {(mr)(m’r)}{r^{5}}}}[6]
На языке волновой механики это выражение рассматривается как возмущение, действующее на оба атома.
Природа межатомных сил имеет электромагнитный характер и называется диполь-дипольным взаимодействием. Существуют диполь-квадрупольные, квадруполь-квадрупольные и другие взаимодействия, при которых энергия изменяется в зависимости от более высоких степеней 1/r[6].
Распределение электронной плотности в химических соединениях
 Рис. Радиальное распределение вероятности нахождения электрона в атоме водорода.
Рис. Модель молекулы водорода и её осевая проекция
Рис. Радиальное распределение вероятности нахождения электрона в атоме водорода.
Рис. Модель молекулы водорода и её осевая проекцияЭлектронная плотность — это плотность вероятности обнаружения электрона в данной точке пространства. Электронная плотность нормирована и, соответственно, указывает на вероятное число электронов в данном элементарном объёме.
Вероятностную (статистическую) интерпретацию волновой функции сформулировал М. Борн в 1926 году как только было опубликована волновое уравнение Шрёдингера. В 1954 году М. Борн удостоен Нобелевской премии по физике с формулировкой «За фундаментальное исследование в области квантовой механики, особенно за статистическую интерпретацию волновой функции».
Расчёт электронной плотности проводят с использованием уравнения Шрёдингера, которое решается аналитически точно для систем, содержащих только один электрон[7].
Получаемая радиальная функция распределения вероятности нахождения электрона в атоме водорода обладает максимумом при α0, как показано на рисунке. Этот наиболее вероятный радиус совпадает с боровским радиусом и принят в качестве атомной единицы для линейных размеров 1 а. е. (бор) = 0,529177·10−10м ≈ 0,529 Å. Более размытое облако плотности вероятности, полученное при решении уравнения Шрёдингера для атома водорода, значительно отличается от боровской модели атома и согласуется с принципами неопределённости Гейзенберга. С учётом статистической интерпретации волновой функции М. Борна и принципа неопределённости Гейзенберга длины диполей AP и BQ взаимодействующих атомов в расчётах Ф. Лондона достаточно размыты. Размыто и электронное кольцо в модели молекулы водорода по Н. Бору до состояния тороидального электронного облака с неопределёнными границами.
Наиболее вероятный радиус электронного кольца (тора) молекулы водорода (re) определяется боровским радиусом (α0) и длиной химической связи (d): re2 = α02 — (d/2)2; re = 0,374 Å.
Благодаря пространственной симметрии дипольный момент молекулы водорода равен нулю, что соответствует её низкой химической активности[8]. Пространственная симметрия электронной плотности сохраняется, если соединяющиеся в молекулу атомы имеют одинаковую энергию ионизации. В этом случае связывающее электронное кольцо располагается на равном расстоянии от каждого из ядер. Если же потенциалы ионизации различны электронная плотность смещается в сторону атома с большим первым потенциалом ионизации[9]. Смещение электронной плотности приводит к асимметрии распределения электрических зарядов в молекуле, молекула становится полярной системой с определённым дипольным моментом.
Приближённые квантовохимические методы расчёта
Поскольку точное решение уравнения Шрёдингера для атомно-молекулярных систем, содержащих два и более электрона, невозможно, предложены приближённые методы расчёта электронной плотности. Все они возникли в 1930-х годах, проделали значительный путь развития и долгое время дополняли друг друга. Наиболее важные из них — теория валентных связей, теория молекулярных орбиталей, теория кристаллического поля, теория функционала плотности.
В рамках теории валентных связей разработана концепция резонанса (Л. Полинг) и родственная ей концепция мезомерии (К. Ингольд). Концепция резонанса рассмотрена на примере молекулярного иона водорода. Л. Полинг показал, что стабильность молекулярного иона водорода:
вызвана резонансом электрона, то есть движением его «взад и вперёд» между двумя ядрами с «резонансной частотой», равной по величине энергии резонанса (50 ккал/моль), делённой на константу Планка h. Для молекулярного иона в основном состоянии эта частота равна 7.1014сек−1[10].
Концепция резонанса дополняла постулаты классической теории химического строения и утверждала, что если для данного соединения классическая теория допускает построение нескольких приемлемых структурных формул, то действительному состоянию молекул этого соединения отвечает не какая-либо одна отдельная формула, а некоторое их сочетание (наложение, резонанс структур)[11].
Мезомерия является теорией электронного строения химических соединений, согласно которой истинное распределение электронной плотности в молекуле является промежуточным между распределениями, представленными несколькими классическими формулами[12].
Обычно рассматривают положительный и отрицательный мезомерные эффекты:
Винилхлорид: +М-эффект
Аллил-катион: −М-эффект
Кампания идеологического вмешательства в теорию химического строения
Кампания началась в 1949 году с публикации статьи В. М. Татевского и М. М. Шахпаронова «Об одной махистской теории в химии и её пропагандистах»[13]. В качестве главного объекта нападения была выбрана теория резонанса Л. Полинга. Было объявлено, что «представления о реальной молекуле как о чём-то среднем между двумя (и более) крайними абстрактными структурами являются буржуазными и поэтому направленными против всего самого „святого“». Были указаны и пропагандисты теории Я. К. Сыркин и М. Е. Дяткина — авторы книги «Химическая связь и строение молекул», в которой нашла отражение теория резонанса.
В воздухе очередной раз запахло инквизицией. В этой тревожной обстановке ведущие химики страны собрались на Всесоюзное совещание по проблемам химического строения (1951 г., Москва). Стенограмма этого совещания — один из наиболее позорных документов, когда-либо созданных коллективными усилиями ученых, хранится в химических библиотеках всего мира, и от этого срама бог весть когда ещё удастся отмыться… До крови не дошло — спасла оттепель, начавшаяся весной следующего года. Я. К. Сыркин и М. Е. Дяткина, подготовленные недавними друзьями и коллегами к выдаче в качестве первых козлов отпущения, уцелели; более того Я. К. Сыркин в дальнейшем стал академиком[14].
Лайнус Полинг удостоен в 1954 году Нобелевской премии по химии «за исследование природы химической связи и её применение для определения структуры сложных соединений».
Однако консенсус в теории химического строения не был достигнут. В. М. Татевский в курсе «Строение молекул» (1977 г.) отмечал:
… полностью выпадают и «висят в воздухе» представления уходящих в прошлое, но всё ещё фигурирующих в литературе так называемых «теории резонанса» и «теории мезомерии», которые не имеют основы ни в классической теории химического строения, ни в законных приложениях классической физики к вопросам строения молекул, ни в квантовой механике[15].
Лишь в 1991 году проведён принципиальный анализ кампании по борьбе с теорией резонанса и было показано, что эта кампания «нанесла серьёзный ущерб престижу советской науки»[16].
Атомы в
Теория химического строения — Википедия
Теория химического строения — учение о строении молекулы, описывающее все те её характеристики, которые в своей совокупности определяют химическое поведение (реакционную способность) данной молекулы. Сюда относятся: природа атомов, образующих молекулу, их валентное состояние, порядок и характер химической связи между ними, пространственное их расположение, характерное распределение электронной плотности, характер электронной поляризуемости электронного облака молекулы и т. д.[1]
Основные положения теории химического строения, являющейся фундаментом химии, были развиты русским химиком А. М. Бутлеровым.
Бутлеров определял понятие химического строения так:
Исходя от мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определённым количеством принадлежащей ему химической силы (сродства), я называю химическим строением распределение действия этой силы, вследствие которой химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу[1].
Предпосылки создания теории химического строения
В 1812 году итальянский физик и химик Амедео Авогадро, изучая молекулярные веса газов (водорода, кислорода, азота, хлора), выдвинул молекулярную гипотезу строения вещества. Однако работа Авогадро долгое время не получала признания, что тормозило развитие основных идей в области химического строения молекул. Лишь после убедительного доклада Станислао Канниццаро на первом международном съезде химиков в Карлсруэ (1860) атомные веса, определённые с помощью закона Авогадро, стали общепринятыми[2]. На съезде разграничили понятия «атом», «молекула», утвердили атомно-молекулярное учение, основное положение которого «атомы при взаимодействии образуют молекулу».
Атомно-молекулярное учение послужило основой создания теории химического строения Бутлерова.
Теория химического строения Бутлерова
Термин «химическое строение» впервые ввёл А. М. Бутлеров 19 сентября 1861 года в докладе «О химическом строении веществ» на химической секции Съезда немецких естествоиспытателей и врачей в Шпейере (опубликованном в том же году на немецком[3] и в следующем — на русском языках[4]). В том же докладе он заложил основы классической теории химического строения. Главные положения этой теории следующие:
- атомы в молекулах веществ соединены друг с другом согласно их валентности, порядок распределения связей в молекуле называется химическим строением;
- изменение этой последовательности приводит к образованию нового вещества с новыми свойствами;
- свойства веществ зависят не только от их качественного и количественного состава, но и от «химического строения», то есть от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой;
- атомы в молекулах оказывают влияние друг на друга, и это влияние приводит к химическим изменениям поведения атома;
- определить состав и строение химического вещества можно по продуктам химических превращений.
Геометрия молекул
В 1864 году Бутлеров первым объясняет явление изомерии, показав что изомеры — это соединения, обладающие одинаковым элементным составом, но различным химическим строением. В 1874 году возникает стереохимия, или трёхмерная структурная химия в форме постулата Вант-Гоффа о тетраэдрической системе валентностей у атома углерода.
В настоящее время принято различать структурную и пространственную изомерию.
Структурную изомерию подразделяют на изомерию скелета, обусловленную различным порядком связи атомов, образующих скелет молекулы, например в Н-бутане и изобутане, и на изомерию положения одинаковых функциональных групп при одинаковом углеродном скелете молекулы, например в орто- , мета- и пара- изомерах ароматических соединений.
Пространственная изомерия обусловлена существованием стереоизомеров, соединений, имеющих одинаковый порядок связей атомов, но различное пространственное расположение. К видам пространственной изомерии относятся: оптическая изомерия, обусловливающая существование энантиомеров — пары стереоизомеров, представляющих собой зеркальные отражения друг от друга, не совмещаемые в пространстве; диастереомерия, обусловливающая существование изомеров, не являющихся энантиомерами; геометрическая изомерия, обусловливающая цис- и транс- изомеров, свойственных соединениям с двойными связями и малыми циклами.
Электронные интерпретации строения молекул
Строение молекулы H2 по БоруС открытием в 1897 году электрона (Дж. Томсоном, Э. Вихертом) появились электронные интерпретации строения молекул. Американский физикохимик Г. Льюис в 1912 году предложил электронную теорию химической связи, по которой связь между атомами в молекуле осуществляется обобществлённой электронной парой. Электронная теория химической связи Льюиса стала основой классической теории строения в органической химии, базирующейся на представлении о парной связи между атомами, образованной дублетом электронов. Валентный штрих между символами элементов в молекуле был заменён двумя точками, обозначающими связывающую электронную пару.
В 1913 году датский физик Нильс Бор предложил рассматривать электронную пару в форме вращающегося кольца, плоскость которого перпендикулярна оси молекулы и равноудалена от ядер атомов.
Динамическое равновесие молекулярной системы, по Бору, достигается за счёт баланса сил между силами взаимного отталкивания ядер и силами притяжения ядер к плоскости кольца электронов. Боровская интерпретация строения молекулы учитывала кулоновское отталкивание электронов, в кольце они находятся в диаметрально противоположном положении.
Молекулу метана Нильс Бор описывал следующим образом:
Ядро углерода, заключённое в очень маленькое кольцо из двух электронов, расположено в центре (тетраэдра), а ядро водорода по углам. Химические связи представляют собой четыре двухэлектронных кольца, вращающихся вокруг линий, соединяющих центр с углами[5].
Квантовая природа межатомных сил
Схема диполь-дипольного взаимодействия двух атомов водорода по ЛондонуВ своём докладе, прочитанном в Королевском колледже в Лондоне в ознаменовании столетия опубликования трудов Дж. Максвелла по электромагнитному излучению, К. Коулсон дал анализ происхождения и сущности межатомных сил, приводящих к образованию молекулы[6]. Коулсон, ссылаясь на работу Лондона, на примере двух атомов водорода показывает «каким образом два нейтральных атома или молекулы могут оказывать притяжение друг к другу на значительном расстоянии».
Ядра A и B двух атомов водорода находятся на расстоянии r друг от друга (рис.). Каждый атом несёт по одном электрону (в P и Q соответственно). Совокупность зарядов +e в A и -e в P приблизительно эквивалентна электрическому диполю, имеющему величину e·AP. Подобным же образом совокупность +e в B и -e в Q приблизительно эквивалентна электрическому диполю e·BQ. Эти два диполя взаимодействуют друг с другом. Общая потенциальная энергия двух диполей, m и m’, находящихся на расстоянии r, равна:
mm′r3−3(mr)(m′r)r5{\displaystyle {\frac {mm’}{r^{3}}}-3{\frac {(mr)(m’r)}{r^{5}}}}[6]
На языке волновой механики это выражение рассматривается как возмущение, действующее на оба атома.
Природа межатомных сил имеет электромагнитный характер и называется диполь-дипольным взаимодействием. Существуют диполь-квадрупольные, квадруполь-квадрупольные и другие взаимодействия, при которых энергия изменяется в зависимости от более высоких степеней 1/r[6].
Распределение электронной плотности в химических соединениях
 Рис. Радиальное распределение вероятности нахождения электрона в атоме водорода.
Рис. Модель молекулы водорода и её осевая проекция
Рис. Радиальное распределение вероятности нахождения электрона в атоме водорода.
Рис. Модель молекулы водорода и её осевая проекцияЭлектронная плотность — это плотность вероятности обнаружения электрона в данной точке пространства. Электронная плотность нормирована и, соответственно, указывает на вероятное число электронов в данном элементарном объёме.
Вероятностную (статистическую) интерпретацию волновой функции сформулировал М. Борн в 1926 году как только было опубликована волновое уравнение Шрёдингера. В 1954 году М. Борн удостоен Нобелевской премии по физике с формулировкой «За фундаментальное исследование в области квантовой механики, особенно за статистическую интерпретацию волновой функции».
Расчёт электронной плотности проводят с использованием уравнения Шрёдингера, которое решается аналитически точно для систем, содержащих только один электрон[7].
Получаемая радиальная функция распределения вероятности нахождения электрона в атоме водорода обладает максимумом при α0, как показано на рисунке. Этот наиболее вероятный радиус совпадает с боровским радиусом и принят в качестве атомной единицы для линейных размеров 1 а. е. (бор) = 0,529177·10−10м ≈ 0,529 Å. Более размытое облако плотности вероятности, полученное при решении уравнения Шрёдингера для атома водорода, значительно отличается от боровской модели атома и согласуется с принципами неопределённости Гейзенберга. С учётом статистической интерпретации волновой функции М. Борна и принципа неопределённости Гейзенберга длины диполей AP и BQ взаимодействующих атомов в расчётах Ф. Лондона достаточно размыты. Размыто и электронное кольцо в модели молекулы водорода по Н. Бору до состояния тороидального электронного облака с неопределёнными границами.
Наиболее вероятный радиус электронного кольца (тора) молекулы водорода (re) определяется боровским радиусом (α0) и длиной химической связи (d): re2 = α02 — (d/2)2; re = 0,374 Å.
Благодаря пространственной симметрии дипольный момент молекулы водорода равен нулю, что соответствует её низкой химической активности[8]. Пространственная симметрия электронной плотности сохраняется, если соединяющиеся в молекулу атомы имеют одинаковую энергию ионизации. В этом случае связывающее электронное кольцо располагается на равном расстоянии от каждого из ядер. Если же потенциалы ионизации различны электронная плотность смещается в сторону атома с большим первым потенциалом ионизации[9]. Смещение электронной плотности приводит к асимметрии распределения электрических зарядов в молекуле, молекула становится полярной системой с определённым дипольным моментом.
Приближённые квантовохимические методы расчёта
Поскольку точное решение уравнения Шрёдингера для атомно-молекулярных систем, содержащих два и более электрона, невозможно, предложены приближённые методы расчёта электронной плотности. Все они возникли в 1930-х годах, проделали значительный путь развития и долгое время дополняли друг друга. Наиболее важные из них — теория валентных связей, теория молекулярных орбиталей, теория кристаллического поля, теория функционала плотности.
В рамках теории валентных связей разработана концепция резонанса (Л. Полинг) и родственная ей концепция мезомерии (К. Ингольд). Концепция резонанса рассмотрена на примере молекулярного иона водорода. Л. Полинг показал, что стабильность молекулярного иона водорода:
вызвана резонансом электрона, то есть движением его «взад и вперёд» между двумя ядрами с «резонансной частотой», равной по величине энергии резонанса (50 ккал/моль), делённой на константу Планка h. Для молекулярного иона в основном состоянии эта частота равна 7.1014сек−1[10].
Концепция резонанса дополняла постулаты классической теории химического строения и утверждала, что если для данного соединения классическая теория допускает построение нескольких приемлемых структурных формул, то действительному состоянию молекул этого соединения отвечает не какая-либо одна отдельная формула, а некоторое их сочетание (наложение, резонанс структур)[11].
Мезомерия является теорией электронного строения химических соединений, согласно которой истинное распределение электронной плотности в молекуле является промежуточным между распределениями, представленными несколькими классическими формулами[12].
Обычно рассматривают положительный и отрицательный мезомерные эффекты:
Винилхлорид: +М-эффект
Аллил-катион: −М-эффект
Кампания идеологического вмешательства в теорию химического строения
Кампания началась в 1949 году с публикации статьи В. М. Татевского и М. М. Шахпаронова «Об одной махистской теории в химии и её пропагандистах»[13]. В качестве главного объекта нападения была выбрана теория резонанса Л. Полинга. Было объявлено, что «представления о реальной молекуле как о чём-то среднем между двумя (и более) крайними абстрактными структурами являются буржуазными и поэтому направленными против всего самого „святого“». Были указаны и пропагандисты теории Я. К. Сыркин и М. Е. Дяткина — авторы книги «Химическая связь и строение молекул», в которой нашла отражение теория резонанса.
В воздухе очередной раз запахло инквизицией. В этой тревожной обстановке ведущие химики страны собрались на Всесоюзное совещание по проблемам химического строения (1951 г., Москва). Стенограмма этого совещания — один из наиболее позорных документов, когда-либо созданных коллективными усилиями ученых, хранится в химических библиотеках всего мира, и от этого срама бог весть когда ещё удастся отмыться… До крови не дошло — спасла оттепель, начавшаяся весной следующего года. Я. К. Сыркин и М. Е. Дяткина, подготовленные недавними друзьями и коллегами к выдаче в качестве первых козлов отпущения, уцелели; более того Я. К. Сыркин в дальнейшем стал академиком[14].
Лайнус Полинг удостоен в 1954 году Нобелевской премии по химии «за исследование природы химической связи и её применение для определения структуры сложных соединений».
Однако консенсус в теории химического строения не был достигнут. В. М. Татевский в курсе «Строение молекул» (1977 г.) отмечал:
… полностью выпадают и «висят в воздухе» представления уходящих в прошлое, но всё ещё фигурирующих в литературе так называемых «теории резонанса» и «теории мезомерии», которые не имеют основы ни в классической теории химического строения, ни в законных приложениях классической физики к вопросам строения молекул, ни в квантовой механике[15].
Лишь в 1991 году проведён принципиальный анализ кампании по борьбе с теорией резонанса и было показано, что эта кампания «нанесла серьёзный ущерб престижу советской науки»[16].
Атомы в молекулах
В классической теории химического строения понятие атома в молекуле является изначальным. Интуитивно ясно, что атом в молекуле меняется, меняются и его свойства в зависимости от окружения этого атома, прежде всего ближайшего. Основным показателем является расстояние между атомами в молекуле, определяющее как длину химической связи, так и прочность химической связи.
В квантовой теории понятие атома вторично. Так, по утверждению В. М. Татевского, молекула не состоит из атомов: «С современной точки зрения ясно, что при образовании молекулы сохраняются не атомы, а только ядра атомов и электроны»[17].
Было предпринято множество попыток сохранить понятие атома в молекуле, но, тем не менее, практически всегда они не удовлетворяли последующих исследователей по тем или иным причинам.
Одна из наиболее удачных попыток сохранения классической концепции атома в молекуле принадлежит Р. Бейдеру и его сотрудникам[18]. В рамках этой теории (QTAIM) электронная плотность «задаёт некоторое скалярное поле в трёхмерном пространстве, которое может быть охарактеризовано, например, его совокупностью экстремальных точек, линий и поверхностей, особых точек и т. п.»[19].
Таким образом, в квантовой теории атомов в молекулах Р. Бейдера оказывается возможным физическое обоснование ключевых понятий химии «атом», «молекула», «химическая связь» в терминах топологии функции электронной плотности в трёхмерном пространстве и описание химического строения молекул.
Электронная корреляция и конфигурация молекул
Электронная корреляция (взаимная обусловленность движения всех электронов атомной или молекулярной системы как целого определяется электростатическим отталкиванием электронов и статическим особенностями систем, в частности принципом Паули (фермиевская корреляция). Полный учёт электронной корреляции при расчёте энергии и определении электронной структуры системы достигается методом конфигурационного взаимодействия.
Простая и надёжная система правил для понимания и предсказания конфигурации молекул заложена в теории отталкивания электронных пар, наиболее важное правило которой достаточно эмпирично, хотя имеет квантовомеханическое обоснование, заключающееся в принципе Паули, а именно «электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга». При этом конфигурация молекулы будет определяться числом связывающих и неподелённых электронных пар у центрального атома:
- две связывающие электронные пары дают линейную конфигурацию молекулы;
- три — конфигурацию правильного треугольника;
- четыре — конфигурацию тетраэдра;
- пять — тригонально-бипирамидальную конфигурацию;
- шесть — конфигурацию октаэдра.
Наличие неподелённых электронных пар у центрального атома приводит к расширению типов конфигураций молекулы[20].
Строение соединений благородных газов
 Молекула дифторида ксенона
Молекула дифторида ксенона 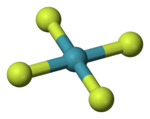 Молекула тетрафторида ксенона
Молекула тетрафторида ксенона  Молекула гексафторида ксенона
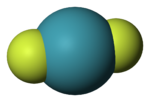
Молекула гексафторида ксенонаОткрытие Н. Бартлеттом в 1962 году первого соединения ксенона положило начало интенсивному развитию химии благородных газов, что привело к получению большого ряда соединений инертных газов и установлению их химического строения.
Оказалось, что все соединения благородных газов имеют обыкновенные ковалентные связи и общепринятые конфигурации молекул. Так, конфигурация молекулы дифторида ксенона линейна: связи ксенон—фтор являются аксиальными и взаимодействуют с тремя неподелёнными электронными парами, находящимися в экваториальных положениях.
В молекуле тетрафторида ксенона осуществляется конфигурация с плоским квадратным расположением лигандов. Неподелённые электронные пары ксенона максимально удалены друг от друга и расположены по разные стороны от этого квадрата.
Структура молекулы гексафторида ксенона представляет собой искажённый октаэдр. «Отклонение атомов фтора от вершин правильного октаэдра указывает на то, что неподелённая электронная пара занимает положение над центром одной из граней октаэдра, а атомы фтора, расположенные в углах этой грани, вынуждены раздвинуться»[20].
Открытие Бартлетта показало ошибочность популярного в то время правила октета,[как?] согласно которому при образовании молекул атомы удовлетворяют свою потребность в достижении 8-электронной валентной оболочки, подобной электронной конфигурации благородных газов за счёт попарного обобществления своих валентных электронов. Оказалось, что атомы благородных газов, имея полностью заполненную валентную оболочку, могут вступать в химические реакции и участвовать в химическом строении молекул.
Строение электронодефицитных соединений
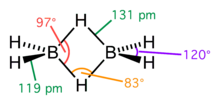
Структурная проблема, связанная с электронодефицитными соединениями, довольно сложна. Фундаментальная трудность заключалась в том, что в молекулах нет достаточного числа валентных электронов для того, чтобы связать все атомы обычными двухэлектронными связями. Так, например, в молекуле диборана имеется двенадцать валентных электронов, все двенадцать нужны для образования ковалентных связей шести атомов водорода с бором, так что для связи атомов бора между собой электронов не остаётся. Сам Полинг допускал, что в диборане функционируют одноэлектронные связи, а молекула в основном состоянии резонирует между семью структурами льюисовского типа, а также между многочисленными структурами, содержащими одноэлектронные связи.
Однако заслуженное признание получили исследования природы химической связи в бороводородах, выполненные американским физикохимиком У. Липскомбом. В его интерпретации в диборане имеют место четыре двух- и две трёхцентровые связи.
Четыре концевые двухцентровые двухэлектронные связи HB лежат в одной плоскости. Два же центральных атома водорода расположены симметрично над этой плоскостью и под нею и объединены с атомами бора двумя трёхцентровыми связями.
В 1976 году Липскомб удостоен Нобелевской премии по химии с формулировкой «за исследование структуры боранов (боргидритов), проясняющих проблему химических связей».
Особенности строения сэндвичевых соединений
Молекула ферроцена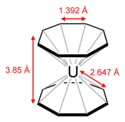
Дальнейшее развитие теории химического строения связано с открытием и установлением структуры ферроцена[21]. Оказалось, что при взаимодействии хлорида двухвалентного железа и циклопентадиена вместо ожидаемого соединения с двумя химическими связями железо-углерод образуется сэндвичеобразное соединение, в котором все 10 атомов углерода соединены с атомом железа.
Рентгеноструктурными исследованиями Э. Фишера установлено, что все атомы углерода в молекуле ферроцена структурно и химически эквивалентны. Атом металла взаимодействует не с одним или двумя конкретными атомами углерода, а со всеми атомами углерода двух циклопентадиенильных колец сразу. Атом металла как бы завис в пространстве между двумя циклами, представленных параллельными правильными пятиугольниками.
В настоящее время получены металлоцены — бициклопентадиенильные соединения переходных металлов для большинства d-элементов.
Сэндвичевые соединения образуются также с использованием в качестве органического фрагмента бензола или циклооктатетраена. Так, например, в ураноцене (см. рисунок) атом урана удерживает два восьмичленных кольца. Все 16 связей уран—углерод в ураноцене идентичны.
В 1973 году Э. Фишер и Дж. Уилкинсон удостоены Нобелевской премии по химии с формулировкой «За новаторскую, проделанную независимо друг от друга, работу в области металлорганических, так называемых сэндвичевых соединений».
Считается, что в сэндвичевых соединениях реализуется многоцентровая связь, тип химической связи, в которой в отличие от двухцентровой двухэлектронной связи, связывающие электронные пары распределены в пространстве трех или большего числа атомных центров молекулы, иона, радикала.[22]
Примечания
- ↑ 1 2 Совещание по теории химического строения в органической химии. Успехи физических наук.. — 1951, октябрь. — Т. XLV, вып. 2. — С. 277—392.
- ↑ Химический энциклопедический словарь / гл. ред. И. Л. Кнунянц. — Сов. энциклопедия, 1983. — С. 652. — 792 с.
- ↑ Butlerow A. Einiges über die chemische Structur der Körper. (Vorgetragen in der chemischen Section der 36. Versammlung deutscher Naturforscher und Aerzte zu Speyer am 19.Septbr.) (нем.) // Zeitschrift für Chemie und Pharmacie : magazin. — 1861. — Bd. 4. — S. 549—560.
- ↑ Бутлеров А. О химическом строении веществ // Учёные записки Казанского университета (отд. физ.-мат. и мед. наук). Вып.1, отд.1. — 1862. — С. 1—11.
- ↑ Бор Н. Избранные научные труды. — М.: «Наука», 1970. — Т. 1. — С. 147. — 584 с.
- ↑ 1 2 3 Коулсон К. Успехи физических наук (статья «Межатомные силы — от Максвелла до Шрёдингера»). — 1963, ноябрь. — Т. LXXXI, вып.3. — С. 545-556.
- ↑ Шусторович Е. М. Химическая связь. Сущность и проблемы.. — М.: «Наука», 1973. — С. 6. — 232 с.
- ↑ Потапов А. А. Ренессанс классического атома. — М.: «Наука», 2011. — С. 352. — 444 с.
- ↑ Ганкин В. Ю., Ганкин Ю. В. Как образуется химическая связь и протекают химические реакции. — М.: «Граница». — С. 65. — 320 с.
- ↑ Паулинг Л. Природа химической связи. — М.-Л.: Химическая литература, 1947. — С. 25—26. — 440 с.
- ↑ Новая иллюстрированная энциклопедия. Пр-Ро. Кн.15. — М.: Большая российская энциклопедия, 2002. — С. 169. — 255 с.
- ↑ Новая иллюстрированная энциклопедия. Ма-Мо. Кн.11. — М.: Большая российская энциклопедия, 2002. — С. 141. — 255 с.
- ↑ Вопросы философии. — 1949. — № 3. — С. 176—192.
- ↑ Охлобыстин О. Ю. Жизнь и смерть химических идей. Очерки по истории теоретической химии.. — М.: Наука, 1989. — С. 184. — 190 с.
- ↑ Татевский В. М. Строение молекул.. — М.: Химия, 1977. — С. 10. — 512 с.
- ↑ Сонин А. С. Печальный юбилей одной кампании. (рус.) // Вестник РАН. — 1991. — Т. 61, № 8. — С. 96—107. Архивировано 5 мая 2010 года.
- ↑ Татевский В. М. Квантовая механика и теория строения молекул. — М.: Издательство МГУ, 1965. — С. 17. — 162 с.
- ↑ Бейдер Р. Атомы в молекулах. Квантовая теория. — М.: Мир, 2001. — 532 с.
- ↑ Степанов Н. Ф. Квантовая механика и квантовая химия. — М.: Мир, 2001. — С. 487. — 519 с.
- ↑ 1 2 Р. Гиллеспи. Геометрия молекул. — М.: Мир, 1975. — 278 с.
- ↑ Несмеянов А.Н. Ферроцен и родственные соединения. Избранные труды 1969 — 1979. — М.: Советская энциклопедия, 1982.
- ↑ Химический Энциклопедический словарь. — М.: Советская энциклопедия, 1983. — 792 с.
Конспект урока на тему «Теория строения химических соединений»
Тема: «Теория строения химических соединений А.М. Бутлерова»
Цель урока: раскрыть представленные теории строения соединений, предложенные предшественниками А.М. Бутлерова; теория радикалов, теория типов; предпосылки создания теории строения химических соединений; закрепить знание основных положений теории химического строения.
Задачи:
Образовательные: формировать понятия о сущности теории химического строения органических веществ, опираясь на знания учащихся об электронном строении атомов элементов, их положении в Периодической системе Д.И. Менделеева, о степени окисления, природе химической связи и о других главнейших теоретических положениях: последовательность расположения атомов углерода в цепи, взаимное влияние атомов в молекуле, зависимость свойств органических веществ от структуры молекул; сформировать представление о ходе развития теорий в органической химии;
Развивающие: развивать мыслительные приемы анализа, сравнения, обобщения; развивать абстрактное мышление; тренировать внимание учащихся при восприятии большого по объему материала; вырабатывать умения анализировать информацию и выделять наиболее важный материал.
Воспитательные: с целью патриотического и интернационального воспитания привести учащимся исторические сведения о жизни и деятельности ученых.
Ход урока
Организационный момент.
– Подготовка учащихся к уроку
– Приветствие
Здравствуйте, ребята. Я рада всех вас видеть на нашем сегодняшнем уроке. На уроке сегодня присутствуют гости, это учителя других школ и студенты ГСГУ. Поздоровайтесь с ними. Присаживайтесь.
Сегодня на уроке мы с вами проверим домашнее задание, а кое-кто из вас выполнит индивидуальное задание. Далее познакомимся с новой темой и выполним теоретические задания по ней. После изучения темы мы выполним задания по новому материалу. При успешном усвоении новой темы напишем небольшую самостоятельную работу и лучшим из вас я поставлю оценку.
После запишем домашнее задание и подведем итог урока.
Проверка домашнего задания
Домашнее задание было из П-6, упр. 4 (письменно).
Пока готовят домашнее задание на доске выполнят индивидуальные задания по карточкам (3 человека)
Индивидуальные задания по карточкам
Задание: определите вид химической связи в молекулах следующих веществH2S –
KCl –
O2 –
Na2S –
N2 –
NH3 –
BaF2 —
Слайд 2. На протяжении нескольких уроков мы с вами проходили химическую связь.
Кто может ответить, что такое химическая связь?
Какие существуют виды химической связи?
Скажите, пожалуйства, а что такое валентность?
А кто может вспомнить, какая валентность у углерода в органических соединениях?
Запасные вопросы: что такое органическая химия.
Сдайте карточки. Я их проверю и оценки за индивидупльное задание вы узнаете на следующем уроке.
А теперь внимательно слушайте ответ. Если у вас будут исправления или дополнения по ответу, вы сможете их сделать после.
Кто может прокомментировать ответ или сделать дополнения? Чтобы вы поставили …за ответ?
Я с вами согласна\не согласна, потому что….
А теперь перейдем к основной части нашего урока. К изучению новой темы.
Тема нашего урока: теория строения химических соединений А.М. Бутлерова.
Пишем число 12 октября 2018 г. Классная работа. Тема урока…
Ручки положили и слушаем меня
Изучение нового материала. Слайд 3.
План урока:
Предшественники А.М. Бутлерова
Становление органической химии. Предпосылки создания теории строения органических соединений.
Основные положения теории строения химических соединений А.М. Бутлерова
Предшественники А.М. Бутлерова
Знания об органических веществах накапливались постепенно еще с глубокой древности, но как самостоятельная наука органическая химия возникла лишь в начале XIX века.
Слайд 4. Теория, объяснявшая образование орг. соединений вмешательством «жизненной силы», получила название витализма. В течение некоторого времени она пользовалась популярностью. В лаборатории удавалось синтезировать лишь самые простые углеродсодержащие вещества, такие как углекислый газ – СО2, карбид кальция – CaC2, цианид калия – KCN. Только в 1828 г. немецкий ученый Вёлер сумел получить органическое вещество мочевину из неорганической соли – цианата аммония – NH4CNO. NH4CNO ––t–> CO(NH2)2
Слайд 5. В 1854 г. французский ученый Бертло получил триглицерид. Это и повлекло за собой необходимость изменения определения органической химии. Ученые пытались на основании состава и свойств разгадать природу молекул органических веществ, стремились создать систему, которая позволила бы связать воедино разрозненные факты, накопившиеся к началу XIX века.
Первая попытка создания теории, стремившейся обобщить имевшиеся об орг. веществах данные, связана с именем французского химика Ж.Дюма. Это была попытка рассмотреть с единой точки зрения довольно большую группу орг. соединений, которые сегодня мы называли бы производными этилена. Орг. соединения оказывались производными некоторого радикала.
Слайд 6. Основные положения теории радикалов:
– в состав органических веществ входят радикалы, несущие на себе положительный заряд;
– радикалы всегда постоянны, не подвергаются изменениям, они без изменений переходят из одной молекулы в другую;
– радикалы могут существовать в свободном виде.
Постепенно в науке накапливались факты, противоречащие теории радикалов. Так Ж.Дюма провел замещение водорода хлором в углеводородных радикалах. Ученым, приверженцам теории радикалов, казалось невероятным, чтобы хлор, заряженный отрицательно, играл в соединениях роль водорода, заряженного положительно. В 1834 г. Ж. Дюма получил задание расследовать неприятное происшествие во время бала во дворце французского короля: свечи при горении выделяли удушливый дым. Ж.Дюма установил, что воск, из которого делались свечи, фабрикант для отбелки обрабатывал хлором. При этом хлор входил в молекулу воска, заменяя часть содержавшегося в ней водорода. Удушливые пары, перепугавшие королевских гостей, оказались хлороводородом (HCl). В дальнейшем Ж.Дюма получил трихлоруксусную кислоту из уксусной.
Таким образом, электроположительный водород заменялся крайне электроотрицательным элементом хлором, а свойства соединения при этом почти не менялись. Тогда Ж.Дюма сделал вывод, что на место дуалистического подхода должен стать подход к орг. соединению как единому целому.
Теория радикалов была постепенно отвергнута, однако она оставила глубокий след в органической химии.
— А кто из вас может предположить какое значение для химии имеет теория радикалов (ответы учащихся).
Правильный ответ: в органическую химию введен термин «радикал»
В 40-х г.г. XIXв. Было положено начало учению о гомологии, позволившему выяснить некоторые отношения между составом и свойствами соединений. Выявлены гомологические ряды, гомологическая разность, что позволило классифицировать органические вещества.
-Давайте вспомним, а что такое гомологический ряд? (ответы учащихся)
Слайд 7. Классификация орг.веществ на основе гомологии привела к возникновению теории типов (40-50-е годы XIX в., Ш. Жерар, А.Кекуле и др.)
– в основу теории положена аналогия в реакциях между органическими и некоторыми неорганическими веществами, принятыми в качестве типов (типы: водород, вода, аммиак, хлороводород и др.). Замещая в типе вещества атомы водорода на другие группы атомов, ученые предсказали различные производные. Например, замещение атома водорода в молекуле воды на радикал метил приводит к возникновению молекулы спирта. Замещение двух атомов водорода – к появлению молекулы простого эфира.
Все орг. вещества считали производными простейших неорганических веществ – водорода, хлороводорода, воды, аммиака.
Слайд 8 Теория типов сыграла большую роль в развитии органической химии:
– позволила предсказать и открыть ряд веществ;
– оказала положительное влияние на развитие учения о валентности;
– обратила внимание на изучение химических превращений органических соединений, что позволило глубже изучить свойства веществ, а также свойства предсказываемых соединений;
– создала совершенную для того времени систематизацию органических соединений.
Не следует забывать, что в действительности теории возникали и сменяли друг друга не последовательно, а существовали одновременно. Химики нередко плохо понимали друг друга.
Ни одна из этих теорий не стала теорией органической химии в полном смысле слова. Нужна была новая теория. Такой теорией стала теория строения химических соединений А.М. Бутлерова.
Становление органической химии. Предпосылки создания теории строения соединений
Слайд 9. Ученые многих стран своими работами подготовили почву для создания теории, объясняющей строение и свойства органических веществ. 
Основные положения теории химического строения А.М. Бутлерова (1861 г.)
А теперь берем ручки и записываем в тетради Основные положения теории химического строения
Слайд 10.
1. Атомы в молекулах соединяются в определенном порядке в соответствии с их валентностью
В соответствии с этими представлениями валентность элементов условно изображают черточками. Такое схематичное изображение строения молекул называют структурными формулами. В этих соединениях углерод четырехвалентен. (Черточка символизирует ковалентную связь, пару электронов).
А теперь откройте учебники на стр. 66,и найдите в тексте какие цепи может образовывать углерод, соединяясь друг с другом. Кто готов поднимите руку.
А теперь выполним задание, которое написано на слайде. Подобные задания вы выполняли в прошлом году. Кто готов написать на доске подмите руку.
Задание: написать стурктурную формулу: 2,3-диметил-3-этилгептен-1
(если нет руки. Давайте разберем вместе). Молодцы! Материал помните.
Слайд 11. Далее в тетради пишем второе положение
2. Свойства веществ зависят не только от их качественного и количественного состава, но и от строения их молекул
Это положение обьясняет явление изомерии.
Кто может вспомнить какие вещества называют изомерами? (ответы учащихся)
А теперь выполним задание, которое вы видите на слайде
Задание: написать изомеры пентана, бутен-1(назвать вид изомерии)
Слайд 12. Внимание на слайд. Записываем третье положение
3. Свойства веществ зависят от взаимного влияния атомов (групп атомов) в молекулах.
Если у вас есть вопросы по основным положениям теории химического строения, то вы можете задать их.
Закрепление пройденного материала
Если вопросов нет, то переходим к закреплению пройденного материала. На слайде вы видите задание. Кто знает ответ поднимите руку. Молодцы
Слайд 13. Задание 1

Слайд 14. Задание 2. Переходим ко второму заданию. В тетрадях запишите сокращенные структурные формулы и укажите какие вещества являются гомологами. Кто сделал встаньте. 5 человек к доске. Проверьте правильность выполненого задания. Если есть вопросы, то задайте их.

Если все понятно, то переходим к самостоятельной работе. На выполнение задания 3 минуты. Кто выполнил работу встаньте.
Положили ручки работа закончена. Проверьте правильность выполннего задания. Критерии оценки сказать. Встаньте те, у кого 5. Присоединитесь к ним те, у кого 4. Вы молодцы, я рада, что помните старый и поняли новый материал, и хорошо поработали на уроке.
Дополнительное задание
Слайд 15. Самостоятельное задание: написать 5 изомеров состава С6Н14. Остальные меняются тетрадями и проверяют по слайду 14 правильность выполненого задания.
Домашнее задание. Слайд 16 я напишу в ЭЖ
П-8 читать и особое внимание уделите основыным положениям теории строения А.М. бутлерова, стр.75, упр.5 письменно в тетради. Откройте его и посмтрите. Есть ли вопросы?
Итог урока. Выставление отметок
Сегодня урок прошел продуктивно, вы хорошо работалию За урок сегодня получили оценки …..
В конце урока я хотела бы, чтобы вы оцели свою работу. При выхоте стоит корзинка с кружками разного цвета: зеленый – я все понял, желтый – были небольшие затруднения, красный –я многое не понял.
Прикрепите кружок на доску, когла бцдите уходить из класса.
Вы молодцы! Урок закончен
Возникновение и развитие теории химического строения
ВОЗНИКНОВЕНИЕ И РАЗВИТИЕ ТЕОРИИ ХИМИЧЕСКОГО СТРОЕНИЯ [c.5]Таким образом, за время первого (подготовительного) периода истории кинетики были намечены основные пути ее развития в XIX в., дано отграничение области химической динамики и созданы предпосылки для возникновения учения о скоростях реакции. Но для развития целенаправленных исследований скоростей реакций нужно было более глубоко исследовать химическую статику (и в первую очередь химические равновесия), уточнить основные химические понятия, разработать теорию химического строения соединений, получить более четкие представления о механизмах реакций. Многие из таких задач были решены во время второго периода истории химической кинетики. [c.146]
Появление новых направлений исследований связи между строением и запахом органических соединений было обусловлена дальнейшим развитием теории химического строения — возникновением стереохимии. [c.128]
Развитие теоретических представлений органической химии в XIX веке до возникновения теории химического строения [c.46]
В этой главе целесообразно рассмотреть не только возникновение классической теории химического строения и развитие ее вплоть до времени появления электронных представлений, но и посвятить специальный параграф историографии этой теории, поскольку до недавнего времени существовали большие разногласия в вопросе о роди различных химиков в ее возникновении и развитии. [c.31]
Стереохимия —учение о пространственном строении молекул. Оно возникло немногим более ста лет назад и по своей сути является развитием бутлеровского учения о химическом строении веществ… — так написано в современном (1964) руководстве по стереохимии Терентьева и Потапова [21, стр. 9]. Можно подумать, что авторы относят возникновение стереохимии к моменту, непосредственно последовавшему за возникновением классической теории химического строения. Однако это не так. Далее [там же, стр. 15] по поводу опытов Пастера (стр. 20) по механическому разделению рацемата винной кислоты на две оптически активные формы можно прочитать Этот опыт Пастера действительно имел необычайно большое значение 1848 г. стал годом рождения новой области науки — стереохимии . [c.61]
До конца XIX в. влияние физики на развитие структурной теории в органической химии носило весьма ограниченный характер, но после открытия электрона (Вихерт, 1897 г.) картина резко изменилась. Классическая теория химического строения, обогащенная теорией сродствоемкости, получила дальнейшее развитие, которое позволяет говорить о возникновении современной теории химического строения. Смысл произошедшего здесь перелома заключается в том, что такие основные понятия теории химического строения, как валентность, химическая связь, взаимное влияние атомов, приобрели вещественность, наполнившись электронным содержанием. [c.348]
Возникновение стереохимических представлений — естественный и закономерный этап в развитии теории химического строения. [c.222]
С середины XIX в. возникают и укрепляются отдельные направления в физической химии. Г. И. Гесс (1836) установил закон постоянства сумм теплот, который способствовал возникновению термохимии. Огромное значение для развития физической химии имело открытие законов термодинамики (Карно, Джоуль, Майер, Клаузиус, Томсон и др.). Гиббсом было создано термодинамическое учение о фазовом и химическом равновесии. Открытие Д. И. Менделеевым периодического закона, создание А. М. Бутлеровым теории химического строения оказали сильное влияние на формирование представлений о взаимосвязи химической природы веществ и их физических свойств. [c.7]
Возникновение во второй половине XIX столетия глубоко материалистической и диалектической по своему существу теории химического строения А. М. Бутлерова подняло органическую химию на новую, высшую ступень. Эта теория не только объяснила весь накопленный до ее возникновения опытный материал, но и дала возможность предсказывать новые факты, новые соединения, а также сознательно выбирать пути синтеза этих соединений. Основные положения теории химического строения надолго определили направление развития органической химии и являются ее незыблемым фундаментом. [c.630]
В настоящей монографии решение вопроса о приоритете вытекает как логическое следствие из рассмотрения истории возникновения и развития классической теории химического строения. Этому вопросу вместе с обзором литературы по истории теории химического строения посвящена заключительная глава. [c.6]
ВОЗНИКНОВЕНИЕ И РАЗВИТИЕ КЛАССИЧЕСКОЙ ТЕОРИИ ХИМИЧЕСКОГО СТРОЕНИЯ [c.31]
Наше отступление в область историографии преследует несколько целей. Во-первых, вопрос об освещении генезиса теории химического строения — это та самая лакмусовая бумажка , с помощью которой можно проверить, основывали ли свои выводы в спорном вопросе историки химии на работе с первоисточниками или же заимствовали уже готовую точку зрения, восходящую к несоответствующему действительности утверждению Л. Мейера и к тому искажению действительности, которое еще раньше допустил сам Кекуле, Из нашего обзора легко увидеть, что, начиная о Вюрца и Ладенбурга, историки химии, даже сами участвовавшие так или иначе в развитии структурной теории, в большинстве своем друг за другом давали неточное ЕЛИ просто неправильное описание ее возникновения и первоначального развития, связанное, как уже давно показал Марковников, с неправильным отождествлением теории химического строения с положениями о валентности и образовании химических связей. Естественно, что даже при неполном изучении первоисточников историки химии наталкивались на факты, противоречившие традиционному взгляду. Особенно наглядно эти противоречия обнаружились у такого превосходного историка химии, как Гребе, [c.46]
К началу 60-х годов XIX в. развитие химии и химического производства достигло относительно высокого уровня. Был накоплен обширный опытный и теоретический материал, который послужил основанием для возникновения теории химического строения. [c.12]
Возникновение теории химического строения знаменовало качественно новый этап в развитии химической науки. Теория А. М. Бутлерова вобрала в себя все то положительное, что имелось у его предшественников. Признав существование радикалов, способных при химических превращениях переходить без изменения из одной молекулы в другую, она отбросила ошибочное, метафизическое положение об абсолютной неизменности, прочности радикалов. В отличие от Д. Дальтона, А. М. Бутлеров признает качест
Дальнейшее развитие теории строения А. М. Бутлерова
Итак, история химии полимеров показывает, что на определенном этапе развития этой области навстречу структурным представлениям и классическим методам органического синтеза направляются кинетические исследования. На основе детального изучения механизма и промежуточных продуктов реакций полимеризации — в частности, радикалов — кинетика дает широкие возможности управления синтезом с доведением процесса до заданных веществ — полимеров, олигомеров или теломеров. Кинетика приступает к решению проблемы, которая длительное время составляла главный предмет структурной химии, — проблемы зависимости свойств вещества от его химического строения. Это, видимо, следует рассматривать как шаг на том нути, который в свое время предвидел Бутлеров Рациональнее всего допустить, — говорил он, — что в дальнейшем развитии химии, с уяснением динамических отношений в химических соединениях, теория химического строения (как менее общая) войдет, как часть, в химическую динамику… [44]. [c.86]Особенно быстро начинает развиваться органическая химия с 60-х годов прошлого столетия, когда А. М. Бутлеров создал теорию химического строения органических соединений, ставшую научной основой для дальнейшего развития исследований в этой области химии. Немаловажную роль сыграли в развитии химической науки развивающиеся буржуазные общественно-экономические отношения, и в первую очередь рост производительных сил. Однако в дореволюционной России химическая промышленность не получила должного развития. Только победа Великой Октябрьской социалистической революции создала в нашей стране благоприятные условия для развития химической науки, и в частности органической химии. За годы советской власти родилась мощная химическая промышленность. Впервые была создана нефте- и газоперерабатывающая промышленность, началось производство пластических масс, искусственных волокон и каучуков. Стала развиваться химия красителей, лекарственных веществ, витаминов и моющих средств. Органические соединения начали применяться практически во всех отраслях промышленности лакокрасочной, фармацевтической, пищевой, топливной, кожевенной, текстильной и др. [c.7]
По вопросу дальнейшего развития теории химического строения Бутлеров писал Само собой разумеется, что, когда мы будем знать ближе натуру химической энергии, самый род атомного движения,— когда законы механики получат и здесь приложение,— тогда учение о химическом строении падет, как падали прежние химические теории, но, подобно большинству этих теорий, оно падет не для того, чтобы исчезнуть, а для того, чтобы войти в измененном виде в круг новых и более широких воззрений . Итак, автор теории химического строения предвидел приложение механики атом-ного мира (т. е. квантовой механики) к его теории. Именно применение квантовой механики к проблемам структуры вещества подняло теорию химического строения Бутлерова на новую, высшую ступень. Только в одном не прав был Бутлеров его теория не пала, а превратилась в общехимическую теорию, являющуюся фундаментом современной химии. [c.12]
Совершенно противоположную позицию в вопросах познания строения молекул занял А. М. Бутлеров. Теоретические представления Бутлерова, понятия его теории химического строения весьма важны для нашего времени и являются прочным фундаментом дальнейшего развития современной органической химии. [c.402]
Основные положения новой теории А. М. Бутлеров сформулировал в статье О химическом строении органических веществ (1861) Исходя от мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определенным количеством принадлежащей ему химической силы (сродства), я называю химическим строением распределение действия этой силы, вследствие которого химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу И далее Химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением . Так по-новому определяет А. М. Бутлеров природу химического вещества. Это принципиальное положение легло в основу дальнейшего развития органической химии. Из него следует, что введенное А. М. Бутлеровым понятие химического строения вещества включает представление о расположении атомов и распределении связей в молекуле, а также о взаимном влиянии отдельных атомов и атомных групп в молекуле. [c.60]
Разрабатывая теорию химического строения, Бутлеров не ста-вил перед собой задачу выяснения природы химической связи, справедливо считая, что химия в то время еще не была готова к решению этой задачи. Действительно, необходимой предпосылкой создания теории химической связи было выяснение строения атома. Лишь после того, как стали известны основные черты электронной структуры атомов, появилась возможность для разработки такой теории. В 1916 г. американский физико-химик Дж. Льюис высказал предположение, что химическая связь возникает путем образования электронной пары, одновременно принадлежащей двум атомам эта идея послужила исходным пунктом для разработки современной теории ковалентной связи. В том же 1916 г. немецкий ученый В. Коссель предположил, что при взан.мо-действии двух атомов один из них отдает, а другой принимает электроны при этом первый атом превращается в положительно заряженный, а второй — в отрицательно заряженный ион взаимное электростатическое притяжение образовавшихся ионов и приводит к образованию устойчивого соединения. Дальнейшее развитие идей Косселя привело к созданию современных представлений [c.119]
Не кто иной как создатель теории химического строения, творец структурных воззрений А. М. Бутлеров указал химии пути ее дальнейшего развития. [c.55]
В России начало систематическим исследованиям непредельных соедине ний положил в 1870 г. великий русский химик, создатель теории строения органических веществ А. М. Бутлеров. Он первый установил способность непредельных углеводородов полимеризоваться под действием хлорида цинка и серной кислоты, положил начало исследованиям механизма полимеризации непредельных соединений, изучая главным образом ди- и тримеры. Дальнейшее развитие исследований непредельных углеводородов принадлежат выдающемуся русскому химику А. Е. Фаворскому. [c.372]
Большое значение для дальнейшего развития теории химического строения получило учение о взаимном влиянии атомов в молекулах соединений. Сама идея взаимного влияния атомов в молекулах фигурировала уже в докладе Бутлерова в 1861 г. В дальнейшем эта идея получила в исследованиях Бутлерова определенное развитие. Бутлеров указал (1863), что атомы в молекулах проявляют различные свойства в зависимости от природы элементов, с которыми они соединены. Так, атом водорода ведет себя совер-гпенно различно (по отношению к реагентам), в зависимости от того, соединен о