Теория органических соединений М.Бутлерова
Тема: Теория строения органических соединений А.М. Бутлерова
Цель: Познакомить учащихся с основными предпосылками создания теории строения органических соединений А. М. Бутлерова. Рассмотреть основные положения теории. Раскрыть значение теории А. М. Бутлерова для органической химии.
Задачи:
Образовательные: изучить предпосылки создания теории химического строения, ее основные положения, зависимость свойств веществ от строения молекулы, значение теории строения для развития науки и жизнедеятельности человека. Углубить основные химические понятия: вещество, химическая реакция.
Развивающие: развивать у учащихся умение сравнивать, анализировать и применять информацию из других областей знаний, развивать коммуникативные способности, умение предъявлять результаты групповой деятельности.
Воспитательные: способствовать воспитанию у учащихся активной жизненной позиции.
УУД
Личностные УУД: личностное, профессиональное самоопределение, смыслообразование
Регулятивные УУД: целеполагание, саморегуляция
Коммуникативные УУД: планирование учебного сотрудничества с учителем и сверстниками — определение цели, функций участников, способов взаимодействия
Познавательные УУД: анализ объектов с целью выделения признаков, структурирование знаний; осознанное и произвольное построение речевого высказывания в устной и письменной форме; выбор наиболее эффективных способов решения задач в зависимости от конкретных условий; подведение под понятие, выведение следствий
Планируемые результаты
Предметные:
Знать: основные положения теории строения органических веществ; что такое химическое строение.
Знать понятия: гомолог, гомологический ряд, изомерия.
Уметь: записывать молекулярные и структурные формулы.
Личностные: формирование ответственного отношения к учению, готовности и способности обучающихся к саморазвитию и самообразованию на основе мотивации к обучению и познанию
Метапредметные: Воспроизведение своими словами правил, понятий, алгоритмов, выполнение действий по образцу, алгоритму
Основные понятия
Теория строения органических веществ. Химическое строение, гомолог, гомологический ряд, изомерия.
Формы организации работы на уроке
Технология. Поисковая технология, технология уровневой дифференциации, проблемное обучение
План урока.
Организационный момент (требования к предмету: тетради, учебники, поведение в кабинете, оборудование кабинета и т. д.)
д.)
Актуализация знаний
Давайте вспомним, на каких основных законах базируется неорганическая химия?
(закон постоянства состава- каким бы способом ни было получено вещество, его химический состав и свойства остаются неизменными., закон сохранения веществ- суммарная масса реагентов равна суммарной массе продуктов реакции.)
Органическая химия также базируется на этих 2х законах, а также на теории строения органических веществ.
Давайте вспомним, что такое вещество, и на какие 2 группы они делятся?
(вид материи с определёнными химическими и физическими свойствами)
(делятся на 2 большие группы, простые и сложные, сложные в свою очередь на неорганические (Соли, кислоты, основания, оксиды), органические (УВ, элементорганические вещества).
Органическая химия есть химия углеводородов и их производных, т. е. продуктов, образующихся при замене водорода другими атомами или группами атомов». Сейчас органическую химию чаще всего называют химией соединений углерода. Почему же из более чем ста элементов Периодической системы Д. И. Менделеева природа именно углерод положила в основу всего живого?
е. продуктов, образующихся при замене водорода другими атомами или группами атомов». Сейчас органическую химию чаще всего называют химией соединений углерода. Почему же из более чем ста элементов Периодической системы Д. И. Менделеева природа именно углерод положила в основу всего живого?
Способность атомов углерода соединяться между собой и давать сложные частицы проявляется во всех углеродистых соединения. Ни в одном из элементов способности к усложнению не развито в такой степени, как в углероде. Ни одна пара элементов не дает столь много соединений, как углерод с водородом.
Многочисленные связи атомов углерода между собой и с атомами других элементов (водорода, кислорода, азота, серы, фосфора), входящих в состав органических веществ, могут разрушаться под влиянием природных факторов. Поэтому углерод совершает непрерывный круговорот в природе: из атмосферы (углекислый газ) – в растения (фотосинтез), из растений – в животные организмы, из живого – в мертвое, из мертвого – в живое…Органические вещества имеют ряд особенностей, которые отличают их от неорганических веществ.
Решающая роль в создании теории строения органических соединений принадлежит великому русскому ученому Александру Михайловичу Бутлерову. 19 сентября 1861 года на 36-м съезде немецких естествоиспытателей А.М.Бутлеров обнародовал ее в докладе «О химическом строении вещества» (слайд 2).
Основными предпосылками, подготовившими почву для возникновения теории химического строения было, учение о валентности.
Дайте определение понятию валентность? (откройте учебник на стр 14), (количество химических связей, которое образует один атом)
В 1853 г. Э. Франкланд ввел понятие о валентности, установил валентность для ряда металлов, исследуя металлоорганические соединения. Постепенно понятие валентности было распространено на многие элементы.
В 1858 г. А. Кекуле предложил считать атом углерода четырехвалентным.
Важным открытием для органической химии явилась гипотеза о способности атомов углерода к образованию цепей (А.
Одной из предпосылок была выработка правильного представления об атомах и молекулах. До 2-й половины 50-х г.г. XIXв. Не было общепризнанных критериев для определения понятий: «атом», «молекула», «атомная масса», «молекулярная масса». Только на международном конгрессе химиков в Карлсруэ (1860 г.) были четко определены эти понятия, что предопределило развитие теории валентности, возникновение теории химического строения.
Изучение нового материала.
Итак, переходим к изучению особенностей строения органических соединений теории Бутлерова.
Основные положения теории.
Атомы в молекулах органических веществ соединены между собой химическими связями в определенной последовательности согласно их валентности. Углерод в органических соединениях всегда четырехвалентен (запись в тетрадь).
Органические вещества можно расположить в ряд сходных по составу, строению и свойствам – гомологов.
Давайте вспомним, что такое гомологи? Вещества, сходные по строению и по свойствам, но отличающиеся друг от друга на группу атомов СН2 – гомологическую разность, называются гомологами. Гомологическим рядом называется ряд веществ, расположенных в порядке возрастания их относительных молекулярных масс, сходных по строению и химическими свойствам, где каждый член отличается от предыдущего на гомологическую разность СН2.
Например метан – родоначальник гомологического ряда предельных углеводородов (алканов). Его ближайший гомолог – этан.
Существует 2 вида записи формулы строения.
Формулы строения:

Например, полная и сокращенная структурные формулы н-бутана C4H10 имеют вид:
Н Н Н Н
׀ ׀ ׀ ׀
Н – С – С – С – С – Н СН3 – СН2 – СН2 – СН3
׀ ׀ ׀ ׀
Н Н Н Н
полная структурная формула сокращенная структурная формула
б) молекулярная (брутто) формула C4H10, показывает только, какие элементы и в каком соотношении входят в состав вещества (т.е. качественный и количественный элементный состав), но не отражает порядка связывания атомов.
Свойства органических веществ зависят не только от их качественного и количественного состава, но и от порядка их расположения атомов в молекуле, т.е. от химического строения молекулы.
Данное положение теории строения органических соединений объясняет явление изомерии.
Давайте вспомним, что такое изомерия?
Способность атомов углерода соединяться в различном порядке друг с другом и с атомами других элементов, обусловливает явление изомерии.
Дайте определение понятию изомеры?
Вещества, имеющие одинаковый количественный и качественный состав молекул, но различное химическое строение и свойства называются изомерами.
Существует два основных типа изомерии – структурная и пространственная
Структурная изомерия определяется различным порядком соединения атомов в молекуле. Различают три вида структурной изомерии:
вид изомерии, связанный с изменение строения углеродной цепи, называется изомерией углеродного скелета (изомерией цепи). Например, пентан имеет следующие изомеры:
С
׀
С – С – С – С – С С — С – С – С С — С – С
׀ ׀
С С
н-пентан, Tкип.= +36°С 2-метилбутан, Ткип. = +27°С 2,2 –диметилпропан, Ткип.= +5°С
= +27°С 2,2 –диметилпропан, Ткип.= +5°С
вид изомерии, связанный с изменением места расположения кратной связи и /или атомов и групп атомов (галогенов, гидроксо-, нитрогрупп и др.), заместивших атомы водорода в углеродной цепи, называется изомерией положения. Например,
СН3 — СН2 – СН= СН2 и СН3 — СН = СН– СН
бутен-1 бутен-2
СН3 — СН2 – СН2-ОН и СН3 — СН – СН3
пропанол-1 ׀
ОН пропанол-2
межклассовая изомерия. Изомеры имеют одинаковую молекулярную формулу, но относятся к разным классам органических соединений. Например, этиловый спирт и диметиловый эфир отвечают формуле С2Н6О:
СН3 — СН2 — ОН СН3 — О — СН3
спирт Tкип. = +78,4°С эфир Tкип.= -23,7°С
= +78,4°С эфир Tкип.= -23,7°С
Пространственная изомерия обусловливается различным расположением атомов и групп атомов в пространстве. Пространственная изомерия подразделяется на: а)геометрическую (цис- и транс-изомерию), она возможна при наличии двойной связи в корне молекулы:
СН3 СН3 СН3 Н
С = С С = С
Н Н Н СН3
цис-изомер транс-изомер
б)оптическая (зерккальная), она возможна при наличии ассиметричного атома углерода (при атоме углерода 4 разных заместителя)
Молекула каждого вещества обладает определенным химическим строением, которое может быть установлено химическими методами.
 Изучая свойства вещества можно определить химическое строение его молекулы, а по строению молекулы — предвидеть свойства вещества.
Изучая свойства вещества можно определить химическое строение его молекулы, а по строению молекулы — предвидеть свойства вещества.Атомы или группы атомов, образующие молекулу, взаимно влияют друг на друга, от чего зависят и химические свойства соединения.
Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.
Закрепление(мин)
Ребята, сегодня мы пытались найти ответы на многие вопросы, которые касаются органических соединений и органической химии. Подведем итог.
Что же изучает органическая химия?
Какие химические вещества называются органическими.
В чем состоит особенность органических соединений?
Какова валентность углерода в органических соединениях?
Какова его степень окисления?
Какое химическое свойство является общим для органических соединений?
Задание на карточках.
Составьте структурные формулы органических веществ.
1 вариант2 вариант
C5H12
C2H6
C7H16
C3H8
Подведение итогов
Рефлексия.
На уроке я узнал…
Мне понравилось…
Не понравилось…
Например, н-бутан и изобутан имеют одну молекулярную формулу C4H10, но разную последовательность связей
Н Н Н Н Н Н Н
׀ ׀ ׀ ׀ ׀ ׀ ׀
Н – С – С – С – С – Н Н – С – С – С – Н
׀ ׀ ׀ ׀ ׀
Н Н Н Н Н — С -Н
׀
н-бутан Н изо-бутан
|
|
«буквограмма. Нормальный бутан и изобутан отличаются
Тип урока: лекция с применением аудиовизуальных средств обучения.
- Познакомить учащихся с предпосылками возникновения теории строения органических веществ, основными положениями теории А.М.Бутлерова. Уметь доказывать эти положения.
- Сформировать понятие об изомерии, изомерах, структурных формулах простейших органических веществ (полные и сокращенные), определять изомеры, гомологи.
- Знать значение теории строения органических веществ и основные направления ее дальнейшего развития, причины многообразия органических веществ.
- Продолжить формирование мировоззренческих понятий: о материальном единстве неорганических и органических веществ, познаваемости природы, причинно-следственной зависимости между строением и свойствами органических веществ.
Оборудование: CD-Rom “Органическая химия. 10-11
классы” (1С, Лаборатория систем мультимедиа,
МарГТУ, 2002г. ), компьютер, проектор, экран, таблицы
“Изомерия”, “Гомология”, набор шаро-стержневых
моделей, штатив с подсветкой и пробирками,
растворы NaOH, HCl, H 2 O, фенолфталеин, метиловый
оранжевый.
), компьютер, проектор, экран, таблицы
“Изомерия”, “Гомология”, набор шаро-стержневых
моделей, штатив с подсветкой и пробирками,
растворы NaOH, HCl, H 2 O, фенолфталеин, метиловый
оранжевый.
Предварительная подготовка учащихся: за 1 неделю до начала урока учащиеся получили следующие задания:
- подготовить библиографическую справку об А.М.Бутлерове.
- составить модели молекул органических веществ из шаро-стержневого набора.
- творческое задание “Противоречия органической химии XIX века”.
Ход урока
Актуализация опорных знаний.
1 ученик у доски: Электронное строение атома углерода, возможные валентности и степени окисления.
2 ученик: обсуждение выполнения домашней работы (ст.149, зад.5).
3, 4 ученики: на листочках выполняют задание №5 стр. 149.
5, 6 ученики: работа по карточкам.
Карточка 1. Составьте структурные формулы следующих веществ: сероводорода, оксида углерода (IV), фосфорной кислоты.
Карточка 2. Составьте структурные
формулы следующих веществ: хлороводорода, оксида
углерода (II), серной кислоты.
Составьте структурные
формулы следующих веществ: хлороводорода, оксида
углерода (II), серной кислоты.
Фронтальная беседа.
- Что такое органическая химия?
- Сколько органических веществ насчитывается на сегодняшний день?
- Какие элементы наиболее часто встречаются в составе органических веществ?
- Основные отличия органических веществ от неорганических.
- Основная мысль теории Витализма.
- Можно ли провести резкую грань между органическими и неорганическими веществами? Почему?
Работа по содержимому CD-ROM
I. Основные положения теории химического строения.
1. Предмет органической химии.
1) Органическая химия как наука.
2) История органической химии.
Ученый И.Я.Берцелиус.
3) Синтез органических веществ.
Ученый Шееле
4) Успехи органического синтеза
Ученые Зинин, Бертло
5) Особенности органических веществ.
6) Гомология.
7) Изомерия.
8) Физические свойства органических веществ.
Учитель подытоживает: Итак, органических веществ число огромно! Значение их трудно переоценить. Органические вещества имеют много особенностей и отличий от неорганических веществ. И начнем мы наше знакомство с ними с теории строения А.М.Бутлерова.
Запишите тему лекции (Смотри Приложение 1 . Презентация к уроку).
Слайд 1. Теория строения органических веществ Александра Михайловича Бутлерова.
Факты без теории – не наука! (А.М.Бутлеров)
Учитель: Какими же фактами обладала наука в XIX веке? Особенности развития органической химии в XIX веке.
Ученик выступает с результатами творческой работы “Основные противоречия химии XIX века” (Смотри Приложение 2. Презентация ученика) .
Слайд 2. Предпосылки возникновения теории строения (Смотри Приложение 1 . Презентация к уроку).
Учитель. Существовало несколько теорий,
которые пытались объяснить отдельные факты, но
целостной теории на то время не было.
Слайд 3. А.М.Бутлеров (1828 — 1886)
Доклад “О химическом строении вещества”ю.
Теория строения органических веществ.
- А.М.Бутлеров (параллельно уч-ся выступают с докладами о его жизни и деятельности)
- 1-е положение
- 2-е положение
- 3-е положение (показ демонстрационного опыта: влияние различных атомов на свойства веществ, содержащих водород: NaOH, HCl, H 2 O, c индикаторами)
- Строение органических веществ (параллельно – показ шаро-стержневых моделей)
- Изомерия (здесь показываем только изомерию углеродного скелета, положение функциональных групп, межклассовая, геометрическая)
Работа с CD-ROM закончена.
Учитель: Так в чем же причина многообразия органических веществ?
Учащиеся высказывают предположения.
Слайд 4. Причины многообразия органических веществ:
- способность атомов углерода образовывать цепи (неразветвленные и разветвленные) и циклы;
- изомерия органических веществ;
- гомология органических веществ
Слайд 5. Значение теории для науки:
Значение теории для науки:
- подтвердила материалистическое понимание природы;
- углубила представление о веществе;
- объяснила и систематизировала накопленные факты;
- дала научную основу для классификации веществ
В конце урока – тестовая работа (тест раздается каждому ученику в отпечатанном виде).
Тест. Введение в органическую химию.
1. Что входит в состав всех органических веществ?
а) кислород;
б) водород;
в) углерод;
г) все перечисленные.
2. Ученый, сформулировавший основные положения теории строения веществ:
а) Семенов;
б) Бутлеров;
в) Фредерик;
г) Кекуле.
3. Простейший представитель углеводородов:
а) метаналь;
б) метан;
в) метанол;
г) метановая кислота.
4. Углерод в органических веществах имеет валентность:
а) 1;
б) 2;
в) 3;
г) 4.
5. К органическим веществам не относится:
а) сероуглерод;
б) углеводород;
в) спирт;
г) эфир.
6. Основной тип химической связи в органических веществах:
а) ковалентная неполярная;
б) ковалентная полярная;
в) водородная;
г) донорно-акцепторная.
7. Гомологическая разность:
а) СН 3 ;
б) СН 4 ;
в) СН 2 ;
г) С 2 Н 6 .
8. Термин “органическая химия” ввел:
а) М.Бертло;
б) Г.Кольбе;
в) А.Бутлеров;
г) И.Берцелиус.
9. Структурные формулы показывают:
а) общее количество атомов в молекуле;
б) количество атомов углерода в молекуле;
в) последовательность соединения атомов в молекуле;
г) расположение атомов в пространстве.
10. Принадлежность к органическим веществам часто можно установить:
а) по выделению СО 2 при их горении;
б) по выпадению осадка при взаимодействии с водой;
в) по цвету;
г) по агрегатному состоянию.
Слайд 6. Ответы:
Слайд 7. Критерии оценок:
- “5” – 10 ответов
- “4” — 8-9 ответов
- “3” — 6-7 ответов
- “2” — до 5 ответов
Слайд 8. Домашнее задание: выучить конспект, § 20.1 – 20.3, составить формулы возможных изомеров вещества С 5 Н 12 , творческие задания.
Слайд 9. Подведение итогов урока, выставление оценок.
5. /Martinova/1 Готовимся к ЕГЭ/Химические элементы.doc
6. /Martinova/2 предпрофильная полготовка/титульный лист.doc
7. /Martinova/2 предпрофильная полготовка/эллективные курсы.doc
8. /Martinova/4 Тренировочные задания/7-8 класс(1)/Вещества и их свойства.doc
9. /Martinova/4 Тренировочные задания/7-8 класс(1)/Физические и химические явления.doc
10. /Martinova/4 Тренировочные задания/7-8 класс(1)/Химические элементы.doc
11. /Martinova/4 Тренировочные задания/9 класс(2)/Химическая кинетика.doc
Тест текущего контроля №1
1. Определил органическую химию как химию углеводородов и их производных
Определил органическую химию как химию углеводородов и их производных
2.Впервые получил мочевину нагреванием раствора ционата аммония
3.Органических веществ известно
4.Валентность и степень окисления кислорода в Н 2 О 2 равны соответственно
1) 2 и -1 2) 2 и -2 3) 2 и 0 4) 1 и -1
5. Синтетическим веществам-катализаторам соответствуют следующие природные вещества:
6.Теорию типов предложил
7.Теория,указывающая на то, что органические вещества образуются под действием «жизненной силы»,-это
имеют валентность четыре
все перечисленные факторы
9.Определите валентность и степень окисления в пропане
1) 3 и +4 2) 4 и -4 3) 4 и -8/3 4) 4 и +8/3
10.Ацетилен С 2 Н 2 и бензол С 6 Н 6 отличаются
качественным составом
процентным содержанием элементов в молекуле
молекулярной массой
всеми перечисленными факторами
Тест текущего контроля №1
Предмет органической химии. Теория химического строения А.М. Бутлерова.
Теория химического строения А.М. Бутлерова.
1.Ввел понятия «органическая химия» и «органические вещества»
1) Шорлеммер 2) Велер 3) Берцелиус 4) Бутлеров
2.Впервые получил щавелевую кислоту гидролизом дициана
1) Кольбе 2) Берцелиус 3) Бутлеров 4) Велер
3.Неорганических веществ известно
1)около 100 млн. 2) около 1 млн. 3)около 100 тыс. 4) около 20 млн.
4.Валентность и степень окисления кислорода в О 2 равны соответственно
1) 2 и +2 2) 2 и -2 3) 2 и 0 4) 0 и 0
5. Синтетическим веществам — пищевым добавкам и стимуляторам роста соответствуют следующие природные вещества:
1) гормоны 3) витамины 3) ферменты 4) белки,жиры,углеводы
6.Теорию радикалов предложил
1) Жерар 2) Берцелиус 3) Франкланд 4) Кекуле
7.Теория,которая делила органические вещества на группы, близкие воде, хлороводороду, аммиаку или другим веществам, -это
1) теория радикалов 2)теория типов 3) структурная теория 4)витализм
8. Многообразие органических веществ связано с тем, что атомы углерода
Многообразие органических веществ связано с тем, что атомы углерода
имеют валентность четыре
способны образовывать разные по кратности связи
способны образовывать связи С-С и создавать цепи и циклы
все перечисленные факторы
9.Определите валентность и степень окисления углерода в бутане
1) 3 и +4 2) 4 и -4 3) 4 и -5/2 4) 4 и +5/2
10.Нормальный бутан и изобутан отличаются
1)количественным составом
2)молекулярной массой
3)порядком соединения атомов в молекуле
4)всеми перечисленными факторами
Вариант 1
1 (3 балла). Элемент, который обязательно входит в состав органических соединений:
А. Кислород. В. Углерод.
Б. Азот. Г. Фосфор.
2 (3 балла). Среди веществ, входящих в состав живой клетки, к органическим веществам не относится:
А. Глюкоза. В. Жир.
Б. Вода. Г. Белок.
3 (3 балла). Ученый, который ввел понятие «органическая химия»:
А. Бутлеров А. В. Велер Ф.
Бутлеров А. В. Велер Ф.
Б. Бертло М. Г. Берцелиус Й.
4 (3 балла). Валентность углерода в органических соединениях равна:
А. I Б. II В. III Г. IV
5 (3 балла). Причиной многообразия органических соединений не является:
А. Явление изомерии.
Б. Способность атомов углерода соединяться друг с другом.
В. Способность атомов углерода образовывать одинарные, двойные и тройные связи.
Г. Способность атомов углерода образовывать аллотропные модификации.
Природа вещества:
Искусственное органическое соединение.
Синтетическое органическое соединение.
Вещество:
А. Ацетатное волокно. В. Лавсан
Б. Капрон. Г. Вискоза. Д. Полиэтилен.
А. 2,2,3 – триметилбутан.
Б. 2,3 – диметил – 5-этилгексан.
В. 2 – этил – 3 –метилпентан.
Тема «Предмет органической химии. Теория строения органических соединений».
Вариант 2
Часть А. Тестовые задания с выбором ответа и на установление соответствия
1 (3 балла). Принадлежность к органическим веществам можно установить:
А. По окраске вещества. В. По растворимости вещества в воде.
По окраске вещества. В. По растворимости вещества в воде.
Б. По продуктам сгорания вещества. Г. По агрегатному состоянию в-ва.
2 (3 балла). Вид химической связи, наиболее характерный для органических соединений:
А. Ковалентная неполярная. В. Ионная.
Б. Ковалентная полярная. Г. Металлическая.
3 (3 балла). Органическим соединением природного происхождения не является:
А. Гемоглобин. В. Мочевина.
Б. Полиэтилен Г. Инсулин.
4 (3 балла). Формулу CH – CH называют:
А. Молекулярной. В. Полной структурной.
Б. Сокращенной структурной. Г. Все ответы верны.
5 (3 балла). Ученый, первым осуществивший синтез щавелевой кислоты из неорганических веществ:
А. Велер Ф. В. Кольбе А.
Б. Бертло М. Г. Бутлеров А.
6 (5 баллов). Установите соответствие.
Раздел химии:
I.Неорганическая химия. II. Органическая химия.
Ученый:
А. Бутлеров А. В. Велер Ф.
Б. Менделеев Д. Г. Ломоносов М.
Открытие:
Периодический закон. 2. Структурная теория строения.
Атомно-молекулярное учение. 4. Синтез мочевины.
Часть Б. Задания со свободным ответом
7 (8 баллов). Напишите структурные формулы соединений, названия которых:
А. 2,4,6 – триметилгептан.
Б. 2 – этилпропан.
В. 2,2 – диметил – 3 – пропилпентан.
8 (8 баллов). Назовите соединения, формулы которых приведены ниже, по систематической номенклатуре:
Тема «Предмет органической химии. Теория строения органических соединений».
Вариант 3
Часть А. Тестовые задания с выбором ответа и на установление соответствия
1 (3 балла). Автор теории строения органических веществ:
А. Менделеев Д. В. Бутлеров А.
Б. Кекуле Ф. Г. Берцелиус Й.
2 (3 балла). Формулу C – C – С называют:
А. Сокращенной структурной. В. Молекулярной.
Б. Полной структурной. Г. Все ответы верны.
3 (3 балла). Элемент, атомы которого способны соединяться друг с другом с образованием цепей:
А. Водород. В. Кислород.
Б. Азот. Г. Углерод.
4 (3 балла). Число всех химических связей в молекуле пропана:
А. 4 Б. 6 В. 8 Г. 10
4 Б. 6 В. 8 Г. 10
5 (3 балла). Изомером бутана является:
А. Пентан. В. Изобутан.
Б. Пропан. Г. Изопентан.
6 (5 баллов). Установите соответствие.
Фамилия ученого:
М. Бертло.
Ф. Велер.
А. Бутлеров.
Г. Кольбе.
Синтезированное вещество:
А. Сахаристое вещество. В. Мочевина.
Б. Жир. Г. Уксусная кислота.
Часть Б. Задания со свободным ответом
7 (8 баллов). Напишите структурные формулы соединений, названия которых:
А. 2,5,5 – триметилоктан.
Б. 2 – метил – 3 – этилбутан.
В. 3,3 – диметилпентан.
8 (8 баллов). Назовите соединения, формулы которых приведены ниже, по систематической номенклатуре:
Приложенные файлы
26.1: Органические соединения и структуры: обзор
Цели обучения
- Распознавать состав и свойства, типичные для органических и неорганических соединений.
- Определять и называть простые (прямоцепочечные) алканы по данным формулам и писать формулы для прямоцепочечных алканов по их названиям.

- Напишите сокращенные структурные формулы алканов, зная полные структурные формулы.
- Нарисуйте формулы линейного угла по структурным формулам.
- Давать названия алканам по системе IUPAC и писать формулы для алканов, которым присвоены названия IUPAC
- Чтобы описать функциональные группы и объяснить, почему они полезны при изучении органической химии.
Ученые 18-го и начала 19-го веков изучали соединения, полученные из растений и животных, и обозначили их как органические , потому что они были выделены из «организованных» (живых) систем. Соединения, выделенные из неживых систем, таких как горные породы и руды, атмосфера и океаны, были обозначены как неорганические .Многие годы ученые считали, что органические соединения могут образовываться только живыми организмами, потому что они обладают жизненной силой, присущей только живым системам. Теория жизненной силы начала приходить в упадок в 1828 году, когда немецкий химик Фридрих Вёлер синтезировал мочевину из неорганических исходных материалов. Он провел реакцию с цианатом серебра (AgOCN) и хлоридом аммония (NH 4 Cl), рассчитывая получить цианат аммония (NH 4 OCN). То, что он ожидал, описывается следующим уравнением.
Он провел реакцию с цианатом серебра (AgOCN) и хлоридом аммония (NH 4 Cl), рассчитывая получить цианат аммония (NH 4 OCN). То, что он ожидал, описывается следующим уравнением.
\[AgOCN + NH_4Cl \rightarrow AgCl + NH_4OCN \label{Eq1}\]
Вместо этого он обнаружил, что продукт представляет собой мочевину (NH 2 CONH 2 ), хорошо известное органическое вещество, которое легко выделяют из мочи.Этот результат привел к серии экспериментов, в которых большое разнообразие органических соединений было получено из неорганических исходных материалов. Теория жизненной силы постепенно ушла в прошлое, когда химики узнали, что они могут создавать многие органические соединения в лаборатории.
Сегодня органическая химия изучает химию соединений углерода, а неорганическая химия изучает химию всех других элементов. Может показаться странным, что мы делим химию на две ветви — одну, которая рассматривает соединения только одного элемента, и другую, которая охватывает более 100 остальных элементов. Однако такое деление представляется более разумным, если учесть, что из десятков миллионов охарактеризованных соединений подавляющее большинство составляют соединения углерода.
Однако такое деление представляется более разумным, если учесть, что из десятков миллионов охарактеризованных соединений подавляющее большинство составляют соединения углерода.
Примечание
Слово органический имеет разные значения. Органические удобрения, такие как коровий навоз, являются органическими в первоначальном смысле; он получен из живых организмов. Органические продукты – это продукты, выращенные без синтетических пестицидов или удобрений. Органическая химия – это химия соединений углерода.
Углерод уникален среди других элементов тем, что его атомы могут образовывать стабильные ковалентные связи друг с другом и с атомами других элементов во множестве вариаций. Образовавшиеся молекулы могут содержать от одного до миллионов атомов углерода. Ранее мы рассмотрели органическую химию, разделив ее соединения на семейства на основе функциональных групп. Мы начнем с простейших членов семейства, а затем перейдем к молекулам, которые являются органическими в первоначальном смысле, то есть они производятся живыми организмами и находятся в них. Эти сложные молекулы (все содержащие углерод) определяют формы и функции живых систем и являются предметом биохимии.
Эти сложные молекулы (все содержащие углерод) определяют формы и функции живых систем и являются предметом биохимии.
Органические соединения, как и неорганические соединения, подчиняются всем законам природы. Часто нет четкого различия в химических или физических свойствах органических и неорганических молекул. Тем не менее полезно сравнить типичные члены каждого класса, как в таблице \(\PageIndex{1}\).
| Органический | Гексан | Неорганический | NaCl | |
|---|---|---|---|---|
| низкая температура плавления | −95°С | высокие температуры плавления | 801°С | |
| низкая температура кипения | 69°С | высокие точки кипения | 1413°С | |
| низкая растворимость в воде; высокая растворимость в неполярных растворителях | нерастворим в воде; растворим в бензине | большая растворимость в воде; низкая растворимость в неполярных растворителях | растворим в воде; нерастворим в бензине | |
| легковоспламеняющиеся | легковоспламеняющийся | негорючий | негорючий | |
| водные растворы не проводят электричество | непроводящий | водные растворы проводят электричество | проводящий в водном растворе | |
| имеют ковалентную связь | ковалентные связи | проявляют ионную связь | ионные связи |
Однако имейте в виду, что для каждой категории в этой таблице есть исключения. Чтобы дополнительно проиллюстрировать типичные различия между органическими и неорганическими соединениями, в таблице \(\PageIndex{1}\) также перечислены свойства неорганического соединения хлорида натрия (обычная поваренная соль, NaCl) и органического соединения гексана (C 6 H 14). ), растворитель, который используется для извлечения соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию определенных типичных свойств, как показано в таблице \(\PageIndex{1}\).
Чтобы дополнительно проиллюстрировать типичные различия между органическими и неорганическими соединениями, в таблице \(\PageIndex{1}\) также перечислены свойства неорганического соединения хлорида натрия (обычная поваренная соль, NaCl) и органического соединения гексана (C 6 H 14). ), растворитель, который используется для извлечения соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию определенных типичных свойств, как показано в таблице \(\PageIndex{1}\).
Углеводороды
Начнем изучение органической химии с углеводородов, простейших органических соединений, которые состоят только из атомов углерода и водорода. Как мы уже отмечали, существует несколько различных видов углеводородов. Они различаются по типу связи между атомами углерода и по свойствам, возникающим в результате этой связи. Углеводороды, имеющие только углерод-углеродные одинарные связи (С-С) и существующие в виде непрерывной цепи атомов углерода, также связанных с атомами водорода, называются алканы (или насыщенные углеводороды). Насыщенный в данном случае означает, что каждый атом углерода связан с четырьмя другими атомами (водорода или углерода) — максимально возможное; в молекулах отсутствуют двойные и тройные связи.
Насыщенный в данном случае означает, что каждый атом углерода связан с четырьмя другими атомами (водорода или углерода) — максимально возможное; в молекулах отсутствуют двойные и тройные связи.
Примечание
Слово насыщенный имеет то же значение для углеводородов, что и для пищевых жиров и масел: молекула не имеет углерод-углеродных двойных связей (C=C).
Ранее мы ввели три простейших алкана — метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ), и они снова показаны на рисунке \( \ИндексСтраницы{1}\).
Рисунок \(\PageIndex{1}\): Три простейших алкана Показанные плоские изображения не точно отображают валентные углы или молекулярную геометрию. Метан имеет тетраэдрическую форму, которую химики часто изображают клиньями, обозначающими связи, выходящие к вам, и пунктирными линиями, обозначающими связи, отходящие от вас. Обычная сплошная линия указывает на связь в плоскости страницы. Напомним, что теория VSEPR правильно предсказывает тетраэдрическую форму молекулы метана (рис. \(\PageIndex{2}\)).
Напомним, что теория VSEPR правильно предсказывает тетраэдрическую форму молекулы метана (рис. \(\PageIndex{2}\)).
Метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются началом ряда соединений, в которых любые два члена в последовательности различаются. одним атомом углерода и двумя атомами водорода, а именно единицей CH 2 . Первые 10 членов этой серии приведены в таблице \(\PageIndex{2}\).
| Имя | Молекулярная формула (C n H 2 n + 2 ) | Концентрированная структурная формула | Число возможных изомеров |
|---|---|---|---|
| метан | СН 4 | СН 4 | — |
| этан | С 2 Н 6 | CH 3 CH 3 | — |
| пропан | С 3 Н 8 | CH 3 CH 2 CH 3 | — |
| бутан | С 4 Н 10 | CH 3 CH 2 CH 2 CH 3 | 2 |
| пентан | С 5 Н 12 | CH 3 CH 2 CH 2 CH 2 CH 3 | 3 |
| гексан | С 6 Н 14 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 | 5 |
| гептан | С 7 Н 16 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 | 9 |
| Октан | С 8 Н 18 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 | 418 |
| нонан | С 9 Н 20 | СН 3 СН 2 СН 2 СН 2 СН 2 СН 2 СН 2 СН | 6 3 9090 235 |
| декан | С 10 Н 22 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 | 75 |
Рассмотрим серию на рисунке \(\PageIndex{3}\). Последовательность начинается с C 3 H 8 , и на каждом шаге вверх по последовательности добавляется единица CH 2 . Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором (здесь группа СН 2 ), называется гомологическим рядом. Члены такого ряда, называемые гомологами , обладают свойствами, которые изменяются регулярным и предсказуемым образом. Принцип гомологии дает организацию органической химии почти так же, как таблица Менделеева дает организацию неорганической химии.Вместо сбивающего с толку множества отдельных соединений углерода мы можем изучить несколько членов гомологического ряда и вывести из них некоторые свойства других соединений этого ряда.
Последовательность начинается с C 3 H 8 , и на каждом шаге вверх по последовательности добавляется единица CH 2 . Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором (здесь группа СН 2 ), называется гомологическим рядом. Члены такого ряда, называемые гомологами , обладают свойствами, которые изменяются регулярным и предсказуемым образом. Принцип гомологии дает организацию органической химии почти так же, как таблица Менделеева дает организацию неорганической химии.Вместо сбивающего с толку множества отдельных соединений углерода мы можем изучить несколько членов гомологического ряда и вывести из них некоторые свойства других соединений этого ряда.
Принцип гомологии позволяет написать общую формулу для алканов: C n H 2 n + 2 .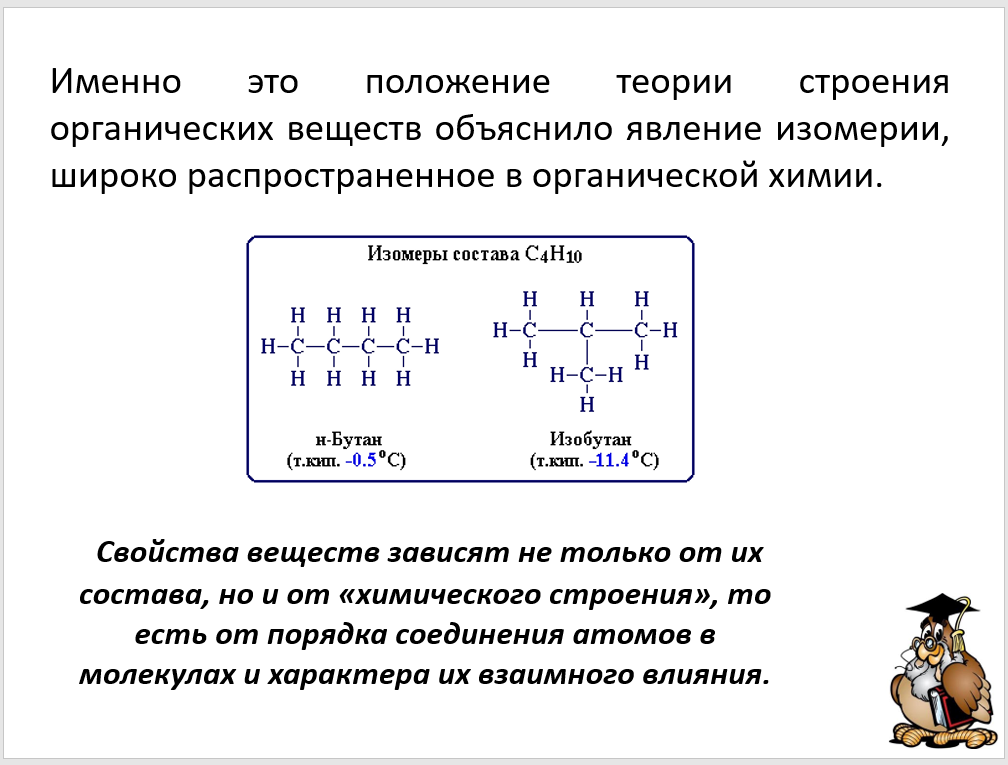 Используя эту формулу, мы можем написать молекулярную формулу любого алкана с заданным числом атомов углерода. Например, алкан с восемью атомами углерода имеет молекулярную формулу C 8 H (2 × 8) + 2 = C 8 H 18 .
Используя эту формулу, мы можем написать молекулярную формулу любого алкана с заданным числом атомов углерода. Например, алкан с восемью атомами углерода имеет молекулярную формулу C 8 H (2 × 8) + 2 = C 8 H 18 .
Мы используем несколько видов формул для описания органических соединений. Молекулярная формула показывает только виды и количество атомов в молекуле. Например, молекулярная формула C 4 H 10 говорит нам о том, что в молекуле 4 атома углерода и 10 атомов водорода, но не различает бутан и изобутан.Структурная формула показывает все атомы углерода и водорода и связывающие их связи. Таким образом, структурные формулы идентифицируют конкретные изомеры, показывая порядок присоединения различных атомов. К сожалению, структурные формулы трудно напечатать/записать и они занимают много места. Химики часто используют сокращенные структурные формулы, чтобы облегчить эти проблемы. В сокращенных формулах атомы водорода показаны рядом с атомами углерода, к которым они присоединены, как показано для бутана:
.
Окончательная сокращенная формула представляет собой формулу линейного угла, в которой атомы углерода подразумеваются в углах и концах линий, и понимается, что каждый атом углерода связан с достаточным количеством атомов водорода, чтобы дать каждому атому углерода четыре связи.Например, мы можем представлять пентан (CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 ) и изопентан [(CH 3 ) 2 CHCH 2 CH 3 ] следующим образом:
Примечание
Скобки в сокращенных структурных формулах указывают на то, что заключенная группа атомов присоединена к соседнему атому углерода.
Номенклатура
Как отмечено в Таблице \(\PageIndex{2}\): число изомеров быстро увеличивается по мере увеличения числа атомов углерода.Имеется 3 пентана, 5 гексанов, 9 гептанов и 18 октанов. Было бы трудно присвоить уникальные индивидуальные имена, которые мы могли бы запомнить. Систематический способ именования углеводородов и других органических соединений был разработан Международным союзом теоретической и прикладной химии (IUPAC). Эти правила, используемые во всем мире, известны как Система номенклатуры IUPAC. (Некоторые из названий, которые мы использовали ранее, такие как изобутан, изопентан и неопентан, не следуют этим правилам и называются общими именами .) Название основы (таблица \(\PageIndex{3}\)) указывает количество атомов углерода в самой длинной непрерывной цепи (LCC). Атомы или группы, присоединенные к этой углеродной цепи, называемые заместителями , затем называются, а их положения обозначаются цифрами. Сейчас мы будем рассматривать только те заместители, которые называются алкильными группами.
Систематический способ именования углеводородов и других органических соединений был разработан Международным союзом теоретической и прикладной химии (IUPAC). Эти правила, используемые во всем мире, известны как Система номенклатуры IUPAC. (Некоторые из названий, которые мы использовали ранее, такие как изобутан, изопентан и неопентан, не следуют этим правилам и называются общими именами .) Название основы (таблица \(\PageIndex{3}\)) указывает количество атомов углерода в самой длинной непрерывной цепи (LCC). Атомы или группы, присоединенные к этой углеродной цепи, называемые заместителями , затем называются, а их положения обозначаются цифрами. Сейчас мы будем рассматривать только те заместители, которые называются алкильными группами.
| Стержень | Номер |
|---|---|
| мет- | 1 |
| эт- | 2 |
| опора- | 3 |
| а- | 4 |
| отложен- | 5 |
| шестигранник- | 6 |
| гепт- | 7 |
| окт- | 8 |
| не | 9 |
| дек- | 10 |
Алкильная группа представляет собой группу атомов, образующуюся при удалении одного атома водорода из алкана. Группа названа путем замены суффикса -ane исходного углеводорода на -yl . Например, группа СН 3 , полученная из метана (СН 4 ), образуется в результате вычитания одного атома водорода и называется метильной группой . Алкильные группы, которые мы будем использовать чаще всего, перечислены в таблице \(\PageIndex{4}\). Алкильные группы не являются независимыми молекулами; это части молекул, которые мы рассматриваем как единое целое, чтобы систематически называть соединения.
Группа названа путем замены суффикса -ane исходного углеводорода на -yl . Например, группа СН 3 , полученная из метана (СН 4 ), образуется в результате вычитания одного атома водорода и называется метильной группой . Алкильные группы, которые мы будем использовать чаще всего, перечислены в таблице \(\PageIndex{4}\). Алкильные группы не являются независимыми молекулами; это части молекул, которые мы рассматриваем как единое целое, чтобы систематически называть соединения.
Упрощенные правила ИЮПАК для обозначения алканов следующие (показаны в примере \(\PageIndex{1}\)).
- Назовите алканы в соответствии с LCC атомов углерода в молекуле (а не общим числом атомов углерода). Этот LCC, считающийся материнской цепью, определяет название основания, к которому мы добавляем суффикс — ан , чтобы указать, что молекула является алканом.
- Если углеводород разветвлен, пронумеруйте атомы углерода LCC.
 Номера присваиваются в том направлении, которое дает наименьшие номера атомам углерода с присоединенными заместителями.Дефисы используются для отделения чисел от названий заместителей; запятые отделяют числа друг от друга. (LCC не нужно писать прямой линией; например, LCC в следующем примере имеет пять атомов углерода.)
Номера присваиваются в том направлении, которое дает наименьшие номера атомам углерода с присоединенными заместителями.Дефисы используются для отделения чисел от названий заместителей; запятые отделяют числа друг от друга. (LCC не нужно писать прямой линией; например, LCC в следующем примере имеет пять атомов углерода.)
- Расположите названия групп заместителей в алфавитном порядке перед названием исходного соединения. Если одна и та же алкильная группа встречается более одного раза, то указываются номера всех атомов углерода, к которым она присоединена.Если одна и та же группа появляется более одного раза у одного и того же атома углерода, номер этого атома углерода повторяется столько раз, сколько появляется группа. Причем количество одинаковых групп обозначается греческими приставками ди -, три -, тетра — и так далее. Эти префиксы , а не учитываются при определении алфавитного порядка заместителей.
 Например, этил указан перед диметилом; di- просто игнорируется. Последняя названная алкильная группа ставится перед названием исходного алкана, образуя одно слово.
Например, этил указан перед диметилом; di- просто игнорируется. Последняя названная алкильная группа ставится перед названием исходного алкана, образуя одно слово.
При соблюдении этих правил каждое уникальное соединение получает собственное эксклюзивное имя. Правила позволяют нам не только называть соединение по заданной структуре, но и рисовать структуру по заданному имени. Лучший способ научиться пользоваться системой IUPAC — это заставить ее работать, а не просто запомнить правила. Это проще, чем кажется.
Пример \(\PageIndex{1}\)
Назовите каждое соединение.
Решение
- LCC имеет пять атомов углерода, поэтому исходным соединением является пентан (правило 1).Ко второму атому углерода пентановой цепи присоединена метильная группа (правило 2). Поэтому название 2-метилпентан.
- LCC имеет шесть атомов углерода, поэтому исходным соединением является гексан (правило 1).
 Метильные группы (правило 2) присоединены ко второму и пятому атомам углерода. Название 2,5-диметилгексан.
Метильные группы (правило 2) присоединены ко второму и пятому атомам углерода. Название 2,5-диметилгексан. - LCC имеет восемь атомов углерода, поэтому исходным соединением является октан (правило 1). Имеются метильная и этильная группы (правило 2), обе присоединены к четвертому атому углерода (если считать от вправо, то дает этому атому углерода меньший номер; правило 3).Таким образом, правильное название – 4-этил-4-метилоктан.
Упражнение \(\PageIndex{1}\)
Назовите каждое соединение.
Пример \(\PageIndex{2}\)
Нарисуйте структуру каждого соединения.
- 2,3-диметилбутан
- 4-этил-2-метилгептан
Решение
При рисовании структур всегда начинайте с родительской цепи.
- Исходной цепью является бутан, что указывает на четыре атома углерода в LCC.
Затем добавьте группы на свои места.
 Вы можете нумеровать родительскую цепочку в любом направлении, если вы непротиворечивы; просто не меняйте направление до того, как структура будет готова. Название указывает на две метильные (CH 3 ) группы, одну на втором атоме углерода и одну на третьем.
Вы можете нумеровать родительскую цепочку в любом направлении, если вы непротиворечивы; просто не меняйте направление до того, как структура будет готова. Название указывает на две метильные (CH 3 ) группы, одну на втором атоме углерода и одну на третьем.Наконец, заполните все атомы водорода, имея в виду, что каждый атом углерода должен иметь четыре связи.
- В данном случае исходной цепью является гептан, что указывает на семь атомов углерода в LCC.
–С–С–С–С–С–С–С–
Добавление групп в соответствующие позиции дает
Заполнение всех атомов водорода дает следующие сокращенные структурные формулы:
Обратите внимание, что облигации (тире) могут быть показаны или нет; иногда они необходимы для расстановки.
Упражнение \(\PageIndex{2}\)
Нарисуйте структуру каждого соединения.
- 4-этилоктан
- 3-этил-2-метилпентан
- 3,3,5-триметилгептан
Функциональные группы
Функциональные группы представляют собой атомы или небольшие группы атомов (от двух до четырех), которые проявляют характерную реакционную способность. Конкретная функциональная группа почти всегда будет демонстрировать свое характерное химическое поведение, когда она присутствует в соединении. Из-за их важности для понимания органической химии функциональные группы имеют характерные названия, которые часто переносятся в названия отдельных соединений, включающих определенные группы.При изучении органической химии чрезвычайно важно уметь быстро распознавать наиболее распространенные функциональные группы, поскольку они являются ключевыми структурными элементами, определяющими реакцию органических молекул. На данный момент мы будем беспокоиться только о рисовании и распознавании каждой функциональной группы, как показано Льюисом и линейными структурами. Большая часть оставшейся части вашего изучения органической химии будет посвящена изучению поведения различных функциональных групп в органических реакциях.
Конкретная функциональная группа почти всегда будет демонстрировать свое характерное химическое поведение, когда она присутствует в соединении. Из-за их важности для понимания органической химии функциональные группы имеют характерные названия, которые часто переносятся в названия отдельных соединений, включающих определенные группы.При изучении органической химии чрезвычайно важно уметь быстро распознавать наиболее распространенные функциональные группы, поскольку они являются ключевыми структурными элементами, определяющими реакцию органических молекул. На данный момент мы будем беспокоиться только о рисовании и распознавании каждой функциональной группы, как показано Льюисом и линейными структурами. Большая часть оставшейся части вашего изучения органической химии будет посвящена изучению поведения различных функциональных групп в органических реакциях.
Ранее мы рассмотрели несколько видов углеводородов. Теперь мы рассмотрим некоторые из множества органических соединений, содержащих функциональные группы. Сначала мы ввели идею функциональной группы, особого структурного расположения атомов или связей, которое придает молекуле характерную химическую активность. Если вы понимаете поведение конкретной функциональной группы, вы многое узнаете об общих свойствах этого класса соединений. В этой главе мы проводим краткое, но систематическое исследование некоторых семейств органических соединений.Каждое семейство основано на общей простой функциональной группе, содержащей атом кислорода или атом азота. Некоторые распространенные функциональные группы перечислены в таблице \(\PageIndex{5}\), а более полный список можно найти здесь.
Сначала мы ввели идею функциональной группы, особого структурного расположения атомов или связей, которое придает молекуле характерную химическую активность. Если вы понимаете поведение конкретной функциональной группы, вы многое узнаете об общих свойствах этого класса соединений. В этой главе мы проводим краткое, но систематическое исследование некоторых семейств органических соединений.Каждое семейство основано на общей простой функциональной группе, содержащей атом кислорода или атом азота. Некоторые распространенные функциональные группы перечислены в таблице \(\PageIndex{5}\), а более полный список можно найти здесь.
Сводка
- Простые алканы существуют в виде гомологического ряда, в котором соседние члены отличаются единицей CH 2 .
- Сокращенные химические формулы показывают атомы водорода (или другие атомы или группы) рядом с атомами углерода, к которым они присоединены.
- Формулы линейного угла подразумевают наличие атома углерода на углах и концах линий.
 Подразумевается, что каждый атом углерода связан с достаточным количеством атомов водорода, чтобы дать каждому атому углерода четыре связи.
Подразумевается, что каждый атом углерода связан с достаточным количеством атомов водорода, чтобы дать каждому атому углерода четыре связи. - Алканы имеют как общие названия, так и систематические названия, установленные IUPAC.
- Функциональная группа, структурное расположение атомов и/или связей, в значительной степени отвечает за свойства семейств органических соединений.
Авторы и авторство
5 Происхождение жизни | Пределы органической жизни в планетарных системах
9 Масиа, Э.2005. Роль фосфора в химической эволюции. Хим. соц. 34:691-701.
10 Мур, К. Б. 1971. Фосфор. Стр. 131–135 в Справочнике по содержанию элементов в метеоритах (Б. Мейсон, изд.). Гордон и Брич, Нью-Йорк.
11 Джойс Г.Ф. и Оргел Л.Е. 1999. Перспективы понимания происхождения мира РНК. Стр. 49–77 в The RNA World, Second Edition (RF Gesteland, TR Cech и JF Atkins, ред. ). Лабораторный пресс Колд-Спринг-Харбор, Колд-Спринг-Харбор, Н.Ю.
). Лабораторный пресс Колд-Спринг-Харбор, Колд-Спринг-Харбор, Н.Ю.
12 Zabinski, R.F., and Toney, M.D. 2001. Ингибирование ионами металлов неферментативного декарбоксилирования и трансаминирования, катализируемого пиридоксальфосфатом. Дж. Ам. хим. соц. 123:193-198.
13 Noller, H. F. 2004. Движущая сила молекулярной эволюции трансляции. РНК 10:1833-1837.
14 Коди Г.Д., Хазен Р.М., Брандес Дж.А., Моровиц Х. и Йодер Х.С. мл. 2001. Геохимические корни автотрофной фиксации углерода: гидротермальные эксперименты в системе лимонной кислоты, H 2 O-( ±FeS)−(±NiS). Геохим. Космохим. Acta 65 (20):3557-3576.
15 Аменд, Дж.П., и Шок, Э.Л. 1998. Энергетика синтеза аминокислот в гидротермальных экосистемах. Наука 281:1659-1662.
16 Чиба, К.Ф. 2000. Энергия для микробной жизни на Европе. Природа 403:381-382.
17 Шапиро, Р. 1984. Невероятность синтеза пребиотических нуклеиновых кислот. Истоки жизни 14:565-570.
Истоки жизни 14:565-570.
18 Шапиро, Р. 1988. Пребиотический синтез рибозы.Критический анализ. Происхождение Life Evol. биосф. 18:71-85.
19 Шапиро, Р. 1995. Пребиотическая роль аденина: критический анализ. Происхождение Life Evol. биосф. 25:83-98.
20 Shapiro, R. 1999. Пребиотический синтез цитозина: критический анализ. Последствия для происхождения жизни. Проц. Натл. акад. науч. США 96:4396-4401.
21 Shapiro, R. 2000. Репликатор не участвовал в происхождении жизни. IUBMB Life 49:173-176.
22 Шапиро, Р. 2006. Взаимодействия малых молекул сыграли центральную роль в происхождении жизни. Q. Rev. Biol. 81:105-125.
23 Джойс Г.Ф. и Оргел Л.Е. 1999. Перспективы понимания происхождения мира РНК. Стр. 49–77 в The RNA World, Second Edition (RF Gesteland, TR Cech и JF Atkins, ред.). Лабораторный пресс Колд-Спринг-Харбор, Колд-Спринг-Харбор, Нью-Йорк,
24 Shapiro, R. 2000. Репликатор не участвовал в происхождении жизни. IUBMB Life 49:173-176.
2000. Репликатор не участвовал в происхождении жизни. IUBMB Life 49:173-176.
25 Boutlerow, A. 1861. Образование моносахаридов из формальдегида [на французском языке]. CR Séances Acad. науч. о. 53:145-147.
26 Breslow, R. 1959. О механизме формозной реакции. Тетраэдр Летт. 21:22-26.
27 Зубай, Г. 1998. Исследования катализируемого свинцом синтеза альдопентоз. Происхождение Life Evol. биосф. 28:13-26.
28 Холлис, Дж. М., Фогель, С.Н., Снайдер, Л.Е., Джуэлл, П.Р., и Ловас, Ф.Дж. 2001. Пространственный масштаб гликолевого альдегида в центре галактики. Астрофиз. Дж. 554:L81-L85.
29 Ларральд Р., Робертсон М.П. и Миллер С.Л. 1995. Скорость разложения рибозы и других сахаров. Последствия для химической эволюции. Проц. Натл. акад. науч. США 92:8158-8160.
30 Нильсен, П.Е. 2004. Технология PNA. Мол. Биотех. 26:233-248.
31 Кэрнс-Смит, А. 1982. Генетический захват и минеральное происхождение жизни. Издательство Кембриджского университета, Кембридж, Великобритания
1982. Генетический захват и минеральное происхождение жизни. Издательство Кембриджского университета, Кембридж, Великобритания
32 Gilbert, W. 1986. Происхождение жизни: мир РНК. Природа 319:618.
33 Рикардо, А., Карриган, М.А., Олкотт, А.Н., и Беннер, С.А. 2004. Боратные минералы стабилизируют рибозу. Наука 303:196.
34 Чжай М. и Шоу Д.М. 1994. Космохимия бора. Часть I: Бор в метеоритах. Метеоритика 29:607-615.
35 Киршвинк Дж. Л., Вайс Б. П. и Бьюкес Н. Дж. 2006. Бор, рибоза и марсианское происхождение земной жизни. Геохим. Космохим. Acta Дополнение 70(18):S320.
36 Чжан, X.V., Мартин, С.Т., Френд, К.М., Шунен, М.А., и Холланд. HD, 2004, Пути синтеза пребиотиков с участием минералов: фотоэлектрохимическое восстановление углерода (+IV) сульфидом марганца, J. Am. хим. соц. 126 (36):11247-11253; Чжан, XV, и Мартин, С.T., 2006, Движущие части цикла Кребса в обратном направлении через фотохимию минералов, J. Am. хим. соц. 128(50):16032-16033.
Am. хим. соц. 128(50):16032-16033.
37 Кэрнс-Смит, А. 1982. Генетический захват и минеральное происхождение жизни. Издательство Кембриджского университета, Кембридж, Великобритания
38 Сегре Д., Бен-Эли Д. и Ланцет Д. 2000. Композиционные геномы: передача пребиотической информации во взаимно каталитических нековалентных ансамблях. Проц. Натл. акад. науч. США 97:4112-4117, с.4112.
39 Сегре Д. и Ланцет Д. 2000. Сочинение жизни. Отчеты EMBO 1:217-222.
40 Чжай М. и Шоу Д.М. 1994. Космохимия бора. Часть I: Бор в метеоритах. Метеоритика 29:607-615.
41 Сегре, Д., и Ланцет, Д. 2000. Сочинение жизни. Отчеты EMBO 1:217-222.
42 Чжай М. и Шоу Д.М. 1994. Космохимия бора. Часть I: Бор в метеоритах. Метеоритика 29:607-615.
43 Сегре, Д., Бен-Эли, Д., и Ланцет, Д. 2000. Композиционные геномы: пребиотическая передача информации во взаимно каталитических нековалентных сборках. Проц. Натл. акад. науч. США 97:4112-4117, с. 4112.
Проц. Натл. акад. науч. США 97:4112-4117, с. 4112.
44 Сегре Д., Бен-Эли Д. и Ланцет Д. 2000. Композиционные геномы: пребиотическая передача информации во взаимно каталитических нековалентных ансамблях. Проц. Натл. акад. науч. США 97:4112-4117.
45 Икин, Р.Э. 1963. Подход к эволюции метаболизма. Проц. Натл. акад. науч. США 40:360-366.
46 Фрай, И. 2000. Возникновение жизни на Земле: научный обзор. Rutgers University Press, Нью-Брансуик, Нью-Джерси
47 Chang, S. 1993. Пребиотический синтез в планетарной среде. Стр. 259-299 в Химия происхождения жизни (Дж. М. Гринберг, К. Х. Мендоса-Гомес и В. Пиранелло, ред.). Kluwer Academic Publishers, Дордрехт, Нидерланды.
48 Димер, Д.В. 1997.Первые живые системы: биоэнергетическая перспектива. Микробиолог. Мол. биол. Откр. 61:239-261.
49 Моровиц, Х. Дж. 1999. Теория биохимической организации, метаболических путей и эволюции.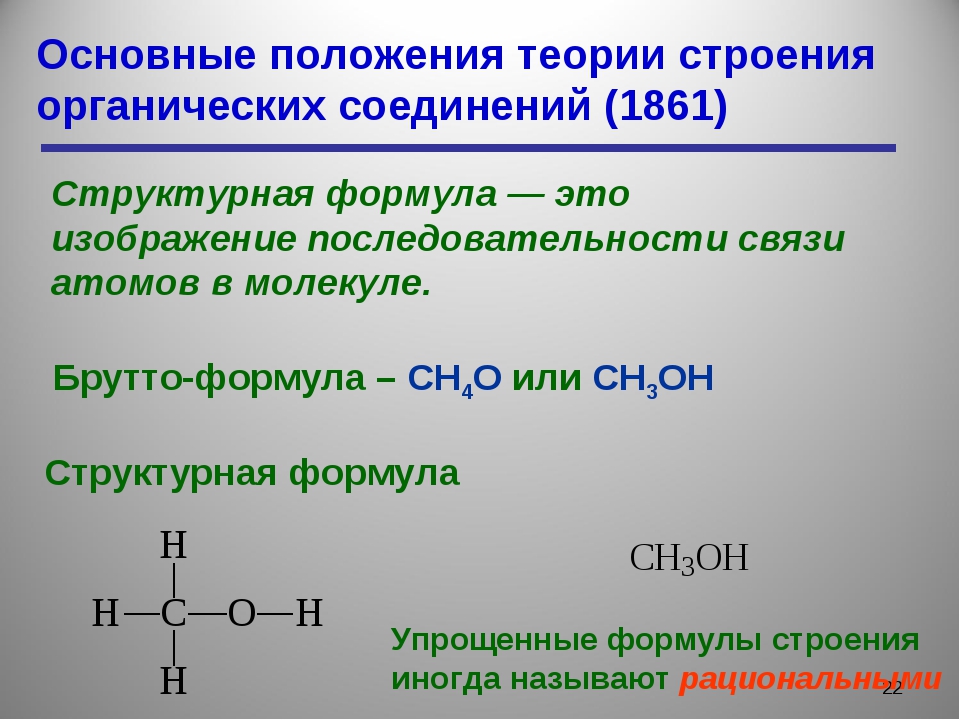 Сложность 4:39-53.
Сложность 4:39-53.
50 Смит Э. и Моровиц Х. 2004. Универсальность промежуточного метаболизма. Проц. Натл. акад. науч. США 101:13168-13173.
51 Холм, Н.Г. 1992. Почему гидротермальные системы предлагаются в качестве вероятной среды для зарождения жизни? Происхождение Life Evol.биосф. 22:5-14.
Органическая химия
CHEM 252 Синтетические методы (F)
(совместно с Chem 152). Обзор реакций, особенно полезных в органической лаборатории. Особое внимание уделяется методам получения углерод-углеродных связей и окислительно-восстановительным последовательностям. Для прохождения курса Chem 252 учащиеся должны будут сдать дополнительный документ и/или сдать экзамен сверх тех, которые ожидаются от студентов, зачисленных на курс Chem 152. Требования: Chem 140C или 140CH (152) или статус выпускника (252).
CHEM 254 Механизмы органических реакций (F)
(совместно с Chem 154; ранее Chem 247). Качественный подход к механизмам различных органических реакций; замещения, присоединения, отщепления, конденсации, перегруппировки, окисления, восстановления, свободнорадикальные реакции и фотохимия. Включает рассмотрение молекулярной структуры и реакционной способности, синтетических методов, спектроскопических инструментов и стереохимии. Подчеркнутые темы будут меняться от года к году.Это первая четверть продвинутой последовательности органической химии. Учащиеся Chem 254 должны будут сдать дополнительный документ и/или сдать экзамен сверх того, что ожидается от студентов Chem 154. Предварительные требования: Chem 140C или 140CH (154) или статус выпускника (254).
Качественный подход к механизмам различных органических реакций; замещения, присоединения, отщепления, конденсации, перегруппировки, окисления, восстановления, свободнорадикальные реакции и фотохимия. Включает рассмотрение молекулярной структуры и реакционной способности, синтетических методов, спектроскопических инструментов и стереохимии. Подчеркнутые темы будут меняться от года к году.Это первая четверть продвинутой последовательности органической химии. Учащиеся Chem 254 должны будут сдать дополнительный документ и/или сдать экзамен сверх того, что ожидается от студентов Chem 154. Предварительные требования: Chem 140C или 140CH (154) или статус выпускника (254).
CHEM 255 Синтез сложных молекул (W)
(вместе с Chem 155.) В этом курсе обсуждается планирование экономических путей синтеза сложных органических молекул. Будет описано использование конкретных реагентов и защитных групп, а также контроль стереохимии во время синтеза.Примеры будут выбраны из недавней литературы. Студенты, изучающие Chem 255, должны будут сдать дополнительный документ и/или сдать экзамен, помимо тех, что ожидаются от студентов, изучающих Chem 155. (Может не предлагаться каждый год.) Предварительные требования: Chem 152 или 252 или согласие преподавателя.
Студенты, изучающие Chem 255, должны будут сдать дополнительный документ и/или сдать экзамен, помимо тех, что ожидаются от студентов, изучающих Chem 155. (Может не предлагаться каждый год.) Предварительные требования: Chem 152 или 252 или согласие преподавателя.
CHEM 256 Структура и свойства органических молекул (W)
(совместно с Chem 156.) Введение в измерение и теоретическую корреляцию физических свойств органических молекул.Охватываемые темы включают молекулярную геометрию, теорию молекулярных орбит, орбитальную гибридизацию, ароматичность, химическую реактивность, стереохимию, инфракрасные и электронные спектры, фотохимию и ядерный магнитный резонанс. Учащиеся Chem 256 должны будут сдать дополнительный документ и/или сдать экзамен сверх того, что ожидается от студентов Chem 156. Предварительные требования: Chem 140C или 140CH (156) или статус выпускника (256).
CHEM 257 Химия биоорганических и натуральных продуктов (S)
(совместно с Chem 157. ) Комплексный обзор современной биоорганической и природной химии. Темы включают биосинтез натуральных продуктов, молекулярное распознавание и взаимодействие малых молекул и биомолекул. Студенты Chem 257 должны будут выполнить дополнительную курсовую работу помимо той, которая ожидается от студентов Chem 157. Предварительные требования: Chem 140C или 140CH (157) или статус выпускника (257).
) Комплексный обзор современной биоорганической и природной химии. Темы включают биосинтез натуральных продуктов, молекулярное распознавание и взаимодействие малых молекул и биомолекул. Студенты Chem 257 должны будут выполнить дополнительную курсовую работу помимо той, которая ожидается от студентов Chem 157. Предварительные требования: Chem 140C или 140CH (157) или статус выпускника (257).
CHEM 258 Прикладная спектроскопия (S)
(совместно с Chem 158.) Интенсивный обзор современных спектроскопических методов, используемых для определения структуры органических молекул.Особое внимание будет уделяться решению проблем и интерпретации спектров. Студенты должны будут написать и представить статью, в которой рассматривается недавняя исследовательская публикация, в которой сообщается об определении структуры природных продуктов спектроскопическими методами. Рекомендуется: один год органической химии с лабораторией.
Единая теория накопления органического вещества
Гетеротрофные организмы потребляют органическое вещество (ОВ) как для получения энергии, так и для синтеза биомассы. Их деятельность превращает большую часть этого обратно в неорганические питательные вещества, которые питают первичное производство.Остаточное органическое вещество накапливается в виде крупных резервуаров в океане, отложениях и почвах. Вместе эти бассейны содержат примерно в пять раз больше углерода, чем атмосфера, и играют центральную роль в глобальной биогеохимии (1). Таким образом, динамика круговорота и накопления органического вещества является ключом к пониманию того, как углеродный цикл меняется в зависимости от климата (1⇓–3).
Их деятельность превращает большую часть этого обратно в неорганические питательные вещества, которые питают первичное производство.Остаточное органическое вещество накапливается в виде крупных резервуаров в океане, отложениях и почвах. Вместе эти бассейны содержат примерно в пять раз больше углерода, чем атмосфера, и играют центральную роль в глобальной биогеохимии (1). Таким образом, динамика круговорота и накопления органического вещества является ключом к пониманию того, как углеродный цикл меняется в зависимости от климата (1⇓–3).
Запасы органического вещества на корню состоят из гетерогенной смеси тысяч соединений, многие из которых не охарактеризованы, с концентрациями, превышающими несколько порядков (4⇓⇓–7).Соединения часто концептуально описываются с точки зрения степени «лабильности», которая коррелирует со скоростью потребления, так что лабильные соединения имеют небольшое количество и короткое время пребывания в окружающей среде (8, 9). В большинстве биогеохимических моделей деградация органического вещества определяется простыми константами скорости, а не явным потреблением динамическими микробными сообществами (10, 11). Хотя был достигнут значительный прогресс в объединении круговорота органического вещества с динамикой микробного сообщества (12⇓⇓⇓⇓–17), нам все еще не хватает механистического понимания механизмов экологического контроля органического вещества и его накопления.
Хотя был достигнут значительный прогресс в объединении круговорота органического вещества с динамикой микробного сообщества (12⇓⇓⇓⇓–17), нам все еще не хватает механистического понимания механизмов экологического контроля органического вещества и его накопления.
Круговорот растворенного органического вещества (РОВ) в океане изучается в течение многих десятилетий, что делает этот резервуар идеальным для разработки механистической основы накопления органического вещества. Для объяснения накопления РОВ в океане были выдвинуты три гипотезы: 1) «Упорство»: соединения могут накапливаться, потому что они относительно медленно разлагаются или устойчивы к дальнейшему разложению микроорганизмами (8, 9, 18, 19). Это согласуется с наблюдениями, теорией и выводами о широком диапазоне скоростей потребления и сложного возраста в океане (20⇓⇓⇓⇓–25), а также в отложениях и почвах (9⇓–11, 26, 27). .2) «Разбавление»: Накопление может представлять собой сумму низких концентраций многих органических соединений, каждое из которых было разбавлено микробами до минимального количества (28). Это подтверждается доказательствами того, что концентрация явно неподатливого РОВ из глубин океана способствует росту микробов (29). Усилия по моделированию позволили согласовать наблюдаемые возрасты углерода с этим механизмом и интерпретировать минимальные концентрации как концентрации ресурсов для существования — минимальные концентрации, до которых население может истощать свои необходимые ресурсы (17, 30).3) «Зависимость от свойств экосистемы»: накопление может быть результатом несоответствия между характеристиками органического вещества и метаболическими способностями ближайшего микробного сообщества (например, субстратной специфичностью ферментов) (31⇓⇓–34). Например, рассредоточение микробных популяций, которое контролируется связностью окружающей среды и может проявляться как стохастический процесс (35), может допускать периодические или спорадические события потребления органического вещества (32, 34). В почвах и отложениях применимы некоторые аспекты этих гипотез, в то время как на накопление ОВ влияют и другие процессы, такие как разнообразные окислительно-восстановительные условия и физико-химическая динамика твердых органических частиц и минеральных матриц.
Это подтверждается доказательствами того, что концентрация явно неподатливого РОВ из глубин океана способствует росту микробов (29). Усилия по моделированию позволили согласовать наблюдаемые возрасты углерода с этим механизмом и интерпретировать минимальные концентрации как концентрации ресурсов для существования — минимальные концентрации, до которых население может истощать свои необходимые ресурсы (17, 30).3) «Зависимость от свойств экосистемы»: накопление может быть результатом несоответствия между характеристиками органического вещества и метаболическими способностями ближайшего микробного сообщества (например, субстратной специфичностью ферментов) (31⇓⇓–34). Например, рассредоточение микробных популяций, которое контролируется связностью окружающей среды и может проявляться как стохастический процесс (35), может допускать периодические или спорадические события потребления органического вещества (32, 34). В почвах и отложениях применимы некоторые аспекты этих гипотез, в то время как на накопление ОВ влияют и другие процессы, такие как разнообразные окислительно-восстановительные условия и физико-химическая динамика твердых органических частиц и минеральных матриц.
Здесь мы исследуем, почему ОВ накапливается, используя стохастическую модель, которая имитирует сложную динамику микробного потребления ОВ. Мы обнаруживаем, что механизмы, лежащие в основе каждой из трех вышеупомянутых гипотез, действуют в модели одновременно. Мы разрабатываем количественное определение функциональной сопротивляемости, которое зависит как от микробного сообщества, так и от условий окружающей среды, а также от характеристик субстрата. Мы демонстрируем способность модели объяснять накопление РОВ в океане.Кроме того, поскольку она основана на основных принципах микробной экологии, мы предполагаем, что эта схема может также распространяться на среду почвы и отложений. Наконец, пороговое поведение индикатора сопротивляемости предполагает нелинейную реакцию ОВ на изменения в окружающей среде.
Механистическая модель потребления ОВ.
Мы разрабатываем модель потребления органического вещества микробными популяциями, используя установленные формы уравнений для микробного роста и дыхания (12, 36, 37).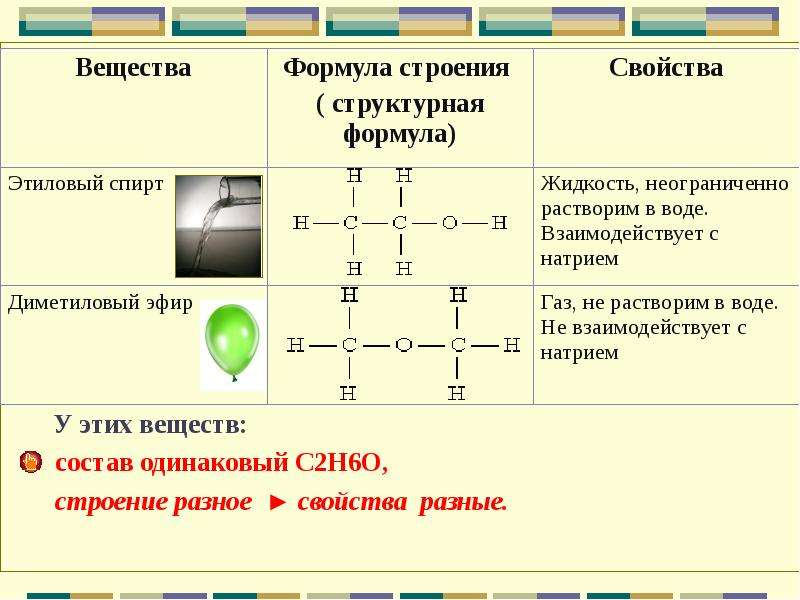 Модель разрешает несколько пулов ОМ (n = 1000), которые поставляются стохастически и потребляются одной или несколькими микробными популяциями (n = 1000 или 2000; уравнения 4 — 6 и рис. 1). Стохастическое снабжение фиксирует изменчивый характер высвобождения органических соединений, который является функцией сложной биологической динамики (например, экссудации, лизиса и выедания). Мы представляем чистое воздействие каждого сложного взаимодействия ОМ-микроб [например, гидролиз, ферментативные скорости, клеточное распределение фермента и свободную энергию, высвобождаемую при окислении ОМ (16, 32, 33, 38)] с упрощенным набором параметров: максимум скорость поглощения, концентрация полунасыщения и выход биомассы ( Материалы и методы ).Чтобы учесть влияние переменного состава сообщества, мы модулируем потребление ОВ каждой популяцией с течением времени в соответствии со стохастически заданной вероятностью ее присутствия. Мы различаем степень «специалистов» (использующих один пул OM) и «универсалов» (использующих несколько пулов OM), включая штраф, который увеличивается с количеством потребляемых пулов, чтобы представить компромисс между стратегиями.
Модель разрешает несколько пулов ОМ (n = 1000), которые поставляются стохастически и потребляются одной или несколькими микробными популяциями (n = 1000 или 2000; уравнения 4 — 6 и рис. 1). Стохастическое снабжение фиксирует изменчивый характер высвобождения органических соединений, который является функцией сложной биологической динамики (например, экссудации, лизиса и выедания). Мы представляем чистое воздействие каждого сложного взаимодействия ОМ-микроб [например, гидролиз, ферментативные скорости, клеточное распределение фермента и свободную энергию, высвобождаемую при окислении ОМ (16, 32, 33, 38)] с упрощенным набором параметров: максимум скорость поглощения, концентрация полунасыщения и выход биомассы ( Материалы и методы ).Чтобы учесть влияние переменного состава сообщества, мы модулируем потребление ОВ каждой популяцией с течением времени в соответствии со стохастически заданной вероятностью ее присутствия. Мы различаем степень «специалистов» (использующих один пул OM) и «универсалов» (использующих несколько пулов OM), включая штраф, который увеличивается с количеством потребляемых пулов, чтобы представить компромисс между стратегиями. Мы варьируем как количество пулов, потребляемых каждой популяцией, так и количество потребителей каждого пула (рис.1; Приложение SI , рис. S1). Темпы потери популяции пропорциональны биомассе в соответствии как с квадратичными, так и с линейными параметрами смертности, имитируя хищничество, лизис вирусов, старение и потребность в обслуживании.
Мы варьируем как количество пулов, потребляемых каждой популяцией, так и количество потребителей каждого пула (рис.1; Приложение SI , рис. S1). Темпы потери популяции пропорциональны биомассе в соответствии как с квадратичными, так и с линейными параметрами смертности, имитируя хищничество, лизис вирусов, старение и потребность в обслуживании.
Схема модели потребления ОМ. Множественные пулы ОВ C и микробные популяции B разрешены. Значения параметров, определяющие снабжение каждого пула ОМ, взаимодействие между каждым пулом и микробной популяцией (кинетика поглощения и выход) и потери биомассы (из-за вирусного лизиса, выпаса, старения и поддержания клеток), назначаются стохастически.Здесь мы показываем наглядный пример, где потоки, определяемые значениями этих параметров, представлены стрелками разной ширины. Предложение и наличие или отсутствие каждой популяции изменяются стохастически с течением времени в модели в соответствии с заданными вероятностями.
Поскольку мы ожидаем, что значения этих параметров роста и смертности будут широко варьироваться среди организмов и субстратов, мы выбираем значения всех параметров из равномерного распределения в широких правдоподобных диапазонах (таблица 1; Приложение SI , Текст SI 1 ). Мы численно интегрируем уравнения вперед во времени, позволяя концентрациям пулов органического вещества возникать в результате экологических взаимодействий. Представленная здесь динамика является устойчивой в пространстве параметров, вариациях структуры модели и вариациях количества пулов и популяций OM ( SI, Приложение , SI, текст 2 и 3 и рис. S2–S7). Последовательное преобразование одного пула ОВ в другой из-за неполного окисления дает качественно сходные растворы ( SI Приложение , SI Текст 2 ), хотя это может увеличить возраст соединения (17).Мы представляем результаты моделирования, интегрированные за 10 лет (рис. 2).
Мы численно интегрируем уравнения вперед во времени, позволяя концентрациям пулов органического вещества возникать в результате экологических взаимодействий. Представленная здесь динамика является устойчивой в пространстве параметров, вариациях структуры модели и вариациях количества пулов и популяций OM ( SI, Приложение , SI, текст 2 и 3 и рис. S2–S7). Последовательное преобразование одного пула ОВ в другой из-за неполного окисления дает качественно сходные растворы ( SI Приложение , SI Текст 2 ), хотя это может увеличить возраст соединения (17).Мы представляем результаты моделирования, интегрированные за 10 лет (рис. 2).
Параметры и их распределения для модели микробного потребления ОВ
Рис. 2. Расчетные концентрации из стохастической модели потребления ОВ. ( A ) Смоделированные концентрации ОВ C и связанная с ними диагностика C*, прожиточные концентрации микробных потребителей (уравнение 2 и Приложение SI , уравнение S18 ) в сравнении с индикатором сопротивления Q (уравнение 3 ). Порог Q=1 (серая пунктирная линия) разграничивает функционально рекальцитрантное (накапливающееся) и функционально лабильное (уравновешенное) ОВ. Мы иллюстрируем скомпилированные результаты двух версий модели, каждая из которых разрешает 1000 пулов OM: одна только с 1000 специализированных микробных популяций, а другая со специализированными и дополнительными 1000 универсальными популяциями, которые потребляют различное количество пулов OM. Мы компилируем 10 симуляций каждой версии модели, так что 10 000 концентраций ОВ лежат в основе иллюстрированной статистики.Красные и светло-красные точки обозначают объединенные в бины средние значения для двух компиляций. Красные и светло-красные столбцы (для модельных решений) и светло-синяя заштрихованная область (для диагностики C*) указывают на 16-й и 84-й процентили (эквивалентно одному стандартному отклонению для распределения Гаусса). Серые точки обозначают 20 000 отдельных концентраций ОВ из обеих компиляций вместе взятых. ( B ) Нормализованные частоты концентраций и их вклады в общий углерод в модели (для версии как со специалистами, так и с универсалами).
Порог Q=1 (серая пунктирная линия) разграничивает функционально рекальцитрантное (накапливающееся) и функционально лабильное (уравновешенное) ОВ. Мы иллюстрируем скомпилированные результаты двух версий модели, каждая из которых разрешает 1000 пулов OM: одна только с 1000 специализированных микробных популяций, а другая со специализированными и дополнительными 1000 универсальными популяциями, которые потребляют различное количество пулов OM. Мы компилируем 10 симуляций каждой версии модели, так что 10 000 концентраций ОВ лежат в основе иллюстрированной статистики.Красные и светло-красные точки обозначают объединенные в бины средние значения для двух компиляций. Красные и светло-красные столбцы (для модельных решений) и светло-синяя заштрихованная область (для диагностики C*) указывают на 16-й и 84-й процентили (эквивалентно одному стандартному отклонению для распределения Гаусса). Серые точки обозначают 20 000 отдельных концентраций ОВ из обеих компиляций вместе взятых. ( B ) Нормализованные частоты концентраций и их вклады в общий углерод в модели (для версии как со специалистами, так и с универсалами). Частоты разделены на Q≈1 (отсечка 1,01).
Частоты разделены на Q≈1 (отсечка 1,01).
Растворы обнаруживают бимодальное распределение концентраций ОВ (рис. 2), что предполагает набор качественно различных регуляторов накопления ОВ. Заметна ли бимодальность, зависит от распределения параметров ( SI Приложение , рис. S13), а также от других источников и поглотителей, не включенных в модель (например, фотолиз). В простой модели большинство пулов истощаются до относительно низких концентраций (от 10-4 до 1 мкМ C), в то время как подмножество накапливается до значительно более высоких концентраций (0.от 1 до 10 мкМ C). Последние накопленные пулы составляют основную часть общего содержания углерода (рис. 2 B ).
Диагностика функциональной сопротивляемости.
Мы оцениваем, уравновешивается ли каждый пул OM в модели или накапливается. Уравновешивание указывает на то, что пул может поддерживать микробную популяцию в данной среде, и мы классифицируем этот пул как «функционально лабильный». В противном случае пул накапливается в окружающей среде, и мы классифицируем этот пул как «функционально неподатливый». Например, мы описываем динамику популяции специалистов j, существующую исключительно за счет пула ОМ i, как ( Материалы и методы ): (t)Bj(t),[1]где Bj — биомасса, Pj — вероятность присутствия популяции j, yij — выход биомассы, ρijmax — максимальная скорость поглощения, kij — концентрация полунасыщения для поглощения , Ci — концентрация пула ОВ, а Lj — скорость убыли популяции, которая варьируется в зависимости от биомассы (уравнение 6 и Таблицу 1). Когда система находится в устойчивом состоянии или близко к нему (∂Bj(t)∂t≈0), концентрацию пула i можно оценить как: Cij*=kijPjyijρijmaxLj−1,[2], что является прожиточным минимумом i для специалистов j (30). Для пула с несколькими конкурирующими потребителями концентрация этого пула будет определяться населением с наименьшей прожиточной концентрацией для этого пула (30). Затем население может продолжать потреблять пул пропорционально его запасу, сохраняя при этом прожиточный минимум (17, 30).
Например, мы описываем динамику популяции специалистов j, существующую исключительно за счет пула ОМ i, как ( Материалы и методы ): (t)Bj(t),[1]где Bj — биомасса, Pj — вероятность присутствия популяции j, yij — выход биомассы, ρijmax — максимальная скорость поглощения, kij — концентрация полунасыщения для поглощения , Ci — концентрация пула ОВ, а Lj — скорость убыли популяции, которая варьируется в зависимости от биомассы (уравнение 6 и Таблицу 1). Когда система находится в устойчивом состоянии или близко к нему (∂Bj(t)∂t≈0), концентрацию пула i можно оценить как: Cij*=kijPjyijρijmaxLj−1,[2], что является прожиточным минимумом i для специалистов j (30). Для пула с несколькими конкурирующими потребителями концентрация этого пула будет определяться населением с наименьшей прожиточной концентрацией для этого пула (30). Затем население может продолжать потреблять пул пропорционально его запасу, сохраняя при этом прожиточный минимум (17, 30).
Для уравновешивания пула ОМ (Cij*>0 в уравнении 2 ) максимальная скорость локального синтеза биомассы (Pjyijρijmax) должна превышать скорость потери биомассы в установившемся режиме (Lj). Используя Cij* в качестве диагностики и распространив выражение на универсальные значения, которые могут потреблять более одного пула OM ( Приложение SI , уравнения S17 и S18 ), мы обнаруживаем, что многие концентрации смоделированных пулов точно соответствуют прожиточного минимума среди их потребителей и, таким образом, уравновесились (рис.2 А ; Приложение SI , рис. С8 и С9). Поскольку эти пулы поддерживают микробный рост в этой конкретной модельной среде, мы считаем их функционально лабильными. Эти низкие концентрации согласуются с измеренными наномолярными или более низкими концентрациями известных лабильных компонентов морского МОВ, таких как свободные аминокислоты и глюкоза (4, 39).
Используя Cij* в качестве диагностики и распространив выражение на универсальные значения, которые могут потреблять более одного пула OM ( Приложение SI , уравнения S17 и S18 ), мы обнаруживаем, что многие концентрации смоделированных пулов точно соответствуют прожиточного минимума среди их потребителей и, таким образом, уравновесились (рис.2 А ; Приложение SI , рис. С8 и С9). Поскольку эти пулы поддерживают микробный рост в этой конкретной модельной среде, мы считаем их функционально лабильными. Эти низкие концентрации согласуются с измеренными наномолярными или более низкими концентрациями известных лабильных компонентов морского МОВ, таких как свободные аминокислоты и глюкоза (4, 39).
Большинство пулов, которые накапливаются до более высоких концентраций, никогда не уравновешиваются в простой модели. Для этих пулов темпы потерь всех потребляющих популяций соответствуют или превышают их максимальные темпы синтеза биомассы. Мы считаем эти пулы функционально неподатливыми. Мы можем надежно определить порог, при котором пулы переходят от функционально лабильных (истощенных до Cij*) к функционально неподатливым (накапливающимся). Мы определяем показатель неподатливости Qi для пула i как: Qi=maxjPjρijmaxLjyij+∑kykjρkjρij︸воздействие других пулов,[3] где индекс k обозначает пул, отличный от пула i, потребляемый универсальным населением j, а ρkj/ρij является относительным поглощением пул k в пул i по совокупности j (см. SI Приложение , SI Text 4 для получения).Для специалистов член, представляющий влияние других пулов, выпадает из уравнения. Если Qi>1, пул i функционально лабилен: по крайней мере, одна популяция может истощить его до концентрации прожиточного минимума при наличии достаточного времени, при этом шкала времени уравновешивания определяется соответствующими параметрами роста и потери. Если Qi≤1, пул i функционально неподатлив и со временем накапливается в нашей модели. Таким образом, Qi=1 служит эмерджентным порогом между функциональной лабильностью и функциональной сопротивляемостью (рис.
Мы считаем эти пулы функционально неподатливыми. Мы можем надежно определить порог, при котором пулы переходят от функционально лабильных (истощенных до Cij*) к функционально неподатливым (накапливающимся). Мы определяем показатель неподатливости Qi для пула i как: Qi=maxjPjρijmaxLjyij+∑kykjρkjρij︸воздействие других пулов,[3] где индекс k обозначает пул, отличный от пула i, потребляемый универсальным населением j, а ρkj/ρij является относительным поглощением пул k в пул i по совокупности j (см. SI Приложение , SI Text 4 для получения).Для специалистов член, представляющий влияние других пулов, выпадает из уравнения. Если Qi>1, пул i функционально лабилен: по крайней мере, одна популяция может истощить его до концентрации прожиточного минимума при наличии достаточного времени, при этом шкала времени уравновешивания определяется соответствующими параметрами роста и потери. Если Qi≤1, пул i функционально неподатлив и со временем накапливается в нашей модели. Таким образом, Qi=1 служит эмерджентным порогом между функциональной лабильностью и функциональной сопротивляемостью (рис. 2).
2).
Индикатор непокорности Ци демонстрирует, как непокорность одновременно определяется химическими, биологическими, экологическими и экологическими характеристиками. В уравнении 3 , фермент-зависимое взаимодействие субстрат-микроб i-j фиксируется как yij, так и ρijmax, которые также отражают энергетическое содержание и доступность ОМ (40⇓-42). Вероятность встречи популяции с пулом ОВ (Pj) и скорость потери биомассы (Lj) отражают экологический контекст — разнообразие и обилие местных микробных популяций, хищников и вирусов.Эти процессы контролируются многими факторами, включая отбор и связь с окружающей средой (35), которая частично определяется физическими условиями, такими как циркуляция и опускание частиц в океане, а также пористость и диффузия в почвах. Разнообразие и связь также влияют на доступность других пулов для использования универсалами. В уравнении 3 , потребление дополнительного пула ОВ k популяцией j может увеличить потенциал популяции по истощению пула i (т. е. Qi увеличивается). Другими словами, способность потребителей пула ОМ i потреблять другие пулы увеличивает функциональную лабильность пула i.Это обеспечивает механистическое объяснение наблюдаемого «эффекта прайминга», при котором добавление других субстратов позволяет метаболизировать данный пул (34, 43, 44).
е. Qi увеличивается). Другими словами, способность потребителей пула ОМ i потреблять другие пулы увеличивает функциональную лабильность пула i.Это обеспечивает механистическое объяснение наблюдаемого «эффекта прайминга», при котором добавление других субстратов позволяет метаболизировать данный пул (34, 43, 44).
В окружающей среде функционально рекальцитрантный пул ОВ может накапливаться или уменьшаться со скоростью, зависящей от производства, потребления и физического транспорта с течением времени, или он может уравновешиваться из-за абиотического, зависящего от концентрации поглотителя, такого как фотолиз (8, 34). ). В варианте модели со многими универсалами Ци достигает минимума единицы (с точностью до 1%) (рис.2 А ). Когда Qi≈1, пулы неуравновешены и функционально неподатливы, но потребление может продолжаться консументами, скорость потерь которых динамически регулируется, чтобы приблизиться к их максимальной скорости биосинтеза.
Непокорность возникает как явление, зависящее от сообщества и контекста, которое может меняться во времени и пространстве ( Приложение SI , рис. S10). Важно отметить, что показатель неподатливости для каждого пула ОМ (Qi) определяется как максимальное из нескольких значений, специфичных для популяции (уравнение 3 ) — по одной для каждой популяции j, потребляющей пул i. Следовательно, является ли каждый пул функционально лабильным или рекальцитрантным, зависит от местного микробного сообщества. Для разнообразного сообщества потребителей мы можем проанализировать долю сообщества, которая считает каждый пул непокорным ( SI, Приложение , рис. S11). Эта зависимость от сообщества подразумевает, что статистически функциональная сопротивляемость может быть более заметной, когда ОМ подвергается воздействию меньшего разнообразия гетеротрофных микроорганизмов.Это также означает, что функциональная сопротивляемость может возникать из-за потребности в специализированных ферментах или дорогостоящих путях потребления для некоторых типов ОМ (45): если требуется специализация, в целом может быть меньше возможных потребителей, и поэтому становится менее вероятным, что какой-либо один потребитель присутствует в данной среде.
S10). Важно отметить, что показатель неподатливости для каждого пула ОМ (Qi) определяется как максимальное из нескольких значений, специфичных для популяции (уравнение 3 ) — по одной для каждой популяции j, потребляющей пул i. Следовательно, является ли каждый пул функционально лабильным или рекальцитрантным, зависит от местного микробного сообщества. Для разнообразного сообщества потребителей мы можем проанализировать долю сообщества, которая считает каждый пул непокорным ( SI, Приложение , рис. S11). Эта зависимость от сообщества подразумевает, что статистически функциональная сопротивляемость может быть более заметной, когда ОМ подвергается воздействию меньшего разнообразия гетеротрофных микроорганизмов.Это также означает, что функциональная сопротивляемость может возникать из-за потребности в специализированных ферментах или дорогостоящих путях потребления для некоторых типов ОМ (45): если требуется специализация, в целом может быть меньше возможных потребителей, и поэтому становится менее вероятным, что какой-либо один потребитель присутствует в данной среде. Это согласуется с данными о том, что определенные гетеротрофные клады потребляют алициклические молекулы, богатые карбоксильными группами, которые составляют значительную часть (до 8%) морского DOC (6, 46).
Это согласуется с данными о том, что определенные гетеротрофные клады потребляют алициклические молекулы, богатые карбоксильными группами, которые составляют значительную часть (до 8%) морского DOC (6, 46).
Объединение гипотез.
Три текущие гипотезы накопления РОВ в океане — непокорность, разбавление и зависимость от свойств экосистемы — объясняют аспекты общего количества углерода в модели. Дополнительные процессы, такие как минеральная защита и различные окислительно-восстановительные условия почв и отложений, также могут быть включены в структуру, чтобы изменить ее для этих других систем. Мы можем рассматривать каждую гипотезу в отдельности как предельный случай образования больших резервуаров органического углерода в природных условиях.Общее содержание органического углерода представляет собой сумму всех пулов ОВ. Традиционный взгляд на сопротивляемость, сфокусированный на внутренних качествах субстрата или реакции, специфичной для микроба и субстрата, представлен в модели выходом биомассы yij и максимальной скоростью поглощения ρijmax. Качество акцептора электронов или минеральной защиты также может быть представлено этими параметрами. Когда yijρijmax становится малым, а другие параметры остаются постоянными, органическое вещество становится неподатливым (уравнение 3 ), а общий пул органического углерода становится большим.Количество присутствующих пулов органического вещества n может влиять на общий объем углерода двумя противоположными способами. По мере увеличения n общее количество углерода увеличивается даже при низких уравновешенных жизненных концентрациях (гипотеза разбавления). Однако влияние других пулов ОМ (прайминг) означает, что по мере увеличения n вероятность Qi>1 увеличивается, что снижает вероятность функциональной неподатливости и, таким образом, потенциально снижает общий углерод. Зависимость от свойств экосистемы заключена в стационарной скорости гибели популяции Lj и вероятности присутствия Pj.По мере увеличения Lj органическое вещество становится неподатливым, а общий углерод увеличивается.
Качество акцептора электронов или минеральной защиты также может быть представлено этими параметрами. Когда yijρijmax становится малым, а другие параметры остаются постоянными, органическое вещество становится неподатливым (уравнение 3 ), а общий пул органического углерода становится большим.Количество присутствующих пулов органического вещества n может влиять на общий объем углерода двумя противоположными способами. По мере увеличения n общее количество углерода увеличивается даже при низких уравновешенных жизненных концентрациях (гипотеза разбавления). Однако влияние других пулов ОМ (прайминг) означает, что по мере увеличения n вероятность Qi>1 увеличивается, что снижает вероятность функциональной неподатливости и, таким образом, потенциально снижает общий углерод. Зависимость от свойств экосистемы заключена в стационарной скорости гибели популяции Lj и вероятности присутствия Pj.По мере увеличения Lj органическое вещество становится неподатливым, а общий углерод увеличивается. По мере того, как частота ближайших потребителей уменьшается, Pj уменьшается, увеличивая общее количество углерода.
По мере того, как частота ближайших потребителей уменьшается, Pj уменьшается, увеличивая общее количество углерода.
Таким образом, степень, в которой каждый механизм контролирует накопление ОВ в различных средах, зависит от пространства параметров, задающего характеристики популяции и ОВ. Здесь мы предполагаем равномерное распределение этих параметров, используя правдоподобные диапазоны для океана (Таблица 1; Приложение SI , Текст SI 1 ).Эти диапазоны будут варьироваться в зависимости от окружающей среды. Например, если стохастичность присутствия популяции не применима к данной экосистеме отложений, то вероятность присутствия P может быть установлена равной единице для анализа этой среды. Модель согласуется с моделью исх. 17 в том, что внутренняя сопротивляемость не является необходимой для накопления органического вещества в океане, а также с экспериментальными доказательствами потребления в ограниченном разбавлении ( SI Приложение , SI Текст 5 и рис. S12) (29). Здесь мы предоставляем обобщенную структуру, которая включает в себя более полный набор динамики, чем в ссылке.17 — тот, который также согласуется с доказательствами непокорности (8, 18, 19) и влияния микробного сообщества (31, 33, 34, 45, 46). Возникающие распределения скоростей разложения органического вещества согласуются с теорией и наблюдениями о том, что скорости реминерализации распределены логнормально в широком диапазоне из-за мультипликативной стохастичности в основных процессах (27) ( SI Приложение , рис. S13). Они также согласуются с континуальными моделями внутренней реактивности, которые предполагают широкое распределение скоростей (10, 11), стремящееся к логнормальному распределению (47).
S12) (29). Здесь мы предоставляем обобщенную структуру, которая включает в себя более полный набор динамики, чем в ссылке.17 — тот, который также согласуется с доказательствами непокорности (8, 18, 19) и влияния микробного сообщества (31, 33, 34, 45, 46). Возникающие распределения скоростей разложения органического вещества согласуются с теорией и наблюдениями о том, что скорости реминерализации распределены логнормально в широком диапазоне из-за мультипликативной стохастичности в основных процессах (27) ( SI Приложение , рис. S13). Они также согласуются с континуальными моделями внутренней реактивности, которые предполагают широкое распределение скоростей (10, 11), стремящееся к логнормальному распределению (47).
Прогнозирование закономерностей накопления ОМ.
Наша структура может помочь объяснить крупномасштабные модели накопления органического вещества. Здесь мы используем нашу модель, чтобы понять вертикальную структуру растворенного органического углерода (РОУ) в океане. В глобальном масштабе концентрации DOC достигают максимума на поверхности моря и приближаются к минимуму на глубине (рис. 3 A ) (8). Поскольку стохастическая модель непригодна для многомерных биогеохимических моделей, мы используем аналог модели пониженной сложности, который отражает суть стохастической модели, разрешая 25 совокупных пулов.Мы включили этот аналог модели в полностью динамическую модель экосистемы стратифицированной морской водной толщи, где производство и потребление всех органических и неорганических пулов механически разрешаются как рост, дыхание и смертность фотоавтотрофных и гетеротрофных микробных популяций ( SI Приложение ). , СИ Текст 6 и рис. S14). Модель интегрирована для 6000 лет до квазиравновесия ( Приложение SI , Текст SI 6 ).
В глобальном масштабе концентрации DOC достигают максимума на поверхности моря и приближаются к минимуму на глубине (рис. 3 A ) (8). Поскольку стохастическая модель непригодна для многомерных биогеохимических моделей, мы используем аналог модели пониженной сложности, который отражает суть стохастической модели, разрешая 25 совокупных пулов.Мы включили этот аналог модели в полностью динамическую модель экосистемы стратифицированной морской водной толщи, где производство и потребление всех органических и неорганических пулов механически разрешаются как рост, дыхание и смертность фотоавтотрофных и гетеротрофных микробных популяций ( SI Приложение ). , СИ Текст 6 и рис. S14). Модель интегрирована для 6000 лет до квазиравновесия ( Приложение SI , Текст SI 6 ).
, показывающие накопление РОУ.( A ) Биомасса фитопланктона, общая потребляющая DOC биомасса B и общая DOC.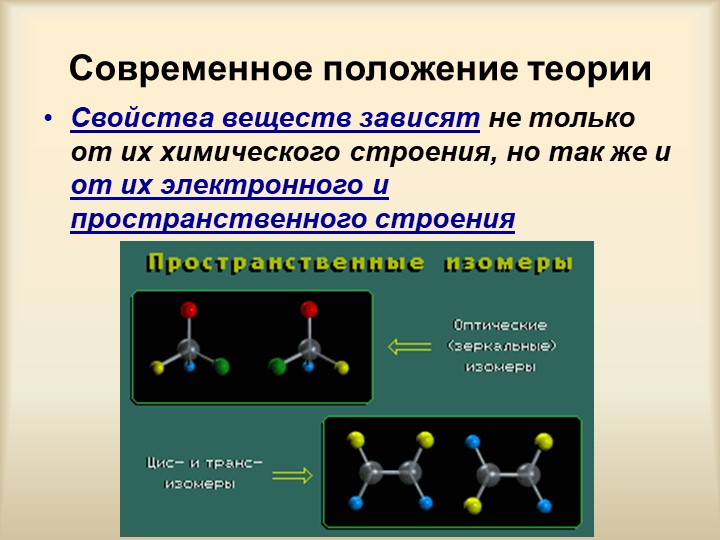 Проиллюстрированы среднегодовые профили общего DOC для двух станций временных рядов в открытом океане: HOT (временной ряд Гавайских островов в Тихом океане) и BATS (станция временного ряда Bermuda Atlantic в Атлантическом океане) (50). ( B ) Концентрация каждого из 25 выделенных пулов DOC, которые различаются в модели водного столба по максимальной скорости поглощения ρmax (цветовая шкала). Каждый пул классифицируется как функционально лабильный (сплошная линия) или функционально неподатливый (пунктирная линия) в зависимости от глубины с использованием индикатора неподатливости Q (уравнение 3 ). ( C ) Максимальная (максимальная) (поверхностная) концентрация C каждого пула DOC и связанная с ним диагностическая C*, прожиточная концентрация микробной популяции потребителей (уравнение 2 ), построенная в зависимости от максимальной скорости поглощения для этого бассейн. ( D ) Время оборота каждого пула DOC, рассчитанное диагностическим путем на основе интегрированной концентрации и интегрированной скорости потребления, нанесенных на график в зависимости от максимальной скорости поглощения.
Проиллюстрированы среднегодовые профили общего DOC для двух станций временных рядов в открытом океане: HOT (временной ряд Гавайских островов в Тихом океане) и BATS (станция временного ряда Bermuda Atlantic в Атлантическом океане) (50). ( B ) Концентрация каждого из 25 выделенных пулов DOC, которые различаются в модели водного столба по максимальной скорости поглощения ρmax (цветовая шкала). Каждый пул классифицируется как функционально лабильный (сплошная линия) или функционально неподатливый (пунктирная линия) в зависимости от глубины с использованием индикатора неподатливости Q (уравнение 3 ). ( C ) Максимальная (максимальная) (поверхностная) концентрация C каждого пула DOC и связанная с ним диагностическая C*, прожиточная концентрация микробной популяции потребителей (уравнение 2 ), построенная в зависимости от максимальной скорости поглощения для этого бассейн. ( D ) Время оборота каждого пула DOC, рассчитанное диагностическим путем на основе интегрированной концентрации и интегрированной скорости потребления, нанесенных на график в зависимости от максимальной скорости поглощения.
Экологические взаимодействия в модели приводят к характеристикам, типичным для морской толщи воды (рис.3; Приложение SI , рис. S15). Смоделированный РОУ скапливается по всей толще воды. Общий DOC плавно уменьшается с глубиной, при этом более высокий поверхностный DOC переносится на глубину за счет вертикального перемешивания (рис. 3 A ). Большинство бассейнов истощены до прожиточного минимума по всей толще воды (рис. 3 B и C ). Один пул остается функционально неподатливым во всей толще воды из-за медленного расхода (самая светлая желтая линия на рис. 3 B ), что согласуется с наблюдаемым однородным составом старого морского DOC (7, 48).
Многие залежи РОУ в модели накапливаются на поверхности и истощаются на глубине от 500 до 1000 м. Этот переход обусловлен увеличением добротности этих бассейнов от поверхности к глубине (рис. 3 B ). В частности, темпы потери популяций самые высокие на поверхности и затухают с глубиной. Это связано с тем, что пик продуктивности приходится на поверхность, и поэтому общая биомасса, уровень активности и, следовательно, уровень хищничества (неявно представленный в модели; уравнение 6 ) также достигают максимума на поверхности.Прожиточные концентрации для функционально лабильных пулов также уменьшаются с глубиной по мере снижения темпов потерь, и, таким образом, общая концентрация функционально лабильного органического вещества также уменьшается с глубиной, внося небольшой вклад в вертикальный градиент DOC. Таким образом, экологически детерминированный переход от функциональной сопротивляемости к функциональной лабильности для некоторых пулов во многом объясняет снижение DOC с глубиной. Этот переход согласуется с наблюдениями о том, что подгруппа DOC устойчива к потреблению поверхностными сообществами, но способна реминерализоваться глубинными сообществами (31).
Это связано с тем, что пик продуктивности приходится на поверхность, и поэтому общая биомасса, уровень активности и, следовательно, уровень хищничества (неявно представленный в модели; уравнение 6 ) также достигают максимума на поверхности.Прожиточные концентрации для функционально лабильных пулов также уменьшаются с глубиной по мере снижения темпов потерь, и, таким образом, общая концентрация функционально лабильного органического вещества также уменьшается с глубиной, внося небольшой вклад в вертикальный градиент DOC. Таким образом, экологически детерминированный переход от функциональной сопротивляемости к функциональной лабильности для некоторых пулов во многом объясняет снижение DOC с глубиной. Этот переход согласуется с наблюдениями о том, что подгруппа DOC устойчива к потреблению поверхностными сообществами, но способна реминерализоваться глубинными сообществами (31).
Наша схема также может быть использована для исследования микробного контроля ОВ в почвах и отложениях.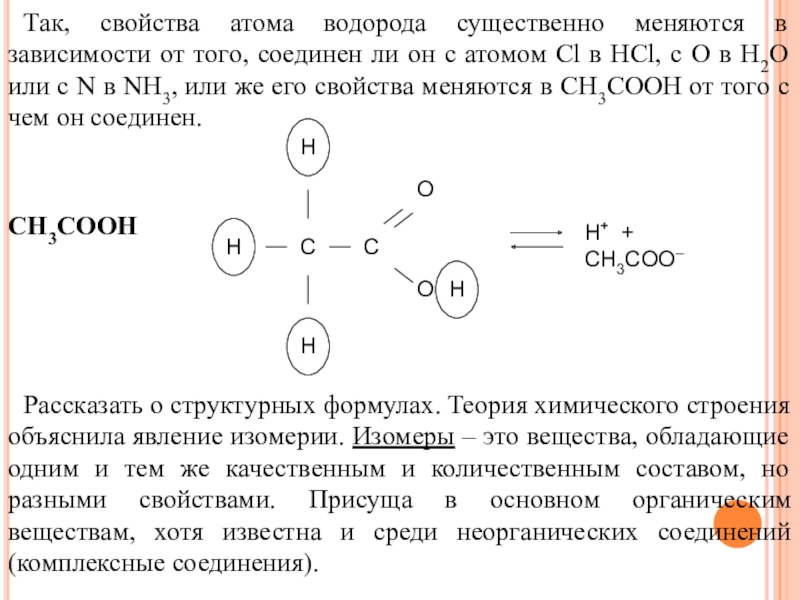 Модель может быть адаптирована для учета различных характеристик этих сред. Например, здесь мы используем простую параметризацию для запаса каждого класса органического вещества, но версия модели отложений или почвы может включать более сложные описания того, как физика и химия твердых частиц и минеральных матриц влияют на скорость поступления. Хотя кинетика поглощения Михаэлиса-Ментен не применима к катализируемому ферментами расщеплению полимерных органических соединений до мономерных соединений, экологические принципы нашей схемы должны оставаться в силе ( SI Приложение , SI Текст 7 ).Действительно, мы обнаруживаем, что даже в ее нынешнем виде простая модель фиксирует ключевое наблюдение за ОВ отложений: пропорциональное увеличение скорости разложения ОВ с увеличением концентрации ОВ (49) ( SI Приложение , рис. S16). Это еще раз демонстрирует согласованность с предсказаниями установленных моделей кинетического разложения первого порядка (12, 49). Наша схема также может быть использована для изучения влияния более ферментативно разнообразных осадочных сообществ по сравнению с пелагическими сообществами на накопление органического вещества (33) путем изменения матрицы потребления сообщества, чтобы включить большую степень универсальных способностей.
Модель может быть адаптирована для учета различных характеристик этих сред. Например, здесь мы используем простую параметризацию для запаса каждого класса органического вещества, но версия модели отложений или почвы может включать более сложные описания того, как физика и химия твердых частиц и минеральных матриц влияют на скорость поступления. Хотя кинетика поглощения Михаэлиса-Ментен не применима к катализируемому ферментами расщеплению полимерных органических соединений до мономерных соединений, экологические принципы нашей схемы должны оставаться в силе ( SI Приложение , SI Текст 7 ).Действительно, мы обнаруживаем, что даже в ее нынешнем виде простая модель фиксирует ключевое наблюдение за ОВ отложений: пропорциональное увеличение скорости разложения ОВ с увеличением концентрации ОВ (49) ( SI Приложение , рис. S16). Это еще раз демонстрирует согласованность с предсказаниями установленных моделей кинетического разложения первого порядка (12, 49). Наша схема также может быть использована для изучения влияния более ферментативно разнообразных осадочных сообществ по сравнению с пелагическими сообществами на накопление органического вещества (33) путем изменения матрицы потребления сообщества, чтобы включить большую степень универсальных способностей. Кроме того, изменение выхода или скорости поглощения с помощью акцепторов электронов может включать в модель различные окислительно-восстановительные условия. Снижение выхода с акцептором электронов более низкого качества может свидетельствовать о том, что некоторые типы ОМ функционально лабильны при наличии кислорода, но функционально неподатливы в бескислородной среде.
Кроме того, изменение выхода или скорости поглощения с помощью акцепторов электронов может включать в модель различные окислительно-восстановительные условия. Снижение выхода с акцептором электронов более низкого качества может свидетельствовать о том, что некоторые типы ОМ функционально лабильны при наличии кислорода, но функционально неподатливы в бескислородной среде.
Последствия.
Наша модель согласуется с наблюдениями и предыдущими результатами моделирования отложений, согласно которым большинство различных типов органического вещества присутствуют в относительно низких (<1 мкМ C) концентрациях, в то время как большая часть общего запаса биомассы является функционально неподатливой (8, 10, 51) (рис.2 B и 3 B ). Непокорная часть может уравновешиваться, если подвергается воздействию абиотических поглотителей, зависящих от концентрации (8), или может медленно меняться со временем (7, 8). В нашей схеме также подчеркивается, что явно низкие темпы потребления неподатливого DOC в океане могут контролироваться частотой встреч с «правильными» популяциями и субстратами в дополнение к биохимическим и энергетическим ограничениям. Это согласуется с пониманием того, что локальные поглотители вызывают снижение глубоководного РОУ на 10–20 % на пути глубоководной циркуляции океана (32).
Это согласуется с пониманием того, что локальные поглотители вызывают снижение глубоководного РОУ на 10–20 % на пути глубоководной циркуляции океана (32).
Модель водной толщи связывает тысячелетние временные масштабы круговорота ОВ (24) с микробным потреблением, происходящим в субгодовых временных масштабах (рис. 3 D ). Хотя трансформация органического углерода через сложную сеть взаимодействий также может объяснить старый углеродный возраст (17), медленный оборот как дополнительный механизм согласуется с выводами о том, что размер резервуаров органического углерода не достигает устойчивого состояния в течение геологических временных масштабов (2). Хотя наша модель совместима с гипотезой разбавления, она также включает другие объяснения накопления и поэтому согласуется с более широким набором наблюдений, включая композиционное единообразие вездесущих непокорных классов (7, 48).
Ключевым аспектом нашей структуры является пороговое поведение накопления. Пороговое значение, Q=1, устанавливается динамикой микробных популяций, потребляющих пулы ОМ. Q = 1 представляет собой экологический порог в континууме ОВ и микробных характеристик, включая факторы, которые, как известно, влияют на сопротивляемость, такие как термодинамические ограничения (40), ферментативный контроль (33), минеральная защита (41, 44, 52) и молекулярные свойства. (19). Нелинейное поведение порога предполагает, что небольшие изменения в окружающей среде могут привести к большому истощению или накоплению органического вещества.
Q = 1 представляет собой экологический порог в континууме ОВ и микробных характеристик, включая факторы, которые, как известно, влияют на сопротивляемость, такие как термодинамические ограничения (40), ферментативный контроль (33), минеральная защита (41, 44, 52) и молекулярные свойства. (19). Нелинейное поведение порога предполагает, что небольшие изменения в окружающей среде могут привести к большому истощению или накоплению органического вещества.
Потребление рекальцитрантного ОВ зависит от скорости микробной обработки, которая увеличивается с температурой. Если другие факторы остаются постоянными, модель предсказывает, что при более высоких температурах накапливается меньше органического вещества ( SI Приложение , SI Text 3 и рис. S10 C ). Действительно, потеря почвенного органического вещества является вероятной положительной обратной связью с текущим потеплением (53). Структура здесь дополнительно предполагает, что снижение ОВ при потеплении может быть нелинейным из-за того, что некоторые пулы ОВ пересекают порог от функционально неустойчивых до функционально лабильных ( SI Приложение , рис. S10c). Это может помочь понять взаимосвязь между температурой и резервуарами органического углерода в климате Земли в прошлом, например, повышенное захоронение углерода в океане, «инертные» резервуары углерода в почве и, возможно, морской DOC в ледниковые периоды (54, 55). Нелинейность, обусловленная температурой, также может служить объяснением 10-кратно более высокой скорости микробного использования DOC в более теплом глубоком Средиземноморье по сравнению с более холодным глубоким открытым океаном (56). Использование этой схемы для количественного прогнозирования изменений в резервуарах органического углерода при текущем повышении глобальной температуры потребует точных оценок темпов гибели микробных сообществ, а также понимания того, как температура повлияет как на микробные показатели, так и на разнообразие сообщества.
S10c). Это может помочь понять взаимосвязь между температурой и резервуарами органического углерода в климате Земли в прошлом, например, повышенное захоронение углерода в океане, «инертные» резервуары углерода в почве и, возможно, морской DOC в ледниковые периоды (54, 55). Нелинейность, обусловленная температурой, также может служить объяснением 10-кратно более высокой скорости микробного использования DOC в более теплом глубоком Средиземноморье по сравнению с более холодным глубоким открытым океаном (56). Использование этой схемы для количественного прогнозирования изменений в резервуарах органического углерода при текущем повышении глобальной температуры потребует точных оценок темпов гибели микробных сообществ, а также понимания того, как температура повлияет как на микробные показатели, так и на разнообразие сообщества.
Мы определяем набор средств контроля накопления и оборота органического вещества, основанный на сложности микробных экосистем. Ранее разрозненные гипотезы накопления ОМ, включая многие механизмы, вызывающие функциональную сопротивляемость, включены в одну структуру. Концентрации ОВ опосредованы характеристиками взаимодействия субстрат-микроб, неоднородностью органических субстратов, динамикой микробного сообщества, а также экологическим и биогеохимическим разнообразием, обусловленным связностью окружающей среды (рис.4). Модель согласуется с исчерпывающим набором наблюдений и теорией концентраций органического вещества, скорости оборота и возраста. Схема может использоваться для количественной оценки степени, в которой каждая из включенных гипотез объясняет накопление органического вещества в различных средах, и для разработки проверяемых гипотез о том, как органические резервуары меняются в зависимости от биогеохимической среды.
Концентрации ОВ опосредованы характеристиками взаимодействия субстрат-микроб, неоднородностью органических субстратов, динамикой микробного сообщества, а также экологическим и биогеохимическим разнообразием, обусловленным связностью окружающей среды (рис.4). Модель согласуется с исчерпывающим набором наблюдений и теорией концентраций органического вещества, скорости оборота и возраста. Схема может использоваться для количественной оценки степени, в которой каждая из включенных гипотез объясняет накопление органического вещества в различных средах, и для разработки проверяемых гипотез о том, как органические резервуары меняются в зависимости от биогеохимической среды.
Контроль накопления ОВ при потреблении микробами. Начиная с репрезентативной произвольной концентрации в центре, изменение общего углерода ОВ рассчитывается для 10-кратного изменения каждого из четырех параметров (т.т. е. в каждом квадранте различаются два параметра: более медленная микробная обработка за счет снижения максимальной скорости поглощения, более быстрый оборот за счет увеличения скорости потери популяции, меньшая связанность за счет снижения вероятности присутствия популяции и большее количество субстратов (химическое разнообразие) за счет большее количество пулов ОМ.
Материалы и методы
Уравнения моделей.
Мы описываем потребление и рост микробов в резервуарах органического углерода. Структура модели является достаточно общей, чтобы также учитывать неорганические питательные вещества, и может быть расширена для учета круговорота других элементов.Мы моделируем поглощение ρij каждого пула ОВ i в соответствии с его концентрацией Ci микробной популяцией j как функцию времени t с использованием насыщающей формы (Михаэлиса–Ментен) как ρij(t)=ρijmaxCi(t)Ci(t)+ kij,[4] где ρijmax — максимальная скорость поглощения, а kij — константа полунасыщения (табл. 1).
Каждая популяция синтезирует биомассу в соответствии с эффективностью роста для каждого пула (урожайность yij) и теряет биомассу со скоростью, пропорциональной ее биомассе, согласно квадратичному параметру смертности mjq (неявно представляющему хищников и вирусов) и линейному параметру смертности mjl (представляющему клеточную поддержание и старение).Скорости изменения концентрации Ci пула i и биомассы Bj популяции j равны∂Ci(t)∂t=si(t)−∑jIj(t)ρij(t)Bj(t),[5]∂ Bj(t)∂t=∑iIj(t)yijρij(t)Bj(t)−mjqBj(t)2−mjlBj(t),[6]где si(t) — скорость предложения i-го пула, равная определяется вероятностью поставки каждого пула qi assi(t)=σi с вероятностью qi0 с вероятностью 1−qi,[7] где σi — потенциальная скорость поставки, которая здесь является долей от общей поставки ОВ в домен (табл. 1). ). Термин Ij(t) указывает на присутствие населения j в момент времени t в соответствии с вероятностью присутствия Pj (подробности см. ниже), поскольку Ij(t)=1 с вероятностью Pj0 с вероятностью 1−Pj.[8] Поскольку наличие населения j в среднем с течением времени равно Pj, мы включаем Pj в уравнения. 1 – 3 для краткости. Все значения параметров (ρmax,k [через сродство ρmaxk−1], y,mq,ml,q и P) устанавливаются путем случайной выборки из однородных распределений (таблица 1; SI Приложение , SI Text 1 ) .
1). ). Термин Ij(t) указывает на присутствие населения j в момент времени t в соответствии с вероятностью присутствия Pj (подробности см. ниже), поскольку Ij(t)=1 с вероятностью Pj0 с вероятностью 1−Pj.[8] Поскольку наличие населения j в среднем с течением времени равно Pj, мы включаем Pj в уравнения. 1 – 3 для краткости. Все значения параметров (ρmax,k [через сродство ρmaxk−1], y,mq,ml,q и P) устанавливаются путем случайной выборки из однородных распределений (таблица 1; SI Приложение , SI Text 1 ) .
Выход yij отражает стоимость ферментов и свободную энергию, высвобождаемую при окислении ОМ. ρijmax и yij могут быть взаимозависимыми из-за стратегий клеточной оптимизации, отражающих присущий компромисс между распределением белка и эффективностью (57, 58).Различные комбинации ρijmax и yij также могут представлять различные способы поглощения высокомолекулярных DOM (59). Аналогично, различные комбинации параметров могут объяснить дополнительную обратную связь между внешней концентрацией и скоростью клеточной обработки ρijmax (60). Реальные популяции могут изменять свой клеточный механизм из-за пластичности, где в модели множество наборов параметров представляют статические фенотипы среди этих различных режимов.
Реальные популяции могут изменять свой клеточный механизм из-за пластичности, где в модели множество наборов параметров представляют статические фенотипы среди этих различных режимов.
Вероятность присутствия.
Наблюдения показывают, что состав сообщества диктует характер реминерализации РОВ, казалось бы, непредсказуемым образом (61, 62), и данные подтверждают наличие локализованных стоков РОВ (32). Чтобы смоделировать это воздействие, мы включаем в модель динамику присутствия-отсутствия населения. Каждой популяции назначается общая вероятность присутствия Pj, имитирующая спорадическое присутствие редких функциональных типов и почти гарантированное присутствие вездесущих типов. Когда Ij(t)=0 (уравнение 8 ), популяция не потребляет ОВ и не синтезирует биомассу на этом временном шаге, но ее биомасса все еще подвержена потерям.По сути, эта динамика расширяет диапазон максимальных скоростей обработки (синтеза) до более низких значений, демонстрируя, как отсутствие определенных функциональных типов способствует увеличению времени эффективной реминерализации. Эта динамика приводит к тому, что большинство взаимодействий происходит на средних (хотя и в широком диапазоне) скоростях, при этом очень медленные и очень быстрые взаимодействия встречаются довольно редко ( SI Приложение , рис. S13). С течением времени среднее присутствие приближается к Pj, а стационарные балансы, рассчитанные с общей вероятностью Pj, близко соответствуют модельным решениям.
Эта динамика приводит к тому, что большинство взаимодействий происходит на средних (хотя и в широком диапазоне) скоростях, при этом очень медленные и очень быстрые взаимодействия встречаются довольно редко ( SI Приложение , рис. S13). С течением времени среднее присутствие приближается к Pj, а стационарные балансы, рассчитанные с общей вероятностью Pj, близко соответствуют модельным решениям.
Матрица потребления.
Матрица потребления определяет, какие популяции потребляют какие пулы OM ( Приложение SI , рис. S1). Мы различаем возможности специалистов и универсалов популяций в зависимости от количества пулов ОМ, используемых каждой популяцией (nup, которое может варьироваться от одного до n, количество пулов ОМ), а также с широкой популярностью пулов ОМ. каждого пула по количеству потребителей каждого (ncons, которое может варьироваться от единицы до m, количество популяций) (рис.1). В версии модели с одними специалистами (рис. 2; SI Приложение , рис. S2) каждая популяция потребляет только один уникальный пул. Для универсальных популяций (рис. 2; SI, Приложение , рис. S2) мы сначала случайным образом назначаем nup каждой популяции из линейного диапазона от одного до n. Во-вторых, мы присваиваем вес каждому пулу ОМ с точки зрения его вероятности потребления ncons, линейно варьируя веса. Наконец, мы назначаем конкретные пулы, занятые каждой популяцией (т., мы заполняем каждый столбец матрицы потребления) выборкой из n возможностей с весами. Для взвешенной выборки мы используем алгоритмы «ProbabilityWeights» и «sample» в пакете StatsBase в Julia.
S2) каждая популяция потребляет только один уникальный пул. Для универсальных популяций (рис. 2; SI, Приложение , рис. S2) мы сначала случайным образом назначаем nup каждой популяции из линейного диапазона от одного до n. Во-вторых, мы присваиваем вес каждому пулу ОМ с точки зрения его вероятности потребления ncons, линейно варьируя веса. Наконец, мы назначаем конкретные пулы, занятые каждой популяцией (т., мы заполняем каждый столбец матрицы потребления) выборкой из n возможностей с весами. Для взвешенной выборки мы используем алгоритмы «ProbabilityWeights» и «sample» в пакете StatsBase в Julia.
Моделирование.
В симуляциях, показанных на рис. 2, мы разрешаем 1000 классов ОМ и 1000 или 2000 пулов биомассы: модельная версия с 1000 специалистов и модельная версия с 1000 специалистов и еще 1000 с диапазоном универсальных способностей.Результаты с последними 2000 пулов аналогичны модели только с 1000 универсалов. Для каждого эксперимента мы интегрируем модель вперед во времени на 10 лет, пока пулы, которые могут уравновеситься, не уравновесятся. Концентрации многих неподатливых пулов со временем продолжают увеличиваться (если только в модель не будет добавлен зависящий от концентрации поглотитель). SI Приложение , на рис. S13 показаны результирующие распределения концентраций биомассы, концентраций органического вещества и скоростей реминерализации ансамблей, которые согласуются с наблюдаемыми и предполагаемыми распределениями характеристик органического вещества, скоростей реминерализации и возраста в океане, отложениях, почвах. и озера (10, 21⇓⇓⇓⇓⇓–27, 63⇓–65).
Концентрации многих неподатливых пулов со временем продолжают увеличиваться (если только в модель не будет добавлен зависящий от концентрации поглотитель). SI Приложение , на рис. S13 показаны результирующие распределения концентраций биомассы, концентраций органического вещества и скоростей реминерализации ансамблей, которые согласуются с наблюдаемыми и предполагаемыми распределениями характеристик органического вещества, скоростей реминерализации и возраста в океане, отложениях, почвах. и озера (10, 21⇓⇓⇓⇓⇓–27, 63⇓–65).
В Приложение SI , SI Текст 2 и Рис. S2–S7 мы демонстрируем качественную согласованность решений в различных вариантах модели. Все модели подтверждают представленные выводы. Решения различаются количественно, но не качественно, в зависимости от универсальных возможностей микробных популяций, количества разрешенных пулов ОВ, отношения пулов ОМ к разрешенным популяциям, длины численного интегрирования и способа поглощения популяциями ( аддитивное потребление по сравнению спереключение с течением времени для оптимизации роста). В версии модели, где универсалы переключают свое потребление с течением времени ( Приложение SI , рис. S7), значения Q<1 получаются для некоторых пулов, поскольку универсалы перестают потреблять функционально непокорные пулы, несмотря на их способность делать это.
В версии модели, где универсалы переключают свое потребление с течением времени ( Приложение SI , рис. S7), значения Q<1 получаются для некоторых пулов, поскольку универсалы перестают потреблять функционально непокорные пулы, несмотря на их способность делать это.
Модель упрощенной версии.
Для модели пониженной сложности потребления ОВ, используемой в модели морской экосистемы, мы сводим сложность к одному основному параметру лабильности — максимальной скорости поглощения — и определяем меньшее количество пулов ОВ (n = 25) ( SI Приложение , Инжир.С15). Значения y, mq, ml и сродства к поглощению поддерживают постоянными, так как их изменение влияет на растворы количественно, но не качественно. Специализированная популяция, которая в совокупности представляет несколько кладов, потребляет каждый пул. Поскольку мы не включаем стохастические процессы, вероятность присутствия P=1 для всех популяций. В соответствии с теорией и результатами нашей стохастической модели (27, 66) мы предполагаем логнормальное распределение для разделения общего производства органического вещества на 25 пулов ( SI Приложение , рис. S15 D ), который представляет собой средний результат микробной трансформации во времени и пространстве.
S15 D ), который представляет собой средний результат микробной трансформации во времени и пространстве.
Модель морской экосистемы.
Версия модели пониженной сложности включена в модель динамической морской экосистемы стратифицированной вертикальной толщи воды, где производство и потребление всех органических и неорганических пулов обусловлено ростом, дыханием, экскрецией и смертностью микробных популяций ( Приложение SI , рис. S14). Свет и вертикальное смешивание ослабевают с глубиной.Две популяции фитопланктона преобразуют растворенный неорганический углерод и азот в биомассу с помощью энергии света. Популяции микробных гетеротрофов потребляют ВОВ (25 пулов) и взвешенное ОВ (ВОВ) (один пул), окисляют часть углерода для получения энергии и выделяют неорганический углерод и азот в качестве продуктов жизнедеятельности. Для простоты POM рассматривается как один агрегатный пул, опускающийся с постоянной скоростью. Общее МОВ образуется в результате деградации ПОМ (из-за внеклеточного гидролиза ПОМ) и потери биомассы всеми популяциями.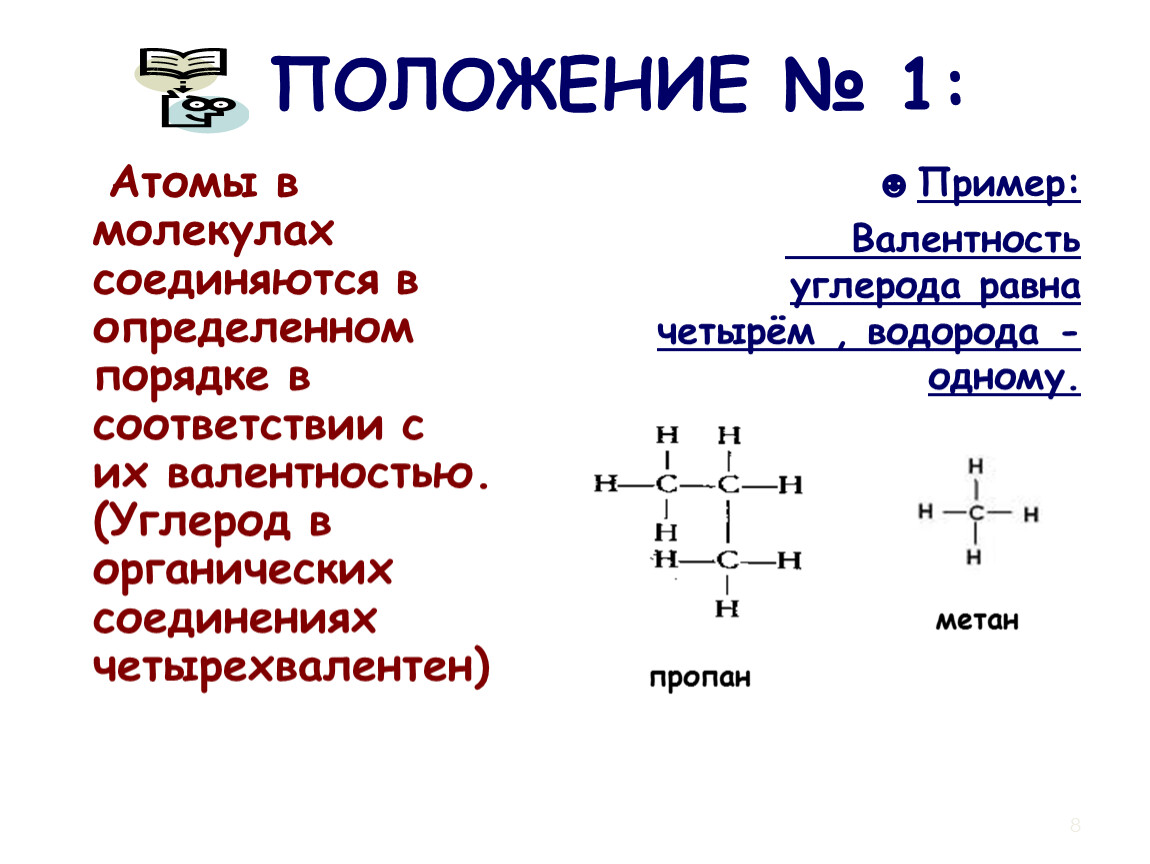 Модель представляет собой модифицированную версию опубликованной модели, в которой углерод и азот органических пулов и биомасс определяются независимо друг от друга (67). Значения параметров перечислены в SI, Приложение , Таблица S1. См. SI Приложение , SI Text 6 для уравнений модели и более подробной информации.
Модель представляет собой модифицированную версию опубликованной модели, в которой углерод и азот органических пулов и биомасс определяются независимо друг от друга (67). Значения параметров перечислены в SI, Приложение , Таблица S1. См. SI Приложение , SI Text 6 для уравнений модели и более подробной информации.
Химия (CHEM) | Пенн Стейт
Этот педагогически инновационный курс будет преподаваться в команде инструктором с кафедры английского языка и одним инструктором с кафедры химии.Оба инструктора будут присутствовать в классе в течение всего семестра, проводя совместные презентации и ведущие дискуссии. Интеграция контента предметной области гуманитарных и естественных наук побудит студентов с гуманитарным и естественнонаучным образованием, а также других заинтересованных студентов пройти курс и узнать, как интегрировать эти две области знаний в свое образование и свою жизнь после окончания Университета штата Пенсильвания. . Этот курс преподает как основные концепции химии, так и их культурную разработку в литературе, а также моделирует критическую оценку последствий химии и литературы, возникающих из общего культурного поля, а не автономно из двух отдельных культур. Курс направлен на то, чтобы дать студентам тонкое понимание того, как литература и наука информируют друг друга и разрешают культурные, религиозные и политические трения. Понимание происхождения и развития этих идей, перспектив и открытий является важным компонентом науки и научных достижений, но слишком часто наши методы преподавания науки сосредоточены почти исключительно на преподавании фактов и теорий за счет исторических открытий, творений и развитие этих фактов и теорий.Эти курсы преподают как научные факты и теории, так и контексты их производства, чтобы отточить способности студентов к критической оценке фактов. Литературная и научная направленность будет варьироваться от класса к классу, но может включать работы таких литературных авторов, как Мэри Шелли, Эдвард Бульвер-Литтон, Брэм Стокер, Герберт Уэллс, Гаррет Сервисс, Олдос Хаксли, Роальд Хоффманн, Карл Джерасси, Дон Делилло, Уильям Батлер Йейтс, Артур Мейчен, Д.Х.Х. Хаксли, Уильям Крукс, Уильям Рамсей, Фредерик Содди, Эрнест Резерфорд, Вильгельм Конрад Рентген, Анри Беккерель, Дж.
Курс направлен на то, чтобы дать студентам тонкое понимание того, как литература и наука информируют друг друга и разрешают культурные, религиозные и политические трения. Понимание происхождения и развития этих идей, перспектив и открытий является важным компонентом науки и научных достижений, но слишком часто наши методы преподавания науки сосредоточены почти исключительно на преподавании фактов и теорий за счет исторических открытий, творений и развитие этих фактов и теорий.Эти курсы преподают как научные факты и теории, так и контексты их производства, чтобы отточить способности студентов к критической оценке фактов. Литературная и научная направленность будет варьироваться от класса к классу, но может включать работы таких литературных авторов, как Мэри Шелли, Эдвард Бульвер-Литтон, Брэм Стокер, Герберт Уэллс, Гаррет Сервисс, Олдос Хаксли, Роальд Хоффманн, Карл Джерасси, Дон Делилло, Уильям Батлер Йейтс, Артур Мейчен, Д.Х.Х. Хаксли, Уильям Крукс, Уильям Рамсей, Фредерик Содди, Эрнест Резерфорд, Вильгельм Конрад Рентген, Анри Беккерель, Дж. Дж. Томсон, Нильс Бор и Мария Кюри. Основные понятия химии окружающей среды. Конкретная направленность этого класса будет варьироваться от класса к классу, но все разделы будут тратить примерно 40% класса на разделы, специально посвященные ключевым понятиям в базовой химии, 40% класса на литературные интерпретации и влияние на концепции в химии. в конкретные исторические периоды и 20% класса по значимым методам теоретизирования границ и взаимосвязей науки и культуры.и о понятии «культура науки». Однако эти предметы будут переплетаться на протяжении всего семестра. Действительно, педагогика курса зависит от того, чтобы литература и наука не были четко отделены друг от друга. Вместо этого учащиеся будут изучать современную науку, изучая происхождение, развитие и культурные аспекты этой науки, и научатся интегрировать свое понимание областей науки и гуманитарных наук в ходе курса. Курс будет предлагаться один раз в год примерно на 20-35 мест в каждом предложении.
Дж. Томсон, Нильс Бор и Мария Кюри. Основные понятия химии окружающей среды. Конкретная направленность этого класса будет варьироваться от класса к классу, но все разделы будут тратить примерно 40% класса на разделы, специально посвященные ключевым понятиям в базовой химии, 40% класса на литературные интерпретации и влияние на концепции в химии. в конкретные исторические периоды и 20% класса по значимым методам теоретизирования границ и взаимосвязей науки и культуры.и о понятии «культура науки». Однако эти предметы будут переплетаться на протяжении всего семестра. Действительно, педагогика курса зависит от того, чтобы литература и наука не были четко отделены друг от друга. Вместо этого учащиеся будут изучать современную науку, изучая происхождение, развитие и культурные аспекты этой науки, и научатся интегрировать свое понимание областей науки и гуманитарных наук в ходе курса. Курс будет предлагаться один раз в год примерно на 20-35 мест в каждом предложении.
Органический синтез | кафедра химии | Школа естественных наук Висса
Органический синтез
Появившаяся в начале девятнадцатого века структура молекулы и возможность ее синтеза представляют собой два самых влиятельных открытия всех времен. Превратив алхимию в современную химию, эти открытия изменили мир, поскольку они продолжают развиваться и приносить пользу науке и обществу.Органический синтез или синтетическая органическая химия, как ее иначе называют, представляет собой искусство и науку конструирования органических молекул , первичным элементом которых является углерод, таких как те, что содержатся в живых существах, а также в некоторых синтетических материалах. Лекарства, витамины и другие пищевые продукты, косметика, полимеры и пластмассы, высокоэнергетическое топливо и высокотехнологичные материалы — вот лишь некоторые из преимуществ органического синтеза для общества. Как вездесущая и стимулирующая наука и технология, эта дисциплина также повлияла на другие науки и технику, способствуя появлению и развитию других дисциплин и технологий , таких как химическая биология, медицинская химия, биология и биотехнология, физика, материаловедение и нанотехнология.Это признание центральной роли и важности органического синтеза делает необходимым и диктует его непрерывное совершенствование — как развитие методов, так и тотальный синтез.
Превратив алхимию в современную химию, эти открытия изменили мир, поскольку они продолжают развиваться и приносить пользу науке и обществу.Органический синтез или синтетическая органическая химия, как ее иначе называют, представляет собой искусство и науку конструирования органических молекул , первичным элементом которых является углерод, таких как те, что содержатся в живых существах, а также в некоторых синтетических материалах. Лекарства, витамины и другие пищевые продукты, косметика, полимеры и пластмассы, высокоэнергетическое топливо и высокотехнологичные материалы — вот лишь некоторые из преимуществ органического синтеза для общества. Как вездесущая и стимулирующая наука и технология, эта дисциплина также повлияла на другие науки и технику, способствуя появлению и развитию других дисциплин и технологий , таких как химическая биология, медицинская химия, биология и биотехнология, физика, материаловедение и нанотехнология.Это признание центральной роли и важности органического синтеза делает необходимым и диктует его непрерывное совершенствование — как развитие методов, так и тотальный синтез.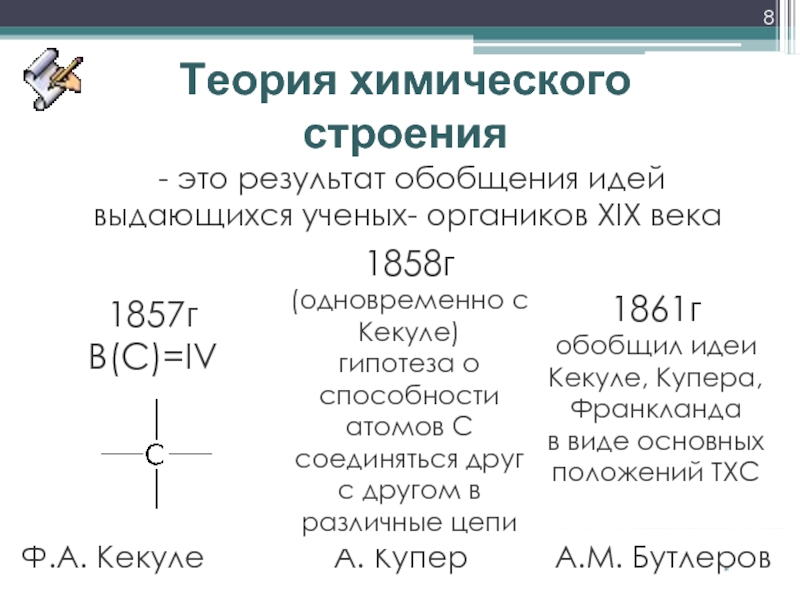 Первое необходимо для улучшения нашей способности создавать молекулы всех видов и со всеми намерениями и целями эффективными и экологичными способами, а второе — для проверки и применения недавно открытых синтетических методов для синтеза все возрастающей молекулярной сложности и разнообразие для конкретных приложений и полезных продуктов.
Первое необходимо для улучшения нашей способности создавать молекулы всех видов и со всеми намерениями и целями эффективными и экологичными способами, а второе — для проверки и применения недавно открытых синтетических методов для синтеза все возрастающей молекулярной сложности и разнообразие для конкретных приложений и полезных продуктов.
Признавая незаменимый характер и центральную роль органического синтеза, химический факультет недавно принял решение создать необходимое количество преподавателей, занимающихся развитием органического синтеза и его применениями в биологии и медицине, среди других дисциплин. Набор профессоров К.С. Николау в 2013 году и Ласло Кюрти в 2015 году демонстрируют эту инициативу, цель которой состоит в том, чтобы привлечь в Райс больше синтетических органических факультетов в качестве средства повышения узнаваемости риса на национальном и международном уровнях и облегчения взаимодействия и междисциплинарных исследований в Университете и соседних с нами учреждениях. в Техасском медицинском центре.Исследования в лаборатории Кюрти сосредоточены в первую очередь на открытии и разработке новых синтетических реакций, особенно применимых к процессу открытия и разработки лекарств, в то время как лаборатория Николау сосредоточена в первую очередь на открытии и разработке синтетических стратегий и технологий для синтеза сложных природных и разработанные молекулы биологического и медицинского значения. Ожидается, что прогнозируемое укрепление органического синтеза в Райсе также приведет к установлению академического и промышленного партнерства с фармацевтическим и биотехнологическим секторами — парадигма, которая уже реализована на некоторых факультетах.В дальнейшем ожидается дальнейшее укрепление органического синтеза на кафедре за счет набора новых преподавателей.
в Техасском медицинском центре.Исследования в лаборатории Кюрти сосредоточены в первую очередь на открытии и разработке новых синтетических реакций, особенно применимых к процессу открытия и разработки лекарств, в то время как лаборатория Николау сосредоточена в первую очередь на открытии и разработке синтетических стратегий и технологий для синтеза сложных природных и разработанные молекулы биологического и медицинского значения. Ожидается, что прогнозируемое укрепление органического синтеза в Райсе также приведет к установлению академического и промышленного партнерства с фармацевтическим и биотехнологическим секторами — парадигма, которая уже реализована на некоторых факультетах.В дальнейшем ожидается дальнейшее укрепление органического синтеза на кафедре за счет набора новых преподавателей.
Исследовательский факультет
Происхождение жизни | Биониндзя
Считается, что первоначальное формирование примитивных живых структур (протоклеток) требовало специфической поддерживающей химической среды
- Ранняя Земля имела химически восстановительную атмосферу, которая при воздействии энергии в различных формах (тепло, электрический разряд и т.
 д.) .) производили множество простых органических соединений (мономеров)
д.) .) производили множество простых органических соединений (мономеров) - Эти соединения накапливались в молекулярном «супе», что позволяло образовывать более сложные соединения (полимеры)
Существует ряд мест, предположительно обеспечивающих подходящие условия для образование концентрированного химического супа, включая вулканы, гидротермальные источники, береговые линии и космическое пространство
1. Вулканы
- Газовый состав вулканических извержений содержит высокие уровни связанного азота и другого сырья, которое может быть использовано для примитивного метаболизма
- Интенсивная вулканическая деятельность может также генерировать достаточно тепловой энергии для катализа образования органических молекул
2. Гидротермальные жерла
- Гидротермальные жерла – это области на дне океана, где из земной коры выделяется перегретая вода
- Эти жерла также выделяют богатые водородом жидкости для создания химического градиента и рН, пригодных для органического синтеза
2 2 2 3.
 Изучая свойства вещества можно определить химическое строение его молекулы, а по строению молекулы — предвидеть свойства вещества.
Изучая свойства вещества можно определить химическое строение его молекулы, а по строению молекулы — предвидеть свойства вещества. Предмет органической химии.
Предмет органической химии.
 Алкины. Гомологический ряд, получение, свойства и применение.
Алкины. Гомологический ряд, получение, свойства и применение.
 edu.ru) [ смотреть]
edu.ru) [ смотреть]


 Номера присваиваются в том направлении, которое дает наименьшие номера атомам углерода с присоединенными заместителями.Дефисы используются для отделения чисел от названий заместителей; запятые отделяют числа друг от друга. (LCC не нужно писать прямой линией; например, LCC в следующем примере имеет пять атомов углерода.)
Номера присваиваются в том направлении, которое дает наименьшие номера атомам углерода с присоединенными заместителями.Дефисы используются для отделения чисел от названий заместителей; запятые отделяют числа друг от друга. (LCC не нужно писать прямой линией; например, LCC в следующем примере имеет пять атомов углерода.) Например, этил указан перед диметилом; di- просто игнорируется. Последняя названная алкильная группа ставится перед названием исходного алкана, образуя одно слово.
Например, этил указан перед диметилом; di- просто игнорируется. Последняя названная алкильная группа ставится перед названием исходного алкана, образуя одно слово. Метильные группы (правило 2) присоединены ко второму и пятому атомам углерода. Название 2,5-диметилгексан.
Метильные группы (правило 2) присоединены ко второму и пятому атомам углерода. Название 2,5-диметилгексан. Вы можете нумеровать родительскую цепочку в любом направлении, если вы непротиворечивы; просто не меняйте направление до того, как структура будет готова. Название указывает на две метильные (CH 3 ) группы, одну на втором атоме углерода и одну на третьем.
Вы можете нумеровать родительскую цепочку в любом направлении, если вы непротиворечивы; просто не меняйте направление до того, как структура будет готова. Название указывает на две метильные (CH 3 ) группы, одну на втором атоме углерода и одну на третьем. Подразумевается, что каждый атом углерода связан с достаточным количеством атомов водорода, чтобы дать каждому атому углерода четыре связи.
Подразумевается, что каждый атом углерода связан с достаточным количеством атомов водорода, чтобы дать каждому атому углерода четыре связи. д.) .) производили множество простых органических соединений (мономеров)
д.) .) производили множество простых органических соединений (мономеров)