Периодический закон | CHEMEGE.RU
Периодический закон — это фундаментальный закон, который был сформулирован Д.И. Менделеевым в 1869 году.
В формулировке Дмитрия Ивановича Менделеева периодический закон звучал так: «Свойства элементов, формы и свойства образуемых ими соединений находятся в периодической зависимости от величины их атомной массы.» Периодическое изменение свойств элементов Менделеев связывал с атомной массой. Понимание периодичности изменения многих свойств позволило Дмитрию Ивановичу определить и описать свойства веществ, образованных еще не открытыми химическими элементами, предсказать природные рудные источники и даже места их залегания.
Более поздние исследования показали, что свойства атомаов и их соединений зависят в первую очередь от электронного строения атома. А электронное строение определяется свойствами атомного ядра. В частности, зарядом ядра атома.
Поэтому современная формулировка периодического закона звучит так:
«Свойства элементов, форма и свойства образованных ими соединений находятся в периодической зависимости от величины заряда ядер их атомов«.
Следствие периодического закона – изменение свойств элементов в определенных совокупностях, а также повторение свойств по периодам, т.е. через определенное число элементов. Такие совокупности Менделеев назвал периодами.
Периоды – это горизонтальные ряды элементов с одинаковым количеством заполняемых электронных уровней. Номер периода обозначает число энергетических уровней в атоме элемента. Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом.
Группы – вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы. Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns— и np— подуровнях.
Периодическая система элементов Д. И. Менделеева состоит из семи периодов, которые представляют собой горизонтальные последовательности элементов, расположенные по возрастанию заряда их атомного ядра.
Каждый период (за исключением первого) начинается атомами щелочных металлов (Li, Na, К, Rb, Cs, Fr) и заканчивается благородными газами (Ne, Ar, Kr, Xe, Rn), которым предшествуют типичные неметаллы.
В периодах слева направо возрастает число электронов на внешнем уровне.
Как следствие,
В периодах слева направо постепенно ослабевают металлические и усиливаются неметаллические свойства.
В первом периоде имеются два элемента – водород и гелий. При этом водород условно размещают в IA или VIIA подгруппе, так как он проявляет сходство и со щелочными металлами, и с галогенами. Как и щелочные металлы, водород является восстановителем. Отдавая один электрон, водород образует однозарядный катион H+. Как и галогены, водород – неметалл, образует двухатомную молекулу H2 и может проявлять окислительные свойства при взаимодействии с активными металлами:
2Na + H2 → 2NaH
В четвертом периоде вслед за Са расположены 10 переходных элементов (от скандия Sc до цинка Zn), за которыми находятся остальные 6 основных элементов периода ( от галлия Ga до криптона Кr). Аналогично построен пятый период. Переходными элементами обычно называют любые элементыа с валентными d– или f–электронами.
Шестой и седьмой периоды имеют двойные вставки элементов. За элементом Ва расположены десять d–элементов (от лантана La — до гадолиния Hg), а после первого переходного элемента лантана La следуют14 f–элементов — лантаноидов (Се — Lu). После ртути Hg располагаются остальные 6 основных р-элементов шестого периода (Тl — Rn).
В седьмом (незавершенном) периоде за Ас следуют 14 f–элементов- актиноидов (Th — Lr). В последнее время La и Ас стали причислять соответственно к лантаноидам и актиноидам. Лантаноиды и актиноиды помещены отдельно внизу таблицы.
В Периодической системе каждый элемент расположен в строго определенном месте, которое соответствует его порядковому номерому.
Элементы в Периодической системе разделены на восемь групп (I – VIII), которые в свою очередь делятся на подгруппы — главные, или подгруппы А и побочные, или подгруппы Б. Подгруппа VIIIБ-особая, она содержит триады элементов, составляющих семейства железа (Fе, Со, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Внутри каждой подгруппы элементы проявляют похожие свойства и схожи по химическому строению. А именно:
В главных подгруппах сверху вниз усиливаются металлические свойства и ослабевают неметаллические.
В главных подгруппах сверху вниз увеличивается устойчивость соединений элементов в низшей степени окисления.
В побочных подгруппах наоборот: сверху вниз металлические свойства ослабевают и увеличивается устойчивость соединений с высшей степенью окисления.
В зависимости от того, какая энергетическая орбиталь заполняется в атоме последней, химические элементы можно разделить на s-элементы, р-элементы, d- и f-элементы.
У атомов s-элементов заполняются s-орбитали на внешних энергетических уровнях. К s-элементам относятся водород и гелий, а также все жлементы I и II групп главных подгрупп (литий, бериллий, натрий и др.). У p-элементов электронами заполняются p-орбитали. К ним относятся элементы III-XIII групп, главных подгрупп. У d-элементов заполняются, соответственно, d-орбитали. К ним относятся элементы побочных подгрупп.
Из строения атомов и электронных оболочек вытекают следующие закономерности:
Номер периода соответствует числу заполняемых энергетических уровней.
Номер группы, как правило, соответствует числу валентных электронов в атоме (т.е. электроном, способных к образованию химической связи).
Номер группы, как правило, соответствует высшей положительной степени окисления атома. Но есть исключения!
О каких же еще свойствах говорится в Периодическом законе?
Периодически зависят от заряда ядра такие характеристики атомов, как орбитальный радиус, энергия сродства к электрону, электроотрицательность, энергия ионизации, степень окисления и др.
Рассмотрим, как меняется атомный радиус. Вообще, атомный радиус – понятие довольно сложное и неоднозначное. Различают радиусы атомов металлов и ковалентные радиусы неметаллов.
Радиус атома металла равен половине расстояния между центрами двух соседних атомов в металлической кристаллической решетке. Атомный радиус зависит от типа кристаллической решетки вещества, фазового состояния и многих других свойств.
Мы говорим про орбитальный радиус изолированного атома .
Орбитальный радиус – это теоретически рассчитанное расстояние от ядра до максимального скопления наружных электронов.
Орбитальный радиус завит в первую очередь от числа энергетических уровней, заполненных электронами.
Чем больше число энергетических уровней, заполненных электронами, тем больше радиус частицы.
Например, в ряду атомов: F – Cl – Br – I количество заполненных энергетических уровней увеличивается, следовательно, орбитальный радиус также увеличивается.
Если количество заполняемых энергетических уровней одинаковое, то радиус определяется зарядом ядра частицы.
Чем больше заряд ядра, тем сильнее притяжение валентных электронов к ядру.
Чем больше притяжение валентных электронов к ядру, тем меньше радиус частицы. Следовательно:
Чем больше заряд ядра атома (при одинаковом количестве заполняемых энергетических уровней), тем меньше атомный радиус.
Например, в ряду Li – Be – B – C количество заполненных энергетических уровней, заряд ядра увеличивается, следовательно, орбитальный радиус также уменьшается.
В группах сверху вниз увеличивается число энергетических уровней у атомов. Чем больше количество энергетических уровней у атома, тем дальше расположены электроны внешнего энергетического уровня от ядра и тем больше орбитальный радиус атома.
В главных подгруппах сверху вниз увеличивается орбитальный радиус.
В периодах же число энергетических уровней не изменяется. Зато в периодах слева направо увеличивается заряд ядра атомов. Следовательно, в периодах слева направо уменьшается орбитальный радиус атомов.
В периодах слева направо орбитальный радиус атомов уменьшается.
| Пример. Выберите три элемента, которые в Периодической системе находятся в одной группе, и расположите эти элементы в порядке увеличения радиуса атома 1) O 2) Se 3) F 4) S 5) Na |
| Решение: В одной группе Периодической системы находятся элементы кислород O, селен Se и сера S. В группе снизу вверх атомный радиус уменьшается, а сверху вниз – увеличивается. Следовательно, правильный ответ: O, S, Se или 142. Ответ: 142 |
| Пример. Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке уменьшения радиуса атома 1) K 2) Li 3) F 4) B 5) Na |
| Решение: В одном периоде Периодической системы находятся элементы литий Li, фтор F и натрий Na. В периоде слева направо атомный радиус уменьшается, а справа налево – увеличивается. Следовательно, правильный ответ: Li, B, F или 243. Ответ: 243 |
Рассмотрим закономерности изменения радиусов ионов: катионов и анионов.
Катионы – это положительно заряженные ионы. Катионы образуются, если атом отдает электроны.
Радиус катиона меньше радиуса соответствующего атома. С увеличением положительного заряда иона радиус уменьшается.
Например, радиус иона Na+ меньше радиуса атома натрия Na:
Анионы – это отрицательно заряженные ионы. Анионы образуются, если атом принимает электроны.
Радиус аниона больше радиуса соответствующего атома.
Радиусы ионов также зависят от числа заполненных энергетических уровней в ионе и от заряда ядра.
Например, радиус иона Cl– больше радиуса атома хлора Cl.
Изоэлектронные ионы – это ионы с одинаковым числом электронов. Для изоэлектронных частиц радиус также определяется зарядом ядра: чем больше заряд ядра иона, тем меньше радиус.
Например: частицы Na+ и F‒ содержат по 10 электронов. Но заряд ядра натрия +11, а у фтора только +9. Следовательно, радиус иона Na+ меньше радиуса иона F ‒.
Еще одно очень важное свойство атомов – электроотрицательность (ЭО).
Электроотрицательность – это способность атома смещать к себе электроны других атомов при образовании связи. Оценить электроотрицательность можно только примерно. В настоящее время существует несколько систем оценки относительной электроотрицательности атомов. Одна из наиболее распространенных – шкала Полинга.
По Полингу наиболее электроотрицательный атом – фтор (значение ЭО≈4). Наименее элекроотрицательный атом –франций (ЭО = 0,7).
В главных подгруппах сверху вниз уменьшается электроотрицательность.
В периодах слева направо электроотрицательность увеличивается.
| Пример.Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания их электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности: 1) Mg 2) P 3) O 4) N 5) Ti |
| Решение: Элементы-неметаллы – это фосфор Р, кислород О и азот N. Электроотрицательность увеличивается в группах снизу вверх и слева направо в периодах. Следовательно, правильный ответ: P, N, O или 243. Ответ: 243 |
Поделиться ссылкой:
chemege.ru
Периодический закон и Периодическая система химических элементов Д.И. Менделеева

Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства.
Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Тренировочные задания
1. Среди перечисленных химический элемент с максимальным радиусом атома — это
1) неон
2) алюминий
3) калий
4) кальций
2. Среди перечисленных химический элемент с минимальным радиусом атома — это
1) алюминий
2) бор
3) калий
4) неон
3. Наиболее ярко металлические свойства выражены у элемента
1) Rb
2) Li
3) Mg
4) Ca
4. Наиболее ярко неметаллические свойства выражены у элемента
1) F
2) S
3) O
4) N
5. Наибольшее число валентных электронов у элемента
1) фтор
2) водород
3) натрий
4) сера
6. Наименьшее число валентных электронов у элемента
1) кислород
2) кремний
3) водород
4) кальций
7. Металлические свойства элементов возрастают в ряду
1) Ba, Li, Cs, Mg
2) Al, Mg, Ca, K
3) Li, Cs, Mg, Ba
4) Na, Mg, Li, Al
8. Неметаллические свойства элементов ослабевают в ряду:
1) N, S, Br, Cl
2) O, S, Se, Te
3) Se, I, S, O
4) N, P, O, F
9. Химические элементы перечислены в порядке возрастания атомного радиуса в ряду
1) углерод, бериллий, магний
2) калий, магний, алюминий
3) хлор, натрий, фтор
4) азот, фосфор, фтор
10. Химические элементы перечислены в порядке убывания атомного радиуса в ряду
1) водород, бор, алюминий
2) углерод, кремний, калий
3) натрий, хлор, фтор
4) сера, кремний, магний
11. Кислотные свойства водородных соединений усиливаются в ряду
1) HI – PH3 – HCl – H2S
2) PH3 – H2S – HBr – HI
3) H2S – PH3 – HCl – SiH4
4) HI – HCl – H2S – PH3
12. Кислотные свойства водородных соединений ослабевают в ряду
1) HI – PH3 – HCl – H2S
2) PH3 – H2S – HBr – HI
3) H2S – PH3 – HCl – SiH4
4) HI – HBr – HCl – HF
13. Основные свойства соединений усиливаются в ряду
1) LiOH – KOH – RbOH
2) LiOH – KOH – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
14. Основные свойства соединений ослабевают в ряду
1) LiOH – Ba(OH)2 – RbOH
2) LiOH – Ba(OH)2 – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
15. Во втором периоде Периодической системы элементов Д.И. Менделеева с увеличением заряда ядра у химических элементов:
1) возрастает электроотрицательность
2) уменьшается заряд ядра
3) возрастает атомный радиус
4) возрастает степень окисления
16. Наиболее сильной кислотой, образованной элементом второго периода, является
1) угольная
2) азотная
3) фтороводородная
4) азотистая
17. Наиболее сильное основание образует химический элемент
1) магний
2) литий
3) алюминий
4) калий
18. Наиболее сильная бескислородная кислота соответствует элементу
1) селен
2) фтор
3) йод
4) сера
19. В ряду элементов Li → B → N → F
1) убывает атомный радиус
2) возрастают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
20. В ряду элементов Li → Na → K → Rb
1) убывает атомный радиус
2) ослабевают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
Ответы


himi4ka.ru
Периодический закон и периодическая система
Периодический закон – основной закон химии – был открыт в 1869 году Д.И. Менделеевым. В то время атом еще считался неделимым и ничего не было известно о его внутреннем строении.
 Атомные массы (тогда – атомные веса) и химические свойства элементов были положены в основу Периодического закона Д.И. Менделеева. Д.И. Менделеев, расположив 63 известных в то время элемента в порядке возрастания их атомных масс, получил естественный (природный) ряд химических элементов, где он отметил периодическую повторяемость химических свойств. Например, типичного неметалла фтор F повторялись у элементов хлор Сl, бром Br, йод I, свойства типичного металла литий Li – у элементов натрий Na
Атомные массы (тогда – атомные веса) и химические свойства элементов были положены в основу Периодического закона Д.И. Менделеева. Д.И. Менделеев, расположив 63 известных в то время элемента в порядке возрастания их атомных масс, получил естественный (природный) ряд химических элементов, где он отметил периодическую повторяемость химических свойств. Например, типичного неметалла фтор F повторялись у элементов хлор Сl, бром Br, йод I, свойства типичного металла литий Li – у элементов натрий Na
Для некоторых элементов Д.И. Менделеевым не было обнаружено химических аналогов (у алюминия Al и кремния Si, например), в сиу того что в то время такие аналоги известны еще не были. В таблице им предназначались пустые места, но на основе периодической повторяемости ученый предсказал их химические свойства). После открытия соответствующих элементов предсказания Д.И. Менделеева полностью подтвердились (аналог алюминия – галлий Ga, аналог кремния – германий Ge).
Периодический закон в формулировке Д.И. Менделеева представлен так: в периодической зависимости от величины атомных весов элементов находятся свойства простых тел, а также формы и свойства соединений элементов.
Современная формулировка Периодического закона Д.И. Менделеева звучит следующим образом: свойства элементов находятся в периодической зависимости от порядкового номера.
Периодический закон Д.И. Менделеева стал базой для создания ученым Периодической системы химических элементов. Она представлена 7 периодами и 8 группами.
Периодами называются горизонтальные ряды таблицы, которые делятся на малые и большие. 2 элемента (1-й период) или 8 элементов (2-й, 3-й периоды) находятся в малых периодах, а в больших периодах находятся 18 элементов (4-й, 5-й периоды) или 32 элемента (6-й период), 7-й период пока остается незавершенным. Каждый период с типичного металла начинается и заканчивается типичным неметаллом и благородным газом.
Группами элементов называются вертикальные столбцы. Каждая группа представлена двумя подгруппами – главной и побочной. Подгруппой называется совокупность элементов, которые являются полными химическими аналогами; часто элементы подгруппы имеют высшую степень окисления, соответствующую номеру группы. Например, высшая степень окисления (+ II) отвечает элементам подгруппы
Химические свойства элементов в главных подгруппах могут меняться от неметаллических до металлических (в главной подгруппе V группы азот – неметалл, а висмут – метал) – в широком диапазоне. Свойства элементов в побочных подгруппах меняются, но не столь резко; например, элементы побочной группы IV группы – цирконий, титан, гафний – очень похожи по своим свойствам (особенно цирконий и гафний).
В Периодической системе в I группе (Li – Fr), II (Mg – Ra) и III (In, Tl) расположены типичные металлы. Неметаллы расположены в группах VII (F – At), VI (O – Te), V (N – As), IV (C, Si) и III (B). Некоторые элементы главных групп ( Be, Al, Ge, Sb, Po), а также многие элементы побочных групп могут проявлять и металлические, и неметаллические свойства. Это явление получило название амфотерности.
Для некоторых главных групп применяют групп овые названия: VIII (Не – Rn) – благородные газы, VII (F – At) – галогены, IV (О – Ро) – халькогены, II (Са – Ra) – щелочноземельные металлы, I (Li – Fr) – щелочные металлы.
овые названия: VIII (Не – Rn) – благородные газы, VII (F – At) – галогены, IV (О – Ро) – халькогены, II (Са – Ra) – щелочноземельные металлы, I (Li – Fr) – щелочные металлы.
Форма Периодической системы, которую предложил Д.И. Менделеев, получила название короткопериодной, или классической. В современной химии все шире используется другая форма – длиннопериодная, в которой все периоды – малые и большие – вытянуты в длинные ряды, начинающиеся щелочным металлом и заканчивающиеся благородным газом.
Периодический закон Д.И. Менделеева и Периодическая система элементов Д.И. Менделеева стали основой современной химии.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Вопрос 9
Периодический закон Д.И Менделеева.
Свойства химических элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости, от величины атомного веса.
Физический смысл периодического закона.
Физический смысл периодического закона заключается в периодичном изменении свойств элементов, в результате периодически повторяющихся e-ых оболочек атомов, при последовательном возрастании n.
Современная формулировка ПЗ Д.И Менделеева.
Свойство химических элементов, а также свойство образованных ими простых или сложных веществ находится в периодичной зависимости от величины заряда ядер их атомов.
Периодическая система элементов.
Периодическая система – система классификаций химических элементов, созданная на основе периодического закона. Периодическая система – устанавливает связи между химическими элементами отражающие их сходства и различия.
Периодическая таблица( существует два вида: короткая и длинная) элементов.
Периодическая таблица элементов – графическое отображение периодической системы элементов, состоит из 7 периодов и 8 групп.
Вопрос 10
Периодическая система и строение электронных оболочек атомов элементов.
В дальнейшем было установлено, что не только порядковый номер элемента имеет глубокий физический смысл, но и другие понятия, ранее рассмотренные ранее также постепенно приобретали физический смысл. Например, номер группы, указывая на высшую валентность элемента, выявляет тем самым максимальное число электронов атома того или иного элемента, которое может участвовать в образовании химической связи.
Номер периода, в свою очередь, оказался связанным с числом энергетических уровней, имеющихся в электронной оболочке атома элемента данного периода.
Таким образом, например, „координаты» олова Sn (порядковый номер 50, 5 период, главная подгруппа IV группы), означают, что электронов в атоме олова 50, распределены они на 5 энергетических уровнях, валентными являются лишь 4 электрона.
Физический смысл нахождения элементов в подгруппах различных категорий чрезвычайно важен. Оказывается, что у элементов, расположенных в подгруппах I категории, очередной (последний) электрон располагается на s-подуровне внешнего уровня. Эти элементы относят к электронному семейству. У атомов элементов, расположенных в подгруппах II категории, очередной электрон располагается на р-подуровне внешнего уровня. Это, элементы электронного семейства „р». Так, очередной 50-й электрон у атомов олова располагается на р-подуровне внешнего, т. е. 5-го энергетического уровня.
У атомов элементов подгрупп III категории очередной электрон располагается на d-подуровне, но уже пред внешнего уровня, это элементы электронного семейства «d». У атомов лантаноидов и актиноидов очередной электрон располагается на f-подуровне, пред пред внешнего уровня. Это элементы электронного семейства «f».
Не случайно, следовательно, отмеченные выше числа подгрупп этих 4-х категорий, то есть 2-6—10—14, совпадают с максимальными числами электронов на подуровнях s-p-d-f.
Но можно, оказывается, решить вопрос о порядке заполнения электронной оболочки и вывести электронную формулу для атома любого элемента и на основе периодической системы, которая с достаточной ясностью указывает уровень и подуровень каждого очередного электрона. Периодическая система указывает и на размещение одного за другим элементов по периодам, группам, подгруппам и на распределение их электронов по уровням и подуровням, потому что каждому элементу соответствует свой собственный, характеризующий его последний электрон. В качестве примера разберем составление электронной формулы для атома элемента циркония (Zr). Периодическая система дает показатели и „координаты» этого элемента: порядковый номер 40, период 5, группа IV, побочная подгруппа. Первые выводы: а) всех электронов 40, б) эти 40 электронов распределены на пяти энергетических уровнях; в) из 40 электронов только 4 являются валентными, г) очередной 40-й электрон поступил на d-подуровень пред внешнего, т. е. четвертого энергетического уровня. Подобные выводы можно сделать о каждом из 39 элементов, предшествующих цирконию, только показатели и координаты будут каждый раз иными.
studfile.net
Урок-семинар в 11-м классе «Сущность и значение периодического закона»
Цели урока:
- Образовательные:
- обобщение, систематизация знаний учащихся о сущности периодического закона Д.И.Менделеева, причинах периодическогоизменения свойств химических элементов в свете теории строения атома.
- Развивающие:
- развитие умений учащихся планировать и проводить эксперименты исследовательского характера, излагать теоретический материал, аргументировать выдвинутые идеи, делать выводы, применять, систематизировать и обобщать знания, устанавливать причинно-следственные связи.
- Воспитательные: формирование научного мировоззрения учащихся.
Оборудование:
- Таблица: «Периодическое изменение свойств элементов» (Приложение 1)
- Химические реактивы для выполнения лабораторных опытов: гидроксид алюминия, гидроксид хрома (III), растворы соляной кислоты, азотной кислоты, гидроксида калия, гидроксида натрия.
ХОД УРОКА
Учитель: Периодический закон и периодическая система химических элементов пережили уже два этапа в их понимании и развитии. На первом этапе – химическом – внимание концентрировалось на периодическом изменении свойств элементов, на втором – электронном – внимание сосредоточено на зависимости свойств элементов от электронного строения атомов. Цель нашего урока – систематизировать и обобщить знания о связи периодического закона с теорией строения атома, на основе периодического закона подтвердить наиболее общие законы развития природы.
Сообщение учащегося: Причины периодичности.
Приложение 1, слайд № 1
Периодическая зависимость – повторяемость свойств через определенный период. Период – ряд элементов с одинаковым числом энергетических (квантовых) уровней, расположенных в порядке возрастания зарядов атомных ядер.
В III периоде атомы элементов имеют 3
энергетических уровня. От элемента к элементу на
единицу возрастает заряд ядра и число электронов
на внешнем электронном слое, атомные радиусы
сокращаются, т. к. происходит их стягивание в
результате притяжения к ядру большего
количества электронов. Натрий и магний – это
s-элементы, в их атомах заполняется s-подуровень,
от алюминия до аргона – p-элементы, т. к. в их
атомах заполняется p-подуровень. С накоплением
электронов в наружном электронном слое и
сокращением атомного радиуса связано ослабление
металлических свойств и нарастание
неметаллических свойств. Восстановительные
свойства ослабляются, окислительные
усиливаются.
В периодах растет высшая степень окисления в
соединениях, она определяется числом электронов
наружного слоя.
Характер оксидов и гидроксидов изменяется от
основных через амфотерные к кислотным, гидроксид
натрия – сильное основание, щелочь, гидроксид
алюминия – амфотерный гидроксид, хлорная
кислота – самая сильная кислота.
Валентность в гидридах металлов увеличивается,
в летучих водородных соединениях неметаллов
падает. Эти закономерности повторяются в каждом
периоде.
В главных подгруппах располагаются элементы
сходные, но неодинаковые, с ростом заряда ядра
атомные радиусы увеличиваются, т. к. растет число
электронных слоев в атомах, усиливается свойство
отдавать электроны, растут металлические
свойства.
Т. о. главная причина периодичности связана с
периодическим изменением числа электронов в
наружном слое атома. Количественные изменения,
постоянно накапливаясь, приводят к качественным
изменениям – возникновению новых свойств.
Современная формулировка периодического закона:
свойства химических элементов и их соединений
находятся в периодической зависимости от
зарядов атомных ядер, числа валентных
электронов, строения внешних электронных слоев
атомов химических элементов. Химический элемент
– совокупность атомов с одинаковым зарядом ядра.
Важнейшие свойства химических элементов – металличность и неметалличность. Подтвердим зависимость свойств химических элементов от строения атома.
Учащиеся выполняют задание № 1 экспериментально-теоретической программы урока
Опишите строение атома определенного химического элемента по плану: схема строения атома, электронная формула, электронно-графическая формула, принадлежность к металлам или неметаллам, определенному семейству, число валентных электронов.
1 вариант 2 вариант
элемент № 11 (Na) элемент № 15 (P)
Составьте уравнения реакций, подтверждающих химические свойства простого вещества, оксида и гидроксида соответствующего элемента, укажите химический характер проявляемых свойств.
Выводы учащихся:
Натрий – s – элемент, типичный металл, т. к. на внешнем электронном слое атома содержит один электрон. Натрий – одновалентен, высшая степень окисления равна +1. При горении среди других продуктов сгорания образует оксид Nа2О. При растворении в воде образует щелочь, сильное основание, это доказывается малиновой окраской индикатора фенолфталеина. Главное свойство оснований – взаимодействие с кислотами. Таким образом, соединения натрия, как типичного металла, проявляют основные свойства.
Фосфор – р – элемент, неметалл, т. к. на внешнем слое атома содержит 5 электронов. Фосфор пятивалентен, высшая степень окисления равна +5. При горении образует высший оксид Р2О5, при растворении оксида в воде образуется фосфорная кислота Н3РО4 – кислота средней силы. Наличие кислоты в растворе доказывается красной окраской лакмуса. Главное свойство кислот – взаимодействие с основаниями.
Таким образом, соединения фосфора, как неметалла, проявляют кислотные свойства.
Учитель: Естественная система химических элементов включает элементы не только с ярко выраженными металлическими и неметаллическими свойствами. Деление элементов на металлы и неметаллы относительно, несовершенно.Приведите доказательства этого положения.
Учащиеся приводят примеры металлических признаков физических свойств графита, кремния, йода, металлического водорода, молекулярной кристаллической решетки и химической инертности инертных газов, амфотерности соединений многих металлов.
Учитель: Деление элементов на металлы и неметаллы применимо больше к простым веществам, которые, в зависимости от условий могут проявлять как металлические, так и неметаллические свойства. Металличность и неметалличность простых веществ – это функция условий существования химического элемента. Для соединения металлов и неметаллов в единую систему связующим мостиком являются амфотерные соединения. Выявим причины амфотерности на основе строения атомов элементов.
Учащиеся выполняют задание № 2 экспериментально-теоретической программы урока
а) Опишите строение атома химического элемента по плану: схема строения атома, электронная формула, электронно-графическая формула, принадлежность к металлам или неметаллам, определенному семейству,число валентных электронов
1 Вариант 2 Вариант
элемент №13 (AL) элемент №24 (Cr)
б) Вам выданы следующие вещества:
1 Вариант 2 Вариант
Гидроксид алюминия Гидроксид хрома (III)
На основе строения атома указанного элемента определите химический характер соединения, подтвердите свойства экспериментально, составьте молекулярные и ионные уравнения реакций. Укажите, какие свойства проявляет соединение в каждой реакции, каковы признаки реакций? Выявите главную причину проявляемых соединением свойств.
Выводы учащихся: гидроксиды алюминия и хрома (III) амфотерны, амфотерность обусловлена промежуточным числом валентных электронов и проявляемой промежуточной степенью окисления алюминия и хрома +3.
Учитель: Все разнообразие химических элементов связано единой идеей строения атома. Периодический закон в настоящее время является важнейшим инструментом познания, определяет развитие атомной физики, химии, геологии, астрономии, атомной и ядерной техники, химической технологии, металлургии, медицины и других отраслей знания. Выделяют несколько важнейших функций периодического закона.
Сообщение учащегося. Функции периодического закона.
Приложение 1, слайд № 3.
Объясняющая функция закона заключается в
способности объяснить те или иные явления. При
составлении таблицы Менделеев трижды
сознательно нарушил принцип ее построения,
отраженный в периодическом законе. Он переставил
элементы местами так, что элемент с большей
массой опережает элемент с меньшей массой, но при
такой расстановке все они попадают в группы
сходных по свойствам элементов. Открытие
строения атома оправдало данные перестановки.
Элементы оказались в системе расставлены
правильно на основе зарядов атомных ядер.
Перестановки Менделеева можно объяснить
явлением изотопии. Развивающая функция закона
проявляется в том, что закон может дать толчок
развитию других направлений науки.
Периодический закон способствовал развитию
теории строения атома, что дало самому закону
более глубокое научное обоснование.
Обобщающая функция проявляется в способности
соединить отдельные факты в строгую систему
взаимосвязанных явлений.
Прогностическая функция заключается в
способности предсказывать свойства и явления.
Сообщение учащегося. Прогностическая функция периодического закона.
У 10-ти элементов Менделеев изменил принятые в то время относительные атомные массы и соответственно изменил их валентность, у 10-ти других атомные массы подправил, 8 элементов разместил в системе вопреки принятым представлениям. Все эти новшества были восприняты ученым миром как неслыханная дерзость. Но твердо убежденный в естественности своей системы, Менделеев решается на невиданный в истории химии шаг. Свойства предсказанных им экабора, экаалюминия и экасилиция он описывает с удивительной точностью и предлагает даже методы их открытия.
Открытие Л.Буабодраном галлия, Л.Нильсоном
скандия, К.Винклером германия подтвердило
прогностические возможности периодического
закона.
В 1884 г. Николай Александрович Морозов,
заключенный царским правительством за
революционную деятельность пожизненно в
Шлиссельбургскую крепость, начинает от тоски
тюремной жизни изучать химию. Он знакомится с
системой Менделеева и ставит перед собой вопрос:
нет ли периодической зависимости среди
углеводородов? Морозов составляет свою таблицу и
приходит к неожиданному выводу: все
углеводороды, как и все элементы периодической
системы, в той или иной степени активны, но среди
элементов нет химически инертных, подобно
предельным углеводородам. Возникает вопрос: а
что, если инертные элементы существуют в природе,
но пока не открыты? И Морозов предсказывает, что
эти элементы следует искать в воздухе, т. к.
скорее всего это газы.
Можно представить себе торжество Морозова, когда
он, находясь в заключении, узнал из газет, что
английский ученый У. Рамзай открыл, и именно в
воздухе, инертный газ аргон. Вскоре последовало
открытие и других инертных газов.
Так на основе периодической системы Морозову
удалось предсказать то, что не удалось сделать в
полной мере даже самому Менделееву.
Сообщение учащегося. Искусственное получение элементов
К 1937 г. общее число открытых элементов достигло 88. Самым тяжелым из них был уран – № 92. Значит, в периодической системе оставались еще 4 «окна» с номерами 43, 61, 85, 87. Все попытки найти их в природе заканчивались неудачей. Этим окнам суждено было заполниться в период с 1937 по 40-й годы, и получены они были при помощи ядерных реакций. Самым первым был искусственно получен элемент № 43 путем обстрела изотопов молибдена ядрами атомов дейтерия (дейтерий – изотоп водорода).
Ядра атомов молибдена и дейтерия сливаются,
образую ядро с зарядом 43, массой 99. Этот элемент
был назван в честь торжества техники технецием.
Искусственным путем было открыто значительное
число химических элементов.
. Ядерные реакции еще раз доказывают взаимосвязь
всех элементов, объединенных в периодическую
систему.
Сообщение учащегося. «Меченые атомы»
«Меченые атомы» – радиоактивные изотопы –
разновидности атомов одного и того же
химического элемента, отличающиеся массой.
Спонтанно делясь, они постоянно сигнализируют о
себе, и их распад можно зафиксировать
регистрационными приборами; меченые атомы
широко применяют в сельском хозяйстве, медицине,
в научных исследованиях. Так, например, было
обнаружено, какую природу имеет кислород,
выделяющийся при фотосинтезе.
Для испытаний растения поливали водой, содержащей изотоп кислорода-18, а углекислый газ содержал обычный распространенный легкий изотоп кислорода — 16. Выделяющийся при фотосинтезе кислород содержал только изотопы — 18, значит, он имеет «водное» происхождение, и этот факт сыграл определенную роль при раскрытии фотосинтетических процессов.
Учитель: Периодический закон, основанный на теории строения атома, объяснил множество явлений природы, подтвердил философские категории.
Учитель предлагает учащимся воспользоваться справочниками, словарями, ознакомиться с философскими категориями: «причина и следствие», «единичное, особенное, общее», « содержание и форма», ответить на вопросы:
1. Что помогают осознать категории общего и
особенного? Чем обусловлена общность всех
химических элементов? Чем обусловлена
особенность отдельных групп элементов и
единичность (индивидуальность) каждого из
химических элементов?
2. Что выражает бесконечная цепь причин и
следствий? Какова главная причина
периодического изменения свойств элементов?
Каковы следствия увеличения числа валентных
электронов в атомах элементов одного периода и
увеличения атомных радиусов элементов главных
подгрупп?
Учащиеся отвечают на вопросы.
Сообщение учащегося. Содержание и форма.
Любой предмет состоит из отдельных элементов и процессов, которые в совокупности составляют содержание предмета. У содержания имеется форма, форма и содержание не существуют друг без друга. В процессе развития содержание играет ведущую роль, его изменение ведет к изменению формы. Если периодический закон – это содержание, то его формой является графическое изображение – периодическая система. Существует около пятисот вариантов периодической системы (например, короткая и длинная), но содержание одно – периодическая зависимость свойств от зарядов атомных ядер элементов. В п. с. 7 периодов и 8 групп. По форме период – горизонтальный ряд элементов, начинающийся щелочным металлом и заканчивающийся инертным элементом, а по содержанию период – это ряд элементов с одинаковым числом энергетических уровней. По форме группа – это вертикальная колонка элементов, а по содержанию – это ряд элементов, имеющих одинаковую максимальную степень окисления. По форме каждый элемент имеет свое место, свою клетку в периодической системе, а по содержанию каждый элемент можно отнести к s-, p-, d- или f семействам.
Учитель: Закон – объективная, всеобщая, необходимая и существенная связь явлений и предметов, которая характеризуется устойчивостью и повторяемо
urok.1sept.ru
Формулировка — периодический закон — Большая Энциклопедия Нефти и Газа, статья, страница 1
Формулировка — периодический закон
Cтраница 1
Формулировка периодического закона Д. И. Менделеевым и современная формулировка не противоречат друг другу, потому что для большинства элементов при увеличении заряда ядра относительная атомная масса тоже увеличивается. Существуют лишь немногие исключения из этого правила. Например, элемент № 18 аргон Аг имеет меньшую атомную массу, чем элемент № 19 калий К. [1]
Формулировка периодического закона, которую дал Д. И. Менделеев, и современная формулировка не противоречат друг другу, потому что для большинства элементов при увеличении заряда ядра атомная масса тоже увеличивается. [2]
Уточнена формулировка Периодического закона. [3]
Чем отличается формулировка периодического закона, данная Д. И. Менделеевым, от современной. [4]
Существует несколько формулировок периодического закона в ядерном аспекте. [5]
Почему предложенная Менделеевым формулировка периодического закона оказалась неточной. [6]
Заслуживает внимания и формулировка периодического закона, данная Менделеевым в лекциях: Свойства элементов, а так как очень часто смешивают понятие простых тел и элементов, то, прибавим, и простых веществ, ими образуемых, и сложных тел, эти элементы заключающих, представляют периодическую функцию от величин атомных весов, элементам свойственных. На наш 1взгляд, изучение периодичности свойств в указанной Менделеевым последовательности в настоящее время, на базе теорий строения атома и химической связи, способствует наиболее полному и глубокому раскрытию этой темы. [7]
Что характерно, некорректная формулировка периодического закона Д. И. Менделеева, не обнаруженная своевременно, стала хронической болезнью. Неоднократно менялось основание, отражающее интегративную тенденцию в законе, но оставалась неизменной сама конструкция дефиниции закона. [8]
Если говорить о формулировке Периодического закона на основе данных современной науки, то ее надо выразить таким образом, что периодическая изменяемость качества элемента находится в зависимости от изменения атомного веса, заряда ядра и конфигурации электронов. При этом как заряд ядра и порядковый номер элемента, так и конфигурация электронов могли быть определены лишь на основе Периодического закона. [9]
Уточненная в 1871 г. формулировка периодического закона, открытого Менделеевым в 1868 г., была следующая: свойства элементов ( а следовательно, образованных ими простых и сложных тел) находятся в периодической зависимости от ит атомных весов. [10]
С современных позиций некорректность формулировки Периодического закона очевидна. Это разные генетические линии развития: атомные веса — поступательная, а химические свойства — попятная. Они не связаны прямой причинно-следственной связью, а тем более функциональной зависимостью. Самое большее, на что можно было указать, это на корреляцию между двумя тенденциями развития ряда химических элементов. Выражение по мере роста атомных весов вместо от величины атомных весов наиболее адекватно выражает суть связи повторяемости свойств и величины атомных весов химических элементов. [11]
Как это следует из самой формулировки периодического закона, он относится к свойствам элементов. Однако, поскольку свойства простых тел зависят, главным образом, от свойств атомов элементов, их образующих, постольку периодичность в подавляющем большинстве случаев проявляется и для простых тел. [12]
Так теория строения атомов позволила уточнить формулировку периодического закона и более глубоко раскрыть его сущность. [14]
Страницы: 1 2 3
www.ngpedia.ru
Экзаменационный билет № 21
1. Закон Мозли. Роль закона Мозли. Современная формулировка Периодического закона.
Закон Мозли — закон, связывающий частоту спектральных линий характеристического рентгеновского излучения атома химического элемента с его порядковым номером.
Согласно
Закону Мозли, корень
квадратный из
частоты 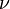 спектральной
линии характеристического
излучения элемента есть линейная
функция его
порядкового номера
спектральной
линии характеристического
излучения элемента есть линейная
функция его
порядкового номера  :
: 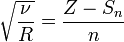
где 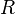 — постоянная
Ридберга,
— постоянная
Ридберга,  — постоянная
экранирования,
— постоянная
экранирования, 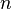 — главное
квантовое число.
На диаграмме Мозли зависимость
от
— главное
квантовое число.
На диаграмме Мозли зависимость
от 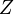 представляет
собой ряд прямых (К-, L-, М- и т. д. серии,
соответствующие значениям n = 1, 2, 3,…).
представляет
собой ряд прямых (К-, L-, М- и т. д. серии,
соответствующие значениям n = 1, 2, 3,…).
Закон
Мозли явился неопровержимым доказательством
правильности размещения элементов
в периодической
системе элементов Д.
И. Менделеева и
содействовал выяснению физического
смысла 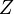 .
.
В соответствии с Законом Мозли, рентгеновские характеристические спектры не обнаруживают периодических закономерностей, присущих оптическим спектрам. Это указывает на то, что проявляющиеся в характеристических рентгеновских спектрах внутренние электронные оболочки атомов всех элементов имеют аналогичное строение.
Более поздние эксперименты выявили некоторые отклонения от линейной зависимости для переходных групп элементов, связанные с изменением порядка заполнения внешних электронных оболочек, а также для тяжёлых атомов, появляющиеся в результате релятивистских эффектов (условно объясняемых тем, что скорости внутренних электронов сравнимы со скоростью света).
В зависимости от ряда факторов — от числа нуклонов в ядре атома (изотопический сдвиг), состояния внешних электронных оболочек (химический сдвиг) и пр. — положение спектральных линий на диаграмме Мозли может несколько изменяться. Изучение этих сдвигов позволяет получать детальные сведения об атоме.
2. Особенности протекания химических реакций в растворах электролитов. Признаки протекания реакций в растворах электролитов.
Электролиты – это вещества, растворы которых обладают ионной проводимостью.
Поскольку электролиты в растворах образуют ионы, то для отражения сущности реакций часто используют так называемые ионные уравнения реакций. Написанием ионных уравнений подчёркивается тот факт, что, согласно теории диссоциации, в растворах происходят реакции не между молекулами, а между ионами.
С точки зрения теории диссоциации при реакциях между ионами в растворах электролитов возможны два исхода:
1. Образующиеся вещества – сильные электролиты, хорошо растворимые в воде и полностью диссоциирующие на ионы.
2. Одно (или несколько) из образующихся веществ – газ, осадок или слабый электролит (хорошо растворимый в воде).
Например, можно рассмотреть две реакции:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2, (1)
2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2. (2)
В ионной форме уравнения (1) и (2) запишутся следующим образом:
2Al + 2Na+ + 2OH— + 6 H2O = 2Na+ + 2[Al(OH)4]— + 3H2, (3)
2Al + 2K+ + 2OH— + 6 H2O = 2K+ + 2[Al(OH)4]— + 3H2, (4)
В данном случае алюминий не является электролитом, а молекула воды записывается в недиссоциированной форме потому, что является очень слабым электролитом. Неполярные молекулы водорода практически нерастворимы в воде и удаляются из сферы реакции. Одинаковые ионы в обеих частях уравнений (3), (4) можно сократить, и тогда эти уравнения преобразуются в одно сокращённое ионное уравнение взаимодействия алюминия с щелочами:
2Al + 2OH— + 6H2O = 2[Al(OH)4]— + 3H2. (5)
Очевидно, что при взаимодействии алюминия с любой щелочью реакция будет описываться уравнением (5). Следовательно, ионное уравнение, в отличие от молекулярного, относится не к одной какой-нибудь реакции между конкретными веществами, а к целой группе аналогичных реакций. В этом его большая практическая ценность и значение, например благодаря этому широко используются качественные реакции на различные ионы.
Так, при помощи ионов серебра Ag+ можно обнаружить присутствие в растворе ионов галогенов, а при помощи ионов галогенов можно обнаружить ионы серебра; при помощи ионов бария Ba2+ можно обнаружить ионы SO2- и наоборот.
С учётом вышеизложенного можно сформулировать правило, которым удобно руководствоваться при изучении процессов, протекающих в растворах электролитов.
Реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
Следовательно, реакции идут с образованием веществ с меньшей концентрацией ионов в растворе в соответствии с законом действующих масс. Скорость прямой реакции пропорциональна произведению концентраций ионов реагирующих компонентов, а скорость обратной реакции пропорциональна произведению концентраций ионов продуктов. Но при образовании газов, осадков и слабых электролитов ионы связываются (уходят из раствора) и скорость обратной реакции уменьшается.
studfile.net