Физические явления в химии (8 класс)
Составила: Филиппова Е.А.
Цель урока: формирование познавательных УУД при изучении физических и химических явлений, признаков протекания химических реакций, их практического значения через проблемное обучение и исследовательскую деятельность.
Тип урока: Урок открытия новых знаний (изучения нового материала).
Формы организации познавательной деятельности: индивидуальная, фронтальная, групповая.
Методы обучения: частично-поисковый, объяснительно-иллюстративный, исследовательский.
Технологии обучения: технология проблемного диалога, исследовательская технология
Обеспечение урока: компьютер, проектор, электронная презентация, выполненная в программе PowerPoint, раздаточный материал (памятки по ТБ, карточки — инструкции для выполнения лабораторной работы, карточки с заданием), химическое оборудования для выполнения лабораторных опытов.
УМК: Химия. 8 класс. Учебник-навигатор. ФГОС. Габриелян О.С., Сивоглазов В.И., Сладков С.А.- М.:Дрофа, 2014.
8 класс. Учебник-навигатор. ФГОС. Габриелян О.С., Сивоглазов В.И., Сладков С.А.- М.:Дрофа, 2014.
Цель: проверка готовности учащихся к уроку
Приветствие учащихся, включение в деловой ритм. Эмоциональный настрой.
Проверка рабочих мест, готовятся к уроку.
Личностные:формирование личностного смысла обучения.
Регулятивные: готовятся к началу урока.
Коммуникативные:используют речевые средства общения.
II. Этап актуализации и фиксирования индивидуального затруднения в проблемном действии.
Цель: подготовка мышления учащихся, организация ими внутренней потребности к построению учебных действий, фиксирование индивидуального затруднения
Актуализация знаний.
Организует повторение понятий “химия”, “вещество”, “свойства веществ”.
Давайте с вами вспомним, что изучает наука химия?
Что такое свойства веществ?
На какие две группы можно разделить свойства веществ?
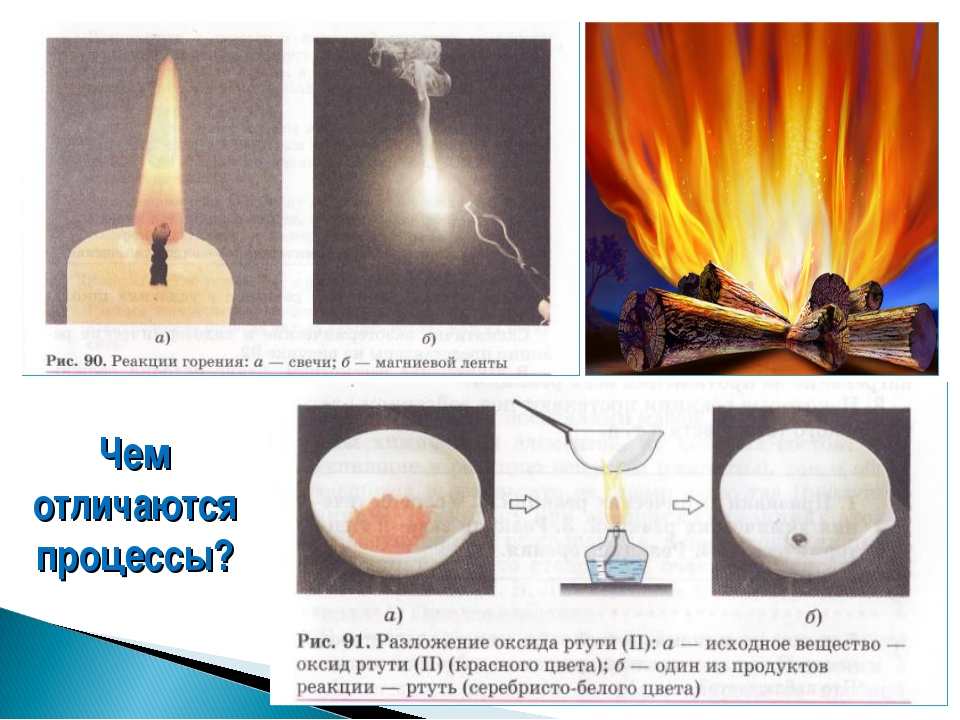
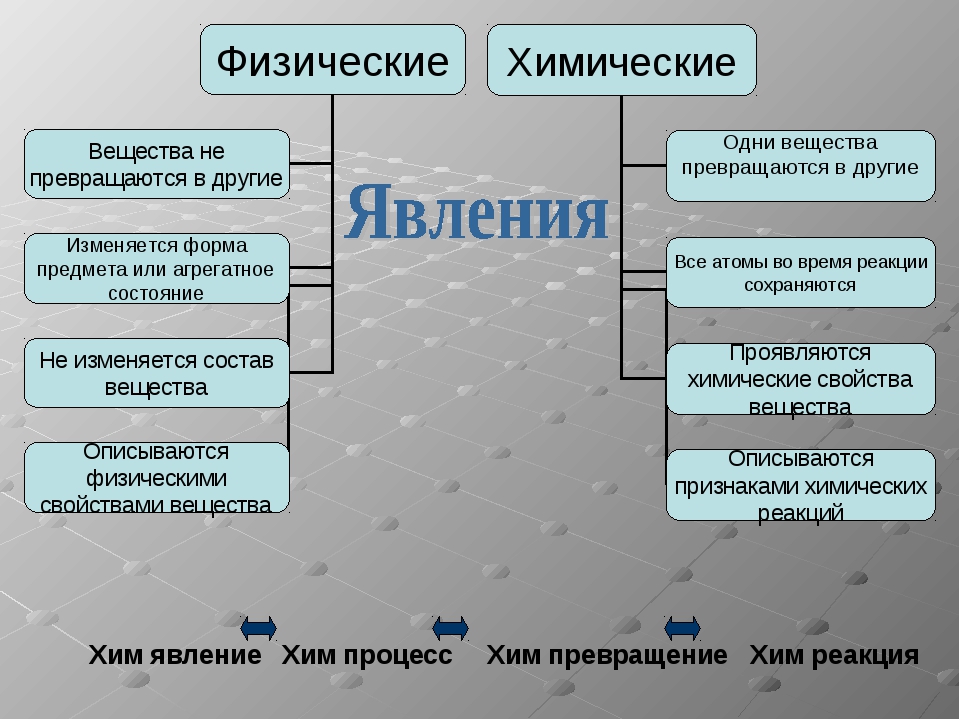
Хорошо, значит если свойства веществ можно разделить на физические и химические.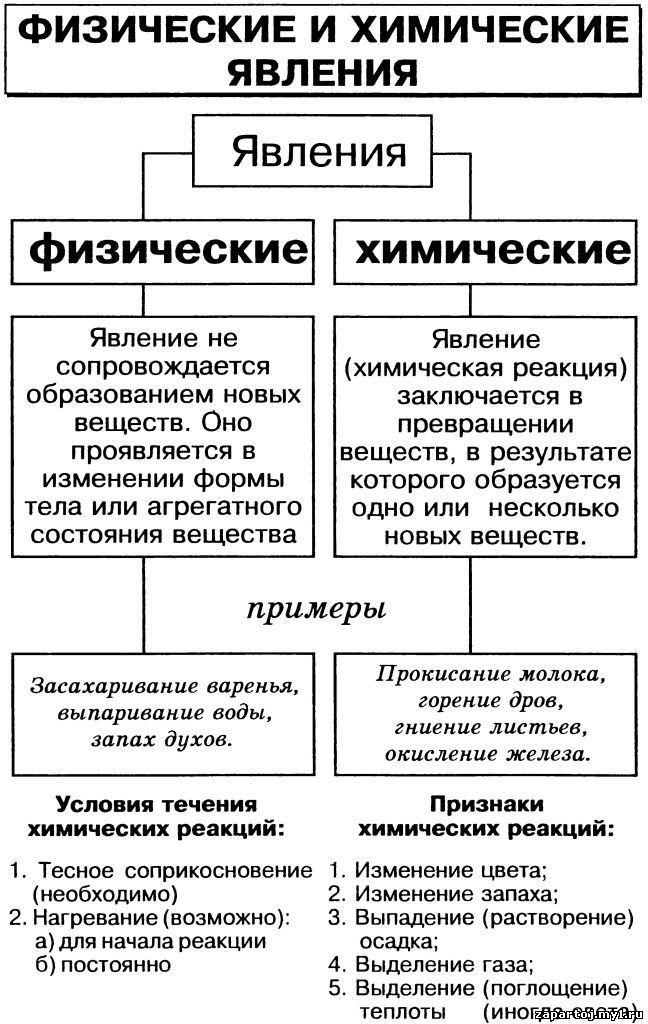 То и явления, происходящие вокруг нас можно разделить на физические и химические?
То и явления, происходящие вокруг нас можно разделить на физические и химические?
Дают определение понятиям, описывают физические свойства вещества.
Химия- наука о веществах, их свойствах и превращениях.
Это признаки, по которым одни вещества отличаются от других.
Физические и химические.
Формулирование ответов (да, нет, возможно).
Учащиеся выдвигают гипотезы:
Познавательные: выдвижение гипотез, их обоснование, выделение того, что уже пройдено.
Коммуникативные: умение давать определение понятиям, описывать свойства веществ; воспроизводить и фиксировать затруднения
Регулятивные:формулируют ответ, осуществляют целеполагание.
Давайте посмотрим несколько слайдов.
Слайды презентации: извержение вулкана, образование инея, образование тумана, образование облаков, таяние льда, плавление металла.
Что мы можем найти общее на этих картинках?
Давайте посмотрим ещё несколько слайдов.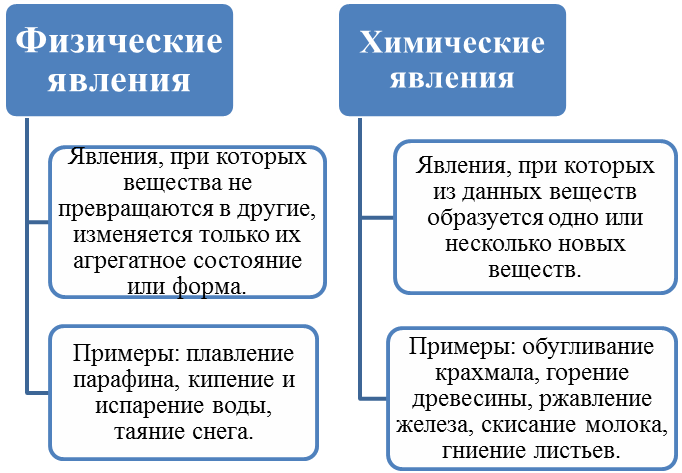
Слайды презентации: гниение листьев осенью, горение древесины, горение бумаги, скисание молока.
Что мы сейчас увидели, есть ли общее у этих явлений?
Создание проблемной ситуации
Как вы определили, что на первом слайде физические явления, а на втором слайде химические явления? Можно ли ответить на этот вопрос с точки зрения химии?
1) По первым слайдам презентации: извержение вулкана, образование инея, образование тумана,образование облаков, таяние льда – это физические явления.
2) По следующим слайдам презентации: гниение листьев осенью, горение древесины, горение бумаги, скисание молока — к физическим явлениям не относятся (химические).
3) делают вывод, что для ответа на вопросы знаний недостаточно.
Делают умозаключения, сравнения, выводы.
Отвечают на поставленные вопросы, опираясь на ранее полученные знания и жизненный опыт. (испытывают затруднения при объяснении сущности физических и химических явлений, выявлении признаков химических реакций, условий их протекания)
III. Этап выявления места и причины затруднения.
Этап выявления места и причины затруднения.
Цель: организация анализа учащимися возникшей ситуации и выявление причины затруднения, подведение детей к формулированию темы и постановке цели урока
Попробуйте сформулировать тему урока, т.е. что мы сегодня будем с вами изучать?
Какова цель нашего урока?
Формулируют и записывают в тетрадь тему урока: “Физические явления. Химические реакции”.
Определяют цель урока: Выявить различия между физическими и химическими явлениями, изучить признаки химических реакций.
Познавательные (общеучебные):
постановка и формулирование проблемы;самостоятельное выделение и формулирование познавательной цели.
Коммуникативные: умение слушать, учитывать позиции других людей, владеть монологической и диалогической формами речи.
IV. Этап построения проекта выхода из затруднения.
Цель: постановка цели учебной деятельности и выбор способа и средств их реализации
Составим последовательность наших шагов для достижения цели урока (формулируется в совместной беседе с учащимися).
1. Вспомнить, всё, что вы уже знаем по этой теме из физики, природоведения, из жизни.
2. Выяснить, что такое физические и химические явления.
3. Охарактеризовать признаки отличия этих явлений друг от друга.
Познавательные:(постановка и решение проблемы): создание алгоритма деятельности.
Регулятивные(планирование): планируют последовательность действий.
Коммуникативные:планируют учебное сотрудничество.
V. Этап реализации построенного проекта.
Цель: формирование умений у учащихся применения нового способа действий
Перед тем, как вы приступите к работе, вы должны разделиться на 5 групп. Каждая группа получает инструктивную карту с описанием того, что вы должны сегодня на уроке выполнить. Но прежде всего, давайте с вами вспомним правила работы в группе (слайд)
Задание № 1: Пользуясь текстом учебника, на страницах 129,135 заполните таблицу. (Происходит обсуждение вопросов в группах, результат заносится в тетрадь).
Работают с текстом учебника, анализируют информацию, заполняют таблицу.
Явления
Определение
Признаки
Физические явления
Явления, при которых вещества не превращаются в другие, а только меняется их агрегатное состояние или форма.
Изменение агрегатного состояния, формы.
Химические явления
Явления, при которых из данных веществ образуется одно или несколько новых веществ.
Изменение окраски;
Образование или растворение осадка;
Изменение запаха;
Выделение газа;
Поглощение или выделение теплоты (иногда и света).
Регулятивные: коррекция – внесение дополнений в план действия
Познавательные:
общеучебные – смысловое чтение, извлечение необходимой информации, преобразование;
логические – анализ.
Коммуникативные: умение точно формулировать свою мысль,взаимодействие в групповом коллективе для принятия эффективных совместных решений.
По окончании заполнения таблицы проверяем правильность её заполнения на доске. Заранее подготовить признаки и примеры явлений для оформления таблица на доске в распечатанном виде.
Признаки: вещество не изменяется, образуется новое вещество, меняется форма, меняется агрегатное состояние, изменение цвета, образование осадка, образование газа, появление запаха.
Примеры: плавление парафина, испарение воды, таяние снега, горение древесины, ржавление железа, скисание молока, гниение листьев.
Вывод: (делают сами учащиеся, учитель лишь корректирует)
Работа учащихся у доски. От каждой группы приглашается к доске учащийся и выполняет задание.
Явления
Признаки
Примеры
Физические явления
Изменение агрегатного состояния, формы.
Плавление парафина, кипение и испарение воды, таяние снега.
Химические явления
Изменение окраски;
Образование или растворение осадка;
Изменение запаха;
Выделение газа;
Поглощение или выделение теплоты (иногда и света).
Oбугливание крахмала, горение древесины, ржавление железа, скисание молока, гниение листьев
Регулятивные: умение исправлять ошибки.
Познавательные: умение структурировать знания, осознанно строить речевое высказывание;
логические – синтез (достраивание информации).
Коммуникативные: умение точно формулировать свою мысль, принимать решение.
VI. Этап первичного закрепления с проговариванием во внешней речи.
Цель: усвоение учащимися нового способа действия
Задание №2: На примере конкретных химических реакций рассмотрим признаки. (Напомнить правила по технике безопасности).
Выполняем лабораторные опыты и заносим результаты в таблицу. (Работа с лабораторными опытами проводится в группах, что предусматривает обсуждение результатов между членами групп.)
По инструктивным картам по группам выполняют лабораторные опыт, фиксируют в инструктивной карте наблюдаемые явления, делают вывод.
Обсуждают результаты и сверяют их с эталоном. (слайд).
Регулятивные:планирование последовательности действий.
Познавательные:логические -построение цепи рассуждения, формулирование выводов
Коммуникативные: умение точно выражать свои мысли.
Во время проверки на каждый пример необходимо задать вопрос: А где подобные признаки реакции можно видеть в нашей повседневной жизни?
Какую роль играют физические и химические явления в жизни человека?
Особое внимание уделите 5 опыту.Как доказать, является ли взаимодействие кислоты и щелочи химической реакцией?
— бутылка с минеральной водой, мама окрасила волосы, сода и уксус — для теста.
Ответы учащихся.
Использование индикатора.
VII. Этап самостоятельной проверки с самопроверкой по эталону.
Цель: исполнительная рефлексия
Задание №3: В качестве проверки усвоения изученного материла, учащиеся работают с тестом “Физически и химические явления”
После того как вы оценили друг друга, давайте вернёмся к основному вопросу нашей темы и ещё раз сделаем вывод, что такое физические и химические явления и чем они отличаются друг от друга.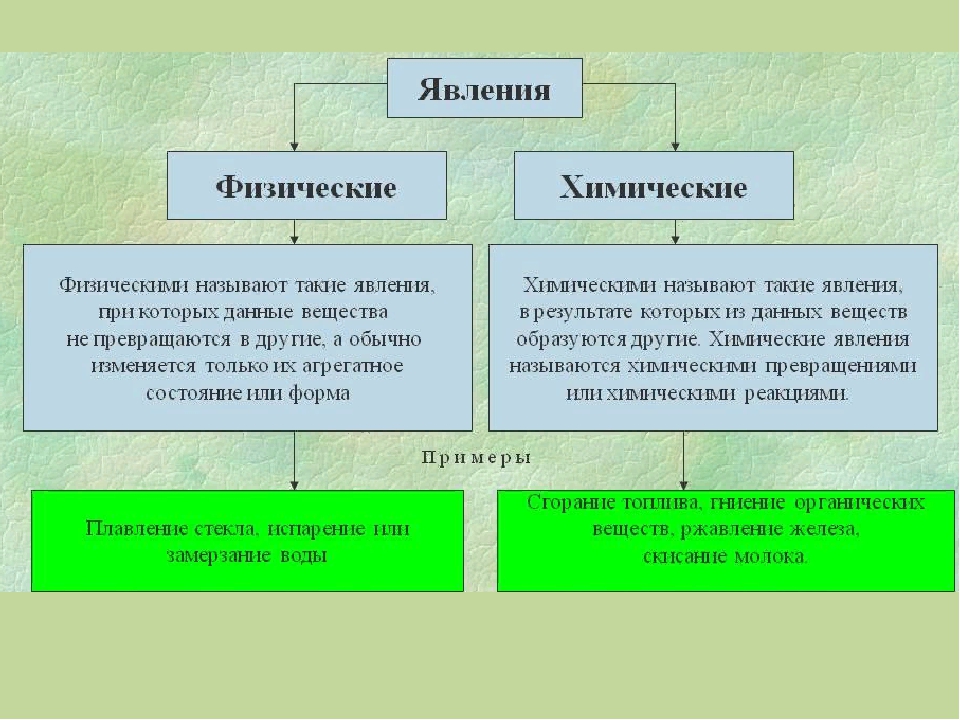
Выполняют тест, осуществляют взаимопроверку по эталону, анализируют результат.
Регулятивные:планирование последовательности действий, контроль по эталону, коррекция реального действия и результата, оценка того, что усвоено и что еще нужно усвоить.
VIII. Этап включения в систему системы знаний и повторения.
Цель: повторение и закрепление изученного, выявление границы применимости нового знания и использование его в системе изученных ранее знаний.
Анализирует работу класса, нацеливает на формулирование выводов по уроку. Выставляет оценки. Предлагает разноуровневые домашние задания по выбору, комментирует предложенные задания:
1 уровень: параграфы 24-25, выучить определения, стр.105 упр.2,4; стр.108 упр.1,2,4.
2 уровень: параграфы 24-25, составить тест по изученной теме или сделать подборку стихов, загадок, пословиц о химических и физических явлениях.
3 уровень: параграфы 24-25, мини-проект “Физические и химические явления в повседневной жизни”
Подводят итог своей деятельности, высказывая, формулируют умения устанавливать значения результатов своей деятельности для удовлетворения своих потребностей, мотивов, жизненных интересов.
Коммуникативные: умение слушать, учитывать позиции других людей, владеть монологической и диалогической формами речи.
IX. Этап рефлексии учебной деятельности. Цель: самооценка учащимися результатов своей деятельности.
А теперь закончим предложения и наш урок
Сегодня я понял……
Меня удивило……
Мне захотелось……
Особенно интересно было….
Урок окончен. Спасибо за урок.
Слушают, задают вопросы на понимание и уточнение, участвуют в обсуждении,
выражают собственное мнение о работе и полученном результате.
Личностные:смыслообразование – установление учащимися связи между учебной целью, деятельностью и результатом учения.
Физические и химические явления. признаки химических реакций. условия течения и возникновения химических реакций — Химия — 8 класс
Вещества, в отличие от смесей, обладают постоянными свойствами. При температуре ниже 0°С вода является твёрдым веществом, поэтому зимой обычно идёт снег
Весной столбик термометра поднимается выше, и снег тает, превращаясь в жидкость, но по-прежнему остаётся водой
Летняя жара способствует быстрому испарению воды и она превращается в водяной пар.
Когда мы кипятим чайник, то видим выделяющиеся пузырьки газа, вода кипит и превращается в пар, но на холодных частях посуды образуются капли все той же воды. То есть образования нового вещества не происходит
А что будет, если мы пропустим через воду электрический ток?
Вода разлагается на два разных вещества, водород и кислород. То есть происходит образование новых веществ.
На поверхности железа с течением времени образуется ржавчина. Тоже новое вещество.
С веществами могут происходить различные изменения. Иногда меняется агрегатное состояние вещества, форма тела, из которого состоит вещество, тогда мы говорим, что это физическое явление. А если происходит образование нового вещества, то это химическое явление.
(сопровождает видео) Готовое к употреблению мясо приобретает ни с чем не сравнимый аромат
(сопровождает видео) соляная кислота так действует на цинковый порошок.
Какие изменения мы наблюдаем во время химической реакции?
На поверхности железа с течением времени образуется ржавчина.
 Тоже новое вещество.
Тоже новое вещество. С веществами могут происходить различные изменения. Иногда меняется агрегатное состояние вещества, форма тела, из которого состоит вещество, тогда мы говорим, что это физическое явление. А если происходит образование нового вещества, то это химическое явление.
Очень часто химические реакции сопровождаются признаками.
(сопровождает видео) Готовое к употреблению мясо приобретает ни с чем не сравнимый аромат
(сопровождает видео) соляная кислота так действует на цинковый порошок.
Какие изменения мы наблюдаем во время химической реакции?
Посмотрим, что происходит при взаимодействие нитрата свинца и йодида натрия
Какой признак сопровождает эту химическую реакцию.
Химические реакции не начинаются просто так, например, чтобы в воздухе образовался озон, необходим разряд молнии.
Чтобы сахар обуглился, его надо поджечь
Чтобы реакция продолжалась, так же нужно соблюдать условия: например, чтобы свеча горела, нужет постоянный приток кислорода.
 , а вода разлагается на водород и кислород только под действием постоянного электрического тока.
, а вода разлагается на водород и кислород только под действием постоянного электрического тока.Урок химии в 8-м классе по теме «Физические и химические явления. Признаки химических реакций»
Цель: совершенствовать умение отличать физические процессы от химических, выяснить признаки химических реакций.
Задачи:
- Усвоить понятия «физические явления», «химические явления», химическая реакция.
- Изучить признаки протекания химических реакций.
- Развивать логическое мышление, память, внимание, умение сравнивать и анализировать, умение применять полученные знания и навыки при выполнении практических упражнений.
- Воспитывать трудолюбие, целеустремленность, культуру речи и общения.
Формы работы: коллективно-групповая, индивидуальная.
Тип урока: урок формирования новых знаний.
Оборудование: презентация к уроку, раздаточный материал; спиртовка, пробиркодержатель, спички.
Реактивы: растворы соляной кислоты, гидроксида натрия, сульфата меди (II), цинк, сахарный песок, спирт.
План урока.
1. Вступительное слово (формулировка темы и цели урока).
3.Формулировка определений – физических и химических явлений, исходя из результатов групповой работы.
4. Лабораторная работа: «Признаки химических реакций».
5. Вывод по результатам лабораторной работы.
6. Домашнее задание.
7. Рефлексия.
Ход урока
Вступление (Приложение: слайд № 1)
«Химии никоим образом научиться невозможно, не видав самой практики и не принимаясь за химические операции.»
М.В. Ломоносов (слайд)
Как вы понимаете эти слова? (изучение химии невозможно без практики)
Действительно, для того чтобы проводить опыты, нужно знать какие вещества необходимо взять.
Какие классы неорганических веществ вы знаете? Назовите их (оксиды, кислоты, соли, основания)
Вы знаете вещества, знаете их состав, строение.
Отсюда вытекает тема нашего сегодняшнего урока, как вы ее сформулируете? «Физические и химические явления». А всегда ли вы можете с уверенностью сказать, о каком явлении идет речь – физическом или химическом? (Нет). Что для этого необходимо знать? (Признаки)
Совершенно верно. Поэтому дополняем нашу тему: «Физические и химические явления. Признаки химических реакций» (Приложение: слайд № 2). Исходя из темы органично исходит и цель нашего урока. Чему же вы должны научиться в ходе сегодняшнего урока?
Приложение: слайд № 3)
(Дети формулируют цель урока, учитель ее записывает на доске). Я запишу цели нашего урока, чтобы в конце урока вы к ним вернулись и выяснили, достигли вы этих целей или нет.
Что ж, приступаем к нашему уроку.
Задание № 1 (групповая работа) (Приложение: слайд № 4)
Первоначально нам необходимо вспомнить уже известные вам определения физических и химических явлений. Для этого у вас на столах лежат разрезанные карточки с отдельными словами, относящиеся к определению физических и химических явлений. Я попрошу вас из этих слов восстановить определения данных явлений. Работаете группой. На работу отводится 1 мин. Чтобы я видела, что ваш стол справился с заданием, по окончании поднимите руки. (Я прошу зачитать получившееся определение физических явлений стол № …)
Идем дальше.
Задание № 2 (групповая работа) (Приложение: слайд № 5)
Чтобы вспомнить, что по своей сути представляют физические и хим. явления, я предлагаю вам выполнить следующее задание.
 Приступаем к обсуждению. На работу вам отводится 0,5 мин.
Приступаем к обсуждению. На работу вам отводится 0,5 мин. 1.
Приятна мне твоя прощальная краса –
Люблю я пышное природы увяданье.
В багрец и золото, одетые леса.
(А.С.Пушкин)
2.
И трещат сухие сучья,
Разгораясь жарко.
Освящая тьму ночную
Далеко и жарко!
(И.Суриков)
3.
В декабре, в декабре
Все деревья в серебре.
Нашу речку, словно в сказке
За ночь вымостил мороз…
(С.Я.Маршак)
4.
А если медь в печи нагреть.
То станет тяжелее медь
С окалиною вместе.
Не верите – так взвесьте…
(Е.Ефимовский)
5.
Что за звездочки резные
На пальто и на платке?
Все сквозные, вырезные,
А возьмешь – вода в руке?
(Е.Благинина)
6.
На рукомойнике моем
Позеленела медь.
Но так играет луч на нем,
Что весело смотреть.
(А.Ахматова)
Как видно из примеров, физические и химические явления весьма распространены в природе и многие из них используются во благо человека.
Сегодня мы должны более подробно ознакомиться с химическими явлениями.
Сейчас я вам продемонстрирую опыт – разложение сахара. Вы должны прокомментировать его и сделать вывод — относится ли этот процесс к физическому или к химическому (Показ опыта. Ответ учеников).
По каким признакам вы относите это явление к химическому? (Изменение цвета, запаха). Т. образом, химические реакции всегда сопровождаются видимыми изменениями, поэтому, чтобы научиться отличать химические явления от физических, необходимо научиться, прежде всего, наблюдать, чем мы сейчас с вами и займемся.
Задание № 3 (Приложение: слайд № 6)
Вам предстоит провести лабораторную работу, исходя из которой, вы должны выяснить, какими признаками могут сопровождаться химические реакции. Перед практической работой – инструктаж:
1. при работе с кислотами и щелочами необходимо соблюдать осторожность, т.к. это едкие вещества. Все работы проводить над столом;
при работе с кислотами и щелочами необходимо соблюдать осторожность, т.к. это едкие вещества. Все работы проводить над столом;
2. растворы веществ наливать в пробирки в небольших количествах, по 1 мл, что соответствует 1 см;
Проведение лабораторной работы
| Названия исходных веществ | Наблюдения |
|
|
|
|
|
|
|
|
|
|
После работы проверка результатов заполнения таблицы (Приложение: слайд № 7)
Исходя из своих наблюдений, сделайте вывод – какими же признаками могут сопровождаться химические реакции (Ответы учеников).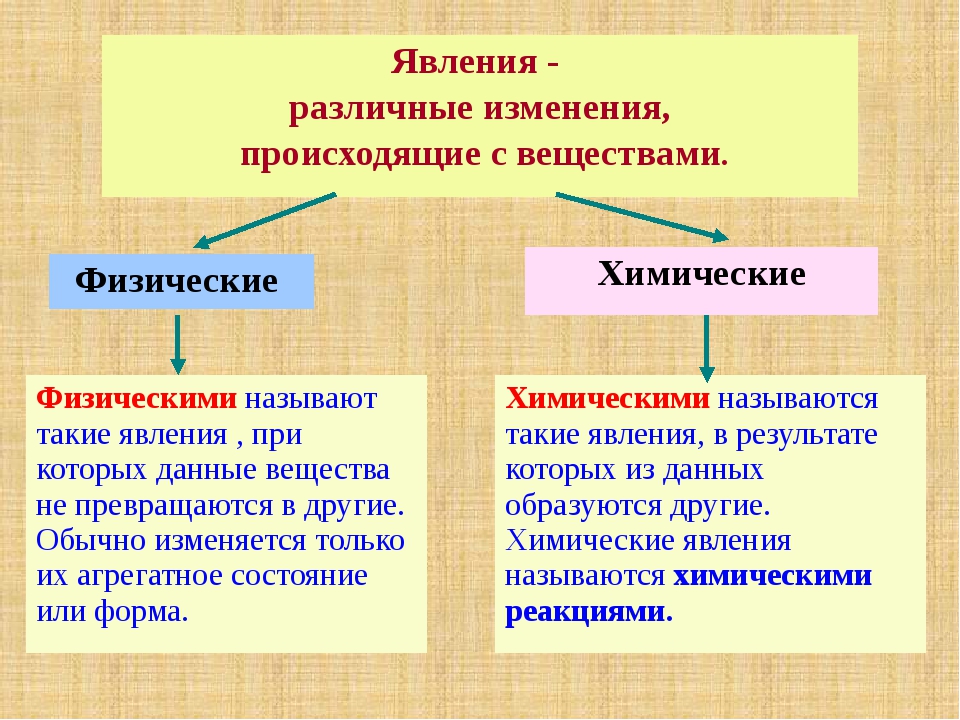
Вывод: химические реакции могут сопровождаться следующими признаками: (
- образованием осадка или его растворением;
- выделением газа;
- выделением (поглощением) тепла, иногда света;
- изменением цвета;
- изменением запаха.
Задание № 4 (Приложение: слайд № 9)
Для того, чтобы проверить, насколько результативным было изучение новой темы, вам сейчас предстоит пройти небольшой индивидуальный тест. На работу 2 мин. + 1 мин. на взаимопроверку.
Вариант 1.
Из приведенных явлений выделите знаком «+» те, которые относятся к физическим:
1) таяние льда;
2) помутнение известковой воды от углекислого газа;
3) растирание кусочка сахара в порошок;
4) растворение сахара в воде;
5) почернение медной пластинки при накаливании.
Вариант 2.
Из приведенных явлений выпишите те, которые относятся к химическим:
1) замерзание воды;
2) прокисание молока;
3) ржавление гвоздя;
4) растворение уксусной кислоты в воде;
5) гниение дерева.
Вариант 3.
Из приведенных явлений выпишите те, которые относятся к химическим:
1) ковка металла;
2) образование снежинок;
3) горение спирта;
4) прокисание яблочного сока;
5) обугливание лучинки.
Вариант 4.
Из приведенных явлений выпишите те, которые относятся к физическим:
а) исчезновение черного налета на серебряных ложках при обработке их раствором уксусной кислоты;
1) испарение спирта;
2) замерзание воды;
3) горение магния;
4) растворение сахара в воде
5) подгорание пищи на сковороде;
Отложите ручки, возьмите в руки карандаши, поменяйтесь тестами с партнером по плечу и проверьте работы друг друга (Приложение: слайд № 10), оцените работы (Приложение: слайд № 11).
Ученика под № 1 за каждым столом я попрошу собрать тесты и сдать их мне.
Ну что ж, возвращаемся к целям урока, которые были поставлены нами вначале занятия и смотрим, достигнуты ли вами цели? Все ли мы с вами повторили и изучили?
Цель урока:
- совершенствовать умения отличать физические явления от химических;
- выяснить признаки химических реакций.

Поднимите руки те, кто не достиг этих целей?
Ваше д/з. Оно будет следующим.
1. Повторение определений.
2. Изучение параграфа 26, в. 1-3 стр. 94-95 (Приложение: слайд № 12)
Благодарю вас за работу на уроке и прежде чем вы покинете кабинет заполните листочек с рефлексией и сдайте его мне, это будет ваш билет на выход.
Рефлексия (2 мин.) (Приложение: слайд № 13)
Продолжите предложение:
Изучая тему «Физические и химические явления»
- Раньше я думал что …
- Теперь я узнал что …
Физические и химические явления. Лабораторный опыт № 3 «Изучение признаков химических явлений»
КР
Приём «Ключевые слова»
Задание
1. Пользуясь учебником (стр.24) ознакомьтесь с определениями понятий «физическое явление»,
«химическое явление». В чём различие физических и химических явлений?
ФО – словесные комментарии учителя (похвала)
ГР
Приём «Химический эксперимент»
Учитель напоминает учащихся о соблюдении правил техники безопасности при выполнении опытов. Работу оформить на бумаге А3
Работу оформить на бумаге А3
1 группа
1.Рассмотрите сахар –рафинад.
2.Измельчите рафинад в сахар-песок
3.Растворите измельчённый сахар в воде
Что произошло с сахаром?
К каким явлениям следует отнести изменение сахара при измельчении? Дайте обоснованный ответ
К каким явлениям следует отнести изменение сахара при растворении его в воде? Дайте обоснованный ответ
2 группа
1.Возьмите кусочек парафина от свечи
2. Поместите кусочек парафина в фарфоровую чашку и нагревайте его до расплавления
3.После расплавления, потушите пламя и рассмотрите содержимое фарфоровой чашки
Что произошло с парафином?
К каким явлениям следует отнести изменение парафина при нагревании? Ответ обоснуйте
3 группа
1.Возьмите стеклянную трубку
2.Поместите её средней часть в пламя спиртовки.
3. После сильного накаливания попытайтесь осторожно согнуть. Потушите пламя спиртовки
Что произошло со стеклянной трубкой?
К каким явлениям следует отнести изменение стеклянной трубки при нагревании? Ответ обоснуйте
ФО
Взаимооценивание
Приём «Две звезды и одно пожелание»
Физминутка «Движение – жизнь»
ГР
Приём «Лабораторный опыт»
Теперь давайте ознакомимся с химическими явлениями и их признаками. Предлагаю выполнить лабораторный опыт
Предлагаю выполнить лабораторный опыт
«Изучение признаков химических явлений»
Учитель напоминает учащимся о соблюдении правил техники безопасности при выполнении опытов
Задание для выполнения
1 группа
Проведите опыт, используя предложенный план действий
Запишите наблюдения
Сделайте вывод о признаках химических явлений
План действий | Наблюдение | Вывод |
Поместите измельчённый сахар в железную ложку и нагрейте |
2 группа
Проведите опыт, используя предложенный план действий
Запишите наблюдения
Сделайте вывод о признаках химических явлений
План действий | Наблюдение | Вывод |
На свежий срез картофеля капните раствор йода |
3группа
1. Проведите опыт, используя предложенный план действий
Проведите опыт, используя предложенный план действий
Запишите наблюдения
Сделайте вывод о признаках химических явлений
План действий | Наблюдение | Вывод |
Налейте в пробирку немного уксусной кислоты и опустите в неё кусочек мела |
Дескриптор
Обучающиеся
— проводят лабораторные опыты согласно предложенному плану действий
— записывают наблюдения;
— формулируют вывод о признаках химических явлений
Каждая группа презентует результаты.
ФО
Самооценивание
Приём «Большой палец»
Классу демонстрируется образец заполненной таблицы, они сравнивают со своей работой.
С помощью приема «Большой палец» исходя из следующих критериев:
— записаны верно наблюдения
— верно записан вывод
Указаны верно наблюдения и вывод – палец вверх
Допущены ошибки либо в наблюдениях, либо неверный вывод – палец вниз
учебник
карточки с заданиями для
сахар –рафинад, вода, стеклянная палочка, химический стакан, ступка и пестик
парафиновая свеча, скальпель, фарфоровая чашка, штатив, спиртовка
стеклянная трубка, спиртовка
стикеры
распечатанные задания для каждой группы
спиртовка, железная ложка,сахар-песок
срез картофеля, раствор йода, пипетка
кусочек мела; пробирка;
уксусная кислота
слайд с заполненной таблицей
СТРУКТУРА УРОКА | |||||||||||||||||||||||
1. Цель: актуализация имеющихся знаний, развитие познавательных интересов и инициативы учащихся, формирование коммуникативных умений. | |||||||||||||||||||||||
Деятельность учителя | Деятельность учащихся | ||||||||||||||||||||||
Приветствие учителя и эмоциональный настрой учащихся. ☺☺☺☺☻☻☻☻ Ты знаешь, газ мельчайший, водород, В соединении с кислородом — это Июньский дождь от всех своих щедрот, сентябрьские туманы на рассветах. Кипит железо, серебро, сурьма И тёмно – бурые растворы брома. И кажется Вселенная сама Одной лабораторией огромной. *** Ещё в полях белеет снег, А воды уж весной шумят — Бегут и будят сонный брег, Бегут и блещут и гласят… О чём же эти строки, ребята? Какова тема нашего сегодняшнего урока? | Включение учащихся в деловой ритм . Эти строки о химических и физических явлениях. например, тает снег, идет дождь, появляется туман — это физические явления, соединяется водород с кислородом, и образуется вода, кипит железо, серебро, сурьма т. е с чем-то вступает в реакцию — это химические явления. Ученик -Думаю, что тема нашего сегодняшнего урока — физические и химические явления. | ||||||||||||||||||||||
2. Цель: Создание проблемной ситуации. | |||||||||||||||||||||||
Деятельность учителя | Деятельность учащихся | ||||||||||||||||||||||
беседа Воп вопрос – проблема: Мы все с вами уже знаем, что химия – это наука, которая изучает вещества и их свойства. Нас всегда окружают какие-либо вещества, но всегда ли вещества остаются неизменными? В природе непрерывно происходит изменение агрегатного состояния вещества вещ или его формы, а также идёт образование новых веществ. С (фото физических и химических явлений: горение свечи, капли воды, приготовление пищи, растворение сахара) на доске. Явление – это изменение или процесс. Задача: познакомиться на уроке с классификацией явлений, происходящих в природе и в жизни человека. Вы знаете вещества, знаете их состав, строение. Но наши знания будут неполными, если мы не изучим явления происходящие с ними. — Какие явления могут происходить с веществом парафин, мы назовем, после того как понаблюдаем за горящей свечой. Изменение агрегатного состояния- это признак какого явления? — Физического явления. — Как будет называться явление, связанное с горением? — Химическое явление. | Учащиеся пытаются ответить на поставленные вопросы и понимают, что не всё им под силу. Ответы учащихся — плавление парафина затвердевание парафина горение парафина. | ||||||||||||||||||||||
3. Целеполагание. Цель: формирование познавательных мотивов учебной деятельности | |||||||||||||||||||||||
Деятельность учителя | Деятельность учащихся | ||||||||||||||||||||||
Сравнительная характеристика химических и физических явлений Работа в группах Лабораторная работа: «Физические и химические явления»Оборудование и материалы: Химический стаканчик с водой, штатив с пробирками, сухое горючее, асбестовая сетка, держатель, пробка для пробирки; Кусочек цинка (металлического), раствор соляной кислоты (HCl), раствор сульфата меди (CuSO4), раствор гидроксида натрия (NaOH), хлорид натрия (поваренная соль) (NaCl). Задание: Поместите в пробирку немного поваренной соли (хлорид натрия) и добавьте воды. Встряхните пробирку. Налейте в пробирку немного воды, заткните горлышко пробирки пробкой и нагрейте воду до кипения. В пробирку с кусочком металлического цинка прилейте несколько капель раствора соляной кислоты (HCl). К раствору сульфата меди (II) добавьте 2 –3 капли раствора гидроксида натрия.
Дополнить таблицу
ЗАПОМНИТЕ!!!! | Работа в группах, записи в тетрадях. Выводы по работе: В первом опыте соль растворилась в воде, во втором – вода поменяла агрегатное состояние, в третьем выделился газ, а в четвертом – выпал осадок. Заполняют таблицу в тетрадях. Взаимопроверка в парах. С ВЫВОД : Вещества в ходе первых экспериментов остаются сами собой. В ходе двух последних — они превращаются в другие вещества. Записи в тетради!!! | ||||||||||||||||||||||
4. Планирование. Цель: формирование способностей анализировать, сравнивать имеющийся учебный материал | |||||||||||||||||||||||
Деятельность учителя | Деятельность учащихся | ||||||||||||||||||||||
В учебнике ознакомьтесь с правилами физических и химических явлений. РАБОТА С УЧЕБНИКОМ (О.С. Габриелян. § 26 с.90-91)
Объясните пожалуйста: данные схемы. Химическая реакцияИдет, течет или протекает Продукты реакции реагирующие (исходные) Признаки реакции Условия протекания реакции
Зап Записать!!!! Реагирующие вещества (исходные) – вещества, присутствующие вначале реакции. Продукты реакции – вещества, образующиеся в ходе реакции. Условия протекания реакции – то, что необходимо выполнить, чтобы реакция началась и продолжала протекать. Признаки реакции: Так как в результате химической реакции образуются новые вещества, обладающие другими свойствами, не схожими со свойствами исходных веществ, то внешние качественные характеристики смеси меняются.
| Работа в парах. Заполнение сравнительной таблицы
Ответы учащихся. Высказывание учащихся. | ||||||||||||||||||||||
5. «Открытие» нового знании. Цель: формирование основ теоретического мышления, развитие умений находить общее, высказывать свою точку зрения. | |||||||||||||||||||||||
Деятельность учителя | Деятельность учащихся | ||||||||||||||||||||||
Задания: Опишите реакцию горения угля, как пример химического явления по заданным характеристикам.
Заслушивает ответы учащихся, работающих в паре. Проводит рефлексию деятельности учащихся. Сегодня мы познакомились с с физическими и химическими явлениями. Вернёмся к целям, поставленным в начале урока. Удалось ли их достичь? Довольны ли работой на уроке?
| Выступление учащихся, обмен мнениями, высказываниями. УГЛЕРОД и КИСЛОРОД УГЛЕКИСЛЫЙ ГАЗ ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТ РЕАКЦИИ УСЛОВИЯ ПРОТЕКАНИЯ РЕАКЦИИ: ВОЗДУХ, НАГРЕВАНИЕ ПРИЗНАКИ РЕАКЦИИ: ВЫДЕЛЕНИЕ ТЕПЛА В реакции участвовали углерод и кислород. Образовался оксид углерода (углекислый газ). Для этого потребовался воздух и нагревание. При горении выделяется энергия. С + О2 →СО2 | ||||||||||||||||||||||
6. Цель: Применить новые знания в учебной ситуации | |||||||||||||||||||||||
Деятельность учителя | Деятельность учащихся | ||||||||||||||||||||||
Работа в группах У вас на столе лежат конверты с заданиями, вам необходимо их выполнить, соблюдая ТБ И полученные результаты занести в таблицу Опыт 1. «Взаимодействие мыльного раствора с раствором уксусной кислоты» В пробирку налить 2 мл мыльного раствора, а затем к нему добавить несколько капель уксусной кислоты, результат наблюдения занести в соответствующую графу таблицы. Опыт 2. «Взаимодействие раствора уксусной кислоты с кусочком мела» В пробирку налить 2 мл раствора уксусной кислоты, а затем опустить в нее кусочек мела. Наблюдаемый результат занести в графу таблицы. Опыт 3. «Взаимодействие сырого картофеля с раствором йода» На свежий срез картофеля капнуть капельку раствора йода, наблюдаемый результат занести в таблицу. | Выполняют задание.
Работа с таблицей | ||||||||||||||||||||||
7. Цель: формирование способностей объективно оценивать меру своего продвижения к цели урока. | |||||||||||||||||||||||
Деятельность учителя | Деятельность учащихся | ||||||||||||||||||||||
Какие явления наблюдаются в следующих стихах?1. Унылая пора! Очей очарованье! 2. И трещат сухие сучья, 3. В декабре, в декабре 4. А если медь в печи нагреть. 5. Что за звездочки резные Предлагает вспомнить тему, задачи урока; Оценить меру своего личного продвижения к цели и успехи всего класса Какой ответ на основной вопрос урока мы можем дать? Оцените свою деятельность на уроке с помощью листа самооценки (см. Сейчас прозвенит долгожданный звонок. Увы, но к концу подошёл наш урок. Прошу, уберите рабочее место. Давайте без слов, и, пожалуй, без жестов. Поставьте на место свои реактивы, Пробирки же все уберите в штативы. Сгоревшие спички и мусор — в ведро. И чтоб кабинет после вас – на все 100. А я в благодарность вам всем объявляю, Проверив работы, в журнал выставляю Отметки все ваши, надеясь привычно, Что будут они «хорошо» и «отлично». Большое спасибо я вам говорю. Мы цели достигли. Благодарю!
| Ответы учащихся. Определяют степень соответствия поставленной цели и результатов деятельности: называют тему и задачи урока, отмечают трудные и наиболее понравившиеся эпизоды урока. Определяют степень своего продвижения к цели. Сегодня я понял…… Теперь я могу……. Я приобрёл…… Меня удивило…… Я попробую…… Мне захотелось…… | ||||||||||||||||||||||
8. Домашнее задание. | |||||||||||||||||||||||
Для 1 группы- стр. 92 упр. 5 (б), упр. 6 (а). Для 2 группы- стр. 92 упр. 5(в), упр. 6 (б) для 3 группы- стр. 92 упр. 5 (б), упр. (6а) творческое задание – Сделать подборку стихов, загадок, пословиц о химических и физических явлениях. | |||||||||||||||||||||||
Физические и химические свойства материи
Мы все ежедневно окружены материей. Все, что мы используем, к чему прикасаемся, едим и т. д., является примером материи. Материю можно определить или описать как все, что занимает пространство, и она состоит из крошечных частиц, называемых атомами. Он должен отображать два свойства массы и объема.
д., является примером материи. Материю можно определить или описать как все, что занимает пространство, и она состоит из крошечных частиц, называемых атомами. Он должен отображать два свойства массы и объема.
Введение
Различные типы материи можно различить по двум компонентам: составу и свойствам.Состав материи относится к различным компонентам материи вместе с их относительными пропорциями. Свойства материи относятся к качествам/атрибутам, которые отличают один образец материи от другого. Эти свойства обычно сгруппированы в две категории: физические или химические.
Рисунок \(\PageIndex{1}\): Организационная разбивка химических и физических свойств вещества.Физические свойства и изменения
Физические свойства можно наблюдать или измерять без изменения состава вещества.Физические свойства используются для наблюдения и описания материи. Физические свойства материалов и систем часто описывают как интенсивные и экстенсивные свойства. Эта классификация относится к зависимости свойств от размера или протяженности рассматриваемой системы или объекта.
Интенсивное свойство — это объемное свойство, означающее, что это физическое свойство системы, которое не зависит от размера системы или количества материала в системе. Примеры интенсивных свойств включают температуру, показатель преломления, плотность и твердость объекта.Когда алмаз разрезают, его кусочки сохраняют свою внутреннюю твердость (пока их размер не достигает толщины в несколько атомов). Напротив, экстенсивное свойство является аддитивным для независимых, невзаимодействующих подсистем. Свойство пропорционально количеству материала в системе.
Интенсивные свойства : Физическое свойство, которое будет одинаковым независимо от количества материи.
- плотность: \(\rho=\frac{m}{v}\) Цвет
- : Пигмент или оттенок
- проводимость: электричество проходит через вещество
- пластичность: если вещество можно сплющить
- блеск: насколько блестящим выглядит вещество
Экстенсивные свойства : Физическое свойство, которое изменится при изменении количества материи.
- масса: сколько материи в пробе
- том: сколько места занимает образец
- длина: Как долго образец
Физическое изменение
Изменение, при котором меняется внешний вид материи, но состав остается неизменным.
Происходит физическое изменение без каких-либо изменений в молекулярном составе. Один и тот же элемент или соединение присутствует до и после изменения. Одна и та же молекула присутствует во всех изменениях.Физические изменения связаны с физическими свойствами, поскольку некоторые измерения требуют внесения изменений. Три основных состояния вещества: твердое, жидкое, газообразное
- Solid отличается фиксированной структурой. Его форма и объем не меняются. В твердом теле атомы плотно упакованы в фиксированном порядке.
- Жидкость отличается пластичной формой (способна принимать форму контейнера), но постоянным объемом. В жидкости атомы расположены близко друг к другу, но не в фиксированном порядке.

- Газ состоит из отдельных атомов. Однако, в отличие от твердого и жидкого, газ не имеет фиксированной формы и объема.
Пример \(\PageIndex{1}\): физическое изменение
Когда жидкая вода (\(H_2O\)) замерзает в твердое состояние (лед), она кажется измененной; Однако это изменение носит только физический характер, поскольку состав составляющих молекул тот же: 11,19% водорода и 88,81% кислорода по массе.
Рисунок \(\PageIndex{2}\) : Физическое изменение: таяние льда — это физическое изменение.из Википедии.
Химические свойства и изменения
Химические свойства вещества описывают его «потенциал» подвергаться некоторым химическим изменениям или реакциям в силу своего состава. Какие элементы, электроны и связи присутствуют, чтобы дать потенциал для химических изменений. Довольно сложно определить химическое свойство, не используя слово «изменение». В конце концов вы сможете взглянуть на формулу соединения и указать некоторые химические свойства. В настоящее время это очень трудно сделать, и от вас не ожидается, что вы сможете это сделать.Например, водород может загореться и взорваться при определенных условиях. Это химическое свойство. Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода. Это химическое свойство.
В настоящее время это очень трудно сделать, и от вас не ожидается, что вы сможете это сделать.Например, водород может загореться и взорваться при определенных условиях. Это химическое свойство. Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода. Это химическое свойство.
Химическое изменение приводит к образованию одного или нескольких веществ, состав которых полностью отличается от исходного вещества. Элементы и/или соединения в начале реакции перегруппировываются в новые соединения или элементы продукта. ХИМИЧЕСКОЕ ИЗМЕНЕНИЕ изменяет состав исходного вещества. В конце химического превращения присутствуют различные элементы или соединения. Атомы в соединениях перестраиваются, образуя новые и разные соединения.
Пример \(\PageIndex{1}\): Коррозия металлов
Коррозия – это нежелательное окисление металлов, приводящее к образованию оксидов металлов.
\[2 Mg + O_2 \rightarrow 2 MgO\]
Рисунок \(\PageIndex{3}\): Химическое изменение: горящая лента магния с очень коротким воздействием для получения деталей окисления. от капитана Джона Йоссариана (Википедия)
от капитана Джона Йоссариана (Википедия)Проблемы
Следующие вопросы предполагают множественный выбор.
1. Молоко скисает. Это ________________
- Химическая замена
- Физическое изменение
- Химическая собственность
- Физическая собственность
- Ничего из вышеперечисленного
2. HCl, являющаяся сильной кислотой, представляет собой __________, древесина, распиленная надвое, представляет собой ___________
- Химическое изменение, физическое изменение
- Физическое изменение, Химическое изменение
- Химические свойства, физические изменения
- Физические свойства, химические изменения
- Ничего из вышеперечисленного
3.CuSO 4 растворяется в воде
- Химическая замена
- Физическое изменение
- Химическая собственность
- Физическая собственность
- Ничего из вышеперечисленного
4. Фосфат алюминия имеет плотность 2,566 г/см3
Фосфат алюминия имеет плотность 2,566 г/см3
- Химическая замена
- Физическое изменение
- Химическая собственность
- Физическая собственность
- Ничего из вышеперечисленного
5. Что из перечисленного является примерами материи?
- Собака
- Углекислый газ
- Кубики льда
- нитрат меди (II)
- Движущийся автомобиль
6.Признаком какого типа изменений является образование пузырьков газа?
7. Верно или неверно: рост хлеба — это физическое свойство. 8. Верно или неверно: нарезание картофеля кубиками — это физическое изменение. 9. Является ли солнечный свет материей? 10. Масса свинца является _____________свойством.
Решения
- химическая замена
- химическое свойство, физическое изменение
- физическое изменение
- физическое имущество
- Все вышеперечисленное
- химический
- Ложь
- Правда
- №
- физическое имущество
Ссылки
- Петруччи, Биссоннетт, Херринг, Мадура.
 Общая химия: принципы и современные приложения. Десятое изд. Река Аппер-Сэдл, Нью-Джерси 07458: Pearson Education Inc., 2011.
Общая химия: принципы и современные приложения. Десятое изд. Река Аппер-Сэдл, Нью-Джерси 07458: Pearson Education Inc., 2011. - Краколис, Питерс. Основы вводной химии. Активный подход к обучению. Второе изд. Белмонт, Калифорния 94001: Брукс/Коул, 2007.
Авторы и авторство
Детали стандартов— SAS
Тематическая область — 3:
Наука и технологии и инженерное образование
- Стандартная площадь — 3.2: Физические науки: химия и физика
- Организационная категория — 3.2.A: Химия
- Уровень обучения — 3.2.8.A: 8 КЛАСС
Сравните и сопоставьте физические и химические изменения продуктов.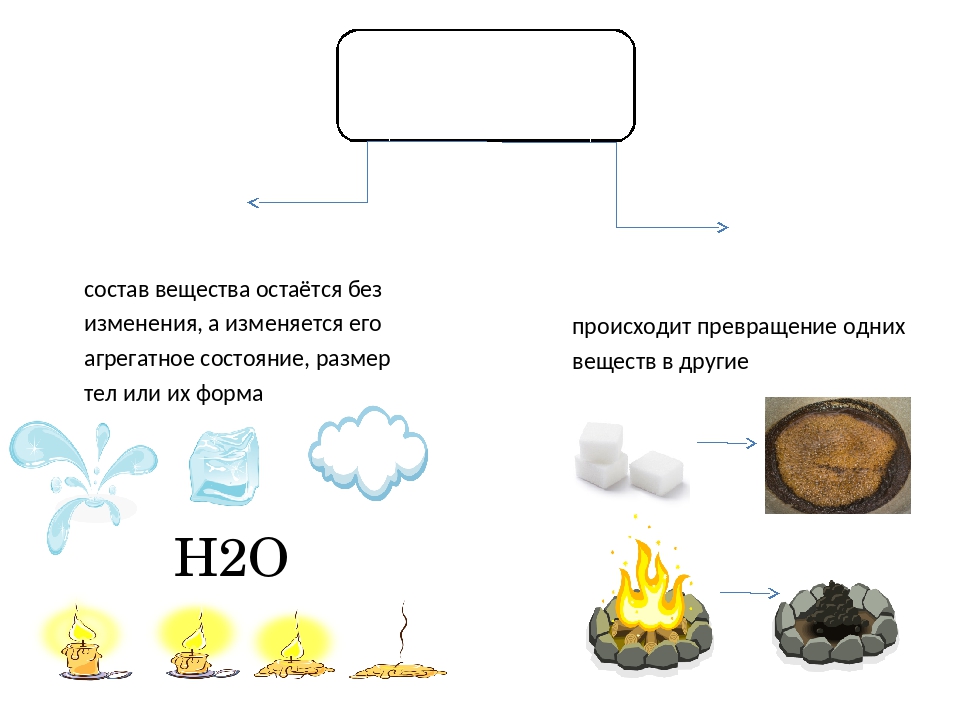
- Якорь оценки — S8.С.1
Структура, свойства и взаимодействие вещества и энергии
Дескриптор привязки — S8.C.1.1 Объяснить понятия о строении и свойствах (физических и химических) вещества.
Допустимый контент — S8.C.1.1.1 Объясните различия между элементами, соединениями и смесями.

Примеры химических изменений — объяснение, свойства, примеры и часто задаваемые вопросы
Изменение в материи является одним из основных понятий науки.Различают два типа изменений: физические и химические. Предварительные главы помогают учащимся понять основную разницу между этими двумя изменениями. В этом разделе мы поймем, что такое химические изменения и их свойства. Эта концептуальная страница, определяющая примеры химических изменений, была отформатирована экспертами Веданту для удобства студентов. Здесь вы найдете лучшее определение химических изменений, а также 20 примеров химических изменений. При химическом изменении химическая природа реагентов полностью меняется, образуя новые вещества, приобретающие новые химические и физические свойства.
Что такое химическое изменение?
Мы наблюдаем различные изменения формы веществ в природе. Не все изменения являются постоянными. Временные изменения, при которых химические свойства вещества не изменяются, называются физическими изменениями.
Не все изменения являются постоянными. Временные изменения, при которых химические свойства вещества не изменяются, называются физическими изменениями.
Химическое изменение – это химические изменения реагентов с образованием новых веществ в конце реакции. Прежде чем перейти к 20 примерам химических изменений, давайте кратко рассмотрим характеристики химических изменений.
Свойства химических изменений
Основные свойства химических изменений приведены ниже.
Молекулярный состав реагентов изменяется по мере того, как они образуют новые вещества, которые полностью отличаются от исходных соединений.
Изменение температуры также наблюдается в химической реакции, когда молекулы распадаются на атомы или группы атомов с образованием новых соединений. Либо энергия высвобождается, либо поглощается при химическом изменении.
 Когда высвобождается энергия, это называется экзотермической химической реакцией. Когда энергия поглощается, это называется эндотермической реакцией.
Когда высвобождается энергия, это называется экзотермической химической реакцией. Когда энергия поглощается, это называется эндотермической реакцией.Химическое изменение необратимо. Это означает, что новообразованные вещества нельзя легко превратить обратно в исходные соединения, просто изменив физические условия реакции. Следовательно, химическое изменение является необратимым или постоянным.
При химическом превращении происходит изменение массы реагентов. Либо масса вычитается, либо добавляется для образования новых веществ с новыми свойствами.
Примеры химического изменения
Теперь, когда вы поняли, что такое химическое изменение и его специфические свойства, вы можете легко идентифицировать происходящие в природе изменения и реакции. Когда лед тает, образуя воду, это физическое изменение, поскольку химические свойства воды не изменяются. Фактически, воду можно очень легко охладить, чтобы снова образовать лед. Когда вода реагирует с щелочным металлом, она образует основание и выделяется водород. Вы можете видеть, что в продукте отсутствуют реагенты, вода и щелочной металл.Продукты, с другой стороны, представляют собой совершенно новые вещества, отличающиеся от реагентов.
Фактически, воду можно очень легко охладить, чтобы снова образовать лед. Когда вода реагирует с щелочным металлом, она образует основание и выделяется водород. Вы можете видеть, что в продукте отсутствуют реагенты, вода и щелочной металл.Продукты, с другой стороны, представляют собой совершенно новые вещества, отличающиеся от реагентов.
Как только вы подробно изучите некоторые примеры химических изменений, вы сможете легко обнаружить различия между физическими и химическими изменениями. На самом деле, вы также сможете относиться к свойствам химических изменений, упомянутых выше. Следуйте этой странице, чтобы правильно понять эту концепцию и использовать ее для развития своих базовых знаний о химических реакциях.
Давайте рассмотрим еще несколько примеров химических изменений в следующем разделе.
20 Примеры химических изменений
После того, как вы поняли определение химических изменений, вы можете перейти к разделу примеров. Этот раздел поможет вам найти 20 примеров химических изменений.
Этот раздел поможет вам найти 20 примеров химических изменений.
ржавчину из железа в присутствии влаги и кислорода
жжение дерева
молока становится тщёртвым
Формирование карамели из сахара на отопление
Выпечка печенья и тортов
Приготовление пищи
кислотно-базовая реакция
переваривание пищи
кипятки
созревание фруктов
гниение еды
ферментация
освещение MatchStick
Фейерверк взрывы
Фотосинтез
Формирование сыра из молока
Бумага сжигания
жжение свечей
химические изменения с участием неорганических соединений показывают отчетливые изменения в составе конечных продуктов с точки зрения состояния, цвета и т. д.Химическая природа продуктов будет совершенно иной, чем у реагентов. Состав и разложение веществ при химическом изменении в приведенной выше статье были правильно определены, чтобы студенты всех уровней успеваемости могли легко усвоить концепцию и продолжить изучение главы без каких-либо хлопот. Вы подробно изучите эти функции в соответствующей главе.
д.Химическая природа продуктов будет совершенно иной, чем у реагентов. Состав и разложение веществ при химическом изменении в приведенной выше статье были правильно определены, чтобы студенты всех уровней успеваемости могли легко усвоить концепцию и продолжить изучение главы без каких-либо хлопот. Вы подробно изучите эти функции в соответствующей главе.
Rader’s CHEM4KIDS.COM — Основы химии для всех!
Спасибо за визит! Прямо сейчас вы на CHEM4KIDS.COM. Это не только для детей, это для всех. Если вам нужна помощь и информация по основам химии, оставайтесь на этом сайте. У нас есть информация о материи, атомах, элементах, периодической таблице, реакциях и биохимии. Если вы не знаете, что щелкнуть, попробуйте нашу карту сайта, на которой перечислены все темы на сайте. Если вы потерялись во всей информации, воспользуйтесь функцией поиска вверху или внизу каждой страницы.
ХОРОШО! Как мы уже двадцать лет, давайте начнем здесь...
Что такое химия ? Что ж… Вот наше лучшее определение: Химия — это изучение материи и изменений, происходящих с этой материей. Химия изучает то, как материя изменяется и трансформируется, создавая известную вам Вселенную.
Не спрашивайте нас, почему это важно. Это просто так. Это очень важно. Все на Земле, все в Солнечной системе, все в нашей галактике и все во Вселенной состоит из материи. Материя — это название, которое ученые дали всему, что можно потрогать, увидеть, ощутить или обонять.
Это все для введения. Теперь вам решать, щелкайте и получайте удовольствие! CHEM4KIDS.COM — один из многих бесплатных научных сайтов, разработанных нашей командой. Возможно, вы также использовали Biology4Kids, Geography4Kids, Cosmos4Kids или Physics4Kids. У нас даже есть математический сайт под названием NumberNut.com.
Если вы не увлекаетесь графикой, такой как изображение домашней страницы выше, используйте инструмент поиска (на базе Google), который проверит наши сайты.
 Введите ключевое слово или фразу и нажмите кнопку поиска, чтобы начать.
Введите ключевое слово или фразу и нажмите кнопку поиска, чтобы начать. Секции Chem4Kids
Сеть научных и математических сайтов Rader
Живая наука для класса 7 Наука Глава 8
Страница № 87:
Вопрос 1:
Что из перечисленного является химическим изменением?
(a) Образуется субстанция с различными химическими свойствами.
(b) Образуется вещество в другом состоянии, но со схожими химическими свойствами.
(c) Молекулы веществ не претерпевают никаких изменений.
(d) Образуется вещество другой формы и размера, но со схожими химическими свойствами.
Ответ:
(а) Образуется вещество с различными химическими свойствами.
Химическое изменение происходит, когда два вещества вступают в химическую реакцию с образованием новых веществ с другими химическими свойствами.
Страница № 87:
Вопрос 2:
Что из перечисленного является необратимым физическим изменением?
(а) ржавление железа
(б) замерзание воды
(в) двойная реакция разложения
(г) разбитие стеклянного стакана
Ответ:
(d) Разбивание стеклянного стакана
Разбивание стеклянного стакана является необратимым физическим изменением.Ржавление железа – это химическое изменение. Замерзание воды является обратимым физическим изменением. Двойная реакция разложения – это химическое превращение.
Страница № 87:
Вопрос 3:
Стрелка вниз в химической реакции показывает
(а) выделение газа
(б) образование осадков
(в) окисление
(г) вытеснение
Ответ:
(b) образование осадка
В химической реакции стрелка, указывающая вниз, показывает образование осадка, а стрелка, указывающая вверх, показывает выделение газа.
Страница № 87:
Вопрос 4:
Химическая реакция, при которой выделяется тепло, называется
(а) экзотермическая реакция
(б) эндотермическая реакция
(в) реакция разложения
(г) реакция нейтрализации
Ответ:
(а) экзотермическая реакция
Экзотермические реакции сопровождаются выделением тепла.Эндотермические реакции сопровождаются поглощением тепла.
Страница № 87:
Вопрос 5:
Сколько продуктов образуется при реакции соединения?
(a) только два
(b) только один или два
(c) только один
(d) количество не может быть указано
Ответ:
(c) только один
В реакции соединения соединение образуется из его элементов. Например, вода и кислород объединяются, образуя воду.
Например, вода и кислород объединяются, образуя воду.
Страница № 87:
Вопрос 6:
Что происходит при реакции замещения?
(a) Более реактивный элемент заменяет менее реактивный элемент.
(b) Менее реактивный элемент заменяет более реактивный элемент.
(c) Элемент заменяет элемент, который в равной степени реакционноспособен.
(d) Любой элемент может заменить любой другой элемент безотносительно к реакционной способности.
Ответ:
(a) Более реактивный элемент заменяет менее реактивный элемент.
В реакции замещения более реакционноспособный элемент замещает менее реакционноспособный элемент из его соединения.
Страница № 87:
Вопрос 7:
Реакция нейтрализации
(a) реакция разложения.
(б) реакция замещения.
(в) комбинированная реакция.
(г) двойная реакция замещения.
Ответ:
(г) реакция двойного замещения.
Реакция нейтрализации – это реакция двойного замещения, в которой кислота вступает в реакцию с основанием, и происходит обмен радикалами с образованием соли и воды.
Страница № 87:
Вопрос 8:
Реакция окисления включает присоединение
(a) только кислорода
(b) только водорода
(c) кислорода или удаления водорода
(d) водорода или удаления кислорода
Ответ:
(c) кислород или удаление водорода
Реакция окисления включает добавление кислорода или удаление водорода из вещества.
Страница № 87:
Вопрос 9:
В какой из следующих реакций присутствует только один реагент?
(a) реакция сочетания
(b) реакция разложения
(c) реакция одинарного замещения
(d) реакция двойного замещения
Ответ:
(b) реакция разложения
В реакции разложения соединение (реагент) распадается на два или более веществ (продуктов).
Страница № 87:
Вопрос 10:
Если A более реакционноспособен, чем B, что из следующего верно?
(a) A заменит B из соли B.
(b) B заменит A из соли A.
(c) Оба могут вытеснить друг друга из своих солей.
(d) Оба не могут вытеснить друг друга из своих солей.
Ответ:
(a) A заменит B из соли B.
Данная реакция является примером реакции замещения, в которой более реакционноспособный элемент замещает менее реакционноспособный элемент из его солевого раствора.
Страница № 88:
Вопрос 1:
Почему водопроводные трубы оцинкованы?
Ответ:
Водопроводные трубы сделаны из железа. Ржавление железа происходит при взаимодействии железа с воздухом и водой. Поэтому для предотвращения ржавления железа водопроводные трубы гальванизируют, т.е. железные трубы покрывают такими металлами, как цинк или хром, чтобы предотвратить взаимодействие железа с воздухом.
Поэтому для предотвращения ржавления железа водопроводные трубы гальванизируют, т.е. железные трубы покрывают такими металлами, как цинк или хром, чтобы предотвратить взаимодействие железа с воздухом.
Страница № 88:
Вопрос 2:
Когда вода замерзает, она образует лед с разными свойствами. Почему же тогда мы говорим, что замораживание — это физическое изменение?
Ответ:
При физическом изменении изменяются только физические свойства вещества, новые вещества не образуются.
Замерзание воды является физическим изменением, поскольку изменяется только физическое состояние воды; то есть вода превращается в лед. Следовательно, замораживание — это физическое изменение.
Страница № 88:
Вопрос 3:
Приведите по одному примеру каждой химической реакции со следующими характеристиками.
(а) выделение газа
(б) изменение цвета
(в) образование осадка
(г) изменение состояния с жидкого на газообразное
(д) изменение состояния с газообразного на жидкое
Ответ:
(а) Zn + H 2 → ZNSO 4 → ZNSO 4 + H 2 + H 2 ↑
Zinc Серсурический цинковый водородл
кислотный сульфат
(b) Cuco 3 → CUO + CO 2 ↑
Медный медь углерода
карбонатный оксид диоксид
(зеленый) (черный)
(C) CUSO 4 + H 2 S → CUS ↓ + H 2 SO 4
Медный водород Серсурический
Сульфатсульфид серы
(D) 2H 2 O (L) → 2H 2 9 (G) + O 2 (G)
Водный водород кислород
(e) 2H 2 (g) + O 2 (g) → 2H 2 O (l)
Hydrogen Oxygen
Страница № 88:
Вопрос 4:
Различают эндотермические реакции и экзотермические реакции.
Ответ:
| Эндотермическая реакция | Экзотермическая реакция |
| Эти реакции сопровождаются поглощением тепла. | Эти реакции сопровождаются выделением тепла. |
| Плавление твердых тел, плавление, испарение и парообразование являются примерами эндотермической реакции. | Сжигание бензина и окисление аммиака являются примерами экзотермической реакции. |
Страница № 88:
Вопрос 5:
Что такое комбинированная реакция? Привести пример.
Ответ:
В реакции соединения соединение образуется из его элементов или из более простых веществ. Например, магний реагирует с кислородом при нагревании с образованием оксида магния.
2Mg + O 2 → 2MgO
Страница № 88:
Вопрос 6:
Когда говорят, что вещество восстанавливается в результате химической реакции?
Ответ:
В химической реакции говорят, что вещество восстанавливается, если к нему добавляется водород или из него удаляется кислород.
Страница № 88:
Вопрос 7:
Что такое кристаллизация?
Ответ:
Кристаллизация – это процесс, при котором чистое твердое вещество отделяется от раствора в виде его кристаллов.
Например, поваренная соль, полученная из морской воды, содержит растворимые примеси, такие как хлорид магния. Для очистки поваренной соли применяется процесс кристаллизации.
Страница № 88:
Вопрос 8:
Что такое пересыщенный раствор?
Ответ:
Раствор, в котором растворяется больше растворенного вещества за счет повышения температуры насыщенного раствора, называется перенасыщенным раствором. При охлаждении пересыщенного раствора до комнатной температуры он легко кристаллизуется.
При охлаждении пересыщенного раствора до комнатной температуры он легко кристаллизуется.
Страница № 88:
Вопрос 1:
Обсудите методы предотвращения коррозии железа.
Ответ:
Ржавление железа можно предотвратить следующими методами:
(a) Покраска: слой краски, нанесенный на поверхность железного предмета, предотвращает взаимодействие кислорода и влаги, присутствующих в атмосфере, с железным предметом.
(b) Масло или жир: нанесение масла или жира на поверхность железных инструментов помогает предотвратить попадание кислорода и влаги из атмосферы.
(c) Гальванизация: Гальванизация — это процесс покрытия железных предметов тонким слоем металла, такого как цинк или хром.Тонкое покрытие из цинка или хрома защищает железо от ржавчины.
Страница № 88:
Вопрос 2:
Какой газ выделяется при добавлении разбавленной соляной кислоты к карбонату кальция?
Как вы будете проверять газ? Напишите химические уравнения обеих реакций.
Ответ:
Углекислый газ выделяется при добавлении разбавленной соляной кислоты к карбонату кальция.Уравнение, участвующее:
Dioxide углекислый может быть протестирован путем прохождения его над лайм-водой. Известковая вода становится молочной. Вовлечение уравнения:
Лайм карбонат кальциевой воды
карбонат диоксида
Карбонат кальция, образованный в реакции белый в цвет и мало растворим в воде.Он дает молочный вид и используется в качестве теста на наличие углекислого газа.
Страница № 88:
Вопрос 1:
При каких изменениях вещества претерпевают химические превращения — физических или химических?
Ответ:
При химических изменениях вещества претерпевают химические превращения с образованием новых веществ.
Страница № 88:
Вопрос 2:
Rush представляет собой смесь и не имеет химической формулы.Правда или ложь?
Ответ:
Ложь.
Ржавчина представляет собой соединение. Его химическая формула: Fe 2 O 3 .H 2 O.
Страница № 88:
Вопрос 3:
Процесс осаждения цинка на железо для предотвращения ржавчины называется__________
Ответ:
Процесс нанесения цинка на железо для предотвращения ржавчины называется цинкованием .
Страница № 88:
Вопрос 4:
Какой газ выделяется при нагревании карбоната кальция?
Ответ:
При нагревании карбоната кальция образуется оксид кальция и выделяется диоксид углерода.
CaCO 3 → CaO + CO 2
Страница № 88:
Вопрос 5:
Когда два растворимых вещества в растворе реагируют с образованием нерастворимого вещества, образуется _________.
Ответ:
Когда два растворимых вещества в растворе реагируют с образованием нерастворимого вещества, образуется осадок .
Страница № 88:
Вопрос 6:
Теплота поглощается в _________ реакции.
Ответ:
Тепло поглощается эндотермической реакцией.
Страница № 88:
Вопрос 7:
Если в правой части уравнения написано «+тепло», какой это тип реакции?
Ответ:
Знак «+тепло» означает, что реакция сопровождается выделением тепла. Реакция экзотермическая.
Реакция экзотермическая.
Страница № 88:
Вопрос 8:
Определите, к какому типу реакции относится каждое из следующих явлений:
(a) X + Y → XY
(b) XY → X + Y AX + B
(e) AB + CD → AD + BC
(f) Кислота + основание → соль + вода
Ответ:
(a) Комбинированная реакция
(b) Реакция разложения
(c) Двойная реакция замещения
(d) Однократная реакция замещения
(e) Двойная реакция замещения
(f) Реакция нейтрализации
Страница № 88:
Вопрос 9:
Окислитель обеспечивает ________ или удаляет _________ из вещества.
Ответ:
Окислитель обеспечивает кислород или удаляет водород из вещества.
Страница № 88:
Вопрос 10:
Какой метод вы будете использовать для получения чистой жидкости, если в ней присутствуют растворенные примеси?
Ответ:
Мы будем использовать метод кристаллизации для получения чистой жидкости, если в ней есть растворенные примеси.
Страница № 88:
Вопрос 11:
Соль получают из морской воды путем кристаллизации. Правда или ложь?
Ответ:
Ложь.
Соль получают из морской воды выпариванием.
Страница № 88:
Вопрос 12:
Пересыщенный раствор твердого вещества в жидкости легко кристаллизуется.Правда или ложь?
Ответ:
Верно.
Перенасыщенный раствор содержит больше растворенного вещества, чем оно может оставаться растворенным в воде. Он очень нестабилен и легко кристаллизуется.
Страница № 89:
Вопрос 3:
Объясните этапы получения основного гидроксида магния из металлического магния.
Ответ:
В приготовление основного гидроксида магния из металлического магния входят следующие этапы:
(a) Возьмите небольшой кусочек магниевой ленты.
(b) Очистите его кончик наждачной бумагой.
(c) Держите его щипцами и поднесите к огню. Он горит ослепительным пламенем и образует порошкообразный пепел (оксид магния).
(e) Соберите золу в пробирку, смешайте ее с небольшим количеством воды и перемешайте.
При растворении оксида магния в воде образуется гидроксид магния. Уравнение вовлечено:
2mgo + 2H 2 O → 2 мг (OH) 2
Магниевый водопровод
Оксид гидроксида
Страница № 89:
Вопрос 4:
Реакция разложения противоположна реакции соединения. Объясните с помощью примера.
Объясните с помощью примера.
Ответ:
Реакция, при которой соединение распадается на два или более простых вещества, называется реакцией разложения.
Например, при пропускании электрического тока через воду, в которую добавлено небольшое количество серной кислоты, вода разлагается с образованием газообразных водорода и кислорода.
2H 2 O → 2H 2 + O 2
Реакция, в которой два или более элементов объединяются с образованием одного соединения, называется реакцией сочетания.
Например, водород соединяется с кислородом, образуя воду.
2H 2 + O 2 → 2H 2 O
Из приведенных выше примеров ясно, что реакция разложения является противоположностью реакции сочетания.
Страница № 89:
Вопрос 5:
При каких двух условиях обычно протекают реакции разложения? Приведите по одному примеру каждого.
Ответ:
Два условия, при которых обычно протекает реакция разложения, следующие:
(a) Нагревание: При нагревании гидроксида кальция образуются оксид кальция и пар.
CA (OH) 2 → CaO + H 2 o
Кальций кальций 2 o
оксид кальция
. Оксид гидроксида
(b) электролиз: когда электрический ток пропускается через расплавленный оксид алюминия, он подвергается разложению для формирования алюминия и кислорода. газ.
2Al 2 O 3 → 4Al + 3O 2
Страница № 89:
Вопрос 6:
Что такое реакция смещения? Какое правило регулирует замещение элемента в соединении другим элементом? Объясните на примере.
Ответ:
В реакции замещения один элемент замещает другой элемент в соединении. Как правило, более реакционноспособный элемент заменяет менее реакционноспособный элемент из его соединения. Например, железо является более активным элементом, чем медь. Если в раствор сульфата меди добавить кусок железа, образуется сульфат железа. Металлическая медь осаждается на куске железа.
Как правило, более реакционноспособный элемент заменяет менее реакционноспособный элемент из его соединения. Например, железо является более активным элементом, чем медь. Если в раствор сульфата меди добавить кусок железа, образуется сульфат железа. Металлическая медь осаждается на куске железа.
CUSO 4 + Fe → Feso 4 + Cu
Медный железный железный железный утюг
сульфат сульфата
Страница № 89:
Вопрос 7:
Что такое двойная реакция разложения? Какие типы реакций двойного разложения вы знаете? Приведите по одному примеру каждого.
Ответ:
Реакция, в которой два соединения реагируют с образованием двух других соединений путем взаимного обмена атомами или группами атомов, называется реакцией двойного замещения. Существует два типа реакции двойного смещения.
(a) Реакция осаждения : в этой реакции два соединения реагируют в водном состоянии с образованием нерастворимого продукта, который появляется в виде осадка. Например, водный раствор хлорида натрия и нитрат серебра реагируют с образованием белого осадка хлорида серебра.
NaCl + Agno 3 → Agcl ↓ + Nano 3
Натрий серебристый серебристый натрий
хлористый нитрат хлористый нитрат
(b) реакция нейтрализации: при реакции основания и кислоты обмениваются их ионами и образуют соединениями. называется солью, водой и иногда газом. Например, соляная кислота реагирует с гидроксидом калия с образованием хлорида калия (соли) и воды.
HCl + KOH → KCL + H 2 O
Гидрохлорный калий калия
Кислотный гидроксид хлорида
Страница № 89:
Вопрос 8:
Объясните термины окисление и окислитель.
Ответ:
Окисление — это химическая реакция, которая включает присоединение кислорода или удаление водорода из вещества. Например, когда углерод реагирует с кислородом с образованием углекислого газа, говорят, что он окисляется, приобретая кислород.
Например, когда углерод реагирует с кислородом с образованием углекислого газа, говорят, что он окисляется, приобретая кислород.
C + O 2 → CO 2 → CO 2
Углерод из углерода углерода
Диоксид
, аналогичным образом, когда сульфид водорода реагирует с хлором, сульфид водорода окисляется до серы по потере водорода.
H 2 S + CL 2 S + CL 2 → S + 2HCL
Гидрохлорическая сера 80199
Сульфидная кислота
. Оксидирующий агент — это тот, который окисляет другие вещества либо путем обеспечения им кислорода или путем удаления из них водорода.
Страница № 89:
Вопрос 1:
В каком городе, по вашему мнению, ржавчина будет более серьезной проблемой — в Дели или в Мумбаи? Почему?
Ответ:
Для образования ржавчины необходимы два условия: содержание кислорода и влаги в атмосфере. Климат Дели жаркий и сухой, тогда как климат Мумбаи влажный. Следовательно, ржавчина является более серьезной проблемой в Мумбаи, поскольку в атмосфере больше влаги и кислорода.
Климат Дели жаркий и сухой, тогда как климат Мумбаи влажный. Следовательно, ржавчина является более серьезной проблемой в Мумбаи, поскольку в атмосфере больше влаги и кислорода.
Страница № 89:
Вопрос 2:
Когда горит свеча, происходят как физические, так и химические изменения. Что это за изменения?
Ответ:
Плавление парафина является физическим изменением, а образование двуокиси углерода и водяного пара является химическим изменением. Поэтому при горении свечи происходят как физические, так и химические изменения.
Страница № 89:
Вопрос 3:
LPG (сжиженный нефтяной газ) в газовом баллоне находится в виде жидкости.Какие физические и химические изменения происходят, когда он выходит из цилиндра и горит?
Ответ:
СНГ в баллоне существует в виде жидкости. Когда он выходит из цилиндра, он становится газом, что является физическим изменением. Сжигание сжиженного нефтяного газа представляет собой химическое изменение.
Когда он выходит из цилиндра, он становится газом, что является физическим изменением. Сжигание сжиженного нефтяного газа представляет собой химическое изменение.
Страница № 89:
Вопрос 4:
При открытии бутылки с газированной водой выделяется газ.Происходит ли химическая реакция? Объяснять.
Ответ:
Нет, химической реакции не происходит. Когда бутылку газировки открывают, выделяется углекислый газ. Углекислый газ уже растворен внутри бутылки содовой. При снятии крышки давление внутри сбрасывается, и углекислый газ выходит.
Страница № 89:
Вопрос 5:
Почему нельзя класть ложки из нержавеющей стали в банки для рассола?
Ответ:
Сталь вступает в реакцию с кислотами, присутствующими в травильном растворе, и образует ржавчину. Следовательно, мы никогда не должны класть ложки из нержавеющей стали в банки для рассола.
Следовательно, мы никогда не должны класть ложки из нержавеющей стали в банки для рассола.
Посмотреть решения NCERT для всех глав класса 7
План урока по физическим и химическим изменениям для средней школы
Длина
Этот урок займет примерно 45-90 минут.
Стандарты учебной программы
NGSS.MS-PS1-2
Анализ и интерпретация данных о свойствах веществ до и после взаимодействия веществ, чтобы определить, произошла ли химическая реакция.
CCSS.ELA-LITERACY.RST.6-8.2
Определение основных идей или выводов текста; предоставить точное изложение текста, отличное от предшествующих знаний или мнений.
CCSS.ELA-LITERACY.RST.6-8.3
Точно следуйте многоэтапной процедуре при проведении экспериментов, проведении измерений или выполнении технических задач.
CCSS.ELA-LITERACY.RST.6-8.4
Определение значения символов, ключевых терминов и других слов и фраз, относящихся к предметной области, в том виде, в каком они используются в конкретном научном или техническом контексте, имеющем отношение к текстам для 6-8 классов и темы.
Словарь
- химическая реакция
- физическая реакция
Инструкции к уроку
Необходимые материалы:
Активизируйте ранее полученные знания, спросив учащихся, что происходит со снеговиком в теплый день. Выслушав их ответы, помогите им понять, что снеговик меняет форму, но он по-прежнему сделан из того же материала, что и вода. Затем спросите их, что происходит с поленом в камине, если его поджечь. Помогите им понять, что иногда изменения заставляют объекты превращаться в новые материалы, как дерево в золу.
Прочитайте урок «Урок химических реакций для детей: определение и примеры» всем классом. Сделайте паузу после прочтения «Что происходит?» и разделы «Изменить или не изменить». Задайте учащимся следующие вопросы:
- В чем разница между физическим и химическим изменением?
- Каковы некоторые примеры физических и химических изменений?
Прочитайте оставшуюся часть урока вместе с учениками.
Предложите учащимся перечислить, как они могут определить, произошла ли химическая реакция, и привести пример чего-то, что меняет цвет, что-то, что меняет температуру и что-то, что меняет внешний вид, вкус и запах после химической реакции.
Используйте лист для печати урока, чтобы проверить понимание.
Создать реакцию
Необходимые материалы: пустые бутылки из-под воды, воздушные шарики, пищевая сода, уксус, воронка
- Разделите учащихся на пары. Обеспечьте каждую пару набором материалов.
- Предложите учащимся насыпать пищевую соду в шарик.
- Попросите учеников налить уксус в пустую бутылку.
- Спросите учащихся, что, по их мнению, произойдет, если они прикрепят верхнюю часть воздушного шара к бутылке и смешают содержимое.
- Попросите учеников надеть воздушный шарик на горлышко бутылки. Как только он будет надежно прикреплен, учащиеся могут вылить содержимое воздушного шара в бутылку.
- Предложите учащимся наблюдать и записывать происходящее.

- Предложите учащимся написать лабораторный отчет, описывающий их эксперимент.
- Предложите учащимся классифицировать реакцию как химическую или физическую и объяснить, почему она попадает в эту категорию.
Дополнение
- Предложите учащимся следовать рецепту приготовления смеси.Продемонстрируйте, что это физическое изменение, потому что ингредиенты могут быть разделены обратно в их первоначальную форму.
- Предложите учащимся приготовить блины по рецепту. Объясните, что ингредиенты нельзя разделить, поэтому это химическая реакция.
Урок изменения состояний материи для детей
Урок физического изменения для детей: определение и примеры
Какие есть разделы химии и их определение?
ОРГАНИЧЕСКАЯ ХИМИЯ
Органическая химия включает изучение структуры, свойств и получение химических соединений, которые состоят в основном из углерода и водорода.
Органическая химия пересекается со многими областями, включая
.- Медицинская химия — проектирование, разработка и синтез лекарственных средств. Он пересекается с фармакологией (изучением действия лекарств).
- Металлоорганическая химия — изучение химических соединений, содержащих связи между углеродом и металлом.
- Химия полимеров — изучение химии полимеров.
- Физическая органическая химия — изучение взаимосвязей между структурой и реакционной способностью в органических молекулах.
- Стереохимия — изучение пространственного расположения атомов в молекулах и их влияния на химические и физические свойства веществ.
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Неорганическая химия — это изучение свойств и поведения неорганических соединений.
Он охватывает все химические соединения, кроме органических соединений.
Химики-неорганики изучают такие вещи, как кристаллическая структура, минералы, металлы, катализаторы и большинство элементов периодической таблицы.
Отрасли неорганической химии включают:
Бионеорганическая химия — изучение взаимодействия ионов металлов с живой тканью, главным образом путем их непосредственного влияния на активность ферментов.
Геохимия — изучение химического состава и изменений горных пород, минералов и атмосферы земли или небесного тела.
Ядерная химия — изучение радиоактивных веществ.
Металлоорганическая химия — изучение химических соединений, содержащих связи между углеродом и металлом.
Химия твердого тела — изучение синтеза, строения и свойств твердых материалов.
АНАЛИТИЧЕСКАЯ ХИМИЯ
Аналитическая химия включает качественное и количественное определение химических компонентов веществ.
Примеры областей, использующих аналитическую химию, включают:
Судебная химия — применение химических принципов, приемов и методов при расследовании преступлений.
Химия окружающей среды — изучение химических и биохимических явлений, происходящих в окружающей среде. Она в значительной степени опирается на аналитическую химию и включает химию атмосферы, воды и почвы.
Биоаналитическая химия — исследование биологических материалов, таких как кровь, моча, волосы, слюна и пот, на наличие специфических лекарств.
ФИЗИЧЕСКАЯ ХИМИЯ
Физическая химия — изучение влияния химической структуры на физические свойства вещества.
Физико-химики обычно изучают скорость химической реакции, взаимодействие молекул с излучением и расчет структур и свойств.
Подразделы физической химии включают:
Фотохимия — изучение химических изменений, вызываемых светом.

Химия поверхности — изучение химических реакций на поверхности веществ. Он включает такие темы, как адсорбция, гетерогенный катализ, образование коллоидов, коррозия, электродные процессы и хроматография.
Химическая кинетика — изучение скоростей химических реакций, факторов, влияющих на эти скорости, и механизма, по которому протекают реакции.
Квантовая химия — математическое описание движения и взаимодействия субатомных частиц.Он включает в себя квантование энергии, корпускулярно-волновой дуализм, принцип неопределенности и их связь с химическими процессами.
Спектроскопия — использование поглощения, испускания или рассеяния электромагнитного излучения веществом для изучения вещества или химических процессов, которым оно подвергается.
БИОХИМИЯ
Биохимия — это изучение химических реакций, протекающих в живых организмах. Он пытается объяснить их химическими терминами.
Он пытается объяснить их химическими терминами.
Биохимические исследования включают рак и биологию стволовых клеток, инфекционные заболевания, клеточные мембраны и структурную биологию.
Он охватывает молекулярную биологию, генетику, биохимическую фармакологию, клиническую биохимию и сельскохозяйственную биохимию.
Молекулярная биология — изучение взаимодействий между различными системами клетки, такими как различные типы ДНК, РНК и биосинтез белков.
Генетика — изучение генов, наследственности и изменчивости живых организмов.
Фармакология — изучение механизмов действия лекарств и влияния лекарств на организм.
o Токсикология — подраздел фармакологии, изучающий действие ядов на живые организмы.Клиническая биохимия — изучение изменений, вызываемых болезнью, в химическом составе и биохимических процессах организма.


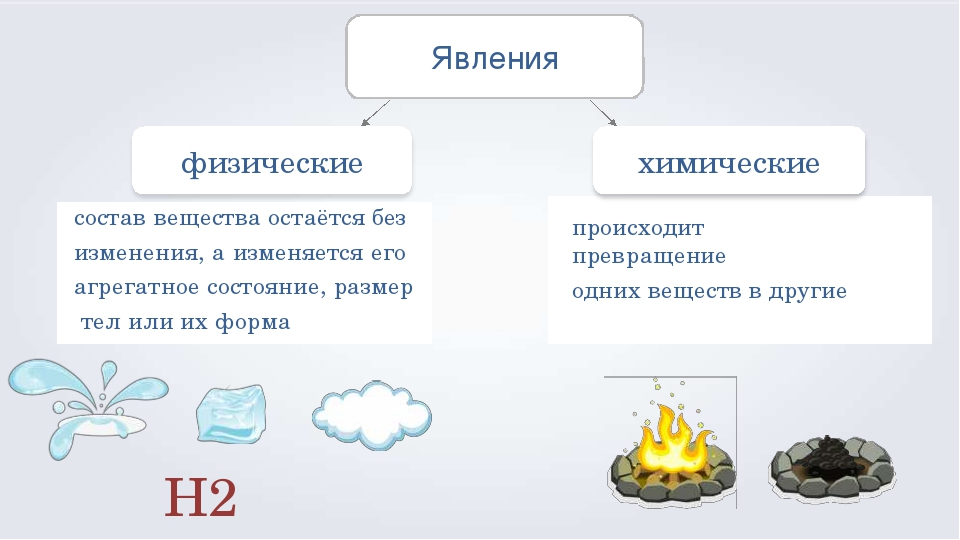
 Актуализация знаний
Актуализация знаний
 Мы часто сталкиваемся с понятием «явление». А что, на ваш, взгляд означает данное слово?
Мы часто сталкиваемся с понятием «явление». А что, на ваш, взгляд означает данное слово? Многое они не знают.
Многое они не знают.
 Встряхните пробирку.
Встряхните пробирку.
 Сравнить их и записать отличия. Как называются эти реакции в химии, вы узнаете из учебника.
Сравнить их и записать отличия. Как называются эти реакции в химии, вы узнаете из учебника.

 Применение нового знания.
Применение нового знания.
 Рефлексия.
Рефлексия. приложение), который находится у каждого из вас.
приложение), который находится у каждого из вас.

 Общая химия: принципы и современные приложения. Десятое изд. Река Аппер-Сэдл, Нью-Джерси 07458: Pearson Education Inc., 2011.
Общая химия: принципы и современные приложения. Десятое изд. Река Аппер-Сэдл, Нью-Джерси 07458: Pearson Education Inc., 2011.
 Когда высвобождается энергия, это называется экзотермической химической реакцией. Когда энергия поглощается, это называется эндотермической реакцией.
Когда высвобождается энергия, это называется экзотермической химической реакцией. Когда энергия поглощается, это называется эндотермической реакцией. ..
..