Задачи по химии. Как решать задачи по химии
Химия – наука, которая очень тесно связана с окружающим нас миром. Все живое состоит из элементов и соединений элементов, свойства которых изучает химия. Она настолько глубоко внедрилась в нашу жизнь, что невозможно представить существование без нее. В быту: при приготовлении пищи, консервировании, уборке дома, стирке, мы, сами того не замечая, используем знания о химических процессах. При производстве любого окружающего нас предмета, на том или ином этапе его получения, также необходимо применение химических знаний. Сохранение здоровья также напрямую зависит от того, насколько обширны наши знания о химии.
Теоретические знания этой науки и умение производить вычисления помогут вам лучше ориентироваться в реальной жизни. Если вы получаете химическое или тесно связанное с химией образование, то просто необходимо научиться решать задачи по химии. На производстве, в химической и экологической лаборатории очень часто вам придется производить вычисления, правильность которых будет зависеть от того навыка, который вы приобрели, обучаясь будущей специальности.
При получении образования Вам придется не только решать контрольные работы, но и писать рефераты, курсовые работы и, конечно же, Вас ждет защита диплома специалиста, а также, вполне возможно, и защита магистерской, затем кандидатской диссертаций. При написании текста работы необходимо проверить его уникальность, исключить плагиат. Здесь вы сможете бесплатно проверить уникальность Вашей работы, а также, в случае необходимости, подобрать необходимый готовый текст или заказать его выполнение.
Сайт Задачи по химии создан для того, чтобы помочь освоить вам различные типы задач и приобрести необходимые навыки их решения. Здесь размещены как теоретическая часть по общей химии и органической химии, так и примеры задач по химии с готовыми решениями.
Многие учащиеся и их родители задаются вопросом: Как научиться решать задачи по химии? Ниже приведем несколько советов, которые помогут вам решать задачи по химии самостоятельно.
Советы по самостоятельному решению задач по химии
Вот несколько советов, которые, я очень надеюсь, помогут вам в освоении этого нелегкого дела.
- Первое и самое главное – ваше желание, ваш труд и усердие. Поставьте перед собой цель и не отступайте!
- Второе – это теоретические знания, без которых вы просто не сможете правильно написать даже самую простую формулу соединения, не говоря уже об уравнениях реакций между ними. Здесь важно научиться «читать» таблицу Менделеева – самую большую открытую шпаргалку, в которой можно найти сведения о свойствах элементов и образуемых ими соединений.
- Сама задача. Внимательно прочитайте условие задачи по химии и запишите кратко все известные данные, а также что надо найти (иногда даже это вызывает определенные трудности). Далее четко следуем выбранному алгоритму решения химических задач.
Алгоритм решения задачи по химии
Для решения задачи по химии следует придерживаться нижеприведенного порядка действий. Чем точнее вы выполните наши рекомендации, тем быстрее будет найдено правильное решение! Итак, давайте перейдем непосредственно к алгоритму решения задач по химии:
- Записать уравнение реакции (при необходимости), не забыть расставить коэффициенты. Для наглядности, над соответствующими соединениями, записать известные и неизвестные данные.
- Определить, каким способом можно найти неизвестные данные. Можно ли это сделать в одно действие или в несколько. Возможно, придется воспользоваться таблицей Менделеева (для определения молекулярной массы, например) или другими справочными данными (например, при переводе массы вещества в объем, необходимо знать его плотность).
- Далее, при необходимости, составить пропорцию (хотя этот способ имеет много противников) или использовать понятие количество вещества. Либо подставить известные и найденные данные в необходимые формулы. Напоминаю, что действий в большинстве случаев больше одного, поэтому определите, какие данные в выбранной формуле для нахождения требуемого параметра, неизвестны и постарайтесь их найти, применяя необходимые пропорции или формулы.
- При необходимости использования формул, следите за единицами измерений. Иногда бывает необходимо перевести их в систему СИ.
- В конце еще раз прочитать условие задачи по химии и проверить правильность ее решения.
И последнее, если не получается решить задачу по химии, то забудьте о том, каким способом вы ее решали. Попробуйте подойти к ней с «другой стороны», найти иной способ решения.
Верьте в свои силы и у вас обязательно все получится. Решать задачи по химии это не так сложно, как кажется! Успехов!
Задачи по химии с решениями
Ниже приведены ссылки на представленные на нашем сайте задачи по химии с готовыми решениями:
zadachi-po-khimii.ru
Примеры задач по химии сложных эфиров и жиров. Видеоурок. Химия 10 Класс
На уроке вы рассмотрите решение качественных и количественных задач по теме «Сложные эфиры. Жиры». Вы потренируетесь в составлении названий и структурных формул сложных эфиров и жиров, узнаете, как с помощью некоторых расчетов можно определить формулу вещества.
Условие задачи.
Какие исходные кислоты и спирты необходимо взять для синтеза сложных эфиров этилбензоата (с запахом мяты) и бензилацетата (с запахом жасмина)?
Решение
1. Вспомните, как образуется название сложного эфира.
Ответ: сначала указывают название радикала – остатка от спирта, а затем название кислотного остатка.
2. Определим исходные вещества для синтеза этилбензоата и бензилацетата.
«Этил» – остаток этилового спирта, «бензоат» – остаток бензойной кислоты. Следовательно, этилбензоат образуется из бензойной кислоты и этилового спирта. «Бензил» – остаток бензилового спирта, «ацетат» – остаток уксусной кислоты.
Формулы сложных эфиров представлены на рисунке 1.

Рис. 1. Формулы и исходные вещества для синтеза этилбензоата и бензилацетата
Приведенные сложные эфиры между собой являются изомерами, их состав соответствует формуле С9Н10О2 (Рис. 2).

Рис. 2. Изомерные сложные эфиры
Условие задачи
При гидролизе сложного эфира, молярная масса которого равна 130 г/моль, образуются кислота А и спирт Б. Определите строение эфира, если: а)серебряная соль кислоты А содержит 59,66 % серебра, б) спирт Б не окисляется дихроматом калия.
Решение
1. Предположим, что кислота, образующая сложный эфир, одноосновна. Но если задача не будет решена таким образом, то придется рассматривать случаи двух-, трехосновной кислот и так далее.
2. Запишем формулу серебряной соли и рассчитаем молярную массу углеводородного радикала R в кислоте.
RCOOAg – формула серебряной соли кислоты А.
Зная молярные массы серебра, углерода и кислорода, выразим молярную массу RCOOAg:
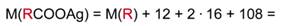

Известно, что серебро составляет 59,66 % от массы всей соли. Составим пропорцию:
59,66 % – 108 г/моль
100 % – (M(R) + 152) г/моль
Произведем соответствующие вычисления и найдем молярную массу R:
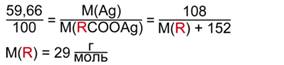
Такая молярная масса соответствует радикалу этилу – С2Н5. Следовательно, кислота, образующая сложный эфир, – пропановая. Тогда, общая формула эфира – С2Н5СООR.
Зная молярную массу эфира С2Н5СООR, можно найти молярную массу радикала R:

Молярной массе 57 г/моль соответствуют 4 изомерных радикала (Рис. 3).
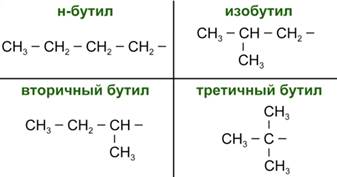
Рис. 3. Изомеры состава -С4Н9
В условии задачи сказано, что спирт Б не окисляется дихроматом калия, следовательно, этот спирт является третичным.
Таким образом, исходный сложный эфир образован пропановой кислотой и третбутиловым спиртом:

Условие задачи
Растительное масло массой 17,56 г нагрели с 3,36 г гидроксида калия до полного исчезновения масляного слоя. При действии избытка бромной воды на полученный после гидролиза раствор образуется только одно тетрабромпроизводное.
Установите возможную формулу жира.
Решение
Запишем в общем виде уравнение гидролиза жира:
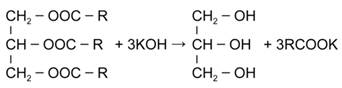
На 1 моль жира при гидролизе приходится 3 моль гидроксида калия.
Найдем количество вещества гидроксида калия и жира (количество жира втрое меньше):

Зная количество и массу жира, можно найти его молярную массу:

На три углеводородных радикала R кислот приходится 705 г/моль:
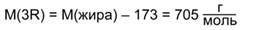
Зная, что тетрабромпроизводное получено только одно, можно сделать вывод, что все кислотные остатки одинаковы и содержат по 2 двойные связи. Тогда получаем, что в каждом радикале содержится 17 атомов углерода, это радикал линолевой кислоты:

Возможная формула жира представлена на рисунке 4.
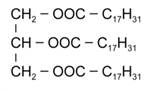
Рис. 4. Формула жира
Список литературы
- Новошинский И.И., Новошинская Н.С. Химия. Учебник для 10 класса общеобр. учрежд. Профильный уровень. – М.: ООО «ТИД «Русское слово – РС», 2008. (§57)
- Рудзитис Г.Е. Химия. Органическая химия. 10 класс: учеб. для общеобр. учрежд. : базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2010. (§31)
- Радецкий А.М. Химия. Дидактический материал. 10–11 классы. – М.: Просвещение, 2011. (с. 55–56)
- Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 164–166)
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- School-collection.edu.ru (Источник).
- Chemport.ru (Источник).
- Fito.nnov.ru (Источник).
Домашнее задание
- №№ 6, 7 с. 128 из Учебника Рудзитиса Г.Е. Химия. Органическая химия. 10 класс: учеб. для общеобр. учрежд. : базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2010.
- Запишите уравнение реакции этерификации, в результате которой образуется метилбензоат.
- Напишите уравнения реакций кислотного и щелочного гидролиза тристеарата.
interneturok.ru
Задача 35 ЕГЭ по химии » HimEge.ru
Нахождение молекулярной формулы веществ
Для решения задач этого типа необходимо знать общие формулы классов органических веществ и общие формулы для вычисления молярной массы веществ этих классов:
Алгоритм решения большинства задач на нахождение молекулярной формулы включает следующие действия:
— запись уравнений реакций в общем виде;
— нахождение количество вещества n, для которого даны масса или объем, или массу или объём которого можно вычислить по условию задачи;
— нахождение молярной массы вещества М = m/n, формулу которого нужно установить;
— нахождение числа атомов углерода в молекуле и составление молекулярной формулы вещества.
Примеры решения задачи 35 ЕГЭ по химии на нахождение молекулярной формулы органического вещества по продуктам сгорания с объяснением
Задача 1.
При сгорании 11,6 г органического вещества образуется 13,44 л углекислого газа и 10,8 г воды. Плотность паров этого вещества по воздуху равна 2. Установлено, что это вещество взаимодействует с аммиачным раствором оксида серебра, каталитически восстанавливается водородом с образованием первичного спирта и способно окисляться подкисленным раствором перманганата калия до карбоновой кислоты. На основании этих данных:
1) установите простейшую формулу исходного вещества,
2) составьте его структурную формулу,
3) приведите уравнение реакции его взаимодействия с водородом.
Решение: общая формула органического вещества СxHyOz.
Переведем объем углекислого газа и массу воды в моли по формулам:
Молярный объем Vm = 22,4 л/моль
n(CO2) = 13,44/22,4= 0,6 моль, =>в исходном веществе содержалось n(C) =0,6 моль,
n(H2O) = 10,8/18 = 0,6 моль, => в исходном веществе содержалось в два раза больше n(H) = 1,2 моль,
Узнаем, содержался ли кислород в органическом соединении. Для этого от массы органического вещества отнимаем массу углерода и массу водорода: m(O)= 11,6 – 0,6* 12 – 1,2= 3,2 г,
Значит, искомое соединение содержит кислород количеством:
n(O)= 3,2/16 = 0,2 моль
Посмотрим соотношение атомов С, Н и О, входящих в состав исходного органического вещества:
n(C) : n(H) : n(O) = x : y : z = 0,6 : 1,2 : 0,2 = 3 : 6 : 1
Нашли простейшую формулу: С3H6О
Чтобы узнать истинную формулу, найдем молярную массу органического соединения по формуле:
М(СxHyOz) = Dвозд(СxHyOz) *M(возд)
Mист(СxHyOz) = 29*2 = 58 г/моль
Проверим, соответствует ли истинная молярная масса молярной массе простейшей формулы:
М (С3H6О) = 12*3 + 6 + 16 = 58 г/моль — соответствует, => истинная формула совпадает с простейшей.
Молекулярная формула: С3H6О
Из данных задачи: » это вещество взаимодействует с аммиачным раствором оксида серебра, каталитически восстанавливается водородом с образованием первичного спирта и способно окисляться подкисленным раствором перманганата калия до карбоновой кислоты» делаем вывод, что это альдегид.
2) При взаимодействии 18,5 г предельной одноосновной карбоновой кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
3) Некоторая предельная карбоновая одноосновная кислота массой 6 г требует для полной этерификации такой же массы спирта. При этом получается 10,2 г сложного эфира. Установите молекулярную формулу кислоты.
4) Определите молекулярную формулу ацетиленового углеводорода, если молярная масса продукта его реакции с избытком бромоводорода в 4 раза больше,чем молярная масса исходного углеводорода
5) При сгорании органического вещества массой 3,9 г образовались оксид углерода (IV) массой 13,2 г и вода массой 2,7 г. Выведите формулу вещества, зная, что плотность паров этого вещества по водороду равна 39.
6) При сгорании органического вещества массой 15 г образовались оксид углерода (IV) объемом 16,8 л и вода массой 18 г. Выведите формулу вещества, зная, что плотность паров этого вещества по фтороводороду равна 3.
7) При сгорании 0,45 г газообразного органического вещества выделилось 0,448 л (н.у.) углекислого газа, 0,63 г воды и 0,112 л (н.у.) азота. Плотность исходного газообразного вещества по азоту 1,607. Установите молекулярную формулу этого вещества.
8) При сгорании бескислородного органического вещества образовалось 4,48 л (н.у.) углекислого газа, 3,6 г воды и 3,65 г хлороводорода. Определите молекулярную формулу сгоревшего соединения.
9) При сгорании органического вещества массой 9,2 г образовались оксид углерода (IV) объёмом 6,72 л (н.у.) и вода массой 7,2 г. Установите молекулярную формулу вещества.
10) При сгорании органического вещества массой 3 г образовались оксид углерода (IV) объёмом 2,24 л (н.у.) и вода массой 1,8 г. Известно, что это вещество реагирует с цинком.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4 ) напишите уравнение реакции этого вещества с цинком.
himege.ru
Примеры решения задач по теме «Основные понятия и законы химии» — Студопедия.Нет
Пример 1 Определите молекулярную массу газа, если 5 г его при нормальных условиях занимают объем 4 л.
Решение:
На основании следствия из закона Авогадро находим массу 22,4 л газа:
4 л газа — 5 г
22,4 л газа — х 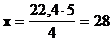 г
г
Молярная масса газа составляет 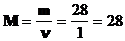 г/моль
г/моль
Пример 2В каком количестве вещества Na2SO4 содержится: а) натрия массой 24 г; б) серы массой 96 г; в) кислорода массой 128 г.
Решение:
а) В одном моле вещества Na2SO4 содержится натрия 46 г, тогда:
1 моль — 46 г
х — 24 г 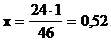 моль
моль
б) В одном моле вещества Na2SO4 содержится серы 32 г, тогда:
1 моль — 32 г
х моль — 96 г 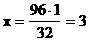 моль
моль
в) В одном моле вещества Na2SO4 содержится 64 г кислорода, тогда:
1 моль — 64 г
х моль — 128 г 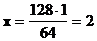 моль
моль
Пример 3. Вычислите число атомов азота в 100 г карбоната аммония, содержащего 10% неазотистых примесей.
Решение:
Большинство расчетных задач лучше решать в молях. Масса чистого карбоната аммония равна m((NН4)2СО3) = 100-0,9 = 90 г. Число молей карбоната аммония составляет v((NH4)2CO3) = m/М = 90/96 = 0,938 моль. Согласно химической формуле (NН4)2СО3 в одном его моле содержится два моль N, поэтому v(N) = 2v((NН4)2СО3) = 1,876. Число атомов азота получается умножением числа молей азота на постоянную Авогадро: N(N) = v-NA = 1,876-6,02-1023 =.1,13-1024.
Ответ. 1,13·1024 атомов азота.
Примеры решения задач по теме «Строение атома»
Пример. Составьте электронные формулы атомов элементов с порядковыми номерами 16 и 22.
Решение.
Электронные формулы изображают распределение электронов в атоме по энергетическим уровням и подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nl*, где n — главное квантовое число, l — орбитальное квантовое число (вместо него указывают соответсвующеебуквенное обозначение — s, p, d. f), х — число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он будет обладать наименьшей энергией — меньшая сумма n+l . Заполнение энергетических уровней и подуровней идет в такой последовательности: 1s®2s®2p®3s®3p®4s®3d®4p®5s®4d®5p®6s®
®(5d1) ®4f®5d®6p®7s®(6d1-2) ®5f®6d®7p
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И.Менделеева, то для элементов №16 (сера) и №22 (титан) электронные формулы имеют вид:
16S 1s22s22p63s23p4
22Ti 1s22s22p63s23p63d24s2
Классы неорганических соединений и периодическая система элементов.
К числу наиболее распространенных классов неорганических соединений относятся оксиды, кислоты и соли.
Оксидами называются сложные вещества, состоящие из двух элементов, один из которых кислород. Оксиды подразделяются на солеобразующие (NO, CO,S2O).
Солеобразующие оксиды по способностям к взаимодействию с веществами кислотного или основного характера могут быть соответственно основными (Na2O, CaO) и кислотными (CO2, SO3). Если же оксид (ZnO, Al2O3) регулирует с веществами и кислотного и основного характера, его называют амфотерным.
ZnO + 2HCE → ZnCE2 + H2O
ZnO + 2NaOH → Na2ZnO2 + H2O
Неметаллические элементы образуют преимущественно кислотные оксиды, металлические – способны давать оксиды всех видов. При этом по мере увеличения степени окисления металла, характер его оксидов меняется от основного до кислотного: MnO (основной) MnO2, (атмосферный) MnO3, Mn2O7 (кислотный). При высокой степени окисления (5, + 6, +7) металлы, как правило, образуют только кислотные оксиды. В периодах слева направо характер оксидов меняется от основного до кислотного.
В главных подгруппах кислотный характер оксидов ослабевает сверху вниз. Так, P2O5 более кислотен, чем Sb2O5. Кислотный или основный характер оксидов определяется природой их внутренних химических связей. В кислотных оксидах элемент соединен с кислородом ковалентными связями; в основных – ионными, в амфотерных – связи частично ионные, частично ковалентные.
Основания и кислородные кислоты являются гидроксидами, поскольку их можно рассматривать как вещества, получившиеся в результате взаимодействия оксидов с водой. Однако, гидроксидами обычно называют только основания и амфотерные гидроксиды. Подвергаясь в растворах электролитической диссоциации, кислоты образуют ионы водорода и ионы кислотного остатка, основания – ионы металла и гидроксильные ионы.
HCL = H+ + CL—
NaOH = Na+ + OH—
Амфотерным оксидами соответствуют амфотерные гидроксиды, способные к взаимодействию и с кислотами, и с основаниями.
Zn(OH)2 + H2SO4 → ZnSO4+ 2H2O
Zn(OH)2 + 2NaOH → NaZnO2 + 2H2O
Предполагается, что эта способность основана на том, что амфотерные гидроксиды в состоянии диссоциировать и по основному типу, образуя ионы OH— , и по кислотному, образуя ионы H+ .
В первом случае имеет место
Zn(OH)2 = Zn2+ + 2OH—
Во втором
Zn(OH)2 = 2H+ + ZnO22-
Диссоциация по кислотному типу происходит в щелочной среде, по щелочному – в кислотной. Существует и другая теория, дающая объяснение своеобразным свойствам амфотерных электролитов – теория комплексных соединений. Амфотерность гидроксидов объясняется их способностью к образованию комплексов.
Типичные амфотерные гидроксиды образованны элементами второй группы – Be (OH)2, Zn (OH)2, третьей – Al(OH)3, Ga(OH)3, In(OH)3. Характерна амфотерность и для гидроксидов элементов четвертой группы – Sn(OH)2, Sn(OH)4, Pb(OH)2, Pb(OH)4.
Выяснить причину основности или кислотности того или другого гидроксида можно оценив характер химической связи между центральным атомом и группами ОН.
Если это ковалентные связи, как H2SO4 , то гидроксид оказывается кислотой, если же ионные как в NaOH, то-основанием. Объясняется это тем, что при наличии в гидроксиде ковалентной связи (в нашем примере связи между серой и кислородом) молекулы растворителя не будут действовать на нее достаточно интенсивно, а подействуют вместо этого на более полярную связь О – Н. Это и повлечет за собой появление в растворе ионов Н+, типичных для кислоты. И в случае же едкого натра полярные молекулы растворителя в первую очередь действуют на связь Na – O , как ионную, после чего в раствор переходят ионы ОН— , типичные для щелочей.
Так как неметаллы соединяется с кислородом ковалентными связями, то их гидроксиды могут диссоциировать в водных растворах только по кислотному типу. Связи же атомов металлов с кислородом значительно разнообразней по степени своей ионности (или ковалентности) и поэтому среди гидроксидов металлов встречаются как кислоты, так и основания и амфотерные соединения. Например Cr(OH)2 – основание, Cr(OH)3 – амфотерное соединение, H2CrO4 – кислота. Основный характер Cr(OH)2 вызван тем, что связь хрома со степенью окисления +2 с кислородом более ионна, чем связь кислорода с водородом. Амфотерность Cr(OH)3 обусловлена примерно одинаковой степенью ионности связи Cr со степенью окисления +3 с кислородом и связей кислорода с водородом. Кислотность H2CrO4 объясняет высокой положительной валентностью хрома (+6) обеспечивающей самостоятельное существование ионов CrO42- в растворе.
Связи между атомами хрома и кислорода в CrO42- ковалентны, поэтому в растворе разрываются не они, а более полярные связи О – Н, т.е. вещество диссоциирует по кислотному типу.
Рост положительной степени окисления слева направо в периодах, а также уменьшение радиусов атомов элементов в периодах способствует усилению ковалентного характера в химических связях между атомами этих элементов и атомами кислорода, и тем самым приводит к усилению кислотности оксидов и гидроксидов элементов.
Соль представляет собой продукт замещения водорода кислоты металлом или группой атомов, способной образовать положительные ионы (например NH4+ – ион аммония). Если водород кислоты полностью замещен на металл (Na2SO4 сульфат натрия) соль называют средней; при частичном замещении – кислой (NaHSO4— гидросульфат натрия). Соли металлов, гидроксиды которых малорастворимы, могут содержать группы ОН или атомы кислорода. Такие соли называются основными, например, CuOHCl –хлорид гидроксимеди, FeOCl – хлорид оксожелеза(III). Если при одном кислотном остатке находятся два металла, то такие соли называются двойными, например, NaKCO3 – карбонат натрия – калия.
Примеры диссоциации солей
Na2SO4 = 2Na+ + SO42-
KNaCO3 = K+ + Na+ + CO32-
Кислые и основные соли диссоциируют по стадиям.
NaHSO4 = Na+ + HSO4—
HSO4— = H+ + SO42-
CuOHCl = CuOH+ + Cl—
CuOH+ = Cu2+ + OH—
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Скоростью химической реакции называют изменение концентрации реагирующего вещества в единицу времени. Скорость реакции определяется природой реагирующих веществ и зависит от условий протекания процесса (концентрации реагирующих веществ, температуры, наличия катализатора и др.).
Зависимость скорости реакции от концентрации выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Например, для реакции
2NO + О2 → 2NO2
закон действия масс может быть записан
υ=κС2NOCO2,
где υ — скорость химической реакции; κ — константа скорости; СNO и CO2 — концентрации реагирующих веществ.
Реакция в гетерогенной системе [например, С(к) + О2(г) → СО2(г)] осуществляется на поверхности раздела между фазами. Поэтому скорость гетерогенных реакций при постоянной температуре зависит не только от концентрации веществ, но и от площади поверхности раздела. Так, для реакции
С(к) + О2(г) → СО2(г)
закон действия масс имеет вид
υ=κCO2S,
где κ — константа скорости; CO2 — концентрация кислорода; S — площадь поверхности раздела между фазами.
Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа:
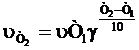 ,
,
где 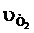 и
и 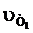 — скорости реакций при Т2 и Т1; γ — температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10°.
— скорости реакций при Т2 и Т1; γ — температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10°.
Одним из методов ускорения химической реакции является катализ, который осуществляется при помощи веществ (катализаторов), увеличивающих скорость реакции, но не расходующихся в результате ее протекания.
Механизм действия катализатора сводится к уменьшению величины энергии активации реакции, т. е. к уменьшению разности между средней энергией активных молекул (активного комплекса) и средней энергией молекул исходных веществ. Скорость химической реакции при этом увеличивается.
studopedia.net
КУРС ХИМИИ | CHEM-MIND.com
- НОВОСТИ
- КУРС ХИМИИ
- Дополнительные уроки
- Курс химии
- Разбор заданий ЕГЭ
- ТЕСТЫ
- Вариаты ЕГЭ
- Тесты по заданиям
- Тесты по темам
- СТАТЬИ
- ОПЫТЫ
- ТАБЛИЦА МЕНДЕЛЕЕВА
Поиск


- НОВОСТИ
-
 Новости
НовостиАлгоритм обучения для подготовки к ЕГЭ по химии
 Новости
НовостиОтветы в тестах вновь правильно отображаются!
 Новости
НовостиТехнические проблемы
 Новости
НовостиНовый раздел на сайте
 Новости
НовостиС 8 марта
-
- КУРС ХИМИИ
- ВсеДополнительные урокиКурс химииРазбор заданий ЕГЭ
 Разбор заданий ЕГЭ
Разбор заданий ЕГЭРазбор задания №11 ЕГЭ по химии
 Разбор заданий ЕГЭ
Разбор заданий ЕГЭРазбор задания №10 ЕГЭ по химии
 Разбор заданий ЕГЭ
Разбор заданий ЕГЭРазбор задания №9 ЕГЭ по химии
 Разбор заданий ЕГЭ
Разбор заданий ЕГЭРазбор задания №8 ЕГЭ по химии
- ВсеДополнительные урокиКурс химииРазбор заданий ЕГЭ
- ТЕСТЫ
www.chem-mind.com
ЕГЭ по химии Примеры и решение заданий А3

Для того чтобы успешно справиться с заданием А3 в ЕГЭ по химии, необходимо изучить и освоить такие понятия как химическая связь, виды химических связей, способы их образования, и собственно характеристики связей. Ниже приведем 5 примеров заданий А3 которые могут встретиться в едином государственном экзамене по химии.
1) В каком ряду записаны формулы веществ только с ковалентной полярной
связью?
1) С12, NO2, НС1
2) HBr,NO,Br2
3) H2S.H2O.Se
4) HI,H2O,PH3
Ответ: Ковалентная полярная связь возникает между двумя не металлами с разной электроотрицательностью, т. е. если вы видите задание с определением ковалентной полярной связью, то можете сразу смело отбрасывать варианты где встречаются молекулы из одного элемента, такие как С12 Br2 . В данном задание такие соединения встречаются в 1 и 2 варианте, в варианте 3 есть атом селена, без связи, значит эти три варианта мы отбрасываем.
Правильный ответ : 4.
2) Между атомами с одинаковой относительной электроотрицательностью образуется химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
Ответ: Для решения данного задания достаточно знать определения химических связей, чем они отличаются, Ионная образуется между металлами и не металлами, ковалентная полярная между атомами с различной электроотрицательностью, ковалентная неполярная между атомами с одинаковой электроотрицательностью, и водородная между электроотрицательным атомом и атомом водорода.
Правильный ответ: 3
3) Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) СаО,С3Н6, S8
2) Fe.NaNO3, CO
3) N2, CuCO3, K2S
4) C6H5N02, SО2, CHC13
Ответ: Задание достаточно простое, первые три варианта имеют в наличии металлы, которые образуют ионные связи, отметаем эти варианты и получаем правильный ответ.
Правильный ответ: 4
4)Полярность связи наиболее выражена в молекуле
1) HI
2) НСl
3) HF
4) НВг
Ответ:полярность связи наиболее выражена в соединениях с наибольшей разностью электроотрицательности элементов. Так как тут все соединения водорода, то можно оценить электроотрицательность только галогенов, из которых фтор является наиболее электроотрицательным.
Правильный ответ: 3
5) Водородная связь не характерна для вещества
1) Н2О
2) СН4
3) NH3
4) СНзОН
Ответ: Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Исходя из определения, в 1,3 и 4 вариантах содержится электроотрицательный элемент.
Правильный ответ: 2
in-chemistry.ru
 Новости
Новости Новости
Новости Новости
Новости Новости
Новости Новости
Новости Разбор заданий ЕГЭ
Разбор заданий ЕГЭ Разбор заданий ЕГЭ
Разбор заданий ЕГЭ Разбор заданий ЕГЭ
Разбор заданий ЕГЭ Разбор заданий ЕГЭ
Разбор заданий ЕГЭ