Кислоты — это… Что такое Кислоты?
КИСЛОТЫ — КИСЛОТЫ, группа веществ, физически весьма различных, но обладающих характерными химич. свойствами. Первоначальное мнение Лавуазье (Lavoisier), что для К. лоты характерно присутствие Оа, давно изменено после открытия бескислородных к т (HCN… … Большая медицинская энциклопедия
КИСЛОТЫ — (соляная, серная, азотная, борная и др.) довольно распространенная группа загрязнителей, поступающих со сточными водами металлургических, машиностроительных, текстильных, химических и целлюлозно бумажных предприятий. Они выпадают также с… … Болезни рыб: Справочник
КИСЛОТЫ — химические соединения, обычно характеризующиеся диссоциацией в водном растворе с образованием ионов Н+ (точнее ионов гидроксония Н3О+ ). Присутствие этих ионов обусловливает характерный острый вкус кислот и их способность изменять окраску… … Большой Энциклопедический словарь
Кислоты — (хим.). К. называется группа соединений с известной,довольно определенной химической функцией, которая резко выражена втаких типичных представителях этой группы, как серная К. h3SO4 азотнаяК. HNO3, соляная К. НСl и пр. Сделать характеристику их в … Энциклопедия Брокгауза и Ефрона
КИСЛОТЫ — электролиты, диссоциирующие в водных растворах с образованием положительно заряженного иона водорода Н+ (HNO3 Н+ + NO3 , h3SO4 2H++SO42 , Ch4COOH H+ + Ch4COO ). В зависимости от числа атомов водорода, способных заме … Геологическая энциклопедия
КИСЛОТЫ — обширный класс хим. соединений; обычно это электролиты, образующие при диссоциации (см.) водорода (Н+), а точнее ионы гидроксония Н30+, и анион. Водород, входящий в состав К., способен замещаться металлами с образованием солей. По числу… … Большая политехническая энциклопедия
кислоты — химические соединения, обычно характеризующиеся диссоциацией в водном растворе с образованием гидратированных ионов Н+. Присутствие этих ионов обусловливает характерный острый вкус килот и их способность изменять окраску индикаторов химических.… … Энциклопедический словарь
Кислоты — химические соединения, содержащие водород, способный замещаться металлом с образованием солей, и диссоциирующие при растворении в воде с образованием ионов Н+ (протонов) или, точнее, ионов гидроксония h4O+. По современным представлениям,… … Большая советская энциклопедия
Кислоты — (хим.) К. называется группа соединений с известной, довольно определенной химической функцией, которая резко выражена в таких типичных представителях этой группы, как серная К. h3SO4, азотная К. HNO3, соляная К. HCl и проч. Сделать характеристику … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
КИСЛОТЫ — класс хим. соединений. Обычно К. наз. в ва, содержащие водород и диссоциирующие в воде с образованием ионов Н+ (точнее, ионов гид роксония Н3О+). Присутствие этих ионов обусловливает характерный острый вкус К. и их способность изменять окраску… … Большой энциклопедический политехнический словарь
Органические кислоты. Функциональная группа органических кислот :: SYL.ru
Огромное число соединений, известных современному миру, относятся к органическим кислотам. В природе они получаются в основном из сахаров в результате сложных биохимических реакций. Их роль во всех процессах жизнедеятельности неоценимо важна. Например, в биосинтезе гликозидов, аминокислот, алкалоидов и прочих биологически реакционноспособных веществ; в углеводном, жировом и белковом обмене… Жизненно необходимых процессов с участием органических кислот великое множество.

Что в них особенного? Уникальные химические и биологические свойства органические кислоты приобретают благодаря собственному элементному и функциональному составу молекул. Определённая последовательность соединения атомов различной природы и специфика их комбинации придают веществу индивидуальные характеристики и особенности взаимодействия с другими.
Качественный состав органических веществ
Главным кирпичиком, своего рода монометром всего живого является углерод, или, как его ещё называют, карбон. Из него построены все «скелеты» – базовые конструкции, остовы – органических соединений и кислот в том числе. На втором месте по степени распространённости – водород, другое название элемента – гидроген. Он заполняет валентности углерода свободные от соединения с прочими атомами, придаёт молекулам объём и плотность.
Третий – кислород, или оксиген, он соединяется с карбоном в составе групп атомов, придавая простому алифатическому или ароматическому веществу абсолютно новые характеристики, например, окислительную способность. Далее в ряду распространённости – азот, его вклад в свойства органических кислот особенный, существует отдельный класс аминосодержащих соединений. Также в органических соединениях присутствуют сера, фосфор, галогены и некоторые другие элементы в значительно меньших количествах.
В отдельный класс выделены и другие органические вещества. Нуклеиновые кислоты – это фосфоро- и азотосодержащие биологические полимеры, построенные из мономеров – нуклеотидов, образующие сложнейшие структуры ДНК и РНК.
Обоснование химической индивидуальности
Определяющим фактором отличия от других веществ является наличие в соединении такой ассоциации атомов, имеющей строгую последовательность их связывания друг с другом и несущей своего рода генетический код класса, как функциональная группа органических кислот. Она называется карбоксильной, состоит из одного атома углерода, водорода и двух – кислорода, и, по сути, объединяет в себе карбонильную (-С=О) и гидроксильную (-ОН) группы.
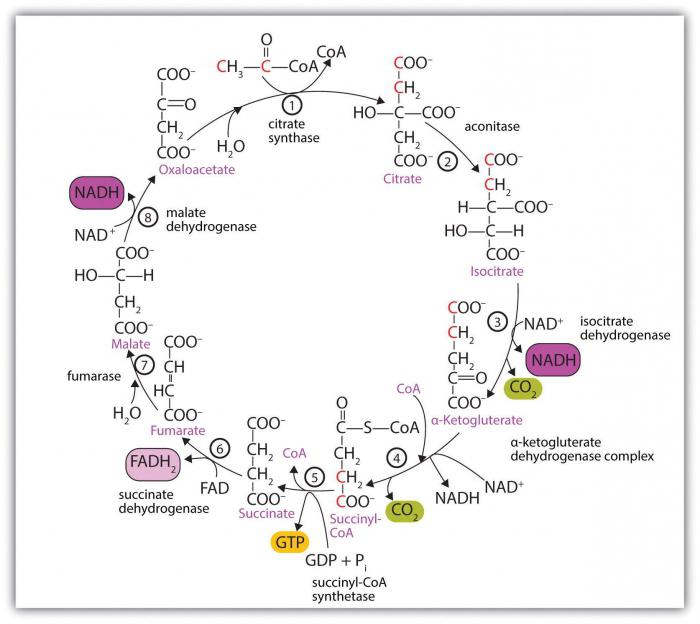
Составные части взаимодействуют на электронном уровне, порождая индивидуальные свойства кислот. В частности, им не присущи карбонильные реакции присоединения, а способность отдавать протон в разы выше, чем у спиртов.
Особенности строения
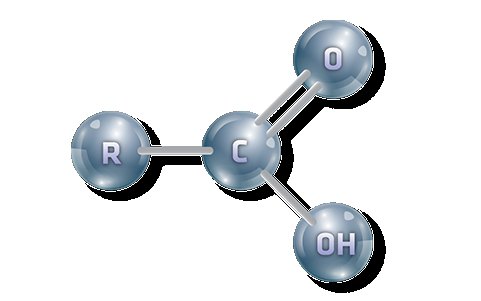
Что же происходит на электронном уровне взаимовлияния в функциональной группе класса органические кислоты? Атом углерода имеет частично положительный заряд за счёт оттягивания плотности связи к кислороду, у которого способность её удерживать значительно выше. Оксиген из гидроксильной части имеет неразделенную пару электронов, которая теперь начинает притягиваться к углероду. Это уменьшает плотность связи кислород-водород, вследствие чего гидроген становится более подвижным. Для соединения становится возможной диссоциация по кислотному типу. Уменьшение положительного заряда углерода обусловливает прекращение протекания присоединительных процессов, о чем уже говорилось выше.
Роль специфических фрагментов
Каждая функциональная группа имеет индивидуальные свойства и наделяет ими вещество, в котором содержится. Наличие нескольких в одном исключает возможность давать те или иные реакции, которыми ранее в отдельности отличались специфические фрагменты. Это важная особенность, которой характеризуется органическая химия. Кислоты могут иметь в своём составе группы, содержащие азот, серу, фосфор, галогены и т. д.
Класс карбоновых кислот
Самая известная группа веществ из всего семейства. Не стоит полагать, что только соединения данного класса – это и есть все органические кислоты. Карбоновые представители являются самой многочисленной группой, но не единственной. Существуют, например, сульфокислоты, они имеют другой функциональный фрагмент. Из них особым статусом отмечены ароматические производные, активно задействованные в химическом производстве фенолов.

Есть ещё один значимый класс, принадлежащий к такому разделу химии, как органические вещества. Нуклеиновые кислоты – это отдельностоящие и требующие индивидуального рассмотрения и описания соединения. О них вкратце уже упоминалось выше.
Карбоновые представители органических веществ содержат в своём составе характерную функциональную группу. Она именуется карбоксильной, специфика её электронного строения описана ранее. Именно функциональная группа обуславливает наличие сильных кислотных свойств, благодаря подвижному, легко отщепляющемуся при диссоциации протону водорода. Слабой из этого ряда является только ацетатная (уксусная).
Классификация карбоновых кислот
По типу строения углеводородного скелета различают алифатические (прямолинейные) и циклические. Например, пропионовая, гептановая, бензойная, триметилбензойная карбоновые органические кислоты. По наличию или отсутствию кратных связей – предельные и непредельные – масляная, уксусная, акриловая, гексеновая и т. д. В зависимости от длины скелета бывают низшие и высшие (жирные) карбоновые кислоты, категория последних начинается с цепи в десять углеродных атомов.
Количественное содержание структурного звена, такого, как функциональная группа органических кислот, тоже является принципом классификации. Существуют одно-, двух-, трёх- и многоосновные. К примеру, муравьиная карбоновая кислота, щавелевая, лимонная и другие. Представители, содержащие помимо основной ещё специфические группы, называются гетерофункциональными.
Современная номенклатура
На сегодняшний день в химической науке используют два способа названий соединений. Рациональная и систематическая номенклатуры имеют по большому счёту одинаковые правила, но отличаются в некоторых деталях составления названий. Исторически сложилось наличие тривиальных «имён» соединений, которые давались веществам, опираясь на присущие им химические свойства, нахождения в природе и прочие моменты. Например, бутановую кислоту называют масляной, пропеновую – акриловой, диуреидоуксусную – аллантоиновой, пентановую – валерьяновой и т. д. Некоторые из них сейчас разрешается использовать в рациональной и систематической номенклатурах.
Поэтапный алгоритм
Путь построения названия веществ, в том числе и таких, как органические кислоты, таков. Вначале необходимо найти самую длинную углеводородную цепь и пронумеровать её. Первый номер должен находиться в непосредственной близости от разветвления конца, чтобы заместители атомов водорода в скелете получили наименьшие локанты – числа, указывающие на номера атомов карбона, с которыми они связаны.
Далее необходимо обнаружить главную функциональную группу, а после идентифицировать остальные, если таковые имеются. Итак, название состоит из: перечисленных в алфавитном порядке и с соответствующими локантами заместителями, основная часть говорит о длине углеродного скелета и его насыщенности атомами водорода, в предпоследнюю очередь определяется принадлежность к классу веществ, указанием специального суффикса и приставки ди- или три- для многоосновных, например, для карбоновых это «-овая» и в конце записывается слово кислота. Этановая, метандиовая, пропеновая, бутиновая кислота, гидроксиуксусная, пентандиовая, 3-гидрокси-4-метоксибензойная, 4-метилпентановая и так далее.
Основные функции и их значение
Неоценимо важны для людей и их деятельности многие кислоты – органические и неорганические. Поступая извне или же вырабатываясь внутри, они инициируют многие процессы, участвуют в биохимических реакциях, обеспечивая исправную работу человеческого тела, а также используются им во многих других сферах.

Соляная (или хлороводородная) кислота является основой желудочного сока и нейтрализатором большинства ненужных и опасных бактерий, попавших в желудочно-кишечный тракт. Незаменимым сырьём в химической промышленности является серная кислота. Органическая часть представителей данного класса ещё более значима – молочная, аскорбиновая, уксусная и многие другие. Кислоты изменяют рН-среду пищеварительной системы в щелочную сторону, что крайне необходимо для поддержания нормальной микрофлоры. Во многих других аспектах они оказывают незаменимое положительное влияние на здоровье человека. Представить же промышленность без применения органических кислот абсолютно невозможно. Всё это работает только благодаря их функциональным группам.
3 На какие группы делят кислоты?
№3 Классификация кислот см. табл. 5.
КЛАССИФИКАЦИЯ КИСЛОТ Таблица 5 | ||
Признаки классификации | Группы кислот | Пример |
Наличие кислорода | Кислородсодержащие | H2SO4, HNO3, карбоновые кислоты, например предельные CnH2n+1COOH |
Бескислородные | H2S, HCl, HBr | |
Основность (число атомов H в молекуле, способных замещаться на металл) | Одноосновные | HCl, HNO 3, CH3COOH |
Двухосновные | H2S, H2SO4, щавелевая кислота HOOC—COOH | |
Трехосновные | Н3РO4 | |
Растворимость | Растворимые | H2SO4, HNO3, HCOOH, CH3COOH |
Нерастворимые | H2SiO3, жирные кислоты, например пальмитиновая C15H31COOH и стеариновая С17Н35СООН | |
Летучесть | Летучие | HCl, H2S, CH3COOH |
Нелетучие | H2SO4, H2SiO3, высшие жирные кислоты | |
Степень электролитической диссоциации | Сильные (α → 1) | H2SO4 HCl, HNO3, HClO4 |
Слабые (α → 0) | H2S, Н2СO3, CH3COOH | |
Стабильность | Стабильные | H2SO4, Н3РO4, HCl |
Нестабильные | H2CO3, H2SO3, H2SiO3 | |
Группа С как кислота, — Справочник химика 21
Запись данных опыта. При растворении гидроксида железа (П1) в щавелевой и лимонной кислотах образуются внутрикомплексные соединения, в которых карбоксильные группы кислот присоединяются к комплексообразователю. Для щавелевокислого комплекса формула имеет вид [c.123]ЖЕЛЧНЫЕ КИСЛОТЫ — группа кислот сложного строения, содержащихся в желчной жидкости. Примером Ж. к. может быть холевая кислота. Ж. к. образуются в печени считают, что этот процесс связан с обменом холестерина. Комплексы Ж к. с жирами и жирными кислотами играют большую роль в усваивании жиров. Ж- к. применяют для синтеза стероидных гормонов. [c.96]
Для нейтрализации непрореагировавших карбоксильных групп кислот, содержащихся в канифоли, продукт модификации (кислый копал) этерифицируют многоатомными спиртами — обычно глицерином или пентаэритритом. Особенно хорошими качествами отличаются смолы, в которых фенольным компонентом является дифенилолпропан. Процесс получения этих смол можно осуществить следующим образом . Сначала конденсацией дифенилолпропана с формальдегидом в щелочной среде получают триметилольное производное дифенилолпропана. Его выделяют путем нейтрализации реакционного раствора кислотой, с последующей промывкой водой и отделением смоляного слоя. После обезвоживания в вакууме триметилолдифе-нилолпропан подвергают взаимодействию с канифолью, и полученный продукт этерифицируют глицерином или пентаэритритом.
Интенсивная полоса у 940 см свидетельствует о вне-плоскостных деформационных колебаниях ОН в карбоксильных группах. Кроме того, наличие карбоксильных групп подтверждается широкими полосами поглощения в области 2500—2700 и 3000—3300 м . Поглощение в области 1230 и 1290 также относится к деформационным колебаниям группы ОН, либо к валентным колебаниям С = 0 в карбоксильных группах кислот. Присутствие небольшого количества ароматических структур подтверждается поглощением в областях 1600 и 690 см , характерных для связей С—С в ароматических [c.250]
С помощью радиоактивного изотопа кислорода ( 0), который был введен в состав спирта, было доказано, что выделение молекулы воды в результате реакции этерификации происходит за счет гидроксила карбоксильной группы кислоты и атома водорода гидроксильной группы спирта. Механизм реакции этерификации можно представить в таком виде [c.167]
Иная классификация была предложена для водорастворимых и маслорастворимых сульфокислот, которые подразделяются на моно- и дисульфокислоты. Каждую группу кислот в свою очередь подразделяют на углеводородные, смоляные и асфальтеновые сульфокислоты [215]. [c.574]
Ионы и РЬ + относятся к группе кислот, занимающих промежуточное положение между жесткими и мягкими [c.593]
Превращение карбоновой кислоты в предельный углеводород может быть осуществлено также по методу Дюма однако в этом случае образующийся углеводород содержит на один атом углерода меньше, чем исходная кислота. Метод заключается в перегонке щелочных или щелочноземельных солей карбоновых кислот с едким натром, натронной известью или гидратом окиси бария. При этом карбоксильная группа кислоты выделяется в виде карбоната [c.32]
На основании данных, полученных с С -содержащими а-кето-кислотами, считают, что термическое разложение а-кетокарбоновых кислот протекает с выделением окиси углерода из карбоксильной группы кислоты [c.329]
Аминокислоты содержат аминогруппу —Nh3, присоединенную к атому углерода, который связан также с карбоксильной группой кислоты —СООН. Простейшая аминокислота, глицин, может существовать в воде в одной из [c.108]
К группе кислот относятся и комплексные частицы, в которых лигандами являются протонсодержащие молекулы. Так, [Сг(Н20)б [Р1(ЫНз)б]и многие другие, диссоциирующие по схемам [Сг (Н2О), ] + [Сг (Н,0)й0Н I + Н+ [c.45]
А н и л и д ы. Реакция основана на взаимодействии кислот и их солей с анилином в присутствии соляной кислоты гидроксильная группа кислоты замещается остатком анилина. [c.129]
Высокополярная карбонильная группа кислот и их производных может подвергаться нуклеофильной атаке. Если для альдегидов и кетонов такого рода атака приводит к присоединению по кратной связи, то в кислотах и их производных R—СО—X) результатом реакции является замещение группы X. [c.95]
Отклонение от закономерного роста кислотной функции (за счет увеличения длин связи Н—X и уменьшения ее прочности) в УИА группе связано, с одной стороны, с повышенной способностью молекулы НР образовывать водородные связи, с другой — нивелирующим действием воды (как ионизирующего растворителя), перекрывающим различия в свойствах остальных членов группы — кислот НС1, НВг и Н1. [c.405]
Влияние растворителей на частоты ОН- и ОО-групп кислот [c.256]
Полоса ОВ-группы кислот в спектрах их спиртовых растворов проявляется в виде максимумов на низкочастотном склоне полосы, ОВ-группы спирта. [c.256]
Известно много кислородсодержащих кислот фосфора. Их можно разделить на две группы кислоты, где степень окисления фосфора меньше 5 (они содержат связи Р-Н или Р-Р) и кислоты, содержащие Р (они ие имеют связей Р-Н и Р-Р). Кислоты, содержащие низкие степени окисления фосфора, обычно легко окисляются кислородом.
Систематическая номенклатура карбоновых кислот и их производных — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 июня 2013; проверки требуют 6 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 июня 2013; проверки требуют 6 правок.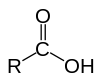 Карбоксильная группа
Карбоксильная группаК классу карбоновых кислот относятся соединения, содержащие карбоксильную группу −COOH. Соединения, содержащие одну карбоксильную группу, называются одноосновными карбоновыми кислотами, две — двухосновными, три — трехосновными и т.д. Номенклатура ИЮПАК разрешает сохранять их тривиальные названия. Для более сложных случаев названия кислот производят от названия углеводородов с тем же числом атомов углерода, что и в молекуле кислоты, с добавлением окончания «-овая» и слова «кислота». Например, этановая кислота, этандиовая кислота.
Допускается использовать окончание «-карбоновая кислота», с уменьшением длины углеводородного радикала на число карбоксильных групп. Этот способ наименования наиболее удобен для трех- и более основных кислот, а также кислот, имеющих циклический или гетероциклический углеводородный радикал. Например, 2-гидрокси-1,2,3-пропантрикарбоновая кислота (тривиальное название — лимонная кислота), 1,2,5,6-бензолтетракарбоновая кислота, 3-пиридинкарбоновая кислота.
Названия солей карбоновых кислот получаются из названий соответствующих им углеводородов путём добавления окончания «-оат» и (для двух- и более основных кислот) числового суффикса перед ним, отражающего количество замещенных карбоксильных групп («-диоат», «-триоат», «-тетраоат» и т.д.) В случае неполного замещения в качестве катиона указывается необходимое количество атомов водорода. Например, (CO−O−K)2 — этандиоат калия (тривиальное название — оксалат калия), H−O−CO−CO−O−K — этандиоат водорода-калия (тривиальное название — гидрооксалат калия).