Кристаллические решетки, подготовка к ЕГЭ по химии
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
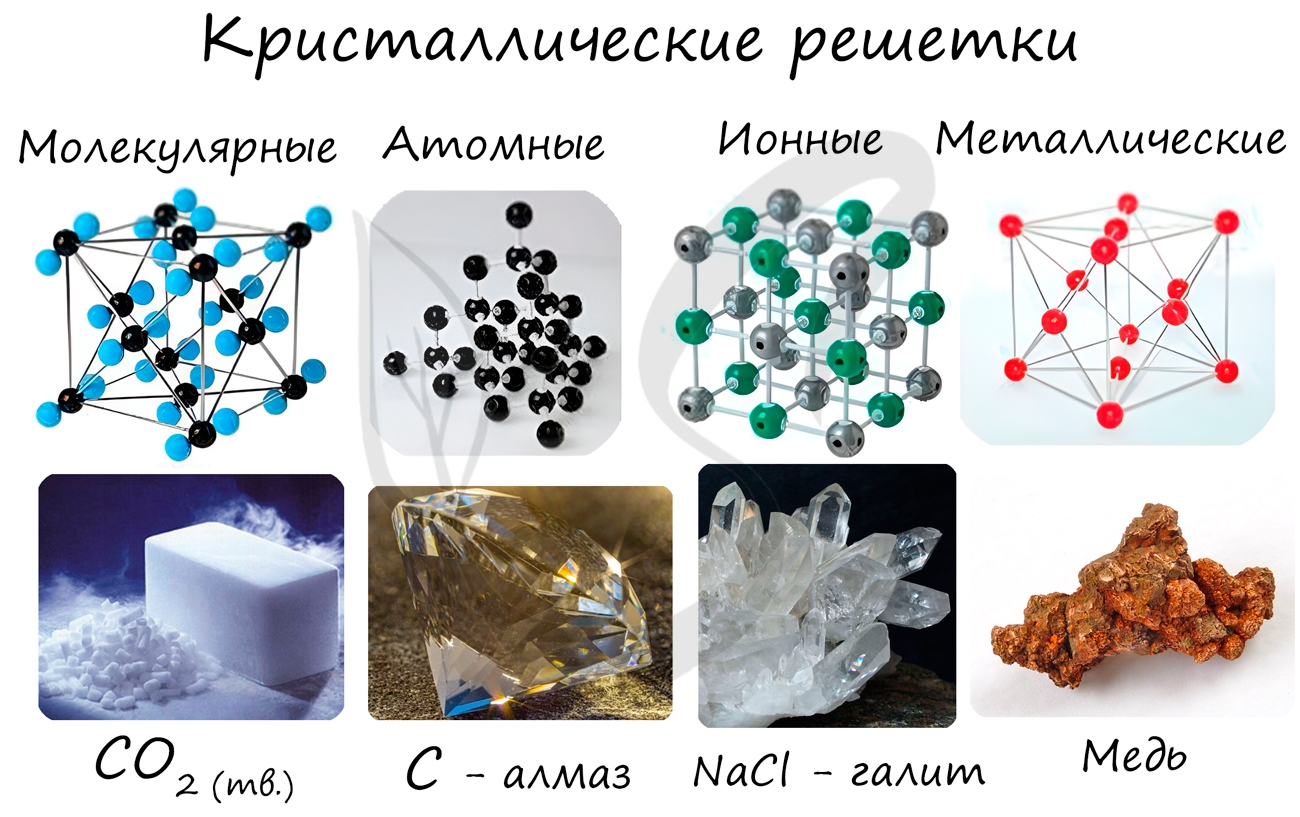
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
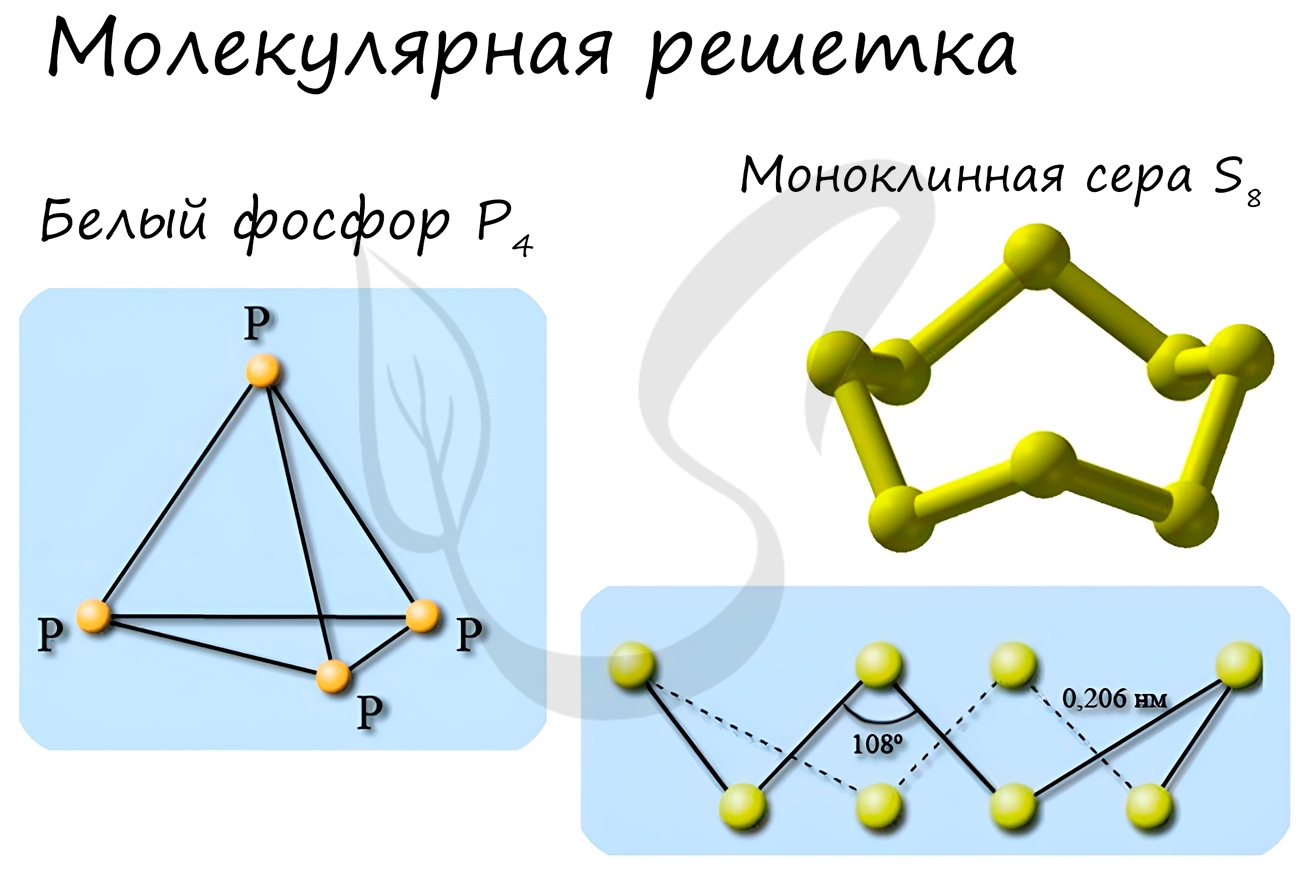
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить красный и белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
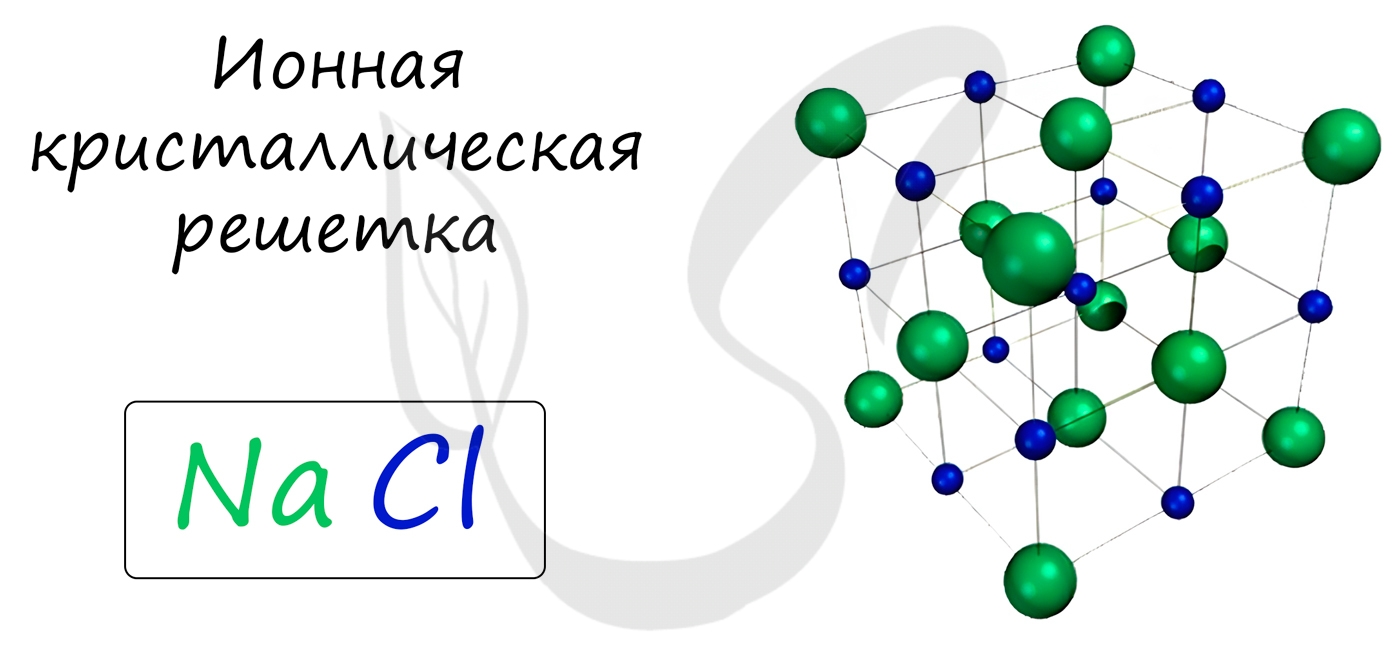
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью — NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.
Примеры: NaCl, MgCl2, NH4Br, KNO3, Li2O, Na3PO4.
Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.

Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), черный фосфор (P).

©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
studarium.ru
Типы кристаллических решёток — урок. Химия, 8–9 класс.
Большинство твёрдых веществ имеет кристаллическое строение, которое характеризуется строго определённым расположением частиц.
Если соединить частицы условными линиями, то получится пространственный каркас, называемый кристаллической решёткой.
Точки, в которых размещены частицы кристалла, называют узлами решётки. В узлах воображаемой решётки могут находиться атомы, ионы или молекулы.
В зависимости от природы частиц, расположенных в узлах, и характера связи между ними различают четыре типа кристаллических решёток: ионную, металлическую, атомную и молекулярную.
Ионными называют решётки, в узлах которых находятся ионы.
Их образуют вещества с ионной связью. В узлах такой решётки располагаются положительные и отрицательные ионы, связанные между собой электростатическим взаимодействием.
Ионные кристаллические решётки имеют соли, щёлочи, оксиды активных металлов.
Ионы могут быть простые или сложные. Например, в узлах кристаллической решётки хлорида натрия находятся простые ионы натрия Na+ и хлора Cl−, а в узлах решётки сульфата калия чередуются простые ионы калия K+ и сложные сульфат-ионы SO42−.
Связи между ионами в таких кристаллах прочные. Поэтому ионные вещества твёрдые, тугоплавкие, нелетучие. Такие вещества хорошо растворяются в воде.

Кристаллическая решётка хлорида натрия
Кристалл хлорида натрия
Металлическими называют решётки, которые состоят из положительных ионов и атомов металла и свободных электронов.
Их образуют вещества с металлической связью. В узлах металлической решётки находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы, отдавая свои внешние электроны в общее пользование).
Такие кристаллические решётки характерны для простых веществ металлов и сплавов.
Температуры плавления металлов могут быть разными (от \(–37\) °С у ртути до двух-трёх тысяч градусов). Но все металлы имеют характерный металлический блеск, ковкость, пластичность, хорошо проводят электрический ток и тепло.
Металлическая кристаллическая решётка

Металлические изделия
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, соединённые ковалентными связями.
Такой тип решётки имеет алмаз — одно из аллотропных видоизменений углерода. К веществам с атомной кристаллической решёткой относятся графит, кремний, бор и германий, а также сложные вещества, например, карборунд SiC и кремнезём, кварц, горный хрусталь, песок, в состав которых входит оксид кремния(\(IV\)) SiO2.
Таким веществам характерны высокая прочность и твёрдость. Так, алмаз является самым твёрдым природным веществом.
У веществ с атомной кристаллической решёткой очень высокие температуры плавления и кипения. Например, температура плавления кремнезёма — \(1728\) °С, а у графита она выше — \(4000\) °С.
Атомные кристаллы практически нерастворимы.

Кристаллическая решётка алмаза

Алмаз
Молекулярными называют решётки, в узлах которых находятся молекулы, связанные слабым межмолекулярным взаимодействием.
Несмотря на то, что внутри молекул атомы соединены очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому молекулярные кристаллы имеют небольшую прочность и твёрдость, низкие температуры плавления и кипения.
Многие молекулярные вещества при комнатной температуре представляют собой жидкости и газы.
Такие вещества летучи. Например, кристаллические иод и твёрдый оксид углерода(\(IV\)) («сухой лёд») испаряются, не переходя в жидкое состояние.
Некоторые молекулярные вещества имеют запах.
Такой тип решётки имеют простые вещества в твёрдом агрегатном состоянии: благородные газы с одноатомными молекулами (He,Ne,Ar,Kr,Xe,Rn), а также неметаллы с двух- и многоатомными молекулами (h3,O2,N2,Cl2,I2,O3,P4,S8).
Молекулярную кристаллическую решётку имеют также вещества с ковалентными полярными связями: вода — лёд, твёрдые аммиак, кислоты, оксиды большинства неметаллов. Большинство органических соединений тоже представляют собой молекулярные кристаллы (нафталин, сахар, глюкоза).

Кристаллическая решётка углекислого газа

«Сухой лёд»
Кристаллики иода
Если известно строение вещества, то можно предсказать его свойства.
Попробуем определить, каковы примерно температуры плавления у фторида натрия, фтороводорода и фтора.
У фторида натрия — ионная кристаллическая решётка. Значит, его температура плавления будет высокой. Фтороводород и фтор имеют молекулярные кристаллические решётки. Поэтому их температуры плавления будут невысокими. Молекулы фтороводорода полярные, а фтора — неполярные. Значит, межмолекулярное взаимодействие у фтороводорода будет сильнее, и его температура плавления будет выше по сравнению со фтором.
Экспериментальные данные подтверждают эти предположения: температуры плавления NaF, HF и F2 составляют соответственно \(995\) °С, \(–83\) °С, \(–220\) °С.
Источники:
Габриелян О. С. Химия. 8 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2013. — 133 с.
www.yaklass.ru
Ионные кристаллические решетки. Свойства веществ с ионным типом кристаллической решетки.
| Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов. Рассмотрим строение кристалла поваренной соли, в узлах которого находятся ионы хлора и натрия. |
Связи между ионами в кристалле очень прочные и устойчивые.Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.
Вещества с ионной кристаллической решеткой обладают следующими свойствами:
1. Относительно высокой твердостью и прочностю;
2. Хрупкостью;
3. Термостойкостью;
4. Тугоплавкостью;
5. Нелетучестью.
Примеры: соли – хлорид натрия, карбонат калия, основания – гидрооксид кальция, гидрооксид натрия.
4. Механизм образования ковалентной связи (обменный и донорно-акцепторный).
Каждый атом стремится завершить свой внешний электронный уровень, чтобы уменьшить потенциальную энергию. Поэтому ядро одного атома притягивается к себе электронную плотность другого атома и наоборот, происходит наложение электронных облаков двух соседних атомов.
Демонстрация аппликации и схемы образования ковалентной неполярной химической связи в молекуле водорода. (Учащиеся записывают и зарисовывают схемы).
Вывод: Связь между атомами в молекуле водорода осуществляется за счет общей электронной пары. Такая связь называется ковалентной.
Прочитать стр. 33 в учебнике и записать определение.
Какую связь называют ковалентной неполярной? (Учебник стр. 33).
Составление электронных формул молекул простых веществ неметаллов:
•• ••
•• CI •• CI •• — электронная формула молекулы хлора,
•• ••
CI — CI — структурная формула молекула хлора.
••
•• N •• N •• — электронная формула молекулы азота,
••
N ≡ N — структурная формула молекулы азота.
Электроотрицательность. Ковалентные полярная и неполярная связи. Кратность ковалентной связи.
Но молекулы могут образовывать и разные атомы неметаллов и в этом случае общая электронная пара будет смещаться к более электроотрицательному химическому элементу.
Изучить материал учебника на стр. 34
Вывод: Металлы имеют более низкое значение электроотрицательности, чем неметаллы. И между ними она сильно отличается.
Демонстрация схемы образования полярной ковалентной связи в молекуле хлороводорода.
Общая электронная пара смещена к хлору, как более электроотрицательному. Значит это ковалентная связь. Она образована атомами, электроотрицательности которых несильно отличаются, поэтому это ковалентная полярная связь.
Составление электронных формул молекул йодоводорода и воды:
••
H •• J •• — электронная формула молекулы йодоводорода,
••
H → J — структурная формула молекулы йодоводорода.
••
H •• O •• — электронная формула молекулы воды,
••
H
Н →О — структурная формула молекулы воды.
↑
Н
Самостоятельная работа с учебником: выписать определение электроотрицательности.
Молекулярные и атомные кристаллические решетки. Свойства веществ с молекулярными и атомными кристаллическими решетками
Самостоятельная работа с учебником.
Вопросы для самоконтроля
— Атом, какого химического элемента имеет заряд ядра +11
– Записать схему электронного строения атома натрия
– Внешний слой завершен?
– Как добиться завершения заполнения электронного слоя?
– Составить схему отдачи электрона
– Сравнить строение атома и иона натрия
— Сравнить строение атома и иона инертного газа неона.
— Определить атом, какого элемента с количеством протонов 17.
– Запишите схему электронного строения атома.
– Слой завершен? Как этого добиться.
– Составить схему завершения электронного слоя хлора.
Задание по группам:
1-3 группа: Cоставьте электронные и структурные формулы молекул веществ и укажите тип связи Br2 ; NH3.
4-6 группы: Cоставьте электронные и структурные формулы молекул веществ и укажите тип связи F
Два ученика работают у дополнительной доски с этим же заданием для образца к самопроверке.
Устный опрос.
1. Дайте определение понятия «электроотрицательность».
2. От чего зависит электроотрицательность атома?
3. Как изменяется электроотрицательность атомов элементов в периодах?
4. Как изменяется электроотрицательность атомов элементов в главных подгруппах?
5. Сравните электроотрицательность атомов металлов и неметаллов. Отличаются ли способы завершения внешнего электронного слоя, характерные для атомов металлов и неметаллов? Каковы причины этого?
7. Какие химические элементы способны отдавать электроны, принимать электроны?
Что происходит между атомами при отдаче и принятии электронов?
Как называют частицы, образовавшиеся из атома в результате отдачи или присоединения электронов?
8. Что произойдет при встрече атомов металла и неметалла?
9. Как образуется ионная связь?
10. Химическая связь, образуемая за счет образования общих электронных пар называется …
11. Ковалентная связь бывает … и …
12. В чем сходство ковалентной полярной и ковалентной неполярной связи? От чего зависит полярность связи?
13. В чем различие ковалентной полярной и ковалентной неполярной связи?
ПЛАН ЗАНЯТИЯ № 8
Дисциплина: Химия.
Тема:Металлическая связь. Агрегатные состояния веществ и водородная связь.
Цель занятия: Сформировать понятие об химических связях на примере металлической связи. Добиться понимания механизма образования связи.
Планируемые результаты
Предметные: формировании кругозора и функциональной грамотности человека для решения практических задач; умение обрабатывать, объяснять результаты; готовность и способность применять методы познания при решении практических задач;
Метапредметные: использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере;
Личностные: умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
Норма времени:2 часа
Вид занятия:Лекция.
План занятия:
1. Металлическая связь. Металлическая кристаллическая решетка и металлическая химическая связь.
2. Физические свойства металлов.
3. Агрегатные состояния веществ. Переход вещества из одного агрегатного состояния в другое.
4. Водородная связь
Оснащение: Периодическая система химических элементов, кристаллическая решетка, раздаточный материал.
Литература:
1. Химия 11 класс: учеб. для общеобразоват. организаций Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил..
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 — изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель: Тубальцева Ю.Н.
cyberpedia.su