Электролиты: понятие и свойства
Электролиты — растворы, содержащие большую концентрацию ионов, обеспечивающих прохождение электрического тока. Как правило, это водные растворы солей, кислот и щелочей.
Это интересно
В организме человека и животных электролиты играют важную роль: к примеру, электролиты крови с ионами железа транспортируют кислород в ткани; электролиты с ионами калия и натрия регулируют водно-солевой баланс организма, работу кишечника и сердца.
Свойства
Чистая вода, безводные соли, кислоты, щелочи ток не проводят. В растворах же вещества распадаются на ионы и проводят ток. Именно поэтому электролиты называют проводниками второго порядка (в отличие от металлов). Электролитами могут быть также расплавы и некоторые кристаллы, в частности диоксид циркония и иодид серебра.
Главное свойство электролитов — способность к электролитической диссоциации, то есть к распаду молекул при взаимодействии с молекулами воды (или других растворителей) на заряженные ионы.
По типу ионов, образующихся в растворе, различают электролит щелочной (электропроводимость обусловлена ионами металлов и ОН-), солевой и кислотный (с ионами Н+ и остатками основания кислоты).
Для количественной характеристики способности электролита к диссоциации введен параметр «степень диссоциации». Эта величина отражает процент молекул, подвергшихся распаду. Она зависит от:
• самого вещества;
• растворителя;
• концентрации вещества;
• температуры.
Электролиты делят на сильные и слабые. Чем лучше реагент растворяется (распадается на ионы), тем сильнее электролит, тем лучше он проводит ток. К сильным электролитам относятся щелочи, сильные кислоты и растворимые соли.
Для электролитов, использующихся в аккумуляторах, очень важен такой параметр, как плотность. От нее зависят условия эксплуатации аккумулятора, его емкость и срок службы. Определяют плотность с помощью ареометров.
Меры предосторожности при работе с электролитами
Самые популярные электролиты, это раствор концентрированной серной кислоты и щелочи — чаще всего гидроксиды калия, натрия, лития. Все они вызывают химические ожоги кожи и слизистых, очень опасные ожоги глаз. Именно поэтому все работы с такими электролитами нужно производить в отдельном, хорошо вентилируемом помещении, используя средства защиты: одежду, маски, очки, резиновые перчатки.
• Рядом с помещением, где проводятся работы с электролитами, должна храниться аптечка с набором нейтрализующих средств и кран с водой.
• Кислотные ожоги нейтрализуются раствором соды (1 ч.л. на 1 ст. воды).
• Ожоги щелочью нейтрализуют раствором борной кислоты (1 ч.л. на 1 ст. воды).
• Для промывания глаз нейтрализующие растворы должны быть в два раза слабее.
• Поврежденные участки кожи сначала промывают нейтрализатором, а потом мылом и водой.
При работе с электролитом следует выполнять  все требования техники безопасности. Например, кислоту наливают в воду (а не наоборот!) не вручную, а с помощью приспособлений. Куски твердой щелочи в воду опускают не руками, а щипцами или ложками. Нельзя работать в одном помещении с аккумуляторами на разнотипных электролитах, и хранить их вместе тоже запрещается.
все требования техники безопасности. Например, кислоту наливают в воду (а не наоборот!) не вручную, а с помощью приспособлений. Куски твердой щелочи в воду опускают не руками, а щипцами или ложками. Нельзя работать в одном помещении с аккумуляторами на разнотипных электролитах, и хранить их вместе тоже запрещается.
Некоторые работы требуют «кипения» электролита. При этом выделяется водород — горючий и взрывоопасный газ. В таких помещениях должна использоваться взрывобезопасная электропроводка и электроприборы, запрещается курение и любые работы с открытым огнем.
Хранят электролиты в пластиковых емкостях. Для работы подходит стеклянная, керамическая, фарфоровая посуда и инструменты.
В следующей статье расскажем подробнее о видах и применении электролита.
pcgroup.ru
Электролит, понятие, свойства и виды
Электролит, понятие, свойства и виды.
Электролит – вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или вследствие движения ионов в кристаллических решётках твёрдых электролитов.
Электролит (определение и понятие)
Электролитическая диссоциация (ионизация)
Виды электролитов: сильные и слабые электролиты
Электролит (определение и понятие):
Электролит – вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или вследствие движения ионов в кристаллических решётках твёрдых электролитов.
Электролиты – вещества, расплавы или растворы которых проводят электрический ток.
Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения ионов. Таким образом, движение электрического тока в электролитах обусловлено ионной проводимостью.
Электролиты – это проводники второго рода, вещества, электропроводность которых обусловлена подвижностью положительно или отрицательно заряженных ионов.
К электролитам относятся вещества с ионной или сильнополярной ковалентной связью. К электролитам относятся растворы солей, оснований и кислот, а также вода. Кроме того, некоторые газы ведут себя как электролиты в условиях высокой температуры или низкого давления. Некоторые кристаллы (например, иодид серебра, диоксид циркония) также являются твердыми электролитами.
Соответственно неэлектролиты – вещества, расплавы и водные растворы которых не проводят электрический ток. К неэлектролитам относятся вещества с неполярной и малополярной ковалентной связью. К неэлектролитам относятся газы (двухатомные газы, благородные газы и др.), твердые вещества и органические вещества (спирты, эфиры, бензол, бензин, сахарозу и пр.).
Способность растворов или расплавов электролитов проводить электрический ток объясняется тем, что молекулы электролитов при растворении в воде или других растворителях (например, этаноле, жидком аммиаке, жидком сернистом ангидриде) либо при расплавлении распадаются на электрически положительно и отрицательно заряженные частицы — ионы. Величина заряда иона численно равна валентности атома или группы атомов, образующих ион.
Положительно заряженные ионы называют катионами, отрицательно заряженные – анионами. Катионы образуют атомы водорода Н+, металлов: К+, Na+, Са2+, Fe3+ и некоторые группы атомов, например группа аммония NH4+
Ионы могут состоять из одного атома – тогда они именуются простыми ионами (Na+, Mg2+, Аl3+ и т.д.) или из нескольких атомов – тогда они именуются сложными ионами (NО3—, SO42— , РО43— и т.д.).
Электролитическая диссоциация (ионизация):
Процесс распада молекул в растворе или расплаве электролита на ионы называется электролитической диссоциацией (или ионизацией). Процесс диссоциации носит обратимый характер. Одновременно с процессами диссоциации в растворах или расплавах электролита протекают и процессы ассоциации ионов в молекулы. При неизменных внешних условиях (температура, концентрация и др.) устанавливается динамическое равновесие между диссоциациями (распадами) и ассоциациями. Это означает, что определенное количество молекул электролита распадается на ионы и такое же количество молекул образуется вновь из ионов. Поэтому в растворах или расплавах электролита всегда диссоциирована определённая доля молекул вещества.
Уравнение диссоциации молекулы электролита (КA) на катион (К+) и анион (А—) в общем виде записывается так:
КА ↔ K+ + A—.
Для конкретных химических соединений уравнение диссоциации выглядит следующим образом:
H ↔ H+ + NO3—,
Ba(OH)2 ↔ Ba2+ + 2OH—,
Na(NO3)2 ↔ Na2+ + 2NO3—.
Число положительных и отрицательных ионов электролита в растворе или расплаве может быть разным, но суммарный заряд катионов всегда равен суммарному заряду анионов, поэтому раствор (или расплав) в целом электрически нейтрален.
Процесс диссоциации
Гидратированные ионы устойчивы. Они беспорядочно передвигаются в растворе. Однако под действием электрического тока их движение приобретает направленный характер.
Растворы электролитов обладают способностью проводить электрический ток вследствие движения ионов. Если в раствор или расплав электролита опустить электроды и на электроды подать электрический ток, то под действием электрического тока ионы приобретут направленное движение: положительно заряженные ионы (катионы) будут двигаться к катоду (отрицательному электроду), отрицательно заряженные (анионы) – к аноду (положительному электроду). Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами. Направленное движение катионов и анионов в растворе или расплаве электролита в противоположных направлениях равносильно электрическому току.
Для измерения количественной характеристики электролитической диссоциации введено понятие степень диссоциации.
Степень диссоциации (α) — это отношение числа молекул, диссоциировавших на ионы (n), к общему числу молекул (N) в растворе электролита.
α = n / N.
Степень диссоциации выражается в долях или процентах.
Степень диссоциации (т.е. полнота диссоциации) электролита зависит от многих факторов: от природы электролита, температуры, концентрации и вида растворителя. Так, один и тот же электролит при разной температуре или при одинаковой температуре, но в разных растворителях, будет диссоциирован в разной степени. Так, диссоциация происходит только в полярном растворителе, в частности, в воде. Соли и щелочи диссоциируются полностью. С увеличением концентрации ионизация электролита идет труднее, и наоборот. Повышение температуры способствует повышению степени диссоциации, и наоборот.
Мерой способности электролитов распадаться на ионы в растворах может служить константа электролитической диссоциации (константа ионизации) (Кд).
Константа диссоциации (Кд) – это отношение произведения концентрации диссоциированных ионов к концентрации недиссоциированных молекул электролита.
Константу диссоциации можно выразить уравнением:
Кд = (K+ ∙ A−) / KA.
где:
KA – концентрация недиссоциированного соединения в растворе;
K + – концентрация катионов в растворе;
A− – концентрация анионов в растворе.
Константа диссоциации (Кд) показывает во сколько раз скорость диссоциации больше скорости ассоциации. Чем больше константа диссоциации, тем сильнее электролит. Константа диссоциации зависит от природы электролита и растворителя, температуры и не зависит от концентрации раствора.
Виды электролитов: сильные и слабые электролиты, солевые, кислотные и щелочные электролиты и пр.:
Исходя из степени диссоциации все электролиты делятся на две группы: сильные электролиты и слабые электролиты.
Сильные электролиты – электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как HCl, HBr, HI, HNO3, H2SO4).
Слабые электролиты – электролиты, степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты, такие как HF, HNO
Необходимо иметь в виду, что между двумя указанными группами не существует чёткой границы: одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом – слабого.
В зависимости от вида ионов, на которые распадается вещество при растворении в воде, различаются:
– электролиты без ионов Н+ и ОН— (солевые электролиты),
– электролиты с обилием ионов Н+ (кислотные электролиты),
– и электролиты с преобладанием ионов ОН— (щелочные электролиты).
В зависимости от вида растворителя электролиты делятся на водные электролиты и неводные электролиты. Отдельно выделяется особый вид электролитов – полиэлектролиты.
В зависимости от того, какое количество ионов образуется при диссоциации молекул электролита, электролиты подразделяются на:
– симметричные электролиты. Симметричные электролиты – электролиты, при диссоциации молекул которого образуется равное число положительных и отрицательных ионов. Симметричными электролитами являются NaCl – 1,1-валентный электролит, HCl – 1,1-валентный электролит и CaSO4 – 2,2-валентный электролит;
– несимметричные электролиты. Несимметричные электролиты – электролиты при диссоциации молекул которого образуется неравное число положительных и отрицательных ионов. Несимметричным электролитом является, например, H2SO4 – 1,2-валентный электролит.
В зависимости от природы электролита выделяются:
– соли. Соли, как электролиты, диссоциируют в водном растворе с образованием иона металла в качестве катиона и иона кислотного остатка в качестве аниона. Соли диссоциируют полностью.
Например, Na(NO3)2 ↔ Na2+ + 2NO3—.
– кислоты. Кислоты, как электролиты, диссоциируют в водном растворе с образованием иона водорода H+ в качестве катиона и иона кислотного остатка в качестве аниона. Многоосновные кислоты диссоциируют ступенчато. Причем каждая последующая ступень диссоциирует сложнее, т.к. образующиеся ионы кислотных остатков являются более слабыми электролитами.
Например, фосфорная кислота диссоциирует в три ступени, потому, что имеет 3 атома водорода:
H3РО4 ↔ H+ + H2РО4—,
H2РО4— ↔ H+ + HРО42—,
HРО42— ↔ H+ + РО43—.
Общая формула диссоциация для фосфорной кислоты будет выглядеть так:
H3РО4 ↔ H+ + H2РО43—.
– основания. Основания, как электролиты, диссоциируют в водном растворе с образованием гидроксид-иона ОН— в качестве аниона и иона металла в качестве катиона.
Например, NaOH ↔ Na+ + OH—. Основания диссоциируют полностью.
Примечание: © Фото https://www.pexels.com, https://pixabay.com




карта сайта
Коэффициент востребованности 39
xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai
Электролиты: свойства и классификации
Электролиты – растворы, имеющие в своем составе заряженные частицы, которые принимают участие в переносе зарядов между электродом и катодом. Могут быть сильными и слабыми. Процесс распада молекул на ионы называется электролитической диссоциацией. Неэлектролиты – водные растворы, в которые вещество перешло в виде молекул с сохранением первоначальной структуры. Все молекулы вещества в таких растворах окружены гидратными оболочками (молекулами воды) и не могут переносить электрический заряд.
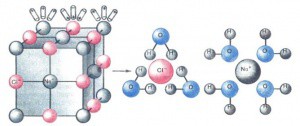
Растворение кристалла поваренной соли
Как протекает электролитическая диссоциация
Вещества-электролиты устроены за счет ионных или ковалентных полярных связей.

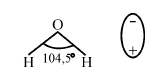
Во время растворения происходит химическое воздействие вещества с молекулами воды, в результате чего оно распадается на электроны. Молекулы воды – активные диполи с двумя полюсами: положительным и отрицательным. Атомы водорода располагаются под углом 104,5°, за счет этого молекула воды приобретает угловую форму.
Вещества, имеющие ионную кристаллическую решетку, намного легче диссоциируют, они уже состоят из активных ионов, а диполи воды во время растворения только ориентируют их. Между диполями воды и ионами электролита возникают усилия взаимного притяжения, связи кристаллической решетки ослабевают и ионы покидают кристалл.

Последовательность процессов при диссоциации растворов с ионной связью
На первом этапе молекулы вещества ориентируются около диполей воды, далее происходит гидратация, а на завершающем этапе диссоциация.
Похожим образом диссоциируют электролиты, у которых молекулы строятся за счет ковалентных связей. Разница только в том, что диполи воды превращают ковалентные связи в ионные. При этом наблюдается такая последовательность процессов:
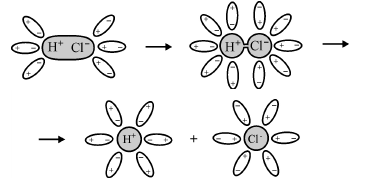
Электролитическая диссоциация полярной молекулы хлороводорода на гидратированные ионы
В растворах происходит хаотическое движение гидратированных ионов, они могут сталкиваться между собой и опять образовывать отдельные связи. Такой процесс называется ассоциацией.
Классификация электролитов
Все электролиты кроме ионов содержат молекулярные структуры, неспособные переносить разряд. Процентное содержание этих элементов оказывает прямое влияние на возможность проводить ток, параметр обозначается α и определяется по формуле:
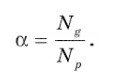
Для вычисления берется отношение количества частиц, распавшихся на ионы к общему числу растворенных частиц. Степень распада определяется опытным путем, если она равняется нулю, то диссоциация полностью отсутствует, если равняется единице, то все вещества в электролите распались на ионы. С учетом химического состава электролиты имеют неодинаковую степень диссоциации, параметр зависит от природы и концентрации раствора, чем ниже концентрация, тем выше диссоциация. Согласно данным определениям все электролиты делятся на две группы.
- Слабые электролиты. Имеют очень незначительную степень диссоциации, химические элементы почти не распадаются на ионы. К таким электролитам относится большинство неорганических и некоторые органические кислоты. Слабые электролиты расщепляются на ионы обратимо, процессы диссоциации и ассоциации по интенсивности могут сравниваться, раствор очень плохо проводит электрический ток.
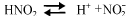
Способность к диссоциации зависит от нескольких факторов, слабые электролиты во многом определяются химическими и физическими особенностями вещества. Важное значение имеет химический состав растворителя.
- Сильные электролиты. Эти растворы в водных растворах интенсивно диссоциируют на ионы, сильные электролиты могут иметь степень диссоциации равную единице. К ним относятся почти весь перечень солей и многие кислоты неорганического происхождения. Сильные электролиты диссоциируют необратимо:

От каких факторов зависит степень диссоциации
- Природа растворителя. Степень диссоциации веществ увеличивается прямо пропорционально полярности. Чем больше полярность, тем выше активность имеют сильные электролиты.
- Температура во время подготовки раствора. Повышение температуры растворителя увеличивает активность ионов и их количество. Правда, при этом есть вероятность одновременного повышения ассимиляции. Процесс растворения веществ в растворителе должен непрерывно контролироваться, при обнаружении отклонений от заданных параметров немедленно вносятся корректировки.
- Концентрация химических веществ. Чем выше концентрация, тем больше вероятность, что после растворения образуются слабые электролиты.
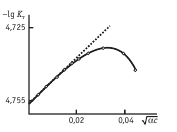
График зависимости константы диссоциации от концентрации
Главные положения теории электролитической диссоциацииСогласно существующей теории, электролитическая диссоциация позволяет растворам проводить электрический ток. В зависимости от этой способности они делятся на электролиты и неэлектролиты. Процесс распада веществ на ионы называется диссоциацией, положительно заряженные двигаются к катоду и называются катионами, негативно заряженные двигаются к аноду и называются анионами. Состав электролитов оказывает влияние на способность к диссоциации, технические нормы позволяют определять эту зависимость количественно.
С учетом получаемых после диссоциации ионов изменяется свойство электролитов. Вне зависимости от химического характера образуемых после диссоциации ионов, электролиты подразделяются на три большие классы:
1.Кислоты. В результате распада образуются анионы кислотного остатка и катионы водорода. Кислоты многоосновные могут преобразовываться по первой степени:
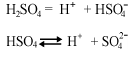
2. Основания. Электролиты, дисоциирующие на анионы гидроксогрупп и катионы металла.
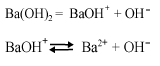
3. Соли. Электролиты диссоциируют на анионы кислотного остатка и катионы металлов. Процесс происходит в одну ступень.
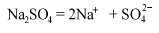
Химические свойства электролитов описываются при помощи химических уравнений и определяются свойствами образованных ионов. Для удаления вредных химических соединений, выделяемых в воздух во время диссоциации, используются химически нейтральные пластиковые воздуховоды.
Перспективы развития теории диссоциацииНа современном этапе развития теории ученые предпринимают попытки описать динамические и термодинамические свойства электролитов учитывая концепцию ионно-молекулярной структуры. Классическая теория считается примитивной, в ней ионы представляются как заряженные жесткие сферы. Главный недостаток традиционной теории – невозможность объяснить локальное снижение диэлектрической проницательности в первом приближении. Ряд растворителей поддается описанию физических свойств ступенчатой зависимостью, но протонные водные растворители имеют намного сложнее процессы релаксации.
Непримитивные модели, рассматривающие ионы в одинаковом масштабе, делятся на две группы:
- Первая. Жидкие фазы рассматриваются как максимально разупорядочные кристаллы, размеры не более пяти молекулярных диаметров.
- Вторая. Жидкости описываются как сильно неидеальные газы. Молекулы растворителя являются точными или обыкновенными диполями.
Зависимость диэлектрической проницаемости от расстояния между ионами

Неравновесные явления в растворах электролитов
Неравновесный распад объясняется несколькими физическими процессами.
- Миграцией и диффузией ионов. Обуславливается сравнительно большим количеством ионных перескоков за единицу времени в сравнении с иными направлениями.
Контакт двух растворов с различными показателями концентрации
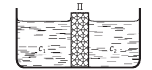
- Эквивалентной и удельной электропроводностью. Электропроводность обеспечивается миграцией ионов, замеры выполняются таким способом, чтобы исключалось влияние градиента химического потенциала.
Принципиальная схема моста переменного тока во время измерения электропроводности
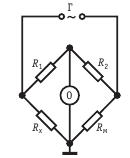
- Числом переноса. Определяется суммой электрической проворности аниона и катиона. Доля тока называется электрическим числом переноса.
Схема определения числа переноса

Перемещение ионов в среде электрического поля по статистике является усредненным процессом, ионы делают беспорядочные перескоки, а элегическое поле оказывает только определенное влияние, точно рассчитать силу и вероятность влияния невозможно. В связи с этим, аналогия диссоциации с обыкновенным поступательным движением твердых тел весьма приближенная, но она позволяет принимать правильные качественные выводы.
plast-product.ru
Электрохимия: свойства электролитов и электролиз
Электрохимия — это наука о электрических явлениях, которые сопровождают химические процессы. Поскольку все химические частицы (атомы, молекулы, атомные и молекулярные ионы) состоят из положительно заряженных ядер и электронов, то любое химическое превращение (разрыв одних химических связей в молекулах и образование других) так или иначе связано с перегруппировкой атомов, их валентных электронов. В окислительно-восстановительных реакциях электроны от одних атомов переходят к другим. Как целостная научная дисциплина электрохимия изучается в вузах. Здесь же мы кратко остановимся на двух разделах, в которых изучаются свойства электролитов и электролиз.
Свойства электролитов
Термин «электролит» (от греческого «разлагаемый электричеством») впервые предложил английский химик и физик М.Фарадей (1791-1867). В 30-х гг. прошлого века М.Фарадей высказал идею, что электролиты под действием электрического поля диссоциируют на «ионы» (в буквальном смысле перевод этого слова означает «скитальцы», «странники»). Именно при приложении разности потенциалов к электродам, опущенным в раствор электролита, через раствор начинает идти электрический ток. Но растворы электролитов обладают и другими удивительными свойствами. Известно, что растворы имеют более низкую температуру замерзания и более высокую температуру кипения, чем чистый растворитель. Это изменение в температурах замерзания и кипения не зависит от природы растворенного вещества, а определяется только его концентрацией и природой растворителя. Растворы электролитов ведут себя так, как будто число частиц в растворе гораздо больше, чем то, которое отвечает их концентрации. Тепловой эффект в реакциях нейтрализации (независимо от того, какая кислота реагирует с какой щелочью) примерно одинаков. При температуре 20o C он равен — 57.3 кДж/моль.
Для объяснения этих особых свойств растворов электролитов в 1887 г. шведский химик С.Аррениус (1859-1927) предложил Теорию электролитической диссоциации. Ее основные положения.
1. При растворении в воде молекулы кислот, оснований и солей диссоциируют на ионы:
Причину, почему молекулы электролитов распадаются на ионы, С.Арренус не рассматривал.
2. Диссоциация молекул на ионы у слабых электролитов является неполной. Поэтому следует ввести понятие «степень диссоциации» (a) и определять его, как долю молекул, распавшихся на ионы. Тогда 1-a будет характеризовать долю молекул нераспавшихся на ионы. Рассмотрим диссоциацию уксусной кислоты:
На основании Закона действующих масс
Здесь скобки [ ] выражают мольную
концентрацию (с) вещества в
растворе. V = 1/c — объем раствора
концентрации c, в котором содержится
1 моль электролита — его называют
«разведением», а выражение (4.5.1)
называют Законом разведения
Оствальда. В теории Аррениуса K
является постоянной величиной для
данного электролита. У сильных
электролитов
У слабых
электролитов
На основе теории электролитической диссоциации все свойства растворов электролитов нашли естественное объяснение и была создана первая теория кислот и оснований. Кислоты — это соединения, молекулы которых диссоциируют на катионы водорода и анионы кислотного остатка. Основания — это соединения, молекулы которых диссоциируют на катионы металла и анионы гидроксила.
Логарифм концентрации ионов водорода, взятый с обратным знаком, называется pH раствора:
pH = — lg [H+].
Сила электролита определяется степенью его диссоциации на ионы:
если в 0.1 М растворе a > 30 %, то электролит называют сильным;
если в 0.1 М растворе a < 3 %, то электролит называют слабым;
если в 0.1 М растворе 3 % < a < 30 %, то это электролит средней силы.
К сильным электролитам относятся почти все соли, ряд неорганических кислот (HCl, HBr, HI, HNO3, h3SO4, HClO4), гидроксиды щелочных и щелочноземельных металлов (щелочи). К слабым электролитам относится соль Fe(SCN)3 — роданистое железо, большинство кислот и оснований [h3S, h3CO3, Al(OH)3, Nh5OH]. К электролитам средней силы относятся HF, h4PO4, h3SO3.
Химические реакции между электролитами имеют ряд особенностей. При сливании растворов хлорида натрия и нитрата калия можно ожидать, что образуются две новые соли — хлорид калия и нитрат натрия:
NaCl + KNO3 = KCl + NaNO3.
Если записать эту реакцию в ионной форме:
Na+ + Cl- + K+ + NO3- = K+ + Cl- + Na+ + NO3-,
то легко видеть, что как были ионы в растворах до их смешения, так они же и остались после сливания растворов солей, и никакая химическая реакция между ионами при этом не идет. Правда при выпаривании этого раствора мы получим кристаллы всех четырех солей. Реакция между электролитами идет в том случае, если какой-либо из продуктов реакции:
1) выпадает в осадок:
2) выделяется в виде газа:
3) представляет собой слабый электролит:
Теория электролитической диссоциации позоляет объяснить, почему растворы солей могут давать нейтральную, кислую или щелочную среду.
Если соль образована сильным основанием и сильной кислотой, то ее pH = 7.
Если соль образована сильным основанием и слабой кислотой, то ее pH > 7 — среда щелочная:
Если соль образована слабым основанием и сильной кислотой, то ее pH < 7 — среда кислая:
Nh5Cl + h3O = Nh5OH + Cl- + H+, Nh5+ + h3O = Nh5OH + H+.
Если соль образована слабым основанием и слабой кислотой, то очень часто не только в растворе, но и на воздухе (в котором всегда присутствуют пары воды) она разрушается:
Современные теории электролитической диссоциации
В противоположность Арренусу, который рассматривал растворы как механическую смесь ионов электролита с молекулами воды, Д.И.Менделеев говорил о химическом взаимодействии между растворенным веществом и растворителем, за счет которого образуются «непрочные соединения в состоянии диссоциации». Теория электролитической диссоциации С.Аррениуса имела два существенных недостатка. Во-первых, она не указывала на причины распада нейтральных молекул на ионы, т.е. игнорировала взаимодействие ионов с молекулами воды, которые являются полярными (диполями). Во-вторых, не учитывала ион-ионное взаимодействие в растворе.
Сейчас установлено, что многие соли имеют ионную кристаллическую решетку и в твердом состоянии состоят из готовых ионов, например кристалл NaCl построен из ионов Na+ и Cl-. При растворении хлористого натрия происходит не диссоциация нейтральных молекул (как мы обычно пишем в школьных учебниках), а разрушение кристаллической решетки. Затраты энергии на разрушение кристаллической решетки компенсируются энергией сольватации (гидратации) ионов молекулами растворителя (воды). При растворении в воде газообразного хлористого водорода происходит химическое взаимодействие молекул HCl с молекулами воды:
При этом протон переходит от молекулы HCl к молекуле воды с образованием иона гидроксония. Далее образовавшиеся ионы за счет ион-дипольного взаимодействия с молекулами воды образуют гидратированные ионы h4O+ и Cl-, при этом выделяется энергия гидратации и компенсируется энергия 428 кДж/моль — энергия связи атомов водорода и хлора в молекуле HCl.
Ион-ионное взаимодействие в растворах электролитов (прежде всего сильных электролитов) позволяет создать количественную теорию электропроводности, рассчитать коэффициенты активности ( их изучение выходит за рамки школьного курса химии).
Электролиз
Электролизом называется процесс разложения расплавов или растворов электролитов под действием постоянного электрического тока. Окислительно-восстановительные реакции, связанные с отдачей или присоединением электронов при электролизе, происходят на электродах. Положительный электрод, к которому подходят анионы, называется анодом, отрицательный электрод, к которому подходят катионы, назывется катодом. Как будут протекать электродные процессы при электролизе зависит, прежде всего, от природы электролита, от того, находится ли электролит в виде расплава или используется его раствор, и от матерала электродов.
Электролиз расплава
Рассматрим электролиз расплава хлористого натрия. При высоких температурах кристаллическая решетка соли разрушается и образуется расплав, в котором ионы могут свободно перемещаться: катионы Na+ будут перемещаться к катоду, а анионы Cl- — к аноду. На катоде (отрицательно заряженном электроде) катионы Na+ присоединяют к себе электроны (восстанавливаются), образуя металлический натрий:
Анод (положительно заряженный электрод) выступает по отношению к анионам хлора как окислитель — отбирает у них электроны:
Суммарное уравнение электролиза:
Электролиз растворов
В растворе, например хлористого натрия, кроме ионов Na+ и Cl- имеются в небольшом количестве и ионы, получемые при диссоциации воды:
Кроме того, в электродном процессе могут участвовать и сами молекулы воды. Так, на отрицательно заряженном электроде (катоде) молекулы воды могут присоединять электроны:
На аноде (положительно заряженном электроде) молекулы воды могут отдавать электроны:
Итак, на катоде при электролизе раствора NaCl могут протекать следующие процессы:
В первую очередь осуществляется тот процесс, который требует минимальной затраты энергии (этому соответствует минимальный отрицательный потенциал E). Поскольку раствор NaCl имеет pH = 7, т.е. [H+] = 1·10-7, то Е для процесса восстановления ионов водорода будет отличаться от Еo (E = -0.413 в). Поэтому на катоде должен протекать процесс:
2H+ + 2e = h3 .
Более точный учет всех обстоятельств электродного процесса заставляет некоторых авторов считать, что при этом протекает процесс:
(Общая химия в формулах, определениях, схемах. Минск, 1996). Эти тонкости не так уж и важны, так как и в том и в другом случае на катоде выделяется водород, и суммарный процесс электролиза будет одним и тем же.
На аноде при электролизе раствора NaCl могут протекать следующие процессы:
В первую очередь осуществляется тот процесс, который требует минимальной затраты энергии. В данном случае на аноде выделяется хлор.
Суммарный процесс электролиза раствора хлористого натрия выглядит так:
2h3O + 2NaCl = h3 + 2NaOH + Cl2 .
Обычно при электролизе растворов руководствуются следующими правилами.
Процессы на катоде
1. В первую очередь восстанавливаются катионы металлов, которые в электрохимическом ряду напряжений стоят правее водорода.
2. Вместо катионов металлов, которые стоят левее водорода (от Li+ до Al3+ включительно), будут восстанавливаться молекулы воды (а в кислой среде — ионы водорода).
3. Металлы, расположенные между алюминием и водородом, будут восстанавливаться одновременно с молекулами воды.
Процессы на аноде
В этом случае появляется еще одна дополнительная особенность: надо учитывать из какого материала сделаны электроды. Различают инертные (нерастворимые) электроды (графит, платина) и активные (растворимые) электроды.
Инертные электроды
1. В первую очередь окисляются простые анионы (Cl-, Br-, I-, S2-).
2. Вместо кислородосодержащих кислотных анионов (CO3-, NO3-, SO42-, PO43-) на аноде окисляются молекулы воды.
3. В щелочных растворах на аноде окисляются ионы гидроксила:
Растворимые электроды
При использовании растворимых анодов (Cu, Zn, Ag, Ni) электроны отдают атомы металлов:
и образующиеся при этом катионы металлов Men+ переходят в раствор.
другие статьи:
- Агрегатные состояние вещества
- Строение атома — развитие моделей
- Квантовая механика и строение атома водорода
- Электронные конфигурации атомов и периодический закон
- Ядра атомов. Радиоактивность и изотопы
- Строение молекул. Типы химической связи
- Квантовая механика молекул и теория химической связи. Метод молекулярных орбиталей. Теория спин-валентности
- Окислительно-восстановительные реакции
- Химическая термодинамика
- Химическая кинетика и катализ
- Химическое равновесие. Обратимые и необратимые реакции
- Электрохимия. Свойства электролитов. Электролиз
www.himikatus.ru
Какие свойства у электролитов 🚩 Естественные науки
Электролитами называются вещества, способные проводить электрический ток за счет собственной диссоциации на ионы. Диссоциация происходит в расплавах и растворах, либо внутри самих электролитов — за счет движения ионов в их кристаллических решетках.
Наиболее яркими примерами электролитов являются растворы солей, оснований и кислот. В некоторых случаях диссоциация происходит в кристаллах — например, в случае диоксида циркония или йодида серебра.
Если распад на ионы происходит в растворе или расплаве, этот процесс называется электролитической диссоциацией. Параллельно с диссоциацией происходит и обратный процесс, когда ионы ассоциируются обратно в молекулы. Если условия среды неизменны, в расплаве или растворе наблюдается равновесие — какая-то часть вещества остается диссоциированной на ионы, а какая-то — ассоциированной в молекулы.
Электролиты принято делить на две группы, в зависимости от их способности диссоциировать. К сильным электролитам относят вещества, у которых степень диссоциации на ионы составляет 100% (то есть равняется единице). Сильными электролитами являются соли, основания и многие кислоты (соляная, бромоводородная, йодоводородная, азотная).
Слабыми электролитами называют вещества, диссоциирующие не полностью. Степень их диссоциации всегда составляет меньше единицы. При этом, чем выше концентрация таких электролитов в растворе, тем меньше степень их диссоциации. К слабым электролитам относится вода, некоторые слабые кислоты и основания.
Между сильными и слабыми электролитами не существует какой-то четкой границы. Так, одно вещество может проявлять свойства сильного электролита в одном растворе и свойства слабого — в другом.
Электролиты обладают рядом уникальных свойств. Если в раствор электролита поместить электроды с разным потенциалом, то через раствор пойдет электрический ток. Общеизвестно, что растворы веществ имеют более высокую температуру кипения и более низкую температуру замерзания, чем сам растворитель. Но растворы электролитов ведут себя несколько иначе — по сравнению с растворами других веществ, они имеют более высокую температуру кипения и более низкую температуру замерзания. Проще говоря, раствор электролита ведет себя так, как будто в нем содержится больше молекул вещества, чем на самом деле.
Благодаря своим особенным свойствам, электролиты находят широкое применение в промышленности. С их помощью выделяют металлы, наносят позолоту, их применяют в источниках тока и при изготовлении конденсаторов.
www.kakprosto.ru
Общая характеристика электролитов
Одни электролиты в растворах полностью распадаются на ионы. Они называются сильными.
Другие электролиты только частично распадаются на ионы, т.е. большая часть их молекул остаётся в растворе в недиссоциированном виде. Такие электролиты называются слабыми.
Данное свойство вещества не абсолютно, и зависит не только от его природы, но и от природы растворителя. Чем больше диэлектрическая постоянная растворителя, тем сильнее его ионизирующая слабость. Так, в водных растворах (ε(Н2О) = 80).LiClиNaClведут себя как сильные электролиты. Но если их растворить в уксусной кислоте (ε = 6) или ацетоне (ε = 21), то они начинают проявлять свойства слабых электролитов.
В водных растворах сильными электролитами являются соли, растворимые основания (образованные, как правило, щелочными и щелочноземельными металлами), некоторые неорганические или минеральные кислоты (HCl, HBr, HI, H2SO4, HNO3 и др.).
В тоже время многие органические кислоты, некоторые неорганические кислоты (HNO2, HF, H2S, H2SiO3, H3PO4 и т.д.), нерастворимые в Н2О основания ведут себя как слабые электролиты.
Вещества, в которых частицы связаны различными видами химической связи, распадаются на ионы сперва по ионным связям
KНSO4K++ НSO4–,
а затем – по наиболее полярным ковалентным связям
НSO4–Н++SO42–.
Гетеролитический разрыв малополярных или неполярных ковалентных связей в процессах диссоциации таких веществ, как правило, не происходит.
Количественно процесс распада молекул электролита на ионы оценивается с помощьюстепени электролитической диссоциации α.
Степень диссоциации – это отношение числа распавшихся на ионы молекул вещества к общему числу его молекул в растворе (распавшихся и нераспавшихся):
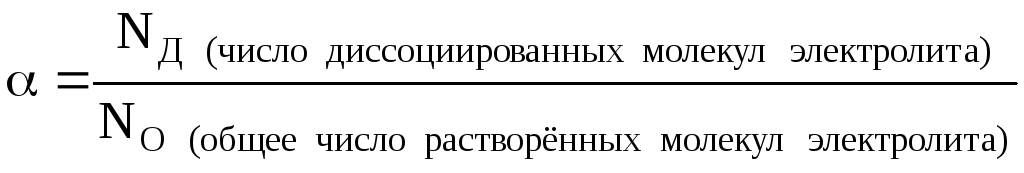
NО=NД+NH (число непродиссоциированных молекул электролита в растворе)
Так как число частиц вещества (N) и их химическое количество (n) связаны между собой соотношениемN=n∙NA, то степень диссоциации можно ещё рассчитать и другим способом:

Для сильных электролитов α близка к единице. Практически все их молекулы в растворе находятся в диссоциированном виде, процесс ассоциации протекает крайне незначительно.
В связи с этим в уравнениях диссоциации
данных веществ вместо знака обратимости
« »
ставят знак «»
(т.е. используют стрелку только в
направлении распада), например:
»
ставят знак «»
(т.е. используют стрелку только в
направлении распада), например:
HClH+ + Cl–
KOНK+ + OH–
K2SO42K++SO42–
Слабые электролиты
Для слабых электролитов степень диссоциации очень мала (α<<1). Так, для воды при 20оС α ≈ 1 ∙ 10–9. Это означает, что только одна молекула из миллиарда распадается на ионы. В растворах слабых электролитов, наряду с диссоциацией, непрерывно протекает и обратный процесс – ассоциация. С течением времени между ними устанавливается химическое равновесие, которое может быть смещено в ту или иную сторону.
В результате диссоциации электролита происходит увеличение числа его частиц в растворе. Это позволяет экспериментально определить степень диссоциации по измерению тех свойств раствора, которые зависят только от количества содержащихся в нём частиц растворённого вещества, но не от их природы, размеров, массы. К таким свойствам относятся температура кипения и замерзания раствора, осмотическое давление и некоторые другие.
Для растворов слабых электролитов значения α, определённые различными способами, как правило, совпадают и всегда значительно меньше единицы, что хорошо согласуется с теорией Аррениуса.
Как показали экспериментальные исследования, степень диссоциации слабых электролитов зависит от температуры раствора и его концентрации.
Таблица 8.Изменение степени диссоциации уксусной кислоты в зависимости от ее молярной концентрации в растворе
Ссн3соон, моль/дм3 | 0,2 | 0,1 | 0,05 | 0,01 | 0,005 | 0,001 |
α, % | 0,95 | 1,4 | 1,9 | 4,2 | 6,0 | 12,4 |
При повышении температуры раствора степень диссоциации увеличивается, т.к. при этом лучше обеспечивается поляризация и облегчается последующий разрыв ковалентной полярной связи в молекулах электролита. При понижении температуры α уменьшается.
Возрастает α и при уменьшении концентрации растворов, т.е. при их разбавлении (табл. 8), т.к. при этом толщина разделяющей ионы водной прослойки становится больше, поэтому электростатическое взаимодействие между ними, приводящее к ассоциации ионов в молекулы, наблюдается реже.
При бесконечно большом разведении степень диссоциации электролита стремится к своему максимальному значению, т.е. к единице (рис. 30).
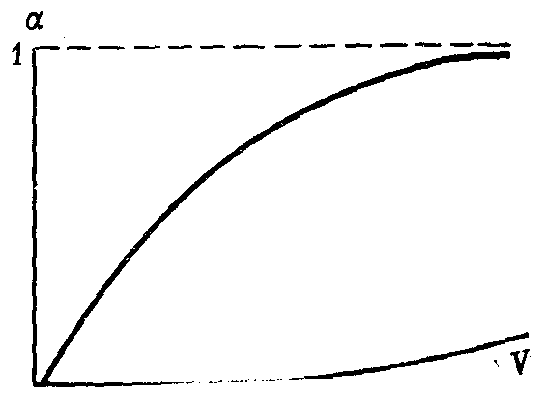
Рис. 30. Изменение степени электролитической диссоциации α с разбавлением V(схема)
Таким образом, для слабых электролитов α не является постоянной величиной. Поэтому их способность к распаду на ионы удобнее сравнивать по константе диссоциации, которая представляет собой константу равновесия обратимой реакции электролитического разложения молекул электролита.
Например:
HNO2 H+ +
NO2–
H+ +
NO2–
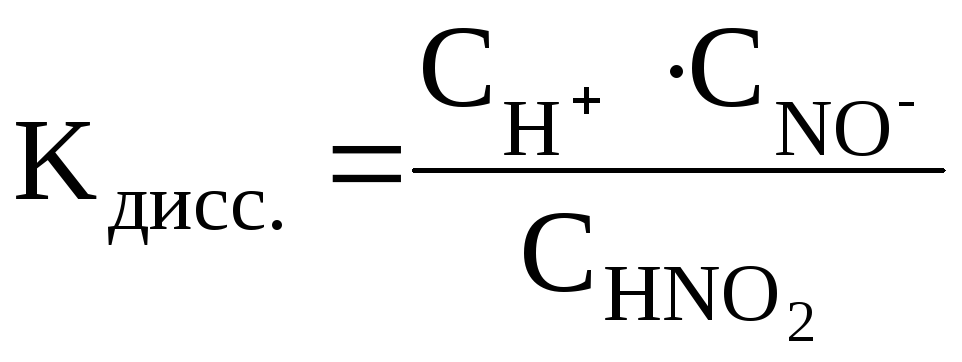
где СН+, СNO2–, CHNO2 – равновесные молярные концентрации ионов H+, NO2– и непродиссоциированных молекул HNO2.
Константа диссоциации слабых электролитов не зависит от их концентрации в растворе даже при значительном разбавлениии и при данной температуре остается постоянной величиной (табл. 9). С увеличением температуры раствора константа диссоциации слабых электролитов во многих случаях изменяется сложным образом (рис. 31).
Таблица 9.Зависимость величиныKдисс.уксусной кислоты в растворе от ее молярной концентрации при Т = 298K
Ссн3соон, моль/дм3 | 0,1 | 0,05 | 0,0012 | 0,0003 |
Kдисс. | 1,845·10–5 | 1,845·10–5 | 1,850·10–5 | 1,855·10–5 |
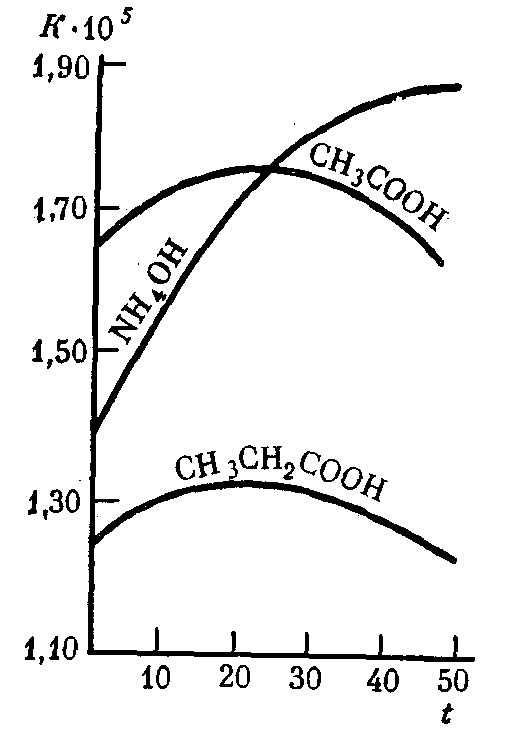
Рис. 31. Зависимость константы диссоциации Kнекоторых слабых электролитов в водных растворах от температурыt(°С)
Чем меньше Kдисс., тем более слабым является данный электролит. Например, уксусная кислота (Kдисс.= 1,85·10–5) почти в 220 000 раз сильнее циановодороднойHCN(Kдисс.= 4,8·10–10) и примерно в 10 раз слабее муравьиной кислоты (Kдисс.= 1,8·10–4).
Существуют слабые электролиты (многоосновные кислоты, многокислотные основания) процесс распада которых на ионы протекает ступенчато, т.е. в несколько стадий. При этом каждая стадия характеризуется своей величиной константы диссоциации.
Например, в 2 стадии осуществляется диссоциация сероводородной кислоты:
1) H2S  H+ +
HS–
H+ +
HS–

2) HS– H+ +
S2–
H+ +
S2–
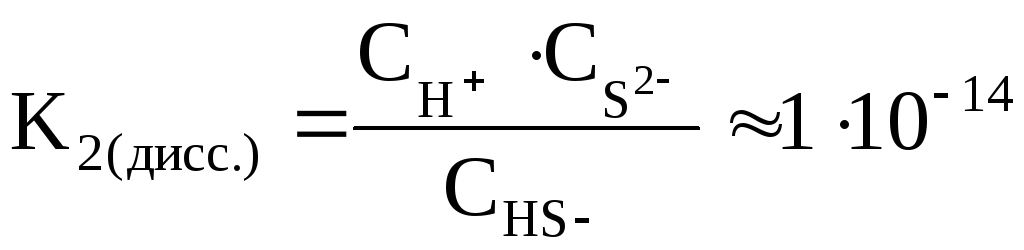
Суммарное уравнение реакции диссоциации H2Sвыглядит следующим образом:
H2S 2H++S2–
2H++S2–
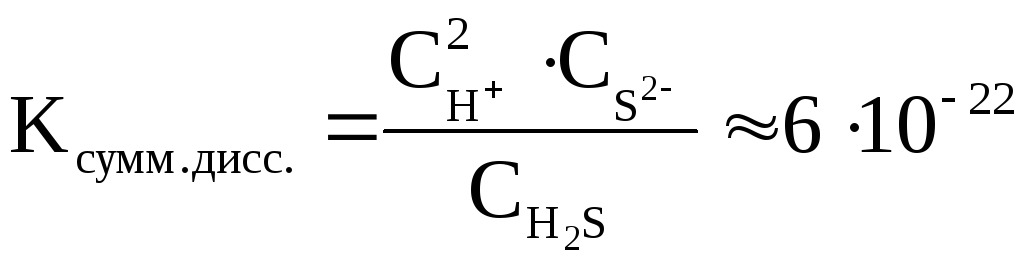
Величина константы диссоциации для суммарного уравнения и значения констант диссоциации отдельных стадий связаны между собой соотношением:
Kсумм.=K1·K2·K3…
При ступенчатой диссоциации распад слабого электролита на каждой последующей стадии происходит в меньшей степени, чем на предыдущей, т.е. K1>K2>K3 и т.д. Это объясняется тем, что отрыв иона происходит уже не от нейтральной молекулы (как на первой стадии), а от частицы со все более возрастающим зарядом и требует поэтому больших затрат энергии.
Часто для оценки силы слабого электролита вместо величины константы диссоциации используют ее десятичный логарифм, взятый с обратным знаком (pK)
pK= -lgKдисс.
В этом случае чем больше величина pK, тем более слабым является электролит.
Степень диссоциации слабого электролита уменьшается, если внести в его раствор даже в небольшом количестве сильный электролит, содержащий в своем составе одноименные ионы.
Например, если в раствор СН3СООН добавить ацетат натрияCH3COONa, то за счет диссоциации соли концентрация ацетат-ионов СН3СОО–резко увеличится. В соответствии с принципом Ле Шателье это приведет к смещению равновесия реакции
СН3СООН СН3СОО–+ Н+
СН3СОО–+ Н+
в левую сторону. Аналогичный эффект наблюдается, если в раствор СН3СООН добавить небольшое количество сильной кислоты.
Таким образом, диссоциация слабой кислоты подавляется в присутствии собственной соли или сильной кислоты. То же можно сказать и о слабом основании, диссоциация которого будет подавляться в сильнощелочной среде или в присутствии соли, содержащей одноименный катион.
При добавлении большого количества соответствующего сильного электролита слабый электролит практически не будет диссоциировать.
Существует количественная связь между степенью диссоциации слабого электролита и его концентрацией в растворе, называемая законом разбавления Оствальда.
Для бинарного электролита, молекулы которого распадаются только на 2 иона, можно показать, что

где С – исходная молярная концентрация электролита в растворе; α – степень диссоциации электролита; С ∙ α – концентрация распавшихся молекул электролита и образовавшихся при этом ионов.
В ильгельм
Фридрих Оствальд (1853 – 1932).
ильгельм
Фридрих Оствальд (1853 – 1932).
Родился в Риге. Учился в Дерптском университете, здесь же в 1878 г. получил степень доктора. С 1882 г. был профессором Рижского университета. С 1887 г. перешел на кафедру физической химии в Лейпциге, где работал до 1928 г.
В. Оствальд изучал электрическую проводимость органических кислот. Познакомившись с работами С. Аррениуса, он стал его сторонником. В. Оствальд внес существенный вклад в теорию электролитической диссоциации. В частности, он предложил свой известный закон разбавления, показал, что аналитические реакции в растворах следует рассматривать как ионные, и объяснил цвет растворов многих веществ специфической окраской ионов. В. Освальду принадлежат также исследования по катализу.
Так как степень диссоциации слабых
электролитов мала, то можно пренебречь
этой величиной в знаменателе. Тогда K=C·α2,
откуда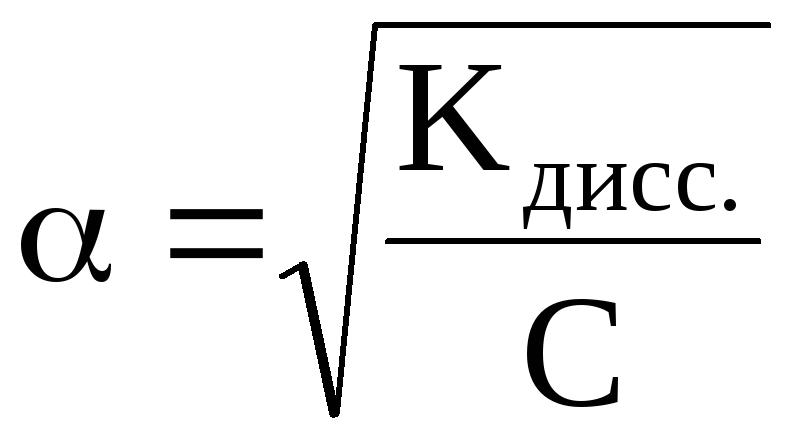 или учитывая, что
или учитывая, что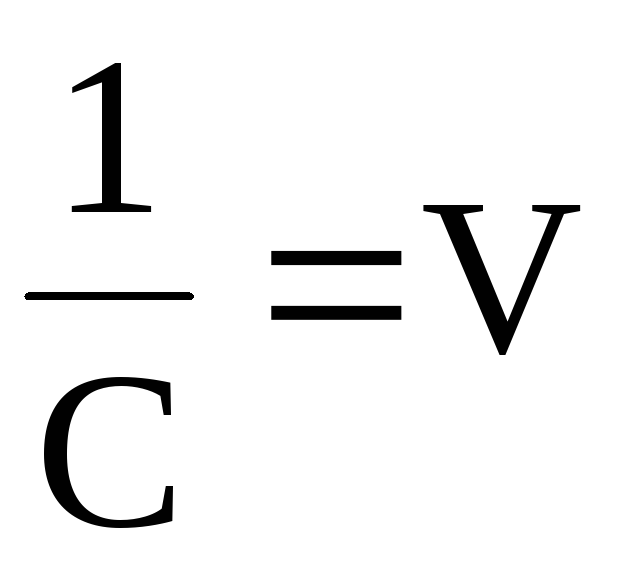 (разведение
или разбавление раствора), то
(разведение
или разбавление раствора), то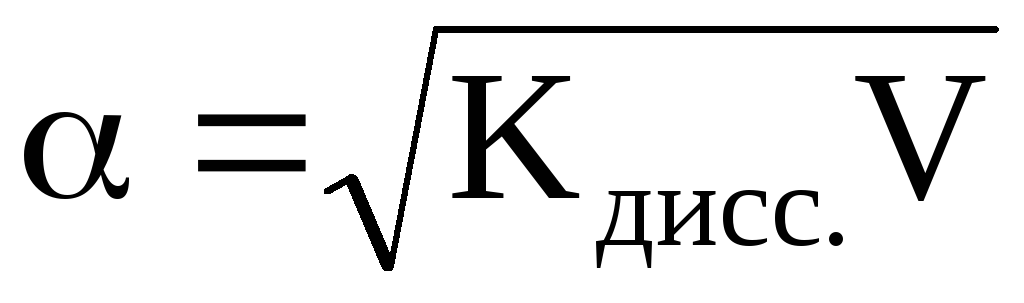 .
.
Для электролитов, молекулы или формульные единицы которых распадаются на большее число ионов, закон разбавления Оствальда носит более сложный характер.
studfile.net
Общая характеристика электролитов
Одни электролиты в растворах полностью распадаются на ионы. Они называются сильными.
Другие электролиты только частично распадаются на ионы, т.е. большая часть их молекул остаётся в растворе в недиссоциированном виде. Такие электролиты называются слабыми.
Данное свойство вещества не абсолютно и зависит не только от его природы, но и от природы растворителя. Чем больше диэлектрическая постоянная растворителя, тем сильнее его ионизирующая слабость. Так в водных растворах (ε(Н2О) = 80).LiClиNaClведут себя как сильные электролиты. Но если их растворить в уксусной кислоте (ε = 6) или ацетоне (ε = 21), то они начинают проявлять свойства слабых электролитов.
В водных растворах сильными электролитами являются соли, растворимые основания (образованные, как правило, щелочными и щелочноземельными металлами), некоторые неорганические или минеральные кислоты (HCl, HBr, HI, H2SO4, HNO3 и др.).
В тоже время многие органические кислоты, некоторые неорганические кислоты (HNO2, HF, H2S, H2SiO3, H3PO4 и т.д.), нерастворимые в Н2О основания ведут себя как слабые электролиты.
Вещества, в которых частицы связаны различными видами химической связи, распадаются на ионы сперва по ионным связям
KНSO4®K++ НSO4–,
а затем – по наиболее полярным ковалентным связям
НSO4–®Н++SO42–.
Гетеролитический разрыв малополярных или неполярных ковалентных связей в процессах диссоциации таких веществ, как правило, не происходит.
Количественно процесс распада молекул электролита на ионы оценивается с помощьюстепени электролитической диссоциации α.
Степень диссоциации – это отношение числа распавшихся на ионы молекул вещества к общему числу его молекул в растворе (распавшихся и нераспавшихся):
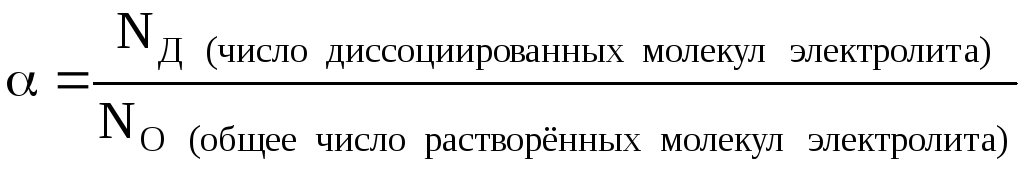
NО=NД+NH (число непродиссоциированных молекул электролита в растворе)
Так как число частиц вещества (N) и их химическое количество (n) связаны между собой соотношениемN=n∙NA, то степень диссоциации можно ещё рассчитать и другим способом:

Для сильных электролитов α близка к единице. Практически все их молекулы в растворе находятся в диссоциированном виде, процесс ассоциации протекает крайне незначительно.
В связи с этим
в уравнениях диссоциации данных веществ
вместо знака обратимости « »
ставят знак «»
(т.е. используют стрелку только в
направлении распада), например:
»
ставят знак «»
(т.е. используют стрелку только в
направлении распада), например:
HClH++Cl–
KOН®K++OH–
K2SO4®2K++SO42–
Слабые электролиты
Для слабых электролитов степень диссоциации очень мала (α<<1). Так для воды при 20оС α ≈ 1 ∙ 10-9. Это означает, что только одна молекула из миллиарда распадается на ионы. В растворах слабых электролитов наряду с диссоциацией непрерывно протекает и обратный процесс – ассоциация. С течением времени между ними устанавливается химическое равновесие, которое может быть смещено в ту или иную сторону.
В результате диссоциации электролита происходит увеличение числа его частиц в растворе. Это позволяет экспериментально определить степень диссоциации по измерению тех свойств раствора, которые зависят только от количества содержащихся в нём частиц растворённого вещества, но не от их природы, размеров, массы. К таким свойствам относятся температура кипения и замерзания раствора, осмотическое давление и некоторые другие.
Для растворов слабых электролитов значения α, определённые различными способами, как правило, совпадают и всегда значительно меньше единицы, что хорошо согласуется с теорией Аррениуса.
Как показали экспериментальные исследования, степень диссоциации слабых электролитов зависит от температуры раствора и его концентрации.
Таблица 8. Изменение степени диссоциации уксусной кислоты в зависимости от ее молярной концентрации в растворе
Ссн3соон, моль/дм3 | 0,2 | 0,1 | 0,05 | 0,01 | 0,005 | 0,001 |
α, % | 0,95 | 1,4 | 1,9 | 4,2 | 6,0 | 12,4 |
При повышении температуры раствора степень диссоциации увеличивается, т.к. при этом лучше обеспечивается поляризация и облегчается последующий разрыв ковалентной полярной связи в молекулах электролита. При понижении температуры – α уменьшается.
Возрастает α и при уменьшении концентрации растворов, т.е. при их разбавлении (табл. 8), т.к. при этом толщина разделяющей ионы водной прослойки становится больше, поэтому электростатическое взаимодействие между ними, приводящее к ассоциации ионов в молекулы наблюдается реже.
При бесконечно большом разведении степень диссоциации электролита стремится к своему максимальному значению, т.е. к единице (рис. 30).

Рис. 30. Изменение степени электролитической диссоциации α с разбавлением V(схема)
Таким образом, для слабых электролитов α не является постоянной величиной. Поэтому их способность к распаду на ионы удобнее сравнивать по константе диссоциации, которая представляет собой константу равновесия обратимой реакции электролитического разложения молекул электролита.
Например:
HNO2 H+ +
NO2–
H+ +
NO2–

где СН+, СNO2–, CHNO2 – равновесные молярные концентрации ионов H+, NO2– и непродиссоциированных молекул HNO2.
Константа диссоциации слабых электролитов не зависит от их концентрации в растворе даже при значительном разбавлениии и при данной температуре остается постоянной величиной (табл. 9). С увеличением температуры раствора константа диссоциации слабых электролитов во многих случаях изменяется сложным образом (рис. 31).
Таблица 9. Зависимость величины Kдисс.уксусной кислоты в растворе от ее молярной концентрации при Т = 298K
Ссн3соон, моль/дм3 | 0,1 | 0,05 | 0,0012 | 0,0003 |
Kдисс. | 1,845·10–5 | 1,845·10–5 | 1,850·10–5 | 1,855·10–5 |
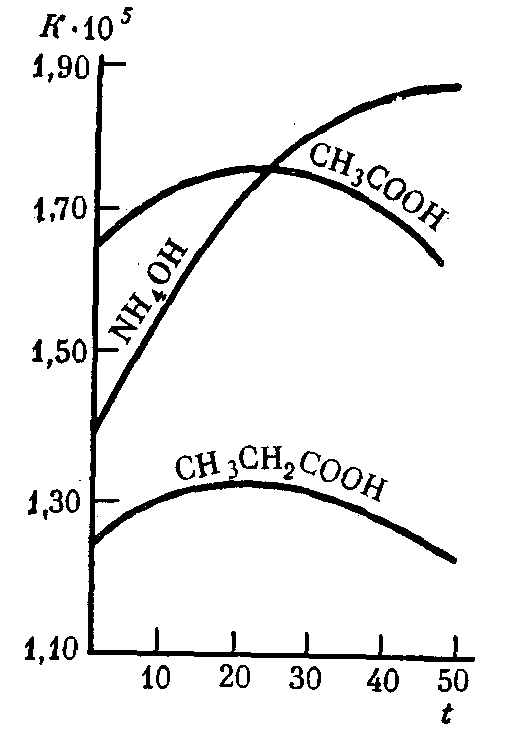
Рис. 31. Зависимость константы диссоциации K некоторых слабых электролитов в водных растворах от температурыt (°С)
Чем меньше Kдисс., тем более слабым является данный электролит. Например, уксусная кислота (Kдисс.= 1,85·10–5) почти в 220 000 раз сильнее циановодороднойHCN(Kдисс.= 4,8·10–10) и примерно в 10 раз слабее муравьиной кислоты (Kдисс.= 1,8·10–4).
Существуют слабые электролиты (многоосновные кислоты, многокислотные основания) процесс распада которых на ионы протекает ступенчато, т.е. в несколько стадий. При этом каждая стадия характеризуется своей величиной константы диссоциации.
Например, в 2 стадии осуществляется диссоциация сероводородной кислоты:
1) H2S 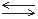 H+ +
HS–
H+ +
HS–
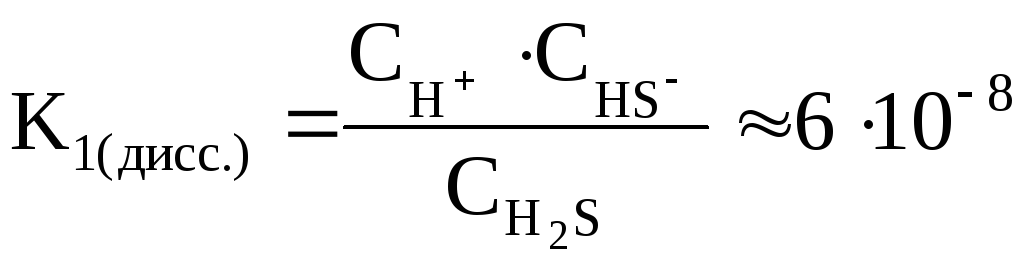
2) HS– H+ +
S2–
H+ +
S2–
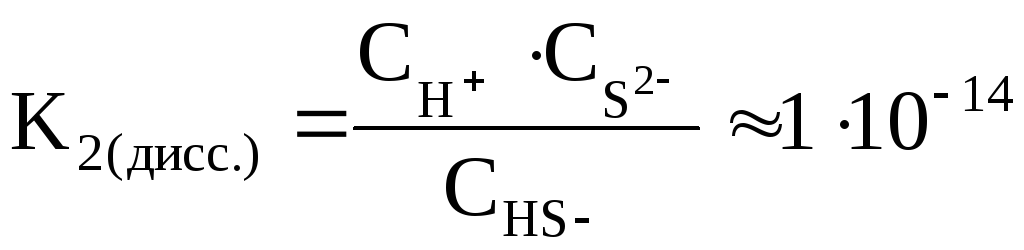
Суммарное уравнение реакции диссоциации H2Sвыглядит следующим образом:
H2S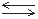 2H++S2–
2H++S2–

Величина константы диссоциации для суммарного уравнения и значения констант диссоциации отдельных стадий связаны между собой соотношением:
Kсумм.=K1·K2·K3…
При ступенчатой диссоциации распад слабого электролита на каждой последующей стадии происходит в меньшей степени, чем на предыдущей, т.е. K1 > K2 > K3 и т.д. Это объясняется тем, что отрыв иона происходит уже не от нейтральной молекулы (как на первой стадии), а от частицы с все более возрастающим зарядом и требует поэтому больших затрат энергии.
Часто для оценки силы слабого электролита вместо величины константы диссоциации используют ее десятичный логарифм, взятый с обратным знаком (pK)
pK= -lgKдисс.
В этом случае чем больше величина pK, тем более слабым является электролит.
Степень диссоциации слабого электролита уменьшается если внести в его раствор даже в небольшом количестве сильный электролит, содержащий в своем составе одноименные ионы.
Например, если в раствор СН3СООН добавить ацетат натрияCH3COONa, то за счет диссоциации соли концентрация ацетат-ионов СН3СОО–резко увеличится. В соответствии с принципом Ле Шателье это приведет к смещению равновесия реакции
СН3СООН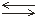 СН3СОО–+ Н+
СН3СОО–+ Н+
в левую сторону. Аналогичный эффект наблюдается если в раствор СН3СООН добавить небольшое количество сильной кислоты.
Таким образом, диссоциация слабой кислоты подавляется в присутствии собственной соли или сильной кислоты. То же можно сказать и о слабом основании, диссоциация которого будет подавляться в сильнощелочной среде или в присутствии соли, содержащей одноименный катион.
При добавлении большого количества соответствующего сильного электролита слабый электролит практически не будет диссоциировать.
Существует количественная связь между степенью диссоциации слабого электролита и его концентрацией в растворе, называемая законом разбавления Оствальда.
Для бинарного электролита, молекулы которого распадаются только на 2 иона, можно показать, что
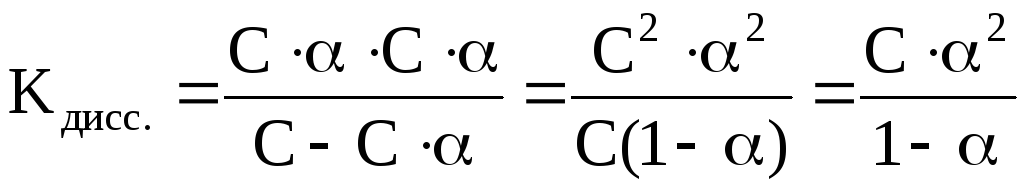
где С – исходная молярная концентрация электролита в растворе; α – степень диссоциации электролита; С ∙ α – концентрация распавшихся молекул электролита и образовавшихся при этом ионов.
В ильгельм
Фридрих Оствальд (1853 – 1932)
ильгельм
Фридрих Оствальд (1853 – 1932)
Родился в Риге. Учился в Дерптском университете, здесь же в 1878 г. получил степень доктора. С 1882 г. был профессором Рижского университета. С 1887 г. перешел на кафедру физической химии в Лейпциге, где работал до 1928 г.
В. Оствальд изучал электрическую проводимость органических кислот. Познакомившись с работами С. Аррениуса он стал его сторонником. В. Оствальд внес существенный вклад в теорию электролитической диссоциации. В частности, он предложил свой известный закон разбавления, показал, что аналитические реакции в растворах следует рассматривать как ионные, и объяснил цвет растворов многих веществ специфической окраской ионов. В. Освальду принадлежат также исследования по катализу.
Так как степень
диссоциации слабых электролитов мала,
то можно пренебречь этой величиной в
знаменателе. Тогда K=C·α2,
откуда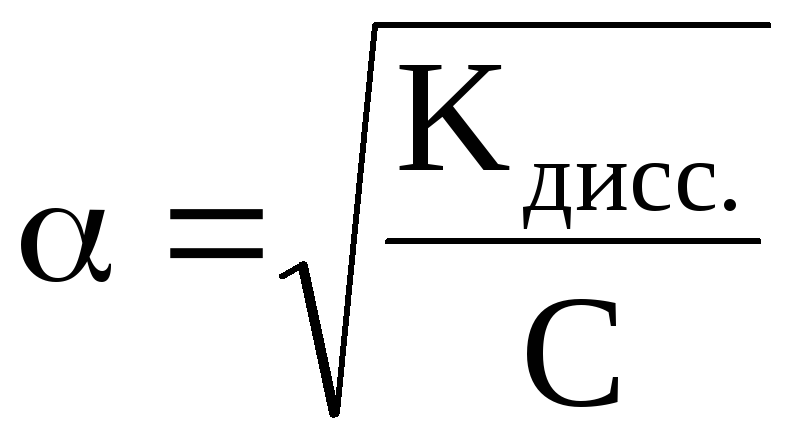 или учитывая, что
или учитывая, что (разведение
или разбавление раствора), то
(разведение
или разбавление раствора), то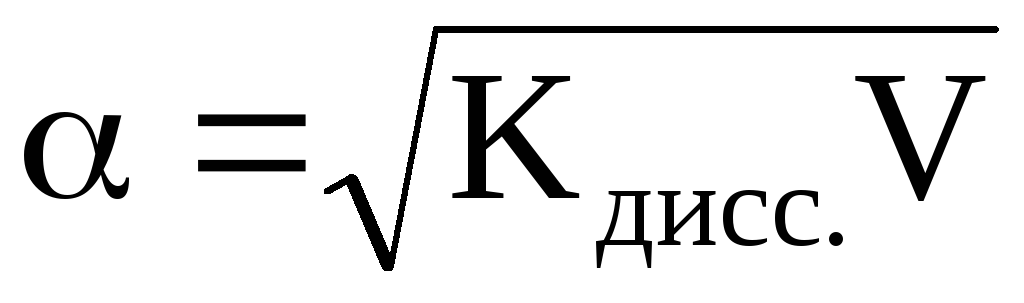 .
.
Для электролитов, молекулы или формульные единицы которых распадаются на большее число ионов, закон разбавления Оствальда носит более сложный характер.
studfile.net
