Обратимые реакции — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 декабря 2014; проверки требуют 15 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 декабря 2014; проверки требуют 15 правок.Обрати́мые реа́кции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:
- 3H2 + N2 ⇌ 2NH3
- N2O4 ⇌ 2NO2
При повышении давления химическое равновесие смещается в сторону реакции, сопровождающейся уменьшением общего количества газов. При понижении — наоборот.
При увеличении концентраций исходных веществ равновесие всегда смещается вправо, а при их уменьшении — влево.
При увеличении концентраций конечных веществ равновесие всегда смещается влево, а при уменьшении — вправо.
При повышении температуры равновесие смещается в сторону эндотермической реакции, а при понижении температуры — в сторону экзотермической реакции.
Интеркаляция — обратимое включение (вставка) молекулы или группы между другими молекулами или группами.
Интеркаляция в литий — ионном акккумуляторе[править | править код]
Переносчиком заряда в литий-ионном аккумуляторе является положительно заряженный ион лития, который внедряется (интеркалируется) в кристаллическую решетку других материалов (например, в графит, оксиды и соли металлов) с образованием химической связи (например: в графит с образованием LiC6, оксиды (LiMO2) и соли (LiMRON) металла).
Интеркаляция в алюминий — ионном аккумуляторе[править | править код]
Алюминий-ионный аккумулятор состоит из металлического алюминиевого анода, катода из графита в виде пены и жидкого ионного невоспламеняющегося электролита. Батарея работает по принципу электрохимического осаждения: происходит растворение алюминия на аноде, далее в среде жидкого электролита анионы хлоралюмината интеркалируют в графит.
1. Химия (10 класс). Шиманович, Василевская, Красицкий, Сечко, Хвалюк
Механизмы ядерных реакций. Прямые реакции Наряду с механизмом ядерной реакции, идущей через
составное ядро, когда в процесс взаимодействия вовлекается все ядро, возможен и
другой механизм, когда налетающая частица взаимодействует лишь с небольшим
числом нуклонов ядра. Это так называемые прямые ядерные реакции. Время их
протекания существенно меньше времени протекания реакций, идущих через составное
ядро и сравнимо с характерным ядерным временем (временем пролета нуклона через
ядро). Для нуклона с энергией десятки МэВ τя ~ 10-22-10-23 с.
где где Δl — переданный ядру момент, |p| = |i ||f | (i,f -импульсы, налетающей и вылетающей частиц), Ji и Jf — спины ядер в начальном и конечном состояниях, si и sf — спины налетающей и вылетающей частиц, Pi и Pf — четности ядер в начальном и конечном состояниях.
Подробнее смотрите
|
3.2. Связь энергии активации с тепловым эффектом реакции
Пусть протекает обратимая реакция

 где
где  и
и — константы скорости прямой и обратной
стадий.
— константы скорости прямой и обратной
стадий.
Тогда для прямой реакции

для обратной реакции
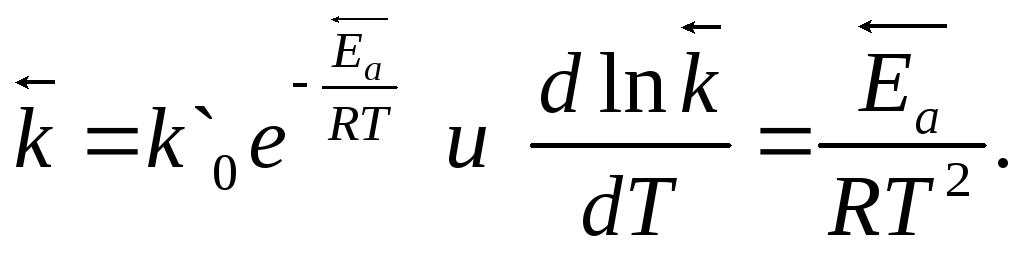
Вычитая из первого уравнения второе, получим
 (3.9)
(3.9)
но
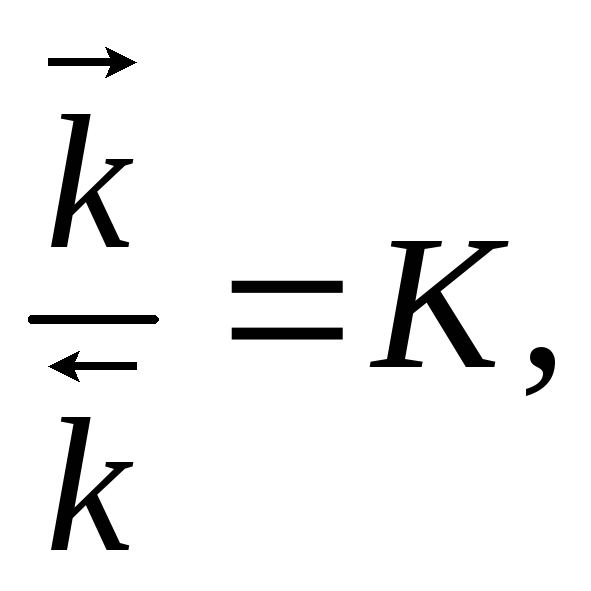
где К – константа равновесия,
тогда
 (3.10)
(3.10)
Вспомнив, что
 (3.11)
(3.11)
где ΔH – тепловой эффект реакции, и сравнив (3.10) и (3.11),
получим
 (3.12)
(3.12)Из уравнения (3.12) следует, что разность между энергиями активации прямой и обратной реакции равна её тепловому эффекту.
Величину
теплового эффекта реакции можно
рассчитать из термодинамических данных.
Поэтому, определив экспериментально,
например,  ,
мы тем самым по (3.12) можем определить и
,
мы тем самым по (3.12) можем определить и .
.
Анализируя (3.12), можно сделать ещё один вывод.
Пусть прямая реакция эндотермична, т.е. ΔH > 0.
Тогда 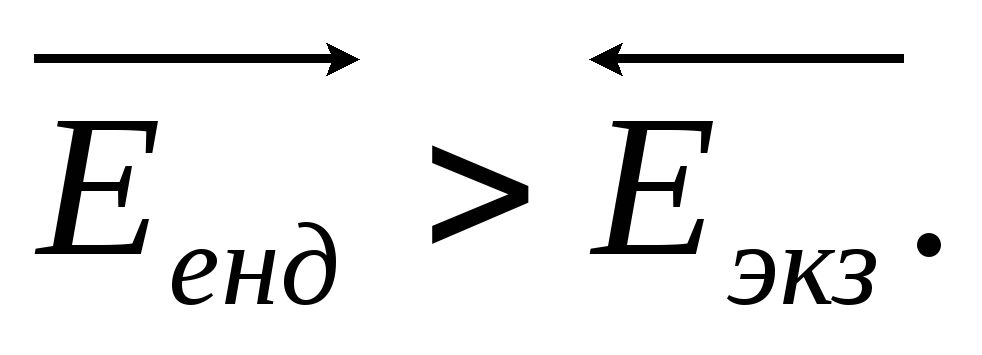 Поэтому
Поэтому
 ,
,
а значит, константа скорости эндотермической реакции будет возрастать с температурой быстрее константа скорости экзотермической реакции.
В заключение отметим, что энергия активации определяется природой реагирующих веществ.