Урок химии в 8 классе «расчеты по химическим уравнениям»
Урок химии в 8 классе
«Расчеты по химическим уравнениям»
Задачи:
формировать умения вести расчеты по уравнению химической реакции на нахождение количества вещества, массы или объема продукта реакции по количеству, массе или объему исходного вещества;
продолжить формирование общеучебных умений и навыков, способов само- и взаимоконтроля;
воспитывать потребность добиваться успехов в приобретении знаний.
Формы работы: фронтальная, индивидуальная, парная, групповая.
Тип урока: комбинированный с применением ИКТ
Ход урока
1. Организационный момент.
2. Проверка знаний
и умений учащихся –
фронтально.
Проверяются знания величин и их единиц измерений, расчетных формул на нахождение количество вещества, используя массу и объем.
Задание: на магнитной доске закреплены карточки с обозначением величин и единиц измерений. Сопоставить величину и единицу измерения.
n
V
г/моль
M
л
моль
Vm
г
л/моль
О
n
моль
твет:m
г
M
г/моль
V
л/моль
Vm
л/моль
Примечание: Ученик
должен не только правильно расставить
карточки, но и прочитать запись, называя
величины: «Единицей измерения количества
вещества является 1 моль» и т. д.
д.
Задание: Используя данные карточки, составить формулу для нахождения количества вещества по известной массе вещества.
n
═
З
V
адание: Используя данные карточки, составить формулу для нахождения количества вещества по известному объему газообразного вещества.V
n
n
V
n
Vm
═3. Изучение нового материала – с использованием презентационного сопровождения урока.
Сначала учитель обращает внимание учащихся на алгоритм решения задач, который они записывают в тетради (слайд 3):
Решение задач преподаватель
объясняет на конкретном примере (задача
№ 1 – слайд 4),
обращая внимание на правильное оформление
задачи.
Задача №1: Рассчитайте количество вещества алюминия, который потребуется для получения 1,5 моль водорода при реакции с соляной кислотой.
Задача №2 (слайд 5) решается аналогично задаче № 1, поэтому учащиеся работают в парах.
Задача № 2:
Определите количество вещества серы, необходимое для получения 2,5 моль сульфида алюминия.После выполнения задания проверяется правильность решения и оформления задачи.
Примечание: для отработки навыка решения задач при самостоятельной работе учащимся предлагается готовое уравнение реакции, чтобы не тратить время урока на отработку навыка составления уравнений химических реакций.
Задача №3: Вычислите массу оксида меди (II), образующегося при разложении 14,7 г гидроксида меди (II).
Задача №3 (слайд 6) выполняется одним из учащихся на доске.
Учитель помогает и направляет действия
ученика.
Задача №4: Рассчитайте массу соли, которая образуется при взаимодействии 13 г цинка с соляной кислотой.
Задача №4 (слайд 7) предлагается ученикам для работы в группах, состоящих из 4 человек (две соседние парты). Группы подобраны таким образом, чтобы хотя бы один ученик был сильный, у другого – средний уровень знаний и ученик с низким уровнем обученности. После выполнения задания проверяется правильность решения и оформления задачи.
Задача №5: Какой объем кислорода (н.у.) образуется при разложении 6 г оксида магния.
Эту задачу (слайд 8) один из учащихся (с высоким уровнем обученности) решает на доске.
Задача №6: Рассчитайте, какой объем водорода должен вступить в реакцию с оксидом меди (II), чтобы образовалось 32 г меди.
Задача №6 (слайд 9) предлагается учащимся для групповой работы.
В конце 2 урока проводится
самостоятельная работа по вариантам.
Самостоятельная работа (слайд 10)
ВАРИАНТ 1:
Вычислите массу меди, которая образуется при восстановлении избытком водорода 4 г оксида меди (II).
CuO + H2 = Cu + H2O
ВАРИАНТ 2:
В реакцию с серной кислотой вступило 20 г гидроксида натрия. Рассчитайте массу образовавшейся соли.
2NaOH + H2SO4 = Na2SO4 + 2H2O
Домашнее задание (слайд 11):
Вычислите объем (н.у.) газа, который образуется при взаимодействии цинка с раствором, содержащим 0,4 моль соляной кислоты.
4. Подведение итогов урока – обсуждение работы каждого учащегося в группе, самоанализ с помощью сигнальных карточек:
усвоил тему урока – зеленая карточка;
остались непонятные вопросы – синяя карточка;

Список литературы:
Габриелян О.С. Химия. 8 класс: Контрольные и проверочные работы. – М.: Дрофа, 2003.
Радецкий А.М., Горшкова В.П. Дидактический материал по химии для 8-9 классов: Пособие для учителя. – М.: Просвещение, 2000.
Образовательный комплекс 1 С: Школа. Химия, 8 класс [Электронный носитель]. – М.: Фирма «1 С», 2004.
Секретная шпаргалка по химии. 3.3 Расчеты по уравнениям реакций | Репетитор Богунова В.Г.
ЕГЭ по химии 2018 был сложным, уровень задач вплотную приблизился к конкурсным заданиям 90-х в столичных медицинских ВУЗах, 20% выпускников не преодолели даже минимальный порог. Но… «нам не стpашен ни вал девятый, ни холод вечной меpзлоты!» Мы поставили цель — стать врачами, и мы добьемся этой цели, не смотря на все трудности! В конце статьи я обязательно раскрою секрет установки на успех. А пока — грызем гранит знаний.
Сегодня мы поучимся выполнять один из самых важных шагов практической химии — расчеты по уравнениям реакций. Этим занимается Стехиометрия – раздел химии, который изучает количественные соотношения между веществами, вступившими в реакцию и образовавшимися в ходе нее.
Этим занимается Стехиометрия – раздел химии, который изучает количественные соотношения между веществами, вступившими в реакцию и образовавшимися в ходе нее.
Как же родилась Стехиометрия? Алхимики начали обозначать химические элементы символами. Позже для записи веществ стали использовать химические формулы. В 1615 г. Жан Бегун, автор первого учебника химии «Начала Химии» предложил использовать химические уравнения. В конце XVIII в. философ И. Кант произнес знаменитые слова: «В каждой естественной науке заключено столько истины, сколько в ней математики». Эти слова произвели огромное впечатление на ученика Канта — немецкого химика И.В. Рихтера, который доказал наличие математической зависимости в химических реакциях. В 1793 г. Рихтер опубликовал работу «Начала стехиометрии, или способ измерения химических элементов». Кстати, первые количественные уравнения химических реакций и термин «стехиометрия» ввел именно Рихтер.
В 1803 г. английский химик Джон Дальтон по результатам экспериментов сформулировал закон простых кратных отношений, который лег в основу расчетов по уравнениям химических реакций
«Если два элемента образуют друг с другом несколько химических соединений, то весовые количества одного элемента, приходящиеся в этих соединениях на одно и то же весовое количество другого элемента, относятся между собой как небольшие целые числа»
Современная формулировка: «Количества веществ реагентов и продуктов относятся друг к другу как коэффициенты в уравнении химической реакции»
Обобщим основные Критерии Расчетов по уравнениям реакций:
1) Расчеты по уравнениям реакций проводят на основании закона простых кратных отношений
2) Основная расчетная величина — количество вещества (моль).НЕЛЬЗЯ использовать для расчетов значения масс!
3) Если участники процесса — исключительно газы, можно проводить расчеты в любых объемных единицах на основании закона объемных отношений Гей-Люссака
Решим несложные задачи, используя Четыре Заповеди и основные Критерии Расчетов. Каждое действие обводится зеленым овалом.
Задача 1
Вычислите массу лития, вступившего в реакцию с 64 г кислорода.
1) Первая Заповедь. Выписать данные задачи в разделе «Дано».
2) Вторая Заповедь. Написать уравнение реакции.
Небольшой экскурс в теорию химии. Литий — металл I(A)-группы (щелочные металлы). Все щелочные металлы реагируют с кислородом уже при комнатной температуре, в связи с чем их хранят под слоем керосина. Запомните: с образованием оксида, с киcлородом реагирует только литий, остальные щелочные металлы при аналогичных условиях образуют пероксиды Ме2О2 и надпероксиды МеО2. Пишем несложное уравнение реакций и расставляем коэффициенты.
Пишем несложное уравнение реакций и расставляем коэффициенты.
3. Третья Заповедь. Сделать предварительные расчеты по данным условия задачи
В условии задачи представлены данные только по кислороду. Составляем досье, в котором обязательно должны быть представлены три величины — масса (или объем), молярная масса, количество вещества (моль).
4. Четвертая заповедь. Составить алгоритм решения задачи.
Формулизируем вопрос задачи «Вычислите массу лития», т.е. записываем формулу расчета массы, которая для нас, как для химиков, должна быть представлена произведением количества вещества на молярную массу. Анализируем компоненты формулы: молярную массу лития определяем по таблице Менделеева, количество вещества лития рассчитываем по уравнению реакции.
Расчеты по уравнению реакции выполняем на основании закона кратных отношений по схеме: точку расчета (количество вещества кислорода) делим на коэффициент при этом веществе, умножаем на коэффициент при искомом веществе и получаем результат. Выписывать отдельно пропорцию для расчетов не обязательно. Это — Легкие Расчеты по уравнениям реакций, которые не противоречат закону кратных отношений, но значительно упрощают решение задач по химии.
Выписывать отдельно пропорцию для расчетов не обязательно. Это — Легкие Расчеты по уравнениям реакций, которые не противоречат закону кратных отношений, но значительно упрощают решение задач по химии.
Задача 2
Сколько граммов оксида магния получится при разложении 252 г карбоната магния МgСО3?
Немного теории. Все нерастворимые карбонаты, а также карбонаты лития и аммония, разлагаются при нагревании: карбонаты металлов разлагаются до оксида металла и углекислого газа, карбонат аммония при разложении образует аммиак, углекислый газ и воду.
Последовательность действия, выполняемых при решении задачи:
1) Выписать данные в разделе «Дано»
2) Написать уравнение реакции
3) Сделать предварительные расчеты
4) Составить алгоритм решения
5) Выполнить анализ и расчеты по главной формуле алгоритма
Задача 3
Сколько меди можно получить из 160 г ее оксида при восстановлении водородом?
Немного теории. Железо и остальные металлы правее него в ряду активности металлов можно восстановить водородом из их оксидов.
Железо и остальные металлы правее него в ряду активности металлов можно восстановить водородом из их оксидов.
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Cr→Zn→Fe→Cd→Co→Ni→Sn→Pb→(H)→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
Последовательность действия, выполняемых при решении задачи:
1) Выписать данные в разделе «Дано»
2) Написать уравнение реакции
3) Сделать предварительные расчеты
4) Составить алгоритм решения
5) Выполнить анализ и расчеты по главной формуле алгоритма
Секретная установка на успех
Утром, встав с постели, повторяем три раза, четко произнося каждое слово: «Я обязательно сдам ЕГЭ по химии на 95+, если буду заниматься: системно, добросовестно, ежедневно!» Этот прием работает на 100%! Проверено моими учениками.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him. ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы «Решение задач по химии» — и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы «Решение задач по химии» — и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Презентация «Решение задач. Расчеты по химическим уравнениям»
библиотека
материалов
Содержание слайдов
Номер слайда 1Решение задач.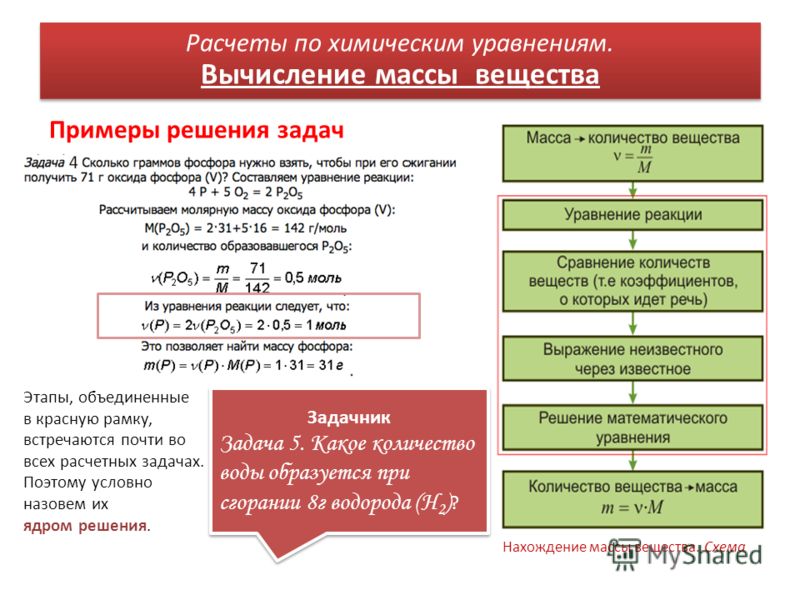 Расчёты по химическим уравнениям. Автор презентации Клименко К. А.учитель химии2020 год1
Расчёты по химическим уравнениям. Автор презентации Клименко К. А.учитель химии2020 год1
Номер слайда 2
Давайте повторим. Что такое химическая формула?Графическое выражение качественного и количественного состава молекулы вещества называется химической формулой. Что такое уравнение химической реакции?Графическое выражение превращения одних веществ в другие посредством химических формул и коэффициентов называется уравнением химической реакции2
Номер слайда 3
Попробуем составить химическую формулу. Хлорид натрия. Сульфат меди (II)Нитрат серебра. Карбонат кальция. Сульфид свинца (II) Сульфит натрия. Фосфат кальция. Na. Cl. Cu. SO4 Ag. NO3 Ca. CO3 Pb. SNa2 SO3 Ca3(PO4)23
Хлорид натрия. Сульфат меди (II)Нитрат серебра. Карбонат кальция. Сульфид свинца (II) Сульфит натрия. Фосфат кальция. Na. Cl. Cu. SO4 Ag. NO3 Ca. CO3 Pb. SNa2 SO3 Ca3(PO4)23
Попробуем составить уравнения химических реакций. Взаимодействие натрия с кислородом4 Na + O2 = 2 Na2 OВзаимодействие хлорида железа (III) с гидроксидом калия. Fe. Cl3 + 3 KOH = Fe(OH)3 + 3 KCl. Взаимодействие гидроксида алюминия с серной кислотой2 Al(OH)3 = 3 h3 SO4 = Al2(SO4)3 + 6 h3 O 4
С чего начать?Рассчитайте массу соли, образующейся при взаимодействии с соляной кислотой (HCl) 28 граммов оксида кальция (Ca. O). Запишем краткое условие задачи. Дано: Решение: Найти:m(Ca. O) = 28г.m(Ca. Cl2) -?5
O). Запишем краткое условие задачи. Дано: Решение: Найти:m(Ca. O) = 28г.m(Ca. Cl2) -?5
Номер слайда 6
Как правильно решить задачу по химии (способ № 1)1. Внимательно прочитать и понять условие задачи.3. Правильно составить уравнение химической реакции4. Подписать над уравнением всё, что даёт нам условие задачи.5. Подписать под уравнением всё, что даёт нам уравнение реакции (молярные массы).6. Исходя из рассуждения составить пропорцию.7. Решить пропорцию.8. Записать ответ.2. Записать краткое условие задачи. Пример:6
Номер слайда 7
Как правильно решить задачу по химии (способ № 2)1. Внимательно прочитать и понять условие задачи.3. Правильно составить уравнение химической реакции.4. Вычислить количества вещества участников химической реакции.5. Используя полученные данные и данные о количестве вещества по уравнению реакции (коэффициенты) составить пропорцию. 6. Решить пропорцию.7. Записать ответ.2. Записать краткое условие задачи. Пример:7
Внимательно прочитать и понять условие задачи.3. Правильно составить уравнение химической реакции.4. Вычислить количества вещества участников химической реакции.5. Используя полученные данные и данные о количестве вещества по уравнению реакции (коэффициенты) составить пропорцию. 6. Решить пропорцию.7. Записать ответ.2. Записать краткое условие задачи. Пример:7
Номер слайда 8
Рассмотрим первый способ на примере задачи. Рассчитайте массу соли, образующейся при взаимодействии с соляной кислотой (HCl) 28 граммов оксида кальция (Ca. O). Са. О + 2 HCl = Ca. Cl2 + h3 O28 г. X г.56 г/моль111 г/моль56 : 111 = 28 : х 111 г/моль × 28 г. 56 г/моль. Х == 55,5 г. Ответ: m(Ca. Cl2) = 55,5г. Второй способ8
O). Са. О + 2 HCl = Ca. Cl2 + h3 O28 г. X г.56 г/моль111 г/моль56 : 111 = 28 : х 111 г/моль × 28 г. 56 г/моль. Х == 55,5 г. Ответ: m(Ca. Cl2) = 55,5г. Второй способ8
Номер слайда 9
Рассмотрим второй способ на примере той же задачи. Рассчитайте массу соли, образующейся при взаимодействии с соляной кислотой (HCl) 28 граммов оксида кальция (Ca. O). Са. О + 2 HCl = Ca. Cl2 + h3 On = m/Mn(Ca. O) = 28г./56г/моль = 0,5 моль1 : 1 = 0,5 : х; 1 моль × 0,5 моль 1 мольх == 0,5 мольm = n × Mm(Ca. Cl2) = 0,5моль × 111г/моль = 55,5г. Ответ: m(Ca. Cl2) = 55,5 г.9
Ответ: m(Ca. Cl2) = 55,5 г.9
Номер слайда 10
Задание на дом:10
Номер слайда 11
Вы можете использовать данное оформление для создания своих презентаций, но в своей презентации вы должны указать источник шаблона: Фокина Лидия Петровнаучитель начальных классов. МКОУ «СОШ ст. Евсино»Искитимского района. Новосибирской области. Сайт http://pedsovet.su/ СПАСИБО АВТОРАМ ФОНОВ И КАРТИНОК11
МКОУ «СОШ ст. Евсино»Искитимского района. Новосибирской области. Сайт http://pedsovet.su/ СПАСИБО АВТОРАМ ФОНОВ И КАРТИНОК11
Номер слайда 12
Интернет-ресурсы: Микроскоп http://img-fotki.yandex.ru/get/9299/134091466.f5/0_d4d6e_ccd0a668_S Колбы http://img-fotki.yandex.ru/get/6613/134091466.a/0_8eae3_6ea58e84_S Пробирки http://img-fotki.yandex.ru/get/9300/134091466.c5/0_c98b9_19d24419_S Горелка http://img-fotki.yandex.ru/get/4904/134091466.f5/0_d4d6d_4740c1eb_S Колбы http://img-fotki.yandex.ru/get/9558/134091466.9a/0_c0378_bebb161_S Блокнот с ручкой http://img-fotki. yandex.ru/get/19/108950446.6d/0_b4102_1793a431_S12
yandex.ru/get/19/108950446.6d/0_b4102_1793a431_S12
Урок 10. расчёты по уравнениям химических реакций. обобщение знаний по теме «первоначальные химические понятия» — Химия — 8 класс
Конспект
Расчеты по уравнениям химических реакций. Обобщение знаний по теме «Первоначальные химические понятия»
Химия, наряду с биологией, физикой и географией, является естественной наукой, то есть наукой, отвечающие за изучение внешних по отношению к человеку, природных явлений. Предметом изучения химии являются вещества в самом широком понимании этого слова. Вещества состоят из молекул, атомов или других частиц. Вид атома называют химическим элементом. В химии есть свой язык: буквами в нем являются знаки химических элементов, которые обозначают атом – мельчайшую химически неделимую частицу вещества. Словами в химии являются химические формулы, которые показывают состав вещества, а предложениями – химические уравнения, которые являются условной записью превращения одних веществ в другие.
Словами в химии являются химические формулы, которые показывают состав вещества, а предложениями – химические уравнения, которые являются условной записью превращения одних веществ в другие.
Химия – наука количественная. И атом, и молекула имеют массу, которая измеряется в атомных единицах массы. Физическая величина количество вещества позволяет считать молекулы не штуками, а порциями. Без точных расчетов немыслимо ни одно производство. На точных химических расчётах основана металлургия, химическая и текстильная промышленность, военное дело и фармакология, медицина и остальные области, связанные с использованием вещества. Да и в быту нам необходимо применять расчёты, связанные с веществами.
Научимся проводить расчёты по уравнению химической реакции.
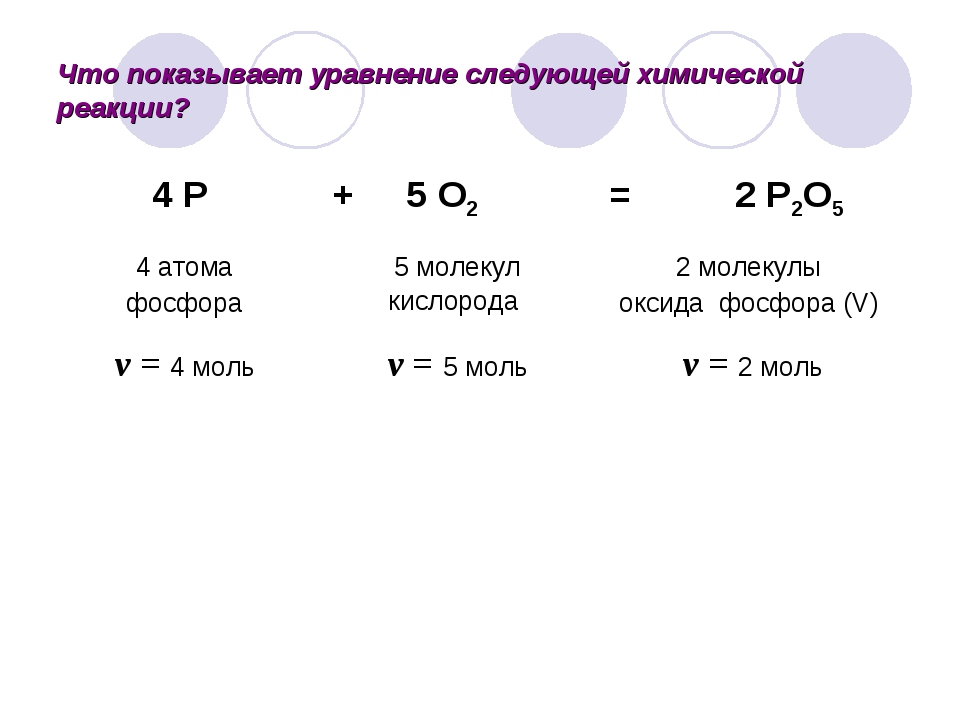
Дана химическая реакция: 4P + 5O2 = 2P2O5
Данные коэффициенты означают, что для получения 2 молекул оксида фосфора (V) необходимо взять 4 атома фосфора и пять молекул кислорода.
А сколько молекул оксида получится, если мы возьмём 2 атома фосфора? Если из 4 атомов фосфора образуется 2 молекулы оксида, то из 2 атомов фосфора образуется 1 молекула оксида. Такое число частиц соответствует определённому количеству вещества.
Такое число частиц соответствует определённому количеству вещества.
В химических уравнениях коэффициенты показывают мольные соотношения, в которых реагируют вещества и образуются продукты реакций.
Определим количество вещества кислорода, необходимое для полного сгорания 0,2 моль фосфора. Нам известно количество вещества фосфора. Чтобы узнать количество вещества кислорода, нам необходимо определить, в каких соотношениях реагируют фосфор и кислород по уравнению химической реакции.
Это соотношение должно сохраниться.
v (O2) = х моль O2 = 0,2 * 5 : 4 = 0,25 моль
А можно ли определить количество вещества одного реагента, если известна масса другого реагента? Определим количество вещества оксида фосфора, которое можно получить при сгорании фосфора в 8 г кислорода.
Для того чтобы узнать количество вещества оксида фосфора, необходимо знать количество вещества любого участника процесса. Про фосфор нам ничего не известно, а вот у кислорода нам известна масса. Если мы найдём количество вещества кислорода, то найдем и количество моль оксида фосфора (V). Нам известна масса кислорода, а масса и количество вещества связаны соотношением:
Нам известна масса кислорода, а масса и количество вещества связаны соотношением:
А если нам нужно узнать не количество вещества, а его массу? Тогда наше решение дополнится ещё одним действием, потому что, зная количество вещества, легко найти массу. Найдём массу оксида фосфора (V) из нашей задачи.
m = ν * M;
m (P2O5) = ν (P2O5) * M (P2O5) = 0,1моль * (31 * 2 + 16 * 5) г/моль = 14,2 г
Точно таким же способом можно найти и объём, и число частиц.
При решении задач на нахождении массы или объёма одного участника химического процесса по известной массе или объёму другого участника химического процесса можно использовать такой алгоритм:
Внеклассный урок — Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций
Для решения расчетных задач по уравнениям химических реакций важно придерживаться определенной последовательности действий, которая позволит прийти к правильным ответам. Рассмотрим этот алгоритм решения на примере.
Рассмотрим этот алгоритм решения на примере.
Задача 1: Вычислим массу и количество вещества оксида магния, образовавшегося при полном сгорании 24г магния.
Итак:
Дано:
m(Mg) = 24 г
Найти: ν(MgO) m(MgO) | Решение:
1. Надо составить уравнение химической реакции:
2Mg + O2 = 2MgO
2. В уравнении одной чертой надо подчеркнуть формулу вещества, масса которой указана в условии задачи, а двумя чертами – формулу вещества, массу которого требуется вычислить:
2Mg + O2 = 2MgO —— ════
3. Под формулами этих веществ указать количество вещества (число молей) согласно уравнениям реакции (оно соответствует коэффициентам, стоящим перед формулами в уравнении):
2Mg + O2 = 2MgO —— ════ 2 моль 2 моль
4. M(Mg) = 24 г/моль. Теперь по массе вещества, заданной в условии задачи, вычислим количество вещества: m(Mg) 24г ν(Mg) = ——— = ——— = 1 моль. M(Mg) 24 г/моль
5. Над формулой оксида магния (MgO), масса которого неизвестна, ставим x моль. А над формулой магния указываем его молярную массу:
1 моль x моль 2Mg + O2 = 2MgO —— ════ 2 моль 2 моль
6. Установим соотношение количеств веществ:
1 моль x моль ——— = ——— 2 моль 2 моль
Отсюда: 1 моль · 2 моль x = ———————— = 1 моль. 2 моль
Итак, один ответ у нас уже есть – мы нашли количество вещества оксида магния: ν(MgO) = 1 моль.
7. Для следующего шага сначала находим молярную массу оксида магния. Молярная масса магния 24 г/моль, кислорода 16 г/моль. Значит: M(MgO) = 24 + 16 = 40 г/моль.
Теперь находим массу оксида магния:
m(MgO) = ν(MgO) · M(MgO) = 1 моль · 40 г/моль = 40 г.
Ответ: ν(MgO) = 1 моль; m(MgO) = 40 г.
|
|
Задача 2: По термохимическому уравнению
2CO (г.) + O2 (г.) = 2CO2 (г.) + 566 кДж
вычислите количество теплоты, выделяющейся при сгорании 5 моль угарного газа (оксида углерода (II)).
Первый шаг делать уже не надо – уравнение химической реакции уже составлено.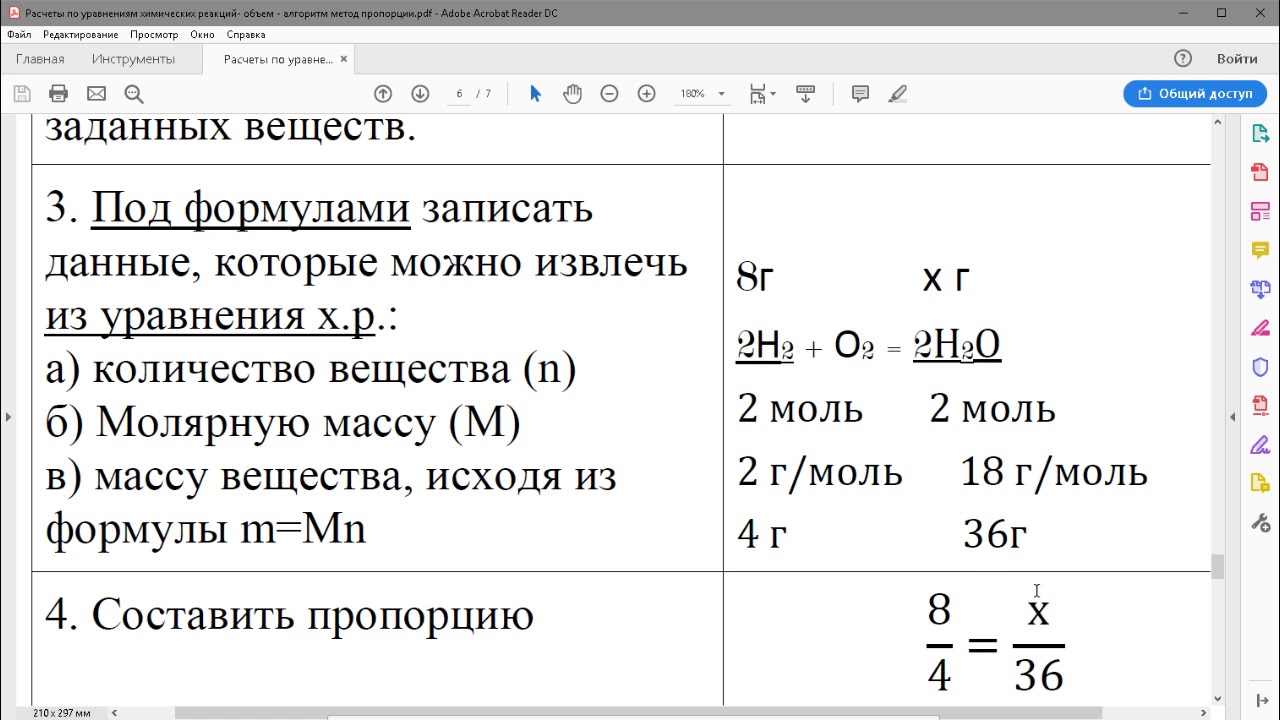
2. Подчеркнем одной чертой формулу вещества, масса которой нам известна:
2CO (г.) + O2 (г.) = 2CO2 (г.) + 566 кДж
———
3. Под формулой оксида углерода укажем число молей:
2CO (г.) + O2 (г.) = 2CO2 (г.) + 566 кДж
———
2 моль
4. Количество вещества оксида углерода вычислять не надо – оно нам известно: 5 моль. Поэтому переходим к следующему шагу.
5. Над формулой угарного газа пишем его молярную массу, а над значением теплоты (Q) ставим x:
5 моль x моль
2CO (г.) + O2 (г.) = 2CO2 (г.) + 566 кДж
———
2 моль
6. Установим соотношение количеств веществ:
5 моль x кДж
——— = ———
2 моль 566 кДж
5 моль · 566 кДж
x = ———————— = 1415 кДж.
2 моль
Ответ: при сгорании 5 моль угарного газа выделяется 1415 кДж теплоты.
Как определить количество вещества по уравнению реакции. Расчёты по уравнениям химических реакций
Урок посвящен продолжению изучения темы «Уравнение химической реакции». В уроке рассматриваются простейшие расчеты по уравнению химической реакции, связанные с соотношением количеств веществ, участвующих в реакции.
Тема: Первоначальные химические представления
Урок: Уравнение химической реакции
1. Соотношение количеств веществ, участвующих в реакции
Коэффициенты в уравнении реакции показывают не только число молекул каждого вещества, но и соотношение количеств веществ, участвующих в реакции. Так, по уравнению реакции: 2h3 + O2 = 2h3O – можно утверждать, что для образования определенного количества воды (например, 2 моль) необходимо столько же моль простого вещества водорода (2 моль) и в два раза меньше моль простого вещества кислорода (1 моль). Приведем примеры подобных расчетов.
Приведем примеры подобных расчетов.
2. Задача 1
ЗАДАЧА 1. Определим количество вещества кислорода, образующегося в результате разложения 4 моль воды.
АЛГОРИТМ решения задачи:
1. Составить уравнение реакции
2. Составить пропорцию, определив количества веществ по уравнению реакции и по условию задачи (обозначить неизвестное количество вещества за х моль).
3. Составить уравнение (из пропорции).
4. Решить уравнение, найти х.
Рис. 1. Оформление краткого условия и решения задачи 1
3. Задача 2 ЗАДАЧА 2. Какое количество кислорода потребуется для полного сжигания 3 моль меди? Воспользуемся алгоритмом решения задач с использованием уравнения химической реакции.
Рис. 2. Оформление краткого условия и решения задачи 2.
Внимательно изучите алгоритмы и запишите в тетрадь, решите самостоятельно предложенные задачи
I . Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода
(4Al +3O2
=2Al2
O3
).
2. Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода
(4Na+O2
=2Na2
O).
Алгоритм №1
Вычисление количества вещества по известному количеству вещества, участвующего в реакции.
Пример. Вычислите количество вещества кислорода, выделившегося в результате разложения воды количеством вещества 6 моль.
II. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль (S+O2 =SO2 ).
2. Вычислите массу лития, необходимого для получения хлорида лития количеством вещества 0,6 моль (2Li+Cl2
=2LiCl).
Алгоритм №2
Вычисление массы вещества по известному количеству другого вещества, участвующего в реакции.
Пример: Вычислите массу алюминия, необходимого для получения оксида алюминия количеством вещества 8 моль.
III. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества сульфида натрия, если в реакцию с натрием вступает сера массой 12,8 г (2Na+S=Na2S).
2. Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди (II) массой 64 г (CuO + h3
= Cu + h3
O).
Внимательно изучите алгоритм и запишите в тетрадь
Алгоритм №3
Вычисление количества вещества по известной массе другого вещества, участвующего в реакции.
Пример. Вычислите количество вещества оксида меди (I), если в реакцию с кислородом вступает медь массой 19,2г.
Внимательно изучите алгоритм и запишите в тетрадь
IV. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу кислорода, необходимую для реакции с железом массой 112 г
(3Fe + 4O2
=Fe3
O4
).
Алгоритм №4
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
Пример. Вычислите массу кислорода, необходимую для сгорания фосфора, массой 0,31г.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода (4Al +3O2 =2Al2 O3 ).
2. Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода (4Na+O2 =2Na2 O).
3. Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль (S+O2 =SO2 ).
4. Вычислите массу лития, необходимого для получения хлорида лития количеством вещества 0,6 моль (2Li+Cl2 =2LiCl).
5. Вычислите количество вещества сульфида натрия, если в реакцию с натрием вступает сера массой 12,8 г (2Na+S=Na2
S).
6. Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди (II) массой 64 г (CuO + h3
= Cu + h3
O).
ТРЕНАЖЁРЫ
Тренажёр №1 — Анализ уравнения химической реакции
Тренажёр №6 — Стехиометрические расчёты
Внимательно изучите алгоритмы и
запишите в тетрадь, решите самостоятельно предложенные задачи
I. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода (4 Al +3 O 2 =2 Al 2 O 3).
2. Вычислите количество вещества оксида натрия, образовавшегося в
результате взаимодействия натрия количеством вещества 2,3 моль с достаточным
количеством кислорода (4 Na
+ O
2 =2 Na
2 O
).
Алгоритм №1
Вычисление количества вещества по известному количеству вещества, участвующего в реакции.
Пример. Вычислите количество вещества кислорода, выделившегося в результате разложения воды количеством вещества 6 моль.
Оформление задачи | |
1. Записать условие задачи | Дано : ν(Н 2 О)=6моль _____________ Найти : ν(О 2)=? |
Решение : М(О 2)=32г/моль | |
и расставим коэффициенты | 2Н 2 О=2Н 2 +О 2 |
, а под формулами – | |
5. составим соотношение | |
6. Записываем ответ | Ответ: ν (О 2)=3моль |
II. Используя алгоритм, решитесамостоятельно следующие задачи:
1. Вычислите массу серы, необходимую для получения оксида серы ( S + O 2 = SO 2).
2. Вычислите массу лития, необходимого для получения хлорида лития количеством вещества 0,6 моль (2 Li + Cl 2 =2 LiCl ).
Алгоритм №2
Вычисление массы вещества по известному количеству другого вещества, участвующего в реакции.
Пример: Вычислите массу алюминия, необходимого для получения оксида алюминия количеством вещества 8 моль.
Последовательность выполнения действий | Оформление решения задачи |
1. | Дано: ν( Al 2 O 3 )=8моль ___________ Найти: m ( Al )=? |
2. Вычислить молярные массы веществ, о которых, идёт речь в задаче | M ( Al 2 O 3 )=102г/моль |
3. Запишем уравнение реакции и расставим коэффициенты | 4 Al + 3O 2 = 2Al 2 O 3 |
4. Над формулами веществ запишем количества веществ из условия задачи , а под формулами – стехиометрические коэффициенты , отображаемые уравнением реакции |
|
5. требуется найти. Для этого составим соотношение. | |
6. Вычисляем массу вещества, которую требуется найти | m = ν ∙ M , m (Al )= ν (Al )∙ M (Al )=16моль∙27г/моль=432г |
7. Записываем ответ | Ответ: m (Al)= 432 г |
III. Используя алгоритм, решитесамостоятельно следующие задачи:
1. Вычислите количество вещества сульфида натрия, если в реакцию с
натриемвступает серамассой 12,8 г (2 Na
+ S
= Na
2 S
).
2. Вычислите количество веществаобразующейся меди, если в реакцию с водородом вступает оксид меди ( II ) массой 64 г ( CuO + H 2 = Cu + H 2 O ).
Внимательно изучите алгоритм и
запишите в тетрадь
Алгоритм №3
Вычисление количества вещества по известной массе другого вещества, участвующего в реакции.
Пример. Вычислите количество вещества оксида меди ( I ), если в реакцию с кислородом вступает медь массой 19,2г.
Последовательность выполнения действий | Оформление задачи |
1. Записать условие задачи | Дано: m ( Cu )=19,2г ___________ Найти: ν( Cu 2 O )=? |
2. о которых, идёт речь в задаче | М(Cu )=64г/моль |
3. Найдём количество вещества, масса которого дана в условии задачи | |
и расставим коэффициенты | 4 Cu + O 2 =2 Cu 2 O |
количества веществ из условия задачи , а под формулами – стехиометрические коэффициенты , отображаемые уравнением реакции | |
6. Для вычисления искомого количества вещества, составим соотношение | |
7. Запишем ответ | Ответ: ν( Cu 2 O )=0,15 моль |
Внимательно изучите алгоритм и
запишите в тетрадь
IV.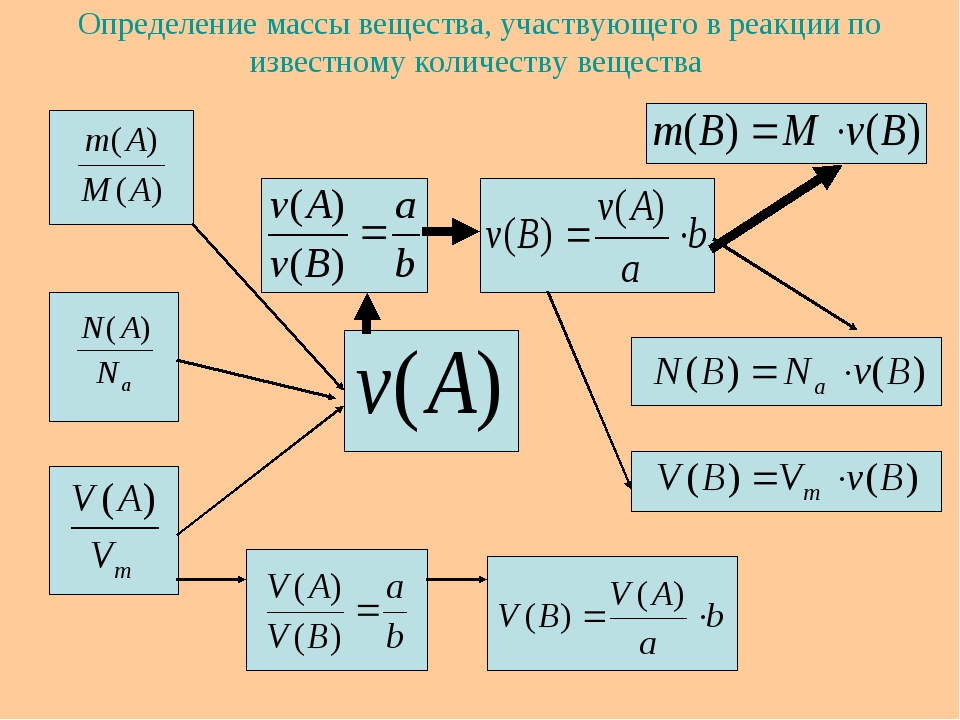 Используя алгоритм, решитесамостоятельно следующие задачи:
Используя алгоритм, решитесамостоятельно следующие задачи:
1. Вычислите массу кислорода, необходимую для реакции с железом массой 112 г
(3 Fe + 4 O 2 = Fe 3 O 4).
Алгоритм №4
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
Пример. Вычислите массу кислорода, необходимую для сгорания фосфора, массой 0,31г.
Последовательность выполнения действий | Оформлениезадачи |
1. Записать условие задачи | Дано: m ( P )=0,31г _________ Найти: m ( O 2 )=? |
2. о которых, идёт речь в задаче | М( P )=31г/моль M ( O 2 )=32г/моль |
3. Найдём количество вещества, масса которого дана в условии задачи | |
4. Запишем уравнение реакции и расставим коэффициенты | 4 P +5 O 2 = 2 P 2 O 5 |
5. Над формулами веществ запишем количества веществ из условия задачи , а под формулами – стехиометрические коэффициенты , отображаемые уравнением реакции | |
6. Вычислим количества вещества, массу которого необходимо найти m ( O 2 )= ν ( O 2 )∙ M ( O 2 )= 0,0125моль∙32г/моль=0,4г | |
8. | Ответ: m ( O 2 )=0,4г |
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода (4 Al +3 O 2 =2 Al 2 O 3).
2. Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода (4 Na + O 2 =2 Na 2 O ).
3. Вычислите массу серы, необходимую для получения оксида серы ( IV ) количеством вещества 4 моль ( S + O 2 = SO 2).
4. Вычислите массу лития, необходимого для получения хлорида лития количеством
вещества 0,6 моль (2 Li
+ Cl
2 =2 LiCl
).
Вычислите массу лития, необходимого для получения хлорида лития количеством
вещества 0,6 моль (2 Li
+ Cl
2 =2 LiCl
).
5. Вычислите количество вещества сульфида натрия, если в реакцию с натрием вступает сера массой 12,8 г (2 Na + S = Na 2 S ).
6. Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди ( II ) массой 64 г ( CuO + H 2 =
Стехиометрия — количественные соотношения между вступающими в реакцию веществами.
Если реагенты вступают в химическое взаимодействие в строго определенных количествах, а в результате реакции образуются вещества, количество которых можно расчитать, то такие реакции называются стехиометрическими .
Законы стехиометрии:
Коэффициенты в химических уравнениях перед формулами химических соединений называются стехиометрическими .
Все расчёты по химическим уравнениям основаны на использовании стехиометрических коэффициентов и связаны с нахождением количеств вещества (чисел молей).
Количество вещества в уравнении реакции (число молей) = коэффициенту перед соответствующей молекулой.
N A =6,02×10 23 моль -1 .
η — отношение реальной массы продукта m p к теоретически возможной m т, выраженное в долях единицы или в процентах.
Если в условии выход продуктов реакции не указан, то в расчетах его принимают равным 100% (количественный выход).
Схема расчёта по уравнениям химических реакций:
- Составить уравнение химической реакции.
- Над химическими формулами веществ написать известные и неизвестные величины с единицами измерения.
- Под химическими формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
- Составить и решить пропорцию.

Пример. Вычислить массу и количество вещества оксида магния, образовавшегося при полном сгорании 24 г магния.
Дано: m (Mg ) = 24 г Найти: ν ( MgO ) m ( MgO ) | Решение: 1. Составим уравнение химической реакции: 2Mg + O 2 = 2MgO. 2. Под формулами веществ укажем количество вещества (число молей), которое соответствует стехиометрическим коэффициентам: 2Mg + O 2 = 2MgO 2 моль 2 моль 3. Определим молярную массу магния: Относительная атомная масса магния Ar (Mg) = 24. Т.к. значение молярной массы равно относительной атомной или молекулярной массе, то M (Mg) = 24 г/моль. 4. По массе вещества, заданной в условии, вычислим количество вещества: 5. 1 моль x моль 2Mg + O 2 = 2MgO 2 моль 2 моль По правилам решения пропорции: Количество оксида магния ν (MgO) = 1 моль. 7. Вычислим молярную массу оксида магния: М (Mg) =24 г/моль, М (О) =16 г/моль. M (MgO) = 24 + 16 = 40 г/моль. Рассчитываем массу оксида магния: m (MgO) = ν (MgO) ×M (MgO) = 1 моль×40 г/моль = 40 г. Ответ: ν (MgO) = 1 моль; m (MgO) = 40 г. |
Для расчётов очень важно выбрать соответствующие друг другу единицы измерения массы, объёма и количества веществ. С этой целью можно воспользоваться таблицей 7.
Таблица 7
Соотношение некоторых единиц физико-химических величин
Для того чтобы решить расчётную задачу по химии, можно воспользоваться следующим алгоритмом.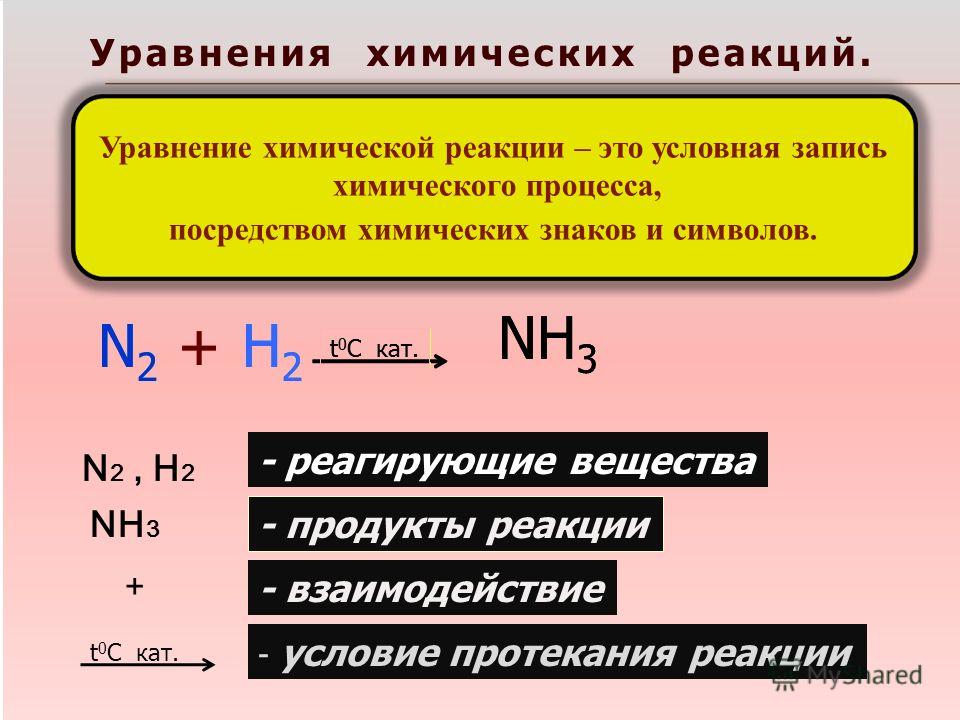
- Составить уравнение химической реакции.
- Перевести данные задачи (массу или объём) в количество вещества (моль, кмоль, ммоль).
Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала надо определить массу чистого вещества, а затем рассчитать его количество; если в задаче речь идёт о растворе, то сначала надо вычислить массу растворённого вещества, которое затем перевести в количество вещества.
- Над соответствующей формулой в уравнении записать найденное количество вещества, а количества над формулами искомых веществ обозначить через х и у.
- Найти количества искомых веществ, зная, что количественные отношения между веществами соответствуют коэффициентам перед их формулами в уравнении реакции.
- Перевести найденные количества веществ в массу или объём.
- Оформить ответ.
Задача 1. Рассчитайте объём водорода (н. у.), который потребуется для взаимодействия с 480 кг оксида железа (III). Вычислите количество вещества воды, которое при этом образуется.
2. а) Для того чтобы найти количество вещества оксида железа (III), сначала рассчитаем его молярную массу (в данном случае киломолярную, так как масса оксида железа (III) дана в килограммах (см. табл. 7)):
Mr(Fe 2 O 3) = 56 2 + 16 3 = 160;
M(Fe 2 O 3) = 160 кг/кмоль.
б) Найдём количество вещества оксида железа (III) в ки-ломолях, так как исходное данное в задаче предложено в килограммах:
3. Над формулой исходного вещества — оксида железа (III) — в уравнении реакции запишем найденное количество вещества — 3 кмоль, а количества веществ водорода и воды обозначим над их формулами соответственно через х и у:
4. а) Согласно уравнению реакции 1 кмоль оксида железа (III) взаимодействует с 3 кмоль водорода. Следовательно, 3 кмоль оксида железа (III) соответствует в три раза большее количество вещества водорода, т. е. х = 9 кмоль.
б) Рассчитаем объём водорода по найденному количеству вещества:
5. Согласно уравнению реакции из 1 кмоль оксида железа (III) образуется 3 кмоль воды, а из 3 кмоль оксида железа (III) — в три раза большее количество вещества воды, т. е. у = 9 моль.
е. у = 9 моль.
Ответ: V(Н 2) = 201,6 м 3 ; n(Н 2 O) = 9 кмоль.
Задача 2. Какой объём воздуха (н. у.) потребуется для взаимодействия с 270 г алюминия, содержащего 20% примесей? Какое количество вещества оксида алюминия при этом получится?
3. Над формулой алюминия в уравнении реакции запишем найденное количество — 8 моль, а количества кислорода и оксида алюминия обозначим соответственно через х и у:
4. Согласно уравнению реакции 4 моль алюминия взаимодействует с 3 моль кислорода, в результате чего получается 2 моль оксида алюминия. Следовательно, 8 моль алюминия соответствуют 6 моль кислорода и 4 моль оксида алюминия.
n(O 2) = 6 моль; n(А1 2 O 3) = 4 моль.
5. Рассчитаем объём кислорода по найденному количеству вещества:
V(O 2) = n(O 2) Vm;
V(O 2) = б моль 22,4 л/моль = 134,4 л.
6. Однако в задаче требуется найти объём не кислорода, а воздуха. В воздухе содержится 21% кислорода по объёму. Преобразуя формулу φ = V(O 2)/V(возд), найдём объём воздуха:
V(возд) = V(O 2) : φ(O 2) = 134,4: 0,21 = 640 (л).
Ответ: V(возд) = 640 л; n(Аl 2 O 3) = 4 моль.
Задача 3. Какой объём водорода (н. у.) выделится при взаимодействии 730 г 30%-й соляной кислоты с необходимым по реакции количеством вещества цинка? Каково это количество вещества?
3. Над формулой хлороводорода в уравнении реакции запишем найденное количество вещества — 6 моль, а количество веществ цинка и водорода обозначим соответственно через х и у:
4. Согласно уравнению реакции 2 моль хлороводорода взаимодействует с 1 моль цинка, в результате чего получается 1 моль водорода. Следовательно, 6 моль хлороводорода соответствуют 3 моль цинка и 3 моль водорода.
5. Рассчитаем объём водорода по найденному количеству:
V(H 2) = n(H 2) V m ;
V(H 2) = 3 моль 22,4 л/моль = 67,2 л.
Ответ: V(H 2) = 67,2 л; n(Zn) = 3 моль.
Ключевые слова и словосочетания
- Единицы важнейших величин.
- Алгоритм вычисления по уравнению реакции.
Работа с компьютером
- Обратитесь к электронному приложению.
 Изучите материал урока и выполните предложенные задания.
Изучите материал урока и выполните предложенные задания. - Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- Какой объём водорода (н. у.) и количество вещества соли образуется при взаимодействии соляной кислоты с 540 мг алюминия, содержащего 4% примесей?
- Какая масса оксида кальция получится при разложении 250 кг карбоната кальция, содержащего 20% примесей? Какой объём (н. у.) оксида углерода (IV) при этом выделится?
- Сколько молекул кислорода и какой объём водорода (н. у.) образуется при разложении 180 г воды?
- Придумайте условие задачи, в которой необходимо использовать приведённое ниже уравнение, и решите её:
Н 3 РO 5 + 3NaOH = Na 3 PO 4 + 3H 2 O.
- Придумайте и решите задачу, в условиях которой была бы дана масса раствора вещества с определённой массовой долей растворённого вещества, а требовалось бы найти количество вещества одного из веществ и объём другого.
 При составлении задачи используйте уравнение реакции:
При составлении задачи используйте уравнение реакции:Zn + H 2 SO 4 = ZnSO 4 + Н 2 .
«Не для муки, а для науки.»
(Народная мудрость)
Расчеты по уравнениям химических реакций
Классификация химических реакций. Реакции соединения, разложения, замещения, двойного обмена, окислительно-восстановительные реакции. Уравнения химических реакций. Подбор стехиометрических коэффициентов в уравнениях реакций. Расчеты по уравнениям реакций. Определение количества вещества и массы реагентов и продуктов. Определение объема газообразных реагентов и продуктов. Теоретический и практический выход продукта реакции. Степень чистоты химических веществ.
Примеры решения типовых задач
Задача 1. При рентгеноскопическом исследовании организма человека применяют так называемые рентгеноконтрастные вещества. Так, перед просвечиванием желудка пациенту дают выпить суспензию труднорастворимого сульфата бария, не пропускающего рентгеновское излучение. Какие количества оксида бария и серной кислоты потребуются для получения 100 сульфата бария?
Какие количества оксида бария и серной кислоты потребуются для получения 100 сульфата бария?
Решение.
BaO + H 2 SO 4 = BaSO 4 + H 2 O
m (BaSO 4) = 100 г; M (BaSO 4) = 233 г/моль
n (BaO) = ?
n (H 2 SO 4) = ?
В соответствии с коэффициентами уравнения реакции, которые в нашем случае все равны 1, для получения заданного количества BaSO 4 требуются:
n (BaO) = n (BaSO 4) = m (BaSO 4) / M(BaSO 4) = 100: 233
[г: (г/моль)] = 0,43 моль
n (H 2 SO 4) = n (BaSO 4) = m (BaSO 4) / M (BaSO 4) = 100: 233
[г: (г/моль)] = 0,43 моль
Ответ. Для получения 100 г сульфата бария требуются 0,43 моль оксида бария и 0,43 моль серной кислоты.
Задача 2. Прежде чем вылить в канализацию жидкие отходы лабораторных работ, содержащие соляную кислоту, полагается их нейтрализовать щелочью (например, гидроксидом натрия) или содой (карбонатом натрия). Определите массы NaOH и Na 2 CO 3 , необходимые для нейтрализации отходов, содержащих 0,45 моль HCl. Какой объем газа (при н.у.) выделится при нейтрализации указанного количества отходов содой?
Определите массы NaOH и Na 2 CO 3 , необходимые для нейтрализации отходов, содержащих 0,45 моль HCl. Какой объем газа (при н.у.) выделится при нейтрализации указанного количества отходов содой?
Решение. Запишем уравнения реакций и условия задачи в формульном виде:
(1) HCl + NaOH = NaCl + H 2 O
(2) 2HCl + Na 2 CO 3 = 2NaCl + H 2 O + CO 2
n (HCl) = 0,45 моль; M(NaOH) = 40 г/моль;
M (Na 2 CO 3) = 106 г/моль; V M = 22,4 л/моль (н.у.)
n (NaOH) = ? m (NaOH) = ?
n (Na 2 CO 3) = ? m (Na 2 CO 3) = ?
V (CO 2) = ? (н.у.)
Для нейтрализации заданного количества HCl в соответствии с уравнениями реакций (1) и (2) требуется:
n (NaOH) = n (HCl) = 0,45 моль;
m (NaOH) = n (NaOH) . M (NaOH) = 0,45 . 40
[моль. г/моль] = 18 г
n (Na 2 CO 3) = n
m (Na 2 CO 3) = n (Na 2 CO 3) / M (Na 2 CO 3) = 0,225 . 106
106
[моль. г/моль] = 23,85 г
Для расчета объема углекислого газа, выделившегося при нейтрализации по реакции (2), дополнительно используется уравнение, связывающие между собой количество газообразного вещества, его объем и молярный объем:
n (CO 2) = n (HCl) / 2 = 0,45: 2 [моль] = 0,225 моль;
V (CO 2) = n (CO 2) . V M = 0,225 . 22,4 [моль. л/моль] = 5,04 л
Ответ. 18 г NaOH; 23,85 г Na 2 CO 3 ; 5,04 л CO 2
Задача 3. Антуан-Лоран Лавуазье открыл природу горения различных веществ в кислороде после своего знаменитого двенадцатидневного опыта. В этом опыте он сначала длительное время нагревал в запаянной реторте навеску ртути, а позже (и при более высокой температуре) — образовавшийся на первом этапе опыта оксид ртути(II). При этом выделялся кислород, и Лавуазье стал вместе с Джозефом Пристли и Карлом Шееле первооткрывателем этого важнейшего химического элемента. Рассчитайте количество и объем кислорода (при н. у.), собранный при разложении 108,5 г HgO.
у.), собранный при разложении 108,5 г HgO.
Решение. Запишем уравнение реакции и условие задачи в формульном виде:
2HgO = 2Hg + O 2
m (HgO) = 108,5 г; M (HgO) = 217 г/моль
V M = 22,4 л/моль (н.у.)
V (O 2) = ? (н.у.)
Количество кислорода n (O 2), который выделяется при разложении оксида ртути(II), составляет:
n (O 2) = 1/2 n (HgO) = 1/2 m (HgO) / M (HgO) = 108,5 / (217 . 2}
[г: (г/моль)] = 0,25 моль,
а его объем при н.у. — V (O 2) = n (O 2) . V M = 0,25 . 22,4
[моль. л/моль] = 5,6 л
Ответ. 0,25 моль, или 5,6 л (при н.у.) кислорода.
Задача 4. Важнейшая проблема в промышленном производстве удобрений — получение так называемого «связанного азота». В настоящее время ее решают путем синтеза аммиака из азота и водорода. Какой объем аммиака (при н.у.) можно получить в этом процессе, если объем исходного водорода равен 300 л, а практический выход (z) — 43 %?
Решение. Запишем уравнение реакции и условие задачи в формульном виде:
Запишем уравнение реакции и условие задачи в формульном виде:
N 2 + 3H 2 = 2NH 3
V (H 2) = 300 л; z(NH 3) = 43% = 0,43
V (NH 3) = ? (н.у.)
Объем аммиака V (NH 3), который можно получить в соответствии с условием задачи, составляет:
V (NH 3) практ = V (NH 3) теор. z(NH 3) = 2/3 . V (H 2) . z(NH 3) =
2/3 . 300 . 0,45 [л] = 86 л
Ответ. 86 л (при н.у.) аммиака.
Если приведенные здесь типовые задачи стали Вам совершенно понятны, приступайте к решению
Расчеты по уравнениям химических реакций — Учебник по Химии. 8 класс. Григорович
Учебник по Химии. 8 класс. Григорович — Новая программа
Вспомните: способы вычисления количества вещества по известной массе или объему (§ 24-26).
Когда повар готовит блюдо, он смешивает продукты в определенных соотношениях. Так и химик перед проведением химической реакции должен решить, в каком массовом соотношении следует смешать реагенты, и вычислить массу продукта, который должен образоваться.
Такие расчеты можно провести по уравнениям химических реакций. Если известна масса одного из веществ, участвующих в реакции, то можно определить массы всех других веществ — и реагентов, и продуктов реакции.
Химическое уравнение показывает, какие вещества и в каком соотношении взаимодействуют, а также в каком соотношении образуются продукты реакции. Например, уравнение реакции взаимодействия водорода с азотом
N2 + 3Н2 = 2NH3
показывает, что три молекулы водорода Н2 взаимодействуют с одной молекулой азота N2 с образованием двух молекул аммиака NH3 (рис. 31.1).
Рис. 31.1. Схематическое изображение количественного соотношения реагентов и продуктов реакции синтеза аммиака
Такое же соотношение будет и для количества вещества всех соединений в реакции: три моля водорода вступает в реакцию с одним молем азота, и при этом образуется два моля аммиака.
Если для проведения реакции взять не три моля водорода, а любое другое количество (например, 3х моль), то количество прореагировавшего азота будет в три раза меньше, чем количество водорода, т. е. n(N2) = х моль:
е. n(N2) = х моль:
n(H2) : n(N2) = 3х : х = 3 : 1
Таким образом, вещества вступают в химические реакции в количествах, пропорциональных их коэффициентам в уравнении реакции (стехиометрическим коэффициентам). Другими словами, соотношение количеств реагентов (в молях) равно соотношению соответствующих коэффициентов в уравнении реакции.
Рассмотрим уравнение реакции горения сероводорода:
2H2S + 3O2 = 2SO2 + 2Н2O
Мы видим, что два моля сероводорода реагирует с тремя молями кислорода с образованием двух молей сернистого газа и двух молей воды. Если в реакцию вступает х моль сероводорода, то соотношение реагентов и продуктов реакции выглядит так:
Таким образом, для любой химической реакции, которую можно описать уравнением:
аА + bВ = сС
справедливо соотношение для количества вещества всех участников реакции:
По этому соотношению можно проводить любые расчеты по уравнению химической реакции.
Задача 1. Какое количество вещества кислорода необходимо для сжигания сероводорода количеством 1,5 моль?
При проведении реакций необходимо знать не только количества веществ, но и их массы или объемы. Эти величины связаны соотношениями:
m = n • М;
V = n • Vm
Но задачи по уравнениям химических реакций проще решать с использованием количества вещества. Если в условии задачи даны масса или объем вещества, то удобнее сразу вычислить количество вещества и далее использовать эту величину для расчетов.
Задача 2. Вычислите объем азота (н. у.), необходимый для получения аммиака NH3 количеством 0,8 моль.
Задача 3. Вычислите массу фосфор(V) оксида, который можно получить сжиганием фосфора в кислороде объемом 11,2 л (н. у.).
Задача 4. Простое вещество массой 10,8 г сожгли, на что израсходовали кислород объемом 6,72 л (н. у.). В результате образовался оксид состава Е2O3. Какое вещество сожгли?
Выводы
Химические вещества вступают в химические реакции в четко определенных соотношениях. Количества веществ всех участников реакции соотносятся как их стехиометрические коэффициенты в уравнении реакции. Для реакции аA + bВ = сС справедливо соотношение:
Количества веществ всех участников реакции соотносятся как их стехиометрические коэффициенты в уравнении реакции. Для реакции аA + bВ = сС справедливо соотношение:
Задания для усвоения материала
1. Проанализируйте уравнение реакции горения метана аналогично тому, как это сделано в данном параграфе для реакции горения сероводорода.
2. В каком количественном соотношении следует смешать железо с серой для получения феррум(II) сульфида?
3. Определите соотношение количества вещества реагентов для получения купрум(II) оксида из простых веществ.
4. Вычислите количество вещества фосфор(V) оксида, который образуется при сгорании фосфора количеством вещества 2 моль. Какое количество вещества кислорода тратится при этом?
5. Определите количество вещества кальций гидроксида, который образуется при взаимодействии воды: а) с 0,5 моль кальций оксида; б) 8 г кальций оксида.
6. Составьте уравнение реакции сгорания аммиака NH3 в кислороде с образованием азота и воды. Вычислите объем кислорода (н. у.), который необходим для сжигания аммиака количеством 24 моль. Какой объем (н. у.) каждого из продуктов реакции при этом образуется?
Вычислите объем кислорода (н. у.), который необходим для сжигания аммиака количеством 24 моль. Какой объем (н. у.) каждого из продуктов реакции при этом образуется?
7. Вычислите массу кальций карбоната, который образуется при взаимодействии карбон(ІV) оксида объемом 11,2 л (н. у.) с кальций оксидом.
8. Вычислите массу сульфур(VІ) оксида, необходимую для получения сульфатной кислоты массой 4,9 г.
9. Вычислите массу гидроген пероксида, необходимую для получения кислорода объемом 5,6 л (н. у.).
10. Карбон(ІV) оксид можно получить сжиганием углерода или метана. Вычислите, какого вещества и во сколько раз больше (по массе) необходимо для получения карбон(ІV) оксида объемом 28 л (н. у.).
11. Вычислите массу ортофосфатной кислоты, которая образуется при взаимодействии фосфор(V) оксида массой 1 кг с водой.
12. При пропускании сульфур(ІV) оксида через раствор барий гидроксида образовалась соль массой 43,4 г. Вычислите объем (н. у.) израсходованного газа.
Химические формулы и уравнения | CPD
Вы когда-нибудь добавляли соль Эпсома в ванну, принимали магнезийное молоко от несварения желудка или клали цветы серы на свои розы? Вы, наверное, знаете химический состав этих продуктов, но как насчет спирта из рогового рога или купоросного масла? и не могли бы вы приготовить глауберову соль?
Эти алхимические имена могут вызывать воспоминания и загадочные, но они плохо передают химические знания. Хотя мы по-прежнему придерживаемся некоторых из этих названий, большинство химикатов теперь получают систематические названия на основе их состава.Несмотря на это, для начинающего химика аммиак и серная кислота могут быть столь же неоднозначными, как спирт из оленьего рога или купоросное масло. Даже систематические названия, такие как хлорид меди, дают лишь частичную информацию — количественное соотношение между элементами отсутствует.
Подобные проблемы существуют при описании реакций. Естественный язык очень хорош для именования вещей, но ему трудно выразить точные суммы, поэтому мы используем числа. Представьте, что вы пытаетесь ответить на вопрос: «Сколько вам лет?» Без использования цифр.
Представьте, что вы пытаетесь ответить на вопрос: «Сколько вам лет?» Без использования цифр.
В вашем классе
Загрузите учебное занятие по написанию формул для соединений неметаллов [MS PowerPoint или pdf] и рабочий лист для учащихся [MS Word].
Двести лет назад шведский химик Йенс Якоб Берцелиус ввел символическую систему для описания химического состава веществ. Символы, обычно это первые или первые два символа названия элемента, в сочетании с числами, чтобы показать относительные количества.Элементы в этих формулах соединены знаком +. Итак, оксид меди превратился в Cu + O, а вода в 2H + O. Эти формулы устранили как тайну состава, вызванную алхимическим названием, так и недостаток количественной информации. Система Берцелиуса с годами превратилась в химические формулы, которые мы знаем сегодня: CuO и H 2 O.
Что нужно знать студентам
Химические уравнения и формулы — важная часть изучения химии с 11-19. Умение правильно их использовать — это часть того, что значит быть химиком. Формулы и уравнения позволяют химикам эффективно передавать химические знания.
Умение правильно их использовать — это часть того, что значит быть химиком. Формулы и уравнения позволяют химикам эффективно передавать химические знания.
Студенты должны понимать, что химические формулы:
- дает название веществу — например, K 2 SO 4 — сульфат калия;
- содержит список элементов, входящих в состав вещества, например калий, серу и кислород;
- обеспечивает соотношение элементов в веществе — например, две части калия, 1 часть серы, 4 части кислорода;
и химические уравнения:
- описывают, как изменяются вещества — например, углерод + кислород → диоксид углерода становится C + O 2 → CO 2 ; Номер
- сообщает нам соотношение реагентов и продуктов в реакции — например, 2Mg + O 2 → 2MgO означает, что две партии магния вступают в реакцию с одной партией кислорода, давая две партии оксида магния;
- может включать государственные символы — (g), (l), (s) и (aq) — которые могут помочь учащимся визуализировать реакцию и объяснить наблюдения.

Студенты должны уметь:
- Напишите формулы элементов и простых соединений, используя химические символы и числа. Код
- называет простые соединения по химической формуле, используя такие префиксы, как моно-, ди-, три- и такие слова, как оксид, хлорид, гидроксид, сульфат, нитрат и карбонат.
- построить словесные уравнения для реакций.
- представляют реагенты и продукты химической реакции в сбалансированном уравнении.
Идеи для вашего класса
Общая последовательность обучения формулам и уравнениям может быть:
- проводить простые реакции в пробирках или на микроуровне;
- выучить общие словесные уравнения для химических реакций;
- научиться писать конкретные словесные уравнения;
- научиться составлять химические формулы;
- и используйте химические формулы и слово уравнение для построения сбалансированных химических уравнений.
На сайте Learn Chemistry можно найти два отличных ресурса для обучения написанию словесных уравнений.
Когда учащиеся научатся пользоваться словесными уравнениями, вы можете переходить к написанию химических формул. К сожалению, названия некоторых веществ не всегда переводятся непосредственно в химические формулы. Например, формулы воды, метана, аммиака, азотной кислоты и т. Д. Придется выучить наизусть. Покажите имена и формулы и дайте учащимся стратегии их запоминания.
Наименование неметаллических соединений начинается с понимания приставок моно-, ди-, три- и т. Д. Свяжите их со словами из повседневной жизни и посмотрите, сколько учеников могут придумать. Затем разбейте формулы некоторых соединений, о которых они, возможно, уже слышали. Например, углекислый газ в виде углерода с двумя атомами кислорода. Потребуется множество примеров, чтобы помочь студентам развить мастерство этих обращений. Затем вы можете попросить студентов придумать свои собственные примеры и предложить своим сверстникам преобразовать их.
Наконец, вы можете перейти к именованию солей и ионных соединений. Опять же, потребуется некоторое механическое заучивание, чтобы убедиться, что они знают названия многоатомных ионов, таких как аммоний, гидроксид и карбонат.
Опять же, потребуется некоторое механическое заучивание, чтобы убедиться, что они знают названия многоатомных ионов, таких как аммоний, гидроксид и карбонат.
Распространенные заблуждения
- Все формулы представляют молекулы, например, «NaCl означает молекулы хлорида натрия».
- Не распознает многоатомные ионы как отдельные химические соединения, например, MgSO 4 , названный тетроксидом серы магния, а не сульфатом магния.
- Принимая многоатомные ионы за элементы, например, «Я не могу найти гидроксид в периодической таблице».
- Перемешивание символа элемента, например Cl, и его формулы как вещества, например Cl 2 . Это может быть осложнено использованием символа элемента для гигантских структур — например, алмаза в виде C и железа Fe — и некоторых, казалось бы, нелогичных исключений, например, S 8 и P 4 .
- Смешение формулы вещества с химическим уравнением его образования.
 Например, ответьте «водород + кислород → вода» на вопрос о формуле воды. Это заблуждение происходит из математики, где эти два слова часто используются как синонимы, и из повседневной жизни, где словесная формула часто ассоциируется с тем, как что-то делается.
Например, ответьте «водород + кислород → вода» на вопрос о формуле воды. Это заблуждение происходит из математики, где эти два слова часто используются как синонимы, и из повседневной жизни, где словесная формула часто ассоциируется с тем, как что-то делается. - Студенты часто испытывают трудности с числовыми соотношениями в уравнениях и формулах, это может затруднить балансирование уравнений и химических расчетов.
Формирующее оценивание
Написание формул и уравнений — это не тот навык, который можно развить после одного или двух уроков.Это навык, который должен быть постоянной частью уроков химии. Используйте регулярное тестирование с низкими ставками словесных уравнений и простых химических уравнений наряду с отзывом формул. Сосредоточьтесь на двухатомных элементах, а также на обычных кислотах, основаниях и солях, чтобы помочь учащимся получить общие химические знания и повысить уверенность в себе. Популярны игры в бинго по формулам или уравнениям, а мини-доски полезны для быстрой формирующей оценки.
Очков на вынос
- Формулы — это не просто сокращение химического названия, но и информация об относительных количествах элементов в веществе.
- Формулы некоторых соединений не могут быть получены из названия вещества, и их необходимо выучить.
- Написание химических формул и уравнений требует частого подкрепления.
- Не торопитесь писать сбалансированные уравнения. Помогите студентам сначала научиться писать формулы и словесные уравнения.
Переход к 14‒16
Когда учащиеся научатся писать формулы и сбалансированные химические уравнения, их можно расширить, включив в них написание ионных уравнений для реакций осаждения и полууравнений для электрохимических и окислительно-восстановительных процессов.
На этом уровне формулы и уравнения используются для выполнения многих химических расчетов, включая относительную формульную массу, количество молей вещества, реакционную массу и расчеты титрования. Овладение этими формулами и уравнениями помогает сгладить выполнение этих расчетов.
Олли Хантер — руководитель отдела химии и координатор EPQ в школе Бененден, Кент, и студент-неполный рабочий день на педагогическом факультете Кембриджского университета
Что скрывается в формулах и уравнениях?
Уравновешивание уравнений и выполнение химических расчетов требуют четкого понимания роли чисел в формулах.Разница между числами перед и числами в формуле может вызвать путаницу.
Число в формуле означает число, кратное элементу (или группам элементов) слева от числа.
Таким образом, формула гидроксида меди Cu (OH) 2 читается как:
1 x Cu + 2 x (O + H) или Cu + 2 x O + 2 x H
Более сложная формула, такая как сульфат аммония (NH 4 ) 2 SO 4 , читается как:
2 x (N + (4 x H)) + 1 x S + 4 x O или 2 x N + 8 x H + S + 4 x O
Число, стоящее перед формулой в уравнении, говорит нам, сколько молекул (или молей) вещества вступают в реакцию. Например, в уравнении 2H 2 + O 2 → 2H 2 O читается как:
Например, в уравнении 2H 2 + O 2 → 2H 2 O читается как:
2 x H 2 + 1 x O 2 → 2 x (H 2 O)
или
две молекулы водорода реагируют с одной молекулой кислорода с образованием двух молекул воды.
Имейте в виду, что некоторые ученики предполагают, что число перед химической формулой является частью формулы или относится только к первому элементу. Например, интерпретация 2NaOH как:
’2NaOH — это формула гидроксида натрия’ или 2 x Na + O + H
Моль в химических реакциях — Введение в химию — 1-е канадское издание
- Выровняйте химическое уравнение в молях.
- Используйте сбалансированное уравнение для построения коэффициентов пересчета в молях.
- Вычислите количество молей одного вещества из молей другого вещества, используя сбалансированное химическое уравнение.
Рассмотрим это вычисленное химическое уравнение:
2H 2 + O 2 → 2H 2 O
Мы интерпретируем это как «две молекулы водорода реагируют с одной молекулой кислорода с образованием двух молекул воды». Химическое уравнение сбалансировано, пока коэффициенты находятся в соотношении 2: 1: 2.Например, это химическое уравнение также сбалансировано:
Химическое уравнение сбалансировано, пока коэффициенты находятся в соотношении 2: 1: 2.Например, это химическое уравнение также сбалансировано:
100H 2 + 50O 2 → 100H 2 O
Это уравнение не является общепринятым — потому что по соглашению мы используем наименьшее отношение коэффициентов, — но оно сбалансировано. Итак, это химическое уравнение:
5,000H 2 + 2,500O 2 → 5,000H 2 O
Опять же, это нетипично, но все же сбалансировано. Предположим, мы используем гораздо большее число:
.12.044 × 10 23 H 2 + 6.022 × 10 23 O 2 → 12.044 × 10 23 H 2 O
Эти коэффициенты также находятся в соотношении 2: 1: 2. Но эти числа связаны с количеством вещей в родинке: первое и последнее числа в два раза больше числа Авогадро, а второе число — числа Авогадро. Это означает, что первое и последнее числа представляют 2 моля, а среднее число — всего 1 моль. Почему бы просто не использовать количество молей для уравновешивания химического уравнения?
Почему бы просто не использовать количество молей для уравновешивания химического уравнения?
2H 2 + O 2 → 2H 2 O
Это то же самое сбалансированное химическое уравнение, с которого мы начали! Это означает, что химические уравнения сбалансированы не только с точки зрения молекул; они также уравновешены по количеству молей .Мы можем так же легко прочитать это химическое уравнение, как «два моля водорода реагируют с одним моль кислорода, образуя два моля воды». Все сбалансированные химические реакции сбалансированы с точки зрения молей.
Интерпретируйте это сбалансированное химическое уравнение в молях.
п. 4 + 5O 2 → п. 4 O 10
Решение
Коэффициенты представляют количество вступающих в реакцию молей, а не только молекул. Мы бы назвали это уравнение следующим образом: «Один моль молекулярного фосфора реагирует с пятью молями элементарного кислорода, образуя один моль декоксида тетрафосфора.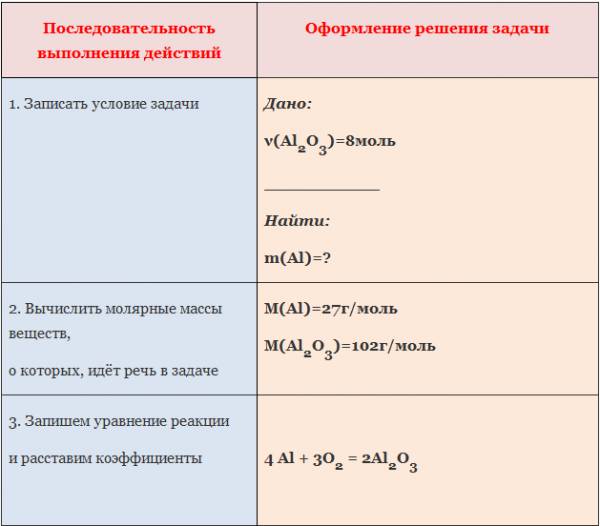 ”
”
Интерпретируйте это сбалансированное химическое уравнение в молях.
N 2 + 3H 2 → 2NH 3
Ответ
Один моль элементарного азота реагирует с тремя молями элементарного водорода с образованием двух молей аммиака.
В главе 4 «Химические реакции и уравнения» в разделе «Химическое уравнение» мы заявили, что химическое уравнение — это просто рецепт химической реакции. Таким образом, химические уравнения также дают нам эквивалентности — эквивалентности между реагентами и продуктами.Однако теперь мы понимаем, что эти эквиваленты выражены в молях . Рассмотрим следующее химическое уравнение:
2H 2 + O 2 → 2H 2 O
Эта химическая реакция дает нам следующие эквиваленты:
2 моль H 2 ⇔ 1 моль O 2 ⇔ 2 моль H 2 O
Любые две из этих величин могут быть использованы для построения коэффициента пересчета, который позволяет нам связать количество молей одного вещества с эквивалентным количеством молей другого вещества. Если, например, мы хотим знать, сколько молей кислорода будет реагировать с 17,6 моль водорода, мы рассчитываем коэффициент преобразования между 2 молями H 2 и 1 моль O 2 и используем его для преобразования из молей отношения одного вещества к молям другого:
Если, например, мы хотим знать, сколько молей кислорода будет реагировать с 17,6 моль водорода, мы рассчитываем коэффициент преобразования между 2 молями H 2 и 1 моль O 2 и используем его для преобразования из молей отношения одного вещества к молям другого:
Обратите внимание, как моль H 2 аннулируется, а моль O 2 — это новая введенная единица. Это пример расчета моль-моль, когда вы начинаете с молей одного вещества и конвертируете в моли другого вещества с помощью сбалансированного химического уравнения.Пример может показаться простым, потому что числа маленькие, но числа не всегда будут такими простыми!
Рассмотрим следующее вычисленное химическое уравнение:
2C 4 H 10 (г) + 13O 2 → 8CO 2 (г) + 10H 2 O (ℓ)
Если в реакцию вступает 154 моль O 2 , сколько моль CO 2 образуется?
Решение
Мы связываем количество кислорода с количеством углекислого газа, поэтому нам нужна эквивалентность между этими двумя веществами. Согласно сбалансированному химическому уравнению эквивалентность:
Согласно сбалансированному химическому уравнению эквивалентность:
13 моль O 2 ⇔ 8 моль CO 2
Мы можем использовать эту эквивалентность для построения надлежащего коэффициента преобразования. Начнем с того, что нам дано, и применим коэффициент преобразования:
Единица моль O 2 стоит в знаменателе коэффициента преобразования, поэтому она отменяется. И 8, и 13 являются точными числами, поэтому они не влияют на количество значащих цифр в окончательном ответе.
Используя приведенное выше уравнение, сколько молей H 2 O образуется при реакции 154 моль O 2 ?
Ответ
118 моль
Важно повторить, что сбалансированные химические уравнения сбалансированы в терминах молей . Не граммы, килограммы или литры, а моль. Любая проблема стехиометрии, вероятно, в какой-то момент должна будет разрешиться через моль, особенно если вы работаете со сбалансированной химической реакцией.
- Сбалансированные химические реакции сбалансированы по молям.
- Сбалансированная химическая реакция дает эквивалентность в молях, что позволяет проводить расчеты стехиометрии.
- Выразите в молях, что означает это химическое уравнение.
CH 4 + 2O 2 → CO 2 + 2H 2 O
- Выразите в молях, что означает это химическое уравнение.
Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2
- Сколько молекул каждого вещества входит в уравнение в упражнении 1, если его интерпретировать с точки зрения молей?
- Сколько молекул каждого вещества входит в уравнение в упражнении 2, если его интерпретировать с точки зрения молей?
- Для химического уравнения 2C 2 H 6 + 7O 2 → 4CO 2 + 6H 2 O, какие эквиваленты можно записать в молях? Используйте знак ⇔.

- Какие эквиваленты можно записать в молях для химического уравнения 2Al + 3Cl 2 → 2AlCl 3 ? Используйте знак ⇔.
- Напишите сбалансированную химическую реакцию для горения C 5 H 12 (продукты — CO 2 и H 2 O) и определите, сколько молей H 2 O образуется при 5,8 моль O 2 реагируют.
- Напишите сбалансированную химическую реакцию образования Fe 2 (SO 4 ) 3 из Fe 2 O 3 и SO 3 и определите, сколько молей Fe 2 (SO 4 ) 3 образуются при 12.В реакцию вступает 7 моль SO 3 .
- Для вычисленного химического уравнения 3Cu (s) + 2NO 3 — (aq) + 8H + (aq) → 3Cu 2+ (aq) + 4H 2 O (ℓ) + 2NO ( ж), сколько молей Cu 2+ образуется при реакции 55,7 моль H + ?
- Для вычисленного химического уравнения Al (s) + 3Ag + (водн.
 ) → Al 3+ (aq) + 3Ag (s), сколько молей Ag образуется при реакции 0,661 моль Al?
) → Al 3+ (aq) + 3Ag (s), сколько молей Ag образуется при реакции 0,661 моль Al? - Для сбалансированной химической реакции 4NH 3 (г) + 5O 2 (г) → 4NO (г) + 6H 2 O (ℓ), сколько молей H 2 O образуется при 0.669 моль NH 3 реагируют?
- Для сбалансированной химической реакции 4NaOH (водн.) + 2S (s) + 3O 2 (г) → 2Na 2 SO 4 (водн.) + 2H 2 O (ℓ), сколько молей Na 2 SO 4 образуются при взаимодействии 1,22 моль O 2 ?
- Для сбалансированной химической реакции 4KO 2 (s) + 2CO 2 (g) → 2K 2 CO 3 (s) + 3O 2 (g), определите количество молей обоих продуктов сформировался, когда 6.Реакция взаимодействия 88 моль КО 2 .
- Для сбалансированной химической реакции 2AlCl 3 + 3H 2 O (ℓ) → Al 2 O 3 + 6HCl (г), определите количество молей обоих продуктов, образовавшихся при 0,0552 моль AlCl 3 реагировать.

- Один моль CH 4 реагирует с 2 молями O 2 с образованием 1 моля CO 2 и 2 моль H 2 O.
- 6.022 × 10 23 молекулы CH 4 , 1.2044 × 10 24 молекулы O 2 , 6.022 × 10 23 молекулы CO 2 и 1.2044 × 10 24 молекулы H 2 O
- 2 моль C 2 H 6 7 моль O 2 ⇔ 4 моль CO 2 ⇔ 6 моль H 2 O
- C 5 H 12 + 8 O 2 → 5CO 2 + 6H 2 O; 4,4 моль
- 20,9 моль
- 1.00 моль
- 3,44 моль K 2 CO 3 ; 5,16 моль O 2
химических реакций | Grandinetti Group
Как мы узнали ранее, наиболее фундаментальными строительными блоками материи для химиков являются атомы (то есть элементы, которые вы видите в периодической таблице). Мы также узнали, что атомы могут соединяться с другими атомами за счет химической связи, образуя молекулы. Напомним, что процесс, при котором одна молекула превращается в другую, называется химическим изменением .Этот процесс химического изменения представлен химической реакцией . Например,
Мы также узнали, что атомы могут соединяться с другими атомами за счет химической связи, образуя молекулы. Напомним, что процесс, при котором одна молекула превращается в другую, называется химическим изменением .Этот процесс химического изменения представлен химической реакцией . Например,
Важно помнить, что в то время как в химической реакции молекулы разрушаются и создаются путем разрыва и образования химических связей, атомы не создаются и не разрушаются в химической реакции. Другими словами, должно быть одинаковое количество атомов каждого типа на продуктивной и реагирующей сторонах стрелки. Убедиться, что это правило соблюдается, называется «уравновешивание химического уравнения».В приведенном выше примере уравнение было бы несбалансированным без 2 перед O 2 и H 2 O. Мы можем составить таблицу, чтобы подтвердить, что количество атомов с каждой стороны стрелки одинаково:
| Реагенты | Продукты | Сбалансированные? | |||
|---|---|---|---|---|---|
| 1 C | 1 C | да | |||
| 4 H | 4 H | да | |||
| 4 O | 4 O | 9 да | 9 да | изменить химическую формулу любого продукта или реагента, пытаясь сбалансировать химическое уравнение.
ДОМ Главы курса Основы калькулятора Математика Обзор Основные понятия Расширенные концепцииРаздел Тесты Предварительное испытание Пост-тест Полезные материалы Глоссарий Онлайн-калькуляторы Калькулятор окислительно-восстановительного потенциала Калькулятор кинетики Аррениуса Калькулятор термодинамики Калькулятор ядерного распада Регрессия методом наименьших квадратов Решатель уравнений метода Ньютона Калькулятор сжимаемости Калькулятор перевода единиц Калькулятор номенклатуры Ссылки по теме Калькуляторы Texas Instruments Калькуляторы Casio Калькуляторы Sharp Калькуляторы Hewlett Packard Кредиты Связаться с веб-мастером | Стехиометрия — это математика, лежащая в основе химии. Имея достаточно информации, можно использовать стехиометрию для вычисления масс, молей и процентов в рамках химического уравнения. Имея достаточно информации, можно использовать стехиометрию для вычисления масс, молей и процентов в рамках химического уравнения. Что такое химическое уравнение Молла Уравновешивающие химические уравнения Ограничивающие реагенты Процентный состав Эмпирические и молекулярные формулы Плотность Концентрации растворов В химии мы используем символы для обозначения различных химических веществ. Успех в химии зависит от знакомства с этими основными символами.Например, символ «С» представляет собой атом углерода, а «H» представляет собой атом водорода. Чтобы представить молекулу поваренной соли, хлорида натрия, мы будем использовать обозначение «NaCl», где «Na» представляет натрий, а «Cl» представляет собой хлор. Мы называем хлор «хлоридом» в этом случае из-за его связи с натрием. У вас будет возможность просмотреть схемы именования или номенклатуру при более позднем чтении. Химическое уравнение — это выражение химического процесса. В этом уравнении AgNO 3 смешан с NaCl. Уравнение показывает, что реагенты (AgNO 3 и NaCl) реагируют посредством некоторого процесса (—>) с образованием продуктов (AgCl и NaNO 3 ). Поскольку они подвергаются химическому процессу, они коренным образом изменяются. Часто составляются химические уравнения, показывающие состояние, в котором находится каждое вещество.Знак (s) означает, что соединение является твердым. Знак (l) означает, что вещество является жидкостью. Знак (aq) обозначает водный раствор в воде и означает, что соединение растворено в воде. Наконец, знак (g) означает, что соединение представляет собой газ. Коэффициенты используются во всех химических уравнениях, чтобы показать относительные количества каждого присутствующего вещества. Это количество может представлять либо относительное количество молекул, либо относительное количество молекул. В некоторых случаях над или под стрелками будет написана различная информация. Эта информация, например значение температуры, показывает, какие условия должны присутствовать для возникновения реакции. Например, на приведенном ниже графике обозначения над и под стрелками показывают, что нам нужен химикат Fe 2 O 3 , температура 1000 градусов C и давление 500 атмосфер, чтобы эта реакция протекала. На приведенном ниже рисунке отражено большинство концепций, описанных выше: Учитывая приведенное выше уравнение, мы можем определить количество молей реагентов и продуктов. Моль просто представляет собой число молекул Авогадро (6,023 x 10 23 ). Родинка похожа на термин, подобный дюжине. Если у вас есть дюжина морковок, у вас есть двенадцать е из них. Точно так же, если у вас есть родинка моркови, у вас есть 6,023 x 10 23 моркови. В приведенном выше уравнении перед членами нет цифр, поэтому предполагается, что каждый коэффициент равен единице (1).Таким образом, у вас одинаковое количество молей Ag
НЕТ 3 , NaCl, AgCl, NaNO 3 . В приведенном выше уравнении перед членами нет цифр, поэтому предполагается, что каждый коэффициент равен единице (1).Таким образом, у вас одинаковое количество молей Ag
НЕТ 3 , NaCl, AgCl, NaNO 3 .Часто важно преобразовать моль в граммы вещества. Это преобразование может быть легко выполнено, когда атомарный и / или молекулярный масса вещества (веществ) известна. Атомный или молекулярный масса вещества в граммах составляет один моль вещества. Например, кальций имеет атомный вес 40 граммов. Итак, 40 грамм кальция составляют один моль, 80 грамм — два моля и т. д. Иногда, однако, нам нужно проделать некоторую работу, прежде чем использовать коэффициенты членов, чтобы представить относительное количество молекул каждого соединения. Это тот случай, когда уравнения не являются пр отлично сбалансирован. Мы будем рассматривать следующее уравнение: Al + Fe 3 O 4 —> Al 2 O 3 Поскольку перед любым из членов нет коэффициентов, легко предположить, что один (1) моль Al и один (1) моль Fe 3 0 4 реагируют с образованием одного (1) моля Al 2 0 3 . Уравновешивание химического уравнения в основном осуществляется методом проб и ошибок. Есть много разных способов и систем сделать это, но для всех методов важно знать, как подсчитать количество атомов в уравнении. Например, мы рассмотрим следующий срок. 2Fe 3 O 4 Этот термин обозначает две (2) молекулы Fe 3 O 4 .В каждой молекуле этого вещества есть три (3) атома Fe. Теперь давайте попробуем сбалансировать уравнение, упомянутое ранее: Al + Fe 3 O 4 —> Al 2 O 3 + Fe Разработка стратегии может быть трудной, но вот один из способов решения такой проблемы.
Пример: у химика есть только 6,0 граммов C 2 H 2 и неограниченная подача кислорода, и он желает произвести как можно больше CO 2 . Если она воспользуется приведенным ниже уравнением, сколько кислорода ей следует добавить в реакцию? 2C 2 H 2 (г) + 5O 2 (г) —> 4CO 2 (г) + 2 H 2 O (л) Чтобы решить эту проблему, необходимо определить, сколько кислорода должно
может быть добавлен, если все реагенты были израсходованы (так можно получить максимальное количество CO 2 ). Затем, поскольку на каждые две (2) молекулы C 2 H 2 приходится пять (5) молекул кислорода, нам нужно умножить моль C 2 H 2 на 5/2, чтобы получить общее количество молей кислорода, которое будет использовано для реакции со всеми C 2 H 2 . Затем мы переводим моли кислорода в граммы, чтобы найти количество кислорода, которое необходимо добавить: Можно рассчитать молярные отношения (также называемые мольными долями) между членами химического уравнения, если задан массовый процент продуктов или реагентов.  процент по массе = масса части / масса целого
Есть два типа задач процентного состава — задачи, в которых вам дается формула (или вес каждой части) и просят вычислить процентное содержание каждого элемента.
и задачи, в которых вам задают проценты и просят вычислить формулу. процент по массе = масса части / масса целого
Есть два типа задач процентного состава — задачи, в которых вам дается формула (или вес каждой части) и просят вычислить процентное содержание каждого элемента.
и задачи, в которых вам задают проценты и просят вычислить формулу. Есть много возможных решений проблем процентного состава. Всегда есть возможность удвоить ответ. Например, CH и C 2 H 2 имеют одинаковые пропорции, но представляют собой разные соединения.Стандартно давать составы в их простейшей форме, где соотношение между элементами как
сокращенная, как это можно назвать — эмпирическая формула. При расчете эмпирической формулы на основе процентного состава, можно преобразовать проценты в граммы. Например, это обычно проще всего предположить, что у вас 100 граммов, поэтому 54,3% превратились бы в 54,3 грамма. Затем мы можем преобразовать массы в моль, что даст нам мольные отношения.
Надо сводить к целым числам.Хороший прием — разделить все члены на наименьшее количество родинок. Пример: если соединение состоит на 47,3% C (углерод), 10,6% H (водород) и 42,0% S (сера), какова его эмпирическая формула? Теперь мы пытаемся получить четное соотношение между элементами, поэтому делим на количество молей серы, потому что это наименьшее число: Итак, имеем: C 3 H 8 S Пример: Определите массовое процентное содержание сероводорода, H 2 SO 4 . Теперь мы можем проверить, что в сумме проценты составляют 100% По сути, это 100, поэтому мы знаем, что все работает, и, вероятно, мы не сделали никаких ошибок по неосторожности. Итак, ответ таков: H 2 SO 4 состоит из 2,06% H, 32,7% S и 65,2% O по массе. Хотя эмпирическая формула представляет собой простейшую форму соединения, Молекулярная формула — это форма термина в том виде, в котором он употребляется в химическом уравнение. Эмпирическая формула и молекулярная формула могут быть то же самое, или молекулярная формула может быть любым, кратным эмпирическим формула. Примеры эмпирических формул: AgBr, Na 2 S, C 6 H 10 O 5 .Примеры молекулярных формул: P 2 , C 2 O 4 , C 6 H 14 S 2 , H 2 , C 3 H 9 . Эмпирическую формулу можно рассчитать, исходя из массового или процентного состава любого соединения. Пример: рассчитайте эмпирическую формулу для соединения, имеющего 43.7 г P (фосфора) и 56,3 грамма кислорода. Сначала конвертируем в родинки: Затем мы разделяем родинки, чтобы добиться равномерного соотношения. Когда мы делим, мы не получаем целых чисел, поэтому мы должны умножать их на два (2). Ответ = P 2 O 5 Вычислить молекулярную формулу, когда у нас есть эмпирическая формула, несложно.
Если мы знаем эмпирическую формулу соединения, все, что нам нужно сделать, это разделить
молекулярная масса соединения по массе эмпирической формулы.Это также можно сделать с помощью одного из элементов формулы;
просто разделите массу этого элемента в одном моль соединения на массу
этого элемента в эмпирической формуле. Результат всегда должен быть
целое число. Пример: если мы знаем, что эмпирическая формула соединения — это HCN, и нам говорят, что для получения соединения необходимо 2,016 грамма водорода, какова его молекулярная формула? В эмпирической формуле водород весит 1,008 грамма.Разделив 2.016 на 1.008 мы видим, что водорода требуется вдвое больше. Следовательно, эмпирическую формулу необходимо увеличить в два раза (2). Ответ: Концентрация раствора — это «сила» раствора. Раствор обычно относится к растворению некоторого твердого вещества в жидкости, например к растворению соли в воде.Также часто необходимо выяснить, сколько воды нужно добавить в раствор, чтобы довести его до определенной концентрации. Концентрация раствора обычно выражается в молярности.
Молярность определяется как количество молей растворенного вещества (что такое
фактически растворено в растворе), деленное на литры раствора (общий объем того, что растворено и в чем оно было растворено). Пример: если 5,00 граммов NaOH растворяются в 5000 мл воды, какова молярность раствора? Таким образом, молярность (М) раствора составляет 0,025 моль / л. Моляльность — еще одно распространенное измерение концентрации. Моляльность определяется как количество молей растворенного вещества, деленное на килограммы растворителя. (вещество, в котором он растворен, как вода). Иногда вместо молярности при экстремальных температурах используется молярность, поскольку объем может сжиматься или расширяться. Пример: Если моляльность раствора C 2 H 5 OH, растворенного в воде, составляет 1,5, а вес воды составляет 11,7 кг, вычислите, сколько C 2 H 5 OH должно было быть добавляли в раствор в граммах? Пример: если молярность раствора составляет 0,30 М, вычислить моляльность.
раствора, зная, что плотность составляет 3,25 г / мл. Где:
T — понижение температуры (для точки замерзания) или температурное расширение (для точки кипения) (° C) Пример: если точка замерзания соленой воды на дорогах составляет -5. Т = К * м Практические задачи1. Если доступно только 0,25 молярного NaOH и воды, сколько NaOH нужно добавить, чтобы получить 10 литров 0.2 молярный раствор NaOH?Проверьте свою работу 2. Если 2,0 моля сахарозы весом 684 грамма поместить в 1000 граммов воды и затем растворить, какой будет молярность раствора? Проверьте свою работу. 3. Если у вас 0,25 молярный раствор бензола с плотностью 15 грамм / литр, рассчитайте моляльность раствора. Проверьте свою работу 4. Если плотность ртути составляет 13,534 г / см 2 и у вас 62,5 см 3 ртути, сколько граммов, молей и атомов ртути у вас есть? (Масса Меркурия 200. [Базовый указатель] [Атомная структура] [Стехиометрия] [Кислотно-основной химический состав] [Номенклатура] |
% PDF-1.7
%
3008 0 объект
>
эндобдж
xref
3008 82
0000000016 00000 н.
0000004624 00000 н.
0000004859 00000 н.
0000004896 00000 н.
0000008046 00000 н.
0000008161 00000 п.
0000008280 00000 н.
0000008437 00000 н.
0000008486 00000 н.
0000008515 00000 н.
0000008554 00000 н.
0000009454 00000 п.
0000009987 00000 н.
0000010346 00000 п.
0000010795 00000 п.
0000010908 00000 п.
0000011515 00000 п.
0000011772 00000 п.
0000012217 00000 п.
0000012890 00000 н.
0000013451 00000 п.
0000013702 00000 п.
0000014147 00000 п.
0000014513 00000 п.
0000014617 00000 п.
0000014703 00000 п.
0000015383 00000 п.
0000016267 00000 п.
0000016973 00000 п.
0000017770 00000 п.
0000017904 00000 п.
0000017933 00000 п.
0000018264 00000 п.
0000018968 00000 п.
0000019631 00000 п.
0000020269 00000 п. 0000022636 00000 п.
0000023375 00000 п.
0000028397 00000 п.
0000059658 00000 п.
0000059852 00000 п.
0000060116 00000 п.
0000060504 00000 п.
0000060892 00000 п.
0000072016 00000 п.
0000072105 00000 п.
0000072161 00000 п.
0000095211 00000 п.
0000095282 00000 п.
0000097932 00000 п.
0000100185 00000 н.
0000102438 00000 п.
0000116362 00000 н.
0000119624 00000 н.
0000120012 00000 н.
0000120111 00000 п.
0000120268 00000 н.
0000120376 00000 н.
0000120486 00000 н.
0000120874 00000 н.
0000121266 00000 н.
0000121388 00000 н.
0000121545 00000 н.
0000121662 00000 н.
0000142545 00000 н.
0000142586 00000 н.
0000143775 00000 н.
0000143816 00000 н.
0000144197 00000 н.
0000144296 00000 н.
0000144445 00000 н.
0000144602 00000 н.
0000144694 00000 н.
0000144793 00000 н.
0000144950 00000 н.
0000145042 00000 н.
0000145141 00000 н.
0000145298 00000 н.
0000147091 00000 н.
0000209582 00000 н.
0000004397 00000 н.
0000001974 00000 н.
трейлер
] / Назад 4699344 / XRefStm 4397 >>
startxref
0
%% EOF
3089 0 объект
> поток
h Wkp {% {ҮJfjC4I
+% ٲ e) 5 /! 0 ㆔ $ yhm (4N 3̴ә6tѳ + ۲WF |; | JQAM: P = j @ Fpw; Y4owVcbjZiMYaWn ‘{V | tC3 {m #> 6n = + îsgv @ ˷ @ ^ — Kĉ / l7Pbʭ > Rx [͏ | 4 {̊kyOM? SONLG4Earcgm & fԐ% 7vԘIvw9hl * OWlta7) df; lNpmF
~ Wj) B_VEru4X4lDY];
0000022636 00000 п.
0000023375 00000 п.
0000028397 00000 п.
0000059658 00000 п.
0000059852 00000 п.
0000060116 00000 п.
0000060504 00000 п.
0000060892 00000 п.
0000072016 00000 п.
0000072105 00000 п.
0000072161 00000 п.
0000095211 00000 п.
0000095282 00000 п.
0000097932 00000 п.
0000100185 00000 н.
0000102438 00000 п.
0000116362 00000 н.
0000119624 00000 н.
0000120012 00000 н.
0000120111 00000 п.
0000120268 00000 н.
0000120376 00000 н.
0000120486 00000 н.
0000120874 00000 н.
0000121266 00000 н.
0000121388 00000 н.
0000121545 00000 н.
0000121662 00000 н.
0000142545 00000 н.
0000142586 00000 н.
0000143775 00000 н.
0000143816 00000 н.
0000144197 00000 н.
0000144296 00000 н.
0000144445 00000 н.
0000144602 00000 н.
0000144694 00000 н.
0000144793 00000 н.
0000144950 00000 н.
0000145042 00000 н.
0000145141 00000 н.
0000145298 00000 н.
0000147091 00000 н.
0000209582 00000 н.
0000004397 00000 н.
0000001974 00000 н.
трейлер
] / Назад 4699344 / XRefStm 4397 >>
startxref
0
%% EOF
3089 0 объект
> поток
h Wkp {% {ҮJfjC4I
+% ٲ e) 5 /! 0 ㆔ $ yhm (4N 3̴ә6tѳ + ۲WF |; | JQAM: P = j @ Fpw; Y4owVcbjZiMYaWn ‘{V | tC3 {m #> 6n = + îsgv @ ˷ @ ^ — Kĉ / l7Pbʭ > Rx [͏ | 4 {̊kyOM? SONLG4Earcgm & fԐ% 7vԘIvw9hl * OWlta7) df; lNpmF
~ Wj) B_VEru4X4lDY];
Глава 6 — Количества в химических реакциях — Химия
Глава 6 — Количества в химических реакциях Этот текст опубликован под лицензией Creative Commons, для ссылки и адаптации нажмите здесь.
6.1: Введение в главу
До сих пор мы говорили о химических реакциях в терминах отдельных атомов и молекул.Хотя это работает, в большинстве реакций, происходящих вокруг нас, задействовано гораздо большее количество химикатов. Даже крошечный образец вещества будет содержать миллионы, миллиарды или сто миллиардов миллиардов атомов и молекул. Как мы можем сравнить количество веществ друг с другом в химическом отношении, если так сложно сосчитать до ста миллиардов миллиардов?
На самом деле есть способы сделать это, и мы рассмотрим их в этой главе. Поступая так, мы расширим наше понимание стехиометрии, которая представляет собой изучение числовых соотношений между реагентами и продуктами в сбалансированной химической реакции.
Поступая так, мы расширим наше понимание стехиометрии, которая представляет собой изучение числовых соотношений между реагентами и продуктами в сбалансированной химической реакции.
6.2: Крот
Рисунок 6.1 «Молекулы воды» показывает, что нам нужны 2 атома водорода и 1 атом кислорода, чтобы образовать 1 молекулу воды. Если мы хотим получить 2 молекулы воды, нам понадобится 4 атома водорода и 2 атома кислорода. Если мы хотим получить 5 молекул воды, нам нужно 10 атомов водорода и 5 атомов кислорода. Соотношение атомов, которые нам понадобятся для образования любого количества молекул воды, одинаково: 2 атома водорода на 1 атом кислорода.
Рис. 6.1. Молекулы воды: Отношение атомов водорода к атомам кислорода, используемых для образования молекул воды, всегда составляет 2: 1, независимо от того, сколько молекул воды производится.
Однако у нас есть проблема в том, что чрезвычайно сложно, если не невозможно, организовать атомы по одному. Как сказано во введении, мы имеем дело с миллиардами атомов одновременно. Как мы можем отслеживать так много атомов (и молекул) одновременно? Мы делаем это, используя массу, а не подсчитывая отдельные атомы.
Как сказано во введении, мы имеем дело с миллиардами атомов одновременно. Как мы можем отслеживать так много атомов (и молекул) одновременно? Мы делаем это, используя массу, а не подсчитывая отдельные атомы.
Атом водорода имеет массу примерно 1 ед. Атом кислорода имеет массу примерно 16 единиц. Следовательно, отношение массы атома кислорода к массе атома водорода составляет примерно 16: 1.
Если у нас есть 2 атома каждого элемента, соотношение их масс будет примерно 32: 2, что уменьшится до 16: 1 — такое же соотношение. Если у нас есть 12 атомов каждого элемента, отношение их общих масс будет приблизительно (12 × 16) 🙁 12 × 1), или 192: 12, что также уменьшается до 16: 1. Если у нас есть 100 атомов каждого элемента, соотношение масс составляет примерно 1600: 100, что снова уменьшается до 16: 1.Пока у нас равное количество атомов водорода и кислорода, соотношение масс всегда будет 16: 1.
Такая же последовательность наблюдается при сравнении соотношений масс других элементов. Например, отношение масс атомов кремния к равному количеству атомов водорода всегда составляет примерно 28: 1, в то время как отношение масс атомов кальция к равному количеству атомов лития составляет примерно 40: 7.
Например, отношение масс атомов кремния к равному количеству атомов водорода всегда составляет примерно 28: 1, в то время как отношение масс атомов кальция к равному количеству атомов лития составляет примерно 40: 7.
Итак, мы установили, что массы атомов постоянны по отношению друг к другу, пока у нас одинаковое количество атомов каждого типа.Рассмотрим более макроскопический пример. Если образец содержит 40 г Ca, этот образец имеет такое же количество атомов, как и образец из 7 г Li. В таком случае нам нужно число, которое представляет удобное количество атомов, чтобы мы могли соотносить макроскопические количества веществ. Ясно, что даже 12 атомов — это слишком мало, потому что сами атомы такие маленькие. Нам нужно число, представляющее миллиарды и миллиарды атомов.
A моль определяется как 6,02 × 10 23 единиц и, таким образом, используется химиками для обозначения большого количества атомов или молекул.Подобно тому, как дюжина подразумевает 12 вещей, родинка (сокращенно моль ) представляет 6,02 × 10 23 вещи. Число 6,02 × 10 23 , названное числом Авогадро, в честь химика XIX века Амедео Авогадро, — это число, которое мы используем в химии для обозначения макроскопических количеств атомов и молекул. Таким образом, если у нас есть 6,02 × 10 23 атомов кислорода, мы говорим, что у нас есть 1 моль атомов кислорода. Если у нас есть 2 моля атомов Na, у нас будет 2 × (6,02 × 10 23 ) атомов Na, или 1.2044 × 10 24 атомов Na. Точно так же, если у нас есть 0,5 моль молекул бензола (C 6 H 6 ), мы имеем 0,5 × (6,02 × 10 23 ) C 6 H 6 молекул, или 3,011 × 10 23 C 6 H 6 молекул.
Число 6,02 × 10 23 , названное числом Авогадро, в честь химика XIX века Амедео Авогадро, — это число, которое мы используем в химии для обозначения макроскопических количеств атомов и молекул. Таким образом, если у нас есть 6,02 × 10 23 атомов кислорода, мы говорим, что у нас есть 1 моль атомов кислорода. Если у нас есть 2 моля атомов Na, у нас будет 2 × (6,02 × 10 23 ) атомов Na, или 1.2044 × 10 24 атомов Na. Точно так же, если у нас есть 0,5 моль молекул бензола (C 6 H 6 ), мы имеем 0,5 × (6,02 × 10 23 ) C 6 H 6 молекул, или 3,011 × 10 23 C 6 H 6 молекул.
Обратите внимание, что мы применяем мольную единицу к различным типам химических соединений. В этих примерах мы привели моль атомов и моль молекул. Слово моль обозначает ряд вещей — 6.02 × 10 23 из них — но само по себе не указывает, что «они» есть. Это могут быть атомы, формульные единицы (ионных соединений) или молекулы. Эту информацию еще нужно уточнить.
Это могут быть атомы, формульные единицы (ионных соединений) или молекулы. Эту информацию еще нужно уточнить.
Поскольку 1 молекула H 2 содержит 2 атома H, 1 моль H 2 молекул (6,02 × 10 23 молекулы) содержит 2 моля атомов H. Используя формулы, чтобы указать, сколько атомов каждого элемента у нас есть в веществе, мы можем связать количество молей молекул с количеством молей атомов.Например, в 1 моль этанола (C 2 H 6 O) мы можем построить следующие зависимости (Таблица 6.1 «Молекулярные отношения»):
Таблица 6.1: Молекулярные отношения
Следующий пример показывает, как мы можем использовать эти отношения в качестве коэффициентов пересчета.
(Вернуться к началу)6.3. Атомная и молярная масса .
Теперь, когда мы представили крот и попрактиковались в его использовании в качестве коэффициента преобразования, мы задаем очевидный вопрос: почему крот соответствует именно этому числу ? Почему это 6. 022 × 10 23 , а не 1 × 10 23 или даже 1 × 10 20 ?
022 × 10 23 , а не 1 × 10 23 или даже 1 × 10 20 ?
Число в моле, число Авогадро, связано с относительными размерами атомной единицы массы и грамма единиц массы. В то время как один атом водорода имеет массу приблизительно 1 а.е.м., 1 моль атомов H имеет массу приблизительно 1 грамм .И хотя один атом натрия имеет приблизительную массу 23 а.е.м., 1 моль атомов Na имеет приблизительную массу 23 грамм .
Масса одного моля вещества в граммах равна массе одного атома или молекулы в единицах атомной массы. Числа в периодической таблице, которые мы определили как атомные массы атомов, не только говорят нам массу одного атома в атомных единицах массы, но также говорят нам массу 1 моля атомов в граммах! Это потому, что все атомы состоят из одних и тех же частей (протонов, нейтронов и электронов), а протоны и нейтроны имеют почти одинаковые массы.Электроны, так как они такие легкие, пренебрегают своим вкладом в атомную массу даже в самых больших атомах. Таким образом, атомная или молекулярная масса указывает, сколько атомов или молекул присутствует. Таким образом, образуется важное трехстороннее соотношение: 1 моль = атомная или молекулярная масса в граммах = 6,02 X 10 23 атомов или молекул. Это эффективно дает нам возможность подсчитывать молекулы в лаборатории, используя общие весы! Обратите внимание, что в химических уравнениях и расчетах мольные концентрации обозначаются сокращенно моль.
Таким образом, атомная или молекулярная масса указывает, сколько атомов или молекул присутствует. Таким образом, образуется важное трехстороннее соотношение: 1 моль = атомная или молекулярная масса в граммах = 6,02 X 10 23 атомов или молекул. Это эффективно дает нам возможность подсчитывать молекулы в лаборатории, используя общие весы! Обратите внимание, что в химических уравнениях и расчетах мольные концентрации обозначаются сокращенно моль.
Напомним, что масса ионного соединения (обозначается формулой , масса ) или ковалентной молекулы (обозначается как молекулярная масса ) — это просто сумма масс его атомов. Чтобы рассчитать формулу или молекулярные массы, важно отслеживать количество атомов каждого элемента в молекулярной формуле, чтобы получить правильную молекулярную массу.
Например:
Молекула NaCl содержит 1 Na + и 1 Cl — .Таким образом, мы можем вычислить формулу массы этого соединения, сложив атомные массы натрия и хлора, как указано в таблице Менделеева (рис. 6.1).
6.1).
Рисунок 6.1 Периодическая таблица элементов
Для более крупной молекулы, такой как глюкоза (C 6 H 12 O 6 ), которая имеет несколько атомов одного и того же типа, просто умножьте атомную массу каждого атома на количество присутствующих атомов, а затем добавьте увеличьте все атомные массы, чтобы получить окончательную молекулярную массу.
Концепция молей может быть распространена также на массы формульных единиц и молекул. Масса 1 моля молекул (или формульных единиц) в граммах численно эквивалентна массе одной молекулы (или формульной единицы) в атомных единицах массы. Например, одна молекула O 2 имеет массу 32,00 ед. (Сумма 2 атомов кислорода), а 1 моль молекул O 2 имеет массу 32,00 г. Как и в случае с массами, основанными на единицах атомной массы, чтобы получить массу 1 моля вещества, мы просто суммируем массы отдельных атомов в формуле этого вещества. Масса 1 моля вещества называется его молярной массой , независимо от того, является ли вещество элементом, ионным соединением или ковалентным соединением.
Масса 1 моля вещества называется его молярной массой , независимо от того, является ли вещество элементом, ионным соединением или ковалентным соединением.
Рисунок 6.2: Удивительный крот. Показаны основные мольные коэффициенты пересчета.
Отношения между мольными количествами и коэффициентами пересчета в граммах, перечисленные выше на рис. 6.2, являются одними из наиболее полезных уравнений во всей химии. Они позволяют проводить химические реакции безопасным и эффективным образом и оказывают огромное влияние на экономику многих промышленных и производственных процессов, а также на производство лекарств.Если вы серьезно изучаете химию, я бы рекомендовал распечатать таблицу 6.2 и сохранить копию в своем блокноте. Это будет чрезвычайно полезно при постановке множества текстовых задач и функционально полезно в лаборатории.
Так почему же так важно соотношение между молью и составной массой? В микроскопическом мире химические уравнения строятся в масштабе молекул. На рисунке 6.3 изображена типичная химическая реакция. Как мы узнали в главе 5, коэффициенты перед каждым соединением представляют количество молекул, необходимое для протекания реакции.В этой реакции горения 2 молекулы бутана (C 4 H 10 ) реагируют с 13 молекулами кислорода с образованием 8 молекул диоксида углерода и 10 молекул воды. Однако в лаборатории химики не могут подсчитать молекулы и поместить их в реакционную колбу. Молекулы слишком малы, чтобы их можно было увидеть невооруженным глазом, и нет доступного оборудования, способного таким образом сортировать и подсчитывать молекулы. С другой стороны, массу легко измерить с помощью весов.Таким образом, отношение массы к количеству присутствующих молекул становится очень важным преобразованием. Поскольку моль представляет собой фиксированное количество молекул (6,02 X 10 23 ), коэффициенты, используемые в химических реакциях, также можно рассматривать как молярные отношения. Вместо того чтобы читать наше уравнение в терминах молекул, мы можем читать его в молях.
На рисунке 6.3 изображена типичная химическая реакция. Как мы узнали в главе 5, коэффициенты перед каждым соединением представляют количество молекул, необходимое для протекания реакции.В этой реакции горения 2 молекулы бутана (C 4 H 10 ) реагируют с 13 молекулами кислорода с образованием 8 молекул диоксида углерода и 10 молекул воды. Однако в лаборатории химики не могут подсчитать молекулы и поместить их в реакционную колбу. Молекулы слишком малы, чтобы их можно было увидеть невооруженным глазом, и нет доступного оборудования, способного таким образом сортировать и подсчитывать молекулы. С другой стороны, массу легко измерить с помощью весов.Таким образом, отношение массы к количеству присутствующих молекул становится очень важным преобразованием. Поскольку моль представляет собой фиксированное количество молекул (6,02 X 10 23 ), коэффициенты, используемые в химических реакциях, также можно рассматривать как молярные отношения. Вместо того чтобы читать наше уравнение в терминах молекул, мы можем читать его в молях. На макроскопическом уровне реакция ниже выглядит так: 2 моля бутана (C 4 H 10 ) реагируют с 13 молями кислорода с образованием 8 моль диоксида углерода и 10 моль воды.
На макроскопическом уровне реакция ниже выглядит так: 2 моля бутана (C 4 H 10 ) реагируют с 13 молями кислорода с образованием 8 моль диоксида углерода и 10 моль воды.
Рисунок 6.3 Реакция горения бутана. В примере показаны молекулярные соотношения субстратов и продуктов реакции.
6.4 Преобразование молярных масс
Самый простой тип манипуляции с использованием молярной массы в качестве коэффициента преобразования — это преобразование моль-масса (или его обратное преобразование, преобразование массы-моль), как показано на рисунке 6.2. При таком преобразовании мы используем молярную массу вещества в качестве коэффициента преобразования для преобразования единиц моля в единицы массы (или, наоборот, единиц массы в единицы моля).
Мы установили, что 1 моль Al имеет массу 26,98 г (пример 3 в разделе 6.3). Выражается математически:
1 моль Al = 26,98 г Al
Мы можем разделить обе части этого выражения на любую сторону, чтобы получить один из двух возможных коэффициентов преобразования:
Первый коэффициент преобразования может использоваться для преобразования массы в моль, а второй — для преобразования из молей в массу. Оба могут использоваться для решения проблем.
Оба могут использоваться для решения проблем.
Подобные преобразования возможны для любого вещества, если правильная атомная масса, формула массы или молярная масса известна (или может быть определена) и выражена в граммах на моль.На рисунке 6.4 представлена диаграмма для определения необходимого коэффициента преобразования, а на рисунке 6.5 представлена блок-схема шагов, необходимых для выполнения преобразования. Обратите внимание, что для преобразования из молей в массу или из массы в моли требуется один математический шаг.
Рис. 6.4 Простая блок-схема преобразования между массой и молями вещества.
Рисунок 6.5 Блок-схема, иллюстрирующая этапы преобразования единиц измерения.
Для вашего здоровья: минералы Для того, чтобы наш организм функционировал должным образом, мы должны получать определенные вещества из нашего рациона. Среди наших диетических потребностей — минералов , неуглеродные элементы, которые наш организм использует для различных функций, таких как развитие костей или обеспечение надлежащей нервной передачи.
Среди наших диетических потребностей — минералов , неуглеродные элементы, которые наш организм использует для различных функций, таких как развитие костей или обеспечение надлежащей нервной передачи.
Министерство сельского хозяйства США разработало некоторые рекомендации по суточному потреблению (RDI) различных минералов. В прилагаемой таблице перечислены РСНП для минералов, как в массе, так и в молях, исходя из ежедневного рациона в 2000 калорий.
Таблица 6.2: Рекомендуемая суточная доза (РСН) минеральных добавок
Таблица 6.2 иллюстрирует несколько вещей. Во-первых, потребности мужчин и женщин в некоторых минералах различны. Крайний случай — для железа; женщинам нужно вдвое больше, чем мужчинам. Во всех остальных случаях, когда используется другой RDI, мужчинам нужно больше, чем женщинам.
Во-вторых, количество различных минералов, необходимых ежедневно, широко варьируется — как в массовом, так и в молярном масштабе. В среднем человеку требуется 0,1 моль Na в день, что составляет около 2,5 г. С другой стороны, человеку требуется всего около 25–35 мкг Cr в день, что составляет менее одной миллионной доли моля.Каким бы небольшим ни было это количество, дефицит хрома в рационе может привести к симптомам, подобным диабету, или неврологическим проблемам, особенно в конечностях (руках и ногах). Что касается некоторых минералов, организму не требуется много, чтобы поддерживать нормальную работу.
В среднем человеку требуется 0,1 моль Na в день, что составляет около 2,5 г. С другой стороны, человеку требуется всего около 25–35 мкг Cr в день, что составляет менее одной миллионной доли моля.Каким бы небольшим ни было это количество, дефицит хрома в рационе может привести к симптомам, подобным диабету, или неврологическим проблемам, особенно в конечностях (руках и ногах). Что касается некоторых минералов, организму не требуется много, чтобы поддерживать нормальную работу.
Хотя правильно сбалансированная диета обеспечивает все необходимые минералы, некоторые люди принимают пищевые добавки. Однако слишком много хорошего, даже минералов, не есть хорошо. Воздействие слишком большого количества хрома, например, вызывает раздражение кожи, а некоторые формы хрома, как известно, вызывают рак (как показано в фильме Эрин Брокович ).
(Вернуться к началу)6.5 Молекулярно-молекулярные отношения в химических реакциях
В этом разделе вы узнаете, как использовать сбалансированную химическую реакцию для определения молярных соотношений между веществами.
В главе 5 вы научились балансировать химические уравнения, сравнивая количество атомов каждого типа в реагентах и продуктах. Коэффициенты перед химическими формулами представляют собой количество молекул или формульных единиц (в зависимости от типа вещества).Здесь мы расширим смысл коэффициентов в химическом уравнении.
Рассмотрим простое химическое уравнение
2H
2 + O 2 → 2H 2 OПри написании сбалансированных химических уравнений принято использовать наименьшее целочисленное отношение для коэффициентов. Однако уравнение сбалансировано, пока коэффициенты находятся в соотношении 2: 1: 2. Например, это уравнение также сбалансировано, если мы запишем его как
4H
2 + 2O 2 → 4H 2 OСоотношение коэффициентов составляет 4: 2: 4, что сокращается до 2: 1: 2.Уравнение также сбалансировано, если мы запишем его как
22H
2 + 11O 2 → 22H 2 O, потому что 22:11:22 также сокращается до 2: 1: 2.
Предположим, мы хотим использовать более крупные числа. Рассмотрим следующие коэффициенты:
12.044 × 10
23 H 2 + 6.022 × 10 23 O 2 → 12.044 × 10 23 H 2 OЭти коэффициенты также имеют соотношение 2: 1: 2 (проверьте и посмотрите), так что это уравнение сбалансировано.Но 6,022 × 10 23 — это 1 моль, а 12,044 × 10 23 — 2 моль (и число написано таким образом, чтобы сделать это более очевидным), поэтому мы можем упростить эту версию уравнения, записав ее как
2 моль H
2 + 1 моль O 2 → 2 моль H 2 OМы можем опустить слово моль и не записывать коэффициент 1 (как наша привычка), так что окончательная форма уравнения, все еще сбалансированная, будет
2H
2 + O 2 → 2H 2 O Теперь мы интерпретируем коэффициенты как относящиеся к молярным количествам, а не к отдельным молекулам. Урок? Сбалансированные химические уравнения сбалансированы не только на молекулярном уровне, но и с точки зрения молярных количеств реагентов и продуктов. Таким образом, мы можем прочитать эту реакцию как «два моля водорода реагируют с одним моль кислорода с образованием двух молей воды».
Урок? Сбалансированные химические уравнения сбалансированы не только на молекулярном уровне, но и с точки зрения молярных количеств реагентов и продуктов. Таким образом, мы можем прочитать эту реакцию как «два моля водорода реагируют с одним моль кислорода с образованием двух молей воды».
Точно так же отношения, которые мы построили в главе 5, также могут быть построены в единицах молей, а не молекул. Например, для реакции, в которой водород и кислород соединяются с образованием воды, мы можем построить следующие отношения:
Мы можем использовать эти соотношения, чтобы определить, какое количество вещества в молях будет реагировать с заданным числом молей другого вещества или производить его.Изучение численных соотношений между реагентами и продуктами в сбалансированных химических реакциях называется стехиометрией .
6.6 Задачи молекулярной массы и массы-массы В этом разделе вы научитесь преобразовывать массу или моль одного вещества в массу или моль другого вещества в ходе химической реакции.
Мы установили, что сбалансированное химическое уравнение сбалансировано с точки зрения молей, а также атомов или молекул.Мы использовали сбалансированные уравнения, чтобы установить отношения, теперь в единицах молей материалов, которые мы можем использовать в качестве коэффициентов пересчета для ответа на стехиометрические вопросы, например, сколько молей вещества А реагирует с таким количеством молей реагента Б. Мы можем расширить эта техника даже дальше. Напомним, что мы можем соотнести молярное количество с массовым количеством, используя молярную массу. Мы можем использовать эту способность, чтобы ответить на вопросы о стехиометрии с точки зрения масс конкретного вещества в дополнение к молям. Делаем это в следующей последовательности:
Рисунок 6.6: Блок-схема для расчета преобразования молей в массу с использованием химических уравнений.
В совокупности эти преобразования называются расчетами молекулярной массы.
В качестве примера рассмотрим вычисленное химическое уравнение
Fe
2 O 3 + 3SO 3 → Fe 2 (SO 4 ) 3 Если у нас есть 3,59 моль Fe 2 O 3 , сколько граммов SO 3 может с ним вступить в реакцию? Используя последовательность расчета молекулярной массы, мы можем определить требуемую массу SO 3 в два этапа. Сначала мы строим соответствующее молярное соотношение, определенное из сбалансированного химического уравнения, для расчета необходимого количества молей SO 3 . Затем, используя молярную массу SO 3 в качестве коэффициента преобразования, мы определяем массу, которую имеет это количество молей SO 3 . Графически это представлено двумя этапами:
Сначала мы строим соответствующее молярное соотношение, определенное из сбалансированного химического уравнения, для расчета необходимого количества молей SO 3 . Затем, используя молярную массу SO 3 в качестве коэффициента преобразования, мы определяем массу, которую имеет это количество молей SO 3 . Графически это представлено двумя этапами:
Первый шаг напоминает упражнения, которые мы делали в разделе 6.4 «Молочно-молекулярные отношения в химических реакциях». Как обычно, мы начинаем с того количества, которое нам дали:
Моль Fe 2 O 3 единиц аннулируют, оставляя моль SO 3 единиц.Теперь мы берем этот ответ и преобразуем его в граммы SO 3 , используя молярную массу SO 3 в качестве коэффициента преобразования:
Наш окончательный ответ выражается тремя значащими цифрами. Таким образом, в двухэтапном процессе мы обнаруживаем, что 862 г SO 3 будут реагировать с 3,59 моль Fe 2 O 3 . Таким образом можно ответить на многие проблемы этого типа.
Таким образом можно ответить на многие проблемы этого типа.
Та же двухэтапная задача может быть решена в одной строке, а не в виде двух отдельных шагов, как показано ниже:
Мы получаем точно такой же ответ, когда объединяем все математические шаги вместе, как и когда мы вычисляем один шаг за раз.
Это небольшой шаг от расчета молекулярной массы к расчету массы-массы. Если мы начнем с известной массы одного вещества в химической реакции (вместо известного числа молей), мы можем вычислить соответствующие массы других веществ в реакции. Первым шагом в этом случае является преобразование известной массы в моль с использованием молярной массы вещества в качестве коэффициента преобразования. Затем — и только тогда — мы используем сбалансированное химическое уравнение, чтобы построить коэффициент преобразования, чтобы преобразовать это количество в моль другого вещества, которое, в свою очередь, может быть преобразовано в соответствующую массу.Последовательно процесс выглядит следующим образом:
Рисунок 6. 7 Блок-схема проведения преобразований с использованием химических уравнений.
7 Блок-схема проведения преобразований с использованием химических уравнений.
Этот трехэтапный процесс можно выполнить в три отдельных шага или объединить в один расчет, содержащий три коэффициента преобразования. Следующий пример иллюстрирует оба метода.
Для вашего здоровья: синтез таксола
Таксол — мощное противоопухолевое средство, которое первоначально было извлечено из тиса тихоокеанского ( Taxus brevifolia ).Как видно из рисунка, таксол — очень сложная молекула с молекулярной формулой C 47 H 51 NO 14 . Выделение таксола из его природного источника представляет определенные проблемы, в основном из-за того, что тихоокеанский тис является медленнорастущим деревом, и необходимо собрать эквивалент шести деревьев, чтобы обеспечить достаточное количество таксола для лечения одного пациента. Хотя родственные виды тисов также производят таксол в небольших количествах, существует значительный интерес к синтезу этой сложной молекулы в лаборатории.
После 20-летних усилий две исследовательские группы объявили о полном лабораторном синтезе таксола в 1994 году. Однако каждый синтез требовал более 30 отдельных химических реакций с общей эффективностью менее 0,05%. Для сравнения: чтобы получить разовую дозу таксола 300 мг, вам нужно будет начать с 600 г исходного материала. Чтобы лечить 26 000 женщин, у которых ежегодно диагностируется рак яичников, с помощью одной дозы, почти 16 000 кг (более 17 тонн) исходного материала необходимо преобразовать в таксол.Таксол также используется для лечения рака груди, который ежегодно диагностируется у 200 000 женщин в США. Это только увеличивает необходимое количество исходного материала.
Очевидно, что существует большой интерес к повышению общей эффективности синтеза таксола. Улучшенный синтез не только будет проще, но и будет производить меньше отходов, что позволит большему количеству людей воспользоваться этим потенциально спасительным лекарством.
Рисунок 6. 8 Структура таксола противоракового препарата. Из-за сложности молекулы атомы водорода не показаны, но они присутствуют на каждом атоме, чтобы дать ему правильное количество ковалентных связей (четыре связи для каждого атома углерода).
8 Структура таксола противоракового препарата. Из-за сложности молекулы атомы водорода не показаны, но они присутствуют на каждом атоме, чтобы дать ему правильное количество ковалентных связей (четыре связи для каждого атома углерода).
- Сбалансированное химическое уравнение может использоваться для связи масс или молей различных веществ в реакции.
Учитывая следующее несбалансированное химическое уравнение,
H 3 PO 4 + NaOH → H 2 O + Na 3 PO 4
какая масса H 2 O получается по реакции 2.35 моль H 3 PO 4 ?
Учитывая следующее несбалансированное химическое уравнение,
C 2 H 6 + Br 2 → C 2 H 4 Br 2 + HBr
какая масса HBr образуется, если в реакцию вступает 0,884 моль C 2 H 6 ?
Определенные жиры используются для изготовления мыла.
 Первый шаг — реакция жира с водой с образованием глицерина (также известного как глицерин) и соединений, называемых жирными кислотами.Вот один пример:
Первый шаг — реакция жира с водой с образованием глицерина (также известного как глицерин) и соединений, называемых жирными кислотами.Вот один пример:C3H5 (OOC (Ch3) 14Ch4) 3a жир + 3h3O → C3H5 (OH) 3глицерин + 3Ch4 (Ch3) 14COOH жирная кислота
Сколько молей глицерина можно получить в результате реакции 1 000,0 г C 3 H 5 (OOC (CH 2 ) 14 CH 3 ) 3 ?
Фотосинтез у растений приводит к общей реакции производства глюкозы (C 6 H 12 O 6 ):
6CO 2 + 6H 2 O → C 6 H 12 O 6 + 6O 2
Сколько молей глюкозы можно получить при реакции 544 г CO 2 ?
Реакции осаждения, в которых твердое вещество (называемое осадком) является продуктом, обычно используются для удаления определенных ионов из раствора.
 Одна из таких реакций выглядит следующим образом:
Одна из таких реакций выглядит следующим образом:Ba (NO 3 ) 2 (водн.) + Na 2 SO 4 (водн.) → BaSO 4 (т.) + 2NaNO 3 (водн.)
Сколько граммов Na 2 SO 4 необходимо для осаждения всех ионов бария, произведенных 43,9 г Ba (NO 3 ) 2 ?
Нитроглицерин [C 3 H 5 (ONO 2 ) 3 ] получают реакцией азотной кислоты (HNO 3 ) с глицерином [C 3 H 5 (OH) 3 ] согласно этой реакции:
C 3 H 5 (OH) 3 + 3HNO 3 → C 3 H 5 (ONO 2 ) 3 + 3H 2 O
Если 87.4 г HNO 3 реагируют с избытком глицерина, какую массу нитроглицерина можно получить?
Антациды — это основания, нейтрализующие кислоты в пищеварительном тракте.
 Гидроксид магния [Mg (OH) 2 ] является одним из таких антацидов. Он реагирует с соляной кислотой в желудке по следующей реакции:
Гидроксид магния [Mg (OH) 2 ] является одним из таких антацидов. Он реагирует с соляной кислотой в желудке по следующей реакции:Mg (OH) 2 + 2HCl → MgCl 2 + 2H 2 O
Сколько граммов HCl может нейтрализовать доза 200 мг Mg (OH) 2 ?
Кислотный дождь вызывается реакцией оксидов неметаллов с водой в атмосфере.В одной из таких реакций участвует диоксид азота (NO 2 ) и образуется азотная кислота (HNO 3 ):
3НО 2 + H 2 O → 2HNO 3 + NO
Если 1,82 × 10 13 г NO 2 попадает в атмосферу каждый год из-за деятельности человека, потенциально сколько граммов HNO 3 может производиться ежегодно?
Упрощенный вариант переработки железной руды в металлическое железо выглядит следующим образом:
2Fe 2 O 3 + 3C → 4Fe + 3CO 2
Сколько граммов C необходимо для производства 1.
 00 × 10 9 г Fe?
00 × 10 9 г Fe?SS Hindenburg содержал около 5,33 × 10 5 г газа H 2 , когда он сгорел в Лейкхерсте, штат Нью-Джерси, в 1937 году. Химическая реакция выглядит следующим образом:
2H 2 + O 2 → 2H 2 O
Сколько граммов H 2 O было произведено?
6.7 Краткое содержание главы
Чтобы убедиться, что вы понимаете материал этой главы, вам следует проанализировать значения следующих жирным шрифтом терминов в следующем резюме и спросить себя, как они относятся к темам в главе.
Химические реакции связаны с количествами реагентов и продуктов. Химики используют единицу моль для обозначения 6,022 × 10 23 вещей, независимо от того, являются ли эти предметы атомами элементов или молекулами соединений. Это число, называемое числом Авогадро , важно, потому что это количество атомов или молекул имеет ту же массу в граммах, что и один атом или молекула в единицах атомной массы. Молярные массы веществ могут быть определены путем суммирования соответствующих масс из периодической таблицы; окончательная молярная масса будет выражаться в граммах.
Это число, называемое числом Авогадро , важно, потому что это количество атомов или молекул имеет ту же массу в граммах, что и один атом или молекула в единицах атомной массы. Молярные массы веществ могут быть определены путем суммирования соответствующих масс из периодической таблицы; окончательная молярная масса будет выражаться в граммах.
Поскольку один моль вещества будет иметь определенную массу, мы можем использовать это соотношение для построения коэффициентов преобразования, которые преобразуют количество моль в количество массы, или наоборот. Такое преобразование молярной массы обычно занимает один алгебраический шаг.
Химические реакции содержат перечень реагентов и продуктов в молярных количествах, а не только в молекулярных количествах. Мы можем использовать коэффициенты сбалансированного химического уравнения, чтобы связать моли одного вещества в реакции с молями других веществ (стехиометрия).При расчете молярной массы мы связываем количество молей одного вещества с массой другого вещества. В расчете массы-массы мы связываем массу одного вещества с массой другого вещества.
В расчете массы-массы мы связываем массу одного вещества с массой другого вещества.
Если средний мужчина имеет массу тела 70 кг, из которых 60% — вода, сколько молей воды в среднем мужчине?
Если средняя женщина 60 лет.0 кг и содержит 0,00174% железа, сколько молей железа в средней женщине?
Сколько молей каждого элемента содержится в 2,67 моль каждого соединения?
- HCl
- H 2 SO 4
- Al (НЕТ 3 ) 3
- Ga 2 (СО 4 ) 3
Сколько молей каждого элемента содержится в 0,00445 моль каждого соединения?
- HCl
- H 2 SO 4
- Al 2 (CO 3 ) 3
- Ga 2 (СО 4 ) 3
Какова масса одного атома водорода в граммах? Какова масса одного атома кислорода в граммах? У этих масс соотношение 1:16, как и ожидалось?
Какая масса одного атома натрия в граммах?
Если 6.
 63 × 10 −6 моль соединения имеет массу 2,151 мг, какова молярная масса соединения?
63 × 10 −6 моль соединения имеет массу 2,151 мг, какова молярная масса соединения?Гемоглобин (молярная масса составляет примерно 64000 г / моль) является основным компонентом красных кровяных телец, транспортирующих кислород и углекислый газ в организме. Сколько молей в 0,034 г гемоглобина?
- 2,67 моль H и 2,67 моль Cl
- 5.34 моль H, 2,67 моль S и 10,68 моль O
- 2,67 моль Al, 8,01 моль N и 24,03 моль O
- 5,34 моль Ga, 8,01 моль S и 32,04 моль O
H = 1,66 × 10 −24 г и O = 2,66 × 10 −23 г; да, они в соотношении 1:16.
6,8 Артикул:
Материалы Главы 6 были адаптированы и изменены из следующих ресурсов Creative Commons, если не указано иное:
1. Анонимный. (2012) Введение в химию: общие, органические и биологические (V1.0). Опубликовано по лицензии Creative Commons by-NC-sa 3.0. Доступно по адресу: http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/index.html
Анонимный. (2012) Введение в химию: общие, органические и биологические (V1.0). Опубликовано по лицензии Creative Commons by-NC-sa 3.0. Доступно по адресу: http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/index.html
2. Поульсен, Т. (2010) Введение в химию. Опубликовано по лицензии Creative Commons by-NC-sa 3.0. Доступно по адресу: http://openedgroup.org/books/Chemistry.pdf
3. OpenStax (2015) Атомы, изотопы, ионы и молекулы: строительные блоки. OpenStax CNX.Доступно по адресу: http://cnx.org/contents/be8818d0-2dba-4bf3-859a-737c25fb2c99@12.
Почему необходимо сбалансировать химические уравнения?
Возьмем, к примеру, сжигание метана (# «CH» _4 «#):
# «CH» _4 «# + #» O «_2» ## rarr ## «CO» _2 «# + #» H «_2» O «#
Если вы посчитаете количество атомов (нижних индексов) углерода, водорода и кислорода в обеих частях уравнения, вы увидите, что на стороне реагента (левая сторона) есть один атом углерода, четыре атома водорода, и два атома кислорода.
На стороне продукта (правая сторона) находятся один атом углерода, два атома водорода и три атома кислорода. Следовательно, уравнение не удовлетворяет закону сохранения массы и не сбалансировано.
Чтобы сбалансировать уравнение, мы должны при необходимости изменить количества реагентов и продуктов, добавляя коэффициенты перед соответствующей формулой (ами).
При балансировке уравнения НИКОГДА не изменяйте нижние индексы, потому что это меняет содержание.# «H» _2 «O» # НЕ то же самое вещество, что и # «H» _2 «O» _2 «#. Чтобы определить количество атомов каждого элемента, коэффициент умножается на индексы в каждой формуле. не является коэффициентом или индексом, это означает 1. Уравнение для сжигания метана имеет следующий вид:
# «CH» _4 «# + # 2» O «_2» ## rarr ## «CO» _2 «# + #» 2H «_2» O «#
Если вы сравните несбалансированное уравнение со сбалансированным уравнением, вы увидите, что химические формулы каждого реагента и продукта не изменились.
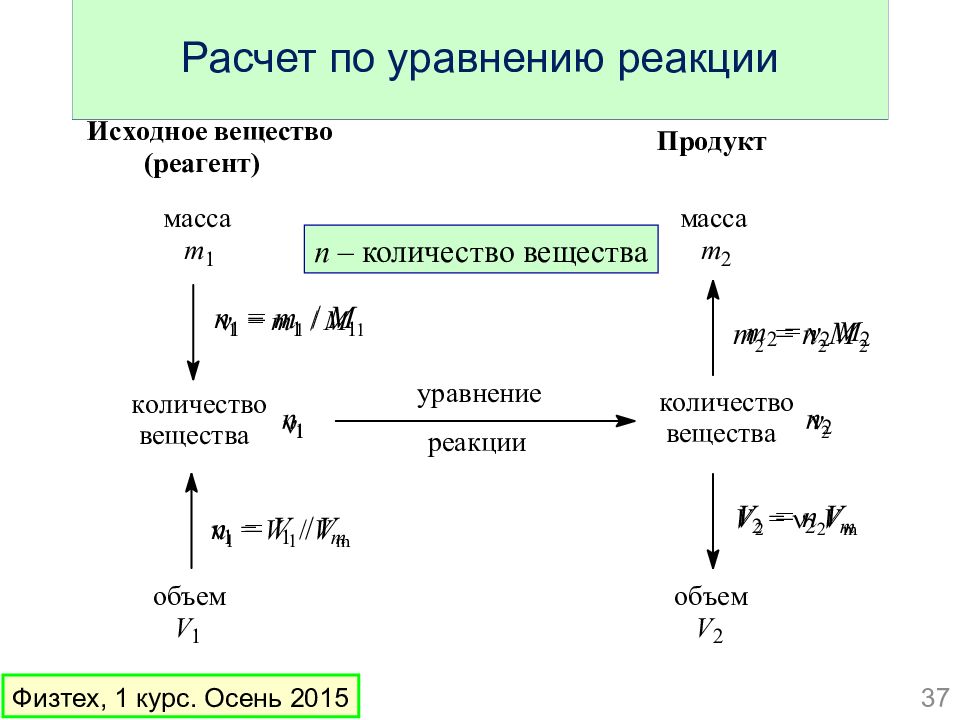
 НЕЛЬЗЯ использовать для расчетов значения масс!
НЕЛЬЗЯ использовать для расчетов значения масс! Чтобы перейти к четвертому шагу, следует сначала определить молярную массу магния. Для этого смотрим по Периодической таблице: относительная атомная масса магния Ar(Mg) = 24. А поскольку числовое значение молярной массы равно относительной атомной или молекулярной массе, то молярная масса тоже равна 24:
Чтобы перейти к четвертому шагу, следует сначала определить молярную массу магния. Для этого смотрим по Периодической таблице: относительная атомная масса магния Ar(Mg) = 24. А поскольку числовое значение молярной массы равно относительной атомной или молекулярной массе, то молярная масса тоже равна 24:
 Для вычисления искомого
количества вещества,
Для вычисления искомого
количества вещества, Записать условие задачи
Записать условие задачи Вычислим количества
вещества, массу которого
Вычислим количества
вещества, массу которого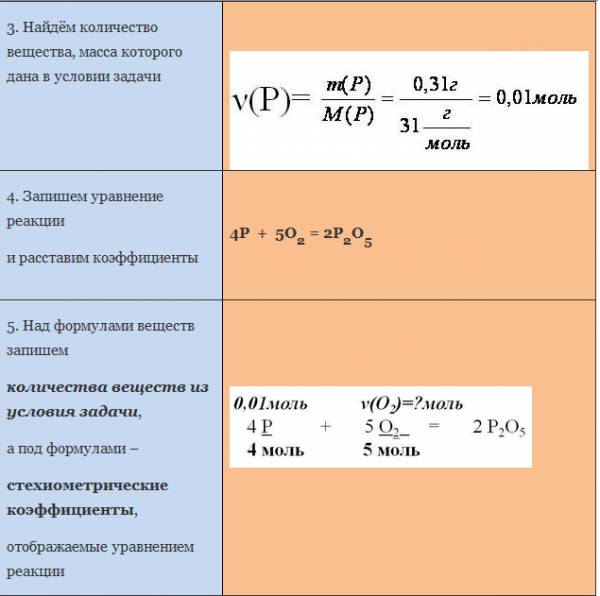 Вычислить молярные массы
веществ,
Вычислить молярные массы
веществ, Вычислить молярные массы
веществ,
Вычислить молярные массы
веществ, Запишем ответ
Запишем ответ
 Над химической формулой оксида магния MgO , масса которого неизвестна, ставим x моль , над формулой магния Mg пишем его молярную массу:
Над химической формулой оксида магния MgO , масса которого неизвестна, ставим x моль , над формулой магния Mg пишем его молярную массу: Изучите материал урока и выполните предложенные задания.
Изучите материал урока и выполните предложенные задания. При составлении задачи используйте уравнение реакции:
При составлении задачи используйте уравнение реакции:
 Например, ответьте «водород + кислород → вода» на вопрос о формуле воды. Это заблуждение происходит из математики, где эти два слова часто используются как синонимы, и из повседневной жизни, где словесная формула часто ассоциируется с тем, как что-то делается.
Например, ответьте «водород + кислород → вода» на вопрос о формуле воды. Это заблуждение происходит из математики, где эти два слова часто используются как синонимы, и из повседневной жизни, где словесная формула часто ассоциируется с тем, как что-то делается.
 ) → Al 3+ (aq) + 3Ag (s), сколько молей Ag образуется при реакции 0,661 моль Al?
) → Al 3+ (aq) + 3Ag (s), сколько молей Ag образуется при реакции 0,661 моль Al?




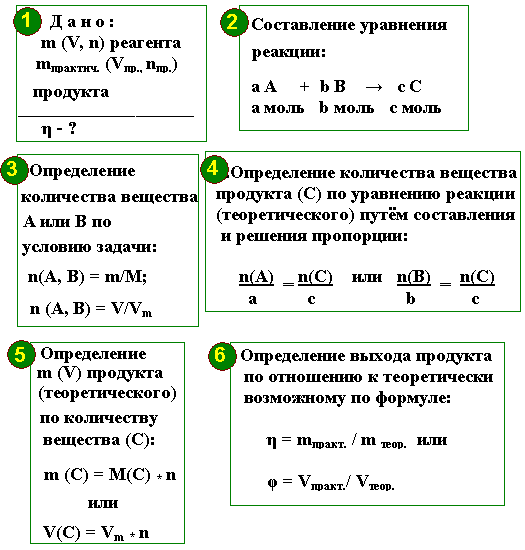 Давайте посмотрим на несколько примеров.
Давайте посмотрим на несколько примеров.
 Например:
Например: количество молей (описано ниже).Если коэффициент не указан, предполагается, что он равен единице (1).
количество молей (описано ниже).Если коэффициент не указан, предполагается, что он равен единице (1). Если бы это было так, реакция была бы весьма впечатляющей: атом алюминия появился бы из ниоткуда, а два (2) атома железа и один (1) атом кислорода волшебным образом исчезли бы. Мы знаем из Закона о сохранении массы (который гласит, что материю нельзя ни создать, ни разрушить)
что этого просто не может произойти. Мы должны убедиться, что количество атомов каждого конкретного элемента в реагентах равно количеству атомов того же элемента в продуктах.К
для этого мы должны вычислить относительное количество молекул каждого члена, выраженное коэффициентом члена.
Если бы это было так, реакция была бы весьма впечатляющей: атом алюминия появился бы из ниоткуда, а два (2) атома железа и один (1) атом кислорода волшебным образом исчезли бы. Мы знаем из Закона о сохранении массы (который гласит, что материю нельзя ни создать, ни разрушить)
что этого просто не может произойти. Мы должны убедиться, что количество атомов каждого конкретного элемента в реагентах равно количеству атомов того же элемента в продуктах.К
для этого мы должны вычислить относительное количество молекул каждого члена, выраженное коэффициентом члена. Следовательно, в двух (2) молекулах вещества должно быть шесть (6) атомов Fe. Точно так же есть четыре (4) атома кислорода в одной (1) молекуле вещества, поэтому в двух (2) молекулах должно быть восемь (8) атомов кислорода.
Следовательно, в двух (2) молекулах вещества должно быть шесть (6) атомов Fe. Точно так же есть четыре (4) атома кислорода в одной (1) молекуле вещества, поэтому в двух (2) молекулах должно быть восемь (8) атомов кислорода. Изменяйте коэффициент только при балансировке уравнения. Также не забудьте отметить, что индекс, умноженный на коэффициент, дает количество атомов этого элемента. Что касается реагентов, у нас есть коэффициент три (3), умноженный на нижний индекс четыре (4), что дает 12 атомов кислорода. На стороне продукта у нас есть коэффициент четыре (4), умноженный на нижний индекс три (3), что дает 12 атомов кислорода. Теперь кислород сбалансирован.
Изменяйте коэффициент только при балансировке уравнения. Также не забудьте отметить, что индекс, умноженный на коэффициент, дает количество атомов этого элемента. Что касается реагентов, у нас есть коэффициент три (3), умноженный на нижний индекс четыре (4), что дает 12 атомов кислорода. На стороне продукта у нас есть коэффициент четыре (4), умноженный на нижний индекс три (3), что дает 12 атомов кислорода. Теперь кислород сбалансирован.

 Затем соотношение молей можно перевести в эмпирическую формулу.
Затем соотношение молей можно перевести в эмпирическую формулу.
 Мы уже обсуждали процентный состав в разделе выше. Если у нас есть только масса, все, что мы делаем, по сути, устраняем этап преобразования
от процента к массе.
Мы уже обсуждали процентный состав в разделе выше. Если у нас есть только масса, все, что мы делаем, по сути, устраняем этап преобразования
от процента к массе.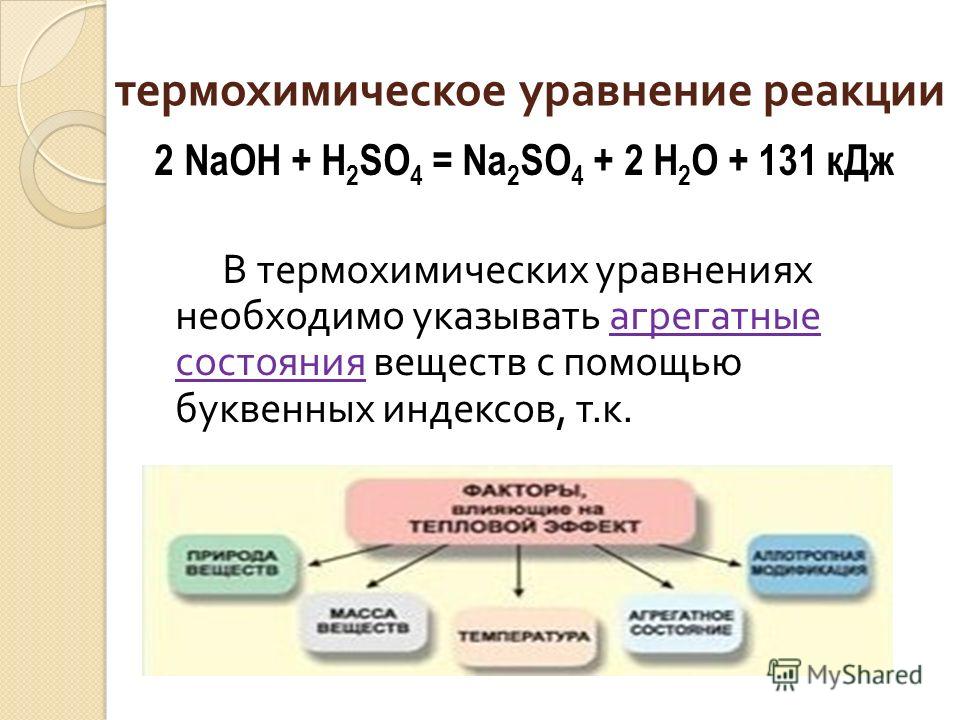

 Затем мы пытаемся решить то, чего не знаем: моли растворенного вещества.Как только мы узнаем количество молей растворенного вещества, мы сможем взглянуть на таблицу Менделеева и вычислить преобразование молей в граммы.
Затем мы пытаемся решить то, чего не знаем: моли растворенного вещества.Как только мы узнаем количество молей растворенного вещества, мы сможем взглянуть на таблицу Менделеева и вычислить преобразование молей в граммы. 2 C, какова молярность раствора? (K f для воды 1,86 C / м.)
2 C, какова молярность раствора? (K f для воды 1,86 C / м.)  6 г / моль.)
Проверьте свою работу
6 г / моль.)
Проверьте свою работу Первый шаг — реакция жира с водой с образованием глицерина (также известного как глицерин) и соединений, называемых жирными кислотами.Вот один пример:
Первый шаг — реакция жира с водой с образованием глицерина (также известного как глицерин) и соединений, называемых жирными кислотами.Вот один пример: Одна из таких реакций выглядит следующим образом:
Одна из таких реакций выглядит следующим образом: Гидроксид магния [Mg (OH) 2 ] является одним из таких антацидов. Он реагирует с соляной кислотой в желудке по следующей реакции:
Гидроксид магния [Mg (OH) 2 ] является одним из таких антацидов. Он реагирует с соляной кислотой в желудке по следующей реакции: 00 × 10 9 г Fe?
00 × 10 9 г Fe? 63 × 10 −6 моль соединения имеет массу 2,151 мг, какова молярная масса соединения?
63 × 10 −6 моль соединения имеет массу 2,151 мг, какова молярная масса соединения?