Конспект урока по химии «Чистые вещества и смеси»
Конспект урока для 8 класса Чистые вещества и смеси
Тип урока. Изучение нового материала.
Цели урока. Обучающие – изучить понятия «чистое вещество» и «смесь», однородные (гомогенные) и неоднородные (гетерогенные) смеси, рассмотреть способы разделения смесей, научить учащихся разделять смеси на компоненты.
Развивающие – развить интеллектуальные и познавательные умения учащихся: выделять существенные признаки и свойства, устанавливать причинно-следственные связи, классифицировать, анализировать, делать выводы, выполнять опыты, наблюдать, оформлять наблюдения в виде таблиц, схем.
Воспитательные – содействовать воспитанию у учащихся организованности, аккуратности при проведении эксперимента, умения организовывать взаимопомощь при работе в парах, духа соревновательности при выполнении упражнений.
Методы обучения. Методы организации учебно-познавательной деятельности
Методы стимулирования интереса к учению – познавательные игры, учебные дискуссии.
Методы контроля – устный контроль, письменный контроль, экспериментальный контроль.
Оборудование и реактивы. На столах учащихся – листы бумаги, ложечки для веществ, стеклянные палочки, стаканы с водой, магниты, порошки серы и железа.
На столе учителя – ложечки, пробирки, держатель для пробирок, спиртовка, магнит, вода, химические стаканы, штатив с кольцом, штатив с лапкой, воронка, стеклянные палочки, фильтры, фарфоровая чашка, делительная воронка, пробирка с газоотводной трубкой, пробирка-приемник, «стакан-холодильник» с водой, лента фильтровальной бумаги (2х10 см), красные чернила, колба, сито, порошки железа и серы в массовом отношении 7 : 4, речной песок, поваренная соль, растительное масло, раствор медного купороса, манная, гречневая крупы.
ХОД УРОКА
Организационный момент
Отметить отсутствующих, объяснить цели урока и познакомить учащихся с его планом.
П л а н у р о к а
1. Чистые вещества и смеси. Отличительные особенности.
2. Однородные и неоднородные смеси.
3. Способы разделения смесей.
Беседа по теме «Вещества и их свойства»
Учитель. Вспомните, что изучает химия.
Ученик. Вещества, свойства веществ, изменения, происходящие с веществами, т.е. превращения веществ.
Учитель. Что называется веществом?
Ученик. Вещество – это то, из чего состоит физическое тело.
Учитель. Вы знаете, что вещества бывают простыми и сложными. Какие вещества называются простыми, а какие – сложными?
Ученик. Простые вещества состоят из атомов одного химического элемента, сложные – из атомов различных химических элементов
Учитель. Какие физические свойства имеют вещества?
Ученик. Агрегатное состояние, температуры плавления, кипения, электро- и теплопроводность, растворимость в воде и др.
Объяснение нового материала
Чистые вещества и смеси.
Отличительные особенности
Учитель. Постоянные физические свойства имеют только чистые вещества. Только чистая дистиллированная вода имеет tпл = 0 °С, tкип = 100 °С, не имеет вкуса. Морская вода замерзает при более низкой, а закипает при более высокой температуре, вкус у нее горько-соленый. Вода Черного моря замерзает при более низкой, а закипает при более высокой температуре, чем вода Балтийского моря. Почему? Дело в том, что в морской воде содержатся другие вещества, например растворенные соли, т.е. она представляет собой смесь различных веществ, состав которой меняется в широких пределах, свойства же смеси не являются постоянными. Определение понятия «смесь» было дано в XVII в. английским ученым Робертом Бойлем:
«Смесь – целостная система, состоящая из разнородных компонентов».Рассмотрим отличительные особенности смеси и чистого вещества. Для этого проделаем следующие опыты.
Опыт 1. Используя инструкцию к опыту, изучите существенные физические свойства порошков железа и серы, приготовьте смесь этих порошков и определите, сохраняют ли эти вещества свои свойства в смеси.
Инструкция для учащихся к опыту«Приготовление и изучение смеси железа и серы»
1. Насыпьте на лист бумаги отдельными кучками порошки серы и железа, рассмотрите их цвет.
2. Возьмите небольшую часть каждого вещества и проведите следующие операции:
а) испытайте магнитом;
б) опустите в стакан с водой.
3. Смешайте стеклянной палочкой оба порошка на бумаге, рассмотрите цвет смеси.
4. Проведите со смесью те же операции, что и с чистыми веществами.
Обсуждение с учащимися результатов проведенного опыта.
Учитель. Опишите агрегатное состояние и цвет серы.
Ученик. Сера – твердое вещество желтого цвета.
Учитель. Каковы агрегатное состояние и цвет железа в виде порошка?
Ученик. Железо – твердое серое вещество.
Учитель. Как эти вещества относятся: а) к магниту; б) к воде?
Ученик. Железо притягивается магнитом, а сера – нет; в воде порошок железа тонет, т.к. железо тяжелее воды, а порошок серы всплывает на поверхность воды, т. к. не смачивается водой.
Учитель. Что можно сказать о соотношении железа и серы в смеси?
Ученик. Соотношение железа и серы в смеси может быть различным, т.е. непостоянным.
Учитель. Сохраняются ли свойства железа и серы в смеси?
Ученик. Да, свойства каждого вещества в смеси сохраняются
.Учитель. Как можно разделить смесь серы и железа?
Ученик. Это можно сделать физическими методами: магнитом или водой.
Учитель. Опыт 2. Сейчас я покажу реакцию взаимодействия серы и железа. Ваша задача внимательно наблюдать этот опыт и определить, сохраняют ли свои свойства железо и сера в полученном в результате реакции сульфиде железа(II) и можно ли выделить из него железо и серу физическими методами.
Я тщательно перемешиваю порошки железа и серы в массовом отношении 7 : 4:
m(Fе) : m(S) = Аr(Fе) : Аr(S) = 56 : 32 = 7 : 4,
помещаю смесь в пробирку, прогреваю в пламени спиртовки, сильно накаливаю в одном месте и прекращаю нагревание, когда начинается бурная экзотермическая реакция. После остывания пробирки осторожно разбиваю ее, предварительно завернув в полотенце, и извлекаю содержимое. Внимательно посмотрите на полученное вещество – сульфид железа(II). Видны ли в нем отдельно серый порошок железа и желтый — серы?
Ученик. Нет, полученное вещество имеет темно-серый цвет.
Учитель. Затем испытываю полученное вещество магнитом. Разделяются ли железо и сера?
Ученик. Нет, полученное вещество не намагничивается.
Учитель. Помещаю сульфид железа(II) в воду. Что вы наблюдаете при этом?
Ученик. Сульфид железа(II) тонет в воде.
Учитель. Сохраняют ли сера и железо свои свойства, входя в состав сульфида железа(II)?
Ученик. Нет, новое вещество обладает свойствами, отличными от свойств взятых для реакции веществ.
Учитель. Можно ли разделить сульфид железа(II) физическими методами на простые вещества?
Ученик. Нет, ни магнит, ни вода не могут разделить сульфид железа(II) на железо и серу.
Учитель. Происходит ли изменение энергии при образовании химического вещества?
Ученик. Да, например, при взаимодействии железа и серы энергия выделяется.
Учитель. Занесем результаты обсуждения опытов в таблицу.
Таблица
Сравнительная характеристика смеси и чистого вещества
Для закрепления этой части урока выполните упражнение: определите, где на рисунке (см. с. 34) изображено простое вещество, сложное вещество или смесь. 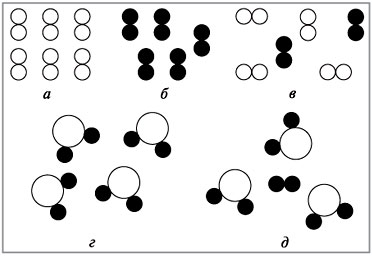
Однородные и неоднородные смеси
Учитель. Выясним, отличаются ли смеси по внешнему виду друг от друга.
Учитель демонстрирует примеры суспензий (речной песок + вода), эмульсии (растительное масло + вода) и растворов (воздух в колбе, поваренная соль + вода, разменная монета: алюминий + медь или никель + медь).
Учитель. В суспензиях видны частицы твердого вещества, в эмульсиях – капельки жидкости, такие смеси называются неоднородными (гетерогенными), а в растворах компоненты не различимы, они являются однородными (гомогенными) смесями. Рассмотрим схему классификации смесей (схема 1).
Схема 1
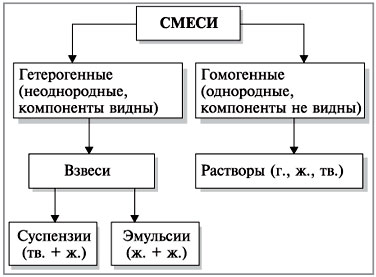
Приведите примеры каждого вида смесей: суспензий, эмульсий и растворов.
Способы разделения смесей
Учитель. В природе вещества существуют в виде смесей. Для лабораторных исследований, промышленных производств, для нужд фармакологии и медицины нужны чистые вещества.
Для очистки веществ применяются различные способы разделения смесей (схема 2).
Схема 2
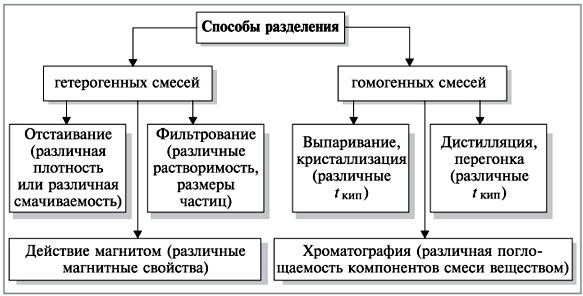
Эти способы основаны на различиях в физических свойствах компонентов смеси.
Рассмотрим способы разделения гетерогенных смесей.
Как можно разделить суспензию – смесь речного песка с водой, т. е. очистить воду от песка?
Ученик. Отстаиванием, а затем фильтрованием.
Учитель. Верно. Разделение отстаиванием основано на различных плотностях веществ. Более тяжелый песок оседает на дно. Так же можно разделить и эмульсию: отделить нефть или растительное масло от воды. В лаборатории это можно сделать с помощью делительной воронки. Нефть или растительное масло образует верхний, более легкий слой. (Учитель демонстрирует соответствующие опыты.)
В результате отстаивания выпадает роса из тумана, осаждается сажа из дыма, отстаиваются сливки в молоке.
А на чем основано разделение гетерогенных смесей с помощью фильтрования?
Ученик. На различной растворимости веществ в воде и на различных размерах частиц.
Учитель. Верно, через поры фильтра проходят лишь соизмеримые с ними частицы веществ, в то время как более крупные частицы задерживаются на фильтре. Так можно разделить гетерогенную смесь поваренной соли и речного песка.
Ученик показывает опыт: наливает в смесь песка и соли воду, перемешивает, а затем пропускает взвесь (суспензию) через фильтр – раствор соли в воде проходит через фильтр, а крупные частицы нерастворимого в воде песка остаются на фильтре.
Учитель. А какие вещества можно использовать в качестве фильтров?
Ученик. В качестве фильтров можно использовать различные пористые вещества: вату, уголь, обожженную глину, прессованное стекло и другие.
Учитель. Какие примеры применения фильтрования в жизни человека вы можете привести?
Ученик. Способ фильтрования – это основа работы бытовой техники, например пылесосов. Его используют хирурги – марлевые повязки; буровики и рабочие элеваторов – респираторные маски. С помощью чайного ситечка для фильтрования чаинок Остапу Бендеру – герою произведения Ильфа и Петрова – удалось забрать один из стульев у Эллочки Людоедки («Двенадцать стульев»).
Учитель. А теперь, познакомившись с этими способами разделения смеси, давайте поможем героине русской народной сказки «Василиса Прекрасная».
Ученик. В этой сказке Баба-Яга приказала Василисе отделить рожь от чернушки и мак от земли. Героине сказки помогли голуби. Мы же теперь можем разделить крупы фильтрованием через сито, если крупинки имеют разные размеры, или взбалтыванием с водой, если частицы имеют разную плотность или различную смачиваемость водой. Возьмем в качестве примера смесь, состоящую из крупинок различного размера: смесь манной и гречневой круп. (Ученик показывает, как манка с меньшими размерами частиц проходит через сито, а гречка остается на нем.)
Учитель. А вот со смесью веществ, имеющих разную смачиваемость водой, вы сегодня уже знакомились. О какой смеси я говорю?
Ученик. Речь идет о смеси порошков железа и серы. Мы проводили с этой смесью лабораторный опыт.
Учитель. Вспомните, как вы разделяли такую смесь.
Ученик. С помощью отстаивания в воде и с помощью магнита.
Учитель. Что вы наблюдали, разделяя смесь порошков железа и серы с помощью воды?
Ученик. Несмачивающийся порошок серы всплывал на поверхность воды, а тяжелый смачивающийся порошок железа оседал на дно.
Учитель. А как происходило разделение этой смеси с помощью магнита?
Ученик. Порошок железа притягивался магнитом, а порошок серы – нет.
Учитель. Итак, мы познакомились с тремя способами разделения гетерогенных смесей: отстаиванием, фильтрованием и действием магнитом. А теперь рассмотрим способы разделения гомогенных (однородных) смесей. Вспомните, после отделения фильтрованием песка мы получили раствор соли в воде – гомогенную смесь. Как из раствора выделить чистую соль?
Ученик. Выпариванием или кристаллизацией.
Учитель демонстрирует опыт: вода испаряется, а в фарфоровой чашке остаются кристаллы соли.
Учитель. При выпаривании воды из озер Эльтон и Баскунчак получают поваренную соль. Этот способ разделения основан на различии в температурах кипения растворителя и растворенного вещества.
Если вещество, например сахар, разлагается при нагревании, то воду испаряют неполностью – упаривают раствор, а затем из насыщенного раствора осаждают кристаллы сахара.
Иногда требуется очистить от примесей растворители с меньшей температурой кипения, например воду от соли. В этом случае пары вещества необходимо собрать и затем сконденсировать при охлаждении. Такой способ разделения гомогенной смеси называется дистилляцией, или перегонкой.
Учитель показывает перегонку раствора медного купороса, вода испаряется при tкип = 100 °С, затем пары конденсируются в пробирке-приемнике, охлаждаемой водой в стакане.
Учитель. В специальных приборах – дистилляторах получают дистиллированную воду, которую используют для нужд фармакологии, лабораторий, систем охлаждения автомобилей.
Ученик демонстрирует рисунок сконструированного им «прибора» для дистилляции воды.
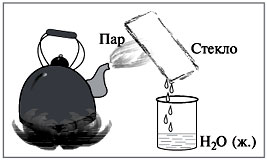
Учитель. Если же разделять смесь спирта и воды, то первым будет отгоняться (собираться в пробирке-приемнике) спирт с tкип = 78 °С, а в пробирке останется вода. Перегонка используется для получения бензина, керосина, газойля из нефти.
Особым методом разделения компонентов, основанным на различной поглощаемости их определенным веществом, является хроматография.
Учитель демонстрирует опыт. Он подвешивает полоску из фильтровальной бумаги над сосудом с красными чернилами, погружая в них лишь конец полоски. Раствор впитывается бумагой и поднимается по ней. Но граница подъема краски отстает от границы подъема воды. Так происходит разделение двух веществ: воды и красящего вещества в чернилах.
Учитель. С помощью хроматографии русский ботаник М.С.Цвет впервые выделил хлорофилл из зеленых частей растений. В промышленности и лабораториях вместо фильтровальной бумаги для хроматографии используют крахмал, уголь, известняк, оксид алюминия. А всегда ли требуются вещества с одинаковой степенью очистки?
Ученик. Для различных целей необходимы вещества с различной степенью очистки. Воду для приготовления пищи достаточно отстоять для удаления примесей и хлора, используемого для ее обеззараживания. Воду для питья нужно предварительно прокипятить. А в химических лабораториях для приготовления растворов и проведения опытов, в медицине необходима дистиллированная вода, максимально очищенная от растворенных в ней веществ. Особо чистые вещества, содержание примесей в которых не превышает одной миллионной процента, применяются в электронике, в полупроводниковой, ядерной технике и других точных отраслях промышленности.
Учитель. Послушайте стихотворение Л.Мартынова «Дистиллированная вода»:
Вода
Благоволила
Литься!
Она
Блистала
Столь чиста,
Что ни напиться,
Ни умыться.
И это было неспроста.
Ей не хватало
Ивы, тала
И горечи цветущих лоз,
Ей водорослей не хватало
И рыбы, жирной от стрекоз.
Ей не хватало быть волнистой,
Ей не хватало течь везде.
Ей жизни не хватало
Чистой –
Дистиллированной воде!
Для закрепления и проверки усвоения материала учащиеся отвечают на следующие вопросы.
1. При измельчении руды на горно-обогатительных фабриках в нее попадают обломки железных инструментов. Как их можно извлечь из руды?
2. Перед переработкой бытового мусора, а также бумажной макулатуры необходимо избавиться от железных предметов. Как проще всего это сделать?
3. Пылесос всасывает воздух, содержащий пыль, а выпускает чистый. Почему?
4. Вода после мойки автомобилей в крупных гаражах оказывается загрязненной машинным маслом. Как следует поступить перед сливом ее в канализацию?
5. Муку очищают от отрубей просеиванием. Почему это делают?
6. Как разделить зубной порошок и поваренную соль? Бензин и воду? Спирт и воду?
Л и т е р а т у р а
Аликберова Л.Ю. Занимательная химия. М.: АСТ-Пресс, 1999; Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. Химия. 8 класс. М.: Дрофа, 2002; Габриелян О.С. Химия.
8 класс. М.: Дрофа, 2000; Гузей Л.С., Сорокин В.В., Суровцева Р.П. Химия. 8 класс. М.: Дрофа, 1995; Ильф И.А., Петров Е.П. Двенадцать стульев. М.: Просвещение, 1987; Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю. Химия. Учебник для учащихся 8 класса общеобразовательных учреждений. М.: Вентана-Граф, 1997; Рудзитис Г.Е., Фельдман Ф.Г. Химия. Учебник для 8 класса общеобразовательных учреждений. М.: Просвещение, 2000; Тыльдсепп А.А., Корк В.А. Мы изучаем химию. М.: Просвещение, 1998.
Чистые вещества и смеси. Разработка урока, презентация, дополнительные материалы
 Химия, 8 класс
Химия, 8 класс
Чистые вещества и смеси
Цели:
Образовательно-развивающие:
Усвоение новых понятий:
Чистое вещество
Смесь
Гетерогенные смеси
Гомогенные смеси
Применение опорных понятий:
Вещество
Плотность
Температура кипения
Формирование УУД:
Определять понятия
Классифицировать понятия
Формулировать вопросы понятия и вопросы-суждения
Отвечать на вопросы-понятия и вопросы-суждения
Формулировать умозаключения
Воспитательная:
Формирование диалектико-материалистического мировоззрения через философскую категорию «количество-качество»
Оборудование:
Компьютер, проектор
Раздаточный материал:
Учебный текст
Карточки с заданиями
Заявка на оценку:
«5» — 25 и более
«4» — 20 – 24 балл
«3» — 15 – 19 баллов
Содержание урока:
Этап урока
Содержание деятельности учителя
Время/ баллы
Содержание деятельности учащихся
1. Вход в урок
Организационный момент.
Приветствие учащихся
Вступительное слово учителя:
Любое вещество обладает строго определёнными свойствами, отличающими его от других веществ. Но жизненный опыт часто противоречит этому: столовый уксус отличается от яблочного, а сахар, полученный из свёклы, от сахара тростникового. Дело в том ,что нас окружают не чистые вещества, а смеси
— Запишите тему урока: Чистые вещества и смеси.
1.3. Определение учебных целей: Сформулируйте цели урока в виде вопросов – понятий по карточке №
2. Сообщает заявку на оценку
5 мин
По 1 баллу тем, кто сформулировал вопрос
Слушают. Личностные УУД: восприятие речи учителя.
Что такое чистые вещества?
Что такое смеси?
Каковы свойства и виды смесей?
В чём заключается сущность образования смеси?
В чём заключается сущность разделения смеси?
2. Изучение нового материала
Задание 1
Итак, в природе чистое вещество практически никогда не встречается. Любое, даже самое чистое вещество имеет примеси.
Индивидуальный труд. Прочитайте текст «Чисты вещества и смеси», выполните задания в карточке:
1. Сформулируйте определения понятий: чистое вещество, смесь, гомогенные смеси, гетерогенные смеси.
2. Сравните чистое вещество и смеси по признакам — состав, количество веществ, физические свойства
3. Составьте схему деления смесей по размеру частиц.
4.Разделите смеси на группы:1) молоко, 2) варенье, 3) чай, 4) гранит, 5) нефть, 6) мыло, 7) кисель, 8) дым, 9) туман, 10) воздух
2. Групповой труд.
1 группа. Понятие «Чистое вещество», таблица «Сравнительная характеристика чистого вещества и смеси», один вопрос суждение.
2 группа. Понятие «Смесь», схема «Смеси по размеру частиц», один вопрос суждение
3 группа. Понятие «Гомогенные смеси», выделение гомогенных смесей из списка, один вопрос суждение.
4 группа. Понятие «Гетерогенные смеси», выделение гетерогенных смесей из списка, один вопрос суждение.
3. Коллективный труд. Выступление от групп
Проверка ответов по слайдам презентации.
Дополнительный материал. Слайд-шоу «Примеры чистых веществ», «Примеры смесей»
2 балла за каждое определение
(1 балл за неполное определение)
Всего 8 баллов
По 1 баллу за каждую ячейку.
Всего 6 баллов
2 балла за схему
(0,5 балла за каждую смесь, правильно соотнесенную с понятием)
Всего 5 балов
По 1 баллу выступающим за каждый ответ
По 2 балла за вопрос-суждение
1. Чистое вещество – вещество образованное только одинаковыми частицами, обладают постоянными свойствами.
Смесь – продукт смешения, механического соединения веществ, на вступающими в химическую реакцию
Гетерогенные смеси – смеси, в которых невооруженным глазом или при помощи микроскопа видны частицы веществ, составляющих смесь.
Гомогенные смеси — смеси, в которых нельзя заметить частицы веществ, входящих в смесь ( даже при помощи микроскопа).
2. Сравнительная характеристика чистого вещества и смеси.
Признаки
Чистое вещество
Смесь
Состав
Постоянные
Меняется
Количество веществ
Одно и то же
Различные, 2 и более
Физические свойства
Постоянные
Зависят от состава и соотношения частей
Свойства компонентов сохраняются
Смеси (по размеру частиц)
3.Гомогенные
Гетерогенные
3, 5, 6, 7, 10 1, 2, 4, 8, 9
Вопросы-суждения.
— Каким образом различаются чистые вещества и смеси?
-Каким образом различаются гомогенные и гетерогенные смеси?
— Как доказать, что молоко относится к гетерогенным смесям?
— Как доказать что нефть является гомогенной смесью?
— В каком случае смесь является гомогенной?
— Почему туман относится к гетерогенным смесям?
Задание 2.
Способы разделения смесей
Мы выяснили, что нас окружают смеси. А в технике, химическом производстве, медицине, фармацевтике требуются чистые вещества.
Каким образом чистое вещество можно получить из смеси?
1. Индивидуальный труд. Что бы ответить на этот вопрос, изучим текст «Разделение смесей» и рисунок.
Заполнить таблицу «Способы разделения смесей»
Способ разделения
Вид смеси
Свойства компонентов
Пример смеси
2. Групповой труд.
1 группа. «Фильтрование».
2 группа «Выпаривание».
3 группа «Перегонка».
4 группа «Отстаивание».
1 балл за каждую ячейку.
Всего 9 баллов
1 балл выступающему.
«Способы разделения смесей»
Способ разделения
Вид смеси
Свойства компонентов
Пример смеси
Фильтрование
Гетерогенные
Жидкость + тв. Нерастворимые.
2, 8
Выпаривание
Гомогенные
Жидкость +тв. Растворимое в-во
3
Перегонка
Гомогенные
Жидкости с разной Т. кип.
5
Отстаивание
Гетерогенные
Жидкости, жид+тв Нераст. Разная плотность веществ. Твердые вещества, одно из которых растворимо
1
Ответ на вопрос-суждение: Чистое вещество можно получить из смеси путем разделения разными способами в зависимости от свойств компонентов смеси.
Обобщение
Чем объяснить, что для разных смесей используют разные способы разделения?
Объяснить то, что для разных смесей используют разные способы разделения, можно разными свойствами компонентов разных смесей.
Итог
Вспомним цели урока.
Достигли мы этих целей? Сможем теперь ответить на поставленные вопросы?
По 2 балла за ответ.
Что такое чистые вещества?
Что такое смеси?
Каковы свойства и виды смесей?
В чём заключается сущность образования смеси?
В чём заключается сущность разделения смеси?
Да. Проговаривают определения понятий.
Свойства смесей зависят от свойств компонентов, образующих эту смесь и их соотношения.
Смеси бывают гомогенные и гетерогенные.
Сущность образования смеси заключается в смешении, механическом соединении веществ, на вступающими в химическую реакцию
Сущность разделения смеси заключается в выделении ее компонентов фильтрованием, перегонкой, отстаиванием, выпариванием. Способ разделения выбирается в зависимости от свойств компонентов смеси.
Выставление оценок
Подсчитайте свои баллы, сравните с заявкой на оценку.
Домашнее задание.
1. Прочитать параграф, выучить определения, ответить на вопросы после параграфа.
2. Используя дополнительны источники информации, кратко охарактеризовать метод разделения смеси – центрифугирование.
3. Провести «Домашний эксперимент»
— Приготовить три одинаковых стакана.
— В один налейте холодную воду и поставьте на 30 минут в холодильник.
— Вынув стакан с водой из холодильника, налейте в два других холодную и теплую водопроводную воду.
— С помощью часов отмечайте время появления пузырьков на стеках стаканов.
— Сделайте вывод из эксперимента в форме умозаключения.
Конспект урока по химии на тему «Чистые вещества и смеси» 7 класс
Тема. Чистые вещества и смеси
Цель: сформировать представление о чистых веществах и смесях, способах разделения смесей, изучить отличия чистых веществ и смесей; изучить классификации смесей; изучить некоторые способы разделения смесей и свойства, лежащие в основе разделения; продолжить знакомство с лабораторным оборудованием; формирование приемов умственной деятельности: анализа, синтеза, сравнения, обобщения; развивать умения правильно наблюдать и делать выводы из наблюдений; развивать умения выполнять химический эксперимент; формирование умений работать в группах; воспитывать точность и организованность в работе, при выполнении химического эксперимента.
Тип урока. Урок усвоения нового материала
Ход урока
Организационный момент
Актуализация
Что изучает химия? (вещества)
Но вещества могут существовать не только отдельно друг от друга, но и в виде смесей.
Тема нашего урока: Чистые вещества и смеси.
Основной этап урока
Чистые вещества в природе встречаются очень редко, чаще вещества встречаются в виде смесей.
Абсолютно чистое вещество, не содержащее примесей других молекул, получить чрезвычайно трудно. Поэтому на практике чистым называют вещество, состоящее из молекул одного вида, в котором других молекул настолько мало, что они не влияют на его свойства.
Реальные вещества всегда содержат какие-то примеси. Даже лекарственные вещества, к чистоте которых предъявляются особые требования, всегда содержат незначительные примеси других веществ. Но этих примесей так мало, что наш организм их просто не замечает. В то же время лекарство с истекшим сроком годности может стать неактивным или даже оказать побочное действие, поскольку количество примесей в нем накопилось выше определенного предела.
Не нужно думать, что чистые вещества абсолютно во всех случаях лучше смесей. Например, нельзя дышать чистым кислородом. Если бы из атмосферы вдруг по каким-то причинам исчез азот, «разбавляющий» кислород до безопасного уровня, все живые организмы на суше погибли бы в течение нескольких часов, а растительность на всех континентах была бы полностью уничтожена чудовищным пожаром.
Слово «смесь» произошло от слов «смешивать», «перемешивать»
Смесь состоит из двух и более компонентов, находящихся в непосредственном контакте друг с другом.
Смеси могут быть различными. Они делятся на однородные (гомогенные) и неоднородные (гетерогенные) системы.
Однородная смесь – смесь, в которой ее компоненты невозможно различить визуально.
Неоднородная смесь — смесь, в которой компоненты смеси можно различить визуально.
Гомогенные смеси можно делить по агрегатному состоянию на твердые, жидкие и газообразные.
— Приведите примеры.(сплавы, растворы солей, смесь газов).
Гетерогенные смеси в свою очередь тоже бывают различными:
Суспензии – гетерогенная смесь, в которой частицы твердого вещества равномерно распределены в жидкости (мука+вода).
Эмульсии – гетерогенные смеси, в которых частицы одной жидкости равномерно распределены в другой. (масло+вода).
Многие лекарства являются смесями. В аптеках готовят из чистых лекарственных веществ микстуры, что в переводе с латинского означает именно смеси. Особым случаем смесей являются растворы. Если смесь глины с песком можно на глаз отличить от песка и глины, то, растворив поваренную соль в воде, мы получим прозрачную жидкость, по внешнему виду неотличимую от воды. Однако в этой смеси частицы, составлявшие ранее кристаллы соли, равномерно распределены в толще молекул растворителя (воды). Если позволить воде испариться, то соль выпадет на дно сосуда в виде тех же кристаллов.
Химическое превращение в итоге не произошло — соль и вода остались самими собой.
Если даже лекарства не бывают абсолютно чистыми, то что же тогда можно называть (в широком смысле) чистым веществом, а что — смесью? К счастью, есть такие физические свойства вещества, которые перестают изменяться после того, как количество примесей уменьшается до определенного уровня. Для очень многих целей вещество с такими неизменными свойствами можно считать чистым. Эти физические свойства — точка плавления и точка кипения. Если плавление образца какого-нибудь вещества не растягивается на несколько градусов, а происходит в пределах одного градуса, такое вещество химик обычно называет чистым. Если вещество кипит при одной температуре, которая не изменяется по мере испарения образца, скорее всего, это тоже чистое вещество. Конечно, из этих правил бывают исключения, поэтому окончательный вывод о чистоте вещества можно сделать только на основании анализа. Что такое химический анализ, мы обсудим позже.
В известных сказках мачеха или другие злыдни заставляли героиню разделять некоторые смеси на отдельные компоненты. — — Вспомните, какие это были смеси, на основе чего было разделение?
— Перед тем, как испечь пирог, муку просеивают через сито. Можно отнести это к способам разделения смесей? На чем основан этот способ?
Как же выделяют чистые вещества из смесей? Для этого существует несколько способов. Опишем некоторые из них.
Чтобы задача выглядела полезной с практической точки зрения, рассмотрим очистку воды. Допустим, в нашем распоряжении есть около полулитра загрязненной воды. В любом населенном пункте найти такую воду не проблема (можно взять воду из лужи или пруда).
Демонстрация
Вода + Песок + Соль + Металлическая стружка
Учитель демонстрирует способы разделения смесей: отстаивание, фильтрование, действие магнитом; однородных смесей: выпаривание.
Действие магнитом. Т.к. металл обладает способностью намагничиваться, то при помощи магнита извлечем из нашей смеси металлическую стружку.
Отстаивание. Нальем грязную воду в химический стакан и дадим спокойно постоять. Через некоторое время наиболее крупные частицы примесей осядут на дно. Жидкость в верхней части стакана станет светлее. Если на поверхности имеется тонкая радужная пленка — значит, вода загрязнена не только частичками почвы, ила, но и нефтепродуктами.
Фильтрование. Осторожно сольем жидкость с осадка в воронку, в которую вставлен фильтр из пористой бумаги.
Воронка находится в другом сосуде, в котором скапливается уже гораздо более чистая вода. На фильтре остаются мелкие частицы примесей. Полученная вода еще не пригодна для питья, так как в ней содержатся бактерии, а также растворенные органические вещества и соли. Но полученная нами вода уже вполне пригодна для того, чтобы помыть доску или полить цветок.Задание 1.
Выпаривание. При нагревании нашего раствора, вода испарится, а соль кристаллизуется на стенках сосуда.
Закрепление
По каким свойства кухонную соль можно ошибочно принять за сахар?
Составьте план разделения смеси
ПЕНОПЛАСТ + СОЛЬ + ЖЕЛЕЗНАЯ СТРУЖКА

4.

5.
Домашнее задание
Приработать параграф 7, письменно 7.20, 7.4
Чистые вещества и смеси. Способы очистки веществ.
План урока химии
Неделя 2
День 3
Занятие 3
Класс 8
Тема занятия:
Чистые вещества и смеси. Способы очистки веществ.
Общие цели:
— научить отличать чистые вещества от смесей
— научить методам разделения смесей
— Развивать критическое мышление на уроках
— Воспитывать умение работы в парах
Результаты обучения:
Учащиеся смогут:
— различать чистые вещества от смесей;
— работать в парах;
— самооценивать свою работу на уроке.
Ключевые идеи:
Поиск дополнительной информации способствует развитию поисковой деятельности учащихся.
Задания:
1. Побуждение.
Создание благоприятного климата в классе.
Проверка д/з. с. 7 вопросы 1-16
2. Презентация.
Знакомство с темой урока.
Основные термины:
Смеси, однородные, неоднородные, отстаивание, фильтрование, фильтрат, перекристаллизация, перегонка.
Задание № 1:
Что вы подразумеваете под словом «смеси»?
Какие бывают смеси?
Запись в тетрадях:
Смеси включают в себя два и более веществ.
По агрегатному состоянию смеси делятся на однородные и неоднородные.
Опыт № 1: растворение сахара в воде.
Опыт № 2: растворение порошка мела в воде.
Однородные смеси- прозрачный раствор, в котором даже под микроскопом нельзя обнаружить отдельные частицы веществ.
Неоднородные смеси – раствор, в котором даже невооруженным глазом можно разглядеть частицы веществ.
Опыт № 3: разделение смеси серы и железных опилок.
А) с помощью магнита
Б) растворением в воде
Что мы наблюдаем в данном опыте?
Что они доказывают?
Данные опыты доказывают, что вещества в смесях сохраняют свои индивидуальные свойства.
Разделение и очистка смесей.
Выделение не растворимых в воде веществ из неоднородной смеси.
Отстаивание.
1. Смесь железных и древесных опилок. Как нужно разделить эту смесь?
2. Нужно очистить озерную воду от мелкого песка.
Фильтрование.
Дана смесь поваренной соли, песка и глины.
Что нужно сделать?
1. Взболтать смесь, поваренная соль растворяется, а песок оседает.
2. Глина не растворяется и не оседает, поэтому нужно отфильтровать смесь.
3. Чтобы выделить поваренную соль из раствора нужно перекристаллизовать раствор.
Выделение растворимых в воде веществ из однородной смеси.
Перекристаллизация.
1. Разделить смесь соли и воды.
Раствор, полученный фильтрованием называется фильтрат.
Перекристаллизация – способ очистки, при котором вначале вещество растворяют в воде, а затем этот раствор выпаривают.
Перегонка.
1. Произвести разделение и очистку природной воды.
Перегонка (дистилляция) – способ разделения однородной жидкой смеси путем испарения летучих жидкостей и последующей конденсации в виде паров.
3.Применение.
С. 10 у. 8-11
У. 8
Воздух, родниковая вода, снег, лед. Есть ли среди них чистые вещества?
Ответ: нет
У.9
Укажите чистые вещества и смеси. Чистые вещества: медная проволока,
Гвоздь, поваренная соль.
Смеси: воздух, водяной пар, бензин.
У. 11
Однородные смеси: чай, молоко, мед.
Неоднородные: кирпич, камень.
Разделите смесь веществ:
1. Песок, железные опилки, поваренная соль.
2. Мел, древесные опилки, сахарный песок.
Мотивация, совместное целеполагание.
(5 мин)
Взаимопроверка (работа в парах)
(20 мин)
15 мин
Домашнее задание
§2-4 с.10 у. 12,13письменно и ответить на вопросы устно.
2 мин
Рефлексия
Подведение итогов урока. Что понравилось? Что узнал (а)?
3 мин
Источники:
Учебник химии 8 класс. Н.Н. Нурахметов, К.А. Сарманова.
Чистые вещества и смеси
ЧИСТЫЕ ВЕЩЕСТВА И СМЕСИ
Трибунская Елена Жановна, учитель химии и биологии
муниципального автономного общеобразовательного учреждения
«Средняя общеобразовательная школа №7» г. Балаково
Саратовской области»
Этап
урока
Деятельность
Планируемые результаты
учителя
учащихся
личностные
метапредметные
предметные
Этап мотивации к учебной деятельности
Приветствует учащихся, проверяет готовность к уроку: Здравствуйте, я рада видеть вас и надеюсь, вы готовы к успешному и плодотворному сотрудничеству сегодня на уроке
Мотивирует учащихся к активной учебно-познавательной деятельности: В начале нашего урока, давайте вспомним, что изучает наука Химия? На какие группы можно разделить вещества?
Посмотрите на глобус.
71 % нашей планеты занимает вещество, без которого не было бы жизни на нашей земле. Что это за вещество?
Прослушайте стихотворение и скажите, какое слово пропущено в стихотворении Л.Мартынова?
Вода
Благоволила
Литься!
Она
Блистала
Столь чиста,
Что ни напиться,
Ни умыться.
И это было неспроста.
Ей не хватало
Ивы, тала
И горечи цветущих лоз,
Ей водорослей не хватало
И рыбы, жирной от стрекоз.
Ей не хватало быть волнистой,
Ей не хватало течь везде.
Ей жизни не хватало
Чистой –
Дистиллированной воде!
Сделайте вывод, о каких веществах пойдет сегодня речь?
Дежурный класса дает список отсутствующих
Отвечают на вопросы, дают определения:
Вещества органические и неорганические, простые и сложные, самое распространенное на земле вода
Анализируют стихотворение, обобщают и делают вывод о существовании чистых веществ.
умение соблюдать дисциплину на уроке, уважительно относиться к учителю и одноклассникам использовать личный жизненный опыт и кругозор.
Умение организовать свою деятельность, сформулировать проблему, оценивать свои достижения и сравнивать их с достижениями других.
Умение слушать одноклассников
систематизация и классификация материала
Актуализация знаний
Этап исследования (в группах)
А так ли часто в повседневной жизни мы встречаемся с чистыми веществами? Как вы думаете, где чистые вещества находят применение?
Дополняет ответы учащихся: в природе нет абсолютно чистых веществ. В современной химии научились получать особо чистые, содержащие до 10% примесей. Например, в полупроводниковой технике применяют сверхчистые вещества, где примеси составляют всего 1 атом на миллион атомов основного элемента (Si, Ge). Превышение нормы ведет к резкому ухудшению полупроводниковых свойств этих веществ.
Как вы думаете, одним или несколькими веществами образованы такие лекарственные препараты как суспензии и эмульсии?
Подводит учащихся к теме урока, цели и задачам.
Особо чистые вещества нужны в атомной энергетике, полупроводниковой промышленности, стекловолоконной оптике, для научных исследований и промышленности.
Формулируют тему, записывают ее в индивидуальный лист
Чистые вещества и смеси
Формулируют цель и задачи урока.
Дать понятие чистое вещество, смеси веществ.
Чем отличаются чистые вещества и смеси, какие бывают смеси, и где они находят практическое применение
использование теоретических знаний в практической деятельности;
сотрудничество с одноклассниками, умение работать в группе, слушать вступать в диалог
умение работать по алгоритму; работать с лаб. оборудованием, учебником, контроль, сличение с эталоном, коррекция действий, оценка усвоенного и что предстоит усвоить
формулирование познавательной цели; установление причинно-следственных связей.
Этап исследования (в парах)
Организует учащихся к решению поставленной проблемы. Побуждает к осознанию противоречия между имеющимися знаниями и наблюдаемыми результатами.
Изучите график. Подумайте, какой вывод можно сделать?
Обозначает проблему: «Почему у морской воды, по сравнению с дистиллированной, tкип не постоянная в разные промежутки времени?
С помощью учителя формулируется определение, что называется чистым веществом.
Для дальнейшей работы нам необходимо вспомнить правила техники безопасности.
Организует лабораторную работу учащихся в паре.
Инструкция для учащихся к опыту
«Изучение свойств железа и серы»
1. Насыпьте на лист бумаги отдельными кучками порошки серы и железа, рассмотрите их цвет, агрегатное состояние вещества.
2. Возьмите небольшую часть каждого вещества и проведите следующие операции:
а) испытайте магнитом;
б) опустите в стакан с водой.
3. Смешайте стеклянной палочкой оба порошка на бумаге, рассмотрите цвет смеси.
4. Дайте определение, что такое смеси?
5. Проведите со смесью те же операции, что и с чистыми веществами.
6. Сделайте вывод, сохраняют ли свои индивидуальные свойства вещества, которые находятся в смеси с другими веществами?
Дополняет ответы учащихся: Способность веществ сохранять свои индивидуальные свойства позволяет отличать их друг от друга в смеси, что широко используется человеком: определяется количество железа в руде, различные примеси в воде.
Аргументируют свою точку зрения, делают вывод: у морской воды непостоянная температура кипения в разные промежутки времени, а у дистиллированной воды температура кипения постоянная
Учащиеся делают вывод, что соленость морской воды влияет на температуру кипения.
Чистые вещества – вещества, которые обладают постоянными физическими свойствами (температуры кипения, температуры плавления, плотность). Примером чистого вещества может случить дистиллированная вода.
Вспоминают правила техники безопасности: с веществами необходимо работать аккуратно, при работе со стеклянной посудой требуется осторожность, чтобы не разбить и не поранить себя
Учащиеся проводят в парах лабораторную работу
Делают вывод из эксперимента, и производят запись в тетради
Свойства
Сера
Железо
1. цвет
светло-желтый
темно-серый
2.отношение к воде
всплывает на поверхность
тонет в воде
3.отношение к магниту
не притягивается
притягивается
к магниту
Делают вывод, что сера и железо обладают разными свойствами.
Отвечают на вопрос, записывают определение: смеси – это сочетание двух и более веществ
Делают вывод, что вещества, находящиеся в смеси сохраняют свои индивидуальные свойства.
планирование учебного сотрудничества со сверстниками
формулирование и аргументация своего мнения и позиции в коммуникации;
умение выражать свои мысли в соответствии с задачами и условиями коммуникации
анализ с целью выделения признаков; подведение под понятие, выведение следствий;
установление причинно-следственных связей;
построение логической цепи рассуждений;
доказательство;
выдвижение гипотез и их обоснование.
формирование умений и навыков практической работы с реактивами и х/посудой
формирование умений оформлять результаты исследований
Этап организации информации
Самостоятельная работа с взаимопроверкой по эталону
Организует самостоятельное выполнение учащимися задания на новую тему с последующей взаимопроверкой. Организует работу с таблицей «Сравнительная характеристика чистого вещества и смеси».
Работают с таблицей
Признаки сравнения
Чистое вещество
Смесь
Состав
Постоянный
Непостоянный
Вещества
Одно и то же
Различные
Физические свойства
Постоянные
Непостоянные
Выполняют самостоятельную работу
Производят взаимопроверку
Оценивают одноклассников
сотрудничество с одноклассниками, умение слушать вступать в диалог;
осознание ответственности за индивидуальную работу.
умение организовать выполнение заданий учителя, анализировать, сравнивать, умение сделать выбор, делать выводы по результатам работы, применить жизненные наблюдения в другой обстановке, использовать информацию с других уроков, из разных источников
извлечение необходимой информации из прослушанного текста: определение основной и второстепенной информации
Реализация построенного проекта
Организует работу с коллекциями
Как Вы думаете: нефть, гранит, мрамор это смесь или чистое вещество?
Возьмите лупу и попробуйте рассмотреть компоненты, входящие в состав смеси?
Задает вопрос, на какие группы можно разделить смеси?
Организует физминутку
Рассматривают примеры природных смесей, делают вывод, что смеси можно разделить на 2 группы: однородные (гомогенные) и неоднородные (гетерогенные). Записывают схему в персональном листе ученика, дают определения
Физминутка
Делают упражнения
осознание ответственности за индивидуальную работу;
сотрудничество с одноклассниками, умение слушать вступать в диалог;
сравнение своих выводов с выводами одноклассников, коррекция знаний, самооценка по результатам работы
умение структурировать учебный материал, выделять в нем главное, систематизировать и делать выводы
Первичное закрепление с проговариванием во внешней речи
В каких агрегатных состояниях могут находиться вещества, входящие в состав смеси? (в мыльных пузырях, в природном газе?)
Показывает видеофрагмент о природном газе
Организует самостоятельную работу по учебнику. Используя учебник с.67-68 выписать из текста примеры природных смесей, и смесей, встречающихся в повседневной жизни. Какое они находят практическое применение
Отвечают на вопросы, приводят свои аргументы, смотрят видеофрагмент.
Работают по учебнику, заполняют таблицу.
Агрегатное состояние веществ
Примеры смесей
Твердое-твердое
Кулинарные смеси
Твердое-жидкое
Раствор соли
Твердое-газообразное
Пыль в воздухе
Жидкое-жидкое
Уксусная кислота и вода
Жидкое-газообразное
Туман
Газообразное-газообразное
смог
планирование учебного сотрудничества в случае затруднений; умение соблюдать дисциплину на уроке, уважительно относиться к учителю и одноклассникам
осознание качества и уровня усвоения материала, коррекция; участие в коллективном обсуждении
умение структурировать предложенный материал
Рефлексия УД на уроке
Подводит итог урока
Какая была тема урока?
Достигли ли мы поставленной цели?
Каждый работал по-разному, оцените свою работу на уроке «Для меня урок сегодня…»
Учащимся дается индивидуальная карточка, в которой нужно подчеркнуть слово напротив фраз, характеризующих его работу на уроке
В заключение хочется зачитать высказывание академика Н. Н. Семенова о значении химии: «Все мы связываем с химической наукой дальнейший прогресс в познании окружающего нас мира. И не может быть в наши дни специалиста, который сумел бы обойтись без знания химии»
Кого из одноклассников вы бы отметили сегодня на уроке? Почему?
Отвечают на вопросы
Выполняют самоанализ урока.
Прием «Для меня урок сегодня…»
1.На уроке я работал
активно пассивно
2.Своей работой на уроке я
доволен
не доволен
3.Материал урока мне был
понятен
не понятен
полезен бесполезен
интересен скучен
самооценка на основе критерия успешности; адекватное понимание причин успеха / неуспеха в учебной деятельности.
оценка, коррекция знаний, применение знаний на практике; участие в коллективном обсуждении
контроль и оценка процесса и результатов деятельности;
Домашнее задание
Параграф 12. Используя учебник, с.66 выписать из текста примеры, характеризующие схему: физическое тело-материал-вещество.
Творческое задание по выбору: Создание презентации: «Применение методов химического анализа в работе криминалистов, археологов, медиков, искусствоведов»
Записывают домашнее задание.
проявление потребности к самореализации
самооценка по результатам работы
анализ проведенной работы
Подведение итогов
Выставляет оценки
Подают дневники
Чистые вещества и смеси — ГДЗ Габриелян Сладков 8 класс рабочая тетрадь
ЧАСТЬ 11. Чистые вещества представлены одним веществом, имеющим одну химическую формулу. Смеси состоят из нескольких веществ, каждое из которых имеет свою химическую формулу → если свойства компонентов смеси разные, то их можно разделить на основании этих свойств.
2. Классификация смесей (примеры).

3. Синонимы: однородные смеси – гомогенные;
неоднородные смеси – гетерогенные.
4. Химический анализ – это установление состава смесей.
ЧАСТЬ 2
1. Распределите по двум столбцам следующие вещества: дистиллированная вода, бронза, алюминий, воздух, гранит, кефир, сера.

2. Напишите, какие минералы входят в состав горной породы – гранита. Кремнезем, полевой шпат, кварц, плагиоклаз.
3. Приведите состав двух используемых на кухне смесей, изучив сведения на их упаковках. 1) поваренная соль
2) сахар
4. Дополните таблицу, записав в неё по два примера смесей.

5. Дополните таблицу «Смеси и их применение». Для выполнения задания используйте возможности Интернета.

6. Подготовьте сообщение или презентацию на тему «Использование химического анализа в той или иной области человеческой деятельности» (область применения выберите самостоятельно). Для выполнения задания используйте возможности Интернета.
Определение нитратов в пищевых продуктах с целью обеспечения безопасности и качества, в частности, овощей и фруктов. Каждый крупный рынок, где продают овощи и фрукты имеет химическую лабораторию, в которой проводят анализ – определяют количество нитрат – ионов в образцах. Предельно допустимое количество нитратов в овощах нормируется нормативными документами – ГОСТами, СанПинами, где для каждого вида продукции указана предельная допустимая концентрация нитрат-ионов. Если содержание нитратов в данном образце превышает эту норму, то продукцию бракуют и не допускают к продаже. Анализ проводится следующим способом. Образец данного овоща тщательно моется, измельчается, берётся навеска, равная 10 граммам и к ней добавляются алюмокалиевые квасцы. Специальный прибор – нитратомер – определяет в этом образце содержание нитратов.
Занятие по химии на тему «Чистые вещества и смеси. Дисперсные системы»
Занятие по химии
Тема: «Чистые вещества и смеси. Дисперсные системы»
Составил: преподаватель УИФ ГБПОУ «ИЭК» Е.И.Панов
Цели:
Повторить в ходе выполнения эвристических заданий понятия «чистые вещества», «смеси», «дисперсная система», «классификация дисперсных систем»
На конкретных примерах разобрать особенности строения и свойств различных дисперсных систем и их значение в практической деятельности человека
Продолжить формирование ключевых компетенций у обучающихся, умений анализировать, сравнивать, сопоставлять, обобщать, делать выводы
Тип занятия: обобщения и закрепления знаний
Форма проведения занятия: лекция с элементами практической работы
Технология, используемая на занятии: развития критического мышления
Время проведения занятия: 90 минут
Ход занятия
1. Стадия вызова
Учитель: Здравствуйте, ребята, мы продолжаем изучить науку химию и сегодня рассмотрим некоторые понятия. На доске приведены несколько карточек. Нам пока неизвестно, как они связаны между собой. Рассмотрите их внимательно, постарайтесь определить каким образом их можно совместить, это поможет определить тему занятия. Время на выполнения задания – 10 минут (Учащиеся выполняют задание, после один ученик по желанию составляет схему на доске).
Химические системы, чистые вещества, смеси, простые вещества, сложные вещества, гомогенные (однородные), гетерогенные (неоднородные).
У вас должна получиться следующая схема:
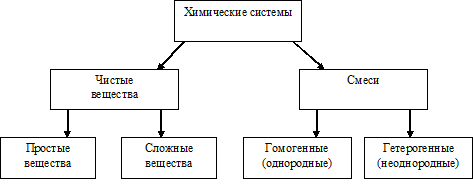
Итак, давайте попробуем сформулировать тему занятия (варианты ответов учащихся).
Тема занятия «Чистые вещества и смеси. Дисперсные системы».
2. Стадия осмысления
Чтобы дополнить составленную схему, вам необходимы дополнительные сведения. Чтобы их получить, предлагаю выполнить следующее задание. У вас на столах лежит текст для маркировки. Прочитайте текст, используя условные обозначения, сделайте пометки на полях. Время на выполнение задания 20 минут. После работы желающие выступят с результатами (ответы учащихся).
Я добавлю на доску дополнительные карточки. Расставьте их, пожалуйста. На это вам еще 10 минут.
Изменяемый состав (да, нет)
Состоит из атомов одного элемента (да, нет)
Есть граница раздела? (да, нет)

Текст для маркировки «Чистые вещества и смеси»
Условные обозначения: «+» новая информация, «v» известная информация, «—» противоречивые данные (я ошибался), «?» недостаточно данных (не понятно)
1. Понятия «смесь», «компонент», «примесь» В повседневной жизни каждый из нас сталкивается со множеством смесей веществ, имеет дело не только с чистыми, но и загрязненными веществами. Важно уметь различать данные понятия и уметь определять по конкретным признакам, с чем имеешь дело: чистым или загрязненным веществом, индивидуальным веществом или смесью веществ. Ведь человек хочет употреблять только ту воду, которая не содержит вредных примесей. Дышать мы хотим воздухом, не загрязненным вредными для здоровья газами. В медицине и производстве лекарственных препаратов проблема получения и использования чистых веществ особенно актуальна. |
|
Смесь – это то, что образуется при перемешивании двух и более различных по свойствам веществ. |
|
Вещества, составляющие смесь, называют компонентами. Например, воздух – смесь газов: азота, кислорода, углекислого газа и других. |
|
Если масса одного компонента в десятки раз меньше массы другого компонента смеси, то его называют примесью. Говорят, что вещество загрязнено. Например, воздух может быть загрязнен угарным газом, продуктом неполного сгорания органических соединений, в частности бензина. Кстати, бензин – это смесь органических веществ – углеводородов. |
|
КЛАССИФИКАЦИЯ СМЕСЕЙ. Смеси отличаются друг от друга по внешнему виду. Например, соленая вода (смесь поваренной соли и воды) и смесь речного песка и воды. В первом случае нельзя увидеть границы раздела фаз твердое-жидкое. Такую смесь называют однородной (или гомогенной). Другими примерами однородных смесей являются уксус (смесь уксусной кислоты и воды), воздух, сахарный сироп. |
|
Смесь речного песка и воды относят к неоднородным (или гетерогенным) смесям, т.к. состав такой смеси неодинаков в разных точках объема. Неоднородными являются смеси глины и воды, бензина и воды. |
|
В основном, всё, что нас окружает, – это смеси веществ. Более того, веществ, абсолютно не содержащих примесей, не бывает. |
|
Но принято говорить об относительной чистоте вещества, т.е. вещества имеют разную степень чистоты. |
|
2. Степень чистоты вещества Если примеси не обнаруживаются при использовании вещества в технических целях, то вещество называется технически чистым. Например, вещество, из которого делают фиолетовые чернила, может иметь в своем составе примеси. Но если эти примеси никак не влияют на качество чернил, то оно — технически чистое. |
|
Если примеси не обнаруживаются с помощью химических реакций, то вещество относят к химически чистым. Например, это дистиллированная вода. |
|
3. Признаки индивидуальности вещества Чистое вещество иногда называют индивидуальным веществом, т.к. оно обладает строго определенными свойствами. Например, только дистиллированная вода имеет температуру плавления 0С, температуру кипения 100С и не имеет вкуса и запаха. |
|
А изменяются ли свойства веществ в смеси? Чтобы ответить на этот вопрос, проведем простой опыт. Смешаем порошки серы и железа. Мы знаем, что железо притягивается магнитом, а сера – нет. Сохранило ли железо свое свойство после смешения с серой? Подействуем магнитом на смесь порошков серы и железа. Мы видим, что железо в смеси с серой не утратило способности к намагничиванию. |
|
Теперь нам необходимо записать в тетрадь определения важных понятий по теме занятия.
Смесь – система, состоящая из двух или более веществ (компонентов).
Гомогенная однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно (между частями системы нет поверхностей раздела).
Гетерогенная неоднородная система, состоящая из однородных частей (фаз), разделённых поверхностью раздела. Однородные части (фазы) могут отличаться друг от друга по составу и свойствам.
Дисперсная фаза – совокупность мелких однородных твёрдых частиц, капелек жидкости или пузырьков газа, равномерно распределённых в окружающей (дисперсионной) среде.
Дисперсионная среда – непрерывная фаза (тело), в объёме которой распределена другая (дисперсная) фаза в виде мелких твёрдых частиц, капелек жидкости или пузырьков газа.
А сейчас немного отдохнем и проведем физминутку.
Один хлопок – команда рукам (поднять, опустить)
Два хлопка – команда ногам (встать, сесть).
В ходе выполнения следующего задания вам необходимо изучить примеры различных дисперсных систем и соотнести их с определенным типом. На доске представлены карточки. Вы выполняете задание в тетради, затем проверяем, что у вас получилось. Время – 20 минут.
газ — жидкость
газ — твердое вещество
жидкость — газ
жидкость — жидкость
твердое вещество — твердое вещество
твердое вещество — газ
твердое вещество — жидкость
жидкость — твердое вещество
кислород
соль
уксус
фосфор
вода с сахаром
смесь древесных и медных опилок
сплав железа с углеродом
растительное масло в воде медный купорос
туман
облака
дым
смог
пыль в воздухе
газированные напитки
взбитые сливки
зубная паста
керамика
пенопласт
поролон
пористый шоколад
молоко
майонез
плазма крови
цитоплазма
морской ил
строительные смеси
желе желатин
помада
оксолиновая мазь
горные породы
цветные стекла
Дисперсионная среда | Дисперсная фаза | Название системы | Пример |
Газ | Жидкость | Аэрозоль | Туман, облака, карбюраторная смесь бензина с воздухом в двигателе автомобиля |
Газ | Твердое вещество | Аэрозоль | Дым, смог, пыль в воздухе |
Жидкость | Газ | Пена | Газированные напитки, взбитые сливки |
Жидкость | Жидкость | Эмульсия | Молоко, майонез, жидкие среды организма (плазма крови, лимфа), жидкое содержимое клеток (цитоплазма, кариоплазма) |
Жидкость | Твердое вещество | Золь, суспензия | Речной и морской ил, строительные растворы, пасты |
Твердое вещество | Газ | Твердая пена | Керамика, пенопласта, полиуретан, поролон, пористый шоколад |
Твердое вещество | Жидкость | Гель | Желе, желатин, косметические и медицинские средства (мази, тушь, помада) |
Твердое вещество | Твердое вещество | Твердый золь | Горные породы, цветные стекла, некоторые сплавы |
3. Стадия рефлексии
Подведем итоги занятия. Для этого выполним небольшой тест. Я буду зачитывать вслух вопросы и варианты ответов, а вы отвечайте в своих тетрадях.
1. Укажите чистые вещества (2,3):
1) воздух; 2) азот
3) дистиллированная вода; 4) газированная вода
2. Чистые вещества, в отличие от смесей (1):
1) имеют постоянные физические и химические свойства
2) имеют только постоянные физические свойства
3) имеют постоянный количественный и качественный состав
4) имеют только постоянные химические свойства
3. Укажите неоднородные смеси веществ (1,3,4):
1) гранит; 2) раствор сахара в воде
3) морковный сок; 4) сметана
4. Укажите однородные смеси веществ (1,3):
1) раствор йода в спирте; 2) кефир
3) сплав золота и меди; 4) смесь муки и соли
5. Однородную смесь можно получить путем смешивания следующих веществ (2,3):
1) угля и песка; 2) углекислого газа и воздуха
3) азота и кислорода; 4) глины и воды
Оценки за занятие вы поставите себе сами, используйте оценочные листы, подпишите их и сдайте мне.
В завершении хочу показать вам небольшой видеоролик по теме занятия (просмотр видеоролика 6 минут).
В качестве домашнего задания вы выполните самостоятельную работу №3, которую найдете на нашем сайте в разделе «Студенту». Благодарю за плодотворную работу.
Список использованных источников
https://interneturok.ru/chemistry/8-klass/bpervonachalnye-himicheskie-predstavleniyab/chistye-veschestva-i-smesi
Габриелян О.С. Химия. учеб. для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г.Остроумов. – М.: Издательский центр «Академия», 2011. – С.58-64
https://ru.wikipedia.org/wiki/Дисперсные_системы
Тест: комплект видеоуроков «Химия. 9 класс» (проект для учителей Videouroki.net)
