Как расставлять коэффициенты в химии: простое объяснение
Пример разбора простых реакцийВсе химические реакции, проходящие в окружающем мире можно описать при помощи специальных уравнений, представляющих собой химические формулы и математические знаки с коэффициентами. И от правильно расставленных коэффициентов в химических уравнениях порой зависит не много не мало, а то какой собственно и будет химическая реакция и будет ли она вообще. В нашей статье мы расскажем о том, как правильно расставлять коэффициенты в химии, чтобы химические уравнения были записаны верно.
Пример разбора простых реакций
Главное правило, которым следует руководствоваться при составлении химических уравнений – принцип сохранения энергии вещества, то есть, сколько есть атомов каждого химического элемента в левой части уравнения, столько должно быть и в правой части того же уравнения.
Для примера возьмем химическую реакцию взаимодействия кальция (Ca) с кислородом (O2).
Теперь вернемся к нашему простому примеру реакции взаимодействия кальция и кислорода. Ее можно записать следующим образом:
Ca + O2 → 2CaO
О чем говорит эта запись? О том, что в результате химической реакции взаимодействия кальция с кислородом образуется оксид кальция, который записан формулой CaO. Но также обратите внимание, что в правой части оксид кальция мы записали с коэффициентом 2 – 2CaO.
2Ca + O2 → 2CaO
Теперь мы можем проверить наше уравнение – с левой стороны у нас два атома кальция и с правой тоже два, а значит между обеими частями можно вполне справедливо поставить знак равенства:
2Ca + O2 = 2CaO
Разберем еще один простой пример, из взаимодействия кислорода и водорода как мы знаем, рождается одно из самых ценным и необычных веществ во Вселенной (и это без преувеличения) – вода, основа жизни на нашей планете. Образование воды можно записать следующим уравнением:
H2 + O2 → H2O
Но где же здесь закралась ошибка? Давайте разберем: в левой части у нас два атома кислорода, а в правой только один. Значит перед формулой воды необходимо поставить коэффициент 2:
Значит перед формулой воды необходимо поставить коэффициент 2:
H2 + O2 → 2H2O
Умножение 2 молекул воды на 2 атома водорода даст нам 4 атома водорода с правой стороны, но ведь с левой стороны атомов водорода лишь два! Значить перед водородом в уравнении мы также должны поставить коэффициент 2 и теперь получим правильное химическое уравнение, где вместо стрелочки → можно уже смело поставить знак равенства.
2H2 + O2 = 2H2O
Пример разбора сложной реакции
Теперь давайте разберем то, как проставлять коэффициенты в более сложных химических уравнениях:
NaOH + H 2SO4 → Na2SO4 + H2O
Перед вами запись так званой реакции нейтрализации – взаимодействие кислоты и основания, в результате которого образуются соли и вода.
Что же мы имеем тут: с левой стороны у нас один атом натрия (Na), а с правой индекс говорит, что атомов натрия уже стало два. Значит логично, что химическую формулу основания гидроксида натрия NaOH надо умножить на 2. Или другими словами поставить перед ней коэффициент 2:
Значит логично, что химическую формулу основания гидроксида натрия NaOH надо умножить на 2. Или другими словами поставить перед ней коэффициент 2:
2NaOH + H2SO4 → Na2SO4 + H2O
Количество серы в серной кислоте (H2SO4) и соли сульфате натрия (Na2SO4) у нас одинаковое, тут все хорошо, а вот с количеством кислорода и водорода опять несоответствие, с левой стороны кислорода 6, а с правой 5. Водорода с правой стороны 4, а с левой только 2, непорядок. Чтобы правильно записать это химическое уравнение надо сравнять количество кислорода и водорода в левой и правой части уравнения, к счастью тут сделать это просто, надо перед H
2NaOH + H2SO4 = Na2SO4 + 2H2O
Таким образом, количество всех химических элементов в правой и левой части уравнения у нас сравнялись, а значит, мы неспроста поставили знак равенства.
Для закрепления материала разберем еще один пример сложного уравнения.
Ba(OH)2 + HNO3 → Ba(NO3)2 + H2O
Это уравнение отображает химическую реакцию гидроксида бария (Ba(OH)2) с азотной кислотой (HNO3) в результате которой образуется нитрат бария (Ba(NO3)2) и вода.
Пример этот нам интересен тем, что тут используются скобки. Они означают, что если множитель стоит за скобками, то каждый элемент умножается на него. Начнем же разбирать это уравнение, первое, что бросается в глаза, несоответствие азота N, слева он один, а вот справа, если принимать во внимание скобки, его уже два. Получим следующее:
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + H2O
Теперь у нас слева стало 4 атома водорода, а справа только 2. Значит, перед формулой воды также ставим коэффициент 2.
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Теперь все элементы уравнены, и мы справедливо поставили знак равенства.
Видео
И чтобы окончательно закрепить материал, рекомендуем посмотреть это образовательное видео.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Коэффициенты в химических уравнениях — Справочник химика 21
Физический смысл наклона отношение коэффициентов в химическом уравнении. [c.280]
[c.280]Эквивалент. Атомы и молекулы вступают друг с другом в химическое взаимодействие в определенных количественных соотношениях, называемых стехиометрическими. Выражающие их коэффициенты в химических уравнениях называют стехиометрическими коэффициентами. В основе стехиометрии (раздела химии, изучающего количественные соотношения участвующих в химических реакциях веществ) лежат четыре закона закон сохранения массы, закон постоянства состава, закон кратных отношений, закон эквивалентов (первые три закона изучают в школьном курсе химии). Согласно закону эквивалентов вещества реагируют и образуются в количествах, пропорциональных их эквивалентам (т. е. в эквивалентных количествах). [c.9]
Вернемся теперь к производственным проблемам. Используя в качестве единицы измерения моль, можно рассчитать массу диоксида серы, освобождающегося в процессе производства, Коэффициенты в химическом уравнении показывают число молей исходных веществ и продуктов.
 Следовательно [c.141]
Следовательно [c.141] Таким образом, подбор коэффициентов в химическом уравнении осуществляется с помощью простых рассуждений после того, как записана схема реакции. При подборе коэффициентов для уравнений окислительно-восстановительных реакций удобно пользоваться другими приемами (см. 7.3).
При алгебраическом суммировании теплот следует учитывать стехиометрические коэффициенты в химических уравнениях. [c.165]
N — мощность, число молекул, молярная доля ДЛ — разность между числом молей продуктов реакции и числом молей исходных веществ п — валентность, коэффициент в химическом уравнении (число молекул), содержание вещества, степень полимеризации Р — общее давление ДР — перепад давления р — парциальное давление, коэффициент в химическом уравнении Q — количество тепла общее, теплотворная способность, тепло реакции д — количество тепла частное, тепло реакции, коэффициент в химическом уравнения, содержание вещества, количество функциональных групп [c. 368]
368]
Как видно, подбор коэффициентов в химических уравнениях осуществляется с помощью простых рассуждений после того, как написаны схемы реакций. Для нахождения коэффициентов уравнений так называемых окислительно-восстановительных реакций удобно пользоваться особыми методами (см. 7.1). [c.15]
При алгебраическом суммировании теплот образования (сгорания) следует учитывать стехиометрические коэффициенты в химических уравнениях. Так, для реакции [c.177]
Стехиометрические уравнения с массовыми стехиометрическими коэффициентами. В расчетах материального баланса реакционного элемента используют и другие формы записи химических превращений. Стехиометрические коэффициенты в химических уравнениях, отражающие количества компонентов, вступающих в химическое взаимодействие и традиционно измеряемые в молях, можно выразить в массовых величинах, умножив мольные коэффициенты на молекулярную массу Например, в мольном выражении стехиометрических коэффициентов окисление диоксида серы выглядит так  250]
250]
Здесь т] — число молей третьего индифферентного компонента, растворенных в 1 моле растворителя (считая, что состав его выражается составом исходной смеси, т. е. х молей А и 1 — х молей В) р и 9 — коэффициенты в химическом уравнении (I) у — выход соединения, т. е. число молей АрВ образующихся в 1 моле исходной смеси к — число молей третьего индифферентного вещества, растворенных в одном моле растворителя, причем расчет ведется на 1 моль равновесной смеси. [c.471]
Каждая стадия а) имеет свое стехиометрическое число ( ,), показывающее, сколько раз должна повториться данная стадия для осуществления одного акта сложной реакции (стехиометрические числа стадий следует строго отличать от стехиометрических коэффициентов в химическом уравнении реакции). Каждая схема механизма должна быть обязательно дополнена набором величин п , например [c.48]
При расстановке коэффициентов в химическом уравнении нельзя произвольно изменять формулы веществ (т. е. изменять индексы в формулах) уравнивание достигается только правильным подбором коэффициентов. [c.54]
е. изменять индексы в формулах) уравнивание достигается только правильным подбором коэффициентов. [c.54]
Уравняв число электронов в полуреакциях, определяют стехиомет-рические коэффициенты в химическом уравнении [c.7]
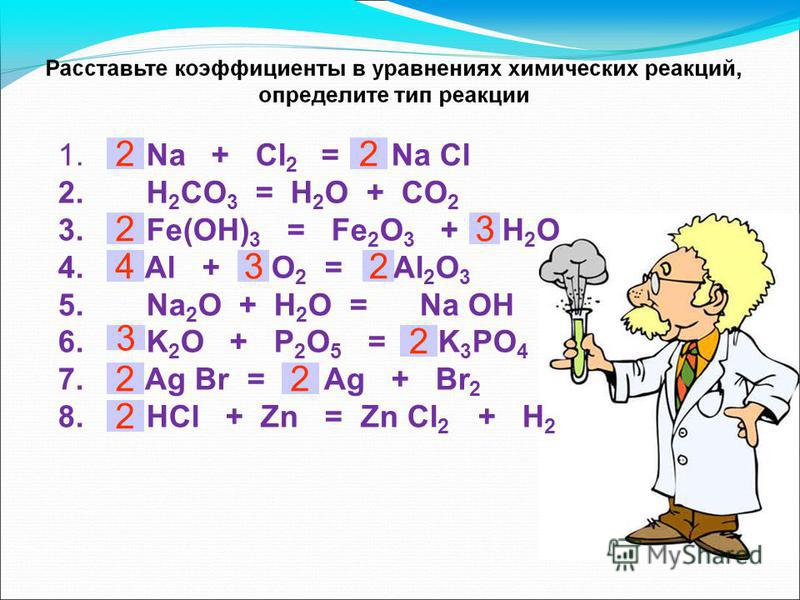
Цель научиться применять понятие о реакциях соединения, разложения, замещения при классификации конкретных реакций закрепить умение расставлять коэффициенты в химических уравнениях. [c.76]
Для словесного выражения значений индексов а, Ь, с, d, е… используются числовые приставки моно, мон (1), ди (2), три (3), тетра, тетр (4), пента, пент (5), гекса, гекс (6), гепта, гепт (7), 0кта, окт (8), нона, нон (9), дека, дек (10). В большинстве случаев (если это не грозит потерей однозначности названия) приставка моно, МОН может быть опущена. К числам одиннадцать и выше применяются непосредственно цифровые обозначения (в письме) или русские названия соответствующих чисел (в устной речи). То же относится и к дробным индексам в веществах нестехиометрического состава. Для неопределенных по значению чисел преимущественно используются приставки эн (п) и эм (т). Все числовые приставки пишутся слитно с тем словом, перед которым их ставят. Коэффициенты в химических уравнениях словесно выражают русскими наименованиями соответствующих чисел. [c.595]
Для неопределенных по значению чисел преимущественно используются приставки эн (п) и эм (т). Все числовые приставки пишутся слитно с тем словом, перед которым их ставят. Коэффициенты в химических уравнениях словесно выражают русскими наименованиями соответствующих чисел. [c.595]
Коэффициенты в химическом уравнении показывают не только число молекул, но и число молей исходных веществ и продуктов реакции. Например, уравнение 1.9.3 показывает, что в реакцию вступают 2 моля алюминия А1 и 6 молей хлороводорода НС1, а в результате реакции образуются 2 моля хлорида алюминия AI I3 и 3 моля водорода Нг. [c.41]
Тема 27. Химические уравнения. | 8 класс
Часть I
1. Закон Ломоносова-Лавуазье – закон сохранения массы веществ:
2. Уравнения химической реакции – это условная запись химической реакции с помощью химических формул и математических знаков.
3. Химическое уравнение должно соответствовать закону сохранения массы веществ, что достигается расстановкой коэффициентов в уравнении реакции.
4. Что показывает химическое уравнение?
1) Какие вещества вступают в реакцию.
2) Какие вещества образуются в результате.
3) Количественные отношения веществ в реакции, т. е. количества реагирующих и образующихся веществ в реакции.
4) Тип химической реакции.
5. Правила расстановки коэффициентов в схеме химической реакции на примере взаимодействия гидроксида бария и фосфорной кислоты с образованием фосфата бария и воды.
а) Запишите схему реакции, т. е. формулы реагирующих и образующихся веществ:
б) начинайте уравнивать схему реакции с формулы соли (если она имеется). При этом помните, что несколько сложных ионов в составе основания или соли обозначаются скобками, а их число – индексами за скобками:
в) водород уравняйте в предпоследнюю очередь:
г) кислород уравняйте последним – это индикатор верной расстановки коэффициентов.
Перед формулой простого вещества возможна запись дробного коэффициента, после чего уравнение необходимо переписать с удвоенными коэффициентами.
Часть II
1. Составьте уравнения реакций, схемы которых:
2. Напишите уравнения химических реакций:
3. Установите соответствие между схемой и суммой коэффициентов в химической реакции.
4. Установите соответствие между исходными веществами и продуктами реакции.
5. Что показывает уравнение следующей химической реакции:
1) Вступили в реакцию гидроксид меди и соляная кислота;
2) Образовались в результате реакции соль и вода;
3) Коэффициенты перед исходными веществами 1 и 2.
6. С помощью следующей схемы составьте уравнение химической реакции, используя удвоение дробного коэффициента:
7. Уравнение химической реакции:
4P+5O2=2P2O5
показывает количество вещества исходных веществ и продуктов, их массу или объём:
1) фосфора – 4 моль или 124 г;
2) оксида фосфора (V) – 2 моль, 284 г;
3) кислорода – 5 моль или 160 л.
Практическое занятие «Расстановка коэффициентов в уравнениях реакций»; 8 класс — К уроку — Химия
Учитель МАОУ «Гимназия №5» г. Чебоксары Василькова Татьяна Арсентьевна
Практическое занятие .«Качественные реакции» для учащихся 8 класса.
Очень важно формировать глубокое понимание законов химии, а также четкую логику действий при составлении уравнений. С этой целью предлагаю вариант проведения практической работы в курсе химии 8 класса по темам «Расстановка коэффициентов» и «Типы химических реакций». Также данный алгоритм поможет в подготовке к осознанному восприятию тем 9 класса в разделе «Теория электролитической диссоциации».
Особенностью варианта является то, что математический механизм расстановки индексов и коэффициентов с использованием информации таблицы растворимости можно наглядно представить ребятам в виде схемы. Отработка осуществляется в зависимости от уровня подготовленности группы учащихся. В менее подготовленной группе – совместные поэтапные действия. Более сильные группы усваивают механизм практически самостоятельно.
Более сильные группы усваивают механизм практически самостоятельно.
Работа содержит следующие этапы:
— знакомство с таблицей растворимости,
-введение понятий «составная часть» как «катион» и «анион» по знаку заряда,
-нахождение катионов и анионов в таблице растворимости (первый столбик и первая строка)
-работа в схемах АВ: А1В1, А1В2, А2В1 и так далее с зарядами +1, +2, +3, -1, -2, -3 по принципу электронейтральности,
-знакомство с алгоритмом «обмен составными частями, индексы, коэффициенты»:
Далее раздаются реактивы на опережающее знание качественного определения катионов без особого акцента на этом. Емкости с растворами веществ, содержащие надписи, являются основой для анализа содержания составных частей.
Таким образом в этом разборе есть элементы связи с будущими понятиями, такими как электролит, диссоциация, качественные реакции на катионы, на анионы.
Привожу примерный текст описания практической работы и раздаточной карточки .
Запишите дату, тему и цели урока.
Тема: Качественные реакции. Расстановка коэффициентов.
Цель работы:
-познакомиться с качественным определение катионов; с вариантами таблиц качественного определения катионов и анионов,
-закрепить навык составления формулы вещества и расчета индексов составных частей при составлении уравнений реакций обмена на основе проведенных реакций;
— закрепить навык расстановки коэффициентов и определения типа реакции.
Приборы и реактивы.
Капельная пластина, таблица растворимости, таблица качественного определения катионов.
Растворы: сульфата меди (II), хлорида или сульфата железа (II), (III), роданида калия, желтой и красной кровяной солей, гидроксида натрия, хлорида бария, нитрата серебра, сульфата алюминия, хлорида калия.
Ход работы: прочитайте инструкцию. Подготовьте все необходимое для проведения опыта по каждому из 8 пунктов. Запишите наблюдения в таблицу по стандартному формату, используя принятые в химии термины для понятий. Расставьте коэффициенты в уравнениях.
Подготовьте все необходимое для проведения опыта по каждому из 8 пунктов. Запишите наблюдения в таблицу по стандартному формату, используя принятые в химии термины для понятий. Расставьте коэффициенты в уравнениях.
Формат таблицы для отчета:
Задача | Ход работы, реактивы | Наблюдения, уравнения реакций | Выводы |
|
|
| |
|
|
| |
… |
|
|
|
Раздаточная карточка. В зависимости от уровня навыков группы устное текстовое сопровождение меняется.
Составление уравнения реакции обмена
на примере
качественного определения в растворе:
…катионов меди (II) (читается «меди два») или Cu2+ (читается «купрум два плюс») анионами ОН— или гидроксид-ионами (гидроксид-анионами)- читается «о аш минус» или при помощи раствора щелочи.
1.1. Готовое уравнение:
Cu SO4 + 2NaOH → Cu (OH)2 + Na2SO4
1.2. Схема, в которой формулы веществ даны в общем виде и составлены согласно принципу электронейтральности (сумма зарядов всех атомов, ионов, составных частей в формульной единице вещества равна нулю). При этом, в реальном уравнении коэффициент и индекс «единица» не пишется:
1 А1В1 + 2а1в1 → 1 А1в2 + 1а2В1
А также в схеме:
-часть А – катионы или положительно заряженные ионы,
-часть В – анионы или отрицательно заряженные ионы,
1А (+2)1В (-2)1 + 2а (+1)1 в (-1)1 → 1А (+2)1в (-1)2 + 1а (+1)2 В (-2)1
Красным цветом показаны заряды ионов (или составных частей). Заряды находим в таблице растворимости.
Заряды находим в таблице растворимости.
В более сложных случаях выводим математически, исходя из положения элементов в периодической системе химических элементов (ПСХЭ).
Синим цветом показаны индексы, которые рассчитаны математически согласно принципу электронейтральности и закону постоянства состава вещества.
Зеленым цветом показаны коэффициенты, которые рассчитываются математически согласно закону сохранения массы в химических уравнениях (число атомов, ионов, составных частей слева и справа в уравнении одинаково).
Последовательности составления уравнения реакции ионного обмена:
1.Составить формулы реагирующих веществ – то есть определить составные части, их заряды по таблице растворимости, рассчитать индексы. Записать формулы в левой части уравнения.
2.Произвести обмен составными частями.
3.Рассчитать индексы в образовавшихся веществах. Записать формулы продуктов реакции в правой части уравнения
4. Рассчитать коэффициенты для каждого вещества уравнения.
Рассчитать коэффициенты для каждого вещества уравнения.
…ионов железа (II) (читается «ионов железа два») гидроксид-ионами или раствором щелочи
Fe SO4 + 2NaOH → Fe (OH)2 + Na2SO4
1А1В1 + 2а1в1 → 1 А1в2 + 1 а2В1
1А (+2)1В (-2)1 + 2а(+1)1 в(-1)1 → 1А(+2)1в(-1)2 + 1а(+1)2 В(-2)1
…ионов железа (II) в растворе вещества раствором красной кровяной соли
3FeSO4 + 2K3 [Fe (CN)6] → Fe3[Fe (CN)6]2 + 3K2SO4
3А1В1 + 2а3в1 → 1 А3в2 + 3 а2В1
3А (+2)1В (-2)1 +2а (+1)3 в (-3)1 → 1А (+2)3в (-3)2 + 3а (+1)2 В (-2)1
…ионов железа (III) раствором щелочи
FeCl3 + 3NaOH → Fe (OH)3 + 3NaCl
…ионов железа (III) раствором желтой кровяной соли
4FeCl3 + 3K4 [Fe (CN)6] → Fe4[Fe (CN)6]3 + 12KCl
…ионов железа (III) роданид-ионами
…FeCl3 + … KSCN → … Fe (SCN)3 + … KCl
…ионов бария сульфат-ионами
…BaCl2 + …Al2(SO4)3 → …Ba SO4 + … Al Cl3
…ионов серебра хлорид-ионами (ионами хлора)
…AgNO3 + …KCl → …AgCl + …KNO3
Химия
1 задание — Проверка знания основных химических понятий.
Тест.
I Вариант:
1. Вещество:
А) капля воды;
Б) поваренная соль;
В) железный гвоздь;
Г) медная монета.
2. Простое вещество:
А) кислород;
Б) вода;
В) хлороводород;
Г) поваренная соль.
3. Химическое явление:
А) плавление льда;
Б) испарение воды;
В) растворение сахара в воде;
Г) горение лучины.
4.Шесть атомов кислорода можно записать как:
А) 6О2;
Б) 6О;
В) 2О3
Г) 3О2
5.Мr(SO3) равна:
А) 40
Б) 64
В) 80
Г) 72
II вариант:
1.Тело:
А) медный купорос;
Б) алюминий;
В) стеклянная пробирка;
Г) мел.
2.Сложное вещество:
А) белый фосфор;
Б) красный фосфор;
В) вода;
Г) водород.
3. Физическое явление:
А) ржавление железа;
Б) почернение меди при нагревании;
В) плавление металла;
Г) скисание молока.
4. Четыре молекулы кислорода можно записать так:
А) 4О2
Б) 4О
В) 4Н 2О
Г) 2О2
5.Mr(CuO) равна:
А) 37
Б) 80
В) 72
Г) 45
2 задание. На этапе проверяется умение определять валентность элемента по формуле и умение составлять формулу по валентности:
1. Проставить валентности над элементами:
K2O, MgO, Al2O3, BaCl2, Ch5, MnO2, Cl2O7
2. Составить формулы:
Ba и О, Na и О, Аl и F, Fe(III) и О, N(IV) и О, Cr(VI) и О
Задание – 3.Задание на разделение смеси.
Золушка собралась на бал. Но мачеха не хотела отпускать ее на бал, поэтому приготовила смесь из гвоздей, древесных опилок, песка и соли и дала ей задание: выбрать гвозди и соль из смеси. Золушка быстро справилась с заданием и успела на бал. Объясните и покажите, как Золушка так быстро справилась с этим заданием.
Золушка быстро справилась с заданием и успела на бал. Объясните и покажите, как Золушка так быстро справилась с этим заданием.
4 задание – Проверка умения составлять уравнения реакций:
$11. Расставьте коэффициенты в уравнениях химических реакции
I вариант
Ca+N2=Ca 3N2
h3+Cl2=HCl
II вариант
K+O2=K2O
H2+F2=HF
$12. Допишите уравнения реакций:
I вариант
Na+O2=
Al+S=
II вариант
Ba+O2=
Al+Cl2=
$13. Заполните пропуски и уравняйте
I вариант
Li+…=LiCl
…+O2=Fe2O3
II вариант
B+…=B2O3
S+…=SO3
Задание — 5. Задания вы можете выбрать, но помните: тот, кто решит задачу варианта В – 4 балла, С – 5 баллов.
С– 1
Ученик должен был взять для реакции 0,2 моль угля. Он отвесил на весах 2 г угля. Правильно ли он выполнил задание?
Он отвесил на весах 2 г угля. Правильно ли он выполнил задание?
С – 2
Ученик должен был взять для реакции 0,5 моль серы. Он отвесил на весах 8г серы. Правильно ли он выполнил задание?
В – 1
Рассчитайте массу 3 моль оксида алюминия.
В – 2
Рассчитайте массу 0,5 моль воды.
Взаимопроверка. Ответы высвечиваются на экране.
Ученики обмениваются тетрадями и проверяют работы друг — друга. За каждый правильный ответ 1 балл.
1 вариант
1-б
2-а
3-г
4-б
5-в
2 вариант
1-в
2-в
3-в
4-а
5-б
.
Ученики проверяют свои работы. За каждый правильный ответ 3-5 баллов, в зависимости от цвета карточки. Ответы записывает на доске 2 обучающихся
Обучающиеся предлагают способы выделения веществ из смеси. Проводят соответствующие опыты
Проводят соответствующие опыты
Оценивание:
«3» — выделение железных гвоздей
«4» — выделение песка и опилок
«5» — выделение соли
Ученики проверяют свои работы. За каждый правильный ответ 3-5 баллов, в зависимости от цвета карточки. Ответы высвечиваются на экране.
Ответы высвечиваются на экране. Ученики проверяют работу друг друга исходя из уровня выполнения задания.
Выставляют баллы
«5» — задача уровня С
«4»- задача уровня — В
Карточка-информатор. «Алгоритм расстановки коэффициентов в уравнениях химических реакций.»
РАССТАНОВКА КОЭФФИЦИЭНТОВ
Число атомов одного элемента в левой части уравнения должно быть равно числу атомов этого элемента в правой части уравнения.
Задание 1 (для групп). Определите число атомов каждого химического элемента, участвующего в реакции.
1. Вычислите число атомов:
а) водорода: 8Nh4, NaOH, 6NaOH, 2NaOH, НзРО4, 2h3SO4, 3h3S04, 8h3SO4;
6) кислорода: C02, 3C02, 2C02, 6CO,, h3SO4, 5h3SO4, 4h3S04, HN03.
2. Вычислите число атомов: а) водорода:
1) NaOH + HCl 2)Ch5+h30 3)2Na+h3
б) кислорода:
1) 2СО + 02 2) С02 + 2Н.О. 3)4NO2 + 2h3O + O2
Алгоритм расстановки коэффициентов в уравнениях химических реакций
Порядок выполнения операций
пример
1.Определить число атомов каждого элемента в левой и правой частях схемы реакции
А1 + О2→ А12О3
А1-1 атом А1-2
О-2 атома О-3
2. Среди элементов с разным числом атомов в левой и правой частях схемы выбрать тот, число атомов которого больше
О-2 атома слева
О-3 атома справа
3. Найти наименьшее общее кратное (НОК) числа атомов этого элемента в левой части уравнения и числа атомов этого элемента в правой части уравнения
НОК = 6
4. Разделить НОК на число атомов этого элемента в левой части уравнения, получить коэффициент для левой части уравнения
6:2 = 3
Аl + ЗО2→Аl2О3
5. Разделить НОК на число атомов этого элемента в правой части уравнения, получить коэффициент для правой части уравнения
6:3 = 2
А1+ О2→2А12О3
6. Если выставленный коэффициент изменил число атомов еще какого-либо элемента, то действия 3, 4, 5 повторить еще раз.
Если выставленный коэффициент изменил число атомов еще какого-либо элемента, то действия 3, 4, 5 повторить еще раз.
А1 + ЗО2→ →2А12О3
А1 -1 атом А1 — 4
НОК = 4
4:1=4 4:4=1
4А1 + ЗО2→ →2А12О3
.Первичная проверка усвоения знаний(8-10 мин.).
. В левой части схемы два атома кислорода, а в правой — один. Число атомов нужно выровнять с помощью коэффициентов.
1)2Mg+O2 →2MgO
2) СаСО3+ 2HCl→ СаСl2 + Н2О + СО2↑
Задание 2 Расставьте коэффициенты в уравнениях химических реакций (обратите внимание, что коэффициент изменяет число атомов только одного элемента):
1. Fe2O3 + Аl → Аl2О3 + Fe; Mg + N2 → Mg3N2;
2. Al + S → Al2S3; A1 + С→Al4C3;
3. Al + Cr2O3 →Cr + Al2O3; Ca + P→Ca3P2;
4. С + h3→Ch5; Ca + С→СаС2;
5. Fe + O2→ Fe3O4; Si + Mg→ Mg2Si;
6/.Na + S→ Na2S; CaO + С→ CaC2 + CO;
7. Ca + N2 → Ca3N2; Si + Cl2 → SiCl4;
8. Ag + S→ Ag2S; Н2 + Сl2 → НСl;
9. N2+ O2→ NO; СО2+ С→ СО;
10. HI → Н2→ + 12; Mg + НСl → MgCl2 + Н2;
HI → Н2→ + 12; Mg + НСl → MgCl2 + Н2;
11. FeS + НС1 → FeCl2 + h3S; Zn+ HCl → ZnCl2 + h3;
12. Br2+ KI → KBr+ I2; Si + HF(r) → SiF4 + h3;
1./ HCl+Na2CO3 → CO2+h3O+ NaCl; KClO3 + S→ →KCl+ SO2;
14. Cl2+ KBr→ KCl + Br2; SiO2 + С→ Si + CO;
15. SiO2 + С→ SiC + CO; Mg + SiO2 → Mg2Si + MgO
16. Mg2Si + HCl → MgCl2 + Sih5
1.Что такое уравнение химической реакции?
2.Что записывают в правой части уравнения? А в левой?
3.Что означает знак «+» в уравнении?
4. Зачем расставляют коэффициенты в уравнениях хим
Если Вы являетесь автором этой работы и хотите отредактировать, либо удалить ее с сайта — свяжитесь, пожалуйста, с нами.
3.9: Как писать сбалансированные химические уравнения
- Последнее обновление
- Сохранить как PDF
- Коэффициенты и индексы
- Уравновешивание химического уравнения
- Резюме
- Словарь
- Участие и авторство
Цели обучения
- Объясните роль индексов и коэффициентов в химических уравнениях.

- Сбалансируйте химическое уравнение, если дано несбалансированное уравнение.
- Объясните роль закона сохранения массы в химической реакции.
Несмотря на то, что химические соединения распадаются и образуются новые соединения во время химической реакции, атомы в реагентах не исчезают, и новые атомы не появляются в продуктах. В химических реакциях атомы никогда не образуются и не разрушаются. Это известно как Закон сохранения массы .Те же самые атомы, которые присутствовали в реагентах, присутствуют и в продуктах — они просто реорганизованы в другое расположение.
Коэффициенты и индексы
Есть два типа чисел, которые появляются в химических уравнениях. Есть нижние индексы (CO 2 ), которые являются частью химических формул реагентов и продуктов; и есть коэффициенты, напр. 2 CO 2, , которые помещаются перед формулами, чтобы указать, сколько молекул этого вещества используется или производится. 2 CO 2 указывает на наличие двух молекул углекислого газа.
2 CO 2 указывает на наличие двух молекул углекислого газа.
\[2 \ce{H_2} \left( g \right) + \ce{O_2} \left( g \right) \rightarrow 2 \ce{H_2O} \left( g \right)\]
в формировании воды, коэффициенты 2 H 2 H 2 , и 2 H 2 o и подписки для примера O 2 , H 2 и ч 2 О . и Вы не можете изменить нижние индексы в химической формуле, чтобы сбалансировать химическое уравнение; можно изменить только коэффициенты. Изменение индексов меняет соотношение атомов в молекуле и результирующие химические свойства. H 2 O отличается от H 2 O 2 Нижние индексы являются частью формул, и после определения формул для реагентов и продуктов нижние индексы нельзя изменять. Коэффициенты указывают количество каждого вещества, участвующего в реакции, и могут быть изменены, чтобы сбалансировать уравнение.
Химические реакции происходят в макроскопическом масштабе (мы их видим), и мы не можем видеть 2 молекулы углекислого газа, 2 CO 2 , но мы можем видеть моль вещества. Что это значит? Моль – это единица измерения количества чего-либо. Моль определяется как 6,02 x 10 90 104 23 90 105 элементов. Таким образом, в этом случае в 2 молях углекислого газа, 2 CO 2 , содержится 1,2 x 10 24 молекул углекислого газа. Помните, что молекулы субмикроскопичны.Мы можем обнаружить моли вещества в лаборатории и даже удержать его, но мы не можем удержать 2 молекулы.
Уравновешивание химического уравнения
Самый простой и наиболее полезный метод балансировки химических уравнений — это «проверка», более известная как метод проб и ошибок. Ниже приводится эффективный подход к балансировке химического уравнения с использованием этого метода.
шагов по балансировке химического уравнения
- Определите самое сложное вещество.

- Начиная с этого вещества, выберите элемент(ы), который(ые) присутствует только в одном реагенте и одном продукте, если возможно.Отрегулируйте коэффициенты, чтобы получить одинаковое количество атомов этого элемента (элементов) с обеих сторон.
- Сбалансируйте оставшиеся атомы, обычно заканчивая наименее сложным веществом и при необходимости используя дробные коэффициенты. Если использовался дробный коэффициент, умножьте обе части уравнения на знаменатель, чтобы получить целые числа для коэффициентов.
- Подсчитайте количество атомов каждого вида в обеих частях уравнения, чтобы убедиться, что химическое уравнение сбалансировано.Это означает, что вы сохранили массу в химической реакции.
Пример \(\PageIndex{1}\): сжигание гептана
Сбалансируйте химическое уравнение горения гептана (\(\ce{C_7H_{16}}\)).
\[\ce{C_7H_{16} (л) + O_2 (г) → CO_2 (г) + H_2O (г) } \номер\]
Раствор
| Ступени | Пример |
|---|---|
1. Определите самое сложное вещество. Определите самое сложное вещество. | Самым сложным веществом является вещество с наибольшим количеством различных атомов, то есть \(C_7H_{16}\). Предположим изначально, что итоговое сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества. |
| 2. Настройте коэффициенты. | а. Так как одна молекула н-гептана содержит 7 атомов углерода, нам нужно 7 молекул CO 2 , каждая из которых содержит 1 атом углерода, справа: \[\ce{C7h26 (л) + O2 (г) → } \underline{7} \ce{CO2 (г) + h3O (г) } \номер \]
б.Так как одна молекула н-гептана содержит 16 атомов водорода, нам нужно 8 H 2 молекул O, каждая из которых содержит 2 атома водорода, справа: \[\ce{C7h26 (л) + O2 (г) → 7 CO2 (г) + } \underline{8} \ce{h3O (г) } \nonumber \]
|
3. Баланс многоатомных ионов как единое целое. Баланс многоатомных ионов как единое целое. | В этой реакции не учитываются многоатомные ионы. |
| 4. Сбалансируйте остальные атомы. | Атомы углерода и водорода теперь уравновешены, но у нас 22 атома кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать атомы кислорода, регулируя коэффициент перед наименее сложным веществом, O 2 , на стороне реагента: \[\ce{C7h26 (л) + }\underline{11} \ce{ O2 (г) → 7 CO2 (г) + 8h3O (г) } \номер\]
|
| 5. Проверьте свою работу. | Теперь уравнение уравновешено, дробные коэффициенты отсутствуют: с каждой стороны 7 атомов углерода, 16 атомов водорода и 22 атома кислорода. Всегда проверяйте, чтобы убедиться, что химическое уравнение сбалансировано. Всегда проверяйте, чтобы убедиться, что химическое уравнение сбалансировано. |
Пример \(\PageIndex{2}\): сжигание изооктана
Сжигание изооктана (\(\ce{C_8H_{18}}\))
\[\ce{C8h28(л) + O2(г) -> CO_2(г) + H_2O(г)} \номер\]
Раствор
Предположение о том, что окончательное сбалансированное химическое уравнение содержит только одну молекулу или формульную единицу самого сложного вещества, не всегда верно, но с него можно начать.При сгорании любого углеводорода с кислородом образуется углекислый газ и вода.
| Ступени | Пример |
|---|---|
| 1. Определите самое сложное вещество. | Самое сложное вещество — это вещество с наибольшим числом различных атомов, то есть \(\ce{C8h28}\). Предположим изначально, что итоговое сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества. Предположим изначально, что итоговое сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества. |
| 2. Настройте коэффициенты. | а. Первым элементом, который появляется в реагентах только один раз, является углерод: 8 атомов углерода в изооктане означает, что в продуктах должно быть 8 молекул CO 2 : \[\ce{C8h28(л) + O2(г) -> }\underline{8} \ce{CO2(г) + h3O(г)}\номер\]
б.18 атомов водорода в изооктане означает, что в продуктах должно быть 9 молекул H 2 молекул O: \[\ce{C8h28 (л) + O2 (г) -> 8CO2 (г) + }\underline{9} \ce{ h3O(г)} \номер\]
|
3. Сбалансируйте оставшиеся атомы. Сбалансируйте оставшиеся атомы. | Атомы углерода и водорода теперь сбалансированы, но у нас 25 атомов кислорода справа и только 2 атома кислорода слева.Мы можем сбалансировать наименее сложное вещество, O 2 , но поскольку на молекулу O 2 приходится 2 атома кислорода, мы должны использовать дробный коэффициент (\(\dfrac{25}{2}\)) для балансировки атомов кислорода: \[\ce{C8h28 (ж) + } \underline{ \dfrac{25}{2} } \ce{O2 (г)→ 8CO2 (г) + 9h3O(г) }\номер\]
Теперь уравнение сбалансировано, но мы обычно пишем уравнения с целыми коэффициентами.Мы можем исключить дробный коэффициент, умножив все коэффициенты в обеих частях химического уравнения на 2 : \[ \underline{2} \ce{C8h28(л) + } \underline{25} \ce{O2(г) ->} \underline{16} \ce{CO2(г) + } \underline{18 } \ce{h3O(g)} \номер\] |
4. Проверьте свою работу. Проверьте свою работу. | Сбалансированное химическое уравнение содержит 16 атомов углерода, 36 атомов водорода и 50 атомов кислорода с каждой стороны. Уравнения баланса требуют от вас некоторой практики, а также некоторого здравого смысла. Если вы обнаружите, что используете очень большие коэффициенты или если вы безуспешно потратили несколько минут, вернитесь и убедитесь, что вы правильно написали формулы реагентов и продуктов. |
Упражнение \(\PageIndex{1}\)
Сбалансировано ли каждое химическое уравнение?
- \(\ce{2Hg(ℓ)+ O_2(g) \rightarrow Hg_2O_2(s)}\)
- \(\ce{C_2H_4(г) + 2O_2(г)→ 2CO_2(г) + 2H_2O(г)}\)
- Ответить на
- да
- Ответ б
- нет
- Ответ c
- да
Упражнение \(\PageIndex{2}\)
Сбалансируйте следующие химические уравнения.
- \(\ce{N2 (г) + O2 (г) → NO2 (г) }\)
- \(\ce{C6h24(ж) + O2(г)→ CO2(г) + h3O(г)}\)
- Ответить на
- N 2 (ж) + 2O 2 (ж) → 2NO 2 (ж)
- Ответ b
- 2C 6 H 14 (л) + 19O 2 (г)→ 12CO 2 (г) + 14H 2 O(г)
Резюме
- Чтобы быть полезными, химические уравнения всегда должны быть сбалансированы.Сбалансированные химические уравнения имеют одинаковое количество и тип каждого атома в обеих частях уравнения.
- Коэффициенты в сбалансированном уравнении должны представлять собой простейшее отношение целых чисел. Масса всегда сохраняется в химических реакциях.
Словарь
- Химическая реакция — Процесс, в котором одно или несколько веществ превращаются в одно или несколько новых веществ.

- Реагенты — Исходные материалы в реакции.
- Продукты — Материалы, присутствующие в конце реакции.
- Сбалансированное химическое уравнение — Химическое уравнение, в котором количество атомов каждого типа одинаково в двух частях уравнения.
- Нижний индекс — Часть химических формул реагентов и продуктов, указывающая число атомов предшествующего элемента.
- Коэффициент — Небольшое целое число, которое появляется перед формулой в сбалансированном химическом уравнении.
Взносы и ссылки
Эта страница была создана на основе контента следующих авторов и отредактирована (тематически или подробно) командой разработчиков LibreTexts в соответствии со стилем, презентацией и качеством платформы:
Страница не найдена | Футхилл Колледж
Позвольте нам помочь вам найти то, что вам нужно
Пришли на эту страницу после поиска в Google?
|
Также попробуйте выполнить следующие действия. |
Поиск рекомендаций по навигации
Важное примечание о результатах поиска
Если неработающая ссылка включает .php:- Наш устаревший веб-сайт использовал расширение файла .php .
- Наш новый сайт использует .HTML
- Если результаты поиска по вашим ключевым словам дают вам вторичный выбор для .html , сначала попробуйте .html.
- Некоторые из наших страниц все еще используют старый .php, пока они не будут перенесены на новый сайт.
Благодарим вас за терпение!
Сообщить о неработающей ссылке
Помогите нам исправить неработающую ссылку и получить необходимую информацию!
Электронная почта ceballosjulie@fhda. edu и [email protected].
edu и [email protected].
Пожалуйста, укажите :
- URL-адрес (веб-адрес) отсутствующей веб-страницы.
- Сообщение электронной почты, в котором была неработающая ссылка, и от кого она была отправлена (если применимо).
- URL-адрес (веб-адрес) страницы, на которую была установлена неработающая ссылка из (если применимо).
Большое спасибо за ваше терпение и помощь.
Поделитесь своим отзывом
Если у вас есть минутка, мы будем рады узнать, что вы думаете о нашем сайте!
Электронная почта [email protected] и smithvanessa@fhda. edu.
edu.
Как сбалансировать химические уравнения?
Чтобы сбалансировать химическое уравнение, начните с подсчета количества атомов каждого элемента по обе стороны от стрелки.Затем сбалансируйте первичные элементы (оставив водород и кислород напоследок), умножив их на соответствующие числа, и, наконец, сбалансируйте водород и кислород таким же образом.
Каким был бы вкус вашей еды, если бы ингредиенты не были добавлены в правильных пропорциях?
Плохо? Может, совсем несъедобно?
Как и в случае с пищей, ингредиенты химической реакции (реагенты) должны присутствовать в правильных пропорциях для образования желаемых продуктов.
Кроме того, закон сохранения массы гласит, что массу нельзя ни создать, ни уничтожить, а можно только переставить.Именно это и происходит в химической реакции. Атомы реагентов перестраиваются с образованием продуктов, и количество (число атомов) каждого элемента не меняется, когда он подвергается этой перегруппировке (реакции).
Таким образом, при написании уравнения химической реакции крайне важно следить за тем, чтобы закон соблюдался и число атомов каждого элемента было одинаковым в обеих частях уравнения. Если это достигается, то говорят, что реакция уравновешена.
Как и у Таноса, закон сохранения массы требует, чтобы каждое химическое уравнение было идеально сбалансировано.
Рекомендуемое видео для вас:
Что такое химическое уравнение?
Прежде чем перейти к процедуре, давайте разберем химическое уравнение и немного познакомимся с его различными компонентами. Химические уравнения аккуратно упакованы и представлены расположением химических символов и чисел для описания химической реакции.
Химическое уравнение можно разделить на две части: часть реагента и часть продукта. Половина реагентов — это половина с левой стороны стрелки с химическими символами каждого участвующего реагента, а продукты, полученные в результате реакции реагентов, написаны с правой стороны стрелки.
Компоненты химического уравнения
Кроме того, физическое состояние каждого элемента также указано после их химических символов/формул в формате нижнего индекса.Говоря о нижних индексах, числа, написанные в нижних индексах после химического символа, указывают количество присутствующих атомов элемента.
Коэффициенты, указанные перед каждым химическим символом, являются результатом балансировки уравнения и передают информацию о количестве молекул каждого элемента/соединения.
Как сбалансировать химическое уравнение?
Балансировка уравнения далека от операции на головном мозге. Все, что для этого требуется, — это иметь некоторый талант к числам и способность следовать основным шагам.Процедура начинается с проверки уравнения реакции. Подсчитываются атомы каждого элемента по обе стороны от стрелки; если они не совпадают, выполняются следующие шаги, чтобы сбалансировать их.
Шаг 1: Запишите количество атомов каждого элемента
Как уже упоминалось, начните с подсчета и записи количества атомов каждого элемента по обе стороны реакции. Рассмотрим реакцию атмосферного азота с водородом. Эти две реакции дают аммиак (Nh4), и эта реакция называется «процессом Габера-Боша».Неуравновешенное уравнение для этой реакции:
Рассмотрим реакцию атмосферного азота с водородом. Эти две реакции дают аммиак (Nh4), и эта реакция называется «процессом Габера-Боша».Неуравновешенное уравнение для этой реакции:
N2 + h3 → Nh4
Проверка показывает, что в уравнении 2 атома азота объединяются с 2 атомами водорода с образованием одной молекулы аммиака. Однако аммиак имеет 3 атома водорода, тогда как сторона реагента имеет только 2. Кроме того, сторона реагента имеет на 1 атом азота больше, чем сторона продукта. Ясно, что уравнение несбалансировано и не подчиняется закону сохранения массы. Танос бы этого не одобрил, так что давайте сбалансируем уравнение, пока он не сломался!
Шаг 2: Начните с первичного элемента
При балансировке химического уравнения всегда оставляйте атомы водорода и кислорода напоследок (поскольку они часто присутствуют с обеих сторон).Начните с элемента, который присутствует только в одном из реагентов и одном из продуктов.
В нашем примере единственным элементом, кроме водорода, является азот, поэтому давайте сбалансируем его. Сторона реагента имеет 2 атома азота, а сторона продукта имеет один атом. Простое умножение аммиака на 2 уравновешивает число атомов азота. Уравнение теперь выглядит так:
Сторона реагента имеет 2 атома азота, а сторона продукта имеет один атом. Простое умножение аммиака на 2 уравновешивает число атомов азота. Уравнение теперь выглядит так:
N2 + h3 → 2Nh4
Теперь у нас есть 2 атома азота с каждой стороны, поэтому азот уравновешен. Далее перейдем к водороду.
Обновим и нашу табличку.
Шаг 3: Сбалансируйте атомы водорода и кислорода
На заключительном этапе мы сбалансируем атомы водорода и кислорода. Согласно нашей таблице, количество атомов водорода увеличилось до 6, в то время как на стороне реагента осталось только 2 атома водорода. Как мы можем преобразовать 2 в 6? Умножив это на 3. Итак, давайте сделаем это!
N2 + 3h3 → 2Nh4
Теперь у нас есть 6 атомов водорода с обеих сторон. Таким образом, водород также сбалансирован.Теперь таблица выглядит следующим образом:
Давайте выполним окончательную проверку, чтобы убедиться, что все элементы сбалансированы. Количество атомов азота с обеих сторон одинаково, как и количество атомов водорода. Таким образом, наше химическое уравнение идеально сбалансировано (как и должно быть).
Таким образом, наше химическое уравнение идеально сбалансировано (как и должно быть).
Еще один пример сбалансированного химического уравнения
Давайте рассмотрим другую химическую реакцию и попробуем сбалансировать ее. В конце концов, практика делает совершенным. Как насчет реакции фотосинтеза? В ходе реакции углекислый газ и вода реагируют друг с другом с образованием глюкозы (C6h22O6) и столь необходимого кислорода.Несбалансированное уравнение:
CO2 + h3O → C6h22O6 + O2
Оставив водород и кислород на потом, давайте сбалансируем количество атомов углерода с обеих сторон. Сторона реагента имеет только 1 атом углерода, а глюкоза продукта имеет 6 атомов углерода. Умножение CO2 на 6 должно сбалансировать атомы углерода. Таким образом:
6CO2 + h30 → C6h22O6 + O2
Теперь перейдем к водороду. Согласно таблице имеем 2 атома водорода со стороны реагента и 12 из них с другой стороны стрелки.Умножение h3O на 6 даст нам баланс водорода.
6CO2 + 6h3O → C6h22O6 + O2
Осталось сбалансировать только кислород. На стороне реагентов их 18, а на стороне продукта всего 8. Если мы умножим глюкозу на любое число, остальные элементы станут несбалансированными, поэтому давайте вместо этого сосредоточимся на одиночной молекуле кислорода
Умножая ее на 6 результатов всего 12 атомов; когда они добавляются к уже существующим 6 атомам кислорода в глюкозе, уравнение уравновешивается.
6CO2 + 6h3O → C6h22O6 + 6O2
Согласно таблице все элементы теперь присутствуют в равных количествах по разные стороны стрелки. Таким образом, наше уравнение сбалансировано.
Final Words
Помимо метода (метода проверки), который мы только что изучили, существуют два других метода балансировки химического уравнения. Первый требует знания алгебраических уравнений и способов их решения, в то время как другой идет еще более сложным путем, используя матрицы.Однако метод проверки является самым простым из трех и может применяться для балансировки всех видов уравнений.
Несколько замечаний, которые следует помнить при выполнении этого метода, включают: Не уравновешивайте уравнение, изменяя числа в нижнем индексе, оставьте атомы водорода и кислорода напоследок, начните с элемента, который появляется только в одном реагенте и одном продукте, и уравновешивайте одиночный/ соло молекулы в конце.
Уравновешивание химического уравнения — это первый шаг в вычислении многих химических свойств.Этот список включает в себя поиск лимитирующего реагента в реакции и расчет выхода продукта, среди многих других!
Объяснение урока: Баланс химических уравнений
В этом объяснении мы узнаем, как определить стехиометрию уравнения реакции, уравновешивая число атомов в реагентах. и продукты.
Рассмотрим реакцию газообразного водорода (h3) с газообразным кислородом (O2) с образованием водяной пар: H()+O()HO()222ggg
Записанное химическое уравнение дает нам полезную информацию о реагентах, продуктах и их состояниях. Однако это
химическое уравнение не полное.
Однако это
химическое уравнение не полное.
Обратите внимание, что в обеих частях уравнения есть два атома водорода, но в стороне реагента есть два атома кислорода, и только один атом кислорода на стороне продукта:
Это уравнение реакции нарушает закон сохранения массы, который гласит, что материя не может быть ни создана, ни уничтожена. Мы должны, когда записав уравнение, найдите способ добиться того, чтобы число атомов водорода и кислорода было одинаковым по обе стороны от стрелки реакции.А Уравнение реакции, не нарушающее закон сохранения массы, называется сбалансированным химическим уравнением.
Определение: сбалансированные химические уравнения
Сбалансированное химическое уравнение представляет собой уравнение реакции, в котором число атомов каждого элемента одинаково в реагенте и продукте стороны уравнения.
Чтобы сбалансировать уравнение, мы могли бы рассмотреть возможность добавления нижнего индекса два после атома кислорода в молекуле воды: H()+O()HO()2222ggl
Это новое уравнение соответствует закону сохранения массы. Однако продуктом этой реакции является перекись водорода, а не вода. Мы не можем изменить значения индекса для любого вещества в правой или левой части химического уравнения, так как это изменит
идентичность соединений, участвующих в реакции.
Однако продуктом этой реакции является перекись водорода, а не вода. Мы не можем изменить значения индекса для любого вещества в правой или левой части химического уравнения, так как это изменит
идентичность соединений, участвующих в реакции.
Вместо этого мы должны корректировать количество молекул или формульных единиц каждого вещества, участвующего в реакции, пока уравнение не будет сбалансировано. Мы могли бы поставить цифру два перед молекулой водорода и молекулой воды в химическом уравнении, таким образом удвоив количество молекулы водорода и воды: 2H()+O()2HO()222ggg
Теперь по обеим сторонам химического уравнения находятся четыре атома водорода и два атома кислорода, и реакция сбалансирована.Цифры которые мы поместили перед молекулами водорода и воды в уравнении, известны как коэффициенты или стехиометрические коэффициенты.
Определение: стехиометрические коэффициенты
Стехиометрические коэффициенты представляют собой числовые значения, записанные перед частицами в химическом уравнении, чтобы сбалансировать общую реакцию.
Стехиометрические коэффициенты показывают соотношение каждого вида, участвующего в реакции. Так, для образования воды из водорода и кислород, отношение молекул водорода к молекулам кислорода составляет 2∶1.
Пример 1: Сбалансированное уравнение образования йодистого водорода
Иодистый водород получают реакцией водорода и йода по уравнению 𝑥𝑦𝑧H+IHI22
Коэффициенты 𝑥, 𝑦 и 𝑧 являются целыми числами. Каковы наименьшие возможные значения 𝑥, 𝑦 и 𝑧?
Ответ
В сбалансированном химическом уравнении количество атомов каждого элемента одинаково по обе стороны реакции. Мы можем видеть либо из химического уравнения, либо из приведенной ниже модели, что есть два атома водорода и два атома йода. атомов со стороны реагента и по одному атому водорода и йода со стороны продукта.
Чтобы на стороне продукта было два атома водорода и йода, должна быть вторая молекула йодистоводородной кислоты.
С двумя молекулами HI реакция уравновешивается.
𝑥, 𝑦 и 𝑧 в химическом уравнении — стехиометрические коэффициенты. Стехиометрические коэффициенты — это цифры, указывающие на необходимое количество молекул или формульных единиц каждого вида. уравновесить химическую реакцию. В этом вопросе 𝑥, 𝑦 и 𝑧 представляют количество молекул h3, I2 и HI соответственно.Реакция уравновешивается одной молекулой h3, одной молекулой I2 и две молекулы HI. Таким образом, 𝑥=1, 𝑦=1 и 𝑧=2.
Пример 2. Выявление дисбаланса элемента в химическом уравнении
Рассмотрим химическое уравнение CHCHOH+O2CO+3HO32222
Какой элемент не сбалансирован в химическом уравнении?
Ответ
Элемент находится в равновесии, если общее число атомов этого элемента одинаково по обе стороны от стрелки реакции.Нижние индексы указывают количество атомов в одной молекуле или формульной единице. Числа перед видом называются коэффициентами
и указать количество молекул или формульных единиц.
На стороне реагента, слева от стрелки реакции, мы видим следующее: CHCHOH+O·322
Коэффициенты отсутствуют, что означает наличие одной молекулы каждого вида. Мы можем определить количество углерода, водорода и атомов кислорода путем сложения нижних индексов вместе для каждого элемента.Ненаписанный нижний индекс является подразумеваемым:
На стороне реагента два атома углерода, шесть атомов водорода и три атома кислорода.
На стороне продукта, справа от стрелки реакции, мы видим следующее: 2CO+3HO·22
Коэффициент два перед молекулой углекислого газа указывает на то, что молекул углекислого газа две. Две молекулы будет иметь в два раза больше атомов, чем одна молекула. Количество атомов вида будет равно количеству атомов в одном молекула, умноженная на коэффициент:
Есть два атома углерода, шесть атомов водорода,
и семь атомов кислорода на стороне продукта.Количество атомов углерода и водорода
одинаково в обе стороны реакции, но число атомов кислорода неодинаково. Элемент, вышедший из равновесия в хим.
уравнение — кислород.
Элемент, вышедший из равновесия в хим.
уравнение — кислород.
Уравновешивание химического уравнения часто представляет собой процесс догадок и проверок, но есть шаги, которые мы можем предпринять, чтобы упростить этот процесс.
Как составить баланс химического уравнения
- Составьте список атомов каждого элемента по обе стороны реакции.
Совет: Если какие-либо многоатомные ионы присутствуют с обеих сторон реакции, относитесь к ним как к единица. Например, CO32– будет учитываться как одна группа, а не один углерод и три атома кислорода. - Идентифицируйте атомы/ионы, которые не равны по обеим сторонам реакции (неуравновешенные).
- Добавьте коэффициенты перед любыми частицами в реакции, чтобы сбалансировать атомы/ионы. Количество атомов/ионов каждого типа в составе будет умножено на коэффициент.
Совет: начните с балансировки атомов или ионов в самых сложных соединениях.
Совет: Элементы баланса в чистом виде последние, например, Fe, О2, S8 и так далее.
- Продолжайте добавлять коэффициенты, пока все атомы/ионы не будут сбалансированы.
Давайте посмотрим, как шаги по балансировке химического уравнения применяются на практике. Ниже приведено несбалансированное химическое уравнение для реакция фосфата натрия с хлоридом кальция: NaPO()+CaCl()NaCl()+Ca(PO)()342342aqaqaqs
Мы начнем с составления списка атомов каждого элемента по обе стороны реакции.Однако мы заметим, что фосфат (PO43–) появляется в обеих частях уравнения. Это означает, что мы можем посчитать ион фосфата как единое целое вместо того, чтобы разбивать его на атомы фосфора и кислорода. Таблица, подобная приведенной ниже, полезна для отслеживания атомы/ионы:
Нам нужно уделять особое внимание при подсчете ионов. Обратите внимание, что в каждой единице фосфата натрия содержится один ион фосфата, а не четыре. и что на каждую единицу фосфата кальция приходится два иона фосфата, а не 12.
Из таблицы видно, что все атомы и ионы в уравнении в настоящее время не сбалансированы. Теперь мы можем начать балансировать
уравнение с добавлением коэффициентов.
Теперь мы можем начать балансировать
уравнение с добавлением коэффициентов.
Начнем с определения самых сложных видов в уравнении. Фосфат кальция содержит наибольшее количество атомов и ионов. Поэтому мы можно начать с балансировки кальция и фосфата. На стороне продукта три атома кальция и только один атом кальция на стороне продукта. сторона реагента. Перед хлоридом кальция можно поставить коэффициент, равный трем:
Если одна формульная единица хлорида кальция содержит один атом кальция и два атома хлора, то три формульные единицы будут содержать всего три атома кальция и шесть атомов хлора:
Сбалансировав атомы кальция, мы можем сбалансировать ионы фосфата, поставив коэффициент два перед фосфатом натрия со стороны реагента:
Если одна формульная единица фосфата натрия содержит три атома натрия и один ион фосфата, то две формульные единицы будут содержать шесть атомы натрия и два иона фосфата:
Теперь мы можем сбалансировать атомы натрия и хлора, поставив перед хлоридом натрия коэффициент, равный шести:
Полное сбалансированное химическое уравнение реакции между фосфатом натрия и хлоридом кальция имеет вид 2NaPO()+3CaCl()6NaCl()+Ca(PO)()342342aqaqaqs
Пример 3.
 Определение коэффициентов, необходимых для балансировки химического уравнения в процессе Габера
Определение коэффициентов, необходимых для балансировки химического уравнения в процессе ГабераВ процессе Габера аммиак (Nh4) получают из азот и водород, в соответствии с показанным уравнением: 𝑥𝑦𝑧N+HNh323
Определите наименьшее возможное целочисленное значение 𝑥, 𝑦 и 𝑧.
Ответ
Этот вопрос предлагает нам сбалансировать химическое уравнение, определив коэффициенты 𝑥, 𝑦 и 𝑧. Химическое уравнение сбалансировано, когда количество атомов каждого элемента и/или количество каждого многоатомный ион одинаков по обе стороны реакции.
Мы можем начать с составления списка количества атомов каждого элемента по обе стороны реакции. Мы можем построить таблицу, подобную следующей, чтобы упорядочить наш список.
Из таблицы видно, что на стороне реагентов два атома азота,
но только один атом азота на стороне продуктов.Установка коэффициента 𝑧 равным двум даст нам равное количество атомов.
азота в продуктах и реагентах.
Теперь мы можем обновить нашу таблицу, используя значение два для коэффициента 𝑧.
Из таблицы видно, что количество атомов азота теперь сбалансировано. Однако на стороне реагентов есть два атома водорода и шесть атомов водорода на стороне продуктов. Мы можем сбалансировать количество атомов водорода, установив коэффициент 𝑦 равным трем.
Давайте еще раз посмотрим на нашу таблицу.
Мы видим, что на стороне реагента равное количество атомов азота и водорода. и со стороны продукта. В результате наше химическое уравнение теперь сбалансировано. Однако нам еще нужно определить коэффициент 𝑥.
Поскольку наше химическое уравнение уже сбалансировано, нам не нужно менять количество атомов азота или водорода, поэтому мы можем установить коэффициент 𝑥 равным единице.
Таким образом, наше окончательное сбалансированное химическое уравнение выглядит так: N+3h3Nh323
Наименьшее возможное целочисленное значение 𝑥, 𝑦 и 𝑧
𝑥=1, 𝑦=3 и 𝑧=2.
Химические уравнения можно составить, проанализировав формулировку химического утверждения. Общие фразы, используемые в химических заявлениях и их отношение к реагентам и продуктам показано в таблице ниже.
| Реагент А | Реагирует с Смешивается с Комбинируется с Добавляется в Горит в | Реагент B |
| Реагенты | Выход Продукция Форма Разлагаются на | Продукты |
| Продукты | Производятся Генерируются из | Реагентов |
Рассмотрим следующее химическое утверждение.Гидроксид кальция реагирует с соляной кислотой с образованием хлорида кальция и воды.
Это химическое утверждение указывает на то, что гидроксид кальция (Ca(OH)2) и соляная кислота
(HCl) являются реагентами и должны быть написаны слева от стрелки реакции. Хлорид кальция
(CaCl2) и вода (HO2) являются продуктами и должны быть указаны на
правая сторона стрелки реакции:
Ca(OH)+HClCaCl+HO222
Хлорид кальция
(CaCl2) и вода (HO2) являются продуктами и должны быть указаны на
правая сторона стрелки реакции:
Ca(OH)+HClCaCl+HO222
После того, как неуравновешенное химическое уравнение было записано, мы можем следовать нашей систематической серии шагов «угадай и проверь», чтобы определить соответствующие стехиометрические коэффициенты.
Пример 4: Сбалансированное уравнение разложения фосфорной кислоты
При нагревании фосфористая кислота (HPO33) разлагается на фосфорную кислоту (HPO34) и острый ядовитый газ фосфин (Ph4). Напишите сбалансированное химическое уравнение для этой реакции, используя наименьшие возможные целочисленные коэффициенты для реагенты и продукты.
Ответ
Мы должны начать эту задачу с расшифровки химической формулировки, чтобы идентифицировать реагенты и продукты.Ключевая фраза
«разлагается на» указывает, что виды, стоящие перед этой фразой в предложении, являются реагентами, а виды
после этой фразы идут продукты. Это означает, что при написании химического уравнения фосфористая кислота должна выглядеть как
слева от реакционной стрелки, а фосфорная кислота и газообразный фосфин должны появиться справа от реакционной стрелки:
HPOHPO+Ph43343
Это означает, что при написании химического уравнения фосфористая кислота должна выглядеть как
слева от реакционной стрелки, а фосфорная кислота и газообразный фосфин должны появиться справа от реакционной стрелки:
HPOHPO+Ph43343
Это несбалансированное химическое уравнение. Уравнение сбалансировано, когда число атомов каждого элемента и/или число каждого многоатомного иона одинакова в обе стороны реакции.
Мы можем начать с составления списка количества атомов каждого элемента с обеих сторон реакции:
Обратите внимание, что мы разделили многоатомные ионы, PO33– и PO43–, на атомы фосфора и кислорода. Это необходимо, поскольку ни один ион не появляется ни на стороне реагента, ни на стороне продукта химического уравнения.
Теперь мы можем начать балансировать уравнение, добавляя коэффициенты. Коэффициенты – это числа, которые можно поставить перед
любые виды в реакции, чтобы сбалансировать уравнение.Нам нужно решить, с какого элемента начать балансировку. Обратите внимание, что
атомы водорода и фосфора присутствуют в двух видах со стороны продукта. Это может привести к балансировке водорода и фосфора.
атомы трудны. Следовательно, мы должны начать с балансировки атомов кислорода.
Обратите внимание, что
атомы водорода и фосфора присутствуют в двух видах со стороны продукта. Это может привести к балансировке водорода и фосфора.
атомы трудны. Следовательно, мы должны начать с балансировки атомов кислорода.
Три атома кислорода со стороны реагента и четыре атома кислорода со стороны продукта. Количество атомов кислорода на часть реагента в этом уравнении всегда будет равна числу атомов кислорода в одной единице фосфористой кислоты, умноженному на коэффициент: 3×=.атомов кислородакоэффициентобщаяатомов кислорода на стороне реагента
Чтобы на стороне реагента было четыре атома кислорода, нам нужно коэффициент атомов кислородакоэффициент×3=4=43.
Коэффициент должен быть равен 43. Использование этого коэффициента уравновесит общее уравнение
очень сложно. Вместо того, чтобы использовать дробь для коэффициента, мы можем найти наименьшее общее кратное трем, число
атомов на стороне реагента и четыре, количество атомов на стороне продукта. Наименьшее общее кратное трех и четырех равно
12. Затем мы можем установить общее число атомов кислорода, необходимых для обеих сторон реакции, равным 12:
Наименьшее общее кратное трех и четырех равно
12. Затем мы можем установить общее число атомов кислорода, необходимых для обеих сторон реакции, равным 12:
Чтобы на стороне реагента было 12 атомов кислорода, перед фосфористой кислотой необходимо поставить коэффициент, равный четырем:
Помещение коэффициента четыре перед фосфористой кислотой также изменит количество атомов водорода и фосфора на сторона реагента. Если в одной единице фосфористой кислоты содержится три атома водорода и один атом фосфора, то четыре фосфористой кислоты единиц будет содержать 12 атомов водорода и четыре атома фосфора:
Чтобы на стороне продукта было 12 атомов кислорода, перед фосфорной кислотой необходимо поставить коэффициент, равный трем:
фосфорная кислота также изменит число атомов водорода и фосфора на сторона продукта.Если в одной единице фосфорной кислоты содержится три атома водорода и один атом фосфора, то три фосфорных кислоты единицы будут содержать девять атомов водорода и три атома фосфора:
При наличии в общей сложности 12 атомов водорода и четырех атомов фосфора на стороне реагента атомы водорода и фосфора теперь уравновешены. Полное сбалансированное химическое уравнение разложения фосфористой кислоты имеет вид
4HPO3HPO+Ph43343
Полное сбалансированное химическое уравнение разложения фосфористой кислоты имеет вид
4HPO3HPO+Ph43343
Рассмотрим следующую неравновесную реакцию горения: CH+OCO+HO26222
Мы можем начать сбалансировать это химическое уравнение, составив список числа атомов каждого элемента:
Кислород существует в чистом виде на стороне реагента.Элементы в чистом виде полезно балансировать в последнюю очередь. Мы можем сбалансировать атомы углерода, поставив коэффициент два перед молекулой углекислого газа и атомы водорода, поставив коэффициент из трех перед молекулой воды. В таблице ниже показаны обновленные итоговые значения на стороне продукта после того, как эти коэффициенты были изменены. добавлено:
Осталось сбалансировать атомы кислорода. На стороне реагента находятся два атома кислорода, а всего семь атомов кислорода.
со стороны продукта.Число атомов кислорода в реагентной части этого уравнения всегда будет равно числу атомов
в молекуле кислорода, умноженной на стехиометрический коэффициент:
2×=. oxygenatomscofficienttotalOxgenatomsна стороне реагента
oxygenatomscofficienttotalOxgenatomsна стороне реагента
Чтобы на стороне реагента было семь атомов кислорода, нам нужно коэффициент атомов кислородакоэффициент×2=7=72.
Коэффициент должен быть равен 72 или 3,5, как показано ниже:
Хотя коэффициент 3,5 перед молекулой кислорода уравновешивает общее уравнение, он означает, что реакция потребляет три с половиной молекулы кислорода.Этого не может быть. Чтобы облегчить путаницу и сохранить сбалансированное химическое уравнение, мы можно умножить все коэффициенты, включая незаписанный перед гл.36, на два:
Таким образом, полное сбалансированное химическое уравнение имеет вид: 2CH+O4CO+6HO267222
Пример 5. Сбалансированное уравнение окисления аммиака
Реакция аммиака (Nh4) с кислородом приводит к образованию оксида азота
(NO) и вода как единственные продукты. Напишите сбалансированное химическое
уравнение этой реакции с использованием наименьших возможных целых числовых коэффициентов для реагентов
и продукты.
Ответ
Мы должны начать эту задачу с расшифровки химической формулировки, чтобы идентифицировать реагенты и продукты. Ключевое слово «Производит» указывает на то, что вещества, стоящие перед этим словом в предложении, являются реагентами, а вещества после этого слова идут продукты. Это означает, что при написании химического уравнения аммиак и кислород должны выглядеть как слева от стрелки реакции, а оксид азота и вода должны появиться справа от стрелки реакции.Заметь кислород пишется как O2, а не O, в хим. уравнение ниже. Это связано с тем, что кислород существует в виде двухатомной молекулы в чистом виде: NH+ONO+HO322
Написанное уравнение является несбалансированным химическим уравнением. Уравнение сбалансировано, если количество атомов в каждом элемент одинаков по обе стороны реакции.
Мы можем начать балансировку уравнения, составив список количества атомов каждого элемента по обе стороны реакции:
Атомы азота уже уравновешены. Элементы, которые существуют в чистом виде в химическом уравнении, такие как кислород,
легче всего балансируются последними. Это означает, что мы должны начать с балансировки атомов водорода.
Элементы, которые существуют в чистом виде в химическом уравнении, такие как кислород,
легче всего балансируются последними. Это означает, что мы должны начать с балансировки атомов водорода.
Три атома водорода со стороны реагента и два атома водорода со стороны продукта. Поскольку три не кратно из двух эти атомы легче всего уравновесить, найдя их наименьшее общее кратное. Наименьшее общее кратное двух и три это шесть. Тогда мы можем установить общее число атомов водорода на обеих сторонах реакции равным шести:
Чтобы на стороне реагента было шесть атомов водорода, перед молекулой аммиака необходимо поставить коэффициент, равный двум.Чтобы на стороне продукта было шесть атомов водорода, необходимо поставить перед молекулой воды коэффициент, равный трем:
Размещение этих коэффициентов повлияло на число атомов азота на стороне реагента и атомов кислорода на стороне
сторона продукта также. Атомы водорода теперь уравновешены, но мы должны сбалансировать атомы азота. Мы можем выполнить это
путем размещения коэффициента два перед молекулой оксида азота:
Мы можем выполнить это
путем размещения коэффициента два перед молекулой оксида азота:
Помещение коэффициента два перед молекулой оксида азота уравновешивает атомы азота и влияет на общее число атомов кислорода на стороне продукта.Все, что осталось сделать, это сбалансировать атомы кислорода.
Число атомов кислорода в реагентной части этого уравнения всегда будет равно числу атомов кислорода в кислородной молекула, умноженная на коэффициент: 2×=.oxygenatomscofcienttotalOxgenatomsconactantside
Чтобы на стороне реагента было пять атомов кислорода, нам нужно коэффициент атомов кислородакоэффициент×2=5=52.
Коэффициент должен быть 52 или 2,5, как показано ниже:
Теперь химическое уравнение сбалансировано.Тем не менее, вопрос был задан для того, чтобы уравнение было сбалансировано с использованием наименьшего возможного
целочисленные коэффициенты. Мы можем сохранить сбалансированное химическое уравнение и изменить десятичный коэффициент перед кислородом. молекулы до целого числа путем умножения всех коэффициентов на два:
молекулы до целого числа путем умножения всех коэффициентов на два:
Сбалансированное химическое уравнение реакции аммиака с кислородом с использованием целых числовых коэффициентов имеет вид 4NH+5O4NO+6HO322
Ключевые моменты
- Сбалансированное химическое уравнение – это уравнение реакции, в котором число атомов каждого элемента одинакова в реагентах и продуктах уравнения.
- Стехиометрические коэффициенты помещаются перед частицами в химическом уравнении, чтобы сбалансировать реакцию.
- Балансировка уравнений — это процесс проб и ошибок.
- Уравнения балансировки можно упростить, если сбалансировать многоатомные ионы как единое целое и отложить балансировку чистых элементов до последнего.
Уравновешивание химических уравнений « KaiserScience
Цель содержания:
Что мы изучаем и зачем мы это изучаем? Содержание, процедуры или навыки.

Целевой словарь
Уровень II: высокочастотные слова, используемые в разных областях контента. Ключ к пониманию направлений и взаимосвязей, а также к выводам.
Уровень III: Низкочастотные, доменные термины.
Основываясь на том, что мы уже знаем
Установить связи с предыдущими знаниями. Отсюда мы строим.
Зачем нам изучать эти навыки?
Базовые знания: Что такое химическое вещество?
Этот урок подготовила Линда Джонс.Первоначально он находился на веб-сайте balanceequations.info, но этого веб-сайта больше не существует.__________
Наша первая идея: закон сохранения массы: Каждый атом, который переходит
в , также должен протекать из него химическая реакция..Пример: 3
красных , 2 желтых и 5 синих атомов переходят в реакции.
И все они выходят с другой стороны.
Это первое условие, которое необходимо выполнить, чтобы получить сбалансированное уравнение.
«Консервация» означает, что ничего не теряется, ничего не создается из воздуха.«Масса» относится к количеству материи.
Нет такой вещи, как «потеря атомов» в химической реакции. Атомы не могут появиться внезапно, если их изначально не было.
Коэффициенты и индексы:Знать, как интерпретировать
два вида чисел , встречающихся в химических уравнениях. Большие числа в красном называются «коэффициентами», , потому что они «появляются вместе с» формулами и действуют как множители. («Со» означает «с», а «эффективный» происходит от латинского слова, означающего «достигать».маленькие числа в синие называются «индексами», , потому что они пишутся под строкой.
 («Сценарий» для «письма» и «подзаголовок» для «ниже»).
(«Сценарий» для «письма» и «подзаголовок» для «ниже»).Цветовое кодирование для простоты
Сейчас мы будем использовать цветные круги в качестве наших «атомов», а первые буквы названий их цветов — в качестве наших «химических символов».Например:
Нижние индексы указывают, сколько атомов каждого вида Нижний индекс говорит нам, сколько атомов каждого вида присутствует в любой формуле.
Нижний индекс ВСЕГДА пишется ПОСЛЕ символа атома, к которому он относится.
Когда атом появляется в формуле только ОДИН РАЗ, мы не пишем индекс, потому что он не нужен.
Объединение двух атомов разного цвета
Что происходит, когда мы объединяем два или более разных атома вместе? Как тогда писать формулы? Напишем формулу молекулы, состоящей из одного атома синего и одного атома белого.

Поскольку мы работаем только с цветами, а не с фактическими символами элементов, не имеет значения, пишем ли мы сначала «B» или «W».
Обратите также внимание на то, что формула остается неизменной независимо от ориентации молекулы.
Теперь напишем формулу для 1 атома синего и 2 атомов белого.
В большинстве случаев, когда 1 атом одного типа и 2 другого соединяются вместе,
одиночный атом будет центральным атомом молекулы, как показано в первых четырех примерах в рамке выше.Последние два примера, в которых синий цвет НЕ является центральным атомом, были добавлены, чтобы показать, что формула, описывающая количество атомов каждого вида, одинакова, независимо от того, как атомы связаны или как они ориентированы в пространстве.
Теперь соединим 1 атом синего и 3 атома белого.
В этом случае атомы почти всегда будут соединяться друг с другом, как показано в первом примере, хотя второй пример все же возможен.

Суть: нижний индекс, стоящий после символа, говорит о том, сколько таких атомов в формуле. Он не дает никакой информации о том, КАК атомы связаны друг с другом.
Просто примечание: СУЩЕСТВУЮТ правила написания химических формул, например, какой символ атома пишется первым, и формулы МОГУТ показать что-то о связности, особенно в случае органических молекул (молекул, которые существуют в живых существах).
Наша цель здесь состоит в том, чтобы понять достаточно о формулах, чтобы сбалансировать химическое уравнение, поэтому мы пока проигнорируем правила написания сложных химических формул.
Вот еще один набор примеров, показывающих, как нижний индекс дает нам информацию о количестве каждого вида атомов в формуле.
Коэффициенты являются множителями
Давайте посмотрим, как коэффициенты используются в химических уравнениях.

Коэффициент
является множителем . Вот несколько примеров.Коэффициент
умножает и применяется ко ВСЕЙ ФОРМУЛЕ, написанной после него, а не только к первой букве.Когда у вас есть сбалансированное уравнение, вы можете умножить коэффициент
на индекс для каждого атома в формуле, чтобы узнать, сколько всего атомов каждого вида у вас есть.(Помните, когда в формуле присутствует только один атом определенного вида, нижний индекс не пишется, поэтому мы используем
«1» в качестве множителя нижнего индекса.)Не делайте эту ошибку:
Число атомов каждого вида одинаково в обоих случаях, но эти две молекулы ОЧЕНЬ отличаются друг от друга.
Не пишите «3 BW2» как «B3W6» или что-то в этом роде.
Уравнения баланса
Теперь давайте начнем с балансировки уравнений.
 Просто помните, что как только формулы в исходном уравнении верны, вы можете добавить групп , изменив коэффициентов .
Просто помните, что как только формулы в исходном уравнении верны, вы можете добавить групп , изменив коэффициентов .После того, как формулы верны, вы должны
НЕ изменить нижних индексов .Пример 1:
Посмотрите на это простое уравнение.Под ним рисунки молекул, которые представляют эти формулы. Найдите наименьшее количество групп в каждой формуле, чтобы учитывались все атомы и уравновешивались обе стороны уравнения.
«реагенты» уравнения — это все, что написано ДО стрелки. «сторона продуктов» уравнения — это все, что написано ПОСЛЕ стрелки.….
При осмотре видно, что 2
красных атомов слева и только 1 красных атомов справа. Таким образом, это уравнение НЕ сбалансировано.
Таким образом, это уравнение НЕ сбалансировано.Чтобы сбалансировать уравнение, нам нужен как минимум еще 1
красный атом в правой части, но мы не можем добавить ТОЛЬКО 1 красный атом. Скорее, мы должны добавить целую ГРУППУ атомов, которая содержит красных представляющих интерес атомов.Это как купить коробку мелков. Чтобы получить один мелок определенного цвета, вы должны купить всю коробку, потому что они просто не приходят по одному мелку за раз.
Нам нужно добавить хотя бы один
красный атом в правую сторону, но для этого нам нужно добавить целую группу, поэтому давайте сделаем это и посмотрим, что у нас получится.Добавление группы уравновешивает наши
красных атомов, давая нам по 2 красных атомов с каждой стороны. Однако теперь белых разбалансированы. У нас есть 2 белых атомов с левой стороны стрелки и 4 с правой стороны. Что нам делать? Конечно, «добавить группу».
У нас есть 2 белых атомов с левой стороны стрелки и 4 с правой стороны. Что нам делать? Конечно, «добавить группу». Теперь, если мы посмотрим на уравнение, мы увидим, что есть
одинаковых чисел из каждого вида из атомов на обеих частей уравнения.Теперь это уравнение уравновешено. Нам осталось только записать
коэффициентов.Помните, что вы не можете представить «2 W2» как «W4».
Вы также не можете представить «2 RW2» как «R2W4».
Итак, сбалансированное уравнение:
Пример 2
ннн
Сначала давайте сбалансируем
синих атомов. Сколько синих атомов слева или «реагентов» уравнения? Сколько справа или «сторона продуктов» ?Чтобы получить еще один атом
синего в правой части, что нам нужно добавить? Да, нам нужно добавить всю группу . Так давайте так.
Так давайте так.Обратите внимание, что мы также добавили красный
коэффициент , 2 перед формулой BW3 , чтобы отразить добавление. Теперь это уравновешивает наши синих атомов, но белых по-прежнему несбалансированы. Сколько белых атомов находится в правой части уравнения? [Ответ: 6]А как мы получим 6 атомов
белого в левой части? Да, добавляя группы.Какое общее количество групп нам нужно слева, чтобы уравновесить 6 белых справа?Итак, теперь у нас есть еще одно правильно сбалансированное уравнение.
Пример 3
С помощью этого уравнения сначала рассмотрим желтые атомы. Слева 1 желтый, справа 2 желтых. Что мы делаем?
ОК. Это уравновешивает наши желтые, но наши красные по-прежнему несбалансированы. Что мы делаем дальше?
ЕДИНСТВЕННАЯ вещь, которую мы ВСЕГДА можем сделать в уравнениях балансировки, если формулы верны, — это ДОБАВИТЬ групп.
Итак, какие группы мы должны добавить? Если мы добавим одну группу R2, как показано ниже, это все равно не уравновесит
красных.Сможете ли вы угадать секрет? Секрет в том, чтобы найти наименьшее общее кратное
, (да, приложение математики!) между исходными 2 красными числами слева и 3 красными числами справа.Чему равно
наименьшее общее кратное чисел 2 и 3? [Ответ: 6] Как получить 6 красных с обеих сторон?Да, «3 группы по 2» и «2 группы по 3.
Но теперь
желтых снова разбалансированы. Что мы делаем дальше? Помните, 4 Y НЕ равно Y4.Изменяем
коэффициент перед «Y» на 4.Итак, окончательное сбалансированное уравнение:
И последнее слово: при балансировке уравнений вам ВСЕГДА нужны наименьшие возможные числа.
 Например, приведенное выше уравнение также может быть записано как.
Например, приведенное выше уравнение также может быть записано как.Все эти уравнения также технически «сбалансированы», но на тесте ТОЛЬКО вариант с наименьшим номером, т.е.например, «4Y + 3R2 => 2Y2R3» будет правильным. Нам
ВСЕГДА нужны уравнения с наименьшими числами.Обзор:
Теперь вы должны понимать основы балансировки химических уравнений.
1.
ВСЕ сбалансированные уравнения должны подчиняться закону сохранения массы , что означает, что они должны иметь одинаковое число атомов каждого сорта на обеих сторон уравнения.2. Нижний индекс
указывает, сколько атомов каждого вида содержится в формуле.3.
Коэффициент является множителем, умножает каждый атом в формуле вместе с его нижним индексом, и является ТОЛЬКО числом, которое может быть изменено в уравнениях баланса. (Если формулы верны, ЕДИНСТВЕННЫЙ способ добавить атомов путем добавления групп. )
(Если формулы верны, ЕДИНСТВЕННЫЙ способ добавить атомов путем добавления групп. )4. П.С. Вы
ВСЕГДА нужны наименьшие возможные числа.Дополнительные материалы
Перейти к этой игре: Сбалансируйте все 10 уравнений.Напишите сбалансированное уравнение.
Уравновешивание: Лаборатория Джефферсона
Перейти к этой игре: Сбалансируйте все 11 уравнений. Напишите сбалансированные уравнения
Chembalancer от FunBasedLearning
Уравновешивание химических уравнений
Chemistryland рассказывает все об уравнениях балансировки
Альтернативный онлайн-учебник Глава 4: Химические реакции и уравнения балансировки
Стандарты обучения
Массачусетские научно-технические учебные программы
ГС-ПС1-7.Используйте математические представления и приведите экспериментальные доказательства в поддержку утверждения о том, что атомы и, следовательно, масса сохраняются во время химической реакции. Используйте концепцию молей и пропорциональные отношения для оценки количества (массы или моли) конкретных реагентов, необходимых для получения определенного количества продукта.
Используйте концепцию молей и пропорциональные отношения для оценки количества (массы или моли) конкретных реагентов, необходимых для получения определенного количества продукта.
Стандарты Совета колледжей для успеха в науке
C-PE.1.4.5 Дана простая химическая реакция (например, синтез воды, разложение перекиси водорода, сжигание метана)
С-ПЭ.1.4.5а Напишите сбалансированную химическую реакцию.
C-PE.2.3.1 Построить сбалансированное символическое представление химической реакции на основе заданных реагентов и продуктов. Постройте представление химической реакции на молекулярном уровне и объясните, используя концепцию атомов, почему материя сохраняется при любых изменениях.
Нравится:
Нравится Загрузка…
Как сбалансировать химические уравнения
Умение составлять химические уравнения — очень важный навык для учащихся.
химии, что делает этот учебник одним из самых популярных.Все
химические расчеты требуют, чтобы вы работали со сбалансированным уравнением. Мы тут
покажет вам простой и легкий способ сбалансировать все химические уравнения, которые вы
встречаются на вводных курсах химии.
Мы тут
покажет вам простой и легкий способ сбалансировать все химические уравнения, которые вы
встречаются на вводных курсах химии.
(Совершенно другой метод используется, если вам приходится работать с половинными уравнениями.
Если вы не знаете, что такое половинное уравнение, не волнуйтесь, так как это означает
они не в вашем курсе и вам не придется беспокоиться о балансировке
их.) Ключом к балансировке химических уравнений является применение приведенных ниже правил.
Если вы уже знаете правила, попробуйте эти рабочие примеры для повторения.
Что такое сбалансированное уравнение?
Химическое уравнение сбалансировано, если количество атомов каждого типа на
каждая часть уравнения одинакова. Это означает, что если у вас есть 12 атомов водорода
в левой части уравнения у вас должно быть 12 атомов водорода в правой
стороны, если слева 4 кислорода, то и на левой должно быть 4 кислорода.
правильно и так далее. Это из-за закона сохранения массы — вы
не может создавать или разрушать атомы во время химической реакции. Но ты не можешь просто
добавлять атомы случайным образом с каждой стороны, вы должны работать с молекулами
реагенты. Кроме того, вам будет очень сложно попытаться сбалансировать уравнение слова,
гораздо проще использовать химическое уравнение с химическими символами, так как
тогда вы сможете увидеть, сколько атомов каждого типа содержится в каждом химическом веществе.
Это из-за закона сохранения массы — вы
не может создавать или разрушать атомы во время химической реакции. Но ты не можешь просто
добавлять атомы случайным образом с каждой стороны, вы должны работать с молекулами
реагенты. Кроме того, вам будет очень сложно попытаться сбалансировать уравнение слова,
гораздо проще использовать химическое уравнение с химическими символами, так как
тогда вы сможете увидеть, сколько атомов каждого типа содержится в каждом химическом веществе.
Пример 1
Несбалансированное уравнение:- C 3 H 8 + O 2 —> H 2 O
+ CO 2
Слева три атома углерода, а справа только один.
правильно.
Слева восемь атомов водорода, а справа только два.
Слева два кислорода, а справа три.
Сбалансированное уравнение:- C 3 H 8 + 5O 2 —> 4H 2 O + 3CO 2
Как сбалансировать уравнение?
Сбалансировать химические уравнения несложно, если вы знаете
способ сделать это. Начните с выяснения, сколько атомов каждого типа находится на каждом
сторона уравнения.Некоторые учителя рекомендуют составить небольшую таблицу с перечислением
числа каждого атома для левой стороны и для правой стороны.
Начните с выяснения, сколько атомов каждого типа находится на каждом
сторона уравнения.Некоторые учителя рекомендуют составить небольшую таблицу с перечислением
числа каждого атома для левой стороны и для правой стороны.
Затем найдите элемент, который находится только в одном химическом веществе слева и в только один справа от уравнения. (Но обычно лучше оставить водород и кислород, пока вы сначала не сделаете остальные.)
Чтобы сбалансировать этот элемент, умножьте химические вещества на той стороне, которая
не имеет достаточно атомов этого типа по количеству, необходимому, чтобы привести его
до того же, что и другая сторона.Число называется коэффициентом.
НО
Если вам нужно умножить, скажем, на 2 1/2, сделайте это, ТОГДА умножьте ВСЕ на
каждую часть уравнения на два, чтобы избавиться от половины.
Нам не нравятся половинки в уравнениях, так как нельзя получить половинку молекулы.
Теперь найдите следующий несбалансированный элемент или вид и выполните
то же самое.
Повторяйте до тех пор, пока не будете вынуждены сбалансировать водород и кислород.
Если на каждой стороне есть комплексный ион, иногда называемый многоатомным ионом уравнения, которое осталось неизменным, то его часто можно сбалансировать во-первых, как бы выступает как единый вид.Ионы NO 3 — и CO 3 2- являются примерами сложного иона.
ОЧЕНЬ полезное правило — оставлять балансировку кислорода и водорода напоследок.
шаги, поскольку эти элементы часто находятся более чем в одном химическом веществе с каждой стороны,
и не всегда легко понять, с чего начать. Некоторые люди также говорят, что вы
должен оставить любой атом или вид с валентностью один до конца,
а также обычно оставляйте все, что присутствует в качестве элемента, до конца.
В приведенном выше примере 1 вы должны сначала сбалансировать углероды, поставив 3 перед
из CO 2 , затем сбалансируйте атомы водорода, поставив 4 перед H 2 O и, наконец,
кислород (который находится более чем в одном соединении справа, поэтому мы оставляем
их до последнего), поставив 5 перед O 2 .
Пример 2
Несбалансированное уравнение:- H 2 SO 4 + Fe —> Fe 2 (SO 4 ) 3 + Н 2
Сначала сбалансируйте SO 4 (поскольку это комплексный ион и он находится в одном химическом с каждой стороны)
3H 2 SO 4 + Fe —> Fe 2 (SO 4 ) 3 + H 2
Теперь сбалансируйте Fe (которое также находится в одном химическом веществе с каждой стороны)
3H 2 SO 4 + 2Fe —> Fe 2 (SO 4 ) 3 + H 2
Наконец, сбалансируйте водород (хотя он находится в одном химическом виде на с каждой стороны, обычно рекомендуется оставить его напоследок)
Сбалансированное уравнение:- 3H 2 SO 4 + 2Fe —> Fe 2 (SO 4 ) 3 + 3H 2
Изменяем коэффициенты в уравнении.
НЕ трогайте нижние индексы атомов в химическом веществе, иначе вы
заменить его другим химическим веществом. Это было бы немного похоже на то, что я хочу
шесть куриных ножек на обед, так что я пойду возьму шестиногую курицу. Как цыплята
есть две ноги, вам понадобятся три нормальные, двуногие, куры, а не шестилапая
монстр-мутант, вероятно, из космоса.
Если вы начнете с попытки сбалансировать что-то, принадлежащее более чем одному виду с одной стороны, вы не можете легко сказать, каких видов вам нужно больше, и поэтому может в конечном итоге ходить по кругу, постоянно меняя вещи.Если такое случается, просто начните сначала, но уравновешивая атомы или сложные ионы, которые по одному виду с каждой стороны. (Это важно, иначе это не сработает.)
А как насчет тех половинок, о которых я упоминал?
Пример 3
Несбалансированное уравнение:- Al + O 2 —> Al 2 O 3
Мы можем начать либо с Al, либо с O, но мы начнем с Al, так как мы
обычно оставляют O в конце. Хотя это не имело бы значения, где мы начали
в таком случае.
Хотя это не имело бы значения, где мы начали
в таком случае.
Поставьте двойку перед Al слева
2Al + O 2 —> Al 2 O 3
Поместите 1 1/2 перед O 2 слева
2Al + 1 1/2O 2 —> Al 2 O 3
Мы не любим половинки, поэтому умножаем все с ОБЕИХ сторон на два
4Al + 3O 2 —> 2Al 2 O 3
Теперь это сбалансированное уравнение.Легко, а?
Пример 4
Несбалансированное уравнение:- Na 2 CO 3 + HCl —> NaCl + CO 2 + Н 2 О
Ну, натрий (Na) еще не сбалансирован и находится в одном химическом виде с каждой стороны, поэтому нам нужно два NaCl справа, согласны? Помните, мы склонны оставить H и O до конца.
Na 2 CO 3 + HCl —> 2NaCl + CO 2 + H 2 O
Слева только один Cl, а справа два, так что давайте разберемся с этим один следующий, сделав его 2HCl слева
Na 2 CO 3 + 2HCl —> 2NaCl + CO 2 + H 2 O
А теперь, если вы посмотрите внимательно, вы увидите, что количество углерода, водорода
и атомы кислорода с каждой стороны одинаковы, так что это уравновешено.
Пример 5
Несбалансированное уравнение: — Mg 3 N 2 + H 2 O —> MgO + NH 3
Мы видим, что слева 3 атома Mg, а справа только один, так что давайте сначала отсортируем это — Mg 3 N 2 + H 2 O —> 3MgO + NH 3
Мы могли бы продолжить, уравновешивая O или N следующим, поскольку мы видим, что они не добавить.Но давайте придерживаться нашего полезного правила оставлять O и H до конца. если возможно, и перейти на азот затем. Их два с левой стороны и только один справа, так что поставьте двойку перед NH 3
Mg 3 N 2 + H 2 O —> 3MgO + 2NH 3
На данный момент мы можем перейти либо к кислороду, либо к водороду, поэтому мы сделать кислород, просто потому, что я хочу. Нам нужно добавить тройку впереди H 2 O для получения трех атомов кислорода с каждой стороны
Mg 3 N 2 + 3H 2 O —> 3MgO + 2NH 3
И быстрый подсчет показывает, что теперь мы все сбалансировали! Для практики,
попробуйте этот, балансируя O перед N, это даст вам то же самое
ответь, конечно.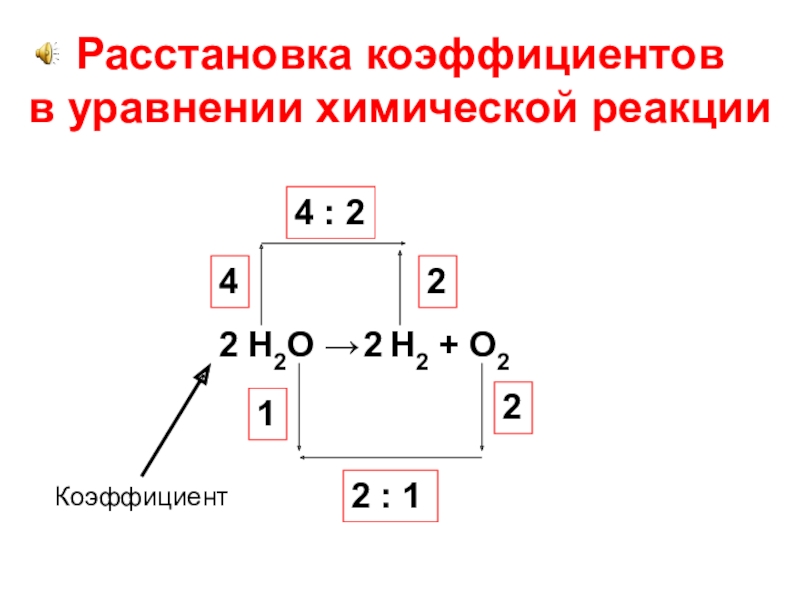
Как только вы немного попрактикуетесь в составлении химических уравнений, многие другие вопросы, заданные в химии, решаются намного легче.
Так же есть набор отработанных примеров уравновешивающих химических уравнений с ответами для практики с участием. Ответы скрыты, поэтому вы можете попробовать их сами, прежде чем нажимать раскрывать каждый по очереди.
Несколько наборов сложных примеров для балансировки доступны для загрузки вместе с ответами на сайте Go Science Girls.Иногда их немного сложнее решить. Часто они частично завершены, как в этом примере.
?KHF2 —>?KF + h3 + F2
Хитрость здесь заключается в том, чтобы определить элемент, который больше всего не сбалансирован (в данном случае буква H слева), сначала сбалансировать его, а затем проверить, какие другие элементы нуждаются в балансировке. В некоторых из их примеров вам, возможно, придется пройти дважды, уравновешивая один набор элементов, затем изменяя другой состав и снова балансируя, чтобы быть полностью правильным. Или используйте половинки, как описано выше, затем удвойте все, как показано выше.
Или используйте половинки, как описано выше, затем удвойте все, как показано выше.
Сбалансированные химические уравнения — Атомы, элементы и соединения — AQA — GCSE Chemistry (Single Science) Revision — AQA
Сбалансированное химическое уравнение представляет собой химическую реакцию с использованием формул реагентов и продуктов. Он показывает число единиц каждого вовлеченного вещества.
Символы состояний
Сбалансированные химические уравнения иногда включают символы состояний в скобках после каждой формулы.Они показывают физическое состояние этого вещества.
Водный раствор образуется при растворении вещества в воде.
Государственные символы полезны, поскольку они показывают, на что похоже вещество.Например:
- H 2 O(л) – жидкая вода, но H 2 O(г) – пар, а H 2 O(т) – лед
- HCl(г) – газообразный хлористый водород, но HCl(водн.) – это соляная кислота
Закон сохранения массы гласит, что во время химической реакции атомы не теряются и не образуются, поэтому общая масса продуктов равна общей массе реагентов. .
Это означает, что химические реакции могут быть представлены уравнениями символов.Сбалансированное символьное уравнение имеет одинаковое количество атомов каждого элемента по обе стороны от стрелки.
Чтобы сбалансировать уравнение, добавьте числа слева от одной или нескольких формул. Вот один из способов выяснить, как это сделать для реакции между азотом и водородом.
| Шаг | Результат |
|---|---|
| Проверьте, равно ли количество атомов каждого элемента с обеих сторон. Их нет. | N 2 + H 2 → NH 3 |
| 1uwx5i9nex0.0.0.0.1:0.1.0.$0.$3.$4.$2.$1.$0″> Слева два атома азота, а справа только один, поэтому поставьте большую двойку слева от NH 3 | N 2 + H 2 → 2NH 3 |
| Проверьте еще раз. Слева два атома водорода, а справа (2 × 3) = 6, поэтому перед H 2 поставьте большую цифру 3. | N 1uwx5i9nex0.0.0.0.1:0.1.0.$0.$3.$4.$2.$2.$1.$1″> 2 + 3H 2 → 2NH 3 |
| Еще раз проверьте, одинаково ли количество элементов с обеих сторон. Есть. | (Два атома азота и шесть атомов водорода) |
| При необходимости добавьте символы состояния. | N 2 (г) + 3H |



