Окислительно-восстановительные реакции. Видеоурок. Химия 9 Класс
Тема: Окислительно-восстановительные реакции
Урок: Окислительно-восстановительные реакции
Рассмотрим реакцию магния с кислородом. Запишем уравнение этой реакции и расставим значения степеней окисления атомов элементов:
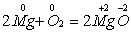
Как видно, атомы магния и кислорода в составе исходных веществ и продуктов реакции имеют различные значения степеней окисления. Запишем схемы процессов окисления и восстановления, происходящих с атомами магния и кислорода.
До реакции атомы магния имели степень окисления, равную нулю, после реакции — +2. Таким образом, атом магния потерял 2 электрона:

Магний отдает электроны и сам при этом окисляется, значит, он является восстановителем.
До реакции степень окисления кислорода была равна нулю, а после реакции стала -2. Таким образом, атом кислорода присоединил к себе 2 электрона:
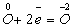
Кислород принимает электроны и сам при этом восстанавливается, значит, он является окислителем.
Запишем общую схему окисления и восстановления:

Число отданных электронов равно числу принятых. Электронный баланс соблюдается.
В окислительно-восстановительных реакциях происходят процессы окисления и восстановления, а значит, меняются степени окисления химических элементов. Это отличительный признак окислительно-восстановительных реакций.
Окислительно-восстановительными называют реакции, в которых химические элементы изменяют свою степень окисления
Рассмотрим на конкретных примерах, как отличить окислительно-восстановительную реакцию от прочих реакций.
1. NaOH + HCl = NaCl + H2O
2. СН4 + 2О2 = СО2 + 2Н2О
Для того чтобы сказать, является ли реакция окислительно-восстановительной, необходимо расставить значения степеней окисления атомов химических элементов.
+1-2+1 +1-1 +1 -1 +1 -2
1. NaOH + HCl = NaCl + H2O
Обратите внимание, степени окисления всех химических элементов слева и справа от знака равенства остались неизменными. Значит, эта реакция не является окислительно-восстановительной.
-4 +1 0 +4 -2 +1 -2
2. СН4 + 2О2 = СО2 + 2Н2О
В результате данной реакции степени окисления углерода и кислорода поменялись. Причем углерод повысил свою степень окисления, а кислород понизил. Запишем схемы окисления и восстановления:
-4 +4
С -8е =С — процесс окисления
0 -2
О +2е = О — процесс восстановления
Чтобы число отданных электронов было равно числу принятых, т.е. соблюдался электронный баланс, необходимо домножить вторую полуреакцию на коэффициент 4:
-4 +4
С -8е =С — восстановитель, окисляется
0 -2
О +2е = О 4 окислитель, восстанавливается
Окислитель в ходе реакции принимает электроны, понижая свою степень окисления, он восстанавливается.
Восстановитель в ходе реакции отдает электроны, повышая свою степень окисления, он окисляется.
Список рекомендованной литературы
1. Микитюк А.Д. Сборник задач и упражнений по химии. 8-11 классы / А.Д. Микитюк. – М.: Изд. «Экзамен», 2009. (с.67)
2. Оржековский П.А. Химия: 9-й класс: учеб. для общеобраз. учрежд. / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. – М.: АСТ: Астрель, 2007. (§22)
3. Рудзитис Г.Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§5)
4. Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с.54-55)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003. (с.70-77)
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) (Источник).
2. Единая коллекция цифровых образовательных ресурсов (интерактивные задачи по теме) (Источник).
3. Электронная версия журнала «Химия и жизнь» (Источник).
Домашнее задание
1. №10.40 – 10.42 из «Сборника задач и упражнений по химии для средней школы» И.Г. Хомченко, 2-е изд., 2008 г.
2. Участие в реакции простых веществ – верный признак окислительно-восстановительной реакции. Объясните почему. Напишите уравнения реакций соединения, замещения и разложения с участием кислорода О2.
interneturok.ru
Окислительно-восстановительные реакции. Видеоурок. Химия 11 Класс
Тема: Окислительно-восстановительные реакции
Урок: Окислительно-восстановительные реакции
Реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. Изменение степеней окисления происходит из-за перехода электронов от восстановителя к окислителю. Степень окисления – это формальный заряд атома, если считать, что все связи в соединении являются ионными.
Окислитель – это вещество, молекулы или ионы которого принимает электроны. Если элемент является окислителем, его степень окисления понижается.
О02 +4е—→ 2О-2 (Окислитель, процесс восстановления)
Процесс приема веществами электронов называется восстановлением. Окислитель в ходе процесса восстанавливается.
Восстановитель – это вещество, молекулы или ионы которого отдают электроны. У восстановителя степень окисления повышается.
S0 -4е— →S+4 (Восстановитель, процесс окисления)
Процесс отдачи электронов называется окислением. Восстановитель в ходе процесса окисляется.
Пример №1. Получение хлора в лаборатории
В лаборатории хлор получают из перманганата калия и концентрированной соляной кислоты. В колбу Вюрца помещают кристаллы перманганата калия. Закрывают колбу пробкой с капельной воронкой. В воронку наливается соляная кислота. Соляная кислота приливается из капельной воронки. Сразу же начинается энергичное выделение хлора. Через газоотводную трубку хлор постепенно заполняет цилиндр, вытесняя из него воздух. Рис. 1.

Рис. 1
На примере этой реакции рассмотрим, как составлять электронный баланс.
1. Запишем схему этой реакции:
KMnO4 + HCI = KCI + MnCI2 + CI2 + H2O
2. Расставим степени окисления всех элементов в веществах, участвующих в реакции:
K+Mn+7O-24 + H+CI— = K+CI— + Mn+2CI— 2 + CI02 + H+2O-2
Степени окисления поменяли марганец и хлор.
3. Составляем схему, отражающую процесс перехода электронов:
Mn+7+5е— = Mn+2 окислитель, процесс восстановление
2 CI— -2е— = CI02 восстановитель, процесс окисление
4. Уравняем число отданных и принятых электронов. Для этого находим наименьшее общее кратное для чисел 5 и 2. Это 10. В результате деления наименьшего общего кратного на число отданных и принятых электронов, находим коэффициенты перед окислителем и восстановителем.
Mn+7+5е— = Mn+2 2
2 CI— -2е— = CI02 5
5. Переносим коэффициенты в исходную схему и преобразуем уравнение реакции.
2KMnO4 + ? HCI = ?KCI + 2MnCI2 + 5CI2 +? H2O
Однако перед формулой соляной кислоты не поставлен коэффициент, так как не все хлоридные ионы участвовали в окислительно-восстановительном процессе. Метод электронного баланса позволяет уравнивать только ионы, участвующие в окислительно-восстановительном процессе. Поэтому нужно уравнять количество ионов, не участвующих в окислительно-восстановительной реакции. А именно катионов калия, водорода и хлоридных анионов. В результате получается следующее уравнение:
2KMnO4 + 16 HCI = 2KCI + 2MnCI2 + 5CI2 + 8H2O
Пример №2. Взаимодействие меди с концентрированной азотной кислотой. Рис. 2.
В стакан с 10 мл кислоты поместили «медную» монету. Быстро началось выделение бурого газа (особенно эффектно выглядели бурые пузырьки в еще бесцветной жидкости). Все пространство над жидкостью стало бурым, из стакана валили бурые пары. Раствор окрасился в зеленый цвет. Реакция постоянно ускорялась. Примерно через полминуты раствор стал синим, а через две минуты реакция начала замедляться. Монета полностью не растворилась, но сильно потеряла в толщине (ее можно было изогнуть пальцами). Зеленая окраска раствора в начальной стадии реакции обусловлена продуктами восстановления азотной кислоты.

Рис. 2
1. Запишем схему этой реакции:
Cu + HNO3 = Cu (NO3)2 + NO2↑ + H2O
2. Расставим степени окисления всех элементов в веществах, участвующих в реакции:
Cu0 + H+N+5O-23 = Cu+2(N+5O-23)2 + N+4O-22↑ + H+2O-2
Степени окисления поменяли медь и азот.
3. Составляем схему, отражающую процесс перехода электронов:
N+5+е—
Cu0 -2е— = Cu+2 восстановитель, процесс окисление
4. Уравняем число отданных и принятых электронов. Для этого находим наименьшее общее кратное для чисел 1 и 2. Это 2. В результате деления наименьшего общего кратного на число отданных и принятых электронов, находим коэффициенты перед окислителем и восстановителем.
N+5+е— = N+4 2
Cu0 -2е— = Cu+2 1
5. Переносим коэффициенты в исходную схему и преобразуем уравнение реакции.
Cu + ?HNO3 = Cu (NO3)2 + 2NO2↑ + 2H2O
Азотная кислота участвует не только в окислительно-восстановительной реакции, поэтому коэффициент сначала не пишется. В результате, окончательно получается следующее уравнение:
Cu + 4HNO3 = Cu (NO3)2 + 2NO2↑+ 2H2O
Классификация окислительно-восстановительных реакций
1. Межмолекулярные окислительно-восстановительные реакции.
Это реакции, в которых окислителем и восстановителем являются разные вещества.
Н2S-2 + Cl02 → S0 + 2HCl—
2. Внутримолекулярные реакции, в которых окисляющиеся и останавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H+2O-2 → 2H02 + O02
3. Диспропорционирование (самоокисление-самовосстановление) – реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl02 + H2O → HCl+O + HCl—
4. Конпропорционирование (Репропорционирование) – реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления
5. N-3H4N+5O3 → N+2O + 2H2O
Важнейшие окислители и восстановители.
Основные окислители и восстановители приведены в таблице 1.
|
Восстановители |
Окислители |
|
1. Простые вещества – металлы |
1. Простые вещества – неметаллы: галогены, кислород, озон |
|
2. Простые вещества – неметаллы (С, Н2, Si) |
2. Оксиды металлов в высоких степенях окисления CrO3, Mn2O7, MnO2, PbO2 |
|
3. Пероксид водорода Н2О2 |
3. Пероксид водорода Н2О2 |
|
4. Оксиды неметаллов (NO, SO2, CO и др.) |
4. Кислородсодержащие кислоты и их соли: азотная, серная, марганцевая и др. |
|
5. Кислородсодержащие кислоты: сернистая, азотистая, фосфористая и их соли |
5. Соли кислот хрома: хроматы, дихроматы, кислородные кислоты хлора: хлорноватистая HClO, хлорноватая HClO3, хлорная HClO4 и их соли. |
|
6. Бескислородные кислоты: сероводородная, хлороводородная и др. и их соли |
6. Соли некоторых металлов в высоких степенях окисления: AgNO3, CuSO4 и др. |
|
7. Соли, в которых металлы находятся не в высших степенях окисления: SnCl2, FeSO4, Cr2(SO4)3,MnSO4 и др. |
|
|
8. Аммиак NH3 |
Табл. 1. Основные окислители и восстановители
Факторы, влияющие на конечные продукты реакции
При протекании окислительно-восстановительных реакций, конечные продукты зависят от многих факторов.
· Состав реагирующих веществ
· Температура
· Концентрация
· Кислотность среды
Рассмотрим это в случае реакции с перманганатом калия. Продукты его восстановления зависят от кислотности среды, что можно изобразить схемой:
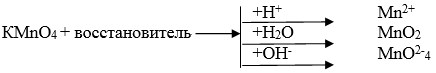
Например, при взаимодействии перманганата калия с нитритом калия в кислой среде
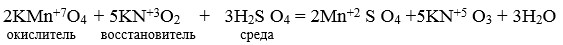
Красно-фиолетовая окраска раствора переходит в бесцветную окраску.
В нейтральной среде образуется MnO2 и окраска меняется с красно-фиолетовой на коричневую.
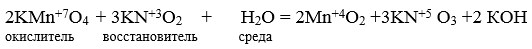
В щелочной среде при восстановлении перманганата калия образуется манганат калия K2 MnO4, который окрашен в зеленый цвет.
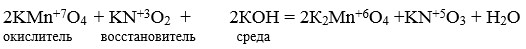
Окислительно-восстановительные процессы происходят в живых организмах, они широко распространены в природе: деятельность вулканов, грозовые разряды и др. многие технологические процессы основаны на окислении и восстановлении. Это и получение металлов, горение, синтез оксидов серы и азота при производстве кислот, получение аммиака.
Подведение итога урока
В ходе урока была изучена тема «Окислительно-восстановительные реакции». Вы узнали определение данных реакций, их отличия от реакций других типов. Вспомнили, что такое степень окисления, окислитель и восстановитель. Учились составлять схемы электронного баланса для окислительно-восстановительных реакций, познакомились с классификацией окислительно-восстановительных реакций.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
3. Габриелян О.С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Internerurok.ru (Источник).
2. Hemi.nsu.ru (Источник).
3. Chemport.ru (Источник).
4. Химик (Источник).
Домашнее задание
1. №№1-3 (с. 162) Габриелян О.С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
2. Почему аммиак проявляет только восстановительные свойства, а азотная кислота – только окислительные?
3. Расставьте коэффициенты в уравнении реакции получения азотной кислоты, используя метод электронного баланса: ?NO2 + ?H2O + O2 = ?HNO3
interneturok.ru
примеры и решение :: SYL.ru
Что такое ОВР? Химия состоит из множества разделов, один из них рассматривает взаимодействия веществ, в результате которых у элементов (веществ) меняются показатели их степеней окисления. Рассмотрим основные термины, связанные с данной проблемой, приведем примеры взаимодействий.
Основные определения
В школьной программе рассматривается метод ОВР. Химия базируется на составлении баланса между количеством отданных (принятых) электронов. Окислителем является ион или атом, принимающий в процессе взаимодействия отрицательные частицы. Процесс, который при этом происходит, называется восстановлением. Восстановителем считают атомы или ионы, которые лишаются своих электронов, окисляясь при этом.

Значимость ОВР
Какое значение имеют ОВР? Химия располагает множеством примеров, когда данные превращения приводили к негативным последствиям. Например, до сих пор ученые не установили истинную причину разрушения статуи Колосса Родосского. Химики убеждены в том, что именно коррозия, которая является ОВР, стала причиной разрушения уникального памятника. В организме живых существ данные превращения обеспечивают обменные процессы.
Алгоритм разбора
Как правильно разбирать реакции ОВР? Химия школьного курса основывается на составлении электронного баланса между окислителем и восстановителем. Остановимся подробнее на последовательности действий школьников. Сначала необходимо поставить степени окисления у всех элементов, имеющихся в реакции. Для того чтобы успешно справиться с поставленной задачей, важно знать правила. Далее необходимо выявить те вещества, в которых после взаимодействия значения степеней окисления изменились.
При составлении электронного баланса, с помощью знака «плюс» показывают число принятых частиц, а «минусом» показывают количество отданных электронов. Между ними определяется наименьшее общее кратное, затем вычисляются индексы. Завершающим этапом будет расстановка коэффициентов в ОВР. Химия неорганических и органических веществ тесно связана с данным типом взаимодействий, к тому же задания предлагаются школьникам на выпускных испытаниях в 9 и 11 классах.
Первый пример
Разве ОВР — химия? Как решать такие задания? Данный вопрос является актуальным для ребят, которые выбрали предмет в качестве выпускного экзамена. На примере взаимодействия оксида железа (3) и угарного газа (оксида углерода (2)) рассмотрим последовательность действий.

Итак, дана схема Fe2O3 + CO → Fe + CO2, ее нужно рассмотреть как ОВР. ЕГЭ (химия) в 11 классе предполагает самостоятельное дополнение школьниками схемы недостающими веществами, но мы начнем с более простого задания, в котором уже даны все участники процесса. Как проверить, что это ОВР? Химия отвечает на этот вопрос посредством степеней окисления. Так как железо превращается из +3 в простое вещество с нулевым показателем степени окисления, а углерод повышает ее с +2 до +4, процесс является ОВР.
Баланс данного задания имеет следующий вид:
Fe(+3)+3e=Fe(0) 2
C(+2)-2e=C(+4) 3
Наименьшее общее кратное составляет 6. Железо является окислителем, угарный газ проявляет восстановительную способность. В готовом виде процесс имеет вид:
Fe2O3 + 3CO → 2Fe + 3CO2
Второй пример
ОВР в органической химии рассматривается по такому же алгоритму, есть только некоторые отличия в расстановке степеней окисления. Одно из заданий ЕГЭ посвящено вопросам, связанным с расстановкой коэффициентов в ОВР. Для успешного выполнения данного задания сначала школьники должны подумать, какие недостающие вещества им нужно вписать, и только после этого переходить к алгоритму разбора ОВР.

Например, с помощью электронного баланса необходимо составить уравнение:
Ph4 + AgNO3 +… = Ag + HNO3
Для начала выявим, какое вещество пропущено в левой части данного взаимодействия. С учетом того, что серебро проявляет окислительные свойства, а фосфор будет восстановителем, недостающим веществом станет вода.
При составлении электронного баланса, получаем следующий вид:
P(-3) отдает 8 электронов = P(+5) 1
Ag(+) принимает электрон = Ag(0) 8
При расстановке коэффициентов, получаем запись процесса:
Ph4 + 8 AgNO3 + 4h3O = 8Ag + 8HNO3 + h4PO4
Ph4 — восстановитель, AgNO3 — окислитель
Третий пример
Воспользовавшись методом электронного баланса, решите уравнение:
Cr2 (SO4) 3 +…+ NaOH = Na2CrO4 + NaBr +…+ h3O
В данной схеме пропущено два вещества, поэтому сначала восстановим пробелы. Хром в данном процессе меняет степень окисления с +3 на +6, следовательно, им проявляются окислительные характеристики. Восстановитель в задании упущен, поэтому его функцию будет выполнять молекулярный бром. Среди продуктов реакции должна быть соль натрия, ею будет сульфат.
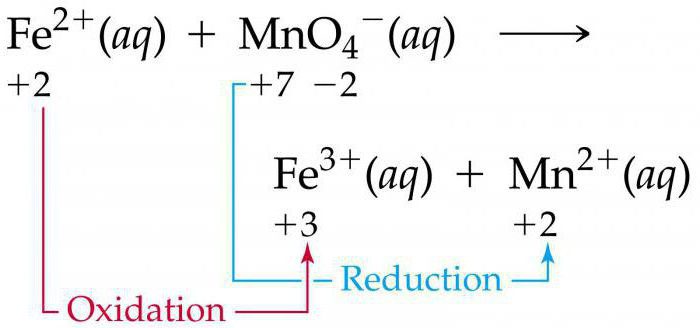
Электронный баланс для данного превращения имеет вид:
2Cr(+3) — 6e = 2Cr(+6) 1
Br2(0) + 2e = 2Br — 3
При расстановке в схеме коэффициентов учитываем, что атом натрия находится в составе нескольких веществ, поэтому его необходимо суммировать:
Cr2(SO4) 3+3 Br2 + 16NaOH = 2Na2CrO4 + 6 NaBr + 3Na2 SO4 + 8h3O
- Cr2(SO4) 3 является окислителем;
- Br2 выступает в роли восстановителя.
Четвертый пример
Воспользовавшись электронным балансом, решите уравнение:
KMnO4 + h3S + h3SO4 = S+ Mn SO4 +…+…
В задании есть два пропуска, причем оба вещества являются продуктами взаимодействия. Учитывая, что в данной схеме в качестве окислителя выступает марганец, а восстановительные свойства характерны для серы, степени окисления в пропущенных веществах остаются неизменными. Ими будет сульфат калия и вода.

Электронный баланс данного процесса:
Mn(+7) забирает 5 e = Mn(+2) 2
S(-2) отдает 2e = S(0) 5
Конечный вариант предлагаемой схемы ОВР имеет следующий вид:
2KMnO4 + 5h3S + 3h3SO4 = 5S + 2MnSO4 + 8h3O + K 2SO4
Перманганат калия проявляет окислительные свойства, сероводород является восстановителем.
Пятый пример
Заполните пропуски, расставьте коэффициенты в предложенной схеме превращений:
KMnO4 + h3SO4 + KBr = MnSO4 + Br2 +…+…
В данном взаимодействии окислительные параметры демонстрирует марганец, входящий в состав марганцовки. Бром, входящий в бромид калия, является восстановителем. Следовательно, среди продуктов реакции должны быть такие вещества, в которых не наблюдается изменений степеней окисления. Недостающими веществами будут выступать вода и сульфат калия. Процесс передачи электронов:
Mn(+7) принимает 5e = Mn(+2) 2
2Br(-) отдает 2e = Br2(0) 5
Расставим полученные коэффициенты в предложенную схему, получим следующее уравнение:
2KMnO4 + 8h3SO4 + 10KBr = 2MnSO4 + 5Br2 + 8h3O + 6K2SO4
Шестой пример
Воспользовавшись электронным балансом, поставьте коэффициенты в предложенной схеме превращений:
P + HNO3 = NO2 +…+…
Пропуски веществ даны в правой части. Чтобы выявить продукты, определяем окислитель и восстановитель. В левой части берется сильная кислота, поэтому в продуктах будет вода. Вторым пропущенным соединением будет являться фосфорная кислота.

Электронный баланс имеет вид:
P(0) отдает 5e = P(+5) 1
N(+5) принимает e = N(+4) 5
Приступаем к расстановке коэффициентов в уравнении:
P + 5HNO3 = 5NO2 + h3O + h4PO4
Заключение
Разбор окислительных и восстановительных процессов методом электронного баланса является одним из тех заданий, которые вызывают серьезные проблемы у выпускников девятого и одиннадцатого классов. Именно поэтому важно отработать алгоритм действий, чтобы ребята успешно выполняли задания данного типа. Среди типичных ошибок, которые допускаются ребятами, выделим неправильную расстановку степеней окисления у элементов в сложных веществах.
Также довольно много проблем возникает при определении количества принятых и отданных атомами (ионами) электронов. Ребята неправильно определяют окислитель и восстановитель, допускают ошибки при расстановке коэффициентов в схеме уравнения. Задания, связанные с ОВР, считаются сложными, поэтому предполагают отработку порядка действий во внеурочной деятельности.
www.syl.ru
Ответы@Mail.Ru: Тема. Окислительно — восстановительные реакции
Посмотрите, какая чушь у вас написана в первой реакции. От этого сразу отвечать не хочется. Конечно, первая реакция выглядит так: FeBr2 + Cl2 = FeCl2 + Br2 Здесь все и так уравнено. Разобрать реакцию как ОВР? Это простая окислительно-восстановительная реакция. Окислитель Сl2 принимает электроны (восстанавливается) : Cl2(0) + 2е = 2Cl(-) Восстановитель Br(-) отдает электроны (окисляется) : 2Br(-) — 2е = Br2(0) Уравнивать число электронов не надо, следовательно не нужны и коэффициенты в реакции, все равны единице (не ставятся) Вторая реакция намного сложнее. В ней два восстановителя (если только она у вас правильно записана) : Fe(2+) и S(4+) в сульфит-ионах. Окислитель Cr(6+) в бихромат-ионах. Уравнения электронного баланса: Fe(2+) — e = Fe(3+) |*2 S(4+) — 2e = S(6+) |*2 Cr(6+) + 3e = Cr(3+) |*2 Здесь все три уравнения надо удвоить, потому, что при хроме двойки в нижних индексах, и у железа справа — тоже. Реакция сложная, с солеобразованием, поэтому надо соблюдать определенный порядок расстановки коэффициентов. Сначала ставим 2 перед FeSO3. Далее считаем число атомов серы справа (7). Поскольку слева должно быть столько же, ставим коэффициент 5 перед h3SO4, уравнивая водород, ставим 5 и перед Н2О. В заключение считаем атомы кислорода, убеждаемся, что их число одинаково слева и справа, следовательно, все уравняли. (Я пропустил еще калий, но число его атомов явно одинаково слева и справа. ) Получаем уравнение реакции 2FeSO3 + K2Cr2O7 + 5h3SO4 = Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 5h3O. Помогаю вам решать эту задачу только потому, что в жизни вам никогда не придется составлять уравнения ОВР, но, пожалуйста, учите элементарную теорию — названия и свойства веществ. Мало ли с какими веществами придется встретиться в практике — надо знать, чего от них можно ожидать.
touch.otvet.mail.ru
Электроотрицательность. Степень окисления и валентность химических элементов. Реакции окислительно — восстановительные.
Окислительно-восстановительные реакции
Одним из основных понятий неорганической химии является понятие о степени окисления (СО).
Степенью окисления элемента в соединении называется формальный заряд атома элемента, вычисленный из предположения, что валентные электроны переходят к атомам с большей относительной электроотрицательностью (ОЭО) и все связи в молекуле соединения являются ионными.
Степень окисления элемента Э указывают вверху над символом элемента со знаком « + » или « -» перед цифрой.
Степень окисления ионов, реально существующих в растворе или кристаллах, совпадает с их зарядовым числом и обозначается аналогично со знаком « + » или « » после цифры, например, Са2+.
Применяют также метод Штока обозначения степени окисления римскими цифрами после символа элемента: Mn (VII), Fe (III).
Вопрос о знаке степени окисления атомов в молекуле решается на основании сопоставления электроотрицательностей связанных между собой атомов, которые образуют молекулу. При этом атом с меньшей электроотрицательностью имеет положительную степень окисления, а с большей электроотрицательностью отрицательную.
Следует отметить, что нельзя отождествлять степень окисления с валентностью элемента. Валентность, определяемая как число химических связей, которыми данный атом соединен с другими атомами, не может равняться нулю и не имеет знака « + » или « ». Степень окисления может иметь как положительное, так и отрицательное значение, а также принимать нулевое и даже дробное значение. Так, в молекуле СO2 степень окисления С равна +4, а в молекуле СН4 степень окисления С равна 4. Валентность же углерода и в том, и в другом соединении равна IV.
Несмотря на указанные выше недостатки, использование понятия степени окисления удобно при классификации химических соединений и составлении уравнений окислительно-восстановительных реакций.
При окислительно-восстановительных реакциях протекают два взаимосвязанных процесса: окисление и восстановление.
Окислением называется процесс потери электронов. Восстановлением процесс присоединения электронов.
Вещества, атомы или ионы которых отдают электроны, называются восстановителями. Вещества, атомы или ионы которых присоединяют электроны (или оттягивают к себе общую пару электронов), называются окислителями.
При окислении элемента степень окисления увеличивается, иначе говоря, восстановитель при реакции повышает степень окисления.
Наоборот, при восстановлении элемента степень окисления понижается, т. е. при реакции окислитель уменьшает степень окисления.
Таким образом, можно дать и такую формулировку окислительно-восстановительных реакций: окислительно-восстановительными реакциями называются реакции, протекающие с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ.
Окислители и восстановители
Для прогноза продуктов и направления окислительно-восстановительных реакций полезно помнить, что типичными окислителями являются простые вещества, атомы которых имеют большую ОЭО > 3,0 (элементы VIA и VIIAгрупп). Из них наиболее сильные окислители фтор (ОЭО = 4,0), кислород (ОЭО = 3,0), хлор (ОЭО = 3,5). К важным окислителям относятся PbO2 , KMnO4 , Cа(SO4)2 , К2Сr2O7 , HClO, HClO3, КСIO4, NaBiO3, H2SO4(конц), HNO3(конц) , Na2O2 , (NH4)2S2O8 , КСIO3 , H2O2 и другие вещества, которые содержат атомы с высшей или высокой СО.
К типичным восстановителям относятся простые вещества, атомы которых имеют малую ОЭО < 1,5 (металлы IA и IIAгрупп и некоторые другие металлы). К важным восстановителям относятся H2S, NH3, HI, KI, SnCl2 , FeSO4 , C, H2 , CO, H2SO3 , Cr2(SO4)3 , CuCl, Na2S2O3 и другие вещества, которые содержат атомы с низкими СО.
Вещества, содержащие атомы в максимальной и минимальной степенях окисления, могут быть соответственно только окислителями, например К2Сг2O7 , КМпO4 , PbO2 , HClO4 или только восстановителями, например NH3 , H2S, HI.
Вещества, содержащие атомы в промежуточных степенях окисления, способны как повышать, так и понижать степень окисления, т. е. могут быть как восстановителями (при действии более активного, чем они, окислителя), так и окислителями (при действии более активного, чем они, восстановителя). Такие вещества проявляют окислительно-восстановительную двойственность.
При составлении уравнений окислительно-восстановительных реакций можно применять два метода: метод электронного баланса и ионно-электронный метод (метод полуреакций). Более правильное представление об окислительно-восстановительных процессах в растворах дает ионно-электронный метод. С помощью этого метода прогнозируют изменения, которые претерпевают реально существующие в растворе ионы и молекулы.
Помимо прогнозирования продуктов реакции, ионные уравнения полуреакций необходимы для понимания окислительно-восстановительных процессов, протекающих при электролизе и в гальванических элементах. Этот метод отражает роль среды как участника процесса. И наконец, при использовании этого метода необязательно заранее знать все образующиеся вещества, так как многие из них получаются при составлении уравнения окислительно-восстановительных реакций.
Следует иметь в виду, что хотя полуреакции отражают реальные процессы, идущие при окислительно-восстановительных реакциях, их нельзя отождествлять с реальными стадиями (механизмом) окислительно-восстановительных реакций.
На характер и направление окислительно-восстановительных реакций влияют многие факторы: природа реагирующих веществ, реакция среды, концентрация, температура, катализаторы.
Биологическое значение окислительно-восстановительных процессов
Важными процессами в животных организмах являются реакции ферментативного окисления веществ-субстратов: углеводов, жиров, аминокислот. В результате этих процессов организмы получают большое количество энергии. Приблизительно 90% всей потребности взрослого мужчины в энергии покрывается за счет энергии, вырабатываемой в тканях при окислении углеводов и жиров. Остальную часть энергии ~10% дает окислительное расщепление аминокислот.
Биологическое окисление протекает по сложным механизмам при участии большого числа ферментов. В митохондриях окисление происходит в результате переноса электронов от органических субстратов. В качестве переносчиков электронов в дыхательную цепь митохондрий входят различные белки, содержащие разнообразные функциональные группы, которые предназначены для переноса электронов. По мере продвижения по цепи от одного интермедиата к другому электроны теряют свободную энергию. На каждую пару электронов, переданных по дыхательной цепи кислороду, синтезируются 3 молекулы АТФ. Свободная энергия, высвобождающаяся при переносе 2 электронов на кислород, составляет 220 кДж/моль.
На синтез 1 молекулы АТФ в стандартных условиях расходуется 30,5 кДж. Отсюда ясно, что довольно значительная часть свободной энергии, выделяющейся при переносе одной пары электронов, запасается в молекулах АТФ. Из этих данных становится понятной и роль многостадийной передачи электронов от исходного восстановителя к кислороду. Большая энергия (220 кДж), выделяемая при переносе одной пары электронов к кислороду, разбивается на ряд порций, соответствующих отдельным стадиям окисления. На трех таких стадиях количество выделяющейся энергии примерно соответствует энергии, необходимой для синтеза 1 молекулы АТФ.
himege.ru
XuMuK.ru — § 5. Окислительно–восстановительные реакции
Все процессы неорганической химии можно разбить на два типа: а) идущие без изменения валентности реагирующих элементов и б) идущие с изменением валентности. К первому из них относятся различные случаи обменного разложения, уравнения которых обычно весьма просты. Ко второму типу относятся реакции вытеснения и ряд иных, часто очень сложных химических процессов. Для быстрого и правильного составления их уравнений необходимо овладеть специально разработанной методикой.
Реакции второго типа называются окислительно–восстановительными или, сокращенно (но не вполне точно), реакциями окисления. Первоначально под окислением понималось только присоединение к веществу кислорода, под восстановлением – его отнятие. Понятия «окисление» и «восстановление» можно, однако, обобщить, если принять во внимание, что кислород почти всегда оттягивает к себе электроны от соединяющегося с ним элемента. Вследствие этого сущность окисления состоит в потере электронов окисляющимся веществом. Наоборот, при восстановлении оно получает обратно отданные ранее электроны., Следовательно, сущность восстановления состоит в присоединении электронов восстанавливающимся веществом.
Для дальнейших рассуждений несущественно, переходят ли электроны с одного атома на другой вполне (ионная связь) или же только более или менее оттягиваются (полярная связь). Поэтому при разборе материала данного параграфа мы будем говорить об отдаче или присоединении электронов независимо от действительного типа валентной связи. В общем, следовательно, окислительно–восстановительные реакции можно определить как процессы, связанные с переходом электронов от одних атомов к другим.
Рассмотрим ряд соединений хлора:
НСl Сl2 Сl2 О Сl2 О7
В НСl хлор отрицательно одновалентен. В молекуле Сl2 ни один , из атомов не оттягивает электронов больше другого; следовательно, заряд каждого из них равен нулю. В Сl2 О хлор снова одновалентен, но уже положительно. В Cl2 O7хлор положительно семивалентен. Схематически все это можно обозначить так:
Говоря о переходе хлора из состояния А в состояние Г, можно сказать, что он отдает восемь электронов, при переходе от В к Г – шесть электронов, от Б к Г – семь электронов. Наоборот, при переходе от Г к В каждый хлор присоединяет шесть электронов, от Г к Б – семь электронов, от Г к А – восемь электронов. Вещество, в состав которого входит элемент, присоединяющий электроны, называется окислителем; вещество, содержащее элемент, отдающий электроны– восстановителем.
1) Соотношение между понятиями «восстановитель» и «окислитель» может быть наглядно выражено схемой: восстановитель <=> электроны <=> окислитель. Простейшей окислительно–восстановительной системой является установка для электролиза (рис. 101). В ней катод отдает ионам электроны, т. е является восстановителем, а анод их с ионов снимает, т. е. функционирует как окислитель. Следует отметить, что из всех имеющихся в распоряжении химии окислительно–восстановительных методов электролиз является самым мощным и универсальным.
2) При работах с окислителями и восстановителями удобно пользоваться их нормальными концентрациями. Под нормальным раствором окислителя или восстановителя понимают раствор, содержащий в литре один окислительный эквивалент, т. е. часть грамм–молекулы, отвечающую одному присоединяемому или отдаваемому каждой молекулой электрону. Например, при применении в качестве окислителя НСlO3, восстанавливающейся до НСl, валентность хлора изменяется от +5 до –1, т. е. один его атом (а следовательно, и одна молекула НСlO3 ) присоединяет 6 электронов.
Поэтому нормальный раствор НClO3, как окислителя, будет содержать в литре 1/6 грамм–молекулы (а как кислоты – одну грамм–молекулу). Все обозначения концентраций остаются такими же, как и при нормальных растворах кислот и оснований (V § 5).
Для составления уравнения окислительно–восстановительной реакции прежде всего необходимо знать химические формулы вводимых в нее веществ и получающихся продуктов. Первые мы, естественно, знаем, вторые же должны быть установлены либо специальным химическим исследованием, либо прямо на основании известных свойств элементов. Так как, однако, окислительно–восстановительные процессы протекают обычно в водных растворах, непосредственно определить, входит ли вода в реакцию или, наоборот, получается в ее результате, часто бывает невозможно, и это выясняется лишь в процессе составления уравнения.
Простейшим примером окислительно–восстановительного процесса может служить любая реакция вытеснения (V § 8). Ниже рассматривается несколько более сложная реакция взаимодействия раствора хлорноватой кислоты с элементарным фосфором.
Исследование продуктов этой реакции показывает, что в результате взаимодействия образуются Н3РО4 и НСl. Следовательно:
НСlО3 + Р => Н3 РО4 + НСl (I)
Найдя заряды меняющих валентность элементов и надписав их над последними, имеем:
HCl+5O3 + P0 => H3P+5O4 + HCl–1 (II)
Из уравнения (II) видно, что валентность хлора изменилась от + 5 до –1. Следовательно, НСlO3 является окислителями одна ее молекула (точнее, хлор) в процессе реакции присоединяет шесть электронов. С другой стороны, валентность фосфора изменилась от 0 до +5. Следовательно, фосфор является восстановителем и каждый его атом отдает пять электронов. Отмечая это под соответствующими веществами, имеем:
Но все молекулы веществ и уступающих в реакцию и получающихся электронейтральны. Поэтому общее число электронов, отданных в процессе реакции восстановителем, должно быть равно общему числу электронов, присоединенных окислителем. Отсюда находим основные коэффициенты уравнения – коэффициенты при окислителе и восстановителе:
Теперь проверяем число атомов каждого элемента в обеих частях уравнения и расставляем соответствующие коэффициенты (начинать проверку целесообразно с элементов, изменяющих в процессе реакции свою валентность; водород и особенно кислород, если они не входят в уравнение в свободном состоянии, следует обычно проверять последними). Уравняв при помощи коэффициентов число атомов Сl и Р в обеих частях, приходим к следующему выражению:
5НСlО3 + 6Р = 6Н3 РО4 + 5НСl (V)
Проверяя водород, видим, что в правой части уравнения его значительно больше, чем в левой. Так как свободный водород в систему не вводился, это значит, что в реакции участвовала вода. Поэтому окончательно имеем:
5НСlО3 + 6Р + 9Н2 О = 6Н3РО4 + 5НСl (VI)
Проверяя кислород, убеждаемся в том, что уравнение составлено правильно.
Формулируя вкратце разобранное выше, приходим к следующей логической последовательности мысленных операций при составлении уравнений окислительно–восстановительных реакций (попутно в качестве более сложного примера рассмотрено взаимодействие между As2 S3 и HNO3 ):
I. Устанавливаем формулы веществ, получающихся в результате реакции:
As2 S3 + HNO3 = H3 AsO4 + H2 SO4 + NO
II. Определяем валентность элементов, изменяющих ее в процессе реакции, до и после нее:
III. Подсчитываем число электронов, отдаваемое молекулой восстановителя и присоединяемое молекулой окислителя:
IV. Находим основные коэффициенты, т. е. коэффициенты при окислителе и восстановителе:
V. Проверяем число атомов каждого элемента (пока без водорода и кислорода) в начальных и конечных продуктах реакции и уравниваем его, расставляя коэффициенты:
3As2 S3 + 28HNO3 = 6H3 AsO4 + 9H2 SO4 + 28NO
VI. Проверяем водород и находим число молекул воды, участвующей в реакции:
3As2 S3 + 28HNO8 + 4Н2 О = 6H8 As04 + 9H2 SO4 + 28NO
VII. Проверяем кислород и убеждаемся в том, что уравнение составлено правильно.
Само собой разумеется, что нет надобности переписывать реакцию несколько раз, и все указанные выше операции производятся последовательно с одним и тем же уравнением (при некотором навыке– в уме). Признаком правильности расставленных коэффициентов является равенство числа атомов каждого элемента в обеих частях уравнения.
Упражнения. Закончить следующие схематические уравнения:
1) Sb2 S5 + HNO3 = H3 Sb04 + H2 SO4 + NO
2) FeSO4 + KClO3 + H2 SO4 = Fe(SO4)3 + KCl
3) HOCl + Br2 = НВrО3 + HCl
4) НСlO3 + HCl = >Cl2
Разобранная выше методика составления уравнений окислительно–восстановительных реакций непосредственно применима к большинству практически встречающихся процессов. Однако в некоторых специальных случаях требуются дополнительные пояснения. Важнейшие из этих случаев рассмотрены ниже.
А) Если число электронов, отдаваемое восстановителем, и число электронов, присоединяемое окислителем, имеют общий наибольший делитель, то оба числа делят на него при нахождении основных коэффициентов. Например, для реакции
основными коэффициентами будут не 8 и 6, а 4 и 3. Наоборот, если число участвующих в реакции электронов нечетно, а в результате ее должно получиться четное число атомов, основные коэффициенты удваивают. Так, при реакции
основными коэффициентами будут не 3 и 1, а 6 и 2.
Упражнения. Закончить следующие схематические уравнения:
1) НСlO3 + H2S => H2SO4 + HCl
2) FeSO4 + HNO3 + H2 SO4 => Fe2 (SO4 )3 + NO
3) HClO4 +SO2 => H2 SO4 + HCl
4) FeCl3 + HJ => J2 + FeCl2 + НСl
Б) Окислитель или восстановитель расходуется также на связывание получающихся продуктов.
Например, рассуждая –по–предыдущему, находим, что при реакции (по стадиям I–IV уже проведенной)
на каждые 3 молекулы восстановителя – Fe(NO3 )2 – нужно затратить одну молекулу окислителя – HNO3 . Однако из сопоставления веществ левой и правой частей уравнения видно, чта, кроме того, при переходе Fe(NO3 )2 в Fe(NO3 )3 на каждую молекулу восстановителя требуется затратить одну молекулу НNОз для дополнительного связывания трехвалентного железа. Таким образом, в общем потребуется азотной кислоты: 1 молекула на окисление плюс 3 молекулы на связывание, т. е. всего 4 молекулы. Уравнение принимает вид
и окончательно (после проведения стадий V и VI):
3Fe(NO3 )2 + 4HNO3 = 3Fe(NO3 )3 + NO + 2Н2 О
Подобный же пример для восстановителя имеем при реакции:
Здесь также находим, что, кроме 4 молекул НСl, реагирующих как восстановитель, необходимо иметь еще 4 ее молекулы для связывания 2К+ и Мn2+. Таким образом, уравнение принимает вид
и окончательно:
К2 МnO4 + 8НСl = 2КСl + МnСl3 + 2Cl + 4Н2 O
Упражнения. Закончить следующие схематические уравнения:
1) СrО3 + НСl = > СrСl3 + Сl2
2) Cu2 O + HNO3 = >Cu(NO3 )2 + NO
3) Ag + HNO3 = >AgNO3 +NO
В) Оба элемента – и отдающий и присоединяющий электроны–находятся в одной и той же молекуле. Сюда относятся, в частности, случаи распада вещества на соединения одного и того же элемента одновременно более высокой и более низкой валентностей. Для нахождения основных коэффициентов подобные процессы рассматривают как бы идущими справа налево.
Упражнения, Закончить следующие схематические уравнения:
1) CuJ2 = > CuJ + J2
2) HNO2 = >HNO3 + NO
3) HClO3 = >ClO2 +HClO4
Г) Окислителем (или восстановителем) является перекисное соединение. Так как такие соединения представляют собой производные перекиси водорода, они ведут себя аналогично последней (IV § 5). Сама H2 О2 при окислительном распаде освобождает один атом кислорода, следовательно, молекула ее в качестве окислителя способна присоединить два электрона. При восстановительном распаде Н2 О2 он освобождает два атома водорода, что соответствует возможности отдачи опять–таки двух электронов,
Упражнения. Закончить следующие схематические уравнения:
1) Cr2 (SO4 )3 + Н2 О2 + КОН = > К2 Сr04 +K2 SO4
2) НОСl + Н2 О2 = > НСl + О2
3) Так как связь между одинаковыми атомами неполярна, при подсчете электрохимической валентности она не учитывается. Например, в перекиси водорода Н–О–О–Н кислород, будучи по существу двухвалентным, имеет отрицательную валентность –I.
4) Несовпадение электрохимической и общей валентности может встречаться и в ряде других случаев. Например, приписывая в Н–CN водороду валентность + 1, а азоту –3, получаем для углерода (в силу электронейтральности молекулы) электрохимическую валентность +2.
Следует отметить, что на значениях коэффициентов окислительно–восстановительного уравнения характер внутримолекулярного распределения зарядов не сказывается. Так, для реакции сгорания HCN в кислороде
4HCN + 5O2 = 2H2 O+4CO2 +2N2
основные коэффициенты 4 и 5 вычисляются независимо от того, принять ли для отдельных атомов молекулы HCN приведенные выше электрохимические валентности или какие–либо другие (например, нулевые). Само собой разумеется, что при любом распределении зарядов должна быть обеспечена электронейтральность молекулы в целом.
5) Ввиду малой полярности связей в органических соединениях часто трудно решить, какие из атомов в молекуле поляризованы положительно и какие отрицательно. Поэтому при составлении уравнений реакций окисления органических соединений основные коэффициенты иногда удобнее находить не по непосредственному подсчету числа электронов, а определяя предварительно число атомов кислорода, необходимое для перевода исходной молекулы в продукты реакции. Зная затем, что каждый пошедший на окисление атом кислорода соответствует переходу двух электронов, легко найти и основные коэффициенты уравнения.
Пример. Действием КМnО4 в кислой среде глюкоза может быть нацело окислена по схеме:
C6 H12 O6 = > 6CO2 + 6H2 O
Подсчитывая число атомов кислорода в глюкозе и продуктах ее окисления, находим, что на каждую молекулу глюкозы нужно затратить 12 атомов кислорода. Это соответствует отдаче 24 электронов, в связи с чем и находят основные коэффициенты уравнения:
5С6 Н12 О6+ 24КМnО4 + 36H2 SO4 = 12K2 SO4 + 24MnSO4 + 30СО2 + 66Н2 О
В заключение следует кратко остановиться на зависимости окислительно–восстановительных процессов от реакции среды, в которой они протекают. Чаще всего тот или иной окислитель или восстановитель является таковым только в определенной среде (кислой или щелочной). Сам процесс протекает более или менее энергично в зависимости от степени ее кислотности (щелочности). Иногда влияние характера среды может быть столь значительным, что обусловливает изменение самого направления процесса. Например, взаимодействие по схеме
в щелочной среде идет направо, в кислой – налево.
Практически для создания в растворе кислой среды чаще всего пользуются серной кислотой (НСl и HNO3 применяют реже, так как первая из них способна окисляться, а вторая сама является окислителем, и поэтому в обоих случаях иногда могут протекать различные побочные реакции). Для создания щелочной среды служит обычно NaOH или КОН.
Вещество, при помощи которого создается определенная среда, не всегда входит в окончательное уравнение реакции. Рассмотрим, например, следующие случаи окисления посредством КМnО4 в щелочной среде:
I SO2 + KMnO4 + КОН = > K2 SO4 + МnО2
II S + КМnО4 + КОН = > K2 SO4 + MnO2
III H2 S + KMnO4 + КОН = > K2 SO4 + MnO2
После нахождения основных коэффициентов и уравнивания числа атомов, меняющих валентность в процессе реакции, имеем:
3SO2 + 2KMnO4 + КОН = > 3K2 SO4 + 2МnО2
S + 2КМnО4 + КОН = > K2 SO4 + 2МnОа
3H2 S + 8КМnО4 + КОН = > 3K2 SO4 + 8МnО2
Только теперь следует приступать к проверке атомов вещества, создающего определенную среду (пока–без водорода и кислорода). Уравнивание числа атомов калия дает:
3SO2 + 2KMnO4 + 4KOH = >3K2 SO4 + 2MnO2
S + 2KMnO4 = > K2 SO4 + 2MnO2
3H2 S + 8KMnO4 = > 3K2 SO4 + 8MnO2 + 2KOH
Окончательно, после уравнивания водорода и кислорода, получаем:
3SO2 + 2КМnО4 + 4КОН = > 3K2 SO4 + 2МnО2 + 2Н2 О
S + 2KMnO4 = > K2 SO4 + 2MnO2
3H2 S + 8КМnО4 = >3K2 SO4 + 8МnО2 + 2КОН + 2Н2 О
Таким образом, с точки зрения подбора коэффициентов вводимая в систему для создания определенной среды щелочь или кислота ведет себя подобно воде: она может потребляться при реакции (случай I), не участвовать в ней (случай II) или даже дополнительно получаться в ее результате (случай III).
Еще по теме:www.xumuk.ru
Химия. ОВР — метод полуреакций
Сегодня мы научимся расставлять коэффициенты в окислительно-восстановительных реакциях (сокращенно ОВР) методом электронно-ионного баланса.
Задание обычно звучит так:
Подберите коэффициенты к уравнениям окислительно-восстановительной реакции, используя метод электронно-ионного баланса, укажите окислитель и восстановитель, процессы окисления и восстановления.
Для примера разберем следующую ОВР:
Cl2 + K2S + KOH → KCl + K2SO4 + H2O
С чего начать?
Первым делом «растворяем то, что растворяется», иначе говоря, растворимые соединения разбиваем на анионы (отрицательно заряженные ионы) и катионы (положительно заряженные ионы).
Для нашей реакции:
Сl20 + K21+ + S2- + K1+ + OH1- → K1+ + Cl1- + K21+ + SO42- + H2O
Сокращаем те ионы, которые повторяются и слева, и справа и получаем уравнение реакции в ионно-молекулярном виде:
Сl20 + S2- + OH1- → Cl1- + SO42- + H2O
Определим среду нашей ОВР. Ионы OH- в левой части реакции говорят нам, что среда щелочная. Это хуже, чем кислотная, но мы справимся ☺
Расставим степени окисления над каждым атомом. Принцип очень простой: степень окисления кислорода (почти) всегда 2-; водорода – 1+; степень окисления металлов равна порядковому номеру группы в таблице Менделеева, где живет этот металл. Степени окисления оставшихся атомов вычисляем, вычитая из степени окисления всего иона степени окисления известных атомов.
Сl20 + S2- + O2-H1+ → Cl1- + S6+O42- + H2O2-
Видно, что в ОВР изменяются степени окисления хлора (было 0, стало 1-) и серы (было 2-, стало 6+).
Степень окисления хлора уменьшилась, т.е. он забрал себе лишние электроны. Степень окисления серы увеличилась, т.е. она электроны отдала. Ион, отдавший ионы, называется восстановителем; получивший электроны – окислителем.
Теперь записываем две полуреакции для серы и для хлора:
Cl20 → Cl1- — окислитель, полуреакция восстановления
S2- → SO42- — восстановитель, полуреакция окисления
После десятка-другого ОВР все описанное выше делается в уме за несколько секунд.
Теперь начинаем работать с выделенными полуреакциями.
Cl20 → Cl1-
Шаг первый: уравниваем количество атомов главного элемента (хлора).
Cl20 → 2Cl1-
Шаг второй: уравниваем количество атомов кислорода. У нас кислорода нет, едем дальше.
Шаг третий: уравниваем количество атомов водорода. Водорода тоже нет, едем дальше.
Шаг четвертый: уравниваем заряды с помощью электронов. В нашем случае слева заряд 0, справа 2 заряда по -1, достаточно очевидно, что нужно добавить 2 электрона слева. Что мы и делаем:
Cl20 + 2е → 2Cl1-
Одна полуреакция готова. Принимаемся за вторую.
S2- → SO42-
Шаг первый: уравниваем количество атомов главного элемента (серы). У нас они уже равны, едем дальше.
Поскольку среда щелочная, шаг второй и шаг третий объединяем: нужно уравнять количества атомов кислорода и водорода, причем делать это нужно, добавляя слева ионы OH-, а справа молекулы воды. Я это делаю обычно перебором. В нашем случае справа нужно добавить 8 ионов OH—, а слева – 4 молекулы воды.
S2- + 8OH— → SO42- + 4H2O
Все атомы уравнялись.
Шаг четвертый: уравниваем заряды с помощью электронов. В нашем случае слева заряд -10, справа -2, вычитаем слева 8 электронов:
S2- + 8OH— — 8e → SO42- + 4H2O
Теперь выписываем наши уравненные полуреакции рядом. Хлор забирает 2 электрона, сера отдает 8 электронов, значит, чтобы все сошлось, необходимо умножить полуреакцию хлора на 4.
А если делать на автомате, то записываем количество электронов, сокращаем (если сокращается) и меняем местами. На получившееся число умножаем полуреакцию и собираем обратно в молекулярно-ионную запись.
Cl20 + 2е → 2Cl— 2→1→4
S2- + 8OH— — 8e → SO42- + 4H2O 8→4→1
4Сl20 + S2- + 8OH— → 8Cl— + SO42- + 4H2O
Проверяем, все ли сходится: хлора – по 8 атомов с каждой стороны, серы – по 1, водорода – по 8, кислорода – по 8.
С теми же коэффициентами переписываем полную ОВР.
4Cl2 + K2S + 8KOH → 8KCl + K2SO4 + 4H2O
Готово.
Для закрепления рассмотрим еще одну реакцию, на этот раз с кислой средой. Не буду расписывать так же подробно, только ключевые моменты.
K2Cr2O7 + Al + H2SO4 → Cr2(SO4)3 + Al2(SO4)3 + K2SO4 + H2O
Наметанным глазом сразу видно: степени окисления меняются у алюминия и у хрома. Выписываем полуреакции и уравниваем их.
Первая полуреакция:
Al0 → Al3+
Шаг первый: уравниваем количество атомов главного элемента – выполнено.
Шаг второй: уравниваем количество атомов кислорода – выполнено.
Шаг третий: уравниваем количество атомов водорода – выполнено.
Шаг четвертый: уравниваем заряды с помощью электронов. Слева заряд 0, справа +3, нужно вычесть слева 3 электрона. Алюминий электроны отдает, значит, он в реакции восстановитель, а его полуреакция является полуреакцией окисления.
Al0 – 3e → Al3+
Вторая полуреакция:
Cr2O72- → Cr3+
Шаг первый: уравниваем количество атомов главного элемента.
Cr2O72- → 2Cr3+
Шаг второй: уравниваем количество атомов кислорода с помощью воды.
Cr2O72- → 2Cr3+ + 7H2O
Шаг третий: уравниваем количество атомов водорода c помощью ионов H+, потому что среда кислая. О том, что она кислая, нам говорит наличие кислоты в левой части реакции (если бы мы записали ионно-молекулярную форму реакции, слева остались бы ионы H+)
Cr2O72- + 14H+ → 2Cr3+ + 7H2O
Шаг четвертый: уравниваем заряды с помощью электронов. Слева заряд +12, справа 2 раза по +3, нужно добавить слева 6 электрона. Хром электроны забирает, значит, он в реакции окислитель, а его полуреакция является полуреакцией восстановления.
Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O
Выписываем полуреакции рядом и производим манипуляции с электронами:
Al0 – 3e → Al3+ 3→1→2
Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O 6→2→1
Собираем две полуреакции в ионно-молекулярную реакцию, домножив, соответственно, на полученные числа.
Cr2O72- + 2Al0 + 14H+ → 2Cr3+ + 2Al3+ + 7H2O
Восстанавливаем полную реакцию, расставляя найденные коэффициенты:
K2Cr2O7 + 2Al + 7H2SO4 → Cr2(SO4)3 + Al2(SO4)3 + K2SO4 + 7H2O
Для проверки я обычно считаю, сходятся ли количества атомов кислорода: слева у нас 7+7*4=35 атомов, справа – 3*4+3*4+4+7=35 атомов.
Кислород сошелся, значит, все верно.
Любую ОВР можно уравнять описанным методом. Бывают, конечно, более сложные варианты, но смысл всегда один и тот же.
Дерзайте, и у вас все получится.
Если у Вас есть вопросы по решению данной задачи (или другой), пишите на наш e-mail [email protected], мы всегда готовы помочь.
С уважением, Botva-Project
botva-project.ru