Решение расчётных задач по уравнению реакции. Видеоурок. Химия 9 Класс
Данный урок посвящен изучению алгоритма решения еще одного типа расчетных задач. С помощью материалов урока Вы научитесь рассчитывать по уравнению реакции массу, количество вещества, или объем продукта реакции, если для его получения дан раствор с определенной массовой долей исходного вещества.
В задачах такого типа используются уже знакомые вам расчеты по уравнению реакции и вычисления, связанные с понятием «массовая доля вещества в растворе».
Тема: Химическая связь. Электролитическая диссоциация
Урок: Решение расчетных задач по уравнению реакции
Какая масса хлорида серебра образуется при взаимодействии избытка раствора нитрата серебра и 100 г раствора соляной кислоты с массовой долей кислоты 15%?
Дано: m(HCl раствора) = 100 г
W (HCl) = 15% или 0.15
Найти: m(AgCl) -?
Решение:
Сначала необходимо записать уравнение химической реакции:
HCl + AgNO
1) Находим массу растворенного в воде хлороводорода:
m(HCl) = m(HCl раствора) · W (HCl)
m(HCl) =100 г · 0.15 = 15 г
2) Находим количество вещества хлороводорода:
n (HCl) = m(HCl)/М(HCl)
n (HCl) =15 г/ 36.5 г/моль = 0.41 моль
3) Находим количество вещества хлорида серебра:
n(HCl) = n (AgCl) => n (AgCl) = 0.41 моль
(т.к. по уравнению реакции количества веществ соляной кислоты и хлорида серебра равны, получается, что количество вещества хлорида серебра равно 0,41 моль)
4) Находим массу хлорида серебра:
m(AgCl) = n (AgCl) · М(AgCl)
m(AgCl) = 0.41 моль · 143.5 г/моль = 58.8 г
Ответ: образуется 58.8 г хлорида серебра.
Чему равна масса сульфата натрия в растворе, если для реакции нейтрализации использовали 8 г 10%-ного раствора гидроксида натрия?
Дано:m(NaOH раствора) = 8г
W(NaOH) = 10% или 0.1
Найти: m(Na2SO4
) =?Решение:
Запишем уравнение реакции: H2SO4 + 2NaOH = Na2SO4 + 2H2O
1) m(NaOH) = m(NaOH раствора) · W(NaOH)
m(NaOH) = 8г · 0.1 = 0.8г
2) n(NaOH) = m(NaOH)/М (NaOH)
n(NaOH) =0.8г/40г/моль = 0.02 моль
3) n((Na2SO4) = ½ n(NaOH)
n((Na2SO4) = ½ · 0.02 моль = 0.01 моль
4) m(Na2SO4) = n(Na2SO4) · М(Na2SO4)
m(Na2SO4) =0.01 моль · 142 г/моль = 1.42г
Ответ: образуется 1.42г сульфата натрия в растворе.
Список рекомендованной литературы
1. Оржековский П.А. Химия: 9-й класс: учеб. для общеобраз. учрежд. / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. – М.: АСТ: Астрель, 2007.
2. Оржековский П.А. Химия: 9-ый класс: учеб для общеобр. учрежд. / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013.
3. Рудзитис Г.Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009.
4. Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008.
5. Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме): (Источник).
2. Электронная версия журнала «Химия и жизнь»: (Источник).
Домашнее задание
1. Оксид меди (II), взятый в избытке, поместили в колбу с 200 г 7%-ой серной кислоты и смесь нагрели. Вычислите массу сульфата меди (II), получившегося в результате реакции.
2. с. 67 №№ 8-10
из учебника П.А. Оржековского «Химия: 9-ый класс» / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013.interneturok.ru
Задачи на расчеты по уравнениям химических реакций и тепловой эффект.
Задание №1
Рассчитайте массу оксида (в граммах), образовавшегося при сгорании 2,4 г металлического магния. Ответ округлите до целых.
РешениеЗадание №2
Рассчитайте объем газа (в литрах), образующегося при взаимодействии 6,72 л хлора (н.у.) с необходимым количеством водорода. Ответ округлите до сотых.
РешениеЗадание №3
Какую массу нитрата свинца (II) (в граммах) можно получить при взаимодействии с избытком азотной кислоты оксида свинца (II) массой 11,15 г? Ответ округлите до сотых.
РешениеЗадание №4
Рассчитайте объем газовой смеси (н.у.), полученной при полном разложении 15 л аммиака. Ответ укажите в литрах и округлите до целых.
РешениеЗадание №5
При сгорании навески серы выделилось 8,96 л сернистого газа (н.у.). Вычислите массу серы, которую взяли для реакции. Ответ округлите до десятых.
РешениеЗадание №6
При прокаливании образца мела выделилось 3,36 л углекислого газа (н. у.). Вычислите массу образовавшегося оксида кальция (в граммах). Ответ округлите до десятых.
РешениеЗадание №7
Рассчитайте массу цинка (в граммах), необходимую для получения 162 г его оксида. Ответ округлите до целых.
РешениеЗадание №8
Вычислите объем газов (н.у.), необходимый для получения 13,5 г воды из простых веществ. Ответ укажите в литрах и округлите с точностью до десятых.
РешениеЗадание №9
Определите массу хлорида алюминия (в граммах), которую можно получить из 33,6 л газообразного хлора (н. у.). Ответ округлите до десятых.
РешениеЗадание №10
Какую массу чистой серной кислоты (в граммах) необходимо затратить для получения 100 г сульфата железа (III) из оксида железа (III)? Ответ округлите до десятых.
РешениеЗадание №11
Какой объем оксида азота (II) можно получить при каталитическом окислении 15,6 л аммиака кислородом (н.у.)? Ответ укажите в литрах и округлите до десятых.
РешениеЗадание №12
Какую массу фосфата калия (в граммах) можно получить из 120 г фосфорной кислоты и избытка гидроксида калия. Ответ округлите до десятых.
РешениеЗадание №13
Рассчитайте объем сероводорода (н.у.), необходимый для получения 31 г сульфида натрия по реакции с гидроксидом натрия. Ответ укажите в литрах с точностью до десятых.
РешениеЗадание №14
Вычислите массу поташа (в граммах), которая при взаимодействии с избытком азотной кислоты даст 20,16 л углекислого газа (н.у.). Ответ округлите до десятых.
РешениеЗадание №15
Какой объем угарного газа (в литрах) (н. у.) можно получить при неполном сгорании 14 г углерода? Ответ округлите до целых.
РешениеЗадание №16
Какую массу гидроксида алюминия можно получить из 50 г сульфата алюминия при его обменной реакции с достаточным количеством раствора гидроксида натрия? Ответ округлите до десятых.
РешениеЗадание №17
Вычислите массу негашеной извести (в граммах), которая может прореагировать с 10 г воды. Ответ округлите до целых.
РешениеЗадание №18
Рассчитайте объем 15%-ного раствора карбоната натрия (плотность 1,1 г/мл), из которого при взаимодействии с избытком соляной кислоты можно получить 22,4 л (н. у.) углекислого газа. Ответ укажите в миллилитрах и округлите до целых.
РешениеЗадание №19
Рассчитайте массовую долю серной кислоты в растворе (плотность 1,35 г/см3), если известно, что 30 мл такого раствора могут полностью прореагировать с 5 г карбоната кальция. Ответ укажите в процентах и округлите с точностью до десятых.
РешениеЗадание №20
Вычислите массу углекислого газа (в граммах), полученного при взаимодействии 121 мл 15%-ного раствора азотной кислоты (плотность 1,16 г/мл) с необходимым количеством карбоната магния. Ответ округлите до десятых.
РешениеЗадание №21
Определите объем водорода (при н.у.), который можно получить при взаимодействии избытка цинкового порошка со 100 мл 10%-ного раствора соляной кислоты (плотность 1,05 г/мл). Ответ укажите в литрах и округлите с точностью до десятых.
РешениеЗадание №22
Вычислите массу гидроксида железа (III), которую можно получить при взаимодействии 2,5 мл 20%-ного раствора бромида железа (III) (плотность 1,38 г/см3) и избытка водного раствора гидроксида натрия. Ответ укажите в граммах и округлите до сотых.
РешениеЗадание №23
Какой объем газообразного аммиака (в литрах) может прореагировать с 650 мл 10%-ного раствора бромоводородной кислоты (плотность 1,14 г/мл)? Ответ округлите до десятых.
РешениеЗадание №24
Определите массу серной кислоты, которая необходима для полной нейтрализации 100 мл 20%-ного раствора гидроксида бария (плотность 1,17 г/мл)? Ответ округлите до десятых.
РешениеЗадание №25
Рассчитайте массу сероводорода, которую можно получить из 13 мл 5%-ного раствора сульфида калия (плотность 1,06 г/мл) и избытка соляной кислоты. Ответ округлите до десятых.
РешениеЗадание №26
Какую массу фосфида магния (в граммах) можно получить из 240 мг металла и 217 мг фосфора? Ответ округлите до сотых.
РешениеЗадание №27
Какой объем аммиака (в литрах) можно получить из 3 г водорода и 11,2 л азота (н. у.)? Ответ округлите до десятых.
РешениеЗадание №28
Рассчитайте объем углекислого газа (в литрах), который можно получить из 12 л кислорода и 14 л угарного газа (н. у.). Ответ округлите до целых.
РешениеЗадание №29
Вычислите массу нитрата аммония (в граммах), которую можно получить из 20 л (н. у.) аммиака и 31,5 г азотной кислоты. Ответ округлите до целых.
РешениеЗадание №30
Определите объем сернистого газа (в литрах), который можно получить из 16 г серы и 8 г кислорода. Ответ округлите до десятых.
РешениеЗадание №31
Какой суммарный объем газов (н. у.) можно получить при взаимодействии 15 г углерода и 16 г серы с избытком кислорода? Ответ округлите до десятых.
РешениеЗадание №32
Какую массу оксида серы (VI) можно получить при взаимодействии 30 л сернистого газа и 30 л кислорода (н. у.)? Ответ укажите в граммах и округлите с точностью до целых.
РешениеЗадание №33
Вычислите массу оксида алюминия, который можно получить из 13,5 г алюминия и 13,5 г кислорода. Ответ округлите до десятых.
РешениеЗадание №34
Определите массовую долю соли в растворе, полученном при смешении 150 г 15%-ного раствора гидроксида натрия и 250 г 10%-ного раствора плавиковой кислоты. Ответ округлите до десятых процента.
РешениеЗадание №35
Рассчитайте массовую долю кислоты в растворе, полученном при смешении 8,5 г 10%-ного раствора аммиака и 40,5 г 50%-ного раствора бромоводородной кислоты. Ответ округлите до десятых процента.
РешениеЗадание №36
Вычислите массовую долю карбоната калия в растворе, полученном при смешении 100 г 2%-ного раствора гидрокарбоната калия и 100 г 20%-ного раствора гидроксида калия. Ответ укажите в процентах и с точностью до сотых.
РешениеЗадание №37
Рассчитайте массовую долю хлороводорода в растворе, полученном при смешении 250 г 10%-ного раствора хлороводорода и 1,7 г нитрата серебра. Ответ округлите до десятых процента.
РешениеЗадание №38
Образец карбоната бария массой 15 г, содержащий 5% инертных примесей, растворили в избытке раствора соляной кислоты. Вычислите объем выделившегося газа. Ответ округлите до десятых.
РешениеЗадание №39
Смесь песка и поваренной соли массой 20 г внесли в 90 мл воды. Доля растворенного вещества в образовавшемся растворе составила 10%. Определите массу песка в исходной смеси. Ответ округлите до целых.
РешениеЗадание №40
Смесь цинка и песка массой 10 г смешали с избытком раствора йодоводородной кислоты, в результате чего образовался газ объемом 3,36 л (н. у.). Определите массовую долю цинка в исходной смеси. Ответ укажите в процентах округлите до десятых процента.
РешениеЗадание №41
Газообразную смесь хлороводорода и кислорода объемом 11,2 л (н. у.) пропустили через необходимый для полной нейтрализации объем раствора гидроксида натрия. После упаривания раствора масса остатка составила 11,7 г. Определите объем кислорода в исходной смеси. Ответ округлите до сотых.
РешениеЗадание №42
При прокаливании алюминиевой стружки массой 54 г в токе кислорода образовалось 96 г оксида. Определите выход реакции. Ответ округлите до целых процентов.
РешениеЗадание №43
Термическое разложение навески карбоната кальция массой 50 г прошло с выходом 95%. Рассчитайте массу воды, которая может прореагировать с полученным твердым остатком. Ответ округлите до сотых.
РешениеЗадание №44
Горение углерода происходит согласно термохимическому уравнению
C(графит) + O2(г) → CO2(г) + 393,5 кДж
Рассчитайте количество энергии, которое выделится при сгорании 6 г углерода. Ответ округлите до сотых.
РешениеЗадание №45
Горение алюминия происходит согласно термохимическому уравнению
4Al(тв) + 3O2(г) → 2Al2O3(тв) + 3352 кДж
Рассчитайте количество энергии, которое выделится при сгорании 13,5 г алюминия. Ответ округлите до целых.
РешениеЗадание №46
Обжиг сульфида свинца (II) происходит согласно термохимическому уравнению
2PbS(тв) + 3O2(г) → 2PbO(тв) + 2SO2(г) + 832 кДж
Рассчитайте массу навески сульфида свинца (II), если в процессе выделилось 70 кДж энергии. Ответ округлите до десятых.
РешениеЗадание №47
Обжиг сульфида алюминия происходит согласно термохимическому уравнению
2Al2S3(тв) + 9O2(г) → 2Al2O3(тв) + 6SO2(г) + 3864 кДж
Рассчитайте массу навески сульфида алюминия, если в процессе выделилось 90 кДж энергии. Ответ округлите до целых.
РешениеЗадание №48
Обжиг пирита происходит в соответствии с термохимическим уравнением
4FeS2(тв) + 11O2(г) → 2Fe2O3(тв) + 8SO2(г) + 3367 кДж
Рассчитайте массу навески пирита, если в процессе выделилось 110 кДж энергии. Ответ округлите до десятых.
РешениеЗадание №49
Разложение нитрата серебра происходит согласно термохимическому уравнению
2AgNO3(тв) → 2Ag(тв) + 2NO2(г) + O2(г) – 316 кДж
Сколько энергии нужно затратить для получения 8,96 л кислорода по данной реакции? Ответ округлите до десятых.
РешениеЗадание №50
Взаимодействие сернистого газа с сероводородом описывается следующей реакцией
SO2(г) + 2H2S(г) → 3S(ромб) + 2H2O(г) + Q
При образовании 8 г серы выделилось 12 кДж энергии. Установите тепловой эффект реакции Q. Ответ округлите до целых.
РешениеЗадание №51
Взаимодействие сернистого газа с кислородом описывается следующей реакцией
2SO2(г) + O2(г) → 2SO3(г) + Q
При образовании 16 г оксида серы (VI) выделилось 28,4 кДж энергии. Установите тепловой эффект реакции Q. Ответ округлите до целых.
РешениеЗадание №52
Взаимодействие магния с азотом описывается следующей реакцией
3Mg(тв) + N2(г) → Mg3N2(тв) + Q
При поглощении 11,2 л азота выделилось 230 кДж энергии. Установите тепловой эффект реакции Q. Ответ округлите до целых.
РешениеЗадание №53
Реакция серы с железом происходит согласно термохимическому уравнению
Fe(тв) + S(ромб) → FeS(тв) + Q
Рассчитайте тепловой эффект реакции Q, если при образовании 40 г сульфида железа (II) выделяется 45,5 кДж энергии. Ответ округлите до целых.
РешениеЗадание №54
Реакция серы с фтором происходит согласно термохимическому уравнению
S(ромб) + 3F2(г) → SF6(г) + Q
Рассчитайте тепловой эффект реакции Q, если при образовании 50 г фторида серы (VI) выделяется 413 кДж энергии. Ответ округлите до целых.
РешениеЗадание №55
Разложение карбоната кальция происходит согласно термохимическому уравнению
CaCO3(тв) → CaO(тв) + CO2(г) – 178 кДж
Сколько энергии нужно затратить для получения 28 г оксида кальция по данной реакции? Ответ округлите до целых.
РешениеЗадание №56
Разложение карбоната свинца происходит согласно термохимическому уравнению
PbCO3(тв) → PbO(тв) + CO2(г) – 87 кДж
Сколько энергии нужно затратить для получения 112 л углекислого газа по данной реакции? Ответ округлите до целых.
РешениеЗадание №57
Разложение карбоната стронция происходит согласно термохимическому уравнению
SrCO3(тв) → SrO(тв) + CO2(г) – 241 кДж
Сколько энергии нужно затратить для получения 104 г оксида стронция по данной реакции? Ответ округлите до целых.
РешениеЗадание №58
Образование оксида азота (II) происходит согласно термохимическому уравнению
N2(г) + O2(г) → 2NO(г) – 180 кДж
Сколько энергии нужно затратить для получения 15 г оксида азота (II) по данной реакции? Ответ округлите до целых.
РешениеЗадание №59
Разложение гидроксида меди (II) происходит согласно термохимическому уравнению
Cu(OH)2(тв) → CuO(тв) + H2O(г) – 46 кДж
Сколько энергии нужно затратить для разложения 9,8 г исходного вещества по данной реакции? Ответ округлите до десятых.
Решениеscienceforyou.ru
Решение задач по химическим уравнениям
Учитель Мацанова Анна Мариковна.
Тип урока. Изучение нового материала
Место урока в программной теме. Тема 3. «Простые вещества».
Урок № 6.
“Недостаточно лищь понять задачу,
необходимо желание решить ее.
Где есть желание, найдется путь!»
Д. Пойа
Цель урока. Создать условия для формирования навыка решения задач по химическим уравнениям
— формировать навыки работы с текстом задачи,
-умение аргументировано выбирать способ решения учебной задачи,
-умения составлять уравнения химических реакций.
Задачи развивающие.
совершенствовать умение работать с учебными материалами, выделять необходимое и главное
-развивать умения анализировать, сравнивать, выделять главное, составлять план действия, делать выводы.
развивать навыки научного познания методами исследовательской деятельности (наблюдение, эксперимент, предположение-гипотеза, дедукция, индукция).
Задачи воспитательные.
формировать естественнонаучное мировоззрение;
совершенствовать коммуникативные умения в ходе коллективного обсуждения;
развивать умение формулировать и аргументировать собственное мнение, развивать самостоятельность.Ход урока.
Организационный момент (1-2 минуты)
Здравствуйте ребята. Сегодня, мы с вами научимся решать задачи по уравнениям химических реакций. Познакомимся с основными способами решения задач по химическим уравнениям (находить количество, массу и объём продуктов реакции по количеству, массе или объёму исходных веществ).
Актуализация знаний и опыта, подготовка к восприятию нового материала.
На предыдущих уроках мы изучали такие понятия как молярная масса, количество вещества, молярный объем и научились производить расчеты с данными величинами по формулам. Вы узнали какие признаки указывают на протекание химических реакций, научились составлять уравнения химических реакций. Я надеюсь, что вы хорошо усвоили эти темы и без труда ответите на мои вопросы:
— как определить молярную массу вещества, в каких единицах измеряется?
— как определить массу вещества, в каких единицах измеряется?
— как определить количество вещества, в каких единицах измеряется?
— чему равен молярный объем, в каких единицах измеряется?
— как определить объем, в каких единицах измеряется?
— как определить количество вещества зная объем?
Учащиеся отвечают на поставленные вопросы у доски.
III. Мотивационно – ориентировочный этап.
На этом этапе осуществляются:
мотивация учебной деятельности учащихся путем создания особо значимых для них проблемных ситуаций, основанных на их конкретном опыте;
определение темы и основных направлений исследования, выделение проблемы, её вербализация, выдвижение гипотез и предположений.
Для того, чтобы научиться решать задачи, необходимо составить алгоритм действий, т.е. определить последовательность действий.
Алгоритм для расчета по химическим уравнениям (у каждого учащегося на столе)
Для того, чтобы решить расчетную задачу по химии, можно воспользоваться следующим алгоритмом:
Внимательно прочитать условия задачи
Запишите краткое условие задачи
Составить уравнение химической реакции.
Подчеркните формулы веществ о которых говорится в кратком условии
Над уравнением запишите данные из условия задачи
Под уравнением запишите количество веществ (формулы которых подчеркнуты) согласно правильно расставленным коэффициентам в уравнении
Если в условии даны масса или объем, какого- либо вещества согласно формулам:
m V
n= ——— n= ———
M Vm
Найдите количество вещества и запишите над уравнением реакции.
Количество неизвестного вещества обозначить за «Х» моль.
Составьте пропорцию и по правилу пропорции найдите значение «Х».
Приступаем к решению задач, применяя алгоритм
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
Задача 1
Вычислите массу кислорода, выделившегося в результате разложения
воды массой 9 г.
Дано:
m (h3O) = 9 г
(h3O) = 9 г
________________
m (О2) = ? г
Решение:
Найдем молярную массу воды и кислорода:
М(Н2 О) = 18 г/моль
М(О 2) = 32 г/моль
Запишем уравнение химической реакции:
2Н2О = 2Н2 + О2
9 г
n= —————- = 0,5 моль
18г/моль
Над формулой в уравнении реакции запишем найденное значение количества вещества, а под формулами веществ — стехиометрические соотношения, отображаемые химическим уравнением
0,5моль х моль
2Н2О = 2Н2 + О2
2моль 1моль
Вычислим количество вещества, массу которого требуется найти.
Для этого составляем пропорцию
0,5моль х моль
———— = ————-
2моль 1моль
откуда х = 0,25 моль
Следовательно, n(O
Найдем массу вещества, которую требуется вычислить
m(O2)= n(O2)*M(O2)
m(O2) = 0,25 моль • 32 г/моль = 8 г
Запишем ответ
Ответ: m(О2) = 8 г
Вычисление объема вещества по известной количеству другого вещества, участвующего в реакции.
Задача 2
Вычислить объем водорода выделившегося при разложении 3 моль воды
Дано:
n(Н2 О) = 3 моль
————————
V(Н2) = ?
Запишем уравнение реакции. Расставим коэффициенты
3 моль х л., у моль
2Н2О = 2Н2 + О2
2 моль 2 моль
Вычислим количество вещества, объем которого требуется найти. Для этого составим пропорцию
3 моль У моль
———— = —————
2 моль 2 моль
У = 3 моль
Найдем объем вещества, который требуется вычислить
V = Vm *n
V(Н2) =3 моль •22,4л/моль=67,2 л
Ответ: V(Н2) =67,2 л
III. Операционно – исполнительный этап.
На этом этапе осуществляются:
Самостоятельная работа с учебными материалами;
сбор необходимой информации и построение умозаключений;
формирование выводов, обобщений.
Задачи для самостоятельного решения по вариантам (закрепление умения решения задач). На столе для каждого учащегося алгоритм решения задач по данной теме. После выполнения заданий учащиеся обмениваются вариантами и проводят взаимопроверку. Правильное решение задач учащиеся видят на зкране.
1 вариант. Найти массу оксида углерода IV получившегося в результате взаимодействия 2 моль углерода с кислородом
2 вариант. Какой объем водорода необходимо затратить на восстановление 0,3 моль свинца из оксида свинца IV
Проверим решение задач.
Задача 1
Дано: Решение:
n(C) = 2 моль 2 моль х г, у моль
———————— C + O2 = CO2
m(CO2) = ? 1 моль 1 моль
2 моль У моль
——— = ———— У= 2 моль n(CO2) = 2 моль
1 моль 1 моль
m =M*n
M(CO2) = 12+32=44 г/моль
m(CO2) = 44 г/моль* 2 моль =88 г
Ответ: масса CO2 = 88 г
Задача 2
Дано: Решение:
n(Pb) =0,3 моль х л, у моль 0,3 моль
_________________ Pb O2 + 2 Н2 = 2 Н2 + Pb
V(Н2) =? 2 моль 1 моль
У моль 0,3 мол
———— = —————- У=0,6 моль n(Н2)
2 моль 1 моль
V = Vm *n V(Н2) =22,4 л/моль*0,6 моль = 13,44 л
Ответ V(Н2) = 13,44 л
Рефлексивно-оценочный этап.
На этом этапе учащиеся совместно с учителем обсуждают предметно-содержательные учебные результаты, степень достижения цели урока, а также способы достижения полученных результатов.
Я рада, что на протяжении всего занятия вы были внимательны, добросовестно отнеслись к выполнению самостоятельного задания. Я хочу, чтобы все, кто работал хорощо – улыбнулись мне, а кто чувствует в себе потенциал работать лучше – поаплодировали себе.
IV Домашнее задание:
1.При восстановлении углем оксидов Fe2O3 и SnO2 получили по 20 г Fe и Sn. Сколько граммов каждого оксида было взято?
2.В каком случае образуется больше воды:
а) при восстановлении водородом 10 г оксида меди (I) (Cu2O) или
б) при восстановлении водородом 10 г оксида меди(II) (CuO)?
Спасибо за работу. На следующем уроке мы дополним и углубим знания по теме: « Решение задач по химическим уравнениям».
Анализ урока химии в 8 классе
Учитель А.М. Мацанова
Тема урока « Решение задач по химическим уравнениям»
Данный урок относится к урокам изучения нового материала. Организация начала урока способствовала позитивному настроению учащихся, поставлена цель урока.
Вначале организована актуализация изученного ранее материала, необходимого для формирования учебной проблемы в виде повторения и обобщения, а также фронтального опроса и работы учащихся у доски.
На следующем этапе урока учащимся был предложен алгоритм для расчета задач по химическим уравнениям. ( у каждого учащегося на столе) Учащиеся согласно алгоритму выполняют решение задач коллективно, с комментариями. Показательно требование учителя давать развернутые ответы на вопросы. Основной этап прошел динамично, живо, ответы учащихся были содержательными, выводы емкими и плавно переходящими от одного вывода к следующему. Шла последовательная работа строго по алгоритму.
Далее предложена самостоятельная работа (решение задач по вариантам), после выполнения которой учащиеся обмениваются заданиями и проводят взаимопроверку, а правильное выполнение заданий учащиеся видят на экране. Учащимся было интересно оценить свои возможности, а учителю было важно выявить уровень знаний учащихся по теме урока.
На уроке решались задачи формирования умения анализировать условие, умение работать по предложенному алгоритму, определения практической значимости данного типа задач. Кроме того, учащиеся учились выстраивать логическую цепочку рассуждений, аргументировать свое мнение, делать выводы, обобщения.
Формы и приемы работы соответствовали выработанным методам, соответствующим изучаемому материалу и способствовали организации деятельности учеников. Задачи и цели урока достигнуты, применение ИКТ уместно, логично, продуктивно.
Урок соответствует базовым требованиям ФГОС.
Сценарий урока рекомендовано тиражировать.
Заместитель директора по учебно – воспитательной работе И.А.Метелев.
Мацанова Анна Мариковна в 1980-м году окончила биолого – химический факультет Хабаровского педагогического института. Педагогический стаж 38 лет ( из них 29 лет в МОУ СОШ №7) В настоящее время работаю в
Принимала участие в работе областной экспертной комиссии по проверке части «С» ЕГЭ, а также в работе экспертной комиссии по организации и проведению Всероссийской предметной олимпиады по химии.
Имею несколько печатных работ : « Использование материалов краеведения на уроках химии и биологии», «Технология современных методов обучения и контроля по химии (тестирование), «Методика решения расчетных задач по химии» (из опыта работы). Имею сертификаты о публикации конспектов уроков на сайте Конспекты – уроков РФ
В 2006 году присвоено звание « Почетный работник общего образования»
Анализ урока химии в 11 классе
Учитель Мацанова А.М.
Тема урока: «Обобщение знаний по теме « Периодический закон и периодическая система химических элементов с точки зрения строения атома» 11 класс
Данный урок относится к урокам повторения, систематизации и обобщения знаний, закрепления умений.
В начале урока учащиеся принимают активное участие в постановке цели урока и прогнозируют его результат. На каждом этапе урока прослеживается активная, творческая работа учащихся, время отведенное на каждый этап скорректировано верно. На уроке используются разнообразные формы, методы и приемы обучения, повышающие степень активности учащихся в учебном процессе. Учитель эффективно сочетает репродуктивную и проблемную формы обучения, учит работать творчески.
На протяжении всего урока идет актуализация изученного ранее материала в виде повторения, обобщения,индивидуальной, фронтальной работы с классом, выполнения самостоятельной работы. Содержание урока соответствует требованиям программы, прослеживается связь теории с практикой, использование жизненного опыта учеников с целью развития у них познавательной активности, межпредметные связи (физика, биология). На каждом этапе подводится итог, учащиеся самостоятельно делают выводы. На последнем этапе урока учащиеся совместно с учителем обсуждают предметно –содержательные учебные результаты, степень достижения цели урока, а также способы достижения полученных результатов.
Задачи и цели урока достигнуты. Все оценки, поставленные учащимся,учитель комментирует.
Урок соответствует базовым требованиям ФГОС.
Сценарий урока рекомендовано тиражировать.
Заместитель директора по учебно – воспитательной работе И.А. Метелев
infourok.ru
Урок 14. Расчеты по уравнениям химических реакций – HIMI4KA
В уроке 14 «Расчеты по уравнениям химических реакций» из курса «Химия для чайников» мы научимся решать задачи, используя уравнения химических реакций.


Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
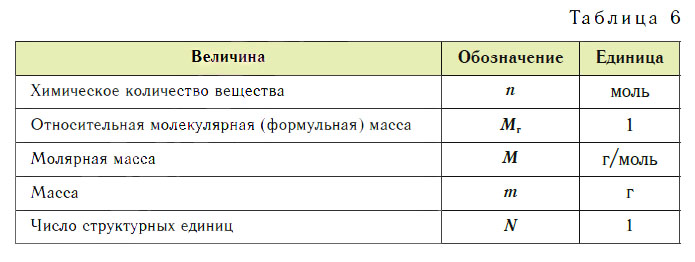
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице 6.

При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое в нимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.


Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на нескольких примерах.
Пример 1. Железо массой 224 г полностью прореагировало с хлором. Рассчитайте массу образовавшегося вещества FeCl3.
Спойлер


[свернуть]
Спойлер


[свернуть]
Пример 2. Определите массу алюминия, прореагировавшего с кислородом, если в результате реакции образовалось вещество Al2O3 химическим количеством 3,5 моль.
Спойлер


[свернуть]
Спойлер


[свернуть]
Пример 3. Рассчитайте объем (н. у.) кислорода, необходимого для полного сгорания фосфора массой 93 г.
Спойлер


[свернуть]
Надеюсь урок 14 «Расчеты по уравнениям химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Химические реакции».
himi4ka.ru
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ | ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
количественный метод | |
1.Прочитайте текст задачи. | 1.Сколько граммов оксида кальция можно получить из 400г известняка, содержащего 20% примесей? |
2.Запишите условие и требование задачи с помощью общепринятых обозначений. | 2.Дано: m(CаСO3) = 400 г ω прим.= 20% (0,2)
m(CаO)=? |
3.Составьте уравнение химической реакции. | 3.Решение: CаСO3 = CаО + СO2 |
4.Массу чистого вещества (как и объём) можно вычислить двумя способами 1 способ: ω (чист.вещ-ва)= 100% — ω прим. ω (чист.вещ-ва) = m (чист.вещества) / m (смеси) Отсюда: m (чист.вещ-ва) = m (смеси) · ω (чист.вещ-ва) 2 способ: m (примеси) = m (смеси) · ω (примеси) m (чист.вещества) = m (смеси) — m (примеси) | 4.Решение: 1 способ: ω (чист.вещества) CаСO3= 100% — 20% = 80% или 0,8 m (чист.вещества) CаСO3= 400г · 0,8 = 320 г 2 способ: m (примеси) = 400 г · 0,2 = 80 г m (чист.вещества) CаСO3= 400 г – 80 г = 320 г Выбирай понятный для тебя способ решения! |
5.В уравнении одной чертой подчеркните формулы веществ, о которых идёт речь в задаче. | 5.CаСO3 = CаО + СO2 |
6.Вычислите молярные массы этих веществ. | 6. М(CаСO3) = 40 + 12 + 16·3 = 100 г/моль М(СaO) = 40 + 16 = 56 г/моль |
7.Массу чистого вещества, полученную в пункте 4, переведите в количество вещества по формуле ν= m/М | 7.ν(CаСO3)= 320 г/100 г/моль = 3,2 моль
|
8.Над подчёркнутой формулой известного вещества укажите величину, полученную в пункте 7, — показывает количество взятого реагента по условию задачи, над формулой вещества, массу которого надо найти, поставим Х моль. | 8. 3,2 моль Х моль CаСO3 = CаО + СO2
|
9. Под подчёркнутыми формулами исходного и образующегося веществ укажите количество вещества (число молей) согласно уравнению реакции (это будут коэффициенты, стоящие перед формулами веществ в уравнении реакции) — показывают необходимые количества исходного и образующегося веществ. |
9. 3,2 моль Х моль CаСO3 = CаО+ СO2 1моль 1моль |
10.Составить и решить пропорцию. | 10. 3,2 моль Х моль Х = 3,2 моль · 1 моль = 3,2 моль 1 моль 1 моль 1 моль ν (CаО) = 3,2 моль. |
11.Вычислите массу продукта реакции m(вещества)= ν( вещества) · М(вещества) | 11. m(СаО) =3,2 моль · 56 г/моль = 179,2 г
|
12.Запишите ответ. | 12.Ответ: m(CаО) = 179,2 г. |
метод пропорций | |
1. Повторить действия пунктов 1 – 6 количественного метода | |
2. По формуле m= М · ν (где ν – коэффициент перед соответствующей формулой вещества в уравнении реакции) найдите массу вещества | m= М · ν m(CаСO3) = 100 г/моль · 1 моль = 100 г m(СaO) = 56 г/моль · 1 моль = 56 г |
3. Над подчёркнутой формулой известного вещества укажите массу, полученную в пункте 4 количественного метода, над формулой вещества, массу которого надо найти, поставим Х г | 3. 320 г Х г CаСO3 = CаО+ СO2
|
4. Под соответствующей формулой записать массу, полученную в пункте 3 | 4. 320 г Х г CаСO3 = CаО+ СO2 100 г 56 г |
5. Составить и решить пропорцию | 5. 320 г = Х г Х = 320 г · 56 г = 179,2 г 100 г 56 г 100 г |
6.Запишите ответ. | 6.Ответ: m(CаО) = 179,2 г. |
nsportal.ru
8 класс« Решение расчётных задач по химическим уравнениям реакций»










 8 класс« Решение расчётных задач по химическим уравнениям реакций» 2 часа.
8 класс« Решение расчётных задач по химическим уравнениям реакций» 2 часа.
Цели: Образовательные: сформировать умения вести расчеты по уравнению химической реакции на нахождение количества вещества, массы продукта реакции по количеству, массе исходного вещества;
Развивающие: продолжить формирование общеучебных умений и навыков, способов само- и взаимоконтроля;
Воспитывающая : способствовать воспитанию таких качеств как точность в работе, самостоятельность, наблюдательность, дисциплинированность.
Формы работы: фронтальная, индивидуальная, парная
Тип урока: комбинированный .
Ход урока
1,Организационный момент. Проверка готовности к уроку.
Учитель: я хочу обратиться к вам: не сдерживайте свои мысли, боясь сказать что-то не то, не правильно. Не ошибается тот, кто ничего не делает .Мир, в котором мы живем, удивителен, прекрасен, разнообразен. Познавая его, мы познаем себя.
Работа по составлению уравнений и классификации химических реакций.
Задание. Составить уравнения химических реакций, определить их тип.
магний + кислород → ?
( 2Mg + O2 → 2 MgO реакция соединения )
азот + водород → ? ( N 2 + 3 H 2 → NH3 реакция соединения
серная кислота +гидроксид калия → соль + вода
( H2SO4 + 2KOH → K2SO4 + 2H2O реакция обмена
оксид железа (III) + водород → железо + ?
( Fe2O3 + 3H2 → 2Fe + 3H2O реакция замещения )
2 Проверка домашнего задания. Прочитайте остальные уравнения химических реакций. Определите тип реакций. Дайте определение всех типов реакций.
3. Изучение нового материала. Решение расчетных задач. Дома, когда мама или вы готовите еду, то планируете, сколько надо взять макарон или картофеля, чтобы накормить всю семью. В химии проводят расчеты, сколько веществ нужно взять для реакции, сколько получится веществ.
Для решения задач по уравнениям химических реакций используется величина количество вещества.
Для того чтобы произвести расчёты по уравнению необходимо составить пропорцию, используя коэффициенты в уравнении реакции, зная, что они показывают величину количество вещества.
Как связаны между собой количество вещества и масса?
Чтобы найти количество вещества необходимо известную массу вещества разделить на его молярную массу Показывают карточки
Чтобы найти массу вещества необходимо количество вещества умножить на его молярную массу.
Молярная масса численно равна относительной молекулярной массе, которая рассчитывается по формуле вещества и значению относительных атомных масс из периодической системы.
Как связанно количество вещества и число частиц?
Чтобы найти количество вещества необходимо поделить число частиц на число Авогадро.
Чтобы найти число частиц необходимо умножить количество вещества на постоянную Авогадро.
Постоянная Авогадро величина приблизительно равна 6,0∙1023 частиц/моль.
4.Работа с учебником стр 41.-43 Разбор задач из учебника 1-2 стр 44
Выполнение самостоятельной работы.стр 40 методички.
5. Взаимопрверка.
6. Решение задач по уравнениям реакций. Вопрос. Как вы думаете каков алгоритм решения таких задач? Ответы.
Алгоритм решения задач по уравнению химической реакции
Запомни: Все задачи решаются на основе закона сохранения массы веществ: масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате реакции.
Схема решения задач:
Расчеты по уравне-нию химической реакции
Запись уравнения химической реакции
Условие Ответ
задачи
Порядок решения задач:
Краткая запись условия задачи.
Запись уравнения химической реакции.
Запись известных и неизвестных величин над формулами веществ.
Запись под формулами веществ количества, молярные массы и массы(или молярные объемы и объемы) веществ.
Составление и решение пропорции.
Запись ответа задачи.
Образец решения задачи:
Задача: Сколько граммов оксида меди (II) образовалось при прокаливании 6,4 г меди.
Дано: Решение
m(Cu) = 6,4 кг 6,4 г Х г
Найти:m(CuO) 2Cu + O2 = 2CuO
ν = 2 моль ν = 2 моль по уравнению реакции
М = 64г/моль М = 80 г/моль
m = 128г m = 160 г
Составляем пропорцию: 6,4 г : 128 г = Х г : 160 кг
Х = 6,4 * 160 / 128 Х = 8 г
Ответ: 8 г CuО
Разбор задачи №3 стр 45
Помните: 1. вещества взаимодействуют в массах, пропорциональных их количествам, т.е. массы веществ, участвующих
в реакции, относятся друг к другу так же, как и их количества;
2. вещества вступают во взаимодействие в количествах, равных их стехиометрическим коэффициентам;
3. задача состоит из 3-ёх частей:
I — химическая – краткая запись данных, составление уравнения реакции;
II — аналитическая – анализ данных в условии и уравнения реакции;
III — математическая – расчеты по уравнению реакции
Образец реш7 .Подведение итогов.
Назовите основные формулы для решения задач данного типа
Какие вы знаете типы реакций по числу вступивших и образующихся в-в.
Вспомним алгоритм решения задач.
С каким предметом связана тема нашего урока.
8 Рефлексия .Что было трудным при изучении нового материала, чему научились.
Зачем нужны такие задачи.
9 Домашнее задание: §17. Выучить формулы и алгоритм решения задач. Выполнить упр 2 стр 48
10 .Оценки за урок .
infourok.ru
Алгоритм решения задач по уравнению химической реакции
Алгоритм решения задач по уравнению химической реакции
17.11.2010 Автор: Т U
Задача: Найдите массу и количество алюминия, которые нужно взять для получения 45 г AL2S3 при взаимодействии с серой
Прежде чем приступить к решению ЛЮБОЙ задачи, нужно проанализировать условие. После этого:
- Записываем «Дано»
| Дано:m (AL2S3)= 45г _____________ Найти: m (Al)-? ν (Al)-? | Решение |
- Записываем уравнение реакции и расставляем коэффициенты:
| Дано:m (AL2S3)= 45г _____________ Найти: m (Al)-? ν (Al)-? | Решение
2Al + 3S = Al2S3 |
- Надписываем над формулами в уравнении известные данные:
| Дано:m (AL2S3)= 45г _____________ Найти: m (Al)-? ν (Al)-? | Решение
xг, y моль 45г 2Al + 3S = Al2S3 |
- Под формулами подписываем данные из уравнения реакции.
(На сегодняшний день мы знаем, что коэффициент показывает нам количество вещества (ν) ) Следовательно:
| Дано:m (AL2S3)= 45г _____________ Найти: m (Al)-? ν (Al)-? | Решение xг, y моль 45г 2Al + 3S = Al2S32моль…………………….. 1 моль |
- По уравнению реакции находим массу 2 моль алюминия и 1 моль Al2S3 и подписываем под формулами веществ в уравнении
| Дано:m (AL2S3)= 45г _____________ Найти: m (Al)-? ν (Al)-? | …………………………………………………….Решение xг, y моль 45г 2Al + 3S = Al2S32моль………………………………….. 1 моль 54г ………. 118г
m=Mv M(Al)= 27(г/моль) m(Al)=27г/моль х 2моль=54г M(Al2S3)= 27х2+32х3 = 54+64=118 г/моль m(Al2S3)=118 г/моль х 1 моль = 118 г |
- Составляем пропорцию:
| Дано:m (AL2S3)= 45г _____________ Найти: m (Al)-? ν (Al)-? | ……………………………………………Решение xг, y моль 45г 2Al + 3S = Al2S32моль………………………….. 1 моль 54г …… 118г
m=Mv M(Al)= 27(г/моль) m(Al)=27г/моль х 2моль=54г M(Al2S3)= 27х2+32х3 = 54+64=118 г/моль m(Al2S3)=118 г/моль х 1 моль = 118 г
54г – 118г Хг – 45г Х=54х45/118 Х= 20,6 г |
Т.о. мы видим, что для получения 45 г Al2S3 нам понадобится 20,6 г Al.
7. Теперь находим какому количеству вещества соответствует найденная масса
| Дано:m (AL2S3)= 45 г_____________ Найти: m (Al)-? ν (Al)-? | Решение xг, y моль 45г 2Al + 3S = Al2S32моль…………………………. 1 моль 54г …………….. 118г
m=Mv M(Al)= 27(г/моль) m(Al)=27г/моль х 2моль=54г M(Al2S3)= 27х2+32х3 = 54+64=118 г/моль m(Al2S3)=118 г/моль х 1 моль = 118 г
54г – 118г Хг – 45г Х=54х45/118 Х= 20,6 г
ν(Al)= 20,6/27=0,8 моль Ответ. m(Al)=20,6 г, ν(Al)=0,8 моль |
Понравилось это:
Нравится Загрузка…
Похожее
Опубликовано в 8 класс |
4schoolchild.wordpress.com