Азотная кислота — Википедия
| Азотная кислота | |||
|---|---|---|---|
| |||
 ( ({{{изображение}}}) | |||
| Систематическое наименование | азотная кислота | ||
| Хим. формула | HNO3 | ||
| Состояние | жидкость | ||
| Молярная масса | 63,012 г/моль | ||
| Плотность | 1,513 г/см³ | ||
| Энергия ионизации | 11,95 ± 0,01 эВ[2] | ||
| Температура | |||
| • плавления | −41,59 °C | ||
| • кипения | 82,6 °C | ||
| Мол. теплоёмк. | 109,9 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −174,1 кДж/моль | ||
| • плавления | 10,47 кДж/моль | ||
| • кипения | 39,1 кДж/моль | ||
| • растворения | −33,68 кДж/моль | ||
| Давление пара | 56 гПА | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | −1,64 [1] | ||
| Растворимость | |||
| • в воде | смешивается | ||
| Показатель преломления | 1,397 | ||
| Дипольный момент | 2,17 ± 0,02 Д | ||
| Рег. номер CAS | 7697-37-2 | ||
| PubChem | 944 | ||
| Рег. номер EINECS | 231-714-2 | ||
| SMILES | |||
| InChI | |||
| RTECS | QU5775000 | ||
| ChEBI | 48107 | ||
| Номер ООН | 2031 | ||
| ChemSpider | 919 | ||
| ЛД50 | 430 мг/кг | ||
| Пиктограммы СГС |    | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
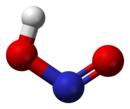
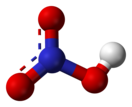
Азо́тная кислота́ (HNO3) — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентрацией 68,4 % и tкип 120 °C при нормальном атмосферном давлении. Известны два твёрдых гидрата: моногидрат (HNO3·H2O) и тригидрат (HNO3·3H2O). Кислота ядовита.
Физические и физико-химические свойства[править | править код]
Плотность раствора азотной кислоты в зависимости от концентрации Фазовая диаграмма водного раствора азотной кислоты
Фазовая диаграмма водного раствора азотной кислотыАзот в азотной кислоте четырёхвалентен[3], степень окисления +5. Азотная кислота — бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C (при нормальном атмосферном давлении) с частичным разложением. Азотная кислота смешивается с водой во всех соотношениях. Водные растворы HNO3 с массовой долей 0,95—0,98 называют «дымящей азотной кислотой», с массовой долей 0,6—0,7 — концентрированной азотной кислотой.
С водой образует азеотропную смесь (массовая доля 68,4 %, d20 = 1,41 г/см3, Tкип = 120,7 °C)
При кристаллизации из водных растворов азотная кислота образует кристаллогидраты:
- моногидрат HNO3·H2O, Tпл = −37,62 °C;
- тригидрат HNO3·3H2O, Tпл = −18,47 °C.
Твёрдая азотная кислота образует две кристаллические модификации:
Моногидрат образует кристаллы ромбической сингонии, пространственная группа P na2, параметры ячейки a = 0,631 нм, b = 0,869 нм, c = 0,544 нм, Z = 4.
Плотность водных растворов азотной кислоты как функция её концентрации описывается уравнением
- d(c)=0,9952+0,564c+0,3005c2−0,359c3,{\displaystyle d(c)=0{,}9952+0{,}564c+0{,}3005c^{2}-0{,}359c^{3},}
где d — плотность в г/см³, c — массовая доля кислоты. Данная формула плохо описывает поведение плотности при концентрации более 97 %.
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
- 4HNO3⟶4NO2↑+2h3O+O2↑{\displaystyle {\mathsf {4HNO_{3}\longrightarrow 4NO_{2}\!\uparrow +2H_{2}O+O_{2}\!\uparrow }}}
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять без разложения только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
- CuO+2HNO3⟶Cu(NO3)2+h3O{\displaystyle {\mathsf {CuO+2HNO_{3}\longrightarrow Cu(NO_{3})_{2}+H_{2}O}}}
- ZnO+2HNO3⟶Zn(NO3)2+h3O{\displaystyle {\mathsf {ZnO+2HNO_{3}\longrightarrow Zn(NO_{3})_{2}+H_{2}O}}}
б) с основаниями:
- KOH+HNO3⟶KNO3+h3O{\displaystyle {\mathsf {KOH+HNO_{3}\longrightarrow KNO_{3}+H_{2}O}}}
в) вытесняет слабые кислоты из их солей:
- CaCO3+2HNO3⟶Ca(NO3)2+h3O+CO2↑{\displaystyle {\mathsf {CaCO_{3}+2HNO_{3}\longrightarrow Ca(NO_{3})_{2}+H_{2}O+CO_{2}\!\uparrow }}}
При кипении или под действием света азотная кислота частично разлагается:
- 4HNO3⟶4NO2↑+O2↑+2h3O{\displaystyle {\mathsf {4HNO_{3}\longrightarrow 4NO_{2}\!\uparrow +O_{2}\!\uparrow +2H_{2}O}}}
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +5 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3
- Cu+4HNO3(60%)⟶Cu(NO3)2+2NO2↑+2h3O{\displaystyle {\mathsf {Cu+4HNO_{3}(60\%)\longrightarrow Cu(NO_{3})_{2}+2NO_{2}\!\uparrow +2H_{2}O}}}
Разбавленная HNO3
- 3Cu+8HNO3(30%)⟶3Cu(NO3)2+2NO↑+4h3O{\displaystyle {\mathsf {3Cu+8HNO_{3}(30\%)\longrightarrow 3Cu(NO_{3})_{2}+2NO\!\uparrow +4H_{2}O}}}
б) с металлами, стоящими в ряду напряжений левее водорода:
- Zn+4HNO3(60%)⟶Zn(NO3)2+2NO2↑+2h3O{\displaystyle {\mathsf {Zn+4HNO_{3}(60\%)\longrightarrow Zn(NO_{3})_{2}+2NO_{2}\!\uparrow +2H_{2}O}}}
- 3Zn+8HNO3(30%)⟶3Zn(NO3)2+2NO↑+4h3O{\displaystyle {\mathsf {3Zn+8HNO_{3}(30\%)\longrightarrow 3Zn(NO_{3})_{2}+2NO\!\uparrow +4H_{2}O}}}
- 4Zn+10HNO3(20%)⟶4Zn(NO3)2+N2O↑+5h3O{\displaystyle {\mathsf {4Zn+10HNO_{3}(20\%)\longrightarrow 4Zn(NO_{3})_{2}+N_{2}O\!\uparrow +5H_{2}O}}}
- 5Zn+12HNO3(10%)⟶5Zn(NO3)2+N2↑+6h3O{\displaystyle {\mathsf {5Zn+12HNO_{3}(10\%)\longrightarrow 5Zn(NO_{3})_{2}+N_{2}\!\uparrow +6H_{2}O}}}
- 4Zn+10HNO3(3%)⟶4Zn(NO3)2+Nh5NO3+3h3O{\displaystyle {\mathsf {4Zn+10HNO_{3}(3\%)\longrightarrow 4Zn(NO_{3})_{2}+NH_{4}NO_{3}+3H_{2}O}}}
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
- увеличение концентрации кислоты ⇐NO2,NO,N2O,N2,Nh5NO3⇒{\displaystyle {\mathsf {\Leftarrow NO_{2},NO,N_{2}O,N_{2},NH_{4}NO_{3}\Rightarrow }}} увеличение активности металла
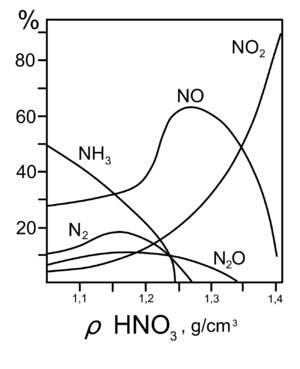 Продукты, полученные при взаимодействии железа с HNO3, разной концентрации
Продукты, полученные при взаимодействии железа с HNO3, разной концентрацииС золотом и платиной азотная кислота, даже концентрированная, не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
- Fe+4HNO3(25%)⟶Fe(NO3)3+NO↑+2h3O{\displaystyle {\mathsf {Fe+4HNO_{3}(25\%)\longrightarrow Fe(NO_{3})_{3}+NO\!\uparrow +2H_{2}O}}}
- 4Fe+10HNO3(2%)⟶4Fe(NO3)2+Nh5NO3+3h3O{\displaystyle {\mathsf {4Fe+10HNO_{3}(2\%)\longrightarrow 4Fe(NO_{3})_{2}+NH_{4}NO_{3}+3H_{2}O}}}
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
- S+6HNO3(60%)⟶h3SO4+6NO2↑+2h3O{\displaystyle {\mathsf {S+6HNO_{3}(60\%)\longrightarrow H_{2}SO_{4}+6NO_{2}\!\uparrow +2H_{2}O}}}
- S+2HNO3(40%)⟶h3SO4+2NO↑{\displaystyle {\mathsf {S+2HNO_{3}(40\%)\longrightarrow H_{2}SO_{4}+2NO\!\uparrow }}}
- P+5HNO3(60%)⟶h4PO4+5NO2↑+h3O{\displaystyle {\mathsf {P+5HNO_{3}(60\%)\longrightarrow H_{3}PO_{4}+5NO_{2}\!\uparrow +H_{2}O}}}
- 3P+5HNO3(30%)+2h3O⟶3h4PO4+5NO↑{\displaystyle {\mathsf {3P+5HNO_{3}(30\%)+2H_{2}O\longrightarrow 3H_{3}PO_{4}+5NO\!\uparrow }}}
и сложные вещества, например:
- FeS+4HNO3(30%)⟶Fe(NO3)3+S+NO↑+2h3O{\displaystyle {\mathsf {FeS+4HNO_{3}(30\%)\longrightarrow Fe(NO_{3})_{3}+S+NO\!\uparrow +2H_{2}O}}}
Некоторые органические соединения (например амины, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Некоторые металлы (железо, хром, алюминий, кобальт, никель, марганец, бериллий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Смесь азотной и серной кислот носит название «меланж».
Азотная кислота широко используется для получения нитросоединений.
Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:
- 3HCl+HNO3 →150oC NOCl+Cl2↑+2h3O{\displaystyle {\mathsf {3HCl+HNO_{3}\ {\xrightarrow {150^{o}C}}\ NOCl+Cl_{2}\!\uparrow +2H_{2}O}}}
Взаимодействие концентрированных азотной и соляной кислот с благородными металлами:
- Au+HNO3+4HCl⟶H[AuCl4]+NO↑+2h3O{\displaystyle {\mathsf {Au+HNO_{3}+4HCl\longrightarrow H[AuCl_{4}]+NO\!\uparrow +2H_{2}O}}}
- 3Pt+4HNO3+18HCl⟶3h3[PtCl6]+4NO↑+8h3O{\displaystyle {\mathsf {3Pt+4HNO_{3}+18HCl\longrightarrow 3H_{2}[PtCl_{6}]+4NO\!\uparrow +8H_{2}O}}}
Нитраты[править | править код]
Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы и некоторые соединения неметаллов, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется.
Соли азотной кислоты при нагревании необратимо разлагаются, причём состав продуктов разложения определяется катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния (исключая литий):
- 2KNO3 →450oC 2KNO2+O2↑{\displaystyle {\mathsf {2KNO_{3}\ {\xrightarrow {450^{o}C}}\ 2KNO_{2}+O_{2}\!\uparrow }}}
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью (а также литий):
- 4Al(NO3)3 →180oC 2Al2O3+12NO2↑+ 3O2↑{\displaystyle {\mathsf {4Al(NO_{3})_{3}\ {\xrightarrow {180^{o}C}}\ 2Al_{2}O_{3}+12NO_{2}\!\uparrow +\ 3O_{2}\!\uparrow }}}
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
- 2AgNO3 →400oC 2Ag+2NO2↑+ O2↑{\displaystyle {\mathsf {2AgNO_{3}\ {\xrightarrow {400^{o}C}}\ 2Ag+2NO_{2}\!\uparrow +\ O_{2}\!\uparrow }}}
г) нитрат аммония:
- Nh5NO3 →240oC N2O↑+ 2h3O{\displaystyle {\mathsf {NH_{4}NO_{3}\ {\xrightarrow {240^{o}C}}\ N_{2}O\!\uparrow +\ 2H_{2}O}}}
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии являются сильными окислителями, например, при сплавлении твердых веществ:
- Fe+3KNO3+2KOH →420oC K2FeO4+3KNO2+h3O{\displaystyle {\mathsf {Fe+3KNO_{3}+2KOH\ {\xrightarrow {420^{o}C}}\ K_{2}FeO_{4}+3KNO_{2}+H_{2}O}}}
Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
- 3KNO3+8Al+5KOH+18h3O→3Nh4↑+8K[Al(OH)4]{\displaystyle {\mathsf {3KNO_{3}+8Al+5KOH+18H_{2}O\rightarrow 3NH_{3}\!\uparrow +8K[Al(OH)_{4}]}}}
Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно.
С азотной кислотой не реагируют стекло, фторопласт-4.
Методика получения разбавленной азотной кислоты путём сухой перегонки селитры с квасцами и медным купоросом была, по-видимому, впервые описана в трактатах Джабира (Гебера в латинизированных переводах) в VIII веке. Этот метод с теми или иными модификациями, наиболее существенной из которых была замена медного купороса железным, применялся в европейской и арабской алхимии вплоть до XVII века.
В XVII веке Глаубер предложил метод получения летучих кислот реакцией их солей с концентрированной серной кислотой, в том числе и азотной кислоты из калийной селитры, что позволило ввести в химическую практику концентрированную азотную кислоту и изучить её свойства. Метод
Тест на тему «Азотная кислота» Помогите, пожалуйста
1-Химическая формула: HNO₃ 2-Степень окисления азота в азотной кислоте равна (+5) 3-Азотная кислота относится к с одноосновным кислотам и является сильным реактивом 4-При взаимодействии с металлами никогда не выделяется водород. в реакциях с металлами кислота восстанавливается до различных соединений с более низкой степенью окисления 5-С концентрированной азотной кислотой не взаимодействуют благородные металлы (Au, Ru, Os, Rh, Ir, Pt), а ряд металлов (Al, Ti, Cr, Fe, Co, Ni) при низкой температуре пассивируются концентрированной азотной кислотой. <a rel=»nofollow» href=»https://nsportal.ru/shkola/khimiya/library/2013/10/01/vzaimodeystvie-metallov-s-kislotami» target=»_blank»>https://nsportal.ru/shkola/khimiya/library/2013/10/01/vzaimodeystvie-metallov-s-kislotami</a> 6-С основаниями, амфотерными гидроксидами <a rel=»nofollow» href=»http://himege.ru/azotnaya-kislota-stroenie-i-ximicheskie-svojstva/» target=»_blank»>http://himege.ru/azotnaya-kislota-stroenie-i-ximicheskie-svojstva/</a> 7- При хранении на свету она разлагается и может окрашиваться в жёлтый цвет за счёт образования бурого оксида азота (IV): 4HNO3=2h3O+4NO2↑+O2↑. 8- не реагирует с Au, Ir, Pt, Rh, Та, W, Zr. 9-Современный лабораторный метод предполагает получение кислоты из нитратов. Для получения азотной кислоты в промышленности используется метод окисления аммиака. 10-Соли азотной кислоты носят общее название азотнокислых солей, или нитратов.
1-Б (больше я не знаю, пока что)
Азотистая кислота — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 декабря 2019; проверки требуют 2 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 декабря 2019; проверки требуют 2 правки.| Азотистая кислота | |||
|---|---|---|---|
| |||
({{{изображение}}}) | |||
| Систематическое наименование | Азотистая кислота | ||
| Хим. формула | HNO2 | ||
| Состояние | в водном растворе — жидкое; в чистом виде — газ | ||
| Молярная масса | 47,0134 г/моль | ||
| Плотность | 1,685 (жидк) | ||
| Температура | |||
| • плавления | 42,35 °C | ||
| • кипения | 158 °C | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 3,4 | ||
| Растворимость | |||
| • в воде | 548 г/100 мл | ||
| Рег. номер CAS | [7782-77-6] | ||
| PubChem | 24529 | ||
| Рег. номер EINECS | 231-963-7 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 25567 | ||
| ChemSpider | 22936 | ||
| Токсичность | высокотоксична, сильнейший неорганический яд, мутагенна | ||
| Пиктограммы ECB |  | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
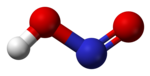
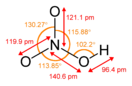
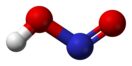
Азо́тистая кислота HNO2 — слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Кислота
В газовой фазе планарная молекула азотистой кислоты существует в виде двух конфигураций: цис- и транс-.


цис-изомер транс-изомер
При комнатной температуре преобладает транс-изомер: эта структура является более устойчивой. Так, для цис-HNO2(г) ΔG° f = −42,59 кДж/моль, а для транс-HNO2(г) ΔG°f = −44,65 кДж/моль.
В водных растворах существует равновесие:
- 2HNO2⟷N2O3+h3O⟷NO↑+NO2↑+h3O{\displaystyle {\ce {2 HNO2 <-> N2O3 + h3O <-> NO ^ + NO2 ^ + h3O}}}
При нагревании раствора азотистая кислота распадается с выделением NO и образованием азотной кислоты:
- 3HNO2⟷HNO3+2NO↑+h3O{\displaystyle {\ce {3 HNO2 <-> HNO3 + 2 NO ^ + h3O}}}
HNO2 является слабой кислотой. В водных растворах диссоциирует (KD = 4,6⋅10−4), немного сильнее уксусной кислоты. Легко вытесняется более сильными кислотами из солей:
- h3SO4+2NaNO2⟶Na2SO4+2HNO2{\displaystyle {\ce {h3SO4 + 2 NaNO2 -> Na2SO4 + 2 HNO2}}}
Азотистая кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (пероксид водорода, хлор, перманганат калия) окисляется в азотную кислоту:
- HNO2+h3O2⟶HNO3+h3O{\displaystyle {\ce {HNO2 + h3O2 -> HNO3 + h3O}}}
- HNO2+Cl2+h3O⟶HNO3+2HCl{\displaystyle {\ce {HNO2 + Cl2 + h3O -> HNO3 + 2 HCl}}}
- 7HNO2+2KMnO4⟶2Mn(NO3)2+2KNO3+3h3O+HNO3{\displaystyle {\ce {7 HNO2 + 2 KMnO4 -> 2 Mn(NO3)2 + 2 KNO3 + 3 h3O + HNO3}}}
В то же время она способна окислять вещества, обладающие восстановительными свойствами:
- 2HNO2+2HI⟶2NO↑+I2+2h3O{\displaystyle {\ce {2 HNO2 + 2 HI -> 2 NO ^ + I2 + 2 h3O}}}
Азотистую кислоту можно получить при растворении оксида азота (III) N2O3 в воде:
- N2O3+h3O⟶2HNO2{\displaystyle {\ce {N2O3 + h3O -> 2 HNO2}}}
Также она получается при растворении в воде оксида азота (IV) NO2:
- 2NO2+h3O⟶HNO3+HNO2{\displaystyle {\ce {2 NO2 + h3O -> HNO3 + HNO2}}}
Азотистая кислота применяется для диазотирования первичных ароматических аминов и образования солей диазония. Нитриты применяются в органическом синтезе при производстве органических красителей.
Азотистая кислота (HNO2) высокотоксична в больших дозах (как и другие производные азота со степенью окисления +3), причём обладает ярко выраженным мутагенным действием, поскольку является дезаминирующим агентом.
Урок-обобщение «Взаимодействие азотной кислоты с органическими веществами»
Цели урока. Обобщение, закрепление и углубление знаний по особенностям взаимодействия азотной кислоты с органическими веществами, повторение типов и механизмов данных реакций, отрабатывание навыков составления УХР по генетической связи органических веществ. Выработка у школьников систематизации теоретического материала с использованием дополнительной литературы и интернет-ресурсов.
План урока:
- Химическая разминка.
- Нитросоединения. Отношение азотной кислоты к углеводородам.
- Взаимодействие азотной кислоты с кислородсодержащими органическими соединениями.
- Взаимодействие азотной кислоты с азотсодержащими органическими соединениями.
- Закрепление.
- Выводы.
Учитель:
Проведем химическую экспресс– разминку по характеристике азотной кислоты среди неорганических веществ. (За правильный ответ по 1-му баллу в индивидуальном первенстве)
- Назовите степень окисления и валентность азота в HNO3. Какие механизмы образования химической связи имеет место между атомами азота и кислорода в азотной кислоте?
- К каким электролитам она относится и чем она является с точки зрения ОВР?
- Перечислить ее физические свойства.
- Почему концентрированную азотную кислоту хранят в темном шкафу?
- Перечислить ее характерные общие химические свойства.
- Из какой кислоты металлы не способны вытеснить водород из азотной кислоты?
- Какие продукты преимущественно образуются при взаимодействии концентрированной и разбавленной азотной кислоты с щелочными и щелочно-земельными, тяжелыми металлами соответственно?
- Какие металлы пассивируются от действия холодной концентрированной азотной и серной кислот?
- Как относится азотная кислота к благородным металлам и что такое “царская водка”?
- Какие продукты образуются при растворении в концентрированной азотной кислоте угля, фосфора, серы?
- Какие превращения возможны при взаимодействии азотной кислоты со сложными веществами, содержащими элементы с низшими и промежуточными значениями степеней окисления?
- Как получают азотную кислоту в лаборатории и промышленности? Назовите эти стадии.
- Какие удобрения получают из азотной кислоты?
Азотная кислота среди органических веществ.
Взаимодействие азотной кислоты с углеводородами.
Вопросы для повторения можно задавать как отдельным группам (химикам-теоретикам и химикам-практикам), так и индивидуально.
Учитель: Какие классы углеводородов вступает в реакцию с азотной кислотой? (Алканы, арены)
Учитель: Составьте уравнения реакций взаимодействия метана, этана (1группа) и пропана (2группа) с азотной кислотой, укажите названия продуктов реакции, тип и механизм протекания реакции. В честь какого ученого носят название эти реакции?
Ученик:
Азотная кислота при обыкновенной температуре почти не действует на парафиновые углеводороды; при нагревании же действует главным образом как окислитель. Однако, как нашел М. И. Коновалов (1889), при нагревании азотная кислота действует отчасти и “нитрующим” образом; особенно хорошо идет реакция нитрования со слабой азотной кислотой при нагревании и повышенном давлении. Реакция нитрования выражается уравнением:
,
т. е. один из атомов водорода заменяется на остаток NO2 (нитрогруппа) и выделяется вода.
Учитель:
Особенности строения изомеров сильно отражаются на течении этой реакции, так как легче всего она ведет к замещению на нитрогруппу атома водорода в остатке СИ (имеющемся лишь в некоторых изомерах), менее легко замещается водород в группе СН2 и еще труднее — в остатке СН3.
Парафины довольно легко нитруются в газовой фазе при 150—475°С двуокисью азота или парами азотной кислоты; при этом происходит частично и окисление. Нитрованием метана получается почти исключительно нитрометан:
Последующие гомологи дают смесь различных нитропарафинов вследствие попутно идущего расщепления. При нитровании этана получаются нитроэтан СН3—СН2—NO2 и нитрометан СН3—NO2. Из пропана образуется смесь нитропарафинов:
Из нормального бутана:
Учитель: Вопрос химикам-практикам: Какое значение имеют данные вещества в народном хозяйстве?
Ученик: Нитрометан – взрывчатая и огнеопасная жидкость, малорастворимая в воде. Распад нитрометана сопровождается резким увеличением объема и выделением большого количества тепла (схема реакции):
CH3NO2 –> CO2 + H2O + N2
Применяют нитрометан в качестве растворителя (например, жиров), в производстве нитроспиртов, в качестве высококипящего однокомпонентного ракетного топлива для жидкостных ракетных двигателей.
Учитель: Обращаем внимание на химическую активность аренов. Как и в первом случае, составляем уравнения реакций взаимодействия аренов с азотной кислотой, вспоминая, какие типы химических реакций характерны для аренов? (Реакции замещения, присоединения, окисления для его гомологов)
Учитель:
- Какие ориентанты 1- и 2-го рода вам известны?
- Составьте уравнения химических реакций взаимодействия азотной кислоты с бензолом (1 группа) и толуолом, назовите продукты реакций; укажите типы и механизмы ХР. Реакции идут с разрывом С-Н или С-С связей?
Ответ: ориентанты первого рода – заместители, повышающие электронную плотность в -электронной системе бензольного кольца: алкильные группы, галогены, -ОН -NH2. Это заместители, обладающие положительным мезомерным эффектом (их индуктивный эффект может быть отрицательным) – OH или Br, а также заместители с положительным индуктивным эффектом (алкильные группы). Эти заместители направляют второй заметитель в o- и n-положения.
Ориентиры второго рода – заместители, снижающие электронную плотность в -электронной системе бензольного кольца: -NO2, -SO3H, -COOH, -CN, -CHO. Это заместители, обладающие отрицательным мезомерным эффектом, или отрицательным индуктивным эффектом, которые притягивают электронную плотность бензольного кольца. Эти заместители ориентируют второй заместитель в м-положение бензольного кольца. Они обедняют электронной плотностью o– и n– положения цикла в большей степени, чем м-положение. В этом случает электронная плотность увеличивается в бензольном кольце в м-положении.
C6
Нитробензол – зеленовато – желтая жидкость с запахом миндаля, очень плохо растворимая в воде. Он очень токсичен – он окисляет гемоглобин в метоглобин:
Нитрование толуола:
C6H5-CH3 + 3HO-NO2 t, h3SO4–> |
СH3-C6H2(NO2)3
+ 3H2O |
Эти реакции относятся к реакциям электрофильного замещения.
Первичные амины получают восстановлением нитросоединений:
Учитель: Какая из данных реакций протекает интенсивнее и почему?
Ученик: Нитрование толуола осуществляется интенсивнее, чем бензола, т.к. в его молекуле имеется ориентант 1-го рода – метильный радикал – электронодонорный заместитель, направляющий другие заместители в орто- и пара-положения и нитрование толуола идет в три стадии (взаимное влияние атомов и групп атомов в органических соединениях)
Учитель: Какое практическое применение данных нитросоединений.
Нитробензол – зеленовато-желтая жидкость с запахом миндаля, очень плохо растворимая в воде. Он очень токсичен – он окисляет гемоглобин в метоглобин.
Нитросоединения – хорошие растворители.
2,4,6 –тринитротолуол (приложение 1), он же тротил, он же тол, он же TNT, он же тринитрометилбензол) – одно из наиболее распространённых бризантных взрывчатых веществ. Представляет собой желтоватое кристаллическое вещество с температурой плавления 80,35 °C. Применяется в промышленности и военном деле как самостоятельно в гранулированном (гранулотол), прессованном или литом виде, так и в составе многих взрывчатых смесей (алюмотол, аммонал, аммонит и другие).
Важнейший ароматический амин – анилин – образуется при восстановлении нитробензола:
Эта реакция носит имя русского химика Н.Н. Зинина, осуществившего ее впервые в 1842г.
Особенности реакции Зинина:
1) распространенным промышленным способом получения анилина является восстановление нитробензола металлами, например железом (чугунными стружками), в кислой среде;
2) восстановление нитросоединений соответствующего строения – это общий способ получения аминов.
Анилин
– один из важнейших продуктов химической промышленности;
a) он является исходным веществом для получения многочисленных анилиновых красителей;
b) анилин используется при получении лекарственных веществ, например сульфаниламидных препаратов, взрывчатых веществ, высокомолекулярных соединений и т. д. Открытие профессором Казанского университета Н.Н. Зининым (1842 г.) доступного способа получения анилина имело большое значение для развития химии и химической промышленности.
Учитель: Составьте УХР разложения нитросоединений аренов.
Взаимодействие азотной кислоты с кислородсодержащими органическими соединениями
Учитель:
Теперь перейдем к изучению особенностей взаимодействия азотной кислоты с кислородсодержащими органическими соединениями. Какие классы из данных групп вступают в реакцию с азотной кислотой? ( Спирты: одно- и многоатомные, фенолы).
Составьте УХР взаимодействия этанола (1 группа) и глицерина (2 группа) с азотной кислотой. Назовите продукты реакций, (к какому классу они относятся), типы и механизмы ХР. Укажите практическое применение данных продуктов реакций.
C2H5OH + HONO2 –> C2H5ONO2 + H2O
Ученик: Этилнитрат – взрывчатое вещество, сложный эфир, продукт реакции ‘ этерификации (реакция электрофильного замещения)
Многоатомные спирты взаимодействуют с кислотами, образуя сложные эфиры. При взаимодействии глицерина с азотной кислотой в присутствии концентрированной серной кислоты образуется нитроглицерин (тринитрат глицерина):
Учитель: Рассмотрите структурную формулу тринитроглицерина. Обратите внимание на то, что в молекуле этого вещества функциональная группа -NO2 связана с углеродом углеводородного радикала не непосредственно, как в нитросоединениях, а через атом кислорода.
Учитель: Какую роль имеют данные нитросоединения в практической деятельности человека? (Вопрос химикам-практикам)
Ученик: Нитроглицерин – тяжелая маслянистая жидкость со сладковатым вкусом, не растворим в воде, но хорошо растворяется в этиловом спирте.
Легко взрывается от небольшого сотрясения или нагревания (это его свойство используется для изготовления взрывчатых веществ), и на его основе изготовляют динамит. Динамит используют в военном и горном деле. При взрыве самопроизвольно происходит реакция:
4 C3H5 (ONO2) –> 12 CO2 +10H2O + 6N2 + O2
Учитель: К производным бензола относится и фенол. В чем отличие взаимодействие фенола с азотной кислотой от взаимодействия с бензолом?
Ученик: Скорость реакции взаимодействия фенола с HNO3 гораздо выше, т.к. фенол, как и толуол, содержат ориентант 1-го рода -OH группу вместо -CH3. Под влиянием фенильного радикала неподеленная электронная пару с O атома -OH группы смещается в бензольное кольцо повышением электронной плотности в положениях 2, 4, 6 и увеличивая полярность связи C-H (реакция электрофильного замещения). Бензол нитруется в одну стадию, а фенол, как толуол, в 3 стадии с образованием 2, 4, 6-тринитрофенола (взаимное влияние атомов в молекулах, разработанный А.М. Бутлеровым) или пикриновой кислоты.
Учитель: Каково значение пикриновой кислоты в народном хозяйстве?
Ученик: Пикриновая кислота (приложение 2), хим., иначе тринитрофенол C6H2(NO2)3OH; кристаллы лимонно-желтого цвета, температура плавления 1225°С, очень ядовита, имеет широкое применение при изготовлении взрывчатых веществ (мелинита и др.). Расплавленная кислота своим янтарным цветом очень напоминает мед (по-гречески – «мели»), так что нет ничего удивительного в том, что взрывчатое вещество на е основе назвали мелинитом.
Учитель: Как влияет на характер кислотных свойств появление в структуре фенола нитрогрупп?
Ученик: Под влиянием нитрогрупп кислотные свойства пикриновой кислоты выше, чем у фенола. Объясняется это тем, что NO2 группа – ориентант 2-го рода и направляет электронную плотность из бензольного кольца на OH– группу, повышая полярность O–H связи
Взаимодействие азотной кислоты с углеводами
Учитель: Какие функциональные группы содержит глюкоза – представитель моносахаридов и дисахариды: сахароза, лактоза, мальтоза?
Ученик: В молекуле глюкозы содержатся одна альдегидная группа, 5 -OH групп, в составе сахарозы (невосстанавливающегося сахара) – только -OH группы, а лактоза и мальтоза, как представители восстанавливающихся сахаров, содержат кроме -OH групп и альдегидные группы.
Учитель: На основании строения, каковы особенности взаимодействия их с азотной кислотой?
Ученик: Все упомянутые представители углеводов в виду наличия -OH групп реагируют с азот
 (
(
 (
(