Что такое Алкены (олефины, этиленовые углеводороды)
Алкены (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие 1 двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n.Атомы углерода при двойной связи находятся в состоянии sp² гибридизации и имеют валентный угол 120°.
Простейшим алкеном является этилен (C2H4).
По номенклатуре IUPAC:
- названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»;
- положение двойной связи указывается арабской цифрой.
Алкены, число атомов углерода в которых больше 2х, (т. е. кроме этилена) имеют изомеры.
Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и пространственная.
Например, единственным изомером пропена является циклопропан (C3H6) по межклассовой изомерии.
Начиная с бутена, существуют изомеры по положению двойной связи (бутен-1 и бутен-2), по углеродному скелету (изобутилен или метилпропен) и геометрические изомеры (цис-бутен-2 и транс-бутен-2).
С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Алкены химически активны.
Их химические свойства во многом определяются наличием двойной связи.
Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения.
Реакции нуклеофильного присоединения обычно требуют наличие сильного нуклеофила и для алкенов не типичны.

Алкены являются важнейшим химическим сырьем.
Промышленное использование этиленаЭтилен используется для производства целого ряда химических соединений: винилхлорида, стирола, этиленгликоля, этиленоксида, этаноламинов, этанола, диоксана, дихлорэтана, уксусного альдегида и уксусной кислоты.
Полимеризацией этилена и его прямых производных получают полиэтилен, поливинилацетат, поливинилхлорид, каучуки и смазочные масла.
Мировое производство этилена составляет порядка 100 млн т/год (по данным на 2005 г: 107 млн т).
Промышленное использование пропилена
Пропилен в промышленности применяется в основном для синтеза полипропилена (62% всего выпускаемого объема).
Также из него получают кумол, окись пропилена, акрилонитрил, изопропанол, глицерин, масляный альдегид.
В настоящее время мировые мощности по выпуску пропилена составляют около 70 млн т/год.
По прогнозам специалистов, потребность в пропилене в ближайшем будущем будет существенно превышать объемы его производства, причем, ожидается, что к 2010 г. объем его мирового выпуска достигнет 90 млн т/год.
объем его мирового выпуска достигнет 90 млн т/год.
Промышленное использование прочих алкенов
Бутилены применяют для производства бутадиена, изопрена, полиизобутилена, бутилкаучука, метилэтилкетона и пр.
Изобутилен — сырье для получения бутилкаучука, изопрена, трет-бутанола; используется для алкилирования фенолов при синтезе ПАВ.
Его сополимеры с бутенами применяют как присадки к маслам и герметики.
Высшие алкены С10-С18 применяют при синтезе ПАВ, а также для получения высших спиртов.
Основное состояние молекулы Н20.— Основное состояние молекулы — Основное состояние молекулы СН4.— Основное состояние молекулы С02.— Основное состояние молекулы С2Н4.— Насыщение валентностей.— Основное состояние молекулы С6Н6.— Сопряжение и сверхсопряжение.— Взаимодействие конфигураций.— Модель свободного электрона.— Молекулы, содержащие атомы переходных элементов (так называемая теория поля лигандов) Возбужденные состояния
СтатьиЧертежиТаблицы
1—переходные
Атомы и молекулы
Атомы, электронные конфигурации
Валентности теория
Валентность
Валентные электроны свободных электронов
Валентных валентность
Взаимодействие атома и поля
Взаимодействие атомов и молекул
Взаимодействие свободных электронов
Взаимодействие электрон-электронное
Взаимодействие электронами
Взаимодействие электронно-электронное
Взаимодействующие поля
Возбужденные состояния атомов
Г-состояния, F-состояния электронные
Конфигурации электронны
Конфигурация
Конфигурация основного состояния
Конфигурация основного состояния атома
Лигандов поля теория
Мир атома
Модели Элементы
Модель атома
Модель взаимодействий
Насыщение
Насыщение валентностей
Насыщенность
Основное состояние
Пар насыщенный
Переходное состояние
Поле свободное
Сверхсопряжение
Сопряжение
Состояние атома основное
Состояние теории
Состояние электронов
Состояния валентные
Состояния возбужденные
Состояния основные
Состояния поля
Теория переходного состояния
Теория поля
Теория электронной конфигурации
Тон электронный в атоме
Электрон валентный
Электрон возбужденный
Электронная конфигурация свободных атомов
Электронная теория
Электронные состояния
Электронные состояния атома или молекулы
Электронные состояния возбужденные
Электронные состояния молекул
Электронный газ без взаимодействия. Свободные электроны
Свободные электроны
Электроны свободные
Элементы Валентность
Элементы теории поля
Из истории валентности
Вплоть до середины XIX века представление о химической связи атомов в молекуле, по существу, отсутствовало, да и само атомно-молекулярное учение считалось в то время лишь гипотезой, которую многие химики подвергали сомнению. Тем не менее, уже тогда существовали химические формулы и уравнения, как-то отражавшие те или иные превращения веществ. Что же это были за формулы и как их составляли, если даже атомы и молекулы считались чем-то потусторонним, недоступным для непосредственного изучения?
Основой для составления формулы вещества был его элементарный состав. Издавна известно, например, что вода состоит из водорода и кислорода, причем их весовое отношение в воде — 1:8.
Количество какого-либо другого элемента, соединяющееся с весовым паем водорода в воде или, что то же самое, с одним паем кислорода, равным 8, называли пайным (или эквивалентным) весом этого элемента. Закон простых кратных отношений был своего рода «квантовой теорией» химии позапрошлого века; из него следовало, что элементы соединяются друг с другом как бы определенными порциями, что и приводит к их целочисленным весовым отношениям.
Каждый элементарный пай обозначался символом соответствующего элемента — Н, О, и т. п. В воде, по условию, на один пай водорода приходился один пай кислорода. Отсюда столетней давности формула воды — НО. Долгое время для углерода принимался пайный вес 6, и формула метана писалась в виде С2Н4. Сто с небольшим лет назад химические формулы многих веществ имели столь же странный и непривычный для нас вид (Н5 — сероводород, КО + НО — едкий калий и т. п.).
Нельзя считать эти формулы абсурдными: какую-то часть истины они все же отражали (элементарный состав вещества, весовое соотношение входящих в него элементов). Современному читателю легко заметить, что пайные веса углерода (6), кислорода (8), азота (7), серы (16) равнялись половине их атомных весов, принятых сегодня. Однако в то время истинные атомные веса определять не умели. Впрочем, все чаще эквиваленты стали называть «атомами», подразумевая под этим некоторое минимальное количество элемента, вступающее в химическое соединение.
Основой для дальнейшего движения вперед послужило развитие представлений о химической частице (молекуле) и окончательное принятие большинством химиков атомно-молекулярного учения. В связи с этим в повестку дня стал важнейшей для химии вопрос: сколько атомов того или иного сорта способен присоединять к себе данный атом и является ли это число достаточно постоянным, характерным для рассматриваемого элемента?
Ответить на этот вопрос было бы не так уж трудно, если бы различные элементы всегда соединялись друг с другом в каких-то строго постоянных отношениях. Однако сплошь и рядом столь завидная простота не обнаруживалась. Многие металлы образуют по два, а то и по три различных соединения с кислородом, а азот дает их целых пять. Это же свойство многие элементы проявляют и в соединениях с хлором, серой, водородом и т. п. В бесчисленных соединениях углерода вообще с трудом угадывался закон кратных отношений: он соединялся с другими элементами в самых причудливых и далеко не всегда простых отношениях.
Но вот в 1849 году двадцатитрехлетний английский химик Эдуард Франкланд открывает новый класс органических соединений, в которых атомы металла связаны с простейшими остатками органических молекул — радикалами (метилом, этилом и т. п.). Сначала были получены органические соединения цинка, затем — соединения ртути, бора, олова, свинца. Новые соединения обладали многими удивительными свойствами и привлекли к себе общее внимание, число их быстро росло. Уже в 1853 году Франкланд подметил одно любопытное явление. Оказалось, что каждый металл, для которого были известны соединения с органическими радикалами, образует только одно соединение этого типа. В летучих, то есть способных к перегонке, металлоорганических соединениях, цинк и ртуть всегда соединялись только с двумя метальными радикалами, бор — с тремя, олово и свинец — с четырьмя. Впервые возникла мысль, что именно эти числа характеризуют способность элементов к соединению друг с другом. Сопоставляя свои наблюдения с материалом, накопленным неорганической химией, Франкланд впервые выдвинул утверждение, что каждому элементу присуще лишь определенное количество единиц сродства, при помощи которых атомы соединяются в молекулу.
Победа научной атомистики и установление точных атомных весов углерода и кислорода, выполненное Станислао Канниццаро в 1858 году, вскоре позволили придать первоначальной мысли Франкланда более совершенную формулировку. Например, такую: «Валентность — это свойство атомов одного элемента присоединять определенное число атомов других элементов. За единицу измерения валентности принята валентность водорода».
Это определение взято из учебника химии, ныне принятого «на вооружение» в средних школах. С той поры, как выраженная в этих словах мысль стала очевидной, прошло более сто лет. За эти более сто лет в химии произошло больше изменений, чем за предыдущие лет пятьсот. Существенно обновилось и то содержание, которое раньше вкладывалось в представление о валентности. Стало очевидным, что валентность тесно связана с электронным строением атомов. Казалось логичным, что максимально возможная валентность атома равна либо числу его внешних (валентных) электронов, которые он в принципе может отдать, либо числу свободных мест в его электронной оболочке, на которые он может принять чужие электроны. Может создаться впечатление, что с этими дополнениями старое определение остается все же удовлетворительным, достаточно полно отражающим современное содержание учения о валентности.
Может создаться впечатление, что с этими дополнениями старое определение остается все же удовлетворительным, достаточно полно отражающим современное содержание учения о валентности.
Автор: О. Охлобыстин.
Какова валентность углерода в Ch5 и C2h3? — Ответы на все
Какова валентность углерода в Ch5 и C2h3?
Ответ проверен экспертом Валентность углерода одинакова во всех углеродных соединениях. В Ch5 углерод образует с водородом 4 одинарные связи, как и в C2H6. Он образует двойную связь в C2h5 и тройную связь в C2h3. Валентность одинакова во всех соединениях.
Какова валентность i-го углерода в Ch5?
4
Образован одним атомом углерода и четырьмя атомами водорода.Водород имеет валентность 1, а четырехвалентный углерод нуждается в четырех валентных электронах, чтобы приобрести конфигурацию благородного газа, где он делит свои 4 электрона с четырьмя атомами водорода. Следовательно, валентность атомов углерода в метане равна 4,

Какова валентность C2h5?
C2h5 представляет собой этен или этилен представляет собой бесцветный углеводород. Углерод имеет валентность 4, так как в молекуле четыре атома Н связаны с парой атомов С, соединенных двойными связями.
Как валентность углерода 4?
Валентность углерода равна 4.Таким образом, он имеет 4 валентных электрона. Он разделяет эти 4 валентных электрона, образуя 4 ковалентные связи. Следовательно, валентность углерода равна 4,
.Как мы можем подтвердить наличие углерода в любом материале?
, если органическое соединение, которое должно быть проверено на наличие углерода, нагревается в присутствии сухого оксида меди (CuO) и дает двуокись углерода, то оно содержит углерод. Углекислый газ не поддерживает горение, поэтому горящая свеча при приближении к нему гаснет. Также известковая вода становится молочной.
Как проверить наличие углерода?
Стандартным тестом на наличие углекислого газа является его реакция с известковой водой (насыщенным водным раствором гидроксида кальция) с образованием молочно-белого осадка гидроксида кальция. Углекислый газ встречается в природе как в свободном виде, так и в соединениях (например, в карбонатах).
Углекислый газ встречается в природе как в свободном виде, так и в соединениях (например, в карбонатах).
Что такое испытание углерода?
Тест на известковую воду: Известковая вода в основном представляет собой раствор гидроксида кальция. Поэтому, если мы барботируем углекислый газ через раствор, он реагирует с раствором гидроксида кальция, образуя белый осадок карбоната кальция.Мы увидим, что известковая вода станет молочно-белой.
молекула этена C2h5 Точка и крест Льюиса электронная диаграмма ковалентные связи шарик и палочка заполнение пространства 3D модели точка кипения точка плавления примечания к редакции химии Дока Брауна
3л. Ковалентная связь в молекуле этена
Док Химия Брауна: химическая связь и структура, уровень GCSE, IGCSE, O, IB, AS, A уровень США 9–12 уровни Примечания к редакции
Диаграмма ковалентной связи для ЭТЕНА ковалентная молекула, молекулярная формула C 2 H 4
* металлы\неметаллы (зигзаг)
| ПД | металлы | Часть современной Периодической таблицы Pd = период, Гп = группа | металлы => неметаллы | |||||||||||||||
| Гп1 | Гп2 | Гп3 | Гп4 | Гп5 | Гп6 | GP7 | Gp0 | |||||||||||
| 1 | 1 Н Примечание что водород не вписывается ни в какую группу, но является неметалл | 2 Он | ||||||||||||||||
| 2 | 3 Ли | 4 Бе | атомный номер Химический символ Например, 4 Be | 5 В | 6 С | 7 Н | 8 О | 9 Ф | 10 Не | |||||||||
| 3 | 11 Нет данных | 12 мг | 13 Ал | 14 Си | 15 Р | 16 С | 17 Класс | 18 Ar | ||||||||||
| 4 | 19 К | 20 Са | 21 Sc | 22 Ти | 23 В | 24 Кр | 25 Мн | 26 Fe | 27 Ко | 28 Никель | 29 Медь | 30 Цинк | 31 Га | 32 Ге | 33 Как | 34 Se | 35 Бр | 36 Кр |
| 5 | 37 Руб | 38 Старший | 39 Д | 40 Цирконий | 41 № | 42 Пн | 43 ТК | 44 Ру | 45 Правая | 46 Пд | 47 Аг | 48 CD | 49 В | 50 Сн | 51 Сб | 52 Те | 53 I | 54 Хе |
| 6 | 55 Цс | 56 Ба | Переходные металлы | 81 Тл | 82 Pb | 83 Би | 84 ПО | 85 В | 86 Р-н | |||||||||
| То ковалентная молекула этена из углерода в сочетании с водородом | ||||||||||||||||||
Два атома углерода (2. 4) соединиться с четырьмя атомами водорода (1) с образованием этена C 2 H 4 (показаны только внешние оболочки электронов углерода).
4) соединиться с четырьмя атомами водорода (1) с образованием этена C 2 H 4 (показаны только внешние оболочки электронов углерода).
Справа диаграмма Льюиса этена — а упрощенная электронная схема «точка-крест» для ковалентно связанной молекулы этена .
Электронный , водород (1) становится подобным гелию (2), а углерод (2.4) становится подобным неону (2.8), поэтому ВСЕ атомы водорода и углерода эффективно имеют полные внешние оболочки при формировании ковалентные связи, когда атомы имеют общие внешние электроны.
Молекула может быть представлена как (отображается формула) с одним углеродом = углеродная двойная связь и четыре углеродных водородных одинарных ковалентные связи (у него плоская форма , он совершенно плоский!, HC=C и HCH валентные углы равны 120 o ). Валентность углерода по-прежнему равна 4,
. Молекула этана удерживается вместе
четырьмя прочными одинарными ковалентными связями CH углерод-водород и одной C = C
углеродуглеродная ковалентная двойная связь.
Приведенные выше диаграммы представляют собой другие стили электронных «точка и х». диаграммы для этилена.
мяч и палочка модель ethene
космос Модель наполнения из этилена
Комментарии
Температура плавления этилена -169 o C
Температура кипения этилена -104 o C
Бесцветный газ при комнатной температуре. с сильным углеводородным запахом.
Что следующий?
Рекомендовать следующее: Ковалентная связь в атоме азота молекула
Объяснение свойств малых ковалентно связанные молекулы
S ub-индекс для Часть 3.
Ковалентная связь: малые молекулы и свойства
Индекс для ВСЕ химические примечания по склеиванию и структуре
Может быть интересно?
Основная химия алкенов, таких как этен
Используйте окно поиска My Google
Кнопки карты сайта ниже
НАЧАЛО СТРАНИЦЫ
%PDF-1.5
%
1 0 объект
>
>>
эндообъект
4 0 объект /CreationDate (D:20210520150039+02’00’)
/ModDate (D:20210520150039+02’00’)
/Режиссер
/Заголовок ()
/Ключевые слова ()
>>
эндообъект
2 0 объект
>
эндообъект
3 0 объект
>
эндообъект
5 0 объект
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/Анноты [29 0 R 30 0 R]
/MediaBox [0 0 612 792]
/Содержание 31 0 Р
/Группа >
/Вкладки /S
/StructParents 0
>>
эндообъект
6 0 объект
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/Annots [33 0 R 34 0 R 35 0 R 36 0 R 37 0 R 38 0 R 39 0 R 40 0 R 41 0 R 42 0 R
43 0 R 44 0 R 45 0 R 46 0 R 47 0 R 48 0 R 49 0 R 50 0 R]
/MediaBox [0 0 612 792]
/Содержание 51 0 Р
/Группа >
/Вкладки /S
/StructParents 3
>>
эндообъект
7 0 объект
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/Annots [52 0 R 53 0 R 54 0 R 55 0 R 56 0 R 57 0 R 58 0 R 59 0 R 60 0 R 61 0 R]
/MediaBox [0 0 612 792]
/Содержание 62 0 Р
/Группа >
/Вкладки /S
/StructParents 22
>>
эндообъект
8 0 объект
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/Annots [64 0 R 65 0 R 66 0 R 67 0 R 68 0 R 69 0 R 70 0 R]
/MediaBox [0 0 612 792]
/Содержание 71 0 Р
/Группа >
/Вкладки /S
/StructParents 33
>>
эндообъект
9 0 объект
>
/ExtGState >
/XОбъект >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/Annots [73 0 R 74 0 R 75 0 R 76 0 R 77 0 R 78 0 R 79 0 R 80 0 R 81 0 R 82 0 R]
/MediaBox [0 0 612 792]
/Содержание 83 0 Р
/Группа >
/Вкладки /S
/StructParents 41
>>
эндообъект
10 0 объект
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/Annots [86 0 R 87 0 R 88 0 R 89 0 R 90 0 R 91 0 R 92 0 R 93 0 R 94 0 R 95 0 R
96 0 Р 97 0 Р]
/MediaBox [0 0 612 792]
/Содержание 98 0 Р
/Группа >
/Вкладки /S
/StructParents 52
>>
эндообъект
11 0 объект
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/Annots [99 0 R 100 0 R 101 0 R 102 0 R 103 0 R 104 0 R 105 0 R 106 0 R]
/MediaBox [0 0 612 792]
/Содержание 107 0 Р
/Группа >
/Вкладки /S
/StructParents 65
>>
эндообъект
12 0 объект
>
/ExtGState >
/XОбъект >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/Аннотации [109 0 R 110 0 R 111 0 R 112 0 R]
/MediaBox [0 0 612 792]
/Содержание 113 0 Р
/Группа >
/Вкладки /S
/StructParents 74
>>
эндообъект
13 0 объект
>
/ExtGState >
/XОбъект >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/Annots [115 0 R 116 0 R 117 0 R 118 0 R 119 0 R 120 0 R 121 0 R 122 0 R]
/MediaBox [0 0 612 792]
/Содержание 123 0 Р
/Группа >
/Вкладки /S
/StructParents 79
>>
эндообъект
14 0 объект
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/Annots [124 0 R 125 0 R 126 0 R 127 0 R 128 0 R 129 0 R]
/MediaBox [0 0 612 792]
/Содержание 130 0 Р
/Группа >
/Вкладки /S
/StructParents 88
>>
эндообъект
15 0 объект
>
/ExtGState >
/XОбъект >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/Анноты [132 0 R 133 0 R 134 0 R 135 0 R 136 0 R]
/MediaBox [0 0 612 792]
/Содержание 137 0 Р
/Группа >
/Вкладки /S
/StructParents 95
>>
эндообъект
16 0 объект
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/Анноты [138 0 R 139 0 R 140 0 R 141 0 R 142 0 R]
/MediaBox [0 0 612 792]
/Содержание 143 0 Р
/Группа >
/Вкладки /S
/StructParents 101
>>
эндообъект
17 0 объект
>
/ExtGState >
/XОбъект >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 612 792]
/Содержание 145 0 Р
/Группа >
/Вкладки /S
/StructParents 107
>>
эндообъект
18 0 объект
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 612 792]
/Содержание 146 0 Р
/Группа >
/Вкладки /S
/StructParents 108
>>
эндообъект
19 0 объект
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 612 792]
/Содержание 148 0 Р
/Группа >
/Вкладки /S
/StructParents 109
>>
эндообъект
20 0 объект
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 612 792]
/Содержание 149 0 Р
/Группа >
/Вкладки /S
/StructParents 110
>>
эндообъект
21 0 объект
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 612 792]
/Содержание 150 0 р
/Группа >
/Вкладки /S
/StructParents 111
>>
эндообъект
22 0 объект
>
эндообъект
23 0 объект
>
эндообъект
24 0 объект
>
эндообъект
25 0 объект
>
эндообъект
26 0 объект
>
эндообъект
27 0 объект
>
эндообъект
28 0 объект
>
эндообъект
29 0 объект
>
/Ф 4
/А >
/StructParent 1
>>
эндообъект
30 0 объект
>
/Ф 4
/А >
/StructParent 2
>>
эндообъект
31 0 объект
>
ручей
x][sF~wNp9Imc{l$q6*$l(B!Akg )&1#?ȒHj>{. _z2/|Yד|zUU?/?|_8)?mjveׯ??KBFIگY!_>ϟ}˿Ⱦ3a−D»2JDG{E7k)o~zٯ#1gϟ ?N/5D.$q»u%zU]7M0qcvb> WeE1r:_b|4
PSXQg)G_Q
0@
_z2/|Yד|zUU?/?|_8)?mjveׯ??KBFIگY!_>ϟ}˿Ⱦ3a−D»2JDG{E7k)o~zٯ#1gϟ ?N/5D.$q»u%zU]7M0qcvb> WeE1r:_b|4
PSXQg)G_Q
0@
%PDF-1.3 % 658 0 объект> эндообъект внешняя ссылка 658 2515 0000000016 00000 н 0000054097 00000 н 0000050596 00000 н 0000054192 00000 н 0000054396 00000 н 00000 00000 н 00000 00000 н 0000091268 00000 н 0000091315 00000 н 0000091362 00000 н 0000091409 00000 н 0000091456 00000 н 0000091503 00000 н 0000091550 00000 н 0000091597 00000 н 0000091644 00000 н 0000091691 00000 н 0000091738 00000 н 0000091785 00000 н 0000091832 00000 н 0000091879 00000 н 0000091926 00000 н 0000091973 00000 н 0000092020 00000 н 0000092068 00000 н 0000092115 00000 н 0000092162 00000 н 0000092209 00000 н 0000092256 00000 н 0000092303 00000 н 0000092350 00000 н 0000092397 00000 н 0000092444 00000 н 0000092491 00000 н 0000092538 00000 н 0000092585 00000 н 0000092632 00000 н 0000092679 00000 н 0000092726 00000 н 0000092773 00000 н 0000092820 00000 н 0000092867 00000 н 0000092914 00000 н 0000092961 00000 н 0000093008 00000 н 0000093055 00000 н 0000093102 00000 н 0000093149 00000 н 0000093196 00000 н 0000093243 00000 н 0000093290 00000 н 0000093337 00000 н 0000093384 00000 н 0000093431 00000 н 0000093478 00000 н 0000093525 00000 н 0000093572 00000 н 0000093619 00000 н 0000093666 00000 н 0000093713 00000 н 0000093760 00000 н 0000093807 00000 н 0000093854 00000 н 0000093901 00000 н 0000093948 00000 н 0000093995 00000 н 0000094042 00000 н 0000094089 00000 н 0000094136 00000 н 0000094183 00000 н 0000094230 00000 н 0000094277 00000 н 0000094324 00000 н 0000094371 00000 н 0000094885 00000 н 0000095411 00000 н 0000095739 00000 н 0000095816 00000 н 0000095863 00000 н 0000095910 00000 н 0000095957 00000 н 0000096004 00000 н 0000096051 00000 н 0000096098 00000 н 0000096145 00000 н 0000096192 00000 н 0000096239 00000 н 0000096286 00000 н 0000096333 00000 н 0000096380 00000 н 0000096427 00000 н 0000096474 00000 н 0000096521 00000 н 0000096568 00000 н 0000096615 00000 н 0000096662 00000 н 0000096709 00000 н 0000096756 00000 н 0000096803 00000 н 0000096850 00000 н 0000096897 00000 н 0000096944 00000 н 0000099870 00000 н 0000102580 00000 н 0000105219 00000 н 0000107655 00000 н 0000110125 00000 н 0000112606 00000 н 0000112871 00000 н 0000113398 00000 н 0000113906 00000 н 0000114562 00000 н 0000117264 00000 н 0000146952 00000 н 0000149374 00000 н 0000195928 00000 н 0000195994 00000 н 0000196063 00000 н 0000196132 00000 н 0000196201 00000 н 0000196270 00000 н 0000196339 00000 н 0000196408 00000 н 0000196477 00000 н 0000196546 00000 н 0000196615 00000 н 0000196684 00000 н 0000196753 00000 н 0000196822 00000 н 0000196891 00000 н 0000196957 00000 н 0000197023 00000 н 0000197089 00000 н 0000197158 00000 н 0000197224 00000 н 0000197290 00000 н 0000197359 00000 н 0000197428 00000 н 0000197500 00000 н 0000197572 00000 н 0000197644 00000 н 0000197713 00000 н 0000197785 00000 н 0000197857 00000 н 0000197929 00000 н 0000197998 00000 н 0000198067 00000 н 0000198139 00000 н 0000198211 00000 н 0000198277 00000 н 0000198349 00000 н 0000198415 00000 н 0000198484 00000 н 0000198559 00000 н 0000198634 00000 н 0000198697 00000 н 0000198760 00000 н 0000198823 00000 н 0000198886 00000 н 0000198946 00000 н 0000199009 00000 н 0000199072 00000 н 0000199135 00000 н 0000199216 00000 н 0000199303 00000 н 0000199369 00000 н 0000199435 00000 н 0000199498 00000 н 0000199564 00000 н 0000199630 00000 н 0000199699 00000 н 0000199768 00000 н 0000199837 00000 н 0000199906 00000 н 0000199975 00000 н 0000200041 00000 н 0000200110 00000 н 0000200179 00000 н 0000200248 00000 н 0000200311 00000 н 0000200389 00000 н 0000200449 00000 н 0000200509 00000 н 0000200569 00000 н 0000200629 00000 н 0000200698 00000 н 0000200776 00000 н 0000200845 00000 н 0000200914 00000 н 0000200983 00000 н 0000201055 00000 н 0000201121 00000 н 0000201184 00000 н 0000201250 00000 н 0000201316 00000 н 0000201379 00000 н 0000201448 00000 н 0000201517 00000 н 0000201583 00000 н 0000201652 00000 н 0000201721 00000 н 0000201790 00000 н 0000201859 00000 н 0000201928 00000 н 0000201997 00000 н 0000202063 00000 н 0000202132 00000 н 0000202201 00000 н 0000202273 00000 н 0000202578 00000 н 0000203072 00000 н 0000203305 00000 н 0000203526 00000 н 0000203924 00000 н 0000206809 00000 н 0000207144 00000 н 0000207233 00000 н 0000207550 00000 н 0000208236 00000 н 0000208476 00000 н 0000208594 00000 н 0000208946 00000 н 0000210317 00000 н 0000210569 00000 н 0000210774 00000 н 0000211169 00000 н 0000213756 00000 н 0000214078 00000 н 0000214316 00000 н 0000214572 00000 н 0000214830 00000 н 0000215085 00000 н 0000215341 00000 н 0000215597 00000 н 0000215853 00000 н 0000216104 00000 н 0000216362 00000 н 0000216617 00000 н 0000216874 00000 н 0000217131 00000 н 0000217383 00000 н 0000217635 00000 н 0000217893 00000 н 0000218155 00000 н 0000218413 00000 н 0000218669 00000 н 0000218926 00000 н 0000219183 00000 н 0000219446 00000 н 0000219711 00000 н 0000219979 00000 н 0000220250 00000 н 0000220514 00000 н 0000220786 00000 н 0000221056 00000 н 0000221333 00000 н 0000221594 00000 н 0000221854 00000 н 0000222116 00000 н 0000222373 00000 н 0000222633 00000 н 0000222897 00000 н 0000223169 00000 н 0000223426 00000 н 0000223689 00000 н 0000223949 00000 н 0000224212 00000 н 0000224587 00000 н 0000224988 00000 н 0000225385 00000 н 0000225770 00000 н 0000226157 00000 н 0000226541 00000 н 0000226925 00000 н 0000227313 00000 н 0000227693 00000 н 0000228079 00000 н 0000228468 00000 н 0000228857 00000 н 0000229244 00000 н 0000229633 00000 н 0000230009 00000 н 0000230400 00000 н 0000230782 00000 н 0000231162 00000 н 0000231547 00000 н 0000231941 00000 н 0000232321 00000 н 0000232716 00000 н 0000233104 00000 н 0000233489 00000 н 0000233882 00000 н 0000234301 00000 н 0000234723 00000 н 0000235142 00000 н 0000235552 00000 н 0000235974 00000 н 0000236397 00000 н 0000236818 00000 н 0000237201 00000 н 0000237588 00000 н 0000237968 00000 н 0000238359 00000 н 0000238746 00000 н 0000239200 00000 н 0000239637 00000 н 0000239892 00000 н 0000240141 00000 н 0000240391 00000 н 0000240640 00000 н 0000240887 00000 н 0000241137 00000 н 0000241384 00000 н 0000241639 00000 н 0000241886 00000 н 0000242129 00000 н 0000242381 00000 н 0000242631 00000 н 0000242877 00000 н 0000243126 00000 н 0000243374 00000 н 0000243668 00000 н 0000243955 00000 н 0000244233 00000 н 0000244525 00000 н 0000244816 00000 н 0000245105 00000 н 0000245395 00000 н 0000245682 00000 н 0000245971 00000 н 0000246254 00000 н 0000246546 00000 н 0000246834 00000 н 0000247121 00000 н 0000247397 00000 н 0000247693 00000 н 0000247992 00000 н 0000248287 00000 н 0000248583 00000 н 0000248888 00000 н 0000249185 00000 н 0000249467 00000 н 0000249754 00000 н 0000250091 00000 н 0000250396 00000 н 0000250559 00000 н 0000250719 00000 н 0000250879 00000 н 0000251036 00000 н 0000251199 00000 н 0000251359 00000 н 0000251519 00000 н 0000251676 00000 н 0000251839 00000 н 0000251993 00000 н 0000252153 00000 н 0000252307 00000 н 0000252467 00000 н 0000252621 00000 н 0000252778 00000 н 0000252932 00000 н 0000253095 00000 н 0000253255 00000 н 0000253415 00000 н 0000253575 00000 н 0000253735 00000 н 0000253895 00000 н 0000254052 00000 н 0000254212 00000 н 0000254375 00000 н 0000254555 00000 н 0000254715 00000 н 0000254878 00000 н 0000255038 00000 н 0000255205 00000 н 0000255362 00000 н 0000255525 00000 н 0000255688 00000 н 0000255858 00000 н 0000256018 00000 н 0000256185 00000 н 0000256345 00000 н 0000256512 00000 н 0000256669 00000 н 0000256839 00000 н 0000257002 00000 н 0000257172 00000 н 0000257332 00000 н 0000257520 00000 н 0000257680 00000 н 0000257847 00000 н 0000258004 00000 н 0000258174 00000 н 0000258337 00000 н 0000258507 00000 н 0000258667 00000 н 0000258837 00000 н 0000258997 00000 н 0000259164 00000 н 0000259321 00000 н 0000259509 00000 н 0000259672 00000 н 0000259839 00000 н 0000259999 00000 н 0000260166 00000 н 0000260326 00000 н 0000260493 00000 н 0000260650 00000 н 0000260817 00000 н 0000260980 00000 н 0000261143 00000 н 0000261303 00000 н 0000261466 00000 н 0000261626 00000 н 0000261786 00000 н 0000261943 00000 н 0000262106 00000 н 0000262269 00000 н 0000262426 00000 н 0000262586 00000 н 0000262743 00000 н 0000262903 00000 н 0000263060 00000 н 0000263217 00000 н 0000263374 00000 н 0000263537 00000 н 0000263688 00000 н 0000263848 00000 н 0000263999 00000 н 0000264159 00000 н 0000264307 00000 н 0000264464 00000 н 0000264615 00000 н 0000264778 00000 н 0000264938 00000 н 0000265098 00000 н 0000265255 00000 н 0000265418 00000 н 0000265578 00000 н 0000265738 00000 н 0000265895 00000 н 0000266058 00000 н 0000266218 00000 н 0000266378 00000 н 0000266535 00000 н 0000266698 00000 н 0000266858 00000 н 0000267018 00000 н 0000267175 00000 н 0000267338 00000 н 0000267498 00000 н 0000267658 00000 н 0000267815 00000 н 0000267978 00000 н 0000268141 00000 н 0000268301 00000 н 0000268464 00000 н 0000268624 00000 н 0000268787 00000 н 0000268950 00000 н 0000269107 00000 н 0000269267 00000 н 0000269427 00000 н 0000269590 00000 н 0000269753 00000 н 0000269907 00000 н 0000270064 00000 н 0000270218 00000 н 0000270372 00000 н 0000270539 00000 н 0000270699 00000 н 0000270853 00000 н 0000271013 00000 н 0000271164 00000 н 0000271318 00000 н 0000271472 00000 н 0000271626 00000 н 0000271793 00000 н 0000271953 00000 н 0000272113 00000 н 0000272264 00000 н 0000272424 00000 н 0000272578 00000 н 0000272735 00000 н 0000272902 00000 н 0000273059 00000 н 0000273216 00000 н 0000273383 00000 н 0000273540 00000 н 0000273694 00000 н 0000273851 00000 н 0000274033 00000 н 0000274233 00000 н 0000274393 00000 н 0000274547 00000 н 0000274729 00000 н 0000274886 00000 н 0000275059 00000 н 0000275241 00000 н 0000275398 00000 н 0000275552 00000 н 0000275725 00000 н 0000275901 00000 н 0000276071 00000 н 0000276231 00000 н 0000276407 00000 н 0000276589 00000 н 0000276743 00000 н 0000276906 00000 н 0000277057 00000 н 0000277230 00000 н 0000277390 00000 н 0000277544 00000 н 0000277717 00000 н 0000277896 00000 н 0000278066 00000 н 0000278245 00000 н 0000278427 00000 н 0000278600 00000 н 0000278754 00000 н 0000278924 00000 н 0000279100 00000 н 0000279270 00000 н 0000279427 00000 н 0000279584 00000 н 0000279754 00000 н 0000279930 00000 н 0000280100 00000 н 0000280257 00000 н 0000280414 00000 н 0000280574 00000 н 0000280731 00000 н 0000280907 00000 н 0000281089 00000 н 0000281304 00000 н 0000281523 00000 н 0000281686 00000 н 0000281843 00000 н 0000282055 00000 н 0000282212 00000 н 0000282397 00000 н 0000282609 00000 н 0000282769 00000 н 0000282929 00000 н 0000283111 00000 н 0000283341 00000 н 0000283501 00000 н 0000283689 00000 н 0000283886 00000 н 0000284043 00000 н 0000284213 00000 н 0000284367 00000 н 0000284552 00000 н 0000284712 00000 н 0000284872 00000 н 0000285054 00000 н 0000285285 00000 н 0000285482 00000 н 0000285642 00000 н 0000285827 00000 н 0000286021 00000 н 0000286178 00000 н 0000286360 00000 н 0000286595 00000 н 0000286755 00000 н 0000286912 00000 н 0000287094 00000 н 0000287316 00000 н 0000287473 00000 н 0000287633 00000 н 0000287793 00000 н 0000287950 00000 н 0000288138 00000 н 0000288335 00000 н 0000288548 00000 н 0000288757 00000 н 0000288917 00000 н 0000289074 00000 н 0000289282 00000 н 0000289439 00000 н 0000289646 00000 н 0000289854 00000 н 00002
00000 н 00002 00000 н 00002 00000 н 00002 00000 н 0000200000 н 00002
00000 н 00002 00000 н
0000291323 00000 н
0000291499 00000 н
0000291653 00000 н
0000291857 00000 н
0000292017 00000 н
0000292177 00000 н
0000292384 00000 н
0000292606 00000 н
0000292817 00000 н
0000292977 00000 н
0000293178 00000 н
0000293385 00000 н
0000293542 00000 н
0000293742 00000 н
0000293958 00000 н
0000294118 00000 н
0000294275 00000 н
0000294477 00000 н
0000294697 00000 н
0000294854 00000 н
0000295014 00000 н
0000295174 00000 н
0000295334 00000 н
0000295539 00000 н
0000295745 00000 н
0000295957 00000 н
0000296170 00000 н
0000296330 00000 н
0000296490 00000 н
0000296701 00000 н
0000296861 00000 н
0000297070 00000 н
0000297270 00000 н
0000297430 00000 н
0000297590 00000 н
0000297793 00000 н
0000298007 00000 н
0000298167 00000 н
0000298367 00000 н
0000298578 00000 н
0000298735 00000 н
0000298911 00000 н
0000299065 00000 н
0000299270 00000 н
0000299430 00000 н
0000299590 00000 н
0000299790 00000 н
0000299999 00000 н
0000300203 00000 н
0000300363 00000 н
0000300569 00000 н
0000300786 00000 н
0000300943 00000 н
0000301150 00000 н
0000301370 00000 н
0000301530 00000 н
0000301687 00000 н
0000301896 00000 н
0000302116 00000 н
0000302273 00000 н
0000302433 00000 н
0000302593 00000 н
0000302750 00000 н
0000302958 00000 н
0000303160 00000 н
0000303382 00000 н
0000303610 00000 н
0000303773 00000 н
0000303933 00000 н
0000304155 00000 н
0000304315 00000 н
0000304523 00000 н
0000304747 00000 н
0000304907 00000 н
0000305133 00000 н
0000305357 00000 н
0000305517 00000 н
0000305737 00000 н
0000305957 00000 н
0000306162 00000 н
0000306380 00000 н
0000306540 00000 н
0000306769 00000 н
0000306994 00000 н
0000307212 00000 н
0000307372 00000 н
0000307581 00000 н
0000307798 00000 н
0000307955 00000 н
0000308162 00000 н
0000308378 00000 н
0000308538 00000 н
0000308695 00000 н
0000308898 00000 н
0000309117 00000 н
0000309274 00000 н
0000309434 00000 н
0000309594 00000 н
0000309754 00000 н
0000309977 00000 н
0000310197 00000 н
0000310425 00000 н
0000310669 00000 н
0000310829 00000 н
0000310989 00000 н
0000311223 00000 н
0000311454 00000 н
0000311681 00000 н
0000311841 00000 н
0000312086 00000 н
0000312317 00000 н
0000312477 00000 н
0000312708 00000 н
0000312942 00000 н
0000313153 00000 н
0000313379 00000 н
0000313539 00000 н
0000313773 00000 н
0000313998 00000 н
0000314213 00000 н
0000314446 00000 н
0000314664 00000 н
0000314888 00000 н
0000315110 00000 н
0000315270 00000 н
0000315500 00000 н
0000315731 00000 н
0000315888 00000 н
0000316048 00000 н
0000316205 00000 н
0000316362 00000 н
0000316586 00000 н
0000316795 00000 н
0000316958 00000 н
0000317128 00000 н
0000317310 00000 н
0000317483 00000 н
0000317643 00000 н
0000317803 00000 н
0000317966 00000 н
0000318139 00000 н
0000318375 00000 н
0000318554 00000 н
0000318714 00000 н
0000318874 00000 н
0000319107 00000 н
0000319277 00000 н
0000319447 00000 н
0000319607 00000 н
0000319774 00000 н
0000319944 00000 н
0000320107 00000 н
0000320280 00000 н
0000320492 00000 н
0000320723 00000 н
0000320883 00000 н
0000321116 00000 н
0000321286 00000 н
0000321456 00000 н
0000321632 00000 н
0000321792 00000 н
0000322026 00000 н
0000322189 00000 н
0000322365 00000 н
0000322599 00000 н
0000322769 00000 н
0000322939 00000 н
0000323099 00000 н
0000323337 00000 н
0000323510 00000 н
0000323680 00000 н
0000323837 00000 н
0000323997 00000 н
0000324157 00000 н
0000324314 00000 н
0000324484 00000 н
0000324654 00000 н
0000324821 00000 н
0000324975 00000 н
0000325123 00000 н
0000325290 00000 н
0000325460 00000 н
0000325623 00000 н
0000325783 00000 н
0000325940 00000 н
0000326088 00000 н
0000326255 00000 н
0000326453 00000 н
0000326620 00000 н
0000326787 00000 н
0000326932 00000 н
0000327092 00000 н
0000327274 00000 н
0000327441 00000 н
0000327604 00000 н
0000327771 00000 н
0000327931 00000 н
0000328098 00000 н
0000328261 00000 н
0000328412 00000 н
0000328579 00000 н
0000328769 00000 н
0000328910 00000 н
0000329089 00000 н
0000329259 00000 н
0000329419 00000 н
0000329617 00000 н
0000329784 00000 н
0000329947 00000 н
0000330114 00000 н
0000330284 00000 н
0000330429 00000 н
0000330629 00000 н
0000330796 00000 н
0000330944 00000 н
0000331107 00000 н
0000331289 00000 н
0000331456 00000 н
0000331619 00000 н
0000331786 00000 н
0000331946 00000 н
0000332125 00000 н
0000332292 00000 н
0000332455 00000 н
0000332618 00000 н
0000332775 00000 н
0000332935 00000 н
0000333095 00000 н
0000333255 00000 н
0000333418 00000 н
0000333581 00000 н
0000333741 00000 н
0000333882 00000 н
0000334023 00000 н
0000334186 00000 н
0000334356 00000 н
0000334519 00000 н
0000334679 00000 н
0000334839 00000 н
0000334984 00000 н
0000335147 00000 н
0000335326 00000 н
0000335489 00000 н
0000335656 00000 н
0000335794 00000 н
0000335954 00000 н
0000336130 00000 н
0000336293 00000 н
0000336453 00000 н
0000336616 00000 н
0000336776 00000 н
0000336939 00000 н
0000337099 00000 н
0000337240 00000 н
0000337403 00000 н
0000337573 00000 н
0000337764 00000 н
0000337927 00000 н
0000338087 00000 н
0000338266 00000 н
0000338429 00000 н
0000338589 00000 н
0000338752 00000 н
0000338919 00000 н
0000339060 00000 н
0000339253 00000 н
0000339420 00000 н
0000339558 00000 н
0000339721 00000 н
0000339897 00000 н
0000340060 00000 н
0000340220 00000 н
0000340383 00000 н
0000340543 00000 н
0000340716 00000 н
0000340879 00000 н
0000341042 00000 н
0000341205 00000 н
0000341362 00000 н
0000341522 00000 н
0000341682 00000 н
0000341845 00000 н
0000342005 00000 н
0000342165 00000 н
0000342325 00000 н
0000342488 00000 н
0000342651 00000 н
0000342814 00000 н
0000342971 00000 н
0000343128 00000 н
0000343288 00000 н
0000343461 00000 н
0000343624 00000 н
0000343787 00000 н
0000343947 00000 н
0000344120 00000 н
0000344283 00000 н
0000344443 00000 н
0000344606 00000 н
0000344766 00000 н
0000344929 00000 н
0000345092 00000 н
0000345255 00000 н
0000345422 00000 н
0000345592 00000 н
0000345755 00000 н
0000345915 00000 н
0000346088 00000 н
0000346251 00000 н
0000346411 00000 н
0000346574 00000 н
0000346737 00000 н
0000346925 00000 н
0000347088 00000 н
0000347251 00000 н
0000347421 00000 н
0000347584 00000 н
0000347747 00000 н
0000347907 00000 н
0000348067 00000 н
0000348237 00000 н
0000348400 00000 н
0000348560 00000 н
0000348723 00000 н
0000348880 00000 н
0000349040 00000 н
0000349200 00000 н
0000349360 00000 н
0000349520 00000 н
0000349683 00000 н
0000349840 00000 н
0000350003 00000 н
0000350166 00000 н
0000350329 00000 н
0000350489 00000 н
0000350649 00000 н
0000350812 00000 н
0000350979 00000 н
0000351142 00000 н
0000351305 00000 н
0000351465 00000 н
0000351635 00000 н
0000351795 00000 н
0000351955 00000 н
0000352115 00000 н
0000352275 00000 н
0000352435 00000 н
0000352595 00000 н
0000352758 00000 н
0000352921 00000 н
0000353084 00000 н
0000353247 00000 н
0000353407 00000 н
0000353577 00000 н
0000353737 00000 н
0000353897 00000 н
0000354057 00000 н
0000354220 00000 н
0000354387 00000 н
0000354550 00000 н
0000354710 00000 н
0000354877 00000 н
0000355037 00000 н
0000355197 00000 н
0000355360 00000 н
0000355520 00000 н
0000355687 00000 н
0000355850 00000 н
0000356010 00000 н
0000356170 00000 н
0000356327 00000 н
0000356487 00000 н
0000356650 00000 н
0000356807 00000 н
0000356967 00000 н
0000357127 00000 н
0000357284 00000 н
0000357447 00000 н
0000357610 00000 н
0000357773 00000 н
0000357930 00000 н
0000358087 00000 н
0000358247 00000 н
0000358410 00000 н
0000358570 00000 н
0000358733 00000 н
0000358893 00000 н
0000359056 00000 н
0000359219 00000 н
0000359379 00000 н
0000359539 00000 н
0000359699 00000 н
0000359856 00000 н
0000360019 00000 н
0000360182 00000 н
0000360342 00000 н
0000360502 00000 н
0000360665 00000 н
0000360825 00000 н
0000360988 00000 н
0000361151 00000 н
0000361311 00000 н
0000361471 00000 н
0000361634 00000 н
0000361794 00000 н
0000361954 00000 н
0000362114 00000 н
0000362277 00000 н
0000362437 00000 н
0000362597 00000 н
0000362757 00000 н
0000362917 00000 н
0000363080 00000 н
0000363240 00000 н
0000363400 00000 н
0000363560 00000 н
0000363717 00000 н
0000363877 00000 н
0000364037 00000 н
0000364197 00000 н
0000364354 00000 н
0000364517 00000 н
0000364677 00000 н
0000364840 00000 н
0000365000 00000 н
0000365163 00000 н
0000365323 00000 н
0000365480 00000 н
0000365640 00000 н
0000365800 00000 н
0000365960 00000 н
0000366123 00000 н
0000366283 00000 н
0000366443 00000 н
0000366603 00000 н
0000366760 00000 н
0000366920 00000 н
0000367080 00000 н
0000367237 00000 н
0000367397 00000 н
0000367560 00000 н
0000367720 00000 н
0000367877 00000 н
0000368040 00000 н
0000368200 00000 н
0000368360 00000 н
0000368520 00000 н
0000368680 00000 н
0000368840 00000 н
0000369003 00000 н
0000369163 00000 н
0000369323 00000 н
0000369483 00000 н
0000369643 00000 н
0000369806 00000 н
0000369963 00000 н
0000370123 00000 н
0000370283 00000 н
0000370443 00000 н
0000370603 00000 н
0000370763 00000 н
0000370923 00000 н
0000371080 00000 н
0000371240 00000 н
0000371400 00000 н
0000371560 00000 н
0000371720 00000 н
0000371883 00000 н
0000372043 00000 н
0000372206 00000 н
0000372369 00000 н
0000372532 00000 н
0000372692 00000 н
0000372852 00000 н
0000373012 00000 н
0000373172 00000 н
0000373332 00000 н
0000373492 00000 н
0000373652 00000 н
0000373812 00000 н
0000373972 00000 н
0000374129 00000 н
0000374286 00000 н
0000374446 00000 н
0000374606 00000 н
0000374766 00000 н
0000374929 00000 н
0000375089 00000 н
0000375246 00000 н
0000375409 00000 н
0000375569 00000 н
0000375729 00000 н
0000375889 00000 н
0000376049 00000 н
0000376209 00000 н
0000376372 00000 н
0000376532 00000 н
0000376692 00000 н
0000376852 00000 н
0000377012 00000 н
0000377175 00000 н
0000377335 00000 н
0000377495 00000 н
0000377655 00000 н
0000377812 00000 н
0000377972 00000 н
0000378132 00000 н
0000378292 00000 н
0000378449 00000 н
0000378609 00000 н
0000378766 00000 н
0000378923 00000 н
0000379083 00000 н
0000379243 00000 н
0000379406 00000 н
0000379569 00000 н
0000379729 00000 н
0000379892 00000 н
0000380052 00000 н
0000380209 00000 н
0000380369 00000 н
0000380529 00000 н
0000380689 00000 н
0000380852 00000 н
0000381012 00000 н
0000381172 00000 н
0000381332 00000 н
0000381489 00000 н
0000381646 00000 н
0000381806 00000 н
0000381966 00000 н
0000382126 00000 н
0000382289 00000 н
0000382449 00000 н
0000382606 00000 н
0000382769 00000 н
0000382929 00000 н
0000383089 00000 н
0000383249 00000 н
0000383409 00000 н
0000383566 00000 н
0000383726 00000 н
0000383886 00000 н
0000384046 00000 н
0000384206 00000 н
0000384366 00000 н
0000384529 00000 н
0000384689 00000 н
0000384849 00000 н
0000385009 00000 н
0000385166 00000 н
0000385326 00000 н
0000385486 00000 н
0000385646 00000 н
0000385803 00000 н
0000385963 00000 н
0000386123 00000 н
0000386283 00000 н
0000386446 00000 н
0000386606 00000 н
0000386773 00000 н
0000386936 00000 н
0000387096 00000 н
0000387259 00000 н
0000387419 00000 н
0000387579 00000 н
0000387742 00000 н
0000387902 00000 н
0000388059 00000 н
0000388222 00000 н
0000388382 00000 н
0000388542 00000 н
0000388702 00000 н
0000388859 00000 н
0000389016 00000 н
0000389176 00000 н
0000389333 00000 н
0000389496 00000 н
0000389659 00000 н
0000389819 00000 н
0000389976 00000 н
00003 00000 н
00003 00000 н
00003 00000 н
00003 00000 н
00003 youtube.com/embed/nn5o2chMOh5?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/> 00000 н
00003 00000 н
00003
00000 н
0000391256 00000 н
0000391416 00000 н
0000391579 00000 н
0000391739 00000 н
0000391902 00000 н
0000392062 00000 н
0000392222 00000 н
0000392382 00000 н
0000392539 00000 н
0000392699 00000 н
0000392859 00000 н
0000393019 00000 н
0000393176 00000 н
0000393336 00000 н
0000393496 00000 н
0000393653 00000 н
0000393816 00000 н
0000393976 00000 н
0000394146 00000 н
0000394366 00000 н
0000394526 00000 н
0000394689 00000 н
0000394849 00000 н
0000395009 00000 н
0000395229 00000 н
0000395389 00000 н
0000395546 00000 н
0000395706 00000 н
0000395866 00000 н
0000396026 00000 н
0000396186 00000 н
0000396343 00000 н
0000396503 00000 н
0000396663 00000 н
0000396888 00000 н
0000397091 00000 н
0000397251 00000 н
0000397408 00000 н
0000397571 00000 н
0000397731 00000 н
0000397891 00000 н
0000398051 00000 н
0000398211 00000 н
0000398371 00000 н
0000398531 00000 н
0000398691 00000 н
0000398851 00000 н
0000399054 00000 н
0000399214 00000 н
0000399377 00000 н
0000399534 00000 н
0000399694 00000 н
0000399854 00000 н
0000400011 00000 н
0000400171 00000 н
0000400331 00000 н
0000400491 00000 н
0000400648 00000 н
0000400808 00000 н
0000400965 00000 н
0000401122 00000 н
0000401351 00000 н
0000401527 00000 н
0000401743 00000 н
0000401903 00000 н
0000402066 00000 н
0000402223 00000 н
0000402380 00000 н
0000402595 00000 н
0000402755 00000 н
0000402912 00000 н
0000403072 00000 н
0000403232 00000 н
0000403392 00000 н
0000403552 00000 н
0000403712 00000 н
0000403872 00000 н
0000404032 00000 н
0000404269 00000 н
0000404481 00000 н
0000404641 00000 н
0000404798 00000 н
0000404961 00000 н
0000405121 00000 н
0000405281 00000 н
0000405441 00000 н
0000405601 00000 н
0000405761 00000 н
0000405918 00000 н
0000406078 00000 н
0000406238 00000 н
0000406460 00000 н
0000406620 00000 н
0000406783 00000 н
0000406943 00000 н
0000407103 00000 н
0000407263 00000 н
0000407420 00000 н
0000407580 00000 н
0000407740 00000 н
0000407900 00000 н
0000408057 00000 н
0000408217 00000 н
0000408377 00000 н
0000408534 00000 н
0000408764 00000 н
0000408959 00000 н
0000409177 00000 н
0000409337 00000 н
0000409500 00000 н
0000409660 00000 н
0000409820 00000 н
0000410029 00000 н
0000410189 00000 н
0000410346 00000 н
0000410509 00000 н
0000410669 00000 н
0000410829 00000 н
0000410989 00000 н
0000411149 00000 н
0000411309 00000 н
0000411469 00000 н
0000411673 00000 н
0000411878 00000 н
0000412038 00000 н
0000412195 00000 н
0000412358 00000 н
0000412518 00000 н
0000412678 00000 н
0000412838 00000 н
0000413001 00000 н
0000413161 00000 н
0000413318 00000 н
0000413478 00000 н
0000413638 00000 н
0000413850 00000 н
0000414010 00000 н
0000414173 00000 н
0000414333 00000 н
0000414493 00000 н
0000414653 00000 н
0000414810 00000 н
0000414970 00000 н
0000415130 00000 н
0000415290 00000 н
0000415447 00000 н
0000415607 00000 н
0000415764 00000 н
0000415921 00000 н
0000416125 00000 н
0000416326 00000 н
0000416529 00000 н
0000416689 00000 н
0000416852 00000 н
0000417012 00000 н
0000417169 00000 н
0000417372 00000 н
0000417532 00000 н
0000417689 00000 н
0000417852 00000 н
0000418012 00000 н
0000418172 00000 н
0000418332 00000 н
0000418492 00000 н
0000418655 00000 н
0000418815 00000 н
0000419028 00000 н
0000419236 00000 н
0000419396 00000 н
0000419553 00000 н
0000419716 00000 н
0000419876 00000 н
0000420036 00000 н
0000420196 00000 н
0000420356 00000 н
0000420519 00000 н
0000420679 00000 н
0000420839 00000 н
0000420999 00000 н
0000421209 00000 н
0000421369 00000 н
0000421532 00000 н
0000421695 00000 н
0000421855 00000 н
0000422015 00000 н
0000422172 00000 н
0000422332 00000 н
0000422492 00000 н
0000422652 00000 н
0000422809 00000 н
0000422969 00000 н
0000423129 00000 н
0000423289 00000 н
0000423491 00000 н
0000423696 00000 н
0000423914 00000 н
0000424074 00000 н
0000424237 00000 н
0000424394 00000 н
0000424551 00000 н
0000424764 00000 н
0000424924 00000 н
0000425081 00000 н
0000425244 00000 н
0000425404 00000 н
0000425564 00000 н
0000425724 00000 н
0000425887 00000 н
0000426050 00000 н
0000426210 00000 н
0000426426 00000 н
0000426656 00000 н
0000426816 00000 н
0000426973 00000 н
0000427136 00000 н
0000427296 00000 н
0000427456 00000 н
0000427616 00000 н
0000427779 00000 н
0000427942 00000 н
0000428102 00000 н
0000428262 00000 н
0000428422 00000 н
0000428644 00000 н
0000428804 00000 н
0000428967 00000 н
0000429127 00000 н
0000429290 00000 н
0000429450 00000 н
0000429607 00000 н
0000429767 00000 н
0000429930 00000 н
0000430093 00000 н
0000430250 00000 н
0000430410 00000 н
0000430570 00000 н
0000430727 00000 н
0000430938 00000 н
0000431144 00000 н
0000431366 00000 н
0000431526 00000 н
0000431689 00000 н
0000431849 00000 н
0000432006 00000 н
0000432236 00000 н
0000432396 00000 н
0000432553 00000 н
0000432716 00000 н
0000432876 00000 н
0000433036 00000 н
0000433196 00000 н
0000433363 00000 н
0000433526 00000 н
0000433686 00000 н
0000433914 00000 н
0000434140 00000 н
0000434300 00000 н
0000434457 00000 н
0000434620 00000 н
0000434780 00000 н
0000434940 00000 н
0000435100 00000 н
0000435263 00000 н
0000435426 00000 н
0000435586 00000 н
0000435746 00000 н
0000435906 00000 н
0000436132 00000 н
0000436292 00000 н
0000436455 00000 н
0000436618 00000 н
0000436781 00000 н
0000436941 00000 н
0000437098 00000 н
0000437258 00000 н
0000437425 00000 н
0000437588 00000 н
0000437748 00000 н
0000437908 00000 н
0000438065 00000 н
0000438283 00000 н
0000438485 00000 н
0000438661 00000 н
0000438824 00000 н
0000438984 00000 н
0000439147 00000 н
0000439304 00000 н
0000439461 00000 н
0000439637 00000 н
0000439797 00000 н
0000439957 00000 н
0000440114 00000 н
0000440277 00000 н
0000440437 00000 н
0000440597 00000 н
0000440757 00000 н
0000440924 00000 н
0000441094 00000 н
0000441254 00000 н
0000441468 00000 н
0000441641 00000 н
0000441804 00000 н
0000441964 00000 н
0000442121 00000 н
0000442284 00000 н
0000442444 00000 н
0000442604 00000 н
0000442764 00000 н
0000442934 00000 н
0000443104 00000 н
0000443264 00000 н
0000443424 00000 н
0000443584 00000 н
0000443763 00000 н
0000443923 00000 н
0000444083 00000 н
0000444246 00000 н
0000444413 00000 н
0000444580 00000 н
0000444740 00000 н
0000444897 00000 н
0000445057 00000 н
0000445224 00000 н
0000445394 00000 н
0000445551 00000 н
0000445711 00000 н
0000445871 00000 н
0000446031 00000 н
0000446244 00000 н
0000446426 00000 н
0000446596 00000 н
0000446759 00000 н
0000446919 00000 н
0000447082 00000 н
0000447239 00000 н
0000447393 00000 н
0000447560 00000 н
0000447720 00000 н
0000447880 00000 н
0000448037 00000 н
0000448200 00000 н
0000448360 00000 н
0000448520 00000 н
0000448680 00000 н
0000448900 00000 н
0000449060 00000 н
0000449217 00000 н
0000449387 00000 н
0000449550 00000 н
0000449710 00000 н
0000449867 00000 н
0000450030 00000 н
0000450190 00000 н
0000450350 00000 н
0000450510 00000 н
0000450735 00000 н
0000450895 00000 н
0000451055 00000 н
0000451215 00000 н
0000451382 00000 н
0000451542 00000 н
0000451702 00000 н
0000451865 00000 н
0000452085 00000 н
0000452245 00000 н
0000452402 00000 н
0000452562 00000 н
0000452785 00000 н
0000452942 00000 н
0000453102 00000 н
0000453262 00000 н
0000453419 00000 н
0000453582 00000 н
0000453778 00000 н
0000453941 00000 н
0000454104 00000 н
0000454264 00000 н
0000454427 00000 н
0000454587 00000 н
0000454744 00000 н
0000454907 00000 н
0000455067 00000 н
0000455227 00000 н
0000455384 00000 н
0000455547 00000 н
0000455707 00000 н
0000455867 00000 н
0000456027 00000 н
0000456239 00000 н
0000456399 00000 н
0000456559 00000 н
0000456722 00000 н
0000456885 00000 н
0000457045 00000 н
0000457202 00000 н
0000457365 00000 н
0000457525 00000 н
0000457685 00000 н
0000457845 00000 н
0000458066 00000 н
0000458223 00000 н
0000458383 00000 н
0000458543 00000 н
0000458706 00000 н
0000458866 00000 н
0000459026 00000 н
0000459189 00000 н
0000459408 00000 н
0000459568 00000 н
0000459725 00000 н
0000459885 00000 н
0000460104 00000 н
0000460261 00000 н
0000460421 00000 н
0000460581 00000 н
0000460738 00000 н
0000460901 00000 н
0000461077 00000 н
0000461237 00000 н
0000461400 00000 н
0000461560 00000 н
0000461720 00000 н
0000461877 00000 н
0000462037 00000 н
0000462197 00000 н
0000462357 00000 н
0000462514 00000 н
0000462674 00000 н
0000462834 00000 н
0000462994 00000 н
0000463154 00000 н
0000463355 00000 н
0000463515 00000 н
0000463675 00000 н
0000463838 00000 н
0000464001 00000 н
0000464161 00000 н
0000464318 00000 н
0000464481 00000 н
0000464641 00000 н
0000464801 00000 н
0000464961 00000 н
0000465166 00000 н
0000465326 00000 н
0000465486 00000 н
0000465646 00000 н
0000465806 00000 н
0000465966 00000 н
0000466126 00000 н
0000466289 00000 н
0000466485 00000 н
0000466645 00000 н
0000466802 00000 н
0000466962 00000 н
0000467170 00000 н
0000467327 00000 н
0000467487 00000 н
0000467647 00000 н
0000467804 00000 н
0000467967 00000 н
0000468134 00000 н
0000468294 00000 н
0000468457 00000 н
0000468617 00000 н
0000468780 00000 н
0000468940 00000 н
0000469097 00000 н
0000469257 00000 н
0000469417 00000 н
0000469580 00000 н
0000469737 00000 н
0000469897 00000 н
0000470057 00000 н
0000470217 00000 н
0000470422 00000 н
0000470582 00000 н
0000470742 00000 н
0000470905 00000 н
0000471068 00000 н
0000471228 00000 н
0000471385 00000 н
0000471548 00000 н
0000471708 00000 н
0000471868 00000 н
0000472028 00000 н
0000472231 00000 н
0000472391 00000 н
0000472551 00000 н
0000472711 00000 н
0000472871 00000 н
0000473031 00000 н
0000473191 00000 н
0000473354 00000 н
0000473559 00000 н
0000473719 00000 н
0000473876 00000 н
0000474036 00000 н
0000474239 00000 н
0000474396 00000 н
0000474556 00000 н
0000474713 00000 н
0000474870 00000 н
0000475033 00000 н
0000475203 00000 н
0000475363 00000 н
0000475526 00000 н
0000475686 00000 н
0000475849 00000 н
0000476009 00000 н
0000476166 00000 н
0000476326 00000 н
0000476486 00000 н
0000476646 00000 н
0000476803 00000 н
0000476966 00000 н
0000477126 00000 н
0000477286 00000 н
0000477446 00000 н
0000477643 00000 н
0000477803 00000 н
0000477963 00000 н
0000478123 00000 н
0000478286 00000 н
0000478446 00000 н
0000478603 00000 н
0000478766 00000 н
0000478926 00000 н
0000479086 00000 н
0000479300 00000 н
0000479460 00000 н
0000479620 00000 н
0000479780 00000 н
0000479937 00000 н
0000480097 00000 н
0000480257 00000 н
0000480420 00000 н
0000480617 00000 н
0000480777 00000 н
0000480934 00000 н
0000481094 00000 н
0000481305 00000 н
0000481462 00000 н
0000481622 00000 н
0000481779 00000 н
0000481933 00000 н
0000482093 00000 н
0000482260 00000 н
0000482420 00000 н
0000482583 00000 н
0000482743 00000 н
0000482906 00000 н
0000483066 00000 н
0000483223 00000 n
0000483383 00000 n
0000483543 00000 n
0000483703 00000 n
0000483860 00000 n
0000484020 00000 n
0000484180 00000 n
0000484340 00000 n
0000484500 00000 n
0000484694 00000 n
0000484854 00000 н
0000485014 00000 n
0000485174 00000 n
0000485337 00000 n
0000485497 00000 n
0000485654 00000 n
0000485817 00000 n
0000485977 00000 n
0000486137 00000 n
0000486297 00000 n
0000486491 00000 n
0000486654 00000 n
0000486814 00000 n
0000486974 00000 н
0000487131 00000 n
0000487291 00000 n
0000487451 00000 n
0000487614 00000 n
0000487811 00000 n
0000487971 00000 n
0000488128 00000 n
0000488288 00000 n
0000488482 00000 n
0000488639 00000 n
0000488799 00000 n
0000488956 00000 n
0000489113 00000 n
0000489276 00000 n
0000489439 00000 n
0000489599 00000 n
0000489762 00000 n
0000489925 00000 n
00004 00000 n
00004 00000 n
00004 00000 n
00004 00000 n
00004
00000 n 00005 00000 n 00005 00000 n 0000591386 00000 n 0000591549 00000 n 0000591712 00000 n 0000591869 00000 n 0000592029 00000 n 0000592192 00000 n 0000592355 00000 n 0000592518 00000 n 0000592681 00000 n 0000592822 00000 n 0000592982 00000 n 0000593142 00000 n 0000593302 00000 n 0000593465 00000 n 0000593628 00000 n 0000593791 00000 n 0000593954 00000 n 0000594121 00000 n 0000594284 00000 n 0000594447 00000 n 0000594610 00000 n 0000594773 00000 n 0000594940 00000 n 0000595107 00000 n 0000595274 00000 n 0000595441 00000 n 0000595611 00000 n 0000595781 00000 n 0000595951 00000 n 0000596118 00000 n 0000596294 00000 n 0000596467 00000 n 0000596640 00000 n 0000596816 00000 n 0000596989 00000 n 0000597162 00000 n 0000597335 00000 n 0000597508 00000 n 0000597693 00000 n 0000597881 00000 n 0000598066 00000 n 0000598254 00000 n 0000598442 00000 n 0000598627 00000 n 0000598812 00000 n 0000599000 00000 n 0000599228 00000 n 0000599463 00000 n 0000599686 00000 n 0000599914 00000 n 0000600130 00000 n 0000600347 00000 n 0000600562 00000 n 0000600771 00000 n 0000600989 00000 n 0000601212 00000 n 0000601432 00000 n 0000601651 00000 n 0000601880 00000 n 0000602107 00000 n 0000602337 00000 n 0000602548 00000 n 0000602757 00000 n 0000602966 00000 n 0000603160 00000 n 0000603354 00000 n 0000603548 00000 n 0000603738 00000 n 0000603932 00000 n 0000604127 00000 n 0000604380 00000 n 0000604662 00000 n 0000604917 00000 n 0000605175 00000 n 0000605430 00000 n 0000605683 00000 n 0000605944 00000 n 0000606201 00000 n 0000606448 00000 n 0000606703 00000 n 0000606956 00000 n 0000607208 00000 n 0000607457 00000 n 0000607712 00000 n 0000607963 00000 n 0000608221 00000 n 0000608478 00000 n 0000608730 00000 n 0000608982 00000 n 0000609237 00000 n 0000609487 00000 n 0000609743 00000 n 0000609996 00000 n 0000610251 00000 n 0000610508 00000 n 0000610759 00000 n 0000611009 00000 n 0000611266 00000 n 0000611524 00000 n 0000611776 00000 n 0000612025 00000 n 0000612282 00000 n 0000612544 00000 n 0000612808 00000 n 0000613071 00000 n 0000613337 00000 n 0000613598 00000 n 0000613855 00000 n 0000614117 00000 n 0000614377 00000 n 0000614627 00000 n 0000614882 00000 n 0000615138 00000 n 0000615386 00000 n 0000615636 00000 n 0000615885 00000 n 0000616140 00000 n 0000616387 00000 n 0000616632 00000 n 0000616890 00000 n 0000617137 00000 n 0000617386 00000 n 0000617637 00000 n 0000617886 00000 n 0000618135 00000 n 0000618387 00000 n 0000618632 00000 n 0000618881 00000 n 0000619132 00000 n 0000619374 00000 n 0000619621 00000 n 0000619871 00000 n 0000620168 00000 n 0000620465 00000 n 0000620759 00000 n 0000621052 00000 n 0000621341 00000 n 0000621630 00000 n 0000621916 00000 n 0000622212 00000 n 0000622500 00000 n 0000622799 00000 n 0000623091 00000 n 0000623387 00000 n 0000623689 00000 n 0000623988 00000 n 0000624279 00000 n трейлер ]>> startxref 0 %%EOF 660 0 obj>stream хХ pT>wMdHj-X;caiDeeZh;}7l7& yK’$ȂAڊF ؐOku,PhsϽ7vo}{w=[
Is C2h5 Polar Or Nonpolar
Ethylene (C2h5) is an organic compound that consists of hydrogen and carbon. Это бесцветный легковоспламеняющийся газ с мускусным и сладким запахом.
Это бесцветный легковоспламеняющийся газ с мускусным и сладким запахом.
C2h5 имеет две молекулы Ch и четыре молекулы H. При окислении этилена образуется оксид этилена, а при гидролизе этилена образуется этиленгликоль.
Ethelene содержит гормон, который в основном известен для роста и развития растений.
Вам интересно, C2h5 полярный или неполярный? Вам не нужно беспокоиться об этом, потому что эта статья поможет вам прояснить все ваши сомнения.
Этилен (C2h5) — нетоксичный газ, снижающий концентрацию кислорода в воздухе для дыхания.
Формула:
Формула этилена C 2 H 4 или H 2 C=CH 2 .
Общее имя:
Обычное название этана – биметил или диметил.
C2h5 полярный или неполярный
Этилен (C2h5)Объяснение 1:
Этилен (C2h5) представляет собой неполярную молекулу из-за особого внешнего вида неполярной ковалентной связи C-H. В C2h5 имеется избыточное количество неполярных ковалентных связей C-H. Атомы водорода расположены симметрично, окружая два атома углерода.
В C2h5 имеется избыточное количество неполярных ковалентных связей C-H. Атомы водорода расположены симметрично, окружая два атома углерода.
Пояснение 2:
Этилен (C2h5) представляет собой неполярную молекулу , поскольку форма молекулы подобна двум симметричным треугольникам. В C2h5 электроотрицательность C и H различна, связи C-H полярны, а связь C-C неполярна. Кроме того, распределение заряда равномерное, поскольку молекула становится симметричной, что приводит к неполярной молекуле.
Пояснение 3:
Этилен (C2h5) представляет собой неполярную молекулу , поскольку электроотрицательность обоих атомов очень похожа. Электроотрицательность водорода 2,2, а электроотрицательность углерода 2,55. Водородно-углеродные связи неполярны, что приводит к полярной молекуле.
Пояснение 4:
Этилен (C2h5) представляет собой неполярную молекулу из-за своей геометрической формы. Кроме того, дипольный момент C2h5 равен нулю, что приводит к неполярной молекуле.
Кроме того, дипольный момент C2h5 равен нулю, что приводит к неполярной молекуле.
При этом также важно знать полярность I2, SF3 и BF3.
РезюмеC2h5 неполярен из-за своей формы и в основном такой же электроотрицательности.
C2h5 Молекулярная геометрия
Молекулярная геометрия C2h5 представляет собой тригональную плоскость относительно углерода слева и справа. Многих смущает, что C2h5 тетраэдрический, но это не тетраэдрический C2h5 имеет треугольную плоскую форму.
Предполагается, что молекулярная форма представляет собой плоский треугольник вокруг каждого атома углерода.
РезюмеВсе просто: молекулярная геометрия C2h5 является тригонально-плоской.
Структура Льюиса C2h5
Точечная диаграмма C2h5 В структуре Льюиса C2h3 необходимо использование двойной связи.
Чтобы нарисовать структуру Льюиса C2h5, , следуйте приведенным ниже инструкциям.
- Прежде всего, найдите общее количество валентных электронов в C2h5 с помощью таблицы Менделеева.
- Углерод находится в четвертой группе, но иногда пишется как 14, поэтому у него четыре валентных электрона. Водород находится в группе 1 и имеет один валентный электрон.
- Как только вы узнаете, что электронная валентность углерода умножается на 2, что становится 4(2)=8, теперь проделайте тот же процесс с водородом 1(4)=4. Добавьте валентные электроны водорода + углерода, чтобы найти общее количество валентных электронов. 4+8= 12.
- Всего у нас есть 12 валентных электронов, распределите их по кругу.
- Поместите водород снаружи углерода, как показано на рисунке выше.
- Поместите два электрона между каждой связью, чтобы образовалась химическая связь.
- Возьмите два валентных электрона в центре, чтобы образовать двойную связь.

- Убедитесь, что водород имеет два валентных электрона, чтобы их октет был заполнен.
Если вы не поняли последние шаги, посмотрите это видео.
Резюме
Попробуйте нарисовать саму структуру Льюиса C2h5, не просматривая видео.Как только вы нарисуете это так, сравните это с видео и посмотрите, сделали ли вы какие-либо ошибки, исправьте их.
Гибридизация этена (C2h5)
C2h5 имеет 2 молекулы CH и 4 H, а атом углерода содержит 6 электронов. Атом водорода имеет 1 электрон.
Гибридизация C2h5 представляет собой sp2 , между двумя атомами углерода образуются сигма- и пи-связи.
Молекула этилена имеет sp2-гибридизацию.
Угол связи этилена (C2h5)
В этилене (C2h5) каждый валентный угол H-C-H равен 116.6°, а каждый валентный угол HCC равен 121,7°.
В углерод-углеродном двойнике нет свободного вращения, и все шесть атомов этилена лежат в одной плоскости.
РезюмеВалентный угол C2h5 равен 120°.
является C2h5 ионным или ковалентным
C2h5 имеют двойную ковалентную связь , потому что структура C2h5 состоит из двойной ковалентной связи между двумя атомами углерода. Вы хотите найти связь с помощью уловки? Вот как найти ионную или ковалентную связь.
РезюмеПросто C2h5 имеет двойную ковалентную связь.
представляет собой C2h5 кислоту или основание Льюиса
C2h5 является основанием, а не кислотой Льюиса. Если кто-нибудь спросит вас, какая из следующих кислот не является кислотой Льюиса? каков будет ваш ответ? Не читайте ответ ниже.
Ответ:
C2h5 не является кислотой Льюиса, поскольку молекулы BF3 и FeCl3 в центральном атоме имеют неполный октет. SiF4 в центральном атоме, и, согласно концепции Льюиса, эти три являются кислотой Льюиса.
РезюмеПросто C2h5 является основанием, а не кислотой Льюиса.
Свойства этилена (C2h5)
- Молярная масса C2h5 составляет 28,054 г·моль−1.
- Кислотность 44.
- Мало растворим в воде.
- Растворимость C2h5 в диэтиловом эфире хорошая.
- C2h5 легко воспламеняется.
- Его температура кипения составляет -103,7 ° C (-154,7 ° F, 169,5 K), а температура плавления составляет -169,2 ° C (-272,5 ° C).6 °F; 104,0 К).
Выше приведены некоторые свойства C2h5.
Использование этилена (C2h5)
- Основным применением этилена является производство полимера.

- C2h5 используется в пластмассовой промышленности.
- Используется во всем мире для созревания фруктов.
- Также используется для приготовления соды.
- Этен используется для изготовления моющих средств, это химическое вещество, используемое для разрушения и удаления жира.
Выше приведены несколько вариантов использования C2h5.
Связанные вопросы
Почему этан важен?
Этен очень важен из-за углеводорода, который имеет более одного атома углерода. Это соединение имеет большое промышленное значение, и этен используется в качестве строительного блока в нефтехимической промышленности.
Этен используется для производства пластика?
Да, этилен используется для производства пластика, как я говорил об использовании этилена в производстве пластмасс.Полиэтилен получают из этилена, что также называют полимеризацией. Как известно, пластик предполагает только один материал, а пластические полимеры бывают разные. Поэтому этилен является важным сырьем для пластика.
Поэтому этилен является важным сырьем для пластика.
Какой растительный гормон отвечает за созревание плодов?
Гормон этилен отвечает за созревание плодов. Многие люди используют различные методы для увеличения производства этилена.
Что такое этилен и его функции?
Этилен играет очень важную роль в росте растений.Они стимулируют цветки, листья и способствуют созреванию плодов.
Вреден ли этилен для человека?
Да, этилен вреден для человека. Это может вызвать головные боли, усталость и головокружение. Этилен является легковоспламеняющимся и реакционноспособным химическим веществом, которое создает опасность возгорания и взрыва.
Последние мысли
Все дело в том, является ли C2h5 полярным или неполярным. Надеюсь, теперь вам ясно, что C2h5 — неполярная молекула из-за одинаковой электроотрицательности обоих атомов.
Молекулярная геометрия C2h5 является тригонально-плоской, выше приведено объяснение его структуры Льюиса.
Этилен (C2h5) имеет sp2-гибридизацию, и его валентный угол составляет от 116,6° до 121,7°.
Этилен представляет собой ковалентную связь и основание Льюиса. Он мало растворим в воде.
Как вы думаете, мы что-то упустили в теме C2h5? Дайте нам знать в разделе комментариев ниже, мы добавим их.
В чем разница между валентными электронами и валентностью элемента? – Легче с практикой.ком
В чем разница между валентными электронами и валентностью элемента?
Количество электронов, которые атом разделяет, теряет или приобретает во время химической реакции, называется валентностью элемента. Самая внешняя оболочка атома называется «валентной оболочкой», а электроны, присутствующие в этой оболочке, называются «валентными электронами».
Чем отличаются валентные электроны элементов в группе?
Элементы каждой группы имеют одинаковое количество электронов на внешней орбитали.Эти внешние электроны также называются валентными электронами. Это электроны, участвующие в химических связях с другими элементами. Каждый элемент в первом столбце (группа один) имеет один электрон на внешней оболочке.
Это электроны, участвующие в химических связях с другими элементами. Каждый элемент в первом столбце (группа один) имеет один электрон на внешней оболочке.
Какая связь между валентными электронами и элементами одной группы периодической таблицы?
Расположение периодической таблицы заставляет нас визуализировать определенные тенденции среди атомов. Вертикальные столбцы (группы) таблицы Менделеева расположены так, что все ее элементы имеют одинаковое количество валентных электронов.Таким образом, все элементы в пределах определенной группы имеют схожие свойства.
В чем разница между валентными электронами и числом валентности?
Валентность атома/элемента – это количество связей, которые он может образовать вокруг себя. Валентные электроны обычно находятся на внешней оболочке элемента и принимают участие в образовании химических связей.
Почему XE может иметь более 8 валентных электронов?
Xe не соответствует правилу октетов. Ксенон, имеющий валентные электроны на 4-м энергетическом уровне, также будет иметь доступ к 4-му подуровне, что позволяет иметь более 8 электронов. XeF4 представляет собой d2sp3-гибридизацию и содержит 2 неподеленные пары и 4 связывающие пары валентных электронов вокруг ксенона.
XeF4 представляет собой d2sp3-гибридизацию и содержит 2 неподеленные пары и 4 связывающие пары валентных электронов вокруг ксенона.
Может ли Xe иметь 12 валентных электронов?
подождите Хе может иметь до 12 валентных электронов, но на этом рисунке их всего 10? Если вы посмотрите видео, Сал объясняет, как иногда атомы могут оставаться стабильными и удерживать «лишние» или «меньше» валентных электронов, тогда они на самом деле тоже предполагаются. Так что в этом случае «Xe» может удерживать 2 дополнительных валентных электрона и при этом оставаться стабильным.
Является ли C2h5 тетраэдрическим?
В C2h5 C гибридизован sp2 и имеет плоскую геометрию.В C2H6 C находится в состоянии sp3-гибридизации и имеет тетраэдрическую геометрию. Вот почему C2h5 плоский, а C2H6 неплоский.
sp3, sp2 и sp Гибридизация в органической химии с практическими задачами
Начнем с ответа на вопрос: зачем нам нужна теория гибридизации?
Вот один из ответов на это. Экспериментально подтверждено, что атом углерода в метане (СН 4 ) и других алканах имеет тетраэдрическую геометрию. Напоминание о том, что в тетраэдрической геометрии всех ангелов 109.5 o и связи имеют одинаковую длину. Помните также, что ковалентные связи образуются в результате перекрытия орбиталей и совместного использования двух электронов между атомами. Итак, чтобы предсказать валентность и геометрию атома углерода, мы рассмотрим его электронную конфигурацию и орбитали.
Экспериментально подтверждено, что атом углерода в метане (СН 4 ) и других алканах имеет тетраэдрическую геометрию. Напоминание о том, что в тетраэдрической геометрии всех ангелов 109.5 o и связи имеют одинаковую длину. Помните также, что ковалентные связи образуются в результате перекрытия орбиталей и совместного использования двух электронов между атомами. Итак, чтобы предсказать валентность и геометрию атома углерода, мы рассмотрим его электронную конфигурацию и орбитали.
C – 1s 2 2s 2 2p 2
Валентные электроны находятся на 2s- и 2p-орбиталях и участвуют в связывании и химических реакциях.
Из электронной конфигурации видно, что невозможно сделать четыре, идентичных по длине связи, энергии и всему остальному (вырожденных) связей, потому что одна из орбиталей является сферической s , а остальные три являются p орбиталей. И здесь нам нужна теория, которая может помочь нам объяснить известную геометрию и валентность атома углерода во многих органических молекулах. Итак,
Итак,
Гибридизация — это теория, которая используется для объяснения определенной молекулярной геометрии, которая иначе была бы невозможна.
Теперь давайте посмотрим, как это происходит, на примере метана. На первом этапе один электрон перескакивает с 2s-орбитали на 2p-орбиталь. Это приводит к возбужденному состоянию углерода:
Обратите внимание, что электрон идет в гору, так как p-подоболочка выше по энергии, чем s-подоболочка и это энергетически невыгодно, но мы увидим, как это компенсируется в следующий шаг, когда орбитали смешиваются (гибридизируются).
Итак, на следующем этапе орбитали s и p углерода в возбужденном состоянии гибридизуются, образуя четыре идентичных по размеру, форме и энергии орбиталей.
Количество гибридных орбиталей всегда равно количеству смешанных орбиталей. Итак, четыре орбитали (одна 2s + три 2p) смешаны, и в результате получается четыре sp 3 орбитали. Это гибридные орбитали, которые чем-то похожи на s- и p-орбитали. И снова мы называем их sp 3 , потому что они состоят из одной s-орбитали и трех p-орбиталей.
Это гибридные орбитали, которые чем-то похожи на s- и p-орбитали. И снова мы называем их sp 3 , потому что они состоят из одной s-орбитали и трех p-орбиталей.
Образование этих вырожденных гибридных орбиталей компенсирует энергию в гору перехода s-p, поскольку они имеют более низкую энергию, чем p-орбитали.
Четыре sp 3 -гибридизированных орбиталей образуют тетраэдрическую геометрию и образуют связи, перекрывая s-орбитали четырех атомов водорода: это объясняет симметричную геометрию метана (CH 4 ), где все связи имеют одинаковую длину и валентный угол.
Все четыре связи C–H в метане являются одинарными связями, которые образованы прямыми (или конечными) перекрытиями sp 3 орбиталей углерода и s-орбиталей каждого водорода.
Связи, образующиеся при прямом перекрытии орбиталей, называются σ (сигма) связями, потому что электронная плотность сосредоточена на оси, соединяющей атомы С и Н.
Если вместо одного водорода подключить другой sp3-гибридизированный углерод, то получится этан:
И, следовательно, во всех алканах имеется представляет собой сигма-связь между атомами углерода и атомами углерода-водорода, а атомы углерода sp3 гибридизуются с тетраэдрической геометрией:
. Чтобы обобщить это, любой атом с четырьмя группами (либо атом, либо неподеленная пара) равен sp 3 гибрид.И на это можно посмотреть так: чтобы четыре группы находились как можно дальше друг от друга, как мы узнали из теории VSEPR, группы должны находиться на одинаковых четырех орбиталях, что возможно только в . sp 3 гибридизация.
Например, какова гибридизация кислорода в следующей молекуле?
Кислород связан с двумя атомами и имеет две неподеленные пары. Всего – четыре группы, и поэтому sp 3 гибридизированы.
При образовании атома углерода в возбужденном состоянии гибридизация sp 3 не является единственным вариантом смешения орбиталей. Гибридизация sp 2 происходит, когда s-орбиталь смешивается только с двумя p-орбиталями, в отличие от трех p-орбиталей в гибридизации sp 3 . Итак, три орбитали смешиваются, и в результате получаются три гибридные орбитали, которые называются sp 2 гибридными орбиталями .
Полученные 3 sp 2 орбитали затем располагаются в тригональной плоской геометрии (120 o ). Важным отличием здесь от гибридизации sp 3 является оставленная (негибридизированная) орбиталь p , которая не участвовала в гибридизации. Этот орбит размещен на 90 O до самолета тригональной плоской компоновки 3 SP 2 Orbitals:
Гибридизация углерода в этилен-C 2 H 4 sp 2 гибридизованные атомы углерода могут образовывать сигма-связь путем перекрывания одной из трех sp 2 орбиталей и связываться с двумя атомами водорода каждый, и два атома водорода образуют сигма-связи с каждым атомом углерода путем перекрытия их 7 s орбиталей с двумя другими sp 2 орбиталями.
Это дает три связи для каждого атома углерода и одну оставшуюся р-орбиталь. Помните, что стандартная валентность углерода равна четырем, и ему нравится иметь четыре связи.
Эта четвертая связь образована параллельным перекрытием двух 2p-орбиталей на каждом углероде. Этот тип связи путем перекрывания орбиталей бок о бок называется π-связью .
Итак, два атома углерода в этилене, первом члене семейства алкенов, имеют двойную связь. В каждой двойной связи имеется одна сигма и одна π связь .
Вот некоторые ключевые параметры sp 2 гибридизации и двойных связей, которые вам необходимо знать:
* Все атомы двойной связи находятся в одной плоскости.
* Угол между атомами равен 120 o .
* Угол между плоскостью и p-орбиталями равен 90 o .
При sp-гибридизации s-орбиталь углерода в возбужденном состоянии смешивается только с одной из трех 2p-орбиталей. Это называется sp гибридизацией, потому что смешаны две орбитали (одна s и одна p): негибридизованные 2p-орбитали расположены в положениях 90 o :
Давайте посмотрим, как это происходит в ацетилен-C2h3.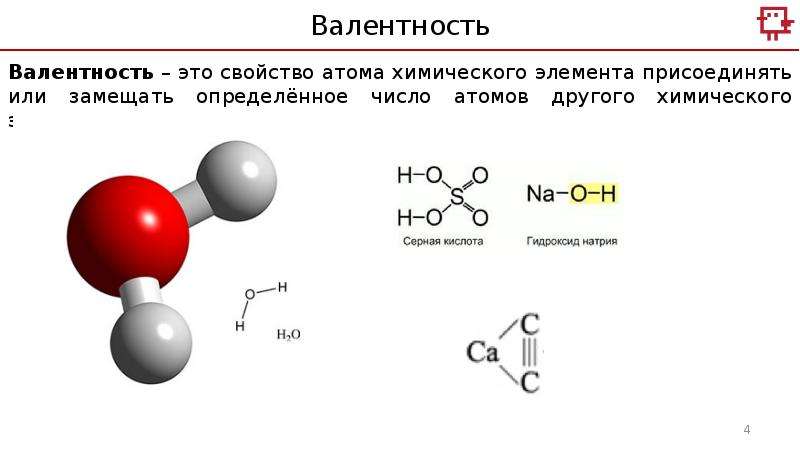
 Ковалентная связь: малые молекулы и свойства
Ковалентная связь: малые молекулы и свойства
