Краткий конспект подготовки к ЗНО по химии №10 Кислоты
Подготовка к ВНО. Химия.
Конспект 10. Кислоты
Общая характеристика кислот
Кислота – это сложное вещество, содержащие один или несколько атомов водорода, способных при химических реакциях замещаться на атомы металла и кислотного остатка.
Кислотным остатком называют часть молекулы кислоты, соединенную с атомом водорода
При замещении водорода в кислотах металлами, кислотные остатки переходят в неизменном виде в состав образующихся веществ – солей. Если кислотный остаток в кислоте соединен с одним атомом водорода, то он одновалентен, если с двумя — двухвалентен, если с тремя – трехвалентен и т.д.
Валентность кислотного остатка определяется количеством атомов водорода в кислоте.
Формулы и названия важнейших кислот указаны в таблице.
Важнейшие неорганические кислоты.
Одним из представителей органических кислот является уксусная кислота .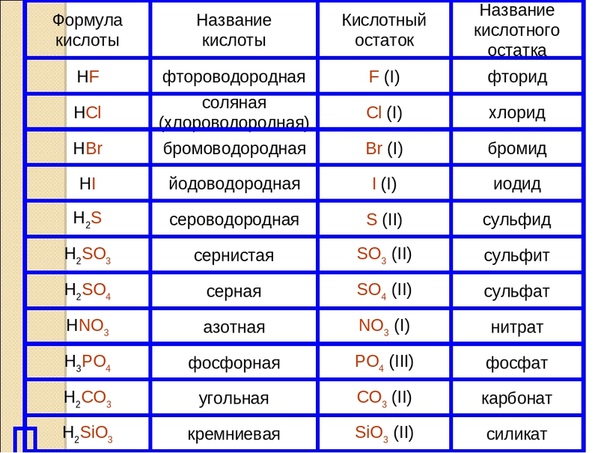
Кислоты в природе
Слово «кислота» по значению связано со словом «кислый», так как имеют общий корень. Отсюда следует, что растворы всех кислот имеют кислый вкус.
Несмотря на это, не следует пробовать на вкус никакие растворы кислот, так как некоторые из них относятся к едким и ядовитым растворам.
Природные источники кислот.
В природе встречается много кислот: лимонная кислота в лимонах, яблочная кислота – в яблоках, щавелевая кислота – в листьях щавеля.
Муравьи защищаются от врагов, выбрасывая едкие капельки муравьиной кислоты. (Она же содержится в пчелином яде и жгучих волосках крапивы.)
При прокисании виноградного сока получается всем известная уксусная кислота (уксус), а при прокисании молока – молочная кислота, та же самая молочная кислота получается при квашении капусты.
Классификация кислот
Кислоты делят на несколько групп. К каждой группе принадлежат кислоты, сходные по определенным признакам.
1. Существуют бескислородные и кислородсодержащие кислоты. Название этих групп указывает на наличие или отсутствие в молекуле кислоты атомов кислорода.
2. Другой признак классификации кислот – количество атомов водорода в кислоте. Соответствующую характеристику кислоты называют основностью. Существуют одно-, двух-, трехосновные кислоты.
3. Приведем еще один признак классификации кислот, как электролитов по степени электролитической диссоциации. Кислота – это электролит, водный раствор которого содержит катионы водорода и анионы кислотного остатка. Если электролит диссоциирует практически нацело – это сильный электролит. Электролит, степень диссоциации которого мала, это слабый электролит.
| Признак классификации | ||
| Степень электролитической диссоциации | Сильные кислоты | |
| Слабые кислоты | ||
Физические свойства кислот
Агрегатное состояние.
При обычных условиях кислоты могут быть твердыми веществами(ортофосфорная , кремниевая ) и жидкостями (в чистом виде жидкостью будет серная кислота ).
Такие газы как хлороводород , бромоводород , сероводород , в водных растворах образуют соответствующие кислоты.
Цвет.
Водные растворы соляной, азотной, серной, ортофосфорной и ряда других кислот не имеют окраски. Водные растворы хромовой кислоты имеют желтую окраску, марганцевой кислоты – малиновую.
Некоторые кислоты имеют запах. Например, кислоты: .
Растворением в воде сероводорода получают сероводородную кислоту .Тухлые яйца пахнут сероводородом. К особым свойствам этой кислоты относится то, что она не очень едкая и очень ядовита.
Растворимость, летучесть и стабильность некоторых кислот.
Меры предосторожности
Серная, соляная, уксусная кислоты могут вызывать сильные ожоги, разрушать ткани. Поэтому при работе с кислотами необходимо соблюдать меры предосторожности.
Если кислота попала на одежду или на поверхность тела, то её необходимо очень быстро смыть большим количеством проточной воды или нейтрализовать нашатырным спиртом.
Если кислота попала на деревянную, металлическую или на другие поверхности, то ее нейтрализуют известью, мелом или содой. Кислоты необходимо хранить в хорошо укупоренной посуде в недоступном месте для детей, и обязательно на таре должна быть бирка с названием кислоты.
При приготовлении раствора серной кислоты необходимо следовать следующему правилу: Кислоту льют в воду тонкой струйкой по стенке стеклянной посуды, но не наоборот.
Химические свойства кислот
1. Действие на индикаторы.
Кислоты в водных растворах изменяют окраску индикаторов.
В кислой среде фиолетовый лакмус приобретает красную окраску. Метиловый оранжевый – красную, а фенолфталеиновый – бесцветный. Если в раствор кислоты добавим по несколько капель универсального индикатора, он также поменяет окраску на красную.
Метиловый оранжевый – красную, а фенолфталеиновый – бесцветный. Если в раствор кислоты добавим по несколько капель универсального индикатора, он также поменяет окраску на красную.
2. Реакция с металлами.
Кислоты взаимодействуют с металлами, стоящими в ряду активности металлов до водорода. При этом получается соль и выделяется водород.
Металлы, расположенные в ряду активности металлов до водорода, вытесняют водород из кислот. Каждый предыдущий металл активнее, чем каждый последующий.
↑
Эта реакция относится к реакциям замещения.
Реакцию между простым и сложным веществами, в результате которой образуются новые простое и сложное вещества, называют реакцией замещения.
При реакциях азотной кислоты и концентрированной серной кислоты с металлами образуются соли, но водород не выделяется.
3. Реакция с основными и амфотерными оксидами с образованием соли и воды.
4. Реагируют с основаниями.
Реакция нейтрализации – реакция между кислотой и основанием, в результате которой получается соль и вода.
5.Реакция с солями.
Реакции кислот с солями не всегда возможны.
А. Кислоты реагируют с растворами солей, если в результате реакции один из продуктов выпадает в осадок.
↓
↓
Б. Если кислота – продукт является летучей, происходит от газообразного соединения или разлагается с образованием газа.
(тв.) (конц.) ↑
Сокращение (тв.) означает «твердое вещество», а (конц.) – «концентрированный раствор».
В. Если кислота, которая вступает в реакцию, является сильной, а кислота, которая образуется, – слабой.
Пользуясь вытеснительным рядом кислот можно предсказать течение реакции. Каждая предыдущая кислота может вытеснить из соли последующую.
Например,
↑,
но не будет происходить реакция между , потому что в слабее и не вытеснит её из соли этой кислоты.
Вытеснительный ряд кислот.
Взаимодействие кислот с солями также относится к реакциям обмена.
6. Термическое разложение кислородсодержащих кислот.
Кислородсодержащие кислоты при нагревании, а угольная кислота и сернистая в обычных условиях, разлагаются с образованием соответствующих кислотных оксидов и воды:
Химические свойства кислот можно обобщить таким образом:
А. Изменяют цвет индикаторов
Б. Реагируют с металлами
В. Реагируют с основными и амфотерными оксидами
Г. Реагируют с основаниями
Д. Реагируют с солями (более слабых и летучих кислот)
Е. Некоторые кислоты разлагаются при нагревании.
Применение кислот
В промышленности.
Наибольшее применение получили серная, соляная, азотная и ортофосфорная кислоты. Их получают на химических заводах в больших количествах.
Их получают на химических заводах в больших количествах.
| Кислота | Область применения |
| Производство других кислот, солей, удобрений, красителей, лекарств, очистка нефтепродуктов. Серную кислоту, за счет ее свойств поглощать большие количества воды, используют для осушения. Применяется для приготовления аккумуляторной кислоты. | |
| Производство солей, красок, лекарств. | |
| Производство удобрений, красителей, взрывчатых веществ. | |
| Производство удобрений, моющих средств. |
В медицине.
Борная кислота — находит применение в медицине (борная мазь).

Раствор соляной (хлороводородной) кислоты применяется для лечения заболеваний желудочно-кишечного тракта (гастрит, панкреатит).
В быту.
Лимонная кислота используется для выведения всевозможных пятен: от вина, различных ягод, красок, ржавчины, чернил.
Щавелевая кислота применяется для удаления пятен от чернил, краски, ржавчины. Кристаллическая кислота может вызвать ожоги слизистых оболочек ротовой полости, пищевода и желудка. Является ядовитым веществом.
Борная кислота – в качестве микроудобрения и средства для борьбы с тараканами и домовыми муравьями.
Уксусная кислота применяется либо в виде столового уксуса, с концентрацией кислоты до 9% или в виде 80 %-ной эссенции. Разбавленная кислота не действует на металлы, ткани растительного и животного происхождения, покровы человека и животных. Уксус применяется в качестве приправы к блюдам, удаления фруктовых пятен с тканей.
 Применяется для очистки от известкового налета раковины эмалированные и фаянсовые, унитазы, умывальники. Можно применять для очистки тканей от ржавых пятен, чернил (готовится слабый раствор кислоты). Соляная кислота разрушает ткани, изготовленные из льна, хлопка, искусственного шелка. При попадании на кожу вызывает химические ожоги.
Применяется для очистки от известкового налета раковины эмалированные и фаянсовые, унитазы, умывальники. Можно применять для очистки тканей от ржавых пятен, чернил (готовится слабый раствор кислоты). Соляная кислота разрушает ткани, изготовленные из льна, хлопка, искусственного шелка. При попадании на кожу вызывает химические ожоги.Азотная кислота в быту используется только в виде разбавленных растворов для чистки изделий, в первую очередь из благородных металлов.
Общие способы получения кислот
1. Бескислородные кислоты получают при растворении в воде газообразных соединений неметаллов с водородом. Так, например, соляная кислота получается в результате растворения газа хлороводорода в воде, сероводородная кислота получается в результате растворения газа сероводорода в воде.
2. Кислородсодержащие кислоты можно получить взаимодействием соответствующих кислотных оксидов с водой.
3. Получение кислот вытеснением из солей слабых кислот сильными, летучих нелетучими, растворимых – нерастворимыми.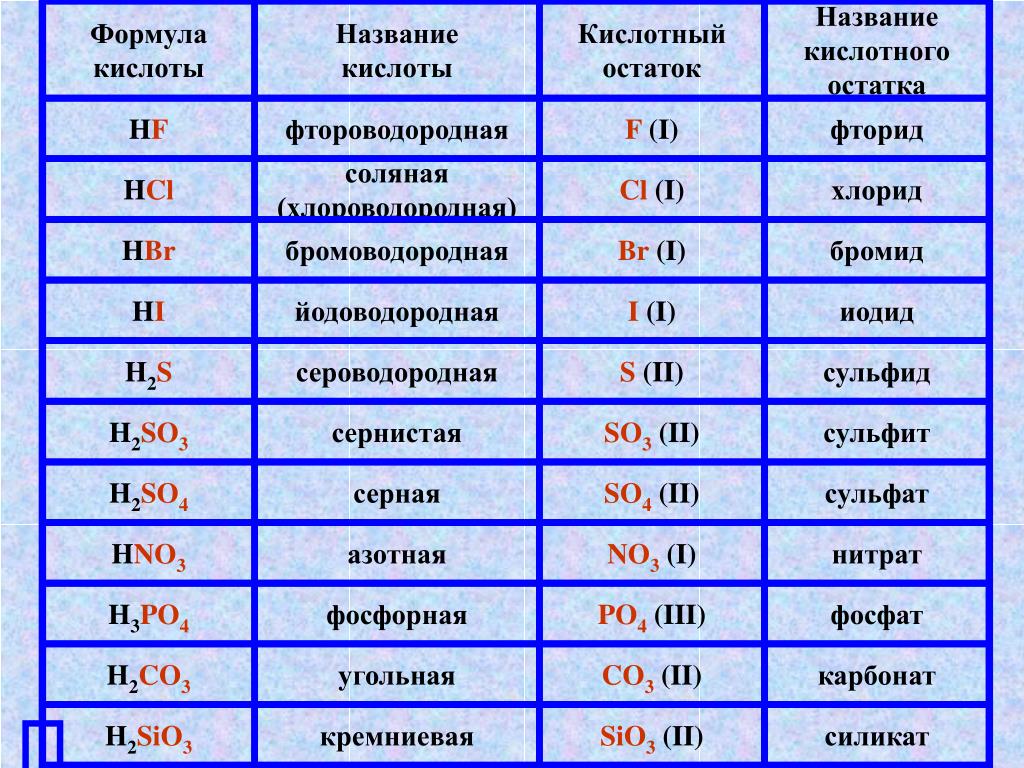 Например, сильная соляная кислота вытесняет слабую уксусную из растворов их солей.
Например, сильная соляная кислота вытесняет слабую уксусную из растворов их солей.
(тв.) ↑
Тесты подготовки к ЗНО:
Online-тест подготовки к ЗНО по химии №12 «Кислоты»
Что пора исправить в учебниках химии
В химии много законов и правил, но всегда есть место неожиданностям. Бывает, что сложившиеся представления прочно укореняются в сознании и необычный факт, который не согласуется с общепринятыми понятиями, воспринимается с недоверием или как чудо. О том, как ученым удалось получить кислоту, про которую даже в учебниках написано, что она не существует, и заставить инертные газы вступать в реакцию, — в сокращенной главе из книги химика Михаила Левицкого «Карнавал молекул. Химия необычная и забавная».
Исправим учебники химии
Только не обещайте исправить положение вещей, а то опять каких-то вещей не досчитаемся!
Михаил Мамчич
Сразу отметим, что этот случай — исключительно редкий. В учебниках содержатся знания, отшлифованные и проверенные десятилетиями, однако бывают сюрпризы. Например, известно, что угольная кислота Н₂СО₃ в свободном виде не существует, она быстро распадается с образованием CO₂ и воды, что мы часто можем наблюдать, открывая газированные напитки. Вот цитата из учебника «Начала химии» (авторы Н.Е. Кузьменко, В.В. Еремин, В.А. Попков): «…свободная угольная кислота неизвестна, так как она неустойчива и легко разлагается…». Результат был проверен столь многократно, что не вызывал никаких сомнений, потому не будем никого укорять за ошибку, поскольку до определенного момента это считалось истиной. Современные исследования показали, что в это утверждение можно внести поправку.
В учебниках содержатся знания, отшлифованные и проверенные десятилетиями, однако бывают сюрпризы. Например, известно, что угольная кислота Н₂СО₃ в свободном виде не существует, она быстро распадается с образованием CO₂ и воды, что мы часто можем наблюдать, открывая газированные напитки. Вот цитата из учебника «Начала химии» (авторы Н.Е. Кузьменко, В.В. Еремин, В.А. Попков): «…свободная угольная кислота неизвестна, так как она неустойчива и легко разлагается…». Результат был проверен столь многократно, что не вызывал никаких сомнений, потому не будем никого укорять за ошибку, поскольку до определенного момента это считалось истиной. Современные исследования показали, что в это утверждение можно внести поправку.
Угольную кислоту Н₂СО₃ как индивидуальное соединение удалось получить при нагревании в высоком вакууме бикарбоната аммония.
Стабильность чистой H₂CO₃ достаточно высока, она может возгоняться в вакууме, но ее разложение при нагревании все же возможно. При любом превращении реагирующие молекулы вначале образуют некое промежуточное соединение (так называемый переходный комплекс), которое затем распадается, образуя продукты реакции. Образование комплекса требует затрат энергии. Чем меньше эта энергия, тем легче проходит реакция. Разложение угольной кислоты при нагревании проходит через циклический переходный комплекс, образуемый четырьмя атомами О-С-О-Н. Цикл возникает благодаря так называемой водородной связи между атомами О и Н (на рисунке показана пунктиром). Энергия образования такого комплекса 184 кДж/моль.
Образование комплекса требует затрат энергии. Чем меньше эта энергия, тем легче проходит реакция. Разложение угольной кислоты при нагревании проходит через циклический переходный комплекс, образуемый четырьмя атомами О-С-О-Н. Цикл возникает благодаря так называемой водородной связи между атомами О и Н (на рисунке показана пунктиром). Энергия образования такого комплекса 184 кДж/моль.
В присутствии воды, т.е. при обычном способе получения угольной кислоты, легко образуется восьмичленный переходный комплекс с помощью тех же водородных связей при участии одной молекулы угольной кислоты и двух молекул Н₂О. Энергия образования такого комплекса почти вдвое меньше, 100 кДж/моль, и разложение проходит очень быстро.
Возможность существования угольной кислоты в свободном виде не только интересна, но и важна, это открытие позволило по-новому взглянуть на процесс дыхания.
Полагают, что в живом организме угольная кислота, «оберегаемая» от разложения специальным ферментом, позволяет осуществлять быстрый перенос углекислого газа из клеток в кровь, а затем мы его выдыхаем через легкие.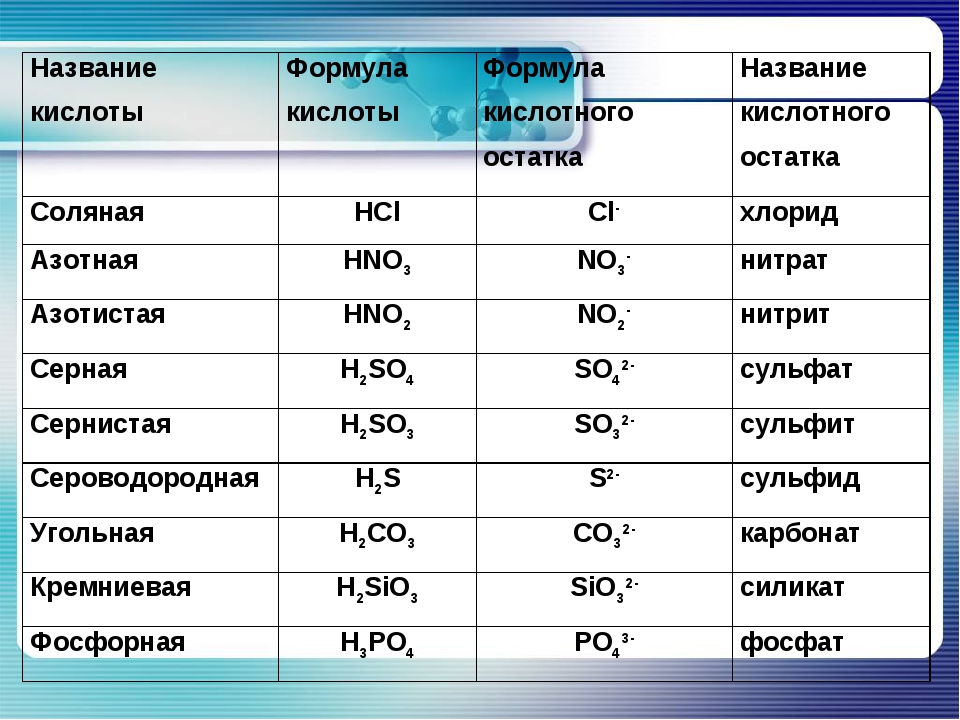
Поскольку свободная угольная кислота получена и, естественно, изучен ее спектр, астрономы полагают, что теперь она может быть спектрально обнаружена в атмосфере планет Солнечной системы.
Полувековая иллюзия
Все иллюзия.
Конечно, и предыдущая фраза.
Станислав Ежи Лец
С момента открытия в конце XIX в. благородных газов (He, Ne, Ar, Kr, Xe) они считались химически абсолютно пассивными и не способными вступать в какие-либо реакции, поэтому их назвали инертными. Такая точка зрения продержалась вплоть до 1962 г., однако в результате работ канадского ученого Нила Бартлетта эти представления пришлось пересматривать.
Нил Бартлетт (1932–2008)
Изучая соединение платины с фтором PtF₆, Бартлетт обратил внимание на сильнейшие окислительные способности этого соединения, оно способно окислять даже молекулярный кислород, который сам хороший окислитель. В результате получается соединение, в котором у кислорода изъят один электрон и он получает положительный заряд O₂+[PtF₆]–. Бартлетту пришла в голову интересная мысль:
Бартлетту пришла в голову интересная мысль:
если гексафторид платины может оторвать электрон от кислорода, то он может проделать то же самое с ксеноном, поскольку, как уже было известно, для этого требуется несколько меньшая энергия, чем в случае кислорода.
В результате опыта он получил сразу несколько химических соединений переменного состава, содержащих ксенон.
Это сообщение сразу привлекло внимание химиков. Оказалось, что фторировать ксенон можно и без участия платины действием элементарного фтора. Так были получены XeF₄ и XeF₆. Фтор настолько сильный окислитель, что способен отрывать электроны даже от устойчивой восьмиэлектронной оболочки инертного газа. На этом исследователи не остановились, удалось даже получить кислородные соединения ксенона, например XeO₃. Таким образом
миф, утверждавший абсолютную инертность благородных газов, удалось разрушить. Возникло не только новое направление в химии, это открытие привело к пересмотру некоторых фундаментальных представлений.
Нулевую группу в периодической системе упразднили, а благородные газы поместили в VIII группу, т.е. туда, где находятся малоактивные благородные металлы палладиевой и платиновой групп.
Прокатиться на реакции
Хорошо кататься по российским просторам на импортном внедорожнике, плохо только, что попадаются дороги
Стас Янковский
Иногда случается так, что разрозненные факты, если их объединить, могут указать новое направление исследований. Рассмотрим, как археологические изыскания и обычные бытовые наблюдения привели к пониманию нового явления.
От наблюдения к открытию
В конце XIX в. достоинства металлического никеля, такие как механическая прочность в сочетании с коррозионной устойчивостью и жаропрочностью, были хорошо известны. Никель применяли для изготовления заводской аппаратуры и для покрытия металлической посуды. Однако коррозионная устойчивость никеля в бытовых условиях оказалась невысокой. Нагревание такой посуды на огне приводило к постепенному ее разрушению, которое долгое время объясняли коррозией, протекающей при повышенной температуре.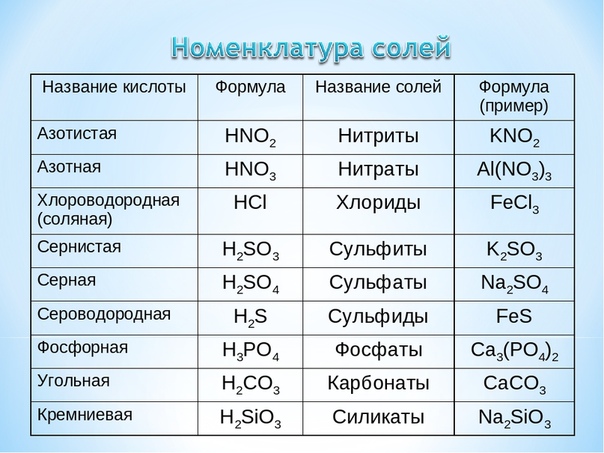
Те, кто был более наблюдателен, замечали, что при нагревании этой посуды на раскаленной плите (без контакта с пламенем) коррозия не наблюдалась. Следовательно, кислород и влага воздуха ни при чем. Оказалось, что все дело в контакте никеля с монооксидом углерода СО, который всегда присутствует в открытом пламени. Окончательную ясность внес английский химик и промышленник Л. Монд (1839–1909), изучавший процессы коррозии никелевой аппаратуры в заводских условиях. Он обратил внимание, что при сжигании смеси Н₂ и СО пламя было ярко окрашено только в том случае, когда смесь газов подавали через никелевую трубку. Выяснилось, что никель взаимодействует с СО, образуя легколетучее соединение — карбонил никеля Ni (CO)₄. Это открытие вызвало интенсивный поток работ, в результате которых были получены карбонилы многих металлов. Возник новый раздел химической науки — химия карбонилов металлов. Кроме того, карбонил никеля подсказал химикам еще одно направление исследований.
Простое взамен громоздкого
Очистка металлов от примесей всегда была делом трудоемким, и потому химики постоянно искали простые и удобные способы, позволяющие отделять металл от загрязнений.
Основной источник металлического никеля — сульфидные руды, в которых содержатся также примеси сульфидов кобальта и железа (CoS, FeS и др.). Ранее для получения никеля в промышленности поступали следующим образом: медно-никелевую руду вместе с флюсами (веществами, снижающими температуру плавления) плавили в электропечах. Железо отделяли, окисляя его, т.е. продувая расплав воздухом в специальных емкостях (конвертерах). Оставшийся расплав сульфидов никеля, меди и кобальта охлаждали, мелко измельчали и направляли на флотацию (разделение твердых частиц, основанное на их различной смачиваемости водой, содержащей добавки вспенивателей). Таким способом отделяли медные и кобальтовые сульфиды от никелевых. Далее полученный концентрат сульфида никеля обжигали, при этом получали оксид никеля NiO, а сера удалялась в виде газообразного оксида. Затем полученный оксид никеля восстанавливали в электродуговых печах, и в результате получали металлический никель. Как видим, процесс громоздкий и трудоемкий.
Карбонил никеля открыл другой, более короткий путь. Он основан на том, что Ni (CO)₄ — необычайно летучее вещество (t кип. = 43 °С). После обработки смеси сульфидов монооксидом углерода СО под давлением образуется карбонил никеля, который можно легко отогнать (карбонилы остальных металлов гораздо более труднолетучи).
При последующем нагревании до 180 °С полученный карбонил легко разлагается, образуя металлический никель высокой степени чистоты.
Транспортные реакции в промышленности и у нас дома
Итак, основной замысел — очистка металла путем перевода его в летучее соединение. Естественно, эту идею постарались применить и к другим металлам. Необходимо было, чтобы металлы сравнительно легко образовывали летучие соединения. Удачные варианты были найдены: при пониженных температурах иод легко реагирует с такими металлами, как титан, цирконий, гафний и др. Полученные иодиды можно легко отогнать, затем при нагревании они разлагаются, образуя чистый металл. Освободившийся иод может быть вновь направлен на взаимодействие с очередной порцией очищаемого металла. Реакции такого типа называют транспортными, роль транспортного средства играет, естественно, иод.
Реакции такого типа называют транспортными, роль транспортного средства играет, естественно, иод.
Способности иода в роли «перевозчика» широки: он реагирует при 1100 °С с элементарным кремнием, образуя летучий SiI₄.
На этом превращения не завершаются, при высокой температуре более устойчивы соединения кремния со степенью окисления два, поэтому получившийся SiI₄ реагирует с имеющимся элементарным кремнием, образуя SiI₂.
Как и в случае с алюминием, окислительно-восстановительная реакция проходит между атомами кремния, только в обратном, нежели у алюминия, направлении: из Si⁴+ и Siº получается Si²+.
Если образовавшийся газообразный SiI₂ направить в холодную зону, то он окажется в условиях, где более устойчивы соединения Si⁴+, в результате пойдет реакция, обратная той, что показана выше.
В холодной зоне останется элементарный кремний (естественно, высокочистый), а SiI₄ можно вновь направить в горячую зону. Потребность в чистом кремнии высока, его используют для изготовления компьютерных процессоров и солнечных батарей.
Чем отличаются процессы очистки металлов и кремния? В конечном итоге чистые металлы получают при термическом разложении летучих иодидов, а элементарный кремний, наоборот, образуется в охлаждаемой зоне. Впрочем, для кремния существует и вторая возможность. Если получившийся при 1100 °СSiI₂ нагреть еще выше (до 1400 °С), он распадется на Si и I₂.
Пожалуй, наиболее эффектное применение транспортной реакции реализовано в лампах накаливания. В вакуумированной ламповой колбе раскаленная вольфрамовая спираль постепенно испаряется и в итоге перегорает. На внутренней стенке такой лампы иногда можно заметить сероватый налет испарившегося вольфрама. Если заранее ввести внутрь стеклянной колбы немного иода, он будет реагировать с осевшим на стенках колбы металлическим вольфрамом, образуя летучий иодид вольфрама. Пары иодида, коснувшись нагретой спирали, разлагаются на вольфрам и иод. Таким образом, вольфрам вновь возвращается на спираль, а иод вовлекается в следующий цикл. В результате срок службы лампы заметно увеличивается. Именно так работают широко известные галогеновые лампы.
Именно так работают широко известные галогеновые лампы.
В рубрике «Открытое чтение» мы публикуем отрывки из книг в том виде, в котором их предоставляют издатели. Незначительные сокращения обозначены многоточием в квадратных скобках. Мнение автора может не совпадать с мнением редакции.
Читайте нас в Facebook, VK, Twitter, Instagram, Telegram (@tandp_ru) и Яндекс.Дзен.
Где можно учиться по теме #химия
«Кислоты». 8-й класс
Цели урока: формирование представлений о кислотах, изучение классификации кислот, их химических свойств, применение и нахождение в природе; продолжить работу по развитию умения составлять формулы химических соединений по таблице растворимости.
Задачи.
- Образовательные : первичное знакомство и изучение нового класса неорганических веществ “Кислоты”; осмысление связи кислот с кислотными оксидами; ознакомить учащихся с определением, составом, классификацией, номенклатурой кислот, научить определять кислоты среди других веществ, классифицировать кислоты, определять валентности кислотных остатков.
- Развивающие: способствовать развитию умения учащихся проводить эксперимент для получения новых знаний; речевых навыков учащихся. Вести работу над общеучебными умениями: сравнивать, обобщать, делать выводы.
- Воспитательные: воспитывать толерантность (формирование уважительного, терпимого отношения друг к другу, выслушивать ответы товарищей, умение бесконфликтно работать в парах), воспитывать интерес у учащихся к урокам химии, соблюдать технику безопасности при работе с кислотами.

Методы: словесные, наглядные, практические.
Тип урока: комбинированный.
Оборудование и реактивы: проектор, компьютер,
презентация по теме: Кислоты”, индикаторы:
лакмус, метилоранж, фенолфталеин; соляная
кислота, лимонная кислота, кремниевая кислота,
серная кислота, колбы, стеклянные палочки,
инструктивные карты учащимся, лучинка, пробирки.
Ход урока
1. Организационный момент. (1 мин.)
2. Актуализация знаний.
Фронтальный опрос
— Какую тему мы изучали на протяжении последних уроков? (Изучали тему: “Соединения химических элементов”)
— Какие соединения химических элементов мы уже изучили? (Познакомились с классом оксидов, оснований)
— Какие химические соединения называются оксидами? (Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых – кислород в степени окисления – 2
— Какие химические соединения называются основаниями? (Основания — это сложные вещества, состоящие из ионов металлов и связанных с ними гидроксид-ионов.)
3. Познавательная задача.
Мы изучаем классификацию неорганических веществ. Сегодня нам с вами предстоит знакомство с еще одним классом, но с каким именно вы узнаете, правильно выполнив следующее задание:
Слайд 1.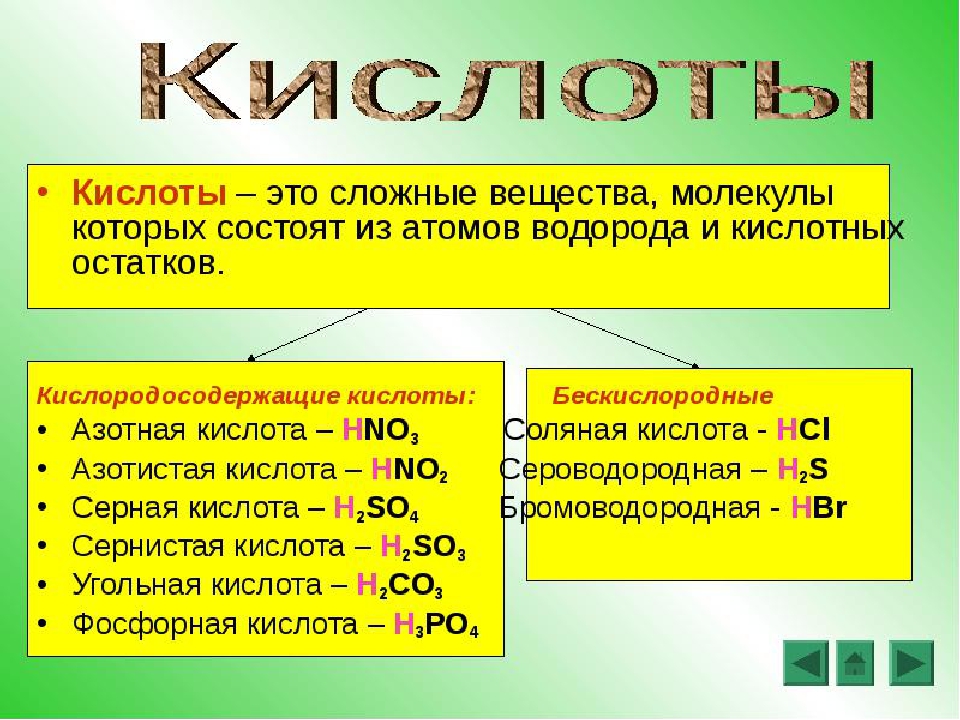 Определите тип каждой из реакций,
уравнения которых записаны в таблице. Из букв
правильных ответов мы и определим название
класса веществ.
Определите тип каждой из реакций,
уравнения которых записаны в таблице. Из букв
правильных ответов мы и определим название
класса веществ.
| Уравнения реакций | Тип химической реакции | |||
| Соединения | Разложения | Замещения | Обмена | |
| Mg+H2SO4=MgSO4+H2 | В | Б | О | М |
| 2Na+S=Na2S | С | Д | Ж | Н |
| 2Fe(OH)3=Fe2O3+3H2O | Г | Т | У | З |
| KOH+HCl=KCl+H2O | Л | Е | В | Ы |
| 2Сa+O2=2CaO | Л | Н | Г | Б |
| Mg+CuCl2=Cu+MgCl2 | З | П | К | Д |
| CaCO3=CaO+CO2 | Р | И | Ф | А |
Название какого класса веществ мы получим из
букв: О, С, Т, Ы, Л, К, И – кислоты.
Слайд 3. Тема урока: Кислоты.
— Дайте названия соединениям, участвующим в выше предложенных реакциях. (Возникает проблемная ситуация, которая будет решаться с помощью подводящего и побуждающего диалога)
Обратите внимание!
— Почему некоторым химическим формулам в таблице вы не дали названий? (Учитель создает проблему)
(Данные формулы нельзя отнести ни к оксидам, ни к основаниям, потому что они не соответствуют им по составу.)
— Совершенно верно. Сегодня мы расширим ваши знания о сложных веществах и познакомимся с еще одним классом неорганических соединений кислотами
4. Изучение нового материала.
С понятием кислоты вы встречались неоднократно
в бытовой жизни. Какие кислоты вам известны? Где
встречаются эти кислоты? Кислоты встречаются
на кухне, в аптечке. Кислоты есть и в организме
живых существ и человека.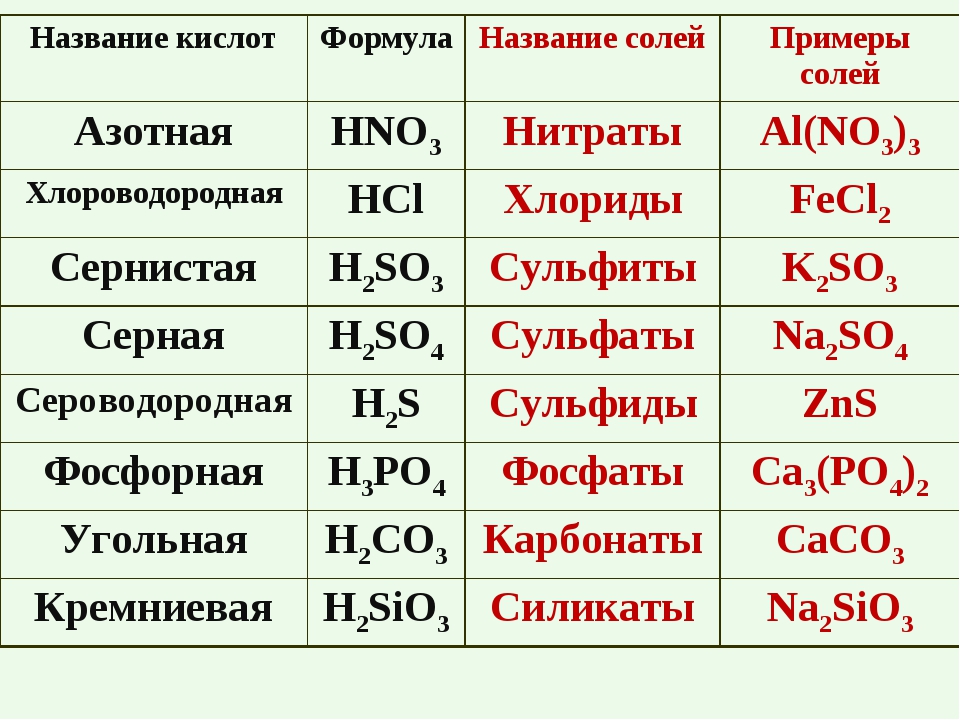 Наверняка те из вас, кто
занимается спортом, слышали, что существует
молочная кислота, которая образуется в мышцах
при физической нагрузке, а в желудке у каждого из
нас содержится соляная кислота, без которой
невозможно полноценное функционирование
организма.
Наверняка те из вас, кто
занимается спортом, слышали, что существует
молочная кислота, которая образуется в мышцах
при физической нагрузке, а в желудке у каждого из
нас содержится соляная кислота, без которой
невозможно полноценное функционирование
организма.
На уроках химии мы уже тоже встречались с этими веществами. Теперь пришло время познакомиться с ними поближе.
Первое упоминание о кислотах было на уроках изучения темы “Водород”. Мы выполняли практическую работу с использованием соляной кислоты.
В следующий раз, когда начали знакомиться с классификацией неорганических веществ и изучали класс “Оксиды”. Мы говорили, что оксиды могут быть двух видов. Какие? Кислотные и основные.
Кислотные оксиды – это оксиды неметаллов, основные – это оксиды металлов.
Слайд 4.
Поиграем в “Крестики-нолики”.
Покажите выигрышный путь, которому соответствуют формулы кислотных оксидов:
Слайд 5.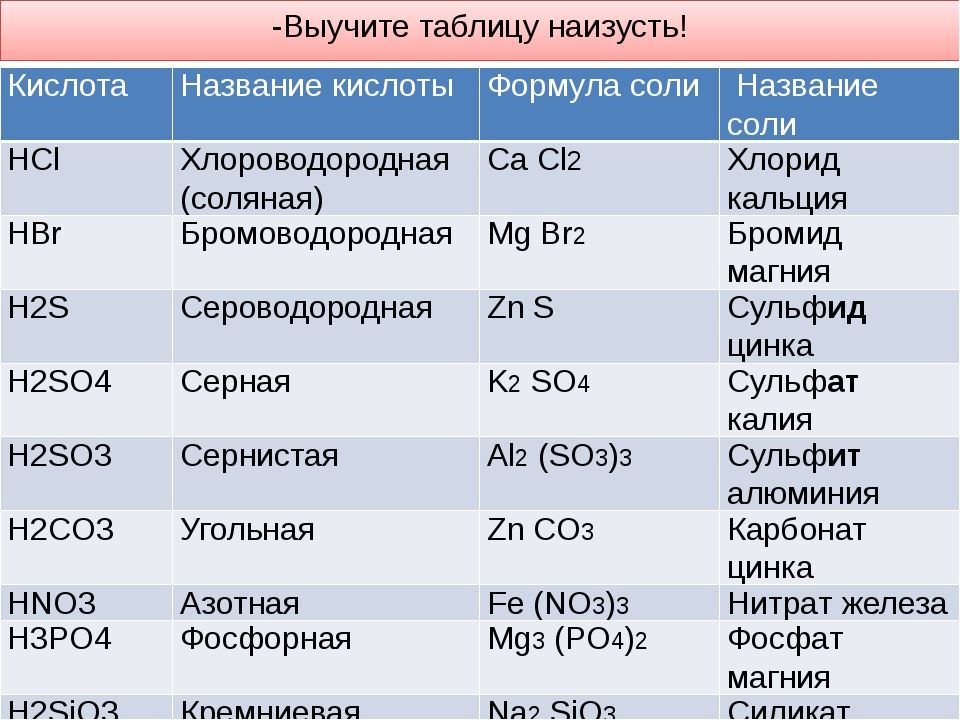 Выполнение у доски.
Выполнение у доски.
| Na2O | CuO | SO3 |
| MgO | Cl2O7 | N2O5 |
| BaO | P2O5 | CO2 |
— Почему кислотные оксиды называются кислотными? (Потому что им соответствуют кислоты)
На прошлом уроке мы учились составлять формулы
соответствующих кислот. Давайте вспомним, как мы
это делали еще раз. (Далее опрос детей о порядке
составления формул кислот). Работа в парах. 1
вариант составляет формулу серной кислоты. 2
вариант проверяет. После проверки и объяснения
ошибок учителем дается задание 2 варианту
составить формулу угольной кислоты, а 1 вариант
проверяет написание формулы.
— Что нужно сделать с оксидом, что бы получить из него кислоту? (Добавить к нему молекулу воды)
— Какой атом выписываем первым? (Водород)
Мы получили формулы кислот. Посмотрите на них. Что у них общего?
На первом месте стоит атом водорода. А все остальные атомы в молекуле, кроме водорода, называются кислотным остатком.
Т.о. кислоты – это сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка.
Вспомните, чему равно валентность атома водорода в соединениях? (1)
В кислотах валентность водорода тоже равна I. А вот валентность кислотного остатка равна числу атомов водорода а кислоте.
Слайд 6. Поработаем над определением.
Задание. Подчеркните кислотный остаток в молекулах кислот:
H2SO4; H2CO3; HNO3; H2SiO3; H3PO4
Задание. Определите валентность кислотных
остатков:
Определите валентность кислотных
остатков:
| II | II | I | II | III | ||||
H2SO4; |
H2CO3; |
HNO3; |
H2SiO3; |
H3PO4 |
Еще раз посмотрим на общую формулу кислот.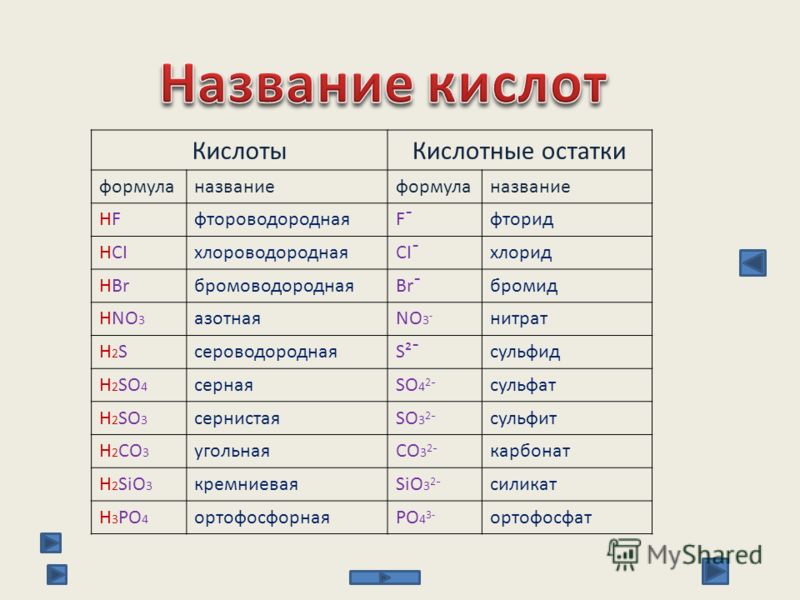 Атомов водорода может быть несколько, а может
быть один. Кислотный остаток состоит из атомов
неметаллов, которых в периодической системе
больше 50. Т.е. кислот существует огромное
множество. Как же в них разобраться? Рассмотрим
их классификацию.
Атомов водорода может быть несколько, а может
быть один. Кислотный остаток состоит из атомов
неметаллов, которых в периодической системе
больше 50. Т.е. кислот существует огромное
множество. Как же в них разобраться? Рассмотрим
их классификацию.
Слайд 7.
I. По числу атомов водорода:
х = 1 – одноосновная, например, HNO3
х = 2 – двухосновная, например, H2CO3
х = 3 – трехосновная, например, H3PO4
Задание. Разделите кислоты по числу атомов водорода:
H3PO4; HCl; H2S; HNO3; H2SO4: HBr; H2CO3; H2SO3; HClO4; H2SiO3.
Слайд 8.
II. По наличию в кислотном остатке атомов кислорода:
- бескислородные HI
- кислородосодержащие H2CO3
Задание. Классифицируйте кислоты по наличию атомов кислорода и допишите в схему:
H3PO4; HCl; HNO3; H2S; H2SO4; HBr
Кислоты различных типов могут быть получены по-разному.
Кислородосодержащие – взаимодействием кислотного оксида с водой:
Cl2O7 + H2O —> HClO4
Бескислородные – взаимодействием неметалла с водородом:
H2 + Cl2 —> HCl
На практической работе – “Получение водорода” мы использовали соляную кислоту. Все видели, что это бесцветная жидкость. Но не все кислоты обладают таким агрегатным состоянием. Посмотрите в таблицу растворимости и скажите какая кислота нерастворимая?
HCl |
жидкости | H2SiO3 |
Твердое вещество |
H2CO3 |
Не существуют в свободном виде |
H2SO4 |
H2SO3 |
H2CO3 = CO2 +H2O
H2SO3 = SO2+ H2O
Как вы думаете, почему кислоты называют именно
кислотами? Потому что они кислые на вкус. Вам
известна лимонная кислота, содержащаяся в
лимонах, уксусная кислота, используемая в
кулинарии, витамины – “аскорбинки” -
аскорбиновая кислота. Они действительно кислые
на вкус. А чем улавливается вкус? Рецепторами,
клетками отвечающими за восприятие и осязание. С
точки зрения химии, кислоты тоже “кислые”. Их
растворы дают кислую среду, которую можно
определить с помощью специальных “химических
рецепторов” – индикаторов. В зависимости от
среды они меняют цвет.
Вам
известна лимонная кислота, содержащаяся в
лимонах, уксусная кислота, используемая в
кулинарии, витамины – “аскорбинки” -
аскорбиновая кислота. Они действительно кислые
на вкус. А чем улавливается вкус? Рецепторами,
клетками отвечающими за восприятие и осязание. С
точки зрения химии, кислоты тоже “кислые”. Их
растворы дают кислую среду, которую можно
определить с помощью специальных “химических
рецепторов” – индикаторов. В зависимости от
среды они меняют цвет.
Слайд 9. Индикатор — вещество, дающее цветные химические реакции в зависимости от среды раствора. (Например лакмус, метилоранж, фенолфталеин)
| Индикатор Среда |
Лакмус |
Метилоранж |
Фенолфталеин |
Кислая среда |
Красный |
Розовый |
Бесцветный |
Задание. Сейчас, приступите, пожалуйста, к
выполнению лабораторного опыта. (Повторение ТБ
при работе с кислотами!)
Сейчас, приступите, пожалуйста, к
выполнению лабораторного опыта. (Повторение ТБ
при работе с кислотами!)
Повторение ТБ при работе с кислотами. Внимание! Работать с кислотами необходимо аккуратно, так как можно получить ожог или отравление.
Но, чтобы этого не случилось нужно при выполнении лабораторных работ с кислотами соблюдать правила техники безопасности.
Повторим: выполнять все указания учителя, Не пробовать вещества на вкус, пробирку в руки не брать, не приступать к выполнению опыта, не зная, что и как нужно делать,
Обращаться с лабораторной посудой бережно и закончив работу, привести рабочее место в порядок. При попадании кислоты на кожу надо смыть её струёй воды.
Обработать 2% раствором гидрокарбонатом натрия.
Выполнение лабораторного опыта по
инструктивным карточкам и оформление отчета в
тетради. Форма работы: парная. Время работы – 8–10
минут.
Инструктивная карта
Лабораторная работа
Тема: “Изменение окраски индикаторов в кислых средах”.
Задание: Исследовать окраску индикаторов в кислых средах.
Оборудование и реактивы: 2 пробирки с соляной и 2 пробирки с лимонной кислотами, лакмусовая бумажка, жидкие фенолфталеин и метилоранж, стеклянные палочки, вода.
1. Проведение исследовательского опыта и оформление результатов. Перепишите в тетрадь таблицу, представленную в конце опыта.
2. Смочите лакмусовую бумажку в первой пробирке
с соляной кислотой результаты исследований
(изменение окраски бумажки) запишите в таблицу.
Затем в эту же пробирку добавьте каплю
фенолфталеина. Перемешайте стеклянной палочкой.
Результаты исследований запишите в таблицу. Во
вторую пробирку добавьте каплю метилоранжа.
Перемешайте стеклянной палочкой. Результаты
наблюдений сравните, и запишите в таблицу.
Результаты
наблюдений сравните, и запишите в таблицу.
3. Повторите опыты, описанные выше (в пункте 2), используя две другие пробирки с лимонной кислотой предварительно их растворив.
4. Не забывайте результаты наблюдений фиксировать в таблице!
Действие кислот на индикаторы
| Индикатор | Окраска индикатора в воде | Окраска индикатора в растворе соляной кислоты (HCl) | Окраска индикатора в лимонной кислоте |
| Фенолфталеин | Бесцветная | ||
| Лакмусовая бумажка | Желтая | ||
| метилоранж | Оранжевая |
Обсуждение результатов и формулирование
выводов (слайд 8).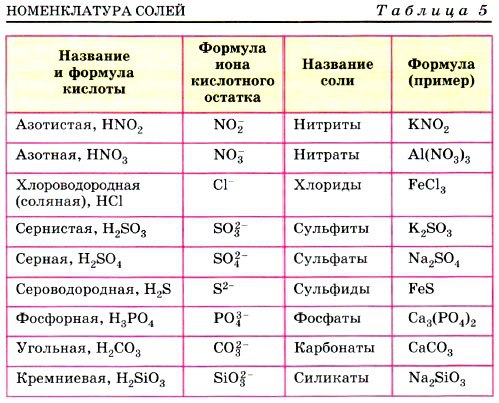
— Как можно определить раствор кислоты среди других веществ? (Раствор кислоты среди других веществ можно определить с помощью индикаторов)
— Какие индикаторы изменили свой цвет в кислотах? (Лакмус и метилоранж)
— Одинаковые ли изменения цвета этих индикаторов вы наблюдали в обеих кислотах? (Да)
— Какую окраску приобрели лакмус и метилоранж и в соляной, и в лимонной кислотах? (Лакмус стал красным, а метилоранж – розовым)
— На основании проведенных опытов сделаем выводы:
независимо от вида кислот индикаторы изменяют свой цвет одинаково; а это означает, что все кислоты обладают сходными свойствами.
С чем же это связано?
Ну и наконец-то пришло время лично познакомиться с героями сегодняшнего вечера – кислотами. Каждая из них имеет свою формулу и определенное название, которые к следующему уроку необходимо выучить.
Слайд 10.
| Формула кислоты | Название кислоты |
| HF | Фтороводородная (плавикова) |
| HCl | Хлороводородная (соляная) |
| HBr | Бромоводородная |
| HI | Йодоводородная |
| H2S | Сероводородная |
| H2SO3 | Сернистая |
| H2SO4 | Серная |
| HNO2 | Азотистая |
| HNO3 | Азотная |
| H2CO3 | Угольная |
| H2SiO3 | Кремниевая |
| H3PO4 | Фосфорная |
Номенклатура кислот: Теперь мы с вами будем
учиться называть кислоты.
Бескислородные кислоты называют с конца молекулы, соединяя название последнего элемента через соединительную гласную О со словом водородная, и добавляем название класса соединения — кислота.
Например: НF – фтороводородная кислота, другое, ее название, – плавиковая кислота.
Учащиеся самостоятельно называют кислоту: HCl – хлороводородная.
Немного о ней: (показываю пузырек с кислотой) – это жидкость, без цвета и запаха, концентрированная дымит на воздухе; содержится в желудке и выполняет две функции: уничтожает большую часть микробов, которые попадают в желудок вместе с пищей, и помогает перевариванию пищи. Желудок готовится к приему пищи заранее: лишь только мы начнем пережевывать пищу, он выделяет желудочный сок, содержащий соляную кислоту. Вот почему так вредно жевать жевательную резинку на голодный желудок, так как сок начнет переваривать стенки самого желудка.
Название кислородсодержащих кислот дает
элемент, стоящий в середине формулы. Например: H2SO4
и H2SO3 – в середине стоит сера, поэтому
первую (у которой больше кислорода) называют
серной (богатая и важная), а вторую (у которой
меньше кислорода) – сернистой (победнее и
скромнее).
Например: H2SO4
и H2SO3 – в середине стоит сера, поэтому
первую (у которой больше кислорода) называют
серной (богатая и важная), а вторую (у которой
меньше кислорода) – сернистой (победнее и
скромнее).
Немного о серной кислоте: (показываю ее) – это жидкость, без цвета и запаха, хорошо поглощает окружающие пары воды и другие газы. Концентрированная серная кислота требует особого обращения с ней при разбавлении: ее нужно приливать в воду, а не наоборот. Иначе может произойти закипание и выплеск кислоты, что может привести к ожогам рук, глаз и лица.
Сообщение учащегося: Серную кислоту человечество
знает около1000 лет. Её выделили из купоросов, и
соответственно назвали купоросным маслом.
Именно под таким названием кислота была известна
в России Серная кислота — сильная двухосновная
кислота при обычных условиях – тяжелая
маслянистая жидкость без цвета и запаха, которая
имеет широкое применение в текстильной,
кожевенной, металлообрабатывающей и пищевой
промышленности (Слайд 28, 29) При
растворении в воде концентрированная серная
кислота выделяет большое количество энергии. Фиксируется внимание учащихся на том, что в связи
с большим выделением количества теплоты при
растворении концентрированной серной кислоты в
воде нельзя вливать воду в кислоту. В этом случае
вода, имеющая меньшую плотность, окажется на
поверхности, закипит, и её брызги вместе с
кислотой могут обжечь руки и лицо. Сильное
разогревание жидкости можно наблюдать с помощью
градусника.
Фиксируется внимание учащихся на том, что в связи
с большим выделением количества теплоты при
растворении концентрированной серной кислоты в
воде нельзя вливать воду в кислоту. В этом случае
вода, имеющая меньшую плотность, окажется на
поверхности, закипит, и её брызги вместе с
кислотой могут обжечь руки и лицо. Сильное
разогревание жидкости можно наблюдать с помощью
градусника.
Учащиеся делают вывод: “Кислоту надо приливать к воде, а не наоборот”.
“Бермудский треугольник!”
Демонстрационный опыт: обугливание древесины концентрированной серной кислотой, т.к. она жадно отнимает воду у органических веществ, вещество при этом обугливается.
Применение кислот. Обсуждение с учащимися.
Итак, мы познакомились еще с одним классом соединений – кислотами.
5. Закрепление
Работа с карточками.
1. Задание “Склеенное слово”.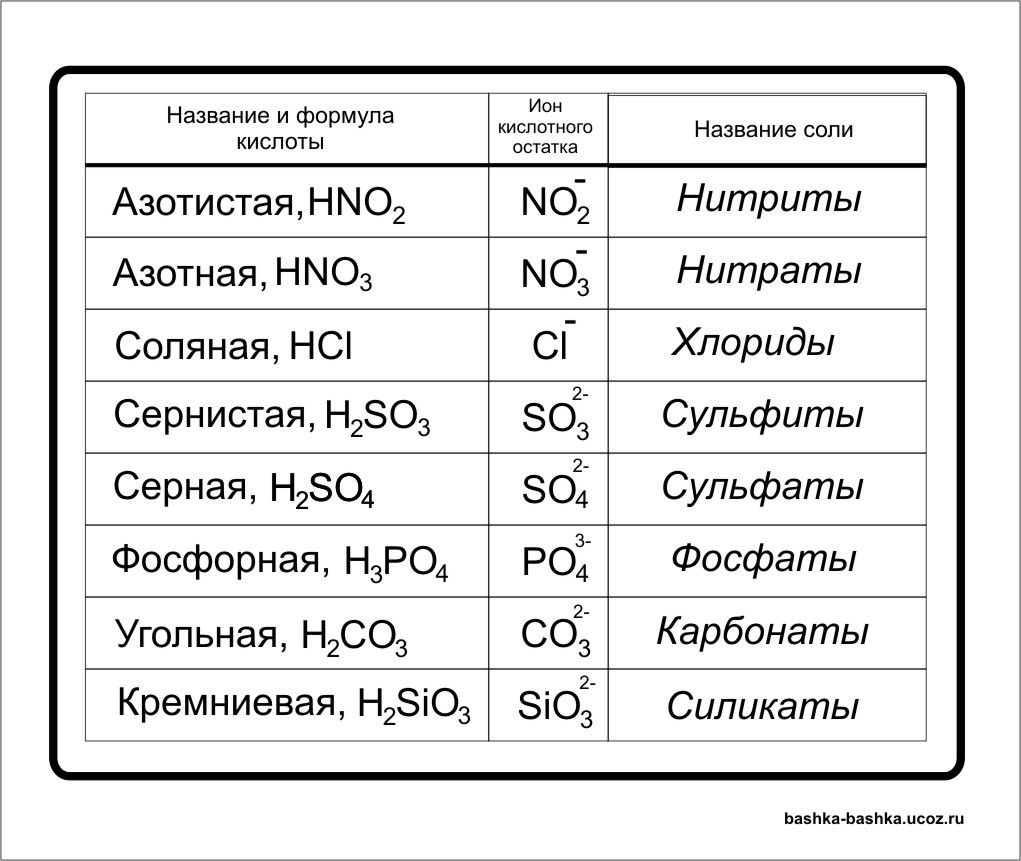 Перед вами
“текст”, в котором “спрятаны” формулы кислот.
Просмотрите текст и найдите формулы кислот,
подчеркните и назовите их, Определите
валентность кислотных остатков.
Перед вами
“текст”, в котором “спрятаны” формулы кислот.
Просмотрите текст и найдите формулы кислот,
подчеркните и назовите их, Определите
валентность кислотных остатков.
H2OSO3H3PO4Na2CO3MgAlPO4H2ОSP2O5CHNO3O2HClBaOSH2CO3Na2O
H2SO4NH3Mg(OH)2Ba(OH)2OSNH2K3NH2SNaClN2O5BaH2Ca(OH)2Al2O3
2. Выберите формулу “третьего лишнего” вещества в каждом ряду:
а) HCl H2SO4 K2O
б) HNO3 H2O H2CO3
в) H2S H2SO4 NaOH
6. Рефлексия.
Слайд 11. Подведем краткие итоги урока.
Давайте вместе заполним таблицу:
Подведем краткие итоги урока.
Давайте вместе заполним таблицу:
| Вопрос (учитель) | Результат (учащиеся) |
| Что запомнили? | Кислоты – это сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка. Кислоты – это чаще всего жидкости, как правило, без вкуса, цвета и запаха. Лакмус окрашивает их растворы в красный цвет. |
| Что поняли? | Валентность кислотного остатка совпадает с числом атомов водорода в кислоте. |
| Чему научились? | Определять растворы кислот с
помощью индикатора. |
7. Слайд 12. Домашнее задание: выучить 12 формул и названий кислот, §20, упр.1,3.
8. Выставление оценок.
Презентация
Урок по химии на тему «Кислоты» (8 класс)
Урок химии в 8 классе по теме «Кислоты».
Цели урока:
сформулировать понятие о кислотах, рассмотреть состав, название и классификацию кислот, познакомить учащихся с важнейшими неорганическими кислотами, способствовать умению учеников применять свои знания в повседневной жизни.
Задачи урока:
· Предметные : усвоение новых знаний на основе имеющихся, самостоятельный поиск новых знаний из различных источников и
закрепление практических умений и навыков; формирование навыка безопасной работы с химическим оборудованием.
· Метапредметные: развитие
познавательного интереса, самостоятельности мышления, памяти, инициативы
учащихся через использование коммуникативно-деятельностной методики,
частично-поискового подхода и элементов проблемного обучения.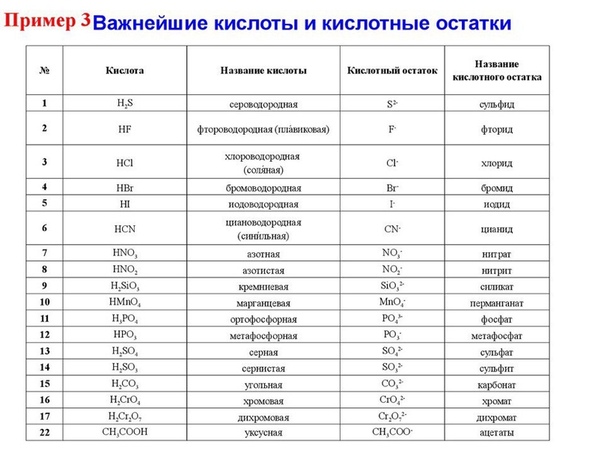
· Личностные: формирование коммуникативных умений, культуры общения, сотрудничества.
Методы и приемы проведения: объяснительно-иллюстративные, словесные, репродуктивные, частично-поисковые.
Форма проведения урока: индивидуальная, групповая работа.
Раздаточный материал: лист самооценки, правила работы в группах, домашнее задание: «Выберите правильные утверждения»
Метапредметные результаты:
Результативные УУД:
- Сформировать умение самостоятельно обнаруживать и формулировать учебную проблему, определять цель учебной деятельности.
- Сформировать умение в диалоге с учителем совершенствовать самостоятельно выработанные критерии оценивания.
- Сформировать умение выдвигать версии решения проблемы, осознавать конечный результат.
Познавательные УУД:
- Сформировать
умения ориентироваться в своей системе знаний.
 .
. - Сформировать умение преобразовать информацию, строить логичное рассуждение, включающее установление причинно-следственных связей.
- Анализировать и обобщить изученную информацию.
Личностные УУД:
- Осознавать значимость знаний.
- Понимать значение соблюдения техники безопасности при работе с кислотами.
- Формировать адекватную самооценку.
- Уметь видеть и признавать свои ошибки.
Коммуникативные УУД:
- Сформировать умение самостоятельно организовать учебное взаимодействие в группе.
- Сформировать умение сравнивать, делать выбор.
- Сформировать умение организовывать учебное сотрудничество.
Предметные результаты:
- Сформировать понятие «кислота».
- Определить среду раствора.
- Составлять формулы кислот.
- Называть
кислоты по формуле.

- Классифицировать кислоты.
- Использовать кислоты по назначению.
Оборудование: учебники, таблица растворимости, аскорбиновая кислота в таблетках; растворы соляной, серной кислот, индикаторы, пробирки с растворами кислот и щелочи по количеству команд, стаканчик, раствор мёда, кусочки яблока, наборы карточек с формулами кислот по числу команд.
Тип урока: урок изучения нового материала.
Учебник: «Химия 8 класс» (Габриелян
Раздел: «Важнейшие классы неорганических соединений».
Этап урока | Задачи этапа | Деятельность учителя | Деятельность ученика | Время этапа | ||||||||||||
1. Организационный момент Цель . | создать мотивацию к учебной деятельности | Взаимное приветствие, проверка готовности учащихся к уроку, проверка оборудования. Подготовка учащихся к восприятию нового материала. Добрый день! Я рада видеть вас сегодня на уроке. Думаю, что наша совместная работа будет полезной и интересной. Давайте улыбнемся друг другу, настроимся на поиск и творчество и начинаем наш урок. Работать будем с оцениванием каждого этапа урока. У каждого на столе лист самооценки. Подпишите инициалы. Как его заполнять, вам известно. | Перед началом урока, на перемене учащимся предлагается на входе в класс выбрать из закрытого мешочка один из кружочков 4-х разных цветов. Обладатель каждого цвета за одним из 4-х столов в классе. |
| ||||||||||||
2. Актуализация знаний. Организация проблемной ситуации | актуализация имеющихся знаний учащихся по пройденной теме. |
Сегодня на уроке для нас опорными
станут знания, приобретенные вами в повседневной жизни и возможно на других
предметах. Итак, смотрим видеоматериал.Приложение 1. Беседа: 1) Кем по профессии является герой из видеофильма? Стоматолог. Слайд 1. 2) Стоматолог говорил о каком-то веществе. Вы догадались, какое это вещество? 3) Какую профессию представляет следующий герой? Кондитер. 4) Какое вещество используют для разрыхления теста? 5) Вы узнали кто это? О чем говорит водитель? Преподаватель Какие вещества используют в своей работе герои фильма?
Для того чтобы сформулировать тему урока, учитель предлагает пословицу : “Как поработаешь, так и полопаешь”. Для вас я приготовила угощения (на подносе канапе из разных фруктов) “Угощенья не спроста
Показывает лабораторный опыт №1 «Образование творога при
действии на молоко лимонного сока». Как вы определили, что произошла химическая реакция? Почему же творог выпал в осадок? Раздает учащимся по таблетке или драже аскорбиновой кислоты и просит попробовать на вкус. — узнали ли вы, выданное вам вещество? |
Дети отвечают — кислоты
Наблюдают за учителем. Предполагаемые ответы: образовался творог, молоко скисло, выпал осадок, произошла химическая реакция. Увидели признак протекания химической реакции – выпадение осадка в виде творога. В молоко добавили лимонный сок. Он кислый, так как содержит в своем составе кислоту. Пробуют на вкус драже аскорбиновой кислоты. Узнают вкус кислоты. |
| ||||||||||||
|
Применение кислот — Какие еще кислоты вам известны? — Где используются кислоты? а) в медицине, б) в кулинарии, в) содержатся в фруктах, г) в организме животных и человека и т.д
Сейчас я предлагаю вам вспомнить, всё, что вы знаете о кислотах. Прием: «Корзина идей». Оцените свои знания.(2 этап) | Высказывают свои знания о кислотах. Например: они кислые, содержатся в фруктах и ягодах. Дома на кухне есть уксусная кислота, лимонная. Аскорбиновая кислота – витамин С. Нахождение кислот в природе. |
| |||||||||||||
3. Этап целеполагания на урок | формирование у учащихся способности самостоятельно ставить учебные цели на урок | — Назовите тему сегодняшнего урока? — что нам нужно знать о кислотах? Оцените свои знания (3 этап) | — «Кислоты». — строение, свойства и др. (высказывают предположения) |
| ||||||||||||
4. Этап «Открытие нового знания» | Изучение нового материала через организацию разных видов деятельности.
| — можно ли распознавать вещества так, как это вы проделали с «аскорбинкой»? — почему? — как же можно изучить кислоты без риска для жизни и здоровья? | — нет. — это опасно. — с помощью других веществ и реакций. |
| ||||||||||||
4.1. Создание проблемной ситуации | формирование системно- информационного анализа, развитие умений определять цели и задачи деятельности, выбирать средства реализации цели | Перед вами две пробирки с неопознанными растворами веществ. Составьте план определения кислоты. | Формулируют задачи: 1. определить состав, 2. узнать, какие бывают кислоты, 3. как отличить кислоту от других веществ |
| ||||||||||||
4.2. Проверка правил техники безопасности | формирование умений безопасного обращения с веществами) | – В лаборатории при проведении химического эксперимента часто приходится работать с реактивами. Напомните правила техники безопасности при выполнении работ. Оцените свои знания (4 этап) | Учащиеся называют правила работы с щелочами, кислотами, стеклянной посудой. |
| ||||||||||||
5. Первичная проверка понимания |
| Однажды английский химик Роберт Бойль, изучая
свойства соляной кислоты, случайно пролил ее. — Как вы думаете, какое название присвоил им Бойль таким веществам? — Предлагаю решить сначала экспериментальную задачу по определению кислоты. — Чем нужно воспользоваться? — Выберите нужный индикатор . Предлагает определить наличие кислот в яблочном соке и растворе меда. Лабораторный опыт: «Определение кислот в продуктах. | Это индикаторы. Учащиеся уже знакомы с индикаторами. — индикатором Пользуясь таблицей индикаторов №4 в учебнике, учащиеся определяют, в какой из пробирок находится кислота. Делают вывод Выполняют опыт, определяя наличие кислот в яблочном соке и
растворе меда. Используют индикатор лакмус. Лакмус изменил цвет – стал красным. Делают вывод, что исследуемые продукты содержат кислоту. |
| ||||||||||||
5.1 Классификация кислот |
| Учитель просит обратить внимание на список кислот и их названия. — найдите в записях формул кислот особый признак. — как называется остальная часть молекулы? — сформулируйте определение кислот — рассмотрим, какие бывают кислотные остатки, распределите их на группы — классифицируйте формулы по количеству атомов водорода. | Изучают текст учебника и записывают в тетрадь. Работают с набором карточек «Формулы кислот» Классифицируют кислоты по признакам. — водород — кислотный остаток Дают свои определения кислотам — есть кислотные остатки с кислородом, а есть – без кислорода, поэтому кислоты могут быть кислородсодержащими и бескислородными. — раскладывают карточки с формулами кислот по количеству атомов водорода Записывают классификацию кислот в тетрадь. |
| ||||||||||||
5.2 Представители кислот |
| Демонстрирует образцы кислот, правило разбавления серной кислоты. Действие концентрированной серной кислоты на бумагу , древесину. «Кислоты, которые не существуют». (угольная, сернистая) Какую кислоту нельзя распознать при помощи индикатора? (Нерастворимая кислота — кремниевая). Оцените свои знания (5 этап) | Наблюдают, делают выводы о правилах безопасности при работе с кислотами. Делают записи в тетради. |
| ||||||||||||
Физкультминутка |
| Широко руки химия простирает (руки в стороны), Во все сферы жизни заглядывает (круговые движения руками), Вперед шагает наука эта (хождение на месте), Продолжим мы работать (приседание) Чтобы науку эту изучать (учащиеся садятся за столы) |
| |||||||||||||
6. | Закрепить на практике полученные знания. |
Мы оказались в лесу. Выберите те предметы, в которых содержатся кислоты
Давайте вернемся к началу урока. Что мы хотели узнать про кислоты? — Почему я использовала для получения творога лимонную кислоту? — Где в природе могут содержаться кислоты? — Какие кислоты содержатся в этих овощах и фруктах? Оцените свои знания (6 этап) |
Правильно – это МУРАВЬИНАЯ, ЩАВЕЛЕВАЯ, ЛИМОННАЯ, ЯБЛОЧНАЯ, МОЛОЧНАЯ, УГОЛЬНАЯ, СОЛЯНАЯ кислоты
Предполагаемые ответы на вопрос «Что такое кислоты?». Ученики еще раз проговаривают ответ (кислоты – это …). Узнали формулы кислот. Называют названия кислот, изображенных на
слайде. Научились определять кислую среду раствора с помощью индикатора.
Узнали, как правильно обращаться с кислотами. Предполагаемый ответ: это сильная кислота, она более безопасная, полезная, так как содержит витамин С. В продуктах: лимон, перец, гранат, смородина. Ответ: аскорбиновая кислота или витамин С |
| ||||||||||||
7. Подведение итогов. Рефлексия.
| формирование у учащихся способности подводить итоги урока, обобщать, делать выводы, характеризовать свои действия. |
| Анализируют свою деятельность .Подводят итоги. Лист самооценки: (Ф.И.учащегося)
Итоговая оценка: |
| ||||||||||||
8. | Комментирование домашнего задания. | В качестве домашнего задания предлагаю вам: прочитать § ???????????77 ;упражнение выучить формулы и названия кислот. 2.Составить кроссворд или синквейн по теме: «Кислоты». 3.Выберите правильные утверждения, соедините линиями точки там, где утверждения верны. Благодарю вас за сотрудничество и поддержку! |
|
Список использованной литературы:
- О.С. Габриелян. Химия. 8 класс Учебник для общеобразовательных учреждений Москва «Дрофа», 2015 г.
- М.Ю. Горшковенко, Химия. 8 класс: поурочные разработки. – М.: ВАКО, 2004
- О.С. Габриелян., А.В. Яшукова. Химия. 8-9 классы: метод.пособие. – М.: Дрофа, 2008
- Мультимедийное приложение к УМК «Химия. 8 кл.»
- http://nsportal.
 ru
ru - http://festival.1september.ru
Аннотация к уроку по теме: «Кислоты»
Урок по химии на тему «Кислоты». Урок проводился в 8 классе.
Обучение химии ведется по общеобразовательной программе, по учебнику Г.Е. Рудзитис, Ф.Г. Фельдман. Химия 8 класс. М. «Просвещение». 2015 год. Урок по разделу «Важнейшие классы неорганических соединений». Согласно базисному учебному плану на изучение химии в 8 классе отводится 2 часа в неделю, в год 68 часов.
Основные этапы урока:
1. Организационный момент.
2. Актуализация знаний, создание проблемной ситуации.
3. Этап целеполагания на урок.
4. Этап «Открытие нового знания».
5. Создание проблемной ситуации.
6. Закрепление изученного материала.
7. Этап рефлексии.
8. Домашнее задание.
Химия является частью естественнонаучного образования. Изучение зависимости
свойств веществ от состава и строения, природы химических связей и способов их
преобразования при химических реакциях, обусловленности многообразия веществ и
методов их практического использования составляет основу таких
мировоззренческих идей, как материальное единство органических и неорганических
веществ, единство и взаимосвязь способов химического движения материи.
Изучение зависимости
свойств веществ от состава и строения, природы химических связей и способов их
преобразования при химических реакциях, обусловленности многообразия веществ и
методов их практического использования составляет основу таких
мировоззренческих идей, как материальное единство органических и неорганических
веществ, единство и взаимосвязь способов химического движения материи.
Химический эксперимент применяется для добывания школьниками новых знаний, постановки перед ними познавательных проблем. Решение их с использованием эксперимента ставит учащихся в положение исследователей. Нарастает самостоятельная поисковая деятельность школьников. Совершенствуется форма организации коллективной учебной деятельности и взаимопомощи школьников.
Цели урока: сформировать понятие о кислотах, как об одном из классов химических соединений; изучить состав, строение, химические свойства.
Задачи урока:
Ø
Предметные: усвоение новых знаний на основе имеющихся, самостоятельный поиск
новых знаний из различных источников и закрепление практических умений и
навыков; формирование навыка безопасной работы с химическим оборудованием.
Ø Метапредметные: развитие познавательного интереса, самостоятельности мышления, памяти, инициативы учащихся через использование коммуникативно-деятельностной методики, частично-поискового подхода и элементов проблемного обучения.
Ø Личностные: формирование коммуникативных умений, культуры общения, сотрудничества.
Методы проведения: исследовательский эксперимент, самостоятельная работа учащихся.
Форма проведения урока: групповая работа.
Ключевые компетенции:
Ø Информационно-познавательная: умение работать с дополнительной литературой, конспектировать, выбирать главное, делать выводы.
Ø Коммуникативная: ведение дискуссии, умение доказать свою точку зрения.
Ø Предметные: исследование строения и свойств кислот; изучение классификации, строения, свойств и применения кислот.
Оборудование:
учебники, таблица растворимости, аскорбиновая кислота в таблетках; растворы
соляной, азотной, серной кислот, индикаторы, пробирки с растворами кислот
и щелочи по количеству команд, стаканчик, раствор мёда, кусочки яблока, наборы
карточек с формулами кислот по числу команд.
Тип урока: урок изучения нового материала.
Тема урока: «Кислоты, их состав и название»
Цель урока: Сформировать комплекс знаний у учащихся о кислотах как классе неорганических веществ.
Задачи:
Образовательные:
Изучить строение, свойства, классификацию, нахождение в природе, области применения кислот.
Воспитательные:
воспитать активную жизненную позицию. продолжать формировать научно-материалистическое мировоззрение: познаваемость окружающего мира, необходимость соблюдения правил техники безопасности при работе с кислотами, культуру выполнения химического эксперимента.
Развивающие:
Стимулировать обучающихся к целеполаганию, планированию деятельности, проведению эксперимента, наблюдению, анализу индивидуальных достижений, умению делать выводы, умению слушать и слышать другого человека;
Обеспечить
формирование познавательных, коммуникативных, регулятивных универсальных
учебных действий обучающихся; Использовать возможности ИКТ,
Интернет-ресурсов и других информационных источников при выполнении домашних
заданий и представлении результатов.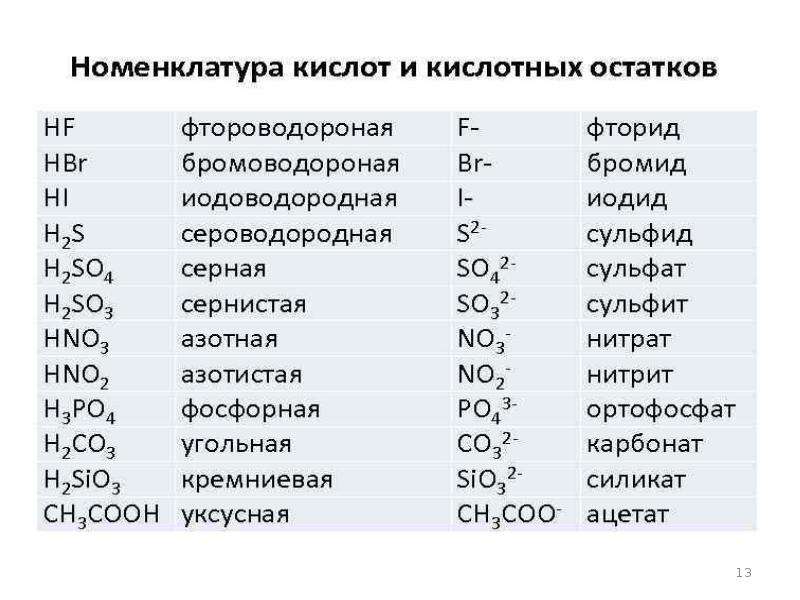
Тип урока: урок усвоения новых знаний
Планируемый результат:
Знать определение, состав кислот и их классификацию;
Знать правила техники безопасности при работе с кислотами;
Знать важнейшие неорганические кислоты;
Уметь определять валентность кислотного остатка и составлять формулы кислот;
Уметь распознавать кислоты с помощью индикаторов;
Уметь использовать возможности ИКТ, Интернет-ресурсов и других информационных источников для выполнения домашних заданий и представления результатов.
Основные понятия:
Кислоты ;
Кислотный остаток;
Систематическая (IUPAC) и историческая номенклатура неорганических кислот;
Индикаторы.
Межпредметные связи: Биология, математика.
Ресурсы:
Основные:
Химия. 8
класс: учебник для общеобразовательных учреждений/ О.С.Габриелян.-М.:Дрофа,
2015.
Химия. Вопросы, задачи, упражнения. 8-9 кл.:учебное пособие для общеобразовательных учреждений/Л.С.Гузей, Р.П.Суровцева.-2-е изд., стереотип. -М.:Дрофа, 2002.-288 с.
Дополнительные:
Библиотекарь (электронная библиотека) http://bibliotekar.ru/
· Фестиваль педагогических идей. Открытый урок. http://festival.1september.ru/
Учительский портал http://www.uchportal.ru/
· Социальная сеть работников образования http://nsportal.ru/
Сеть творческих учителей/химоза http://www.it—n.ru/
Организация пространства: Работа фронтальная, индивидуальная (работа с тестами, подготовка докладов), парная (проведение эксперимента, взаимопроверка, взаимопомощь).
Виды учебной деятельности обучающихся:
Коммуникативные УУД: — обеспечение возможности сотрудничества: умение слышать, слушать и понимать партнера, оказывать поддержку друг другу и эффективно сотрудничать как с учителем, так и со сверстниками, построение речевых высказываний, работа с информацией, построение вопросов;
Личностные УУД: готовность и способность обучающихся к саморазвитию, мотивации к обучению и познанию, самоопределение, ценностно — смысловые установки обучающихся, отражающие их индивидуальноличностные позиции, социальные компетенции, личностные качества;
Регулятивные УУД – целеполагание, самоконтроль, самооценка;
Познавательные УУД – общие
учебные действия, подготовка и решение практических задач, овладение
межпредметными понятиями, расширение опыта специфического для предметной
области (химии), деятельности по получению нового знания, его преобразованию и
применению, а также систему основополагающих элементов научного знания, лежащих
в основе современной научной картины мира.
Приемы и средства обучения: Опора на знания обучающихся, использование алгоритмов, сравнение и анализ, компьютер, мультимедийный проектор, слайды, выполненные в программе Microsoft Power Point, электронное мультимедийное приложениек учебнику изд.
«Дрофа».
Оборудование и реактивы:
На столах учащихся:
периодическая таблица, таблица растворимости, штатив с пробирками, раствор соляной кислоты, раствор гидроксида натрия, в чашечках Петри дольки лимона, яблока, мандарина; индикаторы: фенолфталеин, лакмус, метилоранж, универсальный; стеклянные палочки, карточки для самостоятельной работы.
На столе учителя: Канапе из фруктов и овощей, раствор серной кислоты, вода, индикаторы, штатив с пробирками, компьютер.
В классе: таблица растворимости, периодическая таблица Менделеева
Ход урока
“Ум заключается не только в знании, но и в умении прилагать знание на деле”. (Аристотель)(слайд№2)
(Аристотель)(слайд№2)
1. Организация класса и краткое повторение материала.
Приветствие класса, посадка на места.
v Вспомните, на какие группы классифицируют неорганические соединения? ( На оксиды, основания, кислоты и соли).
v Назовите какие из них мы с вами уже изучили. (Оксиды и основания).
v Дайте определение класса оксиды.
Поиграем в крестики нолики, назовите выигрышный путь, который составляют оксиды. Слайд№3
v Дайте им название Слайд№4
Выпишем на доске и в тетради неизвестные нам соединения в столбик.
v Дайте определение класса оснований.
Поиграем в крестики нолики, назовите выигрышный путь, который составляют основания. Слайд №5
v Дайте им название Слайд№6
2. Многообразие кислот
Выписанные нами в
столбик вещества это жители страны кислот – кислоты. Сегодня на уроке
мы с вами будем их рассматривать. В стране кислот есть королева. Известно о
ней только имя серная кислота. Говорят, что характер её многогранен. Но вы
сможете сами о ней все сказать, узнав материал нашего урока, и
познакомитесь с теми, кто ещё населяет эту страну.
В стране кислот есть королева. Известно о
ней только имя серная кислота. Говорят, что характер её многогранен. Но вы
сможете сами о ней все сказать, узнав материал нашего урока, и
познакомитесь с теми, кто ещё населяет эту страну.
Записываем в тетради тему урока. «Кислоты» (слайд№7)
v Предположите. Что вы узнаете сегодня на уроке?
После изучения данной темы вы должны знать: что такое кислоты, какие они бывают, как их классифицируют, уметь называть кислоты, распознавать их среди других соединений, уметь составлять формулы кислотных оксидов, знать правила техники безопасности при работе с кислотами.
Вокруг нас огромное количество кислот: молочная кислота образуется в мышцах при мышечной нагрузке, муравьи разбрызгивают муравьиную кислоту, защищаясь от врагов, а соляная входит в состав желудочного сока, помогая переваривать пищу. Слайд№8
В фруктах содержится виноградная, яблочная, лимонная кислоты Слайд№9
Кислоты
в составе которых есть углерод органические, а другие неорганические. Слайд№10
Слайд№10
Все не раз ели лимон. Попробуйте еще раз лимон
v Какой он на вкус?
Кислый. Отсюда и название класса – кислоты
(Но встречаются и другие кислоты: горькие — никотиновая, сладкие –салициловая, безвкусная –стеариновая, фосфорная –приятная на вкус.)
(Слайд№11.)
Угощенья не спроста,
На вкус все кислое слегка –
Лимончик, киви, апельсин
И яблочко и мандарин!
Знаешь ты, и знаю я,
Знают даже бегемоты –
Содержат вкусности – кислоты.
Но не один химик не подумает распознавать таким образом кислоты – это может быть смертельно опасно. К кислотам относят и знаменитую цианистоводородную и страшную серную кислоты, поэтому проще и безопаснее распознавать кислоты, с помощью специальных веществ-указателей
v Как
они называются? (Индикаторы).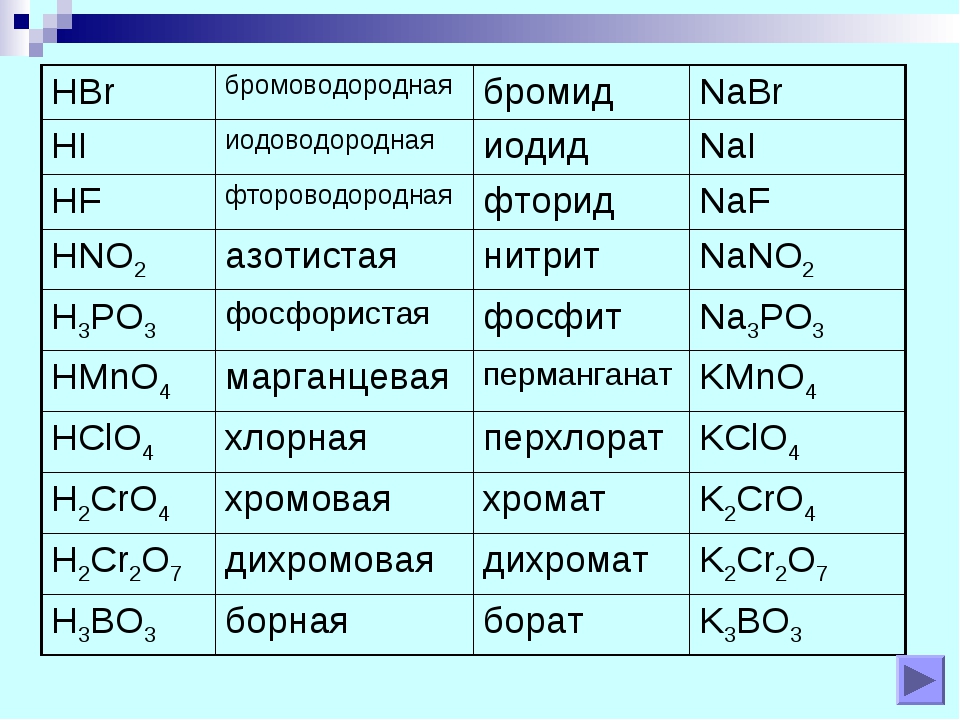
Сейчас вам предстоит провести лабораторный опыт по исследованию изменений окраски индикаторов в кислотных средах.
Правила техники безопасности: Слайд № 12,13,14
Внимание! Работать с кислотами необходимо аккуратно, так как можно получить ожог или отравление. При попадании кислоты на кожу надо смыть ее струей воды.
У вас имеются на партах инструктивные карты и необходимое оборудование и реактивы. Читая внимательно инструкцию, выполните опыты, соблюдая правила техники безопасности (они тоже есть в инструкции).
Итак, приступаем.
3. Лабораторный опыт.
Изменение окраски индикатора в кислой среде органической и неорганической кислот
ИНСТРУКТИВНАЯ КАРТА:
Форма работы: парная.
Время работы – 8-10 минут.
Задание:
Исследовать окраску индикаторов в кислотных средах. Слайд № 15
Оборудование и реактивы:
3 пробирки с соляной и 3 пробирки с лимонной кислотами, лакмусовая бумажка, жидкие фенолфталеин, метилоранж и универсальный индикатор
Проведение опыта и оформление результатов:
1)
Вклейте в тетрадь таблицу: «Действие кислот на индикаторы».
2) Смочите соляной кислотой (HCl) из 1-ой пробирки лакмусовую бумажку. Результаты наблюдений (изменение окраски бумажки) запишите в таблицу.
Затем в эту же пробирку с кислотой добавьте каплю фенолфталеина. Перемешайте стеклянной палочкой.
Результаты наблюдений запишите в таблицу.
Во 2-ую пробирку с соляной кислотой добавьте каплю метилоранжа. Перемешайте стеклянной палочкой. Результаты наблюдений запишите в таблицу.
3) Повторите опыты, описанные выше в пункте 2), используя две другие пробирки с лимонной кислотой.
Не забывайте результаты наблюдений фиксировать в таблице!
ДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫ
Индикатор | Окраска индикатора в воде | Окраска индикатора в растворе соляной кислоты (HCl) | Окраска индикатора в лимонной кислоте |
Лакмусовая бумажка | фиолетовая |
|
|
Фенолфталеин | Бесцветная |
|
|
Метилоранж | Оранжевая |
|
|
Обсуждение результатов и формулирование выводов:
v Как можно определить раствор кислоты среди других веществ?
(Раствор кислоты
среди других веществ можно определить с помощью индикаторов).
v Какие индикаторы изменили свой цвет в кислотах?
(Лакмус и метилоранж).
v Одинаковые ли изменения цвета этих индикаторов вы наблюдали в обеих кислотах? (Да).
v Какую окраску приобрели лакмус и метилоранж и в соляной, и в лимонной кислотах? Слайд№16
(Лакмус стал красным, а метилоранж — розовым). (загадки)
На основании проведенных опытов сделаем выводы:
- независимо от вида кислоты (органической или неорганической) индикаторы изменяют свой цвет одинаково;
- а это означает, что все кислоты обладают сходными свойствами.
v С чем же это связано?
Для того чтобы объяснить сходные свойства кислот, необходимо изучить их состав.
4. Изучение нового материала с элементами самостоятельной работы.
Определение общей формулы кислот
v Прочитайте
вслух формулы кислот, которые записаны в тетради и на доске (HCl, H2SO4,
H3PO4). Слайд №17
Слайд №17
v Что общего во всех этих формулах? ( Все сложные вещества и содержат элемент Н).
v Значит, с каким элементом связаны все общие свойства кислот? (С водородом)
СЛЕДОВАТЕЛЬНО, все общие свойства кислот, в том числе изменение окраски индикаторов, связаны с элементом водородом.
v На каком месте в формуле кислоты записывают знак водорода? (На первом).
Если закрыть водород, то остальная часть молекулы называется кислотным остатком.
Запишите в тетрадь общую формулу для всех кислот
Н кислотный остаток
v В кислотах разные кислотные остатки? (Да).
СЛЕДОВАТЕЛЬНО, специфические свойства каждой кислоты связаны с наличием в них разных кислотных остатков.
Прочитайте кислотные остатки.
Определение зарядов ионов
v Сколько частей можно выделить в молекулах кислот? (Две).
v А сколько видов ионов содержится в
этих кислотах? (Два: один — ион Н, другой — ион
кислотного остатка).
Запишите формулу H2SO4
v Чему равен заряд иона Н? (+).
v Какой по знаку будет заряд иона кислотного остатка? (Отрицательным).
v А как можно определить число этого заряда?
Оказывается для этого нужно посмотреть на число атомов водорода в формуле кислоты.
v Чему равен заряд иона кислотного остатка в H2SO4, HCl, H3PO4?
v Как же можно на основании всего сказанного выше дать определение кислотам? (Подведение под понятие)
КИСЛОТЫ – это сложные вещества, состоящие из ионов водорода и кислотных остатков.
Физминутка (Слайд№18)
Классификация
v А чем еще кроме разных кислотных остатков отличаются формулы этих кислот?
(Числом атомов водорода). Слайд № 19
А) по основности
v Как
вы думаете можно ли по этому признаку классифицировать кислоты? (Да).
v Откройте учебник с.104 §20 первый абзац и найдите название этого признака. (Число атомов водорода называется основностью кислоты. Признак классификации – основность).
v Какие бывают кислоты по основности? (Одноосновные, двухосновные, трехосновные).
v Назовите по этому признаку другие кислоты.
Б) по наличию кислорода Слайд20
v А чем отличаются кислотные остатки в этих формулах? (Есть или нет кислород).
v На с.102 (второй абзац) найдите название второго признака классификации кислот. (По наличию кислорода).
v Как классифицируют кислоты по этому признаку? (Кислородсодержащие и бескислородные).
v Назовите по этому признаку показываемые мною кислоты.
А теперь мы с вами будем учиться называть кислоты. Слайд №21
Бескислородные
кислоты называют с конца молекулы, соединяя
название последнего элемента через соединительную гласную О со словом водородная, и добавляем название класса соединения — кислота. Слайд№22
Слайд№22
Например:
ПОКАЗЫВАЮ HCl – хлороводородная кислота, другое, чаще употребляемое название ее, – соляная кислота.
Немного о ней: (показываю пузырек с кислотой) – это жидкость, без цвета и запаха, концентрированная дымит на воздухе; содержится в желудке и выполняет две функции: уничтожает большую часть микробов, которые попадают в желудок вместе с пищей, и помогает перевариванию пищи. Желудок готовится к приему пищи заранее: лишь только мы начнем пережевывать пищу, он выделяет желудочный сок, содержащий соляную кислоту. Вот почему так вредно жевать жевательную резинку на голодный желудок, так как сок начнет переваривать стенки самого желудка.
Название кислородсодержащих кислот дает элемент, стоящий в середине формулы. Слайд № 23
Например:
ПОКАЗЫВАЮ H2SO4 и H2SO3 – в середине стоит сера, поэтому первую (у
которой больше кислорода) называют серной (богатая и важная), а вторую
(у которой меньше кислорода) – сернистой (победнее и скромнее).
Немного о серной кислоте: (показываю ее) – это жидкость, без цвета и запаха, хорошо поглощает окружающие пары воды и другие газы. Концентрированная серная кислота требует особого обращения с ней с106 рис 61 Сначала вода потом кислота иначе случится беда. При разбавлении: ее нужно приливать в воду, а не наоборот. Иначе может произойти закипание и выплеск кислоты, что может привести к ожогам рук, глаз и лица. За широкое применение в химическом производстве серную кислоту называют: «Хлебом химической промышленности».
v Назовите кислородсодержащие кислоты запишите названия в столбец
Проверяем Слайд №24
В) По растворимости кислоты делят на 2 группы растворимые и нерастворимые
v А как узнать растворимо вещество или нет? (используя таблицу растворимости)
v Назовите растворимые и нерастворимые. Сколько нерастворимых? (все растворимые кроме одной- кремниевой) Слайд № 26
Г) По
устойчивости делят на устойчивые и неустойчивые. Слайд №27
Слайд №27
Итак, мы познакомились еще с одним классом соединений – кислотами. Давайте дадим характеристику королеве страны кислот серной кислоте (неорганическая, двуосновная, кислородсодержащая, растворимая, устойчивая).
v А как вы думаете, почему серная – королева (Является хлебом химической промышленности)
5. Проверка полученных знаний
Проверим полученные знания в следующем задании. Определите свойства каждой из кислот. Из букв соответствующих правильным ответам, вы составите название индикатора, которым нельзя распознать кислоты, но можно распознать щелочи. Слайд №28,29
Свойства веществ | Название кислоты | ||||
серная | соляная | угольная | кремниевая | сернистая | |
Не существует в свободном виде | П | И | Ф | Б | Е |
Бесцветная жидкость | Н | О | — | Р | — |
Нерастворима в воде | Д | З | С | Л | Й |
Конц. | Ф | У | П | Ю | В |
Растворы изменяют окраску лакмуса | Т | А | Л | С | Е |
Конц кислота поглощает влагу из газов | И | В | Р | Г | Б |
Конц. Кислота дымит на воздухе | У | Н | К | Д | Л |
ФЕНОЛФТАЛЕИН
5. Домашнее задание——————————см
Домашнее задание——————————см
Оричи Володина Татьяна Валериевна
2. Дата – 15 апреля 2014
3. Урок проводился в 8 а классе. Учащиеся в данном классе имеют разный уровень обучаемости и обученности, 6 учеников имеют высокий уровень, 5 – выше среднего, остальные – средний и ниже среднего. Поэтому необходимо давать задания разного уровня, создавать ситуацию успеха. Так, на этапе актуализации применялось упражнение на повторение, которое учащиеся выполняли в парах, на этапе открытия нового знания выполняли эксперимент по инструктивным картам различной сложности, на этапе первичного закрепления рассмотренного на уроке материала предлагался тест, содержащий задания разной сложности с выбором одного и нескольких вариантов ответов. У всех учащихся была возможность заработать на уроке баллы.
4. Тема урока « Химические свойства кислот»
выбрана, следуя рабочей
программе, составленной на основании «Программы курса химии для 8-11 классов
общеобразовательных учреждений», допущенной Министерством образования и науки
Российской Федерации и соответствующей федеральному компоненту государственного
образовательного стандарта.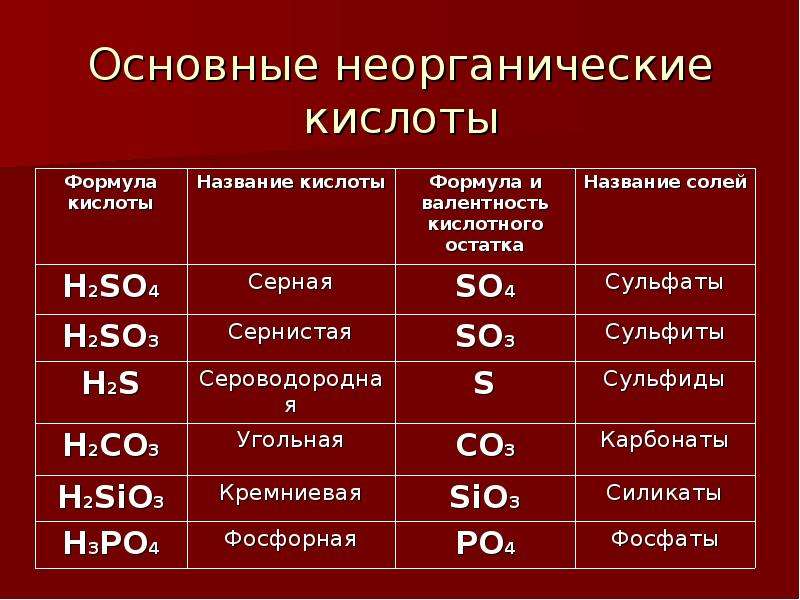 Авторы Н.Е. Кузнецова, И.М. Титова, Н.Н. Гара; 2
часа в неделю
Авторы Н.Е. Кузнецова, И.М. Титова, Н.Н. Гара; 2
часа в неделю
Урок восьмой в Теме 7. « Основные классы неорганических соединений». Всего в данной теме 12часов. На предыдущем уроке вспомнили понятие «основания, щелочи» рассмотрели тему « Химические свойства оснований»
На данном уроке необходимо рассмотреть следующий объем информации: « Генетический ряд неметаллов. Химические свойства кислот. Изменение окраски индикатора в кислой среде. Взаимодействие кислот с металлами. Ряд активности.Реакция нейтрализации». На следующем уроке будем изучать взаимодействие кислот с основными оксидами, с солями.
5. Дидактическая цель: создать условия для осознания и осмысления блока новой учебной информации
Цели по содержанию урока:
* Образовательная: способствовать формированию понятия: кислоты, классификация, строение, свойства
На данном уроке отрабатываются
понятия: кислоты, их классификация причинно-следственные связи: строение- свойства, а именно строение молекулы кислоты и химические свойства;
умения:
— называть оксиды,
основания, кислоты, соли.
— составлять формулы солей, оснований, кислот, оксидов,;
-характеризовать химические свойства кислот;
связь между составом, строением и свойствами веществ.
— составлять уравнения химических реакций,
— распознавать опытным путем растворы кислот ;
-определять принадлежность вещества к определенному классу
* Развивающая:
— продолжить формирование
учебно-интеллектуальных умений учащихся: диалектически анализировать, сравнивать, классифицировать, обобщать, устанавливать причинно-следственные связи, исследовать;
учебно-познавательных умений: участвовать в учебном диалоге, формулировать проблемы, излагать гипотезы, аргументировать, доказывать, исследовать практически (наблюдать, ставить опыты)
* Воспитательная:
— способствовать формированию у учащихся организованности, аккуратности, ответственности, умения вести познавательную деятельность в коллективе, сотрудничать при решении учебных задач
6. Тип урока – изучение
нового материала и первичного закрепления, так как основное время на уроке
уделяю формированию понятия « Химические свойства кислот»
Тип урока – изучение
нового материала и первичного закрепления, так как основное время на уроке
уделяю формированию понятия « Химические свойства кислот»
7. Поставленные цели были реализованы путем рационально выбранной структуры урока.
Этапы урока: Оргмомент. Мотивация и актуализация учебной деятельности учащихся. Целеполагание. Первичное усвоение новых знаний. Осознание, осмысление учебного материала. Информация о домашнем задании. Первичное закрепление рассмотренного на уроке материала. Рефлексия.
Между этапами урока выдержана логическая связь.
Урок начинается с
организационного момента, задача которого — подготовить учащихся к работе на
уроке. (Приветствие друг друга, запись в журнал фамилии тех, кто отсутствует,
проверка готовности ребят к занятию.) Этот этап урока, хотя и был непродолжительным,
позволил быстро включить учащихся в ход урока. Затем была проведена
актуализация опорных знаний – упражнение на классификацию кислот. Задача —
выявить пробелы в знаниях и устранить их, совершенствовать знания и умения,
подготовиться к восприятию новой темы.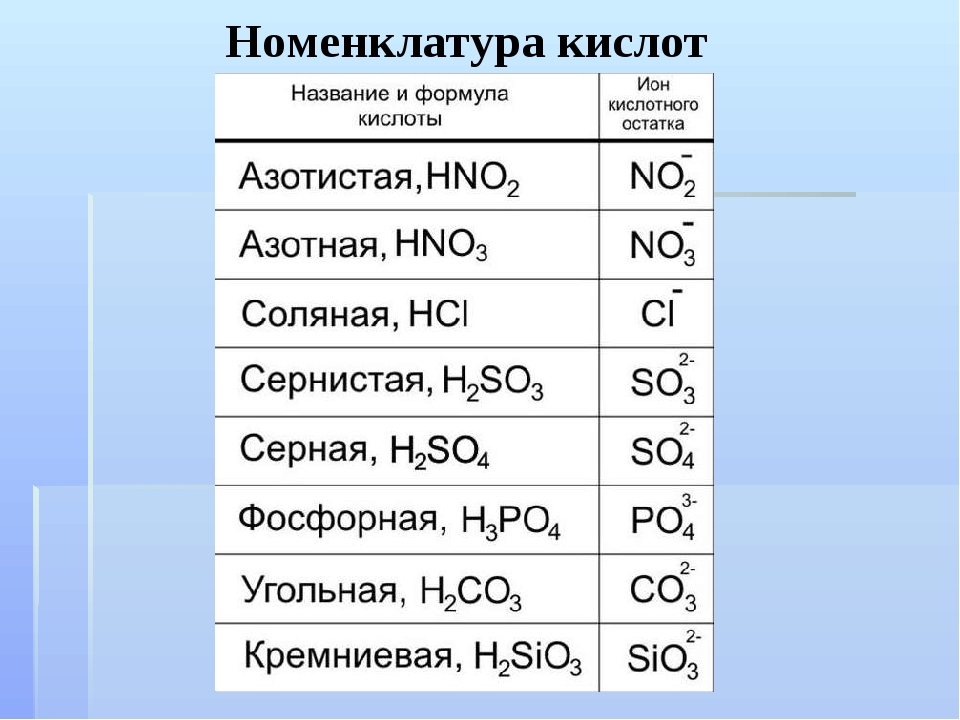 На этапе первичного усвоения учебного
материала в ходе проведения исследования, сделанных выводов и написания
уравнений химических реакций у учащихся формируются понятия «Генетический ряд
неметаллов. Химические свойства кислот. Изменение окраски индикатора в кислой
среде. Взаимодействие кислот с металлами. Ряд активности. Реакция
нейтрализации»
На этапе первичного усвоения учебного
материала в ходе проведения исследования, сделанных выводов и написания
уравнений химических реакций у учащихся формируются понятия «Генетический ряд
неметаллов. Химические свойства кислот. Изменение окраски индикатора в кислой
среде. Взаимодействие кислот с металлами. Ряд активности. Реакция
нейтрализации»
На этапе закрепления проводился тест. //////// Целью этапа закрепления я ставила повторение, воспроизведение усвоенного, но не дословное, а преобразованное, что способствует выработке у учащихся умения применять полученные знания. Завершающим этапом была оценка учителем результатов урока, подведение итогов, комментирование деятельности учащихся, выставление отметок. Проведена рефлексия, целью которой является оценка учащимися насколько занятие было для них познавательным .
На уроке использовались следующие методы обучения:
* методы организации учебной деятельности:
— по источнику передачи и восприятия информации
словесные — диалогическое изложение, эвристическая беседа, межпредметная беседа, объяснение,
наглядные — химический эксперимент, демонстрация символико-графических средств наглядности
— по степени самостоятельности учащихся при овладении знаниями:
Репродуктивные
Проблемно-поисковые
— по степени управления учебной деятельностью
Была организована
самостоятельная деятельность учащихся на разных этапах урока : на этапе
актуализации — выполнение упражнения на ноутбуках, на этапе первичного усвоения
новых знаний учащиеся выполняли эксперимент, на этапе осмысления составляли
уравнения, на этапе закрепления выполняли тестовое задание.
* методы стимулирования интереса к учению – учебная дискуссия, актуализация имеющихся знаний и применение полученных знаний на практике, проблемная ситуация, работа в парах, применение ИКТ
* методы контроля и самоконтроля: устный, письменный контроль
Приемы обучения:
* постановка межпредметных вопросов,
* обращение к жизненному опыту учащегося,
* постановка и решение межпредметных учебных проблем,
* раскрытие причинно-следственных связей,
Средства обучения:
* раздаточный материал- инструктивные карты №1,2,3
* Интерактивная презентация к уроку в программе Smart Notebook
Тест в программе My TestX
* Технические средства обучения: Компьютер мультимедийный
Мультимедийный проектор
Интерактивная доска SMART
Стационарный мобильный класс (12 ноутбуков)
* Реактивы и оборудование:
соляная кислота, серная
кислота, метилоранж, лакмус, гидроксид натрия, железо, цинк, медь, штатив с
пробирками.
Для демонстрационных опытов: серная кислота, оксид меди(2), оксид магния, карбонат натрия, хлорид бария, спиртовка, спички, держатель, штатив с пробирками.
На уроке царила доброжелательная обстановка. Поддерживался положительный эмоциональный настрой урока, что способствует развитию познавательного интереса учеников к предмету.
Высокая работоспособность и доброжелательная психологическая атмосфера, интерес на уроке поддерживался за счет разнообразия заданий, за счет использования ИКТ, проведения опыта, эмоциональной подачи материала, смены видов деятельности и темпа урока.
Аннотация к уроку по теме: «Кислоты»
Урок по химии на тему «Кислоты». Урок проводился в 8 классе.
Обучение
химии ведется по общеобразовательной программе, по учебнику Г.Е. Рудзитис, Ф.Г.
Фельдман. Химия 8 класс. М. «Просвещение». 2015 год. Урок по разделу
«Важнейшие классы неорганических соединений». Согласно базисному учебному
плану на изучение химии в 8 классе отводится 2 часа в неделю, в год 68
часов.
М. «Просвещение». 2015 год. Урок по разделу
«Важнейшие классы неорганических соединений». Согласно базисному учебному
плану на изучение химии в 8 классе отводится 2 часа в неделю, в год 68
часов.
Основные этапы урока:
1. Организационный момент.
2. Актуализация знаний, создание проблемной ситуации.
3. Этап целеполагания на урок.
4. Этап «Открытие нового знания».
5. Создание проблемной ситуации.
6. Закрепление изученного материала.
7. Этап рефлексии.
8. Домашнее задание.
Химия является частью естественнонаучного образования. Изучение зависимости
свойств веществ от состава и строения, природы химических связей и способов их
преобразования при химических реакциях, обусловленности многообразия веществ и
методов их практического использования составляет основу таких
мировоззренческих идей, как материальное единство органических и неорганических
веществ, единство и взаимосвязь способов химического движения материи.
Химический эксперимент применяется для добывания школьниками новых знаний, постановки перед ними познавательных проблем. Решение их с использованием эксперимента ставит учащихся в положение исследователей. Нарастает самостоятельная поисковая деятельность школьников. Совершенствуется форма организации коллективной учебной деятельности и взаимопомощи школьников.
Цели урока: сформировать понятие о кислотах, как об одном из классов химических соединений; изучить состав, строение, химические свойства.
Задачи урока:
Ø Предметные: усвоение новых знаний на основе имеющихся, самостоятельный поиск новых знаний из различных источников и закрепление практических умений и навыков; формирование навыка безопасной работы с химическим оборудованием.
Ø
Метапредметные: развитие познавательного интереса, самостоятельности мышления,
памяти, инициативы учащихся через использование коммуникативно-деятельностной
методики, частично-поискового подхода и элементов проблемного обучения.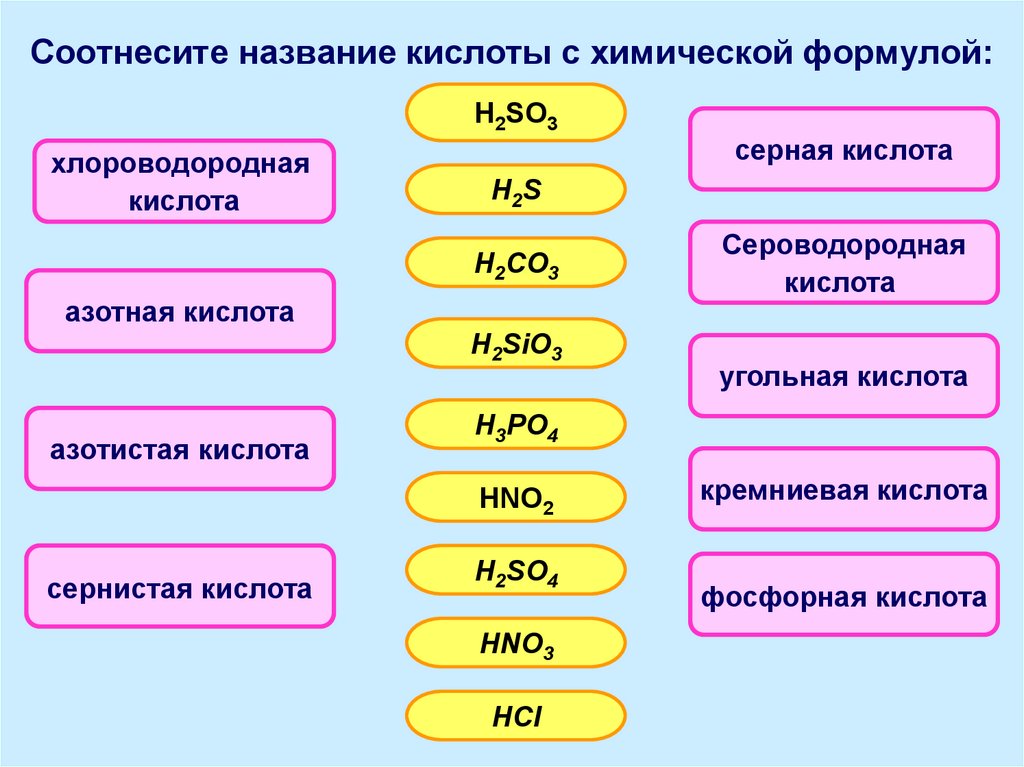
Ø Личностные: формирование коммуникативных умений, культуры общения, сотрудничества.
Методы проведения: исследовательский эксперимент, самостоятельная работа учащихся.
Форма проведения урока: групповая работа.
Ключевые компетенции:
Ø Информационно-познавательная: умение работать с дополнительной литературой, конспектировать, выбирать главное, делать выводы.
Ø Коммуникативная: ведение дискуссии, умение доказать свою точку зрения.
Ø Предметные: исследование строения и свойств кислот; изучение классификации, строения, свойств и применения кислот.
Оборудование: учебники, таблица растворимости, аскорбиновая кислота в таблетках; растворы соляной, азотной, серной кислот, индикаторы, пробирки с растворами кислот и щелочи по количеству команд, стаканчик, раствор мёда, кусочки яблока, наборы карточек с формулами кислот по числу команд.
Тип урока: урок изучения нового материала.
Аннотация к уроку по теме: «Кислоты»
Урок по
химии на тему «Кислоты». Урок проводился в 8 классе.
Урок проводился в 8 классе.
Обучение химии ведется по общеобразовательной программе, по учебнику Г.Е. Рудзитис, Ф.Г. Фельдман. Химия 8 класс. М. «Просвещение». 2015 год. Урок по разделу «Важнейшие классы неорганических соединений». Согласно базисному учебному плану на изучение химии в 8 классе отводится 2 часа в неделю, в год 68 часов.
Основные этапы урока:
1. Организационный момент.
2. Актуализация знаний, создание проблемной ситуации.
3. Этап целеполагания на урок.
4. Этап «Открытие нового знания».
5. Создание проблемной ситуации.
6. Закрепление изученного материала.
7. Этап рефлексии.
8. Домашнее задание.
Химия является частью естественнонаучного образования. Изучение зависимости
свойств веществ от состава и строения, природы химических связей и способов их
преобразования при химических реакциях, обусловленности многообразия веществ и
методов их практического использования составляет основу таких
мировоззренческих идей, как материальное единство органических и неорганических
веществ, единство и взаимосвязь способов химического движения материи.
Химический эксперимент применяется для добывания школьниками новых знаний, постановки перед ними познавательных проблем. Решение их с использованием эксперимента ставит учащихся в положение исследователей. Нарастает самостоятельная поисковая деятельность школьников. Совершенствуется форма организации коллективной учебной деятельности и взаимопомощи школьников.
Цели урока: сформировать понятие о кислотах, как об одном из классов химических соединений; изучить состав, строение, химические свойства.
Задачи урока:
Ø Предметные: усвоение новых знаний на основе имеющихся, самостоятельный поиск новых знаний из различных источников и закрепление практических умений и навыков; формирование навыка безопасной работы с химическим оборудованием.
Ø
Метапредметные: развитие познавательного интереса, самостоятельности мышления,
памяти, инициативы учащихся через использование коммуникативно-деятельностной
методики, частично-поискового подхода и элементов проблемного обучения.
Ø Личностные: формирование коммуникативных умений, культуры общения, сотрудничества.
Методы проведения: исследовательский эксперимент, самостоятельная работа учащихся.
Форма проведения урока: групповая работа.
Ключевые компетенции:
Ø Информационно-познавательная: умение работать с дополнительной литературой, конспектировать, выбирать главное, делать выводы.
Ø Коммуникативная: ведение дискуссии, умение доказать свою точку зрения.
Ø Предметные: исследование строения и свойств кислот; изучение классификации, строения, свойств и применения кислот.
Оборудование: учебники, таблица растворимости, аскорбиновая кислота в таблетках; растворы соляной, азотной, серной кислот, индикаторы, пробирки с растворами кислот и щелочи по количеству команд, стаканчик, раствор мёда, кусочки яблока, наборы карточек с формулами кислот по числу команд.
Тип урока: урок изучения нового материала.
Конспект урока химии «Кислоты»; 8 класс — К уроку — Химия
Разработка урока по теме «Кислоты»
Преподаватель химии — Зайцева Азияна Кан-Маадыровна
Образовательное учреждение -ФГКОУ «Кызылское ПКУ»
Класс — 8
Учебник — Габриелян О. С. «Химия. 8 класс», 2015 год.
С. «Химия. 8 класс», 2015 год.
Тема урока: «Кислоты»
Цель урока: организовать учебную деятельность по усвоению обучающимися состава, номенклатуры и классификации кислот.
Задачи:
Образовательные— продолжить знакомство с основными классами неорганических соединений; сформировать представление о кислотах, умение выделять существенные признаки принадлежности к данному классу; сформировать практические умения определения кислот с помощью индикаторов; сформировать знания номенклатуры и классификации кислот.
Развивающие— развивать умения поиска решения поставленных проблем; развивать навыки составления кластера, отражения основной информации в буклете; развитие приемов логического мышления – умения сравнивать, обобщать, конкретизировать, делать выводы; развитие коммуникативных качеств при работе в группе.
Воспитательные — воспитание любознательности и стремления к активному познанию окружающей действительности.
Тип урока: урок изучения нового материала.
Планируемые результаты:
Предметные результаты: овладение терминологией: кислоты, основность кислот; умение распознавать кислоты среди других веществ, составлять формулы кислот и называть их, знать их классификацию; умение грамотно организовать работу в группе;формирование умений выделять главное в тексте параграфа; формирование навыков планирования ответа.
Метапредметные результаты: умение применять знания, полученные по другим предметам; умение участников группы выстраивать и обосновывать свой ответ при решении проблемного вопроса.
Личностные результаты: формирование интереса к предмету через разные виды работы; умение соотносить свои действия с планируемым результатом, корректировать их.
Применяемые элементы технологий: технология проблемного обучения, технология развития критического мышления, моделирования, ИКТ.
Методы обучения: объяснительно-иллюстративный, частично-поисковый, проблемный, эвристический.
Формы организации познавательной деятельности обучающихся:фронтальная, групповая, парная.
Средства обучения: интерактивная доска, проектор, презентация, учебник, рабочие тетради, карточки-инструктажи, маркеры, ватман,карточки «настроение».
Оборудование и реактивы:лимон, ножик, стакан, соляная кислота, индикаторы, стеклянные палочки, штативы с пробирками, гранулы цинка,железа, медная проволока.
Образовательный продукт урока: опорный конспект, кластер, химическая закладка — буклет.
Технологическая карта урока
Этап занятия | Задачи этапа | Деятельность педагога | Деятельность обучающихся
| Формируемые УУД | Время этапа |
1.
| Создать положительный эмоциональный настрой;настроить кадет на предстоящую деятельность | Проверка внешней и внутренней (психологической) готовности кадет к уроку.
| 1.Приветствие. 2.Пользуясь карточками «настроение», показывают свою психологическую готовность к уроку. | Личностные (организовывать свое рабочее место) Регулятивные(волевая саморегуляция-способность к мобилизации сил и энергии; способность к волевому усилию) | 1 |
2.Вызов | Актуализация имеющихся знаний у кадет по изучаемому материалу, заинтересовать их | Мотивация к учебной деятельности Обращение к жизненному опыту детей. Сегодня на уроке для нас опорными станут знания, приобретенные вами в повседневной жизни и возможно на других предметах. Итак, смотрим видеоматериал.Приложение 1. Беседа: 1) Кем по профессии является герой из видеофильма? Стоматолог. Слайд 1. 2) Стоматолог говорил о каком-то веществе. Вы догадались, какое это вещество? 3) Какую профессию представляет следующий герой? Кондитер. 4) Какое вещество используют для разрыхления теста? 5) Вы узнали кто это? О чем говорит водитель? Преподаватель Какие вещества используют в своей работе герои фильма? |
Смотрят видеоматериал. Высказывают свои предположения, аргументируют свой ответ.
| Личностные (проявлять внимание, воспринимать речь одноклассников)
Коммуникативные (отстаивать свою точку зрения, приводить аргументы)
Познавательные (формирование познавательного интереса; развитие логического мышления) | 5 |
3.
| Изучение нового материала через организацию разных видов деятельности.
| Тема урока: Кислоты Определите цель и задачи урока, что бы вы хотели узнать о кислотах? Слайд 2,3
Предлагаю к концу урока придумать творческое название урока. А. Фронтальная работа/ Парная работа (Оформление буклета по теме урока). Приложение 2. Применение кислот — Какие еще кислоты вам известны? Слайд 4. — Где используются кислоты? а) в медицине, б) в кулинарии, в) содержатся в фруктах, г) в организме животных и человека и т.д. Состав кислот Задание «Круги». На интерактивной доске 2 пересекающихся круга.
Преподаватель: Вам предложены формулы следующих веществ. Подумайте в каком порядке вы их запишете? Напишите их название. HCl H2SO4 HBr HNO3 H2SH3PO4 Эвристическая беседа — Как называются эти соединения? — Объясните, по какому признаку вы распределили кислоты? — Посмотрите на формулы кислот. Что общего в их строении? Слайд 5,6 — Вспомните, чему равна валентность атома водорода? (I). Как нам определить валентность кислотного остатка? Работа с учебником— прочитать определение кислот. Б. Групповая работа Слайд 7. Классификация и свойства кислот Задание 1 группы:изучить классификацию кислот и составить кластер. Приложение 3. Задание 2 группы: исследовать окраску индикаторов в кислотных средах. Приложение 4. Задание 3 группы: исследовать взаимодействие соляной кислоты с разными металлами.Приложение 5. Задание 4 группы: составить формулы кислот из половинок , привести названия. Правила ТБ.Какие существуют меры предосторожности при работе с кислотами? Слайд 8.
В. Проверка групповой работы. Слайд 9, 10. Г. Подведение итогов изучения темы – защита парной работы. | Формулируют цель и задачи урока.
Продолжают обсуждение применения кислот.
Зарисовывают круги в тетрадь, выполняют задание.
Работают в тетрадях и на интерактивной доске.
Формулируют определение кислот.
Работают в группах, итоги работы оформляют на доске.
Повторяют правила техники безопасности с кислотами. Защита групповой и парной работ.
| Личностные (проявлять внимание, желание больше узнать; формирование познавательных интересов) Регулятивные (самостоятельно определять цель и задачи предстоящей учебной деятельности) Коммуникативные (отстаивать свою точку зрения, приводить аргументы, воспринимать текст с учетом поставленной учебной задачи) Познавательные (формирование химического языка; установление причинно-следственных связей, развитие логического мышления) | 30 |
4. Применение полученных знаний в новой ситуации
| Закрепить на практике полученные знания. | 1. Тестовая работа. 2. Индивидуальная работа на доске. Прием: сравнение веществ по нескольким основаниям НСLи NaCL. Приложение 6. Таким образом, NaCL и подобные ему вещества мы рассмотрим на следующем уроке. | 1.Выполняют задание в тетрадях для оценки качества знаний. 2.Индивидуальная работа оформляется на интерактивной доске.
| Регулятивные (отслеживать продвижение в выполнении задания; оценивать собственную учебную деятельность)
| 6 |
5.Военная составляющая урока | Сформировать первичные знания о составе взрывчатых веществ. | Военная промышленность применяет кислоту при изготовлении взрывчатых веществ. Слайд 11.
|
|
| 1 |
6.Подведение итогов
| Обобщить результаты работы, выработать общее мнение. | Оцените свою работу на уроке. Подводит итог урока, объявляет оценки за урок. — Предложите творческое название к уроку.
| Делают выводы о достижении поставленных целей. | Регулятивные (анализировать достижение целей) | 1 |
7.Домашнее задание | Комментирование домашнегозадания. | Домашнее задание: § 21 упр.1-4 стр. | Записывают домашнее задание. | Регулятивные (самостоятельно определять задачи предстоящей учебной деятельности;осознавать конечный результат) | 1 |
О.С. Габриелян. Химия. 8 класс Учебник для общеобразовательных учреждений Москва «Дрофа», 2015 г.
М.Ю. Горшковенко, Химия. 8 класс: поурочные разработки. – М.: ВАКО, 2004
О.С. Габриелян., А.В. Яшукова. Химия. 8-9 классы: метод.пособие. – М.: Дрофа, 2008
Мультимедийное приложение к УМК «Химия. 8 кл.»
http://nsportal.ru
http://festival.1september.ru
Урсоловая кислота
Рекламный проспект
УРСОЛОВАЯ КИСЛОТА
потенциальный компонент медицинских препаратов
и косметических средств
Урсоловая кислота – пентациклическое тритерпеновое соединение, обнаруженное в многочисленных растениях, например, в листьях и плодах брусники, черники, клюквы, облепихи, толокнянки, боярышника, рододендронов и многих других, издавна используемых народной медициной растениях. Установлено, что собственно урсоловая кислота, её смеси с сопутствующей олеаноловой и помоловой кислотами и их коньюгаты с природными сахарами проявляют антимикробную, противовоспалительную, геронтопротекторную (гипохолестеринемическую, кардиостимулирующую и противоатеросклеротическую), а также другие виды биоактивности, благотворно влияющие на здоровье человека.
Установлено, что собственно урсоловая кислота, её смеси с сопутствующей олеаноловой и помоловой кислотами и их коньюгаты с природными сахарами проявляют антимикробную, противовоспалительную, геронтопротекторную (гипохолестеринемическую, кардиостимулирующую и противоатеросклеротическую), а также другие виды биоактивности, благотворно влияющие на здоровье человека.
В Опытном Химическом Производстве НИОХ СО РАН разработаны эффективные технологии извлечения урсоловой кислоты высокой чистоты (содержание основного вещества 90-98%), а также её композиции с олеаноловой кислотой (в соотношении 4:1) из растительного сырья – отходов производств соков, джемов и т.п. в пищевой промышленности.
Области применения
Урсоловая кислота используется в фармакологии как компонент преимущественно профилактических препаратов, в том числе, против лимфоцитной лейкемии, опухолевых новообразований, в качестве модификатора протеинового синтеза. Возможно использование урсоловой кислоты в лечебных косметических средствах и как химический реактив для научных исследований.
Патентная защита
Патент РФ № 2329048 от 31.10.2006 г. «Способ получения урсоловой кислоты».
Коммерческие предложения
Производство продукции по заказам.
Поиск партнеров (предприятий) для организации выпуска лекарственных форм.
Ориентировочная стоимость
Цена договорная.
630090, г. Новосибирск, 90, просп. Академика Лаврентьева, 9
Новосибирский институт органической химии им. Н.Н. Ворожцова СО РАН
Тел.: 8(383) 330-73-93 Щукин Геннадий Иванович, к.х.н.
Факс: 8(383) 330-97-52 E-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
классификация, номенклатура, физические и химические свойства
Из материалов урока Вы познакомитесь с разными способами классификации кислот, расширите свои знания о физических и химических свойствах кислот.
I. Посмотрите видео-презентацию
Кислоты — сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков.
Состав кислот отражен в их названии. Например, у бескислородных кислот название всегда включает название элемента и слово «водородная»:
HCl – хлороводородная, h3S – сероводородная.
Названия кислородсодержащих кислот тоже подчиняются определенным правилам. К названию химического элемента прибавляется суффикс н или ов(ев) и окончание –ая, если число атомов кислорода в молекуле кислоты наибольшее:
H2SO4 — серная
HNO3 – азотная
H2SiO3 — кремниевая
Если в молекуле кислоты число атомов кислорода меньше максимального, то часто в названии используют суффикс ист:
H2SO3 – сернистая
HNO2 – азотистая
Это интересно
Всегда ли кислоты называли кислотами?
Названия неорганических кислот долгое время никак не были связаны с присущим им кислым вкусом. Так, серную кислоту называли купоросным маслом или купоросным спиртом, хлороводородную (соляную) кислоту — соляным спиртом или кислым спиртом, азотную кислоту — селитряной дымистой водкой или крепкой водкой; смесь азотной и хлороводородной кислот называли царской водкой. Названия эти пришли из языка алхимиков и не отражали особенностей строения кислот.
II. Классификация кислот
1. По числу атомов водорода: число атомов водорода (n) определяет основность кислот:
n = 1 одноосновная
n = 2 двухосновная
n = 3 трехосновная
2. По составу:
а) Таблица кислород содержащих кислот, кислотных остатков и соответствующих кислотных оксидов:
|
Кислота (НnА) |
Кислотный остаток (А) |
Соответствующий кислотный оксид |
|
HClO4 хлорная |
ClO4 (I) перхлорат |
Cl2O7 оксид хлора (VII ) |
|
H2SO4 серная |
SO4 (II) сульфат |
SO3 оксид серы (VI ), серный ангидрид |
|
HNO3 азотная |
NO3 (I) нитрат |
N2O5 оксид азота ( V ) |
|
HMnO4 марганцовая |
MnO4 (I) перманганат |
Mn2O7 оксид марганца (VII ) |
|
H2SO3 сернистая |
SO3 (II) сульфит |
SO2 оксид серы (IV ) |
|
H3PO4 ортофосфорная |
PO4 (III) ортофосфат |
P2O5 оксид фосфора (V ) |
|
HNO2 азотистая |
NO2 (I) нитрит |
N2O3 оксид азота (III ) |
|
H2CO3 угольная |
CO3 (II) карбонат |
CO2 оксид углерода ( IV), углекислый газ |
|
H2SiO3 кремниевая |
SiO3 (II) силикат |
SiO2 оксид кремния (IV) |
б) Таблица бескислородных кислот
|
Кислота (НnА) |
Кислотный остаток (А) |
|
HCl соляная, хлороводородная |
Cl (I) хлорид |
|
H2S сероводородная |
S(II) сульфид |
|
HBr бромоводородная |
Br (I) бромид |
|
HI йодоводородная |
I(I) йодид |
|
HF фтороводородная, плавиковая |
F(I) фторид |
III. Физические свойства кислот
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3. Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
H2SO3 HClO4 HNO3
IV. Способы получения кислот
|
Бескислородные |
Кислородсодержащие |
|
HCl, HBr, HI, HF, H2S |
HNO3, H2SO4 и другие |
|
ПОЛУЧЕНИЕ |
|
|
1. Прямое взаимодействие неметаллов H2 + Cl2 = 2 HCl |
1. Кислотный оксид + вода = кислота SO3 + H2O = H2SO4 |
|
2. Реакция обмена между солью и менее летучей кислотой 2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl |
|
V. Химические свойства кислот
1. Изменяют окраску индикаторов
|
Название индикатора |
Нейтральная среда |
Кислая среда |
|
Лакмус |
Фиолетовый |
Красный |
|
Фенолфталеин |
Бесцветный |
Бесцветный |
|
Метилоранж |
Оранжевый |
Красный |
|
Универсальная индикаторная бумага |
Оранжевая |
Красная |
2.Реагируют с металлами в ряду активности до H2 (искл. HNO3 –азотная кислота)
Видео: «Взаимодействие кислот с металлами»
Ме + КИСЛОТА =СОЛЬ + H2↑ (р. замещения)
Zn + 2 HCl = ZnCl2 + H2
3. С основными (амфотерными) оксидами – оксидами металлов
Видео: «Взаимодействие оксидов металлов с кислотами»
МехОу + КИСЛОТА= СОЛЬ + Н2О (р. обмена)
CuO + H2SO4 = Cu SO4 + H2O
4. Реагируют с основаниями – реакция нейтрализации
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H2O ( р. обмена)
H3PO4 + 3NaOH = Na3PO4 + 3H2O
5. Реагируют с солями слабых, летучих кислот — если образуется кислота, выпадающая в осадок или выделяется газ:
2NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl↑ ( р. обмена)
|
Сила кислот убывает в ряду: HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HMnO4 > H2SO3 > H3PO4 > HF > HNO2>H2CO3 > H2S > H2SiO3 . Каждая предыдущая кислота может вытеснить из соли последующую |
Видео: «Взаимодействие кислот с солями»
6. Разложение кислородсодержащих кислот при нагревании ( искл. H2SO4; H3PO4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду:
H2CO3 ↔ H2O + CO2↑
H2SO3 ↔ H2O + SO2↑
Сероводородная кислота в продуктах выделяется в виде газа: СаS + 2HCl = H2S↑ + CaCl2
Видео: «Химические свойства соляной кислоты»
VI. Значение кислот
Роль кислот в нашей жизни трудно не заметить. Во-первых, в желудочном соке человека и животных содержится слабый раствор соляной кислоты. Муравьиная кислота, которая относится к группе органических кислот, содержится в жидкости, выделяемой муравьями, и ожог от крапивы обусловлен действием на кожу именно этой кислоты.
Рис. 1. Кислоты в природе (в лимонном соке содержится лимонная кислота; в жидкости, выделяемой муравьями – муравьиная кислота)
На этикетке многих газированных фруктовых напитков написано, что в их состав входит фосфорная кислота. Азотная кислота используется в производстве минеральных удобрений и взрывчатых веществ. Серную кислоту применяют в производстве аккумуляторных батарей.
VII. Техника безопасности приработе с кислотами
Анимация: Оказание первой помощи при попадании кислот на кожу
Анимация: Правила техники безопасности при работе с кислотами
Анимация: Правило разбавления концентрированной серной кислоты водой
VIII. Задания для закрепления
Задание №1. Распределите химические формулы кислот в таблицу. Дайте им названия:
LiOH, Mn2O7, CaO, Na3PO4, H2S, MnO, Fe(OH)3, Cr2O3, HI, HClO4, HBr, CaCl2, Na2O, HCl, H2SO4, HNO3, HMnO4, Ca(OH)2, SiO2, H2SO3, Zn(OH)2, H3PO4, HF, HNO2,H2CO3, N2O, NaNO3, H2S, H2SiO3
|
Кислоты |
||||||
|
Бескислородные |
Кислородосодержащие |
Растворимые
|
Нерастворимые |
Одноосновные |
Двухосновные |
Трёхосновные |
Задание №2. Составьте уравнения реакций:
Ca + HCl =
Na + H2SO4 =
Al + H2S =
Ca + H3PO4 =
Назовите продукты реакции.
Задание №3. Составьте уравнения реакций, назовите продукты:
Na2O + H2CO3 =
ZnO + HCl =
CaO + HNO3 =
Fe2O3 + H2SO4 =
Задание №4. Составьте уравнения реакций взаимодействия кислот с основаниями и солями:
KOH + HNO3 =
NaOH + H2SO3 =
Ca(OH)2 + H2S =
Al(OH)3 + HF =
HCl + Na2SiO3 =
H2SO4 + K2CO3 =
HNO3 + CaCO3 =
Назовите продукты реакции.
IX. Тренажеры
Тренажёр №1. «Формулы и названия кислот»
Тренажёр №2. » Установление соответствия: формула кислоты — формула оксида»
Тренажёр №3. «Действие кислот на индикаторы»
Тренажёр №4. «Классификация кислот по наличию кислорода в кислотном остатке»
Тренажёр №5. «Классификация кислот по основности»
Тренажёр №6. «Классификация кислот по растворимости в воде»
Тренажёр №7. «Классификация кислот по стабильности»
Интерактивное задание LearningApps.org по теме: “Химические свойства кислот и оснований”
Выполните тест
Выполните итоговый контроль по теме: “Кислоты”
ЦОРы
Видео-презентация: “Кислоты”
Видео-опыт: «Действие кислот на индикаторы»
Видео-опыт: «Взаимодействие кислот с металлами»
Видео-опыт: «Взаимодействие оксидов металлов с кислотами»
Практическая работа: «Реакция обмена между оксидом меди (II) и серной кислотой»
Видео-опыт: «Реакция нейтрализации»
Видео-опыт: «Взаимодействие кислот с солями»
Видео-опыт: «Химические свойства соляной кислоты»
Анимация: “Оказание первой помощи при попадании кислот на кожу”
Анимация: “Правила техники безопасности при работе с кислотами”
Анимация: “Правило разбавления концентрированной серной кислоты водой”
Кислоты/основания — Американское химическое общество
Бесплатные статьи
Химия плавательных бассейнов
Апрель 1983 г.
Автор: Неизвестно
Химия Связи: Кислоты/Основы, Равновесие
Описание: Обсуждается основная химия химических веществ, добавляемых в плавательный бассейн для контроля роста бактерий и других растворенных загрязнителей. Подробно рассматривается роль хлора, гипохлорита натрия, хлорноватистой кислоты и иона водорода (H + ) в системе равновесия плавательного бассейна.Описывает роль ионов водорода в определении рН. Включает студенческий эксперимент с использованием красной капусты для определения кислотности. Весь этот выпуск за апрель 1983 года посвящен химии кислот и щелочей, а также другим темам: антациды, шампунь и pH, кислотный дождь и концепция кислотно-щелочного баланса. К этой статье не было подготовлено никакого сопроводительного Руководства для учителя.
24 часа: еда в пути
февраль 2012 г.
Автор: Брайан Рориг
Химия Связи: Кислоты/основания, реакции
Описание: Подробно обсуждает процесс переработки пищи в организме, включая прием пищи, пищеварение, всасывание и выделение.Обсуждаются ферменты (биологические катализаторы) в слюне с использованием карбоангидразы (не из слюны) в качестве примера эффективности катализируемых химических реакций. Объясняет роль соляной кислоты в пищеварении желудка — не для расщепления пищи, а для создания кислой среды, в которой могут работать пищеварительные ферменты (желудочный сок). Обсуждаются «изжога» и ее средства — нейтрализация желудочного сока с помощью антацидов. Также охватывает роли поджелудочной железы, желчного пузыря, тонкой кишки, толстой кишки и толстой кишки.Это химия на всем протяжении пищеварительного тракта!
Воронки: химия становится глубокой
Апрель/май 2014 г.
Автор: Брайан Рориг
Химия Связи: Кислоты/основания, растворы, реакции
Описание: Представляет воронки с несколькими актуальными новостями. Описывает, что такое воронки, их причины и как они образуются. Обсуждает геологию, химию и химические реакции кислотных дождей и кислых органических материалов, реагирующих с карбонатной породой; е.г., известняк, для образования подземных каверн, которые затем оседают или разрушаются, образуя воронки. Включает в реакции ионы углекислого газа, угольной кислоты, водорода и гидрокарбоната, идентифицируя ионы водорода как ответственные за кислые условия. Показывает карту мира, на которой показано, где встречаются карбонатные породы — области, склонные к образованию воронок. Описывает предупреждающие знаки, которые предшествуют образованию воронки, и устройства для проверки/обнаружения, которые можно использовать для ее обнаружения.
Kitty Litter Chem
Октябрь 2005 г. (стр. 12–14)
Автор: Аманда Ярнелл
Химические связи: Кислоты/основания, связывание, твердые вещества/жидкости/газы, растворы наполнитель для кошачьих туалетов — фуллерова земля, бентонит (монтмориллонит), силикагели и материалы растительного происхождения, такие как Swheat Scoop.Рассказывает о химии каждого типа, в том числе о контроле над запахом (путем протонирования Nh4 в Nh5+, абсорбентах, ароматизаторах и антибактериальных средствах) и слипании глин (поглощение воды между слоями глины, вызывающее набухание глины). Показаны молекулярные модели монтмориллонита до и после добавления воды.
Lab on a Stick
Октябрь 2004 г. (стр. 9–12)
Автор: Christen Brownlee
Химические связи: Кислоты/основания, история/биография, органика/биохимия, реакции, растворы
Описание: перечисляет попытки найти простой в использовании колориметрический анализ мочи на диабет.Включает ранние химические испытания, от использования реагента сульфата меди (II), гидроксида натрия и аммиака, до прогресса, сделанного Уолтером Комптоном, который объединил реагенты в таблетированную форму (называемую Clinitest), до модификации, сделанной Хелен и Элом Фри, которая была таблетка, которая проверяла мочу на кетоновые тела. Описывает тест с бумажными полосками, также разработанный Frees, который использует ферменты глюкозы для определения содержания сахара в моче. В конце концов, бумажная полоска, разработанная Фрисом, содержала десять тестов на одной полоске.Тест-полоски называются Multistix-10SG. В статье есть фотографии тест-полосок. Интервью с Хелен Фри следует за статьей.
Жизнь в теплице
Октябрь 2003 г. (стр. 18–21)
Автор: Хелен Херлокер
Химия Соединения: Кислоты/Основы, Равновесие, Реакции, Устойчивость
Описание: Объясняет парниковый эффект; роль атмосферных химических веществ, поглощающих инфракрасное излучение. Углекислый газ, водяной пар, метан, закись азота, озон, дихлордифторметан, трихлорфторметан перечислены с их относительной эффективностью в поглощении инфракрасного излучения.Диаграммы включены.
Кислоты и основания
Вода
Обычно мы говорим о кислотно-щелочных реакциях в водной среде, то есть в присутствии воды. Наиболее фундаментальной кислотно-щелочной реакцией является диссоциация воды:| H 2 O H + + OH — |
В этой реакции вода распадается на ион водорода (H + ) и гидроксид-ион (OH —).В чистой воде мы можем определить специальную константу равновесия (K w ) следующим образом:
| K W = [H + ][OH — ] = 1,00×10 -14 |
Где K w – константа равновесия для воды при 25°C (безразмерная величина)
[H + ] – молярная концентрация водорода
[OH — ] – молярная концентрация гидроксида
Константа равновесия меньше единицы (1) предполагает, что реакция предпочитает оставаться на стороне реагентов — в этом случае вода предпочитает оставаться водой.Поскольку вода практически не ионизируется, она является очень плохим проводником электричества.
рН
Однако в этом прочтении интерес представляет кислотно-основная природа вещества. как вода. На самом деле вода ведет себя и как кислота, и как основание. Кислотность или основность вещества чаще всего определяется значение рН, определяется следующим образом: pH = -log[H + ]В равновесии концентрация H + составляет 1,00 × 10 -7 , поэтому мы можем рассчитать pH воды в равновесии как:
pH = -log[H + ]= -log[1.00 × 10 -7 ] = 7,00Растворы с pH семь (7) называются нейтральными, растворы со значениями pH ниже семи (7) определяются как кислые, а выше pH семи (7) — как щелочные.
pOH дает нам еще один способ измерения кислотности раствора. Это просто противоположность рН. Высокий pOH означает, что раствор кислый, а низкий pOH означает, что раствор щелочной.
рОН = -log[ОН — ]pH + pOH = 14,00 при 25°C
Определения кислот и оснований
- Аррениус
кислота : образует [H + ] в растворе
основание : образует [OH — ] в растворе водн.) + NaOH(водн.) NaCl(водн.) + H 2 O(l) - Brønsted-Lowery:
кислота : все, что отдает [H + ] (донор протонов)65 основание : все, что принимает [H + ] (акцептор протонов)
нормальное уравнение Бренстеда-Лоури: кислота + основание кислота + основание
пример: HNO 2 (водн.) + H 2 O (водн.) NO 2 — (водн.)+ H 3 O + (водн.)
Каждая кислота имеет сопряженное основание, а каждое основание имеет сопряженную кислоту.Эти сопряженные пары отличаются только одним протоном. В этом примере: NO 2 — представляет собой сопряженное основание кислоты HNO 2 и H 3 O + представляет собой сопряженную кислоту основания H 2 O. 2 Lewis 9:
кислота : принимает пару электронов
основание : отдает пару электронов
Преимущество этой теории состоит в том, что гораздо больше реакций можно считать кислотно-основными, поскольку они не должны происходить в растворе.
Соли
Соль образуется, когда кислота и основание смешиваются, и кислота выделяет ионы H + , а основание выделяет ионы OH — . Этот процесс называется гидролизом. PH соли зависит от сильных сторон оригинальных кислот и оснований:| Кислота | База | соль | соль PH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| STROL 5 | STROL | pH = 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| слабый | сильный | pH > 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| сильный | слабый | pH < 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| слабый | слабый | зависит от того, что сильнее
Эти соли являются кислыми или основными из-за их кислых или основных ионов.Когда слабые кислоты или слабые основания реагируют с водой, они образуют сильные сопряженные основания или сопряженные кислоты соответственно, что определяет рН соли. Чтобы молекула со связью Н-Х была кислотой, водород должен иметь положительную степень окисления, чтобы он мог ионизироваться с образованием положительного иона +1. Например, в гидриде натрия (NaH)
водород имеет заряд -1, так что это не кислота, а основание. Молекулы типа CH 4 с неполярными связями также не могут быть кислотами, поскольку H не ионизируется.Молекулы с сильными связями (большие различия в электроотрицательности) с меньшей вероятностью будут сильными кислотами, поскольку они плохо ионизируются. Для молекулы со связью X-O-H (также называемой
оксокислота), чтобы стать кислотой, водород должен снова ионизироваться с образованием Н + . Чтобы быть основанием, OH должен прерваться, чтобы сформировать ион гидроксида (OH —). И то, и другое происходит при работе с оксокислотами. Сильные кислоты: Эти кислоты полностью ионизируются в растворе, поэтому они всегда представлены в химических уравнениях в их ионизированной форме.Всего семь (7) сильных кислот: HCl, HBr, HI, H 2 SO 4 , HNO 3 , HClO 3 , HClO 4Чтобы рассчитать значение pH, проще всего следовать стандартному процессу «Начало, изменение, равновесие». Пример задачи: определить рН 0,25 М раствора HBr.
Слабые кислоты: Это наиболее распространенный тип кислот. Они следуют уравнению: HA(водн.) H + (водн.) + A — (водн.)Константа равновесия диссоциации кислоты известна как K a .Чем больше значение K a , тем сильнее кислота.
Пример задачи: Определите pH 0,30 М уксусной кислоты (HC 2 H 3 O 2 ) с помощью K a 1,8×10 -5 . Сильные основания: Подобно сильным кислотам, эти основания полностью ионизируются в растворе и всегда представлены в ионизированной форме в химических уравнениях.Существует только восемь (8) сильных оснований: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH) 2 , Sr(OH) 2 , Ba(OH) 2 Пример задачи: определить рН 0,010 М раствора Ba(OH) 2 .
Слабые основания: Они следуют уравнению: Слабое основание + H 2 O сопряженная кислота + OH —пример: NH 3 + H 2 O NH 4 + + OH — К b — константа диссоциации оснований:
К а х К б = К ш = 1.00×10 -14 Чтобы рассчитать pH слабого основания, мы должны следовать очень похожему процессу «Начало, изменение, равновесие», как и для слабой кислоты, однако мы должны добавить несколько шагов. Пример задачи: определить рН 0,15 М аммиака (NH 3 ) с помощью K b = 1,8×10 -5 . При работе со слабыми кислотами и слабыми основаниями вам также, возможно, придется иметь дело с «эффектом общего иона». Это когда вы добавляете соль к слабой кислоте или основанию, которое содержит один из ионов, присутствующих в кислоте или основании.Чтобы иметь возможность использовать тот же процесс для определения pH, когда это произойдет, все, что вам нужно изменить, это ваши «начальные» числа. Добавьте молярность иона, полученного из соли, а затем решите уравнение K a или K b , как вы делали ранее. Пример задачи: найти рН раствора, полученного при растворении 0,100 моль
из HC 2 H 3 O 2 с K a из
1,8х10 -8 и 0.200 моль NaC 2 H 3 O 2 в общем объеме 1,00 л.
Кислотно-основное титрованиеКислотно-основное титрование — это когда вы добавляете основание к кислоте до тех пор, пока не будет достигнута точка эквивалентности, при которой количество молей кислоты равно количеству молей основания. Для титрования сильного основания и сильной кислоты эта точка эквивалентности достигается, когда рН раствора равен семи (7), как показано на следующей кривой титрования:При титровании сильного основания слабой кислотой точка эквивалентности достигается, когда pH больше семи (7).Полуэквивалентность момент, когда половина общего количества основания, необходимого для нейтрализации добавлена кислота. Именно в этот момент pH = p K a слабая кислота. При кислотно-основном титровании основание будет реагировать со слабой кислотой и образовывать раствор, содержащий слабую кислоту и сопряженное с ней основание, пока кислота полностью не исчезнет. Чтобы решить эти типы задач, мы будем использовать значение K a слабой кислоты и молярности таким же образом, как и раньше.До демонстрируя этот способ, давайте сначала рассмотрим короткий путь, называемый Уравнение Хендерсона-Хассельбальха . Это можно использовать только тогда, когда у вас есть немного кислоты и сопряженного основания в вашем растворе. Если у вас есть только кислота, то вы должны решить задачу с чистым K и , а если у вас есть только основание (например, после завершения титрования), вы должны решить задачу с K b .
Где: Пример задачи: 25.0 мл 0,400 М KOH добавляют к 100 мл 0,150 М бензойной кислоты, HC 7 H 5 O 2 ( K a = 6,3×10 Практическая задача о слабой кислоте : C 6 H 5 COONa – соль слабой кислоты C 6 H 5 COOH.0,10 М раствор C 6 H 5 COONa имеет рН 8,60.
См. раствор слабой кислоты. Практическая задача титрования : 20,00 мл 0,160 M HC 2 H 3 O 2 ( K a = 1,8×10 -5 ) титруют 0,200 M NaOH.
См. раствор для титрования. [Основной указатель]
[Химическая номенклатура]
[Атомная структура]
[Периодическая таблица] Chem4Kids.com: Реакции: Кислоты и основанияКаждая жидкость, которую вы видите, вероятно, будет иметь либо кислотных , либо основных признаков. Вода (H 2 O) может быть как кислотой, так и основанием, в зависимости от того, как вы на это смотрите. В одних реакциях его можно рассматривать как кислоту, а в других — как основание.Вода может реагировать даже сама с собой с образованием кислот и оснований. Это происходит в очень малых количествах, так что это никак не повлияет на ваши эксперименты. Это выглядит так: 2H 2 O —> H 2 O + H + + OH — —> H 3 O + + OH — 18 Большую часть времени положительные и отрицательные ионы в дистиллированной воде находятся в равных количествах и компенсируют друг друга.Большая часть воды, которую вы пьете из-под крана, содержит другие ионы. Эти специальные ионы в растворе делают что-то кислым или щелочным. В вашем организме есть небольшие соединения, называемые аминокислотами. Название говорит вам, что это кислоты. Во фруктах есть то, что называется лимонной кислотой. Это тоже кислота. Но как насчет пищевой соды? Когда вы помещаете его в воду, он создает основной раствор. Уксус? Кислота. Итак, что образует кислоту или основание? Химик по имени Сванте Аррениус придумал способ определения кислот и оснований в 1887 году.Он увидел, что когда вы помещаете молекулы в воду, иногда они распадаются и выделяют ион H + (водород). В других случаях вы обнаружите высвобождение иона ОН — (гидроксид). При высвобождении иона водорода раствор становится кислым. При высвобождении гидроксид-иона раствор становится щелочным. Эти два специальных иона определяют, смотрите ли вы на кислоту или основание. Например, уксус также называют уксусной кислотой. (Хорошо, это дает ответ.) Если вы посмотрите на его атомы, когда он находится в воде, вы увидите, что молекула CH 3 COOH расщеплена на CH 3 COO — и H + .Этот ион водорода является причиной того, что его называют кислотой. Химики используют слово « диссоциированный » для описания распада соединения. Ученые используют так называемую шкалу pH , чтобы измерить, насколько кислой или щелочной является жидкость. Хотя в растворе может быть много типов ионов, pH фокусируется на концентрациях ионов водорода (H + ) и ионов гидроксида (OH — ). Шкала измеряет значения от 0 до 14. Дистиллированная вода — 7 (прямо посередине).Кислоты находятся между 0 и 7. Основания — от 7 до 14. Большинство жидкостей, которые вы находите каждый день, имеют pH около 7. Они либо немного ниже, либо немного выше этой отметки. Когда вы начинаете смотреть на рН химических веществ, цифры могут доходить до крайностей. Если вы когда-нибудь зайдете в химическую лабораторию, вы сможете найти растворы с pH 1 и другие с pH 14. Существуют также очень сильные кислоты со значениями pH ниже 1, например аккумуляторная кислота. К основаниям со значением pH около 14 относятся средства для чистки канализации и гидроксид натрия (NaOH).Эти химикаты очень опасны. Подробнее во второй части. Окисление океана в Арктике (видео Геологической службы США) Полезные справочные ссылки Кислоты и основания играют решающую роль в органической химии. Не те сумасшедшие ледовые карты и расчеты pKa. На уровне органической химии вам будет предложено различать и ранжировать кислоты и основания, глядя на их молекулярную структуру и сравнивая их реакции. Это проявляется в начале Орго 1, когда вы изучаете материал, затем снова при ранжировании реакционной способности оснований в реакциях элиминации и снова в Орго 2 при изучении стабильности сложных молекул. Меня как преподавателя орга часто расстраивает то, как преподается этот материал. Мои ученики приходят ко мне в замешательстве от данных, которые они запомнили, но не понимают. И поэтому я создал то, что, как я надеюсь, является полным ресурсом, который поможет вам действительно ПОЛУЧИТЬ кислоты и основания. Обязательно смотрите каждое видео, чтобы узнать информацию с акцентом на концепцию/тренд. Если вы хотите рассмотреть этот предмет с большим вниманием к математике, см. мою серию учебных пособий MCAT Acid/Base. Затем загрузите мою БЕСПЛАТНУЮ Шпаргалку по кислотным основам , чтобы учиться на ходу.И когда вы почувствуете, что готовы, посмотрите, как вы справитесь с моей викториной Acid Base Practice Quiz. Не забудьте взять мини-шпаргалку Strong Acid/Base. Первый шаг к ранжированию кислот и оснований это ПОНИМАНИЕ кислот и оснований. Это видео знакомит вас с определениями Аррениуса, Бренстеда-Лоури и Льюиса с точки зрения логики, а не запоминания. В этом видеоролике также показано, как распознавать кислоту и основание в сопряженной реакционной паре. Вот короткая статья, дополняющая вводное видео, в комплекте с которой: Это видео вполне может быть недостающим звеном между вашим учебником и логикой кислотно-щелочного ранжирования. Начните с изучения взаимосвязей ka/pKa/кислоты, а затем узнайте, что вам ДЕЙСТВИТЕЛЬНО нужно понять для сильных и слабых кислот. Когда большинство из нас слышит слово кислота , на ум приходят такие вещи, как лимоны, батарейки и желудочный сок.Но что на самом деле означает быть кислотой? В этом руководстве мы углубимся в то, как химики определяли кислоты (и основания) в прошлом и как эти определения привели нас к нашему нынешнему уровню понимания, который выходит далеко за рамки лимонов. До 1884 года определение кислоты не выдвигалось далеко за пределы «вещества в лимонах, которое имеет кислый вкус». К счастью, появился герой химии по имени Сванте Аррениус и предложил гораздо более полезное определение кислоты. Определение Аррениуса гласило, что кислоты — это молекулы, которые высвобождают протон (H + ), когда они находятся в воде.Это определение можно выразить в виде химического уравнения: В этом химическом уравнении молекула ГК представляет собой общую формулу кислоты. «А» — это просто заполнитель — это может быть изображение банана, нам все равно. Примером кислоты, записанной в сокращении, является HCl (соляная кислота), в которой атом хлора находится там, где раньше была буква «А» (или банан). HCl является основным компонентом желудочной кислоты. При растворении в воде (или водной среде) HCl распадается, или диссоциирует , полностью на ионы H + и Cl — .Двунаправленные стрелки в приведенном выше уравнении говорят нам о том, что, как и многие химические реакции, диссоциация кислоты является равновесным процессом. Это означает, что реагенты и продукты быстро взаимопревращаются. Для такой кислоты, как HCl, равновесие сильно благоприятствует правой части уравнения, как показано большой верхней стрелкой в приведенном выше уравнении. Еще до Аррениуса химики и простые люди заметили, что некоторые вещества могут нейтрализовать действие кислотных веществ.В 1829 году сэр Джеймс Мюррей предположительно смешал немного гидроксида магния, чтобы облегчить желудочные заболевания некоторых богатых людей. Это, вероятно, дало ему большие очки, учитывая, что диета аристократии в то время, вероятно, состояла в основном из острой острой сальсы и крепкого алкоголя. Это реклама изжоги, ожидающая своего появления. Препарат стал известен как магнезиальное молоко и стал первым популярным желудочным антацидом. Аррениус знал, что оснований могут нейтрализовать кислоты, одним из таких оснований было магнезиальное молоко.Как и для кислот, Аррениус предложил общее определение оснований как веществ, выделяющих гидроксид (OH —), когда они находятся в воде. Опять же, химические уравнения — наши друзья: В этом случае MOH (рифмуется с «d’oh» Гомера Симпсона) — это общая формула основания Аррениуса, где «М» обычно представляет собой металл. Некоторыми примерами являются основания NaOH, Mg(OH) 2 и KOH. Обратите внимание, что кислота Аррениуса выделяет H + , а основание Аррениуса выделяет OH —.Во время реакции нейтрализации нейтральный H 2 O волшебным образом образуется из ионов H + , высвобождаемых из кислоты, и из ионов OH — , высвобождаемых из основания (H + + OH — = Н 2 О). Следовательно, определения Аррениуса могут объяснить загадочные реакции между основными и кислыми веществами, такими как гидроксид магния и желудочная кислота. Молодец, Аррениус. В конце концов, другие химики поняли, что некоторые вещества кажутся кислотными или щелочными, но не совсем соответствуют определению Аррениуса.Например, аммиак (NH 3 ) действует как основание, но NH 3 не содержит молекул OH —, которые нужно высвобождать. Что что? Бедный Аррениус. Он также очень старался дать общее определение. В 1923 году два восхитительных химика по имени Йоханнес Бронстед и Томас Лоури предложили новое определение кислот и оснований. Их определение может объяснить поведение белковых молекул, таких как NH 3 . Согласно Бренстеду и Лоури, кислота — это молекула, которая может переносить протон (H + ) на другую молекулу, а основание — это молекула, которая может принимать протон от другая молекула. Короче говоря, Br ø кислота Нстеда-Лоури отдает протонов, а Br ø основание Нстеда-Лоури принимает протонов.Любая химическая реакция, включающая перенос протонов, является кислотно-щелочной реакцией . Один из способов запомнить это — представить бейсбольного питчера кислотой. Питчер переносит бейсбольный мяч на базу точно так же, как кислота переносит протон. Дальнейшее развитие аналогии с бейсболом будет означать, что кэтчер аналогичен базе, поскольку он принимает бейсбольный мяч. Ловец сидит дома база тоже. Это один из способов запомнить, что бейсбольный кэтчер действует как база Бренстеда-Лоури.Пожалуйста. Время химического уравнения: В этом общем химическом уравнении ГК действует как кислота Бренстеда-Лоури, передавая свой протон молекуле B. В результате молекула B действует как основание Бренстеда-Лоури (или ловушка), принимая протон от НА. Между этим определением и определением Аррениуса есть два отличия: Теперь мы можем вернуться к надоедливой молекуле NH 3 .Когда-то химики подозревали, что эта молекула действует как основание при обычных условиях. Поскольку у NH 3 не было OH — , они не могли понять, что происходит. Определение Бренстеда-Лоури позволило увидеть, как NH 3 может выступать в качестве базы. Вот химическое уравнение для NH 3 в качестве основания с H 2 O в качестве кислоты: Presto. В этом уравнении, если читать слева направо, NH 3 является основанием Бренстеда-Лоури, потому что оно принимает протон от H 2 O.Что, если уравнение читать справа налево? В конце концов, двойные стрелки означают, что эта реакция может идти в обоих направлениях. Переместив свой мозг в правую часть уравнения, мы увидим, что продукты также являются кислотами и основаниями. OH — действует как основание, поскольку принимает протон с образованием H 2 O. NH 4 + действует как кислота, поскольку передает протон с образованием NH 3 . Молекулы с каждой стороны уравнения, отличающиеся только одним протоном, называются сопряженными кислотно-основными парами.В следующем примере одна пара представляет собой NH 3 и Nh5+, а другая пара представляет собой H 2 O и OH — : Это химическое уравнение содержит небольшую уютную кислотно-основную семью. Не для того, чтобы натравить на тебя всего Барни. Связь между молекулами, отличающимися одним протоном, определяет сопряженных кислотно-основных пар . Говорят, что для данной пары сопряженных кислот и оснований молекула, помеченная как кислота, имеет сопряженное основание с другой стороны уравнения.Точно так же молекула, помеченная как основание, имеет сопряженную кислоту с другой стороны уравнения. Например, предположим, что вы были базой NH 3 в приведенном выше уравнении. Остальную часть вашего семейства вы бы описали так: Nh5+ — ваша сопряженная кислота, H 2 O — кислота, от которой вы принимаете протон, а OH — — сопряженное основание кислоты H 2 O. В качестве альтернативы, если вы считаете себя больше основанием OH — , то H 2 O — это ваша сопряженная кислота, Nh5+ — это кислота, от которой вы принимаете протон, а NH 3 — это сопряженное основание кислоты Nh5+. Теперь, когда мы поняли, как определяются кислоты и основания, мы обратимся к силе кислот и оснований. То есть насколько вероятно, что данная кислота передаст свой протон или данное основание примет протон? Посмотрите общее химическое уравнение для кислоты Бренстеда-Лоури в воде: В этом уравнении есть симметрия. Ладно, может быть, не так много симметрии, как у снежинки, но, тем не менее, у нее есть симметрия.Обратите внимание, что в обеих частях уравнения есть кислота и основание в обеих частях уравнения. В результате возникает конкуренция между тем, какая кислота передает свой протон, а какое основание принимает протон. Протонный бой! Исход этого соревнования зависит только от двух факторов: А пока предположим, что реагенты в равных концентрациях.Мы можем предсказать исход соревнования за протон, потому что протон всегда будет стремиться перейти к более сильному основанию (акцептору протона). Одной из самых сильных кислот является наш старый друг HCl. Если бы мы добавили немного HCl к H 2 O, химическое уравнение, описывающее реакцию, выглядело бы следующим образом. В приведенном ниже уравнении реакция сильно благоприятствует правой стороне (посмотрите на большую верхнюю стрелку, указывающую вправо): HCl приближается к полной диссоциации в сочетании с H 2 O.Это связано с тем, что HCl является гораздо более сильной кислотой, чем H 3 O + , и, аналогично, H 2 O является более сильным основанием по сравнению с Cl —. Таким образом, протон хочет перейти от более сильной кислоты (HCl) к более сильному основанию (H 2 O), что приводит к предпочтительному образованию H 3 O + и Cl — . Сила кислоты относительна. Это зависит от того, какая другая кислота находится в кольце, борясь за протон.По соглашению кислоты считаются сильными кислотами , если они намного сильнее кислоты H 3 O + , которая является довольно слабой кислотой по сравнению с HCl. Сильная кислота (например, HCl) почти полностью диссоциирует, когда H 2 O действует как акцептор протона. С другой стороны, слабые кислоты лишь частично диссоциируют в H 2 O. просто оставайтесь на слабой кислоте.Слабые кислоты по определению имеют сильные сопряженные основания. Партнер по сильному сопряженному основанию на другой стороне уравнения прекрасно обходится без протона. В результате передается очень небольшой процент протонов слабых кислот. Эта обратная связь между кислотой и сопряженным с ней основанием показана в таблице ниже. Узнайте здесь о химических процессах в желудке и о том, как щелочи используются для нейтрализации избытка кислот. Познакомься с новенькими в квартале (нет, не с этими новенькими).Мы говорим о кислоте Льюиса и основании Льюиса. Понятие Льюиса о кислоте или основании, названное в честь Гилберта Льюиса, даже более общее, чем определение Бренстеда-Лоури, о котором мы говорили ранее. Следует помнить, что все кислоты Льюиса также являются кислотами Бренстеда-Лоури, а все основания Льюиса также являются основаниями Бренстеда-Лоури. Определение Льюиса — это просто еще один способ взглянуть на то же общее свойство. Это все равно, что сказать, что есть несколько способов почистить банан. Так чем же отличается определение Льюиса? Вместо того, чтобы сосредоточиться на протонах, Гилберт Льюис сосредоточился на электронах.Он специально рассмотрел неподеленные пары электронов. Вот определения Гилберта Льюиса. В мире кислот и оснований Льюиса электроны — главные. Давайте посмотрим на типичное основание Бренстеда-Лоури, чтобы увидеть, как оно также является основанием Льюиса: NH 3 пожертвовал свою электронную пару и действует как основание Льюиса. Протон принял электроны и действует как кислота Льюиса. Хотя все основания Бренстеда-Лоури также являются основаниями Льюиса, не все кислоты Льюиса являются кислотами Бренстеда-Лоури.(Это похоже на то, что все квадраты являются прямоугольниками, но не все прямоугольники являются квадратами.) Al 3+ является примером кислоты Льюиса, которая не является кислотой Бренстеда-Лоури. В конце концов, Al 3+ не имеет протонов для переноса, как того требует определение Бренстеда-Лоури. Однако Al 3+ принимает электронные пары из воды с образованием координированного комплекса Al (H 2 O) 6 3+ . В этом случае Al 3+ действует как кислота Льюиса, а H 2 O действует как основание Льюиса. Концепция кислот и оснований Льюиса может быть очень полезной, особенно когда речь идет о молекулах с кислотными или основными свойствами, но не подпадающих под определения Бренстеда-Лоури. Однако для большинства химиков определение Бренстеда-Лоури достаточно хорошо. С этого момента мы не будем говорить о кислотах и основаниях в смысле Льюиса, а будем использовать старое доброе определение Бренстеда-Лоури. Жаждете еще более интересных определений кислот и оснований, чтобы произвести впечатление на своих друзей? С такими именами, как Люкс-Флад и Усанович, как вы могли устоять? III.Наименование кислот B. Если кислота содержит кислород, определить
название многоатомного аниона. Если анион заканчивается на
« -ite «, то используется окончание « -ous «. Если
анион заканчивается на «- ели «, затем окончание
« -ic » используется.Конечно, есть исключения… если
название кислоты звучит странно, если использовать название аниона,
то вместо него используется имя элемента. Серная кислота звучит плохо, поэтому используйте серу в качестве
вместо этого корень.Однако суффикс по-прежнему
определяется по названию многоатомного аниона.
Таким образом, H 2 SO 4 является серной
кислота напр. H 3 PO 4 основан на
фосфат Фосфорная кислота звучит плохо, поэтому используйте фосфор
вместо… фосфорная кислота Назад к Сок краснокочанной капусты меняет цвет, если добавить немного сока лайма или ложку пищевой соды.Разрыхлитель поможет вашему пирогу красиво подняться в духовке. Вы можете «приготовить» рыбу, добавив сок лимона и лайма, получится севиче. Что общего у всех этих примеров? Все они являются примерами кислотно-основных реакций. Эти типы реакций являются лишь одной из многих химических реакций, происходящих в пище (еще одной может быть потемнение бананов). Кислотно-щелочные реакции имеют много общего, хотя их эффект (изменение цвета, дрожжевой пирог или «приготовленная» рыба) может выглядеть очень по-разному.В этом посте мы обсудим научные основы этих типов реакций. Кислые продукты довольно распространены. Лимонный и лаймовый сок, уксус, йогурт и пахта — все это кислые продукты. Если вы выпьете любой из них, вы почувствуете кислотность. Противоположностью кислой пище (или напитку) является щелочная. Хорошим примером этого является пищевая сода. Пища, которая не является ни кислой, ни щелочной, называется нейтральной. Химики очень хорошо определяют, является ли что-то кислотным или щелочным.Чтобы определить, что это за пища, вы используете шкалу рН. Эта шкала работает от 0 до 14. Любая пища, имеющая значение pH 7, является нейтральной. Продукты с рН ниже 7 относятся к кислым, с рН выше 7 — к щелочным. Чем дальше от нейтрального значения 7, тем более кислой (или щелочной) является пища. Например, лимонный сок имеет значение pH 2-3, а йогурт — около 4-4,5. Таким образом, лимонный сок более кислый, чем йогурт. Вы можете измерить значение pH пищи с помощью pH-метра или специальной полоски для измерения pH.Если вы используете рН-метр, вы можете получить конкретное значение для измеряемого продукта, например. 2.3. Однако, поскольку продукты, естественно, довольно разнообразны, между похожими продуктами может быть довольно много различий. У одного лимона значение pH может быть 2,1, а у другого — 2,4. Вот почему вы часто видите диапазоны для определенных продуктов. Пищевые продукты имеют широкий спектр значений pH, хотя большинство из них либо около 7 (таким образом, нейтрально), либо ниже семи.Поскольку пищевые продукты, особенно свежие продукты, такие как фрукты, овощи и мясо, не очень постоянны по своим свойствам, точное значение pH будет отличаться для каждого отдельного продукта. На значение pH влияет множество факторов, в том числе спелость продукта. Список ниже дает некоторые общие рекомендации (источник). Информационный бюллетень Хотите быть в курсе новых статей о пищевых продуктах? Подпишитесь на нашу еженедельную рассылку Значение pH влияет на вкус вашей пищи, но также может быть очень важно для срока годности вашей пищи, как долго она остается безопасной.Еда может испортиться и испортиться из-за роста нежелательных микроорганизмов. Однако многие микроорганизмы перестают расти, когда значение pH падает ниже определенного значения. Таким образом, достаточное снижение значения pH продлит безопасность пищевых продуктов. Помимо срока годности, значение pH можно использовать для мониторинга пищевых процессов. Например, приготовление йогурта в основном состоит из снижения значения рН молока. Из-за более низкого значения рН молоко будет густеть. Производители будут знать, при каком значении pH процесс завершается.Таким образом, измеряя это значение, они могут отслеживать процесс, не глядя на продукт и не пробуя его на вкус. Так что же делает эти продукты щелочными или кислыми? В то время как сахар делает что-то сладким, а соль делает что-то соленым, протоны создают что-то кислое. Протоны — это одиночные атомы водорода (H), которым не хватает своего электрона. В результате они заряжаются положительно.Химики записывают протоны как: H + . Протоны играют роль во многих реакциях в организме человека и в большинстве живых организмов, если уж на то пошло. Так откуда они берутся? Один из способов — через молекулы, которые являются естественными кислотами (например, лимонная кислота). Они довольно легко отдают один из своих протонов. Когда они это делают, концентрация протонов увеличивается. Если концентрация протонов увеличивается, значение pH пищи уменьшается. Больше протонов, значит больше кислотность.Это отношение может быть выражено следующей формулой: Как видно из этих формул, существует баланс между протонами (H + ) и гидроксид-ионами (OH – ). Они противоположны друг другу. Больше протонов означает более низкое значение pH, тогда как большее количество ионов гидроксида приводит к более высокому значению pH (или более низкому значению pOH). Чаще всего вы найдете только значения pH, значение pOH практически не используется. Эта взаимосвязь лежит в основе кислотно-основных реакций и берет свое начало в молекуле воды. Вода сама по себе нейтральна, но может расщепляться как на протон, так и на гидроксид-ион. Вместо сингулярного протона образуется ион гидроксония (H 3 O + ). В присутствии воды это произойдет, поэтому во многих случаях вы можете использовать их взаимозаменяемо. (Если вы не умеете записывать химические реакции, сначала прочитайте основы химических реакций.) В нейтральной среде имеется равное количество протонов (H + ) и гидроксид-ионов (OH – ).Это равновесие нарушается только в том случае, если пища кислая или щелочная. Кислотные молекулы или щелочные молекулы могут увеличивать содержание протонов или гидроксидов. Когда в воде присутствует кислота (AH в приведенном ниже примере), она снижает значение pH, высвобождая протон: С другой стороны, когда присутствует щелочное вещество, оно образует гидроксид-ион, в результате чего влага становится более щелочной. Это значение pH является сильным индикатором типов химических реакций, которые могут происходить.Различные типы реакций могут происходить в кислой среде, в отличие от щелочной. Общим для всех кислотно-щелочных реакций является обмен протонами. Кислота будет отдавать протон (увеличивая концентрацию протонов, тем самым снижая рН). С другой стороны, щелочное вещество имеет тенденцию принимать протон. Давайте еще раз посмотрим на реакцию, которую мы видели ранее. Посмотрите, как происходит обмен этими протонами. Одна вещь, которую вы могли бы заметить в этих реакциях, это двойные стрелки в них обоих.Эти двойные стрелки указывают на то, что это равновесная реакция. Другими словами, реакция может происходить как слева направо, так и справа налево. Это не означает, что это происходит в одинаковой степени в обоих направлениях. Очень сильные кислоты отдают (почти) все свои протоны. Они, соответственно, называются сильными кислотами. Однако в большинстве случаев только определенный процент кислот отдает свои протоны. Это слабые кислоты. То же самое касается их щелочных аналогов, оснований. Сколько кислоты отдаст свой протон, можно выразить с помощью константы равновесия. Для уравнения кислоты (AH), показанного выше, это выглядит так: [ ] указывает на концентрацию. Поскольку концентрация воды практически постоянна, ее часто не учитывают. Кислота, отдающая почти все свои протоны, будет иметь очень низкую концентрацию AH и высокую концентрацию A – . В результате значение K a будет большим.Чем больше значение K a , тем сильнее кислота. Важно знать, что эта константа равновесия изменяется с температурой. Таким образом, кислота может более или менее легко высвобождать протоны при различных температурах. Для щелочного вещества уравнение равновесия очень похоже: На практике вы не будете часто обсуждать значения K a и K b . Тем не менее, вы будете видеть их эффекты вокруг себя.Пищевая сода, например, является примером щелочного пищевого ингредиента. Сравнение этих химических реакций с этими основными формулами покажет много общего. То же самое касается краснокочанной капусты. Цвет краснокочанной капусты меняется в зависимости от значения pH окружающей жидкости. Это вызвано кислотно-щелочными реакциями с молекулами, которые придают краснокочанной капусте ее цвет! Конечно, кислота — это не только химические реакции. Это также очень важно для вкуса и баланса блюда.Некоторым блюдам просто нужно немного кислоты (например, лимонного сока), чтобы хорошо подействовать. Самин Носрат прекрасно объясняет эту сторону кислоты в своей книге «соль, жир, кислота, тепло». Университет Клемсона, pH-значения обычных продуктов и ингредиентов, ссылка; источник значений pH пищевых продуктов, упомянутых в этой статье | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 .
.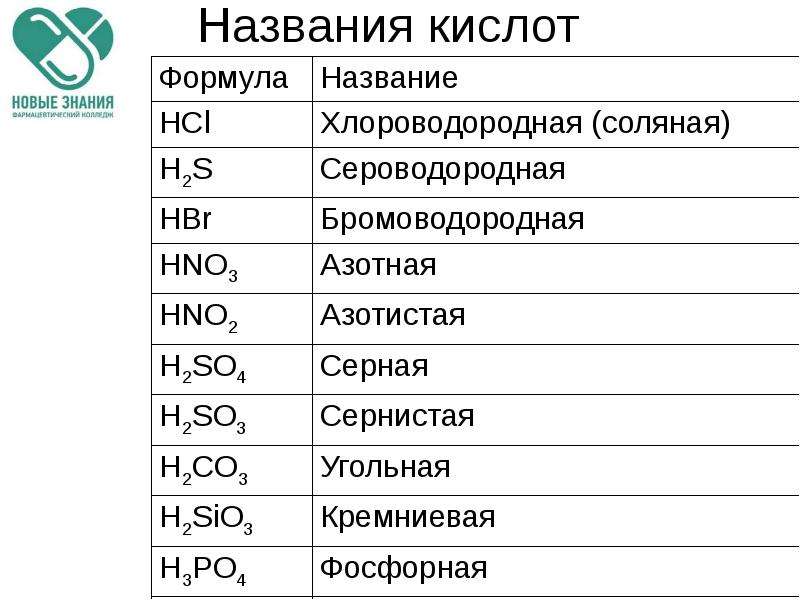


 На предметном столе – колба с горячим
молоком. Учитель выжимает сок из лимона в колбу с молоком. Мгновенно выпадает
осадок в виде творога. Спрашивает: «Что произошло?»
На предметном столе – колба с горячим
молоком. Учитель выжимает сок из лимона в колбу с молоком. Мгновенно выпадает
осадок в виде творога. Спрашивает: «Что произошло?»
 (записывают тему в тетрадь)
(записывают тему в тетрадь) В одной из них кислота.
В одной из них кислота. Кислота попала на фиолетовые
лепестки фиалок. Лепестки окрасились в красный цвет. Это явление удивило
ученого. Особенно интересным оказался фиолетовый настой лакмусового
лишайника. В растворах кислот он приобретал красный цвет.
Кислота попала на фиолетовые
лепестки фиалок. Лепестки окрасились в красный цвет. Это явление удивило
ученого. Особенно интересным оказался фиолетовый настой лакмусового
лишайника. В растворах кислот он приобретал красный цвет.

 Закрепление
Закрепление

 Домашнее задание
Домашнее задание ru
ru Обугливает органические вещества
Обугливает органические вещества Организационный момент
Организационный момент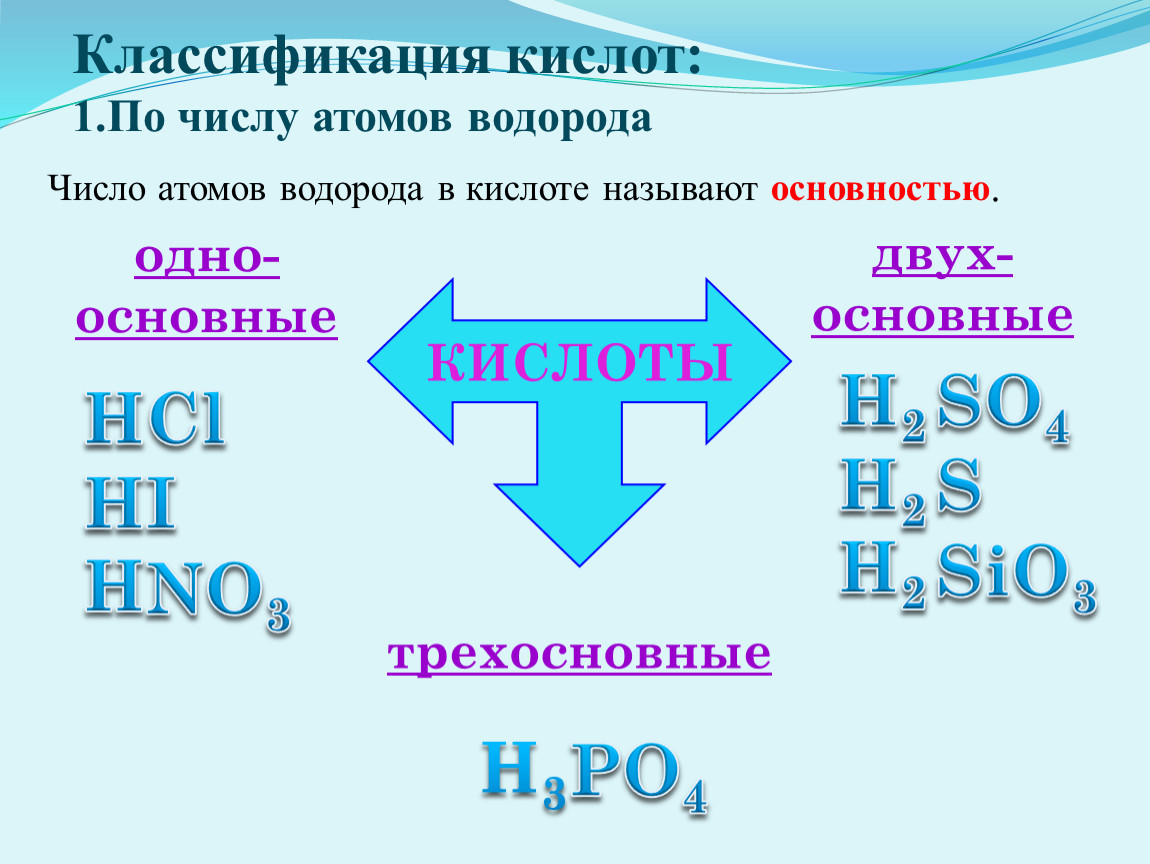
 Осмысление содержания нового материала
Осмысление содержания нового материала

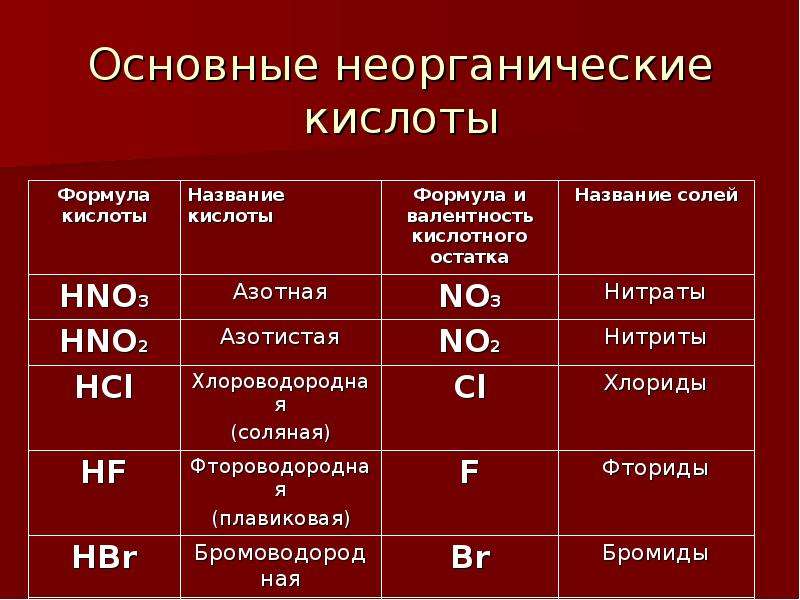




 126 Найти ребусы про кислот. Сообщение «Роль кислот в жизни человека».
126 Найти ребусы про кислот. Сообщение «Роль кислот в жизни человека».