Конспект урока по химии по теме «Сера. Физические и химические свойства, аллотропия. Применение» (9 класс)
Муниципальное казенное общеобразовательное учреждение
«Нижнереутская основная общеобразовательная школа»
Фатежского района Курской области
Конспект урока по химии
9 класс
«Сера. Аллотропия серы. Физические и химические свойства серы. Применение»
Подготовила: учитель химии
первой квалификационной категории
Гнездилова Ирина Александровна
2016 год
Тема: Сера. Аллотропия серы. Физические и химические свойства серы. Применение.
Цели урока:
— Рассмотреть аллотропные модификации серы и ее физические и химические свойства. Охарактеризовать нахождение серы в природе и ее применение.
Основные понятия: Флотация, аллотропные соединения серы: пластическая и кристаллическая (ромбическая, моноклинная) сера.
Задачи урока:
Рассмотреть строение атома серы согласно его положение в периодической системе химических элементов Д.И. Менделеева, аллотропные модификации серы.
Изучить физические и химические свойства серы, нахождение в природе, его области применения.
Продолжить формирование умения учащихся работать с периодической системой химических элементов Д. И. Менделеева.
Совершенствовать умения составлять уравнения химических реакций.
Тип урока: урок открытия новых знаний.
Оборудование: ПСХЭ, образцы серы и ее природных соединений, презентация «Сера», вода, сера, спиртовка, химическая ложечка.
План урока
Положение серы в ПСХЭ
Строение атома, возможные степени окисления
Физические свойства серы
Нахождение в природе
-
Аллотропия серы
Химические свойства серы
Применение серы
Закрепление Планируемые результаты обучения:
Предметные:
знать физические и химические свойства серы, способы ее получения, применение
уметь характеризовать серу по ее положению в ПСХЭ, объяснять причину аллотропии серы, составлять электронную формулу серы, определять ее возможные степени окисления, составлять уравнения химических реакций, характеризующие химические свойства серы, определять коэффициенты методом электронного баланса, составлять реакции ионного обмена.
самостоятельно использовать материалы учебника и справочные таблицы, применять ранее полученные знания.
научиться анализировать, делать выводы, обобщать полученные знания.
Метапредметные:
умение определять цели и задачи деятельности, выбирать средства реализации цели и применять их на практике;
выделять существенные признаки и свойства;
выделять информацию из текста учебника;
высказывать суждения, обосновывать и доказывать свой выбор, приводя факты, взятые из материалов учебника;
использовать знаки, символы, схемы для выполнения заданий; находить закономерности, устанавливать причинно- следственные связи между реальными объектами и явлениями;
способствовать развитию монологической речи, внимания, аналитического мышления;
воспитывать культуру поведения и интерес к предмету.
Личностные:
формировать положительную мотивацию к обучению;
оценивать свою деятельность, определяя по заданным критериям ее успешность или неуспешность и способы ее корректировки, бережно и уважительно относиться к людям и результатам их деятельности;
создавать позитивное эмоциональное отношение учеников к уроку и предмету.
умение работать в группе, отстаивать и аргументировать свою точку зрения
Ход урока
Организационный момент
Учитель. Ребята! На прошлом занятии мы дали характеристику элементам главной подгруппы VI группы. Изучили свойства кислорода, его аллотропные модификации. Давайте вспомним что мы знаем о кислороде:
II. Проверка изученного материала (экспресс-опрос) (слайд 1)
Какое строение имеет кислород?
степень окисления в соединениях: -2, реже +1, +2/.
Когда и кем открыт был кислород? /Первые упоминания о кислороде датируются 8 в., открытие зафиксировано в 18 в. К.Шееле и Дж. Пристли/.
Назовите основные физические и химические свойства кислорода. /Газ, БЦ, БВ, БЗ, ρ = 1,43 г
Как получают кислород в промышленности и в лаборатории? /Из жидкого воздуха (методом фракционной дистилляции), электролитическим разложением воды/.
Какие аллотропные модификации кислорода вам известны? /Кислород — О2 и озон — О3/.
Какова роль озонового слоя для жизни на Земле? /Защита от космического ультрафиолетового излучения/.
Где применяется кислород? /В металлургии, химической промышленности, медицине, в авиации, в ракетно-космической технике, при сварке и резке металлов, и т.д./. (молодцы!)
II. Изучение нового материала
Сегодня мы будем изучать вещество, в состав которых входит элемент, о котором есть такая загадка: «Возьмите первый слог названия “лунного элемента” и прибавьте к нему первый слог радиоактивного металла, открытого супругами Кюри в 1898 г. Вы получите название элемента, которое в переводе на русский язык обозначает светло-желтый».
Кто из вас догадался, что это за элемент? (Сера.)
Эпиграфом к уроку служат такие строки:
Немало сера знаменита,
И в древности ее Гомер воспел,
С ней много тысяч лет прожито,
И человек в ней пользу разглядел.
(слайд 2)
Учитель. На этом уроке мы познакомимся с химическим элементом и простым веществом – серой. Давайте сформулируем тему нашего урока. (слайд 3)
Запишите тему урока: Сера. Аллотропия серы. Физические и химические свойства серы. Применение
А теперь давайте определим цели нашего урока: (слайд 4)
— Рассмотреть аллотропные модификации серы и ее физические и химические свойства. Охарактеризовать нахождение серы в природе и ее применение.
На уроке мы будем работать по следующему плану (слайд 5)
Историческая справка (слайд 6)
Учитель: Человечество познакомилось с серой в древности (около IVв. до н.э.) Жрецы использовали её в составе «священных курений» при некоторых религиозных обрядах. Различные горючие смеси для военных целей тоже содержали серу. Ещё у Гомера упоминаются «сернистые испарения» и смертельное действие продуктов горения серы. Она же входила в состав «греческого огня», наводившего ужас на противников. Точный состав смеси не известен, но полагают, что кроме серы в неё входили нефть, различные горючие масла, смола, селитра, клей и красители.
Элементарную природу серы установил француз Антуан Лоран Лавуазье в своих опытах по сжиганию в 1770 году.
В разные времена сера обозначалась разными символами (слайд 7)
Рассмотрим положение серы в ПСХЭ: (слайд 8)
Валентные состояния атома серы (слайд 9)
В отличие от кислорода, у атомов серы на третьем энергетическом уровне имеется пять незаполненных d – орбиталей. Поэтому возможно распаривание электронов. В результате этого у серы появляется либо 4, либо 6 не спаренных электронов, которые при соединении с более электроотрицательным элементом смещаются в его сторону. Этим и объясняется степень окисления серы в соединениях с кислородом: +4 и +6.
Физические свойства серы
(Демонстрация коллекции минералов) + (слайды)
Рассмотрите образец серы, определите:
агрегатное состояние.
цвет.
растворимость в воде (опустите кусочек серы в стакан с водой, затем порошок серы в пробирку с водой, сделайте вывод.)
Температура плавления -112,8
Температура кипения – 444,6.
Вывод: Сера-это твердое вещество, желтого цвета, в воде не растворяется. (слайд 10)
Демонстрация: Растворение серы в воде и спирте (л.о.выполняют учащиеся).
Сера не растворима в воде, потому что серный порошок плохо смачивается водой и поддерживается на плаву мелкими пузырьками воздуха. Это процесс флотации. Это свойство используется для отделения серы от примесей, в промышленности.
Флотация –это (фр. flottation, от flotter — плавать) — процесс разделения мелких твёрдых частиц (главным образом, минералов), основанный на различии их в смачиваемости водой.
— Сера в природе (самостоятельно изучить схема 4 с.62 (демонстрация слайдов 11 — 19)
Учитель: Ребята, для серы, как и для кислорода, характерна аллотропия. Известно много модификаций серы с циклическим или линейным строением молекул различного состава (слайд 20)
Наиболее устойчива модификация — ромбическая сера,(слайд 21) состоит из молекул S8 .Ее кристаллы имеют вид октаэдров со срезанными углами. Они окрашены в лимонно-желтый цвет и полупрозрачны, температура плавления 112,8 °С. В эту модификацию при комнатной температуре превращаются все другие модификации. Известно, например, что при кристаллизации из расплава сначала получается моноклинная сера (слайд 22) (игольчатые кристаллы, температура плавления 119,3 °С), которая затем переходит в ромбическую.
При нагревании кусочков серы в пробирке она плавится, превращаясь в жидкость желтого цвета. При температуре около 160 °С жидкая сера начинает темнеть и становится настолько густой и вязкой, что даже не выливается из пробирки, однако при дальнейшем нагревании превращается в легкоподвижную жидкость, но сохраняет прежний темно-коричневый цвет. Если ее вылить в холодную воду, она застывает в виде прозрачной резинообразной массы. Это
(слайд 23) Видео получение пластической серы.
5.- Физминутка (слайд 24)
Глубоко вздохнули:
вот, мы набрали кислород.
Выдохнув из легких чистых газ уходит углекислый.
Руки вверх, потом вперед – не поймать нам водород!
Руки в стороны, ходить.
Будем с химией дружить!
— Химические свойства серы: (Презентация и демонстрация опытов)
В связи с большим, чем у кислорода, атомным радиусом, окислительные свойства серы выражены слабее. Поэтому в реакциях с кислородом сера – восстановитель и проявляет степени окисления +4 и +6. Окислительные свойства серы проявляются в реакциях с металлами и водородом, а восстановительные — в реакциях с кислородом и галогенами.
Учитель: Ребята, при обычных условиях сера реагирует со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром:
Видео: Взаимодействие серы с медью (слайд 25)
Запишите уравнение реакции Cu + S → CuS, покажите переход электронов, укажите окислитель и восстановитель.
Взаимодействие серы с натрием (слайд 26)
Запишите уравнение реакции. 2Na + S → Na2S , покажите переход электронов, укажите окислитель и восстановитель.
Взаимодействии цинковой пыли с порошком серы (слайд 27)
Запишите уравнение реакции. Zn + S = ZnS, покажите переход электронов, укажите окислитель и восстановитель.
Затем следует обобщение: сера взаимодействует со всеми металлами, кроме Аи и Рt. С ртутью она, например, взаимодействует даже при обычной температуре, что используют при обеззараживании помещений от пролитой там ртути. Процесс называется демеркуризацией (объясняется этимология этого термина).
ДЕМЕРКУРИЗАЦИЯ (от франц. démercurisation < mercure — ртуть) — система специальных мероприятий по очищению помещений, емкостей и т. п. от разлитой ртути.
Hg0 + S0 = Hg+2S–2
Hg0 – 2e ––> Hg+2
S0 + 2e ––> S–2
И так, мы пришли к выводу, что при нагревании сера реагирует и с другими металлами (Zn, Al), и только золото не взаимодействует с ней ни при каких условиях.
Б) Взаимодействие серы с неметаллами.
Учитель: Из неметаллов с серой не реагируют только азот, иод и инертные газы.
1) Сера – окислитель:
1) H2 +S =H2S (сероводород)
S0+2ē =S2- │окислитель
H2 — 2ē =2H+ │восстановитель
2) Сера – восстановитель (горение серы – видео) (слайд29)
Cера горит синеватым пламенем, образуя оксид серы (IV), сернистый газ
S +O2 = SO2
3. Взаимодействие серы со сложными веществами
Взаимодействие серы со сложными веществами — окислителями можно показать на эффектной реакции взаимодействия бертолетовой соли (если ее можно будет достать!) с__серой. В фарфоровую чашечку втирается немного серы, а затем помещается несколько мелких кристалликов бертолетовой соли. Уже при легком растирании кристалликов раздаются взрывчики и вспыхивает пламя:
2КСl O3 + 3S = 2КСl + 3SО2
Такая реакция, в частности, лежит в основе «работы» спичек. В них красный фосфор и сульфид сурьмы (III) Sb2S3 с помощью клея наносится на боковую поверхность спичечного коробка, а головка спички готовится обычно из бертолетовой соли, серы, стеклянного порошка и клея. Под действием теплоты трения мельчайшие частички красного фосфора превращаются в белый фосфор, который воспламеняется на воздухе и поджигает головку спички. (задание учащимся – к следующему уроку подготовить сообщение о производстве спичек)
Ребята, запишите уравнения, составьте электронный баланс уравнений, записанных в таблице (слайд 30), проверьте друг у друга правильность выполнения задания.
Вопрос: А ещё, с каким веществом сера проявляет восстановительные свойства? (фтор)
— — Применение Сера (самостоятельно изучить схему 5 с.66)
Сообщение учащихся: Сера широко применяется в хозяйственной деятельности человека.
Сера — один из неметаллов, известных человеку с древнейших времен. Ее использовали для религиозных обрядов — поджигали при различных церемониях и ритуалах; ею чернили оружие, употребляли для изготовления косметики и лекарств, жгли для отбелки тканей и борьбы с насекомыми, использовали для изготовления черного пороха. В наши дни сера не теряет, а все более увеличивает свое значение в жизни человека. Бумага и резина, эбонит и спички, ткани и лекарства, косметика и пластмассы, взрывчатка и краски, удобрения и ядохимикаты — это все только небольшой перечень того, для изготовления чего необходима сера. (слайд 31)
Учитель: Примерно половина добываемой в мире серы идет на производство серной кислоты. Чтобы получить 1 т серной кислоты, нужно сжечь более 300 кг серы. Чтобы произвести 1 т целлюлозы, нужно затратить более 100 кг серы. В Канаде изготовлен серный пенопласт, который применяется в строительстве шоссейных дорог и при прокладке трубопроводов в условиях вечной мерзлоты. В Монреале построен одноэтажный дом, состоящий из необычных блоков: 70% песка и 30% серы.
Биологическое значение серы (слайд 32)
V. Закрепление
Учитель. Ребята, мы сегодня много размышляли о невероятном элементе и простом веществе сере и чтобы определить, стало ли нам понятно то, что мы изучали. Давайте применим знания, полученные нами, при решении вот этого задания.
Написать уравнения реакций, отражающих превращения веществ (задание представлено на слайде): (слайд 33)
Na2S
(2)
HgSS CS2
(4) ↓
SO2
Проверьте правильно ли вы выполнили задание (слайд 34)
Решение:
S + Hg = HgS
S + 2Na = Na2S
2S + C CS2
S + O2 SO2
Итог урока: стихотворение (слайд 35)
Вопрос: Достигли мы поставленной в начале урока цели? (Да)
Ребята, какие вопросы вызвали затруднение?
Рефлексивный тест (музыка): Поставить +, если согласны с утверждением (не подписывать) (слайд 36)
Я узнал много нового.
Мне это пригодится в жизни.
На уроке было над чем подумать.
На уроке я поработал добросовестно и цели урока достиг.
Домашнее задание: § 17 с. 62-64, задание 3,4; § 18, вопрос 1. Подготовить сообщение о производстве спичек.
ТЕСТ
1 вариант.
1 УРОВЕНЬ
1.Какие степени окисления проявляет сера:
а) +2, +3, +4. б) -2, +4, +6. в) -1, -2, +6.
2.Флотация — это свойство серы
а)растворяться в воде; б) не смачиваться в воде; в)частично растворяться в горячей воде.
3. При горении серы образуется:
а) сероводород; б) сульфид; в) сернистый газ.
4. В какой форме сера встречается в природе:
а) сульфатная; б) гидросульфидная; в) сульфитная.
5. С какой целью серу применяют в сельском хозяйстве:
а) как удобрение; б) для борьбы с вредителями; в)для подкормки скота.
2 УРОВЕНЬ.
Сумма коэффициентов в уравнении
K2SO3 + H2SO4
а) 11; б) 12; в)13.
3 УРОВЕНЬ.
7. Составьте формулы сульфидов натрия, магния, алюминия.
8.Уравняйте методом электронного баланса уравнение
Ba + H2SO4 →BaSO4 + H2S + H2O
2 вариант.
1 УРОВЕНЬ.
1.Какая электронная формула принадлежит сере:
а) 1s22s22p63s23p4 б) 1s22s22p6, в)1s22s22p63s23p6.
2.В романе А. Дюма герой романа аббат Фариа использовал серу для:
а) для лечения кожной болезни; б) для получения пороха; в) для химических опытов.
3. Для удаления и обезвреживания ртути из разбитого термометра вы будете использовать:
а)серу; б) йод; в)магнит.
4. В какой форме сера не встречается в природе:
а) самородная; б) сульфидная; в) сульфитная.
5.При растворении сероводорода в воде образуется:
а) серная кислота; б) сера; в) сероводородная кислота.
2 УРОВЕНЬ.
Сумма коэффициентов в полном ионном уравнении
Na2SO3 + HCl →
а)14; б) 12; в) 13.
3 УРОВЕНЬ.
7. Составьте формулы сульфатов калия, магния, железа(III).
8. Уравняйте методом электронного баланса схему
Ca + H2SO4 → CaSO4 + S + H2O
Поставить +, если согласны с утверждением (не подписывать).
Я узнал много нового.
Мне это пригодится в жизни.
На уроке было над чем подумать.
На уроке я поработал добросовестно и цели урока достиг.
Поставить +, если согласны с утверждением (не подписывать).
Я узнал много нового.
Мне это пригодится в жизни.
На уроке было над чем подумать.
4.На уроке я поработал добросовестно и цели урока достиг.
Применение серы:
Сера широко применяется в хозяйственной деятельности человека.
Сера — один из неметаллов, известных человеку с древнейших времен. Ее использовали для религиозных обрядов — поджигали при различных церемониях и ритуалах; ею чернили оружие, употребляли для изготовления косметики и лекарств, жгли для отбелки тканей и борьбы с насекомыми, использовали для изготовления черного пороха. В наши дни сера не теряет, а все более увеличивает свое значение в жизни человека. Бумага и резина, эбонит и спички, ткани и лекарства, косметика и пластмассы, взрывчатка и краски, удобрения и ядохимикаты и многое другое.
infourok.ru
План-конспект урока по химии (9 класс) на тему: 9 класс.Урок химии Сера. Аллотропия серы. Физические и химические свойства серы. Применение.
Тема № 2. «Кислород и сера» (9 часов)
Урок 2. (12) .
Тема: Сера. Аллотропия серы. Физические и химические свойства серы. Применение. Цель: — Рассмотреть аллотропные модификации серы и ее физические и химические свойства. Охарактеризовать нахождение серы в природе и ее применение. — Развивать монологическую речь, память, мышление, обще учебные умения и навыки.
— Воспитывать настойчивость при изучении нового материала, при решении задач и заданий.
Основные понятия: Флотация, аллотропные соединения серы: пластическая и кристаллическая (ромбическая, моноклинная) сера. Планируемые результаты обучения: Знать физические и химические свойства серы, ее аллотропные модификации. Уметь составлять уравнения реакций, подтверждающие окислительно – восстановительные свойства серы, сравнивать свойства простых веществ серы и кислорода, разъяснять эти свойства в свете представлений об окислительно – восстановительных реакциях.
Тип урока: урок изучения нового учебного материала.
Оборудование: ПСХЭ, ознакомление с образцами серы и ее природных соединений, презентация «Сера», вода, алюминий, спиртовка, химическая ложечка.
— Ход урока
1.Орг. Момент
2.Анализ К.Р.
3. Проверка Д / З:
1) Дать характеристику химического кислорода и серы элемента по его положению в ПСХЭ;
2) Строение простых веществ: кислорода. Аллотропия кислорода.
3) Задание классу: с. 31 вопросы № 1, 2;
9 класс Карточка № 1 Сера. Аллотропия. Положение кислорода и серы в периодической системе химических элементов. Строение атомов. |
9 класс Карточка № 1 Сера. Аллотропия. Строение простых веществ. Аллотропия. |
4.Изучение нового материала:
-Сера: строение, аллотропные модификации
— Сера – простое вещество
Учитель: Ребята, для серы, как и для кислорода, характерна аллотропия. Известно много модификаций серы с циклическим или линейным строением молекул различного состава.
Наиболее устойчива модификация — ромбическая сера, состоит из молекул S8 .Ее кристаллы имеют вид октаэдров со срезанными углами. Они окрашены в лимонно-желтый цвет и полупрозрачны, температура плавления 112,8 °С. В эту модификацию при комнатной температуре превращаются все другие модификации. Известно, например, что при кристаллизации из расплава сначала получается моноклинная сера (игольчатые кристаллы, температура плавления 119,3 °С), которая затем переходит в ромбическую.
При нагревании кусочков серы в пробирке она плавится, превращаясь в жидкость желтого цвета. При температуре около 160 °С жидкая сера начинает темнеть и становится настолько густой и вязкой, что даже не выливается из пробирки, однако при дальнейшем нагревании превращается в легкоподвижную жидкость, но сохраняет прежний темно-коричневый цвет. Если ее вылить в холодную воду, она застывает в виде прозрачной резинообразной массы. Это пластическая сера. Ее можно получить и в виде нитей. Однако через несколько дней она также превращается в ромбическую серу. ( Демонстрация опыта).
— Сера в природе (самостоятельно изучить схема 2 с.29)
— Химические свойства серы: Презентация и демонстрация опытов)
А) Взаимодействие серы с металлами
Учитель: Ребята, при обычных условиях сера реагирует со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром:
Fe 0+S0=Fe+2S-2
Напишите в уравнении реакции схему перехода электронов.
При нагревании сера реагирует и с другими металлами (Zn, Al), и только золото не взаимодействует с ней ни при каких условиях.
5.- Физминутка
Б) Взаимодействие серы с неметаллами.
Учитель: Из неметаллов с серой не реагируют только азот, иод и благородные газы.
1) Сера – окислитель:
1) h3 +S =h3S (сероводород)
S0+2ē =S2- │окислитель
h3 — 2ē =2H+ │восстановитель
2) Сера – восстановитель
Cера горит синеватым пламенем, образуя оксид серы (IV), сернистый газ
S +O2 = SO2
Ребята, напишите уравнения, составьте электронный баланс уравнений, записанных на слайде №10
Вопрос: А ещё, с каким веществом сера проявит восстановительные свойства?
— — Применение Сера (самостоятельно изучить схему 3 с.30)
— Ребята, какие вопросы вызвали затруднение? Понятно ли
6. Домашнее задание. § 9, 10 повторить § 7, 8
7. Закрепление: с. 31 вопросы № 3,
nsportal.ru
Сера. Аллотропия серы. Физические и химические свойства серы. Применение
Муниципальное бюджетное общеобразовательное учреждение
«Платово — Ивановская основная общеобразовательная школа»
Родионово — Несветайского района Ростовской области
Конспект урока по химии
9 класс
«Сера. Аллотропия серы. Физические и химические свойства серы. Применение»
Подготовила: учитель химии
первой квалификационной категории
Гнездилова Ирина Александровна
2016 год
Тема: Сера. Аллотропия серы. Физические и химические свойства серы. Применение.
Цели урока:
— Рассмотреть аллотропные модификации серы и ее физические и химические свойства. Охарактеризовать нахождение серы в природе и ее применение.
Основные понятия: Флотация, аллотропные соединения серы: пластическая и кристаллическая (ромбическая, моноклинная) сера.
Задачи урока:
- Рассмотреть строение атома серы согласно его положение в периодической системе химических элементов Д.И. Менделеева, аллотропные модификации серы.
- Изучить физические и химические свойства серы, нахождение в природе, его области применения.
- Продолжить формирование умения учащихся работать с периодической системой химических элементов Д. И. Менделеева.
- Совершенствовать умения составлять уравнения химических реакций.
Тип урока: урок открытия новых знаний.
Оборудование: ПСХЭ, образцы серы и ее природных соединений, презентация «Сера», вода, сера, спиртовка, химическая ложечка.
План урока
- Положение серы в ПСХЭ
- Строение атома, возможные степени окисления
- Физические свойства серы
- Нахождение в природе
- Аллотропия серы
- Химические свойства серы
- Применение серы
- Закрепление Планируемые результаты обучения:
Предметные:
- знать физические и химические свойства серы, способы ее получения, применение
- уметь характеризовать серу по ее положению в ПСХЭ, объяснять причину аллотропии серы, составлять электронную формулу серы, определять ее возможные степени окисления, составлять уравнения химических реакций, характеризующие химические свойства серы, определять коэффициенты методом электронного баланса, составлять реакции ионного обмена.
- самостоятельно использовать материалы учебника и справочные таблицы, применять ранее полученные знания.
научиться анализировать, делать выводы, обобщать полученные знания.
Метапредметные:
- умение определять цели и задачи деятельности, выбирать средства реализации цели и применять их на практике;
- выделять существенные признаки и свойства;
- выделять информацию из текста учебника;
- высказывать суждения, обосновывать и доказывать свой выбор, приводя факты, взятые из материалов учебника;
- использовать знаки, символы, схемы для выполнения заданий; находить закономерности, устанавливать причинно- следственные связи между реальными объектами и явлениями;
- способствовать развитию монологической речи, внимания, аналитического мышления;
- воспитывать культуру поведения и интерес к предмету.
Личностные:
- формировать положительную мотивацию к обучению;
- оценивать свою деятельность, определяя по заданным критериям ее успешность или неуспешность и способы ее корректировки, бережно и уважительно относиться к людям и результатам их деятельности;
- создавать позитивное эмоциональное отношение учеников к уроку и предмету.
- умение работать в группе, отстаивать и аргументировать свою точку зрения
Ход урока
- Организационный момент
Учитель. Ребята! На прошлом занятии мы дали характеристику элементам главной подгруппы VI группы. Изучили свойства кислорода, его аллотропные модификации. Давайте вспомним что мы знаем о кислороде:
II. Проверка изученного материала (экспресс-опрос) (слайд 1)
Какое строение имеет кислород? 
степень окисления в соединениях: -2, реже +1, +2/.
Когда и кем открыт был кислород? /Первые упоминания о кислороде датируются 8 в., открытие зафиксировано в 18 в. К.Шееле и Дж. Пристли/.
Назовите основные физические и химические свойства кислорода. /Газ, БЦ, БВ, БЗ, ρ = 1,43 г/л; tпл=-218,7°; tкип=-183°/.
Как получают кислород в промышленности и в лаборатории? /Из жидкого воздуха (методом фракционной дистилляции), электролитическим разложением воды/.
Какие аллотропные модификации кислорода вам известны? /Кислород — О2 и озон — О3/.
Какова роль озонового слоя для жизни на Земле? /Защита от космического ультрафиолетового излучения/.
Где применяется кислород? /В металлургии, химической промышленности, медицине, в авиации, в ракетно-космической технике, при сварке и резке металлов, и т.д./. (молодцы!)
II. Изучение нового материала
Сегодня мы будем изучать вещество, в состав которых входит элемент, о котором есть такая загадка: «Возьмите первый слог названия “лунного элемента” и прибавьте к нему первый слог радиоактивного металла, открытого супругами Кюри в 1898 г. Вы получите название элемента, которое в переводе на русский язык обозначает светло-желтый».
Кто из вас догадался, что это за элемент? (Сера.)
Эпиграфом к уроку служат такие строки:
Немало сера знаменита,
И в древности ее Гомер воспел,
С ней много тысяч лет прожито,
И человек в ней пользу разглядел.
(слайд 2)
Учитель. На этом уроке мы познакомимся с химическим элементом и простым веществом – серой. Давайте сформулируем тему нашего урока. (слайд 3)
Запишите тему урока: Сера. Аллотропия серы. Физические и химические свойства серы. Применение
А теперь давайте определим цели нашего урока: (слайд 4)
— Рассмотреть аллотропные модификации серы и ее физические и химические свойства. Охарактеризовать нахождение серы в природе и ее применение.
На уроке мы будем работать по следующему плану (слайд 5)
Историческая справка (слайд 6)
Учитель: Человечество познакомилось с серой в древности (около IVв. до н.э.) Жрецы использовали её в составе «священных курений» при некоторых религиозных обрядах. Различные горючие смеси для военных целей тоже содержали серу. Ещё у Гомера упоминаются «сернистые испарения» и смертельное действие продуктов горения серы. Она же входила в состав «греческого огня», наводившего ужас на противников. Точный состав смеси не известен, но полагают, что кроме серы в неё входили нефть, различные горючие масла, смола, селитра, клей и красители.
Элементарную природу серы установил француз Антуан Лоран Лавуазье в своих опытах по сжиганию в 1770 году.
В разные времена сера обозначалась разными символами (слайд 7)
Рассмотрим положение серы в ПСХЭ: (слайд 8)
Валентные состояния атома серы (слайд 9)
В отличие от кислорода, у атомов серы на третьем энергетическом уровне имеется пять незаполненных d – орбиталей. Поэтому возможно распаривание электронов. В результате этого у серы появляется либо 4, либо 6 не спаренных электронов, которые при соединении с более электроотрицательным элементом смещаются в его сторону. Этим и объясняется степень окисления серы в соединениях с кислородом: +4 и +6.
Физические свойства серы
(Демонстрация коллекции минералов) + (слайды)
Рассмотрите образец серы, определите:
- агрегатное состояние.
- цвет.
- растворимость в воде (опустите кусочек серы в стакан с водой, затем порошок серы в пробирку с водой, сделайте вывод.)
- Температура плавления -112,8
- Температура кипения – 444,6.
Вывод: Сера-это твердое вещество, желтого цвета, в воде не растворяется. (слайд 10)
- Демонстрация: Растворение серы в воде и спирте (л.о.выполняют учащиеся).
Сера не растворима в воде, потому что серный порошок плохо смачивается водой и поддерживается на плаву мелкими пузырьками воздуха. Это процесс флотации. Это свойство используется для отделения серы от примесей, в промышленности.
Флотация –это (фр. flottation, от flotter — плавать) — процесс разделения мелких твёрдых частиц (главным образом, минералов), основанный на различии их в смачиваемости водой.
— Сера в природе (самостоятельно изучить схема 4 с.62 (демонстрация слайдов 11 — 19)
Учитель: Ребята, для серы, как и для кислорода, характерна аллотропия. Известно много модификаций серы с циклическим или линейным строением молекул различного состава (слайд 20)
Наиболее устойчива модификация — ромбическая сера,(слайд 21) состоит из молекул S8 .Ее кристаллы имеют вид октаэдров со срезанными углами. Они окрашены в лимонно-желтый цвет и полупрозрачны, температура плавления 112,8 °С. В эту модификацию при комнатной температуре превращаются все другие модификации. Известно, например, что при кристаллизации из расплава сначала получается моноклинная сера (слайд 22) (игольчатые кристаллы, температура плавления 119,3 °С), которая затем переходит в ромбическую.
При нагревании кусочков серы в пробирке она плавится, превращаясь в жидкость желтого цвета. При температуре около 160 °С жидкая сера начинает темнеть и становится настолько густой и вязкой, что даже не выливается из пробирки, однако при дальнейшем нагревании превращается в легкоподвижную жидкость, но сохраняет прежний темно-коричневый цвет. Если ее вылить в холодную воду, она застывает в виде прозрачной резинообразной массы. Это пластическая сера. Ее можно получить и в виде нитей. Однако через несколько дней она также превращается в ромбическую серу.
(слайд 23) Видео получение пластической серы.
5.- Физминутка (слайд 24)
Глубоко вздохнули:
вот, мы набрали кислород.
Выдохнув из легких чистых газ уходит углекислый.
Руки вверх, потом вперед – не поймать нам водород!
Руки в стороны, ходить.
Будем с химией дружить!
— Химические свойства серы: (Презентация и демонстрация опытов)
В связи с большим, чем у кислорода, атомным радиусом, окислительные свойства серы выражены слабее. Поэтому в реакциях с кислородом сера – восстановитель и проявляет степени окисления +4 и +6. Окислительные свойства серы проявляются в реакциях с металлами и водородом, а восстановительные — в реакциях с кислородом и галогенами.
Учитель: Ребята, при обычных условиях сера реагирует со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром:
Видео: Взаимодействие серы с медью (слайд 25)
Запишите уравнение реакции Cu + S → CuS, покажите переход электронов, укажите окислитель и восстановитель.
Взаимодействие серы с натрием (слайд 26)
Запишите уравнение реакции. 2Na + S → Na2S , покажите переход электронов, укажите окислитель и восстановитель.
Взаимодействии цинковой пыли с порошком серы (слайд 27)
Запишите уравнение реакции. Zn + S = ZnS, покажите переход электронов, укажите окислитель и восстановитель.
Затем следует обобщение: сера взаимодействует со всеми металлами, кроме Аи и Рt. С ртутью она, например, взаимодействует даже при обычной температуре, что используют при обеззараживании помещений от пролитой там ртути. Процесс называется демеркуризацией (объясняется этимология этого термина).
ДЕМЕРКУРИЗАЦИЯ (от франц. démercurisation < mercure — ртуть) — система специальных мероприятий по очищению помещений, емкостей и т. п. от разлитой ртути.
Hg0 + S0 = Hg+2 S–2
Hg0 – 2e ––> Hg+2
S0 + 2e ––> S–2
И так, мы пришли к выводу, что при нагревании сера реагирует и с другими металлами (Zn, Al), и только золото не взаимодействует с ней ни при каких условиях.
Б) Взаимодействие серы с неметаллами.
Учитель: Из неметаллов с серой не реагируют только азот, иод и инертные газы.
1) Сера – окислитель:
1) H2 +S =H2S (сероводород)
S0+2ē =S2- │окислитель
H2 — 2ē =2H+ │восстановитель
2) Сера – восстановитель (горение серы – видео) (слайд29)
Cера горит синеватым пламенем, образуя оксид серы (IV), сернистый газ
S +O2 = SO2
3. Взаимодействие серы со сложными веществами
- Взаимодействие серы со сложными веществами — окислителями можно показать на эффектной реакции взаимодействия бертолетовой соли (если ее можно будет достать!) с__серой. В фарфоровую чашечку втирается немного серы, а затем помещается несколько мелких кристалликов бертолетовой соли. Уже при легком растирании кристалликов раздаются взрывчики и вспыхивает пламя:
2КСl O3 + 3S = 2КСl + 3SО2
Такая реакция, в частности, лежит в основе «работы» спичек. В них красный фосфор и сульфид сурьмы (III) Sb2S3 с помощью клея наносится на боковую поверхность спичечного коробка, а головка спички готовится обычно из бертолетовой соли, серы, стеклянного порошка и клея. Под действием теплоты трения мельчайшие частички красного фосфора превращаются в белый фосфор, который воспламеняется на воздухе и поджигает головку спички. (задание учащимся – к следующему уроку подготовить сообщение о производстве спичек)
Ребята, запишите уравнения, составьте электронный баланс уравнений, записанных в таблице (слайд 30), проверьте друг у друга правильность выполнения задания.
Вопрос: А ещё, с каким веществом сера проявляет восстановительные свойства? (фтор)
— — Применение Сера (самостоятельно изучить схему 5 с.66)
Сообщение учащихся: Сера широко применяется в хозяйственной деятельности человека.
Сера — один из неметаллов, известных человеку с древнейших времен. Ее использовали для религиозных обрядов — поджигали при различных церемониях и ритуалах; ею чернили оружие, употребляли для изготовления косметики и лекарств, жгли для отбелки тканей и борьбы с насекомыми, использовали для изготовления черного пороха. В наши дни сера не теряет, а все более увеличивает свое значение в жизни человека. Бумага и резина, эбонит и спички, ткани и лекарства, косметика и пластмассы, взрывчатка и краски, удобрения и ядохимикаты — это все только небольшой перечень того, для изготовления чего необходима сера. (слайд 31)
Учитель: Примерно половина добываемой в мире серы идет на производство серной кислоты. Чтобы получить 1 т серной кислоты, нужно сжечь более 300 кг серы. Чтобы произвести 1 т целлюлозы, нужно затратить более 100 кг серы. В Канаде изготовлен серный пенопласт, который применяется в строительстве шоссейных дорог и при прокладке трубопроводов в условиях вечной мерзлоты. В Монреале построен одноэтажный дом, состоящий из необычных блоков: 70% песка и 30% серы.
Биологическое значение серы (слайд 32)
V. Закрепление
Учитель. Ребята, мы сегодня много размышляли о невероятном элементе и простом веществе сере и чтобы определить, стало ли нам понятно то, что мы изучали. Давайте применим знания, полученные нами, при решении вот этого задания.
Написать уравнения реакций, отражающих превращения веществ (задание представлено на слайде): (слайд 33)
Na2S
(2)
HgS S
S  CS2
CS2
(4) ↓
SO2
Проверьте правильно ли вы выполнили задание (слайд 34)
Решение:
- S + Hg = HgS
- S + 2Na = Na2S
-
2S + C
 CS2
CS2
-
S + O2
 SO2
SO2
Итог урока: стихотворение (слайд 35)
Вопрос: Достигли мы поставленной в начале урока цели? (Да)
Ребята, какие вопросы вызвали затруднение?
Рефлексивный тест (музыка): Поставить +, если согласны с утверждением (не подписывать) (слайд 36)
- Я узнал много нового.
- Мне это пригодится в жизни.
- На уроке было над чем подумать.
- На уроке я поработал добросовестно и цели урока достиг.
Домашнее задание: § 17 с. 62-64, задание 3,4; § 18, вопрос 1. Подготовить сообщение о производстве спичек.
ТЕСТ
1 вариант.
1 УРОВЕНЬ
1.Какие степени окисления проявляет сера:
а) +2, +3, +4. б) -2, +4, +6. в) -1, -2, +6.
2.Флотация — это свойство серы
а)растворяться в воде; б) не смачиваться в воде; в)частично растворяться в горячей воде.
3. При горении серы образуется:
а) сероводород; б) сульфид; в) сернистый газ.
4. В какой форме сера встречается в природе:
а) сульфатная; б) гидросульфидная; в) сульфитная.
5. С какой целью серу применяют в сельском хозяйстве:
а) как удобрение; б) для борьбы с вредителями; в)для подкормки скота.
2 УРОВЕНЬ.
- Сумма коэффициентов в уравнении
K2SO3 + H2SO4
а) 11; б) 12; в)13.
3 УРОВЕНЬ.
7. Составьте формулы сульфидов натрия, магния, алюминия.
8.Уравняйте методом электронного баланса уравнение
Ba + H2SO4 →BaSO4 + H2S + H2O
2 вариант.
1 УРОВЕНЬ.
1.Какая электронная формула принадлежит сере:
а) 1s22s22p63s23p4 б) 1s22s22p6, в)1s22s22p63s23p6.
2.В романе А. Дюма герой романа аббат Фариа использовал серу для:
а) для лечения кожной болезни; б) для получения пороха; в) для химических опытов.
3. Для удаления и обезвреживания ртути из разбитого термометра вы будете использовать:
а)серу; б) йод; в)магнит.
4. В какой форме сера не встречается в природе:
а) самородная; б) сульфидная; в) сульфитная.
5.При растворении сероводорода в воде образуется:
а) серная кислота; б) сера; в) сероводородная кислота.
2 УРОВЕНЬ.
- Сумма коэффициентов в полном ионном уравнении
Na2SO3 + HCl →
а)14; б) 12; в) 13.
3 УРОВЕНЬ.
7. Составьте формулы сульфатов калия, магния, железа(III).
8. Уравняйте методом электронного баланса схему
Ca + H2SO4 → CaSO4 + S + H2O
Поставить +, если согласны с утверждением (не подписывать).
- Я узнал много нового.
- Мне это пригодится в жизни.
- На уроке было над чем подумать.
- На уроке я поработал добросовестно и цели урока достиг.
Поставить +, если согласны с утверждением (не подписывать).
- Я узнал много нового.
- Мне это пригодится в жизни.
- На уроке было над чем подумать.
4.На уроке я поработал добросовестно и цели урока достиг.
Применение серы:
Сера широко применяется в хозяйственной деятельности человека.
Сера — один из неметаллов, известных человеку с древнейших времен. Ее использовали для религиозных обрядов — поджигали при различных церемониях и ритуалах; ею чернили оружие, употребляли для изготовления косметики и лекарств, жгли для отбелки тканей и борьбы с насекомыми, использовали для изготовления черного пороха. В наши дни сера не теряет, а все более увеличивает свое значение в жизни человека. Бумага и резина, эбонит и спички, ткани и лекарства, косметика и пластмассы, взрывчатка и краски, удобрения и ядохимикаты и многое другое.
mega-talant.com
1. Сера
Лекция 4
Тема. Сера, азот, фосфор, углерод, кремний, их соединения, применение
1.1. Историческая справка
Сера – одно из немногих веществ, которое было известно с древнейших времен, её использовали первые химики. Одна из причин известности серы – распространенность самородной серы в странах древнейших цивилизаций. Её разрабатывали греки и римляне, производство серы значительно увеличилось после изобретения пороха.
1.2. Место серы в Периодической системе химических элементов Менделеева
Сера расположена в 16 группе Периодической системы химических элементов Менделеева.
На внешнем энергетическом уровне атома серы содержится 6 электронов, которые имеют электронную конфигурацию 3s23p4. В соединениях с металлами сера проявляет отрицательную степень окисления элементов -2, в соединениях с кислородом и другими активными неметаллами – положительные +2, +4, +6. Сера – типичный неметалл, в зависимости от типа превращения может быть окислителем и восстановителем.
1.3. Распространенность в природе
Сера довольно широко распространена в природе. Её содержание в земной коре составляет 0,0048 %.Значительная часть серы встречается в самородном состоянии.
Также сера встречается в форме сульфидов: пирит, халькопирит и сульфатов: гипс, целестин и барит.
Много соединений серы содержится в нефти (тиофен C4H4S, органические сульфиды) и нефтяных газах (сероводород).
1.4. Аллотропные модификации серы
Существование аллотропных модификаций серы связано с её способностью образовывать устойчивые гомоцепи – S – S –. Устойчивость цепей объясняется тем, что связи – S – S – оказываются прочнее, чем связь в молекуле S2. Гомоцепи серы имеют зигзагообразную форму, поскольку в их образовании принимают участие электроны взаимно перпендикулярных р-орбиталей.
Существует три аллотропные модификации серы: ромбическая, моноклинная и пластическая. Ромбическая и моноклинная модификации построены из циклических молекул S8, размещенных по узлам ромбической и моноклинной решеток.
Молекула
S8 имеет форму короны, длины всех связей
– S – S – равны 0,206 нм и углы близки к
тетраэдрическим 108°.
В ромбической сере наименьший элементарный объем имеет форму прямоугольного параллелепипеда, а в случае моноклинной серы элементарный объем выделяется в виде скошенного параллелепипеда.


Кристалл ромбической серы Кристалл моноклинной серы
Пластическая
модификация серы образована спиральными
цепями из атомов серы с левой и правой
осями вращения. Эти цепочки скручены и
вытянуты в одном направлении.
При комнатной температуре устойчива ромбическая сера. При нагревании она плавится, превращаясь в желтую легкоподвижную жидкость, при дальнейшем нагревании жидкость загустевает, так как в ней образуются длинные полимерные цепочки. При медленном охлаждении расплава образуются темно-желтые игольчатые кристаллы моноклинной серы, а если вылить расплавленную серу в холодную воду, получится пластическая сера – резиноподобная структура, состоящая из полимерных цепочек. Пластическая и моноклинная сера неустойчивы и самопроизвольно превращаются в ромбическую.
1.5. Физические свойства серы
Сера представляет собой твердое хрупкое вещество желтого цвета, в воде практически нерастворима, не смачивается водой и плавает на её поверхности. Хорошо растворяется в сероуглероде и других органических растворителях, плохо проводит тепло и электрический ток. При плавлении сера образует легкоподвижную жидкость желтого цвета, которая при 160°С темнеет, её вязкость повышается, и при 200°С сера становится темно-коричневой и вязкой, как смола. Это объясняется разрушением кольцевых молекул и образованием полимерных цепей. Дальнейшее нагревание ведет к разрыву цепей, и жидкая сера снова становится более подвижной. Пары серы имеют цвет от оранжево-желтого до соломенно-желтого цвета. Пар состоит из молекул состава S8, S6, S4, S2. При температуре выше 150 °С молекула S2 диссоциирует на атомы.
Физические свойства аллотропных модификаций серы приведены в таблице:
Свойство | Ромбическая сера | Моноклинная сера | Пластическая сера | ||||||
Цвет |
|
|
| ||||||
Плотность, г/см3 | 2,07 | 1,96 | — | ||||||
Температура плавления, °С | 112,8 | 119,3 | — | ||||||
Температура кипения, °С | 444,6 | ||||||||
studfile.net
Cайт учителя химии Ващенко Н.Ю.
СЕРА S
Cера в природе
Сульфиды
PbS — свинцовый блеск
Cu2S – медный блеск
ZnS – цинковая обманка
FeS2 – пирит, серный колчедан, кошачье золото
h3S – сероводород (в минеральных источниках и природном газе)
Белки — волосы, кожные покровы, ногти…
Сульфаты
CaSO4 x 2h3O — гипс
MgSO4 x 7h3O – горькая соль (английская)
Na2SO4 x 10h3O – глауберова соль (мирабилит)
Физические свойства
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t°кип = 445°С
Аллотропия
Для серы характерны несколько аллотропных модификаций:
Строение атома серы
Размещение электронов по уровням и подуровням
 Основное состояние
Основное состояние1s22s22p63s23p4
| Размещение электронов по орбиталям (последний слой) | Степень окисления | Валентность |
+2, -2 +4 +6 | В основном состоянии II Первое возбуждённое состояние IV Второе возбуждённое состояние VI |
Получение серы
2. Неполное окисление сероводорода (при недостатке кислорода).
2h3S + O2 = 2S + 2h3O
3. Реакция Вакенродера
2h3S + SO2 = 3S + 2h3O
Химические свойства серы
Вулканизация каучука, получение эбонита, производство спичек, пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний), для получения серной кислоты и т.д.
ЗАДАНИЯ
№1. Закончите уравнения реакций:
S + O2 =
S + Na =
S + h3 =
Расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель.
№2. Осуществите превращения по схеме:
h3S → S → Al2S3 → Al(OH)3
№3. Закончите уравнения реакций, укажите, какие свойства проявляет сера (окислителя или восстановителя):
Al + S = (при нагревании)
S + h3 = (150-200)
S + O2 = (при нагревании)
S + F2 = (при обычных условиях)
S + h3SO4(к) =
S + KOH =
S + HNO3 =
Это интересно…
— Содержание серы в организме человека массой 70 кг — 140 г.
— В сутки человеку необходимо 1 г серы.
— Серой богаты горох, фасоль, овсяные хлопья, пшеница, мясо, рыба, плоды и сок манго.
— Сера входит в состав гормонов, витаминов, белков, она есть в хрящевой ткани, в волосах, ногтях. При недостатке серы в организме наблюдается хрупкость ногтей и костей, выпадение волос.
Знаете ли вы…
— Соединения серы могут служить лекарственными препаратами;
ÒСера – основа мази для лечения грибковых заболеваний кожи, для борьбы с чесоткой. Тиосульфат натрия Na2S2O3 используется для борьбы с нею.
— Многие соли серной кислоты содержат кристаллизационную воду: ZnSO4×7h3O и CuSO4×5h3O. Их применяют как антисептические средства для опрыскивания растений и протравливания зерна в борьбе с вредителями сельского хозяйства.
— Железный купорос FeSO4×7h3O используют при анемии.
— BaSO4 применяют при рентгенографическом исследовании желудка и кишечника.
— Алюмокалиевые квасцы KAI(SO4) 2×12h3O — кровоостанавливающее средство при порезах.
— Минерал Na2SO4×10h3O носит название «глауберова соль» в честь открывшего его в VIII веке немецкого химика Глаубера И.Р. Глаубер во время своего путешествия внезапно заболел. Он ничего не мог есть, желудок отказывался принимать пищу. Один из местных жителей направил его к источнику. Как только он выпил горькую соленую воду, сразу стал есть. Глаубер исследовал эту воду, из нее выкристаллизовалась соль Na2SO4×10h3O. Сейчас ее применяют как слабительное в медицине, при окраске хлопчато- бумажных тканей. Соль также находит применение в производстве стекла.
— Тысячелистник обладает повышенной способностью извлекать из почвы серу и стимулировать поглощение этого элемента с соседними растениями.
— Чеснок выделяет вещество – альбуцид, едкое соединение серы. Это вещество предотвращает раковые заболевания, замедляет старение, предупреждает сердечные заболевания.
himiknoginsk.ucoz.ru
Моноклинная (b — сера) — S8 темно-желтые иглы, t°пл. = 119°C; ρ = 1,96 г/см3. Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую. | Пластическая Sn коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании превращается в ромбическую. | |
| ПОЛУЧЕНИЕ ПЛАСТИЧЕСКОЙ СЕРЫ | Основное состояние 1s22s22p63s23p4 |
Размещение электронов по | Степень | Валентность |
+2, -2 | В основном состоянии II | |
| +4 | Первое возбуждённое состояние IV |
+6 | Второе возбуждённое состояние VI | Сера — восстановитель S — 2ē S+2; S — 4ē S+4; S — 6ē S+6 |
1) Сера реагирует со щелочными металлами без нагревания: 2Na + S Na2S ОПЫТ c остальными металлами (кроме Au, Pt) — при повышенной t: 2Al + 3S –tAl2S3 Zn + S –tZnS ОПЫТ Cu + S –tCuS ОПЫТ 2) С некоторыми неметаллами сера образует бинарные соединения: H2 + S H2S 2P + 3S P2S3 C + 2S CS2 | 1) c кислородом: S + O2 –t S+4O2 2S + 3O2 –t;pt 2S+6O3 2) c галогенами (кроме йода): S + Cl2 S+2Cl2 3) c кислотами — окислителями: S + 2H2SO4(конц) 3S+4O2 + 2H2O S + 6HNO3(конц) H2S+6O4 + 6NO2 + 2H2O Реакции диспропорционирования: 4) 3S0 + 6KOH K2S+4O3 + 2K2S-2 + 3H2O
|
doc4web.ru
Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Слайды и текст этой презентации
Слайд 1

Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы.
Подготовила презентацию учитель химии МОУ «Лучистовская школа» города Алушты МустафаеваЛ.З
Слайд 2

Цель работы
Охарактеризовать серу в свете трёх форм существования элемента: в форме атомов, простых веществ (аллотропия), а также некоторых соединений серы.
Химические свойства серы рассмотреть в свете ОВР.
Слайд 3

Физические свойства серы
Твёрдое кристаллическое вещество желтого цвета, без запаха
Плохо проводит теплоту и не проводит электрический ток
Сера в воде практически не растворяется
Температура плавления 1200С
Слайд 4

Нахождение серы в природе
Сера является на 16-м месте по распространённости в земной коре. Встречается в свободном (самородном) состоянии и связанном виде.
Слайд 5

Сера также встречается в виде сульфатов — солей серной кислоты — мирабилит
Слайд 6

Пирит – «огненный камень» (соединение серы в природе)
Слайд 7

Сера входит в состав белков. Особенно много серы в белках волос, рогов, шерсти. Кроме этого сера является составной частью биологически активных веществ: витаминов и гормонов. При недостатке серы в организме наблюдается хрупкость и ломкость костей, выпадение волос.
Сера в природе
Слайд 8

Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца
Слайд 9

Аллотро́пия (от др.-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам: так называемых аллотропических модификаций или аллотропических форм.
Слайд 10

Слайд 11

Ромбическая сера
Ромбическая
(α-сера) – S8, желтого цвета,
t°пл.=113°C; Наиболее устойчивая модификация
Слайд 12
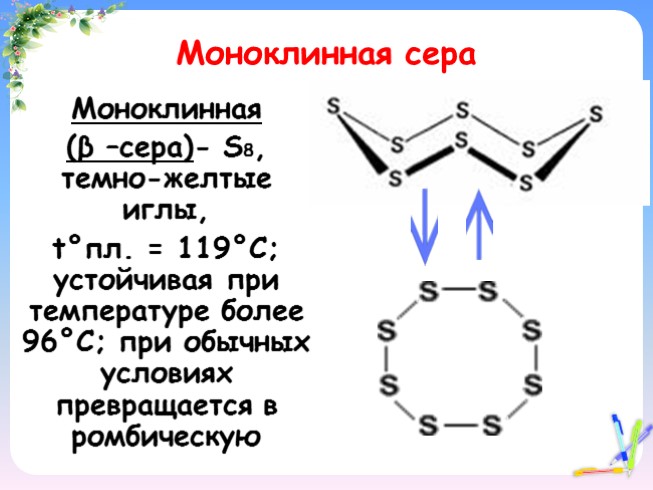
Моноклинная сера
Моноклинная
(β –сера)- S8, темно-желтые иглы,
t°пл. = 119°C; устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую
Слайд 13

Пластическая сера
Пластическая сера- коричневая резиноподобная (аморфная) масса.
Она неустойчива и через некоторое время становится хрупкой, приобретёт желтый цвет, т.е
превращается в ромбическую серу
Слайд 14

Химические свойства серы (восстановительные)
Сера проявляет в реакциях с сильными окислителями:
S — 2ē S+2; S — 4ē S+4; S — 6ē S+6
1) C кислородом:
S + O2 t S+4O2
2S + 3O2 t;Рt 2S+6O3
2) С галогенами (кроме йода)
S + Cl2 S+2Cl2
3) С кислотами — окислителями:
S + 2h3SO4(конц) 3S+4O2 + 2h3O
S + 6HNO3(конц) h3S+6O4 + 6NO2 + 2h3O
Слайд 15

Химические свойства серы (окислительные)
S0 + 2ē S-2
4) Сера реагирует со щелочными металлами без нагревания:
2Na + S Na2S
c остальными металлами (кроме Au, Pt) — при повышенной t:
2Al + 3S –t Al2S3
Cu + S –t CuS
5) С некоторыми неметаллами сера образует бинарные соединения:
h3 + S h3S
2P + 3S P2S3
C + 2S CS2
Слайд 16

Применение серы
Медицина
Производство
серной
кислоты
Сельское хозяйство
Производство спичек
Производство резины
Производство взрывчатых
веществ
Красители
Слайд 17

Спасибо за внимание!
lusana.ru
 CS2
CS2
 SO2
SO2


