Свойства серы, степень окисления, химические и физические свойства, применение, молярная масса серы, формула, температура плавления, характеристика соединений

Сера – важнейший элемент в современной промышленности.
Особые свойства серы (антисептические и антипаразитарные) делают её незаменимым компонентном многих лекарственных препаратов.
Что такое сера и как она выглядит
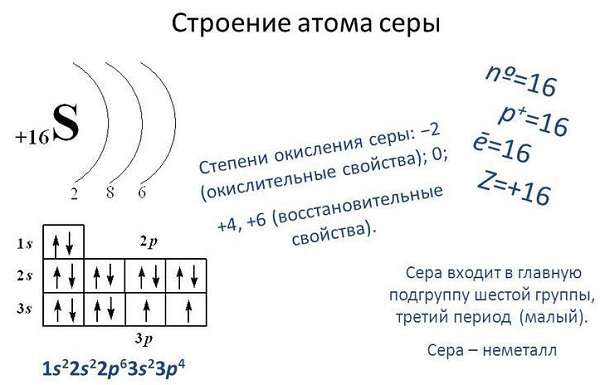
Сера – химический элемент, находящийся по 16 номером в таблице Д. И. Менделеева и обозначающийся буквой S (по первой букве латинского названия Sulphur).

Молярная масса серы равна 32, 065 г/моль, атомная масса — 32,066 а. е. м. Это вещество может быть как ярко-желтого, так и коричневого цвета.

Различают порошкообразную (молотую) и жидкую серу.
Характеристика серы
Сера – вещество с переменной степенью окисления. На внешней электронной орбитали серы находятся шесть валентных электронов, для заполнения не хватает ещё двух, поэтому в соединениях с металлами и водородом она проявляет валентность -2.
При взаимодействии с кислородом и галогенами, т. е. с элементами с большей электроотрицательностью, сера может проявлять положительную валентность, например, +4 и +6.
Физические свойства
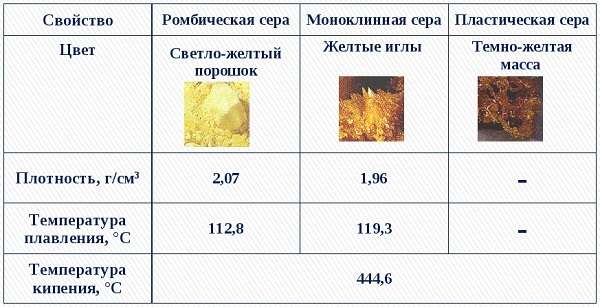
Как простое вещество, сера образует несколько аллотропных модификаций:
- Ромбическая – то, что мы привыкли называть обычной серой. Она устойчива при обычных условиях, встречается чаще всего недалеко от действующих или потухших вулканов.
- Пластическая – представляет собой замкнутые или открытые цепочки соединяющейся между собой серы, получаемые обычно при её сжигании. Имеет самую большую молекулярную массу среди всех разновидностей серы.
- Моноклинная (S8) – соединение серы, которое в молекулярном виде представляет собой восьмиугольник с атомами серы в вершинах. Выглядит как множество цилиндров, похожих на иглы. При комнатной температуре быстро превращается в ромбическую.
Приблизительная молярная масса одной молекулы моноклинной серы – 256 г/моль. В России сера, в основном, бывает только двух товарных видов: гранулированная и комовая.
Сера – легкоплавкое вещество, температура плавления около 120 градусов. Нерастворима в воде и не намокает про соприкосновении с ней.
Не обладает электролитическими свойствами и теплопроводностью. Плотность серы 2,070 г/см³.
Химические свойства
В соединениях с водородом образует серную (химическая формула h3SO4) со степенью окисления серы +6 и сернистую (h3SO3) со степенью окисления +4 кислоты, которые дают соответственно сульфаты и сульфиты.

В нормальных условиях реагируют с активными металлами и ртутью, образуя сульфиды:
Hg + S = HgS
Na + S = Na2S
Также образует сульфиды при нагревании с большинством неактивных металлов, кроме платины и золота:
Fe + S (t) = Fe2S3
Проявляет восстановительные свойства в реакции с кислородом при нагревании, образуя кислотный оксид:
S + O2 = SO2
В реакциях с водородом образует сернистый газ, летучее бесцветное вещество с неприятным запахом тухлых яиц:
h3 + S = h3S
Области применения
Широко применяется в медицине, обладает антисептическими и антипаразитарными свойствами, используется для дезинфекции помещений и избавления от паразитов.
В низких концентрациях способствует формированию новых клеток эпидермиса, из-за чего её часто используют для лечения воспалений. Помимо этого сера имеет слабительное действие, а при приеме внутрь оказывает отхаркивающий эффект.
Благодаря легковоспламеняемости и горючим свойствам, сера хорошо горит. Например, самое простое, где можно взять серу, это открыть полный спичечный коробок сера входит в состав спичечной головки.

При трении головка касается шероховатой поверхности (например, наждачной бумаги), и спичка легко загорается.
Серная кислота (h3SO4) – важнейший продукт химической промышленности, используется в качестве электролита в свинцовых аккумуляторах, применяется для получения соляной, азотной, борной и других кислот.

Серная кислота является необходимым сульфирующим средством при получении многих лекарственных веществ и красок.
Сероводород (h3S) используется для выделения чистой серы, сульфитов и серной кислоты из растворов.
Оксиды серы (SO2 и SO3) находят применения в производстве серной и азотной кислот, а также используются в бытовой химии: входят в состав отбеливателей, дезинфицирующих средств.
Нахождение серы в природе

Чаще всего в природе находится самородная сера (S), однако встречаются и её соединения с другими элементами: FeS2 (сульфат железа (II), пирит), ZnS (сульфат цинка, цинковая обманка), CaSO4*2h3O (гипс), PbS (сульфат свинца, свинцовый блеск) и другие.
Биологическая роль серы
Сера содержится в живых организмах, особенно много её в белках ногтей, волос, копыт. Общая масса серы в человеческом организме составляет около 130 грамм. Также это вещество встречается в составе некоторых витаминов и гормонов.
Сера обладает уникальными химическими и физическими свойствами, благодаря чему является важнейшим компонентом промышленности и незаменима при создании лекарственных препаратов.
tvercult.ru
Соединения серы: формулы, свойства и примеры
Сера
В свободном состоянии сера – твердое кристаллическое вещество желтого цвета. Для серы характерно явление аллотропии, т.е. существование в виде нескольких простых веществ – аллотропных модификаций. Аллотропные модификации серы – ромбическая (наиболее устойчивая), моноклинная и пластическая. Молекулы серы в ромбической модификации состоят из 8-ми атомов.
Сера относится к семейству p-элементов. Электронная конфигурация серы [Ne]3s23p4. Для серы характерно наличие трех степеней окисления «-2», «+4» и «+6».
Для получения серы используют реакцию Вакенродера (1) или получают ее неполным окислением сероводорода (2):
2H2S + SO2 = 3S↓ + 2H2O (1)
H2S + O2 = 2S↓ + 2H2O (2)
Из-за наличия нескольких степеней окисления сера способна проявлять и окислительные (в реакциях с металлами) и восстановительные (в реакциях с сильными окислителями) свойства:
Fe +S = FeS
Fe0 -2e = Fe2+ — процесс окисления (восстановитель)
S0 +2e = S2- — процесс восстановления (окислитель)
S + O2 = SO2
S0 – 4e = S4+ — процесс окисления (восстановитель)
O20 + 2e = 2O2- — процесс восстановления (окислитель)
Сера взаимодействует с концентрированными растворами кислот (растворяется в них) и со щелочами (диспропорционирует):
S +2H2SO4 = 3SO2 + 2H2O
3S + NaOH = K2SO3 + 2K2S + 3H2O
Сероводород. Сероводородная кислота. Сульфиды
При нагревании серы с водородом происходит обратимая реакция в результате которой выделяется сероводород – бесцветный газ с запахом тухлых яиц, ядовитый и плохо растворимый в воде:
S + H2 ↔H2S ↑
Однако, выход сероводорода в этой реакции невелик и для его получения чаще всего используют реакцию действия разбавленных кислот на сульфиды (соли сероводородной кислоты):
FeS + 2HCl = FeCl2 + H2S ↑
Водный раствор сероводорода – очень слабая кислота, диссоциация которой протекает в две ступени:
H2S↔H+ + HS—
HS— ↔ H+ + S2-
В связи с этим, для сероводородной кислоты характерна способность к образованию солей двух видов – средних – сульфидов (кислотный остаток — S2-) и кислых – гидросульфидов (кислотный остаток — HS—).
Сероводородная кислота – сильный восстановитель, т.к. сера, входящая в состав этого вещества, находится в низшей степени окисления и способна повысить её до «+4» или «+6», поэтому состав продуктов реакции определяется силой и количеством окислителя:
H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
H2S + 3H2SO4=4SO2 + 4H2O
H 2S + 4Br2 = S + 3HBr
Для сульфидов, как для солей образованных слабой кислотой, характерна способность к гидролизу. Сульфиды металлов, стоящих в ряду активности левее железа, растворимы в сильных кислотах:
ZnS + H2SO4 = ZnSO4 + H2S ↑
Качественной реакцией на H2S и растворимые в воде сульфиды является:
H2S + Pb(NO3)2 = PbS↓ + 2HNO3
S2- + Pb2+ = PbS↓ (осадок черного цвета)
Оксид серы (IV). Сернистая кислота
В степени окисления «+4» сера образует оксид, которому соответствует кислота. Оксид серы (IV) представляет собой газообразное вещество (сернистый газ) без цвета, но обладающее резким запахом, хорошо растворимое в воде.
Выделяют промышленные и лабораторные способы получения оксида серы (IV). Так, в промышленности (1), его получают при обжиге сульфидов, а в лаборатории (2) – при действии сильных кислот на сульфиты:
4FeS2 + 11O2 =2Fe2O3 + 8SO2↑ (1)
Na2SO3 + 2HCl = 2NaCl + SO2↑ + H2O (2)
В водном растворе оксида серы (IV) возможно одновременное существование нескольких химических равновесий:
H2O + SO2 ↔ H2SO3 ↔H+ + HSO3— ↔ 2H+ + SO32-
Образующаяся в результате сернистая кислота (H2SO3) является двухосновной, поэтому способна к образованию двух типов солей – средних — сульфитов (кислотный остаток SO32) и кислых — гидросульфитов (кислотный остаток HSO2—).
Для оксида серы (IV), сернистой кислоты и её солей характерны химические свойства, которые можно разделить на 3 группы: кислотно-основные реакции (1), реакции окисления (2) и реакции восстановления (2):
Ca(OH)2 + SO2 = CaSO3↓ + H2O (1)
Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl (2)
SO2 + C= S↓ + CO2↑ (3)
Качественная реакция на SO2 и сульфиты – обесцвечивание раствора перманганата калия:
5SO2 + 2KMnO4 + 2H2O = 2H2SO4 + K2SO4 + MnSO4
Оксид серы (VI). Серная кислота
Оксид серы (VI) представляет собой бесцветную жидкость, которую получают окислением оксида серы (IV) кислородом в присутствии катализатора (V
2SO2 + O2 ↔ 2SO3
Оксид серы (VI) хорошо растворим в воде (образуется серная кислота) и в 100%-ной серной кислоте (образуется олеум):
SO3 + H2O = H2SO4
Серная кислота представляет собой тяжелую вязкую жидкость, которая хорошо смешивается с водой в любых отношениях. Водный раствор серной кислоты – сильная кислота. Поскольку H2SO4 двухосновная кислота, она способна образовывать два типа солей – средние – сульфаты (кислотный остаток SO42-) и кислые – гидросульфиты (кислотный остаток HSO4—).
При взаимодействии с металлами (как, стоящими в ряду активности до водорода, так и после него) серная кислота восстанавливается до оксида серы (IV):
Zn + H2SO 4 = ZnSO4 + SO2↑ +2H2O
Cu +2H2SO4= CuSO4 + SO2↑ +2H2O
Разбавленная серная кислота окисляет только металлы, стоящими в ряду активности до водорода:
Zn + H2SO4 = ZnSO4 + H2↑
Качественной реакцией на серную кислоту и растворимые сульфаты является образование осадка сульфата бария – осадка белого цвета, нерастворимого в щелочах и кислотах:
Ba2+ + SO42- = BaSO4↓
Примеры решения задач
ru.solverbook.com
Сера, Вступление | |
| Символ | S |
| Латинское название | Sulfur |
| Тип вещества | простой химический элемент |
Основные параметры серы по таблице Менделеева | |
| Атомный номер Z | 16 |
| Атомная масса | 32.065 |
| Группа | 16 |
| Период | 3 |
| Принадлежность к группе | неметаллы |
Термодинамические свойства серы | |
| Агрегатное состояние при нормальных условиях | твердое тело |
| Точка плавления по Кельвину | 388.36 (Кельвин) |
| Точка плавления по Цельсию | 115.21 (°C) |
| Точка кипения по Кельвину | 717.87 (Кельвин) |
| Точка кипения по Цельсию | 444.72 (°C) |
Электрические свойства серы | |
| Тип электрической проводимости | диэлектрик |
Магнитные свойства серы | |
| Тип магнитной проницаемости | диамагнетик |
Свойства атома серы | |
| Конфигурация электронного облака | 1s2 | 2s22p63s23p4 |
| Радиус атома | 88 · 10 − 12 (Метр) |
| Число протонов p | 16 |
| Число нейтронов n | 16 |
| Число электронов e | 16 |
| Массовое число A | 32 |
| Атомная структура серы | 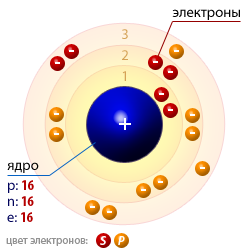 |
Химические свойства серы | |
| Валентность | 6 |
Распространенность серы | |
| Вселенная состоит из серы на | 0.05% |
| Солнце состоит из серы на | 0.04% |
| Мировой океан состоит из серы на | 0.093% |
| Человеческое тело состоит из серы на | 0.2% |
Вселенная | |
| Вселенная состоит из серы на | 0.05% |
www.fxyz.ru
Физические свойства серы. Описание серы
Сера — вещество, в настоящий момент изученное человечеством практически полностью. В древности оно считалось мистическим, было окружено тайнами, легендами и мифами, которые возникали из-за суеверного страха людей перед всем неизведанным. Впрочем, многие физические свойства серы были известны людям еще до того, как Менделеев поместил элемент в периодическую таблицу и присвоил ему номер 16. Это вещество достаточно широко применялось еще в эпоху Гомера, кроме того, некоторую информацию (условно достоверную) о нем можно найти в Новом и Ветхом Заветах.

Химический элемент
В одночасье систематизировать накопленную веками информацию о таком веществе, как сера, было достаточно сложно. Этим занимались многие ученые, но определить ее принадлежность к классу химических элементов удалось Д. И. Менделееву. В периодической системе она обозначена номером 16. Расположена сера в третьем периоде, шестой группе главной подгруппы, атомная масса — 32, плотность (при нормальных условиях) — 2070 кг/м3.
История использования
Древние люди активно применяли физические свойства серы, которые были им известны. Источником ее возникновения считались боги земли, или подземные люди, наделенные особыми качествами. Характерный запах данного вещества и легкость его воспламенения пригодились служителями церкви при проведении различных религиозных обрядов и изгнании «злых духов». В дальнейшем сера стала применяться в военных целях, входила в состав горючих смесей. С большой долей вероятности можно утверждать, что она использовалась при создании «греческого огня», который наводил священный ужас на противника. В быту сера и ее соединения применялись в косметологии, сельском хозяйстве, с ее помощью отбеливали ткани и выводили паразитов. В древнем Китае первые пиротехнические опыты производились при помощи серы. Полученные смеси еще не являлись порохом, но послужили базой для создания его формулы, которая, к слову, в современных условиях была модернизирована. Однако на начальном этапе ее основу составляла именно сера. Химия, точнее, алхимия того времени, называет данный элемент «отцом всех металлов». Подобный вывод основывается на присутствии серы во многих рудах и ее повышенной горючести. Развеять этот миф удается Лавуазье в 1789 году. Ученый отнес элемент к неметаллам и, как показали дальнейшие исследования, был прав. В медицине соединения серы применялись в качестве антисептических и антипаразитарных средств.

В природе
В горных породах земной коры сера встречается достаточно часто. По степени доступности и распространенности она занимает 16 место среди всех химических элементов. Строение атома серы дает возможность данному веществу находиться в чистом виде (в определенных природных условиях). Но в большинстве случаев она входит в состав различных руд, в соединениях образует сульфиды и сульфаты. Наиболее распространены ее связи с металлами: железный колчедан (пирит), киноварь, свинцовый блеск (галенит), цинковая обманка (сфалерит). В Мировом океане присутствуют сульфаты магния, кальция, натрия. На сегодняшний день определено более 200 наименований минералов. Второй — по массовой доле содержания — группой являются гипс, кизерит, глауберова соль. Сера входит в состав белковых молекул, т. е. содержится в организмах животных. Очень широко представлены органические соединения: нефть, газы и природный уголь. Основным источником образования серы и ее производных являются извержения вулканов, но деятельность человека (производственная, хозяйственная) ускорила и обогатила этот процесс. Значительное количество данного вещества накоплено в подземных водах, глинах, гипсе, на дне озер и морей, в нефти, природном газе и угле, в солончаках и в водах океанов. Круговорот серы в биосфере происходит при помощи микроорганизмов, способствует этому и влага, которая испаряется с поверхности огромного водного пространства, выпадает в виде осадков и со сточными потоками рек уходит обратно в моря и океаны.

Название
В период развития алхимии существовало несколько названий, которым обозначали современный химический элемент сера. Какое вещество подразумевалось под ними — не совсем ясно, возможно, речь шла о соединениях, руде или сернистом газе. В периодической системе Менделеева сера обозначена символом S (Sulfur). Данное латинское наименование не имеет ясного происхождения, вероятно, оно было заимствовано из древнегреческого языка, а перевести его можно как «горение». У термина, употребляемого в русском языке, очень древние корни. Словом «сера» обозначались неприятно пахнущие вещества, горючие смеси. Также есть версия о происхождение названия от цвета вещества: «светло-желтый», «серый», т. е. не определенный. Так называли все смолы. Второе название вещества, не применяемое в современности, – «жупел». Также несет в себе определение понятиям горючесть и дурной запах. Филологи пришли к выводу о наличии в этом слове санскритского корня «убивать», что, вероятно, связано со свойствами сернистого газа.
Физические свойства серы

В зависимости от аллотропной модификации, варьируются связи внутри элемента. Принято выделять три образуемых вида решетки (устойчивой цепочки атомов): ромбическая, пластическая, моноклинная. Цвет, физические свойства вещества сера зависят от модификации. Самыми стабильными и распространенными являются циклические соединения S8. Именно такой вид цепочки характерен для кристаллической серы — хрупкого вещества, имеющего желтоватый оттенок. Пластическая и моноклинная модификации являются нестабильными и переходят в циклическую структуру самопроизвольно через некоторое время после получения. Формула серы в данном случае содержит символ S4 или S6. При нормальных условиях (комнатная температура) устойчивым соединением является ромбическая цепочка: в процессе нагревания вещество переходит в жидкое агрегатное состояние, затем густеет. Постепенное охлаждение образует игольчатые кристаллы моноклинной серы, которые имеют темно-желтый цвет. При взаимодействии расплавленного вещества с холодной водой образуется пластическая аллотропная модификация, которая имеет структуру, подобную резине, и состоит из нескольких полимерных цепочек, имеет грязно-желтый (темный) цвет. Наиболее часто встречается описание серы как твердого желтого вещества, которое не взаимодействует с водой, оставаясь на ее поверхности. В качестве растворителя могут применяться органические соединения: скипидар, сероуглерод и т. д. Сера в качестве простого вещества в нормальных условиях имеет следующие термодинамические свойства:
- Относительная плотность – 2,070 г/см3.
- Теплопроводность — 300 К.
- Температура плавления — 112 оС.
- Молярная теплоемкость — 22,6 Дж.
- Температура кипения — 444 оС.
- Молярный объем — 15,5 см3/моль.
В процессе нагревания число атомов серы в молекуле уменьшается. При 300 оС она является достаточно активно двигающейся жидкостью, для получения паров температуру увеличивают до 450 оС. Одноатомную серу можно получить в процессе нагревания вещества до 1760 оС (S8 – S6 – S4 – S2 — S). Данное вещество является плохим проводником электрического тока и тепла, что широко используется при его применении.
Химические свойства
Сера вступает в реакцию со всеми металлами, в результате чего образуются сульфиды. В большинстве случаев для химической реакции необходим катализатор, в качестве которого выступает нагрев. При нормальных условиях (комнатная температура) соединение происходит только со ртутью. Данное свойство используется для обезвреживания ее паров, которые образуются в результате взаимодействия капель металла с кислородом. Не взаимодействует элемент с платиной, иридием, золотом. Полученные сульфиды являются пожароопасными соединениями, которые при поджигании достаточно интенсивно горят. Сера, очищенная на открытом воздухе, реагирует с кислородом. Данное соединение характеризуется процессом образования бесцветного газа (сернистого ангидрида) и горением. Обратимая реакция взаимодействия с водородом происходит при нагреве (по аналогии с углеродом и кремнием), образующиеся газы называют сероводородом, сероуглеродом. Как и все остальные элементы VI группы таблицы Менделеева, сера взаимодействует в запаянной трубке с галогенами (фтор, бром, хлор, фосфор). При комнатной температуре реакция возможна только со фтором. Хлорид серы является веществом, наиболее широко применяемым в химической промышленности. С водой и растворами кислот не взаимодействует, соединения со щелочью обратимы — они образуются при воздействии катализатора. Многие существующие кислоты и соли образованы в результате соединения (обязательным условием является температура) серы с кислородом и водородом.

Электронная структура
Строение атома серы дает возможность элементу проявлять себя в качестве окислителя и восстановителя, а при химической реакции иметь различную валентность. Это обусловлено распределением электронов по уровням. Ядро атома имеет заряд +16 при атомной массе 32 (16 протонов и нейтронов), радиус — 127 пм. Схема серы (электронная) выглядит следующим образом: S+16)2)8)6; в спокойном состоянии — 1S22S22P63S23P4. На третьем уровне атом серы имеет пять незанятых орбиталей, поэтому валентность в его соединениях варьируется в следующих пределах: -2, +2,+4,+6, которые зависят от степени его возбуждения.
Месторождения
Количество добываемой серы увеличивается ежегодно. Это связано с достаточно широким кругом ее применения, который постоянно растет за счет технологических прорывов и более тщательного исследования уже известных химических элементов. В природе сера содержится в самородном виде и входит в состав большого количества руд. В зависимости от этого применяются различные способы ее добычи. Стратиформные месторождения распространены в США, Ираке, среднем Поволжье и Прикарпатье. Они являются наиболее рентабельными в процентном отношении, там добывают от 50 до 60 % серы. Карбонатные и сульфатные породы пролегают огромными пластами, достигающими десятков метров в глубину и нескольких сотен — в длину. Солянокупольные месторождения характерны для регионов интенсивной добычи нефтепродуктов. К самым крупным залежам относят зону Мексиканского залива, которую параллельно разрабатывают США, Чили и Мексика. Наиболее современными, недавно сформировавшимися месторождениями являются вулканогенные залежи. Их происхождение связано с тектоническими разломами земной коры и действием вулканов. Соответственно, данные месторождения располагаются в Тихом океане. Активно осваивают данные зоны Япония и Россия. На территории Евразии более распространены залежи самородной серы, которая имеет достаточно древнее происхождение и преимущественно располагается в поверхностных слоях. Уральские горы, остров Сицилия, Поволжье, Львовская область являются освоенными месторождениями, которые разрабатываются до сегодняшнего дня. Мировая добыча серы составляет более 50 млн тонн в год, при этом 30 % — самородки, 33 % — газ и нефтепродукты, 14 % — переработка производственных выбросов, 16 % — из сульфидов, 6 % — из сульфатов.

Способы добычи
В зависимости от глубины залегания серосодержащей руды используют различные методы ее извлечения и дальнейшей переработки. Физические свойства серы на первый план, независимо от способа добычи, выводят безопасность процесса. Как правило, залежи данного вещества сопровождаются большим скоплением ядовитых газов, также не исключаются случаи самовозгорания. Поверхностные рудные слои снимаются пластами при помощи экскаваторов — этот способ наименее опасен (при соблюдении всех технологических требований). Сера очищенная получается в результате ее дальнейшей переработки на соответствующих предприятиях, куда она доставляется из карьеров. Способы очистки и обогащения разнообразны: термические, центрифугальные, фильтрационные, пароводяные, экстракционные.
Гораздо сложнее производить добычу серы, которая содержится в подземных слоях. Шахтный метод — за счет выделения сопутствующего газа — практически недоступен, поэтому достаточно успешно с 1895 года применяется метод Германа Фраша. Он наиболее продуктивен при разработке богатых месторождений и дает существенную экономию транспортных расходов и затрат на дальнейшую переработку руды, так как предполагает выход чистого вещества. Принцип установки прост: рудные слои, содержащие серу, подвергаются обработке горячей водой, которая подается по трубе. Внутри нее располагаются еще два цилиндрических обособленных сосуда, которые предназначены для подачи газа и выхода готового продукта. За счет низкой температуры плавления на поверхность под давлением выходит сера с небольшим количеством примесей.
Применение
Основным потребителем серы является химическая промышленность, которая не может существовать без кислот на основе данного элемента. Текстильные, нефтеперерабатывающие, пищевые, целлюлозные, горнодобывающие сегменты производства не могут обойтись без этого вещества. Формула серы дает возможность применять ее соединения для изготовления взрывчатки, спичек, резины, косметических средств, лекарств и т. д. В сельском хозяйстве рассматриваемое нами вещество входит в состав удобрений для почвы (повышает процент усвоенного фосфора) и ядов, которыми обрабатывают семена от различных вредителей.
 Для производства красителей и светящихся составов используется очищенная сера. По степени добычи, переработки и использования этого элемента можно судить о промышленном потенциале всего государства. Большинство новейших разработок во многих наукоемких секторах экономики основано на использовании серы и ее соединений. Сложно оценить весь потенциал применения данного химического элемента, который используется человечеством с древних времен и продолжает активно участвовать в технологическом эволюционном процессе.
Для производства красителей и светящихся составов используется очищенная сера. По степени добычи, переработки и использования этого элемента можно судить о промышленном потенциале всего государства. Большинство новейших разработок во многих наукоемких секторах экономики основано на использовании серы и ее соединений. Сложно оценить весь потенциал применения данного химического элемента, который используется человечеством с древних времен и продолжает активно участвовать в технологическом эволюционном процессе.fb.ru