Неорганические вещества — это… Что такое Неорганические вещества?
- Неорганические вещества
Неорганические вещества — это химические вещества, которые не являются органическими, то есть они не содержат углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к неорганическим).
Классификация
Все вещества делятся на простые (элементарные) и сложные. Простые вещества состоят из одного элемента, а в составе сложных входит не менее двух элементов.
- Простые вещества(элементарные)
- Сложные вещества
- Оксиды (, , , и другие)
- Основания (, , , и другие)
- Кислоты (, , , и другие)
- Соли (, , , и другие)
Неорганические вещества разделяют на классы также по составу (двухэлементные, или бинарные, соединения или многокомпонентые соединения), по химическим свойствам (кислотно-основные, окислительно-восстановительные).

См. также
Wikimedia Foundation. 2010.
- Прибытие поезда (фильм)
- Простые вещества
Полезное
Смотреть что такое «Неорганические вещества» в других словарях:
НЕОРГАНИЧЕСКИЕ МАТЕРИАЛЫ — неорганические вещества с функциональными свойствами. Различают металлические, неметаллические и композиционные материалы. Примеры сплавы, неорганические стекла, полупроводники, керамика, керметы, диэлектрики … Большой Энциклопедический словарь
Неорганические соединения — Неорганические вещества – это химические вещества, которые не являются органическими, то есть они не содержат углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к… … Википедия
Неорганические кислоты — Основная статья: Кислота Неорганические (минеральные) кислоты неорганические вещества, обладающие комплексом физико химических свойств, которые присущи кислотам.
 Вещества кислотной природы известны для большинства химических элементов за… … Википедия
Вещества кислотной природы известны для большинства химических элементов за… … Википедиянеорганические материалы — неорганические вещества с функциональными свойствами. Различают металлические, неметаллические и композиционные материалы. Примеры сплавы, неорганические стёкла, полупроводники, керамика, керметы, диэлектрики. * * * НЕОРГАНИЧЕСКИЕ МАТЕРИАЛЫ… … Энциклопедический словарь
Неорганические полимеры — Полимеры с неорганической (не содержащей атомов углерода) главной цепью макромолекулы (См. Макромолекула). Боковые (обрамляющие) группы обычно тоже неорганические; однако полимеры с органическими боковыми группами часто также относят к Н … Большая советская энциклопедия
Вещества красящие — Вещества красящие – вводят в композицию для придания изделию необходимого колера. В производстве пластмасс используют неорганические пигменты – охру, мумию, сурик, умбру, ультрамарин, оксид хрома и др.
 и органические – нигразин, хризоидин.… … Энциклопедия терминов, определений и пояснений строительных материалов
и органические – нигразин, хризоидин.… … Энциклопедия терминов, определений и пояснений строительных материаловВЕЩЕСТВА ВЗВЕШЕННЫЕ — органические и неорганические частицы, содержащиеся в воде во взвешенном состоянии. Наиболее характерное взвешенное вещество естественных водоемов детрит. Экологический энциклопедический словарь. Кишинев: Главная редакция Молдавской советской… … Экологический словарь
Неорганические азиды — Азиды химические соединения, производные азотистоводородной кислоты HN3. Содержат одну или несколько групп N3. Содержание 1 Азиды металлов 2 Азиды неметаллов … Википедия
Неорганические тела — см. Органические вещества … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — К неорганическим относятся соединения всех химических элементов, за исключением большинства соединений углерода. Кислоты, основания и соли.
 Кислотами называются соединения, которые в воде диссоциируют с высвобождением ионов водорода (Н+). Эти… … Энциклопедия Кольера
Кислотами называются соединения, которые в воде диссоциируют с высвобождением ионов водорода (Н+). Эти… … Энциклопедия Кольера
«Общие и отличительные признаки органических и неорганических веществ.» ( 10 класс )
Урок №1
Тема: Общие и отличительные признаки органических и неорганических веществ.
Цель:
Учебная:познакомиться с предметом изучения органической химии, разнообразием органических веществ; рассмотреть подобные и различные признаки органических и неорганических веществ; раскрыть особенности органических веществ; ознакомить учеников с историей органической химии
Развивающая: развивать умение анализировать,сопоставлять сравнивать, делать выводы
Воспитательная: воспитывать чувства гуманизма, коллективизма, уважения к старшим, взаимопомощи, отзывчивости.
Оборудование: мультимедийная презентация, образцы органических веществ (сахар, крахмал, вата, уксус, пластмасса, синтетические волокна, растительное масло, маргарин, мыло, бумага, аспирин, мёд ти т. д.
д.
Тип урока: изучение нового матерала
Ход урока
І. Организационный момент
ІІ. Мотивация учебной деятельности обучающихся, формулировка целей урока.
Нас окружает множество раздичных веществ. Свойства, строение, происхождение этих веществ различно. Сначала все известные вещества химики поделили на 3 группы: Минеральные, растительные и животные. Изучая эти вещества, шведский химик Берцеллиус пришёл к выводу, что между веществами растительного и животного происхожения нет существенных отличий. Он предложил называть их » органическими», т.к. они содержатся в живых организмах. Так возникла » Органическая химия».
Что такое органическая химия и что она изучает? Какие вещества относятся к органическим? Какое строение они имеют, каковы их свойства и применение?
Проблемный вопрос: Каких веществ больльше органических или неорганических? Почему?
Цель урока:
рассмотреть историю развития органической химии;
выяснить, что изучает органическая химия;
сравнить органические и неорганические вещества;
выяснить причины многообразия органических веществ.

ІІІ. Изучение нового материала
История развития органической химии
Способы получения различных органических веществ были известны еще с древности. Египтяне и римляне использовали красители индиго и ализарин, содержащиеся в растительных веществах. Многие народы знали секреты производства спиртных напитков и уксуса из сахар- и крахмалсодержащего сырья.
Во времена средневековья к этим знаниям ничего не прибавилось, некоторый прогресс начался только в 16-17 в: были получены некоторые продукты, в основном путем перегонки некоторых растительных продуктов. В 1769—1785 г. Шееле выделил несколько органических кислот, таких как яблочная, винная, лимонная, галловая, молочная и щавелевая. В 1773 г. Руэль выделил из человеческой мочи мочевину.
Выделенные из животного или растительного сырья продукты имели между собой много общего, но отличались от неорганических соединений.
Как принято считать, органическая химия как наука появилась в 1828 году когда Фридрих Вёлер впервые получил органическое вещество — мочевину — в результате упаривания водного раствора цианата аммония (NH4OCN).
Важным этапом стала разработка теории валентности Купером и Кекуле в 1857 г., а также теории химического строения Бутлеровым в 1861 г. В основу этих теорий были положены четырёхвалентность углерода и его способность к образованию цепей. В 1865 году Кекуле предложил структурную формулу бензола, что стало одним из важнейших открытий в органической химии. В 1875 г. Вант-Гофф и Ле Бель предложили тетраэдрическую модель атома углерода, по которой валентности углерода направлены к вершинам тетраэдра, если атом углерода поместить в центр этого тетраэдра.
В 1931 г. Хюккель применил квантовую теорию для объяснения свойств ароматических углеродов, чем основал новое направление в органической химии — квантовую химию. В 1933 г. Ингольд провел изучение кинетики реакции замещения у насыщенного атома углерода, что привело к масштабному изучению кинетики большинства органических реакций.
На заре органической химии предметом изучения были преимущественно субстанции биологического происхождения. Именно этому факту органическая химия обязана своим названием. Научно-технический прогресс не стоял на месте, и со временем основной материальной базой органической химии стала каменноугольная смола, выделяемая при получении кокса прокаливанием каменного угля. Именно на основе переработки каменноугольной смолы в конце 19 века возник основной органический синтез. В 50-60 годах прошлого века произошел переход основного органического синтеза на новую базу — нефть.
Предмет органической химии.
Кекуле (1851 р) определил органическую химию как химию соединений углерода.
Органическая химия -это химия соединений углерода.
Хотя есть и неорганические соединения углерода: СО, СО2, СаСО3, Н2СО3 и т.д.
Приём «Мозговой штурм»
Среди перечисленных веществ определите органические и неорганические:
Чем отличаются выбранные вещества? ( Природные и синтетические)
Вспомните уроки биологии и составте опорные схемы природных и синтетических органических веществ.
Сравнение органических и неорганических веществ
ІV, НI, ОII, HalIВиды связи
Все типы: ковалентная, ионная
Ковалентная
Строение вещества
Атомная, молекулярная, йонная кристаллические решётки
Молекулярные кристаллические решетки
Термостойкость
Разня: бывают легкоплавкие и тугоплавкие
Легкплавкие, легко разлагаются
скорость реакции
Быстро. Часто реакции протекают мгновенно
Часто реакции протекают мгновенно
Обычно медленно, часто реакции проходят в двух направлениях
Количество
Более 500 тысяч.
Более 20 млн., ежегодно синтезируется 200-300 тыс. новых.
Вопрос: с чем связано многообразие органических веществ ( мнения учеников)
Причины многообразия органических веществ:
Атомы углероды соединяются между собой , образуя цепи, кольца.
| | | | | | | С С
— С-С-С-С – — С-С-С-
| | | | | | |
— С — С С
|
Между атомами углерода образуются разные виды связи:
одинарные С – С;
двойные С =С ;
тройные С ≡ С.
Всостав органических веществ могут входить функциональные группы:
гидроксогруппа — ОН;
альдегидная группа — СНО
карбоксильная группа — СООН
аминогруппа -NH2
нитрогруппа — NО2
Существуют изомеры – вещества, котрые имеют одинаковый качественный и количественный состав, но разное строение и свойства.

СН3 – СН2 – СН2 – СН3 СН3 – СН – СН3
|
СН3
Существуют гомологи – вещества, имеющие сходное строение и свойства,но отличаютсяпо составу на одну или несколько групп –СН2.
СН3 – СН2 – СН3 СН3 – СН2 – СН2 – СН3
Углерод может образовывать прочные химические связи почти со всеми химическими элементами.
IV. Обобщение и систематизация знаний.
Обуждение результатов урока — дебаты.
1) В чем заключается условность термина « органическая химия» ?
2) Подумайте, в некоторых учебниках по химии сведения о органические вещества входят в раздел » элементы IV группы ПС. Насколько правомерно это расположение материала? Обоснуйте «за» и «против».
3) Как определить принадлежность вещества к органическим соединениям?
4) Сформулируйте тезис, который иллюстрирует данная схема. Приведите факты, доказывающие этот тезис.
Приведите факты, доказывающие этот тезис.
Органические Неорганические Неорганические Органические
вещества вещества вещества вещества
Тезис: четкой границы между органическими и неорганическими веществами не существует.
Аргументы:
1. Из органических веществ образуются неорганические и наоборот.
2. Есть вещества, что при наличии «С» имеют относятся к органическим,а по свойствам – к неорганическим.
V. Домашнее задание
2017 год объявлен годом экологии в нашей стране. Напишите сочинение -размышление на тему: » «За» и «против» развития современного органического синтеза с точки зрения роста потребностей человечества и законов экологии.»
неорганических веществ — Справочник химика 21
Твердые п жидкие отходы химических, нефтехимических и нефтеперерабатывающих производств состоят из разнообразных органических и неорганических веществ. Для выбора наиболее оптимального метода обезвреживания и утилизации этих отходов надо знать их состав, количество, свойства и факторы, влияющие на их изменения. Кроме того, необходимо знать степень токсичности этих отходов, чтобы правильно нормировать их содержание в почве и осуществлять санитарный контроль. [c.112]
Для выбора наиболее оптимального метода обезвреживания и утилизации этих отходов надо знать их состав, количество, свойства и факторы, влияющие на их изменения. Кроме того, необходимо знать степень токсичности этих отходов, чтобы правильно нормировать их содержание в почве и осуществлять санитарный контроль. [c.112]
Почему это так Дело в том, что молекулы неорганических веществ оказываются более прочными в том случае, если они состоят из двух или трех атомов. Но по мере присоединения новых и новых атомов молекула становится все более непрочной и склонна разрушиться. Поэтому неорганическая молекула, содержащая больше дюжины атомов,— большая редкость. [c.13]
Химики делят все вещества на два класса. К одному относятся, например, масло, сахар, крахмал, клей, желатин, шелк, каучук, бумага и пенициллин. Все это органические вещества. К, другому относятся воздух, вода, песок, глина, соль, золото, серебро, железо, латунь, стекло и цемент. Это неорганические вещества. [c.9]
Это неорганические вещества. [c.9]
Основные структурные типы неорганических веществ [c.103]
Становилось все более очевидным, что различие между органическими и неорганическими соединениями обусловлено особенностями химического строения молекул этих соединений. Многие химики начали говорить о разных типах строения молекул органических я неорганических соединений. Молекулы большинства неорганических веществ, с которыми имели дело химики XIX в., содержат всего от двух до восьми атомов. Да и вообще в молекулах очень немногих неорганических соединений число атомов достигает десятка. [c.73]
Органические вещества во многом отличаются от неорганических. Например, они гораздо менее прочны и менее долговечны, чем неорганические. Воду (а это неорганическое вещество) можно вскипятить, а получившийся пар нагреть до тысячи градусов без всякого для него вреда. Если вы охладите пар, из него снова получится вода. А если нагревать растительное масло (это — органическое вещество), то оно начнет дымить и гореть и перестанет быть растительным маслом. Соль (неорганическое вещество) вы можете нагревать до тех пор, пока она не расплавится и не раскалится докрасна. Охладите ее — и она останется той же солью. Если же нагревать сахар (органическое вещество), начнут выделяться газы, а потом сахар обуглится и почернеет. После охлаждения уже никогда не удастся снова получить сахар. [c.10]
Соль (неорганическое вещество) вы можете нагревать до тех пор, пока она не расплавится и не раскалится докрасна. Охладите ее — и она останется той же солью. Если же нагревать сахар (органическое вещество), начнут выделяться газы, а потом сахар обуглится и почернеет. После охлаждения уже никогда не удастся снова получить сахар. [c.10]
Еще более заметным для первых химиков было другое различие. Органические вещества можно было обработать теплом или какими-нибудь другими способами и превратить в неорганические. Однако не было известно такого способа, чтобы взять неорганическое вещество и превратить его в органическое. [c.10]
Химиков не переставало удивлять, что органические вещества при нагревании или каком-либо другом жестком воздействии легко превращаются в неорганические вещества. (Возможность обратного превращения, т. е. превращения неорганического вещества в органическое, была установлена несколько позднее.) То время было временем господства витализма — учения, рассматривающего жизнь [c. 69]
69]
Молекулы как органических, так и неорганических веществ состоят из различных атомов. Выяснилось, [c.11]
Комплексные соединения составляют наиболее обширный и разнообразный класс неорганических веществ. К ним принадле- кат также многие металлорганические соединения (стр. 465), связывающие воедино ранее разобщенные неорганическую химию и органическую химию. Многие комплексные соединения — витамин В)2, гемоглобин, хлорофилл и другие — играют большую роль в физиологических и биохимических процессах. Исследование свойств и пространственного строения комплексных соединений оказалось чрезвычайно плодотворным для кристаллохимии, [c.582]
В качестве растворителей применяют различные вещества. Так, вода может служить для извлечения из смеси твердых веществ тех пз них, которые растворимы в ней. Различные органические жидкости, такие, как диэтиловый, или серный, эфир, спирт, бензол, хлорированные углеводороды, бензин и другие погоны нефти, часто используются в лабораториях как растворители преимущественно органических, но часто и неорганических веществ.
 [c.140]
[c.140]До 1827 года химики были убеждены, что только живой организм может вырабатывать мочевину. Однако в 1827 году немецкий химик Фридрих Велер, к своему собственному изумлению, обнаружил, что на самом деле это не так. Он установил, что если кипятить неорганическое вещество цианат аммония, оно превращается в мочевину. Неорганическое вещество в пробирке превращалось в органическое Велер много раз повторил свой эксперимент, прежде чем решился опубликовать результаты. А когда в 1828 году он все же сделал это сообщение, оно ошеломило научный мир. [c.11]
Нефтеперерабатывающая и нефтехимическая промышленность относится к водоемким отраслям народного хозяйства и уступает по водопотреблению лишь энергетике, металлургии, химической нромышлеиности и коммунальному хозяйству. Большую часть воды используют для охлаждения н конденсации продуктовых потоков. В значительной части технологических процессов воду потребляют как растворитель или реагент, вводят в виде пара. Вода, пройдя тот или иной производственный цикл, претерпевает различные изменения либо безвозвратно теряется. Образующиеся сточные воды содержат растворимые и нерастворимые органические и неорганические вещества, включая токсичные. [c.73]
Вода, пройдя тот или иной производственный цикл, претерпевает различные изменения либо безвозвратно теряется. Образующиеся сточные воды содержат растворимые и нерастворимые органические и неорганические вещества, включая токсичные. [c.73]
Важнейшие классы неорганических веществ 41 [c.41]
Институтом катализа СО АН СССР разработана классификация промышлен-ых катализаторов по их назначению (по виду процесса, для которого предназначен анный катализатор). Согласно этой классификации катализаторы подразделяют на руппы 1) катализаторы синтеза на основе неорганических веществ 2) катализато-ы синтеза (превращений) органических соединений 3) катализаторы гидрирования, дегидрирования 4) катализаторы производства мономеров синтетического каучу-а 5) катализаторы полимеризации и конденсации 6) катализаторы окисления [c.3]
Сорбционную очистку сточных вод от ПАВ с помощью ионообменных смол широко применяют для очистки промышленных сточных вод. Р1онообменные материалы — твердые, не растворимые в воде вещества, в структуру которых входят группы атомов, песуииш электрический заряд, скомпенсированный подвижными ионами иротивополож1юго знака. Эти противоионы способны замещаться поиамп того же знака, находящимися в растворе. Ионообменные процессы с участием ПАВ отличаются рядом специфических свойств, не характерных для ионного обмена неорганических веществ [c.219]
Р1онообменные материалы — твердые, не растворимые в воде вещества, в структуру которых входят группы атомов, песуииш электрический заряд, скомпенсированный подвижными ионами иротивополож1юго знака. Эти противоионы способны замещаться поиамп того же знака, находящимися в растворе. Ионообменные процессы с участием ПАВ отличаются рядом специфических свойств, не характерных для ионного обмена неорганических веществ [c.219]
Свободный фтор при нормальных условиях — газ зеленовато-желтого цвета с неприятным запахом. Жидкий фтор желтого цвета. Уже при обычных температурах фтор энергично реагирует почти со всеми органическими и неорганическими веществами, причем реакция протекает с выделением большого количества тепла и часто сопровождается воспламенением. [c.128]
Свойство дифенилолпропана образовывать аддукты с различными органическими и неорганическими веществами (( нол, изопропиловый спирт, аммиак) может быть использовано для очистки дифенилолпропана-сырца, выделенного из реакционной массы любым ме- [c. 161]
161]
Фосген — важный промышленный продукт. Он применяется пр производстве ряда органических и неорганических веществ, на пример красителей. [c.444]
Э. В. В р и ц к е, А. 1). К а и у с т и н с к и й, 1 >. 1. В е с е л о в с к и й. Термодинамические константы неорганических веществ. Изд. АН СССР (1949). [c.202]
Молекула угольной кислоты может лишиться как одного, так и обоих атомов водорода. Если отделить от нее один из них, останется ион бикарбоната. А второй атом водорода отделяется от молекулы в тысячу раз труднее, чё и первый. Если все-таки отде.шть и его, то останется ион карбоната. У человека в крови и тканях всегда ес ь сама угольная кислота, ион бикарбоната и растворенная двуокись углерода, а карбонатного иона в них нет. Оба этих иона легко соединяются с ионами различных металлов. Получающиеся соединения, хотя и содержат углерод, во многом подобны неорганическим веществам. Например, карбонат кальция, или углекислый кальций, есть не что иное, как минерал известняк. Иногда он встречается в природе и в виде другого минерала, покраси- [c.162]
Иногда он встречается в природе и в виде другого минерала, покраси- [c.162]
Водные растворы многих органических веществ можно выпаривать или упаривать только на водяной бане, так как при нагревании чашки с раствором на пламени газовой горелки может произойти пригорание осадка. Хотя большинство неорганических веществ не изменяется под действием относительно высокой температуры, все же и их предпочитают выпаривать или упаривать на водяной бане. Применение бани позволяет более осторожно провести операцию, а также дает возможность лучше следить за ходом процесса. [c.147]
В то время как в. лабораториях ставились опыты по получению нефтеподобных продуктов из неорганических веществ, научная мысль под влиянием фактов геологического порядка стремилась разрешить проблему происхождения нефти другим путем — по ли- [c.310]
Важнейшие классы неорганических веществ 43 [c.43]
Всего неорганических веществ 331 [c.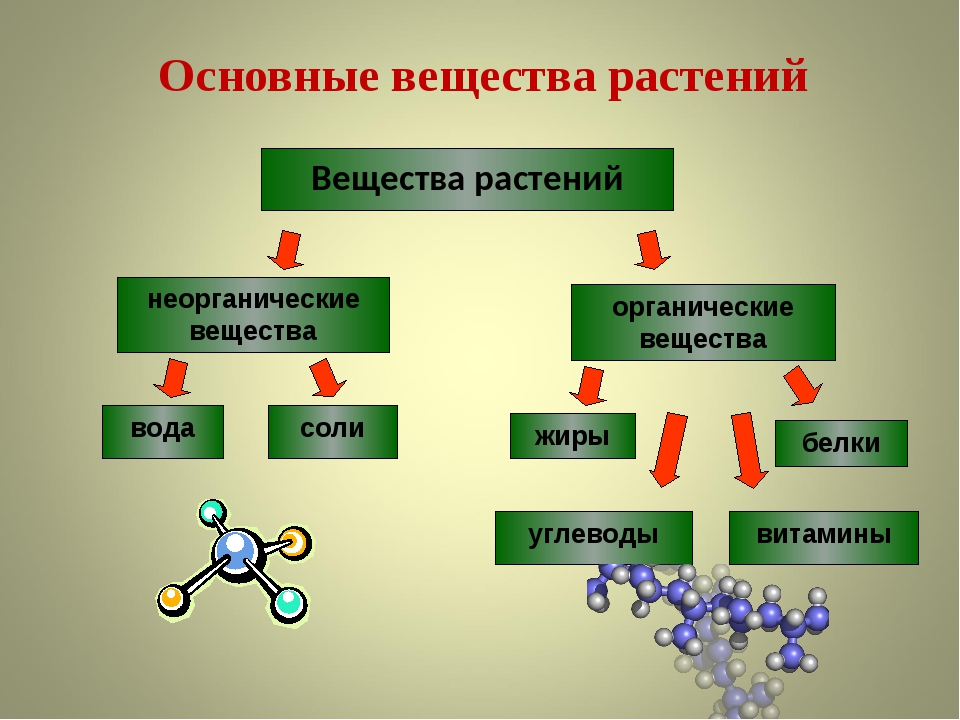 503]
503]
Термодинамические константы неорганических веществ. Изд-во ЛН СССР, М., 1949. [c.464]
Важнейшие классы неорганических веществ. Все вещества делятся на простые и сложные. Простые вещсства состоят из одного элемента, в состав сложных в.ходит два пли более элементов. Простые вещества, в свою очередь, разделяются па металлы и неметаллы или металлоиды . Последнее деление основано на различии в физЕгческнх свойствах простых веществ. [c.39]
Книга является учебником по количественному анализу неорганических веществ, рассчитанным на студентов нехпми-ческих вузов и факультетов. [c.2]
Гранулированный носитель катализатора получают смешением тонко-измельченного порошка плавленного неорганического вещества (А12О3, 2гОг, 51С) или их смеси, со связующим или агломерирующим соединением (глина) и с органическими веществами, образующими газы при повышенной температуре (древесные опилки с размером частиц 0,04— 0,15 1им). Носитель обжигают при температуре 1000—1400° С [c.90]
Носитель обжигают при температуре 1000—1400° С [c.90]
Образующиеся в промышленном производстве отходы представляют собой гетерогенные и гомогенные системы, содержащие газообразные, жидкие или твердые органические и неорганические вещества. К гетерогенным относятся системы газ (Г) — твердое (Т), газ (Г) жидкость (Ж), жидкость (Ж) —твердое (Т), жидкость (ЖО — жидкость, малораст оримая в Ж] (Ж2). К гомогенным относятся системы газ (Г) — газ (Г), жидкость (ЖрО — растворимая в ней жидкость (Жог)- [c.470]
Явление изомерии будет подробно рассмотрено прн изучении органических соединеиг1Й (см. 162), среди которых оно очень распространено. Следует, одсако, иметь в пиду, что изомерия присуща и неорганическим веществам. Так, еще в 1O24 г. Либих [c.118]
В свою очередь, каждая из этих групп разделяется на подгруппы. Так, груп-а катализаторов синтеза неорганических веществ включает в себя следующие одгруппы 1.1) катализаторы синтеза аммиака среднетемпературные 1. 2) катали— [c.3]
2) катали— [c.3]
Из неорганических веществ в химической практике чаще всего ири.ходнтся и reть дело с оксидами, основаниями, кислотами и солями. Эти основные классы неорганических веществ подробно изучаются в средней Н1коле. Поэтому здесь приведем лишь важ-нейрпие сведения о них. [c.39]
Неорганическое соединение — определение и примеры
Определение
существительное
множественное число: неорганические соединения
Химическое соединение, не содержащее ковалентных связей углерод-углерод (CC) и углерод-водород (CH)
Подробности
Обзор
Химическое соединение относится к любому веществу, состоящему из двух или более элементов, которые химически связаны друг с другом. Элемент , в свою очередь, относится к элементу, состоящему только из одного типа атомов.Элементы, которые удерживаются вместе химической связью, образуют соединение. Один из способов классификации соединений — определить их как органических или неорганических . Как правило, органическое соединение представляет собой тип соединения, содержащего атом углерода. И наоборот, неорганическое соединение будет тем, которое не содержит углерода.
Один из способов классификации соединений — определить их как органических или неорганических . Как правило, органическое соединение представляет собой тип соединения, содержащего атом углерода. И наоборот, неорганическое соединение будет тем, которое не содержит углерода.
Витализм против выводов Велера
Одна из преобладающих теорий первых веков — витализм .Согласно этой теории, живые существа обладали некой жизненной силой — vis-vitalis , которая отделяла их от неживых существ. Эта жизненная сила позволяла им производить определенные химические вещества, которые неживые существа не могли производить. Химические вещества, которые производят живые существа, получили название органических , поскольку они произошли от организмов. Те, которые можно было получить из неживых существ, были названы неорганическими , что означает «неорганические». Это была фундаментальная граница, которая отделяла органические от неорганических соединений. Под неорганическими соединениями понимались соединения, не полученные от организмов. Они могут быть получены, например, из геологических систем, например отложения и руды.
Под неорганическими соединениями понимались соединения, не полученные от организмов. Они могут быть получены, например, из геологических систем, например отложения и руды.
Это убеждение существовало на протяжении многих веков, пока Фридрих Вёлер (1800–1882) не оспорил его с эмпирическими данными своих экспериментов. В одном из своих экспериментов он обнаружил, что мочевину, которую когда-то считали производимой только живыми существами, можно производить из неорганических предшественников. В 1828 году он обнаружил, что мочевину можно химически производить из солей цианата калия и сульфата аммония.Это считается решающим поворотным моментом, который позже привел к развитию современной органической химии.
Путаница
На пике витализма существовала четкая граница между органическими и неорганическими соединениями. После дискредитации витализма химики так и не пришли к консенсусу по поводу современного определения органических и неорганических соединений. Простое утверждение, что органическое соединение — это любое соединение, содержащее атом углерода, не будет абсолютно правильным, поскольку это будет намека на включение некоторых углеродсодержащих неорганических соединений. База данных неорганических кристаллических структур, база данных данных о неорганических кристаллических структурах, основанная Гюнтером Бергерхоффом и И.Д. Брауном в 1978 году, определила неорганических углеродных соединений как соединения, содержащие либо C-H, либо C-C связи, но не то и другое вместе. 1 К неорганическим углеродсодержащим соединениям относятся: карбонаты, цианиды, цианаты, карбиды, тиоцианаты, монооксид углерода и диоксид углерода. Аллотропы углерода , как и алмаз, не соединения, а чистый элемент углерода.Таким образом, это не неорганические соединения, а неорганические вещества.
База данных неорганических кристаллических структур, база данных данных о неорганических кристаллических структурах, основанная Гюнтером Бергерхоффом и И.Д. Брауном в 1978 году, определила неорганических углеродных соединений как соединения, содержащие либо C-H, либо C-C связи, но не то и другое вместе. 1 К неорганическим углеродсодержащим соединениям относятся: карбонаты, цианиды, цианаты, карбиды, тиоцианаты, монооксид углерода и диоксид углерода. Аллотропы углерода , как и алмаз, не соединения, а чистый элемент углерода.Таким образом, это не неорганические соединения, а неорганические вещества.
Органические и неорганические соединения
Обобщенные различия между органическими и неорганическими соединениями показаны ниже:
| Органические соединения | Неорганические соединения | |
| Наличие атомов углерода | В основном содержащие углерод атомы | В основном отсутствуют атомы углерода |
| Химическая связь | Ковалентная связь; в основном со связями углерод-водород (C-H) | В основном с ионными связями; в основном отсутствуют связи CH |
| Происхождение | По сути, биологическое (в результате биологической активности) | Химическое (в результате лабораторных работ или экспериментов) или геологическое (в результате естественного процесса, не связанного с жизнью) |
| Соль образование | Не может образовывать соль | Может образовывать соль |
| Атомы металлов | Не содержат атомов металлов | Может содержать атомы металлов |
| Другие особенности | В большинстве водных растворов плохие проводники тепла и электричество | В основном, хорошие проводники тепла и электричества |
| Примеры | углеводы, жиры, белки, нуклеиновые кислоты, мочевина, четыреххлористый углерод | хлорид натрия, латунь, стекло, карбонаты, цианиды, цианаты, карбиды , тиоцианаты, окись углерода, двуокись углерода, вода |
 Исключения существуют в каждой функции. Таким образом, приведенные в таблице различия между ними следует считать верными для большинства случаев, но не для всех.
Исключения существуют в каждой функции. Таким образом, приведенные в таблице различия между ними следует считать верными для большинства случаев, но не для всех.Типы неорганических соединений
Химическое соединение — это вещество, состоящее из атомов или ионов двух или более элементов, которые химически связаны вместе, тогда как химический элемент — это вещество только одного типа атомов. Большинство элементов являются неорганическими, но технически не являются неорганическими соединениями, поскольку они состоят только из одного типа атомов.Таким образом, классификация неорганических соединений влечет за собой группировку веществ, состоящих из более чем одного типа атомов. И наоборот, простые неорганические вещества (не обязательно соединения) типичны как металл или неметалл . Однако нет четкого различия между металлами и неметаллами.
Большинство неорганических соединений являются ионными соединениями. Это означает, что химическая связь, удерживающая атомы вместе, является ионной связью. На основе составляющих неорганических соединений ионные соединения можно разделить на основания, кислоты и соли.Ионная связь — это связь, при которой происходит полный перенос электрона от одного атома к другому. Это электростатическое притяжение между противоположно заряженными ионами, то есть катионом и анионом. Катион — это положительно заряженный ион, а анион — отрицательно заряженный ион. Например, хлорид натрия представляет собой ионное соединение, в котором катион Na + и анион Cl — удерживаются вместе ионной связью . Ионное соединение, содержащее ионы водорода (H + ), классифицируется как кислота.И наоборот, ионное соединение, содержащее гидроксид (OH — ) или оксид (O 2 — ), классифицируется как основание. Ионное соединение, образованное кислотно-основными реакциями без этих ионов, называется солью .
На основе составляющих неорганических соединений ионные соединения можно разделить на основания, кислоты и соли.Ионная связь — это связь, при которой происходит полный перенос электрона от одного атома к другому. Это электростатическое притяжение между противоположно заряженными ионами, то есть катионом и анионом. Катион — это положительно заряженный ион, а анион — отрицательно заряженный ион. Например, хлорид натрия представляет собой ионное соединение, в котором катион Na + и анион Cl — удерживаются вместе ионной связью . Ионное соединение, содержащее ионы водорода (H + ), классифицируется как кислота.И наоборот, ионное соединение, содержащее гидроксид (OH — ) или оксид (O 2 — ), классифицируется как основание. Ионное соединение, образованное кислотно-основными реакциями без этих ионов, называется солью .
Вода, безусловно, является одним из важнейших неорганических соединений для всего живого. Это соединение, состоящее из двух атомов водорода и одного атома кислорода. Однако это не ионное соединение, а молекула, удерживаемая ковалентной связью между водорода и кислородом .
Однако это не ионное соединение, а молекула, удерживаемая ковалентной связью между водорода и кислородом .
Исследования
Изучение свойств и синтеза органических соединений известно как органическая химия , тогда как изучение свойств и синтеза в неорганической химии называется неорганической химией .
Дополнительный
Этимология
- назван в честь раннего представления о том, что неорганические соединения не имеют биологического происхождения
Дополнительная литература
Сравнить
См. Также
Ссылка
- Wayback Machine.(2017, 1 января). База данных неорганических кристаллов: научное руководство. Получено из PDF
© Biology Online. Контент предоставляется и модерируется Biology Online Editors
Organic and Inorganic Substances — Scientific American
Было время, когда определенные приблизительные принципы, как химики называли эти вещества, обнаруживались в организованных телах и входили в состав растительные и животные ткани и занимают промежуточное положение между телами, признанными элементами, и полностью организованными живыми тканями; Повторяем, было время, когда предполагалось, что эти сложные вещества обязаны своим происхождением чему-то большему, чем обычное химическое сродство. Как обычно в истории науки, когда что-то было неясным, предполагалось, что таинственная сила, связанная с составом этих субстанций, объясняется некой оккультной силой. Вызванная таким образом сила была названа «Жизненная сила» — просто название неизвестной причины или причин.
Химия также была разделена на два отдельных отдела просто из-за предполагаемых различий между поведением и составом организованных и неорганических тел. Мы говорим о предполагаемых различиях. Между живым организмом и мертвой массой материи есть разительные различия; но мы сейчас не говорим об этой тайне тайн, жизни; мы даже не говорим о живых существах; только из веществ, которые входят в состав живых существ и составляют их отдельные части; части, которые сами по себе не живут, не могут жить, но вместе составляют то «единство в множественности», которое мы называем живым существом.Если мы вырезаем мозг или сердце из живого животного, эти органы (хотя, возможно, проявляя в большей степени, чем любые другие, тонкие принципы жизни), пока они остаются прикрепленными к остальной части живого организм,) перестают жить; сделайся мертвым, как водка, или сук, срезанный с дерева, более того, умрет даже быстрее, чем сук; ибо это самый необычный закон жизни: чем ниже по шкале одушевленных существ существует организм, тем больше жизненная сила, наделенная отдельными органами.
Как обычно в истории науки, когда что-то было неясным, предполагалось, что таинственная сила, связанная с составом этих субстанций, объясняется некой оккультной силой. Вызванная таким образом сила была названа «Жизненная сила» — просто название неизвестной причины или причин.
Химия также была разделена на два отдельных отдела просто из-за предполагаемых различий между поведением и составом организованных и неорганических тел. Мы говорим о предполагаемых различиях. Между живым организмом и мертвой массой материи есть разительные различия; но мы сейчас не говорим об этой тайне тайн, жизни; мы даже не говорим о живых существах; только из веществ, которые входят в состав живых существ и составляют их отдельные части; части, которые сами по себе не живут, не могут жить, но вместе составляют то «единство в множественности», которое мы называем живым существом.Если мы вырезаем мозг или сердце из живого животного, эти органы (хотя, возможно, проявляя в большей степени, чем любые другие, тонкие принципы жизни), пока они остаются прикрепленными к остальной части живого организм,) перестают жить; сделайся мертвым, как водка, или сук, срезанный с дерева, более того, умрет даже быстрее, чем сук; ибо это самый необычный закон жизни: чем ниже по шкале одушевленных существ существует организм, тем больше жизненная сила, наделенная отдельными органами. Таким образом, изолированное сердце и мозг умирают. Удерживая время до начала разложения (которое также в каждом случае подразумевает перекомпоновку «во что-то новое и странное»), мы можем подвергнуть вещества, содержащиеся в любом из них, самому строгому исследованию, не обнаруживая ни малейшего различия между ним и другим. мертвое вещество того же типа, обнаруженное в минералах или газах.
Таким образом, мы вынуждены сделать вывод, что в сущности этих веществ нет никакой разницы. Просто здесь ,.мы сталкиваемся с трудностью. Сердце или мозг могут быть скормлены другим животным, переварены и ассимилированы в новые организмы, могут даже стать частью других сердец и мозгов живых животных, которые их пожирают.
Но если мы возьмем вещества, из которых состоят сердце и мозг, разделим их на элементы и скармливаем другим животным, мы обнаружим, что не все они ассимилированы. Фосфор в мозге может даже действовать как сильный яд и вызывать смерть животных, которым его скармливают.Но если бы мы остановились здесь и преждевременно сделали абсурдное обобщение, что никакие неорганические вещества не могут быть ассимилированы, мы бы совершили серьезную ошибку.
Таким образом, изолированное сердце и мозг умирают. Удерживая время до начала разложения (которое также в каждом случае подразумевает перекомпоновку «во что-то новое и странное»), мы можем подвергнуть вещества, содержащиеся в любом из них, самому строгому исследованию, не обнаруживая ни малейшего различия между ним и другим. мертвое вещество того же типа, обнаруженное в минералах или газах.
Таким образом, мы вынуждены сделать вывод, что в сущности этих веществ нет никакой разницы. Просто здесь ,.мы сталкиваемся с трудностью. Сердце или мозг могут быть скормлены другим животным, переварены и ассимилированы в новые организмы, могут даже стать частью других сердец и мозгов живых животных, которые их пожирают.
Но если мы возьмем вещества, из которых состоят сердце и мозг, разделим их на элементы и скармливаем другим животным, мы обнаружим, что не все они ассимилированы. Фосфор в мозге может даже действовать как сильный яд и вызывать смерть животных, которым его скармливают.Но если бы мы остановились здесь и преждевременно сделали абсурдное обобщение, что никакие неорганические вещества не могут быть ассимилированы, мы бы совершили серьезную ошибку. Что подразумевается под ассимиляцией? Это превращение веществ, взятых с пищей, в вещества, содержащиеся в организме ». Другими словами, декомпозиция и перекомпоновка. Это разложение и перегруппировка — строго химический процесс; Это было продемонстрировано путем искусственного производства многих органических компонентов вне растений или животных в лаборатории химика.Как химический процесс, он подчиняется тем же законам, что и другие химические процессы.
Один из этих законов заключается в том, что возникновение химического вещества:
Что подразумевается под ассимиляцией? Это превращение веществ, взятых с пищей, в вещества, содержащиеся в организме ». Другими словами, декомпозиция и перекомпоновка. Это разложение и перегруппировка — строго химический процесс; Это было продемонстрировано путем искусственного производства многих органических компонентов вне растений или животных в лаборатории химика.Как химический процесс, он подчиняется тем же законам, что и другие химические процессы.
Один из этих законов заключается в том, что возникновение химического вещества:
Органическая химия:
Органическая химия:Состав и номенклатура углеводородов
Что такое органическое соединение?
Когда вы подъезжаете к насосу на некоторых заправках, вы сталкиваетесь с множеством выбор.
Вы можете купить «этилированный» газ или различные формы «неэтилированного» газа,
имеют разные октановые числа. Когда вы наполняете резервуар, вы можете задаться вопросом: «Что такое
«этилированный» газ, и почему они добавляют свинец в газ? »Или:« Что я получу за свой
денег, если я купил бензин премиум-класса с более высоким октановым числом? »
Когда вы наполняете резервуар, вы можете задаться вопросом: «Что такое
«этилированный» газ, и почему они добавляют свинец в газ? »Или:« Что я получу за свой
денег, если я купил бензин премиум-класса с более высоким октановым числом? »
Затем вы прекращаете покупать лекарства от боли в спине, которая вас беспокоит. с тех пор, как вы помогли другу переехать в новую квартиру. И снова вы столкнулись с варианты (см. рисунок ниже). Вы можете купить аспирин, который использовался почти сотня лет. Или Тайленол, содержащий ацетаминофен.Или более современное обезболивающее, например ибупрофен. Пока вы решаете, какой препарат купить, вы можете задаться вопросом: «Что Чем отличаются эти препараты? »и даже« Как они действуют? »
Затем вы едете в кампус, где садитесь на «пластиковый» стул, чтобы съесть сэндвич, завернутый в «пластик», не беспокоясь о том, почему один из эти пластмассы гибкие, а другие жесткие. Пока вы едите, друг останавливается и начинает дразнить вас о влиянии вашей диеты на уровень холестерина в ваша кровь, что вызывает вопросы: «Что такое холестерин?» и почему неужели так много людей беспокоятся об этом? »
Ответы на каждый из этих вопросов относятся к области, известной как органических
химия . Более 200 лет химики разделили материалы на два
категории. Те, которые изолированы от растений и животных, были классифицированы как органических ,
в то время как те, которые восходят к минералам, были неорганическими . В свое время химики
считали, что органические соединения принципиально отличаются от тех, которые были
неорганические, потому что органические соединения содержат жизненной силы , которая была только
найдено в живых системах.
Более 200 лет химики разделили материалы на два
категории. Те, которые изолированы от растений и животных, были классифицированы как органических ,
в то время как те, которые восходят к минералам, были неорганическими . В свое время химики
считали, что органические соединения принципиально отличаются от тех, которые были
неорганические, потому что органические соединения содержат жизненной силы , которая была только
найдено в живых системах.
Первый шаг в упадке теории жизненной силы произошел в 1828 году, когда Фридрих Велер синтезировал мочевину из неорганических исходных материалов.Волер пытался сделать цианат аммония (NH 4 OCN) из цианата серебра (AgOCN) и аммония хлорид (NH 4 Cl). То, что он ожидал, описывается следующим уравнением.
AgOCN ( водн. ) + NH 4 Cl ( водн. ) AgCl ( с ) + NH 4 OCN ( водн. )
Продукт, который он выделил в этой реакции, не имел свойств цианата. соединения. Это был белый кристаллический материал, идентичный мочевине, H 2 NCONH 2 ,
которые можно выделить из мочи.
соединения. Это был белый кристаллический материал, идентичный мочевине, H 2 NCONH 2 ,
которые можно выделить из мочи.
Ни Велер, ни его современники не утверждали, что его результаты опровергают жизненно важные теория силы. Но его результаты привели в действие серию экспериментов, которые привели к синтез различных органических соединений из неорганических исходных материалов. Этот неизбежно привело к исчезновению «жизненной силы» из списка теорий. это имело какое-либо отношение к химии, хотя и не привело к смерти теории, у которого все еще были сторонники более 90 лет спустя.
Если разница между органическими и неорганическими соединениями не в наличии
таинственная жизненная сила, необходимая для их синтеза, на чем основано различение
между этими классами соединений? Большинство соединений, извлеченных из живых организмов, содержат
углерод. Поэтому возникает соблазн идентифицировать органическую химию как химию углерода. Но это определение будет включать такие соединения, как карбонат кальция (CaCO 3 ),
а также элементарные формы углеродного алмаза
и графит, которые явно неорганические.Поэтому мы определим органическую химию как химию соединений, содержащих
как углерод, так и водород .
Но это определение будет включать такие соединения, как карбонат кальция (CaCO 3 ),
а также элементарные формы углеродного алмаза
и графит, которые явно неорганические.Поэтому мы определим органическую химию как химию соединений, содержащих
как углерод, так и водород .
Несмотря на то, что органическая химия фокусируется на соединениях, содержащих углерод и водород, более 95% соединений, выделенных из природных источников или синтезированных в лаборатории органические. Особая роль углерода в химии элементов заключается в результат комбинации факторов, включая количество валентных электронов на нейтральный атом углерода, электроотрицательность углерода и атомный радиус углерода атомов (см. таблицу ниже).
Физические свойства углерода
| Электронная конфигурация | 1 с 2 2 с 2 2 p 2 | |
| Электроотрицательность | 2,55 | |
| Ковалентный радиус | 0,077 нм |
Углерод имеет четыре валентных электрона 2 с 2 2 p 2 и он должен
либо получить четыре электрона, либо потерять четыре электрона, чтобы достичь конфигурации инертного газа. В
электроотрицательность углерода слишком мала, чтобы углерод мог получать электроны от большинства элементов
для образования ионов C 4-, и слишком большие, чтобы углерод терял электроны с образованием C 4+ ионы. Таким образом, углерод образует ковалентные связи с большим количеством других элементов,
включая водород, азот, кислород, фосфор и серу, обнаруженные в живых системах.
В
электроотрицательность углерода слишком мала, чтобы углерод мог получать электроны от большинства элементов
для образования ионов C 4-, и слишком большие, чтобы углерод терял электроны с образованием C 4+ ионы. Таким образом, углерод образует ковалентные связи с большим количеством других элементов,
включая водород, азот, кислород, фосфор и серу, обнаруженные в живых системах.
Поскольку они относительно малы, атомы углерода могут подходить достаточно близко друг к другу, чтобы образовать сильные двойные связи C = C или даже CC тройные связи.Углерод также образует прочные двойные и тройные связи с азотом и кислородом. Это может даже образовывать двойные связи с такими элементами, как фосфор или сера, которые не образуют двойные связи с собой.
Несколько лет назад беспилотный космический корабль «Викинг» проводил эксперименты, призванные
поиск свидетельств жизни на Марсе. Эти эксперименты основывались на предположении, что
живые системы содержат углерод, и отсутствие каких-либо доказательств существования углеродной жизни на
Предполагалось, что эта планета означает, что жизни не существует. Несколько факторов делают углерод
необходимо для жизни.
Несколько факторов делают углерод
необходимо для жизни.
- Легкость, с которой атомы углерода образуют связи с другими атомами углерода.
- Прочность одинарных связей CC и ковалентные связи углерода с другими неметаллами, такими как N, O, P и S.
- Способность углерода образовывать множественные связи с другими неметаллами, включая C, N, O, P, и атомы S.
Эти факторы обеспечивают почти бесконечное разнообразие потенциальных структур для органических соединения, такие как витамин C, показаны на рисунке ниже.
Никакой другой элемент не может обеспечить разнообразие комбинаций и перестановок, необходимых для жизнь существовать.
Насыщенные углеводороды или алканы
Соединения, содержащие только углерод и водород, известны как углеводородов .
Те, которые содержат как можно больше атомов водорода, считаются насыщенными . Насыщенные углеводороды также известны как алканов .
Насыщенные углеводороды также известны как алканов .
Простейший алкан — метан: CH 4 . Структура Льюиса метана может быть генерируется путем объединения четырех электронов в валентной оболочке нейтрального атома углерода с четырьмя атомами водорода, чтобы сформировать соединение, в котором атом углерода разделяет в общей сложности восемь валентных электронов с четырьмя атомами водорода.
Метан является примером общего правила, согласно которому углерод четырехвалентен ; Это образует в общей сложности четыре связи почти во всех своих соединениях.Чтобы свести к минимуму отталкивание между парами электронов в четырех КД связей, геометрия вокруг атома углерода является тетраэдрической, как показано на рисунке ниже.
Алкан, содержащий три атома углерода, известен как пропан, имеющий формулу
C 3 H 8 и следующую структуру скелета.
Четырехуглеродный алкан представляет собой бутан с формулой C 4 H 10 .
Названия, формулы и физические свойства различных алканов с общим Формула C n H 2 n +2 приведены в таблице ниже. В точки кипения алканов постепенно увеличиваются с увеличением молекулярной массы этих алканов. соединения. При комнатной температуре более легкие алканы являются газами; средние алканы жидкости; а более тяжелые алканы — твердые вещества или смолы.
Насыщенные углеводороды или алканы
| Имя | Молекулярный Формула | Плавка Точка ( o C) | Кипячение Точка ( o C) | Состояние при 25 o C | ||||
| метан | СН 4 | -182. 5 5 | –164 | газ | ||||
| этан | С 2 В 6 | -183,3 | -88,6 | газ | ||||
| пропан | С 3 В 8 | -189.7 | -42,1 | газ | ||||
| бутан | С 4 В 10 | -138,4 | -0,5 | газ | ||||
| пентан | С 5 В 12 | -129.7 | 36,1 | жидкость | ||||
| гексан | С 6 В 14 | -95 | 68,9 | жидкость | ||||
| гептан | С 7 В 16 | -90. 6 6 | 98,4 | жидкость | ||||
| октановое число | С 8 В 18 | -56,8 | 124,7 | жидкость | ||||
| нонан | С 9 В 20 | -51 | 150.8 | жидкость | ||||
| декан | С 10 В 22 | -29,7 | 174,1 | жидкость | ||||
| ундекан | С 11 В 24 | -24,6 | 195.9 | жидкость | ||||
| додекан | С 12 В 26 | -9,6 | 216,3 | жидкость | ||||
| эйкозан | С 20 В 42 | 36,8 | 343 | цельный | ||||
| триаконтан | С 30 В 62 | 65. 8 8 | 449,7 | цельный |
Все алканы в таблице выше — это углеводородов с прямой цепью , в атомы углерода образуют цепочку, идущую от одного конца молекулы до другого. Общую формулу этих соединений можно понять, если предположить, что они содержат цепочки групп CH 2 с дополнительным атомом водорода, закрывающим любой конец цепь.Таким образом, на каждые n атомов углерода должно приходиться 2 n + 2 водорода. атомов: C n H 2 n +2 .
Поскольку две точки определяют линию, углеродный скелет молекулы этана является линейным, как показано на рисунке ниже.
Поскольку валентный угол в тетраэдре равен 109,5, молекулы алканов, содержащие три или четыре атома углерода больше нельзя рассматривать как «линейные», как показано на рисунок ниже.
| Пропан | Бутан |
В дополнение к примерам с прямой цепью, рассмотренным до сих пор, алканы также образуют разветвленные конструкции. Наименьший углеводород, в котором может существовать ответвление, имеет четыре атома углерода.
Это соединение имеет ту же формулу, что и бутан (C 4 H 10 ), но
разная структура.Соединения с одинаковой формулой и разными структурами известны как изомеров (от греческого isos , «равный» и meros ,
«части»). Когда он был впервые обнаружен, разветвленный изомер с формулой C 4 H 10 поэтому было дано название изобутан .
Наименьший углеводород, в котором может существовать ответвление, имеет четыре атома углерода.
Это соединение имеет ту же формулу, что и бутан (C 4 H 10 ), но
разная структура.Соединения с одинаковой формулой и разными структурами известны как изомеров (от греческого isos , «равный» и meros ,
«части»). Когда он был впервые обнаружен, разветвленный изомер с формулой C 4 H 10 поэтому было дано название изобутан .
Изобутан
Лучший способ понять разницу между структурами бутана и изобутан предназначен для сравнения шаровых моделей этих соединений, показанных на рисунке. ниже.
| Бутан | Изобутан |
Бутан и изобутан называются конституционными изомерами , потому что они
буквально различаются по своему телосложению. Один содержит две группы CH 3 и две группы CH 2 группы; другой содержит три группы CH 3 и одну группу CH.
Один содержит две группы CH 3 и две группы CH 2 группы; другой содержит три группы CH 3 и одну группу CH.
Существует три структурных изомера пентана: C 5 H 12 . В первый — это «нормальный» пентан, или n -пентан.
Также возможен разветвленный изомер, первоначально названный изопентаном. Когда больше был открыт сильно разветвленный изомер, названный неопентаном (новый изомер пентан).
Шаровидные модели трех изомеров пентана показаны на рисунке ниже.
| н-пентан | Изопентан |
| Неопентан |
Имеются два структурных изомера с формулой C 4 H 10 ,
три изомера C 5 H 12 и пять изомеров C 6 H 14 . Число изомеров соединения быстро увеличивается с добавлением дополнительных атомов углерода. Там
составляют более 4 миллиардов изомеров, например, для C 30 H 62 .
Число изомеров соединения быстро увеличивается с добавлением дополнительных атомов углерода. Там
составляют более 4 миллиардов изомеров, например, для C 30 H 62 .
Циклоалканы
Если углеродная цепь, образующая основную цепь углеводорода с прямой цепью, длинная достаточно, мы можем представить, как два конца соединяются, образуя циклоалкан . Для образования связи CC, замыкающей кольцо, необходимо удалить по одному атому водорода с каждого конца углеводородной цепи.Циклоалканы следовательно, имеют на два атома водорода меньше, чем исходный алкан, и общая формула C n H 2n .
Наименьшим алканом, который может образовывать кольцо, является циклопропан, C 3 H 6 ,
в котором три атома углерода лежат в одной плоскости. Угол между соседними связями CC составляет всего 60, что очень много. меньше угла 109,5 в тетраэдре, как показано на рисунке ниже.
меньше угла 109,5 в тетраэдре, как показано на рисунке ниже.
Циклопропан, следовательно, подвержен химическим реакциям, которые могут открывать трехчленное кольцо.
Любая попытка заставить четыре атома углерода, которые образуют циклобутановое кольцо, перейти в плоскость атомы образуют структуру, показанную на рисунке ниже, в которой угол между смежные CC облигации будут 90.
Таким образом, один из четырех атомов углерода в циклобутановом кольце смещен из плоскости трех других, чтобы сформировать «сморщенную» структуру, которая нечетко напоминает крылья бабочки.
Угол между соседними связями CC в
плоская молекула циклопентана будет 108, что близко к идеальному углу вокруг
тетраэдрический атом углерода.Циклопентан не является плоской молекулой, как показано на рисунке.
ниже, потому что смещение двух атомов углерода из плоскости трех других
образует сморщенную структуру, которая частично снижает отталкивание между водородом. атомы на соседних атомах углерода в кольце.
атомы на соседних атомах углерода в кольце.
К тому времени, когда мы дойдем до шестичленного кольца в циклогексане, сморщенная структура может быть образуется путем смещения пары атомов углерода на обоих концах кольца из плоскости остальные четыре члена кольца.Один из этих атомов углерода наклонен вверх из кольцо, а другой наклонен вниз, образуя структуру «стул», показанную на рисунок ниже.
Вращение вокруг C C облигации
Если посмотреть на структуру молекулы этана, легко попасть в ловушку.
думать об этой молекуле, как если бы она была статичной. Ничего не может быть дальше от
правда.При комнатной температуре средняя скорость молекулы этана примерно на 500 м / с более чем в два раза превышает скорость Boeing 747.
Во время движения в пространстве молекула кувыркается вокруг своего центра тяжести, как
самолет вышел из-под контроля. В то же время связи CH и CC колеблются.
как пружина со скоростью 9 x 10 13 с -1 .
В то же время связи CH и CC колеблются.
как пружина со скоростью 9 x 10 13 с -1 .
Есть еще один способ, которым может двигаться молекула этана. Группы CH 3 на любом конце молекулы может вращаться относительно каждого вокруг связи CC.Когда это происходит, молекула проходит через бесконечное количество конформаций , которые имеют немного разные энергии. Наивысшая энергетическая конформация соответствует структуре, в которой водород атомы «затмеваются». Если рассматривать молекулу вдоль связи CC, атомы водорода на одной CH 3 группа закроет другие, как показано на рисунке ниже.
Конформация с наименьшей энергией — это структура, в которой атомы водорода «в шахматном порядке», как показано на рисунке ниже.
Разница между затменной и шахматной конформациями этана наилучшая.
проиллюстрировано просмотром этих молекул вдоль связи CC, как показано на рисунке ниже.
| Затмение | В шахматном порядке |
Разница между энергиями этих конформаций относительно небольшой, всего около 12 кДж / моль.Но он достаточно велик, чтобы вращение вокруг связи CC не было плавным. Хотя частота этого вращения составляет порядка 10 10 оборотов в секунду, этан молекула проводит немного больший процент времени в шахматной конформации.
Различные конформации молекулы часто описываются в терминах Ньюмана.
Прогнозы . Эти линейные рисунки показывают шесть заместителей на связи CC, как если бы структура молекулы
проецируется на лист бумаги, освещая ярким светом вдоль CC-связи в шарообразной модели
молекула.Показаны проекции Ньюмана для различных ступенчатых конформаций бутана. на рисунке ниже.
на рисунке ниже.
Из-за легкости вращения вокруг связей CC, существует несколько конформаций некоторых циклоалканов. описано в предыдущем разделе. Циклогексан, например, образует как Соответствие «кресло» и «лодка» показано на рисунке ниже.
| Стул | Лодка |
Разница между энергиями конформации кресла, в котором водород атомы расположены в шахматном порядке, а форма лодочки, в которой они затмеваются, составляет около 30 кДж / моль.В результате, даже если скорость, с которой эти две конформации обмениваются, равна примерно 1 x 10 5 с -1 , можно предположить, что большинство молекул циклогексана на в любой момент времени находятся в конформации стула.
Номенклатура алканов
Распространенных названий, таких как пентан, изопентан и неопентан, достаточно для
различают три изомера по формуле C 5 H 12 . Они
становятся менее полезными, однако, по мере увеличения размера углеводородной цепи.
Они
становятся менее полезными, однако, по мере увеличения размера углеводородной цепи.
Международный союз теоретической и прикладной химии (IUPAC) разработал Системный подход к названию алканов и циклоалканов основан на следующих этапах.
- Найдите самую длинную непрерывную цепочку атомов углерода в структуре скелета. Назовите соединение как производное алкана с таким числом атомов углерода. Следующее соединение, например, является производным пентана, потому что самая длинная цепь содержит пять атомы углерода.
- Назовите заместители в цепи. Заместители, производные от алканов, названы замена — и заканчивая — ил . Это соединение содержит метил (CH 3 -) заместитель.
- Пронумеруйте цепь, начиная с конца, ближайшего к первому заместителю, и укажите
атомы углерода, на которых расположены заместители.
 Используйте минимально возможные числа.Этот
соединение, например, 2-метилпентан, а не 4-метилпентан.
Используйте минимально возможные числа.Этот
соединение, например, 2-метилпентан, а не 4-метилпентан.
- Используйте префиксы di -, tri — и tetra — для описания заместители, которые встречаются два, три или четыре раза в одной и той же цепи атомов углерода.
- Расположите названия заместителей в алфавитном порядке.
Ненасыщенные углеводороды: алкены и Алкины
Карбон не только образует прочный CC
одинарные связи, обнаруженные в алканах, он также образует прочные двойные связи C = C.Соединения, которые
содержат двойные связи C = C, когда-то были известны как олефины (буквально, «чтобы образовать
масло «), потому что они трудно кристаллизоваться (они, как правило, остаются маслянистыми жидкостями, когда
охлаждены.) Эти соединения теперь называются алкенами . Простейший алкен имеет
формула C 2 H 4 и следующая структура Льюиса.
Простейший алкен имеет
формула C 2 H 4 и следующая структура Льюиса.
Связь между алканами и алкенами можно понять с помощью думаю о следующей гипотетической реакции.Начнем с разрыва связи в H 2 молекулы, так что один из электронов попадает на каждый из атомов водорода. Мы делаем то же самое одна из связей между атомами углерода в алкене. Затем мы позволяем неспаренный электрон на каждом атоме водорода для взаимодействия с неспаренным электроном на углероде атома с образованием новой связи CH.
Таким образом, теоретически мы можем превратить алкен в исходный алкан, добавив H 2 молекула через двойную связь C = C.На практике эта реакция происходит только при высоком давления в присутствии подходящего катализатора, такого как кусок металлического никеля.
Поскольку алкен можно рассматривать как производное алкана, из которого H 2 молекула была удалена, общая формула для алкена с одной двойной связью C = C: C n H 2n .
Алкены являются примерами ненасыщенных углеводородов , поскольку они имеют меньше атомов водорода, чем у соответствующих алканов.Когда-то они были названы добавлением суффикс — ene к имени заместителя, имеющего такое же количество углерода атомы.
В номенклатуре алкенов ИЮПАК эти соединения называются производными от исходного алканы. На наличие двойной связи C = C указывает изменение — ane оканчивается на название исходного алкана на -ен .
Расположение двойной связи C = C в каркасной структуре соединения обозначается указанием номера атома углерода, с которого начинается связь C = C.
Затем названия заместителей добавляются в качестве префиксов к названию алкена.
Соединения, содержащие тройные связи CC, называются алкинами . Эти соединения имеют четыре
атомов водорода меньше, чем в исходных алканах, поэтому общая формула алкина с
одиночный CC
тройная связь — C n H 2n-2 .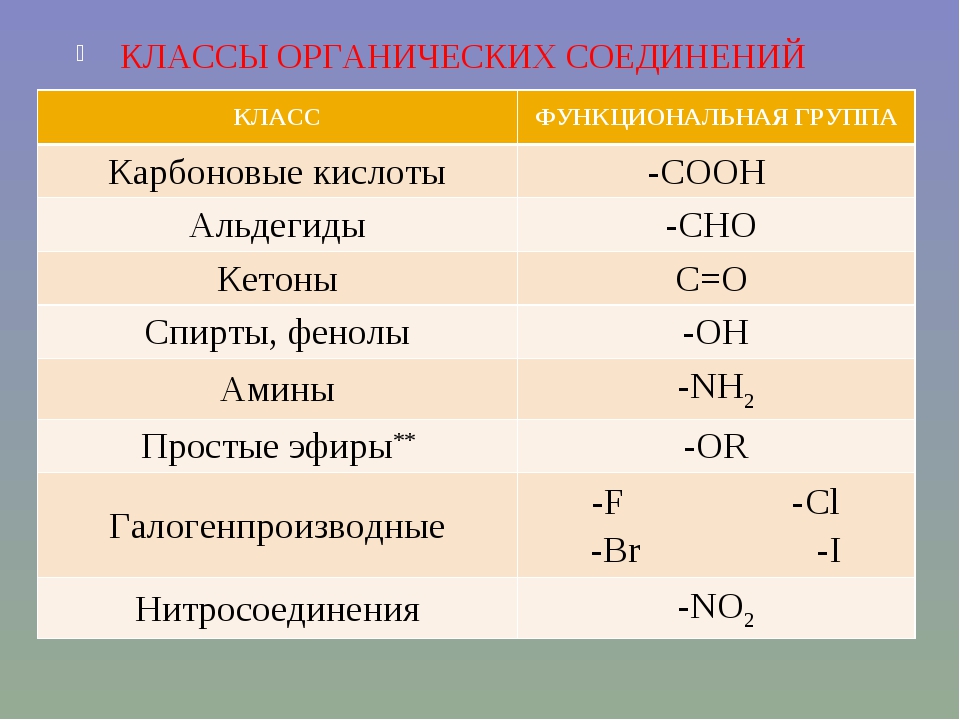 Простейший алкин имеет формулу C 2 H 2 и известен под общим названием ацетилен .
Простейший алкин имеет формулу C 2 H 2 и известен под общим названием ацетилен .
В номенклатуре IUPAC для алкинов эти соединения называются производными от исходного алкан, с окончанием -ын , заменяющий -ан .
Помимо соединений, содержащих одну двойную связь ( алкенов, ) или одну тройную связь ( алкинов ), мы также можем представить соединения с двумя двойными связями ( диенов ), три двойные связи ( триенов, ) или комбинация двойных и тройных связей.
Органическая химия: структура и номенклатура углеводородов
Состав и номенклатура Углеводороды | Изомеры | Реакции алканов, алкенов и алкинов | Углеводороды | Нефть и уголь | Хиральность и оптическая активность
Периодический Стол | Периодическая таблица | Глоссарий | Классные Апплеты
Обзор темы Gen Chem
|
Главная страница справки по общей химии
| Поиск: веб-сайт общей химии.
ученых делают первый шаг к созданию «неорганической жизни» — ScienceDaily
Ученые из Университета Глазго говорят, что они сделали свои первые пробные шаги к созданию «жизни» из неорганических химикатов, потенциально определяющих новую область «неорганической биологии».
Профессор Ли Кронин, заведующий кафедрой химии Гардинерского колледжа науки и техники, и его команда продемонстрировали новый способ изготовления неорганических химических клеток или iCHELL.
Профессор Кронин сказал: «Вся жизнь на Земле основана на органической биологии (т.е.углерод в форме аминокислот, нуклеотидов, сахаров и т. Д.), Но неорганический мир считается неодушевленным.
«То, что мы пытаемся сделать, — это создать самовоспроизводящиеся, развивающиеся неорганические клетки, которые, по сути, были бы живыми. Вы могли бы назвать это неорганической биологией».
Клетки можно разделить на части, создав внутренние мембраны, которые контролируют прохождение материалов и энергии через них, что означает, что несколько химических процессов могут быть изолированы в одной и той же клетке — точно так же, как биологические клетки.
Исследователи говорят, что клетки, которые также могут накапливать электричество, потенциально могут быть использованы во всех сферах медицины, в качестве датчиков или для ограничения химических реакций.
Исследование является частью проекта профессора Кронина, целью которого является продемонстрировать, что неорганические химические соединения способны к самовоспроизведению и развитию — так же, как это делают органические, биологические клетки на основе углерода.
Исследование создания «неорганической жизни» находится на начальной стадии, но профессор Кронин считает, что это вполне осуществимо.
Профессор Кронин сказал: «Главная цель состоит в том, чтобы построить сложные химические клетки с похожими на жизнь свойствами, которые могли бы помочь нам понять, как возникла жизнь, а также использовать этот подход для определения новой технологии, основанной на эволюции в материальном мире — своего рода неорганической живой техники.
«Бактерии — это, по сути, одноклеточные микроорганизмы, состоящие из органических химикатов, так почему же мы не можем создать микроорганизмы из неорганических химикатов и позволить им развиваться?»
«В случае успеха это дало бы нам невероятное понимание эволюции и показало, что это не просто биологический процесс. Это также означало бы, что мы доказали бы, что неуглеродная жизнь может существовать, и полностью изменили бы наши представления о дизайне ».
Это также означало бы, что мы доказали бы, что неуглеродная жизнь может существовать, и полностью изменили бы наши представления о дизайне ».
Статья опубликована в журнале Angewandte Chemie .
История Источник:
Материалы предоставлены Университетом Глазго . Примечание. Содержимое можно редактировать по стилю и длине.
Соль — это органическое соединение? — Соляная библиотека
Хлорид натрия или пищевая соль необходимы для правильного функционирования человеческого организма.Столовая соль использовалась людьми для разных целей на протяжении веков. Однако в солях есть нечто большее, чем обычное изображение белых кристаллов, придающих вкус пище.
Как компания Koyuncu Salt, ведущий турецкий экспортер соли, мы найдем ответ на популярный вопрос: « является ли соль органическим соединением? »и предоставить некоторую важную информацию о химических соединениях для лучшего понимания.
Определение соединения
Прежде чем ответить на вопрос, «является ли соль органическим соединением», нам нужно коснуться того, что означают соединение и органическое соединение в химии.Затем нам нужно провести различие между органическими и неорганическими соединениями для ясного понимания. Итак, что такое соединение?
Соединение, как правило, относится к материалу, состоящему из двух или более элементов. В частности, в биохимии соединение относится к веществу, состоящему из атомов или ионов двух или более связанных элементов. Два или более элемента, связанных химической связью, создают химические соединения.
Химическое соединение должно представлять собой комбинацию элементов разных типов.Например, связывание элементов натрия и хлорида создает NaCl или хлорид натрия, который мы знаем как поваренную соль.
Что такое органическое соединение?
Зная, что означает химическое соединение, мы можем перейти к следующему вопросу; « что такое неорганическое соединение? ”Органическое соединение относится к любому химическому соединению, которое содержит углерод-водородные связи. Органические соединения, содержащие углерод, а также другие элементы, необходимы для воспроизводства живых организмов.
Органические соединения, содержащие углерод, а также другие элементы, необходимы для воспроизводства живых организмов.
Органические соединения, состоящие из молекул углеводородов и белков, являются основой химических реакций в клетках растений и животных. Эти реакции обеспечивают жизненную энергию, необходимую для любой жизнедеятельности, такой как поиск пищи или размножение.
Что означает неорганическое соединение?
Является ли соль органическим соединением? Нам нужно определить неорганические соединения. В химии неорганические соединения — это вещества, в которых два или более химических элемента объединены, но не содержат углерод-водородной связи.
Органические соединения часто классифицируются по элементам или группам элементов, которые они содержат. Например, оксиды можно разделить на ионные или молекулярные. Поскольку органические химические вещества включают только вещества, содержащие атомы углерода, связанные с атомами водорода, большинство элементов и веществ считаются неорганическими химическими веществами.
Химическая формула соли
Теперь вы знаете, что такое органические и неорганические соединения. Мы более подробно рассмотрим химическую формулу соли для дальнейшего понимания этого конкретного соединения, прежде чем ответим на вопрос «является ли соль органическим соединением».”
Соль — химическое соединение, состоящее из аниона и катиона. Соли образуются путем сборки положительно заряженных ионов (катионов) и отрицательно заряженных ионов (анион). Поваренная соль (NaCl) состоит из ионов натрия и хлорида и является ионным соединением.
В съедобной форме пищевая соль обычно используется для усиления вкуса или для консервирования пищи. Соль также может использоваться в промышленных целях, которые называются промышленными солями. Кроме того, соль можно использовать в качестве добавки к рациону животных; эти типы солей являются солями животного происхождения.Кроме того, соли используются для борьбы с обледенением дорог.
Знаете ли вы свойства соли? Вы можете прочитать нашу статью Как определить соль? Узнать сейчас.
Давайте посмотрим на типы соли в химии.
Типы солей в химии
Когда мы говорим о соли, обычно первое, что приходит в голову, — это хлорид натрия, то есть обычная поваренная соль. Однако существует множество способов классификации солей.Типы солей:
● Щелочные соли: Соли, выделяющие гидроксид-ионы при растворении в воде.
● Нейтральные соли: Нейтральные соли, как следует из их названия, не являются ни кислотными, ни основными солями.
● Кислотные соли: Соли, образующие кислые растворы при растворении в растворителе.
● Цвиттерионы: Цвиттерионы не считаются солью, но они содержат анионный и катионный центры в одной и той же молекуле.Цвиттерион называется внутренней солью.
Это разновидности соли в химии. Если вы ищете пищевые виды соли, вы можете ознакомиться с нашей статьей Сколько видов соли существует?
Соль — это органическое соединение?
До сих пор мы рассмотрели определения органических и неорганических соединений, а также химическую формулу соли и типы соли в химии. Теперь мы можем ответить на вопрос; является ли соль органическим соединением?
Теперь мы можем ответить на вопрос; является ли соль органическим соединением?
Неорганические соли
Есть как органические, так и неорганические соли.Однако соли, такие как поваренная соль (хлорид натрия), пищевая сода (хлорид натрия), карбонат кальция и соляная кислота (соляная кислота промышленного качества), являются одними из широко известных неорганических соединений. Итак, чтобы подчеркнуть это, поваренная соль или пищевая соль, которую потребляют люди, являются неорганическими соединениями.
Обычно неорганические соединения имеют высокие температуры плавления, а их электрическая проводимость варьируется в зависимости от степени. Эти свойства неорганических соединений делают их полезными в определенных приложениях:
● В качестве реактивного и ракетного топлива, а также взрывчатых веществ,
● В качестве химикатов при очистке воды и стерилизации,
● Для промышленных целей в качестве пигментов в волокнах, чернилах, красках и бумаге,
● В фармацевтическом производстве и т. Д.
Д.
Органические соли
На самом деле нет однозначного ответа на вопрос «является ли соль органическим соединением?» Есть также органические соли. В химии эти типы солей содержат органический ион. Например, ацетат натрия и большинство основных ингредиентов чистящих средств (соли натрия, такие как лаурат натрия, являются органическими солями. Они получены из органических кислот.
Однако у «органических солей» есть и маркетинговая сторона. В маркетинге столовые соли без каких-либо добавок, таких как йод или вещества, препятствующие слеживанию, называют органическими солями.Например, морские соли, не содержащие каких-либо добавок, можно назвать «органическими».
Разделение органических и неорганических соединений для конкретных приложений
w3.org/2001/XMLSchema-instance»/>
Органические и неорганические соединения определяют структуру, свойства и реакции соединений.Химики в целом и химики-органики в частности могут создавать новые, никогда ранее не предложенные молекулы, которые при тщательном проектировании могут иметь важные свойства для улучшения человеческого опыта. Органические и неорганические соединения играют важную роль в таких отраслях, как производство каучука, пластмасс, топлива, фармацевтики, косметики, моющих средств, покрытий, красителей и агрохимии. Основы биохимии, биотехнологии и медицины построены на органических соединениях и их роли в жизненных процессах.Большинство современных высокотехнологичных материалов состоит, по крайней мере частично, из органических и неорганических соединений. Очевидно, что разделение органических и неорганических соединений критически важно для нашего высокого уровня жизни. В связи с этим мы решили выпустить этот спецвыпуск. Мы получили много статей для этого специального выпуска. Мы отобрали для публикации 7 лучших из них. Этот специальный выпуск содержит 5 оригинальных научных работ и 2 обзорные статьи.
Мы отобрали для публикации 7 лучших из них. Этот специальный выпуск содержит 5 оригинальных научных работ и 2 обзорные статьи.
Исследование Дж.-Y. Лю и др. под названием «Экспериментальные и модельные исследования по прогнозированию образования газовых гидратов» была предложена новая модель прогнозирования образования газовых гидратов на основе анализа некоторых кинетических моделей и кинетических наблюдений за процессом образования гидратов. Анализ настоящей модели показывает, что образование газового гидрата зависит не только от состава газа и содержания свободной воды, но также от температуры и давления. Благодаря контрастному эксперименту, прогнозируемый результат нового метода прогнозирования кинетики кристаллизации газовых гидратов близок к измеренному результату; это означает, что метод прогноза может точно отразить кристаллизацию гидрата.На практике различные параметры должны быть изменены в соответствии с практической ситуацией.
В другом исследовании L. Wang et al. под названием «Синтез и предварительные свойства новых поли (ариловых эфиров), содержащих боковую группу β -нафталина», авторы синтезировали два новых поли (ариловых эфира), содержащих боковую группу β -нафталина, и структуры этих полимеров были определяется с помощью спектроскопии ЯМР. Эти полимеры показали хорошую термическую стабильность с высокой температурой плавления 256 ° C и 274 ° C соответственно.Они исследовали растворимость полимеров в обычных органических растворителях, таких как DMAc, DMSO, CH 2 Cl 2 и CHCl 3 путем электроспиннинга в микроволокно (1–5 мкм мкм) с большим количеством нанопор (<100 мкм). нм) из раствора CHCl 3 . Эти волокна показали высокую гидрофобность, а угол смачивания волокон превышает 120 °. В результате этого исследования эти полимеры обладали превосходной термической стабильностью и хорошей растворимостью. Волокна с множеством нанопор, полученные методом электроспиннинга, обладают высокой гидрофобностью.
под названием «Синтез и предварительные свойства новых поли (ариловых эфиров), содержащих боковую группу β -нафталина», авторы синтезировали два новых поли (ариловых эфира), содержащих боковую группу β -нафталина, и структуры этих полимеров были определяется с помощью спектроскопии ЯМР. Эти полимеры показали хорошую термическую стабильность с высокой температурой плавления 256 ° C и 274 ° C соответственно.Они исследовали растворимость полимеров в обычных органических растворителях, таких как DMAc, DMSO, CH 2 Cl 2 и CHCl 3 путем электроспиннинга в микроволокно (1–5 мкм мкм) с большим количеством нанопор (<100 мкм). нм) из раствора CHCl 3 . Эти волокна показали высокую гидрофобность, а угол смачивания волокон превышает 120 °. В результате этого исследования эти полимеры обладали превосходной термической стабильностью и хорошей растворимостью. Волокна с множеством нанопор, полученные методом электроспиннинга, обладают высокой гидрофобностью. Полимеры потенциально могут быть использованы в качестве жаропрочных материалов, водонепроницаемых материалов и транспортных носителей.
Полимеры потенциально могут быть использованы в качестве жаропрочных материалов, водонепроницаемых материалов и транспортных носителей.
Еще одна ценная статья, озаглавленная «Очистка антоцианов с помощью o -дигидрокси-группировки путем сорбции в катионных смолах, заряженных Fe (III)», была опубликована A. Castañeda-Ovando et al. в этом спецвыпуске. Авторами предложен новый метод очистки антоцианов с o -дигидрокси-расположением. Этот метод основан на механизме обмена лигандов с использованием катионообменной смолы, загруженной ионами металлов, для увеличения сродства смолы к антоцианину (ам) с o -дигидрокси-расположением.Они использовали этот метод для очистки основного антоциана (цианидин-3-глюкозид; Cy-3-glc) из антоцианового метанольного экстракта синей кукурузы. Наилучший результат сорбции показал использование Fe (III) в его ионной форме. Процедура очистки начинается с образования комплекса металл-антоцианин (Cy-3-glc-Fe), который был оптимальным при pH 5, с последующим процессом элюирования 0,1 M NaOH для удаления антоцианов без o -дигидроксигидроксигрупп, сахаров. , и органические кислоты. Наконец, чистый антоцианин получают путем добавления HCl 0.1 M, который разрушает комплекс металл-антоциан. Авторами предложен метод очистки Cy-3-глюкозида путем сорбции на катионообменной смоле, содержащей Fe3 +. Показано, что это вполне жизнеспособно для o- дигидроксиантоцианов, потому что (i) это снижает затраты на процедуру, поскольку его можно проводить за меньшее время в отличие от хроматографических методов, предложенных ранее, (ii) процент экстракции антоцианов достигнуто выше 99,99%, и (iii) можно собрать основной антоциан с высокой чистотой и проанализировать его другими спектроскопическими методами.
, и органические кислоты. Наконец, чистый антоцианин получают путем добавления HCl 0.1 M, который разрушает комплекс металл-антоциан. Авторами предложен метод очистки Cy-3-глюкозида путем сорбции на катионообменной смоле, содержащей Fe3 +. Показано, что это вполне жизнеспособно для o- дигидроксиантоцианов, потому что (i) это снижает затраты на процедуру, поскольку его можно проводить за меньшее время в отличие от хроматографических методов, предложенных ранее, (ii) процент экстракции антоцианов достигнуто выше 99,99%, и (iii) можно собрать основной антоциан с высокой чистотой и проанализировать его другими спектроскопическими методами.
Статья A. Ioutsi et al., Озаглавленная «Послойная сборка полисахаридов и 6,10-ионена для разделения азотсодержащих фармацевтических препаратов и их энантиораспознавания с помощью капиллярного электрофореза». исследовали получение двух капилляров кремнезема, модифицированных слой за слоем 6,10-ионеном и N- (3-сульфо, 3-карбокси) -пропионилхитозаном (SCPC) и 6,10-ионеном и сульфатом декстрана (DS). Динамическое покрытие капилляра эффективно снижает адсорбцию фонового электролита, компонентов матрицы пробы и аналитов на его внутренней стенке.Такие покрытия обеспечивают хорошую воспроизводимость и чувствительность определения. Авторы демонстрируют, что разделение бета-блокаторов, блокаторов кальциевых каналов, альфа-адренергических агонистов, H2-блокаторов и диуретиков было наиболее эффективным и быстрым при использовании капилляров, модифицированных декстрансульфатом. Тетрагидрозолин, карбиноксамин и фурацилин, которые обычно используются для лечения аллергического ринита, были обнаружены в мочевине человека. Их концентрации, независимо подтвержденные с помощью ВЭЖХ, оказались равными, и мкг г мл -1 ; LOD = 0.07, 0,03 и 0,10 мкм г / мл -1 и LOQ = 1,0, 0,8 и 0,6 мкм г / мл -1 , соответственно. В результате этого исследования авторы сообщили об оптимальных условиях для идентификации и разделения тетрагидрозолина (альфа-адренергический агонист), карбиноксамина (h2-блокатор) и фурацилина в мочевине человека.
Динамическое покрытие капилляра эффективно снижает адсорбцию фонового электролита, компонентов матрицы пробы и аналитов на его внутренней стенке.Такие покрытия обеспечивают хорошую воспроизводимость и чувствительность определения. Авторы демонстрируют, что разделение бета-блокаторов, блокаторов кальциевых каналов, альфа-адренергических агонистов, H2-блокаторов и диуретиков было наиболее эффективным и быстрым при использовании капилляров, модифицированных декстрансульфатом. Тетрагидрозолин, карбиноксамин и фурацилин, которые обычно используются для лечения аллергического ринита, были обнаружены в мочевине человека. Их концентрации, независимо подтвержденные с помощью ВЭЖХ, оказались равными, и мкг г мл -1 ; LOD = 0.07, 0,03 и 0,10 мкм г / мл -1 и LOQ = 1,0, 0,8 и 0,6 мкм г / мл -1 , соответственно. В результате этого исследования авторы сообщили об оптимальных условиях для идентификации и разделения тетрагидрозолина (альфа-адренергический агонист), карбиноксамина (h2-блокатор) и фурацилина в мочевине человека. Капилляры, модифицированные DS, также подходят для разделения других азотсодержащих соединений и их энантиомеров.
Капилляры, модифицированные DS, также подходят для разделения других азотсодержащих соединений и их энантиомеров.
Другой вклад в этот специальный выпуск озаглавлен «Анализ противогрибковых компонентов в галлах Melaphis chinensis и их влияние на борьбу с антракнозом китайской капусты, вызываемым Colletotrichumighginsianum » П.-C. Kuo et al. (из Тайваня) и предложила грибковые патогены, вызывающие различные заболевания, которые привели к высокому урожаю и снижению качества растений, представляющих коммерческий интерес, таких как фрукты, овощи и цветы. В своих предварительных экспериментальных результатах метанольные экстракты четырех видов лекарственных растений, Melaphis chinensis , Eugenia caryophyllata , Polygonum cuspidatum и Rheum officinale, обладали противогрибковой активностью по отношению к возбудителю капусты коллекторной76. .Таким образом, это было проведено для идентификации и количественного определения химических компонентов в этих травах и для оценки противогрибкового действия этих соединений. Среди тестов индикаторное соединение метилгаллат из M. chinensis было наиболее эффективным против прорастания конидий. Кроме того, он продемонстрировал значительные эффекты контроля антракноза китайской капусты, вызванного C. Higginsianum PA-01 в камере роста. Эти результаты показывают, что M. chinensis может иметь потенциал для дальнейшей разработки пестицидов растительного происхождения для борьбы с антракнозом капусты и других крестоцветных культур.Результаты настоящего исследования показывают, что метанольные экстракты M. chinensis, E. caryophyllata , P. cuspidatum и R. officinale могут иметь потенциал для дальнейшей разработки пестицидов растительного происхождения для борьбы с антракнозом капусты. и другие крестоцветные культуры. Разработанные аналитические методы ВЭЖХ являются удобными и доступными инструментами для идентификации видов и оценки качества растительного сырья. Для разработки новых ботанических пестицидов полезно следить за содержанием активных компонентов в травах.
Среди тестов индикаторное соединение метилгаллат из M. chinensis было наиболее эффективным против прорастания конидий. Кроме того, он продемонстрировал значительные эффекты контроля антракноза китайской капусты, вызванного C. Higginsianum PA-01 в камере роста. Эти результаты показывают, что M. chinensis может иметь потенциал для дальнейшей разработки пестицидов растительного происхождения для борьбы с антракнозом капусты и других крестоцветных культур.Результаты настоящего исследования показывают, что метанольные экстракты M. chinensis, E. caryophyllata , P. cuspidatum и R. officinale могут иметь потенциал для дальнейшей разработки пестицидов растительного происхождения для борьбы с антракнозом капусты. и другие крестоцветные культуры. Разработанные аналитические методы ВЭЖХ являются удобными и доступными инструментами для идентификации видов и оценки качества растительного сырья. Для разработки новых ботанических пестицидов полезно следить за содержанием активных компонентов в травах.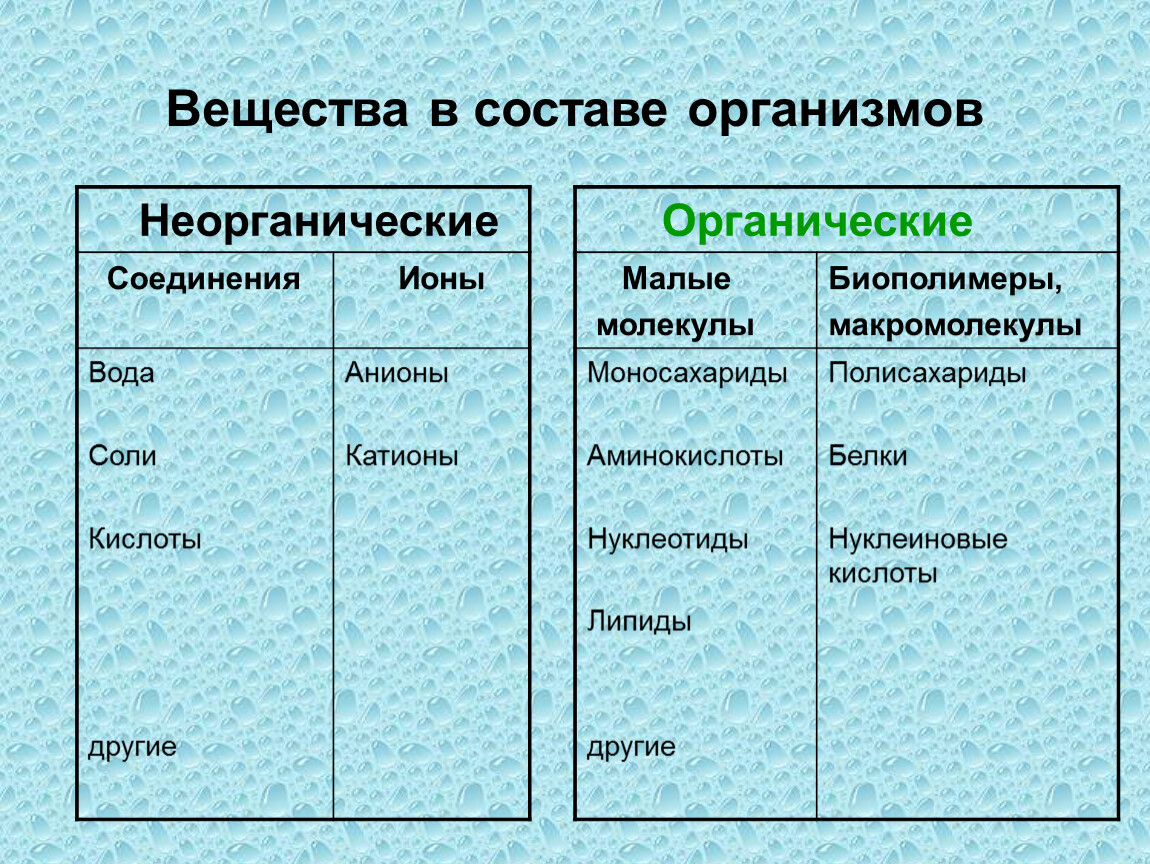 Согласно экспериментальным данным настоящего исследования, метилгаллат показал только 1/80 активности пестицида азоксистробина; однако экстракты трав будут более безопасными и менее опасными для экосистемы. Эти традиционные китайские лекарства могут быть дополнительно изучены на предмет их цитотоксичности и синергетического действия различных комбинаций. Было бы также возможно изучить противогрибковый механизм в будущем.
Согласно экспериментальным данным настоящего исследования, метилгаллат показал только 1/80 активности пестицида азоксистробина; однако экстракты трав будут более безопасными и менее опасными для экосистемы. Эти традиционные китайские лекарства могут быть дополнительно изучены на предмет их цитотоксичности и синергетического действия различных комбинаций. Было бы также возможно изучить противогрибковый механизм в будущем.
Обзорная статья М. Доловы и А. Пика под названием «Хроматографические методы разделения длинноцепочечных моно- и полиненасыщенных жирных кислот.В этом обзоре представлены различные хроматографические системы, ТСХ, ВЭЖХ, ГХ, а также SFC, разработанные для идентификации и точного количественного определения длинноцепочечных моно- и полиненасыщенных жирных кислот из различных образцов с акцентом на избранную литературу, опубликованную за последнее десятилетие. Обсуждались почти все аспекты, такие как стадия предварительного разделения жирных кислот ( цис — и транс -), стационарная фаза, система растворителей и режим обнаружения. Этот обзор литературы, посвященный применению хроматографических методов, таких как ТСХ, ВЭЖХ, ГХ, а также SFC, для анализа моно- и полиненасыщенных жирных кислот (MUFA и PUFA) в различных матрицах, показывает, что все представленные хроматографические методы методы подходят для предварительного разделения и количественного определения этих соединений.Выбор хроматографических систем зависит от типа анализируемой пробы и от цели хроматографического анализа (проблема, которую следует решить с помощью этого метода). На мгновение, чтобы получить полное фракционирование «транс- / цис-» жирных кислот из различных образцов, используется традиционная Ag-TLC или ВЭЖХ с аргентацией (Ag-HPLC). Колоночная хроматография, такая как ГХ и ВЭЖХ, может использоваться на дальнейших этапах хроматографического анализа ненасыщенных жирных кислот (MUFA и PUFA), особенно для определения количества разделенных жирных кислот.В случае геометрических изомеров ( цис, — и транс, -) и определения количества и положения двойных связей, присутствующих в исследуемых ненасыщенных жирных кислотах, популярны Ag-HPLC и различные системы ГХ.
Этот обзор литературы, посвященный применению хроматографических методов, таких как ТСХ, ВЭЖХ, ГХ, а также SFC, для анализа моно- и полиненасыщенных жирных кислот (MUFA и PUFA) в различных матрицах, показывает, что все представленные хроматографические методы методы подходят для предварительного разделения и количественного определения этих соединений.Выбор хроматографических систем зависит от типа анализируемой пробы и от цели хроматографического анализа (проблема, которую следует решить с помощью этого метода). На мгновение, чтобы получить полное фракционирование «транс- / цис-» жирных кислот из различных образцов, используется традиционная Ag-TLC или ВЭЖХ с аргентацией (Ag-HPLC). Колоночная хроматография, такая как ГХ и ВЭЖХ, может использоваться на дальнейших этапах хроматографического анализа ненасыщенных жирных кислот (MUFA и PUFA), особенно для определения количества разделенных жирных кислот.В случае геометрических изомеров ( цис, — и транс, -) и определения количества и положения двойных связей, присутствующих в исследуемых ненасыщенных жирных кислотах, популярны Ag-HPLC и различные системы ГХ. Текущая литература указывает, что инновации, которые внедряются в хроматографические системы, включают модифицированные стационарные фазы, новые дериватизирующие агенты для жирных кислот, а также разработку новых систем обнаружения, позволяющих проводить чувствительный и воспроизводимый анализ жирных кислот из сложных образцов.Более того, новые хроматографические системы в сочетании с другими инструментальными методами, такими как МС, МС / МС, ИК или двумерная ГХ, позволяют анализировать большое количество МНЖК и ПНЖК в меньших количествах, что требуется, например, при анализе пищевых продуктов. . Результаты, представленные в этой статье, подтверждают, что хроматографические методы по-прежнему являются мощным инструментом для анализа моно- и полиненасыщенных жирных кислот.
Текущая литература указывает, что инновации, которые внедряются в хроматографические системы, включают модифицированные стационарные фазы, новые дериватизирующие агенты для жирных кислот, а также разработку новых систем обнаружения, позволяющих проводить чувствительный и воспроизводимый анализ жирных кислот из сложных образцов.Более того, новые хроматографические системы в сочетании с другими инструментальными методами, такими как МС, МС / МС, ИК или двумерная ГХ, позволяют анализировать большое количество МНЖК и ПНЖК в меньших количествах, что требуется, например, при анализе пищевых продуктов. . Результаты, представленные в этой статье, подтверждают, что хроматографические методы по-прежнему являются мощным инструментом для анализа моно- и полиненасыщенных жирных кислот.
Последний обзор — обзорная статья в этом специальном выпуске; это от D. Datta et al., и он озаглавлен «Статус реактивной экстракции как метода разделения». В этой обзорной статье представлен современный обзор реактивного извлечения карбоновых кислот из ферментационных бульонов. В этой статье основное внимание уделяется реактивному извлечению, которое, как оказалось, является подходящим вариантом по сравнению с надлежащими методами извлечения. Были представлены механизмы родственных вторичных, третичных и четвертичных аминов и их реакции с карбоновыми кислотами (моно-, ди- и три-). Имеется сводка экспериментальных данных моделирования и их кинетических исследований.
В этой статье основное внимание уделяется реактивному извлечению, которое, как оказалось, является подходящим вариантом по сравнению с надлежащими методами извлечения. Были представлены механизмы родственных вторичных, третичных и четвертичных аминов и их реакции с карбоновыми кислотами (моно-, ди- и три-). Имеется сводка экспериментальных данных моделирования и их кинетических исследований.
Мы искренне надеемся, что такая серия ежегодных выпусков будет иметь долгосрочное влияние и за короткое время сможет собрать вокруг себя сообщество, во многом так же, как успешная ежегодная конференция.
Благодарности
Во-первых, мы выражаем искреннюю благодарность и признательность редакционной коллегии Journal of Chemistry за включение нашего специального выпуска в качестве ежегодного. Мы также хотели бы поблагодарить авторов этого специального выпуска за их научно обоснованные исследования / обзорные статьи.С большим удовольствием и уважением мы выражаем нашу благодарность рецензентам за критическую оценку каждой статьи, их конструктивную критику и своевременную реакцию, которая сделала возможным выпуск этого специального выпуска.
Хасан Услу
Драгомир Янков
Кайлас Л. Васевар
Саид Азизян
Наджиб Уллах
Вакар Ахмад
Что такое органическое соединение? [Видео]
Привет, и добро пожаловать в это видео о органических и неорганических соединениях. Сегодня мы рассмотрим как исторические, так и современные определения и попутно представим несколько примеров каждого из них.
Первоначальная классификация органических и неорганических соединений была сделана много веков назад, но с тех пор изменилась. Испытывая трепет перед живыми организмами, ранние ученые предположили, что между живыми и неживыми предметами должна быть фундаментальная разница. Это было основано на теории витализма , которая утверждала, что живые организмы приводятся в движение жизненной силой, которая делает их по своей сути отличными от их неодушевленных собратьев. Таким образом, ученые-виталисты классифицировали химические соединения живых организмов как органические, а соединения неживых вещей как неорганические. Считая, что люди не могут создавать или манипулировать жизненной силой живых организмов, химики считали невозможным синтезировать органические вещества из безжизненных неорганических соединений.
Считая, что люди не могут создавать или манипулировать жизненной силой живых организмов, химики считали невозможным синтезировать органические вещества из безжизненных неорганических соединений.
Лишь в начале 1800-х годов химики развенчали эту виталистскую теорию. Фридрих Велер синтезировал мочевину, основное азотсодержащее соединение в моче и, следовательно, органическое соединение, используя цианат калия и хлорид аммония, два неорганических соединения. При этом он продемонстрировал, что никакая жизненная сила не отделяет органические соединения от неорганических, и что последние могут быть использованы для создания первых.
Однако, хотя витализм был полностью опровергнут, номенклатура органического и неорганического продолжает жить в современной химии, но с обновленными определениями.
В широком смысле, по сегодняшнему определению, органические соединения — это вещества на основе углерода . Это фактически соответствует первоначальному виталистскому определению, потому что земные формы жизни фактически основаны на углероде. Следовательно, большинство химических соединений в организмах являются органическими по сегодняшнему определению. Например, ДНК, белков, , жиры и углеводы являются органическими соединениями.
Следовательно, большинство химических соединений в организмах являются органическими по сегодняшнему определению. Например, ДНК, белков, , жиры и углеводы являются органическими соединениями.
Однако, в отличие от определения виталистов, органические соединения не обязательно должны быть получены из живого организма, но могут быть синтезированы в лаборатории. Например, нейлон, полезный и популярный полимер, представляет собой синтетическое органическое соединение.
От простых углеродных цепочек, называемых алканами , насыщенных только водородом, до длинных сложных молекул, наполненных различными функциональными группами, есть миллионы органических соединений. Функциональные группы состоят из элементов в правом верхнем углу периодической таблицы (кислород, азот, сера, фосфор, кремний и галогены).
Органические соединения обычно представляют собой молекулярные твердые вещества, что означает, что они образуют автономные молекулярные единицы за счет ковалентной связи. В твердой и жидкой фазах эти звенья удерживаются вместе за счет слабых межмолекулярных взаимодействий, что приводит к более низким температурам плавления и кипения по сравнению со многими неорганическими соединениями.
В твердой и жидкой фазах эти звенья удерживаются вместе за счет слабых межмолекулярных взаимодействий, что приводит к более низким температурам плавления и кипения по сравнению со многими неорганическими соединениями.
Неорганические соединения обычно можно определить как соединения, не содержащие углерода. Очевидно, что это большая часть таблицы Менделеева, поэтому физические характеристики неорганических соединений сильно различаются, и их трудно резюмировать.Мы ежедневно сталкиваемся с множеством неорганических соединений, например, ионных соединений, таких как хлорид натрия; кварц в ваших часах — диоксид кремния; и вода, наиболее известное неорганическое соединение.
Может быть, в этот момент вы думаете про себя: «Ну, если в соединении есть углерод, я буду считать его органическим». К сожалению, хотя все органические соединения содержат углерод, не все углеродсодержащие соединения являются органическими.
Например, сплавы, содержащие углерод, считаются неорганическими. Сюда входит сталь, сплав железа и углерода. А аллотропы углерода, такие как графит и алмаз, не считаются органическими соединениями, потому что они просто один элемент, а не соединение элементов. Кроме того, простые оксиды, такие как монооксид углерода и диоксид углерода, также часто определяют как неорганические. На самом деле это может быть пережитком витализма, который считал углекислый газ неорганическим, потому что он был произведен из неодушевленных источников, таких как вулканы и минералы.
Сюда входит сталь, сплав железа и углерода. А аллотропы углерода, такие как графит и алмаз, не считаются органическими соединениями, потому что они просто один элемент, а не соединение элементов. Кроме того, простые оксиды, такие как монооксид углерода и диоксид углерода, также часто определяют как неорганические. На самом деле это может быть пережитком витализма, который считал углекислый газ неорганическим, потому что он был произведен из неодушевленных источников, таких как вулканы и минералы.
Таким образом, более строгое и, возможно, более полезное определение органических соединений требует, чтобы соединение имело углерод-водородные связи.Хотя даже у этого определения есть заметные исключения, такие как мочевина и четыреххлористый углерод, которые не содержат углерод-водородных связей, но считаются органическими. Кроме того, некоторые органические соединения образуют комплексы с металлами, которые обычно находятся в центре внимания химиков-неоргаников. Это дает начало промежуточным классификациям, таким как металлоорганические соединения и металлопротеины. Здесь, в геме, металлопротеине в гемоглобине, вы можете увидеть органическую структуру, сосредоточенную вокруг атома железа.
Здесь, в геме, металлопротеине в гемоглобине, вы можете увидеть органическую структуру, сосредоточенную вокруг атома железа.
Если все это кажется немного произвольным, это понятно, на самом деле не существует идеальных определений для органических и неорганических соединений.Даже ИЮПАК не дает конкретных определений.
Однако, несмотря на это, все же практично признать разницу между органическими и неорганическими веществами. Химия органических и неорганических соединений настолько различна, что имеет смысл преподавать их отдельно, а химикам — специализироваться на одном или другом. Например, поведение более крупных атомов металла может сильно отличаться от поведения более мелких атомов в органических соединениях, а синтетические методы, используемые для создания сложных органических молекул, требуют глубоких знаний, которые могут не иметь отношения к химикам-неорганикам.Таким образом, несмотря на некоторую двусмысленность в определениях, полезно иметь общее представление о том, какие соединения являются органическими, а какие неорганическими, поскольку для понимания каждого класса необходимы химические знания.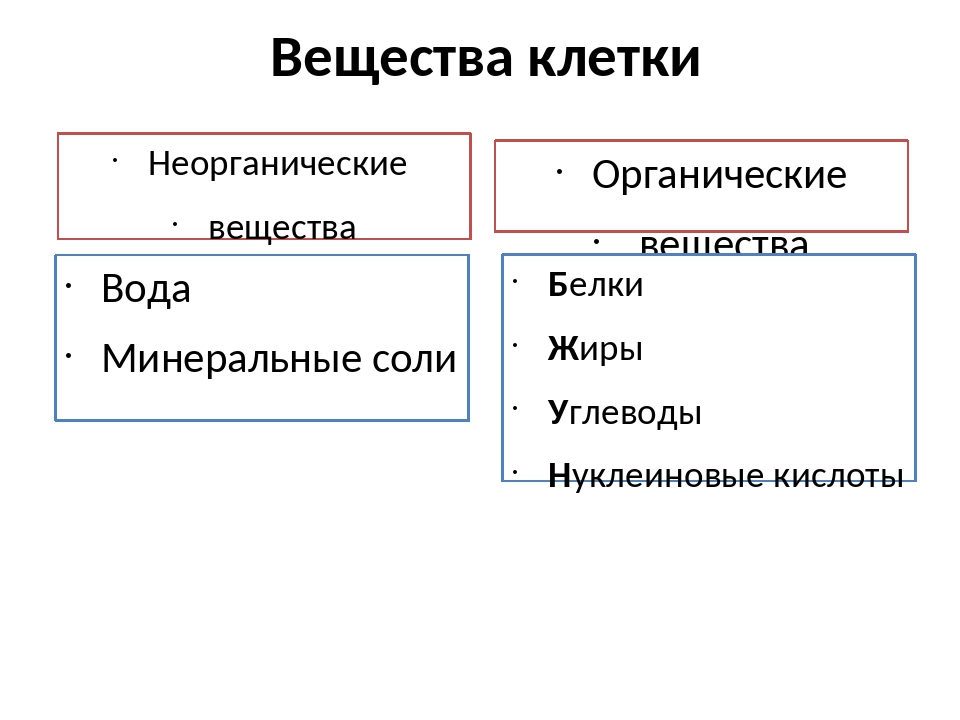
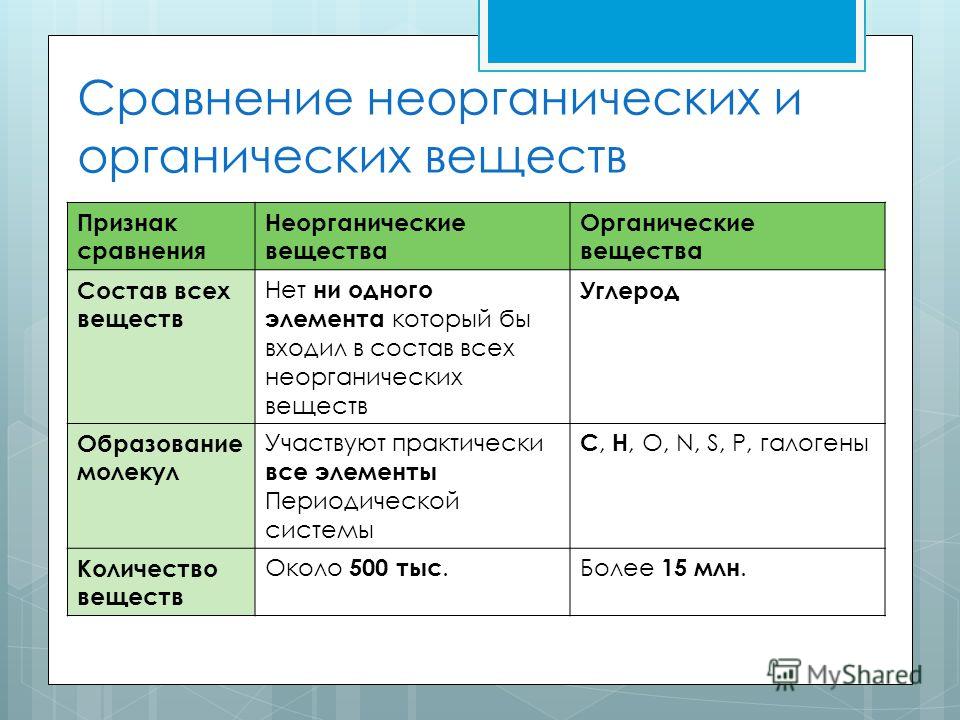
 Вещества кислотной природы известны для большинства химических элементов за… … Википедия
Вещества кислотной природы известны для большинства химических элементов за… … Википедия и органические – нигразин, хризоидин.… … Энциклопедия терминов, определений и пояснений строительных материалов
и органические – нигразин, хризоидин.… … Энциклопедия терминов, определений и пояснений строительных материалов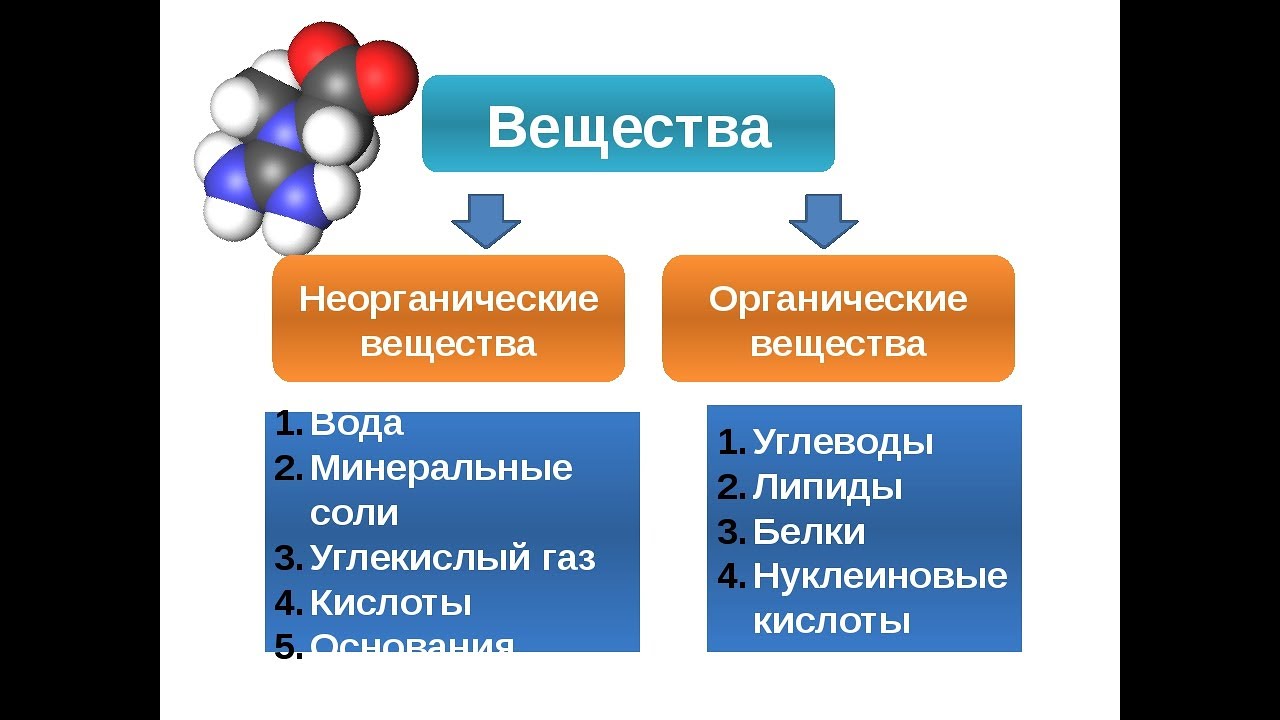 Кислотами называются соединения, которые в воде диссоциируют с высвобождением ионов водорода (Н+). Эти… … Энциклопедия Кольера
Кислотами называются соединения, которые в воде диссоциируют с высвобождением ионов водорода (Н+). Эти… … Энциклопедия Кольера

 Используйте минимально возможные числа.Этот
соединение, например, 2-метилпентан, а не 4-метилпентан.
Используйте минимально возможные числа.Этот
соединение, например, 2-метилпентан, а не 4-метилпентан.