Неорганическая химия. Весь школьный курс в таблицах — Манкевич Н.В., Литвинова С.А. | 978-985-579-296-4
Стоимость товара может отличаться от указанной на сайте!Наличие товара уточняйте в магазине или по телефону указанному ниже.
г. Воронеж, площадь Ленина, д.4
8 (473) 277-16-90
г. Липецк, проспект Победы, 19А
8 (4742) 22-00-28
г. Липецк, пл.Плеханова, д. 7
8 (4742) 47-02-53
8 (473) 247-22-55
г. Воронеж, ул. Плехановская, д. 33
8 (473) 252-57-43
г. Воронеж, ул. Ленинский проспект д.153
8 (473) 223-17-02
г. Нововоронеж, ул. Ленина, д.8
Нововоронеж, ул. Ленина, д.88 (47364) 92-350
г. Воронеж, ул. Хользунова, д. 35
8 (473) 246-21-08
г. Россошь, пр. Труда, д. 26А
8 (47396) 5-28-07
8 (4722) 42-48-42
г. Губкин, ул. Дзержинского,д. 115
8 (47241) 7-35-57
г.Воронеж, ул. Жилой массив Олимпийский, д.1
8 (473) 207-10-96
г. Воронеж, ул. Пушкинская, 2
8 (473) 300-41-49г. Липецк, ул.Стаханова,38 б
Липецк, ул.Стаханова,38 б
8 (4742) 78-68-01
8 (4725) 39-00-10
г. Воронеж, Московский пр-т, д. 129/1
8 (473) 269-55-64
ТРЦ «Московский Проспект», 3-й этаж
| 01.Вода02.Водород 03.Воздух 04.Бутлеров и теория строения 05.Углеводы 06.Строение атома 07.Менделеев 08.Периодический Закон Менделеева 1 09.Периодический Закон Менделеева 2 10.Периодический Закон Менделеева 3 11.Сера 12.Сера в природе 13.Получение Азота, Аммиака, Азотной кислоты 14. 15.Фосфор 16.Производство алюминия 17.Кристаллическое состояние вещества 18.Общие свойства растворов 19.Дисперсные системы 20.Энергетика Химических Процессов 21.Общие свойства P-элементов А. В. Мануйлов, В. И. РодионовВы зашли на образовательный сайт, в основу которого положен экспериментальный учебник по химии для 8-11 классов средней школы1). Здесь нет ошибки: учебник был написан как для начинающих химиков, так и для выпускников школ и абитуриентов. В последующие годы материал учебника серьезно перерабатывался и расширялся, однако от первоначального варианта неизменным осталось главное – структура разделов, отражающая нашу основную идею о том, что изучение химии должно строиться на основе знаний об атоме. Первоначально весь материал учебника был разбит на три уровня, но в интернет-издании число уровней сокращено до двух – базового и профильного. Наш базовый уровень ориентирован на успешную сдачу теоретических разделов ЕГЭ, а профильный уровень соответствует программе по химии для поступающих в Новосибирский государственный университет, которая несколько шире стандартных профильных программ. Профильный уровень следует читать вместе с 1-м уровнем. Читателям, желающим освоить только более легкий базовый уровень, можно пропускать разделы 2-го уровня (они помечены звездочками (**) и напечатаны темно-синим шрифтом). При этом целостность восприятия материала не нарушается. С помощью опубликованного здесь интернет-учебника можно не только начинать изучение химии «с нуля», но и повторять предмет для подготовки к серьезным экзаменам. Cтудентам он поможет восполнить пробелы в школьном образовании. К началу учебного года переработан материал практически всех глав первой книги. Сделаны более качественные иллюстрации. Оглавление первой книгиУдобнее читать учебник с помощью браузеров Internet Explorer или Google Chrome. Браузеры Mozilla, Opera и некоторые другие не всегда правильно отображают отдельные символы: стрелки, греческие буквы и т.д. Глава 1. Первоначальные химические понятия.
|
|
Химия. Весь школьный курс в таблицах, определениях и схемахMOBILE
Врублевский А.И.
есть в наличии
Аннотация
Данная книга представляет собой пособие по химии справочного характера, предназначенное для экспресс-повторения базового школьного курса химии непосредственно перед вступительными испытаниями. Широкое использование обобщающих схем, таблиц, рисунков позволило автору при сравнительно небольшом объеме книги представить практически весь материал школьной программы и программы для поступающих в вузы.
Пособие предназначено абитуриентам, старшеклассникам, педагогам, слушателям подготовительных курсов и отделений вузов.
Широкое использование обобщающих схем, таблиц, рисунков позволило автору при сравнительно небольшом объеме книги представить практически весь материал школьной программы и программы для поступающих в вузы.
Пособие предназначено абитуриентам, старшеклассникам, педагогам, слушателям подготовительных курсов и отделений вузов.
Дополнительная информация
| Регион (Город/Страна где издана): | Москва |
| Год публикации: | 2018 |
| Тираж: | 3000 |
| Дополнительный тираж: | Да |
| Страниц: | 384 |
| Формат: | 60×84/16 |
| Ширина издания: | 145 |
| Высота издания: | 200 |
| Тип иллюстраций: | черно-белые |
| Возраст от: | 18 |
| Полный список лиц указанных в издании: | Врублевский А.И. |
Как найти в магазине
| Этаж: 2 | Шкаф: 30. 01 01 |
| Зал: 1 | Полка: 3 |
Нет отзывов о товаре
С этим товаром покупают
Популярные книги автора
Неорганическая химия весь школьный курс. Химия
Если вы поступили в университет, но к этому времени так и не разобрались в этой нелегкой науке, мы готовы раскрыть вам несколько секретов и помочь изучить органическую химию с нуля (для «чайников»). Вам же остается только читать и внимать.
Основы органической химии
Органическая химия выделена в отдельный подвид благодаря тому, что объектом ее изучения является все, в составе чего есть углерод.
Органическая химия – раздел химии, который занимается изучением соединения углерода, структуру таких соединений, их свойства и методы соединения.
Как оказалось, углерод чаще всего образует соединения со следующими элементами — H, N, O, S, P. Кстати, эти элементы называются органогенами .
Органические соединения, количество которых сегодня достигает 20 млн, очень важны для полноценного существования всех живых организмов. Впрочем, никто и не сомневался, иначе человек просто закинул бы изучение этого непознанного в долгий ящик.
Цели, методы и теоретические представления органической химии представлены следующим:
- Разделение ископаемого, животного или растительного сырья на отдельные вещества;
- Очистка и синтез разных соединений;
- Выявление структуры веществ;
- Определение механики протекания химических реакций;
- Нахождение зависимости между структурой и свойствами органических веществ.
Немного из истории органической химии
Вы можете не верить, но еще в далекой древности жители Рима и Египта понимали кое-что в химии.
Как мы знаем, они пользовались натуральными красителями. А нередко им приходилось использовать не готовый естественный краситель, а добывать его, вычленяя из цельного растения (например, содержащиеся в растениях ализарин и индиго).
Можем вспомнить и культуру употребления алкоголя. Секреты производства спиртных напитков известны в каждом народе. Причем многие древние народы знали рецепты приготовления «горячей воды» из крахмал- и сахарсодержащих продуктов.
Так продолжалось долгие, долгие годы, и только в 16-17 веках начались какие-то изменения, небольшие открытия.
В 18 веке некто Шееле научился выделять яблочную, винную, щавелевую, молочную, галловую и лимонную кислоту.
Тогда всем стало ясно, что продукты, которые удалось выделить из растительного или животного сырья, имели много общих черт. В то же время они сильно отличались от неорганических соединений. Поэтому служителям науки нужно было срочно выделить их в отдельный класс, так и появился термин «органическая химия».
Несмотря на то, что сама органическая химия как наука появилась лишь в 1828 году (именно тогда господину Вёлеру удалось выделить мочевину путем упаривания цианата аммония), в 1807 году Берцелиус ввел первый термин в номенклатуру в органической химии для чайников:
Раздел химии, который изучает вещества, полученные из организмов.
Следующий важный шаг в развитии органический химии – теория валентности, предложенная в 1857 году Кекуле и Купером, и теория химического строения господина Бутлерова от 1861 года. Уже тогда ученые стали обнаруживать, что углерод – четырехвалентен и способен образовывать цепи.
Уже тогда ученые стали обнаруживать, что углерод – четырехвалентен и способен образовывать цепи.
В общем, с эти самых пор наука регулярно испытывала потрясения и волнения благодаря новым теориям, открытиям цепочкам и соединениям, что позволяло так же активно развиваться органической химии.
Сама наука появилась благодаря тому, что научно-технический прогресс не в состоянии был стоять на месте. Он продолжал и продолжал шагать, требуя новых решений. И когда каменноугольной смолы в сфере промышленности перестало хватать, людям просто пришлось создать новый органический синтез, который со временем перерос в открытие невероятно важного вещества, которое и по сей день дороже золота – нефть. Кстати, именно благодаря органической химии на свет появилась ее «дочка» — поднаука, которая получила название «нефтехимия».
Но это уже совсем другая история, которую вы можете изучить сами. Далее мы предлагаем вам посмотреть научно-популярное видео про органическую химию для чайников:
Ну а если вам некогда и срочно нужна помощь профессионалов , вы всегда знаете, где их найти.
Е.Н.ФРЕНКЕЛЬ
Пособие для тех, кто не знает, но хочет узнать и понять химию
Я, Френкель Евгения Николаевна, заслуженный работник высшей школы РФ, выпускница химического факультета МГУ 1972 г., педагогический стаж 34 года. Кроме того, я мать троих детей и бабушка четырех внуков, старший из которых школьник.
Меня волнует проблема школьных учебников. Главная беда многих из них – тяжелый язык, который требует дополнительного «перевода» на понятный школьнику язык изложения учебного материала. Ко мне часто обращаются ученики средней школы с такой просьбой: «Переведите текст учебника, чтобы понятно было». Поэтому я написала «Самоучитель по химии», в котором многие сложные вопросы изложены вполне доступно и в то же время научно. На основе этого «Самоучителя», который был написан в 1991 г.
, я разработала программу и содержание подготовительных курсов. На них обучались сотни школьников. Многие из них начинали с нуля и за 40 занятий понимали предмет настолько, что сдавали экзамены на «4» и «5». Поэтому в нашем городе мои пособия-самоучители расходятся как горячие пирожки.
Может, и другим пригодятся мои наработки?
Статья подготовлена при поддержке учебного центра «МакарОФФ». Учебный центр предлагает Вам пройти курсы маникюра в Москве недорого . Профессиональная школа маникюра проводит обучение по маникюру, педикюру, наращиванию и дизайну ногтей, а также курсы мастеров-универсалов ногтевого сервиса, наращивание ресниц, микроблейдинг, шугаринг и эпиляция воском. Центр выдаёт дипломы после обучения и гарантированное трудоустройство. Подробная информация обо всех программах обучения, цены, расписание, акции и скидки, контакты на сайте: www.akademiyauspeha.ru .
Уважаемые читатели! Предлагаемый вашему вниманию «Самоучитель по химии» – не обычный учебник. В нем не просто излагаются какие-то факты или описываются свойства веществ. «Самоучитель» объясняет и учит даже в том случае, если вы, к сожалению, не знаете и не понимаете химии, а к учителю обратиться за разъяснениями не можете или стесняетесь. В виде рукописи эта книга используется школьниками с 1991 г., и не было ни одного ученика, который бы провалился на экзамене по химии и в школе, и в вузах. Причем многие из них совсем не знали химии.
«Самоучитель» рассчитан на самостоятельную работу ученика. Главное – отвечать по ходу чтения на те вопросы, которые встречаются в тексте. Если вы не смогли ответить на вопрос, то читайте внимательнее текст еще раз – все ответы имеются рядом. Желательно также выполнять все упражнения, которые встречаются по ходу объяснения нового материала. В этом помогут многочисленные обучающие алгоритмы, которые практически не встречаются в других учебниках. С их помощью вы научитесь:
Составлять химические формулы по валентности;
Составлять уравнения химических реакций, расставлять в них коэффициенты, в том числе в уравнениях окислительно-восстановительных процессов;
Составлять электронные формулы (в том числе краткие электронные формулы) атомов и определять свойства соответствующих химических элементов;
Предсказывать свойства
некоторых соединений и определять, возможен
данный процесс или нет.
В пособии два уровня сложности. Самоучитель первого уровня сложности состоит из трех частей.
I часть. Элементы общей химии (публикуемая ).
II часть. Элементы неорганической химии.
III часть. Элементы органической химии.
Книг второго уровня сложности тоже три.
Теоретические основы общей химии.
Теоретические основы неорганической химии.
Теоретические основы органической химии.
Глава 1. Основные понятия химии.
Глава 2. Важнейшие классы неорганических соединений.
Глава 3. Элементарные сведения о строении атома. Периодический закон Д.И.Менделеева.
Глава 4. Понятие о химической связи. Глава 5. Растворы. Глава 6. Электролитическая диссоциация.
Глава 7. Понятие об окислительно-восстановительных реакциях. Глава 8. Расчеты по химическим формулам и уравнениям.
Приложение. |
Что такое химия? Где мы встречаемся с химическими явлениями?
Химия – везде. Сама жизнь – это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов.
Что изучает химия?
Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества.
Что такое вещество?
Вещество – это то, из чего состоит окружающий нас мир и мы сами.
Что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество*. Изменились молекулы – изменилось вещество (оно стало другим), изменились его свойства. Например, свежее молоко стало кислым, зеленые листья стали желтыми, сырое мясо при обжаривании изменило запах.
Все эти изменения – следствие сложных и многообразных химических процессов. Однако признаки простых химических реакций, в результате которых изменяется состав и строение молекул, такие же: изменение цвета, вкуса или запаха, выделение газа, света или тепла, появление осадка.
Что же такое молекулы, изменение которых влечет за собой столь разнообразные проявления?
Молекулы – это мельчайшие частицы вещества, отражающие его качественный и количественный состав и его химические свойства.
Изучая состав и строение одной молекулы, можно предсказать многие свойства данного вещества в целом. Такие исследования – одна из главных задач химии.
Как устроены молекулы? Из чего они состоят?
Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака). Например, Н – атом водорода, О – атом кислорода.
Число атомов в молекуле обозначают при помощи индекса
– цифры внизу справа после символа.
Например:
Примеры молекул:
О 2 – это молекула вещества кислорода, состоящая из двух атомов кислорода;
Н 2 О – это молекула вещества воды, состоящая из двух атомов водорода и одного атома кислорода.
Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента – цифры перед символом:
Аналогично изображают число молекул:
2Н 2 – две молекулы водорода;
3Н 2 О – три молекулы воды.
Почему атомы водорода и кислорода имеют разные названия и разные символы? Потому что это атомы разных химических элементов.
Химический элемент – это вид атомов с одинаковым зарядом ядер.
Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях, из чего состоит атом?
Нейтральный атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов:
В ходе химических реакций число электронов любого атома может изменяться, а вот заряд ядра атома не меняется . Поэтому заряд ядра атома – своеобразный «паспорт» химического элемента. Все атомы с зарядом ядра +1 принадлежат химическому элементу под названием водород. Атомы с зарядом ядра +8 относятся к химическому элементу кислороду.
Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Д.И.Менделеева (порядковый номер равен заряду ядра атома), определенное название, а для некоторых химических элементов – особое прочтение символа в химической формуле (табл. 1).
Таблица 1
Символы (знаки) химических элементов
| № п/п | № в таблице
Д. И.Менделеева И.Менделеева | Символ | Прочтение в формуле | Название |
| 1 | 1 | H | аш | Водород |
| 2 | 6 | C | це | Углерод |
| 3 | 7 | N | эн | Азот |
| 4 | 8 | O | о | Кислород |
| 5 | 9 | F | фтор | Фтор |
| 6 | 11 | Na | натрий | Натрий |
| 7 | 12 | Mg | магний | Магний |
| 8 | 13 | Al | алюминий | Алюминий |
| 9 | 14 | Si | силициум | Кремний |
| 10 | 15 | P | пэ | Фосфор |
| 11 | 16 | S | эс | Сера |
| 12 | 17 | Cl | хлор | Хлор |
| 13 | 19 | K | калий | Калий |
| 14 | 20 | Ca | кальций | Кальций |
| 15 | 23 | V | ванадий | Ванадий |
| 16 | 24 | Cr | хром | Хром |
| 17 | 25 | Mn | марганец | Марганец |
| 18 | 26 | Fe | феррум | Железо |
| 19 | 29 | Cu | купрум | Медь |
| 20 | 30 | Zn | цинк | Цинк |
| 21 | 35 | Br | бром | Бром |
| 22 | 47 | Ag | аргентум | Серебро |
| 23 | 50 | Sn | станнум | Олово |
| 24 | 53 | I | йод | Йод |
| 25 | 56 | Ba | барий | Барий |
| 26 | 79 | Au | аурум | Золото |
| 27 | 80 | Hg | гидраргирум | Ртуть |
| 28 | 82 | Pb | плюмбум | Cвинец |
Вещества бывают простые и сложные . Если молекула состоит из атомов одного
химического элемента, это простое вещество. Простые
вещества – Са, Сl 2 , О 3 , S 8 и т. д.
Если молекула состоит из атомов одного
химического элемента, это простое вещество. Простые
вещества – Са, Сl 2 , О 3 , S 8 и т. д.
Молекулы сложных веществ состоят из атомов разных химических элементов. Сложные вещества – H 2 O, NO, H 3 PO 4, C 12 H 22 O 11 и т. д.
Задание 1.1. Укажите число атомов в молекулах сложных веществ H 2 O, NO, H 3 PO 4 , C 12 H 22 O 11 , назовите эти атомы.
Возникает вопрос: почему для воды всегда записывается формула Н 2 О, а не НО или НО 2 ? Опыт доказывает, что состав воды, полученной любым способом или взятой из любого источника, всегда соответствует формуле Н 2 О (речь идет о чистой воде).
Дело в том, что атомы в молекуле воды и в молекуле любого другого вещества соединены при помощи химических связей. Химическая связь соединяет как минимум два атома. Поэтому, если молекула состоит из двух атомов и один из них образует три химические связи, то другой также образует три химические связи.
Число химических связей , образуемых атомом, называют его валентностью .
Если обозначить каждую химическую связь черточкой, то для молекулы из двух атомов АБ получим АБ, где тремя черточками показаны три связи, образуемые элементами А и Б между собой.
В данной молекуле атомы А и Б трехвалентны.
Известно, что атом кислорода двухвалентен, атом водорода одновалентен.
В о п р о с. Сколько атомов водорода может присоединиться к одному атому кислорода?
О т в е т. Два атома. Состав воды описывают формулой Н–О–Н, или Н 2 О.
П о м н и т е! В устойчивой молекуле не может быть «свободных», «лишних» валентностей. Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).
Таблица 2
Значение постоянных валентностей некоторых элементов
Для других атомов валентность** можно определить (вычислить)
из химической формулы вещества. При этом нужно
учитывать изложенное выше правило о химической
связи. Например, определим валентность x марганца Mn по формуле вещества MnO 2:
При этом нужно
учитывать изложенное выше правило о химической
связи. Например, определим валентность x марганца Mn по формуле вещества MnO 2:
Общее число химических связей, образуемых
одним и другим элементом (Mn и О), одинаково:
x · 1 = 4; II · 2 = 4. Отсюда х = 4, т.е. в этой
химической формуле марганец четырехвалентен.
П р а к т и ч е с к и е в ы в о д ы
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т.е. валентность одного элемента равна индексу другого элемента:
Задание 1.2. Определите валентности элементов в соединениях:
CO 2 , CO, Mn 2 O 7 , Cl 2 O, P 2 O 3 , AlP, Na 2 S, NH 3 , Mg 3 N 2 .
П о д с к а з к а. Сначала укажите валентность атомов, у которых она постоянная. Аналогично определяется валентность атомных групп ОН, РО 4 , SО 4 и др.
Задание 1.3. Определите валентности атомных групп (в формулах подчеркнуты):
H 3 PO 4 , Ca(OH ) 2 , Ca 3 (PO 4) 2 , H 2 SO 4 , CuSO 4 .
(Обратите внимание! Одинаковые группы атомов имеют одинаковые валентности во всех соединениях.)
Зная валентности атома или группы атомов, можно составить формулу соединения. Для этого пользуются следующими правилами.
Если валентности атомов одинаковы, то и число атомов одинаково, т.е. индексы не ставим:
Если валентности кратны (обе делятся на одно и то же число), то число атомов элемента с меньшей валентностью определяем делением:
В остальных случаях индексы определяют «крест-накрест»:
Задание 1. 4. Составьте химические формулы
соединений:
4. Составьте химические формулы
соединений:
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением реакции . Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
С + O 2 = CO 2 .
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O 2 , образует одну молекулу углекислого газа СО 2 . Число атомов каждого химического элемента до и после реакции должно быть одинаково . Это правило – следствие закона сохранения массы вещества. Закон сохранения массы: масса исходных веществ равна массе продуктов реакции.
Закон был открыт в XVIII в. М.В.Ломоносовым и, независимо от него, А.Л.Лавуазье.
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли KClO 3 получается соль KСl и кислород О 2:
KClO 3 KСl + О 2 .
Число атомов калия и хлора одинаково, а кислорода – разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
Наконец, между правой и левой частями уравнения можно поставить знак равенства:
2KClO 3 = 2KСl + 3О 2 .
Полученная запись показывает, что при разложении сложного вещества KClO 3 получаются два новых вещества – сложное KСl и простое – кислород O 2 . Числа перед формулами веществ в уравнениях химических реакций называют коэффициентами .
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым. Составим уравнение реакции веществ CaCl 2 и Na 3 PO 4:
CaCl 2 + Na 3 PO 4 ……………… .
П о с л е д о в а т е л ь н о с т ь д е й с т в и й
1) Определим валентность исходных атомов и группы PO 4:
2) Напишем правую часть уравнения (пока без индексов, формулы веществ в скобках надо уточнить):
3) Составим химические формулы полученных веществ по валентностям составных частей:
4) Обратим внимание на состав самого сложного соединения Ca 3 (PO 4) 2 и уравняем число атомов кальция (их три) и число групп РО 4 (их две):
5) Число атомов натрия и хлора до реакции теперь стало равным шести. Поставим соответствующий коэффициент в правую часть схемы перед формулой NaCl:
3CaCl 2 + 2Na 3 PO 4 = Ca 3 (PO 4) 2 + 6NaCl.
Пользуясь такой последовательностью, можно уравнять схемы многих химических реакций (за исключением более сложных окислительно-восстановительных реакций, см. главу 7).
Типы химических реакций. Химические реакции бывают разных типов. Основными являются четыре типа – соединение, разложение, замещение и обмен.
1. Реакции соединения – из двух и более веществ образуется одно вещество:
Например:
Са + Сl 2 = CaCl 2 .
2. Реакции разложения – из одного вещества получаются два вещества или более:
Например:
Ca(HCO 3) 2 CaCO 3 + CO 2 + H 2 O.
3. Реакции замещения – реагируют простое и сложное вещества, образуются также простое и сложное вещества, причем простое вещество замещает часть атомов сложного вещества:
А + ВХ АХ + В.
Например:
Fe + CuSO 4 = Cu + FeSO 4 .
4. Реакции обмена – здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
Упражнения к главе 1
1. Выучите табл. 1. Проверьте себя, напишите химические символы: серы, цинка, олова, магния, марганца, калия, кальция, свинца, железа и фтора.
2. Напишите символы химических элементов,
которые в формулах произносятся как: «аш», «о»,
«купрум», «эс», «пэ», «гидраргирум», «станнум»,
«плюмбум», «эн», «феррум», «це», «аргентум».
Назовите эти элементы.
Напишите символы химических элементов,
которые в формулах произносятся как: «аш», «о»,
«купрум», «эс», «пэ», «гидраргирум», «станнум»,
«плюмбум», «эн», «феррум», «це», «аргентум».
Назовите эти элементы.
3. Укажите число атомов каждого химического элемента в формулах соединений:
Al 2 S 3 , СаS, МnО 2 , NH 3 , Mg 3 P 2 , SO 3 .
4. Определите, какие из веществ – простые, а какие – сложные:
Na 2 O, Na, O 2 , CaCl 2 , Cl 2 .
Прочитайте формулы этих веществ.
5. Выучите табл. 2. Составьте химические формулы веществ по известной валентности элементов и атомных групп:
6. Определите валентность химических элементов в соединениях:
N 2 O, Fe 2 O 3 , PbO 2 , N 2 O 5, HBr, SiH 4 , H 2 S, MnO, Al 2 S 3 .
7. Расставьте коэффициенты и укажите типы химических реакций:
а) Mg + O 2 MgO;
б) Al + CuCl 2 AlCl 3 + Cu;
в) NaNO 3 NaNO 2 + O 2 ;
г) AgNO 3 + BaCl 2 AgCl + Ba(NO 3) 2 ;
д) Al + HCl AlCl 3 + H 2 ;
е) KOH + H 3 PO 4 K 3 PO 4 + H 2 O;
ж) CH 4 C 2 H 2 + H 2 .
* Существуют вещества, построенные не из молекул. Но об этих веществах речь пойдет позже (см. главу 4).
** Строго говоря, по нижеизложенным правилам определяют не валентность, а степень окисления (см. главу 7). Однако во многих соединениях числовые значения этих понятий совпадают, поэтому по формуле вещества можно определять и валентность.
Печатается с продолжением
М.: 201 7. — 3 51 с.
Самоучитель основан на методике, которую автор с
успехом использует более 20 лет. С её помощью множество школьников смогли
поступить на химические факультеты и в медицинские вузы. Эта книга — именно
Самоучитель, а не Учебник. Вы не столкнётесь здесь с простым описанием научных
фактов и свойств веществ. Материал структурирован таким образом, что,
встретившись со сложными вопросами, которые вызывают затруднения, вы сразу же
найдёте пояснение автора. В конце каждой главы приводятся проверочные задания и
упражнения для закрепления материала. Любознательному читателю, который просто
хочет расширить свой кругозор, Самоучитель даст возможность освоить этот предмет
«с нуля». Прочитав его, вы не сможете не влюбиться в эту интереснейшую науку —
химию!
В конце каждой главы приводятся проверочные задания и
упражнения для закрепления материала. Любознательному читателю, который просто
хочет расширить свой кругозор, Самоучитель даст возможность освоить этот предмет
«с нуля». Прочитав его, вы не сможете не влюбиться в эту интереснейшую науку —
химию!
Формат: pdf
Размер: 2,7 Мб
Смотреть, скачать: drive.google
Оглавление
От автора 7
ЧАСТЬ 1. ЭЛЕМЕНТЫ ОБЩЕЙ ХИМИИ 9
Глава 1. Основные понятия и законы предмета «Химия» 9
1.1. Простейшие понятия: вещество, молекула, атом, химический элемент 9
1.2. Простые и сложные вещества. Валентность 13
1.3. Уравнения химических реакций 17
Глава 2. Основные классы неорганических соединений 23
2.1. Оксиды 23
2.2. Кислоты 32
2.3. Основания 38
2.4. Соли 44
Глава 3. Элементарные сведения о строении атома 55
3.1. Структура Периодической системы Менделеева 55
3.2. Ядро атома. Изотопы 57
3.3. Распределение электронов в поле ядра атома 60
3.4. Строение атома и свойства элементов 65
Глава 4. Понятие о химической связи 73
4.1. Ионная связь 73
4.2. Ковалентная связь 75
4.3. Химическая связь и агрегатные состояния вещества. Кристаллические решётки
80
Глава 5. Скорость химической реакции 87
5.1. Зависимость скорости химической реакции от различных факторов 87
5.2. Обратимость химических процессов. Принцип Ле-Шателье 95
Глава 6. Растворы 101
6.1. Понятие о растворах 101
6.2. Электролитическая диссоциация 105
6.3. Ионно-молекулярные уравнения реакций 111
6.4. Понятие о рН (водородном показателе) 113
6.5. Гидролиз солей 116
Глава 7. Понятие об окислительно-восстановительных реакциях123
ЧАСТЬ 2. ЭЛЕМЕНТЫ НЕОРГАНИЧЕСКОЙ ХИМИИ 130
Глава 8. Общие свойства металлов 130
8.1. Внутреннее строение и физические свойства металлов 131
8.2. Сплавы 133
8.3. Химические свойства металлов 135
8. 4. Коррозия металлов 139
4. Коррозия металлов 139
Глава 9. Щелочные и щёлочноземельные металлы 142
9.1. Щелочные металлы 142
9.2. Щелочноземельные металлы 145
Глава 10. Алюминий 153
Глава 11. Железо 158
11.1. Свойства железа и его соединений 158
11.2. Получение железа (чугуна и стали) 160
Глава 12. Водород и кислород 163
12.1. Водород 163
12.2. Кислород 165
12.3. Вода 166
Глава 13. Углерод и кремний 170
13.1. Строение атома и свойства углерода 170
13.2. Свойства соединений углерода 173
13.3. Строение атома и свойства кремния 176
13.4. Кремниевая кислота и силикаты 178
Глава 14. Азот и фосфор 182
14.1. Строение атома и свойства азота 182
14.2. Аммиак и соли аммония 184
14.3. Азотная кислота и её соли 187
14.4. Строение атома и свойства фосфора 189
14.5. Свойства и значение соединений фосфора 191
Глава 15. Сера 195
15.1. Строение атома и свойства серы 195
15.2. Сероводород 196
15.3. Сернистый газ и сернистая кислота 197
15.4. Серный ангидрид и серная кислота 198
Глава 16. Галогены 202
16.1. Строение атома и свойства галогенов 202
16.2. Соляная кислота 205
РАЗДЕЛ 3. ЭЛЕМЕНТЫ ОРГАНИЧЕСКОЙ ХИМИИ 209
Глава 17. Основные понятия органической химии 210
17.1. Предмет органической химии. Теория строения органических веществ 210
17.2. Особенности строения органических соединений 212
17.3. Классификация органических соединений 213
17.4. Формулы органических соединений 214
17.5. Изомерия 215
17.6. Гомологи 217
17.7. Названия углеводородов. Правила международной номенклатуры 218
Глава 18. Алканы 225
18.1. Понятие об алканах 225
18.2. Гомологический ряд, номенклатура, изомерия 225
18.3. Строение молекул 226
18.4. Свойства алканов 226
18.5. Получение и применение алканов 229
Глава 19. Алкены 232
19.1. Гомологический ряд, номенклатура, изомерия 232
19. 2. Строение молекул 234
2. Строение молекул 234
19.3. Свойства алкенов 234
19.4. Получение и применение алкенов 238
19.5. Понятие об алкадиенах (диены) 239
Глава 20. Алкины 244
20.1. Определение. Гомологический ряд, номенклатура, изомерия 244
20.2. Строение молекул 245
20.3. Свойства алкинов 246
20.4. Получение и применение ацетилена 248
Глава 21. Циклические углеводороды. Арены 251
21.1. Понятие о циклических углеводородах. Циклоалканы 251
21.2. Понятие об ароматических углеводородах 252
21.3. История открытия бензола. Строение молекулы 253
21.3. Гомологический ряд, номенклатура, изомерия 255
21.4. Свойства бензола 256
21.5. Свойства гомологов бензола 259
21.6. Получение бензола и его гомологов 261
Глава 22. Спирты 263
22.1. Определение 263
22.2. Гомологический ряд, номенклатура, изомерия 264
22.3. Строение молекул 265
22.4. Свойства одноатомных спиртов 266
22.5. Получение и применение спиртов (на примере этилового спирта) 268
22.6. Многоатомные спирты 269
22.7. Понятие о фенолах 271
Глава 23. Альдегиды 276
23.1. Определение. Гомологический ряд, номенклатура, изомерия 276
23.2. Строение молекул 277
23.3. Свойства альдегидов 278
23.4. Получение и применение альдегидов на примере уксусного альдегида 280
Глава 24. Карбоновые кислоты 282
24.1. Определение 282
24.2. Гомологический ряд, номенклатура, изомерия 283
24.3. Строение молекул 284
24.4. Свойства кислот 285
24.5. Получение и применение кислот 287
Глава 25. Сложные эфиры. Жиры 291
Глава 26. Углеводы 297
Глава 27. Азотсодержащие соединения 304
27.1. Амины 304
27.2. Аминокислоты 306
27.3. Белки 308
Глава 28. Понятие о полимерах 313
ЧАСТЬ 4. РЕШЕНИЕ ЗАДАЧ 316
Глава 29. Основные расчётные понятия 317
Глава 30. Задачи, решаемые по стандартным формулам 320
30.1. Задачи по теме «Газы» 320
30.2. Задачи по теме «Способы выражения концентрации растворов» 324
Глава 31. Задачи, решаемые по уравнениям реакций 330
Задачи, решаемые по уравнениям реакций 330
31.1. Оформление расчётов по уравнениям реакций 330
31.2. Задачи по теме «Количественный состав смесей» 333
31.3. Задачи на «избыток-недостаток» 337
31.4. Задачи на установление формулы вещества 342
31.5. Задачи, в которых учитывается «выход» полученного вещества 349
Всем известно, что школьный курс является той основой, которая дает самые необходимые знания о мире, в котором мы живем. Это действительно так и такой предмет как химия прекрасное тому подтверждение, так как, по сути, абсолютно все, что нас окружает и есть химия — химические элементы, их соединения, процессы взаимодействия и т.д. Поэтому неудивительно, что в школьный курс входит много тем по химии .
Важность изучения химииИзучая предмет химии, школьник не только познает мир и определенные законы его существования, но и развивает память, логическое и абстрактное мышление, аналитические способности и интеллектуальные возможности в целом. ЕГЭ по химии, который является предметом по выбору, есть ни что иное как закономерное подведение итогов учебно-образовательной деятельности.
Кроме того, успешная сдача ЕГЭ по химии после окончания школы облегчит получение высшего образования, ведь его результаты высшими учебными заведениями засчитываются как вступительные экзамены. Поэтому нужно относиться к этому экзамену как к важному этапу в вашем будущем. Благодаря полученным знаниям будет проще потом осваивать другие сложные предметы в университете.
Что представляет собой подготовка к ЕГЭ по химииКонечно, залогом успешного изучения и усвоения материала является постоянная работа — это касается абсолютно всех предметов. Однако такой специфический предмет как химия, зачастую требует особого подхода и применения дополнительных методов обучения. Например, таковыми являются самостоятельная работа или систематические занятия с репетитором. Но что делать, когда возможности для дополнительных занятий с преподавателем нет, а некоторые разобрать по учебнику практически не реально, впрочем, как и систематизировать все полученные знания, когда это необходимо для подготовки к ЕГЭ по химии?
Сегодня существует прекрасная возможность для дополнительного образования, расширения, углубления знаний и закрепления пройденных материалов — химия онлайн бесплатно. Такие уроки основаны на многолетнем педагогическо-психологическом опыте. Всемирная сеть в этом случае становится надежным другом и помощником современной молодежи, предлагая изучение различных тем по химии, включая различные методы подачи материала — видеоуроки с пояснениями, примерами опытов, решением практических задач и многое другое, систематизированные оптимальным образом электронные конспекты и таблицы.
Такие уроки основаны на многолетнем педагогическо-психологическом опыте. Всемирная сеть в этом случае становится надежным другом и помощником современной молодежи, предлагая изучение различных тем по химии, включая различные методы подачи материала — видеоуроки с пояснениями, примерами опытов, решением практических задач и многое другое, систематизированные оптимальным образом электронные конспекты и таблицы.
Эта наука столь сложна, сколь и интересна. Однако уроки химии онлайн позволяют наиболее эффективно усвоить даже самую сложную тему, а при необходимости — проконсультироваться с квалифицированным преподавателем, в том числе и по вопросам, касающимся ЕГЭ по химии. Все это делает обучение легким и понятным, каждый может избежать сложных вопросов, разобраться в темах, которые пропустил ранее.
ИтогоЗанимаясь химией онлайн и бесплатно , вы в доступной для усвоения форме перенимаете многолетний опыт и получаете багаж систематизированных знаний. Каждый может выбрать для себя различные режимы и варианты обучения. Выпускники могут повторять пройденный в школе материал и восполнять имеющиеся пробелы в знаниях, выполняя задания различной сложности и изучая темы по химии по той системе, на которой и основан ЕГЭ. Конечно, готовых ответов никто не предоставит, тем более что каждый год список вопросов и заданий меняется. Однако структура в основном остается прежней, позволяя разработчикам совершенствовать эффективность оценки, а учащимся — наиболее полно раскрывать свой потенциал. Возможно, это поможет и школам показывать лучшую успеваемость своих учеников.
Кроме того, уроки химии онлайн — это удобно, а также может пригодиться как практикующим преподавателям для перенятия опыта, так и родителям, для того чтобы быть в курсе того, как сегодня строится процесс обучения их детей. Занятия химией онлайн помогут освежить знания будущим абитуриентам, желающим получить еще одно образование. Поэтому трудно поспорить с тем, что благодаря возможностям Интернета учиться становится проще абсолютно всем.
Наука химия очень интересна, и знание её может пригодиться в жизни абсолютно каждому человеку. Но оказывается, что не так легко её понять, изучая по школьному учебнику, особенно с учётом того, что у преподавателя далеко не всегда есть время ответить на все вопросы учащихся. Эта книга-самоучитель, составленная Е. Н. Френкелем, как раз создана для того, чтобы найти в ней ответы на все свои вопросы.
Информация в книге подаётся таким образом, чтобы она была максимально понятна, т.е. здесь нет просто сухих фактов. Можно прочитать теоретическое положение и сразу же увидеть пояснения, которых нет в обычных учебниках. Также в книге разбираются способы решения задач, даются задания для закрепления материала и вставлены задания, встречающиеся в ЕГЭ. Эта книга будет полезна всем, кто хочет лучше понять школьный курс химии, углубить свои знания, вспомнить изученное ранее. Её могут использовать школьники и абитуриенты при подготовке к экзаменам в медицинские вузы или на химические факультеты. Также она будет интересна всем, кто просто интересуется наукой химией, но по каким-либо причинам не уделил ей должного внимания в школе. После изучения книги приходит понимание, что химия не такая уж сложная, а главное – интересная наука.
Произведение относится к жанру Учебная литература. Оно было опубликовано в 2016 году издательством АСТ. Книга входит в серию «Средняя и старшая школа. Лучшие методики обучения». На нашем сайте можно скачать книгу «Химия. Самоучитель. Книга для тех, кто хочет сдать экзамены, а также понять и полюбить химию. Элементы общей, неорганической и органической химии» в формате fb2, rtf, epub, pdf, txt или читать онлайн. Рейтинг книги составляет 4.46 из 5. Здесь так же можно перед прочтением обратиться к отзывам читателей, уже знакомых с книгой, и узнать их мнение. В интернет-магазине нашего партнера вы можете купить и прочитать книгу в бумажном варианте.
Школьный курс химии и реальное химическое производство. Мнение практика.
Не так давно в журнале «Химия и химики» появилось две интересных статьи, привлекших моё внимание.
В первой из них – В.Н. Витер. «Преподавание химии: взгляд научного работника», затронут вопрос усвояемости и достоверности школьных знаний: «Упрощенное изложение учебного материала значительно повышает его усвоение. Но злоупотребление этим может привести к ошибочным или оторванным от практики знаниям. …С другой стороны, нынешнее «усложнение» школьной программы понижает и доступность знаний, и их адекватность».
В другой короткой статье – Himeck «Взгляд российского шахтера на систему образования» – автор сетовал, что в школу опять возвращается (правда, на новом технологическом уровне) «бумажная» химия, когда вместо демонстрационных опытов и химического практикума учащимся всё чаще предлагают соответствующие видеозаписи. В результате ученики утрачивают интерес к предмету, а самые любознательные начинают самостоятельно экспериментировать с пиротехникой. «…Может пиротехника это и не плохо», но, признаемся, чревато.
Как мне кажется, существует ещё одна сторона затронутой в статьях проблемы. Очень неплохо, чтобы у учащихся одновременно сформировался интерес к химической науке как таковой, но в тоже время они хотя бы приблизительно представляли, чем реально придётся заниматься, если решат посвятить себя работе в химической отрасли. Важно, чтобы безболезненно прошёл процесс перехода от популярных знаний и химических фокусов, к весьма сложным в освоении прикладным знаниям и навыкам, к достаточно нелёгкой, часто далёкой от романтики работе. До учащегося необходимо довести простую мысль, что любой полезный труд способен дать не только средства к существованию, но и простор для творчества, возможность получать от него удовлетворение, но только при условии достижения определённой квалификации.
Когда автор сам учился в школе, производственным процессам, в частности, технологии неорганических веществ в школьных программе было посвящено гораздо больше места. Тогда для всех школ СССР был единый набор учебников. В него входили учебники по неорганической химии за 7-8 и за 9 классы авторов Ходакова Ю. В., Эпштейна Д.А., Глориозова П.А. В них были разобраны (по 0,5-2 стр.) производства фосфора, аммиака, мочевины, азотной кислоты, суперфосфата. А производству серной кислоты контактным методом на основе пирита посвящён почти целый раздел. Кроме прочего, на примере данного производства рассматривались вопросы скорости химических реакций, равновесия в них и явление катализа. В отдельной главе неплохо излагались основные принципы агрохимии и описывались методы производства минеральных удобрений.
В., Эпштейна Д.А., Глориозова П.А. В них были разобраны (по 0,5-2 стр.) производства фосфора, аммиака, мочевины, азотной кислоты, суперфосфата. А производству серной кислоты контактным методом на основе пирита посвящён почти целый раздел. Кроме прочего, на примере данного производства рассматривались вопросы скорости химических реакций, равновесия в них и явление катализа. В отдельной главе неплохо излагались основные принципы агрохимии и описывались методы производства минеральных удобрений.
В настоящее время существует несколько комплектов школьных учебников по химии. В РФ наиболее распространён базовый комплект за 8-11 классы О.С. Габриеляна. В каждой из книг есть какие-то сведения как по неорганической (общей), так и по органической химии. Данные учебные пособия неоднократно критиковались. Вот, последний попавшийся мне пример. В практикуме за 11 класс (изд. 2007 г.) утверждается, что при термическом разложении полиэтилена образуется исходный мономер. Как написал один из участников «химического» форума, на почве этих сведений у него на первом курсе института даже зародилась мысль наделать из полиэтиленовых пакетов… этилового спирта. Увы, это невозможно, т.к. реально при термическом разложении полиэтилена образуется смесь продуктов, в.ч. какое-то количество непредельных углеводородов, но получить таким способом мало-мальски значительный выход целевых продуктов и разделить их – задача неблагодарная.
Но, мало находить ошибки и критиковать, неплохо бывает также что-то предложить. Лично мне кажется, что в пособии недостаточно внимания уделено собственно химическим производствам. Из неорганических остался только уже описанный процесс производства серной кислоты (в 9-м классе). Описание воспроизведено почти дословно по учебнику Ходакова Ю.В. и др. Хотя в последние 20-30 лет установки, использующие в качестве сырья пирит, в РФ полностью вышли из употребления (используется чистая сера – комовая и жидкая). Произошли и другие заметные изменения технологии производства серной кислоты контактным методом. Об остальных промышленных процессах основной химии сказано буквально парой строк. Хотя, надо отдать должное, глава о минеральных удобрениях (9 класс), перекочевав почему-то в «Приложение» (?), осталась достаточно содержательной. В учебниках профильной серии (10-11 классы) по данным производствам почти ни чего не прибавилось. Правда, дано некоторое понятие об экологии.
Об остальных промышленных процессах основной химии сказано буквально парой строк. Хотя, надо отдать должное, глава о минеральных удобрениях (9 класс), перекочевав почему-то в «Приложение» (?), осталась достаточно содержательной. В учебниках профильной серии (10-11 классы) по данным производствам почти ни чего не прибавилось. Правда, дано некоторое понятие об экологии.
Всё же химические закономерности лучше изучать, не только «вообще», но и на примере реально используемых в человеческой деятельности процессов. Автор попытается проделать это на примере хорошо знакомого ему производства экстракционной фосфорной кислоты. Данный материал вряд ли можно отнести к разряду «занимательных», но зато, он позволяет составить некоторое представление о проблемах, стоящих в реальном производстве. Предполагается изложить его, насколько это возможно, в виде понятном для читателя знакомого хотя бы с основами химии. Т.е. данная информация, возможно, сгодится хотя бы для классного чтения.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Учебная программа по химии для старших классов | Time4Learning
Посмотреть демонстрационные ролики нашего урока!Учебная программа по химии подготовит вашего ученика к полному пониманию состава и свойств вещества, изменений и взаимодействия веществ, органической химии, ядерной химии и многого другого.
Читайте дальше, чтобы узнать больше об учебной программе химии для старших классов Time4Learning и о том, как она может помочь учащимся лучше понять мир вокруг них, а также достичь своих академических целей.
Что вы преподаете в химии в старших классах?
Химия средней школы знакомит учащихся с более сложными темами, такими как стехиометрия, термодинамика, виртуальные лабораторные эксперименты и многое другое.Эта прочная база знаний подготовит их к таким предметам, как физика и продвинутая биология в ближайшем будущем.
Некоторые другие темы, которые должны быть изучены в десятом классе химии, включают:
- Разница между физическими свойствами и химическими свойствами вещества.
- Соотношение между количеством нейтронов в атоме элемента, его массовым числом и его изотопами.
- Как водородная связь и силы Ван-дер-Ваальса влияют на летучесть, температуры кипения и плавления жидкостей и твердых тел.
- Как кинетико-молекулярная теория объясняет свойства плазмы.
- Спонтанные и неспонтанные реакции.
- Определения кислот и оснований Бренстеда-Лоури.
- Роль ядерного синтеза в производстве практически всех элементов тяжелее гелия.
Задачи обучения химии
К концу курса студенты должны иметь рабочее понимание основных концепций химии, включая атомные номера и электронные конфигурации, закон идеального газа, энтальпию и фазовые изменения и многое другое.
Цели обучения химии в средней школе обычно включают:
- Описывать гетерогенные смеси, включая суспензии и коллоиды.
- Используйте периодическую таблицу для определения тенденций в электроотрицательности и сродстве к электрону.
- Спроектировать и провести эксперимент для проверки свойств веществ.
- Напишите выражения равновесия и используйте их для вычисления константы равновесия для реакций.
- Объясните поведение идеальных газов с точки зрения кинетико-молекулярной теории, включая диффузию и эффузию.
- Опишите, как измерять pH с помощью индикаторов и измерителей.
- Объясните и сравните реакции деления и синтеза.
- Определите, какие бытовые химикаты опасно хранить вместе или смешивать.
Почему выбирают Time4Learning’s Chemistry Homeschool Curriculum
Учебная программа по химии на дому Time4Learning охватывает основные концепции химии и включает в себя виртуальные лабораторные эксперименты, которые поощряют применение мышления более высокого порядка. Студенты должны хорошо владеть алгеброй, чтобы понимать и решать задачи по химии.Это одна из причин, почему мы рекомендуем химию в 10-м классе. Однако родители могут выбрать любой естественнонаучный курс по своему усмотрению.
Студенты должны хорошо владеть алгеброй, чтобы понимать и решать задачи по химии.Это одна из причин, почему мы рекомендуем химию в 10-м классе. Однако родители могут выбрать любой естественнонаучный курс по своему усмотрению.
В нашей программе химии для старших классов средней школы изучаются не только понятия химии, но и словарный запас, элементы и химические уравнения, помогающие учащимся интерпретировать химию.
Вот некоторые дополнительные преимущества, которые Time4Learning предоставляет родителям и учителям.
В качестве полной учебной программы
| В качестве дополнения
|
Ресурсы домашнего обучения для дополнительных 10-х классов
бесплатных онлайн-уроков химии | A2Z Homeschooling
Что такое химия и как лучше всего ее изучать? С бесплатными онлайн-уроками химии!
Бесплатные уроки химии в средней школе (и начальной) , планы уроков и игры, которые помогут вам овладеть химией.
Chem4Kids
Итак, вы спрашиваете, что такое ХИМИЯ? Что ж … вот наше лучшее определение. Химия — это изучение ВЕЩЕСТВА и изменений, которые происходят с ней. .
Химия, 7 / е
Онлайн-урок химии.
Chemistry 11
Джереми Шнайдер приложил согласованные усилия, чтобы использовать учебник как можно реже (на случай, если он снова изменится в будущем). Таким образом, для большинства этих уроков не требуется учебник. Любые ссылки на Нельсона, которые появляются, обычно могут быть заменены другим текстом по основам химии.
The Chemistry of Health
Этот буклет естественнонаучного образования предлагает образец того, как фундаментальные исследования химии и биохимии могут способствовать лучшему пониманию здоровья человека. Станьте свидетелем увлекательности исследований, проводимых в современных химических лабораториях. Национальные институты здоровья.
Станьте свидетелем увлекательности исследований, проводимых в современных химических лабораториях. Национальные институты здоровья.
Роберт Брюс Томпсон
Чтение изнутри
С большим количеством полноцветных иллюстраций и фотографий Иллюстрированное руководство по экспериментам по домашней химии предлагает занятия вводного уровня, подходящие для лабораторных занятий по химии в средней школе или первом году обучения в средней школе, а также более продвинутые занятия, подходящие для студентов, которые намереваются поступить в совет колледжа. Экзамен по химии Advanced Placement (AP).Студент, который завершит все лаборатории, описанные в этой книге, проработает эквивалент двух полных лет работы в лаборатории химии в средней школе или прохождения первого года лабораторного курса общей химии в колледже.
Это практическое введение в реальную химию — с использованием реального оборудования, реальных химикатов и реальных количественных экспериментов — идеально подходит для многих тысяч молодых людей и взрослых, которые хотят испытать магию химии.
Kindle Edition
Chemtutor
Это руководство начинается с основ и дает экспертную помощь на самых сложных этапах понимания вашего первого курса химии.
Курсы по химии на Coursera
Эти курсы постоянно меняются и ведутся на многих языках со всего мира, поэтому выберите свой предпочтительный язык. Для подростков сначала поищите курсы общих понятий, а затем продолжайте работу. Когда я посмотрел, мне предложили курс судебной медицины.
Creative Chemistry
Химические головоломки, интерактивные контрольные опросы, молекулярные модели и гараж настройки Sc1, которые помогут улучшить ваши научные исследования GCSE. Все, что вам нужно для вашего химического клуба.
Общая химия в Интернете
Для целеустремленных подростков это бесплатный полный курс химии прямо в Интернете.
История компании Eastman Chemicals
Химические изобретения компании Eastman Chemicals перемежаются с массовыми культурными мероприятиями. История рассказана с помощью Flash-анимации и поп-музыки каждого десятилетия.
История рассказана с помощью Flash-анимации и поп-музыки каждого десятилетия.
Химия
Курсы MIT, но подходят для подростков.
LaurenHill Academy: Chemistry 534
Заметки из курса средней школы в Квебеке. Вам тоже понадобится книга, но эти заметки помогут.Здесь немного больше науки.
Подробнее…
Пузыри
Химические вещества
Классы
Расследование на месте преступления
Эксперименты
Пищевая химия
Рецепт Гака
Мороженое
Отравление свинцом
Яркие демонстрации
Программное обеспечение
Теги: химия, классы, средняя школа, онлайн-классы, наука
Химия: курс средней школы — онлайн-видеоуроки
Об этом курсе
Этот курс охватывает многие из тех же тем, изучаемых в классах химии в средней школе.Вы можете использовать уроки, чтобы дополнить свое изучение всего, от атомной структуры и групп периодической таблицы до их приложений в стехиометрии, химической термодинамике и органической химии. Преподаватели иллюстрируют содержание урока графикой и примерами задач, чтобы помочь вам перейти от материала к пониманию ключевых концепций каждого урока. Также есть теги к видео и соответствующие расшифровки уроков, которые вы можете использовать для быстрого и легкого доступа к основным пунктам. Дополнительные ресурсы включают ссылки на дополнительные текстовые уроки, в которых излагается важная терминология, и тесты для самооценки, которые позволяют определить области, требующие улучшения.
Использование курса
Этот курс химии может помочь нескольким типам учащихся.
- Учащиеся старших классов могут пополнить свои знания, усвоить пропущенные на уроке понятия по химии или подготовиться к тестам и экзаменам.
- Учителя могут вовлекать своих учеников в обсуждение в классе после показа в классе видеороликов по химии.
- Родители могут использовать этот курс как экономичное решение для обучения своих старшеклассников.

- Независимые учащиеся могут получить доступ к этому курсу в любое удобное время с любого компьютера или мобильного устройства.
Темы курса
- Введение в химию
- Ядерная химия
- Равновесие
- Измерение и решение проблем
- Экспериментальная лаборатория химии
- Материя
- Атомная структура
- Периодическая таблица элементов
- Химическая связь
- Переходы жидкой и твердой фаз
- Газы
- Решения
- Стехиометрия и химические уравнения
- Кислоты, основания и реакции
- Кинетика
- Термодинамика
- Органическая химия
- Репрезентативные элементы
- Ресурсы для учителей химии в старших классах
Онлайн-курс химии — Средняя школа Джеймса Мэдисона
Описание курса
Химия — это изучение материи, энергии и их взаимодействия.Материя — это все вокруг вас и во Вселенной, поэтому химия помогает вам понять ваш непосредственный мир и Вселенную. В этом курсе вы узнаете о составе вещества от субатомного уровня до молекулярного уровня и до макроскопического уровня. Вы увидите, как одни и те же строительные блоки могут быть преобразованы в бесчисленное множество веществ. Этот курс поможет вам предсказать свойства различных веществ и реакции, которым они подвергаются. Вы поймете, почему вода имеет решающее значение для жизни на Земле, и изучите различные типы химических реакций, протекающих в растворах.Вы познакомитесь с такими отраслями химии, как термохимия, электрохимия, органическая химия, биохимия и ядерная химия. Вы узнаете, почему химия имеет решающее значение в биологии, инженерии и повседневной жизни.
Студентам предоставляется возможность определить основные концепции в материалах для чтения, а затем применить эти знания в упражнениях по повторению. Понимание будет оцениваться с помощью формирующих занятий, экзаменов с несколькими вариантами ответов и комплексного заключительного экзамена.
Краткое содержание курса
Возьмите химию онлайн для летней школы или восстановления кредита
Опередите свое текущее положение в определенной предметной области
Восполнить невыполненные или неполные кредиты за курс средней школы по мере необходимости
Как работают онлайн-курсы для старших классов
Доступ к электронным книгам и урокам через собственный защищенный студенческий портал
Учитесь в любое время дня и ночи и учитесь в удобном для вас темпе
Запросить академическое руководство у сертифицированных преподавателей и научных консультантов
Посещайте добровольные еженедельные живые уроки под руководством учителя в нашей виртуальной средней школе
Получите дополнительную помощь в обучении в нашем онлайн-центре ресурсов обучения
Завершите курс всего за 6 недель
* ПРИМЕЧАНИЕ. В стоимость индивидуальных курсов входят только электронные книги.
Онлайн-химия входит в учебную программу для студентов, обучающихся на программе подготовки к колледжу, и на факультатив для студентов, обучающихся на общих курсах. Вы также можете приобрести его как отдельный курс для восстановления кредита в средней школе или в летнюю онлайн-школу. Звоните 1-800-349-6861 или , запишитесь онлайн прямо сейчас!
Мастер-класс Высшая школа химии
Химия — это изучение состава, структуры и свойств материи.Именно благодаря пониманию химии были открыты продукты, принесшие пользу обществу, и были внедрены технологии, поддерживающие окружающую среду. Знание того, как изменяется материя, даст нам представление о происхождении жизни, чтобы мы могли понять, что жизнь могла быть сформирована только в результате сверхъестественного акта творения, а не в результате изменения во времени.
- Курс естественных наук для старших классов с лабораторной программой
- Лабораторные эксперименты включены с инструкциями о том, где заказать лабораторное оборудование и расходные материалы, необходимые для курса.
- Основано на том принципе, что те, кто может понимать и применять информацию, добиваются большего успеха, чем те, кто просто запоминает материал
Этот курс читал Др.Englin в течение нескольких лет, со студентами, поступающими в медицинскую школу и аспирантуру. Он хотел разработать серию курсов, которые дадут студентам инструменты, которые помогут им преуспеть в высшем образовании. В основе всеобъемлющего материала лежит Бог-Творец.
Содержание
- 1. Введение
- 2. Метрические измерения в химии
- 3.Химические растворы — процентные концентрации
- 4. Химический раствор — молярность
- 5. Молекулярная масса и атомная теория
- 6. Приготовление молярных растворов
- 7. Химические реакции
- 8. Химические уравнения I
- 9. Химические уравнения II
- 10. Моли по химическим уравнениям
- 11. Определение количества реагента и продукта в граммах
- 12. Электронные конфигурации
- 13.Электронные конфигурации продолжение
- 14. Периодическая таблица элементов
- 15. Группы Периодической таблицы элементов
- 16. Ионные связи
- 17. Ковалентные облигации
- 18. Металлические атомы
- 19. Аккумуляторы
- 20. Кислота и основания I
- 21. Кислота и основания II
- 22. Слабые кислоты и основания
- 23. Буферы
- 24. Химия углерода
- 25.Органическая химия
- 26. Биохимия
- 27. Скорость химических реакций
- 28. Химия окружающей среды
- Приложение 1 — Лабораторные процедуры
- Приложение 2 — Христианские химики
- Глоссарий и указатель
Подтверждения
Автор делает изучение химии более практичным, ссылаясь на химические вещества в повседневной жизни, и сильно напоминает студентам, что открытый порядок исходит от нашего Бога-Создателя.
Э. Ховард Каллахан, инженер-химик (кооператив) из Технологического института Джорджии, M.Div. из Юго-Западной баптистской духовной семинарии
Бесплатный курс химии: основы иммерсивной химии
Этот бесплатный курс химии — веселый, увлекательный и доступный первый курс для изучения основ химии. Эти бесплатные уроки химии идеально подходят для начинающих.
Посмотрите, насколько увлекательным может быть изучение науки! Мы начинаем с занимательной истории нашей планеты и вселенной, которой 14 миллиардов лет, в том виде, в каком мы ее знаем.Затем мы учимся читать современную таблицу Менделеева. Мы закончим изучение теории кислот и оснований, и вы сможете проводить лабораторные работы у себя дома. (Или просто смотрите, как вам удобнее.)
БЕСПЛАТНАЯ основа иммерсивной химии
Необходимое условие: Вы интересуетесь наукой!
Описание: В этом бесплатном курсе химии вы узнаете о химических элементах, их происхождении и их расположении в периодической таблице.Поймите, что мы знаем о структуре атомов, включая тот «парадокс», что эти крошечные вещи, из которых состоит все, по-видимому, в основном ничто! Поймите, что элементы имеют более одной формы … заряжать или не заряжать … это вопрос химика;)
Изучив базовые уроки химии о нейтральных атомах, вы узнаете об ионах (заряженных, ненейтральных атомах). Им нравится прилипать к молекулам воды, как крошечные магниты. Это многое объясняет о кислотах и щелочах.Вы увидите демонстрацию кислот и оснований, изучите теорию, решите проблемы и (при желании) создадите свой собственный самодельный набор для тестирования pH.
Цель базовых уроков химии — заложить прочный фундамент в понятиях химии. И показать вам, что изучение химии может быть приятным и полезным занятием, свободным от беспокойства и беспокойства. Таким образом, в этом курсе НЕ есть какая-либо раздражающая математика. Если вы заинтересованы в изучении математики, пожалуйста, ознакомьтесь с БЕСПЛАТНЫМИ преалгебрами WON, Algebra WON или Алгеброй TOO.
Таким образом, в этом курсе НЕ есть какая-либо раздражающая математика. Если вы заинтересованы в изучении математики, пожалуйста, ознакомьтесь с БЕСПЛАТНЫМИ преалгебрами WON, Algebra WON или Алгеброй TOO.
Важные идеи, которые вы узнаете:
- Понимание того, что такое атомы и элементы
- Знание «большой истории» элементов, образующихся от самых простых элементов до самых больших и сложных
- Распознавание различных форм элементов
- Чтение периодической таблицы, которая не просто список вещей, которые нужно запомнить
- Построение мысленной модели атомов и атомной теории
- Получение основ химии о кислотах и основаниях (каламбур)
- Видение, действие и опыт практической химии
Включены видеоролики и материалы: 65 видеороликов (всего 6 часов) плюс 11 рабочих листов в формате pdf для печати, ключи для ответов и примечания.
Темы: Темы перечислены на сворачиваемой правой боковой панели в верхней части этой страницы. Темы станут активными ссылками на материалы курса сразу после того, как вы зарегистрируетесь с помощью кнопки Начать!
Рекомендуемый график: От 1 до 3 часов в уроке из 4 уроков базовой химии
Возраст: 13+ лет или отлично подходит для начинающих, интересующихся наукой
Стоимость: Это совершенно бесплатный курс химии
Для кого этот курс?
Независимо от того, являетесь ли вы студентом, ищущим более интересный подход, чем тот, который предлагается в средней школе физики или химии, семья, обучающаяся на дому, ищет не столь страшную учебную программу по естествознанию, эмигранты или путешественники, которые ищут качественные уроки английского языка за границей , первокурсник колледжа, которому необходимо быстро овладеть тем, что вы «должны» знать о науке, одаренный ребенок или взрослый, снова возвращающийся в школу, — это отличный курс для развития прочных основ естественных наук.
Этот бесплатный курс химии преподается с использованием контекстно-зависимого контента, который объединяет и опирается на то, что вы уже знаете об окружающем мире. Уникальный стиль преподавания и материалы доктора Скотта помогли тысячам учащихся, так же как и вы, улучшить их понимание науки… встретив их именно там, где они находятся, и продвигаясь дальше. Вы получите все необходимое личное общение и обратную связь от доктора Скотта, когда сейчас зарегистрируетесь в БЕСПЛАТНОЙ программе базовой иммерсивной химии.
Онлайн-курс естественных наук для старших классов | Химия
Этот список является репрезентативным для материалов, предоставленных или используемых в этом курсе. Имейте в виду, что фактически используемые материалы могут отличаться в зависимости от школы, в которую вы записаны, и от того, проходите ли вы курс как независимое обучение.
Чтобы получить полный список материалов, которые будут использоваться в этом курсе вашим зачисленным студентом, посетите MyInfo .Все списки могут быть изменены в любое время.
Scope & Sequence: Scope & Sequence документы описывают, что охватывает курс (объем), а также порядок , в котором рассматриваются темы (последовательность). В этих документах перечислены учебные цели и навыки, которые необходимо освоить. K12 Объем и последовательность документов для каждого курса включают:
Обзор курса
Этот курс охватывает все ключевые области химии, включая атомную структуру, химические связи и реакции, растворы, стехиометрию, термохимию, органическую химию и ядерную химию.Курс включает прямое онлайн-обучение, виртуальные лаборатории и связанные с ними оценки, которые используются вместе с книгой по решению проблем.
вернуться наверхПродолжительность курса
Два семестра
вернуться наверхПредварительные требования
Средняя школа K12 Физические науки или SCI102: Физические науки и удовлетворительное владение основами алгебры, подтвержденное успехом в MTh222: Алгебра I или эквиваленты
вернуться наверхКраткое содержание курса
SEMESTER ONE
Раздел 1: Исследование химии
Студенты изучают химию как одну из наук и сталкиваются с концепциями материи, энергии, метрической системы и научных методов. Студенты изучают взаимосвязь материи и энергии, в том числе узнают о классификации материи. Чтобы подготовить студентов к решению задач по химии на протяжении всего курса, студенты изучают метрическую систему, значащие числа и научный метод, применяемый в химических исследованиях.
Студенты изучают взаимосвязь материи и энергии, в том числе узнают о классификации материи. Чтобы подготовить студентов к решению задач по химии на протяжении всего курса, студенты изучают метрическую систему, значащие числа и научный метод, применяемый в химических исследованиях.
- Введение в семестр
- Химия и общество
- Материя и энергия Обзор
- : Дело
- Чистые вещества
- Смеси
- Обзор: Вещества
- Лаборатория бумажной хроматографии 1
- Лаборатория бумажной хроматографии 2
- Свойства веществ
- Решение задач в химии Обзор
- : свойства и проблемы
- Метрическая система: базовые единицы
- Метрическая система: производные единицы Обзор
- : метрическая система
- Графики
- Научный метод и химия Обзор
- : построение графиков и научный метод
Раздел 2: Атомная структура
Этот модуль знакомит студентов с атомом и исследует меняющиеся точки зрения на природу атома на протяжении всей истории.Следуя исторической истории, студенты узнают о частях атома и его свойствах, таких как атомный номер, атомная масса и расположение электронов. Этот модуль готовит студентов к работе с периодической таблицей.
- Ранние теории атома
- Ядерный атом
- Атомный номер и массовое число Обзор
- : Atom
- Лаборатория свойств веществ 1
- Лаборатория свойств веществ 2
- Ионы
- Изотопы и атомная масса Обзор
- : аспекты Atom
- Атом Бора
Блок 3: Периодическая таблица
Опираясь на материю и структуру атома, студенты теперь обращают свое внимание на организацию атомов и элементов и их графическое представление в виде периодической таблицы.Определяются свойства периодической таблицы, а затем студенты изучают тенденции, которые обнаруживаются при расположении атомов в соответствии с атомным номером. Студенты изучают элементы, узнавая о металлах и других классах элементов.
Студенты изучают элементы, узнавая о металлах и других классах элементов.
- Атомный номер и периодический закон
- Периодическая таблица
- Тенденции в периодической таблице
- Обзор: Периодическая таблица
- Металлы
- Неметаллы Обзор
- : металлы и неметаллы
- Лаборатория реакций металлов 1
- Лаборатория реакций металлов 2
- Металлоиды
- Внутренние переходные металлы Обзор
- : металлоиды и переходные металлы
Блок 4: Химическая связь
Атомы образуют связи.В первой части этого раздела студенты узнают о различных типах связей, в основном об ионных и ковалентных связях. В этом разделе основное внимание уделяется пониманию того, почему и как образуются связи, и названию используемых веществ. В этот блок включены исследования тех межмолекулярных сил, которые приводят к образованию водородных связей.
- Одноатомные ионы
- Многоатомные ионы
- Обзор: Ions
- Ионные связи и соли
- Свойства ионных соединений Обзор
- : ионные соединения
- Лаборатория: соли: реакции осаждения 1
- Лаборатория: соли: реакции осаждения 2
- Ковалентная связь и молекулы
- Строения Льюиса
- Силы Ван-дер-Ваальса Обзор
- : атомная связь
Блок 5: Химические реакции
Связь теперь прочно установлена, поэтому студенты могут прогрессировать в изучении того, как разрываются и образуются связи в химических реакциях.Различные типы химических реакций изучаются как в прямом обучении, так и в виртуальных лабораториях. Студенты изучают основы продуктов и реакций и учатся уравновешивать уравнения, чтобы показать, что масса сохраняется по мере того, как в этих реакциях происходят изменения.
- Сохранение массы
- Балансировка химических уравнений Обзор
- : химические уравнения
- Типы реакций 1
- Типы реакций 2 Обзор
- : химические реакции
- Лаборатория химических реакций 1
- Лаборатория химических реакций 2
Блок 6: Стехиометрия
Теперь, когда учащиеся понимают основы химических реакций и способность уравновешивать химические уравнения, они могут применять эти знания в реальных ситуациях. Стехиометрия — это исследование определения выходов химических реакций с учетом масс некоторых частей химического уравнения. Освоение этого позволяет студентам решать задачи, аналогичные тем, с которыми сталкиваются химики на промышленном производстве.
Стехиометрия — это исследование определения выходов химических реакций с учетом масс некоторых частей химического уравнения. Освоение этого позволяет студентам решать задачи, аналогичные тем, с которыми сталкиваются химики на промышленном производстве.
- Стехиометрия и ее использование
- Взаимосвязь числа молей Обзор
- : стехиометрия
- Взаимосвязь молярных масс
- Соотношение молярный объем
- Обзор: Moles
- Моли и химические уравнения
- Расчет выходов реакций
- Лаборатория стехиометрии химических реакций 1
- Лаборатория стехиометрии химических реакций 2
Раздел 7: Обзор семестра и тест
- Обзор семестра
- Семестровый тест
СЕМЕСТР ВТОРОЙ
Раздел 1: Состояния материи
Изучение газов, жидкостей и твердых тел не только говорит нам об их свойствах, но и дает прочную основу для понимания того, как устроена материя и как она себя ведет.Студенты внимательно изучают, как объем газа ведет себя при изменении давления и температуры. Студенты также исследуют некоторые свойства жидкостей и твердых тел и связывают все три состояния вещества с помощью фазовых диаграмм.
- Введение в семестр
- Поведение газов
- Закон о газе
- Обзор: Газы
- Лаборатория: газовые законы 1
- Лаборатория: газовые законы 2
- Закон об идеальном газе
- Абсолютный ноль Обзор
- : Закон об идеальном газе
- Некоторые свойства жидкостей
- Некоторые свойства твердых тел Обзор
- : жидкости и твердые вещества
Раздел 2: Решения
Большая часть химии включает понимание растворов, в которых растворенное вещество помещено в растворитель.Свойства полученного решения можно понять, изучив взаимодействия между частями раствора. Студенты изучают различные способы описания концентрации раствора и разделения компонентов.
- Решения
- Процесс растворения Обзор
- : Решения и растворение
- Лаборатория: Факторы, влияющие на образование раствора 1
- Лаборатория: Факторы, влияющие на образование раствора 2
- Молярность и мольная доля
- Моляльность и массовый процент Обзор
- : молярность и моляльность
- Коллигативные свойства
- Разделительные растворы
Блок 3: Кислоты и основания
Большинство студентов, поступающих на химию, имеют некоторый опыт работы с кислотами и основаниями из повседневной жизни.В этом разделе, после изучения свойств кислот и оснований, студенты анализируют различные определения кислот и оснований, которые были разработаны со времен Аррениуса. Они узнают, как решать проблемы, связанные с силой кислот и оснований. Студенты получают практический опыт работы с кислотами и основаниями в виртуальной лаборатории, включая титрование.
- Свойства кислот и оснований
- Типы кислот и оснований Обзор
- : кислоты и основания
- Измерение кислот и оснований
- Буферы и титрование Обзор
- : Измерение pH
- Лаборатория: титрование: проверка качества воды 1
- Лаборатория: титрование: проверка качества воды 2
Раздел 4: Химическая термодинамика
Важной частью изучения материи является изучение энергии, связанной как с химическими, так и с физическими изменениями.Изучение энергии в химических системах называется химической термодинамикой. Это включает в себя понимание того, что энергия сохраняется во время химических реакций, а также при переходе веществ из газа в жидкости и в твердые тела — и обратно. Все это содержание составляет закон сохранения энергии.
- Сохранение энергии
- Измерение теплового потока
- Обзор: Тепловая энергия
- Лаборатория: Теплообмен 1
- Лаборатория: Теплообмен 2
- Удельная теплоемкость
- Написание термохимических уравнений Обзор
- : больше аспектов тепла
Установка 5: Скорость реакции и равновесие
В предыдущем разделе студенты получили базовое представление о роли энергии в химии и о том, как она применяется к определенным процессам.В этом разделе студенты изучают роль энергии в двух важных химических явлениях: скорости реакции и равновесии системы. Основываясь на понимании теории столкновений, учащиеся развивают «большую идею» понимания того, почему химические реакции происходят и не происходят.
- Скорость реакции и энергия активации
- Факторы, влияющие на скорость реакции Обзор
- : Скорость реакции
- Лаборатория: факторы скорости реакции 1
- Лаборатория: факторы скорости реакции 2
- Равновесие
- Принцип Ле Шателье Обзор
- : Equilibrium
Раздел 6: Электрохимия
В этом разделе студенты проводят систематическое изучение электрохимических процессов.Они изучают основы преобразования электрической энергии в химическую и наоборот. Они исследуют гальванические элементы, батареи и электролитические элементы.
- Электрохимические процессы
- Гальванический элемент
- Обзор: Электрохимия
- Лаборатория: гальваника 1
- Лаборатория: гальваника 2
- Сухие камеры
- Ячейки электролитические Обзор
- : электрохимические элементы
Раздел 7: Органическая химия
По мере прохождения этой учебной программы учащиеся узнают о химических веществах и их связи с живыми существами.В этом отделении они проводят систематическое изучение соединений на основе углерода, поскольку изучают органическую химию и биохимию. Во-первых, они сталкиваются с некоторыми типами органических соединений и узнают о схемах их наименования. Затем студенты переключают свое внимание на биохимию, включая изучение углеводов, жиров и белков.
- Углеводороды и другие органические химические вещества
- Лаборатория моделирования органических соединений
- Полимеры Обзор
- : углеводороды и полимеры
- Углеводы и жиры
- Белки и нуклеиновые кислоты
- Обзор: биохимия
Раздел 8: Ядерная химия
В основе изучения классической химии лежат реакции, в которых участвуют отношения между электронами реагентов и продуктов.
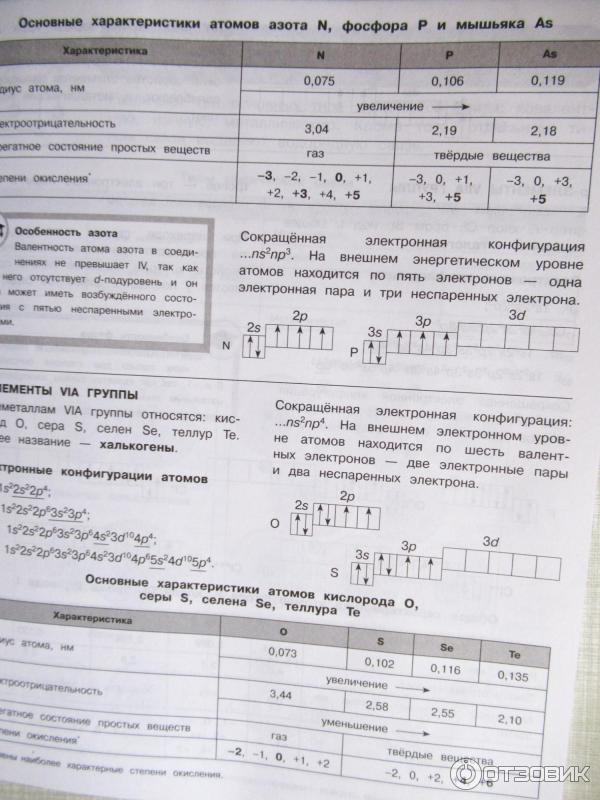
 Кремний
Кремний

 В.Мануйлов
В.Мануйлов , я
разработала программу и содержание
подготовительных курсов. На них обучались сотни
школьников. Многие из них начинали с нуля и за 40
занятий понимали предмет настолько, что сдавали
экзамены на «4» и «5». Поэтому в нашем городе мои
пособия-самоучители расходятся как горячие
пирожки.
, я
разработала программу и содержание
подготовительных курсов. На них обучались сотни
школьников. Многие из них начинали с нуля и за 40
занятий понимали предмет настолько, что сдавали
экзамены на «4» и «5». Поэтому в нашем городе мои
пособия-самоучители расходятся как горячие
пирожки.

