Сила кислот и оснований
Константы кислотности и основности
Константа равновесия является количественной характеристикой силы кислоты или основания. Количественно кислотность вычисляют по отношению к воде. При этом мерой кислотности выступает константа равновесия реакции (константа кислотности) $Ka$. Для выражения $A ↔ B + H^+$ константа кислотности равна:
Стандартное равновесие имеет вид: $H_3O^+ ↔ H_2O + H^+$, $Ka = 1$. Тогда для любого кислотно — основного процесса:
$A_1 + B_2 ↔ A_2 + B_1$
При взаимодействии с водой любой кислоты $A$ константы равновесия соответствуют приведенным в справочной литературе значениям:
$A + H_2O ↔ H_3O^+ + B^-$
для многоосновных кислот, последовательно отдающих несколько протонов, первая константа кислотности всегда выше последующих;
для оксокислот (группы $-OH$ присоединены к одному и тому же атому) $pK_{a2}$ обычно больше $pK_{a1}$ на $5$.
Пример 1
Значения $pK_{ai}$ для ортофосфорной кислоты равны $2,12$; $7,21$; $12,67$ для $i = 1,2,3$ соответственно. То есть в водной среде преобладают разные кислотно — основные равновесия в зависимости от $pH.$
На рис. 1 отображено содержание разных ионов ортофосфорной кислоты как функция $pH$, $x_i$ — доля данного иона в смеси.

Рисунок 1. Зависимость относительного содержания различных ионов ортофосфорной кислоты от $pH$
При небольших значениях $pH$ доля иона ${PO}^{3-}_4$ очень мала, но при $pH > pKa1$ этот ион начинает доминировать. Протонированные ионы, в основном, присутствуют в растворе, когда $pH$ имеет промежуточное между соответствующими $pKa$ значение.
Константа основности рассчитывается исходя из соотношения:
$B + H_2O ↔ A +OH^-$
Константу кислотности можно связать с константой основности соотношением:
$pKa + pKb = 14.$
Чем сильнее будет сопряженная кислота, тем слабее сопряженное основание. Величине рКa соответствует значение —$lgKa.$
Кислота считается сильной, если $pKa
$HA + H_2O = +A^-$ будут идти практически до конца и кислотные свойства определяются исключительно свойствами $H_3O^+.$
Основание является в водном растворе сильным, если $pKb
Значения $pKa$ для слабых кислот лежат в интервале $\sim 2-15,7$.
Автопротолиз воды
Равновесие автопротолиза воды имеет вид:

Рисунок 2.
Для данной реакции термодинамическая константа равновесия установлена экспериментально. При температуре $298 \ K$ она равна:
$K = [H_3O^+][OH^-] = 1 \cdot 10^{-14}$
Данную константу равновесия называют ионным произведением воды $Kw.$
Согласно протолитической теории, константа равновесия реакции автопротолиза равна константе кислотности воды $Ka (H_2O).$ Исходя из величины $Kw$, определяется шкала $pH$:

Рисунок 3.
Гидролиз
Согласно теории Бренстеда — Лоури, гидролиз солей можно рассматривать как частный случай кислотно — основного равновесия. Гидролиз — обменное взаимодействие ионов с водой, протекающее с изменением $pH$.
Гидролиз по аниону представлен уравнением:

Рисунок 4.
Константа гидролиза $Kr$ является константой основности сопряженного основания $CH_3COO^-.$
Гидролиз по каниону представлен уравнением:

Рисунок 5.
В данном примере константа гидролиза является константой кислотности сопряженной кислоты $[Fe(H_2O)_6]^{3+}.$
Чем сильнее гидролиз по аниону, тем слабее кислота. Чем сильнее гидролиз по катиону, тем слабее основание.Равновесие гидролиза практически всегда смещено влево, при $Kr ≪ 1$. Наличие гидролиза можно определить по изменению $pH$ раствора.
Гидролиз усиливается при:
- нагревании;
- разбавлении;
- добавлении веществ, связывающих ионы $OH^-$ или $H_3O^+.$
Кислоты сила — Справочник химика 21
Ход изменения растворимости галогенидов серебра можно объяснить и в терминах теории жестких и мягких кислот и оснований. Фторид-ион — более жесткое основание, чем хлорид-ион свойства бромид-иона занимают промежуточное положение при переходе к типично мягкому основанию — иодид-иону. Поскольку ион Ag+ представляет собой мягкую кислоту, силы взаимодействия катиона и аниона возрастают от AgF к Agi, что имеет следствием уменьшение растворимости галогенидов в том же направлении. Различие в растворимости труднорастворимых соединений серебра можно качественно наблюдать а опыте 8. [c.648]Сколько минут потребуется для выделения 250 мл гремучего газа прп электролизе разбавленной серной кислоты Сила, тока 0,5 А. Газ измерен при 7°С и 102,9 кПа. [c.174]
Все элементы этой подгруппы являются неметаллами. Соединения серы, селена и теллура с кислородом образованы ковалентными связями. С водородом они образуют соединения типа h33(HjO, HjS, HjSe, НДе). Из них вода является амфотерным электролитом, а остальные, растворяясь в воде, дают кислоты, сила которых возрастает от HjS к НДе. Вода проявляет и окислительные и восстановительные свойства (см. работу 23), водородные соединения S, Se, Те — восстановители, активность которых возрастает в ряду HjS, HjSe, НДе. Окислительное число кислорода, серы, селена и теллура в этих соединениях равно —2. Кислород и сера образуют, кроме того, соединения, в которых атомы кислорода или серы связаны между собой,— это пероксиды —О—О— с окислительным числом кислорода —1, супероксиды О » с окислительным числом кислорода -4-, озониды Оз с окислительным числом кислорода —
Укажите различие в химических свойствах щелочных металлов и металлов подгруппы меди (отношение к воздуху, воде, разбавленным кислотам сила образуемых оснований восстановительные свойства). Чем можно объяснить это различие [c.235]
Сила кислот. Сила кислоты (как и любого другого электролита) определяется степенью диссоциации, а, которая равна отношению количества продиссоциировавших молекул к общему количеству молекул данного электролита в растворе, т.е. долю продиссоциировавших молекул, ее можно также выражать в процентах [c.17]
Действительно, для этих кислот сила кислоты в воде делается идентичной силе кислоты сольватированного протона НзО» (рД д= —1,74). [c.37]
Летучие водородные соединения галогенов (галоводороды) НЭ хорошо растворимы в воде. В водных растворах они ведут себя как кислоты. Сила (степень диссоциации) галоводородных кислот растет по мере уменьшения электроотрицательности галогенов (сверху вниз). Объясняется это общим уменьшением прочности связи Н—Э в молекулах галоводородов от фтора к астату. Молекулы наиболее слабой фтороводородной кислоты склонны к ассоциации, поэтому для нее известны кислые соли.
Являясь органическими производными аммиака, амины сохраняют главные его химические особенности. В частности, амины проявляют основные свойства. Это обнаруживается ио щелочной реакции водных растворов аминов. По мере роста углеводородного остатка растворимость аминов в воде уменьшается. Поэтому высшие амины уже не дают щелочной реакции. Однако и они сохраняют свойства оснований, это обнаруживается в способности любых аминов образовывать соли с кислотами. Сила аминов как ооюва-ний зависит от их строения, от природы органического радикала, но причина основных свойств во всех случаях — свободная электронная пара атома азота. [c.228]
Титрование в кислых растворителях солей органических кислот следует рассматривать как титрование оснований. В кислых растворителях роль оснований играют соли, образованные растворителем как кислотой, и соли всех кислот, сила которых слабее или равна кислотной силе растворителя. В уксусной кислоте основаниями являются большинство солей органических кислот. Поэтому раздельное титрование органического основания в смеси с солью органической кислоты следует рассматривать как титрование смеси органического и минерального основания. [c.459]
h5Y — этилендиаминтетрауксусная кислота / — сила электрического тока j — плотность тока k — константа ступенчатого равновесия К — константа суммарного равновесия Лд — константа распределения Kt — катион [c.4]
На окисление золота и платины у азотной кислоты силы не хватает , эти металлы переводятся в раствор более сильным окислителем-(/орс/сой водкой (смесь азотной и хлороводородной кислот). [c.159]
Как уже было сказано ранее, большинство гидроксидов р-элементов в высших степенях окисления — кислоты. Сила кислот в группах с увеличением порядкового номера элемента уменьшается, а в периодах их кислотные свойства усиливаются слева направо. Например
По этой причине невозможно различить силу перечисленных кислот в водных растворах. Другими словами, самой сильной кислотой, сила которой может быть измерена в воде, оказывается Н3О . Вещества, являющиеся лучшими донорами протонов, чем Н3О, образуют этот ион в воде и создается впечатление, что все они обладают одинаковой силой как кислоты. Указанный эффект называется выравнивающим действием воды на силу кислот. Чтобы можно было провести различие между силой таких кислот, необходимо использовать какой-либо растворитель, являющийся худшим акцептором протонов, чем вода, в котором эти вещества окажутся не полностью ионизованными. Таким образом удается установить, что относительная сила перечисленных выше кислот убывает в такой последовательности [c.249]
С рассмотренной точки зрения становится ясным различие т1сжду реакциями нейтрализации сильной кислоты сильным осно- ваинем и случаями нейтрализации, когда хотя бы одно из исхода ных веществ — слабый электролит. При нейтрализации сильной кислоты сил >ным основанием в растворе образуется только одии слабый электролит — вода. При этом равновесие [c.255]
Примем теперь во внимание отталкивание ядром центрального иона (лития, затем бериллия, бора и т. д.) протонов, содержащихся в гидроксильных группах. При переходе от гидроокиси лития к гидроокиси бериллия, к гидрату окиси бора и т. д. заряд ядра центрального иона возрастает, возрастает и отталкивание им протонов. Связь протонов с молекулой все более ослабляется, они получают возможность отщепляться от молекулы, т. е. появляются кислотные свойства. Основания сменяются кислотами, сила которых возрастает от борной кислоты к азотной. [c.32]
Обращаясь к периодической системе элементов, можно видеть, что оксиды наиболее электроотрицательных элементов реагируют с водой с образованием наиболее сильных кислот. Неметаллическим элементам с постепенно убывающей электроотрицательностью отвечают кислоты, сила которых последовательно уменьшается.
Таким образом, гидратированный катион алюминия представляет собой слабую кислоту, сила [c.347]
Степень диссоциации кислоты, сила кислоты, растет с К, т. е. убывает с ростом рК, сила основания убывает с ростом К, т. е. растет с рК. Условие [А»] = [Н ] соблюдается только в нейтральном растворе. Вообще говоря, [c.62]
Определение силы кислот и кислотности растворов
Для количественного определения силы кислот, практическ полностью ионизованных в растворе, Гаммет [13] ввел индикаторную функцию кислотности Яо [c.105]В теории электролитической диссоциации (Оствальд н Аррениус, 1880—1890 гг.) было показано, что водородсодержащие соединения, обладающие кислотными свойствами, образуют в водном растворе ионы водорода. Применение закона действующих масс к равновесию диссоциации привело к формулировке констант диссоциации в качестве рациональной количественной меры силы кислоты. Подобно этому, основные свойства связывали с образованием в растворе гидроксильных ионов, а взаимно антагонистическое действие кислот и оснований объясняли реакцией Н++0Н Н20. Все это позволило определить кислоты и основания как вещества, образующие в водном растворе ионы водорода и гидроксил-ионы соответственно. Такое определение было общепринятым в течение следующих 30 или 40 лет. За это время было получено много количественных соотношений для процессов диссоциации и гидролиза, для буферных растворов, и для индикаторных равновесий, таким образом, многие результаты получили удовлетворительное объяснение. [c.15]
Если различия значений потенциалов полуволн карбонилсодержащих соединений в спиртовых и в диметилформамидных растворах обусловлены только различием в протонодонорных свойствах растворителей, то полярографирование этих веществ в диметилформамидных и спиртовых растворах в присутствии кислот должно было бы привести к смещению потенциалов полуволн в сторону но.ложительных нотенциалов и притом на величину, пропорциональную протонодонорным свойствам добавляемой кислоты, которые количественно выражаются константой кислотности Ка- Это обстоятельство может быть использовано для количественной характеристики кислотности таких веществ, для которых практически отсутствуют надежные методы определения силы кислоты в данной среде.
Естественно, что влияние растворителя на кислотно-основные равновесия наиболее значительно тогда, когда сам растворитель участвует в равновесии, ак в случае определения силы кислоты стандартным методам при помощи реакции А-[-5Нч=ьВ-+-5Н 2 (где 5Н—молекула растворителя). Существование такого равновесия предполагает, что растворитель обладает свойствами основания, подобно тому как протекание реакции В + 5Н (где 5 — анион, образованный из молекулы растворителя отщеплением протона) предполагает его кислотность. Если рассматривать щирокий круг растворителей, то наиболее важным свойством, качественно определяющим поведение растворит еля, является его (КИСЛОТНОСТЬ или основность, обусловленная химической природой. В предварительной классификации растворителей мы можем пренебречь другими факторами, в частности влиянием диэлектрической проницаемости на ассоциацию ионов или взаимодействием между ними. [c.60]
К). ОПРЕДЕЛЕНИЕ СИЛЫ КИСЛОТ И КИСЛОТНОСТИ РАСТВОРОВ [c.35]
Значения потенциалов полунейтрализации кислот и оснований зависят от многих факторов, поэтому определение относительной шкалы кислотности каждого растворителя проводилось с одной и той же системой титрантов хлорная кислота — гидроокись тетраэтиламмония и одной и той же системой электродов стеклянный— насыщенный каломельный. Идеальным случаем явился бы тот, при котором растворы хлорной кислоты и гидроокиси тетраэтиламмония приготовлялись бы в среде исследуемого растворителя. Однако, если это условие выполнимо почти для всех случаев в отношении хлорной кислоты, то раствор гидроокиси тетраэтиламмония в силу некоторых технических причин или в силу нерастворимости гидроокиси тетраалкиламмония в некоторых растворителях готовился в среде смешанного растворителя бензол—метиловый спирт, находящего наиболее широкое применение при титриметрических определениях в аналитической химии неводных растворов.
Ниже приводятся разработанные нами методики определения серебра в рудах, концентратах, черновой меди. Для того чтобы получать устойчивые, хорошо воспроизводимые результаты, надо соблюдать некоторые простые предосторожности . Температура раствора перед титрованием не должна превышать 20—22° С, так как растворимость осадка иодида серебра возрастает с увеличением температуры. После каждого определения электрод следует протирать фильтровальной бумагой, а в конце рабочего дня погружать в раствор тиосульфата. Титрование лучше проводить при pH около 2—2,5, так как при таком pH исключается гидролиз солей алюминия (образование коллоидных частиц гидроокиси алюминия вызывает понижение силы тока после конечной точки и, следовательно, менее четкую конечную точку) кроме того, даже при отсутствии алюминия такая кислотность раствора способствует возрастанию тока окисления избыточного иодида. Титрование при pH 2—2,5 исключает влияние марганца (II), который не окисляется анодно при потенциале титрования серебра в менее кислых растворах (при pH больше 2,5) возможно отложение двуокиси марганца на поверхности платинового электрода и появление начального тока, что в известной мере мешает определению серебра. Не следует удалять железо из раствора перед титрованием серебра, так как при этом возможны потери серебра с осадком гидроокиси железа. В отличие от катодного метода не нужно также связывать железо в комплексные соединения, Ре +-ион при потенциале титрования серебра +1,0 в (МИЭ) не восстанавливается на электроде и совершенно не мешает ни реакции в растворе (см. выше), ни анодной реакции иодида. Нельзя оставлять растворы, в которых предполагается титровать серебро, под тягой, где выпаривают солянокислые растворы или где хранится соляная кислота раствор поглощает хлориды и расход иодида на титрова- [c.301]
Как уже указывалось, в разбавленных водных растворах молекулы кислот отдают протоны воде в различной степени, зависящей от силы кислоты, так что в разбавленных растворах сильных кислот эффективной частицей является ион гидроксония Н3О+. Кислотность , или тенденция таких растворов отдавать протон какому-либо основанию, измеряется как концентрация иона гидроксония, и обычно ее рассматривают как pH раствора. Рассчитать или измерить концентрацию иона гидроксония в таких разбавленных растворах не очень трудно, однако в случае более концентрированных растворов возникают большие трудности величины, рассчитанные из констант диссоциации кислоты и измеренные часто по электродвижущим силам соответствующих концентрационных элементов, представляют собой активности-, способы же расчета концентрации иона гидроксония из активности не известны, за исключением расчета для разбавленного раствора. Трудности определения и измерения pH в концентрированных растворах были достаточно четко выявлены Бейтсом [38]. [c.72]
Значительную информацию о механизмах кислотно-катализируемых реакций можно получить при использовании кислотных функций. В разбавленных растворах кислот наиболее распространенной мерой кислотности раствора является величина pH. Однако значение pH теряет свою ценность для более концентрированных растворов, где коэффициент кислотности заметно отличается от единицы. Для таких растворов более удовлетворительным является измерение силы кислоты в
Acid прочность — Acid strength
Кислота сила относится к тенденции к кислоте , символизируемой химической формулой HA, диссоциировать в протон , H + , и анион , A — . Диссоциации сильной кислоты в растворе эффективно завершено, за исключением самых концентрированных растворов.
- HA → H + + А —
Примеры сильных кислот являются соляная кислота (HCl), хлорная кислота (HClO 4 ), азотная кислота (HNO 3 ) и серная кислота (H 2 SO 4 ).
Слабая кислота лишь частично диссоциированы, как с недиссоциированная кислота и ее продукты диссоциации присутствует в растворе в равновесии друг с другом.
- HA ⇌ Н + + А — .
Уксусная кислота (СН 3 СООН) является примером слабой кислоты. Сила слабой кислоты количественно с помощью своей кислотной константы диссоциации , р К значение.
Силы слабой органической кислоты могут зависеть от замещающих эффектов. Прочность на неорганической кислоты зависит от степени окисления для атома , к которому может быть присоединен протон. Кислота сила растворителя зависит. Так , например, хлористый водород , является сильной кислотой в водном растворе, но является слабой кислотой при растворении в ледяной уксусной кислоте .
Меры силы кислоты
Обычной мерой силы кислоты является ее кислоты константа диссоциации ( K ), которые могут быть определены экспериментально путем титрования методами. Более сильные кислоты имеют больший K A и меньшую константу логарифмическую (р К = -log К а ) , чем более слабым кислотам. Сильнее кислота, тем более легко он теряет протон, H + . Два ключевых фактора , которые способствуют легкости депротонирования являются полярность Н-связи , и размер атома А, которые определяют прочность Н-связь. Кислотные силы зависят также от стабильности сопряженной базы.
В то время как р К значение измеряет тенденцию кислотного растворенного вещества для переноса протона к стандартному растворителе (обычно вода или ДМСО ), тенденция кислотного растворителя для переноса протона к опорному растворенного вещества (наиболее часто слабая анилина базовой ) измеряется его функцией Гаммета кислотности , в Н 0 значение. Хотя эти две концепции силы кислоты , часто составляют одной и той же общей тенденции вещества, донором протона, то р K A и H 0 значения являются мерой различных свойств и иногда могут расходиться. Так , например, фтористый водород, является ли растворенный в воде (р К с = 3.2) или ДМСО (р К с = 15), имеет р К а значения , указывающие , что он подвергается неполной диссоциации в этих растворителях, что делает его слабой кислотой. Тем не менее, как тщательно высушивают, аккуратным кислой среде, фтористый водород имеет H 0 значение -15, что делает его более сильно протонирования средой , чем 100% -ной серной кислоты и , таким образом, по определению, суперкислотных . (Чтобы предотвратить двусмысленность, в остальной части этой статьи, «сильной кислоты» будет, если не указано иное, относятся к кислоты , которая является сильной , как измеряется его р К значением (р К <-1,74). Это использование согласуется с просторечии большинства практикующих химиков.)
Когда кислая среда в вопросе представляет собой разбавленный водный раствор, то Н — приблизительно равен рН стоимость, которая представляет собой отрицательный логарифм концентрации водного раствор H + в растворе. РН простого раствора кислоты в воде определяется как K A и концентрации кислоты. Для растворов слабых кислот, это зависит от степени диссоциации , которая может быть определена путем расчета равновесия. Для концентрированных растворов кислот, особенно сильных кислот , для которых рН <0, Н 0 значение является лучшим показателем кислотности , чем рН.
Сильные кислоты
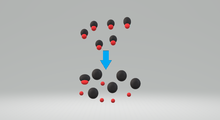 Изображение сильной кислоты в основном диссоциация. Маленькие красные круги представляют собой Н + ионов.
Изображение сильной кислоты в основном диссоциация. Маленькие красные круги представляют собой Н + ионов.Сильная кислота представляет собой кислоту , которая диссоциирует по реакции
- HA + S ⇌ SH + + А —
где S представляет собой молекулу растворителя, такие как молекулы воды или ДМСО , до такой степени , что концентрация недиссоциированных видов HA является слишком низкой , чтобы быть измерено. Для практических целей сильной кислоты , можно сказать, полностью диссоциирует. Примером сильной кислоты является хлористоводородной кислотой
- HCl → Н + + Cl- — (в водном растворе)
Любая кислота с ар K значением , которое меньше , чем около -2 классифицируются как сильная кислота. Это связано с очень высокой буферной емкости растворов с рН 1 или менее , и известен как эффект выравнивания .
Ниже приведены сильные кислоты в водном и растворе диметилсульфоксида. Величины р К а , не могут быть измерены экспериментально. Значения в таблице приведены средние значения из целых 8 различных теоретических расчетов.
Оценочные р К а значения кислота формула в воде в ДМСО Соляная кислота HCl -5,9 ± 0,4 -2,0 ± 0,6 бромистоводородная кислота HBr -8,8 ± 0,8 -6,8 ± 0,8 йодисто-водородная кислота ПРИВЕТ -9,5 ± 1 -10,9 ± 1 трифторметансульфокислоту Н [CF 3 SO 3 ] -14 ± 2 -14 ± 2 Хлорная кислота Н [ClO 4 ] -15 ± 2 -15 ± 2
Кроме того, в воде
Следующее может быть использовано в качестве protonators в органической химии
Сульфоновые кислоты , такие как п-толуолсульфоновой кислота (tosylic кислота) представляют собой класс сильных органических оксикислот. Некоторые сульфоновые кислоты могут быть выделены в виде твердых веществ. полистирола , функционализированная в полистиролсульфонат является примером вещества , которое является твердым веществом сильной кислоты.
Слабые кислоты
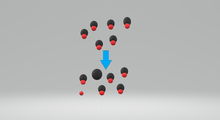 Изображение слабой кислоты частично диссоциировать
Изображение слабой кислоты частично диссоциироватьСлабая кислота представляет собой вещество, которое частично диссоциирует, когда она растворяется в растворителе. В растворе существует равновесие между кислотой, HA, и продуктами диссоциации.
- ЧАСA⇌ЧАС++A-{\ Displaystyle \ mathrm {HA} \ rightleftharpoons \ mathrm {Н ^ {+} + А ^ {-}}}
Растворитель (например , вода) опускается из этого выражения , когда его концентрация эффективно неизменной в процессе кислотной диссоциации. Сила слабой кислоты может быть количественно определена в терминах константы диссоциации , К , определяется следующим образом , где [X] означает концентрацию химического фрагмента, X.
- Кaзнак равно[ЧАС+][A-][AЧАС]{\ Displaystyle К_ {а} = {\ гидроразрыва {[Н ^ {+}] [А ^ {-}]} {[AH]}}}
Когда численное значение K а известно , что может быть использовано для определения степени диссоциации в растворе с заданной концентрацией кислоты, T H , применяя закон сохранения массы .
- TЧАСзнак равно[ЧАС]+[ЧАСA]знак равно[ЧАС]+Кa[A][ЧАС]знак равно[ЧАС]+Кa[ЧАС]2{\ Displaystyle {\ {начинаются выровнены} Т_ {H} & = [Н] + [HA] \\ & = [Н] + К_ {а} [А] [Н] \\ & = [Н] + К_ { а} [Н] ^ {2} \ {конец выровнен}}}
где Т Н является значение аналитической концентрации кислоты. Когда все величины в этом уравнении, рассматриваются как числа, ионные заряды не показаны , и это становится квадратным уравнением в значении величины концентрации ионов водорода, [Н] .
- Кa[ЧАС]2+[ЧАС]-TЧАСзнак равно0{\ Displaystyle К_ {а} [Н] ^ {2} + [Н] -T_ {H} = 0}
Это уравнение показывает , что рН раствора слабой кислоты зависит от того, как его K значения и его концентрации. Типичные примеры слабых кислот включают уксусную кислоту и фосфорную кислоту . Кислоты , такие как щавелевая кислоты (HOOC-COOH) называются двухосновными , потому что она может потерять два протона и реагирует с двумя молекулами простого основания. Фосфорная кислота (Н 3 РО 4 ) является трехосновной.
Для более строгого лечения кислоты прочности см кислоты константа диссоциации . Это включает в себя кислоты , такие как двухосновной кислоты янтарной кислоты , для которых не может быть использован простой способ вычисления рН раствора, как показано выше,.
Экспериментальное определение
Экспериментальное определение ар К в стоимости обычно осуществляется с помощью титрования . Типичная процедура будет выглядеть следующим образом . Некоторое количество сильной кислоты добавляет к раствору , содержащему кислоту или соль кислоты, до точки , где соединение является полностью протонированным. Раствор затем титруют с сильным основанием
- НА + ОН — → A — + Н 2 О
пока только депротонированный вид, А — , остается в растворе. В каждой точке титрования рН измеряли с помощью стеклянного электрода и рН — метра . Константа равновесия найдена путем подгонки расчетные значения рН до наблюдаемых значений, с использованием метода наименьших квадратов .
Конъюгат кислоты / пара оснований
Иногда указано , что «конъюгат слабой кислоты является сильным основанием». Такое утверждение неверно. Так , например, уксусная кислота является слабой кислотой , которая имеет K A = 1,75 × 10 -5 . Его сопряженное основание представляет собой ацетат ион с K б = 10 -14 / К = 5,7 · 10 -10 (из соотношения К × К б = 10 -14 ), что , безусловно , не соответствует сильному основанию. Конъюгат слабой кислоты часто является слабым основанием , и наоборот .
Кислоты в неводных растворителях
Сила кислоты варьирует от растворителя к растворителю. Кислота , которая является сильной в воде может быть слабой в менее основном растворителе, и кислоты , который является слабым в воде могут быть сильными в более основном растворителе. В соответствии с Бренстеда-Лоури теории кислотно-основного , то S растворитель может принимать протон.
- HA + S ⇌ — + HS + .
Так , например соляная кислота является слабой кислотой в растворе в чистой уксусной кислоте , HO 2 CCH 3 , который является более кислым , чем вода.
- HO 2 CCH 3 + HCl ⇌ (HO) 2 CCH 3 + + Cl- —
Степень ионизации галогенводородных кислот уменьшается в порядке HI> НВг> HCl. Уксусная кислота называется дифференцированием растворителя для трех кислот, в то время как вода не.
Важным примером растворителе , который является более основным , чем вода является диметилсульфоксид , ДМСО, (СН 3 ) 2 SO. Соединение , которое является слабой кислотой в воде может стать сильной кислотой в ДМСО. Уксусная кислота является примером такого вещества. Обширная библиография р К через значения в виде раствора в ДМСО и других растворителях может быть найдена на Кислотности-основность данных в неводных растворителях .
Сверхкислоты являются сильными кислотами , даже в растворителях с низкой диэлектрической проницаемостью. Примеры суперкислот являются гексафтороантимонатом водородом и магией кислоты . Некоторые суперкислоты можно кристаллизовать. Они также могут количественно стабилизировать карбокатионы .
Факторы, определяющие силу кислоты
Индуктивный эффект
В органических карбоновых кислотах, электроотрицательный заместитель может тянуть электронную плотность из кислой связи через индуктивный эффект , что приводит к меньшим р К а значению. Эффект уменьшается, тем дальше электроотрицательным элементом является из карбоксильной группы, как показано на следующей серии галогенированных бутановой кислоты .
| Состав | название | р К |
|---|---|---|
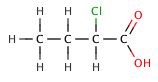 | 2-chlorobutanoic кислоты | 2,86 |
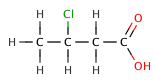 | 3-chlorobutanoic кислоты | 4,0 |
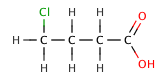 | 4-chlorobutanoic кислоты | 4.5 |
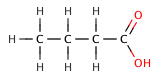 | бутановая кислота | 4.5 |
Влияние степени окисления
В наборе оксокислот одного элемента, р K а значения уменьшаются с степенью окисления элемента. Оксокислоты хлора иллюстрируют эту тенденцию.
† теоретическая
Рекомендации
внешняя ссылка
сила кислоты — это… Что такое сила кислоты?
сила кислоты — Крепость раствора кислоты [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN acid strength … Справочник технического переводчика
КИСЛОТЫ — КИСЛОТЫ, группа веществ, физически весьма различных, но обладающих характерными химич. свойствами. Первоначальное мнение Лавуазье (Lavoisier), что для К. лоты характерно присутствие Оа, давно изменено после открытия бескислородных к т (HCN… … Большая медицинская энциклопедия
Карбоновые кислоты — класс органических соединений, содержащих карбоксильную группу (карбоксил) Большинство К. к. имеет тривиальные названия, многие из которых связаны с их нахождением в природе, например муравьиная, яблочная, валериановая, лимонная… … Большая советская энциклопедия
Диэтиламид лизергиновой кислоты — ЛСД Химическое соединение ИЮПАК (6aR,9R) N,N диэтил 7 метил 4,6,6a,7,8,9 гексадигидроиндоло [4,3 fg]хинолин 9 карбоксамид Брутто … Википедия
Диэтиламид d-лизергиновой кислоты — ЛСД Химическое соединение ИЮПАК (6aR,9R) N,N диэтил 7 метил 4,6,6a,7,8,9 гексадигидроиндоло [4,3 fg]хинолин 9 карбоксамид Брутто … Википедия
Диэтиламид Лизергиновой Кислоты — ЛСД Химическое соединение ИЮПАК (6aR,9R) N,N диэтил 7 метил 4,6,6a,7,8,9 гексадигидроиндоло [4,3 fg]хинолин 9 карбоксамид Брутто … Википедия
КИСЛОТА СОЛЯНАЯ — Acidum hydrochloricum. Синоним: кислота хлористоводородная. Свойства. Бесцветная прозрачная летучая жидкость своеобразного запаха, кислого вкуса. Смешивается с водой и спиртом во всех отношениях, образуя растворы кислой реакции. Удельный вес 1,1 … Отечественные ветеринарные препараты
Теории кислот и оснований — совокупность фундаментальных физико химических представлений, описывающих природу и свойства кислот и оснований. Все они вводят определения кислот и оснований двух классов веществ, реагирующих между собой. Задача теории предсказание продуктов… … Википедия
Суперкислота — Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей. Суперкислота (или сверхкислота … Википедия
КАТАЛИЗ — ускорение химических реакций под действием малых количеств веществ (катализаторов), которые сами в ходе реакции не изменяются. Каталитические процессы играют огромную роль в нашей жизни. Биологические катализаторы, называемые ферментами,… … Энциклопедия Кольера
Электронная плотность — плотность вероятности обнаружения электрона в данной точке конфигурационного пространства. Рассмотрим водородоподобный атом систему из двух зарядов: положительно заряженного тяжёлого ядра, и электрона, вероятность обнаружения которого… … Википедия
Кислоты органические, сила — Справочник химика 21
Осаждение белков органическими кислотами. Органические кислоты необратимо осаждают белок из растворов. Различные кислоты отличаются по силе действия. [c.23]Селеновая и теллуровая кислоты — бесцветные кристаллические вещества, хорошо растворимые в воде. Селеновая кислота по силе приближается к серной кислоте, тогда как теллуровая кислота — весьма слабая. Селеновая кислота энергично соединяется с водой и обугливает органические вещества. Окислительные свойства у них выражены сильнее, чем у серной кислоты. Например, концентрированная серная кислота окисляет только НВг и HI (с выделением Вгг и Ь), а селеновая и теллуровая кислоты окисляют и НС1 по реакции [c.304]
Из органических кислот наиболее сильной является муравьиная, приближающаяся по степени диссоциации к минеральным кислотам средней силы. Остальные органические кислоты значительно слабее. Так, например, константа диссоциации муравьиной кислоты равна 2,140-10 , уксусной — 0,176-10″» , а пропионовой — 0,134-10″ [c.112]
Чем больше концентрация протонов, тем быстрее идет гидролиз. Поэтому в качестве катализаторов применяют сильные минеральные кислоты. По силе минеральные и некоторые органические кислоты можно расположить в следу( ий ряд j — — , [c.287]
Смесь двух солей можно титровать и как смесь двух кислот разной силы. Например, смеси органических нитратов или нитратов сложных эфиров можно дифференцированно титровать как смесь двух кислот разной силы в среде метилизобутилкетона в качестве титранта используют [484] раствор гидроокиси тетрабутиламмония в смеси бензола с метиловым спиртом (10 1). Смеси солей как смеси кислот разной силы можно также титровать в [c.149]
Это кислоты средней силы. Для сравнения ниже даны значения рА» ряда неорганических и органических кислот. Здесь и далее приведены значения рА для воды в качестве растворителя. [c.92]
Эффективность противоизносного действия некоторых фосфорсодержащих соединений также связывается е их термической или гидролитической устойчивостью. В результате разложения присадок образуются органические кислоты различной силы, и чем выше сила кислоты (ниже рКд), тем более высокими противоизносными свойствами обладает соединение [25]. [c.45]
Эфиры кремневых кислот. Органические силикаты и силаны обычно применяют как гидравлические жидкости специального назначения и жидкие теплоносители. Как было показано на рис. 7, эти жидкости обладают низкой радиационной стойкостью типичные изменения их свойств при облучении приведены в табл. 13. [c.65]
Серная кислота обладает настолько сильным свойством поглощать воду, что ее можно использовать в качестве эффективного обезвоживающего средства. Газы, которые не реагируют с серной кислотой, можно высушивать пропусканием их через серную кислоту. Дегидратирующая сила концентрированной кислоты настолько велика, что под ее воздействием органические [c.297]
В точном соответствии с описанной выше методикой 25 г фракции было растворено в бензоле и обработано в делительной воронке 3 %-ным раствором двууглекислой соды. Исчезновения окраски содового раствора добиться не удалось, лишь уменьшилась сила окраски. Навеска продукта подверглась 22-кратной обработке раствором двууглекислой соды по 20 лл в каждой обработке. Всего ушло на обработку продукта 440 мл раствора двууглекислой соды. Все содовые вытяжки солей карбоновых кислот экстрагировались бензолом для извлечения нейтральных масел. Было произведено 2 обработки по 20 мл бензола каждая. После разложения серной кислотой раствора солей карбоновых кислот органические кислоты были извлечены эфиром. Отгонка растворителя производилась на водяной бане. Остаток в колбе высушивался в сушильном шкафу до постоянного веса. [c.220]
Это объясняется следующим образом. В сложных эфирах радикал спирта связан через кислород с карбонильной группой более часто встречающимися в органических соединениях ковалентными связями это несколько сближает эфиры по свойствам с альдегидами и кетонами. В отличие от этого в свободных кислотах водород карбоксила, способный к диссоциации в виде положительного иона, связан с остатком кислоты электростатическими силами притяжения (электровалентные связи). В анионе диссоциированной кислоты, как теперь установлено, по существу нет истинной карбонильной группы, содержащейся в альдегидах, кетонах и сложных эфирах (с. 214). [c.217]
Константы диссоциации этих промежуточных стадий (ступеней) приведены в табл. 7. Как видно из приведенных данных, по мере увеличения номера стадии (ступени) диссоциации уменьшается величина К. Электролиты, имеющие несколько ступеней диссоциации, диссоциируя по первой ступени, в большинстве случаев являются сильными электролитами, а по второй и особенно третьей — слабыми. Для органических кислот значение константы тем меньше, чем длиннее алифатическая цепочка. Объясняется это явление тем, что оторвать Н+-ион от аниона гораздо труднее, чем от незаряженного атома. В случае же длинной цепи в органической кислоте кулоновские силы взаямодействия между Н+-ионом и отрицательно зар яженным концом молекулы уменьшаются. Н. А. Измайлов показал, что при переходе от растворителя к растворителю константы диссоциации кислот изменяются в миллионы раз, а соотношения в силе кислот в тысячи раз. [c.71]
Селеновая и теллуровая кислоты получаются окислением НдЗеОз и НзТеОз сильными окислителями. Селеновая кислота по силе сходна с серной кислотой, так же гигроскопична и легко обугливает органические вещества ортотеллуровая кислота — весьма слабая кислота. [c.286]
Простейшим представителем двухосновных органических кислот является щавелевая (Н2С2О4), молекула которой слагается из двух карбоксильных групп (НООС—СООН). Щавелевая кислота представляет собой белое кристаллическое вещество, довольно хорошо растворимое в воде. Она является одной из органических кислот средней силы (/ i = 7-10 , /легкорастворимы только соли Na, К и NH . При действии сильных окислителей (КМпО и др.) щавелевая кислота легко окисляется до СО2 и Н2О. [c.317]
Перегруппировка им№т препаративное двачение. так как с ое помощьто можпо получить ип только трудно доступные иными путями кетоны, но ц исходя из них, трехзамещешше уксусные кислоты. Катализаторами перегруппировки могут служить как органические кислоты средней силы, тан и минеральные кислоты. [c.878]
Н2С2О4 — органическая кислота средней силы. Поскольку она менее летучая, чем соляная кислота, то при нагревании вытесняет ее из солей [c.99]
По мере уменьшения силы льюисовских кислот слева направо (табл.2.3) сужается набор активаторов из однотипных рядов, содействующих генерированию АЦ. Самая сильная кислота (BF3) вызывает ионизацию всех активирующих оснований [37] и в этом смысле нивелирует их индивидуальность. Очевидно, индивидуальность активирующих оснований (способность ионизироваться) нивелируется и в прямо противоположном случае — при использовании слабой кислоты Льюиса из-за низких акцепторных свойств. Кроме