Элегантный силикат алюминия al2 sio3 3 cas поставщики для дома и бизнеса
Измените свое пространство с помощью самого инновационного. силикат алюминия al2 sio3 3 cas поставщики доступно на Alibaba.com. Они представлены в обширной коллекции, которая включает несколько типов с точки зрения дизайна и размеров. Благодаря неограниченной универсальности используемых материалов. силикат алюминия al2 sio3 3 cas поставщики можно использовать для всех видов продукции для различных целей. Соответственно, вам попадутся самые подходящие. силикат алюминия al2 sio3 3 cas поставщики, чтобы удовлетворить ваши потребности в соответствии с вашими требованиями.
Эти. Изготовлены из прочных и надежных материалов. силикат алюминия al2 sio3 3 cas поставщики предлагают удивительную долговечность. Из-за высокой температуры плавления и низкой теплопроводности. силикат алюминия al2 sio3 3 cas поставщики обладают высокой термостойкостью, что делает их идеальными для использования в качестве посуды и других важных домашних и промышленных компонентов. Их легко чистить благодаря их антипригарным свойствам. Таким образом, вы всегда сможете сохранить. силикат алюминия al2 sio3 3 cas поставщики в исходном привлекательном состоянии.
Их легко чистить благодаря их антипригарным свойствам. Таким образом, вы всегда сможете сохранить. силикат алюминия al2 sio3 3 cas поставщики в исходном привлекательном состоянии.
Все. силикат алюминия al2 sio3 3 cas поставщики на Alibaba.com обладают невероятной прочностью и способностью удерживать тяжелые грузы без поломок. В то же время расширение. силикат алюминия al2 sio3 3 cas поставщики впечатляюще химически инертны. В связи с этим они совместимы практически со всеми типами химических соединений. Это делает их идеальными для хранения и переноски нескольких продуктов и других товаров. При совершении покупок на сайте высшее качество. силикат алюминия al2 sio3 3 cas поставщики гарантируется, потому что все поставщики имеют надежный опыт стабильной поставки продуктов премиум-класса.
Получите максимальную отдачу от своих денег, получив высочайшее качество продукции. Оцените замечательное. силикат алюминия al2 sio3 3 cas поставщики на Alibaba. com и определите, что больше всего соответствует вашим потребностям. Сравните предложения из нескольких. силикат алюминия al2 sio3 3 cas поставщики оптовиков и поставщиков на сайте, чтобы получить лучшие предложения для оптимальной прибыли.
com и определите, что больше всего соответствует вашим потребностям. Сравните предложения из нескольких. силикат алюминия al2 sio3 3 cas поставщики оптовиков и поставщиков на сайте, чтобы получить лучшие предложения для оптимальной прибыли.
«Запретные» вещества могут ускорять теплоперенос и усиливать магнитное поле на суперземлях
Суперземля Gliese 832с в сравнении с нашей планетой
Ученые с помощью математического моделирования «заглянули» в недра суперземель и выяснили, что в них могут существовать соединения, запрещённые классической химией — эти вещества могут ускорять теплоперенос и усиливать магнитное поле таких планет, говорится в статье, опубликованной в журнале Scientific Reports.
Авторы исследования — группа из МФТИ под руководством Артёма Оганова, профессора Сколтеха и заведующего лабораторией в МФТИ. Ранее Оганов и его коллеги с помощью алгоритма USPEX открыли новые соединения натрия и хлора, другие экзотические вещества.
В новой работе они попытались выяснить, какие соединения могут образовывать кремний, кислород и магний при высоких давлениях. Эти элементы были выбраны не случайно.
«Планеты земного типа состоят из тонкой силикатной коры, силикатно-оксидной мантии — которая у Земли составляет примерно 7/8 объема и состоит более, чем на 90% из силикатов и оксида магния, и железного ядра. Можно сказать, что магний, кислород и кремний являются основой химии Земли и планет земного типа», — говорит Оганов.
С помощью алгоритма USPEX ученые исследовали различные структурные композиции Mg-Si-O, которые могут возникать в диапазоне давлений от 5 до 30 миллионов атмосфер. Такое давление может существовать в недрах суперземель, планет с твёрдой поверхностью, чья масса в несколько раз выше массы Земли. Таких планет нет в Солнечной системе, однако астрономам известны планеты у других звёзд, которые «не дотягивают» по массе до газовых гигантов, но существенно тяжелее Земли. Их и называют суперземлями. К ним относятся, например, недавно открытая Gliese 832с, которая в пять раз тяжелее Земли или мега-земля Kepler-10c — её масса в 17 раз больше земной.
Их и называют суперземлями. К ним относятся, например, недавно открытая Gliese 832с, которая в пять раз тяжелее Земли или мега-земля Kepler-10c — её масса в 17 раз больше земной.
Результаты компьютерного моделирования показали, что в недрах таких планет могут существовать «экзотические» соединения MgSi3O12 и MgSiO6. В них гораздо больше атомов кислорода, чем в нашем «земном» MgSiO3.
Кроме того, MgSi3O12 – металлический оксид, это проводник, в то время как остальные вещества, состоящие из атомов Mg-Si-O – диэлектрики или полупроводники.
«Их свойства очень сильно отличаются от обычных соединений магния, кислорода и кремния — многие являются металлами или полупроводниками. Это важно для генерации магнитных полей на этих планетах. Поскольку магнитные поля генерируются конвекцией электрически проводящего вещества планетных недр, высокая проводимость может означать более мощное магнитное поле», — поясняет Оганов.
В свою очередь, более сильное магнитное поле означает более мощную защиту от космической радиации, а значит и более благоприятные условия для живых организмов.
Моделирование также позволило учёным выяснить, какие реакции распада при сверхвысоких давлениях суперземель испытывает MgSiO3 — пост-перовскит.
«От этого зависят границы слоев в мантии и их динамика. Например, экзотермическое фазовое превращение ускоряет конвекцию мантии и теплоперенос внутри планеты, а эндотермическое — замедляет. То есть скорость перемещения литосферных плит на такой планете может быть выше», — отмечает Оганов.
По его словам, конвекция, которая определяет тектонику плит и перемешивание мантийного вещества, может быть более быстрой (ускоряя перемешивание вещества и перенос тепла), либо более медленной. Для случая эндотермического превращения возможен сценарий расслоения планеты на несколько независимо конвектирующих оболочек, отметил он.
Благодаря тому, что земные континенты перемещаются, «плавая» на поверхности мантии, на Земле есть вулканизм и атмосфера.
Таблица растворимости — Электронный учебник K-tree
Скачать изображениеРастворимость — это свойство вещества растворяться в воде или другом растворителе. В воде могут растворяться и твёрдые и жидкие и газообразные вещества. По растворимости все вещества делятся на три группы:
- хорошо растворимые
- мало растворимые
- нерастворимые
Абсолютно нерастворимых веществ несуществует, поэтому название нерастворимые условно и нужно читать «практически нерастворимые».
Растворимость веществ зависит от температуры зависит от температуры и давления, так, например, вещество KNO
Нерастворимые вещества
Твёрдые- Стекло
- Сера
- Золото
- Бензин
- Растительное масло
Малорастворимые вещества
Твёрдые- Алебастр
- Сульфат свинца
- Диэтиловый эфир
- Бензол
- Метан
- Азот
- Кислород
Растворимые вещества
Твёрдые- Соль
- Медный купорос
- Хлороводород
- Аммиак
| КатионыАнионы | OH— | F— | Cl— | Br— | I— | S2- | NO3— | CO32- | SiO32- | SO42- | PO43- |
| H+ | Р | Р | Р | Р | Р | М | Р | — | Н | Р | Р |
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Mg2+ | Н | РК | Р | Р | Р | М | Р | Н | РК | Р | РК |
| Ca2+ | М | НК | Р | Р | Р | М | Р | Н | РК | М | РК |
| Sr2+ | М | НК | Р | Р | Р | Р | Р | Н | РК | РК | РК |
| Ba2+ | Р | РК | Р | Р | Р | Р | Р | Н | РК | НК | РК |
| Sn2+ | Н | Р | Р | Р | М | РК | Р | Н | Н | Р | Н |
| Pb2+ | Н | Н | М | М | М | РК | Р | Н | Н | Н | Н |
| Al3+ | Н | М | Р | Р | Р | Г | Р | Г | НК | Р | РК |
| Cr3+ | Н | Р | Р | Р | Р | Г | Р | Г | Н | Р | РК |
| Mn2+ | Н | Р | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe3+ | Н | Р | Р | Р | — | — | Р | Г | Н | Р | РК |
| Co2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Ni2+ | Н | М | Р | Р | Р | РК | Н | Н | Р | Н | |
| Cu2+ | Н | М | Р | Р | — | Н | Р | Г | Н | Р | Н |
| Zn2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cd2+ | Н | Р | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Hg2+ | Н | Р | Р | М | НК | НК | Р | Н | Н | Р | Н |
| Hg22+ | Н | Р | НК | НК | НК | РК | Р | Н | Н | М | Н |
| Ag+ | Н | Р | НК | НК | НК | НК | Р | Н | Н | М | Н |
| КатионыАнионы | OH— | F— | Cl— | Br— | I— | S2- | NO3— | CO32- | SiO32- | SO42- | PO43- |
Таблица 1. Растворимость веществ Растворимость веществ
|
|||||||||||
Список растворимости элементов
вещество хорошо растворимо в воде
вещество малорастворимо в воде
вещество практически нерастворимо в воде, но легко растворяется в слабых или разбавленных кислотах
- H-SiO3
- Ba-CO3
- Pb-OH
- Pb-PO4
- Mn-S
- Fe-S
- Fe-SiO3
- Co-PO4
- Cu-OH
- Zn-CO3
- Cd-SiO3
- Hg-PO4
- Ag-OH
- Mg-OH
- Sn-OH
- Pb-F
- Al-OH
- Mn-CO3
- Fe-CO3
- Co-OH
- Ni-OH
- Cu-S
- Zn-SiO3
- Cd-PO4
- Hg2-OH
- Ag-CO3
- Mg-CO3
- Sn-CO3
- Pb-CO3
- Cr-OH
- Mn-SiO3
- Fe-SiO3
- Co-S
- Ni-CO3
- Cu-SiO3
- Zn-PO4
- Hg-OH
- Hg2-CO3
- Ag-SiO3
- Ca-CO3
- Sn-SiO3
- Pb-SiO3
- Cr-SiO3
- Mn-PO4
- Fe-PO4
- Co-CO3
- Ni-SiO3
- Cu-PO4
- Cd-OH
- Hg-CO3
- Hg2-SiO3
- Ag-PO4
- Sr-CO3
- Sn-PO4
- Pb-SO4
- Mn-OH
- Fe-OH
- Fe-OH
- Co-SiO3
- Ni-PO4
- Zn-OH
- Cd-CO3
- Hg-SiO3
- Hg2-PO4
вещество нерастворимо в воде и растворяется только в сильных неорганических кислотах
вещество нерастворимо ни в воде, ни в кислотах
вещество полностью гидролизуется при растворении и не существует в контакте с водой
вещество не существует
Скачать статью в формате PDF.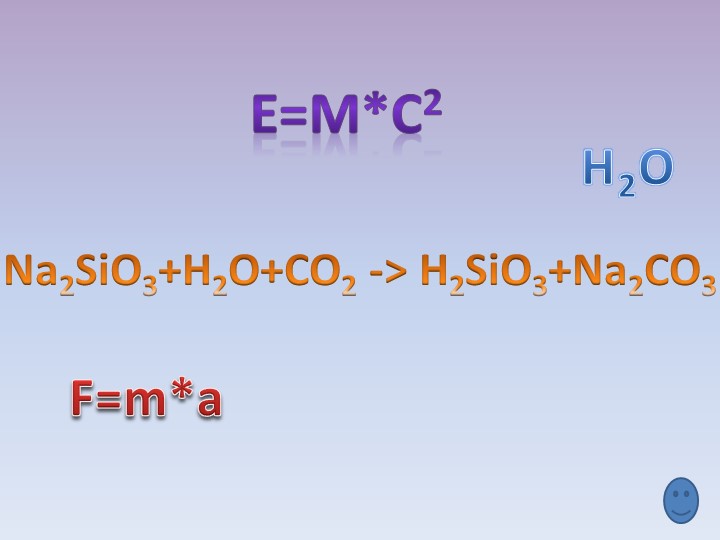
Кремний и его соединения
Кремний и его соединения
Автор: edu2
Методическая копилка — Химия
Разработка урока по химии в 9 классе
УМК О.С.Габриелян «Химия 9 кл.»
Тема «Кремний и его соединения»
Тип урока: лекция (включает элементы беседы и лабораторный опыт)
Цели урока: — дать общую характеристику кремния;
— рассмотреть природные соединения кремния;
— провести сравнительный анализ с соединениями углерода;
— изучить особенности строения, свойства, способы получения и области применения кремния и его соединений: SiH4, SiO2, H2SiO3.
Задачи урока:
Образовательные:
- Сформировать представления учащихся о кремнии как о химическом элементе
- Продолжить формирование умений давать характеристику химическому элементу по положению его в периодической системе, составлять схему строения атома.

- Ознакомить учащихся с физическими и химическими свойствами кремния.
- Ознакомить учащихся с наиболее значимыми соединениями кремния и их применением.
Развивающие:
- Развивать умение определять закономерность между составом, строением, свойствами и применением веществ.
- Продолжить формирование умений учащихся анализировать, сравнивать, делать выводы.
Воспитательные:
- Воспитывать умения аккуратно вести записи в тетради.
- Формировать у учащихся познавательной активности к изучаемому предмету путем привлечения их в творческий процесс и знакомства с краеведческим материалом.
Оборудование: авторская презентация «Кремний и его соединения», реактивы: раствор соляной кислоты, раствор силикатного клея; штатив с пробирками; образцы природных соединений кремния ( гранит, горный хрусталь, кварц и др.), образцы изделий из стекла, фаянса, фарфора, керамики.
Ход урока:
- Вводная часть (слайд 1)
Подсказка. Представьте себе — встает человек утром с постели, подходит к зеркалу, а вместо него — пустая рамка, ищет очки, а от них лишь одна оправа; вдруг он ощущает порывы ветра, так как в доме нет ни одного окна; от ужаса человек хочет выпить глоток воды, но не может найти ни одной чашки, стакана — вообще нет никакой в доме посуды — все бесследно исчезло! И это только начало ужаса.
Далее треск, грохот — рушатся потолок, стены, они летят и рассыпаются, превращаясь в пыль и песок. Параллельно с этим выделяется огромное количество кислорода, который меняет состав воздуха, то есть земной атмосферы!
А самое страшное, что в последствии почти целиком исчезает земная кора, испаряются океаны и не существует больше жизнь на Земле.
Что это за элемент и почему его исчезновение могло вызвать такие катастрофические изменения? Подсказка. Что объединяет объекты на слайде между собой?
Учащиеся (предполагаемый ответ): Все объекты на слайде состоят из веществ, в состав которых входит кремний и элемент, о котором идет речь в рассказе, — кремний.
— Сегодня мы познакомимся с ещё одним неметаллом, значимость которого очень велика, т.к. по распространенности на Земле он второй после кислорода, — это кремний.
2.Кремний – химический элемент
1) Строение и свойства атома кремния (слайд 2-8)
Латинское название «силициум» берёт своё начало от латинского «силекс» — камень. С греческого языка «кремнос» — утёс, скала.
1 ученик у доски: характеристика положения кремния в таблице химических элементов
Д.И. Менделеева, возможные степени окисления, построение электронной формулы атома кремния.
2 ученик делает обобщение:
-У кремния электроны расположены на трёх энергетических уровнях, а у углерода – на двух, следовательно, окислительные (неметаллические) свойства у кремния выражены слабее, а восстановительные (металлические) – сильнее.
2) Нахождение в природе (слайды 9-14)
(материал о биологическом значении кремния в организме человека готовиться учащимися за ранее)
— Земная кора на одну четверть состоит из соединений кремния. Наиболее распространённым является оксид кремния (IV) – кремнезём. В природе он образует минерал кварц и многие другие разновидности: горный хрусталь, аметист, агат, опал, яшма, халцедон, сердолик (полудрагоценные камни), а также обычный кварцевый песок.
Наиболее распространённым является оксид кремния (IV) – кремнезём. В природе он образует минерал кварц и многие другие разновидности: горный хрусталь, аметист, агат, опал, яшма, халцедон, сердолик (полудрагоценные камни), а также обычный кварцевый песок.
Именно кремень положил начало каменному веку. Причин этому две: доступность и распространённость, а также способность образовывать на сколе острые режущие края.
Второй тип природных соединений кремния – силикаты. Самые распространённые алюмосиликаты: гранит, различные виды глин, слюды. Не содержащий алюминия силикат – асбест (из него изготавливают огнестойкие ткани)
Кремний придаёт гладкость и прочность костям человека, входит в состав низших живых организмов – диатомовых водорослей и радиолярий (образует их скелеты) .
3.Кремний – простое вещество(15-32)
1)Аллотропные модификации кремния
2)Строение кристаллического кремния
3)Физические свойства
— Вы обратили внимание, что когда мы говорим о содержании в природных условиях элемента кремния, то упоминаем только его соединения, но не простое вещество.
Кремний в свободном виде в природе не встречается в отличие от углерода (алмаз,
графит, аморфный С и т.д.)
Кремний – неметалл, существует в кристаллическом и аморфном виде.
Кристаллический кремний – серовато-стального цвета с металлическим блеском, твёрдый (7 баллов по шкале Мооса), но хрупкий, малореакционноспособный; полупроводник, (с повышением температуры электропроводность повышается), и с нарушением правильности структуры.
Такие свойства обусловлены строением кристаллов, аналогичным структуре алмаза.
Физические константы: g = 2,33 г/см3; tпл.= 1415 0С; t кип.= 3500 0С
Аморфный кремний представляет собой порошок.
4) Открытие кремния
— Уже в глубокой древности люди широко использовали в своём быту соединения кремния. Вспомните древних людей. Из чего были изготовлены их орудия труда? Но сам кремний впервые был получен в 1824 г. Шведским химиком И. Я. Берцелиусом. Однако, за 12 лет до него кремний получили Ж. Гей-Люссак и Л. Тенар, но он был очень загрязнён примесями.
Я. Берцелиусом. Однако, за 12 лет до него кремний получили Ж. Гей-Люссак и Л. Тенар, но он был очень загрязнён примесями.
5) Получение кремния
— Способы получения кремния основаны в основном на восстановлении оксида кремния (IV) сильными восстановителями – активными металлами (Mg, Al) и углеродом.
Лабораторный способ: SiO2 + 2Mg = 2MgO + Si
Промышленный способ: SiO2 + 2C →t2CO + Si
6) Химические свойства
а) кремний — восстановитель
Все реакции протекают при нагревании!
- Si + O2 = SiO2 (оксид кремния (IV))
Si0 – 4e— Si+4 восстановитель
O2 + 4e— 2O-2 окислитель
- Si + 2Г2 = SiГ4 (галогенид кремния)
- Si + 2NaOH(конц.
 ) + H2O = Na2SiO3 + 2H2 ↑
) + H2O = Na2SiO3 + 2H2 ↑
б) кремний – окислитель
Si + 2Ca = Ca2Si (силицид кальция)
Вывод: свойства кремния и углерода похожи. Оба неметалла взаимодействуют с кислородом, галогенами, металлами. Но в отличие от углерода кремний напрямую не соединяется с водородом.
4.Соединения кремния (33-44)
1) Силан SiH4
-Силан получают косвенно, действуя на силициды металлов водой или кислотами:
Mg2Si + 4H2O = 2Mg(OH)2 + SiH4
Силан – бесцветный газ, самовоспламеняющийся на воздухе и сгорающий с образованием оксида кремния и воды:
SiH4 + 2O2 = SiO2 + 2H2O
2) Свойства кремнезёма
Рассматриваются свойства оксида кремния (IV) и проводится сравнительный анализ двух оксидов – SiO2 и CO2. Результаты обсуждения в виде таблицы выводятся на экран.
Результаты обсуждения в виде таблицы выводятся на экран.
Обратите внимание на одно важное свойство оксида кремния:
SiO2 + 4HF = 2H2O + SiF4
Оксид кремния входит в состав стекла, поэтому плавиковую кислоту нельзя хранить в стеклянной посуде.
Оксид кремния (IV) необходим и растениям, и животным. Он придаёт прочность стеблям растений и покровам животных ( камыши твёрдо стоят, осока режет, как лезвие, чешуя рыб, панцири насекомых, крылья бабочек, перья птиц, шерсть животных содержат оксид кремния (IV).
Вывод: физические свойства оксидов резко отличаются, т.к. они образуют разные кристаллические решётки – молекулярную (CO2) и атомную (SiO2), но химические свойства схожи. Отличие состоит в различном отношении к воде.
3) Кремниевая кислота и её соли
-кремниевая кислота H2SiO3 —единственная нерастворимая неорганическая кислота, — двухосновная,
— слабая H2SiO3 →tH2O +SiO2
При высыхании образует силикагель, используемый в качестве адсорбента.
Получить кремниевую кислоту можно только из её солей.
Проведение лабораторного опыта и составление уравнения реакции получения кремниевой кислоты (самостоятельно, на доске)
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
SiO32- + 2Н+ = H2SiO3
Соли кремниевой кислоты называют силикатами
Их можно получить сплавлением оксида кремния с оксидами металлов или карбонатами:
SiO2 + CaO = CaSiO3
SiO2 + CaCO3 = CaSiO3 + CO2
5.Применение соединений кремния в народном хозяйстве (слайды 45-47)
6. Заключительные выводы (слайд 48-49)
7. Самоконтроль (слайд 50)
8. Д/з (слайд 51)
Приложение 1.
Инструктивная карта по теме «Кремний и его соединения»
обучающегося _________ класса__________________________________________
(фамилия и имя)
|
Углерод и его соединения |
Кремний и его соединения |
|
1.Химический
1) Положение в ПСХЭ:2 период, IVA группа 2) Строение атома +6 С ) ) 1s22s22p2 2e 4e 3) Свойства атома Является элементом неметаллом Высшая СО = + 4 Низшая СО = – 4 4) Нахождение в природе Углерод – элемент жизни 2. Алмаз – твердый, очень прочный, прозрачный, не обладает электропроводностью и теплопроводностью. Графит – темно-серого цвета, имеет металлический блеск, мягкий, проводит тепло и электрический ток. 2) Строение Имеют атомную кристаллическую решетку. 3) ПолучениеSiO2 +3C = Si + C + 2CO (получение графита) 4) Химические свойства1. восстановительные:
2. окислительные:
3. Оксид углерода (IV) СО2 – кислотный оксид СтроениеМолекулярная кристаллическая решетка Физические свойстваГаз, при обычных условиях легко сжижается и затвердевает, в воде растворяется, тяжелее воздуха. Химические свойства1)Взаимодействие с водой СО2 + Н2О ↔ Н2СО3 2)Взаимодействие с основными оксидами СаО + СО2 = СаСО3↓ 3)Взаимодействие со щелочами 2КОН + СО2 = К2СО3 + НО 4) Взаимодействие с магнием 2Mg + CO2 = 2MgO + C 5)Взаимодействие с углеродом CO2 + C = 2CO 4. Кис Угольная кислота Н2СО3 Двухосновная, кислородсодержащая, слабая, летучая
Получение Может быть вытеснена из состава соли более сильными кислотами СаСО3 + 2 НCl = СaСl2 + Н2СО3 СО2↑ Н2О Химические свойства1)При нагревании разлагается: Н2СО3 ↔ СО2↑+ Н2О 2)Взаимодействие со щелочами: 2NaOH+H2CO3=Na2CO3 + 2H2O
|
элемент
1) Положение в ПСХЭ: 2)Строение атома +… Si 3) Свойства атома Является элементом…………………. Высшая СО = …… Низшая СО = …… 4) Нахождение в природе: вещества 1) Физические свойстваКристаллический кремний ….
Аморфный кремний……………
2) Строение Имеет ……………… кристаллическую решетку. 3) Получение1)в промышленности: 2)в лаборатории:
4) Химические свойства 1. восстановительные: 2. окислительные:
ды Оксид кремния (IV) …. — …………………… Строение……………… кристаллическая решетка Физические свойстваХимические свойства 1) Взаимодействие с водой 2) Взаимодействие с основными оксидами 3) Взаимодействие со щелочами 4) Взаимодействие с магнием 5) Взаимодействие с углеродом 6) взаимодействие с плавиковой кислотой лоты
Кремниевая кислота……… …………………………………………………
Получение Химические свойства1)При нагревании разлагается: 2) Взаимодействие со щелочами:
|
Самоконтроль
1. Какое место занимает кремний в периодической системе:
Какое место занимает кремний в периодической системе:
а) 2 период, 4Б гр. б) 3 период, 3А гр. в) 3 период, 4А гр.
2. Кристаллическая решетка кремния и его соединений :
а) ионная; б) атомная; в) молекулярная
3. По распространенности в природе кремний …. элемент:
а) первый; б) второй; в) третий
4. Кремний вступает в реакцию с:
а) металлами, водородом, галогенами;
б) металлами, галогенами, легко растворяется в щелочах;
в) оксидами, кислотами, неметаллами
5. Соли кремниевой кислоты:
а) силициды; б) гидрокарбонаты; в) силикаты
Кислоты — Госстандарт
Кислоты — химические соединения, способные отдавать катион водорода либо соединения, способные принимать электронную пару с образованием ковалентной связи.
В быту и технике под кислотами обычно подразумеваются кислоты Брёнстеда, образующие в водных растворах избыток ионов гидроксония h4O+. Присутствие этих ионов обуславливает кислый вкус растворов кислот, способность менять окраску индикаторов и, в высоких концентрациях, раздражающее действие кислот. Подвижные атомы водорода кислот способны замещаться на атомы металлов с образованием солей, содержащих катионы металлов и анионы кислотного остатка.
Кислотами называются сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться или обмениваться на атомы металла и кислотный остаток.
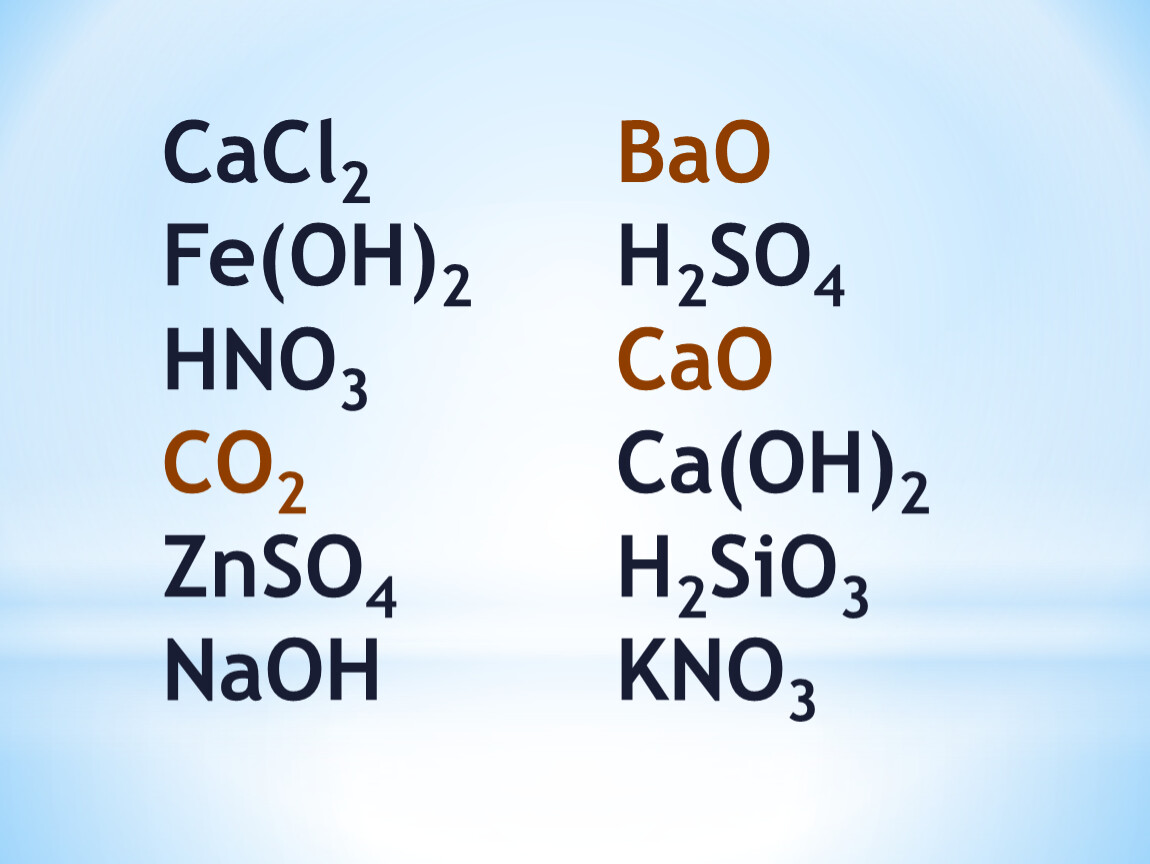
По наличию или отсутствию кислорода в молекуле кислоты делятся на кислородсодержащие (h3SO4 серная кислота, h3SO3 сернистая кислота, HNO3 азотная кислота, h4PO4фосфорная кислота, h3CO3 угольная кислота, h3SiO3кремниевая кислота) и бескислородные (HF фтороводородная кислота, HCl хлороводородная кислота (соляная кислота), HBr бромоводородная кислота, HI иодоводородная кислота, h3S сероводородная кислота).
Неорганических соединений, содержащих четыре атома водорода, способных замещаться на металл, очень мало.
Часть молекулы кислоты без водорода называется кислотным остатком.
Кислотные остатки могут состоять из одного атома (-Cl, -Br, -I) – это простые кислотные остатки, а могут – из группы атомов (-SO3, -PO4, -SiO3) – это сложные остатки.
В водных растворах при реакциях обмена и замещения кислотные остатки не разрушаются:
h3SO4 + CuCl2 → CuSO4 + 2 HCl↑
Слово ангидрид означает безводный, то есть кислота без воды. Например,
h3SO4 – h3O → SO3. Бескислородные кислоты ангидридов не имеют.
Своё название кислоты получают от названия образующего кислоту элемента (кислотообразователя) с прибавлением окончаний «ная» и реже «вая»: h3SO4 – серная; h3SO3 – угольная; h3SiO3 – кремниевая и т.д.
Элемент может образовать несколько кислородных кислот. В таком случае указанные окончания в названии кислот будут тогда, когда элемент проявляет высшую валентность (в молекуле кислоты большое содержание атомов кислорода). Если элемент проявляет низшую валентность, окончание в названии кислоты будет «истая»: HNO3 – азотная, HNO2 – азотистая.
Если элемент проявляет низшую валентность, окончание в названии кислоты будет «истая»: HNO3 – азотная, HNO2 – азотистая.
Кислоты можно получать растворением ангидридов в воде. В случае, если ангидриды в воде не растворимы, кислоту можно получить действием другой более сильной кислоты на соль необходимой кислоты. Этот способ характерен как для кислородных так и бескислородных кислот. Бескислородные кислоты получают так же прямым синтезом из водорода и неметалла с последующим растворением полученного соединения в воде:
h3 + Cl2 → 2 HCl;
h3 + S → h3S.
Растворы полученных газообразных веществ HCl и h3S и являются кислотами.
При обычных условиях кислоты бывают как в жидком, так и в твёрдом состоянии.
Химические свойства кислот
Растворы кислот действуют на индикаторы. Все кислоты (кроме кремниевой) хорошо растворяются в воде. Специальные вещества – индикаторы позволяют определить присутствие кислоты.
Индикаторы – это вещества сложного строения. Они меняют свою окраску в зависимости от взаимодействия с разными химическими веществами. В нейтральных растворах — они имеют одну окраску, в растворах оснований – другую. При взаимодействии с кислотой они меняют свою окраску: индикатор метиловый оранжевый окрашивается в красный цвет, индикатор лакмус – тоже в красный цвет.
Они меняют свою окраску в зависимости от взаимодействия с разными химическими веществами. В нейтральных растворах — они имеют одну окраску, в растворах оснований – другую. При взаимодействии с кислотой они меняют свою окраску: индикатор метиловый оранжевый окрашивается в красный цвет, индикатор лакмус – тоже в красный цвет.
Взаимодействуют с основаниями с образованием воды и соли, в которой содержится неизменный кислотный остаток (реакция нейтрализации):
H2SO4 + Ca(OH)2 → CaSO4 + 2 H2O.
Взаимодействуют с основанными оксидами с образованием воды и соли (реакция нейтрализации). Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации:
H3PO4 + Fe2O3 → 2 FePO4 + 3 H2O.
Взаимодействуют с металлами. Для взаимодействия кислот с металлами должны выполнятся некоторые условия:
1. металл должен быть достаточно активным по отношению к кислотам (в ряду активности металлов он должен располагаться до водорода). Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами;
металл должен быть достаточно активным по отношению к кислотам (в ряду активности металлов он должен располагаться до водорода). Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами;
2. кислота должна быть достаточно сильной (то есть способной отдавать ионы водорода H+).
При протекании химических реакций кислоты с металлами образуется соль и выделяется водород (кроме взаимодействия металлов с азотной и концентрированной серной кислотами,):
Zn + 2HCl → ZnCl2 + H2↑;
Cu + 4HNO3 → CuNO3 + 2 NO2 + 2 H2O.
Названия важнейших кислот и их солей
Формула кислоты | Название кислоты | Кислотный остаток | Название солей (кислотного остатка) |
HF | Фтороводородная | F— | Фториды |
HCl | Хлороводородная | Cl— | Хлориды |
HBr | Бромоводородная | Br— | Бромиды |
HI | Иодоводородная | I— | Иодиды |
HCN | Циановодородная | CN— | Цианиды |
H2S | Сероводородная | S2- | Сульфиды |
H2SO4 | Серная | SO42- | Сульфаты |
H2SO3 | Сернистая | SO32- | Сульфиты |
HNO3 | Азотная | NO3— | Нитраты |
HNO2 | Азотистая | NO2— | Нитриты |
H2CO3 | Угольная | CO32- | Карбонаты |
H3PO4 | Ортофосфорная | PO43- | Ортофосфаты |
HPO3 | Метафосфорная | PO3— | Метафосфаты |
H3PO3 | Фосфористая | HPO32- | Фосфиты |
H2CrO4 | Хромовая | CrO42- | Хроматы |
H2CrO7 | Дихромовая | Cr2O72- | Дихроматы |
H3CrO3 | Ортохромистая | CrO33- | Ортохромиты |
HMnO4 | Марганцовая | MnO4— | Перманганаты |
H2MnO4 | Марганцовистая | MnO42- | Манганаты |
H3BO3 | Ортоборная | BO33- | Ортобораты |
HBO2 | Метаборная | BO2— | Метабораты |
H2B4O7 | Тетраборная | B4O72- | Тетрабораты |
H3AlO3 | Ортоалюминиевая | AlO33- | Ортоалюминаты |
HalO2 | Метаалюминиевая | AlO2— | Метаалюминаты |
H4SiO4 | Ортокремниевая | SiO44- | Ортосиликаты |
H2SiO3 | Метакремниевая | SiO32- | Метасиликаты |
HСlO4 | Хлорная | ClO4— | Перхлораты |
HСlO3 | Хлорноватая | ClO3— | Хлораты |
HСlO2 | Хлористая | ClO2— | Хлориты |
HСlO | Хлорноватистая | ClO— | Гипохлориты |
ПолисиликатыПолисиликаты представляют собой геохимически важные соединения, образующиеся в результате реакции кислого оксида SiO 2 (кремнезема) и оксидов основных металлов. Эти соединения содержат определенные оксоанионы кремния, имеющие ковалентные связи Si-O, но не имеют простого силикат-иона SiO 4 4-. Скорее, они имеют много 2-координированных атомов кислорода, связывающих атомы кремния в олигомерные или полимерные структуры.Почти во всех силикатах кремний имеет координационное число 4. Эти соединения содержат определенные оксоанионы кремния, имеющие ковалентные связи Si-O, но не имеют простого силикат-иона SiO 4 4-. Скорее, они имеют много 2-координированных атомов кислорода, связывающих атомы кремния в олигомерные или полимерные структуры.Почти во всех силикатах кремний имеет координационное число 4.Ортосиликат-ион, SiO4 4- Ортосиликат-ион отсутствует в большом количестве минералов. Это очень сильное основание, которое не сохраняется в водном растворе. В природе встречается в сочетании с кислыми катионами в нерастворимых солях.
Полисиликаты олигомерныеПолимерные силикатные структуры требуют мостиковых (двухкоординатных) атомов кислорода.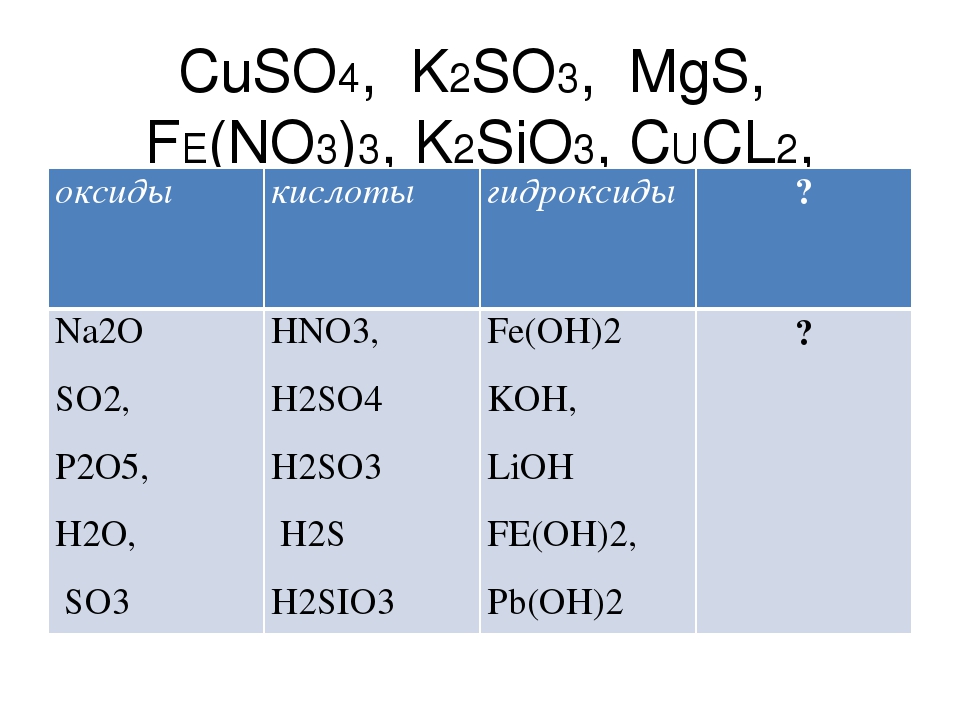 Чтобы освободить место для мостикового кислорода, из «принимающего» кремния необходимо удалить оксид. Чтобы освободить место для мостикового кислорода, из «принимающего» кремния необходимо удалить оксид. Дисиликат-ион редко встречается в природе. Встречается только в редком минерале тортвейтите Sc 2 Si 2 O 7 . Более крупные структуры, такие как трисиликат и тетрасиликат, чрезвычайно эффективны. Циклические олигомерные полисиликатыВместо того, чтобы образовывать длинные структуры с открытой цепью, концы цепей будут соединяться, устраняя ионы оксида.Ион метасиликата является олигомером неизвестного иона SiO 3 2-. В этих структурах каждый кремний имеет два мостиковых и два концевых атома кислорода. На атом кремния приходится -2 плотности заряда. Наиболее распространенными циклическими полисиликатами являются циклические тримеры (SiO 3 ) 3 6- и циклические гексамеры (SiO 3 ) 6 12-. Циклический тример обнаружен в минерале бенитоите BaTi(Si 3 O 9 .  Циклический герамер обнаружен в минерале берилле Be 3 Al 2 (Si 6 O 18 ) Полисиликаты цепиЛинейные (1-D) полимеры формулы (SiO 3 ) n 2n- могут быть образованы через мостиковый кислород. В этих структурах имеется заряд -2 на атом кремния. Группа минералов, называемых минералами пироксена, имеет такой тип структуры.
Линейные цепи могут быть связаны бок о бок, если ион оксида заменен другим мостиковым атомом кислорода. Крокидолит, асбестовый минерал с формулой Na 2 Fe 5 (OH) 2 [Si 4 O 11 ] 2 , является примером. Этот минерал имеет волокнистую природу и обладает огнестойкими и термостойкими свойствами, что обусловлено длинноцепочечной структурой аниона. Полисиликаты листовыеКогда соединение цепей из стороны в сторону продолжается бесконечно, удаляется больше оксидов, и получается двумерный полимер. Эти двумерные полимеры называются листовыми силикатами и содержат анион [Si 4 O 10 ] n 4n-. Минералы, содержащие эту структуру, легко расщепляются на тонкие пластины.
Трехмерные полимерные силикатыЛисты соединяются в трехмерный полимер, когда удаляются все оксидные ионы (все атомы кислорода в структуре являются мостиками).Эта структура содержит незаряженный оксид кремнезема [SiO 2 ] n , который больше не является основным, а скорее кислотным оксидом. Многие распространенные минералы содержат эту структуру: кварц, кремень, яшма, оникс, аметист, цитрин, агат и халцедон.
СтеклоКогда кислый кремнезем реагирует с основными оксидами при очень высоких температурах (~ 1700 0 C) и затем слишком быстро охлаждается, чтобы полисиликатные ионы могли образовать упорядоченные полисиликатные ионы, обнаруженные в минералах.В результате образуется аморфное твердое вещество или стекло. Для стекол характерно отсутствие определенной точки замерзания. Простое стекло получают плавлением (плавлением) песка с двууглекислым натрием и известняком (источники основных оксидов Na 2 O и CaO). Специальные стекла изготавливаются путем изменения состава кислотных и основных оксидов в стекле.
Узнайте больше об очках здесь и на сайте Glass Resource музея Корнинга. Химия почвТот факт, что все более полимеризующиеся полисиликатные ионы имеют уменьшающиеся заряды на кремний, что приводит к пониженной основности, имеет важные последствия для химии почвы.
Дождевая вода несколько кислая из-за растворенного CO 2 даже при отсутствии оксидов серы и азота. Со временем дождевая вода будет реагировать с менее полимеризованными силикатными анионами, заменяя оксидные ионы мостиковым кислородом с образованием более высокополимеризованного силиката. Оксиды удаляются в виде молекул воды. На промежуточной стадии выветривания присутствует большое количество слоистых силикатов, таких как глина, а также некоторое количество кварца.Эти почвы обычно встречаются в регионах с умеренным климатом под покровом травы или деревьев. Изоморфное замещениеИоны полисиликата имеют отрицательный заряд, который должен быть уравновешен соответствующими катионами.Концевые атомы кислорода обладают отрицательно заряженными поверхностями, которые приближаются к плотноупакованным поверхностям с отрицательным зарядом. Катионы, необходимые для нейтрализации отрицательного заряда полисиликата, расположены в слоях между цепочками или слоями или в тетраэдрических или октаэдрических отверстиях, присутствующих в трехмерной решетке.Типы катионов, обнаруженных в конкретной форме полисиликата, будут зависеть от
 Например, оливин, который имеет идеальный состав Mg 2 SiO 4 , может содержать различное процентное содержание изоморфного замещения Fe 2+ (радиус 92 пм) вместо равного количества Mg 2 + ионов (радиус 86 пм).
Изоморфное замещение увеличивает количество возможных замещений в силикатах. Примеры
 Существуют диагональные отношения элементов (особенно во втором периоде) к элементам на одну группу правее и на один период вниз по таблице. Существуют диагональные отношения элементов (особенно во втором периоде) к элементам на одну группу правее и на один период вниз по таблице.
| ||
Уравнение состояния постперовскитовой фазы, синтезированной из природного (Mg,Fe)SiO3 ортопироксена
Аннотация
С помощью алмазной наковальни с лазерным нагревом исследованы стабильность и уравнение состояния постперовскитовой фазы (типа ppv, CaIrO 3 ), синтезированной из природного пироксена состава с 9 мол.% FeSiO 3 . Наши измеренные данные объемного давления в диапазоне 12–106 ГПа для фазы ppv дают объемный модуль 219(5) ГПа и объем при нулевом давлении 164,9(6) Å 3 , когда K ′ 0 = 4 Объемный модуль упругости ppv составляет 575(15) ГПа при давлении 100 ГПа. Давление перехода снижается за счет присутствия Fe. Наши данные рентгеновской дифракции показывают, что фаза ppv может формироваться при P > 109(4) ГПа и 2400(400) К, что соответствует ≈400–550 км над границей ядра и мантии.Прямое сравнение объемов сосуществующих перовскита и фаз типа CaIrO 3 при 80–106 ГПа показывает, что фаза ppv имеет меньший объем, чем перовскит, на 1,1(2)%. Используя измеренные объемы вместе с объемным модулем, рассчитанным из уравнения подгонки состояния, мы находим, что объемная скорость звука уменьшается на 2,3 (2,1)% на этом переходе при 120 ГПа. После декомпрессии без дальнейшего нагрева было обнаружено, что фазу ppv все еще можно было наблюдать при столь низком давлении, как 12 ГПа, а также сообщалось о доказательствах, по крайней мере, частичного сохранения условий окружающей среды.
Используя измеренные объемы вместе с объемным модулем, рассчитанным из уравнения подгонки состояния, мы находим, что объемная скорость звука уменьшается на 2,3 (2,1)% на этом переходе при 120 ГПа. После декомпрессии без дальнейшего нагрева было обнаружено, что фазу ppv все еще можно было наблюдать при столь низком давлении, как 12 ГПа, а также сообщалось о доказательствах, по крайней мере, частичного сохранения условий окружающей среды.
Область D″ мантии Земли, лежащая чуть выше границы между ядром и мантией, долгое время была одной из наименее изученных областей планеты. Сейсмические исследования показывают, что D″ является сложным и неоднородным по латерали, включая доказательства сейсмического разрыва D″, аномальной сейсмической анизотропии и зон сверхнизких скоростей (1–3). Фаза ферромагнезиального силиката перовскита (pv), (Mg,Fe)SiO 3 , считалась доминирующим минералом нижней мантии, но ее свойства не согласуются со свойствами области D″.Таким образом, открытие фазы постперовскита (ppv) при 125 ГПа и 2500 К (4) привлекло значительное внимание из-за ее потенциального отношения к D″. Квантово-механические расчеты из первых принципов (5–9) поддерживают термодинамическую стабильность новой фазы и накладывают ограничения на некоторые физические свойства, включая тензор упругости и наклон Клапейрона перехода. Однако теоретические исследования предполагают разную степень приближения, и поэтому сравнение с прямым экспериментом имеет важное значение.Экспериментальные исследования наложили ограничения на давление перехода и параметры элементарной ячейки фазы ppv (4, 5, 10–16). Помимо кристаллической структуры, уравнение состояния (УС) является наиболее фундаментальным параметром, полученным в результате экспериментов при высоком давлении. До сих пор не проводилось экспериментальных исследований, в которых напрямую сравниваются уравнения состояния фаз pv и ppv в широком диапазоне условий давления для соответствующего мантийному химическому составу.
Квантово-механические расчеты из первых принципов (5–9) поддерживают термодинамическую стабильность новой фазы и накладывают ограничения на некоторые физические свойства, включая тензор упругости и наклон Клапейрона перехода. Однако теоретические исследования предполагают разную степень приближения, и поэтому сравнение с прямым экспериментом имеет важное значение.Экспериментальные исследования наложили ограничения на давление перехода и параметры элементарной ячейки фазы ppv (4, 5, 10–16). Помимо кристаллической структуры, уравнение состояния (УС) является наиболее фундаментальным параметром, полученным в результате экспериментов при высоком давлении. До сих пор не проводилось экспериментальных исследований, в которых напрямую сравниваются уравнения состояния фаз pv и ppv в широком диапазоне условий давления для соответствующего мантийному химическому составу.
Результаты и обсуждение
Фазы Pv и ppv были синтезированы из образца ортопироксена, содержащего 9 мол. % Fe с использованием ячейки с алмазной наковальней с лазерным нагревом (см. Экспериментальные методы ). Используя синхротронную рентгеновскую дифракцию, мы получили данные объем-давление при 300 К путем постепенной декомпрессии образца без какого-либо дополнительного нагрева. Во время декомпрессии зависимость давление-нагрузка в алмазной ячейке сильно нелинейна, что делает очень сложным контроль распределения достигнутых состояний давления-объема. Тем не менее, мы смогли успешно измерить несколько точек данных при очень низких давлениях.Во время декомпрессии образцы не нагревали, чтобы избежать обратного превращения метастабильной фазы ppv. При декомпрессии наблюдается некоторое уширение дифракционных пиков. Однако аргон, который использовался в качестве среды, передающей давление, является относительно мягким и, как ожидается, будет ограничивать уровень возникающих негидростатических напряжений. Кроме того, pv и ppv сосуществуют в наших образцах и, таким образом, подвергаются одинаковым стрессовым условиям.
% Fe с использованием ячейки с алмазной наковальней с лазерным нагревом (см. Экспериментальные методы ). Используя синхротронную рентгеновскую дифракцию, мы получили данные объем-давление при 300 К путем постепенной декомпрессии образца без какого-либо дополнительного нагрева. Во время декомпрессии зависимость давление-нагрузка в алмазной ячейке сильно нелинейна, что делает очень сложным контроль распределения достигнутых состояний давления-объема. Тем не менее, мы смогли успешно измерить несколько точек данных при очень низких давлениях.Во время декомпрессии образцы не нагревали, чтобы избежать обратного превращения метастабильной фазы ppv. При декомпрессии наблюдается некоторое уширение дифракционных пиков. Однако аргон, который использовался в качестве среды, передающей давление, является относительно мягким и, как ожидается, будет ограничивать уровень возникающих негидростатических напряжений. Кроме того, pv и ppv сосуществуют в наших образцах и, таким образом, подвергаются одинаковым стрессовым условиям.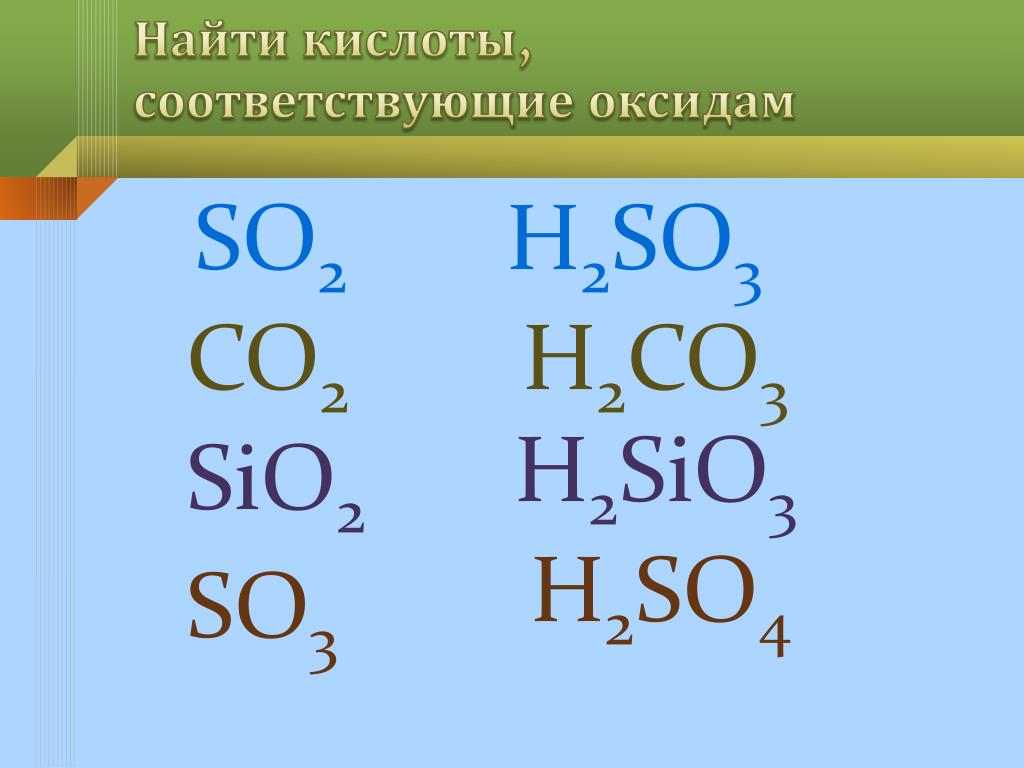 Согласие наших измерений pv с более ранними данными (17–19), как обсуждается ниже, подтверждает правильность наших результатов как для фаз pv, так и для ppv.
Согласие наших измерений pv с более ранними данными (17–19), как обсуждается ниже, подтверждает правильность наших результатов как для фаз pv, так и для ppv.
Для фазы ppv дифракционные линии 022 и 131 дали наибольшую интенсивность. Параметры элементарной ячейки обычно уточнялись по этим двум линиям вместе с 020, 132 и 113. Во многих случаях также использовались 110, 042 и 004. Характерная картина дифракции показана на рис. 1. При давлениях <32 ГПа дифракционная интенсивность пиков ppv-фазы заметно снижается. При этих давлениях для уточнения параметров элементарной ячейки использовались только 020, 022, 132 и 113.Для фазы pv мы обычно использовали 101, 110, 111 и 112 для уточнения параметров элементарной ячейки, хотя другие пики были включены, когда их можно было наблюдать с достаточной интенсивностью. Дифракционные пики были приспособлены к функциям профиля псевдо-Фойгта, а постоянные решетки при каждом давлении были определены методом наименьших квадратов. Максимальные отклонения между измеренными и рассчитанными параметрами элементарной ячейки для фазы ppv составляют 0,2–0,4 %. На рис. 2 показаны осевые отношения b / a и c / a для фазы ppv в зависимости от давления (см. , вставка ).Хотя отношение b / a больше, оба параметра демонстрируют слабую зависимость от давления при очень высоких давлениях. Результаты хорошо согласуются с теоретическими предположениями (5, 6) и имеющимися экспериментами (4, 10, 12, 13).
На рис. 2 показаны осевые отношения b / a и c / a для фазы ppv в зависимости от давления (см. , вставка ).Хотя отношение b / a больше, оба параметра демонстрируют слабую зависимость от давления при очень высоких давлениях. Результаты хорошо согласуются с теоретическими предположениями (5, 6) и имеющимися экспериментами (4, 10, 12, 13).
Интегрированная рентгенограмма при 106(2) ГПа после закалки от 1800 К.Параметры элементарной ячейки для фазы ppv, полученные методом наименьших квадратов, составляют a = 2,478(7) Å, b = 8,198(23) Å и c = 6,132(10) Å. Pt, платина; Re, рений. Пики Re вызваны низкоинтенсивными хвостами рентгеновского луча, которые не полностью удаляются системой вторичного отверстия (31). Вертикальные полосы показывают ожидаемые положения пиков и относительные интенсивности для фаз pv ( Pbnm ) и ppv ( Cmcm ).
Вертикальные полосы показывают ожидаемые положения пиков и относительные интенсивности для фаз pv ( Pbnm ) и ppv ( Cmcm ).
УС фаз pv и ppv. Штриховая и пунктирная кривые — экспериментально определенные УРС для MgSiO 3 pv (17) и Mg 0,95 Fe 0,05 SiO 3 pv (18) соответственно. Сплошная кривая показывает аппроксимацию конечной деформации Эйлера второго порядка ( K 0 ′ = 4,0) к данным ppv-фазы. Теоретический объем нулевого давления для ppv взят из Tsuchiya et al. (6). ( Вставка ) Зависимость от давления осевых отношений фазы ppv.
Подгонка данных давление-объем для фазы ppv к УС Берча-Мурнагана (20) дает объемный модуль K 0 , 219(5) ГПа и объемное давление окружающей среды, В 0 , из 164. 9(6) Å 3 для производной давления по объемному модулю, K 0 ′, зафиксирована на 4 (рис.2). Цифры в скобках представляют погрешности 1-σ. Наши результаты сравниваются с теоретическими исследованиями для MgSiO . 3 ppv и экспериментальные исследования для MgSiO 3 pv фаза в таблице 1. Чтобы проиллюстрировать компромиссы, если мы зафиксируем K 0 ′ = 4,4, получаем В 0 = 166,2(7) Å 3 и К 0 = 198(5) ГПа, которые близки к результатам обобщенного градиентного приближения Оганова и Оно (5) (табл. 1).В целом хорошее соответствие теории и эксперимента свидетельствует о том, что малые концентрации Fe не оказывают сильного влияния на модуль всестороннего сжатия PPV-фазы (табл.
9(6) Å 3 для производной давления по объемному модулю, K 0 ′, зафиксирована на 4 (рис.2). Цифры в скобках представляют погрешности 1-σ. Наши результаты сравниваются с теоретическими исследованиями для MgSiO . 3 ppv и экспериментальные исследования для MgSiO 3 pv фаза в таблице 1. Чтобы проиллюстрировать компромиссы, если мы зафиксируем K 0 ′ = 4,4, получаем В 0 = 166,2(7) Å 3 и К 0 = 198(5) ГПа, которые близки к результатам обобщенного градиентного приближения Оганова и Оно (5) (табл. 1).В целом хорошее соответствие теории и эксперимента свидетельствует о том, что малые концентрации Fe не оказывают сильного влияния на модуль всестороннего сжатия PPV-фазы (табл. 1). Наши измеренные объемы элементарной ячейки фазы ppv при P > 100 ГПа также согласуются с экспериментальными данными, полученными как для образцов, не содержащих Fe, так и для образцов, содержащих Fe (4, 5, 10, 12, 13) (рис. 2). EOS для pv было рассчитано с использованием данных об объеме давления при 83–106 ГПа вместе с экспериментально определенным объемом при нулевом давлении из извлеченного образца [ V 0 = 163.3(1) Е 3 ], что согласуется с ожидаемым значением для бесжелезистых и железосодержащих pv (17, 18). Полученные параметры уравнения состояния сравниваются с предыдущими экспериментами в таблице 1. Измеренные объемы элементарной ячейки pv-фазы согласуются с предыдущими исследованиями (17, 18) (рис. 2).
1). Наши измеренные объемы элементарной ячейки фазы ppv при P > 100 ГПа также согласуются с экспериментальными данными, полученными как для образцов, не содержащих Fe, так и для образцов, содержащих Fe (4, 5, 10, 12, 13) (рис. 2). EOS для pv было рассчитано с использованием данных об объеме давления при 83–106 ГПа вместе с экспериментально определенным объемом при нулевом давлении из извлеченного образца [ V 0 = 163.3(1) Е 3 ], что согласуется с ожидаемым значением для бесжелезистых и железосодержащих pv (17, 18). Полученные параметры уравнения состояния сравниваются с предыдущими экспериментами в таблице 1. Измеренные объемы элементарной ячейки pv-фазы согласуются с предыдущими исследованиями (17, 18) (рис. 2).
Сравнение параметров уравнения состояния фаз ppv и pv, полученных в этом исследовании и в предыдущей работе
Из-за относительной нехватки данных по низкому давлению и длительной экстраполяции из поля стабильности фазы ppv наши параметры уравнения состояния при нулевом давлении неизбежно страдают некоторой неопределенностью. Поэтому в этом исследовании мы специально стремились получить сосуществование pv и ppv, а не одну фазу любого из них. Этот подход позволяет напрямую сравнивать объемы и объемные модули двух фаз при более низких мантийных давлениях. В этом случае особенно сложно получить качественные дифрактограммы, поскольку синтез необходимо проводить вблизи границы раздела фаз, где кинетика очень вялая. Интенсивность дифракции снижается, поскольку количество каждой фазы меньше, а пики также перекрываются.Однако преимущество нашего подхода заключается в том, что мы проводим прямое сравнение свойств двух фаз в идентичных условиях эксперимента, которое не подвержено ошибкам, вызванным различиями давления и напряженного состояния между образцами.
Поэтому в этом исследовании мы специально стремились получить сосуществование pv и ppv, а не одну фазу любого из них. Этот подход позволяет напрямую сравнивать объемы и объемные модули двух фаз при более низких мантийных давлениях. В этом случае особенно сложно получить качественные дифрактограммы, поскольку синтез необходимо проводить вблизи границы раздела фаз, где кинетика очень вялая. Интенсивность дифракции снижается, поскольку количество каждой фазы меньше, а пики также перекрываются.Однако преимущество нашего подхода заключается в том, что мы проводим прямое сравнение свойств двух фаз в идентичных условиях эксперимента, которое не подвержено ошибкам, вызванным различиями давления и напряженного состояния между образцами.
Прямое сравнение объемов pv и ppv при 83–106 ГПа показывает, что фаза ppv имеет объем на 1,1(2)% меньше, чем фаза pv. Для сравнения, теоретические исследования (5–6, 8) концевого элемента, не содержащего Fe, оценивают изменения объема в 1.4–1,6 % при 120 ГПа, что несколько больше наших экспериментальных результатов. Дифференцируя уравнение состояния давление-объем, объемные модули обеих фаз были рассчитаны как функция давления. Модуль объемного сжатия фазы ppv составляет 575(15) ГПа при давлении 100 ГПа и 641(17) ГПа при 120 ГПа. Статические расчеты из первых принципов дают аналогичные значения 647–681 ГПа при последнем давлении (5–9). Наш расчетный объемный модуль упругости для pv при 120 ГПа составляет 663(26) ГПа. Таким образом, объемные модули pv и ppv перекрываются в пределах взаимных неопределенностей.Опять же, этот вывод согласуется с теоретическими расчетами (5–9). Несмотря на то, что это фаза высокого давления, возможно, что ppv имеет более низкий объемный модуль, чем pv, при глубоких мантийных давлениях. Уменьшение объемного модуля при фазовых переходах при высоком давлении наблюдалось в ряде оксидных систем, в которых имеются дополнительные механизмы сжатия, доступные в фазе высокого давления (21). За этот эффект в фазе ppv может быть ответственна повышенная сжимаемость вдоль оси b .
Дифференцируя уравнение состояния давление-объем, объемные модули обеих фаз были рассчитаны как функция давления. Модуль объемного сжатия фазы ppv составляет 575(15) ГПа при давлении 100 ГПа и 641(17) ГПа при 120 ГПа. Статические расчеты из первых принципов дают аналогичные значения 647–681 ГПа при последнем давлении (5–9). Наш расчетный объемный модуль упругости для pv при 120 ГПа составляет 663(26) ГПа. Таким образом, объемные модули pv и ppv перекрываются в пределах взаимных неопределенностей.Опять же, этот вывод согласуется с теоретическими расчетами (5–9). Несмотря на то, что это фаза высокого давления, возможно, что ppv имеет более низкий объемный модуль, чем pv, при глубоких мантийных давлениях. Уменьшение объемного модуля при фазовых переходах при высоком давлении наблюдалось в ряде оксидных систем, в которых имеются дополнительные механизмы сжатия, доступные в фазе высокого давления (21). За этот эффект в фазе ppv может быть ответственна повышенная сжимаемость вдоль оси b . Объединение результатов для объема и объемного модуля показывает, что при 120 ГПа объемная скорость звука изменяется на -2,3 (2,1)% при переходе при глубоких мантийных давлениях. Теоретические исследования предсказывают, что уменьшение объемной скорости звука будет <1% при переходе (5, 8). Наши результаты согласуются с этими исследованиями, но также допускают большее снижение объемной скорости звука до ≈4%.
Объединение результатов для объема и объемного модуля показывает, что при 120 ГПа объемная скорость звука изменяется на -2,3 (2,1)% при переходе при глубоких мантийных давлениях. Теоретические исследования предсказывают, что уменьшение объемной скорости звука будет <1% при переходе (5, 8). Наши результаты согласуются с этими исследованиями, но также допускают большее снижение объемной скорости звука до ≈4%.
При низких давлениях объем ppv, по-видимому, становится больше, чем объем pv (17, 18) (рис.2). К сожалению, дифракционные картины pv становятся достаточно слабыми при этих низких давлениях, так что из наших экспериментов нельзя получить надежный объем. В этом случае из-за нехватки данных по низкому давлению и возможного влияния девиаторного напряжения при сравнении наших результатов по PPV с pv EOS (17, 18) потребуются дальнейшие эксперименты для определения объемных соотношений между двумя фазами в метастабильная область низкого давления.
Наши результаты показывают, что фазу ppv можно синтезировать при 109(4) ГПа и 2400(400) К для исходного образца с 9 мол. % FeSiO 3 (рис. 3). Этот результат согласуется с другими экспериментами (10, 12). По расчетной мантийной геотерме переход должен был произойти на ≈400–550 км выше границы ядро–мантия (рис. 3). Наоборот, для приписывания ppv-перехода разрыву D″ (1, 2) необходимы температуры ≈3500–4000 К в глубокой нижней мантии. Однако существует ряд осложняющих факторов, в том числе многокомпонентные химические эффекты, неопределенности шкалы давления (22), неопределенности наклона Клапейрона и влияние самой трансформации на динамику мантии и геотерму (23), которые необходимо учитывать при выводах. около фазовой границы.Однако вялая кинетика превращения указывает на то, что измеренное нами давление является верхней границей давления перехода.
% FeSiO 3 (рис. 3). Этот результат согласуется с другими экспериментами (10, 12). По расчетной мантийной геотерме переход должен был произойти на ≈400–550 км выше границы ядро–мантия (рис. 3). Наоборот, для приписывания ppv-перехода разрыву D″ (1, 2) необходимы температуры ≈3500–4000 К в глубокой нижней мантии. Однако существует ряд осложняющих факторов, в том числе многокомпонентные химические эффекты, неопределенности шкалы давления (22), неопределенности наклона Клапейрона и влияние самой трансформации на динамику мантии и геотерму (23), которые необходимо учитывать при выводах. около фазовой границы.Однако вялая кинетика превращения указывает на то, что измеренное нами давление является верхней границей давления перехода.
Фазовая диаграмма для системы (Mg,Fe)SiO 3 , полученная как экспериментально, так и теоретически. Давление-температура, при которых наблюдалась фаза ppv (вместе с фазой pv) в настоящей работе, обозначены •.Для других исследований ромбы и треугольники, направленные вверх, относятся к образцам, содержащим железо, другие символы относятся к образцам, не содержащим железа. Закрашенные символы, ppv; открытые символы, ст. Теоретические ограничения наклона Клапейрона фазового перехода ppv в MgSiO 3 (штриховые светлые линии) взяты из Tsuchiya et al. (6). Пунктирная темная линия проведена по имеющимся данным с тем же наклоном. Геотермальная энергия взята из исх. 32. CMB, граница ядра и мантии.
Давление-температура, при которых наблюдалась фаза ppv (вместе с фазой pv) в настоящей работе, обозначены •.Для других исследований ромбы и треугольники, направленные вверх, относятся к образцам, содержащим железо, другие символы относятся к образцам, не содержащим железа. Закрашенные символы, ppv; открытые символы, ст. Теоретические ограничения наклона Клапейрона фазового перехода ppv в MgSiO 3 (штриховые светлые линии) взяты из Tsuchiya et al. (6). Пунктирная темная линия проведена по имеющимся данным с тем же наклоном. Геотермальная энергия взята из исх. 32. CMB, граница ядра и мантии.
При снижении давления <30 ГПа дифракционные линии фазы ppv ослабевают, но все еще четко наблюдаются при 24 и 12 ГПа.Наиболее интенсивную дифракционную линию фазы 022 ppv можно было наблюдать даже после того, как образец был возвращен в условия давления и температуры окружающей среды (рис. 4 и 5). Измеренное расстояние d пика 022 ppv составило 2,688 Å, что сравнимо с теоретически рассчитанным значением 2,690 Å (J. Tsuchiya, личное сообщение). Ослабление и потеря большинства дифракционных пиков, кроме 022, свидетельствует о возможной частичной аморфизации образца. Действительно, пик 022 все еще можно было обнаружить, но он был значительно менее интенсивным при повторном исследовании образца через 7 дней после его первого гашения.Наличие относительно низких уровней девиаторных напряжений за счет использования среды под давлением Ar в этом исследовании может повысить стабильность CaIrO . 3 -фаза в условиях окружающей среды по сравнению с другими исследованиями, в которых использовались более твердые среды под давлением. Наше наблюдение метастабильности фазы ppv при низких давлениях и даже при атмосферном давлении согласуется с теоретическими предсказаниями (24). Однако в других экспериментальных исследованиях было обнаружено, что фаза PPV является аморфной при исследовании с помощью просвечивающей электронной микроскопии после восстановления до давления окружающей среды, но не было предоставлено никакой информации о стабильности фазы PPV при низком давлении (≈10 ГПа) (12, 14) .
Tsuchiya, личное сообщение). Ослабление и потеря большинства дифракционных пиков, кроме 022, свидетельствует о возможной частичной аморфизации образца. Действительно, пик 022 все еще можно было обнаружить, но он был значительно менее интенсивным при повторном исследовании образца через 7 дней после его первого гашения.Наличие относительно низких уровней девиаторных напряжений за счет использования среды под давлением Ar в этом исследовании может повысить стабильность CaIrO . 3 -фаза в условиях окружающей среды по сравнению с другими исследованиями, в которых использовались более твердые среды под давлением. Наше наблюдение метастабильности фазы ppv при низких давлениях и даже при атмосферном давлении согласуется с теоретическими предсказаниями (24). Однако в других экспериментальных исследованиях было обнаружено, что фаза PPV является аморфной при исследовании с помощью просвечивающей электронной микроскопии после восстановления до давления окружающей среды, но не было предоставлено никакой информации о стабильности фазы PPV при низком давлении (≈10 ГПа) (12, 14) . Фаза ppv MgGeO 3 остается метастабильным после декомпрессии до 6 ГПа (25).
Фаза ppv MgGeO 3 остается метастабильным после декомпрессии до 6 ГПа (25).
Эволюция дифракционного пика 022 ppv во время декомпрессии. ( a ) Давление (в ГПа) показано рядом с каждым спектром. Ar обозначает пик дифракции аргона.Интенсивности при различных давлениях относительны, поскольку образцы текстурированы, и в некоторых случаях интегрирование проводилось по полным дифракционным кольцам, а в других случаях по частичным кольцам. ( b ) Сплошная кривая показывает полиномиальную аппроксимацию измеренных интервалов d для пика CaIrO 3 типа 022 (•).
Инжир. 5.
5.Интегрированная рентгенограмма извлеченного образца. Двумерное изображение сильно текстурировано, что отражено заметным дифракционным пиком 022 для фазы ppv, тогда как другие пики ppv являются слабыми (ppv113) и/или перекрываются (ppv 131). Сокращения те же, что и на рис. 1.
Экспериментальные методы
Состав природного ортопироксена, определенный электронно-зондовым анализом, был (Mg 1.80 Fe 0,18 Ал 0,01 Са 0,01 )Si 2 О 6 . Порошковая рентгеновская дифракция подтвердила, что образец представляет собой чистый ортопироксен с и . 0 = 18,244 Å, б 0 = 8. 837 Å, в 0 = 5,186 Å и В 0 = 836,07 Å 3 . Образцы загружали в отверстие рениевой прокладки диаметром 50 мкм ячейки с алмазной наковальней. Толщина рениевых прокладок после предварительного вдавливания составляла 25–27 мкм. Образцы прессовали с помощью симметричной алмазной ячейки со скошенными калеттами диаметром 150 мкм. В качестве внутренних стандартов давления использовали Pt, Au или NaCl (26–28).Ar и NaCl использовались в качестве изоляционных и передающих давление сред.
837 Å, в 0 = 5,186 Å и В 0 = 836,07 Å 3 . Образцы загружали в отверстие рениевой прокладки диаметром 50 мкм ячейки с алмазной наковальней. Толщина рениевых прокладок после предварительного вдавливания составляла 25–27 мкм. Образцы прессовали с помощью симметричной алмазной ячейки со скошенными калеттами диаметром 150 мкм. В качестве внутренних стандартов давления использовали Pt, Au или NaCl (26–28).Ar и NaCl использовались в качестве изоляционных и передающих давление сред.
Эксперименты по дифракции рентгеновских лучей под высоким давлением проводились на линии луча 13-ID-D сектора GeoSoilEnviroCARS усовершенствованного источника фотонов и на BL10XU SPring-8 (Японский научно-исследовательский институт синхротронного излучения). В GeoSoilEnviroCARS монохроматический рентгеновский пучок с длиной волны 0,3344 Å был сфокусирован до 5 на 6 мкм 2 парой зеркал Киркпатрика-Баэза. Рентгеновские дифрактограммы были получены с помощью фотопластины MAR345 с временем экспозиции 60 или 180 с. Двумерные дифракционные изображения анализировали с помощью программы fit2d (29). Генеральный директор 2 использовали в качестве эталона для определения расстояния и ориентации детектора. Интегрированные одномерные дифракционные картины были получены от полных колец, а также в некоторых случаях путем ограничения интегрирования частичными кольцами для усиления сигнала в текстурированных узорах.Образцы нагревали с помощью системы двухстороннего лазерного нагрева в GeoSoilEnviroCARS (30, 31). ТЭМ 00 (поперечная электромагнитная мода) Nd: YLF-лазер с диаметром горячей точки ≈ 20 мкм использовался для достижения температуры ≈ 1700–1880 K при времени нагрева 30–36 мин.
Рентгеновские дифрактограммы были получены с помощью фотопластины MAR345 с временем экспозиции 60 или 180 с. Двумерные дифракционные изображения анализировали с помощью программы fit2d (29). Генеральный директор 2 использовали в качестве эталона для определения расстояния и ориентации детектора. Интегрированные одномерные дифракционные картины были получены от полных колец, а также в некоторых случаях путем ограничения интегрирования частичными кольцами для усиления сигнала в текстурированных узорах.Образцы нагревали с помощью системы двухстороннего лазерного нагрева в GeoSoilEnviroCARS (30, 31). ТЭМ 00 (поперечная электромагнитная мода) Nd: YLF-лазер с диаметром горячей точки ≈ 20 мкм использовался для достижения температуры ≈ 1700–1880 K при времени нагрева 30–36 мин.
В BL10XU монохроматический пучок с длиной волны 0,4129 или 0,4150 Å был коллимирован до диаметра 20 мкм и направлялся через ячейку с алмазной наковальней. Рентгеновские дифрактограммы записывали на фотопластинку Rigaku (Токио) с экспозицией от 180 до 300 с.Образцы также нагревались многомодовым Nd:YAG или TEM . 01 (поперечная электромагнитная мода) Лазер Nd:YLF с двусторонним нагревом. Пятно нагрева было >20 мкм, а температура колебалась от 2000 до 2400 К.
Рентгеновские дифрактограммы записывали на фотопластинку Rigaku (Токио) с экспозицией от 180 до 300 с.Образцы также нагревались многомодовым Nd:YAG или TEM . 01 (поперечная электромагнитная мода) Лазер Nd:YLF с двусторонним нагревом. Пятно нагрева было >20 мкм, а температура колебалась от 2000 до 2400 К.
Были проведены эксперименты с использованием трех различных конфигураций образцов. Для первого эксперимента (выполненного на Advanced Photon Source) образец смешивался с 10 мас.% Pt, которая служила средой давления и поглотителем лазера.Аргон загружали криогенно для теплоизоляции образца от алмазных наковальней. Образец был сжат непосредственно до 106(2) ГПа. Перед нагревом наблюдались слабые и широкие дифракционные пики, свидетельствующие о неупорядоченном или частично аморфном материале образца после холодного сжатия. Затем образец нагревали до 1880(50) К в течение 36 мин. После температурной закалки ppv (CaIrO 3 -тип) и фазы pv сосуществовали. Давление после нагрева составляло 100(1) ГПа.Затем образец сжимали до 106 ГПа и проводили несколько дополнительных циклов нагрева (всего ≈90 мин) при 1700–1800 К. Сосуществование pv и CaIrO Пики типа 3 продолжали наблюдаться без существенного изменения их относительной интенсивности, что указывает на то, что после преобразования в фазу pv переход в фазу ppv происходит значительно медленнее, чем из исходно неупорядоченного или аморфного материала.
Давление после нагрева составляло 100(1) ГПа.Затем образец сжимали до 106 ГПа и проводили несколько дополнительных циклов нагрева (всего ≈90 мин) при 1700–1800 К. Сосуществование pv и CaIrO Пики типа 3 продолжали наблюдаться без существенного изменения их относительной интенсивности, что указывает на то, что после преобразования в фазу pv переход в фазу ppv происходит значительно медленнее, чем из исходно неупорядоченного или аморфного материала.
Во втором эксперименте (SPring-8) смесь ортопироксена и золота подвергалась непосредственному сжатию до 105 ГПа и нагреванию в течение 30 мин.В качестве изолирующей среды использовали NaCl. Рентгенограммы In situ показали пики, относящиеся как к фазам pv, так и к фазам ppv при 109(4) ГПа и 2400(400) K. В третьем эксперименте (SPring-8) образец ортопироксена был изолирован от алмазов. с использованием слоев NaCl, которые также служили эталоном давления. Образец непосредственно сжимали до 115(5) ГПа и нагревали до 2000(400) К в течение ≈30 мин. Снова наблюдалось сосуществование фаз pv и ppv, и они продолжали наблюдаться после ≈60 мин дополнительного нагрева.Ограничения доступного времени пучка не позволили провести декомпрессионные эксперименты для образцов, синтезированных на SPring-8, и эти данные в основном используются для установления термобарических условий, при которых может наблюдаться фаза ppv для этого состава.
Снова наблюдалось сосуществование фаз pv и ppv, и они продолжали наблюдаться после ≈60 мин дополнительного нагрева.Ограничения доступного времени пучка не позволили провести декомпрессионные эксперименты для образцов, синтезированных на SPring-8, и эти данные в основном используются для установления термобарических условий, при которых может наблюдаться фаза ppv для этого состава.
Благодарности
Мы благодарим Y. Iizuka за анализ данных микрозонда, а также рецензентов и редактора за их комментарии, позволившие улучшить рукопись. Эта работа была поддержана Национальным научным фондом, Фондом Паккарда, Национальным научным советом и Национальным исследовательским центром синхротронного излучения.Часть этой работы была выполнена в GeoSoilEnviroCARS, Advanced Photon Source, Аргоннская национальная лаборатория. GeoSoilEnviroCARS поддерживается Национальным научным фондом, Министерством энергетики и штатом Иллинойс. Использование усовершенствованного источника фотонов было поддержано Департаментом фундаментальных энергетических наук Министерства энергетики.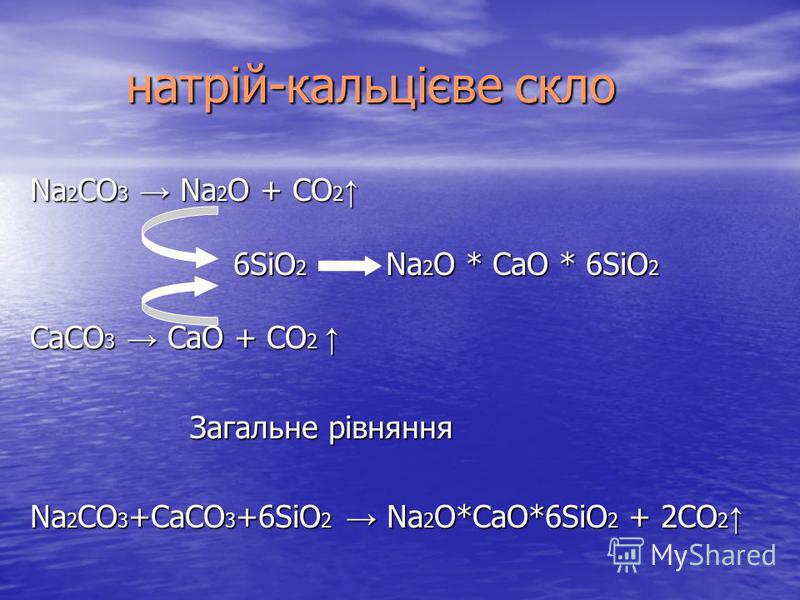
Сноски
- † Кому следует направлять корреспонденцию по настоящему адресу: Департамент наук о Земле, Университет Западного Онтарио, Лондон, Онтарио, Канада N6A 5B7. Электронная почта: sshieh{at}uwo.ca
↵ ¶ Текущий адрес: Группа совместного доступа высокого давления, Усовершенствованный источник фотонов, Аргоннская национальная лаборатория, Аргонн, Иллинойс 60439.
Вклад авторов: С.Р.С. и Т.С.Д. проектное исследование; С.Р.С., Т.С.Д., А.К., Г.С., В.Б.П. и Н.С. проведенное исследование; Г.С., В.Б.П., Н.С., К.Х. и Ю.О. предоставил новые реагенты/аналитические инструменты; С.Р.С., Т.С.Д. и А.К. проанализированные данные; и С.Р.С. и Т.С.Д. написал бумагу.
Заявление о конфликте интересов: Конфликты не заявлены.

Этот документ был отправлен непосредственно (трек II) в офис PNAS.
- Сокращения:
- EOS,
- уравнение состояния;
- пв,
- перовскит;
- ппв,
- постперовскит.
Сокращения:
Бесплатно доступен в Интернете через опцию открытого доступа PNAS.
- © 2006 г. Национальной академии наук США
%PDF-1.3 %verypdf.com 122 0 объект > эндообъект внешняя ссылка 122 71 0000000022 00000 н 0000196979 00000 н 0000197122 00000 н 0000197514 00000 н 0000197658 00000 н 0000197963 00000 н 0000198560 00000 н 0000199372 00000 н 0000200197 00000 н 0000200837 00000 н 0000201701 00000 н 0000202604 00000 н 0000203383 00000 н 0000204199 00000 н 0000204428 00000 н 0000204487 00000 н 0000205469 00000 н 0000205508 00000 н 0000208185 00000 н 0000208304 00000 н 0000208620 00000 н 0000208805 00000 н 0000212138 00000 н 0000212793 00000 н 0000213002 00000 н 0000224158 00000 н 0000224337 00000 н 0000224407 00000 н 0000224603 00000 н 0000229462 00000 н 0000229749 00000 н 0000230442 00000 н 0000230555 00000 н 0000230760 00000 н 0000242939 00000 н 0000243248 00000 н 0000243598 00000 н 0000243674 00000 н 0000243879 00000 н 0000257714 00000 н 0000258002 00000 н 0000258179 00000 н 0000258243 00000 н 0000258447 00000 н 0000265942 00000 н 0000266232 00000 н 0000266888 00000 н 0000267097 00000 н 0000277054 00000 н 0000278018 00000 н 0000278212 00000 н 0000278421 00000 н 0000288499 00000 н 0000288636 00000 н 0000288773 00000 н 0000288910 00000 н 0000289047 00000 н 0000289184 00000 н 0000289321 00000 н 0000289458 00000 н 0000289595 00000 н 0000289732 00000 н 0000289869 00000 н 00002
00000 н 00002
00000 н 00002 00000 н 0000200000 н 00002 00000 н 00002 00000 н 00002 00000 н 00002 00000 н трейлер ] >> startxref 0 %%EOF 1 0 объект > эндообъект 2 0 объект > эндообъект 3 0 объект > эндообъект 4 0 объект > эндообъект 5 0 объект > эндообъект 6 0 объект > эндообъект 7 0 объект > эндообъект 8 0 объект > /ProcSet [/PDF/Текст ] /ExtGState > /Цветное пространство > >> эндообъект 9 0 объект > ручей HWr}GD,u6ZIdI@ʇ{sN7@ZN;zzr\Vq8EW/|,_ospoke3\qlX$o\&N8-L=\U/ǒEj{%o2ꯗ.
 g&»w1S|obrsi)î5Vxy̵UPP(4‰9|Wiɣ19ٓ#Z_g#*藱\C4|>lD03؛E4,E\ /Q3hd}\6*ʶ6S4dGt
_K㟯??OQ&.9RwaFj»BϘrVCE$A+jX`̓
$zMBx |F= %{H$uP$_]/
ڎ+»MnWj˹vW>_
g&»w1S|obrsi)î5Vxy̵UPP(4‰9|Wiɣ19ٓ#Z_g#*藱\C4|>lD03؛E4,E\ /Q3hd}\6*ʶ6S4dGt
_K㟯??OQ&.9RwaFj»BϘrVCE$A+jX`̓
$zMBx |F= %{H$uP$_]/
ڎ+»MnWj˹vW>_Силикаты — Химия LibreTexts
Вопросы для обсуждения
- Как классифицировать силикаты?
- Что такое асбест?
Здесь показана фотография кварца, одного из многих силикатов. Кварц сам по себе является очень интересным минералом, который используется во многих технологиях, начиная от часов и заканчивая компьютерами и научными приборами, потому что кварц является важным пьезоэлектрическим материалом.Разумное применение пьезоэлектрического эффекта заключается в использовании его вибрационного движения для подачи чернил высокой вязкости в систему струйной печати с каплей по требованию. Пьезоэлектрические материалы также используются в пьезоэлектрических преобразователях и зуммерах. Также были разработаны методы применения пьезоэлектрических материалов для преобразования энергии статической волны во вращательное движение. Такой пьезоэлектрический двигатель разработан для применения в наручных часах.
Такой пьезоэлектрический двигатель разработан для применения в наручных часах.
Силикаты — самый крупный, самый интересный и самый сложный класс минералов, чем любые другие минералы.Приблизительно 30% всех минералов представляют собой силикаты, и некоторые геологи считают, что 90% земной коры состоит из силикатов, материала на основе SiO 4 4-. Таким образом, кислород и кремний являются двумя наиболее распространенными элементами в земной коре.
Силикаты основаны на основной химической единице SiO 4 4-, анионной группе в форме тетраэдра. Центральный ион кремния имеет заряд плюс четыре, в то время как каждый кислород имеет заряд минус два (-2), и, таким образом, каждая связь кремний-кислород равна половине (½) общей энергии связи кислорода.Это условие оставляет атомам кислорода возможность связываться с другим ионом кремния и, следовательно, связывать один тетраэдр SiO 4 4- с другим.
В крайнем случае тетраэдры расположены правильным, упорядоченным образом, образуя трехмерную сеть. Такой структурой является кварц (см. схему), и его формула SiO 2 . Если кремнезем в расплавленном состоянии охлаждается очень медленно, он кристаллизуется при температуре замерзания. Но если расплавленный кремнезем охладить быстрее, то в результате получится беспорядочное тело, которое называется стеклом , часто также называемым кварцем .{4-}\) единиц, которые связаны между собой общими атомами кислорода.
Такой структурой является кварц (см. схему), и его формула SiO 2 . Если кремнезем в расплавленном состоянии охлаждается очень медленно, он кристаллизуется при температуре замерзания. Но если расплавленный кремнезем охладить быстрее, то в результате получится беспорядочное тело, которое называется стеклом , часто также называемым кварцем .{4-}\) единиц, которые связаны между собой общими атомами кислорода.
Ортосиликаты
Ортосиликаты представляют собой минералы, состоящие только из одиночных единиц SiO 4 4- единиц. Катионы — это некоторые другие металлы. Например, следующие минералы являются ортосиликатами:
Ионы Be и Zn тетраэдрически связаны с кислородом силиката в этих двух минералах: фенаките, Be 2 SiO 4 и виллемите, Zn 2 SiO 4 .В оливине (Fe, Mg) 2 SiO 4 катионами являются Fe 2+ или Mg 2+ .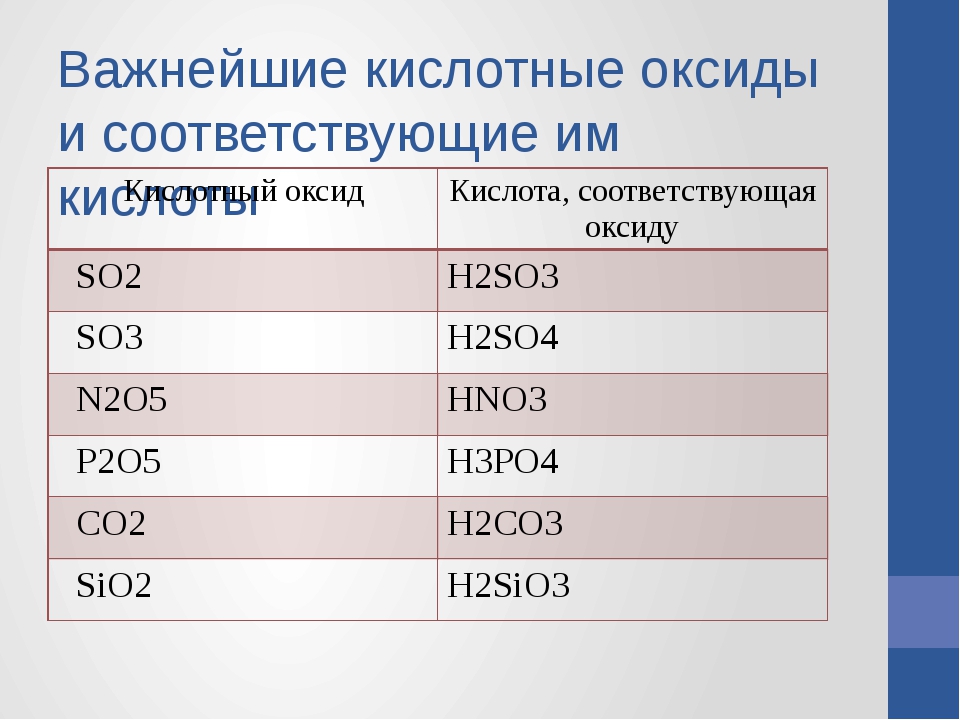 Эта формула предполагает, что этот минерал представляет собой смешанную соль силикатов железа и магния. Эти катионы октаэдрически координированы с атомами кислорода силиката. Чистая соль Fe 2 SiO 4 называется фаялитом, а Mg 2 SiO 4 — форстеритом.
Эта формула предполагает, что этот минерал представляет собой смешанную соль силикатов железа и магния. Эти катионы октаэдрически координированы с атомами кислорода силиката. Чистая соль Fe 2 SiO 4 называется фаялитом, а Mg 2 SiO 4 — форстеритом.
Пиросиликаты
Когда два элемента SiO 4 4- соединяются вместе, они образуют пиросиликатную группу , Si 2 O 7 6-.Например, тортвейтит, Sc 2 Si 2 O 7 является пиросиликатным.
Кольцевые и цепочечные силикаты
Когда два кислородных звена SiO 4 4- делятся с другими звеньями SiO 4 4-, силикаты образуют кольцо или бесконечную цепь. Стехиометрия силикатов становится (SiO 3 ) n 2n-. Бенитоит BaTi(SiO 3 ) 3 содержит три кольца кремнезема, но это релаксированные 6-атомные кольца
SiO 2
/ \
О О
| |
O 2 SiSiO 2
\ /
О
Драгоценный камень берилл Be 3 Al 2 (SiO 3 ) 6 содержит шестигранные кольца.
одноцепочечного диоксида кремния называются пироксенами . Было показано, что некоторые синтетические метасиликаты Na 2 (SiO 3 ) содержат силикаты с простой цепью (SiO 3 ) n , в которых связи Si-O типа Si-O-Si составляют 168 нм. , с углами Si-O-Si 137 o .Связи Si=O короче, 1,57 нм. Природные пироксены включают энстатит MgSiO 3 , диопсид CaMg(SiO 3 ) 2 и жадеит NaAl(SiO 3 ) 2 .
Силикаты с двойной цепью
Силикаты с двойной цепью называются амфиболами , здесь показана часть двойной цепи, такая же, как двойная цепь, показанная в Inorganic Chemistry от Swaddle. Эти цепи имеют стехиометрию (Si 4 O 11 ) n 6n .Вы можете легко определить один такой блок на диаграмме. Тремолит, Ca 2 Mg 5 (Si 4 O 11 ) 2 (OH) 2 , является таким минералом.
Эти цепи имеют стехиометрию (Si 4 O 11 ) n 6n .Вы можете легко определить один такой блок на диаграмме. Тремолит, Ca 2 Mg 5 (Si 4 O 11 ) 2 (OH) 2 , является таким минералом.
Настоящий асбест, такой как крокидолит или голубой асбест, состоит из двуцепочечных силикатов. Асбестозы были идентифицированы как канцерогены, и с тех пор его применение было ограничено из-за запрета на ограничение его воздействия на население. Большинство коммерческих асбестов представляют собой хризотил, который содержит слои силикатного листа, как мы увидим ниже.
Силикаты с листовой структурой
Листовые пластины называются филлосиликатами (филло означает листовидный). Эти силикаты легко расщепляются (как и графит). Тальк представляет собой типичный листовой силикат, Mg 3 (OH) 2 (Si 2 O 5 . Тальк является основным ингредиентом мыльного камня (стеатита).
Тальк является основным ингредиентом мыльного камня (стеатита).
На приведенной ниже диаграмме показано расположение листов брусита Mg(OH) 2 , в котором листы состоят из октаэдров с общими углами Mg(OH) 6 .В хлорите есть два типа листов. Половина листов такая же, как у брусита, но половина бруситовых листов зажата между листами силикатов. Тальк состоит только из прослоенных листов.
Диаграмма взята из серии полисом, в которой обсуждаются листовые силикаты.
Змеевик, Mg 3 (OH) 4 Si 2 O 5 , имеет изогнутые листы.
Асбохризотил технический представляет собой листовой силикат, но листы свернуты в трубку.Эти трубки выглядят как волокна, и их обычно называют асбестовыми.
Силикаты с трехмерным каркасом
Как упоминалось ранее, единицы SiO 4 4- могут делиться каждым кислородом с другими единицами, образуя трехмерную сеть, и кварц имеет такую структуру. Здесь показана часть такой структуры. При таком расположении стехиометрия снижается до SiO 2 , который часто называют кремнеземом . Совокупность мелких кусочков кварца – это песок.
Здесь показана часть такой структуры. При таком расположении стехиометрия снижается до SiO 2 , который часто называют кремнеземом . Совокупность мелких кусочков кварца – это песок.
См. анимированную иллюстрацию кольцевой структуры Боба Хэнсона.
Кварц — это группа минералов.
Асбестозы?
Асбест — это название шести природных минералов, добываемых из земли. Различные типы асбеста:
- Амозит
- Хризотил
- Тремолит
- АктинолитUnlink
- Антофиллит
- Крокидолит
Три из этих шести используются чаще. Хризотил (белый) является наиболее распространенным, но нередко можно встретить и . Amosite (коричневый / почти белый) или Crocidolite (синий). Асбест представляет собой негорючий волокнистый материал, который используется в качестве изоляционного материала для клемм, тормозных накладок, строительных материалов и фильтров. При смешивании с цементом усиливает механическую прочность бетона. Он разлагается из-за потери воды и образует форстерит и кремнезем при высокой температуре.
При смешивании с цементом усиливает механическую прочность бетона. Он разлагается из-за потери воды и образует форстерит и кремнезем при высокой температуре.
Пример 1
Какова стехиометрия бесконечной цепочки силикатов при наличии двух общих атомов кислорода с соседними звеньями?
Раствор
Сначала мы можем нарисовать такую цепочку:
О О О О О О О О О О О О Си Си Си Си Си Си / \ / \ / \ / \ / \ / \ / О О О О О О О
На этой диаграмме основная единица выделена жирным шрифтом, а стехиометрия, по-видимому, SiO 3 .
ОБСУЖДЕНИЕ
Существует ли другой тип цепи, удовлетворяющий заданному в вопросе условию? Если вы работаете с трехмерными моделями, то наверняка понимаете, что это единственный способ построить единую цепочку. Бесконечные цепи и кольцевые структуры имеют одинаковую стехиометрию.
вопросов
- Каков химический состав кварца?
Решения
- SiO 4
Skill —
Опишите базовую единицу силиката SiO 4 4- и ее универсальность в соединении друг с другом или друг с другом. - SiO 2
Навык —
Определить единицы, используемые для построения структуры. - Тетраэдры образуют трехмерную сеть, подобную сети алмаза, но со связями Si-O-Si в местах связей С-С алмаза.
Навык —
Эти диаграммы обсуждались во время лекций. - Минералы, состоящие из одного SiO 4 4- единиц.
Skill —
Минералы, состоящие из единичных единиц Be 2+ , называются ортосиликатами. Они образуют соли с двухвалентными катионами Be 2+ , Zn 2+ , Mg 2+ , Fe 2+ и т. д., но эти двухвалентные катионы прочно связаны с кислородом единиц Be 2+ .
Они образуют соли с двухвалентными катионами Be 2+ , Zn 2+ , Mg 2+ , Fe 2+ и т. д., но эти двухвалентные катионы прочно связаны с кислородом единиц Be 2+ . - Пиросиликаты
- Тетраэдры образуют трехмерную сеть, подобную сети алмаза, но со связями Si-O-Si в местах связей С-С алмаза.
Навык —
Эти диаграммы обсуждались во время лекций.
Авторы и авторство
Силикаты-Типы-Классификация-Примеры-Структура-Формула-Орто-Пиро-Циклическая-Цепь-Текто
Силикаты – это минералы, содержащие кремний и кислород в тетраэдрических единицах SiO 4 4- , которые связаны друг с другом по нескольким схемам.В зависимости от способа соединения тетраэдрических блоков силикаты подразделяются на следующие типы.
Ортосиликаты (или силикаты Neso или Island) являются простейшими силикатами, которые содержат дискретные тетраэдрические единицы SiO 4 4-. То
основной структурный
единица ортосиликатной единицы показана ниже.
То
основной структурный
единица ортосиликатной единицы показана ниже.
Ион ортосиликата представляет собой сильное сопряженное основание слабой ортокремниевой кислоты. а также он не будет сохраняться в водных растворах.Следовательно, в природе орто силикатные минералы встречаются редко и встречаются только с катионами, образующими сильно нерастворимые соли.
Примеры ортосиликатов:
1) Фенакит (также известный как фенакит) — Be 2 SiO 4
2) Виллемит — Zn 2 SiO 4 — Мелкая силикатная руда цинка. Сильно флуоресцентный (зеленый) в коротковолновом УФ.
Примечание. Ионы Be 2+ и Zn 2+ тетраэдрически окружены атомами кислорода силиката.
3) Оливин — (Fe/Mg) 2 SiO 4 : Обычно зеленого цвета. Катионы октаэдрически координированы с атомами кислорода силиката.
4) Циркон — ZrSiO 4 :
Древнейший минерал на Земле. Координационный номер Zr 4+ 8.
Координационный номер Zr 4+ 8.
Пиросиликат (или силикат Соросиликата, или дисиликат) содержат ионы Si 2 O 7 6-, которые образуются путем соединения двух тетраэдрических SiO 4 4-, которые имеют один общий атом кислорода в одном углу один кислород удаляется при присоединении).Структура пиросиликата показана ниже.
Пиросиликат-ион менее основный, чем ортосиликат-ион. Там только один Минерал в природе, содержащий пиросиликат-ион.
Напр. 1) Тортвейтит — Sc 2 Si 2 O 7
Циклические силикаты содержат ионы (SiO 3 ) n 2n-, которые образуются путем циклического связывания трех или более тетраэдрических звеньев SiO 4 4-.Каждая единица разделяет два атома кислорода с другими единицами.
Напр.
1) Бенитоит — BaTi(SiO 3 ) 3 : содержит три тетраэдра, расположенных циклически [Si 3 O 9 ) 6-].
2) Берилл — Be 3 Al 2 (SiO 3 ) 6 : содержит шесть силикатных колец [Si 6 O 18 ) 12-]. Это алюмосиликат.Каждый алюминий окружен 6 атомами кислорода восьмигранный. Хорошо известные разновидности берилла включают изумруд и Аквамарин.
Цепочечные силикаты или пироксены содержат (SiO 3 ) n 2n- ионы, которые образуются путем линейного связывания n тетраэдрических звеньев SiO 4 4- Каждая единица разделяет два атома кислорода с другими единицами.
Примеры цепочечных силикатов:
1) Сподумен — LiAl(SiO 3 ) 2 — пироксеновый минерал, состоящий из иносиликата лития-алюминия
2) Диопсит — CaMg(SiO 3 ) 2
3) Волластонит — Ca 3 (SiO 3 ) 3
Примечание.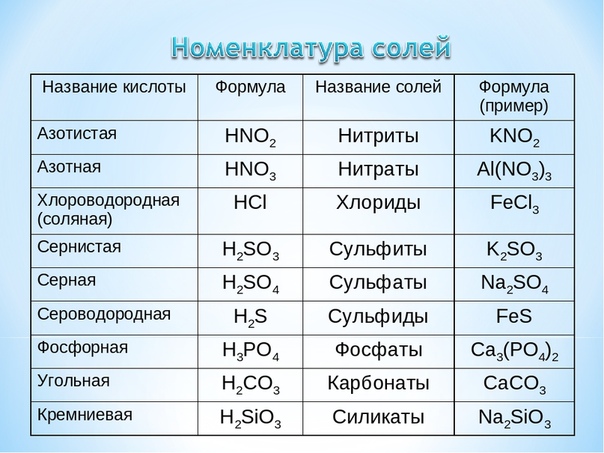 Формула циклических силикатов, а также цепочечных силикатов:
(SiO 3 ) n 2n-.Следовательно, они рассматриваются как
олигомеры неизвестного SiO 3 2- ион.
Формула циклических силикатов, а также цепочечных силикатов:
(SiO 3 ) n 2n-.Следовательно, они рассматриваются как
олигомеры неизвестного SiO 3 2- ион.
Общая формула силикатов с двойной цепью (или амфиболов) : (Si 4 O 11 ) n 6n- . Есть два типа тетраэдров: те, которые имеют 3 общие вершины, и те, которые имеют только 2 общие вершины.
Напр.
1) Асбест — Это негорючие волокнистые силикаты.Они использовались в качестве теплоизоляционного материала, тормозных накладок, строительных материалов и фильтров. Это канцерогенные амфиболы, поражающие легкие. Следовательно, их применение в настоящее время ограничено.
2) Тремолит — Ca 2 Mg 5 (Si 4 O 11 ) 2 (OH) 2
Примечание. Одноцепочечные и двухцепочечные силикаты вместе известны как иносиликаты.
Общая формула Sheet или Phyllo или двумерные (2-D) силикаты (Si 2 O 5 ) n 2n- .Каждый тетраэдр SiO 4 разделяет три атома кислорода с другими и, таким образом, образует двумерные листы. Эти силикаты легко расщепляются, как и графит. То слои удерживаются вместе слабыми силами Ван-дер-Ваальса.
Напр.
1) Тальк — Mg 3 Si 4 O 10 (OH) 2 : Это основной ингредиент мыльного камня. Это самый мягкий материал с гладким и жирным прикосновением.
2) Слюды: Общая формула X 2 Y 4–6 Z 8 O 20 (OH,F) 4
Где X = K, Na или Ca
Y = Al, Mg или Fe
Z = Si или Al
Э. г. Мусковитовая слюда — KAl 2 (AlSi 3 O 10 )(F,OH) 2 —
очень легко расщепляется на тонкие слои
г. Мусковитовая слюда — KAl 2 (AlSi 3 O 10 )(F,OH) 2 —
очень легко расщепляется на тонкие слои
и лепидолит — KLi 2 Al(Al,Si) 3 O 10 (F,OH) 2
3) Глина: это алюмосиликат листовой структуры.
4) Каолинит — AlSiO 5 (OH) 5
Общая формула трехмерных (3-D) или текто или каркасных силикатов : (SiO 2 ) n .Все атомы кислорода SiO 4 являются общими с другими тетраэдрами и, таким образом, образуют трехмерную сеть.
Напр. SiO 2 — Кварц, тридимит и кристобалит — это кристаллические формы кремнезема.
При замене звеньев SiO 4 4- на звенья AlO 4 5- образуются трехмерные алюмосиликаты .
Напр. Полевой шпат, цеолиты, ульта и т. д.,
НЕСКОЛЬКО ВАЖНЫХ ЗАМЕЧАНИЙ О СИЛИКАТАХ
* Силикатные минералы очень распространены в земной коре, так как кислород и
Кремний является наиболее распространенным элементом.
* Степень полимеризации обозначается преобразованием кислорода в кремний. отношение (O/Si). Чем выше степень полимеризации, тем ниже будет отношение O/Si соотношение. Значения O/Si для ортосиликатов (неполимеризованных) = 4:1 в то время как для тектосиликатов (наиболее полимеризованный силикат) = 2:1.
* С увеличением степени полимеризации снижается заряд на атом кремния, а также основность силикатного минерала.Верно, диоксид кремния (SiO 2 ) является кислотным оксидом.
* Основные силикатные минералы легко реагируют со слабыми кислотами и подвергаются выветривание.
Вопрос-1) Какое утверждение о силикатах НЕ верно?
а) Основной единицей силикатов является SiO 4 4- . При этом кремний 4-координирован с атомами кислорода тетраэдрически.
При этом кремний 4-координирован с атомами кислорода тетраэдрически.
б) Асбест является амфиболом силикат.
c) Тальк и слюда являются примерами силикатов с цепочечной структурой.
г) Цеолиты представляют собой алюмосиликаты.
e) Некоторые силикаты содержат дискретные молекулярные ионы.
Подсказка: Тальк и слюда представляют собой листовые или филлосиликаты.
Вопрос-2) (SiO 3 ) n 2n- может быть эмпирической формулой:
а) Циклические силикаты
б) Пиросиликаты
c) Цепные силикаты
г) оба а и с
Вопрос-3) Общая формула силикат-иона присутствующих циклических силикатов составляет:
а) SiO 4 4-
б) Si 2 O 5 2-
c) Si 2 O 7 6-
г) (SiO 3 ) n 2n-
Вопрос-4) Какое из следующих утверждений НЕ верно?
а) Глина представляет собой алюмосиликат листовой структуры.
б) Через три размерные алюмосиликаты, SiO 4 4- заменяется на AlO 4 5- шт.
в) В тектосиликаты, все атомы кислорода в тетраэдрах SiO 4 являются общими.
г) Кварц представляет собой филлосиликат.
Вопрос-5) Слоистые силикатные структуры в глинах состоят в следующем группа.
а) SiO 4 4-
б) Si 2 O 5 2-
c) Si 2 O 7 6-
г) (SiO 3 ) n 2n-
Вопрос-6) Амфиболовые силикатные минералы состоят из
а) одиночные кремниевые тетраэдры
б) цепочки кремнеземных тетраэдров
в) двойные цепи кремнеземных тетраэдров
d) листы кремнеземных тетраэдров
Вопрос-7) Что из следующего верно относительно ионного обмена на алюмосиликаты?
а) Na + сорбируется сильнее, чем K +
б) Ca 2+ сорбируется меньше сильнее, чем Na +
в) NO 3 — сорбируется сильнее, чем Na +
г) Al 3+ сорбируется сильнее, чем Mg 2+
Объяснение: Чем больше плотность заряда, тем больше сорбция. А вы знаете, что плотность заряда обратно пропорциональна радиусу. Больше
заряд и чем меньше радиус, тем выше плотность заряда.
А вы знаете, что плотность заряда обратно пропорциональна радиусу. Больше
заряд и чем меньше радиус, тем выше плотность заряда.
Вопрос-8) Берилл, Be 3 Al 2 Si 6 O 18 is:
а) ортосиликат
б) пиросиликат
c) циклический силикат
г) Нет
Не подсказка!: Изумруд и аквамарин являются драгоценными формами берилла.
Вопрос-9) Какое из следующих утверждений верно для амфибола? силикаты?
а) Эмпирическая формула: [(SiO 3 ) 2- ] n
б) Существует два типа тетраэдры: те, что имеют 3 вершины, и те, что имеют 2 вершины.
в) Есть только один тип тетраэдров.
d) Эмпирическая формула: [(Si 4 O 11 ) 6- ] n
Вопрос-10) Формула пиросиликатного иона:
а) SiO 4 4-
б) Si 3 O 9 2-
c) Si 2 O 7 6-
г) Si 6 O 18 12-
Вопрос-11) В нормальных силикатах каждый атом кремния окружен
а) пять атомов кислорода в тригонально-бипирамидальной геометрии
б) четыре атома кислорода в квадратной плоской геометрии
в) четыре атома кислорода в тетраэдрическая геометрия
г) шесть атомов кислорода в октаэдрической геометрии
Вопрос-12) Что из перечисленного является примером циклического силикат?
а) Сподумен
б) Оливин
в) Берилл
г) Асбест
Вопрос-13) Эмпирическая формула силикатов с двойной цепью:
а) SiO 4 4-
б) Si 3 O 9 2-
c) Si 2 O 7 6-
d) (Si 4 O 11 ) n 6n-
Вопрос-14) Силикаты, в которых три атома кислорода вершины тетраэдров являются общими:
а) Амфиболы
б) пироксены
c) филлосиликаты
г) пиросиликаты
Вопрос-15) Отношение «Si» к «O» в филлосиликатах составляет:
а) 2 : 4
б) 1 : 4
в) 2 : 5
г) 1 : 5
16) Какой из перечисленных минералов лития относится к пироксеновому типу силикатный состав?
а) Лепидолит
б) Сподумен
в) Петалит
г) нет
Примечание. Петалит, LiAlSi 4 O 10 представляет собой тектосиликаты.
Петалит, LiAlSi 4 O 10 представляет собой тектосиликаты.
17) Формула циклического силиката, в котором 6 тетраэдров расположены циклически:
а) Si 6 O 18 12-
б) Si 6 O 18 6-
c) Si 6 O 6 2-
г) Si 6 O 18 6-
18) В каких из перечисленных силикатов присутствуют два типа SiO 4 тетраэдры: те, что имеют 3 общие вершины, и те, что имеют 2 общие вершины.
а) Пироксены
б) Филлосиликаты
в) Амфиболы
г) Текто силикаты
19) Число атомов кислорода, участвующих в делении [Si 3 O 9 ] 6- ион:
а) 2
б) 3
в) 6
г) 4
20) Среди полевых шпатов, мусковитовой слюды и цеолита,
а) все трехмерные силикаты
б) полевой шпат и цеолит трехмерны, а мусковит слюда слоистая
в) полевой шпат трехмерный, а цеолит и мусковит слюда слоистая
d) все представляют собой слоистые силикаты
21) Общий заряд циклического силикатного аниона [Si 6 O 18 ] n- это:
а) 24
б) 12
в) 18
г) 6
22) Силикатный минерал с более низкой степенью полимеризации среди следующих:
1) Грунерит — Fe 7 Si 8 O 22 (OH) 2
2) Пирофиллит, Al 2 Si 4 O 10 (OH) 2
3) Тальк — Mg 3 Si 4 O 10 (OH) 2
4) Тремолит — Ca 2 Mg 5 (Si 4 O 11 ) 2 (OH) 2
Подсказка: Чем больше отношение O/Si, тем ниже степень
полимеризации.
23) Что из перечисленного не является ортосиликатом?
а) Фенакит
б) оливин
в) Оливин
г) Берилл
24) BaTi[Si 3 O 9 ] относится к классу:
а) ортосиликат
б) циклический силикат
в) цепочечный силикат
г) силикатный листовой
25) Какие из перечисленных силикатов имеют трехмерную структуру?
1)Несо
2)филло
3)Соро
4)Текто
26) Значение n в молекулярной формуле Be n Al 2 Si 6 O 18 это:
а) 3
б) 4
в) 6
г) 8
27) Основная структурная единица полевошпатовой цеолитовой слюды и асбест:
а) SiO 4 4-
б) SiO 2
в) (R 2 SiO) n
г) (SiO 3 ) n 2n-
28) Тортветит, Sc 2 Si 2 O 7 это:
а) пиросиликат
б) ортосиликат
в) силикатный листовой
г) ан амфибол
29) Что из следующего неверно относительно анионной единицы пиросиликат?
а) Он имеет один кислород, общий для двух SiO 4 тетраэдры.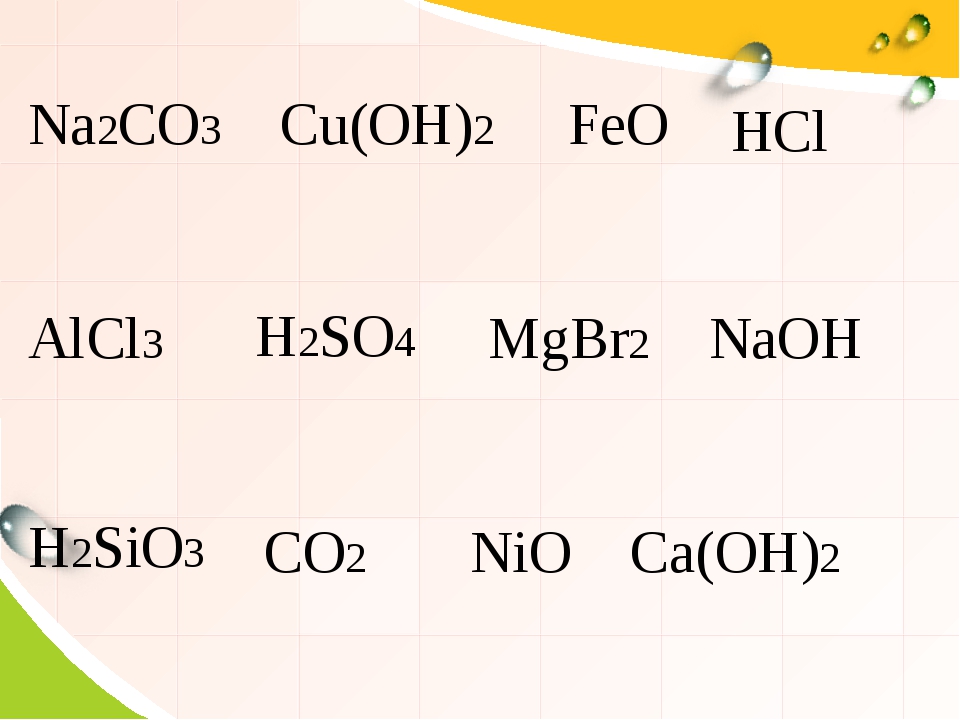
б) Имеет три тетраэдра SiO 4 , соединенных циклически.
в) Он имеет основную природу и поэтому легко реагирует со слабыми кислотами.
d) Отношение O/Si составляет 3,5:1.
30) Силикат, содержащий по одному одновалентному угловому атому кислорода в каждом единица тетраэдра:
а) Циклический силикат.
б) Филлосиликат.
в) Амфиболы.
г) ортосиликаты.
31) Какой тип силикатных минералов показан на этой схеме? силикатных тетраэдров?
а) Ортосиликат.
б) Циклический силикат.
в) Каркасный силикатный.
г) Филосиликат.
32) Какие из следующих силикатов относятся к пироксенам?
а) Одноцепочечные силикаты.
б) Филлосиликат.
в) Тектосиликаты.
d) Силикаты с двойной цепью.
33) Минералы слюды, такие как мусковит, флогопит и биотит,
некоторые камни сверкают, так как они очень легко разбиваются на тонкие параллельные пластины
плоские поверхности, которые отражают свет. Причина:
Причина:
1) Это ортосиликаты, содержащие дискретные единицы SiO 4 2- тетраэдры.
2) Это каркасные силикаты.
3) Это филлосиликаты со слоями, удерживаемыми вместе сильными силами Ван дер Ваала.
4) Это филлосиликаты со слоями, удерживаемыми вместе слабыми силами Ван-дер-Вааля.
34) Блоки Si 4+ в Полевых шпатах заменены на:
1) Ca 2+
2) Нет данных +
3) Ал 3+
4) К +
35) Название структуры силикатов, в которой три кислорода атомы SiO 4 4- являются общими:
1) Пиросиликаты
2) Пироксены
3) Тектосиликаты
4) Амфиболы
36) Тип силикатной единицы, присутствующей в бериллсиликате Be 3 Al 2 [Si 6 O 18 ] :
1) соросиликатный
2) циклосиликатный с шестью звеньями
3) силикатный листовой
4) циклосиликатный с тремя звеньями
37) Сколько атомов кислорода в SiO 4 4- единиц являются общими в непрерывном трехмерном каркасе силикатов?
1) 2
2) 3
3) 4
4) 1
38) Берилл – силикат. Его анионная часть содержит [Si n O 3n ] 12-,
тогда значение n:
Его анионная часть содержит [Si n O 3n ] 12-,
тогда значение n:
1) 3
2) 6
3) 9
4) 18
39) Назовите тип строения силиката, в котором атом кислорода SiO 4 4- общий :
1) несиликат
2) Соросиликат
3) Филосиликат
4) Тектосиликат
40) Кремнезем представляет собой сетчатое твердое вещество со связями Si-O-Si.Во многих алюмосиликатах, несколько атомов Si в структуре кремнезема заменены атомами Al. Цеолиты, глины, асбест и т. д. являются примерами алюмосиликатов. имеющие разную структуру. Неверным является утверждение: (НЕСТ 2017)
(A) Основной структурной единицей силикатов является тетраэдрическая (SiO 4 ) 4− .
(B) Результат замены атома Si в кремнеземе на атом Al отрицательно заряжены на атоме Al.
(C) Кремнезем растворяется в водном растворе NaOH с образованием силиката натрия.
в котором Na + связан с оксианионами.
(D) Силиконы являются примерами силикатов.
41) Наиболее вероятная геометрия силикатного блока: (НЕСТ 2012)
(А) квадратный плоский.
(B) квадратно-пирамидальный.
(С) октаэдрический.
(D) четырехгранный
42) Синий египетский CaCuSi 4 O 10 пример из:
А) силикатный листовой
B) Циклический силикат
С) Пиросиликат
D) Цепной силикат
43) Наиболее часто используемый кислотный катализатор в нефтяной промышленности и соответствующие соответственно: (CSIR NET JUNE 2012 Solved — AdiChemistry)
1) Алюмофосфат и риформинг
2) Алюмосиликат и крекинг
3) Алюмосиликат и риформинг
4) Алюмофосфаты и крекинг.
44) Виды, образующиеся в результате замены одной четверти Si(IV) в пирофиллит [Al2(OH)2Si4O10] с Al(III). Баланс заряда по K(I)] составляет (CSIR NET, июнь 2019 г., решено – AdiChemistry)
(1) Москвич
(2) Флогопит
(3) Монтмориллонит
(4) Тальк
Вопрос-45) силикаты с непрерывным трехмерным каркасом известны как:
(1) Тектосиликаты
(2) амфиболы
(3) Пироксены
(4) Циклические силикаты
Ответ: 1
Кристаллическая структура бултфонтейнита, Ca4[SiO3(OH)]2F2·2h3O, из рудника Н’Чванинг II (марганцевое месторождение Калахари, Южно-Африканская Республика) | Интернет-исследования в области здравоохранения и окружающей среды (HERO)
ID ГЕРОЯ
8653741
Тип ссылки
Журнальная статья
Заголовок
Кристаллическая структура бултфонтейнита Ca4[SiO3(OH)]2F2·2h3O из рудника Н’Чванинг II (марганцевое месторождение Калахари, Южно-Африканская Республика)
Авторы)
Бьяджони, К; Бонаккорси, Э; Мерлино, С.
Год
2010
Объем
115
Номера страниц
9-15
Язык
английский
DOI
10.2424/АСТСН.М.2010.02Абстрактный
Обнаружение в 1980-х годах хорошо окристаллизованных образцов бултфонтеинита из рудника Н’Чванинг II (Калахарское месторождение марганца, ЮАР) позволило собрать новые данные о кристаллической структуре этого гидрата силиката кальция. Исследование кристаллической структуры согласуется с общими чертами, описанными МакИвером (1963), и позволяет описать разумную схему водородной связи.
Ключевые слова
бульфонтеинит; Кристальная структура; шахта Н’Чванинг II; Южно-Африканская Республика
Расчет уравнения состояний (Mg0.92, Fe0.08)SiO3 Перовскит на основе Mie-Grüneisen-Debye Model
[1]
Knittle, E. , and R. Teanloz, Синтез и уравнение состояния перовскита (Mg, Fe)SiO3 при давлении более 100 ГПа, science, 235, 668-670, (1987).
, and R. Teanloz, Синтез и уравнение состояния перовскита (Mg, Fe)SiO3 при давлении более 100 ГПа, science, 235, 668-670, (1987).
DOI: 10.1126/science.235.4789.668
[2] Morishima, H., E. ohtani, T. kato, O. shimomura, and T. kikegawa, Тепловое расширение перовскита MgSiO3 при 20,5 ГПа, Geophys, Res, lett. 12, 899-902, (1994).
DOI: 10.1029/94gl00844
[3]
Мао, Х. К., Р. Дж. Хемли, Ю. Фей и др., Влияние давления, температуры и состава на параметры решетки и плотность перовскитов (Mg, Fe)SiO3 до 30 ГПа, J. Geophys. рез., 96, 8069-8079, (1991).
К., Р. Дж. Хемли, Ю. Фей и др., Влияние давления, температуры и состава на параметры решетки и плотность перовскитов (Mg, Fe)SiO3 до 30 ГПа, J. Geophys. рез., 96, 8069-8079, (1991).
DOI: 10.1029/91jb00176
[4] Фунамори, Н., Яги, Т. Рентгеновское наблюдение перовскита MgSiO3 на месте при высоком давлении и высокой температуре в условиях нижней мантии, Geophys, Res. лет. 20, 387~390, (1993).
DOI: 10. 1029/92gl02960
1029/92gl02960
[5] Ван, Ю., Д.Дж. Вайднер, Р.К. Либерманн, С. Лю, Дж. Ко, М., Т. Воан.Ю. Чжао. А. Еганех-Хаери и Р. Э. Г. Пакало, Фазовый переход и тепловое расширение перовскита MgSiO3, наука, 251; 410-413, (1991).
DOI: 10.1126/наука.251.4992.410
[6]
С. В. Сингейкин, Дж. Чжан, Дж. Д. Басс, Эластичность монокристаллического и поликристаллического перовскита MgSiO3 с помощью бриллюэновской спектроскопии, Geophys, Res. летт., т. 31. Л06620. doi: 10. 1029/2004GL019559, (2004).
В. Сингейкин, Дж. Чжан, Дж. Д. Басс, Эластичность монокристаллического и поликристаллического перовскита MgSiO3 с помощью бриллюэновской спектроскопии, Geophys, Res. летт., т. 31. Л06620. doi: 10. 1029/2004GL019559, (2004).
[7] Винет, П., Дж. Ферранте, Дж. Х. Роуз и Дж. Р. Смит, Сжимаемость твердого тела, J. Geophys. рез., 92, 9319-9325, (1987).
[8]
Я. Джексон и С.М. Ригден, Анализ данных PVT: ограничения на термоупругие свойства минералов высокого давления, Phys, Earth. Планета интер., 96, 85-112, (1996).
Джексон и С.М. Ригден, Анализ данных PVT: ограничения на термоупругие свойства минералов высокого давления, Phys, Earth. Планета интер., 96, 85-112, (1996).
[9] Фике, Г., Деваэле А., Андро Д., Кунц М. и Бихан Т.Л. Термоупругие свойства и кристаллическая структура перовскита MgSiO3 при более низком мантийном давлении и температурных условиях, Geophys: Res, Lett., 27, 21-24, (2000).
DOI: 10.1029/1999gl008397
[10]
Фредерик. К. Мартон, Джоэл Ита и Рональд Э. Коэн, Уравнение давления-объема-температуры состояния перовскита MgSiO3 на основе молекулярной динамики и ограничений на нижний состав породы, J. Geophys. Рез. 106: 8615-8627, (2001).
К. Мартон, Джоэл Ита и Рональд Э. Коэн, Уравнение давления-объема-температуры состояния перовскита MgSiO3 на основе молекулярной динамики и ограничений на нижний состав породы, J. Geophys. Рез. 106: 8615-8627, (2001).
DOI: 10.1029/2000jb7
[11] Ван, Ю., Вайднер, Д.Т., Либерманн, Р.К. и Чжао Ю., P-V-T уравнение состояния перовскита (Mg, Fe)SiO3 Ограничения состава нижней мантии, физ. Планета Земля. Интер., 83: 13-40, (1994).
DOI: 10. 1016/0031-9201(94)
1016/0031-9201(94)
[12] Такэнико Яги и Нобумаса Фунамори, Химический состав нижней мантии, выведенный из уравнения состояния перовскита MgSiO3, Phil.Транс.Р. соц. Lond, A. 354, doi: 10. 1098/rsta. 1996. 0053.
[13]
Агнес Деваэль, Франсуа. Гайо, Тепловые параметры нижней мантии Земли, Физика Земли и недр планет 107: 261-267. (1998).
Гайо, Тепловые параметры нижней мантии Земли, Физика Земли и недр планет 107: 261-267. (1998).
DOI: 10.1016/s0031-9201(98)00095-8
[14] Чжао.Ю. и Андерсон Д.Л., Минеральная физика. Ограничения на химические вещества. Состав нижней мантии Земли, физ. Земной шар. Планета. Интер., 85: 273-292, (1994).
[15]
Андерсон, О. Л., Масуда. К., Исаак Д.Г. Пределы значений δT и γ для перовскита MgSiO3. phys, Earth planet, Inter., 96: 31-46, (1996).
Л., Масуда. К., Исаак Д.Г. Пределы значений δT и γ для перовскита MgSiO3. phys, Earth planet, Inter., 96: 31-46, (1996).
[16] Юичиро Хама и Кайчи Суито, Уравнение состояния перовскита MgSiO3 и его термоупругие свойства в условиях нижней мантии.Дж. Геофиз. рез., 103, 7443-7462, (1998).
DOI: 10.1029/97jb03672
.

 ) + H2O = Na2SiO3 + 2H2 ↑
) + H2O = Na2SiO3 + 2H2 ↑ Простые
Простые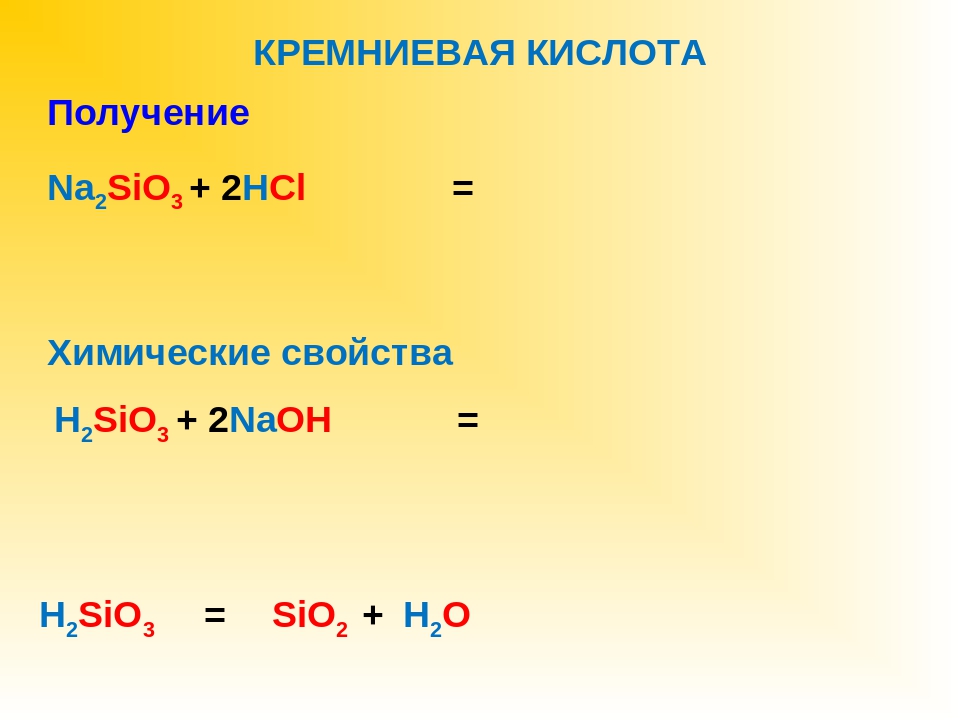 Окси
Окси .
. Если это связывание происходит в чередующихся группах SiO 3 в каждой цепи, получается двухцепочечная структура (Si 4 O 11 ) n 6n-. В таких структурах происходит уменьшение заряда и числа атомов кислорода, приходящихся на один атом кремния.
Если это связывание происходит в чередующихся группах SiO 3 в каждой цепи, получается двухцепочечная структура (Si 4 O 11 ) n 6n-. В таких структурах происходит уменьшение заряда и числа атомов кислорода, приходящихся на один атом кремния. Для этого рассчитайте отношение O/Si (чем ниже отношение, тем более полимеризована структура.
Для этого рассчитайте отношение O/Si (чем ниже отношение, тем более полимеризована структура. Во время этого процесса кремний-кислородные мостики разрываются.
Во время этого процесса кремний-кислородные мостики разрываются.  Такие почвы менее плодородны, чем вновь орошаемые пустынные почвы из-за потери некислотного элемента питания растений К + . Слоистые силикаты, присутствующие в промежуточных почвах, все еще могут удерживать катионы на своей отрицательно заряженной поверхности, которые могут высвобождаться по мере необходимости для растений. Эти почвы встречаются в еще достаточно плодородных кукурузно-пшеничных поясах.
Такие почвы менее плодородны, чем вновь орошаемые пустынные почвы из-за потери некислотного элемента питания растений К + . Слоистые силикаты, присутствующие в промежуточных почвах, все еще могут удерживать катионы на своей отрицательно заряженной поверхности, которые могут высвобождаться по мере необходимости для растений. Эти почвы встречаются в еще достаточно плодородных кукурузно-пшеничных поясах. 
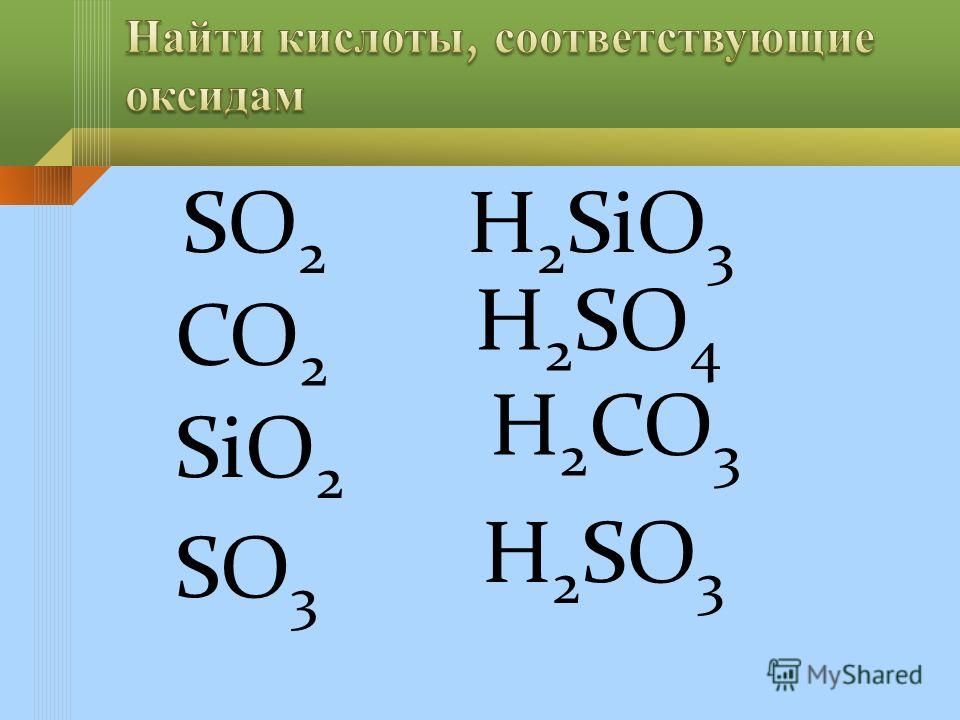
 Они образуют соли с двухвалентными катионами Be 2+ , Zn 2+ , Mg 2+ , Fe 2+ и т. д., но эти двухвалентные катионы прочно связаны с кислородом единиц Be 2+ .
Они образуют соли с двухвалентными катионами Be 2+ , Zn 2+ , Mg 2+ , Fe 2+ и т. д., но эти двухвалентные катионы прочно связаны с кислородом единиц Be 2+ .