Сильная и слабая кислота 2019
Кислоты — это химические вещества, которые подают ионы водорода или протоны при смешивании в растворах. Количество протонов, выделяемых конкретной кислотой, фактически определяет прочность кислоты — будь то сильная кислота или слабая кислота. Чтобы понять силу кислот, нужно сравнить их тенденцию пожертвовать протоны на аналогичную основу (в основном воду). Сила обозначается номером pKA.
Что такое сильная кислота?
Говорят, что кислота является сильной, если она диссоциирует или ионизируется полностью в растворе. Это означает, что он может давать наибольшее количество ионов Н + или протонов при смешивании в растворе. Эти ионы представляют собой заряженные частицы. Поскольку сильная кислота подавляет большее количество ионов при ее разрушении или ионизации, это означает, что сильная кислота является проводником электричества.
Когда кислота смешивается в H2O, протон (H+ ион) переносится в H2O с образованием h4O+
В общем случае,
Такие химические реакции можно почтить, но в немногих случаях кислота выделяет H+ ион довольно легко, и реакция выглядит как односторонняя. И кислота полностью диссоциирована.
Например, когда хлористый водород растворяется в H2O, чтобы сделать HCl, так мало реакции обратного, что мы можем написать:
Когда-нибудь будет проведена стопроцентная виртуальная реакция, в которой хлористый водород будет демонстрировать реакцию с h4O+ (Ион гидроксида) и Cl– ионов. Здесь сильной кислотой является хлористый водород.
Что такое слабая кислота?
Говорят, что кислота является слабой, если она частично или частично ионизирует, выделяя в раствор лишь некоторые из ее атомов водорода. Следовательно, он менее эффективен по сравнению с сильной кислотой при выделении протонов. Слабые кислоты имеют более высокую рКа, чем сильные кислоты.
Этановая кислота является хорошим примером слабой кислоты. Он показывает реакцию с H2O для получения h4O+ (Ионы гидроксида) и СН3СООН (ионы этаноата), но обратная реакция показывает больший успех, чем передний. Молекулы реагируют довольно легко, чтобы улучшить кислоту, и H2О.
В любой момент, только около одного процента CH3Молекулы СООН показывают превращение в ионы. Все, что осталось — это простая молекула уксусной кислоты (систематически называемая этановой кислотой).
Разница между сильной кислотой и слабой кислотой
Определение
Сильная кислота
Сильная кислота представляет собой кислоту, полностью ионизирующуюся в водном растворе. Сильная кислота всегда теряет протон (A H +), когда растворяется в H2О. Другими словами, сильная кислота всегда находится на цыпочках и достаточно эффективн
Разница между сильными и слабыми кислотами
Основное отличие — сильные и слабые кислоты
Кислота — это молекула или другой вид, который может пожертвовать протон или принять электронную пару в реакциях. Кислоты подразделяются на две группы, известные как сильные кислоты и слабые кислоты. Основное различие между сильными и слабыми кислотами заключается в том, что сильные кислоты полностью диссоциируют в водных растворах в то время как слабые кислоты частично диссоциируют в водных растворах.
Ключевые области покрыты
1. Что такое сильная кислота
— определение, свойства, примеры
2. Что такое слабая кислота
— определение, свойства, примеры
3. В чем разница между сильной кислотой и слабой кислотой
— Сравнение основных различий
Ключевые слова: кислота, константа диссоциации кислоты, депротонирование, рН, полярность, протон, сильная кислота, слабая кислота
Что такое сильная кислота
Сильные кислоты — это молекулы, которые полностью распадаются на ионы, когда они находятся в воде. Другими словами, кислоты выделяют Н+ ионы в раствор путем их полной ионизации. Сила кислоты характеризуется их константа диссоциации кислоты значения (К). Обычно сильные кислоты имеют очень большой Кзначение.
Чем сильнее кислота, тем легче она теряет протоны. Эти протоны легко высвобождаются благодаря высокой полярности связи между атомом Н и остальной частью молекулы. это
полярность определяется электроотрицательностью двух атомов, участвующих в этой связи. депротонирования (удаление протона) сильной кислоты зависит от полярности и размера аниона, к которому присоединен протон.В качестве примера, если рассматривается кислота под названием H-A, диссоциация кислоты HA может быть представлена как
HA(Водно) + H2О(Л) а–(Водно) + H3О+(Водно)
Но если молекула кислоты имеет больше чем один протон, который может быть выпущен, это может быть показано как ниже. Приведенный ниже пример показывает диссоциацию дипротоновой кислоты. Это означает, что он может выпустить два протона.
ЧАС2В(Водно) + H2О(Л) à B2-(Водно)
С другой стороны, сильные кислоты сильно влияют на pH раствора, поскольку сильные кислоты выделяют в раствор ионы H +. PH зависит от концентрации H +. Соотношение между концентрацией H + и pH может быть указано ниже.
pH = -log [H+(Водно)]
Если кислота является сильной кислотой, значение pH является очень малым значением. Например, если сильная монопротонная кислота находится в воде при 0,1 моль-1 концентрация, рН раствора будет,
pH = -log [H+(Водно)]
pH = -log [0,1 моль-1 ]
= 1
Примеры сильных кислот
- Соляная кислота (HCl)
- Азотная кислота (HNO3)
- Серная кислота (H2ТАК4)
- Бромистоводородная кислота (HBr)
- Иодистоводородная кислота (HI)
- Хлорная кислота (HClO4)
- Хлорная кислота (HClO3)
Что такое слабая кислота
Слабые кислоты — это молекулы, которые частично растворяются в ионах в водных растворах. Слабые кислоты не выделяют все Н+ ионы в раствор. Константа диссоциации кислоты (К) это небольшое значение, чем у сильных кислот. РН раствора составляет около 3-5. Это потому, что слабая кислота не повышает концентрацию H + в растворе, как сильная кислота. В системе слабой кислоты в воде в растворе присутствуют ионы H +, анион молекулы и молекула слабой кислоты.
Например, диссоциация этановой кислоты может быть показана, как показано ниже.
Рисунок 1: Диссоциация этановой кислоты
При написании диссоциации слабых кислот следует использовать двойные стрелки вместо одной стрелки. Это показывает, что реакция является равновесной реакцией.
Примеры слабых кислот
- Серная кислота (H2ТАК3)
- Фосфорная кислота (H3ПО4)
- Плавиковая кислота (HF)
- Азотистая кислота (HNO2)
- Бензойная кислота (С6ЧАС5COOH)
- Муравьиная кислота (HCOOH)
- Уксусная кислота (СН3COOH)
Разница между сильными и слабыми кислотами
Определение
Сильная кислота: Сильные кислоты — это молекулы, которые полностью распадаются на ионы, когда они находятся в воде.
Слабая кислота: Слабые кислоты — это молекулы, которые частично растворяются в ионах в водном растворе.
pH
Сильная кислота: PH раствора сильной кислоты очень низкий (около pH = 1).
Слабая кислота: РН раствора слабой кислоты составляет около 3-5.
Константа диссоциации кислоты
Сильная кислота: Константа диссоциации кислоты Kболее высокое значение для сильных кислот.
Слабая кислота: Константа диссоциации кислоты Kявляется более низким значением для сильных кислот.
Количество выпущенных ионов H +
Сильная кислота: Сильные кислоты выделяют всю Н+ ионы это может выпустить в раствор.
Слабая кислота: Слабые кислоты не выделяют все Н+ ионов.
Заключение
Сила кислоты определяется полярностью и атомными размерами молекулы кислоты. В зависимости от того, как молекулы кислоты диссоциируют в воде, существует два типа кислот: сильные и слабые кислоты. Основное различие между сильными и слабыми кислотами состоит в том, что сильные кислоты полностью диссоциируют в водных растворах, тогда как слабые кислоты частично диссоциируют в водных растворах.
Рекомендаци
ru.strephonsays.com
Урок 16. Кислоты и основания – HIMI4KA
В уроке 16 «Кислоты и основания» из курса «Химия для чайников» дадим определение кислотам и основаниям, рассмотрим процесс их диссоциации в водном растворе и различия слабых кислот и оснований от сильных. Кроме того, вы узнаете самые распространенные кислоты и основания. Основы химии, которые вы должны знать перед прочтением данного урока, содержатся в уроке 9 «Ионы в водном растворе».


Что такое кислота и основание?
Для тех, кто только к нам присоединился напоминаю, что ионы — это все те же атомы веществ, просто с бОльшим или меньшим количеством электронов относительно числа протонов. Для кислот и оснований наиболее популярны следующие определения:
Кислота — это вещество, которое при добавлении к воде повышает концентрацию ионов водорода [H+].
Основание — это вещество, которое при добавлении к воде повышает концентрацию гидроксидных ионов [OH—]. Забегая вперед, скажу, что основанием также называют вещество, которое забирает ионы водорода [H+].
Если данные определения вам не понятны, то скорее всего вам нужно вспомнить, что такое простые и сложные ионы. Дальше все будет проще, ведь сложные лишь определения!
Диссоциация кислот

Диссоциация кислот, от HF до HNO3, в водном растворе сопровождается высвобождением одного протона, т.е иона водорода H+.
- HNO3 → H+(водн.) + NO3—(водн.)
В дальнейшем не будем указывать сокращение (водн.), означающее что ион гидратирован, поскольку в водном растворе любой ион гидратирован. Кислоты H2CO3, H2SO3 и H2SO4 диссоциируют в водном растворе с высвобождением двух протонов. Это происходит не в одну, а в две стадии:
- H2CO3 → H+ + HCO3— → 2H+ + CO—
- H2SO3 → H+ + HSO3— → 2H+ + SO—
- H2SO4 → H+ + HSO4— → 2H+ + SO42-
Угольная кислота дает протоны в раствор только частично, так помимо смеси HCO3— и CO— ионов в водном растворе присутствует немного недиссоциированной угольной к-ты. Зато серная кислота полностью высвобождает первый из двух ионов H+, поэтому она считается сильной кислотой. Самые распространенные сильные кислоты — это хлористоводородная и азотная, а распространенная слабая кислота — фосфорная кислота.
Каждая фосфорсодержащая кислота высвобождает в водном растворе три протона, и соответственно осуществляется это в 3 стадии:
- H3PO4 → H+ + H2PO4— → 2H+ + HPO42- → 3H+ + PO43-
Органические кислоты, такие как уксусная и муравьиная кислота, дают H+ из своих карбоксигрупп –COOH.
- CH3 –COOH → CH3 –COO— + H+
Диссоциация оснований

Диссоциация оснований, содержащие OH-группы (гидроксигруппы), например LiOH или Ca(OH)2, дает в водный раствор гидроксидные ионы OH—:
- LiOH → Li+ + OH—
- Ca(OH)2 → Ca2+ + 2OH—
Хотя у аммиака отсутствуют OH— ионы, тем не менее NH3 является основанием, поскольку он образует гидроксидные ионы при реакции с молекулами воды:
- NH3 + H2O → NH4+ + OH—
Надеюсь урок 16 «Кислоты и основания» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Какие кислоты являются сильными (приведите примеры), от чего зависит сила кислоты? ХИМИЯ
Сила кислоты – характеристика кислоты, показывающая, насколько легко кислота отдает протоны молекулам данного растворителя. В основном это вода. Сила кислоты зависит от природы атома при кислотном центре и от его структурного окружения. Сильные кислоты : HI, HBr, HClO4, HCl, h3SO4, HMnO4, HNO3, h3CrO4, h3SO3, h4PO4…. (<———————————————————————-усиление силы кислоты) Кислоты являются, наряду с растворимыми основаниями (щелочами) и растворимыми солями, электролитами, то есть, веществами, растворы или расплавы которых проводят электрический ток. Понятие «сильная» или «слабая» кислота является характеристикой кислоты как сильного или слабого электролита. На «сильные» и «слабые» электролиты делятся в зависимости от степени диссоциации.
от того каким элементом она образована ? HF плавит стекло, вода в ней горит HNO3 ужасная штука h3SO4 тож крепкая настоечка ))))
touch.otvet.mail.ruСамая сильная кислота. Формула самой сильной кислоты :: SYL.ru
О том, какая кислота самая сильная, спорили не одно поколение химиков. В разные времена это звание получала азотная, серная, соляная кислота. Некоторые считали, что сильнее плавиковой кислоты соединения быть не может. В последнее время получены новые соединения с сильными кислотными свойствами. Может быть, именно среди них имеется самая сильная кислота в мире? В этой статье рассмотрены характеристики наиболее сильных стойких кислот нашего времени и даны их краткие химические характеристики.
Понятие кислоты
Химия — точная количественная наука. И звание «Самая сильная кислота» должно быть обоснованно приписано тому или иному веществу. Что же может являться главным показателем, который характеризует силу любого соединения?
Для начала давайте вспомним классическое определение кислоты. В основном это слово применяется для сложных химических соединений, которые состоят из водорода и кислотного остатка. Количество атомов водорода в соединении зависит от валентности кислотного остатка. Например, в молекуле соляной кислоты присутствует лишь один атом водорода; а серная кислота уже владеет двумя атомами Н+.
Свойства кислот
Все кислоты обладают некоторыми химическими свойствами, которые можно назвать общими для данного класса химических соединений.
- Способность взаимодействовать с металлами, выделяя при этом водород.
- Способность взаимодействовать с основаниями, выделяя при этом соли.
- Способность менять цвет индикаторов – например, вызывать покраснение лакмусовой бумаги.

Во всех вышеназванных свойствах проявляется еще одно «умение» любой известной кислоты – это способность отдавать атом водорода, заменяя его на атом другого химического вещества или молекулу какого-либо соединения. Именно эта способность характеризует «силу» кислоты и степень ее взаимодействия с остальными химическими элементами.
Вода и кислота
Наличие воды значительно уменьшает способность кислоты отдавать атомы водорода. Это объясняется тем, что водород способен образовывать собственные химические связи между молекулами кислоты и воды, тем самым его способность отделяться от основания меньше, чем у неразбавленных кислот.
Суперкислота
Слово «суперкислота» введен в химический словарь в 1927 году, с легкой руки знаменитого химика Джеймса Конанта.
Эталоном крепости этого химического соединения является концентрированная серная кислота. Химическое вещество или какая-либо смесь, превышающая показатель кислотности концентрированной серной кислоты, называется суперкислотой. Значение сверхкислоты определяется ее способностью придавать положительный электрический заряд любому основанию. За базовый параметр для определения кислотности принят соответствующий показатель H2SO4 . Среди кислот сильного действия наблюдаются вещества с довольно необычными названиями и свойствами.
Известные сильные кислоты
Самые известные кислоты из курса неорганической химии — это йодоводородная (HI), бромоводородная (HBr), соляная (HCl), серная (H2SO4) и азотная (HNO3) кислоты. Все они обладают большим показателем кислотности и способны реагировать с большинством металлов и оснований. В этом ряду самой сильной кислотой является смесь азотной и соляной кислоты, получившая название «царская водка». Формула самой сильной кислоты этого ряда — HNO3+3 HCl. Это соединение способно растворять даже драгоценные металлы – такие, как золото и платину.

Как ни странно, плавиковая кислота, которая представляет собой соединение водорода самым сильным галогеном – фтором, в претенденты на звание «Самая сильная кислота в химии» так и не попала. Единственной особенностью этого вещества является способность растворять стекло. Поэтому хранят такую кислоту в полиэтиленовой таре.
Сильные органические кислоты
Претенденты на титул «Самая сильная кислота в органической химии» — муравьиная и уксусная кислоты. Муравьиная кислота является самой сильной в гомологическом ряду предельных кислот. Свое название она получила из-за того, что некоторая часть ее содержится в выделениях муравьев.

Уксусная кислота чуть слабее муравьиной, но спектр ее распространения гораздо шире. Она часто встречается в соках растений и образуется при окислении различной органики.
Последние разработки в области химии позволили синтезировать новое вещество, способное конкурировать с традиционными органическими веществами. Трифторметансульфокислота имеет показатель кислотности выше, чем у серной. При этом CF3SO3H является стабильной гигроскопичной жидкостью с установленными физико-химическими свойствами при нормальных условиях. На сегодня титул «Самая сильная органическая кислота» может быть присвоен этому соединению.
Многие могут подумать, что степень кислотности не может быть значительно выше показателя серной кислоты. Но в последнее время ученые синтезировали ряд веществ, у которых параметры кислотности в несколько тысяч раз превышают значения серной кислоты. Аномально высокими значениями кислотности обладают соединения, получаемые при взаимодействии протонных кислот с кислотами Льюиса. В научном мире они называются: комплексные протонные кислоты.
Магическая кислота
Да. Все правильно. Магическая кислота. Так и называется. Магическая кислота является смесью фтороводорода или фтор сульфороновой кислоты с пентафлоридом сурьмы. Химическая формула этого соединения представлена на рисунке:
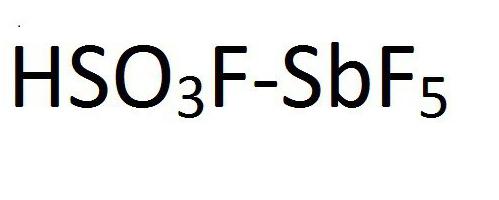
Такое странное название магическая кислота получила на рождественской вечеринке химиков, которая произошла в начале 1960 годов. Один из сотрудников исследовательской группы Дж. Олаха показал забавный фокус, растворив восковую свечу в этой удивительной жидкости. Эта одна из самых сильных кислот нового поколения, но вещество, которое превзойдет ее по силе и кислотности, уже синтезировано.
Самая сильная кислота в мире
Carborane acid – карборановая кислота, которая является на сегодняшний день самой сильным соединением в мире. Формула самой сильной кислоты выглядит таким образом: H(CHB11Cl11).
Этот монстр был создан в 2005 году в Калифорнийском университете при тесном сотрудничестве с Новосибирским институтом катализа СО РАН.
Сама идея синтеза возникла в головах ученых вместе с мечтой о новых, невиданных доселе молекулах и атомах. Новая кислота в миллион раз сильнее серной, при этом она совершенно не агрессивна, и самая сильная кислота легко может храниться в стеклянной бутылке. Правда, со временем стекло все-таки растворяется, а при повышении температуры скорость такой реакции значительно увеличивается.

Такая удивительная мягкость обусловлена высокой стабильностью нового соединения. Как и все химические вещества, относящиеся к кислотам, карборановая кислота легко вступает в реакцию, отдавая свой единственный протон. При этом основание кислоты является настолько стабильным, что химическая реакция дальше не идет.
Химические свойства карборановой кислоты
Новая кислота – отличный донор протона Н+. Именно это и определяет силу этого вещества. Раствор карборановой кислоты содержит больше ионов водорода, чем любая другая кислота в мире. В химической реакции SbF5 — пентафторид сурьмы, связывает илон фтора. При этом высвобождаются новые и новые атомы водорода. Поэтому карборановая кислота и является сильнейшей в мире – взвесь протонов в ее растворе больше аналогичного показателя серной кислоты в 2×1019 раз.
Однако кислотное основание этого соединения потрясающе стабильно. Молекула этого вещества состоит из одиннадцати атомов брома и такого же количества атомов хлора. В пространстве эти частицы образуют сложную, геометрически правильную фигуру, которую называют икосаэдром. Такое расположение атомов является наиболее устойчивым, и это объясняет стабильность карборановой кислоты.
Значение карборановой кислоты
Самая сильная кислота в мире принесла своим создателям заслуженные награды и признание в научном мире. Хотя все свойства нового вещества до конца не изучены, уже становится ясным, что значение этого открытия выходит за рамки лабораторий и научно-исследовательских институтов. Карборановую кислоту можно использовать в качестве мощного катализатора при различных промышленных реакциях. Кроме этого, новая кислота может взаимодействовать с наиболее упрямыми химическими веществами – инертными газами. В настоящее время ведутся работы, допускающие возможность вступления в реакцию ксенона.
Несомненно, удивительные свойства новых кислот найдут свое применение в самых различных областях науки и техники.
www.syl.ru
Кислоты, их классификация
Существует несколько признаков классификации кислот. Разберем некоторые их них. Кислоты – это сложные вещества, состоящие из атомов водорода и кислотных остатков.
По наличию атомов кислорода в кислотах, кислоты делятся на кислородсодержащие, в которых присутствует кислород, например, серная кислота, азотная кислоты, бескислородные, в которых кислорода нет, к таким кислотам относится соляная, сероводородная.

По количеству атомов водорода

По растворимости в воде кислоты делятся на растворимые в воде, к ним относится большинство кислот и нерастворимые в воде, как кремниевая кислота.

По летучести, т.е. способности молекул кислоты легко переходить в газообразное состояние, кислоты делятся на летучие (как соляная, сероводородная и азотная кислоты
) и нелетучие – это большинство кислот: серная, кремниевая, фосфорная.
По степени электролитической диссоциации кислоты делятся на сильные, у которых степень электролитической диссоциации стремится к единице, к ним относятся такие кислоты, как серная, азотная, соляная, а слабые кислоты, у которых степень электролитической диссоциации стремится к нулю, например, сероводородная, угольная, сернистая.
По признаку стабильности кислоты делят на стабильные, как серная, фосфорная, соляная, и нестабильные, которые разлагаются при обычных условиях или при нагревании, это такие кислоты, как кремниевая, сернистая, угольная.

При обычных условиях кислоты могут быть твердыми. Это такие кислоты, как фосфорная и кремниевая. А также кислоты могут быть жидкими, как азотная, серная. Газообразных кислот при обычных условиях нет. Не путайте: соляную, сероводородную, бромоводородную кислоты образуют соответствующе газы, растворенные в воде, но они не являются газообразными кислотами.

Некоторые кислоты, такие как угольная и сернистая, существуют только в водных растворах, потому что они являются слабыми и нестойкими, они легко разлагаются на соответствующие оксиды и воду, поэтому выделить эти кислоты в чистом виде невозможно. Соляная кислота является летучей стабильной кислотой, а кремниевая кислота – нелетучей, нерастворимой и нестабильной кислотой, потому что при нагревании разлагается на оксид и воду.

Большинство водных растворов кислот не имеют окраски: серная, азотная, соляная и др., а хромовая (H2CrO4) имеет жёлтую окраску, марганцевая кислота (HMnO4) имеет малиновую окраску.

videouroki.net

