Сложность структуры атома







Содержание:
Сложность структуры атома
- Сложность строения атома. До конца прошлого века точка соприкосновения физики и химии была относительно небольшой. В 20 веке, наконец, исчезли резкие границы между двумя науками. Промежуточная область, о которой Энгельс писал в 1882 году»вот где следует ожидать лучших результатов», была заполнена 2 новыми областями физической химии и химической физики.
- Первый был начат М. В. Ломоносовым (1752), но его содержание получило широкое развитие в конце XIX века, применив теоретические и экспериментальные методы физики к обычным химическим задачам. Было изучение внутренней структуры атомов и молекул и изменений в химических реакциях.
Второй областью, получившей полное развитие в 20 веке. Людмила Фирмаль
Атом » по своей сути не неделим, но неотделим только доступными средствами, он сохраняется только в известном в настоящее время химическом процессе, но может быть отделен новым процессом, который будет открыт позже. Это гениальное предвидение бутрелова (1886) не было ни понято, ни принято его современниками. Идея атома как атома при отсутствии неделимых частиц материи укрепилась даже в умах ученых, твердо придерживающихся атомной точки зрения, не говоря уже о влиянии»энергетической» философии.
Из-за этого правильная интерпретация важного открытия, сделанного Беккерелем в 1896 году, была отложена на несколько лет. Было известно, что после предварительного освещения в течение некоторого времени находилось светящееся вещество. Это явление называется фосфоресценцией. Вы можете изучить его, используя тестовые материалы для выдувания фотографий с различными веществами. Продолжайте интересоваться этими экспериментами и экспериментами.
Сукводовская-Кюри обратила внимание на то, что воздействие на фотографический вариант урановой природной руды сильнее, чем на ее чистый оксид, несмотря на более высокую долю урана. Это привело к идее, что минералы урана содержат неизвестные элементы, которые более активны, чем сам уран. В результате тщательной и кропотливой работы Кюри в 1898 году удалось выделить из урановой руды 2 новых элемента-полоний и радий.
Было обнаружено, что они оба действуют на фотографические пластины, которые по сравнению с Ураном прочнее. Само это явление впоследствии изучалось главным образом в отношении соединений радия, называемых радиоактивностью. Опыт показал, что активность препарата определяется только содержанием РА и полностью не зависит от формы существования препарата. Также активность препарата практически не зависит от внешних условий.
Нагрев или охлаждение, действие света, электричества и т. д., не имеют никакого видимого эффекта. Все эти факты заставили нас сделать предположения о том, что радиоактивное явление было вызвано спонтанным распадом атомов радия и других радиоактивных элементов, а также предположения, которые в корне противоречат устоявшимся взглядам.
Поэтому был поднят вопрос о внутреннем строении атома. Изучение радиоактивного излучения показало, что оно сложное. Если радиоактивный препарат, окруженный свинцовой капсулой с отверстием в верхней ее части, через которое не проходит излучение, поместить в электрическое поле, то излучение состоит из 3-х составляющих: так называемых альфа (а), бета — {$) и гамма (у) линий(рис. HI-3).
Первый отклоняется в сторону минусового полюса. Они представляют собой поток положительно заряженных, относительно больших масс частиц. Последний более сильно отклоняется в сторону положительного полюса. Они состоят из частиц очень малой массы, отрицательно заряженных. Наконец, V-лучи похожи на свет, но гораздо короче волн. Аналогичное действие деления на радиоактивное излучение оказывает магнитное поле (рис. II 1-4).
Все 3 вида лучей воздействуют на фотопластинку, вызывая блеск определенных веществ. Еще до открытия радиоактивности, когда металл подвергается воздействию света или ультрафиолетового излучения、 Особенно на дневной тарелке. Является- РНС. III-3.Разделение радиоактивного излучения в электрическом поле. Рисунок Sh-4.Разделение радиоактивного излучения в магнитном поле.
Лучи металлической поверхности излучают отрицательное электричество. Вопрос о природе этого электричества был вскрыт в ходе экспериментов с так называемыми. Катодные лучи, полученные разрядом в разреженном пространстве. На рисунке II1-5 показана схема оборудования, используемого для их изучения. Анод а и катод к припаяны к стеклянной емкости, из которой откачивается воздух.
При излучении от катода катодный провод распространяется от it. It обнаруживается при стрельбе и т. д. Если g между пластиной E производит электричество Поле, а затем лучи света, отклоняются в сторону пластины. 1г ц….. \ Положительно заряженный-это、 — s ««’ iiCV m J сами лучи отрицательно charged. By изменение условий эксперимента(напряженности электрического поля и др.), можно изучать различные свойства этих лучей.
Диаграмма III-5.Схема установки-N0CLLLL после предположения, что в результате аналогичного эксперимента катодный луч представляет собой отрицательный поток Электроннолучевой. * »* Чрезвычайно заряженные частицы очень малой массы. Этот вывод был подтвержден дальнейшими исследованиями, и оказалось, что частицы, испускаемые при нагреве или облучении металла, и частицы катодных лучей и Р-лучей совершенно одинаковы. Эти частицы назывались электронами.
Каково количество электричества перед работой с катодным лучом? Функциональность подвергается постоянным изменениям. После этих работ они стали склоняться к инакомыслию. Уже в конце 19-го века удалось получить почти точные оценки минимально возможного количества электроэнергии. Этот наименьший заряд- «атом электричества» — по величине соответствует заряду электрона.
Концепция атомной природы электричества, идея о том, что каждый заряд является целым кратным с 1 или другим знаком электрона (e), в настоящее время общепринята.3-4. Эксперименты с нагревом и освещением металлов показывают, что электроны являются наиболее легко удаляемой частью атомной структуры. Последние отрицательно заряжены, и атом в целом является neutral. So внутри самого атома необходимо как-то компенсировать отрицательный заряд положительным.
Атомная модель, учитывающая это, была предложена Томсоном (1904) на основе концепции положительного заряда, который равномерно распределен по всему объему атома и нейтрализуется электронами, рассеянными в этом»море положительного электричества».У нее не было времени, чтобы сделать детальное развитие, как это было опровергнуто работой Резерфорда.
Резерфорд провел эксперимент с а-частицами. Масса каждого из них соответствует 4 единицам атомного веса(тогда как масса электрона находится только в таких единицах ’ / / 82o).Их заряд положителен, а абсолютная величина равна 2-кратному заряду электрона. Во время радиоактивного распада атома частицы а вылетают с высокой начальной скоростью. Конструкция эксперимента показана на рисунке. II1-6.
Тонкий пучок а-частиц, направленный в сторону тонкого металлического листа M. By перемещая прибор Р вдоль дуги D и регистрируя частицы а, можно было следить за дальнейшим поведением. Большинство а-частиц Проходя через листовку без отклонения, части отклоняются под разными углами, и каждые 10 000, небольшая часть около 1 частицы будет отскакивать почти в противоположном направлении. Результаты этих экспериментов, особенно отскок частиц, не могут быть интерпретированы на основе теории Томсона model.
In дело в том, что частица, летящая с большой скоростью и имеющая относительно большую массу с двойным положительным зарядом, может резко отскочить только при столкновении с препятствием с большим положительным зарядом, сосредоточенным в одном месте. Положительный заряд, распределенный по всему объему атома, не может дать такого отклонения. Кроме того, каждая частица, проходящая через металлический лист, должна проходить через множество атомов, и резкое отталкивание наблюдается очень часто. rarely.
Предмет химия
Примеры решения, формулы и задачи
| Лекции | |
| Расчёт найти определения | Учебник методические указания |
- It также предполагается, что пространство атмосферы> схема эксперимента не полностью заполнена положительными сторонами Резерфорда. Электричество. Исходя из результатов экспериментов Резерфорда, положительно заряженная часть атома, объем его»ядра«, оценивалась примерно следующим образом: если представить, что атом расширится до размеров шара диаметром 10 м, то ядро будет размером с Ядро атома. Pinhead.
So большинство частиц не отклоняются от прямого пути, несмотря на то, что каждая из них пролетает тысячи атомов. только частицы а испытывают отклонения и летят достаточно близко к ядру 1 атомов, встречающихся на пути(рис. II1-7). Вычисление относительного числа таких отскоков n позволило оценить размер ядра. Однако эксперименты с а-частицами дают гораздо больше, что позволяет приблизительно оценить величину положительного заряда ядер различных atoms.
В этом случае отскакивают только те, которые летят непосредственно к ядру. Людмила Фирмаль
In дело в том, что отклонение частиц а тем больше, чем больше положительный заряд атома nucleus. As в результате расчетов было показано, что этот заряд равен числу, соответствующему примерно половине атомного веса элемента, соответствующего минимальному заряду (е). Он основан на моих исследованиях. Резерфорд предложил в 1911 году новую «планетарную» модель, которая уподобляла атом Солнечной системе. system.
In в центре находится очень маленькое положительно заряженное ядро, которое содержит почти всю массу атома, а вокруг ядра находятся электроны, количество которых определяется величиной положительного заряда ядра. Однако такая система будет стабильной только в том случае, если электроны движутся. Таким образом, электроны атома должны иметь примерно такое же движение вокруг ядра, как планеты вокруг Солнца.
Точность планетарной модели атома была немедленно подтверждена дальнейшими экспериментами на частицах а и Р, благодаря конденсационной камере, разработанной Вильсоном в 1911 году. Принцип его работы основан на том, что при охлаждении насыщенного паром воздуха капельки тумана стекают Рисунок II1-7.Часть отклонения. Ядро. Он образуется почти исключительно вокруг посторонних предметов, особенно заряженных particles.
In верхняя часть и часть камеры конденсации (рис. II1-8) имеют боковую стеклянную стенку, а в нижней части расположен поршень, и содержащийся в нем влажный воздух быстро расширяется и несколько охлаждается за счет расширения. Образование тумана не наблюдалось, так как воздух пел до того, как эксперименты полностью устранили пыль. A-или{J — ситуация иная, когда частица проходит через камеру.
Оба выбивают электроны из приближающихся молекул, тем самым создавая больше заряженных частиц. Капельки тумана быстро формируются вокруг последнего, четко показывая весь путь, по которому двигались частицы a или P. Тяжелые частицы а, выбивающие электроны из молекул, не изменяют своего линейного движения. Его выраженное отклонение происходит только при полете вблизи 1 ядра атома.
Наоборот, частицы света, выбивая электрон, сами по себе изменяют свой путь(особенно если скорость уменьшается).На рисунке III-9 показана фотография края траектории частиц А и Р, взятых в камере конденсации, а на рисунке IIMO — 2-частицы. Прямой путь является общим, и скорость частиц очень медленная, и она заканчивается, когда вы перестаете выбивать электроны из приближающихся molecules.
In на фото, путь, подобный тому, что выше, очень редок. Первая кривизна на нем соответствует отклонению, вызванному прохождением атомов вблизи атомного ядра, а вторая соответствует столкновению с другим атомным ядром. Расчеты, основанные на таких снимках, показали, что частицы Р летают в среднем на 1 млн атомов. 111-9.Снимок 111-10. 2 пути a-частиц、 ЦОВ проходят а-и частицы.
Прежде чем постучать по электрону, частица а проходит через 50 миллионов атомов и достигает не более чем в 2, 3 раза ядра, которое находится так близко, что делает заметные отклонения. Это с уверенностью доказывает, что ядро и электроны заполняют очень малую часть пространства, занимаемого ядром. Фактический общий объем всех атомных ядер в организме человека составляет 100 миллилитров на 1 миллилитр.
Добавь 1) » Физическая химия-это наука, объясняющая происходящее посредством химических манипуляций в сложных объектах, основанная на положениях физики и экспериментов. Такое определение дано в «курсе истинной физической химии» М. В. Ломоносова (1752 г.). Как и во многих других случаях, он Наводнение камеры ss-частица X3 стекло T^поршневая запись 111-8.Схема конденсационной камеры.
В Для него это была временная наука, длившаяся более века. Следующим курсом физической химии будет изучение Н. Н. Бекетова(1865).Важность этой дисциплины была широко признана только в конце 19-го века. Вопрос о внутреннем строении атомов и молекул был уже интересен М. В. Ломоносову. «Химическая промышленность погрузится во тьму, и химики, в частности, не должны знать чувствительных частиц внутри структуры», — писал он, ставя перед наукой будущего задачу, решаемую в настоящее время химической химией.
2) различие между физической химией и химической физикой в какой-то мере произвольно(2-я часто включается в 1-ю).при этом каждая из них может быть очень четко очерчена: предмет физической химии (классической) — это обобщение химических процессов, в которых одновременно участвуют многие частицы, а предмет химической физики-рассмотрение взаимодействия между отдельными частицами и ними. 。Основной процесс.
3) первое точное определение заряда эдехтрона было сделано в 1911 году, и метод исследования основывался на наблюдении за поведением мельчайших капелек распыленного масла в электрическом поле. Если небольшое количество таких капель ввести в пространство а между 2 электродами (примерно III-U), то за каждым из них можно наблюдать через микроскоп М. Под действием силы тяжести капли становятся быстрее и быстрее. heavier. As в результате, вы можете рассчитать вес отдельных капель от скорости падения.
Здесь, когда электронный луч направлен в пространство A, часть hx остается в капле, сигнализируя об отрицательном заряде на капле. Если поля нет, то это практически не меняет поведения капель, они продолжают медленно падать. Напротив, заряд на металлической пластине сверху достаточно положительный, и, сигнализируя, что металлическая пластина внизу имеет отрицательный заряд, можно не только остановить падение, но и поднять заряженную каплю.
При определенных напряжениях поля между пластинами мы предполагаем, что другие капли не движутся вверх и вниз. Это означает, что электрическая сила точно уравновесит его вес. Напряженность электрического поля и масса капли позволяют рассчитать количество заряда, имеющегося на ней. Результаты многочисленных экспериментов с использованием различных размеров капель и интенсивностей поля всегда показывали, что заряд всегда является целым числом, кратным определенному минимуму или равным ему.
Такое резкое изменение самого заряда является наиболее убедительным доказательством атомной природы электричества. Очевидно, что поглощение капли только 1 электрона n вызывает минимальное количество заряда, а поглощение 2, 3 нТл и т. д. должно соответствовать его целому числу multiple. So, минимальное количество заряда также соответствует заряду электрона. 4.80 * т0 ″ Вт абсолютной электростатической единицей.
Электроны в полете отклоняются от прямого пути полюсами и магнитными полями. poles. By изучая характер этих отклонений, удалось установить отношение заряда электрона к массе (е / т).Если заряд известен, то он может иметь массу электрона: 9,11 г. радиус электрона равен 2•10 ″ 13см. Рисунок II 1 ВС. Предложена схема определения заряда электронов.
Под абсолютной электростатической единицей количества электричества понимается сила в 1 дан (приблизительно равная весу 1 миллилитра), ряд, действующий на расстоянии 1 сантиметра, не равном ей. 5) 1 результаты эксперимента по диспергированию частиц золотыми хлопьями приведены ниже.
Угол отклонения… 15°30°45°60°75°t05 непрерывного изменения°120°135 ° 150° O количество частиц. 。 。 132 ООО 7800 И 435477 211 70 52 43 33 в) диаметр атома металла обычно составляет около 3А(3×10 — * см).так, более 30 тысяч атомов вписываются в толщину листа металла на 0,1 мм(то есть 1•10-2 см). 7)в 1819 году, то есть исследование Лютера Форда почти 100-летней давности в Московском университете М. G.
It интересно отметить, что очень похожие выражения были развиты в лекции профессора Павлова. Его основные положения таковы: а) dieie является доминирующим по своей природе и имеет абсолютный покой. б) природа света-это электричество. в)все вещества образовались из первичных. г) вещество в своей структуре связано с электрическим зарядом. д) элемент имеет плацентарную структуру; е) первый атом в структуре положительных и отрицательных зарядов. Излишне говорить, что М. Г. теоретический состав Павлова носил спекулятивный характер.
ДОКАЗАТЕЛЬСТВА СЛОЖНОЙ СТРУКТУРЫ АТОМОВ ксе
ДОКАЗАТЕЛЬСТВА СЛОЖНОЙ СТРУКТУРЫ АТОМОВ
Открытие электрона. Первые экспериментальные результаты, из которых можно было сделать вывод о сложной структуре атомов, о наличии внутри атомов электрических зарядов, были получены М. Фарадеем в 1883 г. при изучении законов электролиза.
В 1897 г. Дж. Дж. Томсон в результате экспериментов по изучению электрического разряда в разреженных газах, фотоэффекта и термоэлектронной эмиссии установил, что при соударениях атомов в плазме электрического разряда, при нагревании вещества или освещении его ультрафиолетовым светом из атомов любого химического элемента вырываются одинаковые отрицательно заряженные частицы. Эти частицы были названы электронами. Электрический заряд е отдельных электронов впервые был измерен в опытах Р. Милликена в 1909 г. Он оказался действительно одинаковым у всех электронов.
Масса электрона примерно в 2000 раз меньше массы самого легкого из атомов — атома водорода. Открытие электрона и обнаружение электронов в составе атомов любого химического элемента было первым доказательством сложности атомов.
Периодический закон Менделеева. Открытие Д.И. Менделеевым в 1869 г. периодического закона поставило перед физикой вопрос о причинах повторяемости химических свойств элементов, расположенных в порядке возрастания атомной массы. Естественно было предположить, что увеличение массы атомов химических элементов связано с увеличением числа частиц, входящих в их состав. Периодическую повторяемость химических свойств элементов в таблице Д.И. Менделеева можно рассматривать как свидетельство периодической повторяемости основных особенностей внутренней структуры атомов по мере увеличения числа частиц, входящих в их состав.
Линейчатые спектры. Важным фактором, свидетельствующим о сложной внутренней структуре атомов, было открытие линейчатых спектров. Исследования показали, что при нагревании до высокой температуры пары любого химического элемента испускают свет, узкий пучок которого разлагается призмой на несколько узких пучков света различного цвета. Совокупность наблюдаемых при этом разноцветных линий называется линейчатым спектром испускания. Линейчатый спектр испускания каждого химического элемента не совпадает со спектром испускания ни одного другого химического элемента.
Каждая
отдельная линия в линейчатом спектре
излучения образуется светом с одной
длиной волны. Следовательно, источник
света с линейчатым спектром излучения
испускает электромагнитные волны не
со всевозможными частотами, а только с
несколькими вполне определенными  .
.
При пропускании белого света со сплошным спектром через пары вещества наблюдается возникновение темных линий на фоне сплошного спектра испускания. Темные линии расположены точно в тех местах, в которых наблюдаются светлые линии спектра излучения данного химического элемента. Такой спектр называется линейчатым спектром поглощения.
Линейчатые
спектры поглощения свидетельствуют о
том, что вещество в газообразном состоянии
способно поглощать электромагнитное
излучение только с такими частотами  ,
какие имеются в линейчатом спектре
излучения данного вещества.
,
какие имеются в линейчатом спектре
излучения данного вещества.
Свет с линейчатым спектром излучения испускается веществом в газообразном атомарном состоянии при невысоких давлениях, т.е. при условии слабого взаимодействия атомов между собой. При таких условиях испускание квантов электромагнитного излучения является результатом процессов, происходящих внутри отдельных атомов.
После открытия электрона стала очевидной связь явлений излучения и поглощения света с наличием в них электронов. Действительно, свет — это электромагнитные волны. Излучение электромагнитных волн происходит при ускоренном движении электрических зарядов. Можно предположить, что при соударениях атомов электроны, имеющиеся внутри атомов, могут приобретать избыток энергии и затем излучать электромагнитные волны, совершая гармонические колебания внутри атомов. Различным длинам волн излучаемого света соответствуют различные частоты колебаний электронов внутри атомов. Следовательно, теория строения атома должна дать способы расчета длин волн в спектре любого химического элемента.
Радиоактивность. Еще одним доказательством сложности строения атомов явилось открытие явления радиоактивности. В 1896 г. французский физик Анри Беккерель (1852-1908) производил опыты с солями урана. Он установил, что атомы урана испускают невидимые глазом излучения, способные проникать через бумагу или картон и вызывать почернение фотографической пластинки.
Явление испускания атомами невидимых проникающих излучений назвали радиоактивностью (от слова «радиус» — луч).
Польского происхождения физик Мария Склодовская-Кюри (1867-1934) и французский физик Пьер Кюри (1859-1906) доказали, что радиоактивные излучения испускаются не только атомами урана, но и атомами некоторых других элементов. По радиоактивному излучению ими были открыты два неизвестных ранее химических элемента — радий и полоний.
Исследования радиоактивного излучения показали, что радиоактивные атомы испускают не один, а три вида излучения различной физической природы. Эти излучения были названы альфа-, бета- и гамма-лучами. Альфа-лучи оказались потоком ионов гелия, бета-лучи — потоком электронов, а гамма-лучи — потоком квантов электромагнитного излучения с очень малой длиной волны, порядка 10-11-10-13 м.
В результате радиоактивного распада, как впервые доказали в 1902 г. английские ученые Эрнест Резерфорд (1871-1937) и Фредерик Содди (1877-1956), происходит превращение атомов одного химического элемента в атомы другого химического элемента. Например, атом урана в результате радиоактивного распада превращается в два атома — атом тория и атом гелия. Открытие явления радиоактивного распада доказывало сложность внутренней структуры атомов, опровергало представление о неизменности, неразрушимости атомов.
Опыты по рассеянию альфа-частиц. Большие успехи в исследовании структуры атомов были достигнуты в опытах Резерфорда по изучению рассеяния быстрых заряженных частиц при прохождении через тонкие слои вещества. В этих опытах узкий пучок альфа-частиц, испускаемых радиоактивным веществом 1, направлялся на тонкую металлическую пластинку 2. За пластиной помещался экран 3, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц (рис. 302). Было обнаружено, что большинство альфа-частиц отклоняется от прямолинейного пути на углы не более 1-2°. Однако небольшая доля альфа-частиц испытывала отклонение на значительно большие углы.
Рис.
302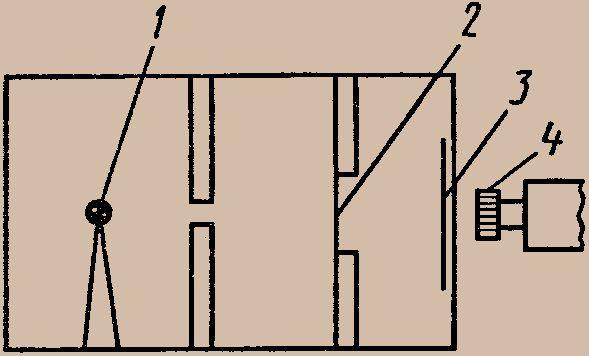
Модель атома Резерфорда. Рассеяние отдельных альфа-частиц на большие углы Резерфорд объяснил тем, что положительный заряд в атоме не распределен равномерно в шаре радиусом 10-10 м, как предполагали ранее, а сосредоточен в центральной части атома в области значительно меньших размеров. В этой центральной положительно заряженной части атома — атомном ядре — сосредоточена и почти вся масса атома. Расчеты Резерфорда показали, что для объяснения опытов по рассеянию альфа-частиц нужно принять радиус атомного ядра равным примерно 10-15 м.
Резерфорд предположил, что атом устроен подобно планетной системе. Как вокруг Солнца на больших расстояниях от него обращаются планеты, так электроны в атоме обращаются вокруг атомного ядра. Радиус круговой орбиты самого далекого от ядра электрона и есть радиус атома. Такая модель атома была названа планетарной моделью.
Планетарная модель атома объясняет основные закономерности рассеяния заряженных частиц.
Так как большая часть пространства в атоме между атомным ядром и обращающимися вокруг него электронами пуста, быстрые заряженные частицы могут почти свободно проникать через довольно значительные слои вещества, содержащие несколько тысяч слоев атомов.
При столкновениях с отдельными электронами быстрые заряженные частицы испытывают рассеяние на очень небольшие углы, так как масса электрона мала. Однако в тех редких случает, когда быстрая заряженная частица пролетает на очень близком расстоянии от одного из атомных ядер, под действием сильного электрического поля атомного ядра может произойти рассеяние заряженной частицы на любой угол до 180° (рис. 303).
Открытие электрона. Доказательства сложной структуры атома.
Периодический закон Д.И. Менделеева показывает существование закономерной связи между всеми химическими элементами. Это говорит о том, что в основе всех атомов лежит нечто общее. До конца XIXвека в химии царило убеждение, что атом есть наименьшая неделимая частица простого вещества. Считалось, что при всех химических превращениях разрушаются и создаются только молекулы, атомы же остаются неизменными и не могут дробиться на части. И, наконец, в концеXIXвека были сделаны открытия, показавшие сложность строения атома и возможность превращения одних атомов в другие.
С 1895 года Джозеф Джон Томсон в Кавендишской лаборатории Кембриджского университета начинает методическое количественное изучение отклонения катодных лучей в электрических и магнитных полях. Для наблюдения этих лучей из стеклянной трубки, в которую впаяны два металлических электрода, выкачивается по возможности весь воздух и затем сквозь нее пропускается ток высокого напряжения. При таких условиях от катода трубки перпендикулярно к его поверхности распространяются «невидимые» катодные лучи, вызывающие яркое зеленое свечение в том месте, куда они попадают. Катодные лучи обладают способностью приводить в движение. На их пути легко подвижные тела откланяются от своего первоначального пути в магнитном и электрическом поле (в последнем в сторону положительно заряженной пластины). Действие катодных лучей обнаруживается только внутри трубки, так как стекло для них непроницаемо. Изучение свойств катодных лучей привело к заключению, что они состоят из мельчайших частиц, несущих отрицательный заряд и летящих со скоростью, достигающей половины скорости света. Также удалось определить массу и величину их заряда. Масса каждой частицы равнялась 0,00055 углеродной частицы. Заряд равняется 1,602 на 10 в минус 19 степени. Особенно замечательно, что масса частиц и величина их заряда не зависит ни от природы газа, остающегося в трубке, ни от вещества из которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут существовать без своих зарядов, не могут быть превращены в электронейтральные частицы: электрический заряд составляет, самую сущность их природы. Эти частицы получили название электронов.
В своем опыте Томсон доказал, что все частицы, образующие катодные лучи, тождественны друг другу и входят в состав вещества.
В это же время появляются и другие доказательства сложной структуры атома. В 1895 В.Рентген (1845–1923) случайно обнаружил таинственное излучение («Х-лучи»), проникавшее сквозь черную бумагу. В 1896 А.Беккерелем было обнаружено явление радиоактивности – способности атомов спонтанно испускать излучение. Резерфордом были обнаружены альфа- и бета-лучи.
Все эти открытия ясно показали, что атом не является «неделимым». Он не только состоит из более мелких частей (электронов и более тяжелых положительных частиц), но эти и другие субчастицы, по-видимому, самопроизвольно испускаются при радиоактивном распаде тяжелых элементов.
Растворы. Концентрация растворов. Сложность строения атома. Периодическая таблица элементов Д.И.Менделеева
МИНИСТЕРСТВО
СПОРТА РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГООБРАЗОВАНИЯ
«ВОЛГОГРАДСКАЯ ГОСУДАРСТВЕННАЯ АКАДЕМИЯ
ФИЗИЧЕСКОЙ КУЛЬТУРЫ»
Реферат на тему:
«Растворы. Концентрация растворов. Сложность строения атома. Периодическая таблица элементов Д.И.Менделеева»
Волгоград 2014
Содержание:
1.Сложность строения атомов.
2.Квантово-механическая
3.Периодическая система
4.Химическая связь. Характеристика химической связи.
5.Типы химической связи. Межмолекулярные взаимодействия.
6.Растворы ,концентрация растворов. Способы выражения
Сложность строения атомов.
В конце XIX
в. изучение электрических разрядов в
газах положило конец представлению об
атоме как простейшей неделимой частице
элемента.
Было обнаружено,
что если из стеклянной трубки, в оба конца
которой впаяны металлические электроды,
откачать воздух до давления менее 0,01
мм рт. ст. и подвести к электродам напряжение
несколько тысяч вольт, то стекло трубки
начинает светиться слабым зеленоватым
светом. Свечение трубки вызывается невидимыми
для глаза лучами, исходящими от отрицательно
заряженного электрода — катода — и получившими
вследствие этого название катодные лучи. Изучение свойств этих лучей показало,
что они действуют на фотографическую
пластинку, вызывают свечение стекла и
других материалов, способны вращать вертушку.
В магнитном и электрическом полях катодные
лучи отклоняются от прямолинейного направления,
причём в электрическом поле — в сторону
положительно заряженного электрода (рис.
1). Твёрдое тело под действием катодных
лучей приобретает отрицательный электрический
заряд. Всестороннее изучение свойств
этих лучей показало, что катодные лучи
представляют собой поток быстродвижущихся
отрицательно заряженных частиц. Масса
этих частиц примерно в 1840 раз меньше массы
атома водорода и составляет 0,00055 а. е.
м. Определение величины заряда показало,
что каждая частица имеет отрицательный
заряд, равный 4,8·10-10 абсолютной
электростатической единицы или 1,60·10-19 Кл.
Эти частицы получили название электроны. Следовательно, электроны представляют
собой мельчайшие частицы, несущие отрицательный
заряд.
Рис. 2. Схема
катодной трубки: К — катод, А — анод с
узким отверстием в центре; Е — две металлические
пластины, между которыми создано электрическое
поле.
Возникновение
катодных лучей наблюдается в газоразрядных
трубках с катодом, изготовленным из самых
разнообразных материалов. Это свидетельствует
о том, что электроны входят в состав различных
атомов.
Электроны
излучаются из веществ (эмитируют) не только
в разрядных трубках. Многие вещества
испускают электроны под действием ультрафиолетовых,
или рентгеновских, лучей. Щелочные металлы
испускают электроны уже при воздействии
на них видимого света. Испускание электронв
наблюдается также при нагревании многих
металлов.
Если поток
быстрых электронов встречает препятствие,
то в результате столкновения возникает
излучение, называемое рентгеновским.
Рис. 2. Схема
рентгеновской трубки.
На рис. 2
схематически показана рентгеновская
трубка. Катод К трубки при нагревании
испускает электроны, которые под действием
приложенного к электродам высокого напряжения
с громадной скоростью устремляются к
аноду А . При ударе электронов об анод
и возникают рентгеновские лучи. Эти лучи
не отклоняются ни в электрическом, ни
в магнитном поле и представляют собой
электромагнитные волны очень малой длины.
Самая длинная рентгеновская волна почти
в 200 раз короче самой короткой волны видимого
света.
Рентгеновские
лучи обладают способностью ионизировать
газы. Под действием рентгеновских лучей
часть электронейтральных молекул газов
теряет электроны, превращаясь в положительно
заряженные ионы, а часть присоединяет
электроны, превращаясь в отрицательно
заряженные ионы. Вызываемая рентгеновскими
лучами ионизация газов свидетельствует
о сложности строения атомов.
Способность
электролитов в растворённом или расплавленном
состоянии проводить электрический ток
также свидетельствует об их ионизации
и, следовательно, о сложности атомов.
Очень важным
для дальнейшего развития учения о строении
атома было открытие явления радиоактивности.
Французский учёный А. Беккерель обнаружил,
что соединения урана являются источником
излучения, которое действует на фотографическую
пластинку, ионизирует воздух, проникает
через непрозрачные тела.
Исследования
Беккереля продолжили М. Склодовская-Кюри
и П. Кюри. Эти учёные открыли в урановой
руде два новых элемента — радий и полоний,
обладающие высокой активностью излучения.
Способность к излучению была обнаружена
также у тория, актиния и ряда других элементов.
Это свойство получило название радиоактивность. Было доказано,
что интенсивность излучения пропорциональна
количеству радиоактивного элемента независимо
от того, входит ли он в состав соединений
или находится в виде простого вещества.
Следовательно, радиоактивность является
общим свойством атомов элементов.
Исследование
лучей радия показало, что они имеют сложный
характер. В электрическом и магнитном
полях пучок лучей радия расщепляется
на три пучка, которые были названы a-, b- и g-лучами
(рис. 3). a-Лучи в электрическом поле отклоняются
от прямолинейного направления движения
в сторону отрицательно заряженной пластинки.
Оказалось, что они представляют собой
поток положительно заряженных частиц,
вылетающих из атома со скоростью около
20000 км/с. Масса каждой такой частицы равна
4 а. е. м., а положительный заряд вдвое больше
заряда электрона. a-Частицы, следовательно, являются ионами
гелия, несущими заряд +2.
Рис. 3. Расщепление
радиоактивного луча в электрическом
поле.
b-Лучи,
подобно катодным в электрическом поле,
отклоняются в направлении положительно
заряженной пластинки. Было установлено,
что b-лучи представляют собой поток электронов,
имеющих скорость от 100000 до 300000 км/с. Как a-, так
и b-лучи легко поглощаются различными материалами.
g-Лучи,
как и рентгеновские лучи, не изменяют
своего направления ни в электрическом,
ни в магнитном поле. Подобно видимому
свету и рентгеновским лучам, g-лучи являются электромагнитными волнами
очень малой длины. Поэтому они легко проникают
через различные материалы.
Обстоятельное
изучение свойств радия показало, что
во время радиоактивного излучения он
распадается, образуя два новых элемента:
гелий и радон. Происходит превращение
атомов одного элемента в атомы других
элементов. Таким образом, ионизация идкостей
и газов и особенно явление радиоактивности
убедительно доказывают, что атомы не
являются неделимыми, а состоят из более
простых частиц.
Квантово-механическая модель атома водорода.
Атом водорода состоит из двух элементарных частиц — протона и электрона. Протон в 1836 раз тяжелее электрона. Обе частицы несут единичный электрический заряд. Протон — положительный, а электрон — отрицательный.
Очевидно, что образовать устойчивую систему — атом — эти частицы могут только в относительном движении. Очевидно также, что при такой разнице в массах более подвижным будет электрон.
Простейшей моделью, объяснившей основные свойства атома водорода, была планетарная модель Резерфорда-Бора 1913 года. Она описывала атом водорода как «планетную систему» — тяжелый протон в центре (ядро атома), а вокруг него вращается легкий электрон.
Модель давала количественные предсказания, совпадающие с данными спектроскопии, но содержала ряд допущений, противоречивших классической электродинамике.
Главное противоречие заключается в том, что, двигаясь последовательно от точки к точке своей траектории по орбите, электрон постоянно изменяет направление своего движения (вектор его скорости постоянно отклоняется от прямой). Это, согласно классической электродинамике, должно приводить к излучению энергии, уменьшению радиуса орбиты и падению электрона на ядро за миллионные доли секунды.
Преодоление этого противоречия выявило принципиально новый тип движения — квантово-механическое движение, и создало стройную теорию этого движения — квантовую механику. Оказалось, что при квантово-механическом движении отсутствуют понятия траектории и орбиты. Электрон при своем движении в поле ядра НЕ перемещается в пространстве из данной точки в соседнюю, а хаотически «прыгает» из одной в другую. Область пространства вокруг ядра, в которой по законам квантовой механики движется электрон с заданной энергией, получила название орбиталь.
Иными словами орбиталь — это область квантово-механического движения электрона.
При таком движении нет и понятия ускорения, связанного с плавным движением по орбите, а потому нет и противоречия с классической электродинамикой. В квантовой же электродинамике свои законы, которые электрон выполняет строго.
Рассмотрим основные понятия и законы квантовой механики, необходимые нам для понимания химического поведения атомов.
Вероятностный характер процессов в микромире: принцип неопределенностей Гейзенберга, волна де-Бройля, волновое уравнение Э.Шредингера.
Как стало ясно после завершения формального описания квантово-механического движения в работах Бора, Гейзенберга, де-Бройля, Шредингера, Борна и многих других физиков, каждый физический объект имеет генеральную характеристику, которая определяет все его наблюдаемые физические свойства.
Эта характеристика называется волновой функцией (или пси-функцией). Зная аналитическое выражение волновой функции частицы математически можно определить ВЕРОЯТНОСТЬтого, что она находится в данной области пространства и имеет определенную энергию, импульс, магнитный момент и другие физические характеристики.
Вероятностный характер квантово-механических предсказаний как раз и является следствием того, что в квантовой механике мы имеем дело с принципиально иным, чем в классической,типом движения.
Как было сказано выше, принципиально новым в этом типе движения является не плавное перемещение частицы от точки к точке, а скачкообразное изменение её положения в пространстве.
Почему же мы не ощущаем таких скачков при движении в нашем, «классическом» мире? Оказалось, что квантово-механическое движение явственно проявляется при условии, что область движения имеет размер L меньший, чем некоторый характерный для данной частицы. Этот характерный размер носит название длины волны де-Бройля и для одиночной частицы в лабораторной системе координат может быть рассчитан по формуле:
=h/mv
Где h- постоянная Планка, равная 6,63х10-34 Дж с
m — масса частицы (для электрона 9,1х10-31 кг)
v — скорость частицы
Для типичного электрона, входящего в состав атома, величина оказывается порядка нанометра, т.е. примерно в 10 раз большей, чем размер атома водорода. И движение электрона в атоме должно подчиняться законам квантово-механического движения.
А для макротел, имеющих массы во многие миллиарды раз большие, чем масса электрона, и величина оказывается меньше размеров атомного ядра. Вот почему мы и не наблюдаем в окружающем нас мире такого «скачкообразного» движения ни футбольных мячей, ни автомобилей на дорогах.
Нужно пояснить появление слова «волна» в формуле де-Бройля. Дело в том, что де-Бройль обобщил особенности движения светового кванта — фотона — на движение любых частиц, обладающих массой. А фотон — это квант электромагнитной волны.
Так возникло понятие корпускулярно-
Позже Гейзенбергом было показано, что это не обязательно и квантово-механическое движение может быть описано без представления о волнах. И сегодня «матричная механика» Гейзенберга становится все более востребованной.
Однако, математически представление Гейзенберга сложнее «волнового», и потому исторически «волновое» описание квантово-механического движения в форме уравнения Шредингера оказалось более распространенным.
Но нужно твердо помнить, что никакой «волнообразности» в квантово-механическом движении нет!
Для того, чтобы попасть из точки А в точку Б движущемуся объекту не обязательно проходить через все промежуточные точки.
Значит ли это, что объект не может попасть в области пространства, содержащие эти точки? Отнюдь нет! Для каждой области пространства определена вероятность того, что искомая частица будет обнаружена именно там.
Математически эта вероятность пропорциональна квадрату модуля значения волновой функции в данной точке ||2. То, что здесь мы столкнулись с понятием модуля волновой функции, связано с тем, что сама волновая функция, как правило, оказывается комплексной.
Формально уравнение Шредингера для энергии выглядит так:
где Ĥ — оператор Гамильтона. Это оператор полной энергии.
Операторы — это особые математические конструкции, которые являются правилами преобразования одной функции в другую. В квантовой механике операторы используются для преобразования волновой функции в функцию определенной физической величины.
Поскольку проведение количественных квантовомеханических расчетов вероятностей по известной волновой функции не входит в нашу задачу (этому вас будут учить в курсе физики), не будем детализировать алгоритма таких расчетов. Укажем только, что это несложная и однозначная математическая задача, легко автоматизируемая даже на ПК.
Но «все просто» становится только тогда, когда мы имеем аналитическое выражение для решения уравнения Шредингера:
(ŕ,t).
где ŕ — вектор пространственного положения тела, t — время.
Для частицы, свободно движущейся в пространстве с постоянным потенциалом U, решением уравнения Шредингера является:
(ŕ,t) = (ŕ)exp(-2πiUt/h)
Математические проблемы, делающие невозможным точное решение уравнения Шредингера для любых систем, более сложных, чем атом водорода, связаны с тем, что неизвестен вид функции потенциальной энергии U(ŕ,t) для таких систем.
На практике используют различные приближения для U(ŕ,t) и получают решения той или иной степени точности.
Итак, совмещая с расчетом вероятности
нахождения частицы в данной области пространства
расчеты результата действия операторов
энергии, импульса и т.п. на её волновую
функцию, мы получим полный набор тех ее
параметров, которые могут быть одновременноэкспериментал
Оказалось, что при квантово-механическом движении не все физические характеристики могут быть определены одновременно и точно.
Выяснилось, в частности, что при квантово-механическом движении неопределенности при одновременном определении импульса и точки его приложения, а также энергии и времени, в течение которого эта энергия фиксируется в системе, связаны так называемымисоотношениями неопределенностей Гейзинберга:
> h/2или (mVx) > h/2
E > h/2
Здесь дельта () именно физическая неопределенн
То, что это именно так, демонстрирует сравнение соотношений неопределенностей для импульса и координаты с рассмотренным нами выражением для .
Действительно, если внимательно
посмотреть на выражение для , то можно
увидеть — даже для макротел значительной
массы мы должны наблюдать квантово-механическое
«скачкообразное» движение при остановке
тела. При v=0 становится бесконечно большим.
И футбольный мяч из рук действительно остановившег
И вообще все «стоящие» предметы
должны начинать движение с квантово-механических
скачков! Этого не происходит именно из-за физической неопределенно
Периодическая система элементов Д.И. Менделеева
Периодическая система элементов является графическим (табличным) изображением периодического закона.
Прообразом периодической системы был «Опыт системы элементов, основанный на их «атомном весе и химическом сходстве», составленный Д.И. Менделеевым 1 марта 1869 г. Это так называемый вариант длинной формы системы элементов, в нем периоды располагались одной строкой.
Короткая форма периодической системы была опубликована Д.И. Менделеевым в декабре 1870г. В этом варианте периоды разбиваются на ряды, а группы — на подгруппы (главные и побочные).
Основным недостатком короткой формы было сочетание в одной группе несходных элементов. Недостатком длинной формы — растянутость, некомпактность.
Короткий вариант периодической системы (см. таблицу) подразделяется на семь периодов — горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера, и восемь групп — вертикальных последовательностей элементов обладающих однотипной электронной конфигурацией атомов и сходными химическими свойствами.
Первые три периода называются малыми, остальные — большими. Первый период включает два элемента, второй и третий периоды — по восемь, четвертый и пятый — по восемнадцать, шестой — тридцать два, седьмой (незавершенный) — двадцать один элемент.
Каждый период (исключая первый) начинается щелочным металлом и заканчивается благородным газом.
Элементы 2 и 3 периодов называются типическими.
Малые периоды состоят из одного ряда, большие — из двух рядов: четного (верхнего) и нечетного (нижнего). В четных рядах больших периодов расположены металлы и свойства элементов слева направо изменяются слабо. В нечетных рядах больших периодов свойства элементов изменяются слева направо, как у элементов 2 и 3 периодов.
Строение атома | Химическая энциклопедия
В середине XIX в. атом считался элементарной, т. е. неделимой, частицей. Но уже к концу этого века появились неоспоримые доказательства сложности строения атома.
Прямым доказательством сложности строения атома явилось и открытие самопроизвольного распада атомов некоторых элементов с испусканием невидимых глазу лучей. Это явление, открытое в 1896 г. французским ученым Анри Беккерелем, получило название радиоактивности. В 1897 г. английский физик Дж. Дж. Томсон установил существование в атоме электронов — отрицательно заряженных частиц.
Эти открытия свидетельствовали о том, что атом имеет сложное строение. На основе своих знаменитых опытов по рассеянию α-лучей английский ученый Эрнест Резерфорд в 1911 г. предложил схему строения атома, получившую название ядерной (планетарной) модели атома.
Ядерная модель атома по Резерфорду
Согласно этой модели, атом состоит из положительно заряженного ядра и движущихся вокруг него электронов. Почти вся масса атома (более 99,96 %) сосредоточена в его ядре, диаметр которого приблизительно в 100 000 раз меньше диаметра всего атома.
На рисунке справа показана модель атома по Резерфорду. Конечно, относительные размеры всего атома и его ядра даны не в соответствующем масштабе. Даже если изобразить размеры ядра атома водорода точкой всего в 1 мм, то границы атома должны были бы находиться на расстоянии 50 м.
Позже было установлено, что ядро атома также имеет сложное строение. Оно состоит из частиц двух типов: протонов и нейтронов.
В таблице ниже приводятся основные характеристики частиц, входящих в состав атома.
Основные характеристики частиц, входящих в состав атома:
| Частица | Символ | Относительная атомная масса | Относительный заряд |
|---|---|---|---|
| Протон | p | 1,007 ≈ 1 | 1+ |
| Нейтрон | n | 1,009 ≈ 1 | 0 |
| Электрон | e— | 1/1840 | 1- |
Протон и нейтрон имеют практически одинаковую массу, равную примерно 1 u, т. е. одной атомной единице массы. Протон (его символ р) имеет относительный заряд 1+, а нейтрон (символ n) электронейтрален.
Относительный заряд электрона (его символическое обозначение е—) равен 1-, а масса примерно в 1840 раз меньше массы протона, т. е. равна 1/1840u. Вам необходимо включить JavaScript, чтобы проголосовать
Строение атома — Знаешь как
 Существование закономерной связи между всеми химическими элементами, ярко выраженное в периодической системе, наталкивает на мысль о том, что в основе всех атомов лежит нечто общее, что все они находятся в близком родстве друг с другом. Однако до конца XIX в. в химии господствовало метафизическое убеждение, что атом есть наименьшая частица простого вещества, последний предел делимости материи. При всех химических превращениях разрушаются и вновь создаются только молекулы, атомы же остаются неизменными и не могут дробиться на более мелкие части.
Существование закономерной связи между всеми химическими элементами, ярко выраженное в периодической системе, наталкивает на мысль о том, что в основе всех атомов лежит нечто общее, что все они находятся в близком родстве друг с другом. Однако до конца XIX в. в химии господствовало метафизическое убеждение, что атом есть наименьшая частица простого вещества, последний предел делимости материи. При всех химических превращениях разрушаются и вновь создаются только молекулы, атомы же остаются неизменными и не могут дробиться на более мелкие части.Только отдельные ученые понимали односторонность и ограниченность такого рода представлений. Так, например, А. М. Бутлеров в 1886 г. писал: «…так называемые ныне «атомы» некоторых элементов в сущности, быть может, способны подвергаться химическому делению, т. е. они не неделимы по своей природе, а неделимы только доступными нам ныне средствами и… могут быть разделены в процессах, которые будут открыты в последствии». Аналогичные мысли почти одновременно с Бутлеровым высказывались Н. А. Морозовым. «Можно ли предположить, — писал он, — что атомы не распадаются никогда на более первоначальные частицы при каких-либо иных космических условиях, вроде тех небесных пожаров, которые обнаруживаются время от времени при спектральном исследовании внезапно вспыхнувших звезд. Конечно, нет! Есть много данных, что атомы химических элементов совершают свою эволюцию в бесконечной истории мироздания».
Но все эти предположения в то время еще не могли быть подтверждены какими-либо экспериментальными данными. Лишь в конце XIX в. были сделаны открытия, показавшие сложность строения атомов и возможность их разрушения при известных условиях с образованием других атомов. На основе этих открытий начало быстро развиваться учение о строении атома.
Открытие электронов
Первые указания на сложную структуру атомов были получены при изучении катодных лучей, возникающих при электрическом разряде в сильно разреженных газах. Для наблюдения этих лучей из стеклянной трубки, в которую впаяны два металлических электрода, выкачивают по возможности весь воздух и затем пропускают сквозь нее ток высокого напряжения. При таких условиях от катода трубки перпендикулярно к его поверхности распространяются «невидимые»катодные лучи, вызывающие яркое зеленоватое свечение стекла трубки в том месте, куда они падают.
Катодные лучи обладают способностью приводить в движение помещенные на их пути легкоподвижные тела и отклоняются от своего первоначального направления в магнитном (рис. 2) и электрическом поле (в последнем в сторону положительно заряженной пластинки). Действие катодных лучей обнаруживается только внутри трубки, так как стекло для них непроницаемо и они не выходят из трубки наружу.
Изучение свойств катодных лучей привело к заключению, что они представляют собой поток мельчайших частиц, заряженных отрицательным электричеством и летящих со скоростью, достигающей половины скорости света. Особыми приемами удалось определить массу катодных частиц и величину их заряда. Оказалось, что масса каждой частицы равняется 0,00055 кислородной единицы, что составляет всего 1/1840часть массы атома водорода, самого легкого из всех атомов. Заряд катодной частицы равняется 1,60·10-19 кулона, или 4,80·10-10 электростатических единиц. Особенно замечательно, что масса частиц и величина их заряда не зависят ни от природы газа, остающегося еще в катодной трубке, ни от вещества, из которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут быть лишены своих зарядов, не могут быть превращены в электронейтральные частицы: электрический заряд составляет, так сказать, самую сущность их природы. Эти частицы получили название электронов. Рис. 2. Отклонение катодных лучей в магнитном поле
Рис. 2. Отклонение катодных лучей в магнитном полеПо современным воззрениям, заряд электрона есть наименьший электрический заряд, наименьшее количество электричества, какое только может существовать. Электричество состоит из отдельных частиц — «атомов» электричества, и всякое заряженное тело содержит непременно целое число таких частиц.
В катодных трубках электроны отделяются от катода под влиянием электрического разряда. Однако они могут возникать и вне всякой связи с электрическим разрядом. Так, например, все металлы испускают электроны при накаливании; в пламени свечи или горелки также присутствуют электроны; многие вещества выбрасывают электроны при освещении ультрафиолетовыми или рентгеновыми лучами и т. д.
Выделение электронов самыми разнообразными веществами указывает на то, что эти частицы входят в состав всех атомов; следовательно, атомы являются сложными образованиями, построенными из более мелких структурных единиц.Вы читаете, статья на тему Строение атома
Опыты доказывающие сложность строения атома
Работа добавлена на сайт samzan.ru: 2016-06-20 Заказать написание уникльной работывразийскии национальный университет имени Гумилева
Выполнила: Зиятова Балжан СиС-12
Проверила:Нуркина З. С.
Опыты доказывающие сложность строения атома
Представление об атомах как неделимых мельчайших частицах вещества возникло еще в античные времена, но только в XVIII веке трудами А. Лавуазье, ось вперед. В 1833 году при исследовании явления электролиза М. Фарадей установил, что ток в растворе электролита это упорядоченное движение заряженных частиц ионов. Фарадей определил минимальный заряд иона, который был назван элементарным электрическим зарядом. Его приближенное значение оказалось равным e = 1,60·1019 Кл.
На основании исследований Фарадея можно было сделать вывод о существовании внутри атомов электрических зарядов.
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Д. И. Менделеев, разработавший в 1869 году периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов.
Важным свидетельством сложной структуры атомов явились спектроскопические исследования, которые привели к открытию линейчатых спектров атомов. В начале XIX века были открыты дискретные спектральные линии в излучении атомов водорода в видимой части спектра. Впоследствии, в 1885 г. И. Бальмером были установлены математические закономерности, связывающие длины волн этих линий.
В 1896 году А. Беккерель обнаружил явление испускания атомами невидимых проникающих излучений, названное радиоактивностью. В последующие годы явление радиоактивности изучалось многими учеными (М. Склодовская-Кюри, П. Кюри, Э. Резерфорд и др.). Было обнаружено, что атомы радиоактивных веществ испускают три вида излучений различной физической природы (альфа-, бета- и гамма-лучи). Альфа-лучи оказались потоком ионов гелия, бета-лучи потоком электронов, а гамма-лучи потоком квантов жесткого рентгеновского излучения.
В 1897 году Дж. Томсон открыл электрон и измерил отношение e / m заряда электрона к массе. Опыты Томсона подтвердили вывод о том, что электроны входят в состав атомов.
Таким образом, на основании всех известных к началу XX века экспериментальных фактов можно было сделать вывод о том, что атомы вещества имеют сложное внутреннее строение. Они представляют собой электронейтральные системы, причем носителями отрицательного заряда атомов являются легкие электроны, масса которых составляет лишь малую долю массы атомов. Основная часть массы атомов связана с положительным зарядом.
Перед наукой встал вопрос о внутреннем строении атомов.
6.1. Опыт Резерфорда. Ядерная модель атома
Первая попытка создания модели атома на основе накопленных экспериментальных данных (1903 г.) принадлежит Дж. Томсону. Он считал, что атом представляет собой электронейтральную систему шарообразной формы радиусом, примерно равным 1010 м. Положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся внутри него (рис. 6.1.1). Для объяснения линейчатых спектров испускания атомов Томсон пытался определить расположение электронов в атоме и рассчитать частоты их колебаний около положений равновесия. Однако эти попытки не увенчались успехом. Через несколько лет в опытах великого английского физика Э. Резерфорда было доказано, что модель Томсона неверна.
Рисунок 6.1.1. Модель атома Дж. Томсона |
Рисунок 6.1.2. Схема опыта Резерфорда по рассеянию α-частиц. K свинцовый контейнер с радиоактивным веществом, Э экран, покрытый сернистым цинком, Ф золотая фольга, M микроскоп |
Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 19091911 годах. Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика порядка 107 м/с, но все же значительно меньше скорости света). α-частицы это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома. Схема опыта Резерфорда представлена на рис. 6.1.2.
От радиоактивного источника, заключенного в свинцовый контейнер, α-частицы направлялись на тонкую металлическую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных α-частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Этот результат был совершенно неожиданным даже для Резерфорда. Его представления находилbcm в резком противоречии с моделью атома Томсона, согласно которой положительный заряд распределен по всему объему атома. При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить α-частицы назад. Электрическое поле однородного заряженного шара максимально на его поверхности и убывает до нуля по мере приближения к центру шара. Если бы радиус шара, в котором сосредоточен весь положительный заряд атома, уменьшился в n раз, то максимальная сила отталкивания, действующая на α-частицу, по закону Кулона возросла бы в n2 раз. Следовательно, при достаточно большом значении n α-частицы могли бы испытать рассеяние на большие углы вплоть до 180°. Эти соображения привели Резерфорда к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла ядерная модель атома. Рис. 6.1.3 иллюстрирует рассеяние α-частицы в атоме Томсона и в атоме Резерфорда.
Рисунок 6.1.3. Рассеяние α-частицы в атоме Томсона (a) и в атоме Резерфорда (b) |
Таким образом, опыты Резерфорда и его сотрудников привели к выводу, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10141015 м. Это ядро занимает только 1012 часть полного объема атома, но содержит весь положительный заряд и не менее 99,95 % его массы. Веществу, составляющему ядро атома, следовало приписать колоссальную плотность порядка ρ ≈ 1015 г/см3. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома. Впоследствии удалось установить, что если заряд электрона принять за единицу, то заряд ядра в точности равен номеру данного элемента в таблице Менделеева.
Радикальные выводы о строении атома, следовавшие из опытов Резерфорда, заставляли многих ученых сомневаться в их справедливости. Не был исключением и сам Резерфорд, опубликовавший результаты своих исследований только в 1911 г. через два года после выполнения первых экспериментов. Опираясь на классические представления о движении микрочастиц, Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, под действием кулоновских сил со стороны ядра вращаются электроны (рис. 6.1.4). Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
Рисунок 6.1.4. Планетарная модель атома Резерфорда. Показаны круговые орбиты четырех электронов |
Планетарная модель атома, предложенная Резерфордом, несомненно явилась крупным шагом вперед в развитии знаний о строении атома. Она была совершенно необходимой для объяснения опытов по рассеянию α-частиц, однако оказалась неспособной объяснить сам факт длительного существования атома, т. е. его устойчивость. По законам классической электродинамики, движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию. За короткое время (порядка 108 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.