Урок 4. Сложные вещества – HIMI4KA
В уроке 4 «Сложные вещества» из курса «Химия для чайников» дадим определение химическим соединениям, рассмотрим различия органических и неорганических соединений, а также выясним, что означает качественный и количественный состав. Напоминаю, что в прошлом уроке «Молекулы и простые вещества» мы рассмотрели, что такое молекулы, простые вещества, а также металлы и неметаллы.


Химические элементы существуют не только в виде свободных атомов и простых веществ. Они также могут входить в состав самых различных химических соединений.
Вещества, состоящие из атомов разных химических элементов, называются сложными веществами или химическими соединениями.
Органические и неорганические вещества
Подавляющее большинство химических веществ — это сложные вещества. Вы уже знаете некоторые из них. Вода, метан, сахар, поваренная соль — сложные вещества. Сложные вещества делятся на две группы — неорганические и органические.
Органические вещества
Все органические вещества объединяет главный признак: в их состав обязательно входят атомы углерода. Кроме углерода, в состав органических веществ чаще всего входят атомы водорода, кислорода, а также азота, фосфора, серы. Почти все органические вещества горючи и легко разлагаются при нагревании. Практически все они имеют молекулярное строение (рис. 41).


Простейшим органическим веществом является природный газ метан. Но вам, наверное, знакомы и такие органические вещества, как сахар (сахароза), уксусная и лимонная кислоты, спирт, крахмал, белки, жиры, пластмассы и т. д. Органических веществ миллионы. Они содержатся во всех животных и растительных организмах (откуда и произошло их название), входят в состав пищи, топлива, лекарств, красителей, самых разнообразных материалов.
Неорганические вещества
Неорганические вещества являются соединениями всех остальных элементов. К неорганическим традиционно относят также несколько веществ, содержащих углерод: углекислый и угарный газы, мел, соду и некоторые другие. Неорганических веществ около 700 тыс., но их общая масса многократно превышает массу органических веществ. Почти все они — твердые вещества немолекулярного строения (рис. 42), входят в состав минералов, почв, горных пород.
Качественный и количественный состав веществ
Каждое вещество характеризуется определенным качественным и количественным составом.
Качественный состав вещества показывает, из атомов каких элементов оно состоит. Например, вода состоит из атомов водорода и кислорода, а метан— из атомов углерода и водорода. Число атомов каждого элемента в составе мельчайшей частицы вещества характеризует его количественный состав. Например, молекула воды состоит из двух атомов водорода и одного атома кислорода, а молекула метана — из одного атома углерода и четырех атомов водорода.
Сложное вещество можно с помощью различных химических методов разложить на несколько новых веществ, и так до тех пор, пока не получатся вещества, каждое из которых будет являться простым. Например, сахар при нагревании разлагается на воду и уголь (углерод):
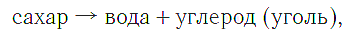
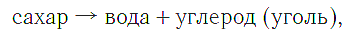
а воду можно разложить с помощью электрического тока на водород и кислород:
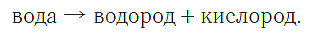
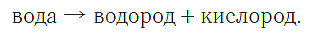
Свойства простых веществ, которые при этом получаются (углерода, кислорода и водорода), совершенно не похожи на свойства сложных веществ — сахара и воды. Это разные вещества с разными свойствами. Свойства сложного вещества не являются суммой свойств простых веществ, которые образуются при его разложении.
Сложные вещества, как и простые, имеют либо молекулярное, либо немолекулярное строение. При этом вещества молекулярного строения могут существовать при обычных условиях в различных агрегатных состояниях. Например, метан — газ, вода — жидкость, сахар — твердое вещество.
Вещества немолекулярного строения при обычных условиях — твердые кристаллы, например поваренная соль, мел. Конечно, при нагревании (иногда до нескольких тысяч градусов) такие вещества плавятся, а затем переходят и в парообразное состояние.
Отличия между сложными веществами и смесями веществ
Необходимо различать сложные вещества и смеси веществ:
| Сложное вещество (химическое соединение) | Смесь веществ |
| Образуется в результате соединения атомов различных элементов между собой (химический процесс) | Образуется в результате смешивания различных веществ (физический процесс) |
| Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено | Свойства веществ, из которых составлена смесь, не изменяются |
| Имеет определенный качественный и количественный состав | Состав произвольный |
| Разлагается на составные части только в результате химических процессов | Разделяется на составные части с помощью различных физических методов |
Краткие выводы урока:
- Сложными называются вещества, состоящие из атомов разных химических элементов.
- Каждое чистое вещество имеет определенный качественный и количественный состав.
- Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено.
- Сложные вещества имеют молекулярное или немолекулярное строение.
- Все сложные вещества делятся на органические и неорганические.
Надеюсь урок 4 «Сложные вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
§ 3. Классификация сложных веществ
Сложные вещества по своему составу подразделяются на бинарные соединения (соединения из атомов только двух элементов) и соединения, в составе которых содержатся атомы более двух элементов. Например, из ряда соединений, состав которых выражается формулами NaI, KNO2, AlN, CaH2, Na2SO3, к бинарным относятся: CaH2, NaI, AlN
По своему составу и свойствам неорганические вещества классифицируют на оксиды, основания, кислоты и соли.
Оксиды – сложные вещества, молекулы которых состоят из атомов кислорода и атомов какого – либо элемента (металла или неметалла).
Примеры оксидов: SO3, CuO, H2O, Fe2O3, CO2.
Основания – сложные вещества, молекулы которых состоят из атомов металла и одной или нескольких гидроксильных групп (-ОН).
Примеры оснований: КОН, Ca(OH)2, Al(OH)3, Fe(OH)2
-6-
К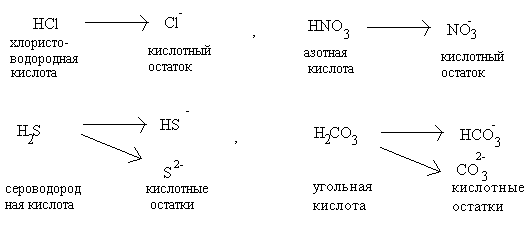 ислоты– сложные
вещества, молекулы которых содержат
атомы водорода, способные замещаться
атомами металла с образованием соли.
Молекулы всех кислот построены однотипно:
они состоят из атомов водорода и кислотных
остатков. Кислотные остатки – это атомы
или группы атомов, которые остаются
после полного или частичного замещения
водорода в молекуле кислоты. Например,
ислоты– сложные
вещества, молекулы которых содержат
атомы водорода, способные замещаться
атомами металла с образованием соли.
Молекулы всех кислот построены однотипно:
они состоят из атомов водорода и кислотных
остатков. Кислотные остатки – это атомы
или группы атомов, которые остаются
после полного или частичного замещения
водорода в молекуле кислоты. Например,
Соли – сложные вещества, молекулы которых всегда содержат атомы металла и атомы кислотного остатка. Соли можно рассматривать как продукт полного или частичного замещения атомов водорода в молекулах кислот атомами металлов, или гидроксильных групп в молекулах оснований на кислотные остатки.
Примеры солей: Ca(HCO3) 2, Mg3(PO4)2, FeCl2, K2CO3, CuOHCl.
Номенклатуру и свойства каждого из этих классов соединений смотри в следующих параграфах (§ 4 — § 8).
ЗАДАНИЕ 3 (для самоконтроля)
1.Укажите, к какому классу химических соединений относится каждое из указанных веществ: а) сернистый газ – SO2, едкий калий — КОН, магнитный железняк – Fe3O4; б) поваренная соль — NaCl, медный купарос – CuSO4·5 H2O, углекислый газ – СО2; в) гашеная известь – Са(ОН)2; триоксид серы – SO3, калийная селитра – KNO3.
2. В приведенных ниже формулах солей подчеркните кислотный остаток:
а) Ca3(PO4)2, FeCl3, K2CO3; б) CaHPO4, CuSO4, CuOHCl;
в)
KMnO4,
FeCl2,
Ca(H2PO
3. Укажите, какие из веществ, состав которых выражается ниже формулами: Cu(OH)2, Al(OH)3, FeOHCl, Zn(OH)2, Ca(OH)2, ALOHCl2
относятся к основаниям, какие – к амфотерным гидроксидам?
§ 4. Бинарные соединения, их номенклатура.
ОКСИДЫ (КЛАССИФИКАЦИЯ)
Состав бинарного соединения можно выразить общей формулой Э’mЭ»n, где атом элемента (Э») имеет отрицательную степень окисления. Названия бинарных соединений составляются из корня латинского названия электроотрицательного элемента (Э») с окончанием »ид» и русского названия элемента Э’ (Э’ – элемент с положительной степенью окисления).
Если элемент (Э’), имеющий положительную степень окисления, может находиться в различных степенях окисления, то в скобках римскими цифрами указывается окислительное число (количественное выражение степени окисления).
Примеры бинарных соединений и их названия:
NaH – гидрид натрия, СаН 2 – гидрид кальция;
CaF2 –фторид кальция, NaI – иодид натрия;
CrCl3 – хлорид хрома (III), или трихлорид хрома;
Ca3N2 – нитрид кальция, СаС2 – карбид кальция;
Al4C3 – карбид алюминия, BN – нитрид бора;
SiC – карбид кремния (IV).
-7-
К бинарным соединениям относятся оксиды,
в составе которых атомы кислорода имеют
С.О., равную (-2):Al2+3O3-2,
Cr+6O3-2,
C+4O2-2.
бинарным соединениям относятся оксиды,
в составе которых атомы кислорода имеют
С.О., равную (-2):Al2+3O3-2,
Cr+6O3-2,
C+4O2-2.
Названия оксидов составляют аналогично другим бинарным соединениям, например, СаО – оксид кальция, Al2O3 – оксид алюминия,
СО
При названии оксидов можно указывать греческими числительными (моно, ди, три, тетра) число атомов кислорода, приходящееся на один атом элемента в соединении, например, MnO – монооксид марганца, СО2 – диоксид углерода, СrО3 – триоксид хрома.
По химическим свойствам оксиды делятся на следующие типы:
Основные оксиды – соединения металлов (в низших степенях окисления) с кислородом. Им соответствуют гидроксиды, являющиеся основаниями. Оксиды щелочных и щелочноземельных металлов взаимодействуют (растворяются) с водой с образованием оснований (растворимых в воде – щелочей). Например:Na2O + H2O = 2NaOH; CaO + H2O = Ca(OH)2.
Основные оксиды остальных металлов не растворяются в воде и соответствующие им гидроксиды (основания) получают из солей реакцией обмена со щёлочью. Названия основных гидроксидов определяется названием образующих их металлов:
Оксид Соответствующий ему гидроксид Название
K2O KOH Гидроксид калия
ВаО Ва(ОН)2 Гидроксид бария
Al2O3 Al(OH)3 Гидроксид алюминия
FeO Fe(OH)2 Гидроксид железа (II)
Cr2O3 Cr(OH)3 Гидроксид хрома (III)
Кислотные оксиды (или ангидриды кислот)- это такие оксиды,
которым соответствуют гидроксиды –
кислоты. К ним относятся оксиды неметаллов
(например, СО2,
SO3,
P2O2)
и оксиды некоторых металлов в их высших
степенях окисления (например, CrO
Кислотные оксиды можно рассматривать как продукты дегидратации кислот (ангидриды). Например:
Кислота Ангидрид кислоты
H2C+4 O3 C+4O2
H2S+6O4 S+6O3
HN+5O3 N2+5O5
H3P+5O4 P2+5O5
Таким образом, зная формулу кислотного оксида, можно легко вывести формулу соответствующей кислоты и наоборот, зная формулу кислоты, можно написать формулу соответствующего ангидрида.
Амфотерные оксиды – такие оксиды, которые в зависимости от условий проявляют и основные, и кислотные свойства, т.е. могут взаимодействовать как с кислотами, так и с основаниями. К ним относятся оксиды цинка — ZnO, алюминия – Al2O3, хрома (III) – Cr2O3, марганца (IV) – MnO2 и др.
Оксиды основные, кислотные, амфотерные называются солеобразующими. Все они способны образовывать соли при взаимодействии с кислотами или основаниями. Есть небольшая группа оксидов, которые не способны образовывать соли. Они называются несолеобразующими, или индифферентными (NO, CO).
УПРАЖНЕНИЕ 3.
Какие из перечисленных
оксидов относятся к основным? К кислотным?
К амфотерным? P2O5,
CaO,
Na2O,
Mn
ОТВЕТ К основным оксидам относятся оксиды металлов при невысоких степенях окисления. Из приведенных оксидов основными являются: СаО, Na2O, Ni2O3, FeO.
-8-
К кислотным относятся : P2O5, Mn2O7, SiO2, т.к. P2O5 и SiO2 – это оксиды неметаллов, а Mn2O7 – оксид марганца в высшей С.О. (+7). Оксиды ZnO и Al2O3 относятся к амфотерным.
Гидроксиды Са(ОН)2, Fe(OH)2, NaOH, Ni(OH)2 – основания; гидроксиды Н 3РО4, HMnO4 и H2SiO3 – кислоты; Zn(OH)2 и Al(OH)3 – имеют амфотерный характер.
В качестве осушителей могут использоваться оксиды: Р2О5, СаО, Na2O, т.к. они активно взаимодействуют с водой.
ЗАДАНИЕ 4 (для самоконтроля)
1. Какие основания соответствуют следующим оксидам : Ag2O, MgO, Cu2O, CrO?
2. Каким кислотам соответствуют следующие ангидриды:
N2O5, Cl2O7, SO2, CrO3, SiO2?
3. Какие оксиды соответствуют следующим гидроксидам
Cr(OH)3, Zn(OH)2, LiOH, Ba(OH)2?
4. Какие из приведенных оксидов ZnO, FeO, Al2O3, CaO, P2O3, Cr2O3, Mn2O7 обладают амфотерными свойствами?
5. Какие из оксидов Fe2O3, CaO, MgO, SO3, P2O5, Na2O, CO2, MnO взаимодействуют с водой?
6. Какие оксиды соответствуют следующим кислотам:
H2SO3, HNO2, HPO3, H3PO4, H2CrO4?
7. Какие из перечисленных оксидов могут использоваться в качестве осушителей: CaO, SiO2, CuO, P2O5, Fe2O3?
8. Какие из перечисленных выше оксидов (п.7) могут быть использованы для осушки углекислого газа?
9. Каждому основанию соответствует основной оксид – оксид металла. Можно ли утверждать, что всякому оксиду металла соответствует основание? Почему?
studfile.net
1.3.1. Простые и сложные вещества
Исходя из основных положений атомно-молекулярного учения, можно дать определения простого и сложного вещества.
Простыми веществами называются вещества, состоящие из атомов одного химического элемента.
Например:
O2, N2, S8.
Сложными веществами называются вещества, состоящие из атомов различных химических элементов.
Например:
Н2О, Н2SО4, CuCl2.
Следует заметить, что такое сложное вещество, как, например, вода Н2О, состоит не из водорода и кислорода (это названия простых веществ – водорода – Н2 и кислорода – O2), а из атомов элемента водорода – Н и атомов элемента кислорода – O.
Некоторые химические элементы способны образовывать несколько простых веществ, отличающихся друг от друга по строению и свойствам. В настоящее время известно более 400 простых веществ. Так, элемент углерод образует простые вещества: графит, алмаз, карбин и фулерен. При сгорании каждого из этих веществ образуется только оксид углерода (IV) СО2. Это подтверждает то, что эти простые вещества состоят из атомов одного и того же элемента С углерода.
Явление, при котором один и тот же элемент может образовать несколько простых веществ, называется аллотропией, а образуемые при этом простые вещества – аллотропными модификациями.
Примером аллотропных модификаций могут быть простые вещества – кислород О2 и озон О3, образованные атомами одного и того же элемента – кислорода.
Явление аллотропии вызывается двумя причинами:
различным числом атомов в молекуле, например, кислород О2 и озон О3,
различным строением кристаллической решетки и образованием различных кристаллических форм, например, алмаз, графит, карбин и фулерен.
Способность вещества участвовать в тех или иных химических реакциях характеризует химические свойства вещества.
Химические явления (процессы) – это процессы, в результате которых из одних веществ образуются другие вещества.
Если в результате протекания процесса химическая природа вещества не меняется, то такие процессы считаются физическими.
Примерами физических процессов традиционно считаются изменения агрегатного состояния вещества: плавление ионных кристаллов некоторых солей, плавление металлов, испарение воды и других жидкостей и т.д.
Следует заметить, что такой процесс, как растворение, считают физико-химическим, и, в данном случае, границы между химическими и физическими явлениями достаточно условны.
Принято различать чистые (химически чистые) вещества и смеси веществ.
Чистыми или индивидуальными веществами называют вещества, состоящие из частиц одного вида (содержащие одинаковые структурные единицы).
Примерами могут служить серебро (содержит только атомы серебра), серная кислота и оксид углерода (IV) (содержат только молекулы соответствующих веществ).
Чистые вещества характеризуются постоянством физических свойств, например, температурой плавления (Тпл) и температурой кипения (Ткип).
Вещество не является чистым, если содержит какое-либо количество одного или нескольких других веществ – примесей.
Если система образована смешиванием нескольких чистых веществ, причем их свойства при этом не изменились и ее можно разделить с помощью физических методов на исходные вещества, то такая система называется смесью. Почва, морская вода, воздух – все это примеры различных смесей. Вещества, входящие в состав смеси, называются компонентами. Содержание компонентов в смеси может меняться в широких пределах.
Многие смеси могут быть разделены на составные части – компоненты – на основании различия их физических свойств. Среди большого числа методов, используемых для разделения и очистки веществ, можно назвать:
фильтрование,
отстаивание с последующей декантацией,
разделение с помощью делительной воронки,
центрифугирование,
выпаривание,
кристаллизация,
перегонка (в том числе фракционная перегонка),
хроматография,
возгонка и другие.
Следует заметить, что на практике вещества, называемые «чистыми», являются таковыми лишь условно. Очистка веществ представляет сложную задачу и получение абсолютно чистых веществ, содержащих структурные единицы только одного вида, практически невозможно.
studfile.net
§ 1.5. Простые и сложные вещества. Аллотропы. Вещества и смеси.
В предыдущей главе было сказано, что образовывать связи друг с другом могут не только атомы одного химического элемента, но также атомы разных элементов. Вещества, образованные атомами одного химического элемента, называют простыми веществами, а вещества, образованные атомами разных химических элементов, — сложными. Некоторые простые вещества имеют молекулярное строение, т.е. состоят из молекул. Например, молекулярное строение имеют такие вещества, как кислород, азот, водород, фтор, хлор, бром, йод. Каждое из этих веществ образовано двухатомными молекулами, поэтому их формулы можно записать как O2, N2, H2, F2, Cl2, Br2 и I2 соответственно. Как можно заметить, простые вещества могут иметь одинаковое название с элементами, их образующими. Поэтому следует четко различать ситуации, когда речь идет о химическом элементе, а когда о простом веществе.
Нередко простые вещества имеют не молекулярное, а атомное строение. В таких веществах атомы могут образовывать друг с другом связи различных типов, которые подробно будут рассмотрены чуть позже. Веществами подобного строения являются все металлы, например, железо, медь, никель, а также некоторые неметаллы — алмаз, кремний, графит и т.д. Для данных веществ обычно характерно не только совпадение названия химического элемента с названием им образованного вещества, но также идентичны запись формулы вещества и обозначения химического элемента. Например, химические элементы железо, медь и кремний, имеющие обозначения Fe, Cu и Si, образуют простые вещества, формулы которых Fe, Cu и Si соответственно. Существует также небольшая группа простых веществ, состоящих из разрозненных атомов, никак не связанных между собой. Такие вещества являются газами, которые называют, ввиду их крайне низкой химической активности, благородными. К ним относятся гелий (Не), неон (Ne), аргон (Аr), криптон (Кr), ксенон (Хе), радон (Rn).
Поскольку только известных простых веществ насчитывается около 500, то логично вытекает вывод о том, что для многих химических элементов характерно явление, называемое аллотропией.
Аллотропия – явление, когда один химический элемент может образовывать несколько простых веществ. Разные химические вещества, образованные одним химическим элементом, называют аллотропными модификациями или аллотропами.
Так, например, химический элемент кислород может образовывать два простых вещества, одно и которых имеет название химического элемента – кислород. Кислород как вещество состоит из двухатомных молекул, т.е. формула его O2. Именно данное соединение входит в состав жизненно необходимого нам воздуха. Другой аллотропной модификацией кислорода является трехатомный газ озон, формула которого O3. Несмотря на то что и озон, и кислород образованы одним химическим элементом, их химическое поведение весьма различно: озон отличается намного большей активностью по сравнению с кислородом в реакциях с теми же веществами. Кроме того, данные вещества отличаются друг от друга по физическим свойствам уже как минимум из-за того, что молекулярная масса озона больше, чем у кислорода в 1,5 раза. Это приводит к тому, что его плотность в газообразном состоянии также больше в 1,5 раза.
Многие химические элементы склонны образовывать аллотропные модификации, отличающиеся друг от друга особенностями строения кристаллической решетки. Так, например, на рисунке 5, вы можете видеть схематичные изображения фрагментов кристаллических решеток алмаза и графита, которые являются аллотропными модификациями углерода.
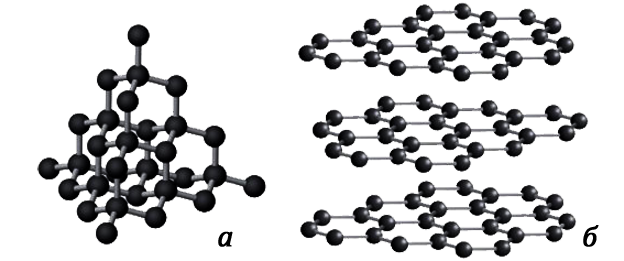
Рисунок 5. Фрагменты кристаллических решеток алмаза (а) и графита (б)
Кроме того, углерод может иметь и молекулярное строение: такая структура наблюдается у такого типа веществ, как фуллерены. Вещества данного типа образованы молекулами углерода сферической формы. На рисунке 6 представлены 3D модели молекулы фуллерена с60 и футбольного мяча для сравнения. Обратите внимание на их интересное сходство.
Рисунок 6. Молекула фуллерена С60 (а) и футбольный мяч (б)
Сложные вещества — это вещества, которые состоят из атомов разных элементов. Они так же, как и простые вещества, могут иметь молекулярное и немолекулярное строение. Немолекулярный тип строения сложных веществ может быть более разнообразен, нежели у простых. Любые сложные химические вещества могут быть получены либо прямым взаимодействием простых веществ, либо последовательностью их взаимодействий друг с другом. Важно осознавать один факт, который заключается в том, что свойства сложных вещества как физические, так и химические сильно отличаются от свойств простых веществ, из которых они получены. Например, поваренная соль, имеющая форуму NaCl и представляющая собой бесцветные прозрачные кристаллы, может быть получена взаимодействием натрия, являющегося металлом с характерными для металлов свойствами (блеск и электропроводность), с хлором Cl2 — газом желто-зеленого цвета.
Серная кислота H2SO4 может быть образована серией последовательных превращений из простых веществ — водорода H2, серы S и кислорода O2. Водород — газ легче воздуха, образующий с воздухом взрывчатые смеси, сера — твердое вещество желтого цвета, способное гореть, и кислород — газ чуть тяжелее воздуха, в котором могут гореть многие вещества. Серная кислота, которая может быть получена из данных простых веществ, представляет собой тяжелую маслянистую жидкость, обладающая сильными водоотнимающими свойствами, из-за которых обугливает многие вещества органического происхождения.
Очевидно, что помимо индивидуальных химических веществ, бывают также и их смеси. Преимущественно именно смесями различных веществ образован мир вокруг нас: сплавы металлов, продукты питания, напитки, различные материалы, из которых состоят окружающие нас предметы.
Например, воздух, которым мы дышим, состоит в основном из азота N2 (78%), жизненно необходимого нам кислорода (21%), оставшийся же 1% приходится на примеси других газов (углекислый газ, благородные газы и др.).
Смеси веществ разделяют на гомогенные и гетерогенные. Гомогенными смесями называют такие смеси, у которых нет границ раздела фаз. Гомогенными смесями являются смесь спирта и воды, сплавы металлов, раствор соли и сахара в воде, смеси газов и т.д. Гетерогенными смесями называют такие смеси, у которых имеется граница раздела фаз. К смесям такого типа можно отнести смесь песка и воды, сахара и соли, смесь масла и воды и др.
Вещества, из которых состоят смеси, называют компонентами.
Смеси простых веществ в отличие от химических соединений, которые могут быть получены из этих простых веществ, сохраняют свойства каждого компонента.
scienceforyou.ru
Классификация веществ — урок. Химия, 8–9 класс.
Все вещества делятся на простые и сложные.
Простые вещества состоят из атомов одного элемента.
Сложные вещества (химические соединения) состоят из атомов нескольких элементов.
Простые вещества разделяют на металлы и неметаллы. Деление основано на различиях в их свойствах.
Металлы имеют характерный «металлический» блеск, ковкость, высокую теплопроводность и электропроводность. При комнатной температуре все металлы (кроме ртути) твёрдые. Большинство металлов вытесняют из кислот водород.
Серебро
Неметаллы не обладают характерным блеском, ковкостью. Многие неметаллы при обычных условиях газообразны.
Красный фосфор
Сложные вещества делят на органические и неорганические.
Органические вещества — соединения углерода. В их состав могут также входить атомы водорода, кислорода, азота, фосфора, серы.
Почти все органические вещества горючи и легко разлагаются при нагревании. Практически все они имеют молекулярное строение.
Органических веществ миллионы. Они содержатся во всех живых организмах, входят в состав продуктов питания, топлива, лекарств, красителей, пластмасс.
Изделия из пластмасс
Неорганические вещества — соединения всех остальных элементов. К ним относятся также некоторые вещества, содержащие углерод: сода, мел, угарный и углекислый газы и др. Простые вещества тоже являются неорганическими.
Неорганических веществ около \(700\) тысяч. Они образуют неживую природу: минералы, горные породы и т. д. Почти все неорганические вещества имеют немолекулярное строение. Большинство из них при обычных условиях представляют собой твёрдые вещества.
Мел
www.yaklass.ru