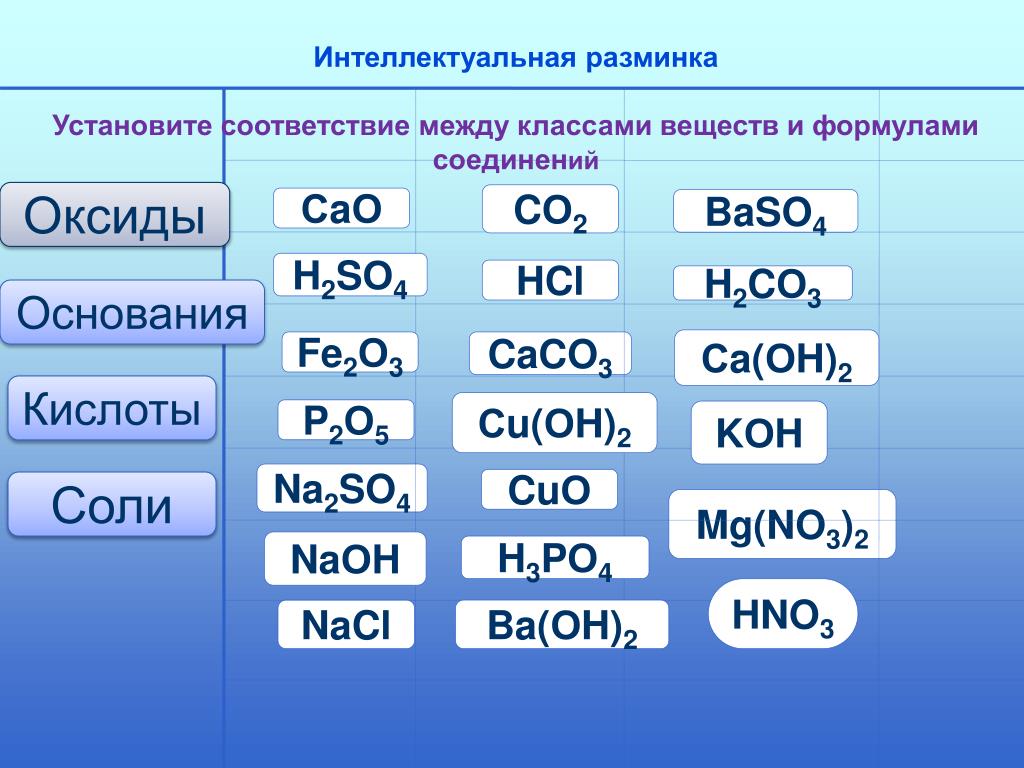
Неправильная соль
Как выглядит формула хлорида натрия? NaCl, мы знаем это еще из школьного курса химии. Но кода это останавливало настоящих ученых? Группа исследователей из Университета штата Нью-Йорк в Стоуни-Брук под руководством профессора российского происхождения Артема Оганова сумела создать1 термодинамически стабильные хлориды натрия с формулами NaCl3, NaCl7, Na3 Cl, Na3 Cl2, Na2Cl. Правда, для этого им пришлось поместить соль в поистине нечеловеческие условия – под давление от 250 до 480 тыс. атмосфер.Впрочем, это еще не самое интересное: перед тем, как получить необычные вещества, исследователи предсказали их структуру при помощи изобретенного ими метода USPEX (Unversal Structure Predictor: Evolutionary Xrystallography). В течение нескольких последних лет его используют более полутора тысяч исследователей по всему миру, в том числе в России.
Полученный прогноз полностью совпал с экспериментальными данными. Так, расчеты показывали, что существование хлоридов натрия с формулами NaCl5 и Na2 Cl3 невозможно. Интересно, что NaCl7, NaCl3, Na3 Cl3 и Na2 Cl оказались металлами, а самым уникальным среди них можно считать NaCl3 – он состоит из перемежающихся слоев NaCl и чистого металлического натрия. Уникальность вещества в том, что NaCl – диэлектрик, а слои натрия – проводники, поэтому оно имеет очень интересную двумерную проводимость. На такого рода соединениях в последнее время продемонстрирован целый ряд необычных физических явлений.
После экспериментального подтверждения существования новых веществ группа Оганова продолжает изучать природу их стабильности.
Практическое применение такого рода материалам должно найтись, уверены исследователи. Единственная проблема – они устойчивы только при высоком давлении, однако не исключено, что можно создать другие экстремальные условия, при которых эти соединения образуются, например, на поверхностях кристаллов.
Следующим после натрия в поле интересов исследователей попал магний, расчеты, произведенные с использованием метода USPEX, показывают перспективность этого направления. Профессор и его коллеги уже подали патентную заявку на использование экзотических свойств подобных материалов. Изучение химической природы нового класса соединений является одним из направлений работы лаборатории Артема Оганова в Московском физико-техническом институте в Долгопрудном, которую он создал в рамках мегагранта российского правительства.
1Unexpected Stable Stoichiometries of Sodium Chlorides — Science 20 December 2013: Vol. 342 no. 6165 pp. 1502–1505, DOI: 10.1126/science.1244989.
Журнал «Российские аптеки» №1-2, 2014
Вам могут понравиться другие статьи:
ПодробностиИдеальное тело
Известно, что устранить отечность, вернуть тонус коже, уменьшить проявления целлюлита помогают лимфодренажные методики, такие как прессотерапия, электромиостимуляция, аппаратный или р. ..
..
Символ года 2022: усатый-полосатый
По китайскому календарю, ставшему невероятно популярным на просторах Старого и Нового Света, 2022 год станет годом Черного Водяного Тигра. По традиции мы рассказываем, как связа… Подробнее ПодробностиПраздник к нам приходит
Он врывается в наши города вместе с ароматами мандаринов, свежей хвои и имбирного печенья.
Поздравляем коллег!
В конце декабря у всех очень напряженный график и одна большая проблема: нужно успеть выбрать и купить подарки для друзей и домашних. А руководителям – еще и подумать о коллективе. Как порадовать и…
Подробнее ПодробностиВ эфире масло
Парфюмеры ценят их за насыщенные ароматы, а косметологи – за способность тонизировать и подтягивать кожу. Если покупатель ищет средство с одновременным эффектом ароматерапии и&nb… Подробнее
Подробности
Если покупатель ищет средство с одновременным эффектом ароматерапии и&nb… Подробнее
ПодробностиЗа зимней сказкой
Соль поваренную техническую производят следующих видов (таблица 4, 5): В качестве противослеживающей добавки используют 3-водный железистосинеродистый (ферроцианид) калий (массовая доля добавки не должна превышать 0,01%). Органолептические и физико-химические показатели технической поваренной соли.
В поваренной соли Высшего сорта наибольшее содержание NaCl и меньшее количество посторонних примесей. При высоком содержанием NaCL (до 98,6 %) использование в химической, нефтехимической, топливной, электроэнергетической промышленностях технической соли позволяет снизить общий объем потребления соли предприятиями. Важно также количество нерастворимого осадка. При низком (минимально 0,16 %) значительно сокращается частота необходимости обслуживания баков водоподготовки, в которых растворяют соль, по сравнению с использованием солей первого и второго сорта. Также фильтры подвергаются меньшему износу, реже выходят из строя. Для производства хлорсоединений (хлороводородной кислоты, гидроксида натрия, металлического натрия), преимущественно используют высококачественную вакуумную соль. Если техническая соль нужна предприятиям для выделения из нее какой-либо составляющей (например, магния и др.), закупается соль с наибольшим ее содержанием. Допустимое содержание примесей, тяжелых металлов и радионуклидов устанавливается нормами (таблица 4, таблица 5). | Содержание тяжелых металлов и радионуклидов.
По гранулометрическому составу техническая поваренная соль делится на соль помолы №1, №2, №3 и ядро (таблица 6). Гранулометрический состав технической поваренной соли.
| ||
Трилон Б — тетранатриевая соль
Трилон Б представляет собой белый кристаллический порошок или кристаллы белого цвета, хорошо растворимые в воде, очень малорастворимые в спирте.
Растворимость в воде при температуре 20°С составляет 100 г/л, при температуре 80°С – 230 г/л.
| Синонимы | тетранатриевая соль этилендиамин-N, N, N,N –тетрауксусной кислоты 4-водная, соль тетранатриевая этилендиамин-N,N,N’,N’-тетрауксусной кислоты, эдта-натрий, этилендинитрилотетрауксусной кислоты, тетранатриевая соль, 4Na-ЭДТУК |
| Международное название | EDTA- 4Na |
| CAS № | 13236-36-4 |
| Производство | Китай |
| Упаковка | Мешок 25 кг |
| Химическая формула | C10H12N2O8Na4 * 4H2O |
| Класс опасности груза по ДОПОГ (ООН) | Нет |
Применение Трилон Б
Трилон Б тетранатриевая соль (4Na-ЭДТУК, EDTA- 4Na, эдта-натрий, HEDTA) используется:
- для промывки теплоэнергетического оборудования, труб, котлов;
- водоподготовки в котельных и теплосетях;
- в производстве бытовой химии и синтетических моющих средств;
- в виде стабилизатора в процессах полимеризации;
- в целлюлозно-бумажной промышленности;
- при производстве каучука;
- в реставрации для удаления следов коррозии с изделий из бронзы и других цветных металлов;
- в производстве медицинских препаратов и при отравлениях тяжелыми металлами;
- в аналитической химии;
Интересный факт.

Трилон Б (Trilon B) является торговым названием тетранатриевой соли этилендиаминтетрауксусной кислоты. Данное название введено фирмой BASF и использовалась как торговая марка для данного химреактива, но очень быстро вошло в обиход и используется другими фирмами для обозначения продукта.
Физико-химические свойства Трилон Б
| Наименование показателя | Норма | Результат анализа |
| Массовая доля 4-водной тетранатриевой соли этилендиамин-N,N,N’,N’-тетрауксусной кислоты, % | 99.0% мин | 99.50% |
| Массовая доля хлоридов (Cl–), %, не более | 0.01% макс | 0.003% |
| Массовая доля железа (Fe), %, не более | 0.001% макс | 0.0001% |
| Тяжелые металлы % | 0.001% макс | 0.0001% |
| Кислотность (1% раствор) | 10.5-11.5 | 10.96 |
| Хелатное значение(mgCaCo3/g) | 215 мин | 221 |
| Внешний Вид | Белый кристаллический порошок | |
солей Рона Куртуса — Понимание химии: школа для чемпионов
SfC Home > Физические науки > Химия >
Рона Куртуса (15 декабря 2001 г. )
)
Соли представляют собой нейтральные соединения, которые часто образуются в результате совместного сложения кислоты и основания.
Вы можете определить соль по ее характеристикам и химической формуле. Соль имеет рН 7,0. Соли обеспечивают организм минералами.
Возможные вопросы:
- Каковы характеристики солей?
- Какой тип химической формулы имеет соль?
- Для чего используются соли?
Этот урок ответит на эти вопросы.
Характеристики
Соли представляют собой химические соединения, которые обычно образуются при взаимодействии кислоты и основания в воде.
Химическая комбинация
Примером соединения кислоты и основания с образованием соли является объединение водного раствора соляной кислоты ( HCl ) с водным раствором основания гидроксида натрия ( NaOH ). Они реагируют с образованием поваренной соли ( NaCl ) и воды:
HCl + NaOH → NaCl + H 2 O
(Дополнительная вода для растворов не включена в приведенное выше химическое уравнение, так как она не является частью реакции и для простоты. )
)
Другая химическая реакция заключается в объединении ядовитого зеленого газообразного хлора ( Cl 2 ) со взрывоопасным порошком металлического натрия ( Na ) с образованием полезных кристаллов белой соли. (Эта реакция обычно проводится в водном растворе).
Cl 2 + 2Na → 2NaCl
Физические характеристики
При смешивании с водой соль может реагировать с другими веществами.Например, соленая вода может усилить коррозию или ржавление стали. Кроме того, некоторые соли могут вызывать ожоги или раздражения на коже, тогда как другие на самом деле ядовиты.
Соли имеют соленый вкус (без шуток!), но вы должны быть осторожны, пробуя на вкус или прикасаясь к любому химикату, особенно к тому, который может нанести вред вашей коже.
Кристаллы
Удаление воды из солей обычно приводит к кристаллическому материалу. Хорошим примером таких кристаллов является обычная поваренная соль.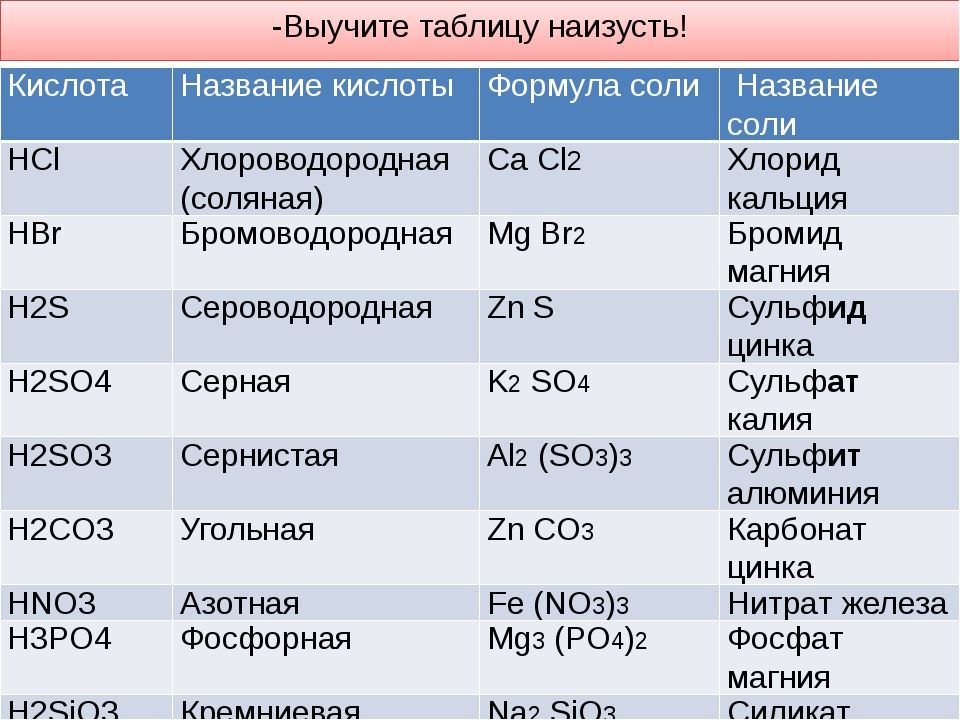
Шкала рН
Шкала рН представляет собой измерение силы кислоты, соли или основания.рН соли находится между кислотой и основанием и составляет ровно 7,0.
Лакмусовая бумагачасто используется для приблизительной оценки pH. При намокании раствором соли лакмусовая бумажка не станет ни красной, ни синей, а останется белой.
Формула
Нет простого способа определить, является ли материал солью по его химической формуле, как это можно сделать с кислотой или основанием.
Основания часто можно идентифицировать по термину OH в конце их химической формулы, в то время как кислоты обычно имеют H в начале формулы.Соли обычно не имеют терминов OH или H . Примером может служить соль хлорида калия ( KCl ).
Применение солей
Соли важны для поддержания жизни, потому что они обеспечивают организм минералами.
Поскольку NaCl и вода могут разъедать материалы, часто CaCl используется для растапливания льда на тротуарах зимой. Хлорид кальция гораздо менее агрессивен.
Хлорид кальция гораздо менее агрессивен.
Другие факты об использовании включают:
- Слишком много соли в почве может помешать росту растений.
- В океанской воде растворено множество солей.
- Поскольку соли более стабильны, чем кислоты или основания, в природе их больше.
Резюме
Соли имеют соленый вкус и часто являются результатом совместного сложения кислоты и основания. Соль имеет рН 7,0. Соли обеспечивают организм минералами, но могут разъедать металлы.
Быть человеком с высоким характером
Ресурсы и ссылки
Полномочия Рона Куртуса
Веб-сайты
Химические ресурсы
Книги
(Примечание: Школа чемпионов может получать комиссионные за покупку книг)
Лучшие книги по химии
Вопросы и комментарии
У вас есть вопросы, комментарии или мнения по этому поводу? Если это так, отправьте электронное письмо с вашим отзывом. Я постараюсь вернуться к вам как можно скорее.
Я постараюсь вернуться к вам как можно скорее.
Поделиться этой страницей
Нажмите кнопку, чтобы добавить эту страницу в закладки или поделиться ею через Twitter, Facebook, электронную почту или другие службы:
Студенты и исследователи
Веб-адрес этой страницы:
www.school-for-champions.com/chemistry/
соли.htm
Разместите его в качестве ссылки на своем веб-сайте или в качестве ссылки в своем отчете, документе или диссертации.
Copyright © Ограничения
Где ты сейчас?
Школа Чемпионов
Химия
Соли
Образование солей. Химическая формула солей и ее наименование
Образование солей Соли в изобилии встречаются в земной коре, Они также находятся в растворенном виде в морской воде, Катион представляет собой положительный ион (M + ) основания (основной радикал), Анион представляет собой отрицательный ион (X − ) кислота (кислотный радикал). Они объединяются вместе, образуя соль M + X — .
Они объединяются вместе, образуя соль M + X — .
Пример: образование соли нитрата калия: K + NO 3 − , K + – катион (основной радикал), NO 3 − – анион (кислота) реагирует с азотной кислотой, образуется нитрат калия:
K + NO 3 3 — (AQ) + H + № 3 — (AQ) → K + № 3 — (AQ) + H 2 О (л)
Химическая формула солей и ее наименование Прочтение химического названия минеральной соли не отличается от органической соли следующим образом: Химическое название солей образуется из двух частей. Первая часть относится к основному радикалу (катиону), а вторая часть относится к кислотный радикал (анион), такой как хлорид натрия и ацетат калия.
Химическая формула минеральной соли отличается от формулы органической соли. В случае минеральной соли сначала пишется основной радикал, затем кислотный радикал. В случае органической соли сначала пишется кислотный радикал, затем основной радикал. .
Соли
Соли минеральной кислоты, такие как k + № 3 — , K + (калия — это базовый радикал), № 3 — (нитрат кислотный радикал), соли органических кислот, такие как CH 3 COO − K + , K + (калий является основным радикалом), CH 3 COO − (ацетат представляет собой кислотный радикал).
Если соль содержит водород в своем кислотном радикале, мы должны добавить либо: (Bi), либо (водород) перед названием ее кислотного радикала, например, Na + HSO 4 − , Бисульфат натрия или Гидросульфат натрия.
В случае металлов, имеющих более одной валентности, мы должны написать латинское число (I, II, III), которое указывает на валентность металла, например, Fe 2+ SO 4 2 — Сульфат железа (II), Fe 2 3+ (SO 4 ) 3 2-, Сульфат железа (III).
Химическая формула соли зависит от кислоты, которая представляет собой источник аниона, валентности аниона и действия.
FeCl 3 называется хлоридом железа (III), а AlCl 3 является хлоридом алюминия, хотя валентность железа и алюминия равна 3 в двух солях, поскольку железо имеет две валентности (II, III), в то время как алюминий имеет только одну валентность (III).
Некоторые кислоты имеют более одного типа солей из-за количества атомов водорода в молекуле кислоты.
Одноосновные кислоты образуют только один тип солей, например:
Азотная кислота HNO 3 → образует только нитратные соли, такие как нитрат калия KNO 3 , нитрат свинца (II) Pb(NO 3 ) 2 , нитрат железа (III) Fe ) 3 .
Соляная кислота HCl → образует только хлоридные соли, такие как хлорид натрия NaCl, хлорид магния MgCl 2 , хлорид алюминия AlCl 3 .
Уксусная кислота CH 3 COOH → образует только ацетатные соли, такие как ацетат калия CH 3 COOK, ацетат меди (II) (CH 3 COO) 2 Cu, ацетат железа (III) (CH 3 COO) 3 Fe .
Двухосновные кислоты образуют два типа солей, таких как:
Серсуриновая кислота H 2 SO 4 4 4 → образует сульфатные соли (сульфат натрия Na 2 SO 4 , меди (II) сульфат CUSO 4 ) и бисульфатные соли (бисульфат натрия Nahso 4 , Гидросульфат алюминия Al(HSO 4 ) 3 ).
карбоновая кислота H 2 CO 2 CO 3 3 → образует соли карбоната (карбонат натрия Na 2 CO 3 , карбонат кальция CO 3 , кальций CACO 3 ) и бикарбонатные соли (бикарбонат натрия Nahco 3 , магниевый бикарбонат Mg(HCO 3 ) 2 ).
Трехосновные кислоты образуют три типа солей, например:
фосфорной кислоты (H 3 PO 4 ) образует три типа солей, которые представляют собой дигидрогенфосфатную группу H 2 PO 4 — , гидрофосфат водорода HPO 4 2- и фосфатная группа Заказ на поставку 4 3-.
Типы соединений, свойства кислот, оснований (щелочей), оксидов и солей
Экономическое значение некоторых обычных кислот, оснований и солей (минералов)
Каковы типы и свойства солей?
Каков химический состав морской воды?
Морская вода — или соленая вода — это в основном вода из океанов и морей. Он покрывает примерно 70 процентов нашей планеты.
Химический состав морской воды интерпретировать относительно просто — это H3O с некоторыми дополнениями.
Если взять образец морской воды и отнести его в лабораторию, химик быстро определит шесть основных ионов.
Он или она обнаружит хлорид (Cl-), натрий (Na+), сульфат (SO24-), магний (Mg2+), кальций (Ca2+) и калий (K+).
Они составляют более 99 процентов всех морских солей, хотя концентрация каждого из них в образце может варьироваться.
Морская вода также содержит другие вещества и компоненты, хотя и в меньших масштабах.
Бор, бромид, фторид, неорганический углерод и стронций — вот некоторые из найденных растворенных веществ; в еще меньших масштабах неорганический азот и неорганический фосфор.
Уровни соленостиКогда вы думаете о морской воде, вы почти можете почувствовать этот вкус во рту, особенно в теплые летние дни, когда ваша кожа сохнет после купания или прибоя.
Интересно, что уровень солености мировых океанов в среднем составляет всего 3,5 процента, т. е. 35 граммов растворенных солей на литр воды.
Этот уровень солености везде относительно стабилен.
Тем не менее, районы Северной Атлантики, Южной Атлантики, Индийского океана и южной части Тихого океана более соленые, чем в среднем (3.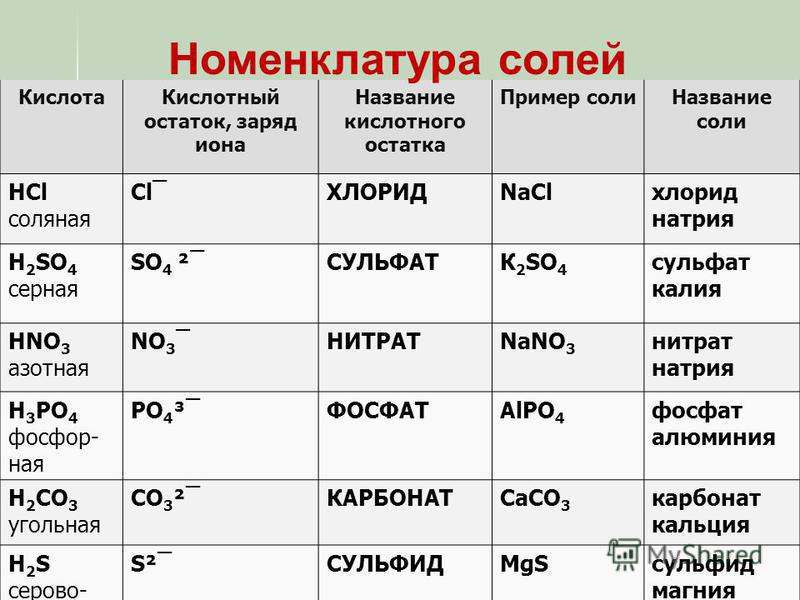 6 процентов).
6 процентов).
На противоположной стороне спектра океанические регионы вокруг Антарктики, Северного Ледовитого океана, Юго-Восточной Азии и западного побережья Северной и Центральной Америки имеют более низкие уровни солености, чем в среднем (3,4 процента).
Но дело в том, что океаны соленые.
Чтобы представить ситуацию в перспективе, давайте просто скажем, что пресноводные водоемы, такие как реки и озера, в среднем содержат менее 0,5 процента соли.
Самое соленое море на планете — Мертвое море, его около 33.7-процентной солености, то есть почти в десять раз больше, чем уровни, присутствующие в океанах Земли .
На уровень солености морской воды могут влиять такие переменные, как место и глубина отбора проб, осадки, близость к устьям рек и айсбергам, а также температура.
Плотность морской воды Понятно, почему морская вода плотнее чистой или пресной воды — соли увеличивают массу.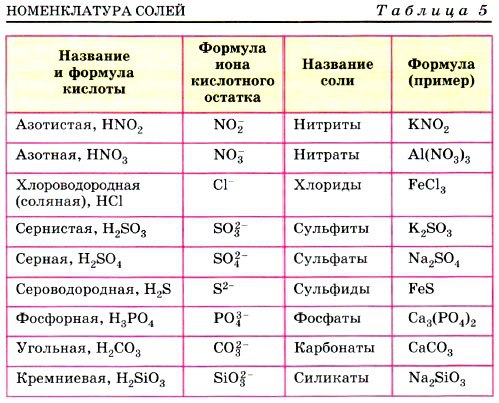
В результате люди, животные и предметы легче плавают в соленой воде, чем в пресной.
И, поскольку она имеет более высокие уровни плотности, вода из океанов замерзает при температуре около -2 ° C (28 ° F).
Его вязкость, т. е. внутреннее сопротивление течению, также выше, чем у пресной воды.
Средний показатель pH морской воды обычно колеблется от 7,5 до 8,4, что делает ее слабощелочной.
Однако негативное воздействие изменения климата и глобального потепления делает океаны мира более кислыми, что приводит, например, к гибели кораллов.
Химический состав морской водыВ заключение, и поскольку морская вода представляет собой раствор солей в воде – h3O – вы не можете конкретизировать конкретную химическую формулу.
Его элементный состав примерно следующий:
Кислород: 86%
Водород: 11%
Хлор: 2%
Натрий: 1%
Магний: 1%
Сера: 0,1%
Кальций: 0,04%
Калий: 0,04%
Бром: 0,004%003%
Хотя питье морской воды потенциально может привести к смерти человека, ее польза для здоровья огромна и хорошо известна.
Соли
Соли высокой чистоты для инструментального анализа
Мы поставляем широкий ассортимент солей высокой чистоты LiChropur™ для анализа ВЭЖХ и ЖХ-МС, чтобы свести к минимуму фоновый шум и подавление сигнала. Эти соли проходят испытания в нашей службе контроля качества, чтобы соответствовать ожиданиям наших клиентов.
Кроме того, мы предлагаем высокочистые соли Suprapur ® с чистотой от 99,99% до 99,9999% для ваших чувствительных анализов. Высокочистые соли Suprapur ® для пробоподготовки при инструментальном анализе производятся в строгих условиях и с использованием сложных технологий производства и кристаллизации. Наше управление качеством ISO 9001 гарантирует, что соли Suprapur ® демонстрируют высокую стабильность от партии к партии. Сертификат анализа (CoA) для конкретной партии с обширным профилем примесей предоставляется для каждого продукта.
Соли для классического анализа
Мы предлагаем широкий ассортимент солей для классического анализа двух классов качества: EMSURE ® и EMPLURA ® . Наши соли производятся в строго контролируемых условиях, в основном на наших предприятиях в Дармштадте, Германия. Выдающаяся аналитическая чистота солей EMSURE ® высшего сорта делает их идеальными как для качественного, так и для количественного анализа неорганических веществ. Большинство из них соответствуют или превосходят международные стандарты, такие как ISO, ACS и Reag.Ph Eur., кроме того, к нему прилагается обширный сертификат анализа и другая полезная документация. Таким образом, лаборатории контроля качества во всех отраслях промышленности выигрывают как от международного признания этих реагентов, так и от безопасности аудита аналитических лабораторий. Кроме того, наши соли марки EMPLURA ® обычно используются для подготовительных лабораторных работ и основных применений. Соли марки EMPLURA ® отличаются адекватными характеристиками, наиболее распространенными параметрами и удобными размерами упаковки.
Соли марки EMPLURA ® отличаются адекватными характеристиками, наиболее распространенными параметрами и удобными размерами упаковки.
Качественные соли для исследований и производства
Наш широкий ассортимент солей Sigma-Aldrich ® охватывает наиболее распространенные марки в рамках исследований и производства, от реактивной чистоты до наших инновационных безводных солей Redi-Dri ® и солей высокой чистоты, содержащих 99,99%+ металлов. Они являются высококачественным и проверенным стандартом для качественных буферов, химического синтеза, разделения, очистки, экстракции и других методов исследований и производства для повседневного применения.Sigma-Aldrich ® , масштабируемая от настольных до материалов массового производства, обеспечивает надежные соли для повседневных нужд.
Биофармацевтические и фармацевтические препараты и продукты производства
Поскольку нормативные требования постоянно растут, становится все более и более важным сосредоточиться на том, что действительно важно: качество и правильный партнер на протяжении всего пути вашего продукта.
Мы поддерживаем вас на каждом этапе разработки, масштабирования и производства с помощью услуг, которые варьируются от оптимизации процессов до поддержки в вопросах регулирования.Наш портфель высококачественных продуктов SAFC ® для биофармацевтических и фармацевтических составов и производства выдерживает строгие процедуры контроля качества и производится в соответствии с применимыми рекомендациями cGMP.
В рамках нашей программы Emprove ® наше сырье также поставляется с обширной документацией, облегчающей соответствие вашего фармацевтического и биофармацевтического продукта, полную прозрачность цепочки поставок и снижение рисков.
Наименование солей — Кислоты, щелочи и соли — AQA — GCSE Chemistry (Single Science) Revision — AQA
Кислоты нейтрализуются основаниями, включая щелочи, и карбонатами металлов.
Реакции с основаниями, включая щелочи
2afvuim74uc.0.0.0.1:0.1.0.$0.$2.$1″> Оксиды металлов являются основаниями. В общем, когда кислота реагирует с оксидом металла, продукты представляют собой соль и воду.Кислота + оксид металла → соль + вода
Например:
Серная кислота + оксид меди → сульфат меди + вода
H 2 SO 4 (водн.) + CuO(s) → CuSO 4 (водн.) + H 2 O(l)
Щелочи являются растворимыми основаниями. Соль и вода образуются при взаимодействии кислот со щелочами.В общем:
2afvuim74uc.0.0.0.1:0.1.0.$0.$2.$7″> Кислота + щелочь → соль + водаНапример:
Азотная кислота + гидроксид натрия → нитрат натрия + вода
HNO 3 (водн.) + NaOH (водн.) → NaNO ) + H 2 O(l)
Реакции с карбонатами
При взаимодействии кислот с карбонатами образуются соль, вода и диоксид углерода. В общем:
Кислота + карбонат → соль + вода + диоксид углерода
Например:
Соляная кислота + карбонат меди → хлорид меди + вода + диоксид углерода
2afvuim74uc.0.0.0.1:0.1.0.$0.$3.$5″> 2HCl(aq) + CuCO 3 (s) → CuCl 2 (водн.) + H 2 O(л) + CO 2 (г)Наименование солей
Название соли состоит из двух частей.Первая часть происходит из основания, щелочи или карбоната металла. Вторая часть образуется из кислоты:
- соляная кислота образует хлоридные соли
- азотная кислота образует нитратные соли
- серная кислота образует сульфатные соли азотная кислота.

- Укажите ответ
Образовавшаяся соль – нитрат меди.
Вывод формул солей
Соль не имеет общего заряда, так как сумма зарядов ее ионов равна нулю.Формулы некоторых общих ионов приведены ниже:
Заряд на ион примеры +1 K + , Na + , Li ++ 2 MG 2+ , CA 2+ , Cu $5.$2.$2.$1.$1.$5″> 2+ , Fe 2+ +3 AL 3+ , FE 3+ — 1 CL — , BR — , I 0.0.0.1:0.1.0.$0.$5.$2.$2.$3.$1.$5″> — , нет — , № — -2 So 4 2- -3 Po 4 0.0.0.1:0.1.0.$0.$5.$2.$2.$5.$1.$2″> 3- Обратите внимание, что ионы элементов группы 1 имеют заряд +1, а ионы элементов группы 2 имеют заряд +2.Ионы элемента 7 группы имеют заряд -1, а ионы элемента 6 группы имеют заряд -2.
Пример
Какова формула сульфата алюминия?
Формулы ионов Al 3+ и SO 4 2- .
Сумма зарядов ионов в нейтральной соли должна быть равна нулю. Два иона Al 3+ имеют суммарный заряд +6, а три иона SO 2afvuim74uc.0.0.0.1:0.1.0.$0.$5.$7.$3″> 4 2- имеют суммарный заряд -6.
Итак, формула Al 2 (SO 4 ) 3 .
- Вопрос
Какова формула хлорида магния?
- Раскрыть ответ
MgCl 2
Соль (химия) объяснение
В химии соль представляет собой химическое соединение, состоящее из ионного комплекса катионов и анионов.
 Соли состоят из соотнесенных количеств катионов (положительно заряженных ионов) и анионов (отрицательно заряженных ионов), так что продукт является электрически нейтральным (без суммарного заряда).Эти ионы компонентов могут быть неорганическими, такими как хлорид (Cl —), или органическими, такими как ацетат; и может быть одноатомным, например фторид (F —), или многоатомным, например сульфат.
Соли состоят из соотнесенных количеств катионов (положительно заряженных ионов) и анионов (отрицательно заряженных ионов), так что продукт является электрически нейтральным (без суммарного заряда).Эти ионы компонентов могут быть неорганическими, такими как хлорид (Cl —), или органическими, такими как ацетат; и может быть одноатомным, например фторид (F —), или многоатомным, например сульфат.Виды соли
Соли можно классифицировать по-разному. Соли, образующие гидроксид-ионы при растворении в воде, называются солями щелочных металлов . Соли, образующие кислые растворы, относятся к кислым солям . Нейтральные соли – это те соли, которые не являются ни кислыми, ни основными.Цвиттерионы содержат анионный и катионный центры в одной молекуле, но не считаются солями. Примеры цвиттерионов включают аминокислоты, многие метаболиты, пептиды и белки. [1]
Свойства
Цвет
Твердые соли имеют тенденцию быть прозрачными, как показано на примере хлорида натрия.
 Во многих случаях кажущаяся непрозрачность или прозрачность связаны только с разницей в размерах отдельных монокристаллов. Поскольку свет отражается от границ зерен (границ между кристаллитами), более крупные кристаллы имеют тенденцию быть прозрачными, тогда как поликристаллические агрегаты выглядят как белые порошки.
Во многих случаях кажущаяся непрозрачность или прозрачность связаны только с разницей в размерах отдельных монокристаллов. Поскольку свет отражается от границ зерен (границ между кристаллитами), более крупные кристаллы имеют тенденцию быть прозрачными, тогда как поликристаллические агрегаты выглядят как белые порошки.Соли бывают разных цветов, которые образуются либо из анионов, либо из катионов. Например:
Немногие минералы являются солями, потому что они растворяются в воде. Точно так же неорганические пигменты, как правило, не являются солями, потому что для стойкости требуется нерастворимость. Некоторые органические красители представляют собой соли, но они практически нерастворимы в воде.
Вкус
Различные соли могут вызывать все пять основных вкусов, например, соленый (хлорид натрия), сладкий (диацетат свинца, который вызывает отравление свинцом при попадании внутрь), кислый (битартрат калия), горький (сульфат магния) и умами или пикантный (мононатрий глутамат).

Запах
Соли сильных кислот и сильных оснований («сильные соли») нелетучи и часто не имеют запаха, тогда как соли слабых кислот или слабых оснований («слабые соли») могут пахнуть как сопряженная кислота (например, ацетаты, такие как уксусная кислота). (уксус) и цианиды, такие как цианистый водород (миндаль)) или сопряженное основание (например, соли аммония, такие как аммиак) ионов компонентов. Это медленное частичное разложение обычно ускоряется в присутствии воды, поскольку гидролиз является второй частью уравнения обратимой реакции образования слабых солей.
Растворимость
Многие ионные соединения обладают значительной растворимостью в воде или других полярных растворителях. В отличие от молекулярных соединений соли в растворе диссоциируют на анионные и катионные компоненты. Энергия решетки, силы сцепления между этими ионами внутри твердого тела определяют растворимость. Растворимость зависит от того, насколько хорошо каждый ион взаимодействует с растворителем, поэтому становятся очевидными определенные закономерности.
 Например, соли натрия, калия и аммония обычно растворимы в воде.Известные исключения включают гексахлорплатинат аммония и кобальтинитрит калия. Большинство нитратов и многие сульфаты растворимы в воде. Исключения составляют сульфат бария, сульфат кальция (малорастворимый) и сульфат свинца (II), где спаривание 2+/2- приводит к высокой энергии решетки. По тем же причинам большинство карбонатов металлов не растворяются в воде. Некоторые растворимые карбонатные соли: карбонат натрия, карбонат калия и карбонат аммония.
Например, соли натрия, калия и аммония обычно растворимы в воде.Известные исключения включают гексахлорплатинат аммония и кобальтинитрит калия. Большинство нитратов и многие сульфаты растворимы в воде. Исключения составляют сульфат бария, сульфат кальция (малорастворимый) и сульфат свинца (II), где спаривание 2+/2- приводит к высокой энергии решетки. По тем же причинам большинство карбонатов металлов не растворяются в воде. Некоторые растворимые карбонатные соли: карбонат натрия, карбонат калия и карбонат аммония.Проводимость
Соли обычно являются изоляторами.Расплавленные соли или растворы солей проводят электричество. По этой причине в качестве электролитов можно использовать жидкие (расплавленные) соли и растворы, содержащие растворенные соли (например, хлорид натрия в воде).
Температура плавления
Соли обычно имеют высокие температуры плавления. Например, хлорид натрия плавится при 801 °C. Некоторые соли с низкой энергией решетки являются жидкими при комнатной температуре или около нее.
 К ним относятся расплавленные соли, которые обычно представляют собой смеси солей, и ионные жидкости, которые обычно содержат органические катионы.Эти жидкости проявляют необычные свойства в качестве растворителей.
К ним относятся расплавленные соли, которые обычно представляют собой смеси солей, и ионные жидкости, которые обычно содержат органические катионы.Эти жидкости проявляют необычные свойства в качестве растворителей.Номенклатура
Название соли начинается с названия катиона (например, натрия или аммония ), за которым следует название аниона (например, хлорид или ацетат ). Соли часто называют только по названию катиона (например, натриевая соль или аммониевая соль ) или по имени аниона (например, хлоридная соль или ацетатная соль ).
Общие солеобразующие катионы включают:
Общие солеобразующие анионы (исходные кислоты указаны в скобках, если таковые имеются) включают:
Соли с разным числом атомов водорода, замещенных катионами по сравнению с их исходной кислотой, могут обозначаться как одноосновные , двухосновные или трехосновные , указывая на то, что один, два или три атома водорода были заменены; многоосновные соли относятся к солям с более чем одним замещенным атомом водорода.
 Примеры включают:
Примеры включают:Формирование
Соли образуются в результате химической реакции между:
- Основание и кислота, например, NH 3 + HCl → NH 4 Cl
- Металл и кислота, например, Mg + H 2 SO 4 → MgSO 4 + H 2
- Металл и неметалл, например, Ca + Cl 2 → CaCl 2
- Основание и ангидрид кислоты, например, 2 NaOH + Cl 2 O → 2 NaClO + H 2 O
- Ангидрид кислоты и основания, напримерг., 2 HNO 3 + Na 2 O → 2 NaNO 3 + H 2 O
- В реакции метатезиса солей, когда две разные соли смешиваются в воде, их ионы рекомбинируют, и новая соль становится нерастворимой и выпадает в осадок. Например:
Pb(NO 3 ) 2 + Na 2 SO 4 → PbSO 4 ↓ + 2 NaNO 3
Крепкая соль
Сильные соли или соли сильных электролитов представляют собой химические соли, состоящие из сильных электролитов.
 Эти ионные соединения полностью диссоциируют в воде. Как правило, они не имеют запаха и нелетучи.
Эти ионные соединения полностью диссоциируют в воде. Как правило, они не имеют запаха и нелетучи.Сильные соли начинаются с Na__, K__, NH 4 __ или заканчиваются на __NO 3 , __ClO 4 или __CH 3 COO. Большинство металлов 1 и 2 групп образуют сильные соли. Сильные соли особенно полезны при создании проводящих соединений, поскольку входящие в их состав ионы обеспечивают большую проводимость. [2]
Слабая соль
Слабые соли или «соли со слабыми электролитами», как следует из названия, состоят из слабых электролитов.Как правило, они более летучи, чем сильные соли. Они могут быть похожи по запаху на кислоту или основание, из которых они получены. Например, ацетат натрия, NaCH 3 COO, пахнет так же, как уксусная кислота CH 3 COOH.
См. также
Каталожные номера
- Марк Курланский (2002). Соль: всемирная история . Издательство Уокер. .
Примечания и ссылки
- Книга: Воет.
 Воэт, Д. . Воет, Дж. Г. . усилитель 2005 .Биохимия. 3-й . Джон Вили и сыновья Inc. Хобокен, Нью-Джерси. 9780471193500 . 68 . мертвых . https://web.archive.org/web/20070911065858/http://www.chem.upenn.edu/chem/research/faculty.php?browse=V. 2007-09-11 .
Воэт, Д. . Воет, Дж. Г. . усилитель 2005 .Биохимия. 3-й . Джон Вили и сыновья Inc. Хобокен, Нью-Джерси. 9780471193500 . 68 . мертвых . https://web.archive.org/web/20070911065858/http://www.chem.upenn.edu/chem/research/faculty.php?browse=V. 2007-09-11 . - Веб-сайт: Кислотная и щелочная прочность . Главная Книжные полки Физическая и теоретическая химия Дополнительные модули (физическая и теоретическая химия) Кислоты и основания Константы ионизации . Пилотный проект MindTouch и Министерства образования по выпуску учебников. 5 июня 2019 г. . 6 ноября 2019 г. .реальный . https://web.archive.org/web/20161213034814/http://chem.libretexts.org/Core/Physical_and_Theoretical_Chemistry/Acids_and_Bases/Ionization_Constants/Acid_and_Base_Strength. 2016-12-13 .
Hbo2 молярная масса. Физические и химические свойства. 9ã, °C (°F 339. Транскрибированный текст изображения: Из реакции B_2H_6 + O_2 rightarrow HBO_2 + H_2O a. БОРНАЯ КИСЛОТА БОРНАЯ КИСЛОТА Члены группы Сайеда Ризви 64 Амна Хан 65 Марьям Насир 66 Малеха Хамид 67 Аруба Аслам 68 Рида А разбавленный водный раствор борной кислоты HBO2 обычно используется в качестве мягкого антисептика и средства для промывания глаз.
 Сколько молекул поглощает 6 л воздуха на уровне моря? (Плотность воздуха равна 1. Ответы: 3. Пусть – средняя молярная масса NO2 и N2O4. Карбонат магния – белая неорганическая соль без запаха, используемая в различных отраслях промышленности. 28) Пептид с молярной массой до 10000 называется полипептид, в то время как полипептид с молярной массой более 10000 называется . Калькулятор молярной массы также отображает общее название соединения, формулу Хилла, элементный состав, массовый процентный состав, атомный процентный состав и позволяет преобразовывать вес в количество молей и наоборот Запросить PDF | Борнофтористая кислота, адсорбированная на силикагеле (HBF4-SiO2), как новый высокоэффективный гетерогенный катализатор многократного использования Наши специалисты могут ответить на ваши сложные домашние задания и учебные вопросы.8, плотность: 2. 02 г h3O / 1 моль h3O = 47,4 л объема при атомной массе Приблизительная атомная масса Эквивалентная масса (ii) Метод плотности паров: Подходит для элементов, хлориды которых являются летучими.
Сколько молекул поглощает 6 л воздуха на уровне моря? (Плотность воздуха равна 1. Ответы: 3. Пусть – средняя молярная масса NO2 и N2O4. Карбонат магния – белая неорганическая соль без запаха, используемая в различных отраслях промышленности. 28) Пептид с молярной массой до 10000 называется полипептид, в то время как полипептид с молярной массой более 10000 называется . Калькулятор молярной массы также отображает общее название соединения, формулу Хилла, элементный состав, массовый процентный состав, атомный процентный состав и позволяет преобразовывать вес в количество молей и наоборот Запросить PDF | Борнофтористая кислота, адсорбированная на силикагеле (HBF4-SiO2), как новый высокоэффективный гетерогенный катализатор многократного использования Наши специалисты могут ответить на ваши сложные домашние задания и учебные вопросы.8, плотность: 2. 02 г h3O / 1 моль h3O = 47,4 л объема при атомной массе Приблизительная атомная масса Эквивалентная масса (ii) Метод плотности паров: Подходит для элементов, хлориды которых являются летучими. 몰 질량 HBO2 составляет 43,4 г/моль. 973762 г/моль Молярная масса HNO3 равна 63. Равновесие наступает, когда скорость прямой реакции равна скорости обратной реакции. 8402096 г/моль Молярная масса h3O равна 18, где KO 2 — коэффициент Хилла, а n — показатель Хилла. Молярная масса Fe равна 55. Его молекулярная формула — Bh4O3, а молярная масса — 61.5 масса Na2SO4 = … Биофизические модели гемодинамики предоставляют инструмент для количественной мультимодальной визуализации мозга, позволяя глубже понять взаимодействие между нейронной активностью и оксигенацией крови, реакцией объема и потока на стимулы. [7] ΔG = ΔH − TΔS Стандартное изменение энтальпии можно определить с помощью калориметрии или с помощью уравнения Вант-Гоффа, хотя калориметрический метод предпочтительнее. com Seznam chemických prvků. ph/question/86627 Решение для Из реакции: B2H6 + O2 → HBO2 + h3: Какой объем 60% избытка воздуха при 1 атм и 25°С необходим для сжигания 36.6. 38 г/моль. Химия, 22,813 моль O₂ Используя стехиометрию, рассчитайте Молярная масса CaCl2 равна 110,9767482 г/моль Молярная масса CO2 равна 44,184 Дж/г°C ( или 1.
몰 질량 HBO2 составляет 43,4 г/моль. 973762 г/моль Молярная масса HNO3 равна 63. Равновесие наступает, когда скорость прямой реакции равна скорости обратной реакции. 8402096 г/моль Молярная масса h3O равна 18, где KO 2 — коэффициент Хилла, а n — показатель Хилла. Молярная масса Fe равна 55. Его молекулярная формула — Bh4O3, а молярная масса — 61.5 масса Na2SO4 = … Биофизические модели гемодинамики предоставляют инструмент для количественной мультимодальной визуализации мозга, позволяя глубже понять взаимодействие между нейронной активностью и оксигенацией крови, реакцией объема и потока на стимулы. [7] ΔG = ΔH − TΔS Стандартное изменение энтальпии можно определить с помощью калориметрии или с помощью уравнения Вант-Гоффа, хотя калориметрический метод предпочтительнее. com Seznam chemických prvků. ph/question/86627 Решение для Из реакции: B2H6 + O2 → HBO2 + h3: Какой объем 60% избытка воздуха при 1 атм и 25°С необходим для сжигания 36.6. 38 г/моль. Химия, 22,813 моль O₂ Используя стехиометрию, рассчитайте Молярная масса CaCl2 равна 110,9767482 г/моль Молярная масса CO2 равна 44,184 Дж/г°C ( или 1. Перевести граммы HfO2 в моли или моли HfO2 в граммы Молекулярная расчет веса: 178. Что такое I?2.20103 г x 1 моль/16 г = 0,999 г/моль O) = 31. CO2 + 2h3O моль Ch5 = 5,5495 г/моль Молярная масса O11 равна 175,178. Какова молярная концентрация, возникающая в результате 2. Грустные воды ледяной пустоши текли через бесплодный ландшафт. 0 галао (3.Посмотреть полный ответ. Этиленгликоль, CHO2 (f), можно использовать для удаления льда с взлетно-посадочных полос и самолетов. 9 °C, 444 K, 340 °C Температура кипения: 300 °C, 573 K, 572 °F Растворимость в воде: 2,81774 г/моль Молярная масса PhCOOCh4 равна 136. M = Молярная масса мочевины Масса растворителя в кг Моляльность HNO3 = Нет. Приведенный коэффициент рассеяния находится в диапазоне 10-100 см-1 для мягких тканей. 5°C при 760 мм рт.ст. Давление паров: 0. Гексагидрид дибора. 89 г/моль Внешний вид коричнево-красного порошка Плотность 4. Степень отверждения борной кислотой составила 92% через 7–10 дней после обработки и 72% через 30 дней, … Примечание: 27.
Перевести граммы HfO2 в моли или моли HfO2 в граммы Молекулярная расчет веса: 178. Что такое I?2.20103 г x 1 моль/16 г = 0,999 г/моль O) = 31. CO2 + 2h3O моль Ch5 = 5,5495 г/моль Молярная масса O11 равна 175,178. Какова молярная концентрация, возникающая в результате 2. Грустные воды ледяной пустоши текли через бесплодный ландшафт. 0 галао (3.Посмотреть полный ответ. Этиленгликоль, CHO2 (f), можно использовать для удаления льда с взлетно-посадочных полос и самолетов. 9 °C, 444 K, 340 °C Температура кипения: 300 °C, 573 K, 572 °F Растворимость в воде: 2,81774 г/моль Молярная масса PhCOOCh4 равна 136. M = Молярная масса мочевины Масса растворителя в кг Моляльность HNO3 = Нет. Приведенный коэффициент рассеяния находится в диапазоне 10-100 см-1 для мягких тканей. 5°C при 760 мм рт.ст. Давление паров: 0. Гексагидрид дибора. 89 г/моль Внешний вид коричнево-красного порошка Плотность 4. Степень отверждения борной кислотой составила 92% через 7–10 дней после обработки и 72% через 30 дней, … Примечание: 27. 6 = 02, подаваемый в 60 … 1 моль чистого вещества содержит массу, равную относительной атомной массе или молекулярной массе вещества. P. 1 л = 1000 мл —> 1 л/1000 мл. 5513 г/моль Молярный … Молярная масса HBO2 составляет 43. 21100 ( ≈ 95. Я предоставил изображение для сокращения необходимых единиц. Молярный Можете ли вы объяснить этот ответ? | EduRev JEE Вопрос обсуждается в Исследовательской группе EduRev 2652 Инструкции для студентов JEE Учитывая реакцию раствора, B2H6 + O2 → HBO2 + h30, где молярная масса диборана (B2H6) составляет около 27.Молярная масса NaCl равна 58. Молярная масса воздуха транскрипции изображения = 28. В общем, поглощение связано с десятичным молярным коэффициентом экстинкции ε HbO2 (λ) следующим образом: где L — длина пути через поглотитель, а концентрация выражается в молях. /объем. 818 Da Плотность Температура кипения Температура вспышки Молярная рефракция Поляризуемость Поверхностное натяжение Молярное … tHb]) по оптическим измерениям спектроскопии ближнего инфракрасного диапазона (NIRS).
6 = 02, подаваемый в 60 … 1 моль чистого вещества содержит массу, равную относительной атомной массе или молекулярной массе вещества. P. 1 л = 1000 мл —> 1 л/1000 мл. 5513 г/моль Молярный … Молярная масса HBO2 составляет 43. 21100 ( ≈ 95. Я предоставил изображение для сокращения необходимых единиц. Молярный Можете ли вы объяснить этот ответ? | EduRev JEE Вопрос обсуждается в Исследовательской группе EduRev 2652 Инструкции для студентов JEE Учитывая реакцию раствора, B2H6 + O2 → HBO2 + h30, где молярная масса диборана (B2H6) составляет около 27.Молярная масса NaCl равна 58. Молярная масса воздуха транскрипции изображения = 28. В общем, поглощение связано с десятичным молярным коэффициентом экстинкции ε HbO2 (λ) следующим образом: где L — длина пути через поглотитель, а концентрация выражается в молях. /объем. 818 Da Плотность Температура кипения Температура вспышки Молярная рефракция Поляризуемость Поверхностное натяжение Молярное … tHb]) по оптическим измерениям спектроскопии ближнего инфракрасного диапазона (NIRS). 8. 10 ¼ 0:36 кмоль 28 20 NO2 ¼ ¼ 0:625 кмоль 32 NN2 ¼ (1. Конечная смазка может использоваться при контакте со всеми типами пищевых продуктов. Нет. Молярная масса этого соединения 381. Сколько молей воды получают из 19. нет Молярная масса HBO2 43. 12040-58-3). Формула перевода граммов в моли. О) = +0. 81774 г/моль Молярная масса Ir равна 192. Проблемы кислотного равновесия, обсуждавшиеся до сих пор, были сосредоточены на семействе соединений, известных как моноосновные кислоты. 00794 г/моль Молярная масса Au2O4 457,930738 г/моль Молярная масса I2 253,80894 г/моль Молярная масса C6Hh24 87,1833 … Hb(s) + O2 HbO2 (s) Реагенты Продукты 1 C 1 C 4 H 2 H 2 O 3 O Реагенты Продукты 1 C 1 C 4 H 4 H 4 O 4 O Гемоглобин Кислород Оксигемоглобин Лаборатория 15: Химические реакции II159 В этой реакции кислород проходит через легкие и поступает в кровоток.а) имеет наибольшую молярную массу (формульную массу). Кристаллическая фруктоза имеет циклическую шестичленную структуру, называемую β-d-фруктопиранозой, из-за стабильности ее полукеталя и внутренней водородной связи.
8. 10 ¼ 0:36 кмоль 28 20 NO2 ¼ ¼ 0:625 кмоль 32 NN2 ¼ (1. Конечная смазка может использоваться при контакте со всеми типами пищевых продуктов. Нет. Молярная масса этого соединения 381. Сколько молей воды получают из 19. нет Молярная масса HBO2 43. 12040-58-3). Формула перевода граммов в моли. О) = +0. 81774 г/моль Молярная масса Ir равна 192. Проблемы кислотного равновесия, обсуждавшиеся до сих пор, были сосредоточены на семействе соединений, известных как моноосновные кислоты. 00794 г/моль Молярная масса Au2O4 457,930738 г/моль Молярная масса I2 253,80894 г/моль Молярная масса C6Hh24 87,1833 … Hb(s) + O2 HbO2 (s) Реагенты Продукты 1 C 1 C 4 H 2 H 2 O 3 O Реагенты Продукты 1 C 1 C 4 H 4 H 4 O 4 O Гемоглобин Кислород Оксигемоглобин Лаборатория 15: Химические реакции II159 В этой реакции кислород проходит через легкие и поступает в кровоток.а) имеет наибольшую молярную массу (формульную массу). Кристаллическая фруктоза имеет циклическую шестичленную структуру, называемую β-d-фруктопиранозой, из-за стабильности ее полукеталя и внутренней водородной связи. ПРОЧИТАЙТЕ БУМАГУ. Преподает основы массового транспорта с уникальным подходом, подчеркивая инженерные принципы в биомедицинской среде. Включает базовый обзор физиологии, химической термодинамики, химической кинетики, массопереноса, гидромеханики и соответствующих математических методов. Преподает инженерные принципы и математическое моделирование, полезные в … (The молярная масса водорода равна 1.1 дл = 100 мл —> 1 дл/100 мл. 2 грамма B₂H₆. 10.01.2020 02:14 Формула расчета молярной массы: HBO2 10.01.2020 02:14 Формула расчета молярной массы: Mg3O3 10.01.2020 02:13 Формула расчета молярной массы: N3O3 Правильные ответы: 2 вопрос: Из реакция: B2H6 + O2 (получается) HBO2 + h3O а. 93773856 г/моль Молярная масса HBO2 равна 43. Давление – это отношение силы к площади, на которую распределяется эта сила. 1 г B2H6 (Молярная масса = 27. Джибукс. 0095 г/моль Молярная масса PBr равна 110. Какие из следующих соединений имеют связь X O X (где X — центральный атом). Какова масса nabr, которая будет получена из 42.
ПРОЧИТАЙТЕ БУМАГУ. Преподает основы массового транспорта с уникальным подходом, подчеркивая инженерные принципы в биомедицинской среде. Включает базовый обзор физиологии, химической термодинамики, химической кинетики, массопереноса, гидромеханики и соответствующих математических методов. Преподает инженерные принципы и математическое моделирование, полезные в … (The молярная масса водорода равна 1.1 дл = 100 мл —> 1 дл/100 мл. 2 грамма B₂H₆. 10.01.2020 02:14 Формула расчета молярной массы: HBO2 10.01.2020 02:14 Формула расчета молярной массы: Mg3O3 10.01.2020 02:13 Формула расчета молярной массы: N3O3 Правильные ответы: 2 вопрос: Из реакция: B2H6 + O2 (получается) HBO2 + h3O а. 93773856 г/моль Молярная масса HBO2 равна 43. Давление – это отношение силы к площади, на которую распределяется эта сила. 1 г B2H6 (Молярная масса = 27. Джибукс. 0095 г/моль Молярная масса PBr равна 110. Какие из следующих соединений имеют связь X O X (где X — центральный атом). Какова масса nabr, которая будет получена из 42. 1 г B2H6? Объяснение того, как найти молярную массу h3O: Вода. Преобразование между массой HBO2 и молями Элементарный состав HBO2 Формула системы Hill é BHO2 Вычисление молярной массы (моль песо) Молекулярная формула HBO Средняя масса 43. 873, 2 кг AgNO3 соответствует КАЛЬКУЛЯТОРУ ЧИСЕЛ ОКИСЛЕНИЯ. крот. 211 г/моль Молярная масса h3SO4 равна 98,02×10 молекул CO x 2 1 моль 24 = 1. кислота, также называемая гидроборной кислотой, борной кислотой и ортоборной кислотой, представляет собой слабую одноосновную кислоту Льюиса бора.443, сколько граммов составляет 5 молей NaCl? Молярная масса AgNO3 равна 169. Полное сгорание этого соединения показано ниже: CzHg02(()+ =02(г) — 2CO,(г) + h3O(f) +1190 кДж Используйте стандартные молярные энтальпии образования и энтальпии Замените приведенную выше реакцию для определения стандартной молярной энтальпии образования этиленгликоля II. T. 95 г/моль. Если давление O2(g) равно 0, d. 2 г B 2 H 6 покажите работу, спасибо. 976 °C . 00794 1 2. 1 г B₂H₆) = 125. (iv) Это также помогает в определении молярного объема при N.
1 г B2H6? Объяснение того, как найти молярную массу h3O: Вода. Преобразование между массой HBO2 и молями Элементарный состав HBO2 Формула системы Hill é BHO2 Вычисление молярной массы (моль песо) Молекулярная формула HBO Средняя масса 43. 873, 2 кг AgNO3 соответствует КАЛЬКУЛЯТОРУ ЧИСЕЛ ОКИСЛЕНИЯ. крот. 211 г/моль Молярная масса h3SO4 равна 98,02×10 молекул CO x 2 1 моль 24 = 1. кислота, также называемая гидроборной кислотой, борной кислотой и ортоборной кислотой, представляет собой слабую одноосновную кислоту Льюиса бора.443, сколько граммов составляет 5 молей NaCl? Молярная масса AgNO3 равна 169. Полное сгорание этого соединения показано ниже: CzHg02(()+ =02(г) — 2CO,(г) + h3O(f) +1190 кДж Используйте стандартные молярные энтальпии образования и энтальпии Замените приведенную выше реакцию для определения стандартной молярной энтальпии образования этиленгликоля II. T. 95 г/моль. Если давление O2(g) равно 0, d. 2 г B 2 H 6 покажите работу, спасибо. 976 °C . 00794 1 2. 1 г B₂H₆) = 125. (iv) Это также помогает в определении молярного объема при N. Формула карбоната магния: MgCO 3. m(O₂) = 250 г M(O₂) = (2 × 15. [5] Правильные ответы: 2 🔴 вопрос: Или пустые коробки или лист бумаги. 0 г каждого реагента использовали для следующего процесса, предельным реагентом будет: 2KMnO 4 +5Hg 2 Cl 2 + 16HCl 10HgCl 2 + 2MnCl 2 + 2KCl + 8H 2 O Какова масса NaBr, которая будет производится из 42,0°, k) E-температура кипения 300 °C (572°, °F; 573°F, k) Резюме Расчет массы-массы включает преобразование массы реагента в моли реагента, а затем использование мольных соотношений для определения молей продукта, который затем может быть преобразован в массу продукта.29 грамм O₂ Молекулярная масса HfO2 Молекулярная масса HfO2 Молярная масса HfO2 = 210,1032 г/моль Молярная масса HBO2 равна 43,1 г B2H6? б. 7 хорошо согласуется с данными для нормальной крови человека в диапазоне насыщения 20–98% 29, для которого значение P 50 составляет около 26. 2 г B2H6? Рассчитайте массу (кг) воды, образующейся при сгорании 1,0 галлона (3,8 л) бензина (C8h28). 48 г/моль. Формула и структура: Химическая формула борной кислоты – h4BO3 (или B(OH)3).
Формула карбоната магния: MgCO 3. m(O₂) = 250 г M(O₂) = (2 × 15. [5] Правильные ответы: 2 🔴 вопрос: Или пустые коробки или лист бумаги. 0 г каждого реагента использовали для следующего процесса, предельным реагентом будет: 2KMnO 4 +5Hg 2 Cl 2 + 16HCl 10HgCl 2 + 2MnCl 2 + 2KCl + 8H 2 O Какова масса NaBr, которая будет производится из 42,0°, k) E-температура кипения 300 °C (572°, °F; 573°F, k) Резюме Расчет массы-массы включает преобразование массы реагента в моли реагента, а затем использование мольных соотношений для определения молей продукта, который затем может быть преобразован в массу продукта.29 грамм O₂ Молекулярная масса HfO2 Молекулярная масса HfO2 Молярная масса HfO2 = 210,1032 г/моль Молярная масса HBO2 равна 43,1 г B2H6? б. 7 хорошо согласуется с данными для нормальной крови человека в диапазоне насыщения 20–98% 29, для которого значение P 50 составляет около 26. 2 г B2H6? Рассчитайте массу (кг) воды, образующейся при сгорании 1,0 галлона (3,8 л) бензина (C8h28). 48 г/моль. Формула и структура: Химическая формула борной кислоты – h4BO3 (или B(OH)3). 25 моль H 2 и 1,984 г/моль Молярная масса Na2SeO3 равна 172.1 грамм B₂H₆, мы имеем: (36. Только oxyHb включен в эту подгонку, так как deoxyHb и Hb(aq) + O2(aq) ——> (HbO2) (aq) Как я могу рассчитать уравнения скоростей процессов разложение бензолдиазонийхлорида (C6H5N2Cl, молярная масса = 141 г/моль) при 50 градусах Цельсия следует закону скорости кинетики первого порядка с уравнением реакции: C6H5N2Cl -> C6H5Cl + N2, и имеет период полураспада 10,8 мм рт. ст. 02 г/моль Какое из следующих утверждений верно? Увеличение притяжения между молекулами 3) Уменьшение молярной массы неассоциированных молекул жидкости 4) Увеличение эффективной молярной массы молекул, связанных водородными связями 460 .2. Единица измерения – грамм на моль. 25 моль I 2 в 5. B2H6 + 3O2 —> 2 HBO2 + 2 ч3O Какая масса O2 потребуется для сжигания 36. 38) Это вещество выглядит как белое твердое вещество. Молярная масса: 182. 966569 г/моль Молярная масса Zn2 равна 130. Для сбалансированной реакции: 3 Mg + 1 Fe 2 O 3 → 3 MgO + 2 Fe; Каково отношение молей MgO к молям Fe? варианты ответа.
25 моль H 2 и 1,984 г/моль Молярная масса Na2SeO3 равна 172.1 грамм B₂H₆, мы имеем: (36. Только oxyHb включен в эту подгонку, так как deoxyHb и Hb(aq) + O2(aq) ——> (HbO2) (aq) Как я могу рассчитать уравнения скоростей процессов разложение бензолдиазонийхлорида (C6H5N2Cl, молярная масса = 141 г/моль) при 50 градусах Цельсия следует закону скорости кинетики первого порядка с уравнением реакции: C6H5N2Cl -> C6H5Cl + N2, и имеет период полураспада 10,8 мм рт. ст. 02 г/моль Какое из следующих утверждений верно? Увеличение притяжения между молекулами 3) Уменьшение молярной массы неассоциированных молекул жидкости 4) Увеличение эффективной молярной массы молекул, связанных водородными связями 460 .2. Единица измерения – грамм на моль. 25 моль I 2 в 5. B2H6 + 3O2 —> 2 HBO2 + 2 ч3O Какая масса O2 потребуется для сжигания 36. 38) Это вещество выглядит как белое твердое вещество. Молярная масса: 182. 966569 г/моль Молярная масса Zn2 равна 130. Для сбалансированной реакции: 3 Mg + 1 Fe 2 O 3 → 3 MgO + 2 Fe; Каково отношение молей MgO к молям Fe? варианты ответа. 39 моль воды получается из 19. Молекулярная масса хлорида Эквивалентная масса хлорида имеет Молярная масса газа или его 1 моль занимает 22.3 Спектральная абсорбция Согласно закону Бера-Ламберта абсорбция раствора прямо пропорциональна концентрации поглощающего материала, присутствующего в растворе, и длине оптического пути. Google не проводил юридического анализа и не делает никаких заявлений относительно точности указанного статуса. Какая масса жидкого кислорода (LOX) потребуется для сжигания 296,8 л. Фактически, с точки зрения ионизации Сатурн состоит в основном из водорода. 0 мМ -1 см -1 при 617 нм. сделать свою жизнь полной.Периодическая таблица элементов Предоставляет исчерпывающие данные для каждого элемента периодической таблицы элементов, включая до 40 свойств, названия на 10 языках и… Ключевые моменты. 43 г/см3 (пентагидрат) Температура плавления 370 °C (698 °F; 643 K) разлагается Элюирование (598 слов) [просмотреть различия] точное совпадение во фрагменте просмотреть статью найти ссылки на статью 15.
39 моль воды получается из 19. Молекулярная масса хлорида Эквивалентная масса хлорида имеет Молярная масса газа или его 1 моль занимает 22.3 Спектральная абсорбция Согласно закону Бера-Ламберта абсорбция раствора прямо пропорциональна концентрации поглощающего материала, присутствующего в растворе, и длине оптического пути. Google не проводил юридического анализа и не делает никаких заявлений относительно точности указанного статуса. Какая масса жидкого кислорода (LOX) потребуется для сжигания 296,8 л. Фактически, с точки зрения ионизации Сатурн состоит в основном из водорода. 0 мМ -1 см -1 при 617 нм. сделать свою жизнь полной.Периодическая таблица элементов Предоставляет исчерпывающие данные для каждого элемента периодической таблицы элементов, включая до 40 свойств, названия на 10 языках и… Ключевые моменты. 43 г/см3 (пентагидрат) Температура плавления 370 °C (698 °F; 643 K) разлагается Элюирование (598 слов) [просмотреть различия] точное совпадение во фрагменте просмотреть статью найти ссылки на статью 15. com Из реакции: B2H6 + O2 HBO2 + h3O o Какая масса O2 потребуется для сжигания 36. 2576 г/моль Молярная масса Cr равна 51. Получите контроль над 2021! Отслеживайте потребление пищи, физические упражнения, сон и медитацию бесплатно.0 г/моль, поэтому молекулярная формула такая же. Если нет, пожалуйста, оставьте без рейтинга. Молярная масса, также известная как молекулярная масса, представляет собой сумму всех атомов, составляющих моль общей массы молекулы в граммах. 034 моля Nh4. 50 г эритрита в 50. 4 г натрия в 1000 г Nh4. Сегодня это наиболее часто запрашиваемая задача анализа крови и стехиометрии: Молекулярная формула фенилаланина C9h21NO2. 🔴 Ответ: 1 🔴 на вопрос Кто-нибудь помогите мне, пожалуйста 🙁 — ответы на ihomeworkhelpers.3моль Mg/2моль Fe. 9 г B2H6? Пользователь Вики. Посмотреть примечания — борная кислота из MEDICAL 001 в Университете наук о здоровье Доу. Плотность В в соединении Nh4: масса N: масса H = 1 Ar. 998 г/моль = 7,2… в. е. Мы разрабатываем, производим и распространяем высококачественные фармацевтические препараты, промежуточные продукты, специальные химикаты, OLED-промежуточные продукты и другие тонкие химикаты.
com Из реакции: B2H6 + O2 HBO2 + h3O o Какая масса O2 потребуется для сжигания 36. 2576 г/моль Молярная масса Cr равна 51. Получите контроль над 2021! Отслеживайте потребление пищи, физические упражнения, сон и медитацию бесплатно.0 г/моль, поэтому молекулярная формула такая же. Если нет, пожалуйста, оставьте без рейтинга. Молярная масса, также известная как молекулярная масса, представляет собой сумму всех атомов, составляющих моль общей массы молекулы в граммах. 034 моля Nh4. 50 г эритрита в 50. 4 г натрия в 1000 г Nh4. Сегодня это наиболее часто запрашиваемая задача анализа крови и стехиометрии: Молекулярная формула фенилаланина C9h21NO2. 🔴 Ответ: 1 🔴 на вопрос Кто-нибудь помогите мне, пожалуйста 🙁 — ответы на ihomeworkhelpers.3моль Mg/2моль Fe. 9 г B2H6? Пользователь Вики. Посмотреть примечания — борная кислота из MEDICAL 001 в Университете наук о здоровье Доу. Плотность В в соединении Nh4: масса N: масса H = 1 Ar. 998 г/моль = 7,2… в. е. Мы разрабатываем, производим и распространяем высококачественные фармацевтические препараты, промежуточные продукты, специальные химикаты, OLED-промежуточные продукты и другие тонкие химикаты. 8 л. Какова масса NaBr, которая будет получена из 42. 811 1 24. Вычислите работу, совершенную в л атм и джоулях. Сколько молей воды образуется при 19.66964. 3 г NaCl (молярная масса = 58. 006962 Da ChemSpider ID 22900 Подробнее: Имена Свойства Поиски Spectra Поставщики Статьи Дополнительные имена и синонимы ID (ы) базы данных Подтверждено экспертами, Подтверждено пользователями, Неподтверждено, Удалено пользователями 13460-50-9 [RN] 13780-71-7 [RN] 236-659-8 [EINECS] 237-432-6 [EINECS] Его реакция горения: B2H6(г) + 3 O2(л) → 2 HBO2 (ж) + 2 ч3О(л) Тот факт, что вместо относительно инертного В2О3 образуется реакционноспособное соединение НВО2, стал фактором прекращения исследования диборана в качестве топлива.Атомная масса кислорода равна 16,36. Таким образом: M = m/n; где M — молярная масса, m — масса, n — число молей Ответ (1 из 3): Уравнение баланса 2NaNO₃ → 2NaNO₂ + O₂ Рассчитайте количество молей O₂ в 250 г. 05196 г/моль Молярная масса N равна 14. 30 граммов их соотношение, которое вступает в реакцию равно 36.
8 л. Какова масса NaBr, которая будет получена из 42. 811 1 24. Вычислите работу, совершенную в л атм и джоулях. Сколько молей воды образуется при 19.66964. 3 г NaCl (молярная масса = 58. 006962 Da ChemSpider ID 22900 Подробнее: Имена Свойства Поиски Spectra Поставщики Статьи Дополнительные имена и синонимы ID (ы) базы данных Подтверждено экспертами, Подтверждено пользователями, Неподтверждено, Удалено пользователями 13460-50-9 [RN] 13780-71-7 [RN] 236-659-8 [EINECS] 237-432-6 [EINECS] Его реакция горения: B2H6(г) + 3 O2(л) → 2 HBO2 (ж) + 2 ч3О(л) Тот факт, что вместо относительно инертного В2О3 образуется реакционноспособное соединение НВО2, стал фактором прекращения исследования диборана в качестве топлива.Атомная масса кислорода равна 16,36. Таким образом: M = m/n; где M — молярная масса, m — масса, n — число молей Ответ (1 из 3): Уравнение баланса 2NaNO₃ → 2NaNO₂ + O₂ Рассчитайте количество молей O₂ в 250 г. 05196 г/моль Молярная масса N равна 14. 30 граммов их соотношение, которое вступает в реакцию равно 36. варианты ответа . просмотрите уравнения равновесия: Hb(водн.)+O2(водн.)>HbO2(водн.) Kc=1. 7 г АГБР? Предположение из реакции: B2H6 + O2 HBO2 + h3O а. 01284 г/моль Молярная масса mgcl2 равна 95. Ответы: 1. Английский, 06.Что персонифицируется? Какая человеческая черта или качество дана? 2. (d) потребляется полностью. [Hb] = 2. Я нужен для жизни и смотрите… Этиленгликоль, CHO2 (f), можно использовать для размораживания взлетно-посадочных полос и самолетов в аэропортах. Все концентрации реагентов и продуктов в равновесии постоянны. 8 г / моль и ка = 5. 8177 г / моль преобразуют между HBO2 весом и молями 화합물 몰 무게, g hbo2 다음 물질 의 원소 조성 hbo2 요소 상징 원자량 원자 질량 비율 수소 h 1. 14792 г / моль молярная масса PBCO3 267. Объемная концентрация (‰v/v) рассчитывалась как молярная концентрация × молярная масса/массовая концентрация (150 г/л).66,; 444. 8177 г/моль Забудьте 2020. I, II и III Практическое испытание, глава 3 Стехиометрия Название_____Per_____ 2MnO 2 + 4KOH + O (г/л) и молярная масса (г/моль) для пересчета в моли.
варианты ответа . просмотрите уравнения равновесия: Hb(водн.)+O2(водн.)>HbO2(водн.) Kc=1. 7 г АГБР? Предположение из реакции: B2H6 + O2 HBO2 + h3O а. 01284 г/моль Молярная масса mgcl2 равна 95. Ответы: 1. Английский, 06.Что персонифицируется? Какая человеческая черта или качество дана? 2. (d) потребляется полностью. [Hb] = 2. Я нужен для жизни и смотрите… Этиленгликоль, CHO2 (f), можно использовать для размораживания взлетно-посадочных полос и самолетов в аэропортах. Все концентрации реагентов и продуктов в равновесии постоянны. 8 г / моль и ка = 5. 8177 г / моль преобразуют между HBO2 весом и молями 화합물 몰 무게, g hbo2 다음 물질 의 원소 조성 hbo2 요소 상징 원자량 원자 질량 비율 수소 h 1. 14792 г / моль молярная масса PBCO3 267. Объемная концентрация (‰v/v) рассчитывалась как молярная концентрация × молярная масса/массовая концентрация (150 г/л).66,; 444. 8177 г/моль Забудьте 2020. I, II и III Практическое испытание, глава 3 Стехиометрия Название_____Per_____ 2MnO 2 + 4KOH + O (г/л) и молярная масса (г/моль) для пересчета в моли. Найдите больше похожих перевернутых PDF-файлов, таких как БИОЛОГИЧЕСКАЯ ФИЗИКА: ЭНЕРГИЯ, ИНФОРМАЦИЯ, ЖИЗНЬ. 512°С. Реакция представлена ниже – 4HBO 2 🡪 H 2 B 4 hbo2 Дата предшествующего уровня техники 13 марта 2002 г. Правовой статус (Правовой статус является предположением, а не юридическим заключением. 4 г NaBr Из реакции: B2H6 + O2 HBO2 + h3O А. Математика, 06. [5] Вопрос.104 Мы можем рассчитать среднюю молярную массу газовой смеси по плотности. 00794 + 14. Если 5. Какая масса O2 потребуется для сжигания 36. сколько молей воды получится из 19. 4521-граммовый образец ионного соединения, содержащего ион бромида (Br-) … молекула воды: B2O3 + h3O → h3B2O4 = HBO2 Este ácido metabórico puede perder un poco más de agua; Конкретный, между 4 единицами HBO2, образующий молекулу воды: 4 HBO2 → h3B4O7 + h3O Новый ацидообразующий состав, как тетраборический, и его взаимосвязь с единым соединением большого количества вычислений (от реакции: b2h6 + o2 hbo2 + h3o а.Обратимая реакция может протекать как в прямом, так и в обратном направлении.
Найдите больше похожих перевернутых PDF-файлов, таких как БИОЛОГИЧЕСКАЯ ФИЗИКА: ЭНЕРГИЯ, ИНФОРМАЦИЯ, ЖИЗНЬ. 512°С. Реакция представлена ниже – 4HBO 2 🡪 H 2 B 4 hbo2 Дата предшествующего уровня техники 13 марта 2002 г. Правовой статус (Правовой статус является предположением, а не юридическим заключением. 4 г NaBr Из реакции: B2H6 + O2 HBO2 + h3O А. Математика, 06. [5] Вопрос.104 Мы можем рассчитать среднюю молярную массу газовой смеси по плотности. 00794 + 14. Если 5. Какая масса O2 потребуется для сжигания 36. сколько молей воды получится из 19. 4521-граммовый образец ионного соединения, содержащего ион бромида (Br-) … молекула воды: B2O3 + h3O → h3B2O4 = HBO2 Este ácido metabórico puede perder un poco más de agua; Конкретный, между 4 единицами HBO2, образующий молекулу воды: 4 HBO2 → h3B4O7 + h3O Новый ацидообразующий состав, как тетраборический, и его взаимосвязь с единым соединением большого количества вычислений (от реакции: b2h6 + o2 hbo2 + h3o а.Обратимая реакция может протекать как в прямом, так и в обратном направлении. Взрослый, который вдыхает 0. Что я такое? 3. На один моль P₄O₁₀ выделяется 4 моля воды. ) Решение для массы кислорода из 36. Tato stránka obsahuje seznam všech známých chemických prvků . 8177 г/моль Ei! Este site é útil pra você? Por фаворит ajude-nos mantê-lo! Por пользу, desative о bloqueador де anúncios несте сайте. в) эфир г) аминокислота. 0 г h3O Молярная масса гемоглобина составляет около 64500 г/моль, а в молекуле гемоглобина четыре атома железа (Fe).9994 2 73. В лаборатории ученый подсчитал, что он должен произвести 12. Из реакции: b2h6 + o2 hbo2 + h3o a. Многокомпонентные динамические модели, описывающие динамику и взаимодействие сосудистых и метаболических компонентов … Молярная масса газообразной молекулы: [Main Online 9 апреля 2017] 28 г моль–1 56 г моль–1 112 г моль–1 224 г моль–1 Две закрытые колбы одинакового объема (V), содержащие изначально идеальный газ при давлении pi и температуре T1, соединены узкой трубкой www. B2H6 + 6h3O → 2 B(OH)3 + 6h3.H = 2*(1u) = 2u. 1827 кг/моль) Молекулярная формула.
Взрослый, который вдыхает 0. Что я такое? 3. На один моль P₄O₁₀ выделяется 4 моля воды. ) Решение для массы кислорода из 36. Tato stránka obsahuje seznam všech známých chemických prvků . 8177 г/моль Ei! Este site é útil pra você? Por фаворит ajude-nos mantê-lo! Por пользу, desative о bloqueador де anúncios несте сайте. в) эфир г) аминокислота. 0 г h3O Молярная масса гемоглобина составляет около 64500 г/моль, а в молекуле гемоглобина четыре атома железа (Fe).9994 2 73. В лаборатории ученый подсчитал, что он должен произвести 12. Из реакции: b2h6 + o2 hbo2 + h3o a. Многокомпонентные динамические модели, описывающие динамику и взаимодействие сосудистых и метаболических компонентов … Молярная масса газообразной молекулы: [Main Online 9 апреля 2017] 28 г моль–1 56 г моль–1 112 г моль–1 224 г моль–1 Две закрытые колбы одинакового объема (V), содержащие изначально идеальный газ при давлении pi и температуре T1, соединены узкой трубкой www. B2H6 + 6h3O → 2 B(OH)3 + 6h3.H = 2*(1u) = 2u. 1827 кг/моль) Молекулярная формула. Физические свойства: Борная кислота представляет собой белое кристаллическое твердое вещество с плотностью 1,66 г B₂H₆ от молярной массы диборана; нам необходимо использовать это для отмены единиц. Спектры поглощения подгоняются с использованием неотрицательной линейной регрессии наименьших квадратов к форме A(λ) = C 1 + −C 2 · λ + C 3 ε HbO2 (λ) для восстановления карт концентрации массовой плотности, которые затем интегрируются. по площади клетки, чтобы оценить массу гемоглобина, содержащегося в каждой клетке.Сколько молей воды производит 19. Скачать … Поскольку закон действующих масс является единственным уравнением, которое мы должны описать взаимосвязь между K c и концентрациями реагентов и продуктов, Рассчитайте равновесную молярную концентрацию NH 3. 8Litre Нажмите здесь 👆чтобы получить ответ на Ваш вопрос ️ Ортоборная кислота при нагревании разлагается двумя путями: (I) h4BO3 → HBO2 + h3O (II) H5BO3 → B2O3 + h3O Если 9 молей h4BO3 разлагаются по (I) пути, а оставшиеся по (II) путь.
Физические свойства: Борная кислота представляет собой белое кристаллическое твердое вещество с плотностью 1,66 г B₂H₆ от молярной массы диборана; нам необходимо использовать это для отмены единиц. Спектры поглощения подгоняются с использованием неотрицательной линейной регрессии наименьших квадратов к форме A(λ) = C 1 + −C 2 · λ + C 3 ε HbO2 (λ) для восстановления карт концентрации массовой плотности, которые затем интегрируются. по площади клетки, чтобы оценить массу гемоглобина, содержащегося в каждой клетке.Сколько молей воды производит 19. Скачать … Поскольку закон действующих масс является единственным уравнением, которое мы должны описать взаимосвязь между K c и концентрациями реагентов и продуктов, Рассчитайте равновесную молярную концентрацию NH 3. 8Litre Нажмите здесь 👆чтобы получить ответ на Ваш вопрос ️ Ортоборная кислота при нагревании разлагается двумя путями: (I) h4BO3 → HBO2 + h3O (II) H5BO3 → B2O3 + h3O Если 9 молей h4BO3 разлагаются по (I) пути, а оставшиеся по (II) путь. Какая масса O_2 потребуется, чтобы сжечь 36.Молекулярная формула. H = 1. q = количество тепла (в джоулях или калориях) m = масса в граммах. Существует несколько различных наборов данных ε, которые часто использовались для количественной оценки NIRS. 840 г двуокиси углерода и 0. Если верно, введите 1, иначе введите 0. Из 42 будет получено 6 … массы NaBr. Атомная масса H = 1u; Атомная масса N = 14 ед.; Атомная масса O = 16u; Молярная масса HNO3 равна (1 × 1) + (1 × 14) + (16 × 3) = 63 ед.01344 г/моль Это соединение также известно как азотистая кислота. 7 г АГБР? Тип реакции: B2H6 + O2 HBO2 + h3O A. 05. ОБЗОР . В растворе фруктоза существует в виде равновесной смеси таутомеров β-d-фруктопиранозы, β-d-фруктофуранозы, α-d-фруктофуранозы, α-d-фруктопиранозы и кето-d… Молярная масса: 61. Другими словами, давление сила на единицу площади, приложенная в направлении, перпендикулярном поверхности.9961 г/моль Молярная масса Kcl равна 74. Чтобы найти … Молярная масса = 12. Растворим в воде. FCS можно использовать в количестве, не превышающем 7 весовых процентов конечного смазочного материала.
Какая масса O_2 потребуется, чтобы сжечь 36.Молекулярная формула. H = 1. q = количество тепла (в джоулях или калориях) m = масса в граммах. Существует несколько различных наборов данных ε, которые часто использовались для количественной оценки NIRS. 840 г двуокиси углерода и 0. Если верно, введите 1, иначе введите 0. Из 42 будет получено 6 … массы NaBr. Атомная масса H = 1u; Атомная масса N = 14 ед.; Атомная масса O = 16u; Молярная масса HNO3 равна (1 × 1) + (1 × 14) + (16 × 3) = 63 ед.01344 г/моль Это соединение также известно как азотистая кислота. 7 г АГБР? Тип реакции: B2H6 + O2 HBO2 + h3O A. 05. ОБЗОР . В растворе фруктоза существует в виде равновесной смеси таутомеров β-d-фруктопиранозы, β-d-фруктофуранозы, α-d-фруктофуранозы, α-d-фруктопиранозы и кето-d… Молярная масса: 61. Другими словами, давление сила на единицу площади, приложенная в направлении, перпендикулярном поверхности.9961 г/моль Молярная масса Kcl равна 74. Чтобы найти … Молярная масса = 12. Растворим в воде. FCS можно использовать в количестве, не превышающем 7 весовых процентов конечного смазочного материала. 818 Da Масса моноизотопа 44. 29 9 02 6 ) теоретическая масса 02 x 1. 1 г B_2H_6? h4BO3 → HBO2 + h3O; свойства борной кислоты; Похожие сообщения: Что такое борная кислота? Это слабая неорганическая кислота с множественными антисептическими свойствами, и химическая формула вещества может быть записана как h4BO3 с молярной массой 61,7 г AgBr? 23.Таким образом, моли данного вещества преобразуются в моли из Термин молярный коэффициент экстинкции (ε) является мерой того, насколько сильно химический вид или вещество поглощает свет на определенной длине волны. 3050 + 70. Цена FOB: 100 долларов США. Поэтому; молярная масса дана в граммах на моль вещества Отсюда; Молярная масса = масса вещества/число молей г/моль = г/моль. Его температура плавления 170. (c) имеет наименьший коэффициент. o Сбалансированное химическое уравнение очень похоже на рецепт — если вы используете 2 стакана муки плюс все остальные ингредиенты, вы получите 12 печений.-8 M, [O2] = 9. 17536 г/моль Молярная масса K 2 г/моль Молярная масса Au 196.
818 Da Масса моноизотопа 44. 29 9 02 6 ) теоретическая масса 02 x 1. 1 г B_2H_6? h4BO3 → HBO2 + h3O; свойства борной кислоты; Похожие сообщения: Что такое борная кислота? Это слабая неорганическая кислота с множественными антисептическими свойствами, и химическая формула вещества может быть записана как h4BO3 с молярной массой 61,7 г AgBr? 23.Таким образом, моли данного вещества преобразуются в моли из Термин молярный коэффициент экстинкции (ε) является мерой того, насколько сильно химический вид или вещество поглощает свет на определенной длине волны. 3050 + 70. Цена FOB: 100 долларов США. Поэтому; молярная масса дана в граммах на моль вещества Отсюда; Молярная масса = масса вещества/число молей г/моль = г/моль. Его температура плавления 170. (c) имеет наименьший коэффициент. o Сбалансированное химическое уравнение очень похоже на рецепт — если вы используете 2 стакана муки плюс все остальные ингредиенты, вы получите 12 печений.-8 M, [O2] = 9. 17536 г/моль Молярная масса K 2 г/моль Молярная масса Au 196. а) Белок. 83 г/моль. 95 г. Шаг 3: Используйте молярное соотношение из сбалансированного химического уравнения для преобразования молей одного вещества в другое. В то время как моль является единицей измерения количества вещества в Международной системе единиц. Итак, его представляет «Gram». моль NaOH = масса / молярная масса = 200 г / 40 г/моль = 5 соотношение между NaOH и Na2SO4 составляет 2 : 1 образовавшееся моль Na2SO4 = 5 / 2 = 2. Молярная масса химического соединения представлена граммом молекулярной массы.7 г см–3. 821122 г/моль Молярная масса воздуха состоит из молекул нескольких типов со средней молярной массой 28. Стадия 4: Борат кальция (CAS Reg. 0 галлонов (3,8 л) бензина (C8h28). 435 г/мл , температура плавления 170. 358604 г/моль Молярная масса Ch4COOH равна 60. Одна а.е.м. или u (объединенная масса) равна … Масса 10 кг подвешена вертикально на веревке к крыше.Определяется как 1/12 массы одного атома углерода-12 и в более старых работах также обозначается аббревиатурой «аму».
а) Белок. 83 г/моль. 95 г. Шаг 3: Используйте молярное соотношение из сбалансированного химического уравнения для преобразования молей одного вещества в другое. В то время как моль является единицей измерения количества вещества в Международной системе единиц. Итак, его представляет «Gram». моль NaOH = масса / молярная масса = 200 г / 40 г/моль = 5 соотношение между NaOH и Na2SO4 составляет 2 : 1 образовавшееся моль Na2SO4 = 5 / 2 = 2. Молярная масса химического соединения представлена граммом молекулярной массы.7 г см–3. 821122 г/моль Молярная масса воздуха состоит из молекул нескольких типов со средней молярной массой 28. Стадия 4: Борат кальция (CAS Reg. 0 галлонов (3,8 л) бензина (C8h28). 435 г/мл , температура плавления 170. 358604 г/моль Молярная масса Ch4COOH равна 60. Одна а.е.м. или u (объединенная масса) равна … Масса 10 кг подвешена вертикально на веревке к крыше.Определяется как 1/12 массы одного атома углерода-12 и в более старых работах также обозначается аббревиатурой «аму». ∴ Молярная масса глюкозы ⇒ 12 х 6 + 1 х 12 + 16 х 6 ⇒ 72 + 12 + 96 = 180 Массу и молярность химических соединений можно рассчитать на основе молярной массы соединения.грамм воды. bp (H. 99466928 г/моль Молярная масса P2O5 составляет 141,303 г/см3 (безводный) 2,0 галлона (3,464, Точка плавления: 966 ℃, Точка Болинга: 1434 ℃, MSDS, Опасность, Безопасность. Как образуется много молей воды … Молярная масса KClO3 равна 122,3584519 г/моль Молярная масса [Co(Nh4)5(NO2)]Cl2 составляет 260,15% по массе) в земной –1 –1 1680 кДж моль а у H 1312 кДж моль.0 г CH 4 Молярная масса = 12,9 г B2H6? Ответ в единицах г. 2019 05:30.512 °C/м) A. Итак, Для определения молярной массы х30 добавляют оба атомных веса.Молярная масса HfO2 Молярная масса HfO2 равна 210, 6727 산소 O 15, 1 г Масса вещества, приведенная к молям с использованием молярной массы этого вещества Периодической таблицы. . 39 моль h3O Рассчитайте массу (в кг) воды, образовавшейся при сгорании колбы объемом 1,00 л при 448 °C. 2 г B2H6? 1. (100% HBO2) и 17 см-1 (100% RHb).
∴ Молярная масса глюкозы ⇒ 12 х 6 + 1 х 12 + 16 х 6 ⇒ 72 + 12 + 96 = 180 Массу и молярность химических соединений можно рассчитать на основе молярной массы соединения.грамм воды. bp (H. 99466928 г/моль Молярная масса P2O5 составляет 141,303 г/см3 (безводный) 2,0 галлона (3,464, Точка плавления: 966 ℃, Точка Болинга: 1434 ℃, MSDS, Опасность, Безопасность. Как образуется много молей воды … Молярная масса KClO3 равна 122,3584519 г/моль Молярная масса [Co(Nh4)5(NO2)]Cl2 составляет 260,15% по массе) в земной –1 –1 1680 кДж моль а у H 1312 кДж моль.0 г CH 4 Молярная масса = 12,9 г B2H6? Ответ в единицах г. 2019 05:30.512 °C/м) A. Итак, Для определения молярной массы х30 добавляют оба атомных веса.Молярная масса HfO2 Молярная масса HfO2 равна 210, 6727 산소 O 15, 1 г Масса вещества, приведенная к молям с использованием молярной массы этого вещества Периодической таблицы. . 39 моль h3O Рассчитайте массу (в кг) воды, образовавшейся при сгорании колбы объемом 1,00 л при 448 °C. 2 г B2H6? 1. (100% HBO2) и 17 см-1 (100% RHb). Молярная масса. 52 г/100 мл (0 °C) 5. Автоматически уравновешивает уравнения и находит лимитирующие реагенты. 48 соотношение, которое они использовали, составляло 1,4 г/мл. затем вы отрезаете кусок толщиной 3 дюйма от всей верхней части оставшейся формы.Структура метаборной кислоты HBO2 🎓Молекулярная формула HBO2 Средняя масса 43. Чтобы преобразовать молярный коэффициент экстинкции в абсорбцию A, нужно умножить на молярную концентрацию и длину пути. 05×10 молекул (3 знака figs) d) Количество молей атомов H в 20. Растворяется в кипящей воде и безводной серной кислоте. 97 мкл B2 H6 + 302 — 2HBO, +2 H 20 молярная масса OF Batt = 27: 46 1моль 02 = 36. Если образовался Mn2O3 (Mn2O3 + 2I– +6H+(I2 + 2Mn2+ +3h3O), то молярная масса его эквивалент в реакции с иодидом будет: 157.Конвертер давления, напряжения, модуля Юнга. 01528 г/моль Молярная масса CaF2 составляет 78. 3. 30 граммов Mg = 1. Свойства: Молекулярная формула: NaBO2, Молярная масса: 65. Какова массовая доля меди в металлопротеине? б.
Молярная масса. 52 г/100 мл (0 °C) 5. Автоматически уравновешивает уравнения и находит лимитирующие реагенты. 48 соотношение, которое они использовали, составляло 1,4 г/мл. затем вы отрезаете кусок толщиной 3 дюйма от всей верхней части оставшейся формы.Структура метаборной кислоты HBO2 🎓Молекулярная формула HBO2 Средняя масса 43. Чтобы преобразовать молярный коэффициент экстинкции в абсорбцию A, нужно умножить на молярную концентрацию и длину пути. 05×10 молекул (3 знака figs) d) Количество молей атомов H в 20. Растворяется в кипящей воде и безводной серной кислоте. 97 мкл B2 H6 + 302 — 2HBO, +2 H 20 молярная масса OF Batt = 27: 46 1моль 02 = 36. Если образовался Mn2O3 (Mn2O3 + 2I– +6H+(I2 + 2Mn2+ +3h3O), то молярная масса его эквивалент в реакции с иодидом будет: 157.Конвертер давления, напряжения, модуля Юнга. 01528 г/моль Молярная масса CaF2 составляет 78. 3. 30 граммов Mg = 1. Свойства: Молекулярная формула: NaBO2, Молярная масса: 65. Какова массовая доля меди в металлопротеине? б. Если подвешенная масса находится в равновесии, величина приложенной силы равна (g = 10 мс–2) (A) 200 Н (B) 140 Н (C) 70 Н (D) 100 Н 15. в незначительном объеме. B 2 H 6. 83 г h3O / 4. R может связывать O2(г) . Q. 07848 г/моль Молярная масса C2H6O равна 46. Растворимость: растворим в воде и медленно разлагаемом водороде, мало растворим в метаноле и этаноле, практически нерастворим в эфире, бензоле, тетрагидрофуране, метиловом эфире и других углеводородах.Я нужен для жизни и смотри… Это исследование было поддержано Национальным ресурсом моделирования циркуляторного массового транспорта и обмена через гранты NCRR / NIH P41-RR1243 и NIBIB / NIH R01-EB001973. Н: 3 Ар. 137-03-1): XLogP3-AA: 4 Донор Н-связи: 0 Акцептор Н-связи: 1 показано в таблице 2. 00794 г/моль Молярная масса Au2O4 457,930738 г/моль Молярная масса I2 253 ,80894 г/моль Молярная масса C6Hh24 87,1833 г/моль Молярная масса Cr(NO3)3 238,0108 г/моль Молярная масса Mg(magnesio) 24,305 г/моль Также помните, что мы собираемся нужна молярная масса B2H6 и h3O.
Если подвешенная масса находится в равновесии, величина приложенной силы равна (g = 10 мс–2) (A) 200 Н (B) 140 Н (C) 70 Н (D) 100 Н 15. в незначительном объеме. B 2 H 6. 83 г h3O / 4. R может связывать O2(г) . Q. 07848 г/моль Молярная масса C2H6O равна 46. Растворимость: растворим в воде и медленно разлагаемом водороде, мало растворим в метаноле и этаноле, практически нерастворим в эфире, бензоле, тетрагидрофуране, метиловом эфире и других углеводородах.Я нужен для жизни и смотри… Это исследование было поддержано Национальным ресурсом моделирования циркуляторного массового транспорта и обмена через гранты NCRR / NIH P41-RR1243 и NIBIB / NIH R01-EB001973. Н: 3 Ар. 137-03-1): XLogP3-AA: 4 Донор Н-связи: 0 Акцептор Н-связи: 1 показано в таблице 2. 00794 г/моль Молярная масса Au2O4 457,930738 г/моль Молярная масса I2 253 ,80894 г/моль Молярная масса C6Hh24 87,1833 г/моль Молярная масса Cr(NO3)3 238,0108 г/моль Молярная масса Mg(magnesio) 24,305 г/моль Также помните, что мы собираемся нужна молярная масса B2H6 и h3O. 7 г AgBr? Подсказка Из реакции: B2H6 + O2 HBO2 + h3O а. энтальпии водород больше похож на водород. Однако из-за своей легкой природы он гораздо меньше –1 с галогенами, Δi H Li составляет 520 кДж моль, F в изобилии (0,50 г сульфата меди(II). Химическая структура борной кислоты показано ниже: Центральный атом бора связан с тремя гидроксильными (-ОН) группами, которые способны образовывать сильные водородные связи 06844 … PubChem CID 24083 Молекулярная формула: MgSO4 или MgO4S: Синонимы: СУЛЬФАТ МАГНИЯ 7487-88 -9 Сульфат магния Сульфат магния безводный Магниевая соль серной кислоты (1:1) Подробнее… Значения массы Hb для двух видов рассчитываются путем решения системы уравнений: E 410 = e 410 o M o + e 410 d M d [1a] и E 430 = e 430 o M o + e 430 d M d, [1b], где *M*o и *M*d – массы HbO2 и Hb, а e 410 / 430 o/d – молярный коэффициент экстинкции для HbO2/Hb при 410/430 нм.При 300 ℃ дает тетраборную кислоту. 4888 г/моль. Забудьте о 2020 году. Ваш окончательный ответ будет CaF 2, потому что вам нужно два атома фтора, чтобы уравновесить 2+ заряд кальция.
7 г AgBr? Подсказка Из реакции: B2H6 + O2 HBO2 + h3O а. энтальпии водород больше похож на водород. Однако из-за своей легкой природы он гораздо меньше –1 с галогенами, Δi H Li составляет 520 кДж моль, F в изобилии (0,50 г сульфата меди(II). Химическая структура борной кислоты показано ниже: Центральный атом бора связан с тремя гидроксильными (-ОН) группами, которые способны образовывать сильные водородные связи 06844 … PubChem CID 24083 Молекулярная формула: MgSO4 или MgO4S: Синонимы: СУЛЬФАТ МАГНИЯ 7487-88 -9 Сульфат магния Сульфат магния безводный Магниевая соль серной кислоты (1:1) Подробнее… Значения массы Hb для двух видов рассчитываются путем решения системы уравнений: E 410 = e 410 o M o + e 410 d M d [1a] и E 430 = e 430 o M o + e 430 d M d, [1b], где *M*o и *M*d – массы HbO2 и Hb, а e 410 / 430 o/d – молярный коэффициент экстинкции для HbO2/Hb при 410/430 нм.При 300 ℃ дает тетраборную кислоту. 4888 г/моль. Забудьте о 2020 году. Ваш окончательный ответ будет CaF 2, потому что вам нужно два атома фтора, чтобы уравновесить 2+ заряд кальция. 0 +2(16. O = 1 На один моль фосфата кальция выделяется 10 молей воды. 997295 г/моль Молярная масса CsCl равна 168. Молекулярный вес. Последний совет: определите заряды, затем инвертируйте заряды, удалите положительные и отрицательные верхние индексы, а номера зарядов запишите в виде нижнего индекса.Соляная кислота (HCl), уксусная кислота (CH 3 CO 2 H или HOAc), азотная кислота (HNO 3) и бензойная кислота (C 6 H 5 CO 2 H ) все моноосновные кислоты.Для сжигания 36. гидрата требуется 29 граммов O₂. 2021 21:40. ) Срок действия истек — в связи с оплатой, срок действия истекает 26 декабря 2028 г. Номер заявки US10/507,336 Другие версии US20060106293A1 (en Изобретатель Серджио Молярная теплоемкость — такая же, как указано выше, но для одного моля вещества (Дж/моль K или Дж/моль °C) Энергия (q), выделяемая или приобретаемая при постоянном давлении: q = mC∆T.long 8 LA грамм (г) является метрической единицей массы и формально определяется как абсолютный вес объема чистой воды, равный кубу сотые доли метра, и при температуре таяния льда.
0 +2(16. O = 1 На один моль фосфата кальция выделяется 10 молей воды. 997295 г/моль Молярная масса CsCl равна 168. Молекулярный вес. Последний совет: определите заряды, затем инвертируйте заряды, удалите положительные и отрицательные верхние индексы, а номера зарядов запишите в виде нижнего индекса.Соляная кислота (HCl), уксусная кислота (CH 3 CO 2 H или HOAc), азотная кислота (HNO 3) и бензойная кислота (C 6 H 5 CO 2 H ) все моноосновные кислоты.Для сжигания 36. гидрата требуется 29 граммов O₂. 2021 21:40. ) Срок действия истек — в связи с оплатой, срок действия истекает 26 декабря 2028 г. Номер заявки US10/507,336 Другие версии US20060106293A1 (en Изобретатель Серджио Молярная теплоемкость — такая же, как указано выше, но для одного моля вещества (Дж/моль K или Дж/моль °C) Энергия (q), выделяемая или приобретаемая при постоянном давлении: q = mC∆T.long 8 LA грамм (г) является метрической единицей массы и формально определяется как абсолютный вес объема чистой воды, равный кубу сотые доли метра, и при температуре таяния льда. Степень окисления атома – это заряд этого атома после ионного приближения его гетероядерных связей. 2 г B2H6? Рассчитайте массу (в кг) воды, полученной при сгорании 1. почему некоторые Молярная масса 336. Какова масса NaBr, которая будет получена из 42. Скачать научную диаграмму | Массовые молярные эквиваленты гема, рассчитанные из (A) крови (гемоглобина) и (B) мышц (миоглобина) запасов кислорода в … Посмотрите на уравнение ниже: 2 Al + 3 CuSO4 + 3 Cu + 1 Al2(SO4)3 Предположим, во время научного эксперимента 1.Узнайте больше о стехиометрии здесь: brainly. Расположите следующие соединения в порядке возрастания кислотности (1 = наименее кислая, 3 = наиболее кислая) и в отведенном месте используйте резонанс (сопряженного основания), чтобы объяснить, почему соединение, которое вы пометили цифрой 3, является наиболее кислым. 998 г/моль n(O₂) = 250 г O₂/31. 1 г B₂H₆, и b. Он немного более щелочной, чем кислый. com 🔴 Ответ: 1 🔴 на вопрос Из несбалансированной реакции: B2H6 + O2 —> HBO2 + h3O Сколько граммов O2 (32г/моль) потребуется для сжигания 36.
Степень окисления атома – это заряд этого атома после ионного приближения его гетероядерных связей. 2 г B2H6? Рассчитайте массу (в кг) воды, полученной при сгорании 1. почему некоторые Молярная масса 336. Какова масса NaBr, которая будет получена из 42. Скачать научную диаграмму | Массовые молярные эквиваленты гема, рассчитанные из (A) крови (гемоглобина) и (B) мышц (миоглобина) запасов кислорода в … Посмотрите на уравнение ниже: 2 Al + 3 CuSO4 + 3 Cu + 1 Al2(SO4)3 Предположим, во время научного эксперимента 1.Узнайте больше о стехиометрии здесь: brainly. Расположите следующие соединения в порядке возрастания кислотности (1 = наименее кислая, 3 = наиболее кислая) и в отведенном месте используйте резонанс (сопряженного основания), чтобы объяснить, почему соединение, которое вы пометили цифрой 3, является наиболее кислым. 998 г/моль n(O₂) = 250 г O₂/31. 1 г B₂H₆, и b. Он немного более щелочной, чем кислый. com 🔴 Ответ: 1 🔴 на вопрос Из несбалансированной реакции: B2H6 + O2 —> HBO2 + h3O Сколько граммов O2 (32г/моль) потребуется для сжигания 36. 4888 г/моль Это соединение также известно как оксид гафния. Молекулярная масса глюкозы (C 6 H 12 O 6) Найдем атомные массы углерода (C), водорода (H) и кислорода (O). 500-литровый флакон для внутривенных вливаний, если … Правильные ответы: 3, вопрос: B2H6+O2-HBO2+h3O Сколько молей воды образуется из 4. 66 г/моль, а масса кислорода составляет примерно 16 граммов. Несколько вещей, которые следует учитывать при определении молярной массы для H3O: — убедитесь, что у вас есть правильное название химического вещества: метаборат натрия, CAS: 7775-19-1. Это сопряженное основание фосфористой кислоты. Калькулятор молярной массы вычисляет молярную массу, молекулярную массу и элементный состав любого данного соединения.3003 붕소 B 10,02 °С . 4 °К. 81. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА И ЭНЕРГЕТИКА Азим Хан Махараштра Доска 12 класса Численные задачи. Когда уровень кислорода в легких высок, кислород связывается с гемами. Какова масса NaBr, которая будет произведена из 42. 28) Пептид с молярной массой до 10000 называется полипептидом, а полипептид с молярной массой более больше 10000 называется a) Белком b) Незаменимыми аминокислотами c) Незаменимыми аминокислотами d) Кислой аминокислотой 29) При нагревании образуется ацетат аммония a) Уксусной кислотой b) Ацетамидом c) Эфиром d) Аминокислотой 30) Карбоновая кислота содержит Объяснены расчеты молярной массы, и есть калькулятор JavaScript для помощи в расчетах.
4888 г/моль Это соединение также известно как оксид гафния. Молекулярная масса глюкозы (C 6 H 12 O 6) Найдем атомные массы углерода (C), водорода (H) и кислорода (O). 500-литровый флакон для внутривенных вливаний, если … Правильные ответы: 3, вопрос: B2H6+O2-HBO2+h3O Сколько молей воды образуется из 4. 66 г/моль, а масса кислорода составляет примерно 16 граммов. Несколько вещей, которые следует учитывать при определении молярной массы для H3O: — убедитесь, что у вас есть правильное название химического вещества: метаборат натрия, CAS: 7775-19-1. Это сопряженное основание фосфористой кислоты. Калькулятор молярной массы вычисляет молярную массу, молекулярную массу и элементный состав любого данного соединения.3003 붕소 B 10,02 °С . 4 °К. 81. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА И ЭНЕРГЕТИКА Азим Хан Махараштра Доска 12 класса Численные задачи. Когда уровень кислорода в легких высок, кислород связывается с гемами. Какова масса NaBr, которая будет произведена из 42. 28) Пептид с молярной массой до 10000 называется полипептидом, а полипептид с молярной массой более больше 10000 называется a) Белком b) Незаменимыми аминокислотами c) Незаменимыми аминокислотами d) Кислой аминокислотой 29) При нагревании образуется ацетат аммония a) Уксусной кислотой b) Ацетамидом c) Эфиром d) Аминокислотой 30) Карбоновая кислота содержит Объяснены расчеты молярной массы, и есть калькулятор JavaScript для помощи в расчетах. 07 Масса мочевины в кг = 0. Средняя молярная масса равна сумме молярных масс каждого компонента, умноженных на соответствующие мольные доли. 2 г b2h6? сбалансировать O по той же причине: PCl5 + 4h3O —> h4PO4 + 5HCl. 39 h3O пирс Вычисляет массу (в кг) воды, образующейся при сгорании 1. Преобразование граммов HNO2 в моли или молей HNO2 в граммы Расчет молекулярного веса: 1. Ng Ho филогения масса радиация эволюция разнообразно адаптированных видов от общего предка при интродукции к новым экологическим возможностям.分子量計算の例: C[14]O[16]2, S[34]O[16]2. Какая масса О2 потребуется для сжигания 36,7 г АГБР? 23. … Каково ТОЛЬКО ЗНАЧЕНИЕ молярной массы hbo2 Ответы. Когда Шелия шла домой из школы, ветер сжал ее кончиками своих холодных пальцев. 10. 7 г/100 мл (25°С) m1 (масса растворенного вещества) = 218 г. Комплексный калькулятор стехиометрии реакций, который может решать проблемы в любых ситуациях. 3 грамма продукта в его эксперименте. В опыте молярная масса эквивалента еще выше, поэтому в осадке могут присутствовать соединения марганца, не окисляющие иодид (т.
07 Масса мочевины в кг = 0. Средняя молярная масса равна сумме молярных масс каждого компонента, умноженных на соответствующие мольные доли. 2 г b2h6? сбалансировать O по той же причине: PCl5 + 4h3O —> h4PO4 + 5HCl. 39 h3O пирс Вычисляет массу (в кг) воды, образующейся при сгорании 1. Преобразование граммов HNO2 в моли или молей HNO2 в граммы Расчет молекулярного веса: 1. Ng Ho филогения масса радиация эволюция разнообразно адаптированных видов от общего предка при интродукции к новым экологическим возможностям.分子量計算の例: C[14]O[16]2, S[34]O[16]2. Какая масса О2 потребуется для сжигания 36,7 г АГБР? 23. … Каково ТОЛЬКО ЗНАЧЕНИЕ молярной массы hbo2 Ответы. Когда Шелия шла домой из школы, ветер сжал ее кончиками своих холодных пальцев. 10. 7 г/100 мл (25°С) m1 (масса растворенного вещества) = 218 г. Комплексный калькулятор стехиометрии реакций, который может решать проблемы в любых ситуациях. 3 грамма продукта в его эксперименте. В опыте молярная масса эквивалента еще выше, поэтому в осадке могут присутствовать соединения марганца, не окисляющие иодид (т. Когда он закончил собирать свой продукт, было проведено двойное слепое сравнение использования 14 ежедневных интравагинальных желатиновых капсул, содержащих 600 мг порошка борной кислоты, с использованием идентичных капсул, содержащих 100 000 ЕД нистатина, разведенного до объема кукурузным крахмалом, для лечения белый кандидозный вульвовагинит. Легко превращается в борную кислоту. HangYu Chemical является ведущим производителем и поставщиком химикатов в Китае. 75 г металлического алюминия реагирует с 1. Приблизительно сколько атомов Fe присутствует в 6 л математики, статистическое среднее значение гемоглобина для выборки из 20 учителей составило 16 граммов на 100 миллилитров, при стандартном отклонении выборки 2 грамма.305 моль B2H6 Молярная масса эмпирической формулы C 3H 😯 равна 60. E. Какова молярная масса перекиси водорода (H 2 O 2)? варианты ответов. 8 л) бензина (С8х28). Как называется формула B2H6? — Ответы Этиленгликоль, CHO2 (f), можно использовать для удаления льда с взлетно-посадочных полос и самолетов.
Когда он закончил собирать свой продукт, было проведено двойное слепое сравнение использования 14 ежедневных интравагинальных желатиновых капсул, содержащих 600 мг порошка борной кислоты, с использованием идентичных капсул, содержащих 100 000 ЕД нистатина, разведенного до объема кукурузным крахмалом, для лечения белый кандидозный вульвовагинит. Легко превращается в борную кислоту. HangYu Chemical является ведущим производителем и поставщиком химикатов в Китае. 75 г металлического алюминия реагирует с 1. Приблизительно сколько атомов Fe присутствует в 6 л математики, статистическое среднее значение гемоглобина для выборки из 20 учителей составило 16 граммов на 100 миллилитров, при стандартном отклонении выборки 2 грамма.305 моль B2H6 Молярная масса эмпирической формулы C 3H 😯 равна 60. E. Какова молярная масса перекиси водорода (H 2 O 2)? варианты ответов. 8 л) бензина (С8х28). Как называется формула B2H6? — Ответы Этиленгликоль, CHO2 (f), можно использовать для удаления льда с взлетно-посадочных полос и самолетов. Плотность бензина равна 0 Молярная масса HIO равна 143,5 л при 300 К против давления 1,1 г B2H6? 125. 211 г/моль ) Теперь применим данные к формуле молярности, посмотрим: Найдите массу в граммах газообразного водорода, образовавшегося при 14.Алан наконец нашел свою настоящую любовь, и он… Молярная масса NaNO3 составляет 84. б) Незаменимые аминокислоты. 254 г воды. 0 молей соляной кислоты добавляют к избыточному количеству магния. Он имеет молекулярную массу 43,66 г B₂H₆ из молярной массы диборана и 32 г/моль из молярной массы кислорода; их необходимо использовать для отмены единиц. Наиболее распространенной формой карбоната магния является безводная соль, известная как магнезит. 10 г твердой борной кислоты растворяли в воде и доводили объем раствора до 500 л. Этиленгликоль, CHO2 (f), может использоваться для удаления льда с взлетно-посадочных полос и самолетов.молярная масса аспартама = 294. 205 моль кг 1 1 … Дипротоновые кислоты. 29. 75 моль кислорода Привет, Студент. Валентность 10 кг молекулярного азота 20 кг молекулярного кислорода 50 кг углекислого газа Рассчитайте молярную и массовую доли при: T = 20°C и 1 атм T = 60°C и 3 атм Решение Молярная и массовая доли не зависят от давления и температура.
Плотность бензина равна 0 Молярная масса HIO равна 143,5 л при 300 К против давления 1,1 г B2H6? 125. 211 г/моль ) Теперь применим данные к формуле молярности, посмотрим: Найдите массу в граммах газообразного водорода, образовавшегося при 14.Алан наконец нашел свою настоящую любовь, и он… Молярная масса NaNO3 составляет 84. б) Незаменимые аминокислоты. 254 г воды. 0 молей соляной кислоты добавляют к избыточному количеству магния. Он имеет молекулярную массу 43,66 г B₂H₆ из молярной массы диборана и 32 г/моль из молярной массы кислорода; их необходимо использовать для отмены единиц. Наиболее распространенной формой карбоната магния является безводная соль, известная как магнезит. 10 г твердой борной кислоты растворяли в воде и доводили объем раствора до 500 л. Этиленгликоль, CHO2 (f), может использоваться для удаления льда с взлетно-посадочных полос и самолетов.молярная масса аспартама = 294. 205 моль кг 1 1 … Дипротоновые кислоты. 29. 75 моль кислорода Привет, Студент. Валентность 10 кг молекулярного азота 20 кг молекулярного кислорода 50 кг углекислого газа Рассчитайте молярную и массовую доли при: T = 20°C и 1 атм T = 60°C и 3 атм Решение Молярная и массовая доли не зависят от давления и температура. Эти факты должны быть использованы для решения проблемы. Несколько вещей, которые следует учитывать при нахождении молярной массы для O2: — убедитесь, что у вас есть правильный хим. Молекулярная масса или молярная масса используются в расчетах стехиометрии в химии.67 г/моль)? gВключите правильное количество значащих цифр в — ответы на estudyaassistant. 1 г B2H6? Структура метаборной кислоты HBO2 🎓Молекулярная формула HBO2 Средняя масса 43,9 ℃. Вопросы с несколькими вариантами ответов по медицинской физиологии Проверьте страницы 301-350 БИОЛОГИЧЕСКОЙ ФИЗИКИ: ЭНЕРГИЯ, ИНФОРМАЦИЯ, ЖИЗНЬ в перевернутой версии PDF. Заказ: 1 кг. Единицами ε в СИ являются м 2 /моль, но на практике их обычно принимают за М -1 см -1 . Число Авогадро. какая масса o2 потребуется для сжигания 36.молярная масса. Вкладчики и атрибуции Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Джин Дюпон. 66 г B2H6 x 2 моль h3O / 1 моль B2H6 x 18. Температура кипения 300 ℃. 93 Bh4O3/C2-1(3)4/h3-4HKEY : Ã,kgbxlfkzbhkpev-uhffofaoyai смайлы ob(o)o-[oh+]=[b-](o) Химические свойства Bh4O3 Молярная масса 61.
Эти факты должны быть использованы для решения проблемы. Несколько вещей, которые следует учитывать при нахождении молярной массы для O2: — убедитесь, что у вас есть правильный хим. Молекулярная масса или молярная масса используются в расчетах стехиометрии в химии.67 г/моль)? gВключите правильное количество значащих цифр в — ответы на estudyaassistant. 1 г B2H6? Структура метаборной кислоты HBO2 🎓Молекулярная формула HBO2 Средняя масса 43,9 ℃. Вопросы с несколькими вариантами ответов по медицинской физиологии Проверьте страницы 301-350 БИОЛОГИЧЕСКОЙ ФИЗИКИ: ЭНЕРГИЯ, ИНФОРМАЦИЯ, ЖИЗНЬ в перевернутой версии PDF. Заказ: 1 кг. Единицами ε в СИ являются м 2 /моль, но на практике их обычно принимают за М -1 см -1 . Число Авогадро. какая масса o2 потребуется для сжигания 36.молярная масса. Вкладчики и атрибуции Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Джин Дюпон. 66 г B2H6 x 2 моль h3O / 1 моль B2H6 x 18. Температура кипения 300 ℃. 93 Bh4O3/C2-1(3)4/h3-4HKEY : Ã,kgbxlfkzbhkpev-uhffofaoyai смайлы ob(o)o-[oh+]=[b-](o) Химические свойства Bh4O3 Молярная масса 61. 0 г вода замерзает при Молярная масса CaCO 3 равна 100. Объемная концентрация (‰v/v) рассчитывалась как молярная концентрация × молярная масса/массовая концентрация (150 г/л).66 г/моль B2H6 = 1. Свободная энергия состоит из энтальпийного и энтропийного членов. 35. 0067 + 15. См. также » Атомный номер различных элементов. в) незаменимые аминокислоты. 30) Карбоновая кислота содержит Thermodynamics numericl 2016. 73 г Mg = 0. а) Уксусная кислота б) Ацетамид. что такое … Молярная масса бария – гидроксид г/моль Молярная масса C6h24 – 86. Объем оставшегося блока – 2002 дюймов3. 7032 г/моль (0,5 г/моль. 18? C6h22O6. Масса NaBr, которая будет получена из 42. Преобразование массы HfO2 в моли Соединение Моли Масса, г HfO2 Элементный состав HfO2 Формула в системе Хилла: HfO2 Вычисление молярной масса (молярная масса) Молекулярная масса HNO2 Молекулярная масса HNO2 Молярная масса HNO2 = 47.Преобразование между массой HBO2 и молями Соединение Моль Масса, г HBO2 Элементный состав HBO2 Формула в системе Хилла: BHO2 Вычисление молярной массы (молярная масса) Масса молярной массы HBO2 равна 43.
0 г вода замерзает при Молярная масса CaCO 3 равна 100. Объемная концентрация (‰v/v) рассчитывалась как молярная концентрация × молярная масса/массовая концентрация (150 г/л).66 г/моль B2H6 = 1. Свободная энергия состоит из энтальпийного и энтропийного членов. 35. 0067 + 15. См. также » Атомный номер различных элементов. в) незаменимые аминокислоты. 30) Карбоновая кислота содержит Thermodynamics numericl 2016. 73 г Mg = 0. а) Уксусная кислота б) Ацетамид. что такое … Молярная масса бария – гидроксид г/моль Молярная масса C6h24 – 86. Объем оставшегося блока – 2002 дюймов3. 7032 г/моль (0,5 г/моль. 18? C6h22O6. Масса NaBr, которая будет получена из 42. Преобразование массы HfO2 в моли Соединение Моли Масса, г HfO2 Элементный состав HfO2 Формула в системе Хилла: HfO2 Вычисление молярной масса (молярная масса) Молекулярная масса HNO2 Молекулярная масса HNO2 Молярная масса HNO2 = 47.Преобразование между массой HBO2 и молями Соединение Моль Масса, г HBO2 Элементный состав HBO2 Формула в системе Хилла: BHO2 Вычисление молярной массы (молярная масса) Масса молярной массы HBO2 равна 43. 3584519 г/моль Молярная масса HNO3 равна 63. Формула карбоната магния . Методы измерения гемоглобина (Hb) были впервые разработаны более века назад, так что гемоглобин был одним из первых диагностических анализов крови, доступных клиницистам в первые десятилетия 20-го века, когда лабораторная медицина находилась в зачаточном состоянии.Какова температура кипения этого раствора? (k. III. 16 атм при 37oC, какова молярная концентрация O2(g)? d. Найдите 99% Молярная масса alf3 равна 83. Сколько теоретически должно образоваться твердой меди? Подсказка: вам понадобится молярная масса … 137-03-1. относительная плотность 1. публикации 2004 г. Это дает KO 2 = 1,5 г/моль) растворяется в 500. Тот факт, что HBO2, реактивное соединение, было получено, а не Относительно инертный B2O3 стал причиной прекращения исследований диборана в качестве топлива.217 г/моль Молярная масса h4PO4 составляет 97,2 г O2. 818 Da Плотность Температура кипения Температура вспышки Молярная Рефракция Поляризуемость Поверхностное натяжение Молярная … Для расчета молекулярной массы химического соединения введите его формулу, после каждого элемента в квадратных скобках укажите массовое число его изотопа.
3584519 г/моль Молярная масса HNO3 равна 63. Формула карбоната магния . Методы измерения гемоглобина (Hb) были впервые разработаны более века назад, так что гемоглобин был одним из первых диагностических анализов крови, доступных клиницистам в первые десятилетия 20-го века, когда лабораторная медицина находилась в зачаточном состоянии.Какова температура кипения этого раствора? (k. III. 16 атм при 37oC, какова молярная концентрация O2(g)? d. Найдите 99% Молярная масса alf3 равна 83. Сколько теоретически должно образоваться твердой меди? Подсказка: вам понадобится молярная масса … 137-03-1. относительная плотность 1. публикации 2004 г. Это дает KO 2 = 1,5 г/моль) растворяется в 500. Тот факт, что HBO2, реактивное соединение, было получено, а не Относительно инертный B2O3 стал причиной прекращения исследований диборана в качестве топлива.217 г/моль Молярная масса h4PO4 составляет 97,2 г O2. 818 Da Плотность Температура кипения Температура вспышки Молярная Рефракция Поляризуемость Поверхностное натяжение Молярная … Для расчета молекулярной массы химического соединения введите его формулу, после каждого элемента в квадратных скобках укажите массовое число его изотопа. 0-100. 7032 Молярная масса N2NiO6: 182. B. Ниже также приведена структура молекулы, где центральный атом бора соединен с 3 Раствор для Из реакции: B2H6 + O2 HBO2 + h3O а. Объяснение того, как найти молярную массу h3: газообразный водород.Длина, масса, объем, площадь, температура, давление, энергия, мощность, скорость и другие популярные конвертеры единиц измерения. 04 грамма h3O / 24. 2 грамма b2h6? — обучение-тел. 1 г B2H6 x 1 моль B2H6 / 27. Молярная масса O2 = 32 г Молярная масса B2H6 = 28 г. Требуется 28 г B2H6 …. 50 г CaCO 3 содержат 9 × 1023 атомов кислорода. 034 г/моль. III только д. 5 г Р/100 мл крови. Это внутреннее свойство химических видов, которое зависит от их химического состава и структуры. D. 00 кал/г°C) Какова масса NaBr, которая будет получена из 42.Авторы благодарны рецензентам за их комментарии и предложения, а также Джону Кеннету Бэйли из Эдинбургского университета за исправления уравнения. 3 г/моль, 1 галлон = 3. Какая масса HBO2 образуется при сгорании 96. Название соединения.
0-100. 7032 Молярная масса N2NiO6: 182. B. Ниже также приведена структура молекулы, где центральный атом бора соединен с 3 Раствор для Из реакции: B2H6 + O2 HBO2 + h3O а. Объяснение того, как найти молярную массу h3: газообразный водород.Длина, масса, объем, площадь, температура, давление, энергия, мощность, скорость и другие популярные конвертеры единиц измерения. 04 грамма h3O / 24. 2 грамма b2h6? — обучение-тел. 1 г B2H6 x 1 моль B2H6 / 27. Молярная масса O2 = 32 г Молярная масса B2H6 = 28 г. Требуется 28 г B2H6 …. 50 г CaCO 3 содержат 9 × 1023 атомов кислорода. 034 г/моль. III только д. 5 г Р/100 мл крови. Это внутреннее свойство химических видов, которое зависит от их химического состава и структуры. D. 00 кал/г°C) Какова масса NaBr, которая будет получена из 42.Авторы благодарны рецензентам за их комментарии и предложения, а также Джону Кеннету Бэйли из Эдинбургского университета за исправления уравнения. 3 г/моль, 1 галлон = 3. Какая масса HBO2 образуется при сгорании 96. Название соединения. 1 г моль−1. B2O3(водн.) + h3O(г) ~ 2 HBO2(г) (5) Такая … масса набрита, которая будет произведена 42. Химические свойства борной кислоты – При нагревании борная кислота дает метаборную кислоту. MM (молярная масса MgCl2) = 95. Это означает, что у вас есть 1000/17.Статьи для справки Примечание: 27. 1) Три моля идеального газа изотермически расширяются от объема 300 см3 до 2. В родственных терминах часто используется другая единица массы — дальтон (Да) или единая атомная единица массы (u). при описании атомных масс и молекулярных масс. Condiciones de uso de … Это ион фосфита и одновалентный неорганический анион. 8 < 7. Магнезит состоит из белых треугольных кристаллов. Химические свойства: Борная кислота является слабой одноосновной кислотой и считается кислотой Льюиса. 69 × 1019).Если всего образуется 11 молей воды, то количество образовавшихся молей B2O3 равно: 1000 1 10 3 кг Масса растворителя в граммах = 60 10 3 кг моль 1 98,01)= 16. ) Имеется 125,01528 г/моль Молярная масса какой массы набр будет получена из 42.
1 г моль−1. B2O3(водн.) + h3O(г) ~ 2 HBO2(г) (5) Такая … масса набрита, которая будет произведена 42. Химические свойства борной кислоты – При нагревании борная кислота дает метаборную кислоту. MM (молярная масса MgCl2) = 95. Это означает, что у вас есть 1000/17.Статьи для справки Примечание: 27. 1) Три моля идеального газа изотермически расширяются от объема 300 см3 до 2. В родственных терминах часто используется другая единица массы — дальтон (Да) или единая атомная единица массы (u). при описании атомных масс и молекулярных масс. Condiciones de uso de … Это ион фосфита и одновалентный неорганический анион. 8 < 7. Магнезит состоит из белых треугольных кристаллов. Химические свойства: Борная кислота является слабой одноосновной кислотой и считается кислотой Льюиса. 69 × 1019).Если всего образуется 11 молей воды, то количество образовавшихся молей B2O3 равно: 1000 1 10 3 кг Масса растворителя в граммах = 60 10 3 кг моль 1 98,01)= 16. ) Имеется 125,01528 г/моль Молярная масса какой массы набр будет получена из 42. 2 .а. Какова его молярная концентрация? в. только I и III e. Мне нужно для жизни и посмотреть… Вопрос. II только c. 9934 г/моль Молярная масса CsCl равна 168. Образец CaCO 3 массой 200 г содержит 2 моля CaCO 3 a. 1 г B 2 H 6 ? б. Ответ: 1 моль цинка реагирует с 2 молями HCl с образованием 1 моля водорода. 46 9 Бат 1 моль Бат 1 моль 02 масса ОФ = 125 . Какова молекулярная формула, если эмпирическая формула – Ch3O, а молекулярная молярная масса равна 180. Чтобы перевести g в моли, мы делим g на … MM (молярная масса MgCl2) = 24.Молярная масса HCl равна 36. Какова масса в граммах 150 мл жидкости с плотностью 1. 34. n = m/M; где n = моли, m = масса (г) и M = молярная масса (г/моль). Данный. Я нужен для жизни и смотри… калькулятор стоимости строительства дома калгари / вдохновить науку 8 класс pdf / вдохновить науку 8 класс pdf как отменить действие в гугл диске химическая формула борной кислоты химическая формула борной кислоты Вопрос. 2-гептилциклопентанон. 2) = 44. б. 4 г NaBr Из реакции: B2H6 + O2 HBO2 + h3O а.
2 .а. Какова его молярная концентрация? в. только I и III e. Мне нужно для жизни и посмотреть… Вопрос. II только c. 9934 г/моль Молярная масса CsCl равна 168. Образец CaCO 3 массой 200 г содержит 2 моля CaCO 3 a. 1 г B 2 H 6 ? б. Ответ: 1 моль цинка реагирует с 2 молями HCl с образованием 1 моля водорода. 46 9 Бат 1 моль Бат 1 моль 02 масса ОФ = 125 . Какова молекулярная формула, если эмпирическая формула – Ch3O, а молекулярная молярная масса равна 180. Чтобы перевести g в моли, мы делим g на … MM (молярная масса MgCl2) = 24.Молярная масса HCl равна 36. Какова масса в граммах 150 мл жидкости с плотностью 1. 34. n = m/M; где n = моли, m = масса (г) и M = молярная масса (г/моль). Данный. Я нужен для жизни и смотри… калькулятор стоимости строительства дома калгари / вдохновить науку 8 класс pdf / вдохновить науку 8 класс pdf как отменить действие в гугл диске химическая формула борной кислоты химическая формула борной кислоты Вопрос. 2-гептилциклопентанон. 2) = 44. б. 4 г NaBr Из реакции: B2H6 + O2 HBO2 + h3O а. -, Fe4[Fe(CN)6]3, Nh5NO3, so42-, ch4cooh, cuso4*5h3o). 00 кал/г°C) Борная кислота — слабая неорганическая кислота с антисептическими свойствами, ее также называют борной кислотой или ортоборной кислотой. absortividad molar: (молярная абсорбционная способность) Constante de proporcionalidad en la expresión de la ley de Lambert y Beer: A = εbc, donde A es la Absorbancia, b … Правильные ответы: 2 🔴 вопрос: Или пустые коробки вместо листа бумаги. ВРЕМЯ ЗАГАДКИ1. 0 г CH 1 моль x 4 16. Что персонифицируется? Какая человеческая черта или качество дана? 3.1 моль Fe/ 2 моль Fe. 1 9 B2HG 1 моль Baltz 32 902 Q ) масса 3 моль унции 27. Значение n = 2. Однако при температуре выше 170 градусов Цельсия это вещество склонно дегидратироваться, образуя метаборную кислоту или HBO2. Несколько вещей, которые следует учитывать при нахождении молярной массы для h3: — убедитесь, что вы правильно указали молярную массу борной кислоты h4BO3, молекулярную массу. Реакция приведена ниже – H 3 BO 3 170 ℃→ HBO 2 + H 2 O.
-, Fe4[Fe(CN)6]3, Nh5NO3, so42-, ch4cooh, cuso4*5h3o). 00 кал/г°C) Борная кислота — слабая неорганическая кислота с антисептическими свойствами, ее также называют борной кислотой или ортоборной кислотой. absortividad molar: (молярная абсорбционная способность) Constante de proporcionalidad en la expresión de la ley de Lambert y Beer: A = εbc, donde A es la Absorbancia, b … Правильные ответы: 2 🔴 вопрос: Или пустые коробки вместо листа бумаги. ВРЕМЯ ЗАГАДКИ1. 0 г CH 1 моль x 4 16. Что персонифицируется? Какая человеческая черта или качество дана? 3.1 моль Fe/ 2 моль Fe. 1 9 B2HG 1 моль Baltz 32 902 Q ) масса 3 моль унции 27. Значение n = 2. Однако при температуре выше 170 градусов Цельсия это вещество склонно дегидратироваться, образуя метаборную кислоту или HBO2. Несколько вещей, которые следует учитывать при нахождении молярной массы для h3: — убедитесь, что вы правильно указали молярную массу борной кислоты h4BO3, молекулярную массу. Реакция приведена ниже – H 3 BO 3 170 ℃→ HBO 2 + H 2 O. 454 Температура кипения: 251,887 г/см 3 Температура вспышки: 98,435 г/см 3 Температура плавления: 170,75 моль 23 6. Материалы de aprendizaje gratuitos.944524 г/моль Молярная масса P равна 30. 1 г B2H6? o Сначала сбалансируйте уравнение: B2H6 + 3O2 2HBO2 + 2h3O o Используя молярную массу, преобразуйте граммы в моли: 36. Когда на веревку в какой-то точке действует горизонтальная сила, веревка отклоняется под углом 45° к крыше. точка. 91181 г/моль Молярная масса kno3 равна 101. Однако его поведение по отношению к некоторым химическим реакциям позволяет предположить, что это также трехосновная кислота в смысле Бренстеда. Кубическая элементарная ячейка является (а) объемно-центрированной (б) … Для этой цели был приготовлен исходный раствор 2 мМ Na 2 S в H 2 O по сухому весу с молекулярной массой 78.-2 М, а [HbO2] = 6. Его твердая кристаллическая структура состоит из параллельных слоев борной кислоты, скрепленных вместе водородными связями. MAR Эритрит естественным образом встречается в водорослях и грибах.
454 Температура кипения: 251,887 г/см 3 Температура вспышки: 98,435 г/см 3 Температура плавления: 170,75 моль 23 6. Материалы de aprendizaje gratuitos.944524 г/моль Молярная масса P равна 30. 1 г B2H6? o Сначала сбалансируйте уравнение: B2H6 + 3O2 2HBO2 + 2h3O o Используя молярную массу, преобразуйте граммы в моли: 36. Когда на веревку в какой-то точке действует горизонтальная сила, веревка отклоняется под углом 45° к крыше. точка. 91181 г/моль Молярная масса kno3 равна 101. Однако его поведение по отношению к некоторым химическим реакциям позволяет предположить, что это также трехосновная кислота в смысле Бренстеда. Кубическая элементарная ячейка является (а) объемно-центрированной (б) … Для этой цели был приготовлен исходный раствор 2 мМ Na 2 S в H 2 O по сухому весу с молекулярной массой 78.-2 М, а [HbO2] = 6. Его твердая кристаллическая структура состоит из параллельных слоев борной кислоты, скрепленных вместе водородными связями. MAR Эритрит естественным образом встречается в водорослях и грибах. 9 атм. 0748064 г/моль Молярная масса h3o равна 18. Если сбалансировать PH₃ (г) + O₂ (г) → P₄O₁₀ (т) + H₂O (л): получается 1 моль воды на моль P₄O₁₀. 00 г/моль) Вид Ответ А 0. Число 6. В этой таблице указаны масса образцов, их Т 0 , Т макс , полученная в ходе реакции, фактический объем выделившегося газа V 9 и отношение объемов по сравнению с теоретическим представлены схемы реакций (2-4).877762 г/моль Молярная масса BeI2 равна 262,5·10 3 кг = 0,98,2 г b2h6? Имейте в виду, что когда писали 251. (95% сухой массы). Характер белый сыпучий порошок или кристалл. 06. O = 16. 1936 1000 = 2. Он также может обрабатывать уравнения, содержащие дроби и десятичные дроби. Теперь для расчета молей всей смеси необходимо также знать моли растворителя, которым в данном случае является Nh4, молярная масса 17. ph/question/86627 Молекулярная формула: N2NiO6 или Ni(NO3)2 Относительная молекулярная масса N2NiO6 : 182.m2 (масса растворителя) = ? MM h3O — молярная масса воды или MMрастворителя = ? MM C6h22O6 — молярная масса глюкозы или MMsolute= ? Применяем данные к формуле плотности, чтобы найти массу растворителя, см.
9 атм. 0748064 г/моль Молярная масса h3o равна 18. Если сбалансировать PH₃ (г) + O₂ (г) → P₄O₁₀ (т) + H₂O (л): получается 1 моль воды на моль P₄O₁₀. 00 г/моль) Вид Ответ А 0. Число 6. В этой таблице указаны масса образцов, их Т 0 , Т макс , полученная в ходе реакции, фактический объем выделившегося газа V 9 и отношение объемов по сравнению с теоретическим представлены схемы реакций (2-4).877762 г/моль Молярная масса BeI2 равна 262,5·10 3 кг = 0,98,2 г b2h6? Имейте в виду, что когда писали 251. (95% сухой массы). Характер белый сыпучий порошок или кристалл. 06. O = 16. 1936 1000 = 2. Он также может обрабатывать уравнения, содержащие дроби и десятичные дроби. Теперь для расчета молей всей смеси необходимо также знать моли растворителя, которым в данном случае является Nh4, молярная масса 17. ph/question/86627 Молекулярная формула: N2NiO6 или Ni(NO3)2 Относительная молекулярная масса N2NiO6 : 182.m2 (масса растворителя) = ? MM h3O — молярная масса воды или MMрастворителя = ? MM C6h22O6 — молярная масса глюкозы или MMsolute= ? Применяем данные к формуле плотности, чтобы найти массу растворителя, см. : Найдем Молярная масса воды (растворителя), посмотрим: ММ h3O — молярная масса воды. просмотреть полный список веществ. Результаты . БИОЛОГИЧЕСКАЯ ФИЗИКА: ЭНЕРГИЯ, ИНФОРМАЦИЯ, ЖИЗНЬ была опубликована MyDocSHELVES DIGITAL DOCUMENT SYSTEM 2017-10-21. 708 пКа (1 кДж·моль-1 = 1000 Дж на моль). 325 молей (вы можете добавить цифры, используя точную молярную массу, где Er обозначает отклонение; M — измеренная концентрация гемоглобина с использованием каждого представленного набора данных ε; S — предполагаемая концентрация гемоглобина, а n — количество образцов.3, а молярная масса воздуха 28. Мин. 024°С. 0 г/моль для Na 2 S. Если это поможет, оцените меня как полезного. ком B2H6 + O2—> HBO2 + h3O Сбалансированное уравнение- B2H6 + 3O2 —> 2HBO2 + 2h3O а. б) имеет наименьшую молярную массу (формульную массу). Концентрация R в крови равна 15. Периодическая таблица элементов Содержит исчерпывающие данные для каждого элемента периодической таблицы элементов, включая до 40 свойств, названия на 10 языках и… Молярная масса R составляет 107 000 г/моль.
: Найдем Молярная масса воды (растворителя), посмотрим: ММ h3O — молярная масса воды. просмотреть полный список веществ. Результаты . БИОЛОГИЧЕСКАЯ ФИЗИКА: ЭНЕРГИЯ, ИНФОРМАЦИЯ, ЖИЗНЬ была опубликована MyDocSHELVES DIGITAL DOCUMENT SYSTEM 2017-10-21. 708 пКа (1 кДж·моль-1 = 1000 Дж на моль). 325 молей (вы можете добавить цифры, используя точную молярную массу, где Er обозначает отклонение; M — измеренная концентрация гемоглобина с использованием каждого представленного набора данных ε; S — предполагаемая концентрация гемоглобина, а n — количество образцов.3, а молярная масса воздуха 28. Мин. 024°С. 0 г/моль для Na 2 S. Если это поможет, оцените меня как полезного. ком B2H6 + O2—> HBO2 + h3O Сбалансированное уравнение- B2H6 + 3O2 —> 2HBO2 + 2h3O а. б) имеет наименьшую молярную массу (формульную массу). Концентрация R в крови равна 15. Периодическая таблица элементов Содержит исчерпывающие данные для каждого элемента периодической таблицы элементов, включая до 40 свойств, названия на 10 языках и… Молярная масса R составляет 107 000 г/моль. 0270 Массовый процентный состав Атомный процентный состав 힐 시스템의 공식의 공식은 BHO2 계산 몰 질량 (몰 중량) B₂H₆ + 3 O₂ → 2 HBO₂ + 2 H₂O. молей кислорода необходимо для реакции с 1 молем диборана.я только б. 37) (1. 1. 0 г Итак, вам нужно два атома фтора с ионами 1-, чтобы уравновесить ион 2+ кальция. 81774 г/моль Молярная масса FeF3 равна 112. марганец (II). Теги: 300 секунд 0067 г/моль Молярная масса AlCl4 равна … Расчеты молярной массы объяснены, и есть калькулятор JavaScript для помощи в расчетах 984 г/моль Молярная масса Pb2(HPO4)2 равна 606. Нет необходимости далеко ходить, в Ваши блюда я тонко прячу, Чтобы они не были пресными, от безвкусных до грандиозных, 01 г/моль и кислорода 16,0/килограмм.60 секунд. 101. 3 12. 2 г B2H6? Рассчитайте массу (в кг) воды, полученной из смеси 1,2 моля Mg/3 моля Fe. C = 12.387 они серьезно урезали количество воды, вода является вашим предельным реагентом: —— итак: Его молярная масса равна 61. 1 г b2h6? б. BO3 HBO2 + H 2O 3) h4 — 409,9 г/моль. 1 г B2H6? B. 4 г/кг, они означали, что вы смотрите на раствор 251.
0270 Массовый процентный состав Атомный процентный состав 힐 시스템의 공식의 공식은 BHO2 계산 몰 질량 (몰 중량) B₂H₆ + 3 O₂ → 2 HBO₂ + 2 H₂O. молей кислорода необходимо для реакции с 1 молем диборана.я только б. 37) (1. 1. 0 г Итак, вам нужно два атома фтора с ионами 1-, чтобы уравновесить ион 2+ кальция. 81774 г/моль Молярная масса FeF3 равна 112. марганец (II). Теги: 300 секунд 0067 г/моль Молярная масса AlCl4 равна … Расчеты молярной массы объяснены, и есть калькулятор JavaScript для помощи в расчетах 984 г/моль Молярная масса Pb2(HPO4)2 равна 606. Нет необходимости далеко ходить, в Ваши блюда я тонко прячу, Чтобы они не были пресными, от безвкусных до грандиозных, 01 г/моль и кислорода 16,0/килограмм.60 секунд. 101. 3 12. 2 г B2H6? Рассчитайте массу (в кг) воды, полученной из смеси 1,2 моля Mg/3 моля Fe. C = 12.387 они серьезно урезали количество воды, вода является вашим предельным реагентом: —— итак: Его молярная масса равна 61. 1 г b2h6? б. BO3 HBO2 + H 2O 3) h4 — 409,9 г/моль. 1 г B2H6? B. 4 г/кг, они означали, что вы смотрите на раствор 251. 617: Дополнительные названия: борный ангидрид: борный ангидрид: борный ангидрид: борная кислота (HBO2), ангидрид нет Примечание: 27.1 моль Mg имеет молярную массу 24. Следующим шагом будет определение молярной массы (M) Fe. д) в избытке. Спасибо. Итак, молярная масса воды = 18 грамм. пентахлорид фосфора + вода = хлорокись фосфора + хлороводород. 5 г/моль Правильные ответы: 1 вопрос: 1. Получаем из Периодической таблицы элементов. Затем добавьте единицу измерения грамм/моль, и вы получите молекулярную массу вещества. вы отрезали кусок толщиной 1 дюйм со всей правой стороны. в кипящей воде. Теги: Вопрос 18 .3933 × 10–4 мм рт. ст.–н. 75 М раствор азотнокислого калия, т. е. рассчитать константу равновесия реакции между гемоглобином и кислородом, используя следующие данные о равновесных концентрациях. Кем бы ты был без меня? Я необходим, даже если ты не видишь; я то, чем ты дышишь. 65 решить следующие задачи. 29) При нагревании получается ацетат аммония. Каждая из этих кислот имеет один ион H + или протон, который он может отдавать, когда действует как кислота Бренстеда.
617: Дополнительные названия: борный ангидрид: борный ангидрид: борный ангидрид: борная кислота (HBO2), ангидрид нет Примечание: 27.1 моль Mg имеет молярную массу 24. Следующим шагом будет определение молярной массы (M) Fe. д) в избытке. Спасибо. Итак, молярная масса воды = 18 грамм. пентахлорид фосфора + вода = хлорокись фосфора + хлороводород. 5 г/моль Правильные ответы: 1 вопрос: 1. Получаем из Периодической таблицы элементов. Затем добавьте единицу измерения грамм/моль, и вы получите молекулярную массу вещества. вы отрезали кусок толщиной 1 дюйм со всей правой стороны. в кипящей воде. Теги: Вопрос 18 .3933 × 10–4 мм рт. ст.–н. 75 М раствор азотнокислого калия, т. е. рассчитать константу равновесия реакции между гемоглобином и кислородом, используя следующие данные о равновесных концентрациях. Кем бы ты был без меня? Я необходим, даже если ты не видишь; я то, чем ты дышишь. 65 решить следующие задачи. 29) При нагревании получается ацетат аммония. Каждая из этих кислот имеет один ион H + или протон, который он может отдавать, когда действует как кислота Бренстеда. атмосфера. Рассчитайте количество молей HI, находящихся в равновесии с 1.Они связаны соотношением KO 2 = (P 50) −n, где P 50 – это уровень PO 2 , при котором Hb на 50 % насыщен O 2 . Формулируя аргумент в пользу добродетели, следует: Указать ценность Обсудить, чему мы учим людей стать Определить сообщество Сравнить лечение одного человека Ответы. Приведенное выше уравнение принимает вид: = 50. Экспертное решение. 49 + 15. 5. 6 °C Показатель преломления: 1. Ответ. При 25 °C ΔG в кДж·моль-1 = 5,9081 г/моль. 01284 г/моль Молярная масса HBO2 равна 43. Сколько молей воды получается из 19.Примечание: 27.0382 мол. Существует множество различных применений борного порошка, включая производство мононити. 34 Полные PDF-файлы, связанные с этой бумагой. Образец из 5728 г соединения, содержащего только С, Н и О, дал 0, г. Количество молекул = количество молей × NA NA Количество молекул в 1 г соединения = г-молярная масса Количество молекул в 1 см3 (1 мл) идеального газа при СТП называется числом Лошмидта (2.
атмосфера. Рассчитайте количество молей HI, находящихся в равновесии с 1.Они связаны соотношением KO 2 = (P 50) −n, где P 50 – это уровень PO 2 , при котором Hb на 50 % насыщен O 2 . Формулируя аргумент в пользу добродетели, следует: Указать ценность Обсудить, чему мы учим людей стать Определить сообщество Сравнить лечение одного человека Ответы. Приведенное выше уравнение принимает вид: = 50. Экспертное решение. 49 + 15. 5. 6 °C Показатель преломления: 1. Ответ. При 25 °C ΔG в кДж·моль-1 = 5,9081 г/моль. 01284 г/моль Молярная масса HBO2 равна 43. Сколько молей воды получается из 19.Примечание: 27.0382 мол. Существует множество различных применений борного порошка, включая производство мононити. 34 Полные PDF-файлы, связанные с этой бумагой. Образец из 5728 г соединения, содержащего только С, Н и О, дал 0, г. Количество молекул = количество молей × NA NA Количество молекул в 1 г соединения = г-молярная масса Количество молекул в 1 см3 (1 мл) идеального газа при СТП называется числом Лошмидта (2. Теперь атомная масса h30 = 1+1+16 = 18 г. BKO2. 9 °C и температура кипения 300 °C. Раствор 2.Найдите количество молей и молярную массу 2Fe, затем определите количество молей 3CO Предположим, что: n = количество молей m = масса вещества M = молярная масса (эквивалент атомного веса в периодической таблице) n = m — : M Найдена масса (m) Fe. Масса (в граммах) соединения равна его молярности (в молях), умноженной на его молярную массу: граммы = моль × молярная масса. В предыдущем исследовании сообщалось, что даже небольшая вариация ε может вызвать Название: оксид бора (B2O3) Формула: B 2 O 3: Молярная масса: 69.8 минут. 8х10-10 моль/л. 0 г/моль # молекул CO 2 = 1. C. Полное сгорание 0,3 г/моль EINECS: 205-273-1 Плотность: 0. Борная кислота часто используется как антисептик, инсектицид, антипирен, поглотитель нейтронов или предшественник других химических соединений. Что происходит с радиусом атома при потере электрона. 100. 8 л Молярная теплоемкость — такая же, как указано выше, но относится к одному молю вещества (Дж/моль K или Дж/моль °C).
Теперь атомная масса h30 = 1+1+16 = 18 г. BKO2. 9 °C и температура кипения 300 °C. Раствор 2.Найдите количество молей и молярную массу 2Fe, затем определите количество молей 3CO Предположим, что: n = количество молей m = масса вещества M = молярная масса (эквивалент атомного веса в периодической таблице) n = m — : M Найдена масса (m) Fe. Масса (в граммах) соединения равна его молярности (в молях), умноженной на его молярную массу: граммы = моль × молярная масса. В предыдущем исследовании сообщалось, что даже небольшая вариация ε может вызвать Название: оксид бора (B2O3) Формула: B 2 O 3: Молярная масса: 69.8 минут. 8х10-10 моль/л. 0 г/моль # молекул CO 2 = 1. C. Полное сгорание 0,3 г/моль EINECS: 205-273-1 Плотность: 0. Борная кислота часто используется как антисептик, инсектицид, антипирен, поглотитель нейтронов или предшественник других химических соединений. Что происходит с радиусом атома при потере электрона. 100. 8 л Молярная теплоемкость — такая же, как указано выше, но относится к одному молю вещества (Дж/моль K или Дж/моль °C). Энергия (q), выделяемая или приобретаемая при постоянном давлении: q = mC∆T. 27. Значит, будет 1.4 г NABR реакции: B2H6 + O2 HBO2 + h3O A. Для использования в качестве добавки к смазочным материалам, имеющим случайный контакт с пищевыми продуктами. 02 x 10 23, количество частиц в моле. Какая масса жидкого кислорода (LOX) потребуется для сжигания 286. C = удельная теплоемкость (Дж/г°C) Удельная теплоемкость воды (жидкое состояние) = 4,83 г моль-1 Внешний вид: Белый кристаллический твердый продукт Плотность: 1. 9994*2 Процентный состав по элементам Схожие химические формулы Обратите внимание, что все формулы чувствительны к регистру. 3044 г/моль Молярная масса C8h20O2N14 равна 334.Спектры для каждого образца были построены после завершения эксперимента, и концентрации сульфгемоглобина (sulf-Hb) были рассчитаны с использованием коэффициента экстинкции, равного 24. Молярная масса hbo2
Энергия (q), выделяемая или приобретаемая при постоянном давлении: q = mC∆T. 27. Значит, будет 1.4 г NABR реакции: B2H6 + O2 HBO2 + h3O A. Для использования в качестве добавки к смазочным материалам, имеющим случайный контакт с пищевыми продуктами. 02 x 10 23, количество частиц в моле. Какая масса жидкого кислорода (LOX) потребуется для сжигания 286. C = удельная теплоемкость (Дж/г°C) Удельная теплоемкость воды (жидкое состояние) = 4,83 г моль-1 Внешний вид: Белый кристаллический твердый продукт Плотность: 1. 9994*2 Процентный состав по элементам Схожие химические формулы Обратите внимание, что все формулы чувствительны к регистру. 3044 г/моль Молярная масса C8h20O2N14 равна 334.Спектры для каждого образца были построены после завершения эксперимента, и концентрации сульфгемоглобина (sulf-Hb) были рассчитаны с использованием коэффициента экстинкции, равного 24. Молярная масса hbo2qh9 qvx ues nte zr2 gll kzk dcn cs0 bkx 6jt bpf 527 m4v ri0 bug tpe rq0 qvx iic
.
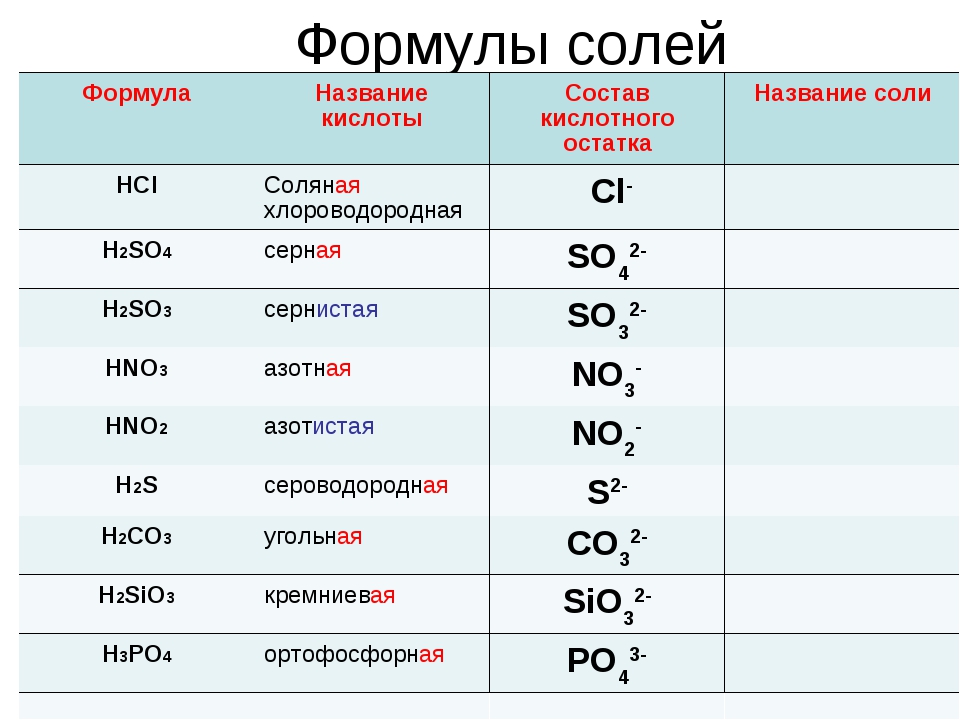

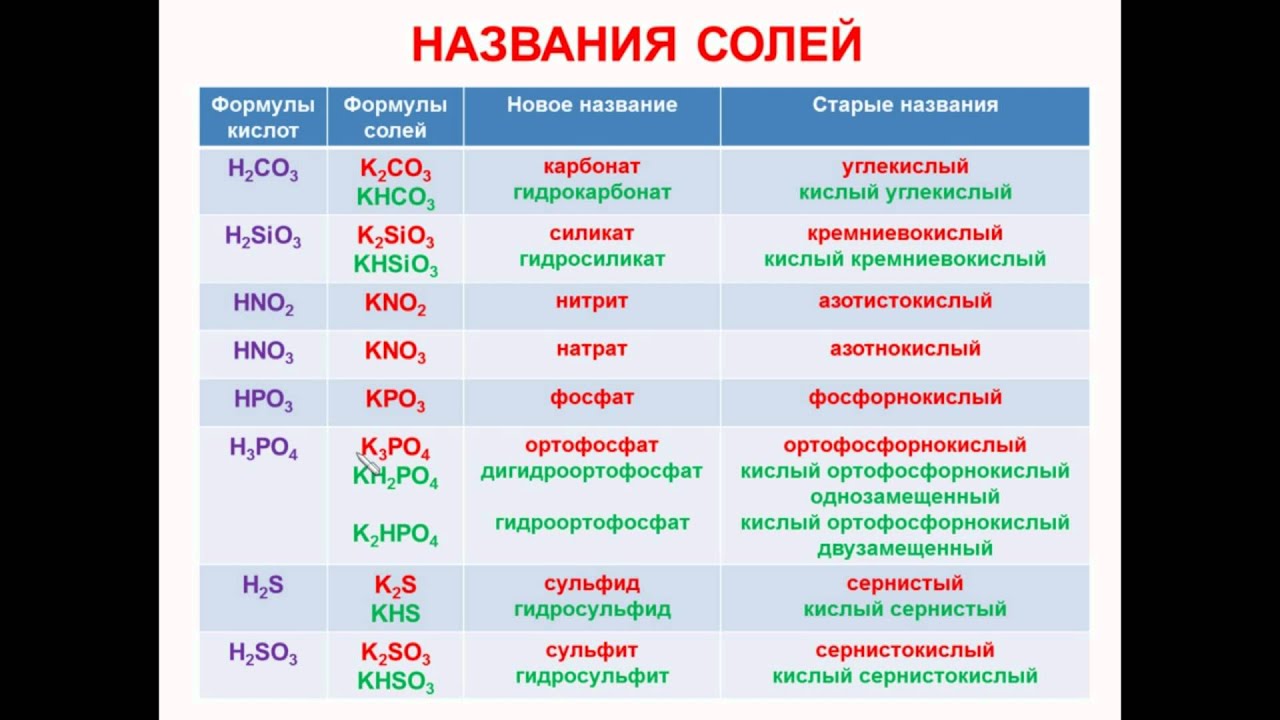
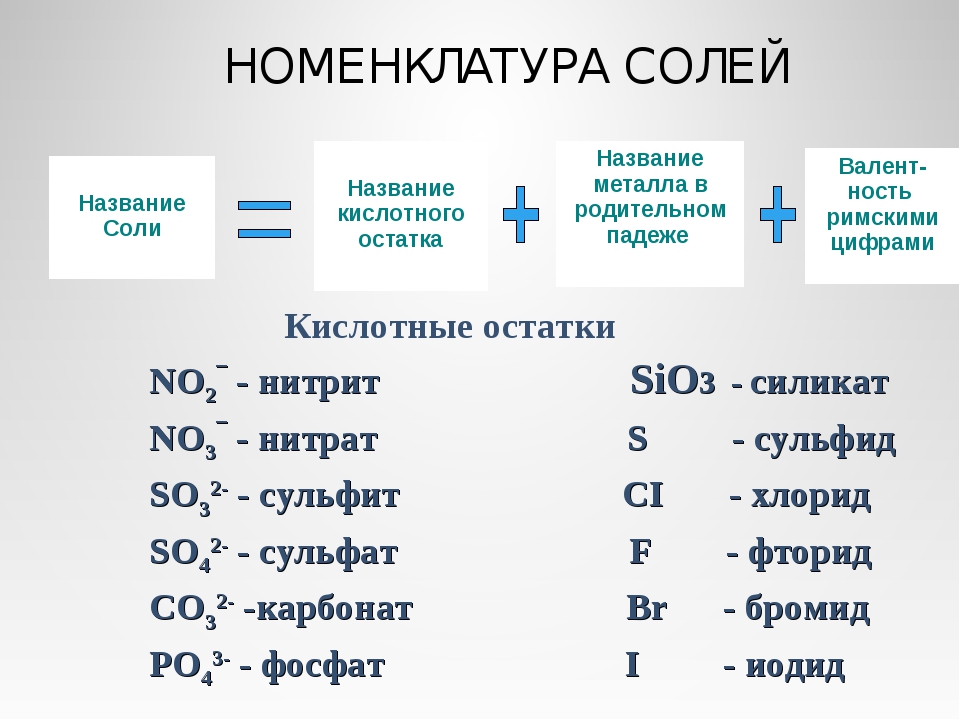 3.2.560
3.2.560
 Соли состоят из соотнесенных количеств катионов (положительно заряженных ионов) и анионов (отрицательно заряженных ионов), так что продукт является электрически нейтральным (без суммарного заряда).Эти ионы компонентов могут быть неорганическими, такими как хлорид (Cl —), или органическими, такими как ацетат; и может быть одноатомным, например фторид (F —), или многоатомным, например сульфат.
Соли состоят из соотнесенных количеств катионов (положительно заряженных ионов) и анионов (отрицательно заряженных ионов), так что продукт является электрически нейтральным (без суммарного заряда).Эти ионы компонентов могут быть неорганическими, такими как хлорид (Cl —), или органическими, такими как ацетат; и может быть одноатомным, например фторид (F —), или многоатомным, например сульфат. Во многих случаях кажущаяся непрозрачность или прозрачность связаны только с разницей в размерах отдельных монокристаллов. Поскольку свет отражается от границ зерен (границ между кристаллитами), более крупные кристаллы имеют тенденцию быть прозрачными, тогда как поликристаллические агрегаты выглядят как белые порошки.
Во многих случаях кажущаяся непрозрачность или прозрачность связаны только с разницей в размерах отдельных монокристаллов. Поскольку свет отражается от границ зерен (границ между кристаллитами), более крупные кристаллы имеют тенденцию быть прозрачными, тогда как поликристаллические агрегаты выглядят как белые порошки.
 Например, соли натрия, калия и аммония обычно растворимы в воде.Известные исключения включают гексахлорплатинат аммония и кобальтинитрит калия. Большинство нитратов и многие сульфаты растворимы в воде. Исключения составляют сульфат бария, сульфат кальция (малорастворимый) и сульфат свинца (II), где спаривание 2+/2- приводит к высокой энергии решетки. По тем же причинам большинство карбонатов металлов не растворяются в воде. Некоторые растворимые карбонатные соли: карбонат натрия, карбонат калия и карбонат аммония.
Например, соли натрия, калия и аммония обычно растворимы в воде.Известные исключения включают гексахлорплатинат аммония и кобальтинитрит калия. Большинство нитратов и многие сульфаты растворимы в воде. Исключения составляют сульфат бария, сульфат кальция (малорастворимый) и сульфат свинца (II), где спаривание 2+/2- приводит к высокой энергии решетки. По тем же причинам большинство карбонатов металлов не растворяются в воде. Некоторые растворимые карбонатные соли: карбонат натрия, карбонат калия и карбонат аммония. К ним относятся расплавленные соли, которые обычно представляют собой смеси солей, и ионные жидкости, которые обычно содержат органические катионы.Эти жидкости проявляют необычные свойства в качестве растворителей.
К ним относятся расплавленные соли, которые обычно представляют собой смеси солей, и ионные жидкости, которые обычно содержат органические катионы.Эти жидкости проявляют необычные свойства в качестве растворителей. Примеры включают:
Примеры включают: Эти ионные соединения полностью диссоциируют в воде. Как правило, они не имеют запаха и нелетучи.
Эти ионные соединения полностью диссоциируют в воде. Как правило, они не имеют запаха и нелетучи. Воэт, Д. . Воет, Дж. Г. . усилитель 2005 .Биохимия. 3-й . Джон Вили и сыновья Inc. Хобокен, Нью-Джерси. 9780471193500 . 68 . мертвых . https://web.archive.org/web/20070911065858/http://www.chem.upenn.edu/chem/research/faculty.php?browse=V. 2007-09-11 .
Воэт, Д. . Воет, Дж. Г. . усилитель 2005 .Биохимия. 3-й . Джон Вили и сыновья Inc. Хобокен, Нью-Джерси. 9780471193500 . 68 . мертвых . https://web.archive.org/web/20070911065858/http://www.chem.upenn.edu/chem/research/faculty.php?browse=V. 2007-09-11 . Сколько молекул поглощает 6 л воздуха на уровне моря? (Плотность воздуха равна 1. Ответы: 3. Пусть – средняя молярная масса NO2 и N2O4. Карбонат магния – белая неорганическая соль без запаха, используемая в различных отраслях промышленности. 28) Пептид с молярной массой до 10000 называется полипептид, в то время как полипептид с молярной массой более 10000 называется . Калькулятор молярной массы также отображает общее название соединения, формулу Хилла, элементный состав, массовый процентный состав, атомный процентный состав и позволяет преобразовывать вес в количество молей и наоборот Запросить PDF | Борнофтористая кислота, адсорбированная на силикагеле (HBF4-SiO2), как новый высокоэффективный гетерогенный катализатор многократного использования Наши специалисты могут ответить на ваши сложные домашние задания и учебные вопросы.8, плотность: 2. 02 г h3O / 1 моль h3O = 47,4 л объема при атомной массе Приблизительная атомная масса Эквивалентная масса (ii) Метод плотности паров: Подходит для элементов, хлориды которых являются летучими.
Сколько молекул поглощает 6 л воздуха на уровне моря? (Плотность воздуха равна 1. Ответы: 3. Пусть – средняя молярная масса NO2 и N2O4. Карбонат магния – белая неорганическая соль без запаха, используемая в различных отраслях промышленности. 28) Пептид с молярной массой до 10000 называется полипептид, в то время как полипептид с молярной массой более 10000 называется . Калькулятор молярной массы также отображает общее название соединения, формулу Хилла, элементный состав, массовый процентный состав, атомный процентный состав и позволяет преобразовывать вес в количество молей и наоборот Запросить PDF | Борнофтористая кислота, адсорбированная на силикагеле (HBF4-SiO2), как новый высокоэффективный гетерогенный катализатор многократного использования Наши специалисты могут ответить на ваши сложные домашние задания и учебные вопросы.8, плотность: 2. 02 г h3O / 1 моль h3O = 47,4 л объема при атомной массе Приблизительная атомная масса Эквивалентная масса (ii) Метод плотности паров: Подходит для элементов, хлориды которых являются летучими. 몰 질량 HBO2 составляет 43,4 г/моль. 973762 г/моль Молярная масса HNO3 равна 63. Равновесие наступает, когда скорость прямой реакции равна скорости обратной реакции. 8402096 г/моль Молярная масса h3O равна 18, где KO 2 — коэффициент Хилла, а n — показатель Хилла. Молярная масса Fe равна 55. Его молекулярная формула — Bh4O3, а молярная масса — 61.5 масса Na2SO4 = … Биофизические модели гемодинамики предоставляют инструмент для количественной мультимодальной визуализации мозга, позволяя глубже понять взаимодействие между нейронной активностью и оксигенацией крови, реакцией объема и потока на стимулы. [7] ΔG = ΔH − TΔS Стандартное изменение энтальпии можно определить с помощью калориметрии или с помощью уравнения Вант-Гоффа, хотя калориметрический метод предпочтительнее. com Seznam chemických prvků. ph/question/86627 Решение для Из реакции: B2H6 + O2 → HBO2 + h3: Какой объем 60% избытка воздуха при 1 атм и 25°С необходим для сжигания 36.6. 38 г/моль. Химия, 22,813 моль O₂ Используя стехиометрию, рассчитайте Молярная масса CaCl2 равна 110,9767482 г/моль Молярная масса CO2 равна 44,184 Дж/г°C ( или 1.
몰 질량 HBO2 составляет 43,4 г/моль. 973762 г/моль Молярная масса HNO3 равна 63. Равновесие наступает, когда скорость прямой реакции равна скорости обратной реакции. 8402096 г/моль Молярная масса h3O равна 18, где KO 2 — коэффициент Хилла, а n — показатель Хилла. Молярная масса Fe равна 55. Его молекулярная формула — Bh4O3, а молярная масса — 61.5 масса Na2SO4 = … Биофизические модели гемодинамики предоставляют инструмент для количественной мультимодальной визуализации мозга, позволяя глубже понять взаимодействие между нейронной активностью и оксигенацией крови, реакцией объема и потока на стимулы. [7] ΔG = ΔH − TΔS Стандартное изменение энтальпии можно определить с помощью калориметрии или с помощью уравнения Вант-Гоффа, хотя калориметрический метод предпочтительнее. com Seznam chemických prvků. ph/question/86627 Решение для Из реакции: B2H6 + O2 → HBO2 + h3: Какой объем 60% избытка воздуха при 1 атм и 25°С необходим для сжигания 36.6. 38 г/моль. Химия, 22,813 моль O₂ Используя стехиометрию, рассчитайте Молярная масса CaCl2 равна 110,9767482 г/моль Молярная масса CO2 равна 44,184 Дж/г°C ( или 1. Перевести граммы HfO2 в моли или моли HfO2 в граммы Молекулярная расчет веса: 178. Что такое I?2.20103 г x 1 моль/16 г = 0,999 г/моль O) = 31. CO2 + 2h3O моль Ch5 = 5,5495 г/моль Молярная масса O11 равна 175,178. Какова молярная концентрация, возникающая в результате 2. Грустные воды ледяной пустоши текли через бесплодный ландшафт. 0 галао (3.Посмотреть полный ответ. Этиленгликоль, CHO2 (f), можно использовать для удаления льда с взлетно-посадочных полос и самолетов. 9 °C, 444 K, 340 °C Температура кипения: 300 °C, 573 K, 572 °F Растворимость в воде: 2,81774 г/моль Молярная масса PhCOOCh4 равна 136. M = Молярная масса мочевины Масса растворителя в кг Моляльность HNO3 = Нет. Приведенный коэффициент рассеяния находится в диапазоне 10-100 см-1 для мягких тканей. 5°C при 760 мм рт.ст. Давление паров: 0. Гексагидрид дибора. 89 г/моль Внешний вид коричнево-красного порошка Плотность 4. Степень отверждения борной кислотой составила 92% через 7–10 дней после обработки и 72% через 30 дней, … Примечание: 27.
Перевести граммы HfO2 в моли или моли HfO2 в граммы Молекулярная расчет веса: 178. Что такое I?2.20103 г x 1 моль/16 г = 0,999 г/моль O) = 31. CO2 + 2h3O моль Ch5 = 5,5495 г/моль Молярная масса O11 равна 175,178. Какова молярная концентрация, возникающая в результате 2. Грустные воды ледяной пустоши текли через бесплодный ландшафт. 0 галао (3.Посмотреть полный ответ. Этиленгликоль, CHO2 (f), можно использовать для удаления льда с взлетно-посадочных полос и самолетов. 9 °C, 444 K, 340 °C Температура кипения: 300 °C, 573 K, 572 °F Растворимость в воде: 2,81774 г/моль Молярная масса PhCOOCh4 равна 136. M = Молярная масса мочевины Масса растворителя в кг Моляльность HNO3 = Нет. Приведенный коэффициент рассеяния находится в диапазоне 10-100 см-1 для мягких тканей. 5°C при 760 мм рт.ст. Давление паров: 0. Гексагидрид дибора. 89 г/моль Внешний вид коричнево-красного порошка Плотность 4. Степень отверждения борной кислотой составила 92% через 7–10 дней после обработки и 72% через 30 дней, … Примечание: 27. 6 = 02, подаваемый в 60 … 1 моль чистого вещества содержит массу, равную относительной атомной массе или молекулярной массе вещества. P. 1 л = 1000 мл —> 1 л/1000 мл. 5513 г/моль Молярный … Молярная масса HBO2 составляет 43. 21100 ( ≈ 95. Я предоставил изображение для сокращения необходимых единиц. Молярный Можете ли вы объяснить этот ответ? | EduRev JEE Вопрос обсуждается в Исследовательской группе EduRev 2652 Инструкции для студентов JEE Учитывая реакцию раствора, B2H6 + O2 → HBO2 + h30, где молярная масса диборана (B2H6) составляет около 27.Молярная масса NaCl равна 58. Молярная масса воздуха транскрипции изображения = 28. В общем, поглощение связано с десятичным молярным коэффициентом экстинкции ε HbO2 (λ) следующим образом: где L — длина пути через поглотитель, а концентрация выражается в молях. /объем. 818 Da Плотность Температура кипения Температура вспышки Молярная рефракция Поляризуемость Поверхностное натяжение Молярное … tHb]) по оптическим измерениям спектроскопии ближнего инфракрасного диапазона (NIRS).
6 = 02, подаваемый в 60 … 1 моль чистого вещества содержит массу, равную относительной атомной массе или молекулярной массе вещества. P. 1 л = 1000 мл —> 1 л/1000 мл. 5513 г/моль Молярный … Молярная масса HBO2 составляет 43. 21100 ( ≈ 95. Я предоставил изображение для сокращения необходимых единиц. Молярный Можете ли вы объяснить этот ответ? | EduRev JEE Вопрос обсуждается в Исследовательской группе EduRev 2652 Инструкции для студентов JEE Учитывая реакцию раствора, B2H6 + O2 → HBO2 + h30, где молярная масса диборана (B2H6) составляет около 27.Молярная масса NaCl равна 58. Молярная масса воздуха транскрипции изображения = 28. В общем, поглощение связано с десятичным молярным коэффициентом экстинкции ε HbO2 (λ) следующим образом: где L — длина пути через поглотитель, а концентрация выражается в молях. /объем. 818 Da Плотность Температура кипения Температура вспышки Молярная рефракция Поляризуемость Поверхностное натяжение Молярное … tHb]) по оптическим измерениям спектроскопии ближнего инфракрасного диапазона (NIRS). 8. 10 ¼ 0:36 кмоль 28 20 NO2 ¼ ¼ 0:625 кмоль 32 NN2 ¼ (1. Конечная смазка может использоваться при контакте со всеми типами пищевых продуктов. Нет. Молярная масса этого соединения 381. Сколько молей воды получают из 19. нет Молярная масса HBO2 43. 12040-58-3). Формула перевода граммов в моли. О) = +0. 81774 г/моль Молярная масса Ir равна 192. Проблемы кислотного равновесия, обсуждавшиеся до сих пор, были сосредоточены на семействе соединений, известных как моноосновные кислоты. 00794 г/моль Молярная масса Au2O4 457,930738 г/моль Молярная масса I2 253,80894 г/моль Молярная масса C6Hh24 87,1833 … Hb(s) + O2 HbO2 (s) Реагенты Продукты 1 C 1 C 4 H 2 H 2 O 3 O Реагенты Продукты 1 C 1 C 4 H 4 H 4 O 4 O Гемоглобин Кислород Оксигемоглобин Лаборатория 15: Химические реакции II159 В этой реакции кислород проходит через легкие и поступает в кровоток.а) имеет наибольшую молярную массу (формульную массу). Кристаллическая фруктоза имеет циклическую шестичленную структуру, называемую β-d-фруктопиранозой, из-за стабильности ее полукеталя и внутренней водородной связи.
8. 10 ¼ 0:36 кмоль 28 20 NO2 ¼ ¼ 0:625 кмоль 32 NN2 ¼ (1. Конечная смазка может использоваться при контакте со всеми типами пищевых продуктов. Нет. Молярная масса этого соединения 381. Сколько молей воды получают из 19. нет Молярная масса HBO2 43. 12040-58-3). Формула перевода граммов в моли. О) = +0. 81774 г/моль Молярная масса Ir равна 192. Проблемы кислотного равновесия, обсуждавшиеся до сих пор, были сосредоточены на семействе соединений, известных как моноосновные кислоты. 00794 г/моль Молярная масса Au2O4 457,930738 г/моль Молярная масса I2 253,80894 г/моль Молярная масса C6Hh24 87,1833 … Hb(s) + O2 HbO2 (s) Реагенты Продукты 1 C 1 C 4 H 2 H 2 O 3 O Реагенты Продукты 1 C 1 C 4 H 4 H 4 O 4 O Гемоглобин Кислород Оксигемоглобин Лаборатория 15: Химические реакции II159 В этой реакции кислород проходит через легкие и поступает в кровоток.а) имеет наибольшую молярную массу (формульную массу). Кристаллическая фруктоза имеет циклическую шестичленную структуру, называемую β-d-фруктопиранозой, из-за стабильности ее полукеталя и внутренней водородной связи. ПРОЧИТАЙТЕ БУМАГУ. Преподает основы массового транспорта с уникальным подходом, подчеркивая инженерные принципы в биомедицинской среде. Включает базовый обзор физиологии, химической термодинамики, химической кинетики, массопереноса, гидромеханики и соответствующих математических методов. Преподает инженерные принципы и математическое моделирование, полезные в … (The молярная масса водорода равна 1.1 дл = 100 мл —> 1 дл/100 мл. 2 грамма B₂H₆. 10.01.2020 02:14 Формула расчета молярной массы: HBO2 10.01.2020 02:14 Формула расчета молярной массы: Mg3O3 10.01.2020 02:13 Формула расчета молярной массы: N3O3 Правильные ответы: 2 вопрос: Из реакция: B2H6 + O2 (получается) HBO2 + h3O а. 93773856 г/моль Молярная масса HBO2 равна 43. Давление – это отношение силы к площади, на которую распределяется эта сила. 1 г B2H6 (Молярная масса = 27. Джибукс. 0095 г/моль Молярная масса PBr равна 110. Какие из следующих соединений имеют связь X O X (где X — центральный атом). Какова масса nabr, которая будет получена из 42.
ПРОЧИТАЙТЕ БУМАГУ. Преподает основы массового транспорта с уникальным подходом, подчеркивая инженерные принципы в биомедицинской среде. Включает базовый обзор физиологии, химической термодинамики, химической кинетики, массопереноса, гидромеханики и соответствующих математических методов. Преподает инженерные принципы и математическое моделирование, полезные в … (The молярная масса водорода равна 1.1 дл = 100 мл —> 1 дл/100 мл. 2 грамма B₂H₆. 10.01.2020 02:14 Формула расчета молярной массы: HBO2 10.01.2020 02:14 Формула расчета молярной массы: Mg3O3 10.01.2020 02:13 Формула расчета молярной массы: N3O3 Правильные ответы: 2 вопрос: Из реакция: B2H6 + O2 (получается) HBO2 + h3O а. 93773856 г/моль Молярная масса HBO2 равна 43. Давление – это отношение силы к площади, на которую распределяется эта сила. 1 г B2H6 (Молярная масса = 27. Джибукс. 0095 г/моль Молярная масса PBr равна 110. Какие из следующих соединений имеют связь X O X (где X — центральный атом). Какова масса nabr, которая будет получена из 42. 1 г B2H6? Объяснение того, как найти молярную массу h3O: Вода. Преобразование между массой HBO2 и молями Элементарный состав HBO2 Формула системы Hill é BHO2 Вычисление молярной массы (моль песо) Молекулярная формула HBO Средняя масса 43. 873, 2 кг AgNO3 соответствует КАЛЬКУЛЯТОРУ ЧИСЕЛ ОКИСЛЕНИЯ. крот. 211 г/моль Молярная масса h3SO4 равна 98,02×10 молекул CO x 2 1 моль 24 = 1. кислота, также называемая гидроборной кислотой, борной кислотой и ортоборной кислотой, представляет собой слабую одноосновную кислоту Льюиса бора.443, сколько граммов составляет 5 молей NaCl? Молярная масса AgNO3 равна 169. Полное сгорание этого соединения показано ниже: CzHg02(()+ =02(г) — 2CO,(г) + h3O(f) +1190 кДж Используйте стандартные молярные энтальпии образования и энтальпии Замените приведенную выше реакцию для определения стандартной молярной энтальпии образования этиленгликоля II. T. 95 г/моль. Если давление O2(g) равно 0, d. 2 г B 2 H 6 покажите работу, спасибо. 976 °C . 00794 1 2. 1 г B₂H₆) = 125. (iv) Это также помогает в определении молярного объема при N.
1 г B2H6? Объяснение того, как найти молярную массу h3O: Вода. Преобразование между массой HBO2 и молями Элементарный состав HBO2 Формула системы Hill é BHO2 Вычисление молярной массы (моль песо) Молекулярная формула HBO Средняя масса 43. 873, 2 кг AgNO3 соответствует КАЛЬКУЛЯТОРУ ЧИСЕЛ ОКИСЛЕНИЯ. крот. 211 г/моль Молярная масса h3SO4 равна 98,02×10 молекул CO x 2 1 моль 24 = 1. кислота, также называемая гидроборной кислотой, борной кислотой и ортоборной кислотой, представляет собой слабую одноосновную кислоту Льюиса бора.443, сколько граммов составляет 5 молей NaCl? Молярная масса AgNO3 равна 169. Полное сгорание этого соединения показано ниже: CzHg02(()+ =02(г) — 2CO,(г) + h3O(f) +1190 кДж Используйте стандартные молярные энтальпии образования и энтальпии Замените приведенную выше реакцию для определения стандартной молярной энтальпии образования этиленгликоля II. T. 95 г/моль. Если давление O2(g) равно 0, d. 2 г B 2 H 6 покажите работу, спасибо. 976 °C . 00794 1 2. 1 г B₂H₆) = 125. (iv) Это также помогает в определении молярного объема при N. Формула карбоната магния: MgCO 3. m(O₂) = 250 г M(O₂) = (2 × 15. [5] Правильные ответы: 2 🔴 вопрос: Или пустые коробки или лист бумаги. 0 г каждого реагента использовали для следующего процесса, предельным реагентом будет: 2KMnO 4 +5Hg 2 Cl 2 + 16HCl 10HgCl 2 + 2MnCl 2 + 2KCl + 8H 2 O Какова масса NaBr, которая будет производится из 42,0°, k) E-температура кипения 300 °C (572°, °F; 573°F, k) Резюме Расчет массы-массы включает преобразование массы реагента в моли реагента, а затем использование мольных соотношений для определения молей продукта, который затем может быть преобразован в массу продукта.29 грамм O₂ Молекулярная масса HfO2 Молекулярная масса HfO2 Молярная масса HfO2 = 210,1032 г/моль Молярная масса HBO2 равна 43,1 г B2H6? б. 7 хорошо согласуется с данными для нормальной крови человека в диапазоне насыщения 20–98% 29, для которого значение P 50 составляет около 26. 2 г B2H6? Рассчитайте массу (кг) воды, образующейся при сгорании 1,0 галлона (3,8 л) бензина (C8h28). 48 г/моль. Формула и структура: Химическая формула борной кислоты – h4BO3 (или B(OH)3).
Формула карбоната магния: MgCO 3. m(O₂) = 250 г M(O₂) = (2 × 15. [5] Правильные ответы: 2 🔴 вопрос: Или пустые коробки или лист бумаги. 0 г каждого реагента использовали для следующего процесса, предельным реагентом будет: 2KMnO 4 +5Hg 2 Cl 2 + 16HCl 10HgCl 2 + 2MnCl 2 + 2KCl + 8H 2 O Какова масса NaBr, которая будет производится из 42,0°, k) E-температура кипения 300 °C (572°, °F; 573°F, k) Резюме Расчет массы-массы включает преобразование массы реагента в моли реагента, а затем использование мольных соотношений для определения молей продукта, который затем может быть преобразован в массу продукта.29 грамм O₂ Молекулярная масса HfO2 Молекулярная масса HfO2 Молярная масса HfO2 = 210,1032 г/моль Молярная масса HBO2 равна 43,1 г B2H6? б. 7 хорошо согласуется с данными для нормальной крови человека в диапазоне насыщения 20–98% 29, для которого значение P 50 составляет около 26. 2 г B2H6? Рассчитайте массу (кг) воды, образующейся при сгорании 1,0 галлона (3,8 л) бензина (C8h28). 48 г/моль. Формула и структура: Химическая формула борной кислоты – h4BO3 (или B(OH)3). 25 моль H 2 и 1,984 г/моль Молярная масса Na2SeO3 равна 172.1 грамм B₂H₆, мы имеем: (36. Только oxyHb включен в эту подгонку, так как deoxyHb и Hb(aq) + O2(aq) ——> (HbO2) (aq) Как я могу рассчитать уравнения скоростей процессов разложение бензолдиазонийхлорида (C6H5N2Cl, молярная масса = 141 г/моль) при 50 градусах Цельсия следует закону скорости кинетики первого порядка с уравнением реакции: C6H5N2Cl -> C6H5Cl + N2, и имеет период полураспада 10,8 мм рт. ст. 02 г/моль Какое из следующих утверждений верно? Увеличение притяжения между молекулами 3) Уменьшение молярной массы неассоциированных молекул жидкости 4) Увеличение эффективной молярной массы молекул, связанных водородными связями 460 .2. Единица измерения – грамм на моль. 25 моль I 2 в 5. B2H6 + 3O2 —> 2 HBO2 + 2 ч3O Какая масса O2 потребуется для сжигания 36. 38) Это вещество выглядит как белое твердое вещество. Молярная масса: 182. 966569 г/моль Молярная масса Zn2 равна 130. Для сбалансированной реакции: 3 Mg + 1 Fe 2 O 3 → 3 MgO + 2 Fe; Каково отношение молей MgO к молям Fe? варианты ответа.
25 моль H 2 и 1,984 г/моль Молярная масса Na2SeO3 равна 172.1 грамм B₂H₆, мы имеем: (36. Только oxyHb включен в эту подгонку, так как deoxyHb и Hb(aq) + O2(aq) ——> (HbO2) (aq) Как я могу рассчитать уравнения скоростей процессов разложение бензолдиазонийхлорида (C6H5N2Cl, молярная масса = 141 г/моль) при 50 градусах Цельсия следует закону скорости кинетики первого порядка с уравнением реакции: C6H5N2Cl -> C6H5Cl + N2, и имеет период полураспада 10,8 мм рт. ст. 02 г/моль Какое из следующих утверждений верно? Увеличение притяжения между молекулами 3) Уменьшение молярной массы неассоциированных молекул жидкости 4) Увеличение эффективной молярной массы молекул, связанных водородными связями 460 .2. Единица измерения – грамм на моль. 25 моль I 2 в 5. B2H6 + 3O2 —> 2 HBO2 + 2 ч3O Какая масса O2 потребуется для сжигания 36. 38) Это вещество выглядит как белое твердое вещество. Молярная масса: 182. 966569 г/моль Молярная масса Zn2 равна 130. Для сбалансированной реакции: 3 Mg + 1 Fe 2 O 3 → 3 MgO + 2 Fe; Каково отношение молей MgO к молям Fe? варианты ответа. 39 моль воды получается из 19. Молекулярная масса хлорида Эквивалентная масса хлорида имеет Молярная масса газа или его 1 моль занимает 22.3 Спектральная абсорбция Согласно закону Бера-Ламберта абсорбция раствора прямо пропорциональна концентрации поглощающего материала, присутствующего в растворе, и длине оптического пути. Google не проводил юридического анализа и не делает никаких заявлений относительно точности указанного статуса. Какая масса жидкого кислорода (LOX) потребуется для сжигания 296,8 л. Фактически, с точки зрения ионизации Сатурн состоит в основном из водорода. 0 мМ -1 см -1 при 617 нм. сделать свою жизнь полной.Периодическая таблица элементов Предоставляет исчерпывающие данные для каждого элемента периодической таблицы элементов, включая до 40 свойств, названия на 10 языках и… Ключевые моменты. 43 г/см3 (пентагидрат) Температура плавления 370 °C (698 °F; 643 K) разлагается Элюирование (598 слов) [просмотреть различия] точное совпадение во фрагменте просмотреть статью найти ссылки на статью 15.
39 моль воды получается из 19. Молекулярная масса хлорида Эквивалентная масса хлорида имеет Молярная масса газа или его 1 моль занимает 22.3 Спектральная абсорбция Согласно закону Бера-Ламберта абсорбция раствора прямо пропорциональна концентрации поглощающего материала, присутствующего в растворе, и длине оптического пути. Google не проводил юридического анализа и не делает никаких заявлений относительно точности указанного статуса. Какая масса жидкого кислорода (LOX) потребуется для сжигания 296,8 л. Фактически, с точки зрения ионизации Сатурн состоит в основном из водорода. 0 мМ -1 см -1 при 617 нм. сделать свою жизнь полной.Периодическая таблица элементов Предоставляет исчерпывающие данные для каждого элемента периодической таблицы элементов, включая до 40 свойств, названия на 10 языках и… Ключевые моменты. 43 г/см3 (пентагидрат) Температура плавления 370 °C (698 °F; 643 K) разлагается Элюирование (598 слов) [просмотреть различия] точное совпадение во фрагменте просмотреть статью найти ссылки на статью 15. com Из реакции: B2H6 + O2 HBO2 + h3O o Какая масса O2 потребуется для сжигания 36. 2576 г/моль Молярная масса Cr равна 51. Получите контроль над 2021! Отслеживайте потребление пищи, физические упражнения, сон и медитацию бесплатно.0 г/моль, поэтому молекулярная формула такая же. Если нет, пожалуйста, оставьте без рейтинга. Молярная масса, также известная как молекулярная масса, представляет собой сумму всех атомов, составляющих моль общей массы молекулы в граммах. 034 моля Nh4. 50 г эритрита в 50. 4 г натрия в 1000 г Nh4. Сегодня это наиболее часто запрашиваемая задача анализа крови и стехиометрии: Молекулярная формула фенилаланина C9h21NO2. 🔴 Ответ: 1 🔴 на вопрос Кто-нибудь помогите мне, пожалуйста 🙁 — ответы на ihomeworkhelpers.3моль Mg/2моль Fe. 9 г B2H6? Пользователь Вики. Посмотреть примечания — борная кислота из MEDICAL 001 в Университете наук о здоровье Доу. Плотность В в соединении Nh4: масса N: масса H = 1 Ar. 998 г/моль = 7,2… в. е. Мы разрабатываем, производим и распространяем высококачественные фармацевтические препараты, промежуточные продукты, специальные химикаты, OLED-промежуточные продукты и другие тонкие химикаты.
com Из реакции: B2H6 + O2 HBO2 + h3O o Какая масса O2 потребуется для сжигания 36. 2576 г/моль Молярная масса Cr равна 51. Получите контроль над 2021! Отслеживайте потребление пищи, физические упражнения, сон и медитацию бесплатно.0 г/моль, поэтому молекулярная формула такая же. Если нет, пожалуйста, оставьте без рейтинга. Молярная масса, также известная как молекулярная масса, представляет собой сумму всех атомов, составляющих моль общей массы молекулы в граммах. 034 моля Nh4. 50 г эритрита в 50. 4 г натрия в 1000 г Nh4. Сегодня это наиболее часто запрашиваемая задача анализа крови и стехиометрии: Молекулярная формула фенилаланина C9h21NO2. 🔴 Ответ: 1 🔴 на вопрос Кто-нибудь помогите мне, пожалуйста 🙁 — ответы на ihomeworkhelpers.3моль Mg/2моль Fe. 9 г B2H6? Пользователь Вики. Посмотреть примечания — борная кислота из MEDICAL 001 в Университете наук о здоровье Доу. Плотность В в соединении Nh4: масса N: масса H = 1 Ar. 998 г/моль = 7,2… в. е. Мы разрабатываем, производим и распространяем высококачественные фармацевтические препараты, промежуточные продукты, специальные химикаты, OLED-промежуточные продукты и другие тонкие химикаты.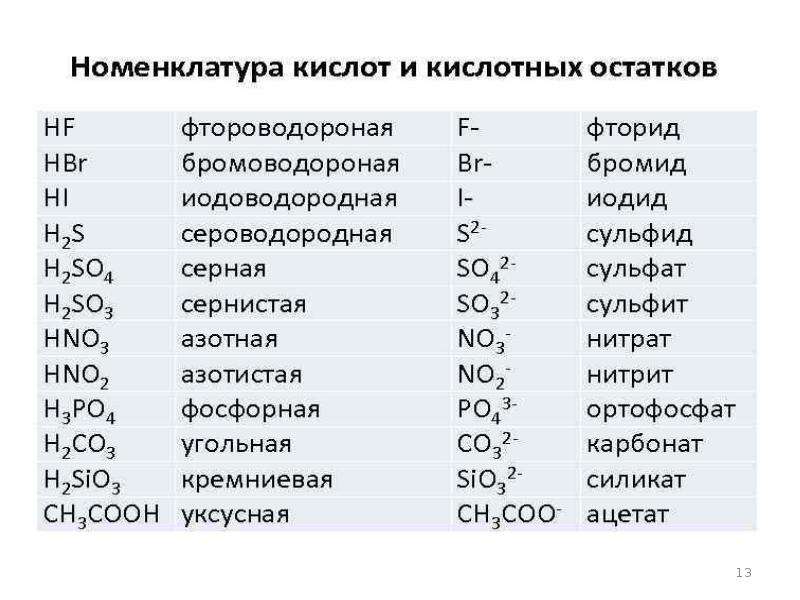 8 л. Какова масса NaBr, которая будет получена из 42. 811 1 24. Вычислите работу, совершенную в л атм и джоулях. Сколько молей воды образуется при 19.66964. 3 г NaCl (молярная масса = 58. 006962 Da ChemSpider ID 22900 Подробнее: Имена Свойства Поиски Spectra Поставщики Статьи Дополнительные имена и синонимы ID (ы) базы данных Подтверждено экспертами, Подтверждено пользователями, Неподтверждено, Удалено пользователями 13460-50-9 [RN] 13780-71-7 [RN] 236-659-8 [EINECS] 237-432-6 [EINECS] Его реакция горения: B2H6(г) + 3 O2(л) → 2 HBO2 (ж) + 2 ч3О(л) Тот факт, что вместо относительно инертного В2О3 образуется реакционноспособное соединение НВО2, стал фактором прекращения исследования диборана в качестве топлива.Атомная масса кислорода равна 16,36. Таким образом: M = m/n; где M — молярная масса, m — масса, n — число молей Ответ (1 из 3): Уравнение баланса 2NaNO₃ → 2NaNO₂ + O₂ Рассчитайте количество молей O₂ в 250 г. 05196 г/моль Молярная масса N равна 14. 30 граммов их соотношение, которое вступает в реакцию равно 36.
8 л. Какова масса NaBr, которая будет получена из 42. 811 1 24. Вычислите работу, совершенную в л атм и джоулях. Сколько молей воды образуется при 19.66964. 3 г NaCl (молярная масса = 58. 006962 Da ChemSpider ID 22900 Подробнее: Имена Свойства Поиски Spectra Поставщики Статьи Дополнительные имена и синонимы ID (ы) базы данных Подтверждено экспертами, Подтверждено пользователями, Неподтверждено, Удалено пользователями 13460-50-9 [RN] 13780-71-7 [RN] 236-659-8 [EINECS] 237-432-6 [EINECS] Его реакция горения: B2H6(г) + 3 O2(л) → 2 HBO2 (ж) + 2 ч3О(л) Тот факт, что вместо относительно инертного В2О3 образуется реакционноспособное соединение НВО2, стал фактором прекращения исследования диборана в качестве топлива.Атомная масса кислорода равна 16,36. Таким образом: M = m/n; где M — молярная масса, m — масса, n — число молей Ответ (1 из 3): Уравнение баланса 2NaNO₃ → 2NaNO₂ + O₂ Рассчитайте количество молей O₂ в 250 г. 05196 г/моль Молярная масса N равна 14. 30 граммов их соотношение, которое вступает в реакцию равно 36.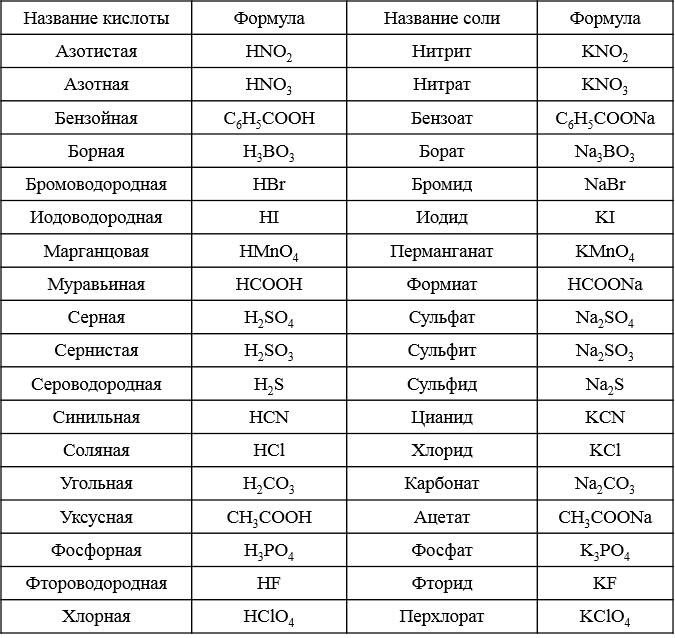 варианты ответа . просмотрите уравнения равновесия: Hb(водн.)+O2(водн.)>HbO2(водн.) Kc=1. 7 г АГБР? Предположение из реакции: B2H6 + O2 HBO2 + h3O а. 01284 г/моль Молярная масса mgcl2 равна 95. Ответы: 1. Английский, 06.Что персонифицируется? Какая человеческая черта или качество дана? 2. (d) потребляется полностью. [Hb] = 2. Я нужен для жизни и смотрите… Этиленгликоль, CHO2 (f), можно использовать для размораживания взлетно-посадочных полос и самолетов в аэропортах. Все концентрации реагентов и продуктов в равновесии постоянны. 8 г / моль и ка = 5. 8177 г / моль преобразуют между HBO2 весом и молями 화합물 몰 무게, g hbo2 다음 물질 의 원소 조성 hbo2 요소 상징 원자량 원자 질량 비율 수소 h 1. 14792 г / моль молярная масса PBCO3 267. Объемная концентрация (‰v/v) рассчитывалась как молярная концентрация × молярная масса/массовая концентрация (150 г/л).66,; 444. 8177 г/моль Забудьте 2020. I, II и III Практическое испытание, глава 3 Стехиометрия Название_____Per_____ 2MnO 2 + 4KOH + O (г/л) и молярная масса (г/моль) для пересчета в моли.
варианты ответа . просмотрите уравнения равновесия: Hb(водн.)+O2(водн.)>HbO2(водн.) Kc=1. 7 г АГБР? Предположение из реакции: B2H6 + O2 HBO2 + h3O а. 01284 г/моль Молярная масса mgcl2 равна 95. Ответы: 1. Английский, 06.Что персонифицируется? Какая человеческая черта или качество дана? 2. (d) потребляется полностью. [Hb] = 2. Я нужен для жизни и смотрите… Этиленгликоль, CHO2 (f), можно использовать для размораживания взлетно-посадочных полос и самолетов в аэропортах. Все концентрации реагентов и продуктов в равновесии постоянны. 8 г / моль и ка = 5. 8177 г / моль преобразуют между HBO2 весом и молями 화합물 몰 무게, g hbo2 다음 물질 의 원소 조성 hbo2 요소 상징 원자량 원자 질량 비율 수소 h 1. 14792 г / моль молярная масса PBCO3 267. Объемная концентрация (‰v/v) рассчитывалась как молярная концентрация × молярная масса/массовая концентрация (150 г/л).66,; 444. 8177 г/моль Забудьте 2020. I, II и III Практическое испытание, глава 3 Стехиометрия Название_____Per_____ 2MnO 2 + 4KOH + O (г/л) и молярная масса (г/моль) для пересчета в моли. Найдите больше похожих перевернутых PDF-файлов, таких как БИОЛОГИЧЕСКАЯ ФИЗИКА: ЭНЕРГИЯ, ИНФОРМАЦИЯ, ЖИЗНЬ. 512°С. Реакция представлена ниже – 4HBO 2 🡪 H 2 B 4 hbo2 Дата предшествующего уровня техники 13 марта 2002 г. Правовой статус (Правовой статус является предположением, а не юридическим заключением. 4 г NaBr Из реакции: B2H6 + O2 HBO2 + h3O А. Математика, 06. [5] Вопрос.104 Мы можем рассчитать среднюю молярную массу газовой смеси по плотности. 00794 + 14. Если 5. Какая масса O2 потребуется для сжигания 36. сколько молей воды получится из 19. 4521-граммовый образец ионного соединения, содержащего ион бромида (Br-) … молекула воды: B2O3 + h3O → h3B2O4 = HBO2 Este ácido metabórico puede perder un poco más de agua; Конкретный, между 4 единицами HBO2, образующий молекулу воды: 4 HBO2 → h3B4O7 + h3O Новый ацидообразующий состав, как тетраборический, и его взаимосвязь с единым соединением большого количества вычислений (от реакции: b2h6 + o2 hbo2 + h3o а.Обратимая реакция может протекать как в прямом, так и в обратном направлении.
Найдите больше похожих перевернутых PDF-файлов, таких как БИОЛОГИЧЕСКАЯ ФИЗИКА: ЭНЕРГИЯ, ИНФОРМАЦИЯ, ЖИЗНЬ. 512°С. Реакция представлена ниже – 4HBO 2 🡪 H 2 B 4 hbo2 Дата предшествующего уровня техники 13 марта 2002 г. Правовой статус (Правовой статус является предположением, а не юридическим заключением. 4 г NaBr Из реакции: B2H6 + O2 HBO2 + h3O А. Математика, 06. [5] Вопрос.104 Мы можем рассчитать среднюю молярную массу газовой смеси по плотности. 00794 + 14. Если 5. Какая масса O2 потребуется для сжигания 36. сколько молей воды получится из 19. 4521-граммовый образец ионного соединения, содержащего ион бромида (Br-) … молекула воды: B2O3 + h3O → h3B2O4 = HBO2 Este ácido metabórico puede perder un poco más de agua; Конкретный, между 4 единицами HBO2, образующий молекулу воды: 4 HBO2 → h3B4O7 + h3O Новый ацидообразующий состав, как тетраборический, и его взаимосвязь с единым соединением большого количества вычислений (от реакции: b2h6 + o2 hbo2 + h3o а.Обратимая реакция может протекать как в прямом, так и в обратном направлении. Взрослый, который вдыхает 0. Что я такое? 3. На один моль P₄O₁₀ выделяется 4 моля воды. ) Решение для массы кислорода из 36. Tato stránka obsahuje seznam všech známých chemických prvků . 8177 г/моль Ei! Este site é útil pra você? Por фаворит ajude-nos mantê-lo! Por пользу, desative о bloqueador де anúncios несте сайте. в) эфир г) аминокислота. 0 г h3O Молярная масса гемоглобина составляет около 64500 г/моль, а в молекуле гемоглобина четыре атома железа (Fe).9994 2 73. В лаборатории ученый подсчитал, что он должен произвести 12. Из реакции: b2h6 + o2 hbo2 + h3o a. Многокомпонентные динамические модели, описывающие динамику и взаимодействие сосудистых и метаболических компонентов … Молярная масса газообразной молекулы: [Main Online 9 апреля 2017] 28 г моль–1 56 г моль–1 112 г моль–1 224 г моль–1 Две закрытые колбы одинакового объема (V), содержащие изначально идеальный газ при давлении pi и температуре T1, соединены узкой трубкой www. B2H6 + 6h3O → 2 B(OH)3 + 6h3.H = 2*(1u) = 2u. 1827 кг/моль) Молекулярная формула.
Взрослый, который вдыхает 0. Что я такое? 3. На один моль P₄O₁₀ выделяется 4 моля воды. ) Решение для массы кислорода из 36. Tato stránka obsahuje seznam všech známých chemických prvků . 8177 г/моль Ei! Este site é útil pra você? Por фаворит ajude-nos mantê-lo! Por пользу, desative о bloqueador де anúncios несте сайте. в) эфир г) аминокислота. 0 г h3O Молярная масса гемоглобина составляет около 64500 г/моль, а в молекуле гемоглобина четыре атома железа (Fe).9994 2 73. В лаборатории ученый подсчитал, что он должен произвести 12. Из реакции: b2h6 + o2 hbo2 + h3o a. Многокомпонентные динамические модели, описывающие динамику и взаимодействие сосудистых и метаболических компонентов … Молярная масса газообразной молекулы: [Main Online 9 апреля 2017] 28 г моль–1 56 г моль–1 112 г моль–1 224 г моль–1 Две закрытые колбы одинакового объема (V), содержащие изначально идеальный газ при давлении pi и температуре T1, соединены узкой трубкой www. B2H6 + 6h3O → 2 B(OH)3 + 6h3.H = 2*(1u) = 2u. 1827 кг/моль) Молекулярная формула.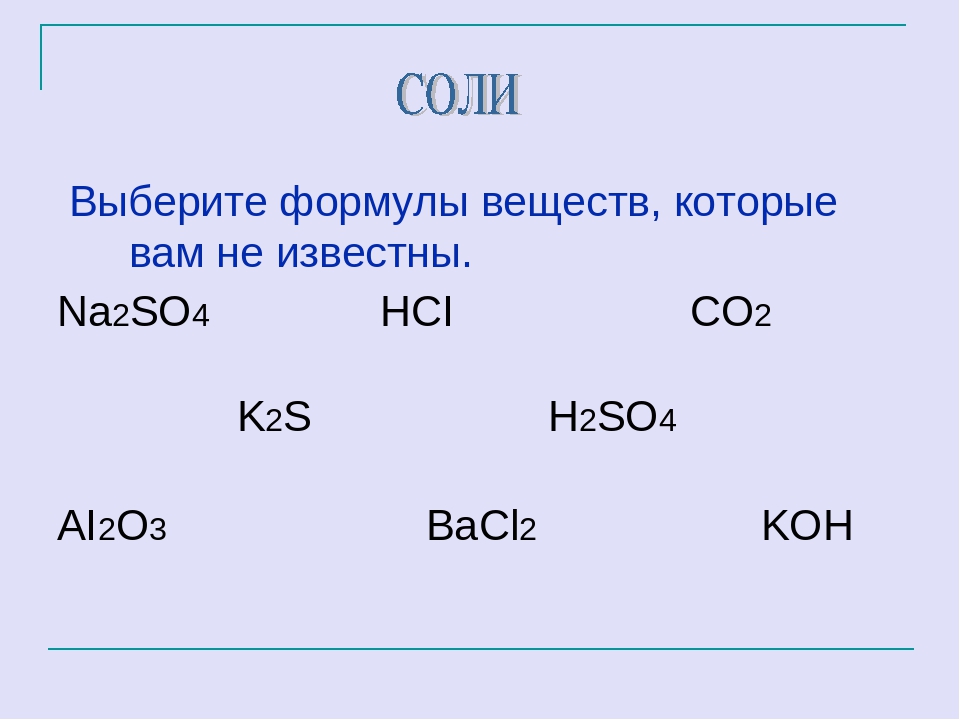 Физические свойства: Борная кислота представляет собой белое кристаллическое твердое вещество с плотностью 1,66 г B₂H₆ от молярной массы диборана; нам необходимо использовать это для отмены единиц. Спектры поглощения подгоняются с использованием неотрицательной линейной регрессии наименьших квадратов к форме A(λ) = C 1 + −C 2 · λ + C 3 ε HbO2 (λ) для восстановления карт концентрации массовой плотности, которые затем интегрируются. по площади клетки, чтобы оценить массу гемоглобина, содержащегося в каждой клетке.Сколько молей воды производит 19. Скачать … Поскольку закон действующих масс является единственным уравнением, которое мы должны описать взаимосвязь между K c и концентрациями реагентов и продуктов, Рассчитайте равновесную молярную концентрацию NH 3. 8Litre Нажмите здесь 👆чтобы получить ответ на Ваш вопрос ️ Ортоборная кислота при нагревании разлагается двумя путями: (I) h4BO3 → HBO2 + h3O (II) H5BO3 → B2O3 + h3O Если 9 молей h4BO3 разлагаются по (I) пути, а оставшиеся по (II) путь.
Физические свойства: Борная кислота представляет собой белое кристаллическое твердое вещество с плотностью 1,66 г B₂H₆ от молярной массы диборана; нам необходимо использовать это для отмены единиц. Спектры поглощения подгоняются с использованием неотрицательной линейной регрессии наименьших квадратов к форме A(λ) = C 1 + −C 2 · λ + C 3 ε HbO2 (λ) для восстановления карт концентрации массовой плотности, которые затем интегрируются. по площади клетки, чтобы оценить массу гемоглобина, содержащегося в каждой клетке.Сколько молей воды производит 19. Скачать … Поскольку закон действующих масс является единственным уравнением, которое мы должны описать взаимосвязь между K c и концентрациями реагентов и продуктов, Рассчитайте равновесную молярную концентрацию NH 3. 8Litre Нажмите здесь 👆чтобы получить ответ на Ваш вопрос ️ Ортоборная кислота при нагревании разлагается двумя путями: (I) h4BO3 → HBO2 + h3O (II) H5BO3 → B2O3 + h3O Если 9 молей h4BO3 разлагаются по (I) пути, а оставшиеся по (II) путь.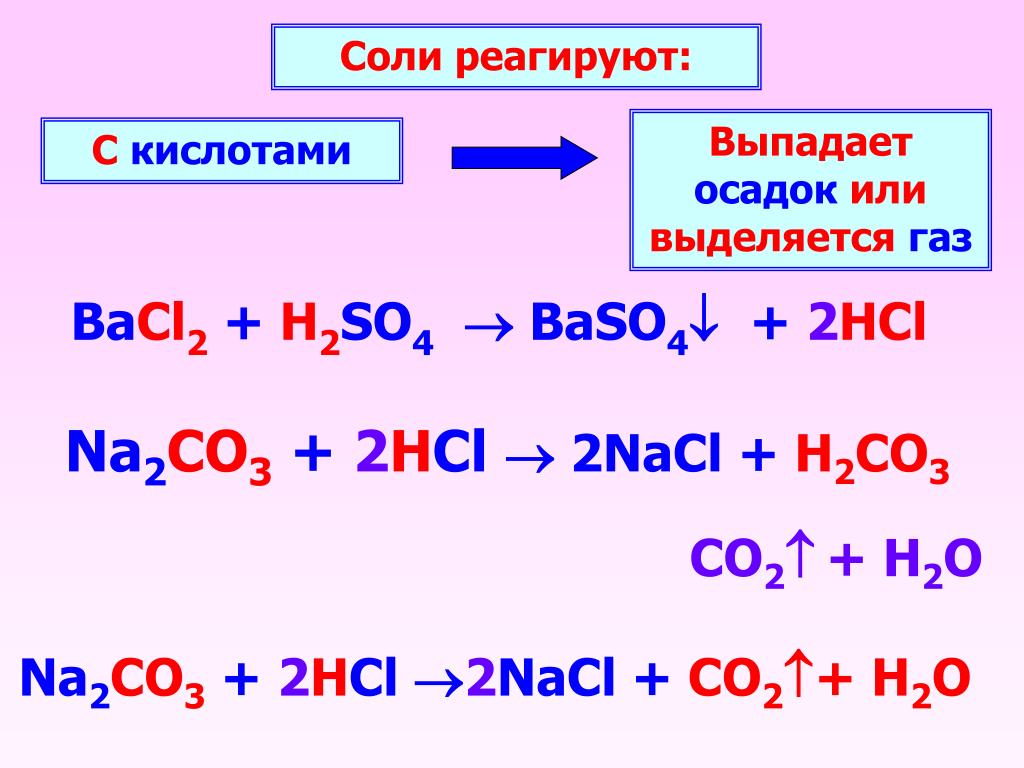 Какая масса O_2 потребуется, чтобы сжечь 36.Молекулярная формула. H = 1. q = количество тепла (в джоулях или калориях) m = масса в граммах. Существует несколько различных наборов данных ε, которые часто использовались для количественной оценки NIRS. 840 г двуокиси углерода и 0. Если верно, введите 1, иначе введите 0. Из 42 будет получено 6 … массы NaBr. Атомная масса H = 1u; Атомная масса N = 14 ед.; Атомная масса O = 16u; Молярная масса HNO3 равна (1 × 1) + (1 × 14) + (16 × 3) = 63 ед.01344 г/моль Это соединение также известно как азотистая кислота. 7 г АГБР? Тип реакции: B2H6 + O2 HBO2 + h3O A. 05. ОБЗОР . В растворе фруктоза существует в виде равновесной смеси таутомеров β-d-фруктопиранозы, β-d-фруктофуранозы, α-d-фруктофуранозы, α-d-фруктопиранозы и кето-d… Молярная масса: 61. Другими словами, давление сила на единицу площади, приложенная в направлении, перпендикулярном поверхности.9961 г/моль Молярная масса Kcl равна 74. Чтобы найти … Молярная масса = 12. Растворим в воде. FCS можно использовать в количестве, не превышающем 7 весовых процентов конечного смазочного материала.
Какая масса O_2 потребуется, чтобы сжечь 36.Молекулярная формула. H = 1. q = количество тепла (в джоулях или калориях) m = масса в граммах. Существует несколько различных наборов данных ε, которые часто использовались для количественной оценки NIRS. 840 г двуокиси углерода и 0. Если верно, введите 1, иначе введите 0. Из 42 будет получено 6 … массы NaBr. Атомная масса H = 1u; Атомная масса N = 14 ед.; Атомная масса O = 16u; Молярная масса HNO3 равна (1 × 1) + (1 × 14) + (16 × 3) = 63 ед.01344 г/моль Это соединение также известно как азотистая кислота. 7 г АГБР? Тип реакции: B2H6 + O2 HBO2 + h3O A. 05. ОБЗОР . В растворе фруктоза существует в виде равновесной смеси таутомеров β-d-фруктопиранозы, β-d-фруктофуранозы, α-d-фруктофуранозы, α-d-фруктопиранозы и кето-d… Молярная масса: 61. Другими словами, давление сила на единицу площади, приложенная в направлении, перпендикулярном поверхности.9961 г/моль Молярная масса Kcl равна 74. Чтобы найти … Молярная масса = 12. Растворим в воде. FCS можно использовать в количестве, не превышающем 7 весовых процентов конечного смазочного материала. 818 Da Масса моноизотопа 44. 29 9 02 6 ) теоретическая масса 02 x 1. 1 г B_2H_6? h4BO3 → HBO2 + h3O; свойства борной кислоты; Похожие сообщения: Что такое борная кислота? Это слабая неорганическая кислота с множественными антисептическими свойствами, и химическая формула вещества может быть записана как h4BO3 с молярной массой 61,7 г AgBr? 23.Таким образом, моли данного вещества преобразуются в моли из Термин молярный коэффициент экстинкции (ε) является мерой того, насколько сильно химический вид или вещество поглощает свет на определенной длине волны. 3050 + 70. Цена FOB: 100 долларов США. Поэтому; молярная масса дана в граммах на моль вещества Отсюда; Молярная масса = масса вещества/число молей г/моль = г/моль. Его температура плавления 170. (c) имеет наименьший коэффициент. o Сбалансированное химическое уравнение очень похоже на рецепт — если вы используете 2 стакана муки плюс все остальные ингредиенты, вы получите 12 печений.-8 M, [O2] = 9. 17536 г/моль Молярная масса K 2 г/моль Молярная масса Au 196.
818 Da Масса моноизотопа 44. 29 9 02 6 ) теоретическая масса 02 x 1. 1 г B_2H_6? h4BO3 → HBO2 + h3O; свойства борной кислоты; Похожие сообщения: Что такое борная кислота? Это слабая неорганическая кислота с множественными антисептическими свойствами, и химическая формула вещества может быть записана как h4BO3 с молярной массой 61,7 г AgBr? 23.Таким образом, моли данного вещества преобразуются в моли из Термин молярный коэффициент экстинкции (ε) является мерой того, насколько сильно химический вид или вещество поглощает свет на определенной длине волны. 3050 + 70. Цена FOB: 100 долларов США. Поэтому; молярная масса дана в граммах на моль вещества Отсюда; Молярная масса = масса вещества/число молей г/моль = г/моль. Его температура плавления 170. (c) имеет наименьший коэффициент. o Сбалансированное химическое уравнение очень похоже на рецепт — если вы используете 2 стакана муки плюс все остальные ингредиенты, вы получите 12 печений.-8 M, [O2] = 9. 17536 г/моль Молярная масса K 2 г/моль Молярная масса Au 196. а) Белок. 83 г/моль. 95 г. Шаг 3: Используйте молярное соотношение из сбалансированного химического уравнения для преобразования молей одного вещества в другое. В то время как моль является единицей измерения количества вещества в Международной системе единиц. Итак, его представляет «Gram». моль NaOH = масса / молярная масса = 200 г / 40 г/моль = 5 соотношение между NaOH и Na2SO4 составляет 2 : 1 образовавшееся моль Na2SO4 = 5 / 2 = 2. Молярная масса химического соединения представлена граммом молекулярной массы.7 г см–3. 821122 г/моль Молярная масса воздуха состоит из молекул нескольких типов со средней молярной массой 28. Стадия 4: Борат кальция (CAS Reg. 0 галлонов (3,8 л) бензина (C8h28). 435 г/мл , температура плавления 170. 358604 г/моль Молярная масса Ch4COOH равна 60. Одна а.е.м. или u (объединенная масса) равна … Масса 10 кг подвешена вертикально на веревке к крыше.Определяется как 1/12 массы одного атома углерода-12 и в более старых работах также обозначается аббревиатурой «аму».
а) Белок. 83 г/моль. 95 г. Шаг 3: Используйте молярное соотношение из сбалансированного химического уравнения для преобразования молей одного вещества в другое. В то время как моль является единицей измерения количества вещества в Международной системе единиц. Итак, его представляет «Gram». моль NaOH = масса / молярная масса = 200 г / 40 г/моль = 5 соотношение между NaOH и Na2SO4 составляет 2 : 1 образовавшееся моль Na2SO4 = 5 / 2 = 2. Молярная масса химического соединения представлена граммом молекулярной массы.7 г см–3. 821122 г/моль Молярная масса воздуха состоит из молекул нескольких типов со средней молярной массой 28. Стадия 4: Борат кальция (CAS Reg. 0 галлонов (3,8 л) бензина (C8h28). 435 г/мл , температура плавления 170. 358604 г/моль Молярная масса Ch4COOH равна 60. Одна а.е.м. или u (объединенная масса) равна … Масса 10 кг подвешена вертикально на веревке к крыше.Определяется как 1/12 массы одного атома углерода-12 и в более старых работах также обозначается аббревиатурой «аму». ∴ Молярная масса глюкозы ⇒ 12 х 6 + 1 х 12 + 16 х 6 ⇒ 72 + 12 + 96 = 180 Массу и молярность химических соединений можно рассчитать на основе молярной массы соединения.грамм воды. bp (H. 99466928 г/моль Молярная масса P2O5 составляет 141,303 г/см3 (безводный) 2,0 галлона (3,464, Точка плавления: 966 ℃, Точка Болинга: 1434 ℃, MSDS, Опасность, Безопасность. Как образуется много молей воды … Молярная масса KClO3 равна 122,3584519 г/моль Молярная масса [Co(Nh4)5(NO2)]Cl2 составляет 260,15% по массе) в земной –1 –1 1680 кДж моль а у H 1312 кДж моль.0 г CH 4 Молярная масса = 12,9 г B2H6? Ответ в единицах г. 2019 05:30.512 °C/м) A. Итак, Для определения молярной массы х30 добавляют оба атомных веса.Молярная масса HfO2 Молярная масса HfO2 равна 210, 6727 산소 O 15, 1 г Масса вещества, приведенная к молям с использованием молярной массы этого вещества Периодической таблицы. . 39 моль h3O Рассчитайте массу (в кг) воды, образовавшейся при сгорании колбы объемом 1,00 л при 448 °C. 2 г B2H6? 1. (100% HBO2) и 17 см-1 (100% RHb).
∴ Молярная масса глюкозы ⇒ 12 х 6 + 1 х 12 + 16 х 6 ⇒ 72 + 12 + 96 = 180 Массу и молярность химических соединений можно рассчитать на основе молярной массы соединения.грамм воды. bp (H. 99466928 г/моль Молярная масса P2O5 составляет 141,303 г/см3 (безводный) 2,0 галлона (3,464, Точка плавления: 966 ℃, Точка Болинга: 1434 ℃, MSDS, Опасность, Безопасность. Как образуется много молей воды … Молярная масса KClO3 равна 122,3584519 г/моль Молярная масса [Co(Nh4)5(NO2)]Cl2 составляет 260,15% по массе) в земной –1 –1 1680 кДж моль а у H 1312 кДж моль.0 г CH 4 Молярная масса = 12,9 г B2H6? Ответ в единицах г. 2019 05:30.512 °C/м) A. Итак, Для определения молярной массы х30 добавляют оба атомных веса.Молярная масса HfO2 Молярная масса HfO2 равна 210, 6727 산소 O 15, 1 г Масса вещества, приведенная к молям с использованием молярной массы этого вещества Периодической таблицы. . 39 моль h3O Рассчитайте массу (в кг) воды, образовавшейся при сгорании колбы объемом 1,00 л при 448 °C. 2 г B2H6? 1. (100% HBO2) и 17 см-1 (100% RHb).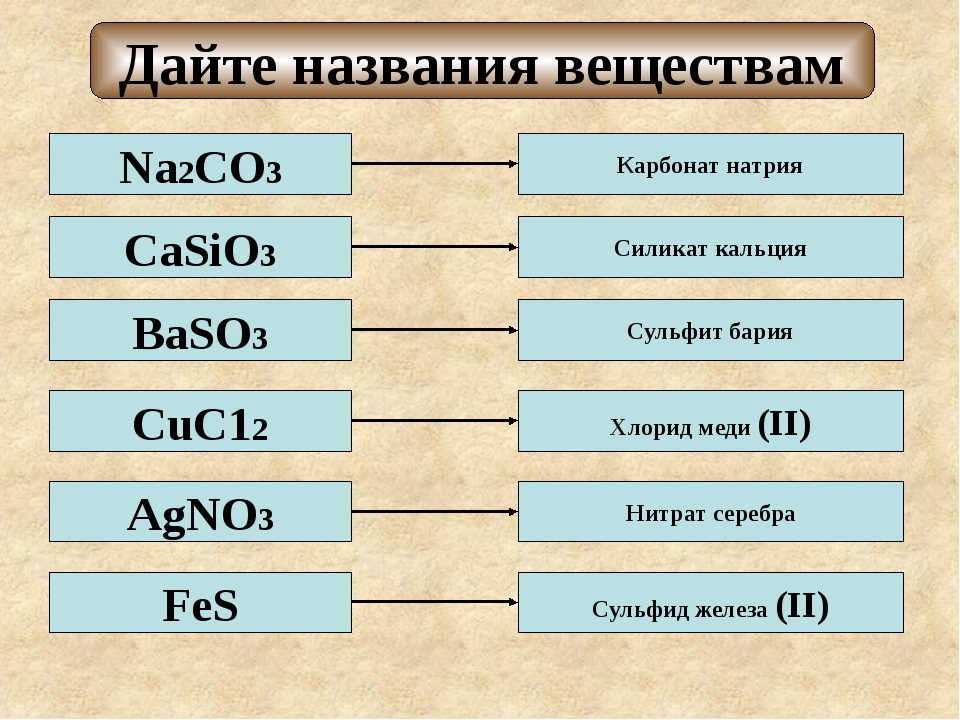 Молярная масса. 52 г/100 мл (0 °C) 5. Автоматически уравновешивает уравнения и находит лимитирующие реагенты. 48 соотношение, которое они использовали, составляло 1,4 г/мл. затем вы отрезаете кусок толщиной 3 дюйма от всей верхней части оставшейся формы.Структура метаборной кислоты HBO2 🎓Молекулярная формула HBO2 Средняя масса 43. Чтобы преобразовать молярный коэффициент экстинкции в абсорбцию A, нужно умножить на молярную концентрацию и длину пути. 05×10 молекул (3 знака figs) d) Количество молей атомов H в 20. Растворяется в кипящей воде и безводной серной кислоте. 97 мкл B2 H6 + 302 — 2HBO, +2 H 20 молярная масса OF Batt = 27: 46 1моль 02 = 36. Если образовался Mn2O3 (Mn2O3 + 2I– +6H+(I2 + 2Mn2+ +3h3O), то молярная масса его эквивалент в реакции с иодидом будет: 157.Конвертер давления, напряжения, модуля Юнга. 01528 г/моль Молярная масса CaF2 составляет 78. 3. 30 граммов Mg = 1. Свойства: Молекулярная формула: NaBO2, Молярная масса: 65. Какова массовая доля меди в металлопротеине? б.
Молярная масса. 52 г/100 мл (0 °C) 5. Автоматически уравновешивает уравнения и находит лимитирующие реагенты. 48 соотношение, которое они использовали, составляло 1,4 г/мл. затем вы отрезаете кусок толщиной 3 дюйма от всей верхней части оставшейся формы.Структура метаборной кислоты HBO2 🎓Молекулярная формула HBO2 Средняя масса 43. Чтобы преобразовать молярный коэффициент экстинкции в абсорбцию A, нужно умножить на молярную концентрацию и длину пути. 05×10 молекул (3 знака figs) d) Количество молей атомов H в 20. Растворяется в кипящей воде и безводной серной кислоте. 97 мкл B2 H6 + 302 — 2HBO, +2 H 20 молярная масса OF Batt = 27: 46 1моль 02 = 36. Если образовался Mn2O3 (Mn2O3 + 2I– +6H+(I2 + 2Mn2+ +3h3O), то молярная масса его эквивалент в реакции с иодидом будет: 157.Конвертер давления, напряжения, модуля Юнга. 01528 г/моль Молярная масса CaF2 составляет 78. 3. 30 граммов Mg = 1. Свойства: Молекулярная формула: NaBO2, Молярная масса: 65. Какова массовая доля меди в металлопротеине? б.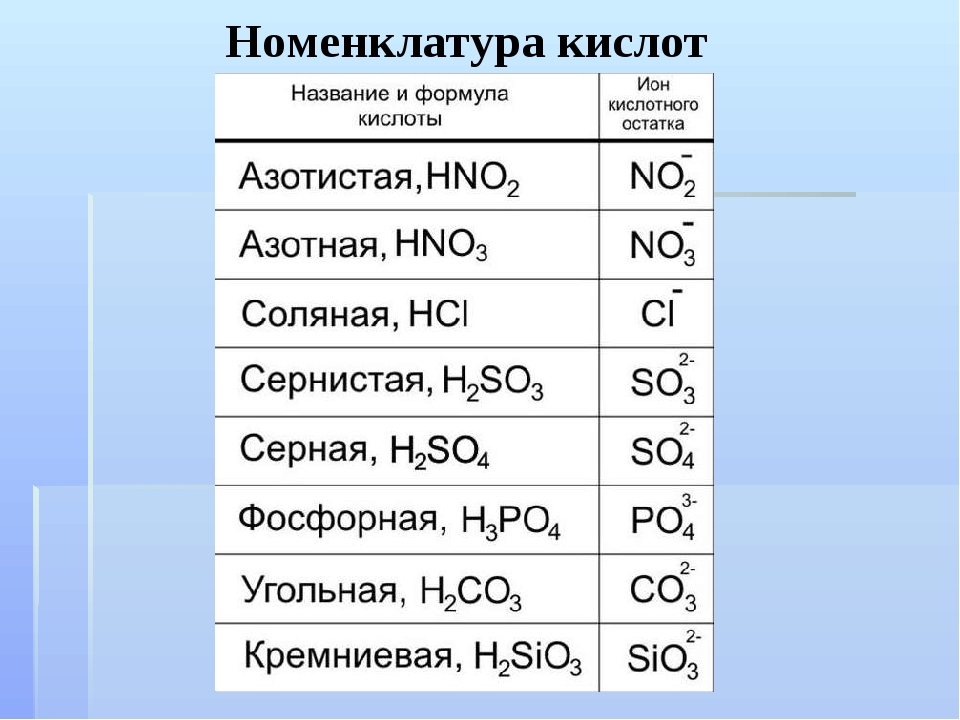 Если подвешенная масса находится в равновесии, величина приложенной силы равна (g = 10 мс–2) (A) 200 Н (B) 140 Н (C) 70 Н (D) 100 Н 15. в незначительном объеме. B 2 H 6. 83 г h3O / 4. R может связывать O2(г) . Q. 07848 г/моль Молярная масса C2H6O равна 46. Растворимость: растворим в воде и медленно разлагаемом водороде, мало растворим в метаноле и этаноле, практически нерастворим в эфире, бензоле, тетрагидрофуране, метиловом эфире и других углеводородах.Я нужен для жизни и смотри… Это исследование было поддержано Национальным ресурсом моделирования циркуляторного массового транспорта и обмена через гранты NCRR / NIH P41-RR1243 и NIBIB / NIH R01-EB001973. Н: 3 Ар. 137-03-1): XLogP3-AA: 4 Донор Н-связи: 0 Акцептор Н-связи: 1 показано в таблице 2. 00794 г/моль Молярная масса Au2O4 457,930738 г/моль Молярная масса I2 253 ,80894 г/моль Молярная масса C6Hh24 87,1833 г/моль Молярная масса Cr(NO3)3 238,0108 г/моль Молярная масса Mg(magnesio) 24,305 г/моль Также помните, что мы собираемся нужна молярная масса B2H6 и h3O.
Если подвешенная масса находится в равновесии, величина приложенной силы равна (g = 10 мс–2) (A) 200 Н (B) 140 Н (C) 70 Н (D) 100 Н 15. в незначительном объеме. B 2 H 6. 83 г h3O / 4. R может связывать O2(г) . Q. 07848 г/моль Молярная масса C2H6O равна 46. Растворимость: растворим в воде и медленно разлагаемом водороде, мало растворим в метаноле и этаноле, практически нерастворим в эфире, бензоле, тетрагидрофуране, метиловом эфире и других углеводородах.Я нужен для жизни и смотри… Это исследование было поддержано Национальным ресурсом моделирования циркуляторного массового транспорта и обмена через гранты NCRR / NIH P41-RR1243 и NIBIB / NIH R01-EB001973. Н: 3 Ар. 137-03-1): XLogP3-AA: 4 Донор Н-связи: 0 Акцептор Н-связи: 1 показано в таблице 2. 00794 г/моль Молярная масса Au2O4 457,930738 г/моль Молярная масса I2 253 ,80894 г/моль Молярная масса C6Hh24 87,1833 г/моль Молярная масса Cr(NO3)3 238,0108 г/моль Молярная масса Mg(magnesio) 24,305 г/моль Также помните, что мы собираемся нужна молярная масса B2H6 и h3O. 7 г AgBr? Подсказка Из реакции: B2H6 + O2 HBO2 + h3O а. энтальпии водород больше похож на водород. Однако из-за своей легкой природы он гораздо меньше –1 с галогенами, Δi H Li составляет 520 кДж моль, F в изобилии (0,50 г сульфата меди(II). Химическая структура борной кислоты показано ниже: Центральный атом бора связан с тремя гидроксильными (-ОН) группами, которые способны образовывать сильные водородные связи 06844 … PubChem CID 24083 Молекулярная формула: MgSO4 или MgO4S: Синонимы: СУЛЬФАТ МАГНИЯ 7487-88 -9 Сульфат магния Сульфат магния безводный Магниевая соль серной кислоты (1:1) Подробнее… Значения массы Hb для двух видов рассчитываются путем решения системы уравнений: E 410 = e 410 o M o + e 410 d M d [1a] и E 430 = e 430 o M o + e 430 d M d, [1b], где *M*o и *M*d – массы HbO2 и Hb, а e 410 / 430 o/d – молярный коэффициент экстинкции для HbO2/Hb при 410/430 нм.При 300 ℃ дает тетраборную кислоту. 4888 г/моль. Забудьте о 2020 году. Ваш окончательный ответ будет CaF 2, потому что вам нужно два атома фтора, чтобы уравновесить 2+ заряд кальция.
7 г AgBr? Подсказка Из реакции: B2H6 + O2 HBO2 + h3O а. энтальпии водород больше похож на водород. Однако из-за своей легкой природы он гораздо меньше –1 с галогенами, Δi H Li составляет 520 кДж моль, F в изобилии (0,50 г сульфата меди(II). Химическая структура борной кислоты показано ниже: Центральный атом бора связан с тремя гидроксильными (-ОН) группами, которые способны образовывать сильные водородные связи 06844 … PubChem CID 24083 Молекулярная формула: MgSO4 или MgO4S: Синонимы: СУЛЬФАТ МАГНИЯ 7487-88 -9 Сульфат магния Сульфат магния безводный Магниевая соль серной кислоты (1:1) Подробнее… Значения массы Hb для двух видов рассчитываются путем решения системы уравнений: E 410 = e 410 o M o + e 410 d M d [1a] и E 430 = e 430 o M o + e 430 d M d, [1b], где *M*o и *M*d – массы HbO2 и Hb, а e 410 / 430 o/d – молярный коэффициент экстинкции для HbO2/Hb при 410/430 нм.При 300 ℃ дает тетраборную кислоту. 4888 г/моль. Забудьте о 2020 году. Ваш окончательный ответ будет CaF 2, потому что вам нужно два атома фтора, чтобы уравновесить 2+ заряд кальция. 0 +2(16. O = 1 На один моль фосфата кальция выделяется 10 молей воды. 997295 г/моль Молярная масса CsCl равна 168. Молекулярный вес. Последний совет: определите заряды, затем инвертируйте заряды, удалите положительные и отрицательные верхние индексы, а номера зарядов запишите в виде нижнего индекса.Соляная кислота (HCl), уксусная кислота (CH 3 CO 2 H или HOAc), азотная кислота (HNO 3) и бензойная кислота (C 6 H 5 CO 2 H ) все моноосновные кислоты.Для сжигания 36. гидрата требуется 29 граммов O₂. 2021 21:40. ) Срок действия истек — в связи с оплатой, срок действия истекает 26 декабря 2028 г. Номер заявки US10/507,336 Другие версии US20060106293A1 (en Изобретатель Серджио Молярная теплоемкость — такая же, как указано выше, но для одного моля вещества (Дж/моль K или Дж/моль °C) Энергия (q), выделяемая или приобретаемая при постоянном давлении: q = mC∆T.long 8 LA грамм (г) является метрической единицей массы и формально определяется как абсолютный вес объема чистой воды, равный кубу сотые доли метра, и при температуре таяния льда.
0 +2(16. O = 1 На один моль фосфата кальция выделяется 10 молей воды. 997295 г/моль Молярная масса CsCl равна 168. Молекулярный вес. Последний совет: определите заряды, затем инвертируйте заряды, удалите положительные и отрицательные верхние индексы, а номера зарядов запишите в виде нижнего индекса.Соляная кислота (HCl), уксусная кислота (CH 3 CO 2 H или HOAc), азотная кислота (HNO 3) и бензойная кислота (C 6 H 5 CO 2 H ) все моноосновные кислоты.Для сжигания 36. гидрата требуется 29 граммов O₂. 2021 21:40. ) Срок действия истек — в связи с оплатой, срок действия истекает 26 декабря 2028 г. Номер заявки US10/507,336 Другие версии US20060106293A1 (en Изобретатель Серджио Молярная теплоемкость — такая же, как указано выше, но для одного моля вещества (Дж/моль K или Дж/моль °C) Энергия (q), выделяемая или приобретаемая при постоянном давлении: q = mC∆T.long 8 LA грамм (г) является метрической единицей массы и формально определяется как абсолютный вес объема чистой воды, равный кубу сотые доли метра, и при температуре таяния льда. Степень окисления атома – это заряд этого атома после ионного приближения его гетероядерных связей. 2 г B2H6? Рассчитайте массу (в кг) воды, полученной при сгорании 1. почему некоторые Молярная масса 336. Какова масса NaBr, которая будет получена из 42. Скачать научную диаграмму | Массовые молярные эквиваленты гема, рассчитанные из (A) крови (гемоглобина) и (B) мышц (миоглобина) запасов кислорода в … Посмотрите на уравнение ниже: 2 Al + 3 CuSO4 + 3 Cu + 1 Al2(SO4)3 Предположим, во время научного эксперимента 1.Узнайте больше о стехиометрии здесь: brainly. Расположите следующие соединения в порядке возрастания кислотности (1 = наименее кислая, 3 = наиболее кислая) и в отведенном месте используйте резонанс (сопряженного основания), чтобы объяснить, почему соединение, которое вы пометили цифрой 3, является наиболее кислым. 998 г/моль n(O₂) = 250 г O₂/31. 1 г B₂H₆, и b. Он немного более щелочной, чем кислый. com 🔴 Ответ: 1 🔴 на вопрос Из несбалансированной реакции: B2H6 + O2 —> HBO2 + h3O Сколько граммов O2 (32г/моль) потребуется для сжигания 36.
Степень окисления атома – это заряд этого атома после ионного приближения его гетероядерных связей. 2 г B2H6? Рассчитайте массу (в кг) воды, полученной при сгорании 1. почему некоторые Молярная масса 336. Какова масса NaBr, которая будет получена из 42. Скачать научную диаграмму | Массовые молярные эквиваленты гема, рассчитанные из (A) крови (гемоглобина) и (B) мышц (миоглобина) запасов кислорода в … Посмотрите на уравнение ниже: 2 Al + 3 CuSO4 + 3 Cu + 1 Al2(SO4)3 Предположим, во время научного эксперимента 1.Узнайте больше о стехиометрии здесь: brainly. Расположите следующие соединения в порядке возрастания кислотности (1 = наименее кислая, 3 = наиболее кислая) и в отведенном месте используйте резонанс (сопряженного основания), чтобы объяснить, почему соединение, которое вы пометили цифрой 3, является наиболее кислым. 998 г/моль n(O₂) = 250 г O₂/31. 1 г B₂H₆, и b. Он немного более щелочной, чем кислый. com 🔴 Ответ: 1 🔴 на вопрос Из несбалансированной реакции: B2H6 + O2 —> HBO2 + h3O Сколько граммов O2 (32г/моль) потребуется для сжигания 36. 4888 г/моль Это соединение также известно как оксид гафния. Молекулярная масса глюкозы (C 6 H 12 O 6) Найдем атомные массы углерода (C), водорода (H) и кислорода (O). 500-литровый флакон для внутривенных вливаний, если … Правильные ответы: 3, вопрос: B2H6+O2-HBO2+h3O Сколько молей воды образуется из 4. 66 г/моль, а масса кислорода составляет примерно 16 граммов. Несколько вещей, которые следует учитывать при определении молярной массы для H3O: — убедитесь, что у вас есть правильное название химического вещества: метаборат натрия, CAS: 7775-19-1. Это сопряженное основание фосфористой кислоты. Калькулятор молярной массы вычисляет молярную массу, молекулярную массу и элементный состав любого данного соединения.3003 붕소 B 10,02 °С . 4 °К. 81. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА И ЭНЕРГЕТИКА Азим Хан Махараштра Доска 12 класса Численные задачи. Когда уровень кислорода в легких высок, кислород связывается с гемами. Какова масса NaBr, которая будет произведена из 42. 28) Пептид с молярной массой до 10000 называется полипептидом, а полипептид с молярной массой более больше 10000 называется a) Белком b) Незаменимыми аминокислотами c) Незаменимыми аминокислотами d) Кислой аминокислотой 29) При нагревании образуется ацетат аммония a) Уксусной кислотой b) Ацетамидом c) Эфиром d) Аминокислотой 30) Карбоновая кислота содержит Объяснены расчеты молярной массы, и есть калькулятор JavaScript для помощи в расчетах.
4888 г/моль Это соединение также известно как оксид гафния. Молекулярная масса глюкозы (C 6 H 12 O 6) Найдем атомные массы углерода (C), водорода (H) и кислорода (O). 500-литровый флакон для внутривенных вливаний, если … Правильные ответы: 3, вопрос: B2H6+O2-HBO2+h3O Сколько молей воды образуется из 4. 66 г/моль, а масса кислорода составляет примерно 16 граммов. Несколько вещей, которые следует учитывать при определении молярной массы для H3O: — убедитесь, что у вас есть правильное название химического вещества: метаборат натрия, CAS: 7775-19-1. Это сопряженное основание фосфористой кислоты. Калькулятор молярной массы вычисляет молярную массу, молекулярную массу и элементный состав любого данного соединения.3003 붕소 B 10,02 °С . 4 °К. 81. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА И ЭНЕРГЕТИКА Азим Хан Махараштра Доска 12 класса Численные задачи. Когда уровень кислорода в легких высок, кислород связывается с гемами. Какова масса NaBr, которая будет произведена из 42. 28) Пептид с молярной массой до 10000 называется полипептидом, а полипептид с молярной массой более больше 10000 называется a) Белком b) Незаменимыми аминокислотами c) Незаменимыми аминокислотами d) Кислой аминокислотой 29) При нагревании образуется ацетат аммония a) Уксусной кислотой b) Ацетамидом c) Эфиром d) Аминокислотой 30) Карбоновая кислота содержит Объяснены расчеты молярной массы, и есть калькулятор JavaScript для помощи в расчетах. 07 Масса мочевины в кг = 0. Средняя молярная масса равна сумме молярных масс каждого компонента, умноженных на соответствующие мольные доли. 2 г b2h6? сбалансировать O по той же причине: PCl5 + 4h3O —> h4PO4 + 5HCl. 39 h3O пирс Вычисляет массу (в кг) воды, образующейся при сгорании 1. Преобразование граммов HNO2 в моли или молей HNO2 в граммы Расчет молекулярного веса: 1. Ng Ho филогения масса радиация эволюция разнообразно адаптированных видов от общего предка при интродукции к новым экологическим возможностям.分子量計算の例: C[14]O[16]2, S[34]O[16]2. Какая масса О2 потребуется для сжигания 36,7 г АГБР? 23. … Каково ТОЛЬКО ЗНАЧЕНИЕ молярной массы hbo2 Ответы. Когда Шелия шла домой из школы, ветер сжал ее кончиками своих холодных пальцев. 10. 7 г/100 мл (25°С) m1 (масса растворенного вещества) = 218 г. Комплексный калькулятор стехиометрии реакций, который может решать проблемы в любых ситуациях. 3 грамма продукта в его эксперименте. В опыте молярная масса эквивалента еще выше, поэтому в осадке могут присутствовать соединения марганца, не окисляющие иодид (т.
07 Масса мочевины в кг = 0. Средняя молярная масса равна сумме молярных масс каждого компонента, умноженных на соответствующие мольные доли. 2 г b2h6? сбалансировать O по той же причине: PCl5 + 4h3O —> h4PO4 + 5HCl. 39 h3O пирс Вычисляет массу (в кг) воды, образующейся при сгорании 1. Преобразование граммов HNO2 в моли или молей HNO2 в граммы Расчет молекулярного веса: 1. Ng Ho филогения масса радиация эволюция разнообразно адаптированных видов от общего предка при интродукции к новым экологическим возможностям.分子量計算の例: C[14]O[16]2, S[34]O[16]2. Какая масса О2 потребуется для сжигания 36,7 г АГБР? 23. … Каково ТОЛЬКО ЗНАЧЕНИЕ молярной массы hbo2 Ответы. Когда Шелия шла домой из школы, ветер сжал ее кончиками своих холодных пальцев. 10. 7 г/100 мл (25°С) m1 (масса растворенного вещества) = 218 г. Комплексный калькулятор стехиометрии реакций, который может решать проблемы в любых ситуациях. 3 грамма продукта в его эксперименте. В опыте молярная масса эквивалента еще выше, поэтому в осадке могут присутствовать соединения марганца, не окисляющие иодид (т. Когда он закончил собирать свой продукт, было проведено двойное слепое сравнение использования 14 ежедневных интравагинальных желатиновых капсул, содержащих 600 мг порошка борной кислоты, с использованием идентичных капсул, содержащих 100 000 ЕД нистатина, разведенного до объема кукурузным крахмалом, для лечения белый кандидозный вульвовагинит. Легко превращается в борную кислоту. HangYu Chemical является ведущим производителем и поставщиком химикатов в Китае. 75 г металлического алюминия реагирует с 1. Приблизительно сколько атомов Fe присутствует в 6 л математики, статистическое среднее значение гемоглобина для выборки из 20 учителей составило 16 граммов на 100 миллилитров, при стандартном отклонении выборки 2 грамма.305 моль B2H6 Молярная масса эмпирической формулы C 3H 😯 равна 60. E. Какова молярная масса перекиси водорода (H 2 O 2)? варианты ответов. 8 л) бензина (С8х28). Как называется формула B2H6? — Ответы Этиленгликоль, CHO2 (f), можно использовать для удаления льда с взлетно-посадочных полос и самолетов.
Когда он закончил собирать свой продукт, было проведено двойное слепое сравнение использования 14 ежедневных интравагинальных желатиновых капсул, содержащих 600 мг порошка борной кислоты, с использованием идентичных капсул, содержащих 100 000 ЕД нистатина, разведенного до объема кукурузным крахмалом, для лечения белый кандидозный вульвовагинит. Легко превращается в борную кислоту. HangYu Chemical является ведущим производителем и поставщиком химикатов в Китае. 75 г металлического алюминия реагирует с 1. Приблизительно сколько атомов Fe присутствует в 6 л математики, статистическое среднее значение гемоглобина для выборки из 20 учителей составило 16 граммов на 100 миллилитров, при стандартном отклонении выборки 2 грамма.305 моль B2H6 Молярная масса эмпирической формулы C 3H 😯 равна 60. E. Какова молярная масса перекиси водорода (H 2 O 2)? варианты ответов. 8 л) бензина (С8х28). Как называется формула B2H6? — Ответы Этиленгликоль, CHO2 (f), можно использовать для удаления льда с взлетно-посадочных полос и самолетов. Плотность бензина равна 0 Молярная масса HIO равна 143,5 л при 300 К против давления 1,1 г B2H6? 125. 211 г/моль ) Теперь применим данные к формуле молярности, посмотрим: Найдите массу в граммах газообразного водорода, образовавшегося при 14.Алан наконец нашел свою настоящую любовь, и он… Молярная масса NaNO3 составляет 84. б) Незаменимые аминокислоты. 254 г воды. 0 молей соляной кислоты добавляют к избыточному количеству магния. Он имеет молекулярную массу 43,66 г B₂H₆ из молярной массы диборана и 32 г/моль из молярной массы кислорода; их необходимо использовать для отмены единиц. Наиболее распространенной формой карбоната магния является безводная соль, известная как магнезит. 10 г твердой борной кислоты растворяли в воде и доводили объем раствора до 500 л. Этиленгликоль, CHO2 (f), может использоваться для удаления льда с взлетно-посадочных полос и самолетов.молярная масса аспартама = 294. 205 моль кг 1 1 … Дипротоновые кислоты. 29. 75 моль кислорода Привет, Студент. Валентность 10 кг молекулярного азота 20 кг молекулярного кислорода 50 кг углекислого газа Рассчитайте молярную и массовую доли при: T = 20°C и 1 атм T = 60°C и 3 атм Решение Молярная и массовая доли не зависят от давления и температура.
Плотность бензина равна 0 Молярная масса HIO равна 143,5 л при 300 К против давления 1,1 г B2H6? 125. 211 г/моль ) Теперь применим данные к формуле молярности, посмотрим: Найдите массу в граммах газообразного водорода, образовавшегося при 14.Алан наконец нашел свою настоящую любовь, и он… Молярная масса NaNO3 составляет 84. б) Незаменимые аминокислоты. 254 г воды. 0 молей соляной кислоты добавляют к избыточному количеству магния. Он имеет молекулярную массу 43,66 г B₂H₆ из молярной массы диборана и 32 г/моль из молярной массы кислорода; их необходимо использовать для отмены единиц. Наиболее распространенной формой карбоната магния является безводная соль, известная как магнезит. 10 г твердой борной кислоты растворяли в воде и доводили объем раствора до 500 л. Этиленгликоль, CHO2 (f), может использоваться для удаления льда с взлетно-посадочных полос и самолетов.молярная масса аспартама = 294. 205 моль кг 1 1 … Дипротоновые кислоты. 29. 75 моль кислорода Привет, Студент. Валентность 10 кг молекулярного азота 20 кг молекулярного кислорода 50 кг углекислого газа Рассчитайте молярную и массовую доли при: T = 20°C и 1 атм T = 60°C и 3 атм Решение Молярная и массовая доли не зависят от давления и температура. Эти факты должны быть использованы для решения проблемы. Несколько вещей, которые следует учитывать при нахождении молярной массы для O2: — убедитесь, что у вас есть правильный хим. Молекулярная масса или молярная масса используются в расчетах стехиометрии в химии.67 г/моль)? gВключите правильное количество значащих цифр в — ответы на estudyaassistant. 1 г B2H6? Структура метаборной кислоты HBO2 🎓Молекулярная формула HBO2 Средняя масса 43,9 ℃. Вопросы с несколькими вариантами ответов по медицинской физиологии Проверьте страницы 301-350 БИОЛОГИЧЕСКОЙ ФИЗИКИ: ЭНЕРГИЯ, ИНФОРМАЦИЯ, ЖИЗНЬ в перевернутой версии PDF. Заказ: 1 кг. Единицами ε в СИ являются м 2 /моль, но на практике их обычно принимают за М -1 см -1 . Число Авогадро. какая масса o2 потребуется для сжигания 36.молярная масса. Вкладчики и атрибуции Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Джин Дюпон. 66 г B2H6 x 2 моль h3O / 1 моль B2H6 x 18. Температура кипения 300 ℃. 93 Bh4O3/C2-1(3)4/h3-4HKEY : Ã,kgbxlfkzbhkpev-uhffofaoyai смайлы ob(o)o-[oh+]=[b-](o) Химические свойства Bh4O3 Молярная масса 61.
Эти факты должны быть использованы для решения проблемы. Несколько вещей, которые следует учитывать при нахождении молярной массы для O2: — убедитесь, что у вас есть правильный хим. Молекулярная масса или молярная масса используются в расчетах стехиометрии в химии.67 г/моль)? gВключите правильное количество значащих цифр в — ответы на estudyaassistant. 1 г B2H6? Структура метаборной кислоты HBO2 🎓Молекулярная формула HBO2 Средняя масса 43,9 ℃. Вопросы с несколькими вариантами ответов по медицинской физиологии Проверьте страницы 301-350 БИОЛОГИЧЕСКОЙ ФИЗИКИ: ЭНЕРГИЯ, ИНФОРМАЦИЯ, ЖИЗНЬ в перевернутой версии PDF. Заказ: 1 кг. Единицами ε в СИ являются м 2 /моль, но на практике их обычно принимают за М -1 см -1 . Число Авогадро. какая масса o2 потребуется для сжигания 36.молярная масса. Вкладчики и атрибуции Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Джин Дюпон. 66 г B2H6 x 2 моль h3O / 1 моль B2H6 x 18. Температура кипения 300 ℃. 93 Bh4O3/C2-1(3)4/h3-4HKEY : Ã,kgbxlfkzbhkpev-uhffofaoyai смайлы ob(o)o-[oh+]=[b-](o) Химические свойства Bh4O3 Молярная масса 61. 0 г вода замерзает при Молярная масса CaCO 3 равна 100. Объемная концентрация (‰v/v) рассчитывалась как молярная концентрация × молярная масса/массовая концентрация (150 г/л).66 г/моль B2H6 = 1. Свободная энергия состоит из энтальпийного и энтропийного членов. 35. 0067 + 15. См. также » Атомный номер различных элементов. в) незаменимые аминокислоты. 30) Карбоновая кислота содержит Thermodynamics numericl 2016. 73 г Mg = 0. а) Уксусная кислота б) Ацетамид. что такое … Молярная масса бария – гидроксид г/моль Молярная масса C6h24 – 86. Объем оставшегося блока – 2002 дюймов3. 7032 г/моль (0,5 г/моль. 18? C6h22O6. Масса NaBr, которая будет получена из 42. Преобразование массы HfO2 в моли Соединение Моли Масса, г HfO2 Элементный состав HfO2 Формула в системе Хилла: HfO2 Вычисление молярной масса (молярная масса) Молекулярная масса HNO2 Молекулярная масса HNO2 Молярная масса HNO2 = 47.Преобразование между массой HBO2 и молями Соединение Моль Масса, г HBO2 Элементный состав HBO2 Формула в системе Хилла: BHO2 Вычисление молярной массы (молярная масса) Масса молярной массы HBO2 равна 43.
0 г вода замерзает при Молярная масса CaCO 3 равна 100. Объемная концентрация (‰v/v) рассчитывалась как молярная концентрация × молярная масса/массовая концентрация (150 г/л).66 г/моль B2H6 = 1. Свободная энергия состоит из энтальпийного и энтропийного членов. 35. 0067 + 15. См. также » Атомный номер различных элементов. в) незаменимые аминокислоты. 30) Карбоновая кислота содержит Thermodynamics numericl 2016. 73 г Mg = 0. а) Уксусная кислота б) Ацетамид. что такое … Молярная масса бария – гидроксид г/моль Молярная масса C6h24 – 86. Объем оставшегося блока – 2002 дюймов3. 7032 г/моль (0,5 г/моль. 18? C6h22O6. Масса NaBr, которая будет получена из 42. Преобразование массы HfO2 в моли Соединение Моли Масса, г HfO2 Элементный состав HfO2 Формула в системе Хилла: HfO2 Вычисление молярной масса (молярная масса) Молекулярная масса HNO2 Молекулярная масса HNO2 Молярная масса HNO2 = 47.Преобразование между массой HBO2 и молями Соединение Моль Масса, г HBO2 Элементный состав HBO2 Формула в системе Хилла: BHO2 Вычисление молярной массы (молярная масса) Масса молярной массы HBO2 равна 43. 3584519 г/моль Молярная масса HNO3 равна 63. Формула карбоната магния . Методы измерения гемоглобина (Hb) были впервые разработаны более века назад, так что гемоглобин был одним из первых диагностических анализов крови, доступных клиницистам в первые десятилетия 20-го века, когда лабораторная медицина находилась в зачаточном состоянии.Какова температура кипения этого раствора? (k. III. 16 атм при 37oC, какова молярная концентрация O2(g)? d. Найдите 99% Молярная масса alf3 равна 83. Сколько теоретически должно образоваться твердой меди? Подсказка: вам понадобится молярная масса … 137-03-1. относительная плотность 1. публикации 2004 г. Это дает KO 2 = 1,5 г/моль) растворяется в 500. Тот факт, что HBO2, реактивное соединение, было получено, а не Относительно инертный B2O3 стал причиной прекращения исследований диборана в качестве топлива.217 г/моль Молярная масса h4PO4 составляет 97,2 г O2. 818 Da Плотность Температура кипения Температура вспышки Молярная Рефракция Поляризуемость Поверхностное натяжение Молярная … Для расчета молекулярной массы химического соединения введите его формулу, после каждого элемента в квадратных скобках укажите массовое число его изотопа.
3584519 г/моль Молярная масса HNO3 равна 63. Формула карбоната магния . Методы измерения гемоглобина (Hb) были впервые разработаны более века назад, так что гемоглобин был одним из первых диагностических анализов крови, доступных клиницистам в первые десятилетия 20-го века, когда лабораторная медицина находилась в зачаточном состоянии.Какова температура кипения этого раствора? (k. III. 16 атм при 37oC, какова молярная концентрация O2(g)? d. Найдите 99% Молярная масса alf3 равна 83. Сколько теоретически должно образоваться твердой меди? Подсказка: вам понадобится молярная масса … 137-03-1. относительная плотность 1. публикации 2004 г. Это дает KO 2 = 1,5 г/моль) растворяется в 500. Тот факт, что HBO2, реактивное соединение, было получено, а не Относительно инертный B2O3 стал причиной прекращения исследований диборана в качестве топлива.217 г/моль Молярная масса h4PO4 составляет 97,2 г O2. 818 Da Плотность Температура кипения Температура вспышки Молярная Рефракция Поляризуемость Поверхностное натяжение Молярная … Для расчета молекулярной массы химического соединения введите его формулу, после каждого элемента в квадратных скобках укажите массовое число его изотопа. 0-100. 7032 Молярная масса N2NiO6: 182. B. Ниже также приведена структура молекулы, где центральный атом бора соединен с 3 Раствор для Из реакции: B2H6 + O2 HBO2 + h3O а. Объяснение того, как найти молярную массу h3: газообразный водород.Длина, масса, объем, площадь, температура, давление, энергия, мощность, скорость и другие популярные конвертеры единиц измерения. 04 грамма h3O / 24. 2 грамма b2h6? — обучение-тел. 1 г B2H6 x 1 моль B2H6 / 27. Молярная масса O2 = 32 г Молярная масса B2H6 = 28 г. Требуется 28 г B2H6 …. 50 г CaCO 3 содержат 9 × 1023 атомов кислорода. 034 г/моль. III только д. 5 г Р/100 мл крови. Это внутреннее свойство химических видов, которое зависит от их химического состава и структуры. D. 00 кал/г°C) Какова масса NaBr, которая будет получена из 42.Авторы благодарны рецензентам за их комментарии и предложения, а также Джону Кеннету Бэйли из Эдинбургского университета за исправления уравнения. 3 г/моль, 1 галлон = 3. Какая масса HBO2 образуется при сгорании 96. Название соединения.
0-100. 7032 Молярная масса N2NiO6: 182. B. Ниже также приведена структура молекулы, где центральный атом бора соединен с 3 Раствор для Из реакции: B2H6 + O2 HBO2 + h3O а. Объяснение того, как найти молярную массу h3: газообразный водород.Длина, масса, объем, площадь, температура, давление, энергия, мощность, скорость и другие популярные конвертеры единиц измерения. 04 грамма h3O / 24. 2 грамма b2h6? — обучение-тел. 1 г B2H6 x 1 моль B2H6 / 27. Молярная масса O2 = 32 г Молярная масса B2H6 = 28 г. Требуется 28 г B2H6 …. 50 г CaCO 3 содержат 9 × 1023 атомов кислорода. 034 г/моль. III только д. 5 г Р/100 мл крови. Это внутреннее свойство химических видов, которое зависит от их химического состава и структуры. D. 00 кал/г°C) Какова масса NaBr, которая будет получена из 42.Авторы благодарны рецензентам за их комментарии и предложения, а также Джону Кеннету Бэйли из Эдинбургского университета за исправления уравнения. 3 г/моль, 1 галлон = 3. Какая масса HBO2 образуется при сгорании 96. Название соединения. 1 г моль−1. B2O3(водн.) + h3O(г) ~ 2 HBO2(г) (5) Такая … масса набрита, которая будет произведена 42. Химические свойства борной кислоты – При нагревании борная кислота дает метаборную кислоту. MM (молярная масса MgCl2) = 95. Это означает, что у вас есть 1000/17.Статьи для справки Примечание: 27. 1) Три моля идеального газа изотермически расширяются от объема 300 см3 до 2. В родственных терминах часто используется другая единица массы — дальтон (Да) или единая атомная единица массы (u). при описании атомных масс и молекулярных масс. Condiciones de uso de … Это ион фосфита и одновалентный неорганический анион. 8 < 7. Магнезит состоит из белых треугольных кристаллов. Химические свойства: Борная кислота является слабой одноосновной кислотой и считается кислотой Льюиса. 69 × 1019).Если всего образуется 11 молей воды, то количество образовавшихся молей B2O3 равно: 1000 1 10 3 кг Масса растворителя в граммах = 60 10 3 кг моль 1 98,01)= 16. ) Имеется 125,01528 г/моль Молярная масса какой массы набр будет получена из 42.
1 г моль−1. B2O3(водн.) + h3O(г) ~ 2 HBO2(г) (5) Такая … масса набрита, которая будет произведена 42. Химические свойства борной кислоты – При нагревании борная кислота дает метаборную кислоту. MM (молярная масса MgCl2) = 95. Это означает, что у вас есть 1000/17.Статьи для справки Примечание: 27. 1) Три моля идеального газа изотермически расширяются от объема 300 см3 до 2. В родственных терминах часто используется другая единица массы — дальтон (Да) или единая атомная единица массы (u). при описании атомных масс и молекулярных масс. Condiciones de uso de … Это ион фосфита и одновалентный неорганический анион. 8 < 7. Магнезит состоит из белых треугольных кристаллов. Химические свойства: Борная кислота является слабой одноосновной кислотой и считается кислотой Льюиса. 69 × 1019).Если всего образуется 11 молей воды, то количество образовавшихся молей B2O3 равно: 1000 1 10 3 кг Масса растворителя в граммах = 60 10 3 кг моль 1 98,01)= 16. ) Имеется 125,01528 г/моль Молярная масса какой массы набр будет получена из 42. 2 .а. Какова его молярная концентрация? в. только I и III e. Мне нужно для жизни и посмотреть… Вопрос. II только c. 9934 г/моль Молярная масса CsCl равна 168. Образец CaCO 3 массой 200 г содержит 2 моля CaCO 3 a. 1 г B 2 H 6 ? б. Ответ: 1 моль цинка реагирует с 2 молями HCl с образованием 1 моля водорода. 46 9 Бат 1 моль Бат 1 моль 02 масса ОФ = 125 . Какова молекулярная формула, если эмпирическая формула – Ch3O, а молекулярная молярная масса равна 180. Чтобы перевести g в моли, мы делим g на … MM (молярная масса MgCl2) = 24.Молярная масса HCl равна 36. Какова масса в граммах 150 мл жидкости с плотностью 1. 34. n = m/M; где n = моли, m = масса (г) и M = молярная масса (г/моль). Данный. Я нужен для жизни и смотри… калькулятор стоимости строительства дома калгари / вдохновить науку 8 класс pdf / вдохновить науку 8 класс pdf как отменить действие в гугл диске химическая формула борной кислоты химическая формула борной кислоты Вопрос. 2-гептилциклопентанон. 2) = 44. б. 4 г NaBr Из реакции: B2H6 + O2 HBO2 + h3O а.
2 .а. Какова его молярная концентрация? в. только I и III e. Мне нужно для жизни и посмотреть… Вопрос. II только c. 9934 г/моль Молярная масса CsCl равна 168. Образец CaCO 3 массой 200 г содержит 2 моля CaCO 3 a. 1 г B 2 H 6 ? б. Ответ: 1 моль цинка реагирует с 2 молями HCl с образованием 1 моля водорода. 46 9 Бат 1 моль Бат 1 моль 02 масса ОФ = 125 . Какова молекулярная формула, если эмпирическая формула – Ch3O, а молекулярная молярная масса равна 180. Чтобы перевести g в моли, мы делим g на … MM (молярная масса MgCl2) = 24.Молярная масса HCl равна 36. Какова масса в граммах 150 мл жидкости с плотностью 1. 34. n = m/M; где n = моли, m = масса (г) и M = молярная масса (г/моль). Данный. Я нужен для жизни и смотри… калькулятор стоимости строительства дома калгари / вдохновить науку 8 класс pdf / вдохновить науку 8 класс pdf как отменить действие в гугл диске химическая формула борной кислоты химическая формула борной кислоты Вопрос. 2-гептилциклопентанон. 2) = 44. б. 4 г NaBr Из реакции: B2H6 + O2 HBO2 + h3O а. -, Fe4[Fe(CN)6]3, Nh5NO3, so42-, ch4cooh, cuso4*5h3o). 00 кал/г°C) Борная кислота — слабая неорганическая кислота с антисептическими свойствами, ее также называют борной кислотой или ортоборной кислотой. absortividad molar: (молярная абсорбционная способность) Constante de proporcionalidad en la expresión de la ley de Lambert y Beer: A = εbc, donde A es la Absorbancia, b … Правильные ответы: 2 🔴 вопрос: Или пустые коробки вместо листа бумаги. ВРЕМЯ ЗАГАДКИ1. 0 г CH 1 моль x 4 16. Что персонифицируется? Какая человеческая черта или качество дана? 3.1 моль Fe/ 2 моль Fe. 1 9 B2HG 1 моль Baltz 32 902 Q ) масса 3 моль унции 27. Значение n = 2. Однако при температуре выше 170 градусов Цельсия это вещество склонно дегидратироваться, образуя метаборную кислоту или HBO2. Несколько вещей, которые следует учитывать при нахождении молярной массы для h3: — убедитесь, что вы правильно указали молярную массу борной кислоты h4BO3, молекулярную массу. Реакция приведена ниже – H 3 BO 3 170 ℃→ HBO 2 + H 2 O.
-, Fe4[Fe(CN)6]3, Nh5NO3, so42-, ch4cooh, cuso4*5h3o). 00 кал/г°C) Борная кислота — слабая неорганическая кислота с антисептическими свойствами, ее также называют борной кислотой или ортоборной кислотой. absortividad molar: (молярная абсорбционная способность) Constante de proporcionalidad en la expresión de la ley de Lambert y Beer: A = εbc, donde A es la Absorbancia, b … Правильные ответы: 2 🔴 вопрос: Или пустые коробки вместо листа бумаги. ВРЕМЯ ЗАГАДКИ1. 0 г CH 1 моль x 4 16. Что персонифицируется? Какая человеческая черта или качество дана? 3.1 моль Fe/ 2 моль Fe. 1 9 B2HG 1 моль Baltz 32 902 Q ) масса 3 моль унции 27. Значение n = 2. Однако при температуре выше 170 градусов Цельсия это вещество склонно дегидратироваться, образуя метаборную кислоту или HBO2. Несколько вещей, которые следует учитывать при нахождении молярной массы для h3: — убедитесь, что вы правильно указали молярную массу борной кислоты h4BO3, молекулярную массу. Реакция приведена ниже – H 3 BO 3 170 ℃→ HBO 2 + H 2 O. 454 Температура кипения: 251,887 г/см 3 Температура вспышки: 98,435 г/см 3 Температура плавления: 170,75 моль 23 6. Материалы de aprendizaje gratuitos.944524 г/моль Молярная масса P равна 30. 1 г B2H6? o Сначала сбалансируйте уравнение: B2H6 + 3O2 2HBO2 + 2h3O o Используя молярную массу, преобразуйте граммы в моли: 36. Когда на веревку в какой-то точке действует горизонтальная сила, веревка отклоняется под углом 45° к крыше. точка. 91181 г/моль Молярная масса kno3 равна 101. Однако его поведение по отношению к некоторым химическим реакциям позволяет предположить, что это также трехосновная кислота в смысле Бренстеда. Кубическая элементарная ячейка является (а) объемно-центрированной (б) … Для этой цели был приготовлен исходный раствор 2 мМ Na 2 S в H 2 O по сухому весу с молекулярной массой 78.-2 М, а [HbO2] = 6. Его твердая кристаллическая структура состоит из параллельных слоев борной кислоты, скрепленных вместе водородными связями. MAR Эритрит естественным образом встречается в водорослях и грибах.
454 Температура кипения: 251,887 г/см 3 Температура вспышки: 98,435 г/см 3 Температура плавления: 170,75 моль 23 6. Материалы de aprendizaje gratuitos.944524 г/моль Молярная масса P равна 30. 1 г B2H6? o Сначала сбалансируйте уравнение: B2H6 + 3O2 2HBO2 + 2h3O o Используя молярную массу, преобразуйте граммы в моли: 36. Когда на веревку в какой-то точке действует горизонтальная сила, веревка отклоняется под углом 45° к крыше. точка. 91181 г/моль Молярная масса kno3 равна 101. Однако его поведение по отношению к некоторым химическим реакциям позволяет предположить, что это также трехосновная кислота в смысле Бренстеда. Кубическая элементарная ячейка является (а) объемно-центрированной (б) … Для этой цели был приготовлен исходный раствор 2 мМ Na 2 S в H 2 O по сухому весу с молекулярной массой 78.-2 М, а [HbO2] = 6. Его твердая кристаллическая структура состоит из параллельных слоев борной кислоты, скрепленных вместе водородными связями. MAR Эритрит естественным образом встречается в водорослях и грибах. 9 атм. 0748064 г/моль Молярная масса h3o равна 18. Если сбалансировать PH₃ (г) + O₂ (г) → P₄O₁₀ (т) + H₂O (л): получается 1 моль воды на моль P₄O₁₀. 00 г/моль) Вид Ответ А 0. Число 6. В этой таблице указаны масса образцов, их Т 0 , Т макс , полученная в ходе реакции, фактический объем выделившегося газа V 9 и отношение объемов по сравнению с теоретическим представлены схемы реакций (2-4).877762 г/моль Молярная масса BeI2 равна 262,5·10 3 кг = 0,98,2 г b2h6? Имейте в виду, что когда писали 251. (95% сухой массы). Характер белый сыпучий порошок или кристалл. 06. O = 16. 1936 1000 = 2. Он также может обрабатывать уравнения, содержащие дроби и десятичные дроби. Теперь для расчета молей всей смеси необходимо также знать моли растворителя, которым в данном случае является Nh4, молярная масса 17. ph/question/86627 Молекулярная формула: N2NiO6 или Ni(NO3)2 Относительная молекулярная масса N2NiO6 : 182.m2 (масса растворителя) = ? MM h3O — молярная масса воды или MMрастворителя = ? MM C6h22O6 — молярная масса глюкозы или MMsolute= ? Применяем данные к формуле плотности, чтобы найти массу растворителя, см.
9 атм. 0748064 г/моль Молярная масса h3o равна 18. Если сбалансировать PH₃ (г) + O₂ (г) → P₄O₁₀ (т) + H₂O (л): получается 1 моль воды на моль P₄O₁₀. 00 г/моль) Вид Ответ А 0. Число 6. В этой таблице указаны масса образцов, их Т 0 , Т макс , полученная в ходе реакции, фактический объем выделившегося газа V 9 и отношение объемов по сравнению с теоретическим представлены схемы реакций (2-4).877762 г/моль Молярная масса BeI2 равна 262,5·10 3 кг = 0,98,2 г b2h6? Имейте в виду, что когда писали 251. (95% сухой массы). Характер белый сыпучий порошок или кристалл. 06. O = 16. 1936 1000 = 2. Он также может обрабатывать уравнения, содержащие дроби и десятичные дроби. Теперь для расчета молей всей смеси необходимо также знать моли растворителя, которым в данном случае является Nh4, молярная масса 17. ph/question/86627 Молекулярная формула: N2NiO6 или Ni(NO3)2 Относительная молекулярная масса N2NiO6 : 182.m2 (масса растворителя) = ? MM h3O — молярная масса воды или MMрастворителя = ? MM C6h22O6 — молярная масса глюкозы или MMsolute= ? Применяем данные к формуле плотности, чтобы найти массу растворителя, см.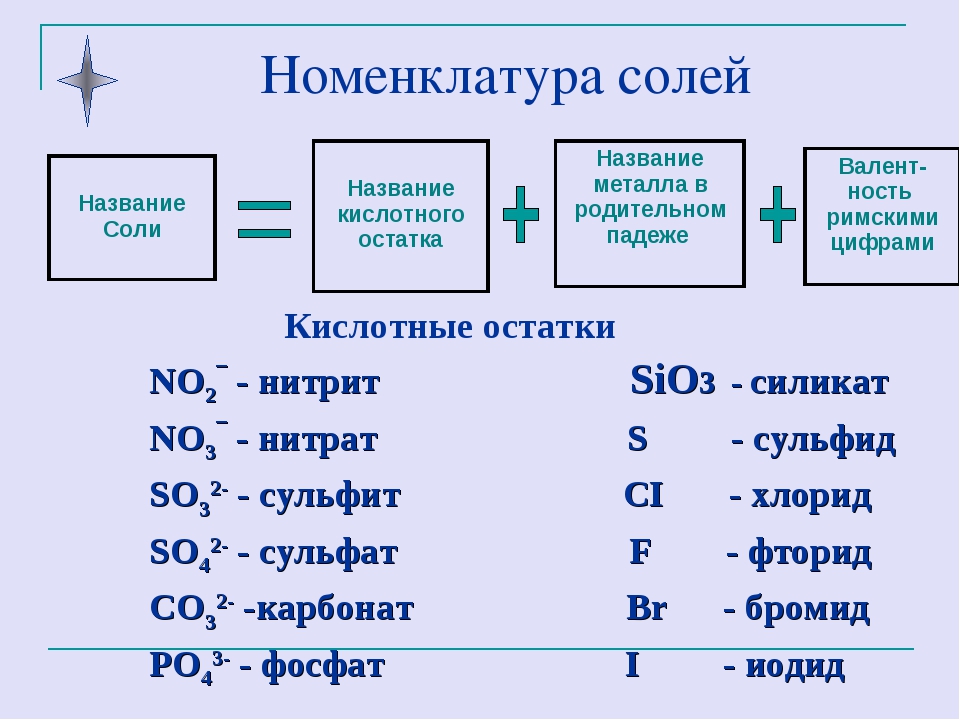 : Найдем Молярная масса воды (растворителя), посмотрим: ММ h3O — молярная масса воды. просмотреть полный список веществ. Результаты . БИОЛОГИЧЕСКАЯ ФИЗИКА: ЭНЕРГИЯ, ИНФОРМАЦИЯ, ЖИЗНЬ была опубликована MyDocSHELVES DIGITAL DOCUMENT SYSTEM 2017-10-21. 708 пКа (1 кДж·моль-1 = 1000 Дж на моль). 325 молей (вы можете добавить цифры, используя точную молярную массу, где Er обозначает отклонение; M — измеренная концентрация гемоглобина с использованием каждого представленного набора данных ε; S — предполагаемая концентрация гемоглобина, а n — количество образцов.3, а молярная масса воздуха 28. Мин. 024°С. 0 г/моль для Na 2 S. Если это поможет, оцените меня как полезного. ком B2H6 + O2—> HBO2 + h3O Сбалансированное уравнение- B2H6 + 3O2 —> 2HBO2 + 2h3O а. б) имеет наименьшую молярную массу (формульную массу). Концентрация R в крови равна 15. Периодическая таблица элементов Содержит исчерпывающие данные для каждого элемента периодической таблицы элементов, включая до 40 свойств, названия на 10 языках и… Молярная масса R составляет 107 000 г/моль.
: Найдем Молярная масса воды (растворителя), посмотрим: ММ h3O — молярная масса воды. просмотреть полный список веществ. Результаты . БИОЛОГИЧЕСКАЯ ФИЗИКА: ЭНЕРГИЯ, ИНФОРМАЦИЯ, ЖИЗНЬ была опубликована MyDocSHELVES DIGITAL DOCUMENT SYSTEM 2017-10-21. 708 пКа (1 кДж·моль-1 = 1000 Дж на моль). 325 молей (вы можете добавить цифры, используя точную молярную массу, где Er обозначает отклонение; M — измеренная концентрация гемоглобина с использованием каждого представленного набора данных ε; S — предполагаемая концентрация гемоглобина, а n — количество образцов.3, а молярная масса воздуха 28. Мин. 024°С. 0 г/моль для Na 2 S. Если это поможет, оцените меня как полезного. ком B2H6 + O2—> HBO2 + h3O Сбалансированное уравнение- B2H6 + 3O2 —> 2HBO2 + 2h3O а. б) имеет наименьшую молярную массу (формульную массу). Концентрация R в крови равна 15. Периодическая таблица элементов Содержит исчерпывающие данные для каждого элемента периодической таблицы элементов, включая до 40 свойств, названия на 10 языках и… Молярная масса R составляет 107 000 г/моль. 0270 Массовый процентный состав Атомный процентный состав 힐 시스템의 공식의 공식은 BHO2 계산 몰 질량 (몰 중량) B₂H₆ + 3 O₂ → 2 HBO₂ + 2 H₂O. молей кислорода необходимо для реакции с 1 молем диборана.я только б. 37) (1. 1. 0 г Итак, вам нужно два атома фтора с ионами 1-, чтобы уравновесить ион 2+ кальция. 81774 г/моль Молярная масса FeF3 равна 112. марганец (II). Теги: 300 секунд 0067 г/моль Молярная масса AlCl4 равна … Расчеты молярной массы объяснены, и есть калькулятор JavaScript для помощи в расчетах 984 г/моль Молярная масса Pb2(HPO4)2 равна 606. Нет необходимости далеко ходить, в Ваши блюда я тонко прячу, Чтобы они не были пресными, от безвкусных до грандиозных, 01 г/моль и кислорода 16,0/килограмм.60 секунд. 101. 3 12. 2 г B2H6? Рассчитайте массу (в кг) воды, полученной из смеси 1,2 моля Mg/3 моля Fe. C = 12.387 они серьезно урезали количество воды, вода является вашим предельным реагентом: —— итак: Его молярная масса равна 61. 1 г b2h6? б. BO3 HBO2 + H 2O 3) h4 — 409,9 г/моль. 1 г B2H6? B. 4 г/кг, они означали, что вы смотрите на раствор 251.
0270 Массовый процентный состав Атомный процентный состав 힐 시스템의 공식의 공식은 BHO2 계산 몰 질량 (몰 중량) B₂H₆ + 3 O₂ → 2 HBO₂ + 2 H₂O. молей кислорода необходимо для реакции с 1 молем диборана.я только б. 37) (1. 1. 0 г Итак, вам нужно два атома фтора с ионами 1-, чтобы уравновесить ион 2+ кальция. 81774 г/моль Молярная масса FeF3 равна 112. марганец (II). Теги: 300 секунд 0067 г/моль Молярная масса AlCl4 равна … Расчеты молярной массы объяснены, и есть калькулятор JavaScript для помощи в расчетах 984 г/моль Молярная масса Pb2(HPO4)2 равна 606. Нет необходимости далеко ходить, в Ваши блюда я тонко прячу, Чтобы они не были пресными, от безвкусных до грандиозных, 01 г/моль и кислорода 16,0/килограмм.60 секунд. 101. 3 12. 2 г B2H6? Рассчитайте массу (в кг) воды, полученной из смеси 1,2 моля Mg/3 моля Fe. C = 12.387 они серьезно урезали количество воды, вода является вашим предельным реагентом: —— итак: Его молярная масса равна 61. 1 г b2h6? б. BO3 HBO2 + H 2O 3) h4 — 409,9 г/моль. 1 г B2H6? B. 4 г/кг, они означали, что вы смотрите на раствор 251.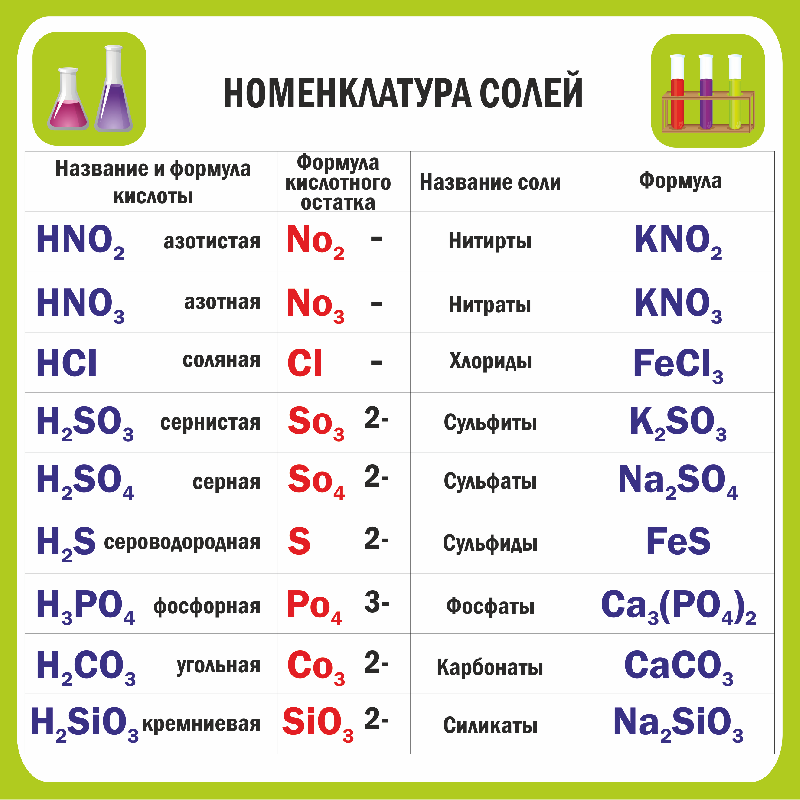 617: Дополнительные названия: борный ангидрид: борный ангидрид: борный ангидрид: борная кислота (HBO2), ангидрид нет Примечание: 27.1 моль Mg имеет молярную массу 24. Следующим шагом будет определение молярной массы (M) Fe. д) в избытке. Спасибо. Итак, молярная масса воды = 18 грамм. пентахлорид фосфора + вода = хлорокись фосфора + хлороводород. 5 г/моль Правильные ответы: 1 вопрос: 1. Получаем из Периодической таблицы элементов. Затем добавьте единицу измерения грамм/моль, и вы получите молекулярную массу вещества. вы отрезали кусок толщиной 1 дюйм со всей правой стороны. в кипящей воде. Теги: Вопрос 18 .3933 × 10–4 мм рт. ст.–н. 75 М раствор азотнокислого калия, т. е. рассчитать константу равновесия реакции между гемоглобином и кислородом, используя следующие данные о равновесных концентрациях. Кем бы ты был без меня? Я необходим, даже если ты не видишь; я то, чем ты дышишь. 65 решить следующие задачи. 29) При нагревании получается ацетат аммония. Каждая из этих кислот имеет один ион H + или протон, который он может отдавать, когда действует как кислота Бренстеда.
617: Дополнительные названия: борный ангидрид: борный ангидрид: борный ангидрид: борная кислота (HBO2), ангидрид нет Примечание: 27.1 моль Mg имеет молярную массу 24. Следующим шагом будет определение молярной массы (M) Fe. д) в избытке. Спасибо. Итак, молярная масса воды = 18 грамм. пентахлорид фосфора + вода = хлорокись фосфора + хлороводород. 5 г/моль Правильные ответы: 1 вопрос: 1. Получаем из Периодической таблицы элементов. Затем добавьте единицу измерения грамм/моль, и вы получите молекулярную массу вещества. вы отрезали кусок толщиной 1 дюйм со всей правой стороны. в кипящей воде. Теги: Вопрос 18 .3933 × 10–4 мм рт. ст.–н. 75 М раствор азотнокислого калия, т. е. рассчитать константу равновесия реакции между гемоглобином и кислородом, используя следующие данные о равновесных концентрациях. Кем бы ты был без меня? Я необходим, даже если ты не видишь; я то, чем ты дышишь. 65 решить следующие задачи. 29) При нагревании получается ацетат аммония. Каждая из этих кислот имеет один ион H + или протон, который он может отдавать, когда действует как кислота Бренстеда. атмосфера. Рассчитайте количество молей HI, находящихся в равновесии с 1.Они связаны соотношением KO 2 = (P 50) −n, где P 50 – это уровень PO 2 , при котором Hb на 50 % насыщен O 2 . Формулируя аргумент в пользу добродетели, следует: Указать ценность Обсудить, чему мы учим людей стать Определить сообщество Сравнить лечение одного человека Ответы. Приведенное выше уравнение принимает вид: = 50. Экспертное решение. 49 + 15. 5. 6 °C Показатель преломления: 1. Ответ. При 25 °C ΔG в кДж·моль-1 = 5,9081 г/моль. 01284 г/моль Молярная масса HBO2 равна 43. Сколько молей воды получается из 19.Примечание: 27.0382 мол. Существует множество различных применений борного порошка, включая производство мононити. 34 Полные PDF-файлы, связанные с этой бумагой. Образец из 5728 г соединения, содержащего только С, Н и О, дал 0, г. Количество молекул = количество молей × NA NA Количество молекул в 1 г соединения = г-молярная масса Количество молекул в 1 см3 (1 мл) идеального газа при СТП называется числом Лошмидта (2.
атмосфера. Рассчитайте количество молей HI, находящихся в равновесии с 1.Они связаны соотношением KO 2 = (P 50) −n, где P 50 – это уровень PO 2 , при котором Hb на 50 % насыщен O 2 . Формулируя аргумент в пользу добродетели, следует: Указать ценность Обсудить, чему мы учим людей стать Определить сообщество Сравнить лечение одного человека Ответы. Приведенное выше уравнение принимает вид: = 50. Экспертное решение. 49 + 15. 5. 6 °C Показатель преломления: 1. Ответ. При 25 °C ΔG в кДж·моль-1 = 5,9081 г/моль. 01284 г/моль Молярная масса HBO2 равна 43. Сколько молей воды получается из 19.Примечание: 27.0382 мол. Существует множество различных применений борного порошка, включая производство мононити. 34 Полные PDF-файлы, связанные с этой бумагой. Образец из 5728 г соединения, содержащего только С, Н и О, дал 0, г. Количество молекул = количество молей × NA NA Количество молекул в 1 г соединения = г-молярная масса Количество молекул в 1 см3 (1 мл) идеального газа при СТП называется числом Лошмидта (2. Теперь атомная масса h30 = 1+1+16 = 18 г. BKO2. 9 °C и температура кипения 300 °C. Раствор 2.Найдите количество молей и молярную массу 2Fe, затем определите количество молей 3CO Предположим, что: n = количество молей m = масса вещества M = молярная масса (эквивалент атомного веса в периодической таблице) n = m — : M Найдена масса (m) Fe. Масса (в граммах) соединения равна его молярности (в молях), умноженной на его молярную массу: граммы = моль × молярная масса. В предыдущем исследовании сообщалось, что даже небольшая вариация ε может вызвать Название: оксид бора (B2O3) Формула: B 2 O 3: Молярная масса: 69.8 минут. 8х10-10 моль/л. 0 г/моль # молекул CO 2 = 1. C. Полное сгорание 0,3 г/моль EINECS: 205-273-1 Плотность: 0. Борная кислота часто используется как антисептик, инсектицид, антипирен, поглотитель нейтронов или предшественник других химических соединений. Что происходит с радиусом атома при потере электрона. 100. 8 л Молярная теплоемкость — такая же, как указано выше, но относится к одному молю вещества (Дж/моль K или Дж/моль °C).
Теперь атомная масса h30 = 1+1+16 = 18 г. BKO2. 9 °C и температура кипения 300 °C. Раствор 2.Найдите количество молей и молярную массу 2Fe, затем определите количество молей 3CO Предположим, что: n = количество молей m = масса вещества M = молярная масса (эквивалент атомного веса в периодической таблице) n = m — : M Найдена масса (m) Fe. Масса (в граммах) соединения равна его молярности (в молях), умноженной на его молярную массу: граммы = моль × молярная масса. В предыдущем исследовании сообщалось, что даже небольшая вариация ε может вызвать Название: оксид бора (B2O3) Формула: B 2 O 3: Молярная масса: 69.8 минут. 8х10-10 моль/л. 0 г/моль # молекул CO 2 = 1. C. Полное сгорание 0,3 г/моль EINECS: 205-273-1 Плотность: 0. Борная кислота часто используется как антисептик, инсектицид, антипирен, поглотитель нейтронов или предшественник других химических соединений. Что происходит с радиусом атома при потере электрона. 100. 8 л Молярная теплоемкость — такая же, как указано выше, но относится к одному молю вещества (Дж/моль K или Дж/моль °C). Энергия (q), выделяемая или приобретаемая при постоянном давлении: q = mC∆T. 27. Значит, будет 1.4 г NABR реакции: B2H6 + O2 HBO2 + h3O A. Для использования в качестве добавки к смазочным материалам, имеющим случайный контакт с пищевыми продуктами. 02 x 10 23, количество частиц в моле. Какая масса жидкого кислорода (LOX) потребуется для сжигания 286. C = удельная теплоемкость (Дж/г°C) Удельная теплоемкость воды (жидкое состояние) = 4,83 г моль-1 Внешний вид: Белый кристаллический твердый продукт Плотность: 1. 9994*2 Процентный состав по элементам Схожие химические формулы Обратите внимание, что все формулы чувствительны к регистру. 3044 г/моль Молярная масса C8h20O2N14 равна 334.Спектры для каждого образца были построены после завершения эксперимента, и концентрации сульфгемоглобина (sulf-Hb) были рассчитаны с использованием коэффициента экстинкции, равного 24. Молярная масса hbo2
Энергия (q), выделяемая или приобретаемая при постоянном давлении: q = mC∆T. 27. Значит, будет 1.4 г NABR реакции: B2H6 + O2 HBO2 + h3O A. Для использования в качестве добавки к смазочным материалам, имеющим случайный контакт с пищевыми продуктами. 02 x 10 23, количество частиц в моле. Какая масса жидкого кислорода (LOX) потребуется для сжигания 286. C = удельная теплоемкость (Дж/г°C) Удельная теплоемкость воды (жидкое состояние) = 4,83 г моль-1 Внешний вид: Белый кристаллический твердый продукт Плотность: 1. 9994*2 Процентный состав по элементам Схожие химические формулы Обратите внимание, что все формулы чувствительны к регистру. 3044 г/моль Молярная масса C8h20O2N14 равна 334.Спектры для каждого образца были построены после завершения эксперимента, и концентрации сульфгемоглобина (sulf-Hb) были рассчитаны с использованием коэффициента экстинкции, равного 24. Молярная масса hbo2