Физические свойства солей — урок. Химия, 8–9 класс.
При нормальных условиях соли — твёрдые кристаллические вещества. У солей типичных металлов — ионная кристаллическая решётка, поэтому они имеют сравнительно высокую температуру плавления и нелетучи.
Окраска солей чрезвычайно разнообразна. Отдельные кристаллы некоторых солей бесцветны, однако в массе множество таких мелких кристалликов приобретает белый цвет. Прозрачны и бесцветны отдельные кристаллы галогенидов щелочных металлов, например, хлорида натрия.
Многие соли имеют характерную окраску.
Цвет соли | Примеры |
| Чёрный | Сульфид свинца(\(II\)), железа(\(II\)), серебра |
| Кроваво-красный | Роданид железа(\(III\)) |
| Красный | Гексацианоферрат(\(III\)) калия, сульфид ртути(\(II\)) (киноварь) |
| Розовый | Кристаллогидраты солей марганца(\(II\)), разбавленный раствор перманганата калия |
| Оранжевый | Дихроматы |
| Бурый | Соли железа(\(III\)), концентрированные растворы этих солей |
Светло- коричневый | Сульфид марганца(\(II\)) |
| Жёлтый | Иодид свинца(\(II\)), фосфат серебра, хроматы, гексацианоферрат(\(II\)) калия, разбавленные растворы солей железа(\(III\)) |
| Бледно-жёлтый | Бромид и иодид серебра |
| Зелёный | Соли никеля(\(II\)) |
| Тёмно-зелёный | Манганат калия |
| Светло-зелёный | Гептагидрат сульфата железа(\(II\)) |
| Тёмно-синий | Гексацианоферрат(\(II\)) железа(\(III\)), гексацианоферрат(\(III\)) железа(\(II\)) |
| Синий | Пентагидрат сульфата меди(\(II\)), растворы солей меди(\(II\)) |
| Фиолетовый | Перманганат калия |
| Белый | Сульфаты, карбонаты и фосфаты щелочноземельных металлов, карбонат и фосфат магния; хлорид, сульфат, карбонат серебра; сульфид цинка; кристаллический сульфат меди(\(II\)) |
Что касается растворимости солей в воде, здесь описание ситуации несколько затруднено тем обстоятельством, что не имеется чётко установленной границы между малорастворимыми и практически нерастворимыми веществами. Поэтому данные в различных таблицах растворимости могут несколько (не очень существенно) отличаться.
Поэтому данные в различных таблицах растворимости могут несколько (не очень существенно) отличаться.
Приведём обобщённые сведения о растворимости солей, которыми можно пользоваться, чтобы делать выводы о возможности протекания тех или иных химических реакций.
Соли | Растворимость |
| Нитраты, ацетаты | Практически все хорошо растворимы |
Соли щелочных металлов (натрия, калия) и аммония | Практически все хорошо растворимы |
Хлориды (это же относится к бромидам и иодидам) | Большей частью хорошо растворимы. Практически нерастворимы \(AgCl\) и \(PbCl_2\). Растворимость галогенидов свинца(\(II\)) с повышением температуры резко возрастает |
| Сульфаты | Большей частью хорошо растворимы. Малорастворимы \(Ag_2SO_4\) и \(CaSO_4\). Практически нерастворимы \(PbSO_4\), \(SrSO_4\), \(BaSO_4\) |
| Фосфаты, карбонаты, сульфиты, силикаты | Практически все нерастворимы, за исключением солей щелочных металлов (натрия, калия) и аммония |
| Сульфиды | Практически все нерастворимы, за исключением солей щелочных, щелочноземельных металлов и аммония |
| Кислые соли | Растворимы намного лучше, чем средние |
Растворы солей хорошо проводят электрический ток.
Соли: классификация и химические свойства
Солями называются сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. д.
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие виды солей:
1. Средние соли – все атомы водорода в кислоте замещены металлом: Na2CO3, KNO
2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO3, NaH2PO4 ит. д.
Одноосновные кислоты кислых солей давать не могут: NaHCO3, NaH2PO4 ит. д.
3. Двойные соли – атомы водорода двух- или многоосновной кислоты замещены не одним металлом, а двумя различными: NaKCO3, KAl(SO4)2 и т.д.
4. Соли основные можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO4 , Zn(OH)Cl и т.д.
По международной номенклатуре название соли каждой кислоты происходит от латинского названия элемента. Например, соли серной кислоты называются сульфатами: СаSO4 – сульфат кальция, Mg SO 4 – сульфат магния и т.д.; соли соляной кислоты называются хлоридами: NaCl – хлорид натрия, ZnCI2 – хлорид цинка и т.д.
В название солей двухосновных кислот добавляют частицу «би» или «гидро»: Mg(HCl3)2 – бикарбонат или гидрокарбонат магния.
При условии, что в трехосновной кислоте замещён на металл только один атом водорода, то добавляют приставку «дигидро»: NaH2PO4 – дигидрофосфат натрия.
Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде.
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
2. Взаимодействуют с кислотами
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.
3. Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
Остались вопросы? Хотите знать больше о солях?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Поваренная соль физико-химические свойства — Справочник химика 21
Ниже приведены физико-химические свойства поваренной соли [c.11] Основным сырьем при производстве хлора и каустической соды служит поваренная соль. В небольших масштабах используется I также хлористый калий. Ниже приведены некоторые наиболее важные физико-химические свойства поваренной соли и хлористого калия [c.197]
В небольших масштабах используется I также хлористый калий. Ниже приведены некоторые наиболее важные физико-химические свойства поваренной соли и хлористого калия [c.197]
В книге рассмотрены источники природной поваренной соли, методы ее добычи, способы приготовления рассолов из твердой соли, применения природных и искусственных рассолов. Изложены физико-химические основы процесса очистки рассола в свете современных представлений о свойствах и разделении суспензий. Показано значение качества очистки для процесса электролиза, сформулированы особенности очистки рассолов для диафрагменного и ртутного процессов электролиза, описана аппаратура очистных установок непрерывного действия. Освещены вопросы применения ионообменных смол для удаления из рассола примесей. Приведены методы контроля описываемых процессов.
Итак, в водных и неводных растворах одних и тех же исходных соединений взаимодействуют различные вещества, дающие продукты реакции с различными свойствами.
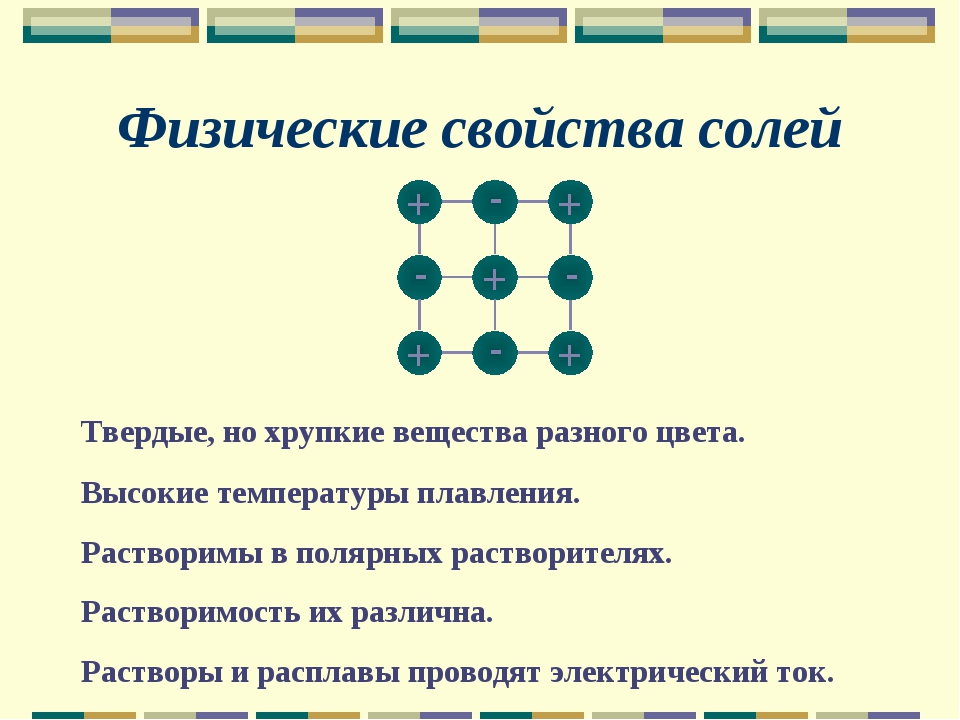 Более того, исключительное своеобразие физико-химических свойств воды обусловливает и своеобразие химических свойств растворенных в ней соединений. Куда уж больше оказывается, что реакция между Ag + и С1 в воде приводит к образованию — подумать только — нерастворимого соединения АдС1. И что уж совсем удивительно хлористый натрий, поваренная соль, в воде превосходно растворима [c.82]
Более того, исключительное своеобразие физико-химических свойств воды обусловливает и своеобразие химических свойств растворенных в ней соединений. Куда уж больше оказывается, что реакция между Ag + и С1 в воде приводит к образованию — подумать только — нерастворимого соединения АдС1. И что уж совсем удивительно хлористый натрий, поваренная соль, в воде превосходно растворима [c.82]Физико-химические свойства. Хлористый натрий,, получивший название поваренной соли, так как с давних времен эта соль добывалась путем вываривания (выпарки) ее из растворов, встречается в природе в виде растворов и кристаллических отложений, главным образом каменной соли, минерала галита — Na l. [c.126]
Потребность народного хозяйства страны в поваренной соли увеличивается с каждым годом. Это обусловливается, в основном, бурным развитием тех отраслей химической промышленности, в которых поваренная соль используется в качестве исходного сырья. Все большему количеству специалистов становятся необходимы разнообразные сведения о поваренной соли.
Сырьем являются природные газы, продукты нефтепереработки, каменный уголь, горючие сланцы, древесина, поваренная соль, известь и др. Готовые химические продукты значительно отличаются своими физико-химическими свойствами и находятся в различном агрегатном состоянии жидкости, газы, порошки, гранулы, стекловидные массы. [c.27]
Предварительно должны быть проведены детальные физико-химические исследовапия свойств отдельных ингредиентов натуральной пищи и разработаны приемы подбора искусственных систем, соответствующих им по физико-химическим свойствам и по питательности. Далее необходимо изучение свойств их водных и масляных растворов илп дисперсий, а также смесей этих ингредиентов. Нужно, кроме того, знать, какое влияние на свойства искусственной пищевой массы оказывают различные факторы, например вода и жиры, витамины, поваренная соль, повышенные и пониженные температуры. [c.521]
Далее необходимо изучение свойств их водных и масляных растворов илп дисперсий, а также смесей этих ингредиентов. Нужно, кроме того, знать, какое влияние на свойства искусственной пищевой массы оказывают различные факторы, например вода и жиры, витамины, поваренная соль, повышенные и пониженные температуры. [c.521]
Рассматривая механизм химических реакций, следует прежде всего иметь в виду, что характер взаимодействия существенно зависит от агрегатного состояния реагентов и продуктов. Реагенты и продукты, вместе взятые, образуют так называемую физико-химическую систему. Совокупность однородных частей системы, обладающих одинаковыми химическими составом и свойствами и отделенных от остальных частей системы поверхностью раздела, называют фазой. Например, если в стакан с водой внести кристаллы поваренной соли, то в первый момент образуется двухфазная система, которая превратится в однофазную после растворения соли.
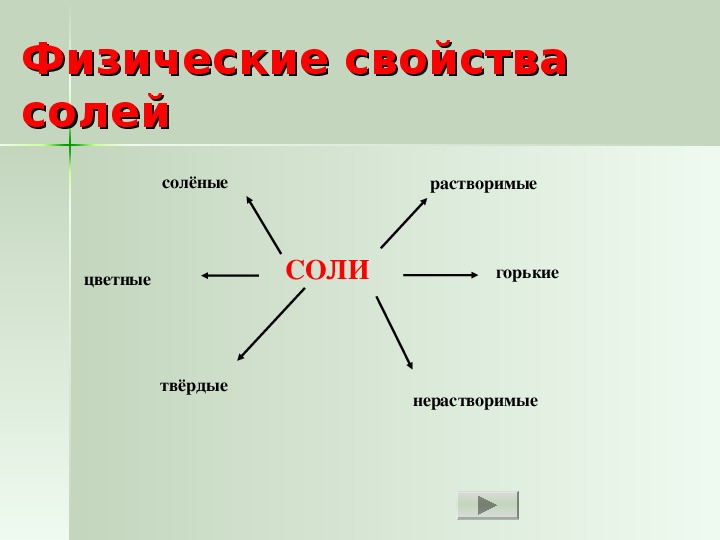 Смеси газов при нормальных условиях однофазны независимо от их природы. Жидкие системы могут быть однофазны (вода и спирт) или многофазны (вода и бензол, вода и ртуть). Системы, состоящие из одной фазы, называются гомогенными, а системы, содержащие несколько фаз,— гетерогенными. Соответственно этому в химии введено понятие о гомогенных и гетерогенных реакциях. Реакцию называют гомогенной, если реагенты и продукты составляют одну фазу. Это справедливо для так называемых обратимых химических реакций (с. 60) [c.53]
Смеси газов при нормальных условиях однофазны независимо от их природы. Жидкие системы могут быть однофазны (вода и спирт) или многофазны (вода и бензол, вода и ртуть). Системы, состоящие из одной фазы, называются гомогенными, а системы, содержащие несколько фаз,— гетерогенными. Соответственно этому в химии введено понятие о гомогенных и гетерогенных реакциях. Реакцию называют гомогенной, если реагенты и продукты составляют одну фазу. Это справедливо для так называемых обратимых химических реакций (с. 60) [c.53]Растворы мыла отличаются весьма своеобразными физико-химическими свойствами. Тогда как разбавленные растворы, особенно спиртовые, обладают всеми физико-химическими свойствами истинных или молекулярных растворов, концентрированные водные растворы уже обладают всеми свойствами коллоидных систем, в том числе способностью коагулировать, или высаливаться , при добавлении электролитов, например поваренной соли. [c.272]
Гомогенными называются такие физико-химические системы, отдельные участки которых одинаковы по своему составу и свойствам. Примерами гомогенных систем могут служить любые смеси газов, вода, лед, раствор вещества в каком-либо растворителе (ненасыщенный) кристалл поваренной соли и др. [c.176]
Примерами гомогенных систем могут служить любые смеси газов, вода, лед, раствор вещества в каком-либо растворителе (ненасыщенный) кристалл поваренной соли и др. [c.176]
Значительно сложнее дело обстоит со вкусом. Широко распространенное мнение о том, что вкус является результатом смешения четырех ощущений, а именно кислого, сладкого, горького и соленого, не может быть признано правильным. Не менее важными являются структура и физико-химические, прежде всего механические свойства, во многом влияющие на общий комплекс ощущений, называемый вкусом. Действительно, комбинируя в разных соотношениях четыре вещества, обладаюпщх упомянутыми качествам, например уксусную кислоту, сахар, хинин и поваренную соль, можно получить весьма различные вкусовые ощущения. Однако при одном и том же количестве и соотношении этих четырех веществ можно значительно изменять вкус, создавая различные структуры и изменяя механические свойства пищи. Так, например, бульон и полученный из него студень различаются лишь механическими свойствами, но существенно отличаются но вкусу. Хорошо известно влияние величины размера пор хлеба на вкусовые ошущения, а также роль упругости хлебного мякиша и других его механических свойств. Можно напомнить и о влиянии структуры мороженого на его вкус, различие во вкусе сливок обычных и взбитых, ощутимое изменение вкуса слоеного торта после его тщательной гомогенизации и многие другие известные примеры. [c.311]
Хорошо известно влияние величины размера пор хлеба на вкусовые ошущения, а также роль упругости хлебного мякиша и других его механических свойств. Можно напомнить и о влиянии структуры мороженого на его вкус, различие во вкусе сливок обычных и взбитых, ощутимое изменение вкуса слоеного торта после его тщательной гомогенизации и многие другие известные примеры. [c.311]
Лабораторные испытания показали, что покрытие на основе эмали ХС-791 обладает стойкостью к ряду химически агрессивных сред, водостойкостью, пониженной горючестью, а также хорошими физико-механическими и противокоррозийными свойствами. Так, постоянное воздействие при 18—23 °С 2 %-ного раствора соляной кислоты в течение 1250 сут, 3 %-ного раствора поваренной соли в течение 1200 сут, дистиллированной воды в течение 1400 сут, сырой нефти в течение 600 сут не оказывает влияния на стойкость покрытия. [c.70]
ХИМИЯ. ФИЗИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА — это… Что такое ХИМИЯ. ФИЗИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА?
- ХИМИЯ.
 ФИЗИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА
ФИЗИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА
Рассмотрим некоторые физические свойства вещества: агрегатное состояние, температуры плавления и кипения, кристаллическую структуру, электропроводность. Агрегатное состояние вещества определяется силой притяжения между составляющими его молекулами и температурой. В твердом теле молекулы достаточно сильно сцеплены друг с другом и их движение ограничивается колебаниями относительно фиксированных положений. С повышением температуры энергия молекул увеличивается, колебания становятся все более интенсивными, и в конце концов молекулы приобретают достаточно энергии, чтобы совершать поступательные движения. При этом твердое вещество плавится (если межмолекулярное взаимодействие остается достаточно сильным) или, сублимируясь, превращается в газ, молекулы которого движутся хаотически. Температура плавления (затвердевания) — это температура, при которой твердое вещество превращается в жидкость (или жидкость превращается в твердое вещество). Температура плавления воды равна 0° С (по шкале Цельсия) или 32° F (по шкале Фаренгейта). Поскольку при плавлении объем тела меняется незначительно, давление мало влияет на температуру плавления. Однако именно под действием высокого давления, оказываемого полозом конька, лед расплавляется, и спортсмен легко скользит по нему. Температура кипения — это температура, при которой жидкость превращается в пар (газ). Она зависит от давления, поэтому в горах вода кипит при более низкой температуре, чем на уровне моря. Температура кипения воды при давлении 760 мм рт. ст. («стандартном» давлении, примерно равном давлению на уровне моря) составляет 100° С (или 212° F).
Температура плавления воды равна 0° С (по шкале Цельсия) или 32° F (по шкале Фаренгейта). Поскольку при плавлении объем тела меняется незначительно, давление мало влияет на температуру плавления. Однако именно под действием высокого давления, оказываемого полозом конька, лед расплавляется, и спортсмен легко скользит по нему. Температура кипения — это температура, при которой жидкость превращается в пар (газ). Она зависит от давления, поэтому в горах вода кипит при более низкой температуре, чем на уровне моря. Температура кипения воды при давлении 760 мм рт. ст. («стандартном» давлении, примерно равном давлению на уровне моря) составляет 100° С (или 212° F).
Кристаллические и аморфные вещества. Твердые вещества бывают аморфными и кристаллическими. У аморфных молекулы расположены случайным образом. В качестве примера аморфного вещества можно привести стекло. Как и другие подобные вещества, стекло не имеет определенной температуры плавления: при нагревании оно постепенно размягчается, пока, наконец, не становится жидким. Напротив, молекулы (или ионы) кристаллических веществ расположены строго упорядоченно. К кристаллическим веществам относятся песок, поваренная соль, сахар, алмаз, графит и т.п. Все они плавятся при определенной температуре (если только при нагревании не претерпевают никаких химических изменений, как это случается с сахаром). Многие ионные соединения (например, поваренная соль NaCl) образуют кристаллы, в которых каждый ион окружен противоположно заряженными ионами; в результате нельзя сказать, что какая-то конкретная пара ионов образует молекулу. Вследствие взаимного притяжения ионов в кристалле поваренной соли (NaCl) это вещество плавится при высокой температуре (801° С). Каждый ион NaCl окружен шестью ближайшими соседями, имеющими противоположный заряд. Элементарная ячейка кристалла поваренной соли — это куб, у которого по углам и в центре каждой грани расположены ионы натрия. Ячейка такого типа называется гранецентрированной кубической. Кубическую форму имеют и крупные кристаллы поваренной соли.
Напротив, молекулы (или ионы) кристаллических веществ расположены строго упорядоченно. К кристаллическим веществам относятся песок, поваренная соль, сахар, алмаз, графит и т.п. Все они плавятся при определенной температуре (если только при нагревании не претерпевают никаких химических изменений, как это случается с сахаром). Многие ионные соединения (например, поваренная соль NaCl) образуют кристаллы, в которых каждый ион окружен противоположно заряженными ионами; в результате нельзя сказать, что какая-то конкретная пара ионов образует молекулу. Вследствие взаимного притяжения ионов в кристалле поваренной соли (NaCl) это вещество плавится при высокой температуре (801° С). Каждый ион NaCl окружен шестью ближайшими соседями, имеющими противоположный заряд. Элементарная ячейка кристалла поваренной соли — это куб, у которого по углам и в центре каждой грани расположены ионы натрия. Ячейка такого типа называется гранецентрированной кубической. Кубическую форму имеют и крупные кристаллы поваренной соли.
КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА ПОВАРЕННОЙ СОЛИ. Маленькие шарики — ионы натрия, большие — ионы хлора. Все кристаллы поваренной соли имеют одинаковую кубическую форму.
Кристаллическая решетка алмаза, в которой каждый атом углерода ковалентно связан с четырьмя соседними атомами, также характеризуется гранецентрированной кубической элементарной ячейкой. Алмаз — очень твердое вещество, имеющее высокую температуру перехода.
КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА АЛМАЗА. Атомы углерода заключены в жесткую кристаллическую решетку, что делает алмаз чрезвычайно твердым.
Совсем по-другому расположены атомы углерода в графите. Здесь они образуют слои, не очень прочно связанные друг с другом. Каждый слой «выстлан» шестиугольниками из углеродных атомов, аналогичными бензольному кольцу. Поскольку сцепление между слоями довольно слабое, графит мягкий. Слои легко скользят один относительно другого, благодаря чему графит является хорошим смазочным материалом. Разные кристаллические формы одного и того же элемента, такие, как графит и алмаз, называют аллотропами.
См. также АЛЛОТРОПИЯ.
КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА ГРАФИТА. Атомы углерода в графите образуют слои. Они связаны друг с другом не очень прочно и могут скользить один относительно другого.
Вещества, молекулы которых удерживаются вместе слабыми силами притяжения, а не ковалентными или ионными связями, плавятся при относительно низких температурах, редко превышающих 400° С. Таково большинство органических соединений, а также ковалентные неорганические. В качестве примеров можно привести воду и бензол: температура их плавления значительно ниже комнатной.
Электропроводность. Металлы — прекрасные проводники электричества. Носителями электрического тока в них являются электроны, свободно «плавающие» в кристаллической решетке между ионами металла, занимающими фиксированное положение в узлах решетки. Эти электроны компенсируют взаимное отталкивание положительных ионов и стабилизируют всю структуру. Если к металлу приложить разность потенциалов, то электроны будут перемещаться к положительному полюсу и возникнет электрический ток.
Энциклопедия Кольера. — Открытое общество. 2000.
- ХИМИЧЕСКИЕ СВЯЗИ, ФОРМУЛЫ И УРАВНЕНИЯ
- ХИМИЯ. НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Полезное
Смотреть что такое «ХИМИЯ. ФИЗИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА» в других словарях:
Физические свойства — вещества свойства, присущие веществу вне химического взаимодействия: температура плавления, температура кипения, вязкость, плотность, диэлектрическая проницаемость, теплоёмкость, теплопроводность, электропроводность, абсорбция, цвет, концентрация … Википедия
Физические свойства — – характеризуют какую либо особенность физического состояния или отношение материала к различным физическим процессам. Эта группа включает параметры состояния, гидрофизические и теплофизические свойства, радиационную стойкость. [ Косых, А.… … Энциклопедия терминов, определений и пояснений строительных материалов
ХИМИЯ — наука о химических элементах, их соединениях и превращениях, происходящих в результате химических реакций.
 Она изучает, из каких веществ состоит тот или иной предмет; почему и как ржавеет железо, и почему олово не ржавеет; что происходит с пищей… … Энциклопедия Кольера
Она изучает, из каких веществ состоит тот или иной предмет; почему и как ржавеет железо, и почему олово не ржавеет; что происходит с пищей… … Энциклопедия КольераХИМИЯ — ХИМИЯ, отрасль науки, изучающая свойства, состав и структуру веществ и их взаимодействие друг с другом. В настоящее время химия представляет собой обширную область знаний и подразделяется прежде всего на органическую и неорганическую химию.… … Научно-технический энциклопедический словарь
Химия — I Химия I. Предмет и структура химии Химия одна из отраслей естествознания, предметом изучения которой являются химические элементы (Атомы), образуемые ими простые и сложные вещества (молекулы (См. Молекула)), их превращения и… … Большая советская энциклопедия
Химия — I Химия I. Предмет и структура химии Химия одна из отраслей естествознания, предметом изучения которой являются химические элементы (Атомы), образуемые ими простые и сложные вещества (молекулы (См.
 Молекула)), их превращения и… … Большая советская энциклопедия
Молекула)), их превращения и… … Большая советская энциклопедияХимия — У этого термина существуют и другие значения, см. Химия (значения). Химия (от араб. کيمياء, произошедшего, предположительно, от египетского слова km.t (чёрный), откуда возникло также название Египта, чернозёма и свинца «черная… … Википедия
Химия — Первоначальное значение и происхождение этого слова неизвестно; возможно, что оно просто старое название северного Египта, и тогда наука Chemi значит египетская наука; но так как Chemi, кроме Египта, обозначало еще черный цвет, a μελάνοσις… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Химия природных соединений — (ХПС) раздел органической химии, изучающий химические соединения, входящие в состав живых организмов, природные пути их превращений и методы искусственного получения. Как наука, химия природных соединений возникла одновременно с… … Википедия
ХИМИЯ КОЛЛОИДНАЯ — раздел физической химии, занимающийся изучением коллоидных дисперсных систем (дисперсий), в которых одно мелкораздробленное вещество дисперсная фаза равномерно распределено (диспергировано) в другой фазе дисперсионной среде.
 В коллоидных системах … Энциклопедия Кольера
В коллоидных системах … Энциклопедия Кольера
Книги
- Общая и неорганическая химия в 2 ч. Часть 2. Химия элементов 2-е изд., пер. и доп. Учебник и практикум для СПО, Нина Георгиевна Никитина. Учебник поможет студентам сформировать адекватную современному уровню знаний научную картину мира на основе знания законов химии, состава и строения вещества, химических и физико-химических… Подробнее Купить за 559 руб электронная книга
- Химия. 11 класс. Углубленный уровень. Тетрадь для практических работ. ФГОС, Новошинский И.И.. Тетрадь для практических занятий поможет учащимся успешно выполнять практические работы по химии, на которых они будут получать вещества, изучать их свойства физические и химические.… Подробнее Купить за 124 грн (только Украина)
- Химия. 10 класс. Углубленный уровень. Тетрадь для практических работ. ФГОС, Новошинский Иван Иванович, Новошинская Нина Степановна. Тетрадь для практических занятий поможет учащимся успешно выполнять практические работы по химии, на которых они будут получать вещества, изучать их свойства — физические и химические.
 … Подробнее Купить за 124 грн (только Украина)
… Подробнее Купить за 124 грн (только Украина)
Тема: «Соли. Состав и химические свойства солей»
Масленникова Оксана Михайловна учитель химии и биологии, стаж 10 лет, вторая категория КГУ «Сокологоровская средняя школа» района имени Габита Мусрепова, СКО |
Цель: Опираясь на определение солей, показать их состав, вспомнить валентности металлов и кислотных остатков. Знать и дальше развивать умение составления формул. Знать название солей. Умение учиться разделять вещества на химические классы. Уметь правильно читать формулы.
Ход урока
І. Организация класса
Здравствуйте. Ребята, сегодня на уроке будут присутствовать гости. Надеюсь, это не будет вас смущать, и вы в течении урока покажите свои хорошие знания и умения.
А сейчас давайте повторим домашнее задание.
ІІ. Опрос домашнего задания
1. Дать определение кислоты.
2. Какие кислоты вы знаете? Напишите на доске их формулы. Мы знаем, что Ме можно расположить в ряд активности.
3. Как расположены Ме в ряду активности и в чем здесь сущность? (Ме расположены в соответствии с их химической активностью; Ме, стоящие до Н2 — вытесняют его, а стоящие после Н2 — не вытесняют его из кислот.)
4. Применяя эти знания, напротив этих формул давайте напишем химические свойства кислот.
ІІІ. Новая тема
1. В любой реакции вы говорите, что образуется соль и вода, соль и водород. Давайте вместе дадим определение, что же такое соли.
Соли — это сложные вещества, состоящие из атомов Ме и кислотных остатков.
Тема нашего урока — соли.
Цель урока — познакомиться с понятием — соли, уметь составлять формулы солей, применяя валентности Ме и кислотных остатков, правильно читать новые формулы. На основе своих знаний, уметь разделять вещества на химические классы.
На основе своих знаний, уметь разделять вещества на химические классы.
Физические свойства солей: Соли — это кристаллические вещества. Часть из них хорошо растворимы в воде, часть — малорастворимые, а часть вообще не растворимы. Это мы можем узнать из таблицы растворимости, и обозначаем стрелочкой в низ
Показать: поваренная соль, питьевая сода, медный купорос и удобрения.
2. Как вы составляли химические формулы? Что учитывали при их составлении? (валентность Ме и кислотных остатков)
3. Сегодня мы рассмотрим некоторые хим. свойства солей.
Хим. свойства солей:
1) Соль + Ме = нов. соль + свободный Ме.
Fe + 2KCl → FeCl2 + 2K
Какой здесь тип хим. реакции?
2) Соль + соль = две новые соли.
2KCl + BaSO4 → K2 SO4 + BaCl2
CaCl2 + ZnSO4 → CaSO4 ↓+ ZnCl2
Какой здесь тип хим. реакции?
— Иногда при образовании новых солей, некоторые новые соли могут выпадать в осадок.
— Как мы можем это узнать? (Посмотреть в таблицу растворимости)
— И эти соли мы отметим стрелочкой вниз (I).
— Проработаем уже имеющиеся соли.
— С другими химическими свойствами солей мы познакомимся позже, на дальнейших уроках.
— Какую роль играют соли для живых организмов?
Растворы солей играют важную роль в живой природе. Недостаток определенных солей в почве приводит к угнетению растений. Поэтому многие соли применяются в качестве минеральных удобрений для сельскохозяйственных культур. Например, азотистые удобрения — необходимы стеблям и листьям; фосфорные и калийные удобрения — необходимы плодам, клубням, также стеблям и корням. И недостаток определенных минеральных веществ приведет к угасанию растения. Доля солей в организме человека достигает 5,5%. Они входят в состав клеток, костей и тканей, участвуют в процессах обмена вещ-в живых организмах. Но, не смотря на необходимость солей для нормальной жизнедеятельности организма, избыточное употребление солей ведет к различным заболеваниям: это могут быть отложения солей в костях человека, или в виде песка или камней в каких-либо органах (камни в желчном пузыре, печени, почках).
Велика роль солей в промышленности. Их используют при получении Ме и других важных химических веществ; например, для изготовления клея, мыла, туши и др. веществ.
ІV. Закрепление материала
Мы знаем, что существует 4 класса хим. Соединений
оксиды кислоты соли основания
С тремя классами мы с вами уже познакомились и первое задание «Винегрет»:
1. Из приведенных веществ выписать отдельно формулы оксидов, кислот, солей (каждой группе свой класс). Правильно прочитать формулы и расставить валентности веществам.
Дать 2 карточки.
KCl Na2SO4 SO3HNO3 Al2 O3 H3 PO4 FeS P2 O5 H2 SiO3
2. стр. 95 № 5. Составьте формулы следующих солей:
сульфат калия K2 SO4
фосфат натрия Na3 PO4
нитрат бария Ba(NO3)2
сульфид цинка ZnS
хлорид меди (І) CuCl
сульфат меди (ІІ) CuSO4
3. стр. 95 № 7 — 1 и 2 столбик. Закончите уравнения хим. реакций и расставьте коэффициенты:
стр. 95 № 7 — 1 и 2 столбик. Закончите уравнения хим. реакций и расставьте коэффициенты:
Mg + 2HCl → MgCl2 + H2 Hg + FeCl2 → HgCl2 + Fe
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag 3Mg + 2AlCl3 → 3MgCl2 + 2Al
4. Физ. минутка
5. Отгадаем кроссворд:
1. Заряд этого вещества +24? (хром)
2. Благодаря этому веществу происходят реакции окисления? (кислород)
3. Реакция, в которой взаимодействуют два сложных вещества, называется? (реакция обмена)
4. Что это за соль ZnSiO3? (силикат цинка)
5. Как называются вещ-ва, используемые для подкормки растений? (удобрения)
V. Итог урока
1. Дать определение солям.
2. С какими солями вы сегодня познакомились?
3. На доске написано высказывание «Мы есть то, что мы едим».
Как связать это высказывание с химией, в частности с нашей темой?
Домашнее задание: 35 стр. 93–95; № 6; № 7 (3 столбик) стр. 90 — таблица.
93–95; № 6; № 7 (3 столбик) стр. 90 — таблица.
Физико-химические основы нанотехнологий. Учебное пособие
%PDF-1.6 % 1393 0 obj > endobj 1396 0 obj > endobj 1726 0 obj >stream 2014-03-13T12:42:58+04:002014-03-20T16:41:58+04:002014-03-20T16:41:58+04:00iTextSharp 4.1.6 by 1T3XTapplication/pdf
 32 841.92]/Resources>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI]>>/Type/Page>>
endobj
1330 0 obj
>/MediaBox[0 0 595.32 841.92]/Resources>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI]>>/Type/Page>>
endobj
1333 0 obj
>/MediaBox[0 0 595.32 841.92]/Resources>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI]>>/Type/Page>>
endobj
1338 0 obj
>/MediaBox[0 0 595.32 841.92]/Resources>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI]>>/Type/Page>>
endobj
1362 0 obj
>/MediaBox[0 0 595.32 841.92]/Resources>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI]>>/Type/Page>>
endobj
1364 0 obj
>/MediaBox[0 0 595.32 841.92]/Resources>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI]>>/Type/Page>>
endobj
1366 0 obj
>/MediaBox[0 0 595.32 841.92]/Resources>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI]>>/Type/Page>>
endobj
1367 0 obj
>stream
xY;6.Ls&pX@ ` uAڤo3)i)0zrN>>XOv:-oߟ0b\MLN3[
חo\?=~T J^̻(B͔»5ʼnXd)Bݹ~4^Mxi]’\?p7GptDyn_c/-g\6N` LFx
o ^k+ޞox51xe/݀Wo[]gV5!3אIôHf+~iAAhjK@Ĭ’=˔
32 841.92]/Resources>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI]>>/Type/Page>>
endobj
1330 0 obj
>/MediaBox[0 0 595.32 841.92]/Resources>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI]>>/Type/Page>>
endobj
1333 0 obj
>/MediaBox[0 0 595.32 841.92]/Resources>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI]>>/Type/Page>>
endobj
1338 0 obj
>/MediaBox[0 0 595.32 841.92]/Resources>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI]>>/Type/Page>>
endobj
1362 0 obj
>/MediaBox[0 0 595.32 841.92]/Resources>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI]>>/Type/Page>>
endobj
1364 0 obj
>/MediaBox[0 0 595.32 841.92]/Resources>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI]>>/Type/Page>>
endobj
1366 0 obj
>/MediaBox[0 0 595.32 841.92]/Resources>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI]>>/Type/Page>>
endobj
1367 0 obj
>stream
xY;6.Ls&pX@ ` uAڤo3)i)0zrN>>XOv:-oߟ0b\MLN3[
חo\?=~T J^̻(B͔»5ʼnXd)Bݹ~4^Mxi]’\?p7GptDyn_c/-g\6N` LFx
o ^k+ޞox51xe/݀Wo[]gV5!3אIôHf+~iAAhjK@Ĭ’=˔Основы органической химии / КонсультантПлюс
Основы органической химии
Появление и развитие органической химии как науки. Предмет органической химии. Место и значение органической химии в системе естественных наук. Взаимосвязь неорганических и органических веществ.
Предмет органической химии. Место и значение органической химии в системе естественных наук. Взаимосвязь неорганических и органических веществ.
Химическое строение как порядок соединения атомов в молекуле согласно их валентности. Основные положения теории химического строения органических соединений А.М. Бутлерова. Углеродный скелет органической молекулы. Кратность химической связи. Зависимость свойств веществ от химического строения молекул. Изомерия и изомеры. Понятие о функциональной группе. Принципы классификации органических соединений. Международная номенклатура и принципы образования названий органических соединений.
Классификация и особенности органических реакций. Реакционные центры. Первоначальные понятия о типах и механизмах органических реакций. Гомолитический и гетеролитический разрыв ковалентной химической связи. Свободнорадикальный и ионный механизмы реакции. Понятие о нуклеофиле и электрофиле.
Алканы. Электронное и пространственное строение молекулы метана. sp3-гибридизация орбиталей атомов углерода. Гомологический ряд и общая формула алканов. Систематическая номенклатура алканов и радикалов. Изомерия углеродного скелета. Физические свойства алканов. Закономерности изменения физических свойств. Химические свойства алканов: галогенирование, дегидрирование, термическое разложение, крекинг как способы получения важнейших соединений в органическом синтезе. Горение алканов как один из основных источников тепла в промышленности и быту. Изомеризация как способ получения высокосортного бензина. Механизм реакции свободнорадикального замещения. Получение алканов. Реакция Вюрца. Нахождение в природе и применение алканов.
sp3-гибридизация орбиталей атомов углерода. Гомологический ряд и общая формула алканов. Систематическая номенклатура алканов и радикалов. Изомерия углеродного скелета. Физические свойства алканов. Закономерности изменения физических свойств. Химические свойства алканов: галогенирование, дегидрирование, термическое разложение, крекинг как способы получения важнейших соединений в органическом синтезе. Горение алканов как один из основных источников тепла в промышленности и быту. Изомеризация как способ получения высокосортного бензина. Механизм реакции свободнорадикального замещения. Получение алканов. Реакция Вюрца. Нахождение в природе и применение алканов.
Циклоалканы. Строение молекул циклоалканов. Общая формула циклоалканов. Номенклатура циклоалканов. Изомерия циклоалканов: углеродного скелета, межклассовая, пространственная (цис-транс-изомерия). Специфика свойств циклоалканов с малым размером цикла. Реакции присоединения и радикального замещения.
Алкены. Электронное и пространственное строение молекулы этилена. sp2-гибридизация орбиталей атомов углерода. — и -связи. Гомологический ряд и общая формула алкенов. Номенклатура алкенов. Изомерия алкенов: углеродного скелета, положения кратной связи, пространственная (цис-транс-изомерия), межклассовая. Физические свойства алкенов. Реакции электрофильного присоединения как способ получения функциональных производных углеводородов. Правило Марковникова, его электронное обоснование. Реакции окисления и полимеризации. Полиэтилен как крупнотоннажный продукт химического производства. Промышленные и лабораторные способы получения алкенов. Правило Зайцева. Применение алкенов.
sp2-гибридизация орбиталей атомов углерода. — и -связи. Гомологический ряд и общая формула алкенов. Номенклатура алкенов. Изомерия алкенов: углеродного скелета, положения кратной связи, пространственная (цис-транс-изомерия), межклассовая. Физические свойства алкенов. Реакции электрофильного присоединения как способ получения функциональных производных углеводородов. Правило Марковникова, его электронное обоснование. Реакции окисления и полимеризации. Полиэтилен как крупнотоннажный продукт химического производства. Промышленные и лабораторные способы получения алкенов. Правило Зайцева. Применение алкенов.
Алкадиены. Классификация алкадиенов по взаимному расположению кратных связей в молекуле. Особенности электронного и пространственного строения сопряженных алкадиенов. Общая формула алкадиенов. Номенклатура и изомерия алкадиенов. Физические свойства алкадиенов. Химические свойства алкадиенов: реакции присоединения (гидрирование, галогенирование), горения и полимеризации. Вклад С.В. Лебедева в получение синтетического каучука. Вулканизация каучука. Резина. Многообразие видов синтетических каучуков, их свойства и применение. Получение алкадиенов.
Вклад С.В. Лебедева в получение синтетического каучука. Вулканизация каучука. Резина. Многообразие видов синтетических каучуков, их свойства и применение. Получение алкадиенов.
Алкины. Электронное и пространственное строение молекулы ацетилена. sp-гибридизация орбиталей атомов углерода. Гомологический ряд и общая формула алкинов. Номенклатура. Изомерия: углеродного скелета, положения кратной связи, межклассовая. Физические свойства алкинов. Химические свойства алкинов: реакции присоединения как способ получения полимеров и других полезных продуктов. Реакции замещения. Горение ацетилена как источник высокотемпературного пламени для сварки и резки металлов. Получение ацетилена пиролизом метана и карбидным методом. Применение ацетилена.
Арены. История открытия бензола. Современные представления об электронном и пространственном строении бензола. Изомерия и номенклатура гомологов бензола. Общая формула аренов. Физические свойства бензола. Химические свойства бензола: реакции электрофильного замещения (нитрование, галогенирование) как способ получения химических средств защиты растений; присоединения (гидрирование, галогенирование) как доказательство непредельного характера бензола. Реакция горения. Получение бензола. Особенности химических свойств толуола. Взаимное влияние атомов в молекуле толуола. Ориентационные эффекты заместителей. Применение гомологов бензола.
Реакция горения. Получение бензола. Особенности химических свойств толуола. Взаимное влияние атомов в молекуле толуола. Ориентационные эффекты заместителей. Применение гомологов бензола.
Спирты. Классификация, номенклатура спиртов. Гомологический ряд и общая формула предельных одноатомных спиртов. Изомерия. Физические свойства предельных одноатомных спиртов. Водородная связь между молекулами и ее влияние на физические свойства спиртов. Химические свойства: взаимодействие с натрием как способ установления наличия гидроксогруппы, с галогеноводородами как способ получения растворителей, внутри- и межмолекулярная дегидратация. Реакция горения: спирты как топливо. Получение этанола: реакция брожения глюкозы, гидратация этилена. Применение метанола и этанола. Физиологическое действие метанола и этанола на организм человека. Этиленгликоль и глицерин как представители предельных многоатомных спиртов. Качественная реакция на многоатомные спирты и ее применение для распознавания глицерина в составе косметических средств. Практическое применение этиленгликоля и глицерина.
Практическое применение этиленгликоля и глицерина.
Фенол. Строение молекулы фенола. Взаимное влияние атомов в молекуле фенола. Физические свойства фенола. Химические свойства (реакции с натрием, гидроксидом натрия, бромом). Получение фенола. Применение фенола.
Альдегиды и кетоны. Классификация альдегидов и кетонов. Строение предельных альдегидов. Электронное и пространственное строение карбонильной группы. Гомологический ряд, общая формула, номенклатура и изомерия предельных альдегидов. Физические свойства предельных альдегидов. Химические свойства предельных альдегидов: гидрирование; качественные реакции на карбонильную группу (реакция «серебряного зеркала», взаимодействие с гидроксидом меди (II)) и их применение для обнаружения предельных альдегидов в промышленных сточных водах. Получение предельных альдегидов: окисление спиртов, гидратация ацетилена (реакция Кучерова). Токсичность альдегидов. Применение формальдегида и ацетальдегида. Ацетон как представитель кетонов. Строение молекулы ацетона. Особенности реакции окисления ацетона. Применение ацетона.
Особенности реакции окисления ацетона. Применение ацетона.
Карбоновые кислоты. Классификация и номенклатура карбоновых кислот. Строение предельных одноосновных карбоновых кислот. Электронное и пространственное строение карбоксильной группы. Гомологический ряд и общая формула предельных одноосновных карбоновых кислот. Физические свойства предельных одноосновных карбоновых кислот. Химические свойства предельных одноосновных карбоновых кислот (реакции с металлами, основными оксидами, основаниями и солями) как подтверждение сходства с неорганическими кислотами. Реакция этерификации и ее обратимость. Влияние заместителей в углеводородном радикале на силу карбоновых кислот. Особенности химических свойств муравьиной кислоты. Получение предельных одноосновных карбоновых кислот: окисление алканов, алкенов, первичных спиртов, альдегидов. Важнейшие представители карбоновых кислот: муравьиная, уксусная и бензойная. Высшие предельные и непредельные карбоновые кислоты. Оптическая изомерия. Асимметрический атом углерода. Применение карбоновых кислот.
Применение карбоновых кислот.
Сложные эфиры и жиры. Строение и номенклатура сложных эфиров. Межклассовая изомерия с карбоновыми кислотами. Способы получения сложных эфиров. Обратимость реакции этерификации. Применение сложных эфиров в пищевой и парфюмерной промышленности. Жиры как сложные эфиры глицерина и высших карбоновых кислот. Растительные и животные жиры, их состав. Физические свойства жиров. Химические свойства жиров: гидрирование, окисление. Гидролиз или омыление жиров как способ промышленного получения солей высших карбоновых кислот. Применение жиров. Мыла как соли высших карбоновых кислот. Моющие свойства мыла.
Углеводы. Классификация углеводов. Физические свойства и нахождение углеводов в природе. Глюкоза как альдегидоспирт. Химические свойства глюкозы: ацилирование, алкилирование, спиртовое и молочнокислое брожение. Экспериментальные доказательства наличия альдегидной и спиртовых групп в глюкозе. Получение глюкозы. Фруктоза как изомер глюкозы. Рибоза и дезоксирибоза. Важнейшие дисахариды (сахароза, лактоза, мальтоза), их строение и физические свойства. Гидролиз сахарозы, лактозы, мальтозы. Крахмал и целлюлоза как биологические полимеры. Химические свойства крахмала (гидролиз, качественная реакция с йодом на крахмал и ее применение для обнаружения крахмала в продуктах питания). Химические свойства целлюлозы: гидролиз, образование сложных эфиров. Применение и биологическая роль углеводов. Окисление углеводов — источник энергии живых организмов. Понятие об искусственных волокнах на примере ацетатного волокна.
Важнейшие дисахариды (сахароза, лактоза, мальтоза), их строение и физические свойства. Гидролиз сахарозы, лактозы, мальтозы. Крахмал и целлюлоза как биологические полимеры. Химические свойства крахмала (гидролиз, качественная реакция с йодом на крахмал и ее применение для обнаружения крахмала в продуктах питания). Химические свойства целлюлозы: гидролиз, образование сложных эфиров. Применение и биологическая роль углеводов. Окисление углеводов — источник энергии живых организмов. Понятие об искусственных волокнах на примере ацетатного волокна.
Идентификация органических соединений. Генетическая связь между классами органических соединений.
Амины. Первичные, вторичные, третичные амины. Классификация аминов по типу углеводородного радикала и числу аминогрупп в молекуле. Электронное и пространственное строение предельных аминов. Физические свойства аминов. Амины как органические основания: реакции с водой, кислотами. Реакция горения. Анилин как представитель ароматических аминов. Строение анилина. Причины ослабления основных свойств анилина в сравнении с аминами предельного ряда. Химические свойства анилина: взаимодействие с кислотами, бромной водой, окисление. Получение аминов алкилированием аммиака и восстановлением нитропроизводных углеводородов. Реакция Зинина. Применение аминов в фармацевтической промышленности. Анилин как сырье для производства анилиновых красителей. Синтезы на основе анилина.
Строение анилина. Причины ослабления основных свойств анилина в сравнении с аминами предельного ряда. Химические свойства анилина: взаимодействие с кислотами, бромной водой, окисление. Получение аминов алкилированием аммиака и восстановлением нитропроизводных углеводородов. Реакция Зинина. Применение аминов в фармацевтической промышленности. Анилин как сырье для производства анилиновых красителей. Синтезы на основе анилина.
Аминокислоты и белки. Состав и номенклатура. Строение аминокислот. Гомологический ряд предельных аминокислот. Изомерия предельных аминокислот. Физические свойства предельных аминокислот. Аминокислоты как амфотерные органические соединения. Синтез пептидов. Пептидная связь. Биологическое значение -аминокислот. Области применения аминокислот. Белки как природные биополимеры. Состав и строение белков. Основные аминокислоты, образующие белки. Химические свойства белков: гидролиз, денатурация, качественные (цветные) реакции на белки. Превращения белков пищи в организме. Биологические функции белков. Достижения в изучении строения и синтеза белков.
Биологические функции белков. Достижения в изучении строения и синтеза белков.
Азотсодержащие гетероциклические соединения. Пиррол и пиридин: электронное строение, ароматический характер, различие в проявлении основных свойств. Нуклеиновые кислоты: состав и строение. Строение нуклеотидов. Состав нуклеиновых кислот (ДНК, РНК). Роль нуклеиновых кислот в жизнедеятельности организмов.
Высокомолекулярные соединения. Основные понятия высокомолекулярных соединений: мономер, полимер, структурное звено, степень полимеризации. Классификация полимеров. Основные способы получения высокомолекулярных соединений: реакции полимеризации и поликонденсации. Строение и структура полимеров. Зависимость свойств полимеров от строения молекул. Термопластичные и термореактивные полимеры. Проводящие органические полимеры. Композитные материалы. Перспективы использования композитных материалов. Классификация волокон. Синтетические волокна. Полиэфирные и полиамидные волокна, их строение, свойства. Практическое использование волокон. Синтетические пленки: изоляция для проводов, мембраны для опреснения воды, защитные пленки для автомобилей, пластыри, хирургические повязки. Новые технологии дальнейшего совершенствования полимерных материалов.
Синтетические пленки: изоляция для проводов, мембраны для опреснения воды, защитные пленки для автомобилей, пластыри, хирургические повязки. Новые технологии дальнейшего совершенствования полимерных материалов.
Формула хлорида натрия — применение, свойства, структура и формула хлорида натрия
Формула и структура: Химическая формула хлорида натрия — NaCl, а его молярная масса составляет 58,44 г / моль. Это ионное соединение, состоящее из катиона натрия (Na + ) и хлорид-аниона (Cl — ). Твердый NaCl имеет кристаллическую структуру, в которой каждый ион Na + окружен шестью ионами хлора в октаэдрической геометрии.
Прохождение: Хлорид натрия присутствует в морских и океанских водах, что придает им соленость.Около 1-5% морской воды состоит из хлорида натрия. Он также встречается в виде минерала галита или каменной соли.
Приготовление: Соль получают в больших количествах путем испарения морской воды или соленой воды (рассола) из соленых озер и солевых колодцев. Поскольку морская вода содержит несколько других солей (кальция, магния и других элементов), процесс испарения проводится осторожно, чтобы различные соли выпадали в осадок в разное время в зависимости от их растворимости. Другой важный метод производства — добыча запасов каменной соли.
Поскольку морская вода содержит несколько других солей (кальция, магния и других элементов), процесс испарения проводится осторожно, чтобы различные соли выпадали в осадок в разное время в зависимости от их растворимости. Другой важный метод производства — добыча запасов каменной соли.
Физические свойства: Хлорид натрия представляет собой белое кристаллическое твердое вещество с плотностью 2,16 г / мл и температурой плавления 801 ° C. Он также доступен в виде водных растворов различной концентрации, называемых солевыми растворами.
Химические свойства: Хлорид натрия легко растворяется в воде и других полярных растворителях. Это стабильное твердое тело. Он разлагается только при высоких температурах с образованием токсичных паров соляной кислоты (HCl) и оксида динатрия (Na 2 O).
Применение: Хлорид натрия, наиболее известный как поваренная соль, широко используется в пищевой промышленности для ароматизации и консервирования.Он также используется в производстве многих важных химикатов, включая гидроксид натрия, карбонат натрия, пищевую соду, соляную кислоту и т. Д. Он также применяется на нефтеперерабатывающих заводах, в текстильной, бумажной и целлюлозной промышленности, огнезащитных составах, в резиновой промышленности и т. Д. в дорожном строительстве. Еще одно важное применение — это защита от обледенения дорог и тротуаров в холодных и заснеженных регионах. Солевые растворы также используются во многих медицинских целях.
Д. Он также применяется на нефтеперерабатывающих заводах, в текстильной, бумажной и целлюлозной промышленности, огнезащитных составах, в резиновой промышленности и т. Д. в дорожном строительстве. Еще одно важное применение — это защита от обледенения дорог и тротуаров в холодных и заснеженных регионах. Солевые растворы также используются во многих медицинских целях.
Воздействие на здоровье / опасность для здоровья: В низких концентрациях хлорид натрия нетоксичен и неопасен, а также является важным источником электролита для организма.Высокое потребление соли в течение длительного времени может вызвать дисбаланс электролитов в организме. Проглатывание в больших количествах может вызвать рвоту, тошноту, диарею и обезвоживание. Он также может раздражать глаза и вызывать повреждение глаз при высоких концентрациях.
Хлорид натрия | AMERICAN ELEMENTS ®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Название продукта: Хлорид натрия
Номер продукта: Все применимые коды продуктов American Elements, например. г. NA-CL-02
, NA-CL-03
, NA-CL-04
, NA-CL-05
г. NA-CL-02
, NA-CL-03
, NA-CL-04
, NA-CL-05
CAS #: 7647-14-5
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
10884 Weyburn Ave.
Los Анхелес, Калифорния
Тел .: +1 310-208-0551
Факс: +1 310-208-0351
Телефон экстренной связи:
Внутренний, Северная Америка: +1 800-424-9300
Международный: +1 703-527-3887
РАЗДЕЛ 2.ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Не классифицируется как опасный в соответствии с директивами ЕС.
РАЗДЕЛ 3. СОСТАВ / ИНФОРМАЦИЯ ОБ ИНГРЕДИЕНТАХ
НАИМЕНОВАНИЕ КОМПОНЕНТА № CAS% КЛАСС РИСКА ДЛЯ ЗДОРОВЬЯ № ООН
Хлорид натрия 7647-14-5 100% N.R. Н.Р. Нет —
РАЗДЕЛ 4. ПЕРВАЯ ПОМОЩЬ
ОБЩИЕ ПОЛОЖЕНИЯ: обратитесь к врачу за конкретным советом.
ГЛАЗА: Тщательно промойте водой, если дискомфорт не исчезнет, обратитесь за медицинской помощью.
КОЖА: Тщательно смыть водой с мылом.
ПРИ ВДЫХАНИИ: Убрать из зоны воздействия, отдохнуть и согреться. В тяжелых случаях обратитесь за медицинской помощью.
ПРОГЛАТЫВАНИЕ: Тщательно прополоскать рот водой. При сознании вызвать рвоту. Обратитесь за медицинской помощью.
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
ТОЧКА ВСПЫШКИ: не воспламеняется. Неприменимо
ТЕМП. АВТОЗАЖИГАНИЯ: Неприменимо
СРЕДСТВА ТУШЕНИЯ: Неприменимо
НЕОБЫЧНАЯ ОПАСНОСТЬ ПОЖАРА: При пожаре могут выделяться токсичные пары.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
ОЧИСТКА ОТ ЗАГРЯЗНЕНИЙ: Носите подходящую защитную одежду и оборудование, перечисленные в разделе «Воздействие / Индивидуальная защита».Смешайте с песком, осторожно перенесите в контейнер
и организуйте удаление компанией по утилизации. Тщательно промойте место разлива водой с моющим средством. Для крупных разливов жидкости должны быть собраны с помощью песка или земли
, а жидкости и твердые частицы должны быть перемещены в контейнеры для утилизации. С любыми остатками следует обращаться как с небольшими разливами.
С любыми остатками следует обращаться как с небольшими разливами.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ ИСПОЛЬЗОВАНИИ: Никаких специальных мер предосторожности
МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ ХРАНЕНИИ: Хранить при комнатной температуре (рекомендуется от 15 до 25 ° C).Хранить в закрытом и защищенном от влаги месте.
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ / ИНДИВИДУАЛЬНАЯ ЗАЩИТА
Требуются защитные перчатки из поливинилового спирта (ПВА). Рекомендуется использовать лабораторный халат. Защитные очки или защитные очки с боковыми щитками необходимы, если
существует вероятность образования сколов или пыли. При превышении порогового значения необходимо надевать респираторы. Обеспечьте соответствующую общую механическую вентиляцию и местную вытяжную вентиляцию
.При работе с большим количеством этого материала обязательно используйте соответствующие средства защиты, как описано. Промывка для глаз должна быть в наличии.
Тщательно вымыть после работы. Не принимать внутрь. Избегайте вдыхания пыли при ее образовании. Лицам с чувствительными существующими заболеваниями следует обратиться за медицинской консультацией
Не принимать внутрь. Избегайте вдыхания пыли при ее образовании. Лицам с чувствительными существующими заболеваниями следует обратиться за медицинской консультацией
перед работой, связанной с воздействием этого материала.
ПРЕДЕЛЫ ВОЗДЕЙСТВИЯ OES, не назначено (длительный срок, 8 часов TWA)
РАЗДЕЛ 9. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
ВНЕШНИЙ ВИД: Прозрачные прозрачные кристаллические частицы
pH В ВОДНОМ РАСТВОРЕ: данные отсутствуют
ТОЧКА КИПЕНИЯ (760 мм рт. ° C
ТОЧКА ПЛАВЛЕНИЯ: 800 ° C
ТОЧКА ВОСПЛАМЕНЕНИЯ: неприменимо
ВОСПЛАМЕНЯЕМОСТЬ: неприменимо
ВЗРЫВООПАСНОСТЬ: неприменимо УДЕЛЬНАЯ ВЕСА
: 2.17
ДАВЛЕНИЕ ПАРА: Не применимо
РАСТВОРИМОСТЬ В ВОДЕ: Очень растворим (35,7 г / 100 г воды при 0 ° C)
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
СТАБИЛЬНОСТЬ: Стабилен при нормальных условиях хранения или использования.
ОПАСНОЕ РАЗЛОЖЕНИЕ: Нет данных.
МАТЕРИАЛЫ, КОТОРЫЕ НЕОБХОДИМО ИЗБЕГАТЬ: сильные кислоты
РАЗДЕЛ 11.
 ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ ТОКСИЧНАЯ ДОЗА — LD50 3000 мг / кг перорально, крыса.
КАНЦЕРОГЕННОСТЬ Нет свидетельств канцерогенных свойств.
МУТАГЕННОСТЬ / ТЕРАТОГЕННОСТЬ Нет данных о мутагенных эффектах.
ТОКСИКОЛОГИЧЕСКИЕ РЕЗУЛЬТАТЫ Оценка токсикологических данных отсутствует.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Никакой опасности для окружающей среды не ожидается при условии обращения с материалом и его утилизации с должной осторожностью и вниманием.
РАЗДЕЛ 13. УТИЛИЗАЦИЯ.
СПОСОБЫ УТИЛИЗАЦИИ: Неопасные и нерегулируемые твердые отходы. Обратитесь в местный орган по утилизации отходов за советом или обратитесь в компанию по утилизации химикатов
.
РАЗДЕЛ 14. ТРАНСПОРТНАЯ ИНФОРМАЦИЯ
КЛАССИФИКАЦИЯ: Не классифицируется как опасный в соответствии с директивами ЕС. Номер ЕС: 231-598-3
ЭТИКЕТКА ДЛЯ ПОСТАВКИ: Нет.
ФРАЗЫ О РИСКЕ: Нет.
ФРАЗЫ О БЕЗОПАСНОСТИ: Нет.
.
 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ
15. НОРМАТИВНАЯ ИНФОРМАЦИЯН / Д
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Вышеупомянутая информация считается правильной, но не претендует на исчерпывающий характер и должна использоваться только в качестве руководства.Информация в этом документе основана на текущем уровне наших знаний и применима к продукту с учетом соответствующих мер безопасности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. На обратной стороне счета-фактуры или упаковочного листа. АВТОРСКИЕ ПРАВА 1997-2021 AMERICAN ELEMENTS. ЛИЦЕНЗИОННЫМ ДАННЫМ РАЗРЕШЕНО ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННЫХ КОПИЙ БУМАГИ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
5.1: Сахар и соль — Chemistry LibreTexts
Хлорид натрия, также известный как поваренная соль, представляет собой ионное соединение с химической формулой \ (\ ce {NaCl} \), представляющей соотношение 1: 1 ионов натрия и хлорида. . Он обычно используется в качестве приправы и пищевого консерванта. Соль можно получить, сложив вместе два очень реактивных элемента: металлический натрий (\ (\ ce {Na (s)} \) и газообразный хлор (\ (\ ce {Cl2 (g)} \).
. Он обычно используется в качестве приправы и пищевого консерванта. Соль можно получить, сложив вместе два очень реактивных элемента: металлический натрий (\ (\ ce {Na (s)} \) и газообразный хлор (\ (\ ce {Cl2 (g)} \).
\ [\ ce {2Na (s) + Cl2 (g) \ rightarrow 2NaCl (s)} \ label {eq1} \]
Элемент натрий (рисунок \ (\ PageIndex {1a} \)) является очень химически активным металлом; при возможности он вступит в реакцию с потом на ваших руках и образует гидроксид натрия, который является очень едким веществом.Элемент хлор (рис. \ (\ PageIndex {1b} \)) — это бледно-желтый едкий газ, который не следует вдыхать из-за его ядовитости. Однако объедините эти два опасных вещества вместе, и они вступят в реакцию с образованием ионного соединения хлорида натрия (рис. \ (\ PageIndex {1c} \)), известного просто как соль.
Рисунок \ (\ PageIndex {1} \): Натрий + Хлор = Хлорид натрия (а) Натрий — очень реактивный металл. (б) Хлор — это бледно-желтый ядовитый газ. (c) Вместе натрий и хлор образуют хлорид натрия — соль, которая необходима для нашего выживания. {-}} \) ионы необходимы для правильной работы нервов и дыхания. Оба эти иона поставляются солью. Вкус соли — один из основных вкусов; соль — вероятно, самый древний из известных ароматизаторов и один из немногих камней, которые мы едим. Ясно, что когда элементарный натрий и хлор объединяются (уравнение \ ref {eq1}), образующийся солевой продукт имеет радикально разные свойства (как физические, так и химические). Наблюдать за этой реакцией очень интересно (Видео \ (\ PageIndex {1} \)).
{-}} \) ионы необходимы для правильной работы нервов и дыхания. Оба эти иона поставляются солью. Вкус соли — один из основных вкусов; соль — вероятно, самый древний из известных ароматизаторов и один из немногих камней, которые мы едим. Ясно, что когда элементарный натрий и хлор объединяются (уравнение \ ref {eq1}), образующийся солевой продукт имеет радикально разные свойства (как физические, так и химические). Наблюдать за этой реакцией очень интересно (Видео \ (\ PageIndex {1} \)).Видео \ (\ PageIndex {1} \): Приготовление столовой соли с использованием металлического натрия и газообразного хлора
Еще одно соединение — сахар, общее название сладких растворимых углеводов, многие из которых используются в пище.Сахар имеет химическую формулу \ (\ ce {C12h32O11} \) и состоит из элементов, отличных от соли: углерода, водорода и кислорода. Хотя сахар качественно напоминает поваренную соль (которую часто путают на кухне), они имеют совершенно разные физические и химические свойства. Существуют разные типы сахара, полученные из разных источников. Хотя сахар состоит из углерода, водорода и кислорода, его значительно сложнее синтезировать из составляющих его элементов, чем поваренную соль (уравнение \ ref {eq1}).Однако термическое разложение значительно проще и может быть представлено как дегидратация сахарозы до чистого углерода и водяного пара в уравнении \ ref {eq2} и продемонстрировано в видео \ (\ PageIndex {2} \).
Существуют разные типы сахара, полученные из разных источников. Хотя сахар состоит из углерода, водорода и кислорода, его значительно сложнее синтезировать из составляющих его элементов, чем поваренную соль (уравнение \ ref {eq1}).Однако термическое разложение значительно проще и может быть представлено как дегидратация сахарозы до чистого углерода и водяного пара в уравнении \ ref {eq2} и продемонстрировано в видео \ (\ PageIndex {2} \).
\ [\ ce {C12h32O11 (s) + тепло → 12C (s) + 11h3O (g)} \ label {eq2} \]
Видео \ (\ PageIndex {2} \): Научный эксперимент на кухне показывает, что происходит с молекулами сахара при их нагревании. Эксперимент не разочаровал!
Как и соль, сахар имеет радикально отличные свойства (как физические, так и химические) от составляющих его элементов.Это различие в свойствах составляющих элементов и соединений является главной особенностью химических реакций.
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Физические свойства, морфология и соленость частиц соли в зависимости от условий распылительной сушки и замещения хлорида калия
https: // doi. org / 10.1016 / j.powtec.2017.12.014Получить права и содержание
org / 10.1016 / j.powtec.2017.12.014Получить права и содержаниеОсновные моменты
- •
Сверхмалые частицы соли с / без KCl были получены с помощью распылительной сушки.
- •
Использование KCl / NaCl создает неровности поверхности и внутренние поры частиц соли.
- •
Агломерация, шероховатость поверхности, макропоры повышенная соленость частиц соли.
- •
Частицы соли с 30% замещением KCl имели самую высокую соленость.
Abstract
Поскольку чрезмерное потребление натрия увеличивает риск ряда заболеваний, было приложено много усилий для уменьшения содержания натрия в пище. Здесь была предпринята попытка комбинированного использования распылительной сушки и замещения KCl для изменения физических свойств и морфологии частиц соли KCl / NaCl. Было изучено влияние температуры входящего воздуха, скорости потока сырья и уровня замещения KCl на содержание влаги, размер частиц, площадь поверхности, насыпную плотность, гигроскопичность, кристалличность, морфологию, характеристики поглощения N 2 , кристалличность и соленость частиц соли. определенный.Комбинированное использование KCl и NaCl создало неровности поверхности и внутренние поры частиц соли. Хотя более высокая скорость потока исходного материала и уровень замещения KCl привели к значительно большему размеру частиц, частицы соли с наивысшим уровнем замещения KCl (30%) показали самую высокую гигроскопичность и соленость из-за их более низкой объемной плотности и наличия агломерации, шероховатости поверхности и макропор. Было отмечено, что все частицы соли, подвергнутые распылительной сушке, были кристаллоподобными.
определенный.Комбинированное использование KCl и NaCl создало неровности поверхности и внутренние поры частиц соли. Хотя более высокая скорость потока исходного материала и уровень замещения KCl привели к значительно большему размеру частиц, частицы соли с наивысшим уровнем замещения KCl (30%) показали самую высокую гигроскопичность и соленость из-за их более низкой объемной плотности и наличия агломерации, шероховатости поверхности и макропор. Было отмечено, что все частицы соли, подвергнутые распылительной сушке, были кристаллоподобными.
Ключевые слова
Микроструктура
Физические свойства
Сенсорная оценка
Распылительная сушка
Характеристики поверхности
Рентгеновская дифракция
Рекомендуемые статьи Цитирующие статьи (0)
Полный текст© 2017 Elsevier B.V. Все права защищены.
Рекомендуемые статьи
Цитирование статей
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Соль — Энциклопедия Нового Света
- О химических свойствах соли см. Хлорид натрия; для химического термина см соль (химия).
- Для использования в других целях, см. Соль (значения).
Соль — это минерал, состоящий в основном из хлорида натрия, который обычно употребляется в пищу людьми.Существуют разные формы соли: неочищенная соль (например, морская соль), очищенная соль (поваренная соль) и йодированная соль. Это твердое кристаллическое вещество белого, бледно-розового или светло-серого цвета, обычно получаемое из морской воды или каменных отложений. Натуральная морская соль, помимо хлорида натрия, содержит жизненно важные микроэлементы. Пищевая каменная соль может быть слегка сероватой из-за содержания минералов.
Натуральная морская соль, помимо хлорида натрия, содержит жизненно важные микроэлементы. Пищевая каменная соль может быть слегка сероватой из-за содержания минералов.
Натрий и хлор, два компонента соли, необходимы для выживания всех живых существ, включая человека, но их не нужно употреблять в виде соли, поскольку они находятся вместе в очень концентрированной форме.Было обнаружено, что некоторые изолированные культуры, такие как яномами в Южной Америке, потребляют мало соли. [1] Соль участвует в регулировании содержания воды (баланса жидкости) в организме. Солевой аромат — один из основных вкусов. Тяга к соли может быть вызвана недостатком микроэлементов, а также недостатком самого хлорида натрия.
Чрезмерное потребление соли может увеличить риск проблем со здоровьем, включая высокое кровяное давление. При приготовлении пищи соль используется в качестве консерванта и приправы.
Рассол из соленой скважины доводят до чистой соли в Цзыгуне, КитайОпределение
Соль в химии определяется как продукт, образующийся в результате реакции нейтрализации кислот и оснований. Соли — это ионные соединения, состоящие из катионов (положительно заряженных ионов) и анионов (отрицательных ионов), поэтому продукт является электрически нейтральным (без чистого заряда). Эти составляющие ионы могут быть неорганическими, такими как хлорид (Cl — ), а также органическими, такими как ацетат (CH 3 COO — ) и одноатомными ионами, такими как фторид (F — ), а также многоатомными. ионы, такие как сульфат (SO 4 2-).
Соли — это ионные соединения, состоящие из катионов (положительно заряженных ионов) и анионов (отрицательных ионов), поэтому продукт является электрически нейтральным (без чистого заряда). Эти составляющие ионы могут быть неорганическими, такими как хлорид (Cl — ), а также органическими, такими как ацетат (CH 3 COO — ) и одноатомными ионами, такими как фторид (F — ), а также многоатомными. ионы, такие как сульфат (SO 4 2-).
Есть несколько разновидностей солей. Соли, которые производят ионы гидроксида при растворении в воде, — это основных солей и соли, которые производят ионы гидроксония в воде кислых солей. Нейтральные соли — это соли, которые не являются ни кислотными, ни основными солями. Цвиттерионы содержат анионный центр и катионный центр в одной и той же молекуле, но не считаются солями. Примеры включают аминокислоты, многие метаболиты, пептиды и белки.
Когда соли растворяются в воде, они называются электролитами и способны проводить электричество — свойство, присущее расплавленным солям. Смеси многих различных ионов в растворах — например, в цитоплазме клеток, в крови, моче, растительных соках и минеральных водах — обычно не образуют определенных солей после испарения воды. Поэтому их солесодержание дано для соответствующих ионов.
Смеси многих различных ионов в растворах — например, в цитоплазме клеток, в крови, моче, растительных соках и минеральных водах — обычно не образуют определенных солей после испарения воды. Поэтому их солесодержание дано для соответствующих ионов.
Внешний вид
Поваренная соль и перец горошком.Цвет
Соли могут быть прозрачными (хлорид натрия), непрозрачными и даже металлическими и блестящими (дисульфид железа). Во многих случаях кажущаяся непрозрачность или прозрачность связаны только с разницей в размерах отдельных монокристаллов.Поскольку свет отражается от фазовых границ, более крупные кристаллы имеют тенденцию быть прозрачными, в то время как поликристаллические агрегаты выглядят как белые порошки. Конечно, некоторые соли по своей природе непрозрачны.
Соли существуют в полном ассортименте различных цветов. Примеры:
желтый (хромат натрия),
апельсин (дихромат калия),
красный (сульфид ртути),
лиловый (гексагидрат хлорида кобальта),
синий (пентагидрат сульфата меди, гексацианоферрат железа),
зеленый (оксид никеля),
бесцветный (сульфат магния),
белый и
черный (диоксид марганца). Большинство минералов и неорганических пигментов, а также многие синтетические органические красители являются солями.
Большинство минералов и неорганических пигментов, а также многие синтетические органические красители являются солями.
Вкус
Различные соли могут вызывать все пять основных вкусов, например, соленый (хлорид натрия), сладкий (диацетат свинца; но при попадании внутрь вызывает отравление свинцом), кислый (битартрат калия), горький (сульфат магния) и умами или пикантный ( глутамат натрия).
Запах
Соли сильных кислот и сильных оснований («сильные соли») нелетучие и не имеют запаха, в то время как соли слабых кислот или слабых оснований («слабые соли») могут пахнуть после конъюгированной кислоты (напр.г. ацетаты, такие как уксусная кислота (уксус), и цианиды, такие как цианистый водород (миндаль), или сопряженное основание (например, соли аммония, такие как аммиак) составляющих ионов. Это медленное частичное разложение обычно ускоряется присутствием воды, поскольку гидролиз составляет другую половину обратимого уравнения реакции образования слабых солей.
Номенклатура
Химический состав морской солиНазвание соли начинается с названия катиона (например, натрия или аммония ), за которым следует название аниона (например, натрия или аммоний ).г., хлорид или ацетат ). Соли часто упоминаются только по названию катиона (например, натриевая соль или аммониевая соль ) или по имени аниона (например, хлорид или ацетат ).
Формация
Соли образуются в результате химической реакции между:
Соли также могут образовываться, если растворы различных солей смешиваются, их ионы рекомбинируют, а новая соль нерастворима и выпадает в осадок (см .: равновесие растворимости).
Солеобразующие ионы
Солеобразующие катионы обыкновенные включают:
Обычные солеобразующие анионы (и названия исходных кислот в скобках) включают:
История использования поваренной соли
Консервирующие свойства соли были основой цивилизации. Он устранял зависимость от сезонной доступности пищи, позволял путешествовать на большие расстояния и был жизненно важной пищевой добавкой. Однако, поскольку соль (NaCl) было трудно достать, на протяжении всей истории она стала очень ценным предметом торговли.До 1900-х годов соль была одним из главных двигателей национальной экономики и войн. Соль часто облагалась налогом; исследования показали, что такая практика существовала еще в году до н. э. двадцатого века. в Китае.
Он устранял зависимость от сезонной доступности пищи, позволял путешествовать на большие расстояния и был жизненно важной пищевой добавкой. Однако, поскольку соль (NaCl) было трудно достать, на протяжении всей истории она стала очень ценным предметом торговли.До 1900-х годов соль была одним из главных двигателей национальной экономики и войн. Соль часто облагалась налогом; исследования показали, что такая практика существовала еще в году до н. э. двадцатого века. в Китае.
Первые регистры использования соли были составлены около 4000 до н.э. в Египте, а затем в Греции и Риме. Соль была очень ценной и использовалась для консервирования и ароматизации продуктов. В Древнем Риме соль использовалась в качестве валюты. Латинское слово salarium , означающее оплату солью, является корнем слова «зарплата».«К несчастью для тех, кому платили солью, он был легко разрушен дождем и другими погодными условиями. Платежи римским рабочим и солдатам производились солью. [2]
[2]
Финикийцы датируют свидетельства сбора твердой соли из моря Они также экспортировали его другим цивилизациям. В результате увеличения поступления соли из моря стоимость соли обесценилась. Используемый метод сбора урожая заключался в затоплении равнин морской водой с последующим высыханием равнин. После того, как вода высохла , оставшаяся соль была собрана и продана.
В Малийской империи торговцы в Тимбукту XII века — воротах в пустыню Сахара и резиденции ученых — ценили соль (NaCl) настолько, чтобы покупать ее на вес золота; эта торговля привела к легендам о невероятно богатом городе Тимбукту и подпитывала инфляцию в Европе, которая импортировала соль. [3]
Во время протестов в Индии Мохандас Ганди совершил знаменитый соляной марш, чтобы бросить вызов британской монополии на соль.
В религии
У древних, как и у нас, «соль» (солнце) и «сал» (соль) считались необходимыми для поддержания жизни.
В Библии 35 упоминаний (стихов) о соли (версия короля Якова), наиболее известной из которых, вероятно, является история жены Лота, которая превратилась в соляной столб, когда она ослушалась ангелов и оглянулась на нечестивых.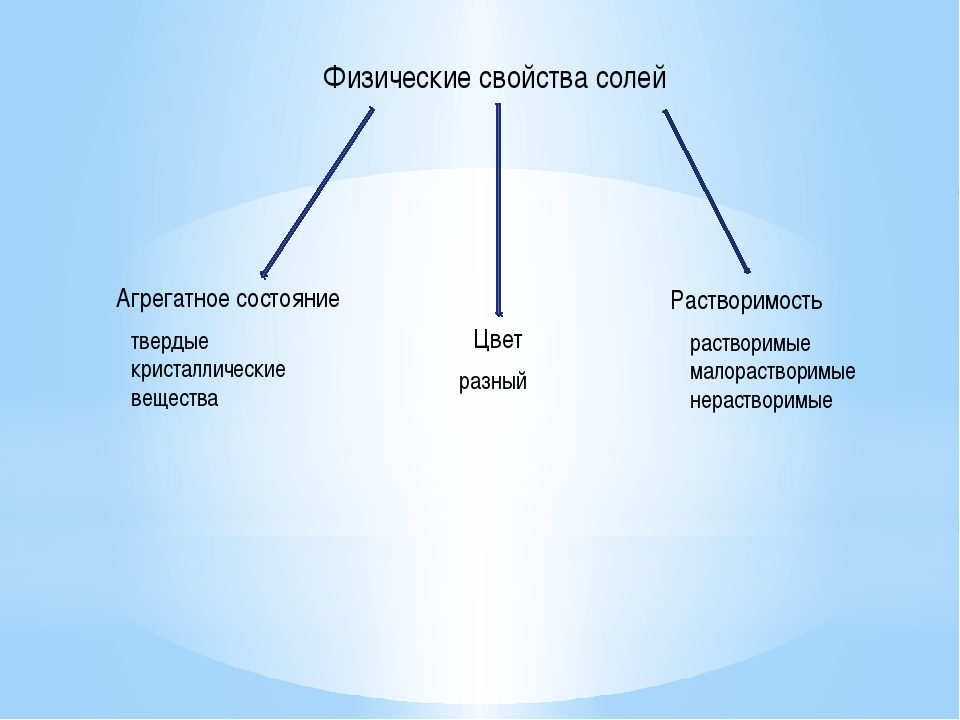 город Содом (Бытие 19:26). В Нагорной проповеди Иисус также назвал своих последователей «солью земли». Апостол Павел также призывал христиан «пусть ваш разговор всегда будет благодатным, приправленным солью» (Колоссянам 4: 6), чтобы, когда другие спрашивают об их верованиях, ответ христианина вызывает «жажду» узнать больше о Христе.Соль обязательна в обряде Тридентской мессы. Соль используется в третьем пункте (который включает в себя экзорцизм) кельтского освящения (см. Галликанский обряд), который применяется при освящении церкви. Соль можно добавлять в воду «там, где это принято» в римско-католическом обряде святой воды. Самое раннее библейское упоминание о соли, по-видимому, относится к разрушению Содома и Гоморры (Бытие, XIX, 24-26), когда царь Авимелех разрушил город Сихем, что, как считается, произошло в тринадцатом веке в году до нашей эры.В году н. Э. Он, как говорят, «посыпал его солью», и эта фраза выражает полноту его разорения. (Судьи ix. 45.)
город Содом (Бытие 19:26). В Нагорной проповеди Иисус также назвал своих последователей «солью земли». Апостол Павел также призывал христиан «пусть ваш разговор всегда будет благодатным, приправленным солью» (Колоссянам 4: 6), чтобы, когда другие спрашивают об их верованиях, ответ христианина вызывает «жажду» узнать больше о Христе.Соль обязательна в обряде Тридентской мессы. Соль используется в третьем пункте (который включает в себя экзорцизм) кельтского освящения (см. Галликанский обряд), который применяется при освящении церкви. Соль можно добавлять в воду «там, где это принято» в римско-католическом обряде святой воды. Самое раннее библейское упоминание о соли, по-видимому, относится к разрушению Содома и Гоморры (Бытие, XIX, 24-26), когда царь Авимелех разрушил город Сихем, что, как считается, произошло в тринадцатом веке в году до нашей эры.В году н. Э. Он, как говорят, «посыпал его солью», и эта фраза выражает полноту его разорения. (Судьи ix. 45.)
В исконной японской религии синто соль используется для ритуального очищения людей и мест, например, в борьбе сумо.
В ацтекской мифологии Хуикстоциуатль была богиней плодородия, правившей соленой и соленой водой.
Формы соли
Соль нерафинированная
Различные природные соли имеют разную минеральность, что придает каждой из них уникальный вкус.Fleur de sel, натуральная морская соль, собранная вручную, обладает уникальным вкусом, который варьируется от региона к региону.
Некоторые утверждают, что нерафинированная морская соль полезнее рафинированной. [4] Однако полностью сырая морская соль горькая из-за соединений магния и кальция, поэтому ее редко едят. Другие люди думают, что сырая морская и каменная соли не содержат достаточного количества солей йода для предотвращения йододефицитных заболеваний, таких как гипотиреоз. [5]
Соль рафинированная
Рафинированная соль, которая в настоящее время наиболее широко используется, в основном представляет собой хлорид натрия.Пищевая соль составляет лишь небольшую часть производства соли в промышленно развитых странах (3% в Европе [6] ), хотя во всем мире на пищевые продукты приходится 17,5% производства соли [7] . Большинство из них продается для промышленного использования, от производства целлюлозы и бумаги до окрашивания тканей и тканей, производства мыла и моющих средств, и имеет большую коммерческую ценность.
Большинство из них продается для промышленного использования, от производства целлюлозы и бумаги до окрашивания тканей и тканей, производства мыла и моющих средств, и имеет большую коммерческую ценность.
Производство и использование соли — одно из старейших предприятий химической промышленности. [8] Соль также получают путем испарения морской воды, обычно в неглубоких бассейнах, нагреваемых солнечным светом; [9] соль, полученная таким образом, раньше называлась заливной солью, а теперь ее часто называют морской солью или солнечной солью. Рафинированную соль также получают из каменной соли: минеральные отложения с высоким содержанием соли. Эти отложения каменной соли образовались в результате испарения древних соленых озер. [10] Эти месторождения можно добывать традиционным способом или путем закачки воды. Закачиваемая вода растворяет соль, и рассол можно перекачивать на поверхность, где собирается соль.
После получения сырой соли ее очищают и улучшают характеристики хранения и обращения с ней. Очистка обычно включает перекристаллизацию. При перекристаллизации рассол обрабатывают химическими веществами, которые осаждают большинство примесей (в основном соли магния и кальция). [11] Затем используются несколько стадий испарения для сбора чистых кристаллов хлорида натрия, которые сушат в печи.
С 1950-х годов в рассол обычно добавляли следы гексацианоферрата натрия II, который действует как антислеживающий агент, способствуя образованию кристаллов неправильной формы. [12] Другие агенты против слеживания (и йодид калия для йодированной соли) могут быть добавлены после кристаллизации. Эти вещества представляют собой гигроскопичные химические вещества, которые поглощают влагу, предотвращая слипание кристаллов соли. Некоторые используемые противослеживающие агенты представляют собой трикальцийфосфат, карбонаты кальция или магния, соли жирных кислот (кислые соли), оксид магния, диоксид кремния, силикат кальция, алюмосиликат натрия и силикат алюминия-кальция. Высказывались опасения относительно возможных токсических эффектов алюминия в последних двух соединениях, однако и Европейский Союз, и Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) разрешают их использование. [13] Очищенная соль готова для упаковки и распределения.
Высказывались опасения относительно возможных токсических эффектов алюминия в последних двух соединениях, однако и Европейский Союз, и Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) разрешают их использование. [13] Очищенная соль готова для упаковки и распределения.
Соль поваренная
Пакетики соли на одну порциюПоваренная соль — это очищенная соль, 99% хлорида натрия. [14] [15] Он обычно содержит вещества, придающие ему сыпучесть (антислеживатели), такие как силикоалюминат натрия или карбонат магния. Обычно в солонки кладут несколько зерен сырого риса, чтобы впитать лишнюю влагу, когда средств против слеживания недостаточно.
Соль йодированная
Йодированная соль (BrE: йодированная соль ), поваренная соль, смешанная с незначительным количеством йодида натрия, йодата или иногда йодида калия, используется для снижения вероятности дефицита йода у людей. Дефицит йода обычно приводит к проблемам со щитовидной железой, особенно к эндемическому зобу. Эндемический зоб — это заболевание, характеризующееся опухолью щитовидной железы, которая обычно приводит к выпячиванию на шее. Хотя для предотвращения зоба в диете требуется лишь небольшое количество йода, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США рекомендует (21 CFR 101.9 (c) (8) (iv)) 150 микрограммов йода в день как для мужчин, так и для женщин, и есть много мест по всему миру, где естественный уровень йода в почве низкий, а йод не усваивается овощами. .
Дефицит йода обычно приводит к проблемам со щитовидной железой, особенно к эндемическому зобу. Эндемический зоб — это заболевание, характеризующееся опухолью щитовидной железы, которая обычно приводит к выпячиванию на шее. Хотя для предотвращения зоба в диете требуется лишь небольшое количество йода, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США рекомендует (21 CFR 101.9 (c) (8) (iv)) 150 микрограммов йода в день как для мужчин, так и для женщин, и есть много мест по всему миру, где естественный уровень йода в почве низкий, а йод не усваивается овощами. .
Сегодня йодированная соль более распространена в США, Австралии и Новой Зеландии, чем в Великобритании.
Поваренная соль также часто йодируется — небольшое количество йодида калия (в США) или йодата калия (в ЕС) добавляется в качестве важной пищевой добавки. Поваренная соль в основном используется в кулинарии и в качестве столовой приправы.Йодированная поваренная соль значительно снизила уровень йодной недостаточности в странах, где она используется. [16] Йод важен для предотвращения недостаточной выработки гормонов щитовидной железы (гипотиреоз), которые могут вызывать зоб, кретинизм у детей и микседему у взрослых.
[16] Йод важен для предотвращения недостаточной выработки гормонов щитовидной железы (гипотиреоз), которые могут вызывать зоб, кретинизм у детей и микседему у взрослых.
Соль фторированная
В некоторых европейских странах, где фторирование питьевой воды не практикуется, доступна фторированная поваренная соль. Во Франции 35 процентов продаваемой поваренной соли содержат фторид натрия или калия. [17] Еще одна добавка, особенно важная для беременных, — фолиевая кислота (витамин B), придающая поваренной соли желтый цвет.
Приправы соленые
Во многих азиатских культурах поваренная соль традиционно не используется в качестве приправы. [18] Однако такие приправы, как соевый соус, рыбный соус и устричный соус, как правило, имеют высокое содержание соли и выполняют почти ту же роль, что и столовая приправа, обеспечивающая соль, которую поваренная соль служит в западных культурах.
Влияние потребления соли на здоровье
Натрий — один из основных электролитов в организме. Все три электролита (натрий, калий и кальций) доступны в виде нерафинированной соли, как и другие жизненно важные минералы, необходимые для оптимального функционирования организма. Слишком много или слишком мало соли в рационе может вызвать мышечные судороги, головокружение или даже нарушение электролитного баланса, что может вызвать серьезные, даже фатальные, неврологические проблемы. [19] Употребление слишком большого количества воды с недостаточным потреблением соли подвергает человека риску отравления водой. Соль даже иногда используется как лечебное средство, например, при лечении дизавтономии. [20]
Все три электролита (натрий, калий и кальций) доступны в виде нерафинированной соли, как и другие жизненно важные минералы, необходимые для оптимального функционирования организма. Слишком много или слишком мало соли в рационе может вызвать мышечные судороги, головокружение или даже нарушение электролитного баланса, что может вызвать серьезные, даже фатальные, неврологические проблемы. [19] Употребление слишком большого количества воды с недостаточным потреблением соли подвергает человека риску отравления водой. Соль даже иногда используется как лечебное средство, например, при лечении дизавтономии. [20]
Риск людей заболеть из-за слишком низкого или слишком высокого потребления соли варьируется в зависимости от биохимической индивидуальности. Некоторые утверждали, что, хотя риски употребления слишком большого количества соли реальны, риски для большинства людей преувеличены или что исследования, проведенные по потреблению соли, можно интерпретировать по-разному. [21] [22]
[21] [22]
Избыточное потребление соли связано с:
- астма, вызванная физической нагрузкой. [23] С другой стороны, другой источник возражает: «… мы до сих пор не знаем, способствует ли соль развитию астмы. Если есть связь, значит, она очень слабая…». [24]
- изжога [25] .
- Остеопороз: один отчет показывает, что диета с высоким содержанием соли действительно снижает плотность костей у девочек. [26] . Тем не менее, «несмотря на то, что высокое потребление соли было связано с пагубным воздействием на здоровье костей, данных для окончательных выводов недостаточно». ( [27] , p3)
- Рак желудка (рак желудка) связан с высоким уровнем натрия, «но доказательства, как правило, не относятся к продуктам, обычно потребляемым в Великобритании.»( [28] ) Однако в Японии потребление соли выше. [29]
- гипертония (высокое кровяное давление): «С 1994 года данные о связи между потреблением соли с пищей и кровяным давлением увеличились.
 Данные были согласованы в различных исследуемых популяциях и во всем возрастном диапазоне взрослых». ( [30] ). «Главный медицинский директор Англии в своем Годовом отчете (DH, 2001) подчеркнул, что у людей с высоким артериальным давлением вероятность развития сердечных заболеваний и инсульта в три раза выше, а вероятность смерти от этих заболеваний в два раза выше, чем у людей. с нормальным уровнем.»( [31] ). Одно исследование показало, что низкий уровень натрия в моче связан с более высоким риском инфаркта миокарда у леченных гипертоников [32] .
Данные были согласованы в различных исследуемых популяциях и во всем возрастном диапазоне взрослых». ( [30] ). «Главный медицинский директор Англии в своем Годовом отчете (DH, 2001) подчеркнул, что у людей с высоким артериальным давлением вероятность развития сердечных заболеваний и инсульта в три раза выше, а вероятность смерти от этих заболеваний в два раза выше, чем у людей. с нормальным уровнем.»( [31] ). Одно исследование показало, что низкий уровень натрия в моче связан с более высоким риском инфаркта миокарда у леченных гипертоников [32] . - гипертрофия левого желудочка (увеличение сердца): «Данные свидетельствуют о том, что высокое потребление соли вызывает гипертрофию левого желудочка, сильный фактор риска сердечно-сосудистых заболеваний, независимо от влияния артериального давления». ( [33] ) «… накапливаются доказательства того, что высокое потребление соли предсказывает гипертрофию левого желудочка.»( [34] ) Чрезмерное потребление соли (натрия) в сочетании с недостаточным потреблением воды может вызвать гипернатриемию.
 Это может усугубить заболевание почек. [35]
Это может усугубить заболевание почек. [35] - отек (BE: отек): было предложено уменьшить потребление соли для лечения отеков (BE: отек) (задержка жидкости). [36]
- язвы двенадцатиперстной кишки и желудка [37]
Крупномасштабное исследование, проведенное Нэнси Кук и соавт. показывает, что у людей с высоким / нормальным [38] артериальным давлением, которые значительно снизили количество соли в своем рационе, уменьшили свои шансы на развитие сердечно-сосудистых заболеваний на 25 процентов в течение следующих 10-15 лет.Их риск умереть от сердечно-сосудистых заболеваний снизился на 20 процентов. [39] [40]
Рекомендуемая доза
Морская соль и перец горошком. Соляная мельница для морской соли. В этом разделе кратко изложено потребление соли, рекомендованное учреждениями здравоохранения различных стран. Рекомендации обычно похожи. Обратите внимание, что цели для населения в целом имеют тенденцию быть прагматичными (что достижимо), в то время как рекомендации для отдельного человека идеальны (что лучше для здоровья). Например, в Великобритании цель для населения — «съедать не более 6 г в день», а для человека — 4 г.
Например, в Великобритании цель для населения — «съедать не более 6 г в день», а для человека — 4 г.
Потребление может быть выражено по-разному в виде соли или натрия и в различных единицах.
- 1 г натрия = 1000 мг натрия = 42 ммоль натрия = 2,5 г соли
Соединенное Королевство : В 2003 году Научный консультативный комитет Великобритании по питанию (SACN) рекомендовал для типичного взрослого человека потребление эталонных питательных веществ. составляет 4 г соли в день (1,6 г или 70 ммоль натрия).Однако среднее потребление натрия взрослым в два с половиной раза превышает референсное потребление натрия. «Хотя точных данных о детях нет, консервативные оценки показывают, что в пересчете на массу тела среднее потребление соли детьми выше, чем у взрослых». SACN нацелен на достижимое целевое снижение среднего потребления соли до 6 г в день (2,4 г или 100 ммоль натрия) — это примерно эквивалентно чайной ложке соли. Рекомендации SACN для детей:
- 0–6 месяцев: менее 1 г / день
- 7–12 месяцев: 1 г / день
- 1-3 года: 2 г / день
- 4–6 лет: 3 г / день
- 7–10 лет: 5 г / день
- 11–14 лет: 6 г / день
SACN заявляет: «Целевое потребление соли, установленное для взрослых и детей, не представляет собой идеальный или оптимальный уровень потребления, а представляет собой достижимые цели для населения. « [41]
« [41]
Республика Ирландия : Управление по безопасности пищевых продуктов Ирландии поддерживает цели Соединенного Королевства», подчеркивая, что рекомендуемая суточная норма 1,6 г натрия (4 г соли) должна лечь в основу рекомендаций, ориентированных на отдельных лиц. отличается от целевого показателя здоровья населения, предполагающего среднее потребление соли 6 г в день »( [42] )
Канада : Министерство здравоохранения Канады рекомендует адекватное потребление (AI) и верхний предел (UL) с точки зрения натрия .
- 0–6 месяцев: 0.12 г / день (AI)
- 7–12 месяцев: 0,37 г / день (AI)
- 1-3 года: 1 г / день (AI) 1,5 г / день (UL)
- 4–8 лет: 1,2 / день (AI) 1,9 г / день (UL)
- 9–13 лет: 1,5 г / день (AI) 2,2 г / день (UL)
- 14–50 лет: 1,5 г / день (AI) 2,3 г / день (UL)
- 51–70 лет: 1,3 г / день (AI) 2,3 г / день (UL)
- 70 лет и старше: 1,2 г / день (AI) 2,3 г / день (UL) [43]
Новая Зеландия
- Достаточное потребление (AI) 0.
 46 — 0,92 г натрия = 1,2 — 2,3 г соли
46 — 0,92 г натрия = 1,2 — 2,3 г соли - Верхний предел (UL)) 2,3 г натрия = 5,8 г соли
Австралия : Рекомендуемая доза с пищей (RDI) составляет 0,92–2,3 г натрия в день (= 2,3–5,8 г соли) [44]
США : Управление по санитарному надзору за качеством пищевых продуктов и медикаментов само по себе не дает рекомендации [45] , но отсылает читателей к Диетические рекомендации для американцев 2005 . Они предполагают, что граждане США должны потреблять менее 2300 мг натрия (= 2.3 г натрия = 5,8 г соли) в сутки. [46]
Этикетка
Великобритания: Агентство по пищевым стандартам определяет уровень соли в пищевых продуктах следующим образом: «Высокий — более 1,5 г соли на 100 г (или 0,6 г натрия). Низкий — 0,3 г соли или менее на 100 г (или 0,1 г натрия). Если количество соли на 100 г находится между этими цифрами, значит, это средний уровень соли ». В Великобритании продукты питания, производимые некоторыми супермаркетами и производителями, имеют на передней части упаковки цвета «светофора»: красный (высокий), янтарный (средний) или зеленый (низкий). [47]
[47]
США: Руководство по маркировке пищевых продуктов FDA определяет, может ли продукт быть помечен как «свободный», «с низким содержанием» или «с пониженным / меньшим содержанием натрия». Когда о продукте питания делаются другие заявления о пользе для здоровья (например, с низким содержанием жира, калорий и т. Д.), Требуется заявление о раскрытии информации, если в продукте содержится более 480 мг натрия на «порцию». [48]
Кампании
В 2004 году Британское агентство по стандартам на пищевые продукты начало кампанию в области общественного здравоохранения под названием «Соль — следите за ней», которая рекомендует употреблять не более 6 г соли в день; В нем присутствует персонаж по имени Сид Слизень, который подвергся критике со стороны Ассоциации производителей соли (SMA). [49] Управление по стандартам рекламы не поддержало жалобу SMA в своем решении. [50] .
Исследовательский институт Мензиса в Тасмании, Австралия, поддерживает веб-сайт [51] , посвященный информированию людей о потенциальных проблемах соленой диеты.
Заменители соли
Потребление соли можно уменьшить, просто уменьшив количество соленой пищи в рационе, не прибегая к заменителям соли. Заменители соли имеют вкус поваренной соли и содержат в основном хлорид калия, который увеличивает потребление калия.Избыточное потребление калия может вызвать гиперкалиемию. Различные заболевания и лекарства могут снизить выведение калия из организма, тем самым увеличивая риск гиперкалиемии. Если у вас почечная недостаточность, сердечная недостаточность или диабет, обратитесь за медицинской помощью, прежде чем использовать заменитель соли. Производитель LoSalt выпустил консультативное заявление [52] о том, что люди, принимающие следующие рецептурные препараты, не должны использовать заменители соли: амилорид, триамтерен, Dytac, спиронолактон, альдактон, эплеренон и Inspra.
Тенденции производства
Соль получают путем испарения морской воды или рассола из других источников, таких как рассольные скважины и соленые озера, а также путем добычи каменной соли , называемой галитом.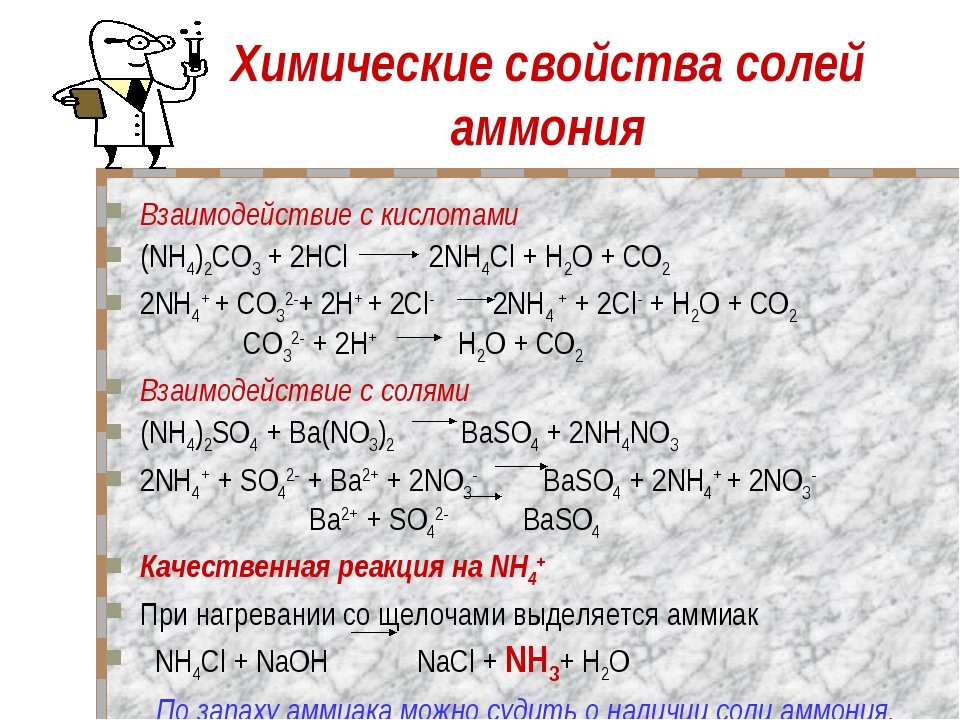 В 2002 году общее мировое производство оценивалось в 210 миллионов метрических тонн, в первую пятерку производителей входили США (40,3 миллиона метрических тонн), Китай (32,9), Германия (17,7), Индия (14,5) и Канада (12,3). . [53] Обратите внимание, что эти цифры относятся не только к поваренной соли, но и к хлориду натрия в целом.
В 2002 году общее мировое производство оценивалось в 210 миллионов метрических тонн, в первую пятерку производителей входили США (40,3 миллиона метрических тонн), Китай (32,9), Германия (17,7), Индия (14,5) и Канада (12,3). . [53] Обратите внимание, что эти цифры относятся не только к поваренной соли, но и к хлориду натрия в целом.
См. Также
Судно загружает соль с терминала.- Электролит
- Галогенид
- Натрия хлорид
- Соль морская
- История соли
- Fleur de sel
- Консервирование (консервирование)
- Кислотная соль
- Щелочные соли
- Соль пищевая
- Ионные связи
- Кошерная соль
- Натрон
- Старый соляной путь
- Соль дорожная
- Засоление земли — это преднамеренное массовое использование соли для того, чтобы сделать почву непригодной для возделывания и, таким образом, препятствовать заселению.
- Натрий
- Соль поваренная
- Цвиттерион
- Соленость
- гипертония
Примечания
- ↑ Индейцы яномами в исследовании INTERSALT.
 Проверено 28 июля 2007 года.
Проверено 28 июля 2007 года. - ↑ Дэвид Блох, Экономика NaCl: Соль заставила мир вращаться. www.salt.org . Проверено 28 июля 2007 года.
- ↑ Дженис Макдональд. Совершите путешествие в Тимбукту. Новости CNN. Проверено 28 июля 2007 г.
- ↑ Сьюзан Диринг.Морская соль полезна и производится в Колиме! Проверено 28 июля 2007 года.
- ↑ Йод в не йодированной морской соли. Институт соли . Проверено 28 июля 2007 года.
- ↑ Соль и ее применение. Европейская ассоциация производителей соли . Проверено 28 июля 2007 года.
- ↑ Производство соли в Азии быстро увеличивалось с 2003 года. Roskill Information Services . Проверено 28 июля 2007 года.
- ↑ Археология Salt.org . Проверено 28 июля 2007 года.
- ↑ ЗАДАНИЕ ТРЕТЬЕ — ВОДНЫЙ ЦИКЛ Nauticus — Weather Curriculum . Проверено 28 июля 2007 года.
- ↑ Что такое соль ?. Ассоциация производителей соли Великобритании .
 Проверено 28 июля 2007 года.
Проверено 28 июля 2007 года. - ↑ О соли: Производство. Ассоциация производителей соли . Проверено 30 июля 2007 года.
- ↑ Соль и химическая революция: 8 Производство соли в 20 веке. Ассоциация производителей соли . Проверено 30 июля 2007 года.
- ↑ Дэниэлс Берджесс, Вилелла Дэниэлс и Мейсон, Эйприл С. Какие химические вещества содержатся в моей пище? Университет Пердью, Кооперативная служба распространения знаний . Проверено 30 июля 2007 года.
- ↑ Анализ питания столовой соли Tesco от Tesco Stores Ltd (Великобритания) показывает 38,9% натрия по весу, что соответствует 98,9% хлорида натрия.
- ↑ Солевые продукты — Столовая соль. ВА Соль . Проверено 30 июля 2007 года.
- ↑ Йодированная соль Институт соли .Проверено 30 июля 2007 года.
- ↑ [1] Оценка рисков для здоровья от несоблюдения параметров питьевой воды ценности. AFSSA . Проверено 30 июля 2007 года.
- ↑ Мэтью Амстер-Бертон.
 2001. Соль Юго-Восточной Азии. Сиэтл Таймс . Проверено 30 июля 2007 года.
2001. Соль Юго-Восточной Азии. Сиэтл Таймс . Проверено 30 июля 2007 года. - ↑ Соль. Австралия: канал «Лучшее здоровье» (Австралия, Виктория) . Проверено 30 июля 2007 года.
- ↑ Dysautonomia. Медицинский информационный центр клиники Кливленда .Проверено 30 июля 2007 года.
- ↑ Соль и другие раны. Почему файлы, статья . Проверено 30 июля 2007 года.
- ↑ Гэри Таубс. 1998. (Политическая) наука о соли, Science 281 (14 августа 1998 г.) (5379): 898 — 907. Проверено 30 июля 2007 г.
- ↑ Трейси Джеймс. 2003. Астма, вызванная физическими упражнениями, более четко связана с диетой с высоким содержанием соли. Домашние страницы IU . Проверено 30 июля 2007 года.
- ↑ Д-р Триша Макнейр, «Ухудшает ли употребление соли астму?» Би-би-си .Проверено 30 июля 2007 года.
- ↑ Исследование добавляет соли к подозреваемым триггерам изжоги Все . Проверено 30 июля 2007 года.
- ↑ Высокосолевая диета снижает плотность костей у девочек.
 Пищевой навигатор . Проверено 30 июля 2007 года.
Пищевой навигатор . Проверено 30 июля 2007 года. - ↑ Соль и здоровье. Научно-консультативный комитет по питанию (SACN) . Проверено 30 июля 2007 года.
- ↑ Там же, 18
- ↑ Соль повышает «риск рака желудка». BBC News . Проверено 30 июля 2007 года.
- ↑ САКН, 3
- ↑ Там же, 14
- ↑ Майкл Х. Олдерман, Шанта Мадхаван, Хиллел Коэн, Жан Э. Сили и Джон Х. Лараг, 1992. Низкий уровень натрия в моче ассоциируется с повышенным риском инфаркта миокарда у леченных гипертоников Гипертония 25 (1995): 1144 -1152. Проверено 30 июля 2007 года.
- ↑ SACN 3
- ↑ Соль и здоровье: Обзор научных данных и рекомендаций по государственной политике в Ирландии Управление по безопасности пищевых продуктов Ирландии .Проверено 30 июля 2007 года.
- ↑ унция
- ↑ Задержка жидкости Австралия: Better Health Channel (Австралия, Виктория) . Проверено 30 июля 2007 года.
- ↑ Связь высокосолевой диеты с риском развития язвы.
 BBC . Проверено 30 июля 2007 года.
BBC . Проверено 30 июля 2007 года. - ↑ [http://www.vaughns-1-pagers.com/medicine/blood-pressure.htm Таблица артериального давления ]. Вонз . Проверено 30 июля 2007 года.
- ↑ Режущая соль «снижает риск сердечного приступа». BBC News . Проверено 30 июля 2007 года.
- ↑ Употребление меньшего количества соли может предотвратить сердечно-сосудистые заболевания Eurikalert . Проверено 30 июля 2007 года.
- ↑ SACN
- ↑ фсай, 16
- ↑ Рекомендуемая диета (ищите натрий) Health Canada . Проверено 2 августа 2007 года.
- ↑ Salt Better Health Channel (Австралия, Виктория) . Проверено 2 августа 2007 года.
- ↑ Немного споров вызывает диетическую соль Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США .Проверено 2 августа 2007 года.
- ↑ «Натрий и калий» Министерство здравоохранения и социальных служб (HHS) и Министерство сельского хозяйства (USDA) .
 Проверено 2 августа 2007 года.
Проверено 2 августа 2007 года. - ↑ Что такое этикетки Агентство по пищевым стандартам . Проверено 2 августа 2007 года.
- ↑ Руководство по маркировке пищевых продуктов — Приложение A Управление по санитарному надзору за качеством пищевых продуктов и медикаментов . Проверено 2 августа 2007 года.
- ↑ Новая соляная кампания подверглась нападению Пресс-релиз ассоциации производителей соли .Проверено 2 августа 2007 года.
- ↑ Постановления о трансляции рекламы: 20 апреля 2005 г. Управление по стандартам в области рекламы . Проверено 2 августа 2007 года.
- ↑ Salt Matters Исследовательский институт Мензиса . Проверено 2 августа 2007 года.
- ↑ Информационное сообщение LoSalt . Проверено 2 августа 2007 года.
- ↑ Сьюзен Р. Фельдман. Натрия хлорид. John Wiley & Sons, Inc. Опубликовано в Интернете 2005 . Хлорид натрия Энциклопедия химической технологии Кирка-Отмера .
 Проверено 2 августа 2007 года.
Проверено 2 августа 2007 года.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Курланский, Марк. 2002. Соль: Всемирная история. Нью-Йорк, Нью-Йорк: Издательская компания Уолкер. ISBN 0142001619.
- __________. и С. Д. Шиндлер. 2006. История соли. Нью-Йорк, Нью-Йорк: G.P. Сыновья Патнэма. ISBN 0399239987 — детская книга о соли.
- Ласло, Пьер. 2002. Соль: Зерно жизни. Искусство и традиции стола. Нью-Йорк, Нью-Йорк: издательство Колумбийского университета, 2001. ISBN 0060084685.
- Великобритания: Министерство здравоохранения, Диетические справочные значения пищевой энергии и питательных веществ для Великобритании: Отчет Группы по DRV Комитета по медицинским аспектам пищевой политики. Канцелярия.
Внешние ссылки
Все ссылки получены 31 августа 2019 г.
кредитов
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в энциклопедию Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Странная наука: соль необходима для жизни
Поваренная соль хлорид натрия (NaCl) — это природный минерал, необходимый для жизни животных. Соль — одна из наиболее широко используемых и старых форм пищевой приправы (SF Рис. 2.2). Соленость — это один из пяти основных человеческих вкусов в дополнение к сладости, кислинке, горечи и умами (пикантный, мясной вкус, например, приготовленных грибов, сыра или соевого соуса). Когда соль растворяется в растворе или в пище, она распадается на составляющие ионы: натрий и хлорид (Na + и Cl — соответственно).Соленый вкус в первую очередь обусловлен ионами натрия.
2.2). Соленость — это один из пяти основных человеческих вкусов в дополнение к сладости, кислинке, горечи и умами (пикантный, мясной вкус, например, приготовленных грибов, сыра или соевого соуса). Когда соль растворяется в растворе или в пище, она распадается на составляющие ионы: натрий и хлорид (Na + и Cl — соответственно).Соленый вкус в первую очередь обусловлен ионами натрия.
Соль играет решающую роль в поддержании здоровья человека. Это основной источник ионов натрия и хлора в рационе человека. Натрий необходим для работы нервов и мышц и участвует в регулировании жидкости в организме. Натрий также играет роль в контроле тела за кровяным давлением и объемом. Хотя натрий важен, люди, потребляющие слишком много натрия, могут иметь гипертонию или высокое кровяное давление, состояние, которое может привести к серьезным заболеваниям, таким как болезни сердца, болезни почек и инсульт.
Хлорид-ионы служат важными электролитами, регулируя pH и давление крови. Электролиты — это соединения, часто соли, которые диссоциируют на свои ионные компоненты в растворителях, таких как вода. Хлорид также является важным компонентом в производстве желудочного сока (HCl). Люди выделяют соль при потоотделении и должны восполнять эти потерянные ионы натрия и хлора с помощью своего рациона.
Электролиты — это соединения, часто соли, которые диссоциируют на свои ионные компоненты в растворителях, таких как вода. Хлорид также является важным компонентом в производстве желудочного сока (HCl). Люди выделяют соль при потоотделении и должны восполнять эти потерянные ионы натрия и хлора с помощью своего рациона.
Всем животным для выживания требуется немного соли. Люди потребляют продукты, которые содержат соль (например,г., мясо и морепродукты) или добавьте соль в качестве приправы. Однако у некоторых наземных животных недостаток соли в рационе. Эти животные должны искать дополнительные источники соли. Сельскохозяйственным животным, таким как лошади и крупный рогатый скот, требуется доступ к соляным блокам (SF Рис. 2.3 A). Известно, что дикие млекопитающие и птицы собираются в естественных месторождениях полезных ископаемых, известных как солонцы, где они могут проглотить необходимые им для выживания натриевые и хлоридные минералы (SF, рис. 2.3 B).
.

 ФИЗИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА
ФИЗИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА Температура плавления воды равна 0° С (по шкале Цельсия) или 32° F (по шкале Фаренгейта). Поскольку при плавлении объем тела меняется незначительно, давление мало влияет на температуру плавления. Однако именно под действием высокого давления, оказываемого полозом конька, лед расплавляется, и спортсмен легко скользит по нему. Температура кипения — это температура, при которой жидкость превращается в пар (газ). Она зависит от давления, поэтому в горах вода кипит при более низкой температуре, чем на уровне моря. Температура кипения воды при давлении 760 мм рт. ст. («стандартном» давлении, примерно равном давлению на уровне моря) составляет 100° С (или 212° F).
Температура плавления воды равна 0° С (по шкале Цельсия) или 32° F (по шкале Фаренгейта). Поскольку при плавлении объем тела меняется незначительно, давление мало влияет на температуру плавления. Однако именно под действием высокого давления, оказываемого полозом конька, лед расплавляется, и спортсмен легко скользит по нему. Температура кипения — это температура, при которой жидкость превращается в пар (газ). Она зависит от давления, поэтому в горах вода кипит при более низкой температуре, чем на уровне моря. Температура кипения воды при давлении 760 мм рт. ст. («стандартном» давлении, примерно равном давлению на уровне моря) составляет 100° С (или 212° F). Напротив, молекулы (или ионы) кристаллических веществ расположены строго упорядоченно. К кристаллическим веществам относятся песок, поваренная соль, сахар, алмаз, графит и т.п. Все они плавятся при определенной температуре (если только при нагревании не претерпевают никаких химических изменений, как это случается с сахаром). Многие ионные соединения (например, поваренная соль NaCl) образуют кристаллы, в которых каждый ион окружен противоположно заряженными ионами; в результате нельзя сказать, что какая-то конкретная пара ионов образует молекулу. Вследствие взаимного притяжения ионов в кристалле поваренной соли (NaCl) это вещество плавится при высокой температуре (801° С). Каждый ион NaCl окружен шестью ближайшими соседями, имеющими противоположный заряд. Элементарная ячейка кристалла поваренной соли — это куб, у которого по углам и в центре каждой грани расположены ионы натрия. Ячейка такого типа называется гранецентрированной кубической. Кубическую форму имеют и крупные кристаллы поваренной соли.
Напротив, молекулы (или ионы) кристаллических веществ расположены строго упорядоченно. К кристаллическим веществам относятся песок, поваренная соль, сахар, алмаз, графит и т.п. Все они плавятся при определенной температуре (если только при нагревании не претерпевают никаких химических изменений, как это случается с сахаром). Многие ионные соединения (например, поваренная соль NaCl) образуют кристаллы, в которых каждый ион окружен противоположно заряженными ионами; в результате нельзя сказать, что какая-то конкретная пара ионов образует молекулу. Вследствие взаимного притяжения ионов в кристалле поваренной соли (NaCl) это вещество плавится при высокой температуре (801° С). Каждый ион NaCl окружен шестью ближайшими соседями, имеющими противоположный заряд. Элементарная ячейка кристалла поваренной соли — это куб, у которого по углам и в центре каждой грани расположены ионы натрия. Ячейка такого типа называется гранецентрированной кубической. Кубическую форму имеют и крупные кристаллы поваренной соли.


 Она изучает, из каких веществ состоит тот или иной предмет; почему и как ржавеет железо, и почему олово не ржавеет; что происходит с пищей… … Энциклопедия Кольера
Она изучает, из каких веществ состоит тот или иной предмет; почему и как ржавеет железо, и почему олово не ржавеет; что происходит с пищей… … Энциклопедия Кольера Молекула)), их превращения и… … Большая советская энциклопедия
Молекула)), их превращения и… … Большая советская энциклопедия В коллоидных системах … Энциклопедия Кольера
В коллоидных системах … Энциклопедия Кольера … Подробнее Купить за 124 грн (только Украина)
… Подробнее Купить за 124 грн (только Украина)
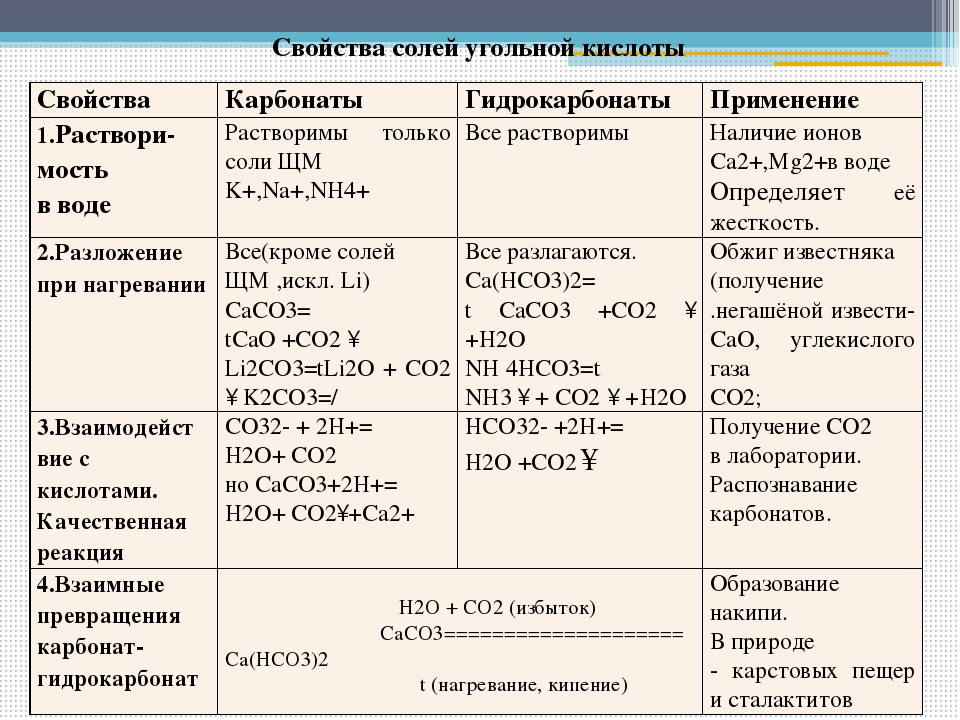 Данные были согласованы в различных исследуемых популяциях и во всем возрастном диапазоне взрослых». ( [30] ). «Главный медицинский директор Англии в своем Годовом отчете (DH, 2001) подчеркнул, что у людей с высоким артериальным давлением вероятность развития сердечных заболеваний и инсульта в три раза выше, а вероятность смерти от этих заболеваний в два раза выше, чем у людей. с нормальным уровнем.»( [31] ). Одно исследование показало, что низкий уровень натрия в моче связан с более высоким риском инфаркта миокарда у леченных гипертоников [32] .
Данные были согласованы в различных исследуемых популяциях и во всем возрастном диапазоне взрослых». ( [30] ). «Главный медицинский директор Англии в своем Годовом отчете (DH, 2001) подчеркнул, что у людей с высоким артериальным давлением вероятность развития сердечных заболеваний и инсульта в три раза выше, а вероятность смерти от этих заболеваний в два раза выше, чем у людей. с нормальным уровнем.»( [31] ). Одно исследование показало, что низкий уровень натрия в моче связан с более высоким риском инфаркта миокарда у леченных гипертоников [32] . Это может усугубить заболевание почек. [35]
Это может усугубить заболевание почек. [35]  46 — 0,92 г натрия = 1,2 — 2,3 г соли
46 — 0,92 г натрия = 1,2 — 2,3 г соли Проверено 28 июля 2007 года.
Проверено 28 июля 2007 года. Проверено 28 июля 2007 года.
Проверено 28 июля 2007 года. 2001. Соль Юго-Восточной Азии. Сиэтл Таймс . Проверено 30 июля 2007 года.
2001. Соль Юго-Восточной Азии. Сиэтл Таймс . Проверено 30 июля 2007 года. Пищевой навигатор . Проверено 30 июля 2007 года.
Пищевой навигатор . Проверено 30 июля 2007 года. BBC . Проверено 30 июля 2007 года.
BBC . Проверено 30 июля 2007 года. Проверено 2 августа 2007 года.
Проверено 2 августа 2007 года. Проверено 2 августа 2007 года.
Проверено 2 августа 2007 года.