Реакция кислоты с солью происходит если.mp4
Здравствуйте, мои Дорогие!!!!
Реакция кислоты с солью происходит если…
Одна из тем, из главной темы «Определение возможности осуществления химических реакций».Урок – 7
Правило 9
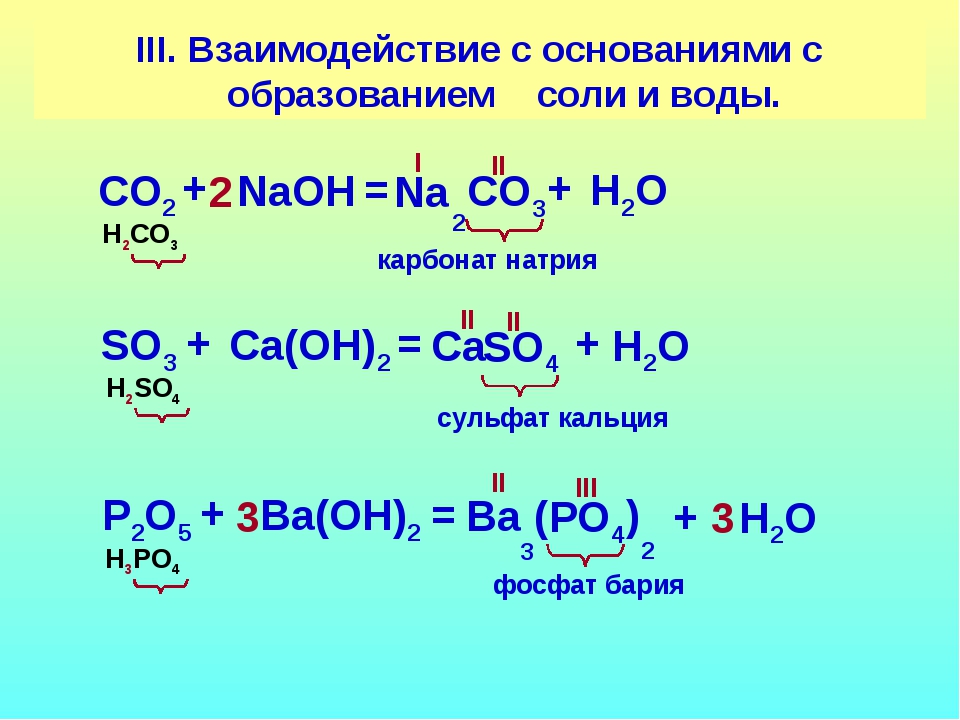
Реакция кислоты с солью происходит, если исходная кислота растворима, а один из продуктов — слабый электролит, при условии, что реагирующая кислота расположена в ряду вытеснения кислот левее кислоты, которой образована соль:
Ряд активности кислот
HNO3
H2SO4 HCL H2SO3 H2CO3 CH3COOH H2S H2SiO3
Каждая последующая кислота вытесняет предыдущую из её солей
Сила кислот уменьшается, гидролиз средних солей по аниону усиливается
Исключения
Существуют химические реакции, которые не подчиняются этому общему правилу.
1. Исключения из правила. Кислоты H3PO4,HCL и HNO3 (стоят в ряду кислот вместе) вытесняют друг друга из растворимых солей только в тех случаях, когда образуется слабый электролит.
2. . Исключения из правила. Сероводородная кислота реагирует с солями
кислот, стоящих левее в ряду активности металлов, если соли образованы
металлами: Cu, Pb, Hg, Ag, так как сульфиды этих
металлов не реагируют с растворами кислот.
Если металл другой, то реакция не пойдет, так как сульфиды других металлов реагируют с растворами кислот, например:
З. . Исключения из правила. Соляная кислота вытесняет серную кислоту только из сульфата серебра, так как при этом образуется менее растворимый (чем ) хлорид серебраРассмотрим задания Задание 21
1. Определите можно ли провести реакцию между веществами, формулы которых: Na2S и HCL
2.Вспомните условия, при котором возможна реакция соли с кислотой
Кислота + соль → новая соль + новая кислота
Кислота растворима Хотя бы один из продуктов слабый электролит
Na2S +
Растворима растворима Слабый электролит
4. Вспомните ряд вытеснения кислот и сравните исходную кислоту с кислотой, которой образована соль.
Ряд активности кислот
HNO3
H2SO4 HCL H2SO3 H2CO3 H2S H2SiO3
H3PO4
Сила кислот уменьшается с лева на право, гидролиз средних солей по аниону усиливается
Каждая последующая кислота вытесняет предыдущую из её солей
Посмотрите исключения из правил (выше по тексту)
6. Сделайте вывод о возможности проведения реакции.
Реакция между веществами, формула которых:
Na2S и HCL осуществима, так как выполняются все условия. Данная реакция не относится к исключениям из правил
Данная реакция не относится к исключениям из правил Задание 21
1. Определите можно ли провести реакцию между веществами, формулы которых: Na2SO4 + H3PO4 →
2.Вспомните условия, при котором возможна реакция соли с кислотой
Кислота + соль → новая соль + новая кислота.
Кислота растворима Хотя бы один из продуктов слабый электролит
Na2SO4 + H3PO4 → Na3PO4 + H2SO4
растворима растворима растворима растворима
Сильные электролиты
реакция не протекает
Смотрите таблицу растворимости (выше по тексту)
Вывод: Ряд вытеснения смотреть не требуется, так как в этом случае образуются сильные электролиты, значит, вывод можно сделать сразу: реакция не идёт (не выполняется одно из условий).
Задание 23
- Определите можно ли провести реакцию между веществами, формулы которых: CuSO4 и H2S
- Вспомните условия, при котором возможна реакция соли с кислотой
Кислота + соль → новая соль + новая кислота.
Кислота растворима Хотя бы один из продуктов слабый электролит
3. Определите растворимость исходной кислоты по таблице растворимости
CuSO4 + H2S → CuS + H2SO4
Растворима Нерастворима, Сильный электролит
слабый электролит
4. Вспомните ряд вытеснения кислот и сравните исходную
кислоту с кислотой, которой образована соль.
Вспомните ряд вытеснения кислот и сравните исходную
кислоту с кислотой, которой образована соль.
Ряд активности кислот
HNO3
H2SO4 HCL H2SO3 H2CO3 H2S H2SiO3
H3PO
Сила кислот уменьшается с лева на право, гидролиз средних солей по аниону усиливается
Каждая последующая кислота вытесняет предыдущую из её солей
H2S Стоит правее H2SO4, поэтому не должна вытеснять её из соли.
Посмотрите исключения из правил (выше по тексту)
Донная реакция: CuSO4 + H2S относится к исключениям из правил.
6. Сделайте вывод о возможности проведения реакции.
Реакция между веществами, формулы которых CuSO4 и H2S осуществима, так как образуется соль CuS – более слабый электролит, чем H2S
Литература: Химия. Гимназия на дому. А.Е.Савельев
Свойства солей
Соли
— это сложные вещества, состоящие из одного (нескольких) атомов металла (или более сложных катионных групп, например, аммонийных групп NН4+, гидроксилированных групп Ме(ОН)nm+) и одного (нескольких) кислотных остатков. Общая формула солей МеnАm, где А — кислотный остаток. Соли (с точки зрения электролитической диссоциации) представляют собой электролиты, диссоциирующие в водных растворах на катионы металла (или аммония NН4+) и анионы кислотного остатка.
Классификация. По составу соли подразделяют на средние (нормальные), кислые (гидросоли), основные (гидроксосоли
Таблица — Классификация солей по составу
| СОЛИ | |||||
|
Средние (нормальные) — продукт полного замещения атомов водорода в кислоте на металл AlCl3 |
Кислые(гидросоли) - продукт неполного замещения атомов водорода в кислоте на металл КHSO4 |
Основные (гидроксосоли) —продукт неполного замещения ОН-групп основания на кислотный остаток FeOHCl |
Двойные — содержат два разных металла и один кислотный остаток КNaSO4 |
Смешанные — содержат один металл и несколько кислотных остатков CaClBr |
Комплексные [Cu(NH3)4]SO4 |
Физические свойства.
Химические свойства
1) Диссоциация. Средние, двойные и смешанные соли диссоциируют одноступенчато. У кислых и основных солей диссоциация происходит ступенчато.
NaCl Na+ + Cl–.
КNaSO4 К+ + Na+ + SO42– .
CaClBr Ca2+ + Cl –+ Br–.
КHSO4 К+ + НSO4– HSO4– H+ + SO42–.
FeOHClFeOH+ + Cl– FeOH+Fe2+ + OH–.
[Cu(NH3)4]SO4 [Cu(NH3)4]2+ + SO42– [Cu(NH3)4]2+ Cu2+ + 4NH3.
2) Взаимодействие с индикаторами. В результате гидролиза в растворах солей накапливаются ионы Н+ (кислая среда) или ионы ОН– (щелочная среда). Гидролизу подвергаются растворимые соли, образованные хотя бы одним слабым электролитом. Растворы таких солей взаимодействуют с индикаторами:
индикатор + Н+ (ОН–) окрашенное соединение.
AlCl3 + H2O AlOHCl2 + HCl Al3+ + H2O AlOH2+ + H+
3) Разложение при нагревании. При
нагревании некоторых солей они разлагаются на оксид металла и
кислотный оксид:
При
нагревании некоторых солей они разлагаются на оксид металла и
кислотный оксид:
СаСO3 СаO + СО2.
соли бескислородных кислот при нагревании могут распадаться на простые вещества:
2AgCl Ag + Cl2.
Соли, образованные кислотами-окислителями, разлагаются сложнее:
2КNO3 2КNO2 + O2.
4) Взаимодействие с кислотами: Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок.
2HCl + Na2CO3 ® 2NaCl + CO2 + H2O 2H+ + CO32–® CO2 + H2O.
СaCl2 + H2SO4 ® CaSO4¯ + 2HCl Сa2+ + SO42- ® CaSO4¯.
Основные соли при действии кислот переходят в средние:
FeOHCl + HCl ® FeCl2 + H2O.
Средние соли, образованные многоосновными кислотами, при взаимодействии с ними образуют кислые соли:
Na2SO4 + H2SO4 ® 2NaHSO4.
5) Взаимодействие со щелочами. Со щелочами
реагируют соли, катионам которых соответствуют нерастворимые
основания.
CuSO4 + 2NaOH ® Cu(OH)2¯ + Na2SO4 Cu2+ + 2OH– ® Cu(OH)2¯.
6) Взаимодействие друг с другом. Реакция происходит, если взаимодействуют растворимые соли и при этом образуется осадок.
AgNO3 + NaCl ® AgCl¯ + NaNO3 Ag+ + Cl– ® AgCl¯.
7) Взаимодействие с металлами. Каждый предыдущий металл в ряду напряжений вытесняет последующий за ним из раствора его соли:
Fe + CuSO4 ® Cu¯ + FeSO4 Fe + Cu2+ ® Cu¯ + Fe2+.
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
8) Электролиз (разложение под действием постоянного электрического тока). Соли подвергаются электролизу в растворах и расплавах:
2NaCl + 2H2O H2 + 2NaOH + Cl2.
2NaClрасплав 2Na + Cl2.
9) Взаимодействие с кислотными оксидами.
СО2 + Na2SiO3 ® Na2CO3 + SiO2
Na2CO3 + SiO2 СО2 + Na2SiO3
Получение. 1) Взаимодействием металлов с неметаллами:
1) Взаимодействием металлов с неметаллами:
2Na + Cl2 ® 2NaCl.
2) Взаимодействием основных и амфотерных оксидов с кислотными оксидами:
CaO + SiO2 CaSiO3 ZnO + SO3 ZnSO4.
3) Взаимодействием основных оксидов с амфотерными оксидами:
Na2O + ZnO Na2ZnO2.
4) Взаимодействием металлов с кислотами:
2HCl + Fe ® FeCl2 + H2.
5) Взаимодействием основных и амфотерных оксидов с кислотами:
Na2O + 2HNO3 ® 2NaNO3 + H2O ZnO + H2SO4 ® ZnSO4 + H2O.
6) Взаимодействием амфотерных оксидов и гидроксидов со щелочами:
В растворе: 2NaOH + ZnO + H2O ® Na2[Zn(OH)4] 2OH–+ ZnO + H2О ® [Zn(OH)4]2–.
При сплавлении с амфотерным оксидом: 2NaOH + ZnO Na2ZnO2 + H2O.
В растворе: 2NaOH + Zn(OH)2 ® Na2[Zn(OH)4] 2OH– + Zn(OH)2 ® [Zn(OH)4]2–
При сплавлении: 2NaOH +
Zn(OH)2
Na2ZnO2 +
2H2O.
7) Взаимодействием гидроксидов металлов с кислотами:
Ca(OH)2+ H2SO4 ® CaSO4¯ + 2H2O Zn(OH)2+ H2SO4 ® ZnSO4 + 2H2O.
8) Взаимодействием кислот с солями:
2HCl + Na2S ® 2NaCl + Н2S.
9) Взаимодействием солей со щелочами:
ZnSО4 + 2NaOH ® Na2SO4 + Zn(OH)2¯.
10) Взаимодействием солей друг с другом:
AgNO3 + KCl ® AgCl¯ + KNO3.
Л.А. Яковишин
Опыты по химии. Соли | Подготовка к ЦТ и ЕГЭ по химии
Взаимодействие кислот с солями
Если соединить растворы соли и кислоты в одном сосуде – происходит обмен ионами. Приведем примеры таких реакций. При соединении раствора хлорида бария с серной кислотой образуется нерастворимая соль — сульфат бария.
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Мрамор (карбонат кальция) взаимодействует с соляной кислотой.
CaCO3 + 2HCl = CaCl2 + CO2 ↑ +H2O
Реакция обмена происходит, так как выделяется летучее соединение – углекислый газ.
В результате обмена ионами образуется нестойкая угольная кислота, которая распадается на углекислый газ и воду. Реакция между солью и кислотой происходит тогда, когда может образоваться осадок или выделиться газ.
Оборудование: пробирка, штатив для пробирок.
Техника безопасности. Следует соблюдать правила работы с растворами кислот. Избегать попадания кислот и и хлорида бария на кожу и слизистые оболочки.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Взаимодействие металлов с солями
Активные металлы вытесняют из солей менее активные (металлы расположены в порядке убывания активности в ряду напряжений).
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
Проведем опыт с раствором сульфата меди (II) CuSO4. В одну колбу с раствором положим кусочки цинка Zn, в другую – стальные кнопки (сталь – сплав на основе железа Fe). Что произойдет через несколько часов? Растворы изменили цвет — значит, сульфата меди там больше не осталось. Активные металлы ‑ цинк и железо заместили медь в сульфате и образовали соли. Цинк и железо окислились, а медь восстановилась.
CuSO4 + Zn = Zn SO4 + Cu
CuSO4 + Fe = Fe SO4 + Cu
В одной колбе медь выделилась на кнопках, в другой – на кусочках цинка. В колбах были разные металлы, поэтому и осадок меди выглядит по-разному. На цинке медь выделилась в виде рыхлой бурой массы. На железных кнопках осадок меди ‑ более плотный, розового цвета.
Оборудование: колбы.
Техника безопасности. Необходимо осторожное обращение с солями меди. Остерегаться попадания солей меди на кожу и слизистые оболочки.
Постановка опыта – Елена Махиненко, текст – к. п.н. Павел Беспалов.
п.н. Павел Беспалов.
Образование и разрушение кристаллогидратов
Кристаллогидраты – вещества, в состав которых входит кристаллизационная вода. Например, медный купорос CuSO4•5H2O ‑ пятиводный сульфат меди. Медный купорос – голубого цвета. При нагревании большинство кристаллогидратов теряют кристаллизационную воду, превращаясь в безводные вещества. При этом часто происходит изменение цвета веществ. Измельчим купорос и прокалим его. Медный купорос постепенно теряет воду, превращаясь в белый порошок сульфата меди.
CuSO4•5H2O = CuSO4 + 5H2O
При добавлении воды происходит обратный процесс: безводный белый сульфат меди превращается в кристаллогидрат –голубой медный купорос.
CuSO4 + 5H2O = CuSO4•5H2O
Вновь образовался кристаллогидрат ‑ пятиводный сульфат меди.
Оборудование: спиртовка, фарфоровая чашка, ступка фарфоровая, шпатель, штатив, стеклянная палочка, химический стакан, вода, пипетка.
Техника безопасности. Следует соблюдать правила работы с нагревательными приборами. Не допускать попадания солей меди на кожу и слизистые оболочки.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
100 ballov.kz образовательный портал для подготовки к ЕНТ и КТА
В 2021 году казахстанские школьники будут сдавать по-новому Единое национальное тестирование. Помимо того, что главный школьный экзамен будет проходить электронно, выпускникам предоставят возможность испытать свою удачу дважды. Корреспондент zakon.kz побеседовал с вице-министром образования и науки Мирасом Дауленовым и узнал, к чему готовиться будущим абитуриентам.
— О переводе ЕНТ на электронный формат говорилось не раз. И вот, с 2021 года тестирование начнут проводить по-новому. Мирас Мухтарович, расскажите, как это будет?
— По содержанию все остается по-прежнему, но меняется формат. Если раньше школьник садился за парту и ему выдавали бумажный вариант книжки и лист ответа, то теперь тест будут сдавать за компьютером в электронном формате. У каждого выпускника будет свое место, огороженное оргстеклом.
Зарегистрироваться можно будет электронно на сайте Национального центра тестирования. Но, удобство в том, что школьник сам сможет выбрать дату, время и место сдачи тестирования.
Кроме того, в этом году ЕНТ для претендующих на грант будет длиться три месяца, и в течение 100 дней сдать его можно будет два раза.
— Расскажите поподробнее?
— В марте пройдет тестирование для желающих поступить на платной основе, а для претендующих на грант мы ввели новые правила. Школьник, чтобы поступить на грант, по желанию может сдать ЕНТ два раза в апреле, мае или в июне, а наилучший результат отправить на конкурс. Но есть ограничение — два раза в один день сдавать тест нельзя. К примеру, если ты сдал ЕНТ в апреле, то потом повторно можно пересдать его через несколько дней или в мае, июне. Мы рекомендуем все-таки брать небольшой перерыв, чтобы еще лучше подготовиться. Но в любом случае это выбор школьника.
— Система оценивания останется прежней?
— Количество предметов остается прежним — три обязательных предмета и два на выбор. Если в бумажном формате закрашенный вариант ответа уже нельзя было исправить, то в электронном формате школьник сможет вернуться к вопросу и поменять ответ, но до того, как завершил тест.
Если в бумажном формате закрашенный вариант ответа уже нельзя было исправить, то в электронном формате школьник сможет вернуться к вопросу и поменять ответ, но до того, как завершил тест.
Самое главное — результаты теста можно будет получить сразу же после нажатия кнопки «завершить тестирование». Раньше уходило очень много времени на проверку ответов, дети и родители переживали, ждали вечера, чтобы узнать результат. Сейчас мы все автоматизировали и набранное количество баллов будет выведено на экран сразу же после завершения тестирования.
Максимальное количество баллов остается прежним — 140.
— А апелляция?
— Если сдающий не будет согласен с какими-то вопросами, посчитает их некорректными, то он сразу же на месте сможет подать заявку на апелляцию. Не нужно будет ждать следующего дня, идти в центр тестирования, вуз или школу, все это будет электронно.
— С учетом того, что школьникам не придется вручную закрашивать листы ответов, будет ли изменено время сдачи тестирования?
— Мы решили оставить прежнее время — 240 минут. Но теперь, как вы отметили, школьникам не нужно будет тратить час на то, чтобы правильно закрасить лист ответов, они спокойно смогут использовать это время на решение задач.
— Не секрет, что в некоторых селах и отдаленных населенных пунктах не хватает компьютеров. Как сельские школьники будут сдавать ЕНТ по новому формату?
— Задача в том, чтобы правильно выбрать время и дату тестирования. Центры тестирования есть во всех регионах, в Нур-Султане, Алматы и Шымкенте их несколько. Школьники, проживающие в отдаленных населенных пунктах, как и раньше смогут приехать в город, где есть эти центры, и сдать тестирование.
— На сколько процентов будет обновлена база вопросов?
— База вопросов ежегодно обновляется как минимум на 30%. В этом году мы добавили контекстные задания, то что школьники всегда просили. Мы уделили большое внимание истории Казахстана и всемирной истории — исключили практически все даты. Для нас главное не зазубривание дат, а понимание значения исторических событий. Но по каждому предмету будут контекстные вопросы.
Для нас главное не зазубривание дат, а понимание значения исторических событий. Но по каждому предмету будут контекстные вопросы.
— По вашему мнению система справится с возможными хакерскими атаками, взломами?
— Информационная безопасность — это первостепенный и приоритетный вопрос. Центральный аппарат всей системы находится в Нур-Султане. Связь с региональными центрами сдачи ЕНТ проводится по закрытому VPN-каналу. Коды правильных ответов только в Национальном центре тестирования.
Кроме того, дополнительно через ГТС КНБ (Государственная техническая служба) все тесты проходят проверку на предмет возможного вмешательства. Здесь все не просто, это специальные защищенные каналы связи.
— А что с санитарными требованиями? Нужно ли будет школьникам сдавать ПЦР-тест перед ЕНТ?
— ПЦР-тест сдавать не нужно будет. Требование по маскам будет. При необходимости Центр национального тестирования будет выдавать маски школьникам во время сдачи ЕНТ. И, конечно же, будем измерять температуру. Социальная дистанция будет соблюдаться в каждой аудитории.
— Сколько человек будет сидеть в одной аудитории?
— Участники ЕНТ не за семь дней будут сдавать тестирование, как это было раньше, а в течение трех месяцев. Поэтому по заполняемости аудитории вопросов не будет.
— Будут ли ужесточены требования по дисциплине, запрещенным предметам?
— Мы уделяем большое внимание академической честности. На входе в центры тестирования, как и в предыдущие годы, будут стоять металлоискатели. Перечень запрещенных предметов остается прежним — телефоны, шпаргалки и прочее. Но, помимо фронтальной камеры, которая будет транслировать происходящее в аудитории, над каждым столом будет установлена еще одна камера. Она же будет использоваться в качестве идентификации школьника — как Face ID. Сел, зарегистрировался и приступил к заданиям. Мы применеям систему прокторинга.
Понятно, что каждое движение абитуриента нам будет видно. Если во время сдачи ЕНТ обнаружим, что сдающий использовал телефон или шпаргалку, то тестирование автоматически будет прекращено, система отключится.
Если во время сдачи ЕНТ обнаружим, что сдающий использовал телефон или шпаргалку, то тестирование автоматически будет прекращено, система отключится.
— А наблюдатели будут присутствовать во время сдачи тестирования?
— Когда в бумажном формате проводили ЕНТ, мы привлекали очень много дежурных. В одной аудитории было по 3-4 человека. При электронной сдаче такого не будет, максимум один наблюдатель, потому что все будет видно по камерам.
— По вашим наблюдениям школьники стали меньше использовать запрещенные предметы, к примеру, пользоваться телефонами?
— Практика показывает, что школьники стали ответственнее относиться к ЕНТ. Если в 2019 году на 120 тыс. школьников мы изъяли 120 тыс. запрещенных предметов, по сути у каждого сдающего был телефон. То в прошлом году мы на 120 тыс. школьников обнаружили всего 2,5 тыс. телефонов, и у всех были аннулированы результаты.
Напомню, что в 2020 году мы также начали использовать систему искусственного интеллекта. Это анализ видеозаписей, который проводится после тестирования. Так, в прошлом году 100 абитуриентов лишились грантов за то, что во время сдачи ЕНТ использовали запрещенные предметы.
— Сколько средств выделено на проведение ЕНТ в этом году?
Если раньше на ЕНТ требовалось 1,5 млрд тенге из-за распечатки книжек и листов ответов, то сейчас расходы значительно сокращены за счет перехода на электронный формат. Они будут, но несущественные.
— Все-таки почему именно в 2021 году было принято решение проводить ЕНТ в электронном формате. Это как-то связано с пандемией?
— Это не связано с пандемией. Просто нужно переходить на качественно новый уровень. Мы апробировали данный формат на педагогах школ, вы знаете, что они сдают квалификационный тест, на магистрантах, так почему бы не использовать этот же формат при сдаче ЕНТ. Тем более, что это удобно, и для школьников теперь будет много плюсов.
Реакции обмена в водных растворах
☰
Между кислотами, основаниями и солями реакции обмена в водных растворах протекают, если одним из продуктов реакции является осадок, вода или газ.
Если к раствору хлорида кальция прилить раствор карбоната натрия, то выпадет осадок карбоната кальция. Это свидетельство протекания реакции обмена:
CaCl2 + Na2CO3 = 2NaCl + CaCO3↓
AgNO3 + NaCl = NaNO3 + AgCl↓
Вообще взаимодействие двух солей возможно, если обе соли, вступающие в реакцию, растворимы в воде, но из продуктов реакции хотя бы одна соль выпадает в осадок.
Однако если соли, вступающие в реакцию, и соли, являющиеся предполагаемыми продуктами реакции, хорошо растворимы в воде, то считается, что реакция обмена не протекает.
С другой стороны, если обе соли нерастворимы в воде, то они друг с другом не реагируют.
При взаимодействии карбоната натрия с соляной кислотой образуется угольная кислота и хлорид натрия. Угольная кислота легко распадается на углекислый газ и воду, поэтому реакция обмена происходит:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
Вообще реакции между солью и кислотой протекают если образуются нерастворимые соли и кислоты или кислота разлагается с выделением газа (или сама является газом, например H2S).
К реакциям обмена относятся реакции нейтрализации, когда взаимодействуют щелочи и кислоты. В результате образуется соль и вода. При этом соль может быть как растворимой в воде, так и не растворимой (выпадать в осадок):
KOH + HNO3 = KNO3 + H2O
Ba(OH)2 + H2SO4 = BaSO4↓ + H2O
Реакции между солями и основаниями могут протекать лишь в случае, если основание — это щелочь:
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Солевой мостик в водном растворе: сильные структурные мотивы, но слабый энтальпический эффект.
Дональд, Дж. Э., Кулп, Д. У. и ДеГрадо, У. Ф. Солевые мосты: геометрически определенные, моделируемые взаимодействия. Белки: Struct. Функц. Биоинформа. 79 , 898–915, https://doi.org/10.1002/prot.22927 (2011).
Артикул CAS Google Scholar
Босхард, Х. Р., Марти, Д. Н.& Желесаров, И. Стабилизация белков соляными мостиками: концепции, экспериментальные подходы и устранение некоторых недоразумений. J. Mol. Признать. 17 , 1–16, https://doi.org/10.1002/jmr.657 (2004).
Артикул PubMed CAS Google Scholar
Waldburger, C., Schildbach, J. & Sauer, R.T. Важны ли скрытые солевые мостики для стабильности белка и конформационной специфичности? Nat.Struct. Биол . 2 , 122–8, PMID: 7749916 (1995).
Петраускас В., Максимович Э. и Матулис Д. Термодинамика образования ионных пар между заряженными поли (аминокислотами). J. Phys. Chem. B 119 , 12164–12171, https://doi.org/10.1021/acs.jpcb.5b05767. PMID: 26317887 (2015).
Плухаржова, Э., Марсалек, О., Шмидт, Б. и Юнгвирт, П. Стабильность пептидного солевого мостика: от газовой фазы через микрогидратацию до моделирования объемной воды. J. Chem. Phys. 137 , 185101, https://doi.org/10.1063/1.4765052 (2012).
Стабильность пептидного солевого мостика: от газовой фазы через микрогидратацию до моделирования объемной воды. J. Chem. Phys. 137 , 185101, https://doi.org/10.1063/1.4765052 (2012).
ADS Статья PubMed CAS Google Scholar
Дрейпер Д. Э. Справочник по ионам и структуре РНК. РНК 10 , 335–343, https://doi.org/10.1261/rna.5205404 (2004).
Артикул PubMed PubMed Central CAS Google Scholar
Smith, M. D. & Cruz, L. Влияние ионной водной среды на структуру и динамику A β 21–30 фрагмент: молекулярно-динамическое исследование. J. Phys. Chem. B 117 , 6614–6624, https://doi.org/10.1021/jp312653h. PMID: 23675877 (2013 г.).
Fox, J. M. et al. . Взаимодействие между анионами хофмейстера и связывающим карманом белка. J. Am. Chem. Soc . 137 , 3859–3866, https://doi.org/10.1021/jacs.5b00187. PMID: 25738615 (2015).
Smith, M. D. и Cruz, L. Изменения в структуре и динамике мутаций Aβ 21-30 , вызванные ионами в растворе. J. Phys. Chem. B 131121094
5, https://doi.org/10.1021/jp408579v (2013).
Liao, Q., Owen, MC, Bali, S., Barz, B. & Strodel, B. Aβ при стрессе: эффекты ацидоза, связывание Cu 2+ и окисление на амилоид -β-пептидные димеры. Chem. Commun . https://doi.org/10.1039/C8CC02263A (2018).
Бай, Дж. У. и Фалконер, Р. Дж. Температурная стабильность лизоцима как функция концентрации ионов: переоценка взаимосвязи между серией хофмейстера и стабильностью белка. Protein Sci. 22 , 1563–1570, https://doi.org/10.1002/pro.2355 (2013).
Артикул PubMed PubMed Central CAS Google Scholar

Пеграм, Л. М. и др. . Почему эффекты Хофмейстера многих солей способствуют сворачиванию белка, но не образованию спирали ДНК Proc. Natl. Акад. Sci. 107 , 7716–7721, https://doi.org/10.1073/pnas.0913376107 (2010).
ADS Статья PubMed Google Scholar
Senske, M. et al. . Температурная зависимость ряда Хофмайстера: термодинамические отпечатки косолутных белковых взаимодействий. Phys. Chem. Chem. Phys. 18 , 29698–29708, https://doi.org/10.1039/C6CP05080H (2016).
Артикул PubMed CAS Google Scholar
Hofmeister, F. Zur lehre von der wirkung der salze. Arch. fuer Experimentelle Pathol. und Pharmakologie 24 , 247–260, https://doi.org/10.1007/BF01918191 (1888).
Артикул Google Scholar
Ринне, К. Ф., Шульц, Дж. К. Ф. и Нетц, Р. Р. Влияние вторичной структуры и гидратационной воды на диэлектрический спектр полиаланина и возможная связь с дебатами о подчиненной и подчиненной воде. J. Chem. Phys. 142 , 215104, https://doi.org/10.1063/1.4921777 (2015).
ADS Статья PubMed CAS Google Scholar
Фенимор, П. В., Фрауэнфельдер, Х., МакМахон, Б.Х. и Парак, Ф. Г. Слейвинг: флуктуации растворителя доминируют в динамике и функциях белков. Proc. Natl. Акад. Sci. 99 , 16047–16051, https://doi.org/10.1073/pnas.212637899 (2002).
ADS Статья PubMed CAS Google Scholar
Дэлдроп, Дж. О. и др. . Ориентация несферических протонированных кластеров воды, выявленная с помощью дихроизма инфракрасного поглощения. Nat. Commun. 9 , 311 (2018).
ADS Статья PubMed PubMed Central CAS Google Scholar
Буассон, Дж., Штирнеманн, Г., Лааге, Д. и Хайнс, Дж. Т. Динамика переориентации воды в первых гидратных оболочках F — и I — . Phys. Chem. Chem. Phys. 13 , 19895, https://doi.org/10.1039/c1cp21834d (2011).
Артикул PubMed CAS Google Scholar
Гейгер, А. и Герц, Х. Г. Исследование протонной магнитной релаксации ориентации воды вокруг I — и Li + . J. Solut. Chem. 5 , 365–388, https://doi.org/10.1007/bf00646412 (1976).
Артикул CAS Google Scholar
Лангер, Х. и Герц, Х. Структура первой гидратной сферы ионов в растворах электролитов. Исследование ядерной магнитной релаксации. Бер.Bunsenges. Phys. Chem. 81 , 478–490, https://doi.org/10.1002/bbpc.19770810506 (1977).
Артикул CAS Google Scholar
Мазитов Р., Мюллер К. Дж. И Герц Х. Г. Определение ориентации воды в гидратной сфере Li + методом ядерной магнитной релаксации. Z. Phys. Chem. 140 , 55–70, https://doi.org/10.1524/zpch.1984.140.1.055 (1984).
Артикул CAS Google Scholar
Сакко А. Структура и динамика растворов электролитов. Подход к релаксации ЯМР. Chem. Soc. Ред. 23 , 129, https://doi.org/10.1039/cs9942300129 (1994).
Артикул CAS Google Scholar
Ким, Дж. С., Ву, З., Морроу, А. Р., Йетирадж, А., Йетирадж, А. Самодиффузия и вязкость в растворах электролитов. J. Phys. Chem. B 116 , 12007–12013, https://doi.org/10.1021/jp306847t (2012).
Артикул PubMed CAS Google Scholar
Allolio, C., Salas-Illanes, N. , Desmukh, Y. S., Hansen, M. R. & Sebastiani, D. Конкуренция водородных связей и кластеризация в водной среде lii. J. Phys. Chem. B 117 , 9939–9946, https://doi.org/10.1021/jp4033468. PMID: 23909514 (2013 г.).
, Desmukh, Y. S., Hansen, M. R. & Sebastiani, D. Конкуренция водородных связей и кластеризация в водной среде lii. J. Phys. Chem. B 117 , 9939–9946, https://doi.org/10.1021/jp4033468. PMID: 23909514 (2013 г.).
Штирнеманн Г., Вернерссон Э., Юнгвирт П. и Лааге Д. Механизмы ускорения и замедления динамики воды ионами. J. Am. Chem. Soc. 135 , 11824–11831, https://doi.org/10.1021/ja405201s (2013).
Артикул PubMed CAS Google Scholar
Любарцев А. П., Лааксонен А. Эффекты концентрации в водных растворах NaCl. Моделирование молекулярной динамики. Дж.Phys. Chem. 100 , 16410–16418, https://doi.org/10.1021/jp961317h (1996).
Артикул CAS Google Scholar
Okur, H. I. et al. . За пределами серии hofmeister: Ион-специфические эффекты на белки и их биологические функции. J. Phys. Chem. B 121 , 1997–2014 гг., Https://doi.org/10.1021/acs.jpcb.6b10797. PMID: 28094985 (2017).
Чжан Ю.И Кремер П.С. Взаимодействие между макромолекулами и ионами: серия Хофмейстера. Curr. Opin. Chem. Биол . 10 , 658–663, https://doi.org/10.1016/j.cbpa.2006.09.020. Модельные системы / Биополимеры (2006).
Дебек, К. Т., Гроненборн, А. М. и Чонг, Л. Т. Оценка прочности соляных мостиков: сравнение текущих биомолекулярных силовых полей. J. Phys. Chem. B 118 , 6561–6569, https://doi.org/10.1021/jp500958r.PMID: 24702709 (2014).
Пиана, С., Линдорф-Ларсен, К. и Шоу, Д. Э. Насколько надежны моделирование сворачивания белка в отношении параметризации силового поля? Biophys. J. 100 , L47 – L49, https://doi.org/10.1016/j.bpj.2011.03.051 (2011).
Артикул PubMed PubMed Central CAS Google Scholar

Rauscher, S. et al. . Структурные ансамбли внутренне неупорядоченных белков сильно зависят от силового поля: сравнение с экспериментом. J. Chem. Теория вычисл. 11 , 5513–5524, https://doi.org/10.1021/acs.jctc.5b00736 (2015).
Артикул PubMed CAS Google Scholar
Хуанг Дж., Лопес П. Э. М., Ру Б. и МакКерелл А. Д. Последние достижения в области поляризуемых силовых полей для макромолекул: микросекундное моделирование белков с использованием классической модели осциллятора Друде. J. Phys. Chem. Lett . 5 , 3144–3150, https: // doi.org / 10.1021 / jz501315h. PMID: 25247054 (2014).
Луо, Ю., Цзян, В., Ю, Х., МакКерелл, А. Д. и Ру, Б. Моделирование спаривания ионов в концентрированных водных растворах солей с поляризуемым силовым полем. Фарадей Обсудить. 160 , 135–149, https://doi.org/10.1039/C2FD20068F (2013).
ADS Статья PubMed PubMed Central CAS Google Scholar
Фыта, М.И Нетц, Р. Р. Оптимизация ионного силового поля на основе свойств сольватации одноионных и ионных пар: выход за рамки стандартных правил смешивания. J. Chem. Phys. 136 , 124103, https://doi.org/10.1063/1.3693330 (2012).
ADS Статья PubMed CAS Google Scholar
Джи, М. Б. и др. . Силовое поле Кирквуда-Баффа для водных галогенидов щелочных металлов. J. Chem. Теория вычислений . 7 , 1369–1380, https://doi.org/10.1021/ct100517z. PMID: 21789033 (2011 г.).
Abraham, M. J. et al. . GROMACS: высокопроизводительное молекулярное моделирование за счет многоуровневого параллелизма от портативных компьютеров до суперкомпьютеров. Software X 1-2 , 19-25, https://doi.org/10.1016/j.softx.2015.06.001 (2015).
ADS Статья Google Scholar
Essmann, U. et al. .Метод Эвальда с гладкой сеткой частиц. J. Chem. Phys. 103 , 8577–8593, https://doi.org/10.1063/1.470117 (1995).
ADS Статья CAS Google Scholar
Бусси, Д., Донадио, Д. и Парринелло, М. Каноническая выборка посредством масштабирования скорости. J. Chem. Phys. 126 , 014101, https://doi.org/10.1063/1.2408420 (2007).
ADS Статья PubMed CAS Google Scholar
Парринелло М. и Рахман А. Полиморфные переходы в монокристаллах: новый метод молекулярной динамики. J. Appl. Phys. 52 , 7182–7190, https://doi.org/10.1063/1.328693 (1981).
ADS Статья CAS Google Scholar
Парринелло М. и Рахман А. Кристаллическая структура и парные потенциалы: исследование молекулярной динамики. Phys. Rev. Lett. 45 , 1196–1199, https: // doi.org / 10.1103 / PhysRevLett.45.1196 (1980).
ADS Статья CAS Google Scholar
Хамфри В., Далке А. и Шультен К. VMD – визуальная молекулярная динамика. J. Mol. График. 14, 33–38 (1996).
Артикул Google Scholar
Брем, М. и Киршнер, Б. Трэвис — бесплатный анализатор и визуализатор для траекторий Монте-Карло и молекулярной динамики. J. Chem. Инф. Модель. 51, 2007–2023 (2011).
Артикул CAS Google Scholar
Грейс, (c) 1996–2008 гг. Группа разработчиков grace, см. Http://plasma-gate.weizmann.ac.il/grace.
Рапапорт Д. Водородные связи в воде. Мол. Phys. −_ {(aq)} \).-_ {(водный)} \]
−_ {(aq)} \).-_ {(водный)} \]
Ни одна из реакций не идет очень далеко вправо, как написано, потому что благоприятствует образованию более слабой пары кислота-основание. И \ (HCN \), и уксусная кислота являются более сильными кислотами, чем вода, а гидроксид — более сильным основанием, чем ацетат или цианид, поэтому в обоих случаях равновесие находится слева. Тем не менее, каждая из этих реакций генерирует достаточное количество гидроксид-ионов для получения основного раствора. Например, \ (pH \) 0,1 М раствора ацетата натрия или цианида калия при 25 ° C составляет 8.- \) является более сильным основанием (\ (pK_b = 4,79 \)), чем ацетат (\ (pK_b = 9,24 \)), что согласуется с \ (KCN \), производящим более основной раствор, чем ацетат натрия при той же концентрации.
Напротив, сопряженная кислота слабого основания должна быть слабой кислотой (уравнение \ (\ ref {16.2} \)). Например, хлорид аммония и хлорид пиридиния представляют собой соли, полученные реакцией соответственно аммиака и пиридина с \ (HCl \). Как вы уже знаете, хлорид-ион настолько слабое основание, что не вступает в реакцию с водой.+ \), образующаяся в результате реакций, достаточно велика, чтобы значительно снизить \ (pH \) раствора: \ (pH \) 0,10 М раствора хлорида аммония или хлорида пиридиния при 25 ° C составляет 5,13. или 3,12 соответственно. Это согласуется с информацией, показанной на рисунке 16.2, что указывает на то, что ион пиридиния более кислый, чем ион аммония.
Что происходит с водными растворами соли, такой как ацетат аммония, где и катион, и анион могут отдельно реагировать с водой с образованием кислоты и основания, соответственно? Согласно рисунку 16.10, ион аммония будет понижать \ (pH \), в то время как в соответствии с уравнением \ (\ ref {16.3} \) ацетат-ион будет повышать \ (pH \). Этот частный случай необычен, поскольку катион является такой же сильной кислотой, как анион является основанием (pKa ≈ pKb). Следовательно, два эффекта аннулируются, и решение остается нейтральным.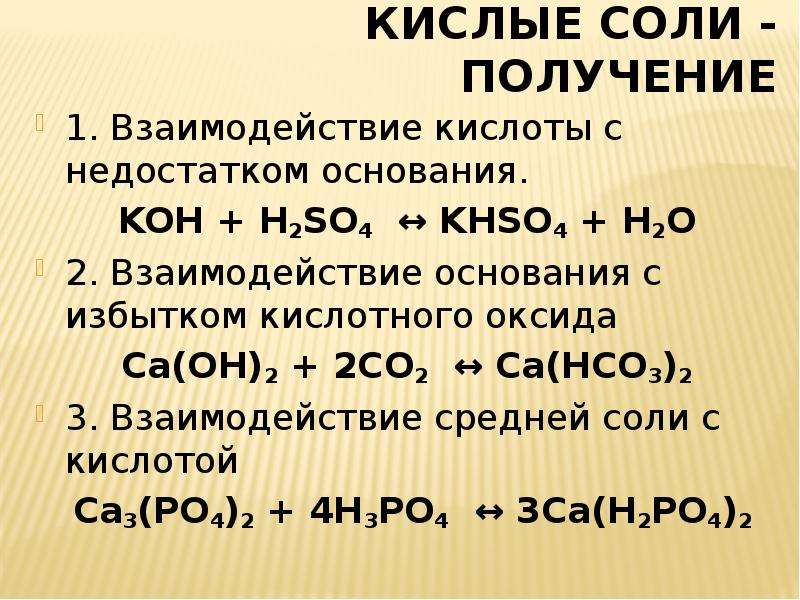 {3 +} \).{3 +} \), имеют разные размеры и заряды, но одинаковое отношение заряда к радиусу. В результате эти пары ионов металлов оказывают сходное влияние на кислотность скоординированных молекул воды, а также часто проявляют другие существенные сходства в химии.
{3 +} \).{3 +} \), имеют разные размеры и заряды, но одинаковое отношение заряда к радиусу. В результате эти пары ионов металлов оказывают сходное влияние на кислотность скоординированных молекул воды, а также часто проявляют другие существенные сходства в химии.
Растворы небольших высоко заряженных ионов металлов в воде являются кислыми.
Реакции, подобные тем, которые обсуждались в этом разделе, в которых соль реагирует с водой с образованием кислого или основного раствора, часто называют реакциями гидролиза.Использование отдельного названия для этого типа реакции неудачно, поскольку предполагает, что они чем-то отличаются. Фактически, реакции гидролиза — это просто кислотно-основные реакции, в которых кислота является катионом, а основание — анионом; они подчиняются тем же принципам и правилам, что и все другие кислотно-основные реакции.
Реакция гидролиза — это кислотно-основная реакция.
Пример \ (\ PageIndex {1} \)
Предскажите, будут ли водные растворы этих соединений кислотными, основными или нейтральными.
- \ (\ ce {KNO_3} \)
- \ (\ ce {CrBr_3} cdot \ ce {H_2O} \)
- \ (\ ce {Na_2SO_4} \)
Дано : соединение
На вопрос : кислотность или основность водного раствора
Стратегия :
- Оцените кислотно-основные свойства катиона и аниона. Если катион является слабой кислотой Льюиса, он не повлияет на \ (pH \) раствора. Однако, если катион представляет собой сопряженную кислоту слабого основания или относительно сильно заряженного катиона металла, он будет реагировать с водой с образованием кислого раствора.Ион {2 -} \) будет реагировать с водой, как показано на рисунке 16.6, с образованием слегка щелочного раствора.
Упражнение \ (\ PageIndex {1} \)
Предскажите, будут ли водные растворы нижеперечисленных кислот кислотными, основными или нейтральными. + \)), или оба.Соли, содержащие мелкие ионы металлов с высоким зарядом, образуют кислые растворы в воде. Реакция соли с водой с образованием кислого или основного раствора называется реакцией гидролиза.
+ \)), или оба.Соли, содержащие мелкие ионы металлов с высоким зарядом, образуют кислые растворы в воде. Реакция соли с водой с образованием кислого или основного раствора называется реакцией гидролиза.
Основные выводы
- Кислотно-основные реакции всегда содержат две сопряженные пары кислота-основание.
- Каждая кислота и каждое основание имеют связанную константу ионизации, которая соответствует их кислотной или основной силе.
кислотно-основная реакция | Определение, примеры, формулы и факты
Кислотно-основная реакция , тип химического процесса, типичным примером которого является обмен одного или нескольких ионов водорода, H + , между частицами, которые могут быть нейтральными (молекулы, такие как вода , H 2 O; или уксусная кислота, CH 3 CO 2 H) или электрически заряженные (ионы, такие как аммоний, NH 4 + ; гидроксид, OH —; или карбонат, CO 3 2-).Он также включает аналогичное поведение молекул и ионов, которые являются кислотными, но не отдают ионы водорода (хлорид алюминия, AlCl 3 и ион серебра AG + ).
сульфат натрияСульфат натрия, также называемый глауберовской солью, является, как и другие соли, продуктом кислотно-щелочной реакции.
Martin WalkerПопулярные вопросы
Что такое кислоты и основания?
Кислоты — это вещества, содержащие один или несколько атомов водорода, которые в растворе выделяются в виде положительно заряженных ионов водорода.Кислота в водном растворе имеет кислый вкус, меняет цвет голубой лакмусовой бумаги на красный, вступает в реакцию с некоторыми металлами (например, с железом) с выделением водорода, реагирует с основаниями с образованием солей и способствует определенным химическим реакциям (кислотный катализ). Основания — вещества, которые имеют горький вкус и меняют цвет красной лакмусовой бумаги на синий. Основания реагируют с кислотами с образованием солей и способствуют определенным химическим реакциям (щелочной катализ).
Основания — вещества, которые имеют горький вкус и меняют цвет красной лакмусовой бумаги на синий. Основания реагируют с кислотами с образованием солей и способствуют определенным химическим реакциям (щелочной катализ).
Как измеряются кислоты и основания?
Кислотам и основаниям присваивается значение от 0 до 14, значение pH, в зависимости от их относительной силы.Чистая вода, которая является нейтральной, имеет pH 7. Раствор с pH менее 7 считается кислым, а раствор с pH более 7 считается щелочным или щелочным. Сильные кислоты имеют более высокую концентрацию ионов водорода, и им присваиваются значения, близкие к 0. И наоборот, сильные основания имеют более высокие концентрации гидроксид-ионов, и им присваиваются значения, близкие к 14. Более слабые кислоты и основания ближе к значению pH 7, чем их более сильные собратья.
Что происходит во время кислотно-щелочной реакции?
Кислотно-основная реакция — это тип химической реакции, которая включает обмен одним или несколькими ионами водорода, H + , между частицами, которые могут быть нейтральными (молекулы, такие как вода, H 2 O) или электрически заряженные (ионы, такие как аммоний, NH 4 + ; гидроксид, OH — ; или карбонат, CO 3 2-).Он также включает аналогичные процессы, которые происходят в молекулах и ионах, которые являются кислотными, но не отдают ионы водорода.
Как кислоты и основания нейтрализуют друг друга (или нейтрализуют друг друга)?
Различные реакции дают разные результаты. Реакции между сильными кислотами и сильными основаниями более полно разлагаются на ионы водорода (протоны, положительно заряженные ионы) и анионы (отрицательно заряженные ионы) в воде. Для слабой кислоты и слабого основания нейтрализация более подходящим образом включает прямой перенос протонов от кислоты к основанию.Если один из реагентов присутствует в большом избытке, реакция может дать соль (или ее раствор), которая может быть кислой, основной или нейтральной в зависимости от силы кислот и оснований, реагирующих друг с другом.
Кислоты — это химические соединения, которые в водном растворе проявляют резкий вкус, разъедающее действие на металлы и способность окрашивать некоторые синие растительные красители в красный цвет. Основания — это химические соединения, которые в растворе становятся мыльными на ощупь и окрашивают красные растительные красители в синий цвет. При смешивании кислоты и основания нейтрализуют друг друга и образуют соли, вещества с солоноватым вкусом и без характерных свойств кислот или оснований.
Идея о том, что одни вещества являются кислотами, а другие — основаниями, почти так же стара, как химия, и термины кислота , основание и соль встречаются очень рано в трудах средневековых алхимиков. Кислоты, вероятно, были первыми из них, которые были обнаружены, по-видимому, из-за их кислого вкуса. Английское слово acid , французское acide , немецкое Säure и русское kislota образованы от слов, означающих кислый (лат. acidus , немецкий sauer , древнескандинавский sūur и Русский кислый ).К другим свойствам, которые в свое время связывали кислоты, относились их растворяющее или коррозионное действие; их действие на растительные красители; и вспенивание, возникающее при нанесении их на мел (образование пузырьков углекислого газа). Основания (или щелочи) характеризовались в основном своей способностью нейтрализовать кислоты и образовывать соли, причем последние довольно слабо характеризовались как кристаллические вещества, растворимые в воде и имеющие соленый вкус.
Несмотря на их неточный характер, эти идеи служили для сопоставления значительного диапазона качественных наблюдений, и многие из самых обычных химических материалов, с которыми сталкивались первые химики, можно было классифицировать как кислоты (соляная, серная, азотная и угольная кислоты), (сода, поташ, известь, нашатырный спирт) или соли (поваренная соль, нашатырный спирт, селитра, квасцы, бура). Отсутствие какой-либо очевидной физической основы для рассматриваемого явления затрудняло количественный прогресс в понимании кислотно-основного поведения, но способность фиксированного количества кислоты нейтрализовать фиксированное количество основания была одним из первых примеров химической эквивалентности. : идея о том, что определенная мера одного вещества в некотором химическом смысле равна разному количеству второго вещества. Кроме того, довольно рано было обнаружено, что одна кислота может быть вытеснена из соли другой кислотой, и это позволило расположить кислоты в приблизительном порядке силы.Также вскоре стало ясно, что многие из этих смещений могут происходить в любом направлении в соответствии с экспериментальными условиями. Это явление свидетельствует о том, что кислотно-основные реакции обратимы, то есть продукты реакции могут взаимодействовать с регенерированием исходного материала. Он также ввел концепцию равновесия в кислотно-щелочную химию: эта концепция гласит, что обратимые химические реакции достигают точки баланса или равновесия, при которой исходные материалы и продукты регенерируются каждой из двух реакций так же быстро, как и они. потребляются другим.
Отсутствие какой-либо очевидной физической основы для рассматриваемого явления затрудняло количественный прогресс в понимании кислотно-основного поведения, но способность фиксированного количества кислоты нейтрализовать фиксированное количество основания была одним из первых примеров химической эквивалентности. : идея о том, что определенная мера одного вещества в некотором химическом смысле равна разному количеству второго вещества. Кроме того, довольно рано было обнаружено, что одна кислота может быть вытеснена из соли другой кислотой, и это позволило расположить кислоты в приблизительном порядке силы.Также вскоре стало ясно, что многие из этих смещений могут происходить в любом направлении в соответствии с экспериментальными условиями. Это явление свидетельствует о том, что кислотно-основные реакции обратимы, то есть продукты реакции могут взаимодействовать с регенерированием исходного материала. Он также ввел концепцию равновесия в кислотно-щелочную химию: эта концепция гласит, что обратимые химические реакции достигают точки баланса или равновесия, при которой исходные материалы и продукты регенерируются каждой из двух реакций так же быстро, как и они. потребляются другим.
Помимо теоретического интереса, кислоты и основания играют большую роль в промышленной химии и в повседневной жизни. Серная кислота и гидроксид натрия входят в число продуктов, производимых в наибольших количествах химической промышленностью, и большой процент химических процессов включает кислоты или основания в качестве реагентов или катализаторов. Почти каждый биологический химический процесс тесно связан с кислотно-щелочным равновесием в клетке или в организме в целом, и кислотность или щелочность почвы и воды имеют большое значение для растений или животных, живущих в них.И идеи, и терминология кислотно-щелочной химии проникли в повседневную жизнь, и термин соль особенно распространен.
Неорганические соли взаимодействуют с щавелевой кислотой в субмикронных частицах с образованием материала с низкой гигроскопичностью и летучестью
Исследовательская статья 27 мая 2014 г.
Исследовательская статья | 27 мая 2014
ГРАММ.Дрозд 1 , Ю. Woo 1 , S. А. К. Хаккинен 1,2 , А. Ненес 3 и В. Ф. Макнил 1 Г. Дрозд и соавт. Дрозд Г. 1 , Ж. Woo 1 , S. А. К. Хаккинен 1,2 , А. Ненес 3 и В. Ф. Макнил 1- 1 Департамент химической инженерии Колумбийского университета, Нью-Йорк, штат Нью-Йорк 10027, США
- 2 Физический факультет Хельсинкского университета, 00014, Хельсинки, Финляндия
- 3 Школы наук о Земле и атмосфере и Химическая и биомолекулярная инженерия, Технологический институт Джорджии, Атланта, Джорджия 30332, США
- 1 Департамент химической инженерии Колумбийского университета, Нью-Йорк, штат Нью-Йорк 10027, США
- 2 Физический факультет Хельсинкского университета, 00014, Хельсинки, Финляндия
- 3 Школы наук о Земле и атмосфере и Химическая и биомолекулярная инженерия, Технологический институт Джорджии, Атланта, Джорджия 30332, США
Летучесть и гигроскопичность — два ключевых свойства органических аэрозольных компонентов, и оба они тесно связаны с химической идентичностью. Хотя гигроскопичность чистых солей, дикарбоновых кислот (DCA) и солей DCA известна, гигроскопичность внутренних смесей этих компонентов, которые обычно присутствуют в атмосфере, полностью не охарактеризована. Здесь мы показываем, что взаимодействия неорганических и органических компонентов, обычно не учитываемые в атмосферных моделях, могут приводить к очень прочно связанным металл-органическим комплексам и сильно влиять на летучесть и гигроскопичность аэрозолей; в частности, бидентатное связывание DCA с растворимыми неорганическими ионами.Мы изучили летучесть чистых, сухих частиц органических солей и гигроскопичность внутренних смесей щавелевой кислоты (OxA, доминирующей DCA в атмосфере) и ряда солей, как одно-, так и двухвалентных. Было подтверждено образование органических солей с очень низкой летучестью с минимальным испарением частиц оксалатной соли при температуре ниже 75 ° C. Резкое увеличение диаметра активации ядер облачной конденсации (CCN) для частиц с двухвалентными солями (например, CaCl 2 ) и относительно небольшие объемные доли частиц OxA указывают на то, что стандартные правила объемной аддитивности для гигроскопичности не применяются.Таким образом, небольшие органические соединения с высокими отношениями O: C способны образовывать частицы с низкой летучестью и очень низкой гигроскопичностью. Учитывая современные знания о механизмах образования солей OxA и M-Ox, ожидается обогащение поверхности нерастворимыми солями M-Ox. Образовавшееся в результате образование нерастворимого покрытия из солей оксалатов металлов может объяснить гигроскопичность с низким содержанием частиц. Образование частиц с твердым покрытием могло бы предложить альтернативное объяснение наблюдений за стеклоподобными частицами без необходимости фазового перехода.
Хотя гигроскопичность чистых солей, дикарбоновых кислот (DCA) и солей DCA известна, гигроскопичность внутренних смесей этих компонентов, которые обычно присутствуют в атмосфере, полностью не охарактеризована. Здесь мы показываем, что взаимодействия неорганических и органических компонентов, обычно не учитываемые в атмосферных моделях, могут приводить к очень прочно связанным металл-органическим комплексам и сильно влиять на летучесть и гигроскопичность аэрозолей; в частности, бидентатное связывание DCA с растворимыми неорганическими ионами.Мы изучили летучесть чистых, сухих частиц органических солей и гигроскопичность внутренних смесей щавелевой кислоты (OxA, доминирующей DCA в атмосфере) и ряда солей, как одно-, так и двухвалентных. Было подтверждено образование органических солей с очень низкой летучестью с минимальным испарением частиц оксалатной соли при температуре ниже 75 ° C. Резкое увеличение диаметра активации ядер облачной конденсации (CCN) для частиц с двухвалентными солями (например, CaCl 2 ) и относительно небольшие объемные доли частиц OxA указывают на то, что стандартные правила объемной аддитивности для гигроскопичности не применяются.Таким образом, небольшие органические соединения с высокими отношениями O: C способны образовывать частицы с низкой летучестью и очень низкой гигроскопичностью. Учитывая современные знания о механизмах образования солей OxA и M-Ox, ожидается обогащение поверхности нерастворимыми солями M-Ox. Образовавшееся в результате образование нерастворимого покрытия из солей оксалатов металлов может объяснить гигроскопичность с низким содержанием частиц. Образование частиц с твердым покрытием могло бы предложить альтернативное объяснение наблюдений за стеклоподобными частицами без необходимости фазового перехода.
Соляные мосты
Соляные мосты (Моделирование белков)Что это такое:
Солевой мостик — это нековалентное взаимодействие между двумя ионизированными
места. Он состоит из двух компонентов: водородной связи и электростатической связи.
взаимодействие. В солевом мостике протон мигрирует из карбонового
кислотной группы к первичному амину или к гуанидиновой группе в Arg.Типичный
солевые мостики включают Lys или Arg в качестве оснований и Asp или Glu в качестве кислот. Из всех
нековалентные взаимодействия, солевые мостики являются одними из самых сильных.
Он состоит из двух компонентов: водородной связи и электростатической связи.
взаимодействие. В солевом мостике протон мигрирует из карбонового
кислотной группы к первичному амину или к гуанидиновой группе в Arg.Типичный
солевые мостики включают Lys или Arg в качестве оснований и Asp или Glu в качестве кислот. Из всех
нековалентные взаимодействия, солевые мостики являются одними из самых сильных.
Когда атомы водорода добавляются в файл PDB, по умолчанию используются все ионизируемые центры, включая тип, который
позволить солевым мостикам образоваться, чтобы быть нейтрализованными Другими словами, соль
по умолчанию мосты не создаются; на самом деле, если бы в
PDB-файл, запуск PDB-файла с использованием MOPAC приведет к его уничтожению.
Возникает закономерный вопрос: «Следует ли ионизовать ионизируемые остатки?» Некоторые остатки, например, Asp, Glu, Arg, Lys,
His и Tyr, а также первый и последний остатки белка потенциально являются
ионизируемые, так почему бы не ионизировать их по умолчанию? Согласно общепринятому мнению, большинство ионизируемых остатков
должны быть ионизированы, но если это будет сделано, некоторые необоснованные структуры могут быть
созданный. Таким образом, в 1QGK последовательность Gln 333 -Asp 334 -Glu 335 -Asn 336 -Asp- 337 -Asp- 338 -Asp 339 -Asp sp 340 34 -A -Trp 342 , или (QDENDDDDDW), присутствует.Если бы Glu и все Asp были
ионизированный, то этот набор связанных остатков будет
есть чистый заряд -7. Это вряд ли произойдет из-за большого
накопление заряда; более вероятная структура
включают один или несколько солевых мостиков и, возможно, один или два других кислотных
остатки также ионизируются. Когда последовательность Asp334-Asp341 была извлечена из
1QGK и оптимизированная как анион 7+, система расширилась примерно на
12%, а при сольватации система сжимается примерно на 3%.Без дополнительной информации решить, какие остатки следует ионизировать, очень сложно. сложно, если не невозможно.
сложно, если не невозможно.
Альтернатива выбору остатков для ionize означает определение всех остатков как изначально нейтральных; это по умолчанию в MOPAC. Вторая операция с использованием SITE = (SALT) может образовывать все простые солевые мостики, САЙТ также может использоваться для ионизации отдельных атомы или остатки.
Оптимизация положений атомов водорода:
После того, как атомы водорода были добавлены к биомолекуле, положение атомов водорода должно быть оптимизировано, прежде чем можно будет начать работу по моделированию химии белков.В течение эта операция немного водорода атомы могут мигрировать из кислотных остатков в основные, создавая солевые мостики, но вряд ли сформируются все те, которые должны присутствовать. Поэтому внимательно изучите структуру белка, в частности, посмотрите в состоянии ионизации остатков Lys и Arg. Изучите окружающую среду каждого нейтральный остаток Lys и Arg, если есть поблизости неионизированный кислотный остаток, осторожно переместите протон от кислоты к остатку основания.
Критерий определения наличия соляного моста:
После внесения всех изменений повторно запустите частичную оптимизацию, чтобы позволяют атомам водорода, которые были модифицированы, двигаться в их правильные позиции. Если есть сомнения относительно того, следует ли использовать соляной мостик или не должно присутствовать, оптимизируйте положения атомов водорода в двух Системы-кандидаты — солевой мостик и нейтральная форма — отдельно. Конечно, чтобы можно было сравнить теплоту пласта, набор используемые ключевые слова должны быть одинаковыми, особенно если EPS = 78.4 используется в одном задании, его следует использовать в другом. То, что имеет более низкую энергию, является предпочтительной структурой. Полученная структура будет хорошей отправной точкой для последующих операции.
Влияние растворителя:
Если растворитель считается важным, добавьте ключевое слово
EPS = 78,4; это приведет к тому, что модель неявной сольватации COSMO Андреаса Кламта будет
использовал.