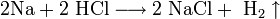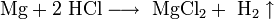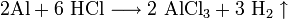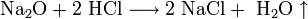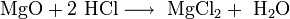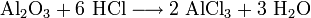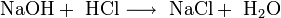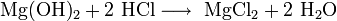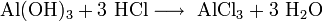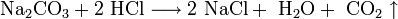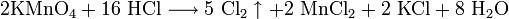СОЛЯНАЯ КИСЛОТА
Применение соляной кислоты
Соляная кислота широко используется в промышленности при извлечении металлов из руд, травлении металлов и т. д. Также она используется при изготовлении паяльной жидкости, при осаждении серебра и как составная частьцарской водки.
Масштабы применения соляной кислоты в промышленности меньше, чем азотной. Связано это с тем, что соляная кислота вызывает коррозию стальной аппаратуры. К тому же летучие пары её довольно вредны и также вызывают коррозию металлических изделий. Это нужно учитывать при хранении соляной кислоты. Хранят и перевозят соляную кислоту в гуммированных цистернах и бочках, т.е. в сосудах, внутренняя поверхность которых покрыта кислотостойкой резиной, а также в стеклянных бутылях и полиэтиленовой посуде.
Соляная кислота применяется для получения хлоридов цинка, марганца, железа и других металлов, а также хлористого аммония. Соляную кислоту применяют для очистки поверхностей металлов, сосудов, скважин от карбонатов, окислов и других осадков и загрязнений. При этом используют специальные добавки — ингибиторы, которые защищают металл от растворения и коррозии, но не задерживают растворение окислов, карбонатов и других подобных соединений.
HCl применяется в промышленном производстве синтетических смол, каучуков. Используется как сырьё в производстве хлористого метила из метилового спирта, хлористого этила из этилена, хлорвинила из ацетилена.
Первая помощь и методы лечения
При обнаружении признаков отравления требуется вызвать бригаду скорой помощи. В домашних условиях допускается проводить мероприятия, направленные на улучшение состояния пострадавшего. Первая помощь при отравлении соляной кислотой должна проводиться быстро, чтобы уменьшить риск возникновения негативных последствий.
Мероприятия:
- При попадании соляного соединения на кожные покровы места повреждения промывают большим количеством прохладной воды. Длительность обработки составляет не менее получаса.
- При интоксикации парами пострадавшему обеспечивают доступ свежего воздуха, открывают окна, расстегивают тесную одежду.
- Рекомендуется следить за состоянием пациента, при отсутствии признаков жизни проводятся реанимационные действия.
- Пострадавшему от паров разрешается дать выпить теплый чай, воду. Рекомендуется провести полоскание полости носа и рта прохладной водой.
- При передозировке, возникнувшей в результате употребления кислоты внутрь, на живот кладут пузырь со льдом, чтобы исключить либо уменьшить возможное кровотечение.
- Не допускается употребление каких-либо лекарственных средств. Разрешается дать пациенту стакан воды (можно минеральной щелочной). Употреблять жидкость требуется маленькими глотками.
- Не разрешено промывать желудок, пытаться вызвать рвотные позывы в домашних условиях. Подобная первая помощь способна привести к развитию ожогов горла, кровотечению.
Лечение проводится в медицинском учреждении под контролем специалистов.


Терапия:
- Очищение желудка при помощи зонда,
- Использование капельниц с лекарственными растворами,
- Назначение препаратов, снимающих болезненные ощущения,
- Применение медикаментов, направленных на восстановление работы органов и систем,
- При необходимости ингаляции кислородом и искусственная вентиляция легких,
- Проведение реанимационной терапии при отсутствии признаков жизни,
- Подбор витаминов и специального питания.
Лечение проводится в реанимации, а затем в стационаре. Длительность зависит от состояния пациента и степени отравления.
Ожоги и отравление
Каким бы эффективным ни было это средство, оно опасно. Соляная кислота, в зависимости от концентрации, может спровоцировать химические ожоги четырех степеней:
- Возникает лишь покраснение и боль.
- Появляются пузыри с прозрачной жидкостью и отек.
- Формируется некроз верхних слоев кожи. Пузыри заполняются кровью или мутным содержимым.
- Поражение достигает сухожилий и мышц.
Если вещество каким-то образом попало в глаза, надо промыть их водой, а потом содовым раствором. Но в любом случае первым делом надо вызвать скорую.
Попадание кислоты внутрь чревато острыми болями в груди и животе, отеком гортани, рвотными кровавыми массами. Как следствие — тяжелые патологии печени и почек.
А к первым признакам отравления парами относят сухой частый кашель, удушье, повреждение зубов, жжение в слизистых оболочках и боли в животе. Первая неотложная помощь — это умывание и полоскание полости рта водой, а также доступ к свежему воздуху. Настоящую помощь может оказать лишь токсиколог.
Свойства химического спектра
Кислота взаимодействует со многими металлами, солями. Она считается довольно сильной и стоит в одном ряду с серной. Основная реакция проявляется на все группы металлов, находящихся левее от водорода (магний, железо, цинк – электротехнические потенциалы).
Хлороводородный раствор в разбавленном виде вступает в реакцию с солями, но только с теми, которые образованы менее сильными кислотами. Известные всем натрия и кальция карбонат после взаимодействия с ним распадаются на воду и угарный газ.
Азотная кислота
– качественная реакция на солевой раствор. Для ее получения необходимо добавить в этот реактив нитрат серебра, как результат – выпадет осадок белого цвета, с которого получается азотное вещество
С помощью данной смеси воды и водорода проводят множество интересных экспериментов. Например, разбавляют его аммиаком. В итоге, получится белый дым, густой, имеющий консистенцию маленьких кристаллов. Метиламин, анилин, диоксид марганца, калий карбонат – реактивы, также поддающиеся под влияние кислоты.
Как и для чего применяют


Пожалуй, это по праву одно из важных веществ, которое встречается и необходимо практически во всех отраслях жизнедеятельности человека.
Локализация области применения:
- Металлургия. Очистка поверхностей от окисленных участков, растворение ржавчины, обработка перед спайкой, лужением. Соляная кислотапомогает извлекать мелкие вкрапления металлов из руд. Цирконий и титан получают, используя способ переведения оксидов в хлориды.
- Промышленность пищевых технологий. Раствор с низкой концентрацией применяется в качестве пищевой добавки. Желатин, фруктоза для диабетиков содержат в своем составе чистый эмульгатор. Обычная сода так же обладает высоким коэффициентом содержания данного вещества. На упаковке товаров увидите его под названием Е507.
- Область медицины. При недостаточном показателе кислотной среды в желудке и проблемах с кишечником. Низкий уровень Ph приводит к появлению рака. Даже при надлежащем питании, витаминов в достатке, опасность не исчезает, необходимо проводить анализы для получения сока из желудочного тракта, ведь при недостаточно кислой среде полезные вещества практически не всасываются, нарушается пищеварение.
- Раствор соли используется как ингибитор – защита от грязи и инфекций, антисептическое действие. Для изготовления клеевых смесей, изделий из керамики. Ним промывают теплообменники.
- Процедура очистки воды для питья тоже не обходится без участия хлора.
- Изготовление каучука, отбеливание тканевых основ.
- Можно ухаживать за линзами с помощью данного раствора.
- Полоскание полости рта в домашних условиях
- Вещество отлично проводит электрический ток.
Как происходит отравление
Соляная кислота – жидкое вещество без цвета, но с характерным резким запахом. Одна из самых сильных кислот, способна растворять некоторые металлы. Легко превращается в газ.
Хлористый водород используется в текстильной промышленности, кожевенном деле, металлургии драгметаллов, при производстве клея, кислот.
Вещество присутствует в желудке в минимальной концентрации. Кислота способствует нормализации пищеварительного процесса, защищает организм от вредных бактерий и микроорганизмов.
При концентрации, превышающей показатель в 24 %, соляная кислота способна нанести необратимый вред человеческому организму. Пары, образующиеся при контакте с воздухом, вызывают раздражение органов зрительной и дыхательной системы.
Выделяют несколько факторов, способных спровоцировать развитие отравления.
Факторы:
Интоксикация парами возможна при работе в помещениях с плохой вентиляцией,
Употребление внутрь по неосторожности, чаще происходит у детей,
Попадание соляной кислоты на эпидермис, слизистую оболочку при несоблюдении правил использования реагента.
Отравление веществом в домашних условиях у взрослых людей происходит в результате применения без средств защиты кожного покрова, глаз, органов дыхательной системы. Интоксикация способна произойти при неаккуратном переливании кислоты из одной емкости в другую.
Фармакодинамика и фармакокинетика
Что такое кислотность желудочного сока? Это характеристика концентрации Соляной Кислоты в желудке. Кислотность выражается в рН
. В норме в составе желудочного сока должна вырабатываться кислота и принимать активное участие в процессах пищеварения. Формула хлороводородной кислоты: HCl
. Ее продуцируют париетальные клетки, расположенные в фундальных железах, с участием Н+/К+-АТФазы
. Эти клетки выстилают дно и тело желудка. Кислотность желудочного сока сама по себе изменчива и зависит от числа париетальых клеток и интенсивности процессов нейтрализации вещества щелочными компонентами желудочного сока. Концентрация продуцируемой к-ты стабильна и равняется 160 ммоль/л. У здорового человека в норме должно вырабатываться не более 7 и не менее 5 ммоль вещества в час.
При недостаточной или избыточной выработке Соляной Кислоты возникают заболевания пищеварительного тракта, ухудшается способность усваивать некоторые и микроэлементы, например, железо. Средство стимулирует выделение желудочного сока, снижает рН
. Активирует пепсиноген
, переводит его в активный фермент пепсин
. Вещество благоприятно воздействует на кислотный рефлекс желудка, замедляет переход не до конца переваренной пищи в кишечник. Замедляются процессы брожения содержимого пищеварительного тракта, исчезает боль, и отрыжка, лучше усваивается железо.
После приема внутрь средство частично метаболизируется слюной и желудочной слизью, содержимым 12-перстной кишки. Несвязанное вещество проникает в 12-перстную кишку, где полностью нейтрализуется ее щелочным содержимым.
Другое применение кислоты в быту
Процедуру проводят следующим образом: кислоту разбавляют водой до достижения 5 %-ной концентрации и добавляют ингибитор из расчета 0,5 г на 1 л жидкости. Полученным составом обрабатывают поверхность и оставляют на 30-40 минут (в зависимости от степени загрязнения), после чего промывают водой.
Слабый кислотный раствор также используется для удаления пятен от ягод, чернил или ржавчины с тканей. Для этого материал замачивают в составе на некоторое время, после чего тщательно ополаскивают и стирают в обычном режиме.
Избавление от накипи в чайнике
Для этой цели используют 3-5 %-ный раствор соляной кислоты, который наливают в чайник и нагревают до 60-80°
С в течение 1-2 часов или до тех пор, пока накипные отложения не распадутся. После этого накипь становится рыхлой и легко удаляется деревянной лопаточкой.
Эффективность метода обусловлена тем, что реагент вступает в реакцию с карбонатами магния и кальция и превращает их в растворимые соли. Выделяющийся при этом углекислый газ разрушает слой накипи и придает ему рыхлость. После удаления солевых отложений посуду тщательно моют чистой водой.
Важный момент!
Этот способ не подходит для удаления накипи в эмалированных или алюминиевых чайниках со сколами и трещинами: это приведет к коррозии металла и его сильному повреждению.
Получение вещества
Теперь можно поговорить о том, что делают для образования соляной кислоты.
Сначала, посредством сжигания в хлоре водорода, получают главный компонент — газообразный хлороводород. Который потом растворяют в воде. Результатом этой простой реакции становится образование синтетической кислоты.
Еще данное вещество можно получить из абгазов. Это — химические отходящие (побочные) газы. Они образуются при самых разных процессах. К примеру, при хлорировании углеводородов. Находящийся в их составе хлороводород называют абгазным. И кислоту, полученную таким образом, соответственно.
Следует отметить, что в последние годы доля абгазного вещества в общем объеме его производства увеличивается. А кислота, образованная вследствие сжигания в хлоре водорода, вытесняется. Однако справедливости ради нужно отметить, что в ней содержится меньше примесей.


Использование на производстве
Она имеет широкое применение в металлургической, пищевой и медицинской промышленности.
- Металлургии. Применение при паянии, лужении и зачистке металлов.
- Пищевая промышленность. Применение при производстве пищевых регуляторов кислотности, к примеру, Е507.
- Гальванопластика. Используется при травлении.
- Медицине. Находит свое применение при производстве искусственного желудочного сока.
Входит в состав синтетических красителей. Используется при производстве чистящих и моющих средств. Но в жидкостях, предназначенных для бытового использования, концентрация серной кислоты незначительна.
Как добывают соляную кислоту в лабораторных условиях


Производство вещества масштабно, продажа свободна. В условиях лабораторных опытов добывают раствор воздействием серной кислоты высокой концентрации на обычную кухонную соль (натрия хлорид).
Существует 2 метода растворения хлороводорода в воде:
- Водород сжигается в хлоре (синтетический).
- Попутный (абгазный). Суть его в проведении органического хлорирования, дегидрохлорирования.
Вещество хорошо поддается синтезу при пиролизе отходов от хлороорганики. Это случается в результате распада углеводородов при полном дефиците кислорода. Можно использовать так же хлориды металлов, которые являются сырьем неорганических веществ. Если нет серной кислоты концентрированной (электролита), берите разведенную.
Что касается добывания реагента в природных условиях, то чаще всего эту химическую смесь можно встретить в водах вулканических отходов. Хлороводород – это составляющая минералов сильвина (калия хлорид, по виду напоминает кости для игр), бишофита. Все это – методы добыть вещество в промышленности.
В организме человека, данный фермент содержится в желудке. Раствор может быть как кислотой, так и основанием. Одним из распространенных способов добывания, называют сульфатный.
Химические свойства
Хлороводородная кислота, хлористый водород или хлористоводородная кислота – раствор НСl
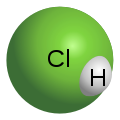
в воде. Согласно Википедии, вещество относят у группе неорганических сильных одноосновных к-т. Полное название соединения на латинском: Hydrochloricum acid.
Формула Соляной Кислоты в химии: HCl
. В молекуле атомы водорода соединяются с атомами галогена – Cl
. Если рассмотреть электронную конфигурацию этих молекул, то можно отметить, что в образовании молекулярных орбиталей соединения принимают участие 1s
-орбитали водорода и обе 3s
и 3p
-орбитали атома Cl
. В химической формуле Соляной Кислоты 1s-
, 3s-
и 3р
-атомные орбитали перекрываются и образуют 1 , 2 , 3 -орбитали. При этом 3s
-орбиталь не носит связывающий характер. Наблюдается смещение электронной плотности к атому Cl
и снижается полярность молекулы, но увеличивается энергия связи молекулярных орбиталей (если рассматривать ее в ряду с другими галогеноводородами
).
Физические свойства хлористого водорода. Это прозрачная бесцветная жидкость, обладающая способностью дымиться при соприкосновении с воздухом. Молярная масса химического соединения = 36,6 грамма на моль. При стандартных условиях, при температуре воздуха 20 градусов Цельсия, максимальная концентрация вещества составляет 38% по массе. Плотность концентрированной хлороводородной к-ты в такого рода растворе составляет 1,19 г/см³. В целом же, физические свойства и такие характеристики, как плотность, молярность, вязкость, теплоемкость, температура кипения и pН
, сильно зависят от концентрации раствора. Эти величины подробнее рассматриваются в таблице плотностей. Например, плотность Соляной Кислоты 10% = 1,048 кг на литр. При затвердевании вещество образует кристаллогидраты
разных составов.
Химические свойства Соляной Кислоты. С чем реагирует Соляная Кислота? Вещество вступает во взаимодействие с металлами, которые стоят в ряду электрохимических потенциалов перед водородом (железо, магний, цинк и другие). При этом образуются соли и выделяется газообразный H
. С Соляной Кислотой не реагирует свинец, медь, золото, серебро и другие металлы правее водорода. Вещество вступает в реакцию с оксидами металлов, при этом образуя воду и растворимую соль. Гидроксид натрия под действием к-ты образует и воду. Реакция нейтрализации характерна для данного соединения.
Разбавленная Соляная Кислота реагирует с солями металлов, которые образованы более слабыми к-ами. Например, пропионовая кислота
слабее, чем соляная. Вещество не взаимодействует с более сильными кислотами. и карбонат натрия
будут образовывать после реакции с HCl
хлорид, угарный газ и воду.
Для химического соединения характерны реакции с сильными окислителями, с диоксидом марганца
, перманганатом калия
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8h3O
. Вещество реагирует с аммиаком
, при этом образуется густой белый дым, который состоит из очень мелких кристаллов хлорида аммония. Минерал пиролюзит с Соляной Кислотой также вступает в реакцию, так как содержит диоксид марганца
: MnO2+4HCl=Cl2+MnO2+2h3O
(реакция окисления).
Существует качественная реакция на хлороводородную кислоту и ее соли. При взаимодействии вещества с нитратом серебра
выпадает белый осадок хлорида серебра
и образуется азотная к-та
. Уравнение реакции взаимодействия метиламина
с хлористым водородом выглядит следующим образом: HCl + Ch4Nh3 = (Ch4Nh4)Cl
.
Вещество реагирует со слабым основанием анилином
. После растворения анилина в воде к смеси прибавляют Соляную Кислоту. В результате основание растворяется и образует солянокислый анилин
(хлорид фениламмония
): (С6Н5Nh4)Cl
. Реакция взаимодействия карбида алюминия с хлористоводородной к-ой: Al4C3+12HCL=3Ch5+4AlCl3
. Уравнение реакции карбоната калия
с к-той выглядит следующим образом: K2CO3 + 2HCl = 2KCl + h3O + CO2.
Применение
в металлургии для извлечения руд, удаления ржавчины, окалин, грязи и окислов, паянии и лужении;
при изготовлении синтетических каучуков и смол;
в гальванопластике;
в качестве регулятора кислотности в пищевой промышленности;
для получения хлоридов металлов;
для получения хлора;
в медицине для лечения недостаточной кислотности желудочного сока;
в качестве чистящего и дезинфицирующего средства.
— (НСl), водный раствор хлороводорода, бесцветного газа с резким запахом. Получают действием серной кислоты на поваренную соль, как побочный продукт хлорирования углеводородов, или реакцией водорода и хлора. Соляная кислота используется, для… … Научно-технический энциклопедический словарь
Соляная кислота
— – HCl (СК) (хлористоводородная кислота, хлороводородная кислота, хлористый водород) – это раствор хлороводорода (НСl) в воде, противоморозная добавка. Представляет собой бесцветную жидкость с резким запахом, без взвешенных частиц.… … Энциклопедия терминов, определений и пояснений строительных материалов
СОЛЯНАЯ КИСЛОТА
— (хлористоводородная кислота) раствор хлористого водорода в воде; сильная кислота. Бесцветная, дымящая на воздухе жидкость (техническая соляная кислота желтоватая из за примесей Fe, Cl2 и др.). Максимальная концентрация (при 20 .С) 38% по массе,… … Большой Энциклопедический словарь
СОЛЯНАЯ КИСЛОТА
— (Acidum muriaticum, Acid, hydrochloricum), раствор хлористого водорода (НС1) в воде. В природе встречается в воде нек рых источников вулканического происхождения, а также находится в желудочном соке (до 0,5%). Хлористый водород может быть получен … Большая медицинская энциклопедия
СОЛЯНАЯ КИСЛОТА
— (хлороводородная кислота, хлористоводородная кислота) сильная одноосновная летучая кислота с резким запахом, водный раствор хлористого водорода; максимальная концентрация 38% по массе, плотность такого раствора 1,19 г/см3. Применяют в… … Российская энциклопедия по охране труда
СОЛЯНАЯ КИСЛОТА
— (хлористоводородная кислота) НСl водный раствор хлористого водорода, сильная одноосновная кислота, летучая, с резким запахом; примеси железа, хлора окрашивают её в желтоватый цвет. Поступающая в продажи концентрированная С. к. содержит 37 %… … Большая политехническая энциклопедия
соляная кислота
— сущ., кол во синонимов: 1 кислота (171) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
СОЛЯНАЯ КИСЛОТА
Современная энциклопедия
Соляная кислота
— СОЛЯНАЯ КИСЛОТА, водный раствор хлористого водорода HCl; дымящая на воздухе жидкость с резким запахом. Применяют соляную кислоту для получения различных хлоридов, травления металлов, обработки руд, в производстве хлора, соды, каучуков и др.… … Иллюстрированный энциклопедический словарь
соляная кислота
— (хлороводородная кислота), раствор хлороводорода в воде; сильная кислота. Бесцветная, «дымящая» на воздухе жидкость (техническая соляная кислота желтоватая из за примесей Fe, Cl2 и др.). Максимальная концентрация (при 20°C) 38% по массе,… … Энциклопедический словарь
Чем опасно интоксикация
Соляная кислота представляет особую опасность для человеческого организма. При отравлении подобным веществом возможно развитие серьезных осложнений и нарушений функциональности организма.
Осложнения:
- Нарушение работы печени, как следствие токсический гепатит,
- Кровотечение в желудке из-за разрушенных стенок органа,
- Шоковое состояние от боли при попадании кислоты на территорию большой площади,
- При попадании в глаза нарушение зрительных функций,
- Серьезные сбои в работе почек,
- Нарушение дыхательного процесса, удушье, нехватка воздуха,
- Развитие коматозного состояния.
Подобные последствия развиваются постепенно в зависимости от степени отравления.
Вывод
При соблюдении мер предосторожности и правил безопасности соляная кислота станет незаменимым помощником в быту. А приобрести ее по самым доступным ценам можно в нашей компании
Как кислоты. Программа образования предусматривает запоминание учениками названий и формул шести представителей этой группы. И, просматривая предоставленную учебником таблицу, вы замечаете в списке кислот ту, которая стоит первой и заинтересовала вас в первую очередь, — соляную. Увы, на занятиях в школе ни свойства, ни любая другая информация о ней не изучается. Поэтому жаждущие получить знания вне школьной программы ищут дополнительные сведения во всяческих источниках. Но частенько многие не находят нужную информацию. И поэтому тема сегодняшней статьи посвящается именно данной кислоте.
Определение
Соляная кислота является сильной одноосновной кислотой. В некоторых источниках ее могут называть хлоро- и хлористоводородной, а также хлористым водородом.
Физические свойства
Она представляет собой бесцветную и дымящуюся на воздухе едкую жидкость (фото справа). Однако техническая кислота из-за наличия в ней железа, хлора и других добавок имеет желтоватый цвет. Самая большая ее концентрация при температуре 20 о С равняется 38%. Плотность соляной кислоты с такими параметрам равна 1,19г/см 3 . Но это соединение в разной степени насыщенности имеет совершенно разные данные. При уменьшении концентрации происходит снижение числового значения молярности, вязкости и температуры плавления, однако повышается удельная теплоемкость и температура кипения. Затвердевание соляной кислоты любой концентрации дает различные кристаллогидраты.
Химические свойства
Все металлы, которые стоят до водорода в электрохимическом ряду их напряжения, могут взаимодействовать с этим соединением, образуя соли и выделяя газообразный водород. Если их заменить оксидами металлов, то продуктами реакции станут растворимая соль и вода. Такой же эффект будет и при взаимодействии соляной кислоты с гидроксидами. Если же к ней добавить любую соль металлов (например, карбонат натрия), остаток которой был взят из более слабой кислоты (угольной), то образуются хлорид этого металла (натрия), вода и газ, соответствующий кислотному остатку (в данном случае — углекислый).


Получение
Обсуждаемое сейчас соединение образуется, когда в воде растворяют газообразный хлороводород, который можно получить, сжигая водород в хлоре. Соляная кислота, которую получили при помощи такого способа, носит название синтетической. Также источником для добывания этого вещества могут служить абгазы. И такую соляную кислоту будут называть абгазной. В последнее время уровень производства соляной кислоты с помощью этого метода гораздо выше, чем ее получение синтетическим способом, хотя последний дает соединение в более чистом виде. Это все пути его добывания в промышленности. Однако в лабораториях соляную кислоту получают тремя способами (первые два отличаются только температурой и продуктами реакции) при помощи различных видов взаимодействия химических веществ, таких как:
- Воздействие насыщенной серной кислоты на хлорид натрия при температуре 150 о С.
- Взаимодействие приведенных выше веществ в условиях с температурой 550 о С и выше.
- Гидролиз хлоридов алюминия или магния.
Применение
Гидрометаллургия и гальванопластика не могут обойтись без использования соляной кислоты, где она нужна, чтобы очищать поверхность металлов при лужении и паянии и получать хлориды марганца, железа, цинка и других металлов. В пищевой промышленности это соединение знают как пищевую добавку E507 — там это регулятор кислотности, необходимый для того, чтобы изготовить сельтерскую (содовую) воду. Концентрированная соляная кислота также находится в желудочном соке любого человека и помогает переваривать пищу. Во время данного процесса ее степень насыщенности уменьшается, т.к. этот состав разбавляется едой. Однако при продолжительном голодании концентрация соляной кислоты в желудке понемногу увеличивается. А так как данное соединение очень едкое, это может привести к язве желудка.
Заключение
Соляная кислота может быть как полезной, так и вредной для человека. Ее попадание на кожу приводит к появлению сильных химических ожогов, а пары данного соединения раздражают дыхательные пути и глаза
Но если обращаться с этим веществом осторожно, оно может не раз пригодиться в
mr-build.ru
| Соляная кислота | |
|---|---|
 ( ({{{картинка3D}}}) | |
 ( ({{{изображение}}}) | |
| Общие | |
| Систематическое наименование | Хлороводородная кислота |
| Хим. формула | H2O:HCl |
| Рац. формула | HCl |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 36.46 г/моль |
| Плотность | 1.19 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | -30 °C |
| • кипения | 48 °C |
| Энтальпия | |
| • образования | -605.22 кДж/моль |
| Химические свойства | |
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | -10 |
| Растворимость | |
| • в воде | смешивается |
| Классификация | |
| Рег. номер CAS | 7647-01-0 |
| Рег. номер EINECS | 933-977-5 |
| екс Алиментариус | E507 |
| RTECS | MW4025000 |
| Безопасность | |
| NFPA 704 | |
ru-wiki.ru
Соляная кислота — Википедия. Что такое Соляная кислота
Соля́ная кислота́ (также хлороводоро́дная, хлористоводоро́дная кислота, хлористый водород[1]) — раствор хлороводорода (HCl) в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота — желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около ω=0,5%{\displaystyle \omega =0,5\%} присутствует в желудке человека, что соответствует pH=pω−lg(ρh3O/μHCl)≅0,86{\displaystyle pH=p\omega -lg(\rho _{H_{2}O}/\mu _{HCl})\cong 0,86}. Максимальная концентрация при 20 °C равна 38 % по массе, плотность такого раствора 1,19 г/см³. Соли соляной кислоты называются хлоридами.
Физические свойства
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
| Конц. (вес), кг HCl/кг | Конц. (г/л), кг HCl/м³ | Плотность, кг/л | Молярность M | Водородный показатель (pH) | Вязкость, мПа·с | Удельная теплоемкость, кДж/(кг·К) | Давление пара, Па | Температура кипения, °C | Температура плавления, °C |
| 10 % | 104,80 | 1,048 | 2,87 | −0,4578 | 1,16 | 3,47 | 0,527 | 103 | −18 |
| 20 % | 219,60 | 1,098 | 6,02 | −0,7796 | 1,37 | 2,99 | 27,3 | 108 | −59 |
| 30 % | 344,70 | 1,149 | 9,45 | −0,9754 | 1,70 | 2,60 | 1,410 | 90 | −52 |
| 32 % | 370,88 | 1,159 | 10,17 | −1,0073 | 1,80 | 2,55 | 3,130 | 84 | −43 |
| 34 % | 397,46 | 1,169 | 10,90 | −1,0374 | 1,90 | 2,50 | 6,733 | 71 | −36 |
| 36 % | 424,44 | 1,179 | 11,64 | −1,06595 | 1,99 | 2,46 | 14,100 | 61 | −30 |
| 38 % | 451,82 | 1,189 | 12,39 | −1,0931 | 2,10 | 2,43 | 28,000 | 48 | −26 |
При 20 °C, 1 атм (101 кПа)При затвердевании даёт кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O.
Химические свойства
- 2Na+2 HCl⟶2 NaCl+ h3↑{\displaystyle {\mathsf {2Na+2\ HCl\longrightarrow 2\ NaCl+\ H_{2}\uparrow }}}
- Mg+2 HCl⟶ MgCl2+ h3↑{\displaystyle {\mathsf {Mg+2\ HCl\longrightarrow \ MgCl_{2}+\ H_{2}\uparrow }}}
- 2Al+6 HCl⟶2 AlCl3+3 h3↑{\displaystyle {\mathsf {2Al+6\ HCl\longrightarrow 2\ AlCl_{3}+3\ H_{2}\uparrow }}}
- Na2O+2 HCl⟶2 NaCl+ h3O{\displaystyle {\mathsf {Na_{2}O+2\ HCl\longrightarrow 2\ NaCl+\ H_{2}O}}}
- MgO+2 HCl⟶ MgCl2+ h3O{\displaystyle {\mathsf {MgO+2\ HCl\longrightarrow \ MgCl_{2}+\ H_{2}O}}}
- Al2O3+6 HCl⟶2 AlCl3+3 h3O{\displaystyle {\mathsf {Al_{2}O_{3}+6\ HCl\longrightarrow 2\ AlCl_{3}+3\ H_{2}O}}}
- NaOH+ HCl⟶ NaCl+ h3O{\displaystyle {\mathsf {NaOH+\ HCl\longrightarrow \ NaCl+\ H_{2}O}}}
- Ba(OH)2+2 HCl⟶ BaCl2+2 h3O{\displaystyle {\mathsf {Ba(OH)_{2}+2\ HCl\longrightarrow \ BaCl_{2}+2\ H_{2}O}}}
- Al(OH)3+3 HCl⟶ AlCl3+3 h3O{\displaystyle {\mathsf {Al(OH)_{3}+3\ HCl\longrightarrow \ AlCl_{3}+3\ H_{2}O}}}
- Na2CO3+2 HCl⟶2 NaCl+ h3O+ CO2↑{\displaystyle {\mathsf {Na_{2}CO_{3}+2\ HCl\longrightarrow 2\ NaCl+\ H_{2}O+\ CO_{2}\uparrow }}}
- 2KMnO4+16 HCl⟶5 Cl2↑+2 MnCl2+2 KCl+8 h3O{\displaystyle {\mathsf {2KMnO_{4}+16\ HCl\longrightarrow 5\ Cl_{2}\uparrow +2\ MnCl_{2}+2\ KCl+8\ H_{2}O}}}
 Соляная кислота (в стакане) взаимодействует с аммиаком
Соляная кислота (в стакане) взаимодействует с аммиаком- Nh4+HCl⟶Nh5Cl{\displaystyle {\mathsf {NH_{3}+HCl\longrightarrow NH_{4}Cl}}}
- HCl+AgNO3→AgCl↓+HNO3{\displaystyle {\mathsf {HCl+AgNO_{3}\rightarrow AgCl{\downarrow }+HNO_{3}}}}
Получение
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
- NaCl+h3SO4→150oCNaHSO4+HCl{\displaystyle {\mathsf {NaCl+H_{2}SO_{4}{\xrightarrow[{}]{150^{o}C}}NaHSO_{4}+HCl}}}
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
- 2NaCl+h3SO4→550oCNa2SO4+2HCl{\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}{\xrightarrow[{}]{550^{o}C}}Na_{2}SO_{4}+2HCl}}}
Возможно получение путём гидролиза хлоридов магния, алюминия (нагревается гидратированная соль):
- MgCl2⋅6h3O→t,oCMgO+2HCl+5h3O{\displaystyle {\mathsf {MgCl_{2}\cdot 6H_{2}O{\xrightarrow[{}]{t,^{o}C}}MgO+2HCl+5H_{2}O}}}
- AlCl3⋅6h3O→t,oCAl(OH)3+3HCl+3h3O{\displaystyle {\mathsf {AlCl_{3}\cdot 6H_{2}O{\xrightarrow[{}]{t,^{o}C}}Al(OH)_{3}+3HCl+3H_{2}O}}}
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
- MgCl2+h3O→Mg2OCl2+HCl{\displaystyle {\mathsf {MgCl_{2}+H_{2}O{\xrightarrow[{}]{}}Mg_{2}OCl_{2}+HCl}}}[4]
Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов HCl, что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость HCl ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.
Применение
Промышленность
Медицина
- Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5 %, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
Особенности обращения

Высококонцентрированная соляная кислота — едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
В РФ оборот соляной кислоты концентрации 15 % и более — ограничен[5].
Примечания
Ссылки
wiki.sc
Раствор соляной кислоты: свойства и применение
Что представляет собой раствор соляной кислоты? Это – соединение воды (h3O) и хлороводорода (HCl), который является бесцветным термическим газом с характерным запахом. Хлориды отлично растворяются и распадаются на ионы. Соляная кислота является самым известным соединением, которое образует HCl, так что о нем и его особенностях можно рассказать в подробностях.

Описание
Раствор соляной кислоты относится к классу сильных. Он бесцветный, прозрачный и едкий. Хотя техническая соляная кислота имеет желтоватый цвет, обусловленный наличием примесей хлора, железа и прочих элементов. На воздухе «дымится».
Стоит отметить, что данное вещество присутствует и в организме каждого человека. В желудке, если быть точнее, в концентрации 0.5%. Интересно, что этого количества достаточно для полного разрушения бритвенного лезвия. Вещество разъест его всего за неделю.
В отличие от той же серной, кстати, масса соляной кислоты в растворе не превышает 38 %. Можно сказать, что данный показатель – «критическая» точка. Если начать увеличивать концентрацию, то вещество просто будет испаряться, вследствие чего хлороводород просто улетучится вместе с водой. Плюс ко всему, данная концентрация сохраняется лишь при 20 °C. Чем выше температура – тем быстрее протекает испарение.
Взаимодействие с металлами
Раствор соляной кислоты может вступать во многие реакции. В первую очередь с металлами, которые стоят до водорода в ряду электрохимических потенциалов. Это – последовательность, в которой элементы идут по мере увеличения такой свойственной им меры, как электрохимический потенциал (φ0). Данный показатель крайне важен в полуреакциях восстановления катиона. К тому же именно этот ряд демонстрирует активность металлов, проявляемую ими в окислительно-восстановительных реакциях.
Так вот, взаимодействие с ними происходит с выделением водорода в виде газа и с образованием соли. Вот пример реакции с натрием, мягким щелочным металлом: 2Na + 2HCl → 2NaCl +Н2↑.
С другими веществами взаимодействие протекает по похожим формулам. Так выглядит реакция с алюминием, легким металлом: 2Al + 6HCl → 2AlCl3 + 3Н2↑.
Реакции с оксидами
С данными веществами раствор кислоты соляной тоже прекрасно взаимодействует. Оксиды – это бинарные соединения элемента с кислородом, имеющие степень окисления, составляющую -2. Всем известными примерами являются песок, вода, ржавчина, красители, углекислый газ.
Соляная кислота взаимодействует не со всеми соединениями, а лишь с оксидами металлов. Вследствие реакции также образуется растворимая соль и вода. В качестве примера можно привести процесс, происходящий между кислотой и оксидом магния, щелочноземельного металла: MgO + 2HCl → MgCl2 + Н2О.
Реакции с гидроксидами
Так называются неорганические соединения, в составах которых присутствует гидроксильная группа –ОН, в которой атомы водорода и кислорода соединены ковалентной связью. И, поскольку раствор соляной кислоты взаимодействует лишь с гидроксидами металлов, стоит упомянуть, что некоторые из них называются щелочами.
Так что получающаяся в итоге реакция называется нейтрализацией. Ее результатом является образование слабо диссоциирующего вещества (то есть воды) и соли.
В качестве примера можно привести реакцию небольшого объема раствора соляной кислоты и гидроксида бария, мягкого щелочноземельного ковкого металла: Ва(ОН)2 + 2HCl = BaCl2 + 2Н2О.

Взаимодействие с другими веществами
Кроме перечисленного, соляная кислота может вступать в реакции и с соединениями иных типов. В частности, с:
- Солями металлов, которые образованы другими, более слабыми кислотами. Вот пример одной из таких реакций: Na2Co3 + 2HCl → 2NaCl +Н2О + СО2↑. Здесь показано взаимодействие с солью, образованной угольной кислотой (Н2СО3).
- Сильными окислителями. С диоксидом марганца, например. Или с перманганатом калия. Сопровождаются такие реакции выделением хлора. Вот один из примеров: 2KMnO4 +16HCl → 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2О.
- Аммиаком. Это – нитрид водорода с формулой NH3, представляющий собой бесцветный, но резко пахнущий газ. Следствие его реакции с раствором соляной кислоты – масса густого белого дыма, состоящего из мелких кристаллов хлорида аммония. Который, кстати, всем известен, как нашатырь (NH4Cl).Формула взаимодействия следующая: NH3 + HCl → NH4CL.
- Нитратом серебра – неорганическим соединением (AgNO3), являющимся солью азотной кислоты и металла серебра. Вследствие контакта с ним раствора соляной кислоты возникает качественная реакция – образование творожистого осадка хлорида серебра. Который не растворяется в азотной. Выглядит это так: HCL +AgNO3 → AgCl↓ + HNO3.
Получение вещества
Теперь можно поговорить о том, что делают для образования соляной кислоты.
Сначала, посредством сжигания в хлоре водорода, получают главный компонент – газообразный хлороводород. Который потом растворяют в воде. Результатом этой простой реакции становится образование синтетической кислоты.
Еще данное вещество можно получить из абгазов. Это – химические отходящие (побочные) газы. Они образуются при самых разных процессах. К примеру, при хлорировании углеводородов. Находящийся в их составе хлороводород называют абгазным. И кислоту, полученную таким образом, соответственно.
Следует отметить, что в последние годы доля абгазного вещества в общем объеме его производства увеличивается. А кислота, образованная вследствие сжигания в хлоре водорода, вытесняется. Однако справедливости ради нужно отметить, что в ней содержится меньше примесей.

Применение в быту
Во многих чистящих средствах, которыми люди, занимающиеся хозяйством, пользуются регулярно, присутствует определенная доля раствора соляной кислоты. 2-3 процента, а иногда и меньше, но он там есть. Именно поэтому, приводя сантехнику в порядок (вымывая кафель, например), нужно надевать перчатки. Высококислотные средства могут навредить коже.
Еще раствор используют в качестве пятновыводителя. Он помогает избавиться от чернил или ржавчины на одежде. Но чтобы эффект был заметен, надо использовать более концентрированное вещество. Подойдет раствор соляной кислоты в 10%. Он, к слову, превосходно выводит накипь.
Важно правильно хранить вещество. Содержать кислоту в стеклянных емкостях и в местах, куда не доберутся животные и дети. Даже слабый раствор, попавший на кожу или слизистую оболочку, может стать причиной химического ожога. Если это случилось, необходимо срочно промыть участки водой.
В области строительства
Использование соляной кислоты и ее растворов – это популярный способ улучшения множества строительных процессов. Например, ее нередко добавляют в бетонную смесь, чтобы увеличить морозостойкость. К тому же так она быстрее застывает, а стойкость кладки к влаге повышается.
Еще соляную кислоту используют, как очиститель от известняка. Ее 10-процентный раствор – лучший способ борьбы с грязью и следами на красном кирпиче. Для очистки других не рекомендуется его использовать. Структура других кирпичей более чувствительна к воздействию данного вещества.

В медицине
В данной сфере рассматриваемой вещество тоже активно применяется. Разбавленная соляная кислота оказывает следующие действия:
- Переваривает в желудке белки.
- Останавливает развитие злокачественных образований.
- Помогает в лечении онкологических заболеваний.
- Нормализует кислотно-щелочной баланс.
- Служит эффектным средством при профилактике гепатита, сахарного диабета, псориаза, экземы, ревматоидного артрита, желчнокаменной болезни, розовых угрей, астмы, крапивницы и многих других недугов.
В общем, полезный препарат. Если у человека понижена кислотность желудочного сока, то ему не помешает пропить курс медикаментов, в составе которых есть соляная кислота. Неплохим вариантом является «Орто Таурин Эрго». Он увеличивает уровень соляной кислоты в желудочной среде, помогает бороться с бактериями и паразитами.
В голову пришла идея разбавить кислоту и употреблять ее внутрь в таком виде, а не в составе медикаментов? Такое практикуется, но категорически запрещено делать это без врачебной консультации и получения инструкции. Неправильно рассчитав пропорции, можно проглотить избыток раствора соляной кислоты, и просто сжечь себе желудок.
Кстати, еще можно принимать медикаменты, стимулирующие выработку данного вещества. И не только химические. Тот же аир, перечная мята и полынь способствуют этому. Отвары на их основе можно сделать самому, и пропить для профилактики.

Ожоги и отравление
Каким бы эффективным ни было это средство, оно опасно. Соляная кислота, в зависимости от концентрации, может спровоцировать химические ожоги четырех степеней:
- Возникает лишь покраснение и боль.
- Появляются пузыри с прозрачной жидкостью и отек.
- Формируется некроз верхних слоев кожи. Пузыри заполняются кровью или мутным содержимым.
- Поражение достигает сухожилий и мышц.
Если вещество каким-то образом попало в глаза, надо промыть их водой, а потом содовым раствором. Но в любом случае первым делом надо вызвать скорую.
Попадание кислоты внутрь чревато острыми болями в груди и животе, отеком гортани, рвотными кровавыми массами. Как следствие – тяжелые патологии печени и почек.
А к первым признакам отравления парами относят сухой частый кашель, удушье, повреждение зубов, жжение в слизистых оболочках и боли в животе. Первая неотложная помощь – это умывание и полоскание полости рта водой, а также доступ к свежему воздуху. Настоящую помощь может оказать лишь токсиколог.
fb.ru
Хлороводородная кислота — это… Что такое Хлороводородная кислота?
- Хлороводородная кислота
-

Модель молекулы соляной кислоты
Соля́ная (или соляна́я) кислота (хлористоводоро́дная кислота) (Hydrochloric acid) — HCl, раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость (техническая соляная кислота желтоватая из-за примесей Fe, Cl2 и др.). Максимальная концентрация при 20 °C равна 38 % по массе, плотность такого раствора 1,19 г/см3. Слабые растворы соляной кислоты (до 0,4 %) имеют специфический терпко-кислый вкус, более концентрированные вызывают ожоги полости рта. Соли соляной кислоты называются хлоридами.
Физические свойства
Физические свойства растворов соляной кислоты разных концентраций приведены в таблице:
При 20 °C, 1 атм (101 kPa)Конц. (вес)
c : кг HCl/кгКонц. (г/л)
c : кг HCl/м³Плотность
ρ : кг/лМолярность
MpH Вязкость
η : мПа·сУдельная
теплоемкость
s : кДж/(кг·К)Давление
пара
PHCl : ПаТ
кипения
т.кип.Т
плавления
т.пл.10 % 104,80 1,048 2,87 M −0,5 1,16 3,47 0,527 103 °C −18 °C 20 % 219,60 1,098 6,02 M −0,8 1,37 2,99 27,3 108 °C −59 °C 30 % 344,70 1,149 9,45 M −1,0 1,70 2,60 1,410 90 °C −52 °C 32 % 370,88 1,159 10,17 M −1,0 1,80 2,55 3,130 84 °C −43 °C 34 % 397,46 1,169 10,90 M −1,0 1,90 2,50 6,733 71 °C −36 °C 36 % 424,44 1,179 11,64 M −1,1 1,99 2,46 14,100 61 °C −30 °C 38 % 451,82 1,189 12,39 M −1,1 2,10 2,43 28,000 48 °C −26 °C При затвердевании даёт кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O.
Химические свойства











Производство
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород может быть получен путём взаимодействия концентрированной серной кислоты на хлорид натрия, или сжиганием водорода в атмосфере хлора.
Применение
Промышленность
Медицина
- Составная часть желудочного сока; разведенную соляную кислоту ранее назначали внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сока.
Особенности обращения

Соляная кислота — едкое вещество, при попадании на кожу вызывает сильные ожоги. Особенно опасно попадание в глаза. При открывании сосудов с соляной кислотой в обычных условиях образуется туман и пары хлороводорода, которые раздражают слизистые оболочки и дыхательные пути.
Реагируя с такими веществами, как хлорная известь, диоксид марганца, или перманганат калия, образует токсичный газообразный хлор.
Ссылки
Wikimedia Foundation. 2010.
- Хлорофита
- Хлоруксусная кислота
Смотреть что такое «Хлороводородная кислота» в других словарях:
Хлороводородная кислота — (хлористоводородная кислота) то же, что соляная кислота … Российская энциклопедия по охране труда
ХЛОРОВОДОРОДНАЯ КИСЛОТА — то же, что (см.) … Большая политехническая энциклопедия
хлороводородная кислота — то же, что соляная кислота … Энциклопедический словарь
ХЛОРОВОДОРОДНАЯ КИСЛОТА — то же, что соляная кислота … Естествознание. Энциклопедический словарь
СОЛЯНАЯ КИСЛОТА — (хлороводородная кислота), р р хлороводорода в воде; сильная кислота. Бесцв., дымящая на воздухе жидкость (техн. С. к. желтоватая из за примесей Fe, Сl2 и др.). макс. концентрация (при 20 °С) 38% по массе, плотность такого р ра 1,19 г/см3.… … Естествознание. Энциклопедический словарь
соляная кислота — (хлороводородная кислота), раствор хлороводорода в воде; сильная кислота. Бесцветная, «дымящая» на воздухе жидкость (техническая соляная кислота желтоватая из за примесей Fe, Cl2 и др.). Максимальная концентрация (при 20°C) 38% по массе,… … Энциклопедический словарь
СОЛЯНАЯ КИСЛОТА — (хлороводородная кислота, хлористоводородная кислота) сильная одноосновная летучая кислота с резким запахом, водный раствор хлористого водорода; максимальная концентрация 38% по массе, плотность такого раствора 1,19 г/см3. Применяют в… … Российская энциклопедия по охране труда
Соляная кислота — – HCl (СК) (хлористоводородная кислота, хлороводородная кислота, хлористый водород) – это раствор хлороводорода (НСl) в воде, противоморозная добавка. Представляет собой бесцветную жидкость с резким запахом, без взвешенных частиц.… … Энциклопедия терминов, определений и пояснений строительных материалов
СОЛЯНАЯ КИСЛОТА — (хлористоводородная к та, хлороводородная к та), р р НС1 в воде бесцв. жидкость с резким запахом; рильная одноосновная кислота. Хлористый водород НС1 (мол. м. 36,461 ) бесцв. газ с резким запахом, во влажном воздухе сильно дымит; длина связи HЧС1 … Химическая энциклопедия
Список кислот и ангидридов — … Википедия
biograf.academic.ru
О соляной кислоте
Что такое соляная кислота ?
Соляная кислота – это прозрачная бесцветная или желтоватая жидкость без взвешенных или эмульгированных частиц

Соляная кислота представляет собой раствор газообразного хлористого водорода HCl в воде. Последний представляет собой гигроскопичный бесцветный газ с резким запахом. Обычно употребляемая концентрированная соляная кислота содержит 36 – 38% хлористого водорода и имеет плотность 1, 19 г/см3. Такая кислота дымит на воздухе, так как из неё выделяется газообразный HCl; при соединении с влагой воздуха образуются мельчайшие капельки соляной кислоты. Она является сильной кислотой и энергично взаимодействует с большинством металлов. Однако такие металлы, как золото,платина, серебро, вольфрам и свинец, соляной кислотой практически не травятся. Многие недрагоценные металлы, растворяясь в кислоте, образуют хлориды, например цинк:
Zn + 2HCl = ZnCl2 + H2
Чистая кислота бесцветна, а техническая имеет желтоватый оттенок, вызванный следами соединений железа, хлора и других элементов (FeCl3). Часто применяют разбавленную кислоту, содержащую 10% и меньше хлористого водорода. Разбавленные растворы не выделяют газообразного HClи не дымят ни в сухом, ни во влажном воздухе.
Применение соляной кислоты
Соляная кислота широко используется в промышленности при извлечении металлов из руд, травлении металлов и т. д. Также она используется при изготовлении паяльной жидкости, при осаждении серебра и как составная частьцарской водки.
Масштабы применения соляной кислоты в промышленности меньше, чем азотной. Связано это с тем, что соляная кислота вызывает коррозию стальной аппаратуры. К тому же летучие пары её довольно вредны и также вызывают коррозию металлических изделий. Это нужно учитывать при хранении соляной кислоты. Хранят и перевозят соляную кислоту в гуммированных цистернах и бочках, т.е. в сосудах, внутренняя поверхность которых покрыта кислотостойкой резиной, а также в стеклянных бутылях и полиэтиленовой посуде.
Соляная кислота применяется для получения хлоридов цинка, марганца, железа и других металлов, а также хлористого аммония. Соляную кислоту применяют для очистки поверхностей металлов, сосудов, скважин от карбонатов, окислов и других осадков и загрязнений. При этом используют специальные добавки — ингибиторы, которые защищают металл от растворения и коррозии, но не задерживают растворение окислов, карбонатов и других подобных соединений.
HCl применяется в промышленном производстве синтетических смол, каучуков. Используется как сырьё в производстве хлористого метила из метилового спирта, хлористого этила из этилена, хлорвинила из ацетилена.
Отравление соляной кислотой
HCl ядовит. Отравления происходят обычно туманом, образующимся при взаимодействии газа с водяными парами воздуха. HCl поглощается также на слизистых оболочках с образованием кислоты, вызывающей их сильное раздражение. При длительной работе в атмосфере HCl наблюдаются катары дыхательных путей, разрушение зубов, изъязвление слизистой оболочки носа, желудочно-кишечные расстройства. Допустимое содержание HCl в воздухе рабочих помещений не более 0, 005 мг/л. Для защиты используют противогаз, защитные очки, резиновые перчатки, обувь, фартук.
В то же время, наше пищеварение невозможно без соляной кислоты, её концентрация в желудочном соке достаточно высока. Если в организме кислотность понижена, то пищеварение нарушается, и врачи прописывают таким больным приём соляной кислоты перед началом еды.
Применение в быту соляной кислоты
Концентрированная «солянка» смешивается с водой в любой пропорции для бытовых нужд. Сильный раствор этой неорганической кислоты без труда очищает фаянсовую сантехнику от известкового налета и ржавчины, а более слабым можно убрать с тканей пятна ржавчины, чернил, ягодного сока.
Если приглядитесь, на средстве для чистки унитазов «Туалетный утенок» написано, что в состав сходит соляная кислота, поэтому работать с ним нужно в резиновых перчатках и беречь глаза от попадания в них брызг.
Кроме того, без этой кислоты немыслима жизнь ни одного человека – она содержится в желудке и именно благодаря ей пища, попавшая в желудок, растворяется (переваривается).
К тому же, эта кислота служит первым барьером от болезнетворных бактерий, попавших в желудок – они погибают в кислой среде.
Ну а людям, страдающим от гастрита с повышенной кислотностью, эта кислота тоже хорошо знакома. Они даже уменьшают ее действие, чтобы она не разрушала стенки желудка, с помощью специальных препаратов, которые взаимодействуют с ней и уменьшают ее концентрацию.
Самые популярные – это препараты, содержащие оксиды магния и алюминия, например, «Маалокс». Впрочем, есть и экстремальщики, которые пьют пищевую соду, хотя уже доказано, что это приводит лишь к временному облегчению.
xn--c1acbdje2abnav6d.xn--p1ai
свойства, получение, применение :: SYL.ru
В школе вы перешли к изучению такого класса неорганических соединений, как кислоты. Программа образования предусматривает запоминание учениками названий и формул шести представителей этой группы. И, просматривая предоставленную учебником таблицу, вы замечаете в списке кислот ту, которая стоит первой и заинтересовала вас в первую очередь, — соляную. Увы, на занятиях в школе ни свойства, ни любая другая информация о ней не изучается. Поэтому жаждущие получить знания вне школьной программы ищут дополнительные сведения во всяческих источниках. Но частенько многие не находят нужную информацию. И поэтому тема сегодняшней статьи посвящается именно данной кислоте.
Определение
Соляная кислота является сильной одноосновной кислотой. В некоторых источниках ее могут называть хлоро- и хлористоводородной, а также хлористым водородом.
 Физические свойства
Физические свойстваОна представляет собой бесцветную и дымящуюся на воздухе едкую жидкость (фото справа). Однако техническая кислота из-за наличия в ней железа, хлора и других добавок имеет желтоватый цвет. Самая большая ее концентрация при температуре 20оС равняется 38%. Плотность соляной кислоты с такими параметрам равна 1,19г/см3. Но это соединение в разной степени насыщенности имеет совершенно разные данные. При уменьшении концентрации происходит снижение числового значения молярности, вязкости и температуры плавления, однако повышается удельная теплоемкость и температура кипения. Затвердевание соляной кислоты любой концентрации дает различные кристаллогидраты.
Химические свойства
Все металлы, которые стоят до водорода в электрохимическом ряду их напряжения, могут взаимодействовать с этим соединением, образуя соли и выделяя газообразный водород. Если их заменить оксидами металлов, то продуктами реакции станут растворимая соль и вода. Такой же эффект будет и при взаимодействии соляной кислоты с гидроксидами. Если же к ней добавить любую соль металлов (например, карбонат натрия), остаток которой был взят из более слабой кислоты (угольной), то образуются хлорид этого металла (натрия), вода и газ, соответствующий кислотному остатку (в данном случае — углекислый).

Получение
Обсуждаемое сейчас соединение образуется, когда в воде растворяют газообразный хлороводород, который можно получить, сжигая водород в хлоре. Соляная кислота, которую получили при помощи такого способа, носит название синтетической. Также источником для добывания этого вещества могут служить абгазы. И такую соляную кислоту будут называть абгазной. В последнее время уровень производства соляной кислоты с помощью этого метода гораздо выше, чем ее получение синтетическим способом, хотя последний дает соединение в более чистом виде. Это все пути его добывания в промышленности. Однако в лабораториях соляную кислоту получают тремя способами (первые два отличаются только температурой и продуктами реакции) при помощи различных видов взаимодействия химических веществ, таких как:
- Воздействие насыщенной серной кислоты на хлорид натрия при температуре 150оС.
- Взаимодействие приведенных выше веществ в условиях с температурой 550оС и выше.
- Гидролиз хлоридов алюминия или магния.
 Применение
ПрименениеГидрометаллургия и гальванопластика не могут обойтись без использования соляной кислоты, где она нужна, чтобы очищать поверхность металлов при лужении и паянии и получать хлориды марганца, железа, цинка и других металлов. В пищевой промышленности это соединение знают как пищевую добавку E507 — там это регулятор кислотности, необходимый для того, чтобы изготовить сельтерскую (содовую) воду. Концентрированная соляная кислота также находится в желудочном соке любого человека и помогает переваривать пищу. Во время данного процесса ее степень насыщенности уменьшается, т.к. этот состав разбавляется едой. Однако при продолжительном голодании концентрация соляной кислоты в желудке понемногу увеличивается. А так как данное соединение очень едкое, это может привести к язве желудка.
Заключение
Соляная кислота может быть как полезной, так и вредной для человека. Ее попадание на кожу приводит к появлению сильных химических ожогов, а пары данного соединения раздражают дыхательные пути и глаза. Но если обращаться с этим веществом осторожно, оно может не раз пригодиться в деятельности человека.
www.syl.ru