Хлорноватистая кислота — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 29 апреля 2019; проверки требуют 3 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 29 апреля 2019; проверки требуют 3 правки.Хлорнова́тистая кислота́ — HClO, очень слабая одноосновная кислота, в которой хлор имеет степень окисления +1. Существует лишь в растворах.
В водных растворах хлорноватистая кислота частично распадается на катион H+{\displaystyle {\mathsf {H}}^{+}} и гипохлорит-анион ClO−{\displaystyle {\mathsf {ClO}}^{-}}
- HOCl⇄ ClO−+H+{\displaystyle {\mathsf {HOCl\rightleftarrows \ ClO^{-}+H^{+}}}}
Неустойчива, постепенно разлагается даже в разбавленных водных растворах на хлороводород и атомарный кислород[1], благодаря которому является сильным окислителем:
- HOCl→ HCl+O{\displaystyle {\mathsf {HOCl\rightarrow \ HCl+O}}}
Реагирует с соляной кислотой HCl, образуя газообразный хлор:
- HOCl+HCl→ h3O+Cl2{\displaystyle {\mathsf {HOCl+HCl\rightarrow \ H_{2}O+Cl_{2}}}}
Как и хлорноватистая кислота, её соли — гипохлориты — являются сильными окислителями. Многие из них неустойчивы. Кристаллогидрат LiClO⋅ h3O{\displaystyle {\mathsf {LiClO\cdot \ H_{2}O}}} выдерживает длительное хранение; NaClO⋅ h3O{\displaystyle {\mathsf {NaClO\cdot \ H_{2}O}}} при 70 °C разлагается со взрывом, а KClO известен только в виде водных растворов. Ca(ClO)2{\displaystyle {\mathsf {Ca(ClO)_{2}}}} в сухом виде вполне устойчив, но в присутствии h3O{\displaystyle {\mathsf {H_{2}O}}} и CO2{\displaystyle {\mathsf {CO_{2}}}} разлагается. Более стоек Mg(ClO)2{\displaystyle {\mathsf {Mg(ClO)_{2}}}}.
Хлорноватистая кислота получается при растворении хлора (реакция диспропорционирования) или оксида хлора(I) в воде.
- Cl2+h3O⟶ HClO+HCl{\displaystyle {\mathsf {Cl_{2}+H_{2}O\longrightarrow \ HClO+HCl}}}
- Cl2O+h3O⟶ 2HClO{\displaystyle {\mathsf {Cl_{2}O+H_{2}O\longrightarrow \ 2HClO}}}
В промышленном масштабе производятся гипохлориты кальция, натрия, калия, лития хлорированием известкового молока и соответствующих щелочей.
Хлорноватистая кислота и гипохлориты легко разлагаются с выделением атомарного кислорода и поэтому широко используются для отбелки целлюлозы и тканей, а также для санитарных целей.
- ↑ Н. В. Манкевич. Неорганическая химия. Весь школьный курс в таблицах. — 8-е. — Минск: «Букмастер» и «Кузьма», 2007. — С. 279. — 416 с.
Ответы@Mail.Ru: подскажите формулу соляной кислоты
Кислота соляная Химическая формула HCl Молекулярная масса (по международным атомным массам 1985 г. ) — 36,46 Соляная кислота (хлористоводородная кислота) (Hydrochloric acid) — раствор хлористого водорода в воде, сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость (техническая соляная кислота желтоватая из-за примесей Fe, Cl2 и др.) . Максимальная концентрация при 20°C равна 38 % по массе, плотность такого раствора 1,19 г/см3. Соли соляной кислоты называются хлоридами.Гидрокарбонат натрия — Википедия
| Гидрокарбонат натрия | |
|---|---|
 ( {{{картинка}}}) | |
 ( ({{{изображение}}}) | |
| Систематическое наименование | гидрокарбонат натрия |
| Традиционные названия | пищевая (питьевая) сода, сода двууглекислая, двууглекислый натрий, бикарбонат натрия, кислый углекислый натрий |
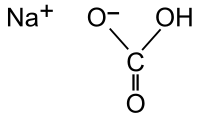
| Хим. формула | CHNaO3 |
| Рац. формула | NaHCO3 |
| Состояние | твёрдое |
| Молярная масса | 84,0066 г/моль |
| Плотность | 2,159 г/см³ |
| Температура | |
| • разложения | 60—200 °C |
| Растворимость | |
| • в воде | 9,59 г/100 мл |
| Рег. номер CAS | 144-55-8 |
| PubChem | 516892 |
| Рег. номер EINECS | 205-633-8 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E500(ii) |
| RTECS | VZ0950000 |
| ChEBI | 32139 |
| ChemSpider | 8609 |
| ЛД50 | 4220 мг/кг |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Гидрокарбона́т на́трия (лат. Natrii hydrocarbonas), другие названия: бикарбона́т на́трия, ча́йная со́да, питьева́я или пищева́я сода, двууглеки́слый натрий — неорганическое соединение, натриевая кислая соль угольной кислоты с химической формулой NaHCO3.
В обычном виде — мелкокристаллический порошок белого цвета.
Используется в промышленности, пищевой промышленности, в кулинарии, в медицине как нейтрализатор химических ожогов кожи и слизистых оболочек концентрированными кислотами и для снижения кислотности желудочного сока. Также применяется в буферных растворах.
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Проявляет все свойства соли сильного основания и слабой кислоты. В водных растворах имеет слабощелочную реакцию. В широком диапазоне концентраций в водном растворе pH раствора изменяется незначительно, на этом основано применение раствора вещества в качестве буферного раствора.
Реакция с кислотами[править | править код]
Гидрокарбонат натрия реагирует с кислотами с образованием соответствующей кислоте соли, например, хлорида натрия, сульфата натрия и угольной кислоты, которая в процессе реакции распадается на углекислый газ и воду, при этом углекислый газ выделяется из раствора в виде пузырьков:
- NaHCO3+HCl→NaCl+h3CO3,{\displaystyle {\mathsf {NaHCO_{3}+HCl\rightarrow NaCl+H_{2}CO_{3}}},}
- h3CO3→h3O+CO2↑,{\displaystyle {\mathsf {H_{2}CO_{3}\rightarrow H_{2}O+CO_{2}\uparrow }},}
- 2NaHCO3+h3SO4→Na2SO4+2h3O+2CO2↑.{\displaystyle {\mathsf {2NaHCO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2H_{2}O+2CO_{2}\uparrow }}.}
В быту обычно применяется реакция «гашения соды» уксусной кислотой, с образованием ацетата натрия или гашение лимонной кислотой с образование цитрата натрия, реакция с уксусной кислотой:
- NaHCO3+Ch4COOH→Ch4COONa+h3O+CO2↑.{\displaystyle {\mathsf {NaHCO_{3}+CH_{3}COOH\rightarrow CH_{3}COONa+H_{2}O+CO_{2}\uparrow }}.}
При температуре выше 60 °C гидрокарбонат натрия начинает распадаться на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C, при более высоких температурах карбонат натрия начинает распадаться на оксид натрия и углекислый газ):
- 2NaHCO3→60−200∘CNa2CO3+h3O+CO2↑.{\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow {60-200^{\circ }C}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}.}
При этом процессе выделения воды в виде водяного пара и углекислого газa масса исходного продукта уменьшается примерно на 37 %[источник не указан 435 дней].
В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом[1]. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции:
- Nh4+CO2+h3O→Nh5HCO3{\displaystyle {\mathsf {NH_{3}+CO_{2}+H_{2}O\rightarrow NH_{4}HCO_{3}}}}
- Nh5HCO3+NaCl→NaHCO3↓+Nh5Cl.{\displaystyle {\mathsf {NH_{4}HCO_{3}+NaCl\rightarrow NaHCO_{3}\downarrow +NH_{4}Cl}}.}
В холодной воде гидрокарбонат натрия мало растворим, и его отделяют от охлаждённого раствора фильтрованием, а из полученного после фильтрования раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь:
- 2Nh5Cl+Ca(OH)2→2Nh4↑+CaCl2+2h3O.{\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow 2NH_{3}\uparrow +CaCl_{2}+2H_{2}O}}.}
Двууглекислый натрий (бикарбонат) применяется в химической, пищевой, лёгкой, медицинской, фармацевтической промышленности, цветной металлургии, в быту. Зарегистрирован в качестве пищевой добавки E500 (ii), входит в состав пищевой добавки E500.
В химической промышленности[править | править код]
Применяется для производства красителей, пенопластов и других органических продуктов, фторорганических соединений, продуктов бытовой химии, наполнителей в огнетушителях, Реагент для отделения диоксида углерода, сероводорода из газовых смесей, например, отходящих газов топливосжигающих установок. В этом процессе углекислый газ поглощается раствором гидрокарбоната натрия при повышенном давлении и пониженной температуре, далее поглощённый углекислый газ выделяется из раствора при подогреве и снижении давления;
В лёгкой промышленности — в производстве резины для подошв обуви и в производстве искусственных кож, кожевенном производстве при дублении и нейтрализации кожи после кислого дубления, текстильной промышленности при отделке шёлковых и хлопчатобумажных тканей;
В пищевой промышленности — в хлебопечении, производстве кондитерских изделий, приготовлении газированных напитков.
В кулинарии[править | править код]

Основное применение пищевой соды в пищевой промышленности и в быту — кулинария, где применяется, преимущественно, в качестве основного или дополнительного разрыхлителя в составе кислого и пресного теста. При добавлении питьевой соды в кислое тесто происходит реакция с молочной кислотой, продуцированной при заквашивании дрожжевыми микроорганизмами, при этой реакции выделяется углекислый газ, вспучивающий тесто.
При добавлении в пресное тесто углекислый газ выделяется при выпечке из-за термического разложения.
При применении соды в чистом виде важно соблюсти правильную дозировку, так как она оставляет в продукте карбонат натрия, дающий определённый привкус. Порядок замешивания для теста: соду — в муку, кислые компоненты (уксус, кефир и пр.) — в жидкость.
В медицине[править | править код]
Традиционно раствор питьевой соды используется для дезинфекции зубов и дёсен при зубных болях[2] и полости рта и горла, при сильном кашле, ангине, фарингите[3], а также как общепринятое средство от изжоги и болей в желудке.
Применяется при заболеваниях, сопровождающиеся выраженным ацидозом (при диабете, инфекциях и др), для борьбы с ацидозом при хирургических вмешательствах (назначается 3-5 г. внутрь)[4].
Применяется в качестве антиаритмического средства[4].
Как антацидное средство (как и все другие щелочи) применяется при язвенной болезни желудка, и двенадцатиперстной кишки, при повышенной кислотности желудочного сока[4].
Имеются так же данные о применении препарата (в виде капельных и внутривенных вливаний) при гипертонической болезни, симптоматической почечной гипертонии[5], и хронической почечной недостаточности[6]. Эффект связан с увеличением выделения ионов натрия и хлора и возрастанием осмотического диуреза[4].
В виде свечей применяется против укачивания при морской и воздушной болезнях[4]
Применяется в качестве отхаркивающего средства, т.к. повышая щелочные резервы крови, сдвигает в щелочную сторону реакцию бронхиальной слизи, делая мокроту менее вязкой[4].
При ринитах, конъюнктивитах, стоматитах, ларингитах и т.п. применяют для полосканий, промываний, ингаляций 0,5 — 2% р-ры гидрокарбоната натрия[4].
Применяется внутривенно с целью быстрого устранения метаболического ацидоза во время реанимационных мероприятий, заболеваниях почек[4].
Нужно иметь ввиду, что в результате применения может возникнуть т.н. кислотный рикошет (при реакции содой с соляной кислотой происходит выделение CO2, который оказывает раздражающее действие на стенку желудка, усиливая выделение гастрина[4]).
В альтернативной медицине питьевая сода иногда заявляется как «лекарство» от рака, однако, никакой экспериментально подтверждённой эффективности применения такого «лечения» не существует[7].
Противопоказания к применению в медицинских целях[править | править код]
Индивидуальная гиперчувствительность; состояния, сопровождающиеся развитием алкалоза; гипокальциемия, при приеме внутрь усиливает алкалоз и повышает риск развития тетанических судорог, гипохлоремия — снижение концентрации в крови ионов Cl—, в том числе вызванная рвотой, или снижением всасывания в желудочно-кишечном тракте, может привести к тяжёлому алкалозу.
Является источником натрия, тем самым увеличивая объём циркулирующей крови, усугубляя отёки и повышая артериальное давление. Применение при сниженной скорости клубочковой фильтрации может привести к метаболическому алкалозу.
Пожаротушение[править | править код]
Гидрокарбонат натрия вместе с карбонатом аммония используется в качестве наполнителя в огнетушителях с сухим наполнением и в стационарных системах сухого пожаротушения. Это применение обусловлено тем, что от воздействия высокой температуры в очаге горения вещество выделяет углекислый газ, атмосфера которого затрудняет доступ кислорода воздуха в очаг горения.
В быту[править | править код]
Применяется как безопасное для здоровья средство для чистки поверхностей столовой и кухонной посуды, поверхностей кухонных столов, иных поверхностей, соприкасающихся с пищей, путем протирки их с помощью влажной тряпки с сухим порошком питьевой соды.
В транспорте[править | править код]
Применяется для нейтрализации следов электролита — серной кислоты на поверхности пластмассовых корпусов свинцовых аккумуляторов насыщенным водным раствором питьевой соды.
В Российской Федерации двууглекислый натрий выпускается в соответствии с требованиями[8] и техническими условиями[9], выпускается на предприятиях АО «Башкирская содовая компания» в г. Стерлитамак, Республика Башкортостан, а также на Крымском содовом заводе в г. Красноперекопск, Крымский полуостров[10].
Гидрокарбонат натрия хранят в закрытых упаковках, в сухом месте вдали от источников огня. Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления. Срок годности не ограничен.
Вещество нетоксично, пожаро- и взрывобезопасно.
Имеет солоноватый, мыльный вкус. При попадании пыли вещества на слизистые оболочки глаз и носа вызывает лёгкое раздражение. При частой работе в атмосфере, загрязнённой пылью двууглекислого натрия, может возникнуть раздражение верхних дыхательных путей. Предельно допустимая концентрация пыли бикарбоната натрия в воздухе производственных помещений 5 мг/м3[11].
- ↑ Глинка Н. Л. Общая химия. — М.: «Химия», 1977, переработанное. — С. 441. — 720 с.
- ↑ Полоскание при зубной боли — рекомендации » Аденто.ру
- ↑ Полоскание рта содой как средство от воспалений
- ↑ 1 2 3 4 5 6 7 8 9 Машковский М.Д. Лекарственные средства (пособие по фармокотерапии для врачей). — Медицина, 1998. — С. 112. — 688 с.
- ↑ Шульцев Г.П., Захарченко В.Н., Барицкий В.Н. и др. К применению гидрокарбоната натрия при гипертонической болезни и почечных гипертониях.. — Киев: Клиническая медицина №10, 1974. — С. 134-138.
- ↑ Рябов С.И. Современные методы лечения хронической почечной недостаточности.. — Киев: Клиническая медицина №10, 1974. — С. 134-138.
- ↑ Sodium Bicarbonate (копия Archive.org) // American Cancer Society, 11/28/2008 (англ.): «Available peer-reviewed medical journals do not support claims that sodium bicarbonate works as a cancer treatment.»
- ↑ ГОСТ 2156-76 «Натрий двууглекислый. Технические условия» и ГОСТ 32802-2014
- ↑ «Добавки пищевые. Натрия карбонаты Е500. Общие технические условия» на предприятии «Сода»
- ↑ Данный объект расположен на территории Крымского полуострова, бо́льшая часть которого является объектом территориальных разногласий между Россией, контролирующей спорную территорию, и Украиной, в пределах признанных международным сообществом границ которой спорная территория находится. Согласно федеративному устройству России, на спорной территории Крыма располагаются субъекты Российской Федерации — Республика Крым и город федерального значения Севастополь. Согласно административному делению Украины, на спорной территории Крыма располагаются регионы Украины — Автономная Республика Крым и город со специальным статусом Севастополь.
- ↑ ГОСТ 2156-76 «Натрий двууглекислый. Технические условия» Архивная копия от 13 января 2010 на Wayback Machine
- ГОСТ 2156-76. Натрий двууглекислый. Технические условия (с Изменениями № 1, 2, 3, 4).
- ГОСТ 32802-2014. Добавки пищевые. Натрия карбонаты E500. Общие технические условия.