2. Схема N 2. Производство патоки с гидролизом крахмала соляной кислотой и очисткой сиропов активированным углем
2. Схема N 2. Производство патоки с гидролизом крахмала соляной кислотой и очисткой сиропов активированным углем.
┌──────────────────┐
│Крахмальное молоко│
└────────┬─────────┘
\/
┌────────────────┐ ┌──────────────────┐
│Соляная кислота ├──────>│ Отмеривание │
└────────────────┘ └────────┬─────────┘
\/
┌────────────────┐ ┌──────────────────┐
┌─────>│Отмеривание воды├──────>│ Осахаривание │
│ │ или промоев │ └────────┬─────────┘
│ └────────────────┘ \/
│ ┌──────────────────┐ ┌──────────────┐
│ │ Нейтрализация │<──────┤ Раствор соды │
│ ┌────────┐ ┌────────┐ └────────┬─────────┘ └──────────────┘
│ │Промои с│ │Жиробел-│ \/
│ │салфето-│ │ковая │<─┐┌──────────────────┐
│ │мойки │ │грязь │ └┤ Жировыделение │
│ └───┬────┘ └────────┘ └───┬────┬─────────┘
│ │ ┌────────────────┘ \/
│П \/ \/ ┌──────────────────┐ ┌──────────────┐
│р ┌────────────────┐ │ Механическая │<──────┤ Диатомит │
│о │ Смешивание │<──────┤ фильтрация │ └──────────────┘
│м └──────────────┬─┘ └────────┬─────────┘
│о \/ \/
│и ┌────────┐ ┌────────┐ ┌──────────────────┐ ┌──────────────┐
│ │Промытая│ │Механи- │ │ Обесцвечивание │<──────┤Свежий активи-│
│ │ грязь │<─┤ческая │ │ жидкого сиропа │ │рованный уголь│
│ │(в завод│ │фильтра-│ └────────┬─────────┘ └──────────────┘
│ │кормов) │ │ция │ \/
│ └────────┘ └─┬──────┘ ┌──────────────────┐
│ │ │ Механическая │
│ │ ┌───────┤ фильтрация │
│ \/ \/ └────────┬─────────┘
│ ┌──────────────────┐ \/
│ │ Обесцвечивание │ ┌──────────────────┐
│ │отработанным углем│<─┐ │ Выпаривание │
│ └───────┬──────────┘ │ └────────┬─────────┘
│ \/ │ \/
│ ┌────────────────┐ │ ┌───────────────────┐
└──────┤ Механическая │ └──┤Первое обесцвечива-│<─┐
│ фильтрация │ │ние густого сиропа │ │ ┌──────────────┐
└───────┬────────┘ └────────┬──────────┘ │ │Отработанный │
\/ \/ │<──┤активизирован-│
┌────────────────┐ ┌──────────────────┐ │ │ный уголь │
│ Промытая грязь │ │ Механическая │ │ └──────────────┘
│(в канализацию) │ │ фильтрация │ │
└────────────────┘ └────────┬─────────┘ │
\/ │
┌───────────────────┐ │ ┌──────────────┐
│Второе обесцвечива-│ └<──┤Свежий активи-│
│ние густого сиропа │ │рованный уголь│
└────────┬──────────┘ └──────────────┘
\/
┌──────────────────┐
│ Механическая │
│ фильтрация │
└────────┬─────────┘
\/
┌──────────────────┐
│ Механическая │
│ фильтрация │
│ (контрольная) │
└────────┬─────────┘
\/
┌──────────────────┐
│ Уваривание │
└────────┬─────────┘
\/
┌──────────────────┐
│ Охлаждение │
└────────┬─────────┘
\/
┌──────────────────┐
│ Слив патоки │
Схема N 2
Осахаривание крахмала проводится соляной кислотой в конверторах или аппаратах непрерывного действия. Нейтрализуют осахаренный сироп раствором соды и фильтруют с диатомитом. Отфильтрованный жидкий сироп обрабатывают активным углем (норитом), отфильтровывают и направляют на выпарку для уваривания. Густой сироп дважды обрабатывают активным углем, подвергают контрольной фильтрации и после этого уваривают до плотности патоки.
Нейтрализуют осахаренный сироп раствором соды и фильтруют с диатомитом. Отфильтрованный жидкий сироп обрабатывают активным углем (норитом), отфильтровывают и направляют на выпарку для уваривания. Густой сироп дважды обрабатывают активным углем, подвергают контрольной фильтрации и после этого уваривают до плотности патоки.
ácido clorhídrico — Traducción al ruso — ejemplos español
Su búsqueda puede llevar a ejemplos con expresiones vulgares.
Su búsqueda puede llevar a ejemplos con expresiones coloquiales.
El ácido clorhídrico la convertirá en queso suizo.
Tengo ácido clorhídrico en el pelo, pero aparte de eso, estoy bien.
Sabe a canela, avellana y una pizca de ácido clorhídrico.
Tome un montón de detergente y un poco de ácido clorhídrico.
Uno de los secuestrados, Trevor Burkett, escapó o fue liberado después de ser obligado a tomar ácido clorhídrico.
Один из похищенных, Тревор Бёркет, сбежал или был освобожден после того, как его заставили выпить соляную кислоту.
Debe haber alguna explicación de brujo para ello, pero básicamente Damon está bebiendo
Desconocido para ella, la caja también contiene Una pequeña cantidad de amoniaco y ácido clorhídrico.
He analizado una muestra de tejido, y había restos de ácido clorhídrico.
Incluido tú diluyendo el ácido clorhídrico.
El ácido clorhídrico de su estómago… es diez veces más fuerte que el nuestro.
La envejecieron artificialmente… usando ácido clorhídrico y lana de acero… que dejó pequeñas partículas oxidadas.
Затем искусственно состарен, с помощью соляной кислоты и металлической стружки, которая оставила маленькие частицы ржавчины.
Según el médico, usaron ácido clorhídrico.
Sin embargo, una empresa había aprovechado el cloro producido para fabricar
No obstante, en 1995, el Perú notificó un aumento del 40% de las incautaciones de ácido clorhídrico respecto de los años anteriores.
Однако в 1995 году Перу сообщила об увеличении на 40 процентов по сравнению с предыдущими годами объема изъятий соляной кислоты.
El ácido clorhídrico se neutraliza mediante la adición de sosa cáustica durante el enfriamiento inicial del gas de proceso o se puede extraer en forma de ácido para ser reutilizado.
Quiero tratar con ácido clorhídrico.
Eso es ácido clorhídrico.
Esto es ácido clorhídrico.
Para empezar, ácido clorhídrico, que disuelve ciertos barros presentes en los pozos.
Bueno, sin ninguna duda obtendrás ácido clorhídrico, etilenglicol, biocidas y combustibles diésel.
Соляно — кислотные обработки скважин — Что такое Соляно — кислотные обработки скважин
Кислотные обработки скважин предназначены для очистки забоев, призабойной зоны, НКТ от солевых, парафинисто-смолистых отложений и продукт
Кислотные обработки скважин предназначены для очистки забоев, призабойной зоны, НКТ от солевых, парафинисто-смолистых отложений и продуктов коррозии при освоении скважины с целью их запуска, а так же для увеличения проницаемости пород. Под воздействием соляной кислоты в породах ПЗС образуются пустоты, каверны, каналы разъедания, вследствие чего увеличивается проницаемость пород, а следовательно и производительность нефтяных (газовых) и приемистость нагнетательных скважин.
Различают следующие разновидности кислотных обработок:
Кислотные ванны предназначены для очистки поверхности открытого забоя и стенок скважины от цементной и глинистой корок, смолистых веществ, продуктов коррозии, кальциевых отложений от пластовых вод и освобождения прихваченного пробкой подземного оборудования. Объем рабочего раствора, при кислотной ванне, составляет не более объема ствола (колонны) в заданном интервале, закачивают его до забоя, не продавливая в пласт. Раствор кислоты выдерживают в интервале обработки 16 — 24 ч. Затем отреагировавшую кислоту вместе с продуктами реакции удаляют из скважины обратной промывкой. В качестве промывочной жидкости используют воду.
Объем рабочего раствора, при кислотной ванне, составляет не более объема ствола (колонны) в заданном интервале, закачивают его до забоя, не продавливая в пласт. Раствор кислоты выдерживают в интервале обработки 16 — 24 ч. Затем отреагировавшую кислоту вместе с продуктами реакции удаляют из скважины обратной промывкой. В качестве промывочной жидкости используют воду.
Простая кислотная обработка предназначена для воздействия на породы ПЗС с целью увеличения их проницаемости. Процесс ведется с обязательным задавливанием кислоты в пласт. Вначале закачивают нефть или воду, затем при открытом затрубном пространстве — расчетное количество приготовленного рабочего раствора соляной кислоты. При этом объем первой порции кислоты рассчитывают так, чтобы она заполнила трубы и кольцевое пространство от башмака до кровли пласта. После этого закрывают задвижку на затрубном пространстве скважины и под давлением закачивают в скважину остатки кислотного раствора. Кислота начинает проникать в пласт. Оставшуюся в трубах и в фильтровой части скважины кислоту продавливают в пласт нефтью или водой.
Оставшуюся в трубах и в фильтровой части скважины кислоту продавливают в пласт нефтью или водой.
Кислотная обработка под давлением применяют с целью продавки кислоты в малопроницаемые интервалы продуктивного пласта. Проводят с применением пакера.
При открытой задвижке затрубного пространства скважины и непосаженом пакере в скважину закачивают кислотный состав в объеме труб и подпакерного пространства, после чего пакером герметизируют затрубное пространство и закачивают кислоту в объеме спущенных труб с максимальным повышением темпа закачки. Затем, не снижая давления, вслед за кислотой прокачивают расчетный объем продавочной жидкости и закрывают задвижку. Скважину оставляют в покое до полного спада или стабилизации давления.
Пенокислотные обработки применяют при значительной толщине пласта и низких пластовых давлениях. В призабойную зону скважины вводя аэрированный раствор кислоты и ПАВ в виде пены. При таких обработках используют кислотный агрегат, компрессор и аэратор. Пенокислотная обработка имеет следующие преимущества:
Пенокислотная обработка имеет следующие преимущества:
Ø Кислотная пена медленнее растворяет карбонатный материал, что способствует более глубокому проникновению активной кислоты в пласт.
Ø Кислотная пена обладает меньшей плотностью и повышенной вязкостью, что позволяет увеличить охват воздействием всей продуктивной толщины пласта.
Ø Содержание в пене ПАВ снижает поверхностное натяжение кислоты на границе с нефтью, а сжатый воздух, находящийся в пене, расширяется во много раз при понижении давления после обработки; все это в совокупности способствует улучшению условий притока нефти в скважину и значительно облегчает ее освоение.
Многократные обработки заключаются в том, что ПЗС обрабатывают несколько раз с интервалами между обработками в 5 — 10 суток с целью вывода скважины на максимальную производительность за короткий срок.
Поинтервальные (ступенчатые) обработки нескольких интервалов пласта значительной толщины с целью полного охвата пласта или отдельных продуктивных пропластков.
После обработки первого интервала и кратковременной его эксплуатации, принудительно-направленным способом воздействует интервал, пока полностью не будет охвачена вся толщина пласта. Проводить ступенчатые обработки целесообразно в скважинах после выхода их из бурения или в начальный период эксплуатации.
Термохимические обработки — обработки скважин горячей соляной кислотой, с магнием в специальном наконечнике, спущенном на НКТ в пределы интервала, намеченного под обработку. Применяют для очистки ПЗС от асфальто-смолистых, парафиновых и других материалов.
Термокислотные обработки — комбинированный процесс, в первой фазе которого осуществляется термохимическая обработка, во второй (без перерыва во времени) — обычная, простая СКУ. Наполненный магнием наконечник спускают на трубах в скважину и устанавливают в зоне обрабатываемого интервала пласта. Затем закачивают нефть и вслед за ней, без перерыва, 15% раствор соляной кислоты. Скорость прокачки кислоты должна быть такой, чтобы в течение всего процесса на выходе наконечника была одинаковая запланированная температура и постоянная кислотность раствора. Для загрузки наконечника используют магний в виде стружек или брусков квадратного или круглого сечения.
Скорость прокачки кислоты должна быть такой, чтобы в течение всего процесса на выходе наконечника была одинаковая запланированная температура и постоянная кислотность раствора. Для загрузки наконечника используют магний в виде стружек или брусков квадратного или круглого сечения.
Формула соляной кислоты в химии
Определение и формула соляной кислоты
Формула –
Молярная масса равна г/моль.
Физические свойства – бесцветная едкая жидкость, на воздухе «дымит».
Техническая соляная кислота имеет желтый цвет из-за наличия примесей железа, хлора и других веществ .
Максимальная концентрация в растворе при равна 38%, плотность этого раствора г/см. Молярная масса г/моль.
Соляная кислота – сильная одноосновная кислота, константа диссоциации . Образует соли – хлориды.
Химические свойства соляной кислоты
- Взаимодействует с металлами, находящимися в электрохимическом ряду напряжений до водорода с образованием соответствующих хлоридов и выделением водорода:
- Взаимодействует с оксидами металлов с образованием растворимых солей и воды:
- Взаимодействует с гидроксидами металлов с образованием растворимых хлоридов и воды:
- Взаимодействует с солями металлов, образованных более слабыми кислотами:
- Реагирует с сильными окислителями (перманганатом калия, диоксидом марганца) с выделением хлора:
- Реагирует с аммиаком с образованием густого белого дыма, состоящего из мельчайших кристалликов хлорида аммония:
Качественной реакцией на соляную кислоту и её соли является реакция с нитратом серебра, в результате которой образуется белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте:
Получают соляную кислоту растворением газообразного хлороводорода в воде.
Применение
Соляная кислота применяется в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при паянии и лужении, для получения хлоридов металлов (цинка, марганца, железа и др.). Смеси соляной кислоты с ПАВ используются для очистки керамических и металлических изделий от загрязнений и дезинфекции.
В пищевой промышленности соляная кислота используется в качестве регулятора кислотности , пищевой добавки . Является естественной составной частью желудочного сока человека.
Концентрированная соляная кислота – едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание кислоты в глаза. Для нейтрализации ожогов применяют раствор слабой щёлочи (питьевой соды).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Кислота соляная ингибированная, каталог ПАО Химпром
Синонимы: кислота хлористоводородная, кислота хлороводородная.
Эмпирическая формула: HCI
Кислота соляная ингибированная выпускается пяти марок: А, Б, В, Г и Д
Технические характеристики кислоты соляной ингибированной:
Примечания
-
Показатели 4, 8, 9, 11, 12 определяют по требованию потребителя.
-
За отсутствие считать содержание массовой доли летучих хлорорганических соединений ниже 1 млн-1 (ррm), т.е. меньше нижней границы определения по методике ФР.1.31.2016.22307.
-
В кислоте соляной ингибированной марок А, Б, В, Г, Д отсутствуют соли четвертичных аммониевых соединений, способных разлагаться с образованием хлорорганических соединений.
- Для показателя 9 при выдерживании товарной формы при температуре минус 50 ºС не менее суток не допускается появления в объеме расслоения или осадка, допускается помутнение.

Условия хранения: продукт хранят в герметичных резервуарах, изготовленных из материалов, стойких к соляной кислоте (стальные гумированные или эмалированные внутри, а также футерованные графитопластовой или диабадовой плиткой по подслою гуммировки) в крытых помещениях, хорошо вентилируемых или под навесом, защищенным от попадания атмосферных осадков и прямых солнечных лучей.
Гарантийный срок хранения: марки А, Б, В, Г — в металлической таре — 2 месяца, в полиэтиленовой таре — 6 месяцев со дня изготовления. Марки Д – 1 год со дня изготовления при хранении продукта в полиэтиленовой или неметаллической таре, или при исключении контакта с металлами во время хранения.
Упаковка: контейнеры кубовые среднетоннажные с металлическим поддоном. Допускается использовать другую тару, обеспечивающую сохранность груза при хранении и транспортировке; специализированные гуммированные ж/д цистерны.
Транспортирование: железнодорожным и автомобильным транспортом.
Номер чертежа знака опасности по ГОСТ 19433: 8.
Классификационный шифр группы опасных грузов: по ГОСТ 19433 — 8113, при перевозке по железной дороге — 8012.
Области применения соляной кислоты
Когда мы слышим о соляной кислоте, возникает ассоциация с областью ее применения в химии или медицине. Но не все знают, что она присутствует в составе многих чистящих средств или спиртовой продукции в качестве добавки Е507. С ее помощью легко можно менять характеристики бетона или восстанавливать процесс пищеварения. Многие даже не догадываются насколько широко на сегодняшний день применение соляной кислоты. Разберем подробно ее полезные свойства в разных сферах деятельности.
- Промышленность. В металлургии соляная кислота необходима при процессе зачистки металла после лужения и пайки. В пищевой промышленности она используется как регулятор кислотности.
 Вы даже можете встретить ее в составе содовой.
Вы даже можете встретить ее в составе содовой. - Домохозяйство. Как было сказано ранее, соляная кислота нужна для получения качественных и эффективных чистящих средств. Особое внимание обратите на то, что в этом случае необходимо соблюдать меры безопасности и работать с ней обязательно в резиновых перчатках. К сожалению, кислота наносит сильные ожоги на кожу.
- Медицина. Вы можете с помощью нее вылечить папилломы или улучшить пищеварение при пониженной кислотности.
- Строительство. Соляная кислота отлично очищает красный кирпич от грязи, а бетонная смесь благодаря ей повышает свою морозостойкость, становится более устойчивой к влаге и в разы быстрее застывает.
Применение данного раствора полезно в любой области, главное соблюдать правила безопасности во время ее использования.
Хранение и транспортировка
Все химикаты опасные для окружающей среды в чистом виде доставляются на объект в специализированных контейнерах, которые исключают утечку раствора. Люки и пробки обязательно должны быть герметичными, чтобы предотвратить контакт соляной кислоты с различными металлами.
Люки и пробки обязательно должны быть герметичными, чтобы предотвратить контакт соляной кислоты с различными металлами.
Вы вряд ли встретите где-либо розничную закупку данного химиката, обычно его поставляют оптом. Купить качественную соляную кислоту, которая отвечает всем нормам и требованиям Вы можете в компании «Еврохиминвест». Клиентам предлагаются только выгодные условия сотрудничества. Компания работает без посредников, поэтому возможность брака или ошибок в заказе полностью исключена. Доставка осуществляется собственным автотранспортом с учетом класса опасности груза. Доверяйте серьезные дела надежным профессионалам, которые сделают свою работу максимально ответственно и аккуратно.
Интересные факты
- Желудок человека вырабатывает агрессивную соляную кислоту, которой под силу растворить бритвенное лезвие за неделю.
- Соляная кислота убивает болезнетворные бактерии, тем самым сохраняя наш организм в тонусе.
- Мы каждый день обновляем пострадавшую поверхность желудка от соляной кислоты в желудочном соке, даже не подозревая об этом.

- В человеке есть жидкость, а именно соляная кислота, которую запрещено проносить на борт самолета. К сожалению, мы не можем ее отделить, поэтому авиакомпании все же допускают людей к полету.
Повторимся, что раствор хлористого водорода может нанести существенный вред организму и имеет второй класс опасности. Поэтому никогда не забывайте про защитные элементы одежды во избежание появлений ожогов на теле.
Причина большинства заболеваний
ПРИЧИНА БОЛЬШИНСТВА ЗАБОЛЕВАНИЙ
От чего зависит состояние нашей иммунной системы?
Наличие или отсутствие дефицитных состояний — витаминов, белков, минералов и даже гормонов?
Наличие или отсутствие аутоиммуных заболеваний (НЯК, болезнь Крона, астма, псориаз, ревматоидный артрит, сахарный диабет 1 типа),
аллергий, дерматитов, нейродермитов, высыпаний на коже, акне?
Бактериальные инфекции (хеликтобактер, кандидоз, стафилококк и тд. )?
)?
Заболевания ЖКТ, сердечно-сосудистой, дыхательной и мочевыделительных систем?
К сожалению, людей без проблем в какой-либо области практически не встречается. В лучшем случае проблема носит скрытый характер. И основа здоровья — состояние ЖКТ. И первое с чего стоит начать — это нормализация его работы.
Большинство людей гастрит не считают чем-то серьезным и опасным.
А между тем:
— От качества обработки пищи в желудке зависит как она будет усвоена
— Отсюда берут начало различные формы желудочно-кишечных расстройств
— От концентрации соляной кислоты зависит уровень антибактериальной и противопаразитарной защиты
— Соляная кислота способствует переходу пищи из желудка в двенадцатиперстную кишку
— Участвует в регуляции секреции двенадцатиперстной кишки и поджелудочной железы⠀⠀
Делится гастрит на 2 основные категории — гиперацидные и гипоацидные.
Людей, у которых присутствует тот или иной тип отклонений очень много.
ГИПЕРАЦИДНЫЕ ГАСТРИТЫ — характерна повышенная кислотность.
• Слишком кислое содержимое желудка переходит из желудка в двенадцатиперстную кишку
• Спазм привратниковой части желудка, боль
• Спаз верхнего отдела тонкого кишечника
• Отток секретов печени и поджелудочной железы
• Пища не получает полноценной обработки желчью и соком поджелудочной железы,
• Кислота раздражает слизистую толстого кишечника
• Частые и обильные поносы
• Стенки толстого кишечника испытывают химический ожог
• Поносы сменяются запорами.
Симптомы гиперацидного гастрита:
— боли/дискомфорт в эпигастрии
— изжоги
— ощущение дискомфорта при длительных перерывах между приемами пищи
— неприязнь к кислому
— отрыжка кислым
— быстрый процесс пищеварения
ГИПОАЦИДНЫЕ ГАСТРИТЫ — характерна пониженная кислотность.
• Из-за отсутствия соляной кислоты нет антибактериального действия желудочного сока
• Не уничтожаются бактерии и микробы, попадая в кишечник
• Там они получают благоприятные условия для размножения
• Ослабляется перистальтика толстого кишечника
• Запор
• Процессы гниения и брожения
• Колиты, энтероколиты, геморрой
• Размножение гнилостной микрофлоры (кандида, стафилококк, хеликобактер и тд.)
• Возможно появление в дальнейшем различного рода опухолей, вплоть до злокачественных!!!
Симптомы гипоацидных гастритов:
— Отрыжка тухлым
— Запоры, геморрой
— Анемия, гиповитаминозы
— Вздутие, газообразование
— Сложно набрать вес
— Зависимость от соли
— Большое количество паразитов, патогенной микрофлоры, хеликобактер и тд.
Как бы это парадоксально не звучало, но какое бы у вас заболевание не было, они возникло неслучайно, под воздействием нескольких факторов: питания, стресса, воды. И начинать нужно прежде всего с питания и смены образа жизни и мышления. Диагностики и лечения ЖКТ.
________
Нужна помощь ведущих специалистов?
Запишитесь на прием по номеру 76-00-00 , 47-00-00
Имеются противопоказания. Необходимо проконсультироваться со специалистом.
Соляная кислота — обзор
8.1.2.2 Коррозия в присутствии газообразных соединений хлора
Присутствие соляной кислоты или молекулярного хлора в газовой фазе значительно увеличивает скорость коррозии стали. Скорость, обнаруженная в установках для сжигания отходов, достигает 1000 нм / ч. Исследования [17] доказывают, что при отсутствии HCl образуется прочный прочный защитный слой. При концентрации HCl 0,1% на поверхности Fe 2 O 3 (гематит) образуются пузырьки, которые, тем не менее, не влияют на целостность защитной окалины. Однако концентрация HCl в дымовых газах 0,8% полностью нарушает целостность слоя гематита, а слой магнетита (Fe 3 O 4 ) становится неравномерным и пористым. Приблизительно 2% соляной кислоты в дымовых газах разрушают оба слоя. Когда рассматриваются окислительные условия, эти явления часто называют активным окислением, катализируемым присутствием хлора. Влияние летучих соединений хлора на высокотемпературную коррозию различных сплавов было предметом ряда исследований [6,11,12,14,19,23].Результаты исследований однозначно указывают на то, что летучие соединения хлора разрушают защитный оксидный слой и тем самым разрушают саму металлическую поверхность. Анализируемые механизмы основаны в основном на исследованиях HCl, Cl 2 и паров NaCl.
Однако концентрация HCl в дымовых газах 0,8% полностью нарушает целостность слоя гематита, а слой магнетита (Fe 3 O 4 ) становится неравномерным и пористым. Приблизительно 2% соляной кислоты в дымовых газах разрушают оба слоя. Когда рассматриваются окислительные условия, эти явления часто называют активным окислением, катализируемым присутствием хлора. Влияние летучих соединений хлора на высокотемпературную коррозию различных сплавов было предметом ряда исследований [6,11,12,14,19,23].Результаты исследований однозначно указывают на то, что летучие соединения хлора разрушают защитный оксидный слой и тем самым разрушают саму металлическую поверхность. Анализируемые механизмы основаны в основном на исследованиях HCl, Cl 2 и паров NaCl.
Газовая коррозия металлов может быть вызвана некоторыми соединениями, содержащими хлор, но чаще всего HCl и в меньшей степени Cl 2 . Первый преобладает в условиях котла, поскольку дымовой газ содержит водяной пар. Cl 2 , однако, может образовываться в восстановительных условиях путем термического разложения HCl [6].
Cl 2 , однако, может образовываться в восстановительных условиях путем термического разложения HCl [6].
Если сталь подвергается воздействию окислительной атмосферы, образуются стабильные оксиды, слой которых постепенно уменьшает диффузию кислорода к металлической поверхности. Таким образом, окисление происходит по так называемому параболическому закону (постепенное уменьшение интенсивности во времени).
Тем не менее, хлор демонстрирует способность проникать через защитный слой оксидов. Он диффундирует через слой, проходит через щели или поры слоя окалины, пока не достигнет поверхности металла, и вступает с ней в реакцию с образованием хлоридов.На границе окалины и металла очень низкий кислородный потенциал. Это соответствует низкому парциальному давлению O 2 , поскольку кислород расходуется на образование оксидов. Такие условия способствуют термической стабильности хлоридов FeCl 2 и CrCl 2 (рис. 8.1). Летучая HCl и Cl 2 реагируют с металлами с образованием хлоридов в соответствии с реакцией (8. 9). Кроме того, металлы могут напрямую реагировать с HCl в соответствии с реакцией (8.10). Хлориды металлов демонстрируют высокие парциальные давления своих паров на границе окалины и поверхности металла, поэтому их постоянная сублимация возможна по реакции (8.11)
9). Кроме того, металлы могут напрямую реагировать с HCl в соответствии с реакцией (8.10). Хлориды металлов демонстрируют высокие парциальные давления своих паров на границе окалины и поверхности металла, поэтому их постоянная сублимация возможна по реакции (8.11)
(8,9) M (т) + Cl2 (г) → MCl2 (т)
(8,10) M (т) + 2HCl (г) → MCl2 (г) + h3 (г)
(8,11) MCl2 (s) → MCl2 (g)
, где M = Fe, Cr, Ni и (s), (g) обозначают твердую и газообразную фазы соответственно.
Образующиеся таким образом летучие хлориды металлов могут диффундировать от металлической поверхности к слою окалины. Концентрация кислорода, возрастающая по мере удаления от металлической поверхности, способствует снижению термодинамической стабильности хлоридов и их окислению в твердые оксиды.Тем не менее оксиды, образовавшиеся из газовых фаз, образуют очень рыхлый слой осаждения, который не предохраняет трубы от коррозии. В этом случае хлорная коррозия протекает по линейному правилу — линейное увеличение во времени.
(8,12) 3MCl2 (г) + 2O2 (г) → M3O4 (т) + 3Cl2 (г)
(8,13) 2MCl2 (г) + (3/2) O2 (г) → M2O3 (т) + 2Cl2 (g)
В результате реакций (8.12) и (8.13) хлор выделяется и диффундирует в дымовой газ или возвращается на металлическую поверхность и инициирует следующий цикл. Графическое изображение этого механизма показано на рис.8.2 [18]. Цикл постепенно перемещает материал с металлической поверхности в зону повышенной концентрации кислорода, а конечный расход хлоридов остается низким. Конечная реакция проходит в соответствии с:
Рисунок 8.2. Схема коррозии от летучих соединений хлора [18].
(8,14) 4M (s) + 3O2 (g) → 2M2O3 (s)
Также было обнаружено, что газообразные соединения хлора могут проникать по границам зерен стали, что называется межкристаллитной коррозией.
В восстановительной среде, где оксиды отсутствуют или нестабильны, хлориды металлов могут образовываться непосредственно на поверхности трубы в соответствии с формулой.(8.9). Скорость хлорной коррозии сильно (экспоненциально) зависит от температуры и теоретически [19] может возрасти примерно в 80 раз при повышении температуры с 300 до 450 ° C. В действительности такой сильной коррозии не наблюдается, поскольку хлоридная коррозия определяется не только кинетикой реакции, но также в большей степени газовой диффузией через зазоры в отложениях и окалине. Поэтому свойства отложений могут иметь большее значение, чем градиенты температуры и парциального давления.Кроме того, скорость коррозии зависит от процесса испарения хлоридов металлов, который также является функцией температуры.
В действительности такой сильной коррозии не наблюдается, поскольку хлоридная коррозия определяется не только кинетикой реакции, но также в большей степени газовой диффузией через зазоры в отложениях и окалине. Поэтому свойства отложений могут иметь большее значение, чем градиенты температуры и парциального давления.Кроме того, скорость коррозии зависит от процесса испарения хлоридов металлов, который также является функцией температуры.
Вышеупомянутые процессы настолько сложны, что, несмотря на ряд исследований, нет единого подхода в их описании. Хлорная коррозия — это сложное взаимодействие реакций, которые регулируются кинетикой, диффузией и фазовым переходом, включая конденсацию, плавление, сублимацию и испарение. Согласно исх. Согласно [20] скорость коррозии определяется зависимостью между скоростью химической реакции и скоростью испарения образующихся хлоридов.При температурах дымовых газов ниже 500 ° C образуется защитный слой хлорида железа, скорость коррозии регулируется параболическим законом и со временем уменьшается. При более высоких температурах скорость коррозии сначала следует параболическому закону, а затем линейному правилу. Это происходит в результате повышения температуры, так как отложения хлоридов становятся более толстыми. Следовательно, достигается определенная толщина, при которой скорости осаждения и испарения находятся в равновесии, и осадок не растет. При температурах, превышающих 800 ° C, увеличения слоя хлоридов недостаточно для покрытия испарения, и скорость коррозии подчиняется линейному закону.
При более высоких температурах скорость коррозии сначала следует параболическому закону, а затем линейному правилу. Это происходит в результате повышения температуры, так как отложения хлоридов становятся более толстыми. Следовательно, достигается определенная толщина, при которой скорости осаждения и испарения находятся в равновесии, и осадок не растет. При температурах, превышающих 800 ° C, увеличения слоя хлоридов недостаточно для покрытия испарения, и скорость коррозии подчиняется линейному закону.
Усиление коррозии железа может быть вызвано образованием легкоплавкого хлорида железа FeCl 3 по реакции:
(8.15) FeCl2 + HCl + (1/4) O2 → FeCl3 + (1/2) h3O
В восстановительной атмосфере HCl может реагировать с CO и H 2 , поражая слой оксидов [9]:
(8.16) Fe2O3 + 2 HCl + CO → FeO + FeCl2 + h3O + CO2
(8.17) Fe3O4 + 2 HCl + CO → 2FeO + FeCl2 + h3O + CO2
Дополнительным источником разрушения, которое происходит при образовании твердых хлоридов, является механическое напряжение, связанное с увеличением объема FeCl 2 по сравнению с объемом железа.
HCl и Cl 2 из-за повреждения защитных слоев могут ускорить другие виды газовой коррозии, например коррозия, вызванная серой.
Типичная картина коррозии газообразными соединениями хлора выглядит следующим образом: темный многослойный осадок оксидов, слабо приставший к трубке. Его толщина составляет порядка 0,1-0,3 мм. При удалении открывается тонкий коричневатый слой, который непосредственно прилипает к поверхности трубки. В конкретном случае испарителя слой отложений обычно тонкий, однако он может быть толще, если коррозия такого рода происходит на трубках пароперегревателя.
На основании лабораторных исследований, представленных в работе. [21], можно сделать вывод, что быстрый рост оксидного слоя из-за воздействия хлора может также происходить, когда соединения хлора отсутствуют на металлической поверхности. Поэтому всегда следует учитывать воздействие хлора и хлоридов, если накипь на трубках отслоилась и отслоилась.
соляная кислота | Соляная кислота
Использование и преимущества
Соляная кислота — сильная коррозионная кислота, которую можно использовать в промышленности для обработки стали, используемой в строительстве. Он используется в химической промышленности при крупномасштабном производстве винилхлорида, используемого для изготовления поливинилхлоридного (ПВХ) пластика, и является одним из химикатов, используемых для производства пенополиуретана и хлорида кальция.
Он используется в химической промышленности при крупномасштабном производстве винилхлорида, используемого для изготовления поливинилхлоридного (ПВХ) пластика, и является одним из химикатов, используемых для производства пенополиуретана и хлорида кальция.
Соляная кислота также используется для производства многих других химикатов, а также в качестве дезинфицирующего средства и слизи, химического вещества, которое предотвращает рост слизи в бумажной массе.
Другие распространенные конечные применения соляной кислоты включают бытовые чистящие средства, обслуживание бассейнов и производство продуктов питания.
Производство стали
Соляная кислота используется в операциях травления для удаления ржавчины и других примесей с углеродистой, легированной и нержавеющей стали, для подготовки стали к окончательному применению в строительных проектах, а также в таких продуктах, как кузова автомобилей и бытовая техника. Он также используется при травлении алюминия и очистке металлов.
Бытовые чистящие средства
Соляная кислота может входить в состав бытовых чистящих средств, таких как чистящие средства для унитазов, чистящие средства для плитки для ванных комнат и другие чистящие средства для фарфора, из-за ее коррозионных свойств, которые помогают очищать стойкие пятна.
Очистка бассейна
Соляная кислота используется в качестве химиката для обработки плавательных бассейнов, чтобы поддерживать оптимальный pH в воде.
Производство и обработка пищевых продуктов
В пищевой промышленности соляная кислота используется для обработки различных пищевых продуктов, таких как кукурузные сиропы, используемые в безалкогольных напитках, печенье, крекерах, кетчупах и злаках. Соляная кислота также используется в качестве подкислителя в соусах, овощных соках и консервированных продуктах, чтобы улучшить вкус и уменьшить порчу.
Производство хлорида кальция
Когда соляная кислота смешивается или реагирует с известняком, образуется хлорид кальция, тип соли, используемый для удаления льда с дорог. Хлорид кальция также используется в производстве пищевых продуктов в качестве стабилизатора и укрепляющего агента, например, в выпечке, а также в качестве противомикробного средства.
Хлорид кальция также используется в производстве пищевых продуктов в качестве стабилизатора и укрепляющего агента, например, в выпечке, а также в качестве противомикробного средства.
Дополнительное использование
Соляная кислота используется в производстве батарей, фотовспышек и фейерверков. Он также используется в обработке кожи, строительстве, кислотной обработке нефтяных скважин и производстве желатиновых продуктов.
ВОДОРОХЛОРИНОВАЯ КИСЛОТА, РАСТВОР | CAMEO Chemicals
Химический лист данных
Химические идентификаторы
В Поля химического идентификатора включать общие идентификационные номера, NFPA алмаз Знаки опасности Министерства транспорта США и общие описание химического вещества. Информация в CAMEO Chemicals поступает
из множества
источники данных.
Информация в CAMEO Chemicals поступает
из множества
источники данных.NFPA 704
| Алмаз | Опасность | Значение | Описание |
|---|---|---|---|
| Здоровье | 3 | Может вызвать серьезные или необратимые травмы. | |
| Воспламеняемость | 0 | Не горит при типичных условиях пожара. | |
| Нестабильность | 1 | Обычно стабильный, но может стать нестабильным при повышенных температурах и давлениях. | |
| Специальный |
(NFPA, 2010)
Общее описание
Бесцветная водянистая жидкость с резким раздражающим запахом. Состоит из хлористого водорода, газа, растворенного в воде.Тонет и смешивается с водой. Выделяет раздражающий пар. (USCG, 1999)
Состоит из хлористого водорода, газа, растворенного в воде.Тонет и смешивается с водой. Выделяет раздражающий пар. (USCG, 1999)
Опасности
Оповещения о реактивности
Реакции воздуха и воды
Водный раствор. При разбавлении может выделяться тепло. Пары в воздухе.
Пожарная опасность
Особые опасности продуктов сгорания: при нагревании образуются токсичные и раздражающие пары. (USCG, 1999)
Опасность для здоровья
Вдыхание паров вызывает ощущение кашля и удушья, а также раздражение носа и легких.Жидкость вызывает ожоги. (USCG, 1999)
Профиль реактивности
ВОДОРОДНАЯ КИСЛОТА — водный раствор хлористого водорода, кислый газ. Реагирует экзотермически с органическими основаниями (амины, амиды) и неорганическими основаниями (оксидами и гидроксидами металлов). Реагирует экзотермически с карбонатами (включая известняк и строительные материалы, содержащие известняк) и гидрокарбонатами с образованием диоксида углерода. Реагирует с сульфидами, карбидами, боридами и фосфидами с образованием токсичных или легковоспламеняющихся газов.Реагирует со многими металлами (включая алюминий, цинк, кальций, магний, железо, олово и все щелочные металлы) с образованием легковоспламеняющегося газообразного водорода. Интенсивно Реагирует с уксусным ангидридом, 2-аминоэтанолом, гидроксидом аммония, фосфидом кальция, хлорсульфоновой кислотой, 1,1-дифторэтиленом, этилендиамином, этиленимином, олеумом, хлорной кислотой, b-пропиолактоном, оксидом пропилена, смесью перхлорат серебра и четыреххлористого углерода, гидроксид натрия. , фосфид урана (IV), винилацетат, карбид кальция, карбид рубидия, ацетилид цезия, ацетилид рубидия, борид магния, сульфат ртути (II) [Льюис].Смеси с концентрированной серной кислотой могут с опасной скоростью выделять токсичный газообразный хлористый водород. Проходит очень бурную реакцию с фосфидом кальция [Mellor 8: 841 (1946-1947)].
Реагирует с сульфидами, карбидами, боридами и фосфидами с образованием токсичных или легковоспламеняющихся газов.Реагирует со многими металлами (включая алюминий, цинк, кальций, магний, железо, олово и все щелочные металлы) с образованием легковоспламеняющегося газообразного водорода. Интенсивно Реагирует с уксусным ангидридом, 2-аминоэтанолом, гидроксидом аммония, фосфидом кальция, хлорсульфоновой кислотой, 1,1-дифторэтиленом, этилендиамином, этиленимином, олеумом, хлорной кислотой, b-пропиолактоном, оксидом пропилена, смесью перхлорат серебра и четыреххлористого углерода, гидроксид натрия. , фосфид урана (IV), винилацетат, карбид кальция, карбид рубидия, ацетилид цезия, ацетилид рубидия, борид магния, сульфат ртути (II) [Льюис].Смеси с концентрированной серной кислотой могут с опасной скоростью выделять токсичный газообразный хлористый водород. Проходит очень бурную реакцию с фосфидом кальция [Mellor 8: 841 (1946-1947)].
Принадлежит к следующей реактивной группе (ам)
Потенциально несовместимые абсорбенты
Информация отсутствует.
Ответные рекомендации
В Поля рекомендаций ответа включать расстояния изоляции и эвакуации, а также рекомендации по пожаротушение, противопожарное реагирование, защитная одежда и первая помощь.В информация в CAMEO Chemicals поступает из различных источники данных.Изоляция и эвакуация
Выдержка из руководства ERG 157 [Вещества — токсичные и / или коррозионные (негорючие / водочувствительные)]:В качестве немедленной меры предосторожности изолировать место разлива или утечки во всех направлениях на расстоянии не менее 50 метров (150 футов) для жидкостей. и не менее 25 метров (75 футов) для твердых тел.
РАЗЛИВ: при необходимости увеличьте в направлении ветра изоляционное расстояние, указанное выше.
ПОЖАР: Если цистерна, железнодорожный вагон или автоцистерна вовлечены в пожар, ВЫЙДИТЕ на 800 метров (1/2 мили) во всех направлениях; также рассмотрите возможность начальной эвакуации на 800 метров (1/2 мили) во всех направлениях. (ERG, 2016)
(ERG, 2016)
Пожарная
Выдержка из руководства ERG 157 [Вещества — токсичные и / или коррозионные (негорючие / водочувствительные)]:Примечание. Некоторые пены вступают в реакцию с материалом и выделяют коррозионные / токсичные газы.
МАЛЫЙ ПОЖАР: CO2 (кроме цианидов), сухой химикат, сухой песок, спиртоустойчивая пена.
БОЛЬШОЙ ПОЖАР: водная струя, туман или спиртоустойчивая пена. Уберите контейнеры из зоны пожара, если это можно сделать без риска. Используйте водяную струю или туман; не используйте прямые потоки. Сделайте плотину противопожарной воды для последующей утилизации; не рассыпать материал.
ПОЖАР В ЦИСТЕРНАХ ИЛИ АВТОМОБИЛЬНЫХ / ПРИЦЕПНЫХ НАГРУЗКАХ: тушите пожар с максимального расстояния или используйте необслуживаемые держатели шлангов или контрольные сопла. Не допускайте попадания воды внутрь контейнеров. После того, как огонь потухнет, охладите емкости затопленным количеством воды.Немедленно удалите воду в случае появления шума из вентиляционных устройств безопасности или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. (ERG, 2016)
ВСЕГДА держитесь подальше от танков, охваченных огнем. (ERG, 2016)
Non-Fire Response
Выдержка из руководства ERG 157 [Вещества — токсичные и / или коррозионные (негорючие / водочувствительные)]:УСТРАНИТЬ все источники воспламенения (запретить курение, факелы, искры или пламя в непосредственной близости). Все оборудование, используемое при работе с продуктом, должно быть заземлено. Не прикасайтесь к поврежденным контейнерам или пролитому материалу, если не носите соответствующую защитную одежду.Остановите утечку, если вы можете сделать это без риска. Для уменьшения испарения можно использовать пену для улавливания паров. НЕ ПОЛУЧАЙТЕ ВОДУ В КОНТЕЙНЕРЫ. Используйте водяной спрей, чтобы уменьшить испарения или отвести облако пара. Избегайте попадания сточных вод на разлитый материал. Не допускайте попадания в водные пути, канализацию, подвалы или закрытые пространства.
МАЛЫЙ РАЗЛИВ: Прикройте СУХОЙ землей, СУХИМ песком или другим негорючим материалом, а затем накройте пластиковым листом, чтобы свести к минимуму распространение или контакт с дождем. Используйте чистые неискрящие инструменты, чтобы собрать материал и поместить его в неплотно закрытые пластиковые контейнеры для последующей утилизации.(ERG, 2016)
Используйте чистые неискрящие инструменты, чтобы собрать материал и поместить его в неплотно закрытые пластиковые контейнеры для последующей утилизации.(ERG, 2016)
Защитная одежда
Кожа: Если химическое вещество находится в растворе, наденьте соответствующую личную защитную одежду для предотвращения контакта с кожей и предотвращения замерзания кожи от контакта с жидкостью или от контакта с сосудами, содержащими жидкость.Глаза: Используйте соответствующие средства защиты глаз, чтобы избежать контакта глаз с жидкостью, которая может привести к ожогам или повреждению тканей в результате обморожения.
Вымыть кожу: Если химическое вещество находится в растворе, рабочий должен немедленно промыть кожу, если она загрязнится.
Удаление: Если химическое вещество находится в растворе, необходимо снять и заменить рабочую одежду, которая стала влажной или значительно загрязненной.
Изменение: Нет рекомендаций относительно необходимости для работника менять одежду после рабочей смены.
Предоставить: Фонтаны для промывки глаз должны быть предоставлены (когда химическое вещество находится в растворе) в местах, где есть вероятность того, что рабочие могут подвергнуться воздействию вещества; это независимо от рекомендаций, связанных с использованием средств защиты глаз.В непосредственной рабочей зоне должны быть предусмотрены средства для быстрого обмачивания тела (когда химическое вещество находится в растворе) для экстренного использования, где есть вероятность воздействия. [Примечание: предполагается, что эти устройства обеспечивают достаточное количество или поток воды для быстрого удаления вещества из любых участков тела, которые могут подвергнуться воздействию. Фактическое определение того, что представляет собой адекватное устройство для быстрого слива, зависит от конкретных обстоятельств. В некоторых случаях должен быть доступен дренчерный душ, в то время как в других наличие воды из раковины или шланга можно считать достаточным.] В непосредственной близости от рабочей зоны должны быть предусмотрены устройства для быстрого смачивания и / или фонтаны для промывки глаз для аварийного использования, где есть любая возможность воздействия очень холодных или быстро испаряющихся жидкостей. (NIOSH, 2016)
(NIOSH, 2016)
Ткани для костюмов DuPont Tychem®
Легенда ткани Tychem®
| QS = Tychem 2000 SFR |
| QC = Tychem 2000 |
| SL = Тихем 4000 |
| C3 = Тихем 5000 |
| TF = Тихем 6000 |
| TP = Tychem 6000 FR |
| BR = Тихем 9000 |
| RC = Tychem RESPONDER® CSM |
| TK = Тихем 10000 |
| RF = Тихем 10000 FR |
Детали тестирования
Данные о проницаемости ткани были получены для DuPont независимыми
испытательные лаборатории с использованием ASTM F739, EN369, EN 374-3, EN ISO 6529
(методы A и B) или методы испытаний ASTM D6978. Нормализованное время прорыва
(время, при котором скорость проникновения равна 0,1 мкг / см2 / мин)
сообщается в минутах.
Все жидкие химикаты были протестированы при температуре примерно от 20 ° C до
27 ° C, если не указано иное.
Другая температура может существенно повлиять на
время прорыва; скорость проникновения обычно увеличивается с
температура.
Все химические вещества имеют
был протестирован при концентрации более 95%, если не указано иное
заявил.Если не указано иное, проницаемость измерялась для отдельных химикатов.
Характеристики проницаемости смесей могут значительно отличаться.
от проницаемости отдельных химических веществ.
Боевые отравляющие вещества (люизит, зарин, зоман, сера
Горчица, табун и нервно-паралитический агент VX) были протестированы при 22 ° C и 50%
относительная влажность в соответствии с военным стандартом MIL-STD-282.
Нормализованное время прорыва
(время, при котором скорость проникновения равна 0,1 мкг / см2 / мин)
сообщается в минутах.
Все жидкие химикаты были протестированы при температуре примерно от 20 ° C до
27 ° C, если не указано иное.
Другая температура может существенно повлиять на
время прорыва; скорость проникновения обычно увеличивается с
температура.
Все химические вещества имеют
был протестирован при концентрации более 95%, если не указано иное
заявил.Если не указано иное, проницаемость измерялась для отдельных химикатов.
Характеристики проницаемости смесей могут значительно отличаться.
от проницаемости отдельных химических веществ.
Боевые отравляющие вещества (люизит, зарин, зоман, сера
Горчица, табун и нервно-паралитический агент VX) были протестированы при 22 ° C и 50%
относительная влажность в соответствии с военным стандартом MIL-STD-282.
| Химическая промышленность | Номер CAS | Государство | QS | QC | SL | C3 | TF | TP | BR | RC | ТК | РФ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Соляная кислота (16%) | 7647-01-0 | Жидкость | ||||||||||
| Соляная кислота (32%) | 7647-01-0 | Жидкость | ||||||||||
| Соляная кислота (37%) | 7647-01-0 | Жидкость | 140 | > 480 | > 480 | > 480 | > 480 | > 480 | > 480 | > 480 | > 480 | |
| Хлористый водород (> 95%, газ) | 7647-01-0 | Пар | имм. | > 480 | > 480 | > 480 | > 480 | > 480 | > 480 | > 480 | > 480 | |
| Хлористый водород (> 95%, жидкость, -90 ° C) | 7647-01-0 | Жидкость | > 180 | |||||||||
| Соляная кислота (16%) | 7647-01-0 | Жидкость | ||||||||||
| Соляная кислота (32%) | 7647-01-0 | Жидкость | ||||||||||
| Соляная кислота (37%) | 7647-01-0 | Жидкость | 140 | > 480 | > 480 | > 480 | > 480 | > 480 | > 480 | > 480 | > 480 |
Особые предупреждения от DuPont
- Зубчатые и переплетенные швы повреждены какой-либо опасной жидкостью
химические вещества, такие как сильные кислоты, и их не следует носить при
эти химические вещества присутствуют.

- ВНИМАНИЕ: эта информация основана на технических данных, которые
DuPont считает себя надежным. Подлежит пересмотру как
приобретаются дополнительные знания и опыт. DuPont не делает
гарантия результатов и не берет на себя никаких обязательств или ответственности …
… в связи с этой информацией. Ответственность за определить уровень токсичности и надлежащие средства индивидуальной защиты необходимое оборудование.Информация, изложенная здесь, отражает лабораторные эксплуатационные качества тканей, а не комплектных предметов одежды, в контролируемых условиях. Он предназначен для информационного использования лицами, имеющими технические навыки для оценка в конкретных условиях конечного использования, по их собственному усмотрению и риск. Любой, кто намеревается использовать эту информацию, должен сначала проверить что выбранная одежда подходит для предполагаемого использования.
 Во многих случаях,
швы и закрытия имеют более короткое время прорыва и более высокую проницаемость
ставки, чем ткань.Пожалуйста, свяжитесь с DuPont для получения конкретных данных. Если ткань
рвется, истирается или прокалывается, или если швы или затворы выходят из строя, или если
прикрепленные перчатки, козырьки и т. д. повреждены, конечный пользователь должен прекратить использование
одежды, чтобы избежать потенциального воздействия химикатов. Поскольку условия использования
находятся вне нашего контроля, мы не даем никаких гарантий, явных или подразумеваемых,
включая, помимо прочего, отсутствие гарантий товарной пригодности или пригодности
для конкретного использования и не несем ответственности в связи с любым использованием
эта информация.Эта информация не предназначена для использования в качестве лицензии на работу.
под или с рекомендацией нарушить какой-либо патент или техническую информацию
компании DuPont или других лиц, охватывающих любой материал или его использование.
Во многих случаях,
швы и закрытия имеют более короткое время прорыва и более высокую проницаемость
ставки, чем ткань.Пожалуйста, свяжитесь с DuPont для получения конкретных данных. Если ткань
рвется, истирается или прокалывается, или если швы или затворы выходят из строя, или если
прикрепленные перчатки, козырьки и т. д. повреждены, конечный пользователь должен прекратить использование
одежды, чтобы избежать потенциального воздействия химикатов. Поскольку условия использования
находятся вне нашего контроля, мы не даем никаких гарантий, явных или подразумеваемых,
включая, помимо прочего, отсутствие гарантий товарной пригодности или пригодности
для конкретного использования и не несем ответственности в связи с любым использованием
эта информация.Эта информация не предназначена для использования в качестве лицензии на работу.
под или с рекомендацией нарушить какой-либо патент или техническую информацию
компании DuPont или других лиц, охватывающих любой материал или его использование.
(DuPont, 2018)
Первая помощь
ВДЫХАНИЕ: вывести человека на свежий воздух; держите его в тепле и спокойствии и немедленно обратитесь за медицинской помощью; при остановке дыхания приступить к искусственному дыханию.ПРОГЛАТЫВАНИЕ: дать человеку пить воду или молоко; не вызывает рвоту.
ГЛАЗА: немедленно промыть большим количеством воды не менее 15 мин. и получить медицинскую помощь; продолжайте промывание еще 15 мин. если врач не приедет вовремя.
КОЖА: сразу же промыть кожу, снимая загрязненную одежду; незамедлительно обратиться за медицинской помощью; используйте мыло и вымойте область не менее 15 мин. (USCG, 1999)
Физические свойства
| Химическая формула: |
Точка воспламенения: данные недоступны
Нижний предел взрываемости (НПВ): данные недоступны
Верхний предел взрываемости (ВПВ): данные недоступны
Температура самовоспламенения: Не горючий (USCG, 1999)
Точка плавления: данные недоступны
Давление газа: 413. 6 мм рт. (USCG, 1999)
6 мм рт. (USCG, 1999)
Плотность пара (относительно воздуха): данные отсутствуют
Удельный вес: данные недоступны
Точка кипения: 123 ° F при 760 мм рт. (USCG, 1999)
Молекулярная масса: 36,46 (USCG, 1999)
Растворимость в воде: данные отсутствуют
Потенциал ионизации: 12,74 эВ (NIOSH, 2016)
IDLH: 50 частей на миллион (NIOSH, 2016)
AEGL (рекомендуемые уровни острого воздействия)
| Срок действия | AEGL-1 | AEGL-2 | AEGL-3 |
|---|---|---|---|
| 10 минут | 1.8 страниц в минуту | 100 частей на миллион | 620 частей на миллион |
| 30 минут | 1,8 частей на миллион | 43 стр. / Мин / Мин | 210 страниц на миллион |
| 60 минут | 1,8 частей на миллион | 22 страниц в минуту | 100 частей на миллион |
| 4 часа | 1,8 частей на миллион | 11 страниц в минуту | 26 страниц в минуту |
| 8 часов | 1.8 страниц в минуту | 11 страниц в минуту | 26 страниц в минуту |
(NAC / NRC, 2017)
ERPG (Руководство по планированию действий в чрезвычайных ситуациях)
| Химическая промышленность | ЭРПГ-1 | ЭРПГ-2 | ЭРПГ-3 |
|---|---|---|---|
| Хлористый водород (7647-01-0) | 3 стр. / Мин | 20 страниц в минуту | 150 страниц в минуту |
(АМСЗ, 2016)
PAC (Критерии защитного действия)
| Химическая промышленность | PAC-1 | PAC-2 | PAC-3 |
|---|---|---|---|
| Хлористый водород; (Соляная кислота) (7647-01-0) | 1. 8 страниц в минуту 8 страниц в минуту | 22 страниц в минуту | 100 частей на миллион |
(DOE, 2016)
Нормативная информация
В Поля нормативной информации включать информацию из Сводный список Раздела III Агентства по охране окружающей среды США Списки, химический объект Министерства внутренней безопасности США Стандарты борьбы с терроризмом, и Управления по охране труда и здоровья США Стандартный список управления производственной безопасностью особо опасных химических веществ (см. подробнее об этих источники данных).Сводный список списков EPA
| Нормативное название | Номер CAS / 313 Код категории | EPCRA 302 EHS TPQ | EPCRA 304 EHS RQ | CERCLA RQ | EPCRA 313 TRI | RCRA Код | CAA 112 (задний) RMP TQ |
|---|---|---|---|---|---|---|---|
| Соляная кислота | 7647-01-0 | 5000 фунтов | |||||
| Соляная кислота (только в аэрозольных формах) | 7647-01-0 | 5000 фунтов | 313 | ||||
| Соляная кислота (конц 37% или более) | 7647-01-0 | 5000 фунтов | 15000 фунтов | ||||
| Хлористый водород (безводный) | 7647-01-0 | 500 фунтов | 5000 фунтов | 5000 фунтов | Х | 5000 фунтов | |
| Хлороводород (только газ) | 7647-01-0 | 500 фунтов | 5000 фунтов | 5000 фунтов | Х | 5000 фунтов |
(Список списков EPA, 2015)
Стандарты по борьбе с терроризмом химического предприятия DHS (CFATS)
| ВЫПУСК | КРАЖА | САБОТАЖ | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Представляющее интерес химическое вещество | Номер CAS | Мин. Концентрация Концентрация | STQ | Безопасность Выпуск | Мин. Концентрация | STQ | Безопасность Выпуск | Мин. Концентрация | STQ | Безопасность Выпуск |
| Кислота соляная (конц.37% или больше) | 7647-01-0 | 37,00% | 15000 фунтов | токсичный | ||||||
| Хлористый водород (безводный) | 7647-01-0 | 1,00% | 5000 фунтов | токсичный | ACG | 500 фунтов | WME | |||
(DHS, 2007)
Список стандартов управления безопасностью процессов (PSM) OSHA
| Химическое название | Номер CAS | Пороговое количество (TQ) |
|---|---|---|
| Соляная кислота безводная | 7647-01-0 | 5000 фунтов |
| Хлористый водород | 7647-01-0 | 5000 фунтов |
(OSHA, 2011)
Альтернативные химические названия
В этом разделе представлен список альтернативных названий этого химического вещества,
включая торговые наименования и синонимы.
- ХЛОРОГОДНАЯ КИСЛОТА
- РАЗБАВЛЕННАЯ ВОДОРОДНАЯ КИСЛОТА
- ВОДОХЛОРНАЯ КИСЛОТА
- ВОДОРОХЛОРИНОВАЯ КИСЛОТА (КОНЦЕНТРАЦИЯ 37% ИЛИ БОЛЕЕ)
- РАСТВОР ВОДОХЛОРНОЙ КИСЛОТЫ [СТАБИЛИЗИРОВАННЫЙ]
- ВОДОРОХЛОРИНОВАЯ КИСЛОТА, РАСТВОР
- ХЛОРИД ВОДОРОДА (HCL)
- МУРИАТОВАЯ КИСЛОТА
соляная кислота, 100 мл — концентрированный 12-молярный раствор 32-36% HCl
Есть вопросы? Обратитесь в службу поддержки клиентов.406-256-0990 или Живой чат в
- Возраст 14+
- На складе, готово к отправке
- Это нужно быстро? Смотрите варианты доставки в корзине.

Бутылка соляной кислоты на 100 мл представляет собой концентрированный 12-молярный 32–36% раствор. Этот концентрированный раствор HCl представляет собой сильно коррозионную кислоту, которая используется во многих промышленных целях. Найдите плотность концентрированной HCl, молярность и многое другое ниже! Читать Более
участника My Science Perks зарабатывают не менее $ 0.16 обратно на этот товар. Войдите или создайте Бесплатный HST Аккаунт, чтобы начать зарабатывать сегодня
Ограничения на доставку:ОПИСАНИЕ
Бутылка соляной кислоты на 100 мл представляет собой концентрированный 12-молярный 32–36% раствор. Это концентрированный раствор HCl технического класса.
Это концентрированный раствор HCl технического класса.
Соляная кислота — бесцветный раствор хлористого водорода (HCl) в воде. Концентрированная HCl — это сильно коррозионная кислота, которая используется во многих промышленных целях. Это химическое вещество используется для регулирования pH в плавательных бассейнах, чтобы сделать их пригодными для использования, и для дезинфекции воды; в этом контексте ее часто называют «соляной кислотой».
Узнайте больше о кислотах в воде, а также о других кислотах и щелочах.
Найдите плотность концентрированной HCl, молярность концентрированной HCl и многое другое ниже! Если вам нужно меньшее количество, у нас есть на продажу флаконы с соляной кислотой объемом 30 мл.
| Формула | HCl |
| Вес формулы | 36,461 |
| Форма | Решение |
| Плотность | 1,18 г / мл |
| Молярность | 12 месяцев |
| Номер CAS | 7647-01-0 |
| Классификация DOT | UN1789, Кислота соляная |
| Код хранилища | Белый |
| Срок годности | 24 месяца |
| Альтернативное имя | соляная кислота |
| Общее использование | Для производства батарей и фейерверков, переработки сахара, производства продуктов питания и многого другого! |
| Опасность | Коррозионные вещества (жидкости и твердые вещества) |
БЛОК ДОПОЛНИТЕЛЬНОЙ ИНФОРМАЦИИ
ВКЛАДКА С СОДЕРЖАНИЕМ
ТАБЛИЦА ТЕХНИЧЕСКИХ ХАРАКТЕРИСТИК
- Описание продукта
- UN1789-100
- Технические характеристики
- СОДЕРЖАНИЕ
Ограничение на доставку: Этот товар доставляется только эконом-классом или наземным обслуживанием на почтовые адреса в 48 смежных штатах США.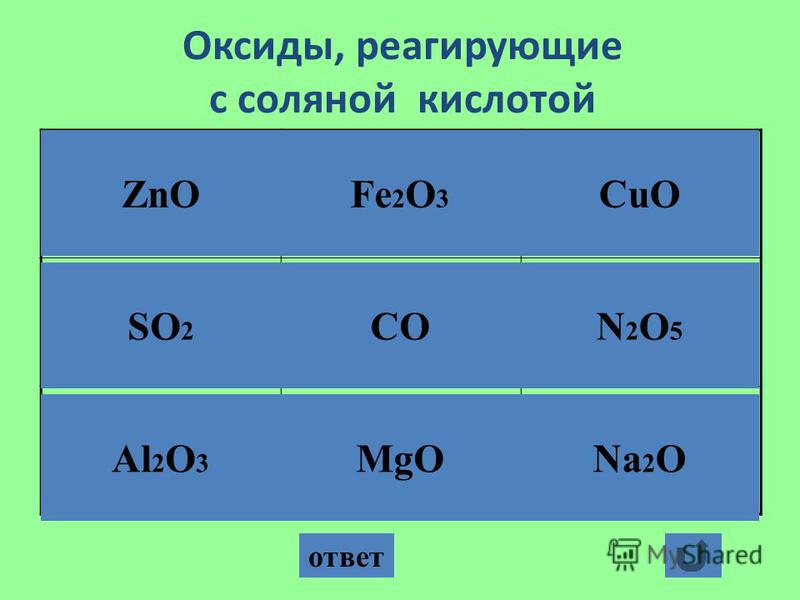
Предупреждение: ОПАСНОЕ ХИМИЧЕСКОЕ ВЕЩЕСТВО — Этот набор содержит опасные химические вещества. Не для детей младше 15 лет. Для использования под присмотром взрослых. Внимательно прочтите предупреждающие надписи.
Мы хотим, чтобы этот предмет был живым, когда вы его получите! Следовательно, нам необходимо знать, когда вы будете дома, чтобы получить его (минимизируя воздействие стихии).Укажите дату доставки, среда — Пятница, это минимум 7 дней с сегодняшнего дня.
Химия / Химия
/ химия /, / химия / химия /
Мы поняли. Наука может быть беспорядочной. Но продукты и услуги Home Science Tools справятся с этим.
Наша продукция долговечна, надежна и доступна по цене, позволяя вам перемещаться из полевых условий в лабораторию и на кухню. Они не подведут вас, независимо от того, с чем они столкнутся. Будь то (чрезмерно) нетерпеливые молодые ученые из года в год или строгие требования, которые возникают раз в жизни.
Они не подведут вас, независимо от того, с чем они столкнутся. Будь то (чрезмерно) нетерпеливые молодые ученые из года в год или строгие требования, которые возникают раз в жизни.
И если ваш научный запрос идет не так, как ожидалось, вы можете рассчитывать на помощь нашей службы поддержки клиентов. Рассчитывайте на дружеские голоса на другом конце телефона и советы экспертов в вашем почтовом ящике. Они не будут счастливы, пока вы не станете счастливыми.
Итог? Мы гарантируем, что наши продукты и услуги не испортят ваше научное исследование, каким бы беспорядочным оно ни было.
Вопросы? Свяжитесь с нашей службой поддержки клиентов.
Роль соляной кислоты (Hcl) в пищеварении
Пищеварение начинается с взгляда, мысли или запаха пищи. Когда мозг ожидает поступления пищи, блуждающий нерв посылает сигнал в желудок, вызывая выброс ацетилхолина. Связывание ацетилхолина с G-клетками в желудке запускает секрецию гастрина и, в сочетании с ацетилхолином и гистамином, стимулирует париетальные клетки в желудочных железах тела желудка, чтобы начать секретировать соляную кислоту (HCl).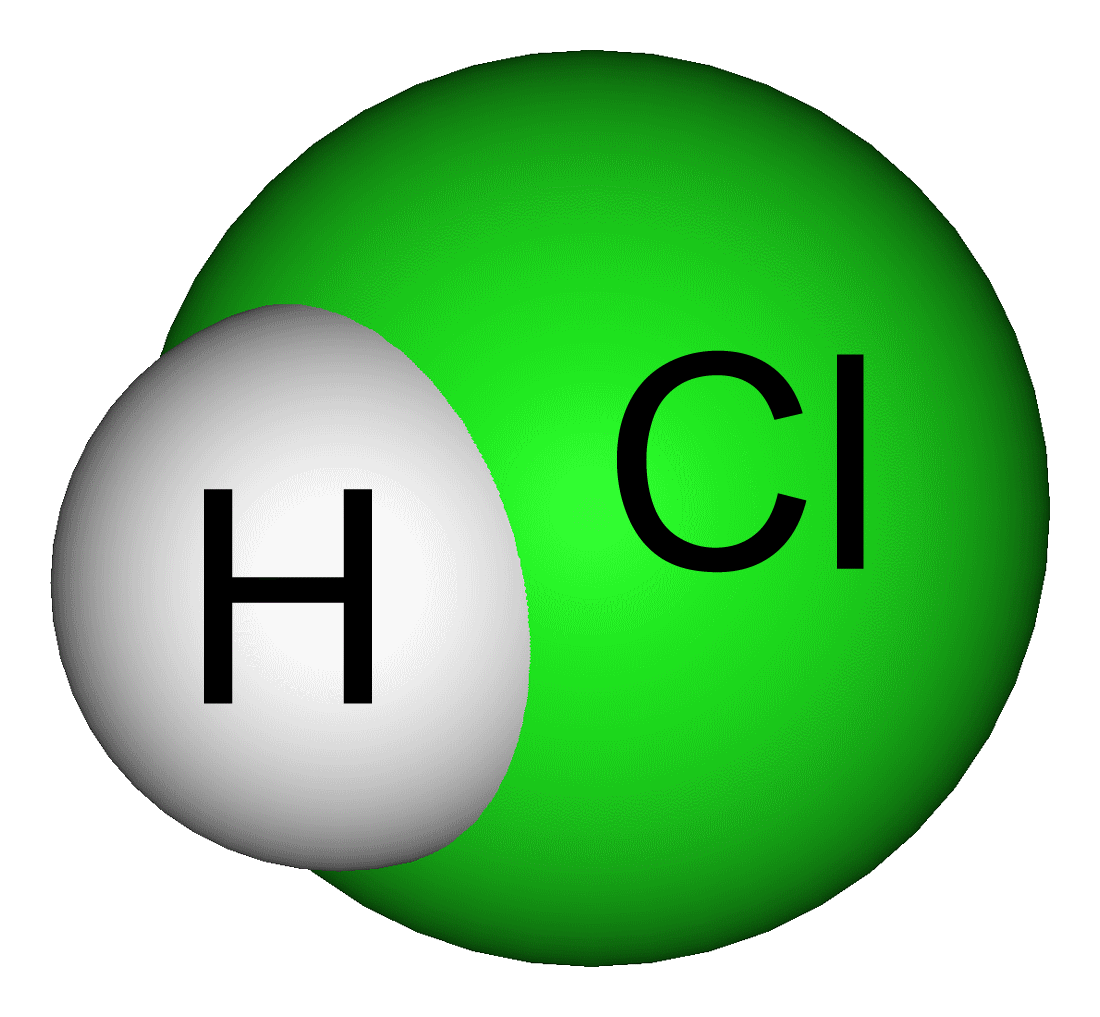
Кислота в желудке служит нескольким целям, но в основном связана с разложением белков и полисахаридов, чтобы они могли проникать через эпителий кишечника. Ежедневно производится примерно 2 л HCl. Уровень pH в желудке колеблется от 1,5 до 3, в зависимости от таких факторов, как прием пищи, стресс, лекарства или добавки. 1 Повышение HCl и снижение уровня pH также сигнализируют о включении моторики желудка для перемещения частично переваренного комка пищи и помощи в уничтожении бактерий, обычно попадающих в организм с пищей.PH желудка регулируется петлей отрицательной обратной связи антральными D-клетками, которые выделяют соматостатин, который ингибирует высвобождение гастрина. 2 По мере того, как пища выходит из желудка, концентрация H + увеличивается, что также препятствует секреции HCl. 1
Соляная кислота способствует перевариванию белков, поставляя H +, который активирует пепсиноген, предшественник пепсина. Пепсиноген секретируется главными клетками желудочных желез тела и антрального отдела желудка. Белки сокращаются до фрагментов различного размера, называемых пептидами или аминокислотами, пепсином, поэтому они могут в конечном итоге абсорбироваться в тонком кишечнике. Это увеличение количества пептидов и аминокислот, наряду с выделением из пищи, еще больше увеличивает секрецию HCl. Без адекватной секреции HCl более крупные фрагменты белков попадают в тонкий кишечник и могут поставить под угрозу эффективность пищеварительных процессов. Стресс может повлиять на секрецию HCl, поскольку повышенная парасимпатическая активность кишечной нервной системы желудка стимулирует высвобождение ацетилхолина, гастрина и гистамина. 1.
Белки сокращаются до фрагментов различного размера, называемых пептидами или аминокислотами, пепсином, поэтому они могут в конечном итоге абсорбироваться в тонком кишечнике. Это увеличение количества пептидов и аминокислот, наряду с выделением из пищи, еще больше увеличивает секрецию HCl. Без адекватной секреции HCl более крупные фрагменты белков попадают в тонкий кишечник и могут поставить под угрозу эффективность пищеварительных процессов. Стресс может повлиять на секрецию HCl, поскольку повышенная парасимпатическая активность кишечной нервной системы желудка стимулирует высвобождение ацетилхолина, гастрина и гистамина. 1.
ССЫЛКИ
- Widmaier EP, Raff H, Strang KT. Физиология человека Вандера: механизмы функции тела. Бостон: Макгроу-Хилл; 2006 г. Обзор секреции кислоты. Руководство Merck Professional Edition.
- https://www.merckmanuals.com/professional/gastrointestinal-disorders/gastritis-and-peptic-ulcer-disease/overview-of-acid-secretion.
 По состоянию на 27 июня 2016 г.
По состоянию на 27 июня 2016 г.
Хлористый водород и соляная кислота — стенограмма видео и урока
Химическая формула
HCl — это химическая формула хлористого водорода и соляной кислоты.Основное различие заключается в том, в каком состоянии они находятся. Хлороводород — это газ, а соляная кислота — водный раствор. Водный просто означает, что он растворен в воде. Вот почему важно указывать состояние вопроса в скобках. Для газообразной версии мы пишем HCl (g), а для кислотной версии мы пишем HCl (aq). Давайте углубимся в каждое из этих состояний.
HCl (г)
Как мы уже обсуждали, хлористый водород — это газ.Мы можем нарисовать точечную структуру Льюиса HCl (г), которая показывает расположение электронов в связи между водородом и хлором. Диаграмма 1 показывает точечную структуру Льюиса газообразного хлористого водорода.
Точки на диаграмме 1 представляют электроны внешней оболочки. Между водородом и хлором делятся два электрона, что делает его ковалентной молекулой . Что-то особенное происходит, когда газообразный хлористый водород пузырится через воду.Давай проверим.
HCl (водн.)
Полярное вещество в целом электрически нейтрально, но одна его сторона заряжена положительно, а другая сторона — отрицательно. Диаграмма 2 показывает полярную природу воды.
Когда газообразный хлористый водород попадает в воду, молекулы воды захватывают атом водорода в HCl (г) и отводят его от атома хлора.Это процесс растворения , при котором образуется соляная кислота. Теперь у нас есть кислый раствор, потому что в нем присутствуют ионы h4 O + 1, которые носят название гидрокония. На диаграмме 3 показан ион гидроксония.
На диаграмме 3 показан ион гидроксония.
Напишем реакцию.
HCl (г) + h3 O (л) → h4 O + 1 + Cl-1
На диаграмме 4 показано, как газообразный хлористый водород может попасть в воду.
Давайте теперь рассмотрим свойства газообразного хлористого водорода и соляной кислоты.
Свойства
Мы будем иметь дело со свойствами газообразного хлористого водорода и соляной кислоты, наблюдаемыми при комнатной температуре. Газообразный хлористый водород очень агрессивен и легко вступает в реакцию с водой, даже с водяным паром в воздухе. Несмотря на то, что он едкий, он не воспламеняется. Если бы хлористый водород был выпущен в замкнутом пространстве, он выглядел бы слегка желтоватым и опускался бы к полу.Он имеет характерный запах, который может гореть при вдыхании, поскольку вступает в реакцию с влагой во рту, легких и носовых проходах с образованием соляной кислоты.
Если бы хлористый водород был выпущен в замкнутом пространстве, он выглядел бы слегка желтоватым и опускался бы к полу.Он имеет характерный запах, который может гореть при вдыхании, поскольку вступает в реакцию с влагой во рту, легких и носовых проходах с образованием соляной кислоты.
Соляная кислота также очень агрессивна и имеет такой же светло-желтый оттенок. Его точка кипения немного выше, чем точка кипения воды, и он очень реактивен с металлами. Сила кислоты измеряется ее значением pH. Значения pH, приближающиеся к нулю, сильнее. Чем больше хлористого водорода пропускается через заданное количество воды, тем выше pH полученной соляной кислоты.
Итоги урока
Давайте рассмотрим. Хлороводородный газ и соляная кислота имеют одинаковую химическую формулу: HCl. Разница между ними состоит в том, что хлористый водород — это газ, а соляная кислота — водный раствор.
В HCl (г) атом водорода имеет два общих электрона с атомом хлора. Когда этот газ барботируется через воду, молекулы воды отделяют атом водорода от атома хлора, что называется растворением . Свободный ион водорода связывается с молекулой воды, образуя гидроксоний h4 O + 1. Реакция следующая:
Свободный ион водорода связывается с молекулой воды, образуя гидроксоний h4 O + 1. Реакция следующая:
HCl (г) + h3 O (l) → h4 O + 1 + Cl-1
Хлороводородный газ тяжелее воздуха, слегка желтого цвета, негорючий и обладает высокой реакционной способностью по отношению к воде.
Соляная кислота тоже слегка желтоватая, и ее силу можно измерить по значению pH. Чем ниже pH, тем сильнее кислота. Соляная кислота очень реактивна с металлами.
Обе формы HCl вызывают коррозию.
Наука за соляной кислотой
Соляная кислота (HCl) — это кислота природного происхождения, которая вырабатывается в желудках млекопитающих для улучшения пищеварения. У людей он содержится в желудочном соке, также известном как желудочная кислота, где помогает расщеплять пищу. Но HCl также получают в промышленных масштабах путем растворения газообразного хлористого водорода в воде. Как едкий и кислотный раствор соляная кислота имеет несколько применений при производстве и переработке различных продуктов.
Биологически соляная кислота играет важную роль в пищеварении. Являясь компонентом желудочного сока в желудке млекопитающих, он придает кислоте желудочного сока нормальный объем от 20 до 100 мл с кислотным pH от 1,5 до 3,5.
В организме HCl вырабатывается париетальными клетками, которые выделяют ионы водорода и хлора. Соляная кислота особенно важна для поддержания необходимого pH, необходимого для активации пепсина, основного пищеварительного фермента, который имеет решающее значение для переваривания белков.
В промышленности HCl получают путем растворения газообразного хлористого водорода в воде. Когда дело доходит до промышленного применения, соляная кислота выполняет различные важные функции: от поддержания оптимального pH в бассейнах до образования неорганических и органических соединений. Вот некоторые примеры практического использования соляной кислоты в промышленности:
- Обработка или производство органических веществ: Для многих органических соединений, таких как дихлорэтан и винилхлорид, в качестве реагента требуется HCl.
 Например, хлор в полимерных пластиках, таких как поливинилхлорид (ПВХ), образуется в результате полимеризации мономера винилхлорида. Одним из путей получения мономеров винилхлорида является экзотермическая реакция ацетилена с безводным газообразным хлористым водородом в присутствии хлорида ртути в качестве катализатора. Вычисленное химическое уравнение: C 2 H 2 + HCl → CH 2 = CHCl.
Например, хлор в полимерных пластиках, таких как поливинилхлорид (ПВХ), образуется в результате полимеризации мономера винилхлорида. Одним из путей получения мономеров винилхлорида является экзотермическая реакция ацетилена с безводным газообразным хлористым водородом в присутствии хлорида ртути в качестве катализатора. Вычисленное химическое уравнение: C 2 H 2 + HCl → CH 2 = CHCl.
- Химическая буферизация: Многие типы производственных процессов требуют поддержания уровня pH в определенном диапазоне.В этих случаях HCl служит буфером. Фармацевтические продукты, обработанные пищевые продукты и чистая питьевая вода нуждаются в соляной кислоте на одном или нескольких этапах обработки.
- Поддержание уровня pH в плавательных бассейнах: Соляная кислота также используется для регулирования pH в плавательных бассейнах, где уровень pH воды должен поддерживаться в слегка щелочном диапазоне от 7,2 до 7,6.
 Гипохлорит натрия, щелочь, регулярно добавляют в бассейны для их дезинфекции.Но его щелочность означает, что он может легко стать чрезмерным и вызвать раздражение кожи пользователей бассейна. Таким образом, уровень pH воды можно снизить, добавив HCl.
Гипохлорит натрия, щелочь, регулярно добавляют в бассейны для их дезинфекции.Но его щелочность означает, что он может легко стать чрезмерным и вызвать раздражение кожи пользователей бассейна. Таким образом, уровень pH воды можно снизить, добавив HCl.
- Поваренная соль для очистки: Поваренная поваренная соль натрия хлорид широко распространена в природе. Концентрация соли в океанской воде составляет около 2,68%, но ее также можно добывать на суше в виде толстых отложений в результате испарения доисторических океанов. Однако есть несколько примесей щелочных веществ, которые необходимо смыть, и это делается с использованием HCl.
- Травильная сталь: Перед обработкой металлов они должны пройти поверхностную обработку, называемую травлением, которая удаляет любые загрязнения, такие как ржавчина, окалина оксида железа, пятна и другие загрязнения. HCl является распространенным и эффективным травильным агентом из-за своей коррозионной активности, но это также означает, что его можно использовать только для марок углеродистой стали, поскольку он может окрашивать или вызывать коррозию марок нержавеющей стали.

- Обработка кожи: В кожевенной промышленности используется HCl для предотвращения роста бактерий на коже, а также для поддержания ее pH.Это помогает предотвратить разложение.
- Образование неорганических соединений: Соляная кислота легко реагирует с щелочными веществами и другими химическими веществами. В результате этих реакций образуются соединения, такие как трехвалентная кислота и хлоргидрат алюминия, которые затем можно использовать для обработки воды.
- Помощь при добыче нефтяных скважин : HCl также используется в больших количествах в нефтедобывающей промышленности, где он применяется при бурении стволов для растворения минералов горных пород, что упрощает бурение.
- Обработка пищевых добавок: Соляная кислота используется при переработке различных пищевых добавок, таких как фруктоза, лимонная кислота и гидролизованный растительный белок.

Соляная кислота — неорганическая кислота, состоящая всего из двух элементов: водорода и хлора. Он имеет простую химическую формулу HCl.Он становится кислотой только при растворении в воде, технически известной как водный раствор. При растворении в воде формулу можно записать как HCl (водн.) .
Если он не растворяется в воде, он известен просто как хлористый водород. В этом состоянии это бесцветный газ при комнатной температуре. Официальное название соляной кислоты по ИЮПАК — хлоран, но она также известна под многими другими названиями, включая соляную кислоту, соляной спирт, хлорид гидроксония и хлороводородную кислоту.
В водном растворе отрицательный ион хлора диссоциирует с положительным ионом водорода.Затем дополнительный водород соединяется с молекулой воды, образуя группу положительных ионов, состоящую из центрального атома кислорода, окруженного тремя атомами водорода. Это формирует тетраэдрическую ионную структуру, известную как протонированная вода, с ионной формулой H 3 O + .
Это формирует тетраэдрическую ионную структуру, известную как протонированная вода, с ионной формулой H 3 O + .
Исследование, объединяющее инфракрасную, рамановскую, рентгеновскую и нейтронную дифракцию, показало, что концентрированная соляная кислота образует H 5 O 2 + в качестве доминирующего катиона. Этот катион и хлорид-анионы связаны водородными связями с соседними молекулами воды различными способами.
Что такое pH соляной кислоты?Как и другие типы кислот, pH соляной кислоты варьируется в зависимости от концентрации. Например, коммерчески доступная соляная кислота имеет уровень pH от 1 до 2 при концентрации 31,45%.
Истинным показателем силы кислоты является константа диссоциации, или pKa. Это соотношение между количеством ионов и количеством молекул вещества в водном растворе.Формула записывается как:
- K a = Константа диссоциации кислоты
- [A — ] = Концентрация конъюгированного основания кислоты
- [H + ] = Концентрация ионов водорода
- [HA] = Концентрация химических веществ HA
Чем ниже pKa, тем легче кислому раствору отдавать или отдавать протоны.

 Вы даже можете встретить ее в составе содовой.
Вы даже можете встретить ее в составе содовой.

 Во многих случаях,
швы и закрытия имеют более короткое время прорыва и более высокую проницаемость
ставки, чем ткань.Пожалуйста, свяжитесь с DuPont для получения конкретных данных. Если ткань
рвется, истирается или прокалывается, или если швы или затворы выходят из строя, или если
прикрепленные перчатки, козырьки и т. д. повреждены, конечный пользователь должен прекратить использование
одежды, чтобы избежать потенциального воздействия химикатов. Поскольку условия использования
находятся вне нашего контроля, мы не даем никаких гарантий, явных или подразумеваемых,
включая, помимо прочего, отсутствие гарантий товарной пригодности или пригодности
для конкретного использования и не несем ответственности в связи с любым использованием
эта информация.Эта информация не предназначена для использования в качестве лицензии на работу.
под или с рекомендацией нарушить какой-либо патент или техническую информацию
компании DuPont или других лиц, охватывающих любой материал или его использование.
Во многих случаях,
швы и закрытия имеют более короткое время прорыва и более высокую проницаемость
ставки, чем ткань.Пожалуйста, свяжитесь с DuPont для получения конкретных данных. Если ткань
рвется, истирается или прокалывается, или если швы или затворы выходят из строя, или если
прикрепленные перчатки, козырьки и т. д. повреждены, конечный пользователь должен прекратить использование
одежды, чтобы избежать потенциального воздействия химикатов. Поскольку условия использования
находятся вне нашего контроля, мы не даем никаких гарантий, явных или подразумеваемых,
включая, помимо прочего, отсутствие гарантий товарной пригодности или пригодности
для конкретного использования и не несем ответственности в связи с любым использованием
эта информация.Эта информация не предназначена для использования в качестве лицензии на работу.
под или с рекомендацией нарушить какой-либо патент или техническую информацию
компании DuPont или других лиц, охватывающих любой материал или его использование.

 По состоянию на 27 июня 2016 г.
По состоянию на 27 июня 2016 г.
 Например, хлор в полимерных пластиках, таких как поливинилхлорид (ПВХ), образуется в результате полимеризации мономера винилхлорида. Одним из путей получения мономеров винилхлорида является экзотермическая реакция ацетилена с безводным газообразным хлористым водородом в присутствии хлорида ртути в качестве катализатора. Вычисленное химическое уравнение: C 2 H 2 + HCl → CH 2 = CHCl.
Например, хлор в полимерных пластиках, таких как поливинилхлорид (ПВХ), образуется в результате полимеризации мономера винилхлорида. Одним из путей получения мономеров винилхлорида является экзотермическая реакция ацетилена с безводным газообразным хлористым водородом в присутствии хлорида ртути в качестве катализатора. Вычисленное химическое уравнение: C 2 H 2 + HCl → CH 2 = CHCl. Гипохлорит натрия, щелочь, регулярно добавляют в бассейны для их дезинфекции.Но его щелочность означает, что он может легко стать чрезмерным и вызвать раздражение кожи пользователей бассейна. Таким образом, уровень pH воды можно снизить, добавив HCl.
Гипохлорит натрия, щелочь, регулярно добавляют в бассейны для их дезинфекции.Но его щелочность означает, что он может легко стать чрезмерным и вызвать раздражение кожи пользователей бассейна. Таким образом, уровень pH воды можно снизить, добавив HCl.
