Вариант i приведены схемы реакций составьте уравнения химических реакций и укажите их тип
Вариант I
Приведены схемы реакций. Составьте уравнения химических реакций и укажите их тип:
а) оксид фосфора (V) + вода →фосфорная кислота
б) соляная кислота + алюминий → хлорид алюминия + водород
в) нитрат серебра + хлорид железа (III)→хлорид серебра + нитрат железа(Ш)
г) гидроксид цинка (II) → оксид цинка (II) + вода
Задача 1. Рассчитайте объем углекислого газа (н. у.), полученного при полном сгорании 2, г углерода.
Задача 2. Какое количество вещества и масса железа потребуется для реакции с 16 г серы? Схема реакции: Fe + S = FeS
Вариант II
Приведены схемы реакций. Составьте уравнения химических реакций и укажите их тип:
а) оксид серы (IV) + вода →сернистая кислота
б) серная кислота + цинк →сульфат цинка + водород
в) азотная кислота + гидроксид хрома
г) гидроксид железа (II) →оксид железа (II) + вода
Задача 1. Рассчитайте
объем водорода (н. у.), полученного при
взаимодействии 48 г магния
с избытком соляной кислоты.
Рассчитайте
объем водорода (н. у.), полученного при
взаимодействии 48 г магния
с избытком соляной кислоты.
Задача 2. Вычислите массу натрия, необходимого для получения 10,7 г хлорида натрия в избытке хлора. Схема реакции: 2Na + С12 = 2NaCl
Вариант III
Приведены схемы реакций. Составьте уравнения химических реакций и укажите их тип:
а) оксид кальция + оксид углерода (IV) →карбонат кальция
б) серная кислота + алюминий →сульфат алюминия + водород
в) фосфорная кислота + гидроксид натрия →фосфат натрия +вода.
г) азотная
кислота →вода + оксид азота (IV)
+ кислород
Задача 2. Вычислите массу и количество
вещества фосфора, необходимого
для реакции с кислородом объемом 11,2 л
(н. у.).
у.).
Уравнения химических реакций — Справочник химика 21
Индексы кИ относятся соответственно к конечным и начальным продуктам реакции индексы, —ко всем участникам реакции к. и v —коэффициенты стехиометрического уравнения химической реакции. [c.72] В случае химической реакции закон сохранения массы принимает иную характерную форму ему подчиняются не компоненты, а химические элементы или, возможно, отдельные радикалы. Вместо суммы чисел молей отдельных компонентов неизменной остается сумма чисел атомов отдельных элементов. Этот факт выражается с помощью уравнения химической реакции. Обычная общая форма этого уравнения
Сравнивая математические операции, выполняемые при комбинировании уравнений химических реакций, а также и соответствующих величин А 2, можно заметить, что эти операции совершенно идентичны. Следовательно, для того чтобы рассчитать свободную энергию какой-либо химической реакции, необходимо подобрать две или большее количество таких химических реакций (с известными значениями А 2), из которых посредством простых арифметических действий можно было бы скомбинировать уравнение интересующей нас химической реакции.
 [c.117]
[c.117]Стехиометрическое уравнение химической реакции показывает, в каких соотношениях вещества вступают во взаимодействие. Однако оказывается, что очень редко реакция протекает по схеме [c.35]
Уравнения химических реакций с указанием теплового эффекта [c.160]
К правой части стехиометрического уравнения химической реакции прибавляют член, показывающий разность между внутренними энергиями (или энтальпиями) исходных веществ и продуктов реакции, т. е. убыль внутренней энергии (энтальпии) системы. Если эта убыль положительна, то при реакции теплота выдел яется, если убыль отрицательна, то теплота поглощается извне. Уравнения, записанные таким образом, называются термохимическими. [c.58]
Определение посредством комбинирования уравнений химических реакций, для которых Д 2 определена одним из первых двух методов. [c.102]
Определение Д 2 посредством комбинирования уравнений химических реакций [c. 116]
116]
Здесь мы познакомим читателя с косвенным методом онределения величины Д2, основанном на комбинировании уравнений химических реакций и их свободных энергий.
Напишем теперь уравнения химических реакций образования ацети фена и бензола из элементов в развернутом виде [c.116]
Сложив приведенные выше уравнения химических реакций, получаем [c.118]
Приняв в этом случае, что при дегидрировании х молей циклогексана образуется, в соответствии с уравнением химической реакции, х мо- [c.137]
Возвращаясь к теории Лэнгмюра, отметим, что в большинстве гетерогенных реакций, представляющих интерес, участвуют газообразные реагенты, поэтому дальнейшее обсуждение будет ограничено газовыми реакциями. Процесс хемосорбции может быть представлен как реакция между адсорбатом (О) и активным участком на поверхности (а) и описан уравнением, подобным уравнению химической реакции [c. 208]
208]
В уравнении химической реакции каждая формула изображает один моль соответствующего вещества. Поэтому, зная мольные массы участвующих в реакции веществ, молуравнению реакции найти соотношение между массами веществ, вступающих в реакцию н образующихся в результате ее протекания. Если в реакции участвуют вещества в газообразном состоянии, то уравнение реакции позволяет найти их объемные отношения. [c.25]
Для того чтобы получить уравнение закона действия масс, представим уравнение химической реакции в общем виде [c.174]
Здесь следует обратить внимание на важное обстоятельство. Последняя реакция является обратной по отношению к рассматриваемой в примере 2, и выражение для константы равновесия получается обратным к выражению для константы равновесия обратной реакции. Если обратить полное уравнение химической реакции, то следует обратить и выражение для ее константы равновесия, поскольку то, что вначале считалось реагентами, теперь стало продуктами, и наоборот.
Вот это утверждение уже представляет собой уравнение химической реакции меди с кислородом, приводящей к получению оксида меди(1). Числа, 2 и 4, помещенные перед символами или формулами, называются стехиомет-рическими коэффициентами. Для проверки подсчитаем атомы каждого элемента в обеих частях уравнения [c.107]
Уравнение химической реакции показывает, что для сгорания каждого моля метана требуется два моля газообразного кислорода, т. е. в нашем случае нужно 2 40,6 моль О2, или [c.370]
Теоретическое количество кислорода, как следует из уравнений химических реакций окисления (горения) 1 кг топлива, определяется из следующего выражения [c.93]
Рассмотрим реакцию, в которой вещества А и В при взаимодействии образ уют С. Уравнение химической реакции пе записываем, поскольку ОНО является очень простым. Пусть в любой момент времени в системе заданной массы и объема V при- [c. 26]
26]
Тем не менее, при образовании фосгена дело обстоит совсем не так. В этом случае уравнение химической реакции запишется [c.30]
Стехиометрическое уравнение химической реакции можно записать в общем виде [c.12]
Составить основное уравнение химической реакции. [c.208]
Что означает слово полное в полном уравнении химической реакции Каким образом полное уравнение реакции иллюстрирует закон сохранения массы [c.102]
Ниже приведено полное уравнение химической реакции [c.105]
Химико-технологические расчеты в производстве минеральных удобрении основаны иа балансовых уравнениях химических реакций обменного разложения или окислительпо-восстаповительных гетерогенных некаталитических процессов. В производстве фосфорной кислоты степень разложе1Н1я фосфата серион кислотой характеризуется коэффициентом разложения
Обратимся теперь к приведенному выше уравнению химической реакции общего вида [c. 183]
183]
Таким образом, решение проблемы влияния нарушения функции распределения на скорость элементарного процесса в общем виде требует установления связи между микроскопическими величинами, характеризующими распределение, и макроскопическим коэффициентом скорости, т. е. решения в общем виде системы уравнений (2,103), к которой присоединены уравнения для заселенностей различных квантовых состояний и уравнения химической реакции. [c.96]
Пример У1-3. Использовать уравнение (У1-28) для вывода кинетического уравнения химической реакции, рассмотренной в примере VI- . [c.177]
Закон Гесса позноляет вычислять тепловые эффекты, оперируя с уравнениями химических реакций так же, как и с обычными алгебраическими уравнениями. [c.53]
Ниже приведены вопросы о кислороде во вдыхаемом и выдыхаемом воздухе и о сгорарии глюкозы в организме. На все из них можно ответить, используя гонятия, которые вы уже изучали (моли и молярные соотношения, следуьзщие из уравнений химических реакций). Для иллюстрации рассмотрим, как отвечать на вопросы этого упражнения. [c.369]
Для иллюстрации рассмотрим, как отвечать на вопросы этого упражнения. [c.369]
Как видно из уравнений химических реакций, для превращения 1 кмоля С в СО2 требуется 1 кмолъ О2 и нри этом получается [c.91]
Важно отметить, что численное значение константы скорости зависит от реагента или продукта, выбранного при определении порядка реакции. Например, если стехиометричеокое уравнение химической реакции имеет вид
Через электролитическую ячейку, содержащую расплавленный Zn lj, в течение определенного времени пропускают ток силой 3,0 А. При этом на катоде выделяется 24,5 г металлического Zn. Запишите уравнение химической реакции на катоде. Составьте уравнение реакции, протекающей на аноде. Сколько времени должен продолжаться указанный процесс Какая масса газообразного хлора выделится при этом на аноде [c.61]
В химических реакциях должно выполняться правило сохранения алгебраической суммы степеней окисления всех атомов. Именно это правило делает понятие степени окисления столь важным в современной химии. Если в ходе химической реакции степень окисления атома повышается, говорят, что он окисляется, если же степень окисления атома понижается, говорят, что он восстанавливается. В полном уравнении химической реакции окислительные и восстановите. ьные процессы должны точно компенсировать друг друга. [c.417]
Именно это правило делает понятие степени окисления столь важным в современной химии. Если в ходе химической реакции степень окисления атома повышается, говорят, что он окисляется, если же степень окисления атома понижается, говорят, что он восстанавливается. В полном уравнении химической реакции окислительные и восстановите. ьные процессы должны точно компенсировать друг друга. [c.417]
| 1. | Химическая реакция | 1 вид — рецептивный | лёгкое |
1 Б.
|
Надо определить, для какого из приведённых процессов можно записать уравнение реакции. Повторяется классификация явлений на физические и химические. |
| 2. | Реагенты и продукты реакции | 1 вид — рецептивный | лёгкое | 1 Б. | Требуется найти формулы реагентов и формулы продуктов реакции в уравнении. |
3.
|
Сколько атомов в формуле? | 1 вид — рецептивный | лёгкое | 1 Б. | Задание на формирование новыков определения числа атомов химического элемента по формуле с коэффициентом. |
| 4. | Пропущенный коэффициент | 2 вид — интерпретация | среднее |
2 Б.
|
Требуется проставить пропущенный коэффициент в уравнении реакции. Отрабатывается умение сравнивать число атомов химического элемента в левой и правой части уравнения реакции. |
| 5. | Найди ошибку в уравнении реакции | 2 вид — интерпретация | среднее | 2 Б. |
Надо проверить уравнения реакции и выбрать то, в котором допущена ошибка в расстановке коэффициентов.
|
| 6. | Характеристика реакции | 3 вид — анализ | среднее | 3 Б. | Требуется расставить коэффициенты в уравнении реакции и указать условия её проведения и признаки протекания. |
| 7. | Допиши уравнение | 3 вид — анализ | сложное |
3 Б.
|
Требуется дописать в уравнении пропущенную формулу и расставить коэффициенты. |
| 8. | Соответствие между реагентами и продуктами реакции | 3 вид — анализ | сложное | 3 Б. | Требуется установить соответствие между левой и правой частями уравнения реакции. |
9.
|
Запиши уравнение реакции | 3 вид — анализ | сложное | 4 Б. | Требуется составить формулы реагирующих веществ и уравнение реакции по её описанию. |
Презентация «Химические уравнения. Типы Химических реакций»
библиотека
материалов
Содержание слайдов
Номер слайда 1
Номер слайда 2
Химические уравнения — Это условная запись химической реакции с помощью химических формул, коэффициентов и математических знаков
Номер слайда 3
2 h3 + O2 = 2 h3O
Номер слайда 4
Химическая реакция происходит согласно ЗАКОНУ СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВА
Номер слайда 5
Закон сохранения массы вещества ( М. В. Ломоносов – 1756 г.) Масса веществ, вступивших в химическую реакцию, равна массе веществ, получившихся в ее результате.
В. Ломоносов – 1756 г.) Масса веществ, вступивших в химическую реакцию, равна массе веществ, получившихся в ее результате.
Номер слайда 6
NaOH + HCl = NaCl + h3O
Номер слайда 7
По уравнению можно определить тип химической реакции
Номер слайда 8
Основные типы химических реакций
Номер слайда 9
Реакции соединения Несколько простых или сложных веществ соединяются в одно, более сложное Zn + S = ZnS CaO + CO2 = CaCO3 Na2O + h3O = 2 NaOH 4Al + 3O2 = 2 Al2O3 Левая часть уравнения – несколько веществ, правая часть – только одно сложное!
Номер слайда 10
Реакции разложения Являются обратными реакциям соединения Из одного сложного вещества получаются несколько других веществ CaCO3 = CaO + CO2 2 KMnO4 = K2MnO4 + MnO2 + O2 2 Fe(OH)3 = Fe2O3 + 3 h3O В левой части уравнения – одно сложное вещество, в правой – несколько различных.
Номер слайда 11
Реакции замещения Это реакции между простым и сложным веществами, в которых атомы простого вещества замещают атомы одного из элементов в сложном веществе. Mg + 2 HCl = MgCl2 + h3 3 CuSO4 + 2 Al = Al2(SO4)3 +3 Cu Левая часть уравнения – простое и сложное вещества, правая – новое простое и новое сложное
Номер слайда 12
Реакции обмена Это реакции, при которых два сложных вещества обмениваются своими составными частями CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4 AgNO3 + HCl = HNO3 + AgCl
Номер слайда 13
Составьте уравнения химических реакций: Горение угля Взаимодействие цинка с соляной кислотой Разложение воды электрическим током Прокаливание карбоната кальция Взаимодействие оксида меди (II) с серной кислотой
Номер слайда 14
Составьте уравнения химических реакций по схемам, определите тип реакций: Cu(OH)2 Na2O + h3O Zn + S P + O2 P2O5 + h3O
Номер слайда 15
Расставьте коэффициенты в предложенных схемах уравнений, определите тип реакций: Al + O2 Al2O3 Fe2O3 +h3O Fe(OH)3 K + h4PO4 K3PO4 + h3 NaOH + h3SO4 Na2SO4 + h3O KMnO4 K2MnO4 + MnO2 + O2
4.
 1: Химические реакции и химические уравнения
1: Химические реакции и химические уравнения\[2H_2 + O_2 \rightarrow 2H_2O\]
Химические формулы и другие символы используются для обозначения исходных материалов или реагентов, которые по соглашению записываются в левой части уравнения, и конечных соединений или продуктов, которые записываются в правой. Стрелка указывает от реагента к продуктам. Химическая реакция вулкана дихромата аммония на рисунке \(\PageIndex{1}\) равна
.\[ (NH_4)_2Cr_2O_7 \rightarrow Cr_2O_3 + N_2 + 4H_2O \label{4.1.1} \]
\[ реагенты \, \, \, \, \,\, \, \, \, \, \, \,\,\, продукты \]
Стрелка читается как «уступает» или «реагирует на форму». Уравнение 4.1.1 показывает, что дихромат аммония (реагент) дает оксид хрома (III), азот и воду (продукты). Уравнение этой реакции еще более информативно, если записать его следующим образом:
\[ (NH_4)_2Cr_2O_7(s) \rightarrow Cr_2O_{3\;(s)} + N_{2\;(g)} + 4H_2O_{(g)} \label{4.1.2}\]
Уравнение 4.1.2 идентично уравнению 4. 1.1, за исключением добавления аббревиатур в скобках для обозначения физического состояния каждого вида. Сокращения: (s) для твердого вещества, (l) для жидкости, (g) для газа и (aq) для водного раствора, раствора вещества в воде.
1.1, за исключением добавления аббревиатур в скобках для обозначения физического состояния каждого вида. Сокращения: (s) для твердого вещества, (l) для жидкости, (g) для газа и (aq) для водного раствора, раствора вещества в воде.
В соответствии с законом сохранения массы количество атомов каждого типа одинаково в обеих частях уравнений 4.1.1 и 4.1.2. Каждая сторона реакции имеет два атома хрома, семь атомов кислорода, два атома азота и восемь атомов водорода.
В сбалансированном химическом уравнении число атомов каждого типа и общий заряд одинаковы с обеих сторон. Уравнения 4.1.1 и 4.1.2 представляют собой сбалансированные химические уравнения. Каждая сторона уравнения отличается тем, как атомы устроены так, чтобы образовывать молекулы или ионы. Химическая реакция представляет собой изменение в распределении атомов, но не в количестве атомов. В этой реакции и в большинстве химических реакций связи в реагентах разрываются (здесь связи Cr–O и N–H) и образуются новые связи для создания продуктов (здесь связи O–H и N≡N). .Если числа атомов каждого типа различны в двух частях химического уравнения, то уравнение несбалансировано и не может правильно описать то, что происходит во время реакции. Чтобы продолжить, уравнение должно быть сначала сбалансировано.
.Если числа атомов каждого типа различны в двух частях химического уравнения, то уравнение несбалансировано и не может правильно описать то, что происходит во время реакции. Чтобы продолжить, уравнение должно быть сначала сбалансировано.
двух веществ в химической реакции есть отношение их коэффициентов в сбалансированном химическом уравнении.
Введение в уравнения химических реакций: https://youtu.be/5mjawuf7K2Q
Как писать уравнения простых реакций
Балансировка уравнения
Каждый написанный вами символ считается за один атом (или один ион) этого элемента.(Позже вы столкнетесь с другим, более математическим взглядом на это, но это будет в будущем.)
Это означает, что в уравнении, которое мы только что написали, вы, кажется, начали с 2 атомов кислорода, а закончили только с 1 в продукте. Нельзя просто так потерять атом кислорода — все надо учитывать.
Вот снова незаконченное уравнение. . .
. .
Mg + O 2 MgO
Так как же получить еще один кислород с правой стороны?
То, что вы абсолютно не должны делать , так это изменять формулу оксида магния.Вы не можете просто переписать формулу оксида магния как MgO 2 — этого не существует! Вы никогда не должны пытаться сбалансировать уравнение, изменяя формулу.
Что вам нужно, так это образовать в два раза больше MgO. Вы можете сделать это, написав большую цифру «2» перед формулой.
Большое число перед формулой умножает всю формулу, пока вы не дойдете до разрыва — например, конца уравнения, знака плюс или стрелки.
Таким образом, исправленная версия будет .. .
Mg + O 2 2MgO
Но будьте осторожны! Написав, что 2, вы нарушили баланс магния. Если оставить все как есть, кажется, что вы каким-то волшебным образом создали еще один атом магния из ниоткуда.
Конечно, это легко исправить, переписав уравнение, начав с 2 атомов магния.
2Mg + O 2 2MgO
И это правильное уравнение — теперь все уравновешено с обеих сторон.
Это, конечно, тривиальный пример, и все это будет просто прокручиваться в вашей голове, но он иллюстрирует принципы.
Вы должны начать со словесного уравнения, даже если оно существует только в вашей голове.
Запишите формулы для всего в вашем словесном уравнении.
Найдите место, где уравнение не сбалансировано, и исправьте его. (Я дам вам дополнительную помощь в этом в следующих примерах.)
В конце вернитесь и проверьте все еще раз на тот случай, если, переделывая что-то, вы накосячили что-то уже проверенное — как, например, с магнием выше.
Примеры
Пример 1
Гептан является одним из углеводородов бензина. Он имеет формулу C 7 H 16 и сгорает с образованием углекислого газа и воды. Напишите уравнение для этого.
Он имеет формулу C 7 H 16 и сгорает с образованием углекислого газа и воды. Напишите уравнение для этого.
У вас есть вся необходимая информация в вопросе, поэтому все, что вам нужно сделать, это записать формулы, чтобы начать процесс написания уравнения. (Я предполагаю, что вы знаете формулы углекислого газа и воды.)
C 7 H 16 + O 2 CO 2 + H 2 O
Лучший способ сбалансировать большинство уравнений — начать с самого начала и работать с элементами по одному. Тем не менее, было бы неплохо оставить до конца все, что встречается более одного раза в любой части уравнения — в данном случае кислород.
Обычно вы обнаружите, что позже это легко уладится.
Итак, начнем с углерода.Если в левой части 7 атомов, то и в правой должно быть 7 атомов. Это означает, что вы должны были произвести 7 молекул углекислого газа.
C 7 H 16 + O 2 7CO 2 + H 2 O
Теперь водороды. Слева 16 атомов водорода, значит, и справа тоже должно быть 16. Вы должны произвести 8 молекул воды.
Слева 16 атомов водорода, значит, и справа тоже должно быть 16. Вы должны произвести 8 молекул воды.
C 7 H 16 + O 2 7CO 2 + 8H 2 O
Теперь посчитайте кислород.Всего на правой стороне их 22. Чтобы получить 22 атома, вы должны начать с 11 молекул кислорода.
C 7 H 16 + 11O 2 7CO 2 + 8H 2 O
И все в порядке. Обычно вы, конечно, не записываете все эти этапы — вы просто записываете исходные формулы, оставляя достаточно места для балансировочных чисел, а затем записываете их по мере их обработки.
Пример 2
Карбонат кальция реагирует с разбавленной соляной кислотой с образованием раствора хлорида кальция, углекислого газа и воды.Напишите уравнение для этого.
Вы должны знать, что разбавленная соляная кислота представляет собой раствор хлористого водорода в воде. Для целей уравнения вы можете просто написать это как HCl. Очевидно, вы должны знать, как выводить эту формулу, но, честно говоря, вы будете встречать ее столько раз, что будете просто знать.
Для целей уравнения вы можете просто написать это как HCl. Очевидно, вы должны знать, как выводить эту формулу, но, честно говоря, вы будете встречать ее столько раз, что будете просто знать.
Если вы разработаете другие формулы, вы получите . . .
CaCO 3 + HCl CaCl 2 + CO 2 + H 2 O
Слева направо, кальций в норме; углерод тоже в порядке; кислород в норме.Водород и хлор явно не в порядке.
Вы можете исправить хлор, имея две партии HCl — НЕ , превратив HCl в несуществующую HCl 2 . Это также ставит водород правильно.
Это дает окончательное сбалансированное уравнение. . .
CaCO 3 + 2HCl CaCl 2 + CO 2 + H 2 O
Пример 3
Это должно проиллюстрировать, как вы решаете конкретную проблему, которая возникает время от времени.
Если нагреть твердый нитрат меди(II), то получится оксид меди(II), диоксид азота и кислород. Уравнение несбалансированного символа . . .
Cu(NO 3 ) 2 CuO + NO 2 + O 2
Работаем систематически, медь в порядке.
С левой стороны 2 атома азота. Маленькая цифра 2 после скобок относится ко всему, что находится внутри скобок. Поэтому вам нужно 2 диоксида азота с правой стороны.
Cu(NO 3 ) 2 CuO + 2NO 2 + O 2
Теперь остается сложная проблема с кислородом. Слева их 6 (2 партии по 3), а справа 7. Не сразу понятно, как с этим разобраться.
Хитрость заключается в том, чтобы позволить себе иметь половину молекулы кислорода — половина молекулы кислорода — это всего лишь один атом кислорода.
Cu(NO 3 ) 2 CuO + 2NO 2 + ½O 2
Теперь с обеих сторон по 6 атомов кислорода.
Хотя обычно так не оставишь. Половинки в уравнениях кажутся неправильными, хотя если вы занимаетесь химией на более продвинутом уровне, они не редкость. Вы можете избавиться от половины, удвоив все в уравнении.
2Cu(NO 3 ) 2 2CuO + 4NO 2 + O 2
Если сейчас все подсчитать, то все уравновешивается.
Вода для жизни — OpenLearn
В предыдущем разделе показано, как различные элементы могут существовать сами по себе или объединяться с другими элементами, образуя соединения.Этот раздел основывается на этих идеях, более подробно рассматривая химические реакции. Он также показывает, как химическую стенографию можно расширить для описания химических реакций.
Сначала рассмотрим некоторые из молекул, описанных ранее: вода, метан, углекислый газ и аммиак.
Вопрос 26
Каковы формулы каждой из этих четырех молекул?
Ответ
Формулы: H 2 O, CH 4 , CO 2 и NH 3 соответственно.
Хотя вам не нужно запоминать химические формулы соединений, представленных в этом курсе, вы, вероятно, сочтете полезным запомнить некоторые из них, например, для четырех молекул выше, а также формулы для водорода (H 2 ). , молекулы азота (N 2 ) и кислорода (O 2 ). Это поможет вам читать и писать эти химические формулы без постоянного обращения к предыдущим разделам.
Теперь вы посмотрите на реакции с участием элементов водорода, углерода и кислорода, а также соединений метана, воды и углекислого газа.
Водород реагирует с кислородом при воспламенении (весьма взрывоопасен) с образованием воды. Чтобы записать такую реакцию в терминах химического уравнения , вещества, вступающие в реакцию, помещаются слева, а вещества, которые образуются в реакции, помещаются справа. реагентов слева связаны с продуктами справа стрелкой.
Уравнение может быть записано как словесное уравнение «водород и кислород образуют воду» или, используя небольшое химическое сокращение, оно может быть записано как:
, где стрелка означает «идти к».
Теперь попробуйте написать уравнение, используя химическую стенографию. Замена символов в слове уравнение дает:
Уравнение показывает, что реагенты слева от стрелки превращаются в продукт справа. Однако с этим уравнением что-то не так. Вы можете увидеть, что не так, взглянув на рисунок 21, где реагенты и продукты показаны в виде диаграммы.
Рис. 21 Неуравновешенное уравнение реакции между водородом и кислородом с образованием воды: (а) схематическое изображение; б) шаростержневая модель.Обратите внимание, что молекула кислорода состоит из двух атомов кислорода, связанных двойной связью. Это связано с тем, что каждый атом кислорода имеет два «крючка» для соединения.
Подсчет количества атомов в каждой части уравнения показывает, что слева два атома кислорода по сравнению с одним справа. Количество атомов кислорода в обеих частях уравнения должно быть одинаковым — они не могут волшебным образом появляться и исчезать во время реакции. Невозможно изменить состав молекулы воды в правой части уравнения, поскольку молекула воды существует как группа из двух атомов водорода и одного атома кислорода, связанных вместе. Каждая молекула кислорода поставляет два атома кислорода, поэтому всегда будет образовываться две молекулы воды, при условии, что есть две молекулы водорода (каждая из которых состоит из двух атомов), которые реагируют с ней. Таким образом, две молекул водорода и одна молекула кислорода необходимы для образования двух молекул воды. Реакция точно выражается следующим образом:
Каждая молекула кислорода поставляет два атома кислорода, поэтому всегда будет образовываться две молекулы воды, при условии, что есть две молекулы водорода (каждая из которых состоит из двух атомов), которые реагируют с ней. Таким образом, две молекул водорода и одна молекула кислорода необходимы для образования двух молекул воды. Реакция точно выражается следующим образом:
Теперь в обеих частях уравнения имеется одинаковое количество атомов каждого типа: химическое уравнение уравновешено , так что теперь мы можем заменить стрелку знаком равенства.
Окончательная подчистка, позволяющая избежать повторения молекул водорода в левой части уравнения и молекул воды в правой, заключается в представлении их как 2H 2 , а не как H 2 + H 2 . Таким образом, сбалансированное химическое уравнение принимает вид:
Это схематически показано на рисунке 22.
Рисунок 22. Сбалансированное уравнение реакции между водородом и кислородом с образованием воды: (a) схематическое изображение; (b) модель «шарик и стержень»
Химические уравнения в очень сжатой форме показывают не только то, какие атомы и молекулы реагируют вместе, образуя продукты, но также и то, сколько атомов и молекул каждого вида задействовано. Важно помнить, что число перед молекулой означает номер этой конкретной молекулы. Например, 3H 2 O означает три молекулы воды, что в сумме дает шесть атомов водорода и три атома кислорода.
Важно помнить, что число перед молекулой означает номер этой конкретной молекулы. Например, 3H 2 O означает три молекулы воды, что в сумме дает шесть атомов водорода и три атома кислорода.
Химические уравнения должны быть сбалансированы; количество атомов каждого типа элемента в обеих частях уравнения должно быть равным.
Теперь вы знаете, как «читать» или интерпретировать химическое уравнение и как оно представляет собой химический процесс. Однако химики также очень хорошо умеют писать химические уравнения как форму стенографии для описания различных химических процессов или реакций.Написание химических уравнений похоже на написание любого иностранного языка — для того, чтобы свободно говорить, требуется практика. Тем не менее, все начинающие ученые должны с чего-то начинать, и в следующем разделе показано, как это сделать, используя очень знакомую химическую реакцию. Если вы хотите проверить, нужно ли вам изучать этот раздел, сначала попробуйте ответить на вопрос 20.
Пять типов реакций — SAS
Меры предосторожности: Учащимся НЕ разрешается работать с концентрированной серной кислотой.Он чрезвычайно раздражает кожу и глаза и обладает высокой реакционной способностью. Вы будете разбавлять 18M серную кислоту до 3M серной кислоты. Добавляйте кислоту ОЧЕНЬ медленно в холодную воду с кубиками льда, постоянно помешивая. Если тепло накапливается, оно может попасть на кожу и вызвать серьезные ожоги.
Предварительная подготовка: Приготовьте разбавленный раствор серной кислоты. Перед уроком потренируйтесь с демонстрацией «Слоновьей зубной пасты».
Скажите ученикам, что вы собираетесь провести для них демонстрацию.Демонстрация представляет собой химическую реакцию. Они увидят признаки того, что происходит химическая реакция (изменение цвета, образование осадка, образование газа, выделение тепла и т. д.). Работая с демонстрацией, записывайте продукты и реагенты на доске. Учащиеся должны скопировать эту информацию, а также свои наблюдения в свою тетрадь.
Учащиеся должны скопировать эту информацию, а также свои наблюдения в свою тетрадь.
Демонстрация: «Слоновья зубная паста»
Используя стеклянный градуированный цилиндр на 500 мл (меньший размер подойдет, но не будет таким театральным), добавьте 5 мл жидкого средства для мытья посуды и 20 мл концентрированного (30%) H 2 O 2 .Размешать. Если у вас нет доступа к концентрированной перекиси водорода, вы можете использовать H 2 O 2 из местного магазина, имея в виду, что она составляет всего 3%. Чтобы конечный продукт выглядел как зубная паста, вы можете капнуть две капли красного пищевого красителя на одну сторону цилиндра. Затем капните две капли зеленого пищевого красителя на другую сторону цилиндра. Когда будете готовы, добавьте 5 мл 2М йодида калия (KI).
Добавляя реагенты, попросите учащихся записывать их, чтобы они могли попрактиковаться в различении реагентов и продуктов.Предложите учащимся записать свои наблюдения. Они должны заметить, что в результате реакции выделяется значительное количество тепла и пузырьков. Возможно, вам придется помочь им записать продукты этой реакции, как показано ниже. Не балансируйте уравнение. На основе Урока 1 учащиеся должны быть в состоянии составить список атомов и сбалансировать реакцию; проведите их через это, если это необходимо.
Они должны заметить, что в результате реакции выделяется значительное количество тепла и пузырьков. Возможно, вам придется помочь им записать продукты этой реакции, как показано ниже. Не балансируйте уравнение. На основе Урока 1 учащиеся должны быть в состоянии составить список атомов и сбалансировать реакцию; проведите их через это, если это необходимо.
Неуравновешенная реакция: H 2 O 2 KI O 2 + H 2 O
Сбалансированная реакция: 2H 2 O 2 KI O 2 + 2H 2 O
Спросите учащихся, «Какие наблюдения вы сделали?» Введите несколько ответов и объясните, почему произошло каждое наблюдение.Большинство учащихся заметят появление пузырьков или пены. Газообразный кислород попадает в мыло, в результате чего образуется пена. На самом деле, если поджечь спичкой деревянную лучинку (кофейную мешалку), задул ее, чтобы она засветилась, и осторожно подержать ее над пузырьками, она снова загорится. Некоторые учащиеся могут заметить появление пены. Если они находятся рядом с демонстрацией, они могут заметить, что на ней жарко. Это результат экзотермической реакции. Сейчас самое время определить экзотермическую реакцию :
На самом деле, если поджечь спичкой деревянную лучинку (кофейную мешалку), задул ее, чтобы она засветилась, и осторожно подержать ее над пузырьками, она снова загорится. Некоторые учащиеся могут заметить появление пены. Если они находятся рядом с демонстрацией, они могут заметить, что на ней жарко. Это результат экзотермической реакции. Сейчас самое время определить экзотермическую реакцию :
Экзотермические реакции: Химические реакции, в ходе которых выделяется тепло или свет.Они часто кажутся теплыми на ощупь. Экзотермические реакции часто записываются с энергией как один из продуктов, например:
2H 2 O 2 KI O 2 + 2 H 2 O + Энергия
Скажите учащимся, «Химические реакции, такие как реакция на демонстрацию зубной пасты для слонов, можно разделить на категории. Есть несколько категорий, на которые обычно ссылаются химики, но сегодня мы сосредоточим наше обсуждение на пяти из них. Пожалуйста, запишите имена в тетради. Оставьте достаточно места, чтобы написать определение и примеры для каждого типа реакции . ” Напишите на доске:
Пожалуйста, запишите имена в тетради. Оставьте достаточно места, чтобы написать определение и примеры для каждого типа реакции . ” Напишите на доске:
Разложение
Синтез
Одиночная замена
Двойная замена
Горение
Реакции разложения
Скажем, «Давайте посмотрим на реакцию слоновьей зубной пасты. Сколько реагентов имеет реакция? Сколько продуктов?» Учащиеся должны ответить единицей и двойкой соответственно.Скажем, «Эта реакция классифицируется как реакция разложения, потому что один реагент, в данном случае H 2 O 2 , распадается на два или более простых продукта (т.е. O 2 и H 2 O). Пожалуйста, запишите это определение в тетрадях. Прежде чем мы перейдем к конкретным примерам, вот общая формула, которую вы можете применить к реакциям разложения. Напишите на доске:
Пожалуйста, запишите это определение в тетрадях. Прежде чем мы перейдем к конкретным примерам, вот общая формула, которую вы можете применить к реакциям разложения. Напишите на доске:
АВ А + В
Примечание: AB представляет собой соединение; A и B представляют собой более простые соединения или элементы.
« Вот конкретный пример» (напишите на доске):
2Cl 2 O 5 2Cl 2 + 5O 2
**Некоторые учащиеся могут спросить, есть ли в этом примере один реагент или два, из-за коэффициента 2 перед пентаоксидом дихлора.Объясните, что по-прежнему существует один тип реагента, но два его набора.
6NaHCO 3 3Na 2 CO 3 + 3H 2 O + 3CO 2
Реакции синтеза
Спросите студентов, «Глядя на список типов реакций, как вы думаете, какой из них противоположен разложению?» (Правильный ответ – синтез. Реакции синтеза иногда называют «реакцией соединения».) «Слово синтез означает создание чего-то нового.Вместо того, чтобы начинать с одного реагента, один продукт будет образовываться из двух или более реагентов. Запишите это определение в свои тетради. Используя общую формулу, которую мы использовали для реакции разложения, можете ли вы создать общую формулу для реакции синтеза?» Напишите на доске:
Реакции синтеза иногда называют «реакцией соединения».) «Слово синтез означает создание чего-то нового.Вместо того, чтобы начинать с одного реагента, один продукт будет образовываться из двух или более реагентов. Запишите это определение в свои тетради. Используя общую формулу, которую мы использовали для реакции разложения, можете ли вы создать общую формулу для реакции синтеза?» Напишите на доске:
А + В АВ
« Вот несколько конкретных примеров» (напишите на доске):
О 2 + 2Н 2 2Н 2 О
2Na + Cl2 2NaCl
Реакции с одинарной и двойной заменой
Скажи, «Как видите, реакции синтеза и разложения связаны между собой.Также связаны реакции одинарного и двойного замещения. В реакции с одной заменой несвязанный элемент заменяет менее реакционноспособный элемент в соединении, создавая новое соединение и один элемент. Общая формула для этого типа реакции выглядит следующим образом» (запишите на доске):
В реакции с одной заменой несвязанный элемент заменяет менее реакционноспособный элемент в соединении, создавая новое соединение и один элемент. Общая формула для этого типа реакции выглядит следующим образом» (запишите на доске):
AB + C B + AC (если C образует отрицательный ион)
AB + C A + CB (если C образует положительный ион)
Металлические и неметаллические отдельные заменители Примеры:
Металл + кислород → оксид металла
ЭКС.2Mg (т) + O 2(г) → 2MgO (т)
Неметалл + кислород → неметаллический оксид
ЭКС. C (s) + O 2(g) → CO 2(g)
Оксид металла + вода → гидроксид металла
ЭКС. MgO (т) + H 2 O (ж) → Mg(OH) 2(т)
Оксид неметалла + вода → кислота
ЭКС.
 CO 2(г) + H 2 O (л) → ; H 2 CO 3(водный)
CO 2(г) + H 2 O (л) → ; H 2 CO 3(водный)
Металл + неметалл → соль
ЭКС. 2 Na (т) + Cl 2(г) → 2NaCl (т)
Источник: http://www.files.chem.vt.edu/RVGS/ACT/notes/Types_of_Equations.html
“ Напомним, что химики называют отрицательные ионы анионами и положительные ионы катионами .Давайте обозначим каждый элемент как катион или анион». Напишите уравнение на доске:
Продолжайте, сказав: «Можно представить себе реакцию одиночного замещения как пару, танцующую (AB), и одинокого человека, вмешивающегося (C), создающего новую пару (AC) и исключающего кого-то (B)». Вы можете использовать известную пару, например, Дженнифер Энистон и Брэд Питт, в качестве пары (AB) и Анджелину Джоли в качестве непарного элемента (C), чтобы добавить к уроку дозу юмора.
Add, «В определении, которое я вам дал, говорится, что несвязанный элемент заменит менее реактивный элемент в соединении, создав новое соединение и один элемент.Как узнать, какие элементы более или менее реакционноспособны, чем другие? Химики создали экспериментальный список распространенных металлов, которые занимают определенные позиции из-за их склонности к реакции. Список называется рядом реактивности металлов . Он помещает более химически активные металлы над менее активными металлами. Вот пример ряда «реактивность металлов» (покажите учащимся следующую таблицу):
“ Обратите внимание, что калий (K) указан выше кальция (Ca) в списке.Посмотрите на следующую реакцию одиночной замены» (запишите на доске):
“ Обратите внимание, что калий, образующий катион, меняется местами с кальцием, который также образует катион. Это сделает калий, потому что он более реактивен, чем кальций (см. диаграмму ряда активности выше) , и менее стабилен, чем кальций, когда он один. Он более стабилен в составе соединения, поэтому замещает кальций (отсюда и название, реакция одинарного замещения).Если бы реакция была записана как…» (напишите на доске):
Это сделает калий, потому что он более реактивен, чем кальций (см. диаграмму ряда активности выше) , и менее стабилен, чем кальций, когда он один. Он более стабилен в составе соединения, поэтому замещает кальций (отсюда и название, реакция одинарного замещения).Если бы реакция была записана как…» (напишите на доске):
“ Не произойдет, потому что кальций не выше калия в ряду реактивности. Давайте попробуем другой пример». Напишите уравнение на доске:
“ Спросите себя, произойдет ли такая реакция? Обратитесь к списку действий. Алюминий здесь представляет собой несвязанный металл (катион). Находится ли он выше металла в соединении (в данном случае меди)? Ответ положительный, поэтому реакция происходит так, как написано.Алюминий, катион, заменяет медь, другой катион, в реакции единственного замещения».
Продолжайте с реакциями с двойной заменой, сказав: «Реакции с двойной заменой аналогичны реакциям с одинарной заменой в том, что вам нужно внимательно относиться к катионам и анионам. Однако вам не нужно будет использовать ряды реактивности металлов. Вот пример общей формулы для реакции двойной замены» (запишите на доске):
Однако вам не нужно будет использовать ряды реактивности металлов. Вот пример общей формулы для реакции двойной замены» (запишите на доске):
“ Какие два катиона? Какие два аниона? Откуда вы знаете?» (Катионы А и С, потому что они пишутся первыми в ионной паре.B и D — анионы, потому что они пишутся вторыми в ионной паре.) Продолжайте, сказав: «Обратите внимание, как катионы меняются местами, как и анионы. Вы начинаете с двух соединений и заканчиваете двумя новыми соединениями. Вот еще примеры». Напишите на доске следующие уравнения:
3MgCl 2 + 2AlN Mg 3 N 2 + 2AlCl 3
CaO + 2KI CaI 2 + K 2 O
2NaF + ZnS Na 2 S + ZnF 2
Реакции горения
Наконец, скажем, «Реакции горения отличаются от других реакций, которые мы рассмотрели, тем, что они обычно следуют очень специфической формуле. Реагентами являются углеводород (в этом уроке) и кислород, а продуктами являются углекислый газ и вода. Костяк следующий» (напишите на доске):
Реагентами являются углеводород (в этом уроке) и кислород, а продуктами являются углекислый газ и вода. Костяк следующий» (напишите на доске):
Продолжайте, сказав: «Часто химики ссылаются на молекулу , горящую в кислороде, когда описывают реакцию горения. Обычно это экзотермические реакции. Что это обозначает?» ( Они выделяют тепло. ) «Вот несколько примеров». Напишите уравнения на доске.
C 10 H 8 + 12O 2 10CO 2 + 4H 2 O + E
C 6 H 12 O 6 + 6O 2 6CO 2 + 6O 2 + Энергия (клеточное дыхание)
Лаборатория: типы реакций
Проведите студентов в лаборатории пяти типов реакций. Раздайте копии Лабораторной таблицы типов реакций (S-C-3-2_Лаборатория типов реакций и KEY.doc) и Таблицы данных (S-C-3-2_Таблица лабораторных данных типов реакций.doc). Часть информации, собранной во время этого лабораторного занятия, будет использована на уроке 3.
Раздайте копии Лабораторной таблицы типов реакций (S-C-3-2_Лаборатория типов реакций и KEY.doc) и Таблицы данных (S-C-3-2_Таблица лабораторных данных типов реакций.doc). Часть информации, собранной во время этого лабораторного занятия, будет использована на уроке 3.
Добавочный номер:
Во время демонстрации «Слоновьей зубной пасты» в качестве катализатора используется йодид калия. Вы можете обсудить роль катализаторов в химических реакциях и связать катализаторы с ферментами, используемыми в биохимических реакциях.
Во время демонстрации «Слоновьей зубной пасты» производилась энергия. Вы можете включить обсуждение термодинамики реакции, такой как энтальпия, энтропия и теплота сгорания (см. Связанные ресурсы).
Учащиеся, которые могут выйти за рамки стандартов во время лабораторных работ, могут собрать газообразный водород из реакции и провести водородный «взрывной тест» (подробную процедуру и объяснение см.
 в разделе «Выбросы водорода» в соответствующих ресурсах).
в разделе «Выбросы водорода» в соответствующих ресурсах).Вы можете обсудить другие типы химических реакций, такие как кислотно-основные и ядерные реакции.
Может оказаться полезным включать заряды в реакции, в которых участвуют катионы и анионы.
Вы можете обсудить, как химики отмечают состояние вещества для каждого реагента и продукта, например:
(г) газ
(с) твердый
(водный) водный
(л) жидкость
6.1 Составление и балансировка химических уравнений – CHEM 1114 – Введение в химию
Упражнения
1.Что значит сказать, что уравнение сбалансировано? Почему важно, чтобы уравнение было сбалансированным?
2. Сбалансируйте следующие уравнения:
а) [латекс]\text{PCl}_5(s) + \text{H}_2 \text{O}(l) \longrightarrow \text{POCl}_3(l) + \text{HCl}(aq) [/латекс]
б) [латекс]\text{Cu}(s) + \text{HNO}_3(водн. ) \longrightarrow \text{Cu(NO}_3)_2(водн.) + \text{H}_2 \text{O }(л) + \text{НЕТ}(г)[/латекс]
) \longrightarrow \text{Cu(NO}_3)_2(водн.) + \text{H}_2 \text{O }(л) + \text{НЕТ}(г)[/латекс]
c) [латекс]\текст{H}_2(g) + \text{I}_2(s) \longrightarrow \text{HI}(s)[/latex]
г) [латекс]\текст{Fe}(s) + \text{O}_2(g) \longrightarrow \text{Fe}_2 \text{O}_3(s)[/latex]
e) [латекс]\text{Na}(s) + \text{H}_2 \text{O}(l) \longrightarrow \text{NaOH}(водн.) + \text{H}_2(g)[ /латекс]
f) [латекс]\текст{(NH}_4)_2 \text{Cr}_2\text{O}_7(s) \longrightarrow \text{Cr}_2\text{O}_3(s) + \text {N}_2(г) + \text{H}_2 \text{O}(г)[/латекс]
г) [латекс]\текст{P}_4(s) + \text{Cl}_2(g) \longrightarrow \text{PCl}_3(l)[/latex]
h) [латекс]\text{PtCl}_4(s) \longrightarrow \text{Pt}(s) + \text{Cl}_2(g)[/latex]
3.Сбалансируйте следующие уравнения:
а) [латекс]\текст{Ag}(s) + \text{H}_2 \text{S}(g) + \text{O}_2(g) \longrightarrow \text{Ag}_2 \text{ S}(s) + \text{H}_2 \text{O}(l)[/latex]
б) [латекс]\текст{P}_4(s) + \text{O}_2(g) \longrightarrow \text{P}_4 \text{O}_{10}(s)[/latex]
c) [латекс]\text{Pb}(s) + \text{H}_2 \text{O}(l) + \text{O}_2(g) \longrightarrow \text{Pb(OH)}_2 (с)[/латекс]
d) [латекс]\text{Fe}(s) + \text{H}_2 \text{O}(l) \longrightarrow \text{Fe}_3 \text{O}_4(s) + \text{ Н}_2(г)[/латекс]
e) [латекс]\text{Sc}_2 \text{O}_3(s) + \text{SO}_3(l) \longrightarrow \text{Sc}_2 \text{(SO}_4)_3(s) )[/латекс]
f) [латекс]\text{Ca}_3 \text{(PO}_4)_2(водн. ) + \text{H}_3 \text{PO}_4(водн.) \longrightarrow \text{Ca(H}_2 \text{PO}_4)_2(водн.)[/latex]
) + \text{H}_3 \text{PO}_4(водн.) \longrightarrow \text{Ca(H}_2 \text{PO}_4)_2(водн.)[/latex]
г) [латекс]\text{Al}(s) + \text{H}_2 \text{SO}_4(aq) \longrightarrow \text{Al}_2 \text{(SO}_4)_3(s) + \text{H}_2(г)[/латекс]
ч) [латекс]\text{TiCl}_4(т) + \text{H}_2 \text{O}(г) \longrightarrow \text{TiO}_2(т) + \text{HCl}(г) [/латекс]
4.Напишите сбалансированное молекулярное уравнение, описывающее каждую из следующих химических реакций.
а) Твердый карбонат кальция нагревается и разлагается на твердый оксид кальция и газообразный диоксид углерода.
b) Газообразный бутан, C 4 H 10 , реагирует с газообразным двухатомным кислородом с образованием газообразного диоксида углерода и водяного пара.
c) Водные растворы хлорида магния и гидроксида натрия реагируют с образованием твердого гидроксида магния и водного раствора хлорида натрия.
d) Водяной пар реагирует с металлическим натрием с образованием твердого гидроксида натрия и газообразного водорода.
5. Красочные фейерверки часто связаны с разложением нитрата бария и хлората калия и реакцией металлов магния, алюминия и железа с кислородом.
а) Напишите формулы нитрата бария и хлората калия.
б) Разложение твердого хлората калия приводит к образованию твердого хлорида калия и газообразного двухатомного кислорода.Напишите уравнение реакции.
c) Разложение твердого нитрата бария приводит к образованию твердого оксида бария, двухатомного газообразного азота и двухатомного газообразного кислорода. Напишите уравнение реакции.
d) Напишите отдельные уравнения реакций твердых металлов магния, алюминия и железа с газообразным двухатомным кислородом с образованием соответствующих оксидов металлов. (Предположим, что оксид железа содержит ионы Fe 3+ .)
6. Заполните пропуск одной химической формулой ковалентного соединения, которая уравновесит уравнение:
7.Водный фтористый водород (фтористоводородная кислота) используется для травления стекла и анализа минералов на содержание в них кремния. Фторид водорода также будет реагировать с песком (диоксидом кремния).
Фторид водорода также будет реагировать с песком (диоксидом кремния).
а) Напишите уравнение реакции твердого диоксида кремния с плавиковой кислотой с образованием газообразного тетрафторида кремния и жидкой воды.
b) Минерал флюорит (фторид кальция) широко распространен в Иллинойсе. Твердый фторид кальция также может быть получен реакцией водных растворов хлорида кальция и фторида натрия с получением водного хлорида натрия в качестве другого продукта.Напишите полное и краткое ионное уравнения этой реакции.
8. Из сбалансированных молекулярных уравнений напишите полные ионные и суммарные ионные уравнения для следующего:
а) [латекс]\text{K}_2 \text{C}_2 \text{O}_4(водн.) + \text{Ba(OH)}_2(водн.) \longrightarrow 2\text{KOH}(водн. ) + \text{BaC}_2 \text{O}_2(s)[/latex]
b) [латекс] {\ text {Pb (NO} _3)} _2 (водн.) + \ text {H} _2 \ text {SO} _4 (водн.) \ longrightarrow \ text {PbSO} _4 (s) + 2 \text{HNO}_3(водный)[/латекс]
c) [латекс]\text{CaCO}_3(s) + \text{H}_2 \text{SO}_4(aq) \longrightarrow \text{CaSO}_4(s) + \text{CO}_2( г) + \text{H}_2\text{O}(l)[/latex]
9. Из утверждения «газообразный азот и газообразный водород реагируют с образованием газообразного аммиака» определите реагенты и продукты.
Из утверждения «газообразный азот и газообразный водород реагируют с образованием газообразного аммиака» определите реагенты и продукты.
10. Из утверждения «раствор гидроксида магния реагирует с раствором азотной кислоты с образованием раствора нитрата магния и воды» определите реагенты и продукты.
11. Напишите и сопоставьте химическое уравнение, описанное в упражнении 1.
12. Напишите и сопоставьте химическое уравнение, описанное в упражнении 2.
13.Баланс: ___NaClO 3 [латекс]\longrightarrow[/латекс] ___NaCl + ___O 2
14. Баланс: ___N 2 + ___H 2 [латекс]\longrightarrow[/латекс] ___N 2 H 4
15. Баланс: ___Al + ___O 2 [латекс]\longrightarrow[/латекс] ___Al 2 O 3
16. Баланс: ___C 2 H 4 + ___O 2 [латекс]\longrightarrow[/латекс] ___CO 2 + ___H 2 O
17. Баланс: ___N 2 (г) + ___H 2 (г) [латекс]\longrightarrow[/латекс] ___NH 3 (г)
Баланс: ___N 2 (г) + ___H 2 (г) [латекс]\longrightarrow[/латекс] ___NH 3 (г)
18. Напишите химическое уравнение, описывающее диссоциацию NaBr(s) в воде.
19. Напишите химическое уравнение, которое представляет диссоциацию (NH 4 ) 3 PO 4 (s) в воде.
20. Напишите полное ионное уравнение реакции FeCl 2 (водн.) и AgNO 3 (водн.).Возможно, вам придется ознакомиться с правилами растворимости.
21. Напишите полное ионное уравнение реакции KCl(водн.) и NaC 2 H 3 O 2 (водн.). Возможно, вам придется ознакомиться с правилами растворимости.
22. Напишите суммарное ионное уравнение реакции FeCl 2 (водн.) и AgNO 3 (водн.). Возможно, вам придется ознакомиться с правилами растворимости.
23. Напишите суммарное ионное уравнение реакции KCl(водн.) и NaC 2 H 3 O 2 (водн. ).Возможно, вам придется ознакомиться с правилами растворимости.
).Возможно, вам придется ознакомиться с правилами растворимости.
24. Определите ионов наблюдателей в упражнениях 20 и 21.
Ответы
1. Уравнение сбалансировано, если одинаковое количество каждого элемента представлено на стороне реагента и продукта. Уравнения должны быть сбалансированы, чтобы точно отражать закон сохранения материи.
2. а) [латекс]\text{PCl}_5(s) + \text{H}_2 \text{O}(l) \longrightarrow \text{POCl}_3(l) + 2\text{HCl} (водный)[/латекс]
б) [латекс]3\текст{Cu}(s) + 8\text{HNO}_3(водн.) \longrightarrow 3\text{Cu(NO}_3)_2(водн.) + 4\text{H}_2 \text{O}(л) + 2\text{NO}(г)[/латекс]
c) [латекс]\текст{H}_2(g) + \text{I}_2(s) \longrightarrow 2\text{HI}(s)[/latex]
г) [латекс]4\текст{Fe}(s) + 3\text{O}_2(g) \longrightarrow 2\text{Fe}_2 \text{O}_3(s)[/latex]
д) [латекс]2\текст{Na}(т) + 2\текст{Н}_2 \текст{О}(л) \longrightarrow 2\текст{NaOH}(водн.) + \текст{Н}_2( г)[/латекс]
f) [латекс]\текст{(NH}_4)_2 \text{Cr}_2\text{2O}_7(s) \longrightarrow \text{Cr}_2\text{O}_3(s) + \text {N}_2(г) + 4\текст{Н}_2 \текст{О}(л)[/латекс]
г) [латекс]\текст{P}_4(s) + 6\text{Cl}_2(g) \longrightarrow 4\text{PCl}_3(l)[/latex]
h) [латекс]\text{PtCl}_4(s) \longrightarrow \text{Pt}(s) + 2\text{Cl}_2(g)[/latex]
3. а) [латекс]4\текст{Ag}(s) + 2\text{H}_2 \text{S}(g) + \text{O}_2(g) \longrightarrow 2\text{Ag}_2 \ текст{S}(s) + 2\text{H}_2 \text{O}(l)[/latex]
а) [латекс]4\текст{Ag}(s) + 2\text{H}_2 \text{S}(g) + \text{O}_2(g) \longrightarrow 2\text{Ag}_2 \ текст{S}(s) + 2\text{H}_2 \text{O}(l)[/latex]
b) [латекс]\текст{P}_4(s) + 5\text{O}_2(g) \longrightarrow \text{P}_4 \text{O}_{10}(s)[/latex]
c) [латекс]2\text{Pb}(s) + 2\text{H}_2 \text{O}(l) + \text{O}_2(g) \longrightarrow 2\text{Pb(OH) )}_2(s)[/латекс]
г) [латекс]3\текст{Fe}(s) + 4\text{H}_2 \text{O}(l) \longrightarrow \text{Fe}_3 \text{O}_4(s) + 4 \текст{Н}_2(г)[/латекс]
e) [латекс]\text{Sc}_2 \text{O}_3(s) + 3\text{SO}_3(l) \longrightarrow \text{Sc}_2 \text{(SO}_4)_3( с)[/латекс]
f) [латекс]\text{Ca}_3 \text{(PO}_4)_2(водн.) + 4\text{H}_3 \text{PO}_4(водн.) \longrightarrow 3\text{Ca(H }_2 \text{PO}_4)_2(водный)[/latex]
г) [латекс]2\текст{Al}(s) + 3\text{H}_2 \text{SO}_4(водн.) \longrightarrow \text{Al}_2 \text{(SO}_4)_3( с) + 3\текст{Н}_2(г)[/латекс]
ч) [латекс]\text{TiCl}_4(тв) + 2\text{H}_2 \text{O}(г) \longrightarrow \text{TiO}_2(тв) + 4\text{HCl}( г)[/латекс]
4. a) [латекс]\text{CaCO}_3(s) \longrightarrow \text{CaO}(s) + \text{CO}_2(g)[/latex]
a) [латекс]\text{CaCO}_3(s) \longrightarrow \text{CaO}(s) + \text{CO}_2(g)[/latex]
b) [латекс]2\text{C} _4 \text{H}_{10}(г) + 13 \text{O}_2(г) \longrightarrow 8\text{CO}_2(г) + 10\text{H}_2\text{O}( g)[/latex]
c) [латекс]\text{MgCl}_{2}(водн.) + 2 \text{NaOH}(водн.) \longrightarrow \text{Mg(OH)}_2(s) + 2 \text{NaCl}(водн.)[/латекс]
г) [латекс]2\text{H}_2 \text{O}(г) + 2 \text{Na}(т) \longrightarrow 2\text{NaOH }(s) + \text{H}_2(g)[/latex]
5. а) [латекс]\текст{Ba(NO}_3)_2[/латекс] , [латекс]\текст{KClO}_3[/латекс]
б) [латекс]2 \текст{KClO}_3( s) \longrightarrow 2 \text{KCl}(s) + 3\text{O}_2(g)[/latex]
c) [latex]2 \text{Ba(NO}_3)_2(s) \longrightarrow 2\text{BaO}(s) + 2\text{N}_2(g) + 5\text{O}_2(g)[/latex]
d) [латекс]2 \text{Mg}(s) + \text{O}_2(g) \longrightarrow 2 \text{MgO}(s)[/latex]; [латекс]4\текст{Al}(s) + 3\text{O}_2(g) \longrightarrow 2\text{Al}_2 \text{O}_3(g)[/latex]; [латекс]4\текст{Fe}(s) + 3\text{O}_2(g) \longrightarrow 2\text{Fe}_2 \text{O}_3(s)[/latex]
6. {2-}(водн.) \longrightarrow \text{CaSO}_4(s) + \text{CO}_2(g) + \text{H}_2 \text{O}(l)[/latex]
{2-}(водн.) \longrightarrow \text{CaSO}_4(s) + \text{CO}_2(g) + \text{H}_2 \text{O}(l)[/latex]
9. реактивы: азот и водород; продукт: аммиак
10. реагенты: магния гидроксид и азотная кислота; продукция: нитрат магния и вода
11. N 2 (г) + 3 H 2 (г) [латекс]\longrightarrow[/латекс] 2 NH 3 (г)
12. Mg(OH) 2 (водн.) + 2 HNO 3 (водн.) [латекс]\longrightarrow[/латекс] Mg(NO 3 ) 2 9004 3 2 9004 + 2 H 2 O (ℓ)
13.2 NaClO 3 [латекс]\longrightarrow[/латекс] 2 NaCl + 3 O 2
14. N 2 + 2 H 2 [латекс]\longrightarrow[/латекс] N 2 H 4
15. 4Al + 3O 2 [латекс]\longrightarrow[/латекс] 2Al 2 O 3
16. C 2 H 4 + 3 O 2 [латекс]\longrightarrow[/латекс] 2 CO 2 + 2 H 2 O
17. N 2 (г) + 3 H 2 (г) [латекс]\longrightarrow[/латекс] 2 NH 3 (г)
N 2 (г) + 3 H 2 (г) [латекс]\longrightarrow[/латекс] 2 NH 3 (г)
18.NaBr(s) [латекс]\longrightarrow[/латекс] Na + (водн.) + Br − (водн.)
19. (NH 4 ) 3 PO 4 (s) [латекс]\longrightarrow[/латекс] 3 NH 4 + (водн.) + PO 90−091 4 )
20. Fe 2+ (водн.) + 2 Cl − (водн.) + 2 Ag + (водн.) + 2 NO 3 − (водн.) [латекс]\longrightarrow[/latex] Fe 2+ (водн.) + 2 NO 3 − (водн.) + 2 AgCl(т)
21.K + (водн.) + Cl — (водн.) + Na + (водн.) + C 2 H 3 O 2 — (latexright) ] Na + (водн.) + Cl — (водн.) + K + (водн.) + C 2 H 3 O 2 — (водн. ) 900
) 900
22. 2 Cl − (водн.) + 2 Ag + (водн.) [латекс]\longrightarrow[/латекс] 2 AgCl(s)
23. Общая реакция отсутствует.
24. В упражнении 20 Fe 2+ (водн.) и NO 3 − (водн.) являются ионами-спектаторами; в упражнении 21 Na + (водн.) и Cl — (водн.) являются ионами-спектаторами.
4.1 Составление и балансировка химических уравнений – Химия
Цели обучения
К концу этого раздела вы сможете:
- Выводить химические уравнения из описательных описаний химических реакций.
- Напишите и составьте химические уравнения в молекулярном, полном ионном и суммарном ионном форматах.
В предыдущей главе было представлено использование символов элементов для представления отдельных атомов. Когда атомы приобретают или теряют электроны, образуя ионы, или объединяются с другими атомами, образуя молекулы, их символы модифицируются или комбинируются для создания химических формул, которые должным образом представляют эти виды. Расширение этого символизма для представления как идентичности, так и относительных количеств веществ, претерпевающих химические (или физические) изменения, требует написания и балансировки химического уравнения . Рассмотрим в качестве примера реакцию между одной молекулой метана (CH 4 ) и двумя двухатомными молекулами кислорода (O 2 ) с образованием одной молекулы двуокиси углерода (CO 2 ) и двух молекул воды (H 2 O). . Химическое уравнение, представляющее этот процесс, представлено в верхней половине рисунка 1, а молекулярные модели, заполняющие пространство, показаны в нижней половине рисунка.
Расширение этого символизма для представления как идентичности, так и относительных количеств веществ, претерпевающих химические (или физические) изменения, требует написания и балансировки химического уравнения . Рассмотрим в качестве примера реакцию между одной молекулой метана (CH 4 ) и двумя двухатомными молекулами кислорода (O 2 ) с образованием одной молекулы двуокиси углерода (CO 2 ) и двух молекул воды (H 2 O). . Химическое уравнение, представляющее этот процесс, представлено в верхней половине рисунка 1, а молекулярные модели, заполняющие пространство, показаны в нижней половине рисунка.
Рисунок 1. Реакция между метаном и кислородом с образованием диоксида углерода и воды (показана внизу) может быть представлена химическим уравнением с использованием формул (вверху).
Этот пример иллюстрирует основные аспекты любого химического уравнения:
- Вещества, вступающие в реакцию, называются реагентами , а их формулы помещаются в левую часть уравнения.

- Вещества, образующиеся в результате реакции, называются продуктами , а их формулы расположены в правой части уравнения.
- Знаки плюс (+) разделяют отдельные формулы реагентов и продуктов, а стрелка (⟶) разделяет реагенты и продукты (левую и правую) части уравнения.
- Относительное количество видов реагентов и продуктов представлено коэффициентами (числа расположены непосредственно слева от каждой формулы). Коэффициент 1 обычно опускается.
Общепринятой практикой является использование наименьших возможных целочисленных коэффициентов в химическом уравнении, как это сделано в этом примере.Заметьте, однако, что эти коэффициенты представляют 90 449 относительных 90 450 чисел реагентов и продуктов, и, следовательно, их можно правильно интерпретировать как отношения. Метан и кислород реагируют с образованием углекислого газа и воды в соотношении 1:2:1:2. Это соотношение выполняется, если числа этих молекул соответственно равны 1-2-1-2, или 2-4-2-4, или 3-6-3-6 и т. д. (рис. 2). Точно так же эти коэффициенты могут быть интерпретированы относительно любой единицы количества (числа), и поэтому это уравнение может быть правильно прочитано многими способами, в том числе:
д. (рис. 2). Точно так же эти коэффициенты могут быть интерпретированы относительно любой единицы количества (числа), и поэтому это уравнение может быть правильно прочитано многими способами, в том числе:
- Одна молекула метана и две молекулы кислорода реагируют с образованием одной молекулы углекислого газа и двух молекул воды.
- Одна дюжина молекул метана и две дюжины молекул кислорода реагируют, чтобы дать одну дюжину молекул углекислого газа и две дюжины молекул воды.
- Один моль молекул метана и 2 моля молекул кислорода реагируют с образованием 1 моль молекул углекислого газа и 2 моль молекул воды.
Рисунок 2. Независимо от абсолютного числа вовлеченных молекул отношения между числом молекул каждого вида, которые реагируют (реагенты), и молекулами каждого вида, которые образуются (продукты), одинаковы и определяются соотношением уравнение химической реакции.

Химическое уравнение, описанное в разделе 4.1, является сбалансированным , что означает, что равное количество атомов для каждого элемента, участвующего в реакции, представлено на стороне реагента и продукта. Это требование, которому должно удовлетворять уравнение, чтобы соответствовать закону сохранения материи. Это можно подтвердить, просто просуммировав количество атомов по обе стороны от стрелки и сравнив эти суммы, чтобы убедиться, что они равны. Обратите внимание, что количество атомов для данного элемента рассчитывается путем умножения коэффициента любой формулы, содержащей этот элемент, на индекс элемента в формуле.Если элемент встречается более чем в одной формуле данной части уравнения, количество атомов, представленных в каждой из них, должно быть вычислено, а затем сложено. Например, оба продукта реакции в примере, CO 2 и H 2 O, содержат элемент кислород, поэтому количество атомов кислорода в продукте уравнения равно
.Подтверждено, что уравнение реакции между метаном и кислородом с образованием углекислого газа и воды сбалансировано в соответствии с этим подходом, как показано здесь:
Сбалансированное химическое уравнение часто может быть получено из качественного описания некоторой химической реакции с помощью довольно простого подхода, известного как уравновешивание путем проверки. Рассмотрим в качестве примера разложение воды с образованием молекулярного водорода и кислорода. Этот процесс качественно представлен несбалансированным химическим уравнением :
Рассмотрим в качестве примера разложение воды с образованием молекулярного водорода и кислорода. Этот процесс качественно представлен несбалансированным химическим уравнением :
Сравнение количества атомов H и O по обе стороны этого уравнения подтверждает его дисбаланс:
| Элемент | Реагенты | Товары | Сбалансированный? |
|---|---|---|---|
| Н | 1 × 2 = 2 | 1 × 2 = 2 | 2 = 2, да |
| О | 1 × 1 = 1 | 1 × 2 = 2 | 1 ≠ 2, нет |
Таблица 2. | |||
Количество атомов H в сторонах реагента и продукта равно, но количество атомов O не равно. Для достижения баланса коэффициенты уравнения могут быть изменены по мере необходимости. Имейте в виду, конечно, что индексы формулы частично определяют идентичность вещества, и поэтому их нельзя изменить, не изменив качественного смысла уравнения. Например, изменение формулы реагента с H 2 O на H 2 O 2 позволит сбалансировать количество атомов, но это также изменит идентичность реагента (теперь это перекись водорода, а не вода).Баланс атомов O может быть достигнут путем изменения коэффициента для H 2 O на 2,
.Баланс атомов H был нарушен этим изменением, но его легко восстановить, изменив коэффициент для произведения H 2 на 2.
Эти коэффициенты дают одинаковое количество атомов H и O на стороне реагента и продукта, поэтому сбалансированное уравнение:
Пример 1
Балансирующие химические уравнения
Напишите сбалансированное уравнение реакции молекулярного азота (N 2 ) и кислорода (O 2 ) с образованием пятиокиси азота.
Решение
Сначала напишите уравнение несбалансированности.
Затем подсчитайте количество атомов каждого типа, присутствующих в несбалансированном уравнении.
| Элемент | Реагенты | Товары | Сбалансированный? |
|---|---|---|---|
| N | 1 × 2 = 2 | 1 × 2 = 2 | 2 = 2, да |
| О | 1 × 2 = 2 | 1 × 5 = 5 | 2 ≠ 5, нет |
Таблица 5. | |||
Хотя азот сбалансирован, необходимо изменить коэффициенты, чтобы сбалансировать количество атомов кислорода. Чтобы сбалансировать количество атомов кислорода, разумной первой попыткой было бы изменить коэффициенты для O 2 и N 2 O 5 на целые числа, которые дадут 10 атомов O (наименьшее общее кратное для атома O нижние индексы в этих двух формулах).
| Элемент | Реагенты | Товары | Сбалансированный? |
|---|---|---|---|
| N | 1 × × 2 = 2 | 2 × 2 = 4 | 2 ≠ 4, нет |
| О | 5 × 2 = 10 | 2 × 5 = 10 | 10 = 10, да |
Таблица 6. | |||
Баланс атомов азота был нарушен этим изменением; восстанавливается изменением коэффициента для реагента N 2 на 2.
| Элемент | Реагенты | Товары | Сбалансированный? |
|---|---|---|---|
| N | 2 × 2 = 4 | 2 × 2 = 4 | 4 = 4, да |
| О | 5 × 2 = 10 | 2 × 5 = 10 | 10 = 10, да |
Таблица 7. | |||
Количество атомов N и O по обе стороны уравнения теперь одинаково, поэтому уравнение сбалансировано.
Проверьте свои знания
Напишите сбалансированное уравнение разложения нитрата аммония с образованием молекулярного азота, молекулярного кислорода и воды. (Подсказка: уравновешивайте кислород в последнюю очередь, так как он присутствует более чем в одной молекуле в правой части уравнения.)
Ответ:
Иногда удобно использовать дроби вместо целых чисел в качестве промежуточных коэффициентов в процессе балансировки химического уравнения.Когда баланс достигнут, все коэффициенты уравнения можно затем умножить на целое число, чтобы преобразовать дробные коэффициенты в целые числа, не нарушая баланса атомов. Например, рассмотрим реакцию этана (C 2 H 6 ) с кислородом с образованием H 2 O и CO 2 , представленную несбалансированным уравнением:
Следуя обычному подходу к проверке, можно сначала сбалансировать атомы C и H, изменив коэффициенты для двух видов продуктов, как показано:
Это приводит к семи атомам O на стороне продукта уравнения, что является нечетным числом — целочисленный коэффициент не может использоваться с реагентом O 2 для получения нечетного числа, поэтому вместо этого используется дробный коэффициент , чтобы получить предварительное сбалансированное уравнение:
Обычное сбалансированное уравнение с целыми коэффициентами получается путем умножения каждого коэффициента на 2:
Наконец, что касается сбалансированных уравнений, вспомните, что соглашение диктует использование наименьших целочисленных коэффициентов . Хотя уравнение реакции между молекулярным азотом и молекулярным водородом с образованием аммиака действительно сбалансировано,
Хотя уравнение реакции между молекулярным азотом и молекулярным водородом с образованием аммиака действительно сбалансировано,
коэффициенты не являются наименьшими возможными целыми числами, представляющими относительное количество молекул реагента и продукта. Разделив каждый коэффициент на наибольший общий делитель, 3, мы получим предпочтительное уравнение:
.Используйте этот интерактивный учебник для дополнительной практики балансировки уравнений.
Физические состояния реагентов и продуктов в химических уравнениях очень часто обозначают аббревиатурой в скобках после формул.Общие сокращения включают s для твердых веществ, l для жидкостей, g для газов и aq для веществ, растворенных в воде ( водные растворы , как было введено в предыдущей главе). Эти обозначения проиллюстрированы в примере уравнения здесь:
Это уравнение представляет реакцию, которая происходит, когда металлический натрий помещают в воду. Твердый натрий реагирует с жидкой водой с образованием газообразного молекулярного водорода и ионного соединения гидроксида натрия (твердое вещество в чистом виде, но легко растворяется в воде).
Твердый натрий реагирует с жидкой водой с образованием газообразного молекулярного водорода и ионного соединения гидроксида натрия (твердое вещество в чистом виде, но легко растворяется в воде).
Особые условия, необходимые для реакции, иногда обозначаются написанием слова или символа над или под стрелкой уравнения. Например, реакция, проводимая при нагревании, может быть обозначена заглавной греческой буквой дельта (Δ) над стрелкой.
Другие примеры этих особых состояний будут рассмотрены более подробно в последующих главах.
Учитывая обилие воды на Земле, само собой разумеется, что в водных средах происходит очень много химических реакций.Когда в этих реакциях участвуют ионы, химические уравнения могут быть написаны с различным уровнем детализации, соответствующим их предполагаемому использованию. Чтобы проиллюстрировать это, рассмотрим реакцию между ионными соединениями, протекающую в водном растворе. При смешивании водных растворов CaCl 2 и AgNO 3 происходит реакция с образованием водного раствора Ca(NO 3 ) 2 и твердого AgCl:
.
Это сбалансированное уравнение, полученное обычным способом, называется молекулярным уравнением , потому что оно не представляет в явном виде ионные соединения, присутствующие в растворе.Когда ионные соединения растворяются в воде, они могут диссоциировать на составляющие их ионы, которые затем гомогенно распределяются по всему образующемуся раствору (подробное обсуждение этого важного процесса дано в главе о растворах). Поэтому ионные соединения, растворенные в воде, более реалистично представляются как диссоциированные ионы, в данном случае:
В отличие от этих трех ионных соединений, AgCl не растворяется в воде в значительной степени, на что указывает обозначение его физического состояния s .
Явное представление всех растворенных ионов приводит к полному ионному уравнению . В данном случае формулы для растворенных ионных соединений заменены формулами для их диссоциированных ионов:
Изучение этого уравнения показывает, что два химических соединения присутствуют в идентичной форме по обеим сторонам стрелки: Ca 2+ ( водный ) и NO3-(водный). NO3-(водный). Эти ионы-спектаторы — ионы, присутствие которых необходимо для поддержания нейтральности заряда — не изменяются ни химически, ни физически в процессе, поэтому их можно исключить из уравнения, чтобы получить более сжатое представление, называемое результирующим ионным уравнением :
NO3-(водный). Эти ионы-спектаторы — ионы, присутствие которых необходимо для поддержания нейтральности заряда — не изменяются ни химически, ни физически в процессе, поэтому их можно исключить из уравнения, чтобы получить более сжатое представление, называемое результирующим ионным уравнением :
Следуя соглашению об использовании наименьших возможных целых чисел в качестве коэффициентов, это уравнение записывается так:
Это результирующее ионное уравнение показывает, что твердый хлорид серебра может быть получен из растворенных хлорида и ионов серебра (I), независимо от источника этих ионов.Эти молекулярные и полные ионные уравнения предоставляют дополнительную информацию, а именно, ионные соединения, используемые в качестве источников Cl — и Ag + .
Пример 2
Молекулярные и ионные уравнения
Когда диоксид углерода растворяется в водном растворе гидроксида натрия, смесь реагирует с образованием водного карбоната натрия и жидкой воды. Напишите сбалансированные молекулярные, полные ионные и суммарные ионные уравнения для этого процесса.
Напишите сбалансированные молекулярные, полные ионные и суммарные ионные уравнения для этого процесса.
Раствор
Начните с определения формул для реагентов и продуктов и правильной организации их в форме химического уравнения:
Баланс в этом случае легко достигается изменением коэффициента для NaOH до 2, что приводит к молекулярному уравнению для этой реакции:
Два растворенных ионных соединения, NaOH и Na 2 CO 3 , могут быть представлены как диссоциированные ионы, чтобы получить полное ионное уравнение:
Наконец, определите ион(ы) наблюдателя, в данном случае Na + ( aq ), и удалите его из каждой части уравнения, чтобы получить результирующее ионное уравнение:
Проверьте свои знания
Двухатомный хлор и гидроксид натрия (щелок) являются товарными химическими веществами, производимыми в больших количествах вместе с двухатомным водородом путем электролиза рассола в соответствии со следующим несбалансированным уравнением:
Напишите сбалансированное молекулярное, полное ионное и суммарное ионное уравнения для этого процесса.
Химические уравнения представляют собой символическое представление химических и физических изменений. Формулы для веществ, претерпевающих изменение (реагентов), и веществ, образующихся при изменении (продуктов), разделены стрелкой, и им предшествуют целые коэффициенты, обозначающие их относительные номера. Сбалансированные уравнения — это те уравнения, коэффициенты которых приводят к равному количеству атомов для каждого элемента в реагентах и продуктах. Химические реакции в водном растворе, в которых участвуют ионные реагенты или продукты, могут быть более реалистично представлены полными ионными уравнениями и, более кратко, сводными ионными уравнениями.
Химия Упражнения в конце главы
- Что значит сказать, что уравнение сбалансировано? Почему важно, чтобы уравнение было сбалансированным?
- Рассмотрите молекулярные, полные ионные и суммарные ионные уравнения.
(а) В чем разница между этими типами уравнений?
(b) В каком случае полное и суммарное ионное уравнения реакции будут идентичными?
- Сбалансируйте следующие уравнения:
(а)
(б)
(в)
(г)
(е)
(ф)
(г)
(ч)
- Сбалансируйте следующие уравнения:
(а)
(б)
(в)
(г)
(е)
(ф)
(г)
(ч)
- Напишите сбалансированное молекулярное уравнение, описывающее каждую из следующих химических реакций.

(a) Твердый карбонат кальция нагревается и разлагается на твердый оксид кальция и газообразный диоксид углерода.
(b) Газообразный бутан, C 4 H 10 , реагирует с газообразным двухатомным кислородом с образованием газообразного диоксида углерода и водяного пара.
(c) Водные растворы хлорида магния и гидроксида натрия реагируют с образованием твердого гидроксида магния и водного хлорида натрия.
(d) Водяной пар реагирует с металлическим натрием с образованием твердого гидроксида натрия и газообразного водорода.
- Напишите сбалансированное уравнение, описывающее каждую из следующих химических реакций.
(a) Твердый хлорат калия, KClO 3 , разлагается с образованием твердого хлорида калия и газообразного двухатомного кислорода.
(b) Твердый металлический алюминий реагирует с твердым двухатомным йодом с образованием твердого Al 2 I 6 .
(c) При добавлении твердого хлорида натрия к водному раствору серной кислоты образуются газообразный хлористый водород и водный раствор сульфата натрия.

(d) Водные растворы фосфорной кислоты и гидроксида калия реагируют с образованием водного дигидрофосфата калия и жидкой воды.
- Красочные фейерверки часто связаны с разложением нитрата бария и хлората калия и реакцией металлов магния, алюминия и железа с кислородом.
а) Напишите формулы нитрата бария и хлората калия.
(b) Разложение твердого хлората калия приводит к образованию твердого хлорида калия и газообразного двухатомного кислорода. Напишите уравнение реакции.
(c) Разложение твердого нитрата бария приводит к образованию твердого оксида бария, двухатомного газообразного азота и двухатомного газообразного кислорода.Напишите уравнение реакции.
(d) Напишите отдельные уравнения реакций твердых металлов магния, алюминия и железа с газообразным двухатомным кислородом с образованием соответствующих оксидов металлов. (Предположим, что оксид железа содержит ионы Fe 3+ .)
- Заполните пропуск одной химической формулой ковалентного соединения, которая уравновесит уравнение:
- Водный фтористый водород (фтористоводородная кислота) используется для травления стекла и анализа минералов на содержание в них кремния.
 Фторид водорода также будет реагировать с песком (диоксидом кремния).
Фторид водорода также будет реагировать с песком (диоксидом кремния).(a) Напишите уравнение реакции твердого диоксида кремния с плавиковой кислотой с образованием газообразного тетрафторида кремния и жидкой воды.
(b) Минерал флюорит (фторид кальция) широко распространен в Иллинойсе. Твердый фторид кальция также может быть получен реакцией водных растворов хлорида кальция и фторида натрия с получением водного хлорида натрия в качестве другого продукта. Напишите полное и краткое ионное уравнения этой реакции.
- Новый способ получения магния из морской воды включает несколько реакций. Напишите сбалансированное химическое уравнение для каждой стадии процесса.
(a) Первый этап – это разложение твердого карбоната кальция из морских раковин с образованием твердого оксида кальция и газообразного диоксида углерода.
(b) Вторая стадия – образование твердого гидроксида кальция как единственного продукта реакции твердого оксида кальция с жидкой водой.
(c) Затем к морской воде добавляют твердый гидроксид кальция, который реагирует с растворенным хлоридом магния с образованием твердого гидроксида магния и водного хлорида кальция.

(d) Твердый гидроксид магния добавляют к раствору соляной кислоты, получая растворенный хлорид магния и жидкую воду.
(e) Наконец, хлорид магния расплавляют и подвергают электролизу с получением жидкого металлического магния и газообразного двухатомного хлора.
- Из сбалансированных молекулярных уравнений напишите полные ионные и суммарные ионные уравнения для следующего:
(а)
(б)
(в)
Глоссарий
- сбалансированное уравнение
- химическое уравнение с одинаковым числом атомов для каждого элемента в реагенте и продукте
- химическое уравнение
- символическое представление химической реакции
- коэффициент
- число, помещаемое перед символами или формулами в химическом уравнении для обозначения их относительного количества
- полное ионное уравнение
- химическое уравнение, в котором все растворенные ионные реагенты и продукты, включая ионы-спектаторы, явно представлены формулами для их диссоциированных ионов
- молекулярное уравнение
- химическое уравнение, в котором все реагенты и продукты представлены как нейтральные вещества
- результирующее ионное уравнение
- химическое уравнение, в котором представлены только те растворенные ионные реагенты и продукты, которые претерпевают химические или физические изменения (исключая ионы-спектаторы)
- продукт
- вещество, образовавшееся в результате химического или физического изменения; показано справа от стрелки в химическом уравнении
- реагент
- вещество, подвергающееся химическому или физическому изменению; показано слева от стрелки в химическом уравнении
- зрительский ион
- ион, который не претерпевает химических или физических изменений во время реакции, но его присутствие необходимо для поддержания нейтральности заряда
Как написать химическое уравнение — мини-химия
Химическое уравнение дает вам важную информацию о химической реакции, а именно:
- Природа реагентов (химических веществ, взаимодействующих друг с другом) и продуктов (произведенных химических веществ)
- Количество реагентов и продуктов
- Физическое состояние реагентов и продуктов (E.
 г. твердое, жидкое, газообразное, водное)
г. твердое, жидкое, газообразное, водное)
Пошаговое руководство по составлению уравнения химической реакции
- Запишите словесное уравнение химической реакции
- Запишите несбалансированное уравнение, используя правильные химические символы для всех реагентов и продуктов
- Сбалансируйте уравнение путем проверки. (Убедитесь, что в обеих частях уравнения указано одинаковое количество атомов каждого типа)
- Напишите символ штата после каждого химического символа
Советы по балансировке уравнения
- Как правило, сначала уравновешиваются атомы H (водорода), затем атомы O (кислорода), а затем любые другие атомы.ИЛИ вы можете начать с балансировки самой сложной молекулы.
- Никогда не меняйте химический символ вещества. (Не изменять нижние индексы в химических символах реагентов или продуктов)
- Число перед формулой умножает каждый следующий за ним символ
- Помните, что атомы не могут быть созданы или уничтожены в результате химической реакции (т.
 е. не «ешьте» никакие химические символы)
е. не «ешьте» никакие химические символы)
Примеры:
Образование хлорида железа(III) из реакции железа с газообразным хлором
- Железо + хлор $\rightarrow$ хлорид железа(III)
- Перед балансировкой: $\text{Fe} \, + \, \text{Cl}_{2} \, \rightarrow \, \text{FeCl}_{3}$
- Балансовое число атомов Cl: 2 атома Cl слева и 3 атома Cl справа.Самый простой способ сбалансировать атомы Cl — умножить 3 слева и 2 справа, чтобы получить в общей сложности 6 атомов Cl.
- Получаем: $\text{Fe} \, + \, 3\text{Cl}_{2} \, \rightarrow \, 2\text{FeCl}_{3}$.
- Обратите внимание, что количество атомов Fe не одинаково для обеих сторон: 1 слева и 2 справа. Следовательно, нам просто нужно будет умножить 2 слева.
- Имеем: $2\text{Fe} \, + \, 3\text{Cl}_{2} \, \rightarrow \, 2\text{FeCl}_{3}$
- Не забывая включить символы состояния: $2\text{Fe} (s) \, + \, 3\text{Cl}_{2}(g) \, \rightarrow \, 2\text{FeCl}_{ 3}(с)$
Образование двуокиси углерода и воды из метана и кислорода. (ИЛИ известный как сжигание метана в кислороде )
(ИЛИ известный как сжигание метана в кислороде )
- метан + кислород $\rightarrow$ углекислый газ + вода
- Преобразуйте вышеуказанное в химические символы: $\text{CH}_{4} \, + \, \text{O}_{2} \, \rightarrow \, \text{CO}_{2} \, + \, \text{H}_{2}\text{O}$
- Сначала баланс H: 4 атома H слева и 2 справа. Следовательно, нам придется умножить химический символ, содержащий H слева, на 2. (т.е. умножить $\text{H}_{2}\text{O}$ на 2)
- Имеем: $\text{CH}_{4} \, + \, \text{O}_{2} \, \rightarrow \, \text{CO}_{2} \, + \, 2\ текст{H}_{2}\text{O}$
- Баланс O: 2 атома O слева и 4 атома O справа.Нам нужно будет умножить $\text{O}_{2}$ слева на 2.
- Имеем: $\text{CH}_{4} \, + \, 2\text{O}_{2} \, \rightarrow \, \text{CO}_{2} \, + \, 2 \text{H}_{2}\text{O}$
- Атомы углерода сбалансированы, поэтому нам не нужно их умножать.
- Включая символ штата: $\text{CH}_{4} (g) \, + \, 2\text{O}_{2}(g) \, \rightarrow \, \text{CO}_{ 2}(г) \, + \, 2\text{H}_{2}\text{O}(l)$
Баланс: $\text{Pb}_{3}\text{O}_{4} \, + \, \text{HNO}_{3} \, \rightarrow \, \text{PbO}_{ 2} + \text{Pb}(\text{NO}_{3})_{2} \, + \, \text{H}_{2}\text{O}$
- Обратите внимание на 3 атома Pb слева и 2 атома Pb справа.
 Есть несколько способов сбалансировать атомы Pb — мы можем умножить $\text{PbO}_{2}$ на 2 или $\text{Pb}(\text{NO}_{3})_{2}. $ на 2 или умножьте обе части уравнения. Любой из способов правильный. Но какой-то «идеальный» путь будет короче других.
Есть несколько способов сбалансировать атомы Pb — мы можем умножить $\text{PbO}_{2}$ на 2 или $\text{Pb}(\text{NO}_{3})_{2}. $ на 2 или умножьте обе части уравнения. Любой из способов правильный. Но какой-то «идеальный» путь будет короче других. - Рассмотрим умножение $\text{Pb}(\text{NO}_{3})_{2}$ на 2. (кратчайший способ в данном случае)
- Имеем: $\text{Pb}_{3}\text{O}_{4} \, + \, \text{HNO}_{3} \, \rightarrow \, \text{PbO}_{ 2} + 2\text{Pb}(\text{NO}_{3})_{2} \, + \, \text{H}_{2}\text{O}$
- У нас есть 1 атом N слева и 4 атома N справа.Нам нужно будет умножить $\text{HNO}_{3}$ на 4 .
- Имеем: $\text{Pb}_{3}\text{O}_{4} \, + \, 4\text{HNO}_{3} \, \rightarrow \, \text{PbO}_ {2} + 2\text{Pb}(\text{NO}_{3})_{2} \, + \, \text{H}_{2}\text{O}$
- Баланс атома H: $\text{Pb}_{3}\text{O}_{4} \, + \, 4\text{HNO}_{3} \, \rightarrow \, \text{PbO} _{2} + 2\text{Pb}(\text{NO}_{3})_{2} \, + \, 2\text{H}_{2}\text{O}$
- Обратите внимание, что количество атомов O сбалансировано.

 CO 2(г) + H 2 O (л) → ; H 2 CO 3(водный)
CO 2(г) + H 2 O (л) → ; H 2 CO 3(водный)  в разделе «Выбросы водорода» в соответствующих ресурсах).
в разделе «Выбросы водорода» в соответствующих ресурсах).
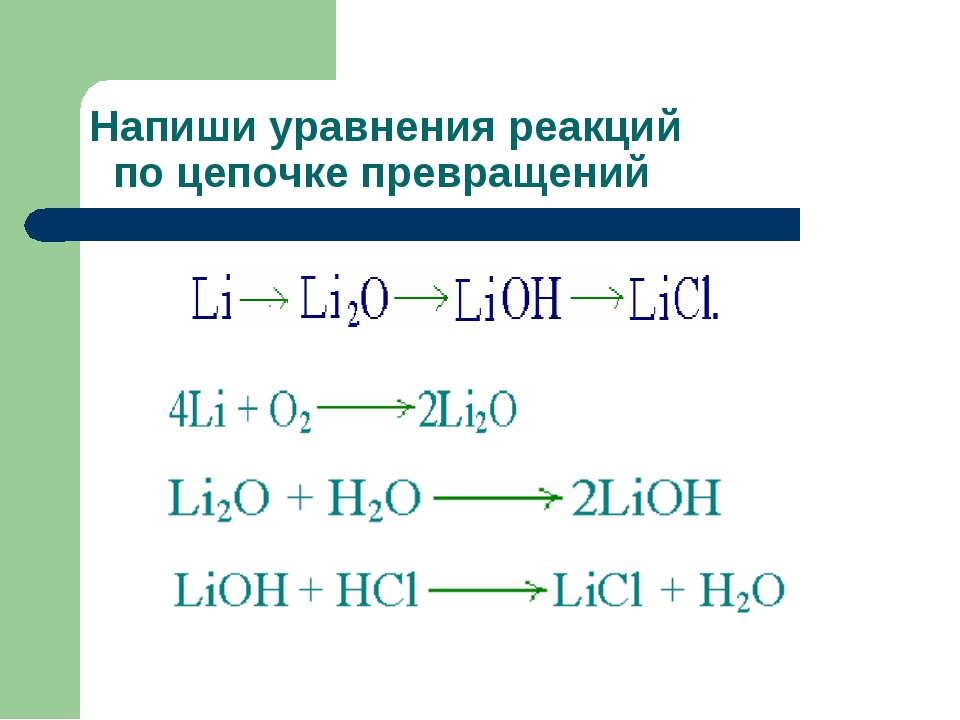

 Фторид водорода также будет реагировать с песком (диоксидом кремния).
Фторид водорода также будет реагировать с песком (диоксидом кремния).
 г. твердое, жидкое, газообразное, водное)
г. твердое, жидкое, газообразное, водное) е. не «ешьте» никакие химические символы)
е. не «ешьте» никакие химические символы) Есть несколько способов сбалансировать атомы Pb — мы можем умножить $\text{PbO}_{2}$ на 2 или $\text{Pb}(\text{NO}_{3})_{2}. $ на 2 или умножьте обе части уравнения. Любой из способов правильный. Но какой-то «идеальный» путь будет короче других.
Есть несколько способов сбалансировать атомы Pb — мы можем умножить $\text{PbO}_{2}$ на 2 или $\text{Pb}(\text{NO}_{3})_{2}. $ на 2 или умножьте обе части уравнения. Любой из способов правильный. Но какой-то «идеальный» путь будет короче других.