Способы получения солей.
Известно большое число реакций, приводящих к образованию солей. Приведем наиболее важные из них.
1. Взаимодействие кислот с основаниями (реакция нейтрализации):
NаОН + НNO3 = NаNO3 + Н2О
Al(OH)3 + 3НС1 = AlCl3 + 3Н2О
2. Взаимодействие металлов с кислотами:
Fе + 2HCl = FeCl2 + Н2
Zn + Н2SО4разб.= ZnSO4 + Н2
3. Взаимодействие кислот с основными и амфотерными оксидами:
СuO + Н2SO4 = СuSO4 + Н2О
ZnO + 2HCl = ZnСl2 + Н2О
4. Взаимодействие кислот с солями:
FeCl2 + H2S = FeS¯ + 2HCl
AgNO3 + HCI = AgCl¯ + HNO3
Ba(NO3)2 + H2SO4 = BaSO4¯ + 2HNO3
5. Взаимодействие растворов двух различных солей:
BaCl2 + Na2SO4 = ВаSO4¯ + 2NаСl
Pb(NO3)2 + 2NaCl = РbС12¯ + 2NaNO3
6. Взаимодействие оснований с кислотными оксидами (щелочей с амфотерными оксидами):
Са(ОН)2 + СО2 = СаСО3¯ + Н2О,
2NаОН(тв.) + ZnO  Na2ZnO2 + Н2О
Na2ZnO2 + Н2О
7. Взаимодействие основных оксидов с кислотными:
СаO + SiO2 СаSiO3
СаSiO3
Na2O + SO3 = Na2SO4
8. Взаимодействие металлов с неметаллами:
2К + С12 = 2КС1
Fе + S  FеS
FеS
9. Взаимодействие металлов с солями.
Cu + Hg(NO3)2 = Hg + Cu(NO3)2
Pb(NO3)2 + Zn = Рb + Zn(NO3)2
10. Взаимодействие растворов щелочей с растворами солей
CuCl2 + 2NaOH = Cu(OH)2↓+ 2NaCl
NaHCO3 + NaOH = Na2CO3+ H2O
Вопросы для самоконтроля
1 — Напишите уравнения реакций:
Na2 SO₄ + NaOH →
Ca(NO₃)₂ + K2 SO₄ →
BaCO₃↓®
¾ Что такое соли?
¾ Какие соли бывают?
¾ Назовите физические свойства солей.
¾ Где применяются соли?
¾ В вашей специальности соли нашли применение?
2 — Составьте уравнения следующих реакций и, пользуясь таблицей растворимости, определите, пройдут ли они до конца:
а) хлорид бария + сульфат натрия;
б) хлорид алюминия + нитрат серебра;
в) фосфат натрия + нитрат кальция;
г) хлорид магния + сульфат калия;
д) сульфид натрия + нитрат свинца;
е) карбонат калия + сульфат марганца;
ж) нитрат натрия + сульфат калия.
Уравнения записывайте в молекулярной и ионных формах.
Гидролиз солей.
Кислая среда образуется в растворах кислот, так как кислоты диссоциируют с образованием ионов водорода: HCl ↔ H+ + Cl- Лакмус в кислой среде окрашивается в красный цвет.
Щелочная среда образуется в растворах щелочей и обусловлена наличием ОН-. Щёлочи диссоциируют с образованием гидроксид-ионов: NaOH ↔ Na+ + OH- Лакмус в щелочной среде окрашивается в синий цвет.
Нейтральная среда образуется тогда, когда концентрация ионов Н+ и ионов ОН- будут равны: [H+] = [OH-] Лакмус не изменяет окраску, остаётся фиолетовым.
Можно предположить, что нейтральная среда образуется в растворе любой средней соли, так как в их составе нет ионов водорода или ионов гидроксильных групп.
Дата добавления: 2017-12-05; просмотров: 582;
Урок 41. Получение солей – HIMI4KA
В уроке 41 «Получение солей» из курса «Химия для чайников» узнаем, какими способами можно получить соли, как их добывают и какое экологические воздействие они оказывают на окружающею среду.


Получение солей
Для получения солей используют реакции, с которыми вы познакомились при изучении химических свойств оксидов, кислот, оснований и солей.
Схемы этих реакций и их примеры приведены в предыдущих уроках на нашем сайте. Номера схем и соответствующие им классы исходных веществ для получения солей указаны в таблице.
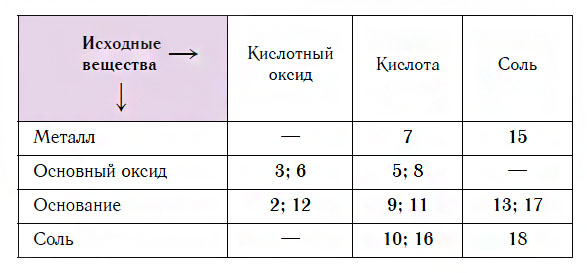

Очевидно, что одну и ту же соль можно получить несколькими способами, исходя из разных веществ. Покажем, как пользоваться этой таблицей, на примерах.
Пример 1. Из таблицы видно, что в строке «Основный оксид» находятся цифры 3, 6, 5, 8. Из них цифры 3 и 6 попадают в столбец «Кислотный оксид», а цифры 5 и 8 — в столбец «Кислота». Это значит, что соль можно получить по реакции основного оксида с кислотным оксидом (по схемам 3 или 6), а также с кислотой (по схемам 5 или 8).
Пример 2. Какие вещества реагируют с кислотами с образованием солей? Из таблицы видно, что в столбце «Кислота» находятся числа 7, 5, 8, 9, 11, 10 и 16. Из них число 7 попадает в строку «Металл»; числа 5 и 8 — в строку «Основный оксид»; числа 9 и 11 — в строку «Основание», а числа 10 и 16 — в строку «Соль». Это значит, что соли образуются в результате взаимодействия кислот с металлами (по схеме 7), с основными оксидами (по схемам 5 или 8), с основаниями (по схемам 9 или 11), а также с солями (по схемам 10 или 16).
Экологические проблемы добычи солей
Чаще всего в месторождениях соли находятся не в чистом виде, а в смеси с различными примесями. Эту смесь, которая называется «руда», из глубоких подземных шахт поднимают на поверхность земли и выделяют из нее полезные соли. Ненужные примеси, которые при этом остаются, собираются в больших количествах, образуя огромные соляные отвалы. Внешне они напоминают горы (рис. 125).


Эти отвалы представляют опасность для окружающей среды. Дело в том, что содержащиеся в отвалах вещества растворяются в дождевой воде и в таком виде проникают глубоко в почву, попадают в подземные воды. Почва от этого становится «мертвой», а вода — непригодной для питья и для использования в быту. Поэтому очень важно в настоящее время уменьшить вредное воздействие соляных отвалов на окружающую среду.
Для решения этой проблемы ученые предлагают разные способы. Один из них заключается в том, что руду перерабатывают под землей, оставляя ненужные отходы в подземных пустотах.
Краткие выводы урока:
- Соли получают, используя различные реакции с участием металлов, оксидов, кислот, оснований и солей.
- Одну и ту же соль можно получить несколькими способами.
Надеюсь урок 41 «Получение солей» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Способы получения аренов | CHEMEGE.RU
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6при n ≥ 6.
Строение, номенклатура и изомерия ароматических углеводородов
Способы получения ароматических углеводородов
Химические свойства ароматических углеводородов
1. Реакция Вюрца-Фиттига
Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол:
2. Дегидроциклизация алканов
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
3. Дегидрирование циклоалканов
При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
| Например, при нагревании циклогексана в присутствии палладия образуется бензол и водород |
| Например, при нагревании метилциклогексана в присутствии палладия образуется толуол и водород |
4. Декарбоксилирование солей бензойной кислоты
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:
5. Алкилирование бензола и его гомологов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
6. Тримеризация ацетилена
При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.
При тримеризации пропина образуется 1,3,5-триметилбензол.
7. Получение стирола
Стирол можно получить дегидрированием этилбензола:
Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан):
Поделиться ссылкой:
Как получают соли? Химия, 8 класс, параграф 33, 5 вопрос. Рудзитис и Фельдман
Правильный ответ:
1. Взаимодействие металлов с неметаллами:
Mg + Сl2 → MgCl2
2. Взаимодействие соли с нелетучими кислотными оксидами:

3. Взаимодействие металлов с кислотами:
6 Na + 2 Н3РO4 → 2 Na3PO4 + 3 Н2
Zn + 2НСl → ZnCl2 + H2
4. Взаимодействие кислотных оксидов с основаниями:
СO2 + КОН → К2СO3 + Н2O
N2O5 + Са(ОН)2 → Ca(NO3)2 + Н2O
5. Взаимодействие солей с кислотами:
ВаСl2 + H2SO4 → BaSО4 + 2 HCl

6. Взаимодействие более активного металла с солью менее активного:
Zn + CuSO4 → ZnSО4 + Сu
Са + FeCl2 → СаСl2 + Fe
7. Взаимодействие неметаллов с основаниями:
2 КОН + Сl2 → КСlO4 + КСl + Н2O
2 Р + 2 NaOH + Н2O→ Na2HPO4 + РН3
8. Взаимодействие основных оксидов с кислотами:
MgO + H2SO4 → MgSO4 + H2O
9. Взаимодействие солей между собой:
Al2(SO4)3 + 3 ВаСl2 → 3 BaSO4 + 2 АlСl3
AgNO3 + NaCl→ AgCl + NaNO3
10. Взаимодействие кислот с основаниями:
NaOH + HCl → NaCl + Н2O
Са(ОН)2 + H2SO4→ CaSО4 + 2 Н2O
11. Взаимодействие кислотного оксида и основного:
SiO2 + PbO → PbSiO3

12. Взаимодействие солей с основаниями:
FeCl3 + 3 КОН → Fe(OH)3 + 3 КСl
Cu(OH)2 + 2 NaHSO4 → CuSО4 + Na2SO4 + 2 H2O