Строение атома франция (Fr), схема и примеры
Общие сведения о строении атома франция
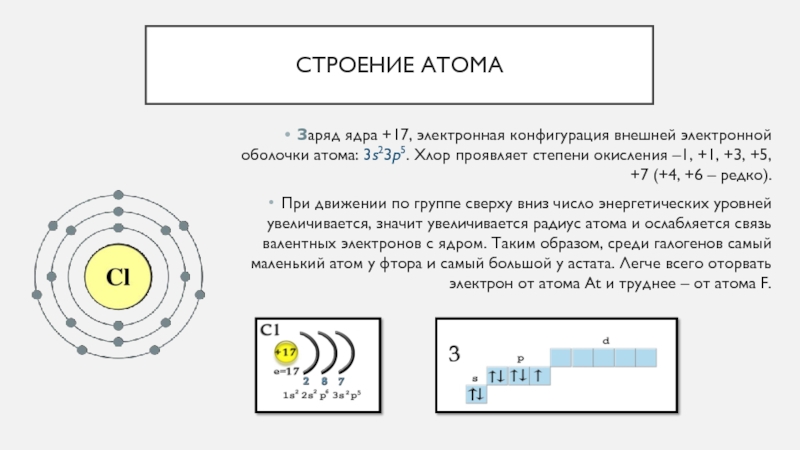
Относится к элементам s-семейства. Металл. Обозначение – Fr. Порядковый номер – 87. Относительная атомная масса – 223,02 а.е.м.
Электронное строение атома франция
Атом франция состоит из положительно заряженного ядра (+87), внутри которого есть 87 протонов и 136 нейтронов, а вокруг, по семи орбитам движутся 87 электронов.
Рис.1. Схематическое строение атома франция.
Распределение электронов по орбиталям выглядит следующим образом:
+87Fr)2)8)18)32)32)8)1;
1s22s22p63s23p63d104s24p64f145s25p65d106s26p67s1.
На внешнем электронном уровне атома франция находится 1 электрон, который является валентным (расположен на 7s- подуровне). Энергетическая диаграмма основного состояния принимает следующий вид:
Наличие одного неспаренного электрона в атоме франция свидетельствует о его способности проявлять степень окисления +1.
Валентный электрон атома франция можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
7 |
0 |
0 |
+1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
0,7 (шкала Полинга) | ||||||||||||||||||||||||||||||||
| Электродный потенциал | Fr←Fr + −2,92 В | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Степени окисления | ||||||||||||||||||||||||||||||||
| Энергия ионизации (первый электрон) | ||||||||||||||||||||||||||||||||
| Термодинамические свойства простого вещества | ||||||||||||||||||||||||||||||||
Плотность (при н. у.) у.) | ||||||||||||||||||||||||||||||||
| Температура плавления | ||||||||||||||||||||||||||||||||
| Температура кипения | ||||||||||||||||||||||||||||||||
| Уд. теплота плавления | ~2 кДж/моль | |||||||||||||||||||||||||||||||
| Уд. теплота испарения | ~65 кДж/моль | |||||||||||||||||||||||||||||||
| Молярная теплоёмкость | 31,6 Дж/(K·моль) | |||||||||||||||||||||||||||||||
| Кристаллическая решётка простого вещества | ||||||||||||||||||||||||||||||||
| Структура решётки | кубическая | |||||||||||||||||||||||||||||||
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Fr | Uut | Uup | Uus | Uuo | ||||||||||||||||||||||||||||
| Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | |||||||||||||||||||||||||
Отрывок, характеризующий Франций– Командир 3 й роты к генералу! командира к генералу, 3 й роты к командиру!… – послышались голоса по рядам, и адъютант побежал отыскивать замешкавшегося офицера. Когда звуки усердных голосов, перевирая, крича уже «генерала в 3 ю роту», дошли по назначению, требуемый офицер показался из за роты и, хотя человек уже пожилой и не имевший привычки бегать, неловко цепляясь носками, рысью направился к генералу. Лицо капитана выражало беспокойство школьника, которому велят сказать невыученный им урок. На красном (очевидно от невоздержания) носу выступали пятна, и рот не находил положения. Полковой командир с ног до головы осматривал капитана, в то время как он запыхавшись подходил, по мере приближения сдерживая шаг. – Вы скоро людей в сарафаны нарядите! Это что? – крикнул полковой командир, выдвигая нижнюю челюсть и указывая в рядах 3 й роты на солдата в шинели цвета фабричного сукна, отличавшегося от других шинелей. – Сами где находились? Ожидается главнокомандующий, а вы отходите от своего места? А?… Я вас научу, как на смотр людей в казакины одевать!… А?… Ротный командир, не спуская глаз с начальника, всё больше и больше прижимал свои два пальца к козырьку, как будто в одном этом прижимании он видел теперь свое спасенье. 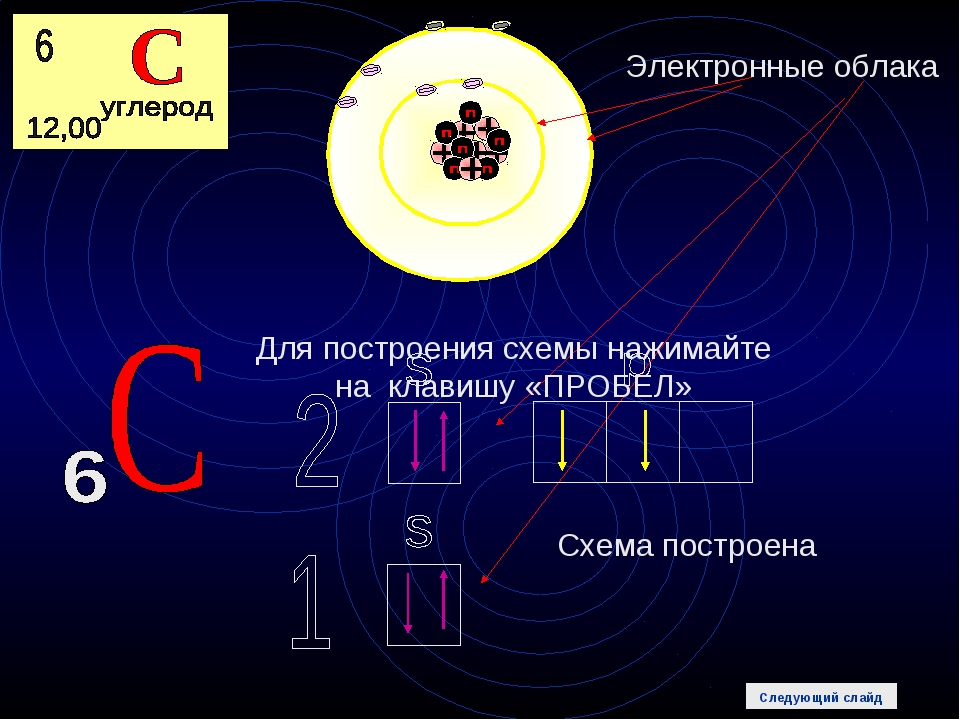 – Ну, что ж вы молчите? Кто у вас там в венгерца наряжен? – строго шутил полковой командир. – Ваше превосходительство… – Ну что «ваше превосходительство»? Ваше превосходительство! Ваше превосходительство! А что ваше превосходительство – никому неизвестно. – Ваше превосходительство, это Долохов, разжалованный… – сказал тихо капитан. – Что он в фельдмаршалы, что ли, разжалован или в солдаты? А солдат, так должен быть одет, как все, по форме. – Ваше превосходительство, вы сами разрешили ему походом. – Разрешил? Разрешил? Вот вы всегда так, молодые люди, – сказал полковой командир, остывая несколько. – Разрешил? Вам что нибудь скажешь, а вы и… – Полковой командир помолчал. – Вам что нибудь скажешь, а вы и… – Что? – сказал он, снова раздражаясь. – Извольте одеть людей прилично… И полковой командир, оглядываясь на адъютанта, своею вздрагивающею походкой направился к полку. Видно было, что его раздражение ему самому понравилось, и что он, пройдясь по полку, хотел найти еще предлог своему гневу. 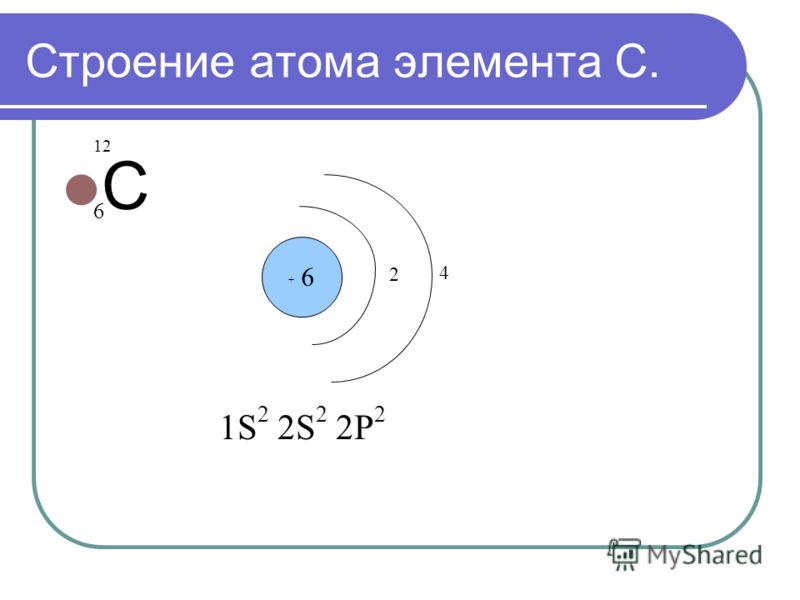 Оборвав одного офицера за невычищенный знак, другого за неправильность ряда, он подошел к 3 й роте. Оборвав одного офицера за невычищенный знак, другого за неправильность ряда, он подошел к 3 й роте.– Кааак стоишь? Где нога? Нога где? – закричал полковой командир с выражением страдания в голосе, еще человек за пять не доходя до Долохова, одетого в синеватую шинель. Долохов медленно выпрямил согнутую ногу и прямо, своим светлым и наглым взглядом, посмотрел в лицо генерала. – Зачем синяя шинель? Долой… Фельдфебель! Переодеть его… дря… – Он не успел договорить. – Генерал, я обязан исполнять приказания, но не обязан переносить… – поспешно сказал Долохов. – Во фронте не разговаривать!… Не разговаривать, не разговаривать!… – Не обязан переносить оскорбления, – громко, звучно договорил Долохов. Глаза генерала и солдата встретились. Генерал замолчал, сердито оттягивая книзу тугой шарф. – Извольте переодеться, прошу вас, – сказал он, отходя. – Едет! – закричал в это время махальный. | ||||||||||||||||||||||||||||||||
Химический элемент франций: характеристика и история открытия.
 Химический элемент Франций (Fr). Общая Характеристика (Fr)
Химический элемент Франций (Fr). Общая Характеристика (Fr)История открытия:
Франций — один из четырех элементов (№№ 43, 61, 85 и 87) которые остались неоткрытыми к 1925 году. Предсказанный еще Меделеевым эка-цезий искали в качестве спутника цезия в цезиевых минералах. С 1929 по 1939 год эка-цезий «находили» несколько раз, называя то виргинием в честь штата США, то молдавием, то алкалинием или руссием. Однако все эти открытия были ошибочными.
В 1939 г. Маргарита Перей из института Кюри в Париже, занимаясь очисткой препарата актиния (Ас-227) от разнообразных продуктов радиоактивного распада, обнаружила b -излучение, которое не могло принадлежать ни одному из известных в то время изотопов.
Когда этот изотоп (период полураспада 21 мин) подвергли химическому исследованию, оказалось, что его свойства соответствуют свойствам эка-цезия.
Окончательно это было подтверждено после второй мировой войны, и в 1946 г. Перей предложила назвать новый элемент францием (Francium) в честь ее родины.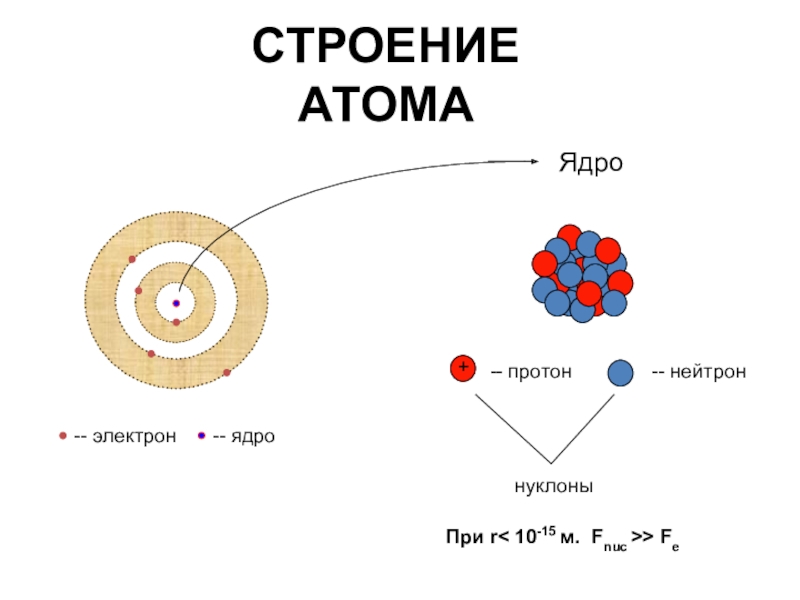
Получение:
Франций-223 (самый долгоживущий из изотопов франция, период полураспада 22,3 минуты) входит в одну из побочных ветвей природного радиоактивного ряда урана-235 и содержится в крайне малых количествах в урановых минералах. Его образование из актиния можно выразить уравнением:
227 Ac (-, a ) 223 Fr. По оценкам, его равновесное содержание в земной коре равно 340 г. Также в одной из побочных ветвей радиоактивного ряда тория содержится франций-224 с периодом полураспада 3,0 минуты. Его равновесное содержание в земной коре составляет лишь 0,5 г.
С помощью ядерных реакций получают и другие изотопы франция. Одна из наиболее распространённых реакций:
197 Au + 18 O = 210 Fr + 5n
Физические свойства:
Радоактивный металл. Вследствие высокой радиоактивности исследования проводятся с микроскопическими количествами. Согласно последним данным, плотность франция при комнатной температуре составляет 1,87 г/см 3 , температура плавления 27°C, температура кипения 677°C.
Франций претерпевает b -распад, превращаясь в изотоп радия: 223 Fr (-, b ) 223 Ra
Химические свойства:
Франций имеет самую низкую электроотрицательность из всех элементов, известных в настоящее время. Электродный потенциал Fr + /Fr = -2,92 В.
Соответственно, франций является и самым химически активным щелочным металлом.
В соединениях проявляет степень окисления +1.
Важнейшие соединения:
Соединения мало изучены вследствие радиоактивности франция. Он обладает большинством свойств, характерных для других щелочных металлов, наиболее похож по свойствам на цезий, всегда сокристаллизуется с его соединениями. Так для выделения франция из смеси с другими продуктами ядерных реакций используется основано на его соосаждении с нерастворимыми солями цезия (перхлоратом или кремневольфраматом цезия). Он извлекается из растворов также хлороплатинатами цезия и рубидия Cs 2 PtCl 6 и Rb 2 PtCl 6 , хлоровисмутатом Cs 2 BiCl 5 , хлоростаннатом Cs 2 SnCl 6 и хлороантимонатом цезия Cs 2 SbCl 5 · 2,5H 2 O, а также свободными гетерополикислотами – кремневольфрамовой и фосфорновольфрамовой.
Образует растворимые соли и гидроксид.
Применение:
Хлорид франция FrCl использовался для обнаружения раковых опухолей, но по причине чрезвычайно высокой стоимости эту соль в масштабных разработках использовать невыгодно.
В настоящее время франций и его соли применения пока что не имеют, в связи с малым периодом полураспада и высокой радиоактивностью.
Тестова Кристина
ХФ ТюмГУ, 581 группа, 2011 г.
Источники: Франций. Популярная библиотека химических элементов http://n-t.ru/ri/ps/pb087.htm
Франций. Википедия, свободная энциклопедия.
Франций – это элемент с атомным числом 87. Атомная масса наиболее долгоживущего изотопа – 223. Франций является радиоактивным щелочным металлом, обладает крайне выраженной химической реактивностью.
FranciumИстория открытия франция
Металл был открыт еще в 1939 году сотрудницей парижского Института Радия по имени Маргарита Перей. Она же — видимо, из патриотических чувств — назвала элемент в честь своей Родины. Франций был открыт при изучении искусственно полученного элемента «актиния»: было замечено нехарактерное радиоактивное свечение. Следует ради справедливости отметить, что над созданием этого элемента могли одновременно с ней работать и другие исследователи, но, как говорится, победителей не судят.
Франций был открыт при изучении искусственно полученного элемента «актиния»: было замечено нехарактерное радиоактивное свечение. Следует ради справедливости отметить, что над созданием этого элемента могли одновременно с ней работать и другие исследователи, но, как говорится, победителей не судят.
Основные характеристики
На сегодняшний день франций является одним из самых редких металлов (да и вообще химических элементов), которые встречаются в природе.
Earth’s Crust
Согласно подсчетам ученых, содержание этого металла в земной коре составляет порядка 340 грамм (меньше содержится только aстата). Связано это главным образом с его физической неустойчивостью. Будучи радиоактивным, он имеет очень короткий период полураспада (у самого стабильного изотопа он составляет 22,3 минуты). Единственное, чем компенсируется его природное содержание, так это тем, что франций является промежуточным звеном распада урана-235 и тория-232. Таким образом, весь франций, который содержится в естественных условиях, является продуктом радиоактивного распада.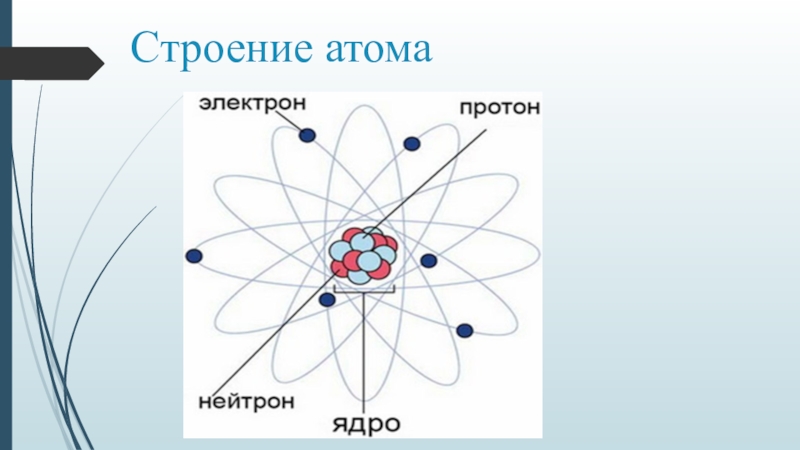
Как можно его получить?
Рассмотрим единственный способ получить самый стабильный изотоп франция. Это можно сделать за счет ядерной реакции золота с атомами кислорода. Все остальные способы (имеется в виду радиоактивный распад) нецелесообразны, так как получаются крайне нестабильные изотопы, которые «живут» не более нескольких минут. Получить в домашних условиях этот элемент, как и все его соединения, понятное дело, не получится (да и незачем, собственно). можно найти множество экспериментов с другими металлами.
Какие химические свойства проявляет франций?
По своим свойствам франций аналогичен цезию. Релятивистские эффекты 6p-оболочки обеспечивают связь франция с кислородом в супероксидах (например, состава FrO 2) более ковалентной, относительно супероксидов прочих элементов этой группы. С учетом максимально низкой электроотрицательности из всех ныне существующих франций характеризуется выраженной химической активностью. Все физические свойства этого элемента указаны только теоретически, так как проверить их на практике не представляется возможным по причине короткого периода «жизни» этого элемента (плотность=1,87 г/см³, t плавления=27 °C, t кипения=677 °C, удельная теплота плавления=9,385 кДж/кг). Все соединения этого элемента растворимы в воде (исключения: соли перхлорат, хлороплатинат, пикраткобальтинитрит франция). Франций всегда сокристаллизуется с веществами, в состав которых входит цезий. Наблюдается его соосаждение с нерастворимыми солями цезия (перхлоратом или кремневольфраматом цезия). Извлечение из растворов франция осуществляется:
Все соединения этого элемента растворимы в воде (исключения: соли перхлорат, хлороплатинат, пикраткобальтинитрит франция). Франций всегда сокристаллизуется с веществами, в состав которых входит цезий. Наблюдается его соосаждение с нерастворимыми солями цезия (перхлоратом или кремневольфраматом цезия). Извлечение из растворов франция осуществляется:
- хлороплатинатами цезия и рубидия Cs 2 PtCl 6 и Rb 2 PtCl 6 ;
- хлоровисмутатом Cs 2 BiCl 5 , хлоростаннатом Cs 2 SnCl 6 и хлороантимонатом цезия Cs 2 SbCl 5 2,5H 2 O;
- cвободными гетерополикислотами: кремневольфрамовой и фосфорновольфрамовой.
Какое практическое значение имеет этот элемент?
Несмотря на всю свою уникальность, никакого применения на практике франций пока еще не имеет. Соответственно, в промышленности и каких-либо технологиях не используется. Причиной тому является его чрезвычайно короткий период полураспада. Есть данные, что хлорид франция может быть использован для диагностики онкологических новообразований, однако в виду значительной стоимости этого образования, подобного рода методика не может быть введена в систематическое использование.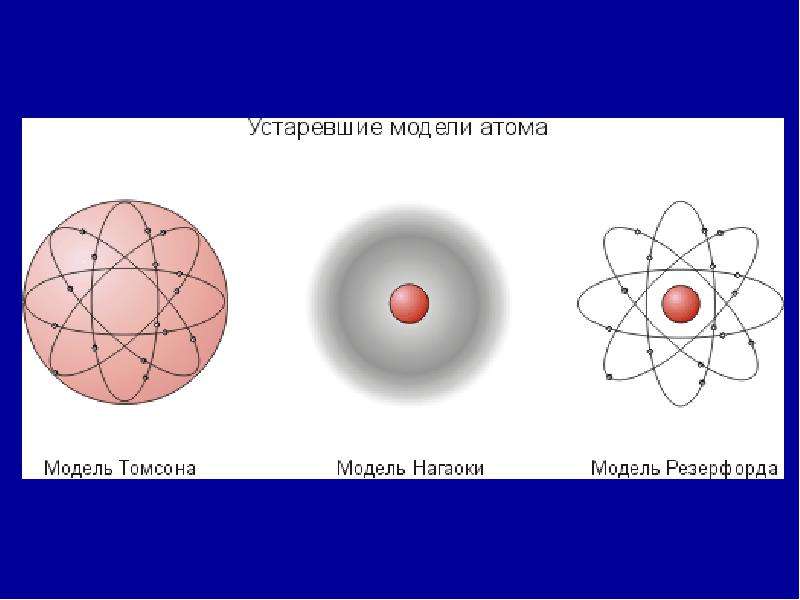 В принципе, теми же свойствами обладает цезий.
В принципе, теми же свойствами обладает цезий.
Caesium
Так что и это свойство франция оказалось невостребованным: его стоимость сравнивается со стоимостью тонны платины или золота. По прогнозам ведущих специалистов, рассматриваемый элемент будет всегда иметь чисто познавательную ценность, не более того.
(Francium; от назв. Франции), Fr — радиоактивный хим. элемент I группы периодической системы элементов; ат. н. 87. Стабильных изотопов неимеет. Получены 18 радиоактивных изотопов с массовыми числами от 204 до 224 и периодами полураспада от 5 10 -3 сек (218Fr) до 23 мин (212Fr). Существование Ф. и некоторые его св-ва предсказал (1870) рус. ученый Д. И. Менделеев, назвав неизвестный в время элемент экацезием. Открыт экацезий в 1939 франц. исследовательницей М. Перей при изучении радиоактивного распада актиния и назван «актинием К». В 1949 «актиний К» переименован во франций. В природе встречаются изотопы 223Fr и 221Fr, из них изотоп 223Fr — как продукт радиоактивного распада актиния 227Ас. В 1m природного урана содержится 0,2 мг 227Ас и 3,8 10 -10 г 223Fr. Франций- самый тяжелый элемент среди металлов щелочной группы. Атомный радиус 12,83 А. Ионный радиус Fr+ равен 1,80 А. Плотность (т-ра 20° С) 2,44 г/см3; tпл 20° С; t кип630° С; теплоемкость 0,0338 кал/г-град; электрическое сопротивление (т-ра 18 С)45 10-6 ом-см.
В 1m природного урана содержится 0,2 мг 227Ас и 3,8 10 -10 г 223Fr. Франций- самый тяжелый элемент среди металлов щелочной группы. Атомный радиус 12,83 А. Ионный радиус Fr+ равен 1,80 А. Плотность (т-ра 20° С) 2,44 г/см3; tпл 20° С; t кип630° С; теплоемкость 0,0338 кал/г-град; электрическое сопротивление (т-ра 18 С)45 10-6 ом-см.
По хим. св-вам франций — полный аналог рубидия и цезия. Гидроокись фторид, хлорид, нитрат, сульфат, сульфид, карбонат, ацетат и оксалат Ф. хорошо растворяются в воде; перхлорат, пикрат, иодат, хлороплатинат, хлоровисмутат, хлоро-антимонат, хлоростаннат и кобаль-тинитрит Ф., а также двойная соль Fr9Bi2I9 и соли франция с гетерополикис-лотами плохо растворимы в воде. Франций выделяют разными методами из продуктов распада 227Ас, из урановой смоляной руды, из продуктов облучения тория и урана быстрыми протонами, а также из продуктов облучения золота ионами 22Ne. При выделении Ф. из продуктов распада 227Ас водный раствор хлорида актиния кипятят с избытком углекислого натрия, осадок отфильтровывают, в фильтрат добавляют соляную к-ту и снова кипятят для разрушения карбонат-ионов. Затем добавляют небольшие количества хлорида лантана и бария, хромата калия и аммония. После этого осадок хроматов отфильтровывают, а фильтрат, содержащий 223Fr, концентрируют упариванием. Для выделения франция из растворов, содержащих, кроме солей Ф., др. соединения, используют ионообменные смолы, методы электрофореза, хрохматографии и др. С помощью франция определяют наличие актиния в природных объектах. Изотоп 223Fr находит применение в биологических исследованиях.
Затем добавляют небольшие количества хлорида лантана и бария, хромата калия и аммония. После этого осадок хроматов отфильтровывают, а фильтрат, содержащий 223Fr, концентрируют упариванием. Для выделения франция из растворов, содержащих, кроме солей Ф., др. соединения, используют ионообменные смолы, методы электрофореза, хрохматографии и др. С помощью франция определяют наличие актиния в природных объектах. Изотоп 223Fr находит применение в биологических исследованиях.
Несомненно одно — его валентный электрон находится на 7 s -орбитали, а радиус атома самый большой среди всех элементов периодической системы. Франций радиоактивный химический элемент. Стабильных изотопов не имеет, а те, что известны — короткоживущие и быстро распадаются, испуская β -излучение (электроны). На всем земном шаре его едва найдется ~500г.
Свойства простого вещества и соединенийВсе данные по свойствам франция получены экстраполяцией на основании результатов по совместному осаждению с другими элементами. В химическом отношении I г самый ближайший аналог цезия, по франций еще более электроположителен. Единственная устойчивая степень его окисления +1.
В химическом отношении I г самый ближайший аналог цезия, по франций еще более электроположителен. Единственная устойчивая степень его окисления +1.
Получают франций только в виде его соединении путем отделения от актиния. С помощью ионнообменного разделения па колонке со смолой « Дауэкс-50» может быть получено микроскопическое количество франция 95%-пой чистоты. Однако период его полураспада 22 мин, т. е. через каждый такой интервал количество его уменьшается вдвое. Никакого применения пока еще не находит. Радиоизлучение франция помогает отыскивать . Появились публикации, в которых утверждается, что радиоактивность франция может оказаться полезной при диагностике онкологических заболеваний: он избирательно способен накапливаться в опухолях на самых ранних стадиях их развития.
Вы читаете, статья на тему франций
ОПРЕДЕЛЕНИЕ
Франций расположен в седьмом периоде I группе главной (А) подгруппе Периодической таблицы.
Относится к элементам s -семейства. Металл. Обозначение — Fr. Порядковый номер — 87. Относительная атомная масса — 223,02 а.е.м.
Электронное строение атома франция
Атом франция состоит из положительно заряженного ядра (+87), внутри которого есть 87 протонов и 136 нейтронов, а вокруг, по семи орбитам движутся 87 электронов.
Рис.1. Схематическое строение атома франция.
Распределение электронов по орбиталям выглядит следующим образом:
87Fr) 2) 8) 18) 32) 32) 8) 1 ;
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4f 14 5s 2 5p 6 5d 10 6s 2 6p 6 7s 1 .
На внешнем электронном уровне атома франция находится 1 электрон, который является валентным (расположен на 7s- подуровне). Энергетическая диаграмма основного состояния принимает следующий вид:
Наличие одного неспаренного электрона в атоме франция свидетельствует о его способности проявлять степень окисления +1.
Валентный электрон атома франция можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), m l (магнитное) и s (спиновое):
Примеры решения задач
ПРИМЕР 1
Франций
ФРА́НЦИЙ -я; ср. [лат. Francium] Химический элемент (Fr), радиоактивный щелочной металл.
◁ Фра́нциевый, -ая, -ое.
фра́нций(лат. Francium), химический элемент I группы периодической системы, относится к щелочным металлам. Радиоактивен, наиболее устойчив изотоп 223 Fr (период полураспада 22 мин). Название от Франции — родины М. Пере (М. Perey), открывшей элемент. Один из редчайших и наименее устойчивых из всех радиоактивных элементов, встречающихся в природе. Свойства франция изучены недостаточно из-за невозможности выделения весомых количеств; по оценке: плотность 2,3-2,5 г/см 3 , t пл 18-21°C. Химически самый активный из всех щелочных металлов.
ФРАНЦИЙФРА́НЦИЙ (лат. Francium), Fr (читается «франций»), радиоактивный химический элемент с атомным номером 87. Самый тяжелый щелочной металл. Расположен в группе IА, в 7 периоде периодической системы элементов.
Francium), Fr (читается «франций»), радиоактивный химический элемент с атомным номером 87. Самый тяжелый щелочной металл. Расположен в группе IА, в 7 периоде периодической системы элементов.
Все радиоизотопы франция быстро распадаются, наиболее долгоживущий встречающийся в природе a-радиоактивный 223 Fr (Т1/2 = 21,8 мин) входит в радиоактивный ряд 235 U. Получены изотопы с массовыми числами 202-229. Электронная конфигурация внешнего слоя 7s 1 . Степень окисления +1 (валентность I). Радиус атома 0,29 нм, радиус иона Fr + 0,178 нм. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус)
0,7.
Нахождение в природе
Содержание в земной коре несколько сотен грамм. 223 Fr постоянно образуется при радиоактивном распаде.
История открытия
Первым вывод о существовании Fr сделал Д. И. Менделеев (см. МЕНДЕЛЕЕВ Дмитрий Иванович)
. В 1938-1939 француженка М. Перей при исследовании радиоактивного распада 227 Ac открыла франций. В 1945 элемент получил название в честь родины М. Перей — Франции.
Перей — Франции.
Физические и химические свойства
Так как в распоряжении исследователей имеются образцы, содержащие не более 10 -13 -10 -14 г Fr, сведения о его свойствах известны только предположительно. Fr похож по свойствам на цезий (см. ЦЕЗИЙ)
. Всегда сокристаллизуется с его соединениями. Плотность Fr может быть 2,5 кг/дм 3 , температура плавления 18-21°C, кипения 640-660°C.
Энциклопедический словарь . 2009 .
Синонимы :Смотреть что такое «франций» в других словарях:
— (Francium), Fr, радиоактивный химический элемент I группы периодической системы, атомный номер 87; щелочной металл. Открыла франций французская радиохимик М. Пере в 1939 … Современная энциклопедия
— (лат. Francium) Fr, химический элемент I группы периодической системы Менделеева, атомный номер 87, атомная масса 223,0197, относится к щелочным металлам. Радиоактивен, наиболее устойчив изотоп 223Fr (период полураспада 21,8 мин). Назван по имени … Большой Энциклопедический словарь
— (символ Fr), радиоактивный, металлический элемент первой группы периодической таблицы, открыт в 1939 г. Самый тяжелый элемент ряда ЩЕЛОЧНЫХ МЕТАЛЛОВ. В натуральном виде присутствует в урановой руде, продукт разложения АКТИНИЯ. Элемент редкий,… … Научно-технический энциклопедический словарь
Самый тяжелый элемент ряда ЩЕЛОЧНЫХ МЕТАЛЛОВ. В натуральном виде присутствует в урановой руде, продукт разложения АКТИНИЯ. Элемент редкий,… … Научно-технический энциклопедический словарь
Fr (назв. в честь Франции, родины M. Пepe, открывшей элемент; лат. Francium * a. francium; н. Franzium; ф. francium; и. francio, francium), радиоактивный хим. элемент I группы системы Mенделеева; ат. н. 87. Cтабильных изотопов не имеет.… … Геологическая энциклопедия
— (лат. Francium), Fr, радиоакт. хим. элемент 1 й группы периодич. системы элементов, ат. номер 87, относится к щелочным металлам. Наим. устойчив из всех радиоакт. элементов, встречающихся в природе. Природный Ф. состоит из b радиоактивного 223Fr… … Физическая энциклопедия
Сущ., кол во синонимов: 2 металл (86) элемент (159) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
87 Радон ← Франций → Радий … Википедия
— (лат. Francium), хим. элемент I гр. периодич. системы, относится к щелочным металлам. Радиоактивен, наиб. устойчив нуклид 223Fr (период полураспада 22 мин). Назв. от Франции родины М. Перей, открывшей элемент. Один из редчайших и наименее… … Естествознание. Энциклопедический словарь
Радиоактивен, наиб. устойчив нуклид 223Fr (период полураспада 22 мин). Назв. от Франции родины М. Перей, открывшей элемент. Один из редчайших и наименее… … Естествознание. Энциклопедический словарь
Франций — Смотри Франций (Fr) … Энциклопедический словарь по металлургии
франций — francis statusas T sritis chemija apibrėžtis Cheminis elementas. simbolis(iai) Fr atitikmenys: lot. francium angl. francium rus. франций … Chemijos terminų aiškinamasis žodynas
Книги
- Радиоактивные металлы франций и дубний. Методы прогнозирования физических параметров , Николаев О.С.. В книге приведены методы прогнозирования физических параметров франция и дубния. Это радиоактивные металлы седьмого периода таблицы Д. И. Менделеева. Малые периодыполураспада этих металлов…
Конспект урока на тему : «Строение атома»
Тема урока: Строение атома
Цели урока:
Образовательная:
создать условия для формирования таких понятий, как атом, орбиталь, изотопы,
протон, нейтрон, электрон. Продолжать формировать умение работать с
Периодической системой, рассмотреть физический смысл порядкового номера
элемента. Познакомить с историей открытия строения атома.
Продолжать формировать умение работать с
Периодической системой, рассмотреть физический смысл порядкового номера
элемента. Познакомить с историей открытия строения атома.
Развивающая: Развивать умение сопоставлять новые научные данные с уже известной структурой периодической системы.
Воспитательная: Воспитательные: воспитывать личностные качества, обеспечивающие успешность исполнительной деятельности
Ход урока
1. Оргмомент
2. Изучение нового материала.
а) Вступительное слово учителя.
Быть может, эти электроны —
Миры, где пять материков,
Искусства, званья, войны, троны
И память сорока веков.
Еще, быть может, каждый атом —
Вселенная, где сто планет;
Там все, что здесь, в объеме сжатом,
Но также то, чего здесь нет.
(В. Брюсов «Мир электрона».)
— Как вы понимаете эти строки?
— Все ли мы с вами знаем о строении атома?
— Что вы можете сказать о строении атома водорода?
— А о строении атома франция или резерфордия?
— Итак, тема урока: «Строение электронных оболочек атома».
Электроны
в атомах химических элементов располагаются на энергетических уровнях. На первом энергетическом уровне могут находится только два электрона, на втором
— восемь. Такие уровни называются завершёнными. Число электронов на
внешнем уровне атома химического элемента равно номеру его группы (для
элементов главных подгрупп). Свойства химических элементов периодически
повторяются, так как периодически повторяется строение внешних энергетических
уровней у их атомов.Впервые понятие «атом» ввел Демокрит, но
он не вкладывал в него столь глубокий смысл.
Демокрит
В основе философии Демокрита лежит учение об атомах и пустоте как двух принципах, порождающих многообразие космоса. Атом есть мельчайшее «неделимое» тело, не подверженное никаким изменениям. Неделимость атома аналогична неделимости «бытия».
Модель Томсона
Гораздо позже в 1904 году Томсон представил свою новую модель атома. Она представляла собой также равномерно заряженную положительным электричеством сферу, внутри которой вращались отрицательно заряженные корпускулы, число и расположение которых зависело от природы атома. После открытия радиоактивности, эта модель не соответствовала действительности.
Опыт Резерфорда
Резерфорд исследовал особенности прохождения альфа-частиц через тонкие металлические пластинки.
На основании этих опытов ученый предложил планетарную модель атома: в центре атома — ядро, вокруг которого вращаются электроны.
Планетарная модель Резерфорда
Положительный заряд сконцентрирован в ядре атома, а отрицательно заряженные электроны находятся вокруг него
А сейчас ребята,
обсудим некоторые термины, запишите их в словарик.
АТОМ — мельчайшая, химически неделимая, частица
ОРБИТАЛИ — место расположения электрона в атоме
Запись а.е.м. – означает атомную единицу массы
В ядре сосредоточена большая часть массы атома
Посмотрите на таблицу.
Строение атома
частица | место нахождения | масса | заряд |
Протон P+ | ядро | 1 а.е.м | +1 |
Нейтрон n0 | ядро | 1а.е.м. | 0 |
Электрон e- | орбиталь | 0 | -1 |
Порядковый номер элемента:
1. Число
протонов
Число
протонов
2. Число электронов
3. Заряд ядра (Z )
Число нейтронов N =A r -Z
ИЗОТОПЫ – это атомы одного химического элемента , имеющие одинаковое число протонов и электронов, но разное нейтронов и разные массовые числа.
Практическая часть
Закончи определения
· АТОМ –это …
· ПЛАНЕТАРНАЯ МОДЕЛЬ –это…
· ОРБИТАЛЬ –это…
· ПОРЯДКОВЫЙ НОМЕР –показывает …
· ИЗОТОПЫ – это…
Заполни таблицу
| Ca | Fe | Cu | Cl |
p+ |
|
|
|
|
e— |
|
|
|
|
n0 |
|
|
|
|
А сейчас ребята выполним небольшой тест
Тестовые задания
1. Заряд
ядра атома азота равен:
Заряд
ядра атома азота равен:
а) 7 б) 13 в) 4 г) 29 д) 11
2.
Число
протонов в ядре атома криптона:
а) 36 б) 17 в) 4 г) 31 д) 6
3.
Число
нейтронов в ядре атома цинка:
а) 8 б) 35 в)11 г)30 д)4
4.
Число
электронов в атоме железа:
а) 11 б)8 в)56 г)26 д)30
5.
Изотопы
водорода отличаются друг от друга:
а) числом e- б) числом n в) химическим знаком г) числом p д) массовым числом
Поменяйтесь заданиями с соседом по парте, проверим ответы:
1.
Заряд
ядра атома азота равен:
а) 7 б) 13 в) 4 г) 29 д) 11
2.
Число
протонов в ядре атома криптона:
а) 36 б) 17 в) 4 г) 31 д) 6
3.
Число
нейтронов в ядре атома цинка:
а) 8 б) 35 в)11 г)30 д)4
4.
Число
электронов в атоме железа:
а) 11 б)8 в)56 г)26 д)30
5.
Изотопы
водорода отличаются друг от друга:
а) числом электронов б) числом нейтронов в) химическим знаком г) числом
p д) массовым числом
Вы справились. Желаю дальнейших успехов в изучении химии!
Желаю дальнейших успехов в изучении химии!
Домашние задание: §37 упр.1-3 с.138
II. Энергетические потребности Франции. Атомная проблема
II. Энергетические потребности Франции
Как обстоит дело во Франции? Какое значение может иметь здесь ядерная энергия по сравнению с обычными источниками энергии и какие выгоды принесет ее использование? Вот вопросы, на которых мы сейчас остановимся.
1. Спрос на энергию
Спрос на энергию во Франции характеризуется следующими цифрами:
а) годовое потребление угля, которое с начала XX века изменилось весьма незначительно, составляет сейчас около 70 млн. т. Есть основания полагать, что в будущем эта цифра сократится, поскольку потребление угля железнодорожным транспортом и расход его на отопление уменьшается из года в год. Однако нужно принять во внимание то обстоятельство, что тепловые электростанции будут расходовать все больше и больше угля;
б) потребление нефтепродуктов на транспорте было до сих пор довольно низким. Оно увеличивается ежегодно примерно на 7 %. В 1955 году потребление нефтепродуктов на территории метрополии составило 15,6 млн. т — вдвое больше, чем в 1949 году;
Оно увеличивается ежегодно примерно на 7 %. В 1955 году потребление нефтепродуктов на территории метрополии составило 15,6 млн. т — вдвое больше, чем в 1949 году;
в) в 1955 году во Франции было израсходовано 49,4 млрд. квт-ч электроэнергии, то есть на 9,1 % больше, чем в 1954 году. За период с 1946 по 1956 год потребление электроэнергии во Франции возросло в 2,6 раза.
Следует добавить, что по потреблению электроэнергии на душу населения (1060 квт-ч) Франция занимает седьмое место в мире после Норвегии (6450 квт-ч), Соединенных Штатов Америки, Швейцарии, Великобритании, Западной Германии и Бельгии. В общем можно сказать, что в 1954 году потребление электроэнергии на душу населения во Франции составило в переводе на условное топливо 105, а в 1915 году — 112 млн. т.
2. Производство энергии.
а) Добыча угля во Франции остается примерно на одном и том же уровне, не превышая 55–60 млн. т в год.
Если сравнить эту цифру с другой, характеризующей потребление, то мы увидим, что Франция испытывает хронический дефицит в угле, главным образом в коксе. Этот дефицит, который приходится покрывать за счет импорта, составляет примерно 15 млн. т в год.
Этот дефицит, который приходится покрывать за счет импорта, составляет примерно 15 млн. т в год.
В 1953 году во Франции было добыто 54,3 млн. т угля, в 1954 году — 56,3 млн. т. В 1955 году добыча угля во Франции, несмотря на уменьшение количества рабочих, занятых в угольной промышленности, достигла уровня рекордного 1952 года. В 1955 году было добыто 57,4 млн. т, что превышает добычу 1938 года на 20 %. Основных угольных бассейнов во Франции около десятка; наиболее значительными из них являются бассейны департаментов Нор и Па-де-Кале (29 млн. т в 1955 году) и Лотарингии (13 млн. т).
Запасы каменного и бурого угля во Франции оцениваются в 12 млрд. т. Следовательно, угля во Франции хватит примерно на 200–250 лет. Другими словами, через 4–5 поколений основная часть угольных запасов Франции будет исчерпана.
б) Добыча нефти во Франции в 1955 году впервые превысила 1 млн. т и достигла 1,036 млн. т против 700 тыс. т в 1954 году, 556 тыс. т в 1953 году и всего 56 тыс. т в 1946 году. Нефтеперерабатывающие заводы в 1955 году дали 23 млн. т нефтепродуктов против 22 млн. т в 1954 году. Это вдвое больше продукции 1949 года и вчетверо — продукции 1938 года. На нефтеперерабатывающих заводах было переработано 25 млн. т сырой нефти, или на 1 млн. т больше, чем в 1954 году.
Нефтеперерабатывающие заводы в 1955 году дали 23 млн. т нефтепродуктов против 22 млн. т в 1954 году. Это вдвое больше продукции 1949 года и вчетверо — продукции 1938 года. На нефтеперерабатывающих заводах было переработано 25 млн. т сырой нефти, или на 1 млн. т больше, чем в 1954 году.
Что касается газа, то в 1953 году Управление национализированными предприятиями газовой промышленности отпустило потребителям 3,14 млрд. кубометров газа. Это является рекордной цифрой, так как в 1954 году было отпущено всего 2,97 млрд. кубометров. Подобный рост в 6 % объясняется проведенными работами по модернизации и укрупнению газовых предприятий (45 газовых заводов в 1955 году были закрыты), а также введением в строй новых заводов.
Трудно сказать, в каких размерах будет расти добыча нефти и газа в будущем. Последние геологические изыскания, проведенные в основном на юго-западе Франции, позволяют надеяться на значительный рост. Можно полагать, что ежедневная добыча газа составит 1 млн. кубометров в 1957 году, 4 млн.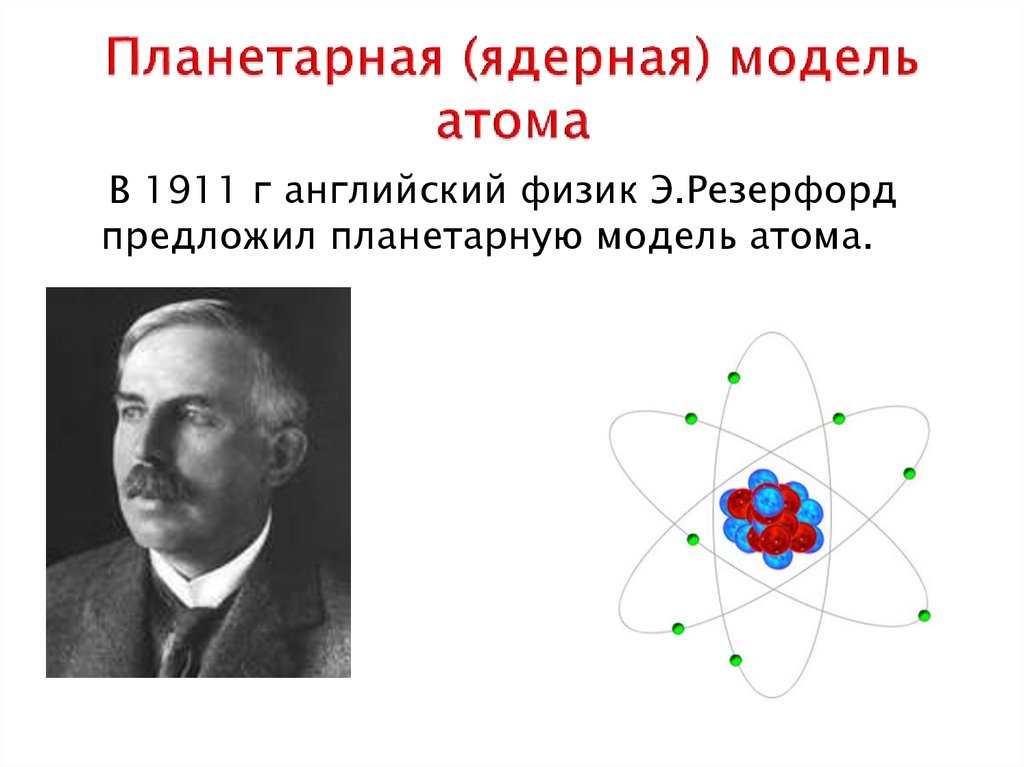 кубометров в 1958 году и 12 млн. кубометров в 1961 году. Если будут открыты новые месторождения природного газа, то стоимость его будет на 30 % ниже стоимости жидкого топлива. Следует отметить, что геологическое строение Западной Европы и последние изыскания, проведенные в Аквитанской низменности во Франции (Парантиз, Лак) и в долине реки По в Италии (Кортемаджиоре), дают основание полагать, что если в этих странах затратить необходимые средства, то можно будет добиться значительного увеличения доли нефти и природного газа в выработке энергии, которая в настоящее время равна всего 2 %.
кубометров в 1958 году и 12 млн. кубометров в 1961 году. Если будут открыты новые месторождения природного газа, то стоимость его будет на 30 % ниже стоимости жидкого топлива. Следует отметить, что геологическое строение Западной Европы и последние изыскания, проведенные в Аквитанской низменности во Франции (Парантиз, Лак) и в долине реки По в Италии (Кортемаджиоре), дают основание полагать, что если в этих странах затратить необходимые средства, то можно будет добиться значительного увеличения доли нефти и природного газа в выработке энергии, которая в настоящее время равна всего 2 %.
в) Почти половину всей производимой во Франции электроэнергии дают гидроэлектростанции, вторую половину — тепловые электростанции.
В 1955 году было выработано примерно 50 млрд. квт-ч электроэнергии, из них 85 % (42 млрд. квт-ч) пошли на промышленные цели, а 15 % (7,5 млрд. квт-ч) были израсходованы на бытовые нужды. Потребление тока высокого напряжения в 1955 году увеличилось по сравнению с предыдущим годом на 10 %, а тока низкого напряжения — на 61 %. Из наиболее крупных потребителей электроэнергии следует отметить черную металлургию (14 %, всего потребляемого количества электроэнергии), электрохимию и электрометаллургию (12 %) и железнодорожный транспорт (7 %). Расход электроэнергии на бытовые нужды возрос во Франции на 11 %, то есть более чем на 2 млрд. квт-ч. Это объясняется резким увеличением числа электроприборов личного пользования, обладание которыми, по взглядам французов, неразрывно связано с понятием комфорта.
Из наиболее крупных потребителей электроэнергии следует отметить черную металлургию (14 %, всего потребляемого количества электроэнергии), электрохимию и электрометаллургию (12 %) и железнодорожный транспорт (7 %). Расход электроэнергии на бытовые нужды возрос во Франции на 11 %, то есть более чем на 2 млрд. квт-ч. Это объясняется резким увеличением числа электроприборов личного пользования, обладание которыми, по взглядам французов, неразрывно связано с понятием комфорта.
Производство гидроэлектроэнергии достигло в 1955 году 25 млрд. квт-ч, что на 5,4 % больше, чем в 1954 году (Альпы-Рона — 65 %, Центральный массив — 20 %, Пиренеи — 15 %).
Дальнейшее увеличение выработки гидроэлектроэнергии зависит от ассигнований на строительство новых электростанций. Не исключено, что увеличения производства гидроэлектроэнергии можно будет добиться также путем использования некоторых других источников (например, энергии морских приливов в бухте Мон-Сен-Мишель), что даст возможность с небольшими затратами увеличить производство гидроэлектроэнергии в ближайшие 20 лет на 40 млрд. квт-ч. Но, как только будет достигнут уровень в 60 млрд. квт-ч в год, стоимость электроэнергии, вырабатываемой гидроэлектростанциями, может стать выше получаемой на тепловых электростанциях. Впрочем, специалисты считают, что если начать постройку гидростанций во всех удобных для этого местах, то через 20 лет все возможности в этой области будут исчерпаны.
квт-ч. Но, как только будет достигнут уровень в 60 млрд. квт-ч в год, стоимость электроэнергии, вырабатываемой гидроэлектростанциями, может стать выше получаемой на тепловых электростанциях. Впрочем, специалисты считают, что если начать постройку гидростанций во всех удобных для этого местах, то через 20 лет все возможности в этой области будут исчерпаны.
Выработка электроэнергии на тепловых электростанциях достигла: В 1955 году 23,95 млрд. квт-ч, или на 12,41 % больше, чем в 1954 году.
Если общее количество производимой во Франции энергии выразить в миллионах тонн условного топлива, то мы получим следующие данные: 1954 год — 71 (уголь — 56, гидроэлектроэнергия — 14,5, газ — 0,51, 1955 год — 73,5 (57,5+15,5+0,5).
Если сравнить цифры, характеризующие наши энергетические потребности, с данными о фактическом производстве энергии, то мы увидим, что в 1954 году мы имели дефицит в 34 млн. т условного топлива, а в 1955 году — уже 38,5 млн. т. Надо полагать, что и впредь этот дефицит будет постоянно расти и в 1965 году составит 50–60 млн. т условного топлива.
т условного топлива.
Вытеснение горючих ископаемых должно идти очень быстрыми темпами. Однако количество электроэнергии, которое произведут атомные электростанции в 1965 году, будет составлять, как полагают, всего 2 млрд. квт-ч. Полная замена горючих ископаемых, используемых для производства электроэнергии, ядерным горючим произойдет только лет через двадцать, а пока, чтобы покрыть постоянно растущие потребности в энергии, нужно развивать наши обычные способы ее производства. Поэтому Управление национализированными предприятиями по производству электроэнергии считает необходимым построить во Франции в ближайшие десять лет 13 тепловых электростанций. Стоит даже вопрос о том, чтобы построить эти электростанции в радиусе 40 км от Парижа, что совершенно непонятно, так как эти электростанции должны будут работать на каменном угле или на мазуте и, следовательно, будут выбрасывать в атмосферу окись углерода и сернистый газ, который, соединяясь с влагой воздуха, образует серную кислоту, не менее вредную для каменных зданий, чем для легких человека.
Принимая во внимание быстрый рост потребностей в энергии, будущее внушает серьезные опасения. Поэтому Франция, как, впрочем, и другие страны, особенно заинтересована в атомной энергии, которая, как нам кажется, сможет обеспечить замену существующих в настоящее время и быстро истощающихся «классических» энергетических ресурсов.
Великие химики. Биографии. — Ивановский государственный химико-технологический университет
АВОГАДРО Амедео
(Avogadro A.)
(9.VIII 1776 — 9.VII 1856)
Итальянский физик и химик, член Туринской академии наук (с 1819 г.). Родился в Турине. Окончил юридический факультет Туринского университета (1792 г.). С 1800 самостоятельно изучал математику и физику. В 1809 — 1819 гг. преподавал физику в лицее г. Верчелли. В 1820 — 1822 и 1834 — 1850 гг. — профессор физики Туринского университета.
Научные работы относятся к различным областям физики и химии.
В 1811 г. заложил основы молекулярной теории, обобщил накопленный к тому времени экспериментальный материал о составе веществ и привел в единую систему противоречащие друг другу опытные данные Ж. Гей-Люссака и основные положения атомистики Дж. Дальтона.
Открыл (1811 г.) закон, согласно которому в одинаковых объемах газов при одинаковых температурах и давлениях содержится одинаковое количество молекул (закон Авогадро).
Именем Авогадро названа универсальная постоянная — число молекул в 1 моль идеального газа.
Создал (1811 г.) метод определения молекулярных масс, посредством которого по экспериментальным данным других исследователей первым правильно вычислил (1811-1820 г.) атомные массы кислорода, углерода, азота, хлора и ряда других элементов.
Установил количественный атомный состав молекул многих веществ (в частности, воды, водорода, кислорода, азота, аммиака, оксидов азота, хлора, фосфора, мышьяка, сурьмы), для которых он ранее был определен неправильно.
Указал (1814 г.) состав многих соединений щелочных и щелочноземельных металлов, метана, этилового спирта, этилена.
Первым обратил внимание на аналогию в свойствах азота, фосфора, мышьяка и сурьмы — химических элементов, составивших впоследствии VA-группу Периодической системы.
Результаты работ Авогадро по молекулярной теории были признаны лишь в 1860 г. на I Международном конгрессе химиков в Карлсруэ.
В 1820-1840 гг. занимался электрохимией, изучал тепловое расширение тел, теплоемкости и атомные объемы; при этом получил выводы, которые координируются с результатами позднее проведенных исследований Д. И. Менделеева по удельным объемам тел и современными представлениями о строении вещества.
Издал труд «Физика весовых тел, или же трактат об общей конструкции тел» (т. 1-4, 1837 — 1841 гг.), в котором, в частности, намечены пути к представлениям о нестехиометричности твердых тел и о зависимости свойств кристаллов от их геометрии.
По материалам биографического справочника «Выдающиеся химики мира» (авторы Волков В. А и др.) — Москва, «Высшая школа», 1991 г.
А и др.) — Москва, «Высшая школа», 1991 г.
Сванте Аррениус
Сванте-Август Аррениус родился 19 февраля 1859 года в старинном шведском городе Упсале. В гимназии он был одним из лучших учеников, особенно легко ему давалось изучение физики и математики.
В 1876 году юноша был принят в Упсальский университет. И уже через два года (на шесть месяцев раньше срока) он сдал экзамен на степень кандидата философии.
Однако впоследствии он жаловался, что обучение в университете велось по устаревшим схемам: например, «нельзя было услышать ни единого слова о менделеевской системе, а ведь ей было уже больше десяти лет»…
В 1881 году Аррениус переехал в Стокгольм и поступил на работу в Физический институт Академии наук. Там он приступил к изучению электрической проводимости сильно разбавленных водных растворов электролитов.
Хотя Сванте Аррениус по образованию — физик, он знаменит своими химическими исследованиями и стал одним из основателей новой науки — физической химии. Больше всего он занимался изучением поведения электролитов в растворах, а также исследованием скорости химических реакций. Работы Аррениуса долгое время не признавали его соотечественники, и только когда его выводы получили высокую оценку в Германии и Франции, он был избран в Шведскую академию наук. За разработку теории электролитической диссоциации Аррениусу была присуждена Нобелевская премия 1903 года.
Больше всего он занимался изучением поведения электролитов в растворах, а также исследованием скорости химических реакций. Работы Аррениуса долгое время не признавали его соотечественники, и только когда его выводы получили высокую оценку в Германии и Франции, он был избран в Шведскую академию наук. За разработку теории электролитической диссоциации Аррениусу была присуждена Нобелевская премия 1903 года.
Веселый и добродушный великан Сванте Аррениус, настоящий «сын шведской сельской местности», всегда был душой общества, располагал к себе коллег и просто знакомых. Он был дважды женат; его двух сыновей звали Олаф и Свен. Он получил широкую известность не только как физикохимик, но и автор множества учебников, научно-популярных и просто популярных статей и книг по геофизике, астрономии, биологии и медицине.
Но путь к мировому признанию для Аррениуса-химика был совсем не прост. У теории электролитической диссоциации в ученом мире были очень серьезные противники. Так, Д. И. Менделеев резко критиковал не только саму идею Аррениуса о диссоциации, но и чисто «физический» подход к пониманию природы растворов, не учитывающий химических взаимодействий между растворенным веществом и растворителем.
Так, Д. И. Менделеев резко критиковал не только саму идею Аррениуса о диссоциации, но и чисто «физический» подход к пониманию природы растворов, не учитывающий химических взаимодействий между растворенным веществом и растворителем.
Впоследствии выяснилось, что и Аррениус, и Менделеев были каждый по-своему правы, и их взгляды, дополняя друг друга, составили основу новой — протонной — теории кислот и оснований.
Клод-Луи БЕРТОЛЛЕ
Французский химик Клод-Луи Бертолле (1748-1822) был коллегой и соратником Лавуазье, доктором медицины и лейб-медиком при дворе герцога Орлеанского, членом Парижской академии наук, правительственным инспектором государственных красильных фабрик, смотрителем монетного двора и, наконец, научным консультантом Наполеона.
Бертолле, родина которого — Таллуар в Савойе, изучал медицину в Турине, где получил диплом в 1770 году. Вскоре после этого он переселился в Париж, где начал свою научную карьеру как врач. Одновременно он изучал химию под руководством известных французских ученых Макера и Буке.
Одновременно он изучал химию под руководством известных французских ученых Макера и Буке.
После 1786 года сблизился с Лавуазье; вместе с ним и еще двумя видными учеными — Гитоном де Морво и Фуркруа — Бертолле разработал основы химической номенклатуры и классификации веществ.
Едва только заблистала звезда Наполеона, Бертолле последовал за ним в Египетский поход. Император осыпал его почестями, назначил сенатором и присвоил ему графский титул, но это не помешало Бертолле, как члену Сената, голосовать в 1814 году за отставку Наполеона. После реставрации монархии Бертолле сумел не только сохранить все свои привилегии, но и получить титул пэра Франции.
В период Революции и Империи Бертолле занимался вопросами, связанными с национальной обороной, а также прикладной химией (например, крашением ткани). Он впервые применил хлор для отбеливания бумаги и тканей, открыл гипохлориты щелочных металлов и хлорат кали («бертоллетову соль«) (1788). Кроме того, он установил состав аммиака, сероводорода и циановодородной кислоты.
Кроме того, он установил состав аммиака, сероводорода и циановодородной кислоты.
В своем «Опыте химической статики» (1803) он связал представление о массе с химическими реакциями и утверждал, что элементы могут соединяться друг с другом в любых пропорциях в зависимости от массы реагирующих веществ. Против этого вывода выступил Пруст. Понятие о массе и ее влиянии на ход химических реакций, однако имело большое значение для создания химической статики в XIX в.
Бертолле был основателем Аркейского общества, труды которого выходили в свет с 1807 по 1817 г. Он умер в 1822 г. в Аркейе, где располагалась созданная им лаборатория.
Клод-Луи Бертолле, который в глазах многих современников и потомков имел репутацию беспринципного и тщеславного придворного и даже не выступил в защиту своего друга и коллеги Лавуазье, когда тот был осужден и приговорен к смертной казни, был тем не менее талантливым ученым и вошел в историю как автор многих химических открытий.
Роберт БОЙЛЬ
(25.I. 1627 — 30.XII. 1691)
Он родился 25 января 1627 года в Лисморе (Ирландия), а образование получил в Итонском колледже (1635-1638) и в Женевской академии (1639-1644). После этого почти безвыездно жил в своем имении в Столбридже, там и проводил свои химические исследования в течение 12 лет. В 1656 году Бойль перебирается в Оксфорд, а в 1668 году переезжает в Лондон.
Научная деятельность Роберта Бойля была основана на экспериментальном методе и в физике, и в химии, и развивала атомистическую теорию. В 1660 году он открыл закон изменения объема газов (в частности, воздуха) с изменением давления. Позднее он получил имя закона Бойля-Мариотта: независимо от Бойля этот закон сформулировал французский физик Эдм Мариотт.
Бойль много занимался изучением химических процессов — например, протекающих при обжиге металлов, сухой перегонке древесины, превращениях солей, кислот и щелочей. В 1654 году он ввел в науку понятие анализа состава тел. p> Одна из книг Бойля носила название «Химик-скептик». В ней были определены элементы — как «первоначальные и простые, вполне не смешанные тела, которые не составлены друг из друга, но представляют собой те составные части, из которых составлены все так называемые смешанные тела и на которые последние могут быть в конце концов разложены«.
p> Одна из книг Бойля носила название «Химик-скептик». В ней были определены элементы — как «первоначальные и простые, вполне не смешанные тела, которые не составлены друг из друга, но представляют собой те составные части, из которых составлены все так называемые смешанные тела и на которые последние могут быть в конце концов разложены«.
А в 1661 году Бойль формулирует понятие о «первичных корпускулах» как элементах и «вторичных корпускулах» как сложных телах.
Он также впервые дал объяснение различиям в агрегатном состоянии тел. В 1660 году Бойль получил ацетон, перегоняя ацетат калия, в 1663 году обнаружил и применил в исследованиях кислотно-основный индикатор лакмус в лакмусовом лишайнике, произрастающем в горах Шотландии. В 1680 году он разработал новый способ получения фосфора из костей, получил ортофосфорную кислоту и фосфин. ..
..
В Оксфорде Бойль принял деятельное участие в основании научного общества, которое в 1662 году было преобразовано в Лондонское Королевское общество (фактически это английская Академия наук).
Роберт Бойль умер 30 декабря 1691 года, оставив будущим поколениям богатое научное наследие. Бойлем было написано множество книг, некоторые из них вышли в свет уже после смерти ученого: часть рукописей была найдена в архивах Королевского общества…
БОР Нильс-Хенрик-Давид
(7.Х 1885 — 18.XI 1962)
Датский физик, член Датского королевского общества наук (с 1917 г.), его президент в 1939 г. Родился в Копенгагене. Окончил Копенгагенский университет (1908 г.). В 1911-1912 гг. работал под руководством английского физика Дж. Дж. Томсона в Кавендишской лаборатории Кембриджского университета, в 1912 — 1913 гг. — в лаборатории Э. Резерфорда в Манчестерском университете. С 1916 г. — профессор Копенгагенского университета и одновременно с 1920 г. — директор созданного им Института теоретической физики.
Научные работы Бора, относящиеся к теоретической физике, вместе с тем заложили основы новых направлений в развитии химии.
Создал (1913 г.) первую квантовую теорию атома водорода, в которой:
· показал, что электрон может вращаться вокруг ядра не по любым, а лишь по определенным квантовым орбитам
· дал математическое описание устойчивости орбит, или стационарного состояния атома
· показал, что всякое излучение либо поглощение энергии атомом связано с переходом между двумя стационарными состояниями и происходит дискретно с выделением или поглощением планковских квантов
· ввел понятие главного квантового числа для характеристики электрона.
Рассчитал спектр атома водорода, показав полное совпадение расчетных данных с эмпирическими. Построил (1913-1921 гг.) модели атомов других элементов Периодической системы, охарактеризовав движение электронов в них посредством главного n и побочного l квантовых чисел.
Заложил (1921 г.) основы первой физической теории Периодической системы элементов, в которой связал периодичность свойств элементов с формированием электронных конфигураций атомов по мере увеличения заряда ядра. Обосновал подразделение групп периодической системы на главные и побочные. Впервые объяснил подобие свойств редкоземельных элементов.
Сформулировал (1918 г.) важный для атомной теории принцип соответствия. Многое сделал для становления и интерпретации квантовой механики, в частности предложил (1927 г.) имеющий большое значение для ее понимания принцип дополнительности. Внес значительный вклад в ядерную физику. Развил (1936 г.) теорию составного ядра, является одним из создателей капельной модели ядер (1936 г.) и теории деления ядер (1939 г.), предсказал явление спонтанного деления ядер урана.
Создал большую школу физиков-теоретиков.
Член многих академий наук и научных обществ. Иностранный член АН СССР (с 1929 г.). Нобелевская премия по физике (1922 г. ).
).
По материалам биографического справочника «Выдающиеся химики мира» (авторы Волков В.А и др.) — Москва, «Высшая школа», 1991 г.
Алексадр Михайлович Бутлеров
Александр Михайлович Бутлеров родился в сентябре 1828 года в городе Чистополе бывшей Казанской губернии. В 1844 году он поступил в Казанский университет. К занятиям химией Бутлерова привлек Николай Николаевич Зинин, который читал курс органической химии и под руководством которого проводились практические занятия в лаборатории. Вскоре Зинин переехал в Петербург, а начинающий ученый остался без руководителя.
Русский химик-органик Владимир Васильевич Марковников писал, что «в течение целых десяти лет Бутлеров на первых порах был предоставлен самому себе в самом восточном университете, вдали от оживляющих сношений с другими учеными». Видимо, полная свобода и отсутствие подавляющего влияния авторитетов создали благоприятные условия для формирования будущего талантливого химика. Результаты не заставили себя долго ждать.
Результаты не заставили себя долго ждать.
В 1851 году Бутлеров защитил в Казанском университете магистерскую диссертацию «Об окислении органических соединений», а в 1854 году уже в Московском университете — докторскую диссертацию «Об эфирных маслах». Спустя четыре года молодой Бутлеров выступил на заседании Парижского химического общества с докладом «О конституции тел вообще», который был встречен с большим интересом и привлек внимание научной общественности.
В шестидесятых годах XIX столетия Бутлеров работал в химической лаборатории Казанского университета. Эти года были ознаменованы блестящими синтетическими работами ученого. Он получил уротропин C6h22N4 из полимера формальдегида HC(O)H и аммиака Nh4, впервые выделил «метиленитан» — сахаристое вещество состава C6h22O6. По словам немецкого химика Эмиля Фишера «Среди всех искусственных сахарообразных продуктов, о которых литература сообщала до 1887 года, только один выдержал проверку временем. Это сахарный сироп, полученный А. М. Бутлеровым».
М. Бутлеровым».
Колоссальное значение имеет бутлеровская теория химического строения . 19 сентября 1861 года Александр Михайлович выступил на 36-м съезде немецких врачей и естествоиспытателей в городе Шпейер с докладом «О химическом строении вещества». Бутлеров сказал, что «химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением. Каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определенным количеством принадлежащей ему химической силы (сродства)».
В 1862/63 учебном году студенты Казанского университета впервые услышали на лекции Александра Михайловича, что «в смысле химического строения может для каждого тела существовать только одна рациональная формула, выражающая это строение. От химического строения зависят реакции, следовательно, зная эту зависимость и, выражая формулой строение, мы выражаем все те превращения, которым вещество может подвергнуться». Впоследствии материал этих лекций лег в основу книги «Введение к полному изучению органической химии». На основании своей теории химического строения Бутлерову удалось объяснить теоретически и подтвердить экспериментальным путем явление изомерии, а для углеводородов и спиртов — предсказать новые виды изомерии.
Впоследствии материал этих лекций лег в основу книги «Введение к полному изучению органической химии». На основании своей теории химического строения Бутлерову удалось объяснить теоретически и подтвердить экспериментальным путем явление изомерии, а для углеводородов и спиртов — предсказать новые виды изомерии.
В 1868 году, по представлению Менделеева, Бутлеров был избран на кафедру органической химии в Петербургском университете, где он работал до 1885 года. Менделеев впоследствии писал: «Александр Михайлович Бутлеров — один из замечательнейших русских ученых. Он русский и по ученому образованию, и по оригинальности своих трудов. Ученик знаменитого академика Зинина, он сделался химиком не в чужих краях, а в Казани…». Спустя шесть лет Бутлеров был избран академиком Петербургской академии наук.
Умер Александр Михайлович в 1886 году, не дожив нескольких дней до своего пятидесятивосьмилетия.
Якоб-Хендрик Вант-Гофф
Якоб-Хендрик Вант-Гофф годился в Роттердаме в Голландии в 1852 году. У Якоба было четыре брата и две сестры. Двое из братьев погибли в младенческом возрасте, а одна из сестер умерла от туберкулеза в возрасте восьми лет.
У Якоба было четыре брата и две сестры. Двое из братьев погибли в младенческом возрасте, а одна из сестер умерла от туберкулеза в возрасте восьми лет.
В 1874 году Вант-Гофф защитил диссертацию, посвященную исследованию некоторых органических кислот, и стал доктором математики и натурфилософии. Однако в университетах Голландии ему не нашлось места для работы. Даже в должности учителя химии было отказано. В течение двух лет он давал частные уроки по химии и физике. Только в 1876 году Вант-Гофф получил должность доцента в ветеринарной школе Утрехта. Здесь, после опубликования работы о структурах молекул, к нему и пришла известность.
В 1878 году Вант-Гоффа стал профессором химии в незадолго до этого основанном Амстердамском университете. В том же году он женился на купеческой дочери Женни Месс, которую он давно любил. С ней он прожил до конца своих дней.
В 1896 году Вант-Гоффа избрали действительным членом Берлинской академии наук, и он с семьей переехал в Берлин.
В списке лауреатов Нобелевской премии по химии имя Якоба-Хендрика Вант-Гоффа стоит первым.
Последние годы жизни Вант-Гоффа были омрачены смертями его родных и близких: в 1902 году умер его отец, через шесть лет застрелился муж дочери Евгении. Вскоре после этого умер младший брат, другая дочь уехала в США. В начале 1907 года Вант-Гофф заболел туберкулезом, и в 1911 году умер в возрасте 59 лет. Его старший брат, врач, писал впоследствии: «Переход от жизни к смести был тихий, совершенно соответствующий тому единственному желанию, которое он высказывал в моменты сознания».
Владимир Иванович Вернадский
(12.III. 1863 — 6.I. 1945)
Владимир Иванович Вернадский (1863-1945) во время учебы в Петербургском университете слушал лекции Д.И. Менделеева, А.М. Бутлерова и других известных российских химиков.
Со временем он сам стал строгим и внимательным учителем. Его учениками или учениками его учеников являются почти все минералоги и геохимики нашей страны.
Выдающийся естествоиспытатель не разделял точку зрения, что минералы есть нечто неизменное, часть установившейся «системы природы». Он считал, что в природе идет постепенное взаимное превращение минералов. Вернадский создал новую науку — геохимию.
Владимир Иванович первым отметил огромную роль живого вещества — всех растительных и животных организмов и микроорганизмов на Земле — в истории перемещения, концентрации и рассеяния химических элементов. Ученый обратил внимание, что некоторые организмы способны накапливать железо, кремний, кальций и другие химические элементы и могут участвовать в образовании месторождений их минералов, что микроорганизмы играют огромную роль в разрушении горных пород.
Вернадский утверждал, что «разгадка жизни не может быть получена только путем изучения живого организма. Для ее разрешения надо обратиться и к его первоисточнику — к земной коре«.
Изучая роль живых организмов в жизни нашей планеты, Вернадский пришел к выводу, что весь атмосферный кислород — это продукт жизнедеятельности зеленых растений.
Владимир Иванович уделял исключительное внимание проблемам экологии. Он рассматривал глобальные экологические вопросы, влияющие на биосферу в целом.
Более того, он создал само учение о биосфере — области активной жизни, охватывающей нижнюю часть атмосферы, гидросферу и верхнюю часть литосферы, в которой деятельность живых организмов (в том числе и человека) является фактором планетарного масштаба.
Он считал, что биосфера под влиянием научных и производственных достижений постепенно переходит в новое состояние — сферу разума, или ноосферу.
Решающим фактором развития этого состояния биосферы должна стать разумная деятельность человека, гармоничное взаимодействие природы и общества. Это возможно лишь при учете тесной взаимосвязи законов природы с законами мышления и социально-экономическими законами.
Жозеф-Луи Гей-Люссак
Французский химик и физик Жозеф-Луи Гей-Люссак родился в Сен-Леонаре в 1778 году. В 1800 году окончил Политехническую школу в Париже, где учился у Клода Бертолле. Работал там же, в 1800-1802 гг. был ассистентом Бертолле.
В 1800 году окончил Политехническую школу в Париже, где учился у Клода Бертолле. Работал там же, в 1800-1802 гг. был ассистентом Бертолле.
В 1805-1806 гг. совершил путешествие по Европе вместе со знаменитым немецким естествоиспытателем Александром Гумбольдтом. С 1809 года Гей-Люссак — профессор химии в Политехнической школе и профессор физики в Сорбонне. С 1832 года он стал профессором химии в Ботаническом саду Парижа.
Работы Гей-Люссака относятся к различным областям химии (свойства галогенов и их соединений, синильной кислоты и дициана, бора и борной кислоты, щелочных металлов и т.д.) и физики (газовые законы).
Ученый впервые построил кривые зависимости растворимости солей в воде от температуры (политермы растворимости), усовершенствовал методы объемного анализа, изобрел башню для получения серной кислоты нитрозным методом, способ получения щавелевой кислоты из древесных опилок и способ производства стеариновых свечей (совместно с Шеврелем)…
Джозайя-Уиллард Гиббс
(Gibbs J.
 W.)
W.)(11.II.1839 — 28.IV.1903)
Один из основателей химической термодинамики Джозайя-Уиллард Гиббс родился в 1839 году в небольшом американском городке Нью-Хейвене. Девятнадцати лет от роду он окончил Йельский университет, а уже через пять лет стал доктором философии и начал преподавать студентам математику.
Позднее он совершенствовал свое образование во Франции, в Сорбонне и Коллеж де Франс, а также в Германии, в знаменитых Берлинском и Гейдельбергском университетах.
Наконец, Гиббс получил должность профессора в родном Йельском университете и начал самостоятельное исследование тепловых процессов в химии. И здесь ему удалось достичь выдающихся результатов. Имя американца Гиббса было присвоено многим величинам и понятиям новой отрасли химии — химической термодинамики (энергия Гиббса, треугольник Гиббса, правило фаз Гиббса).
В сорок лет Гиббс был избран в Национальную академию наук США, хотя перед этим опубликовал в печати всего три научных статьи. Неудивительно: Гиббс писал редко, но «метко». Например, за целых 13 лет (с 1890 по 1903 гг.) он написал всего восемь небольших статей и одну книгу.
Например, за целых 13 лет (с 1890 по 1903 гг.) он написал всего восемь небольших статей и одну книгу.
В 1880 году Джозайя Гиббс стал членом Американской академии искусств и наук — авторитетнейшего научного общества, созданного в Бостоне еще в 1780 году.
Семья Гиббса состояла из двух его сестер и шурина. Они прожили вместе всю жизнь в одном и том же доме в Нью-Хейвене. От дома было полквартала до школы, где учился Гиббс в юности, один квартал до колледжа, где он провел студенческие годы, два квартала до университета, где он преподавал, и столько же до кладбища, где он был похоронен. Тихий провинциальный городок — американская «глубинка» — давал Гиббсу все, что нужно для работы: спокойную размеренную жизнь среди родных, необходимые книги в библиотеке, свободное время для размышлений, живописные окрестности для прогулок. На досуге Гиббс иногда угощал домочадцев собственноручно приготовленными изысканными салатами, которые назывались вполне научно — «гетерогенные равновесия»…
Гиббса отличали скромность, приветливость в общении с людьми. Никогда он не проявлял ни малейшего высокомерия или честолюбия. Даже в пожилом возрасте он не потерял стройной фигуры, всегда был тщательно одет и причесан. Он никогда не спешил и тем не менее никогда никуда не опаздывал.
Никогда он не проявлял ни малейшего высокомерия или честолюбия. Даже в пожилом возрасте он не потерял стройной фигуры, всегда был тщательно одет и причесан. Он никогда не спешил и тем не менее никогда никуда не опаздывал.
В 1901 году Лондонское королевское общество присудило Гиббсу медаль Коплея — самую почетную международную награду, учрежденную раньше Ноболевских премий. И это была последняя награда Гиббса: через два года, в 1903 году, он скончался. Понадобилось почти полвека, чтобы заслуги ученого получили признание не только в Европе, но и на родине. Только в 1950 году его бюст поместили в «Галерее славы великих американцев».
ЗЕЛИНСКИЙ Николай Дмитриевич
(6.II 1861 — 31.VII 1953)
Советский химик-органик, академик (с 1929 г.). Родился в г. Тирасполе. Окончил Новороссийский университет в Одессе (1884 г.). С 1885 г. совершенствовал образование в Германии: в Лейпцигском университете у Я. Вислиценуса и в Гёттингенском университете у В. Мейера. В 1888-1892 гг. работал в Новороссийском университете, с 1893 г. — профессор Московского университета, который оставил в 1911 г. в знак протеста против реакционной политики царского правительства. В 1911-1917 гг. — директор Центральной химической лаборатории министерства финансов, с 1917 г. — вновь в Московском университете, одновременно с 1935 г. — в Институте органической химии АН СССР, одним из организаторов которого он был.
Мейера. В 1888-1892 гг. работал в Новороссийском университете, с 1893 г. — профессор Московского университета, который оставил в 1911 г. в знак протеста против реакционной политики царского правительства. В 1911-1917 гг. — директор Центральной химической лаборатории министерства финансов, с 1917 г. — вновь в Московском университете, одновременно с 1935 г. — в Институте органической химии АН СССР, одним из организаторов которого он был.
Научные исследования относятся к нескольким областям органической химии — химии алициклических соединений, химии гетероциклов, органическому катализу, химии белка и аминокислот.
Вначале занимался исследованием изомерии производных тиофена и получил (1887 г.) ряд его гомологов. Исследуя стереоизомерию предельных алифатических дикарбоновых кислот, нашел (1891 г.) способы получения из них циклических пяти- и шестичленных кетонов, из которых в свою очередь получил (1895-1900 гг.) большое количество гомологов циклопентана и циклогексана. Синтезировал (1901-1907 гг.) многочисленные углеводороды, содержащие от 3 до 9 атомов углерода в кольце, что послужило основой искусственного моделирования нефти и нефтяных фракций. Положил начало ряду направлений, связанных с изучением взаимных превращений углеводородов.
Синтезировал (1901-1907 гг.) многочисленные углеводороды, содержащие от 3 до 9 атомов углерода в кольце, что послужило основой искусственного моделирования нефти и нефтяных фракций. Положил начало ряду направлений, связанных с изучением взаимных превращений углеводородов.
Открыл (1910 г.) явление дегидрогенизационного катализа, заключающееся в исключительно избирательном действии платины и палладия на циклогексановые и ароматические углеводороды и в идеальной обратимости реакций гидро- и дегидрогенизации только в зависимости от температуры.
Совместно с инженером А. Кумантом создал (1916 г.) противогаз. Дальнейшие работы по дегидрогенизационно-гидрогенизационному катализу привели его к открытию (1911 г.) необратимого катализа. Занимаясь вопросами химии нефти, выполнил многочисленные работы по бензинизации нефтяных остатков посредством крекинга (1920-1922 гг.), по «кетонизации нафтенов». Получил (1924 г.) алициклические кетоны каталитическим ацилированием нефтяных цикланов. Осуществил (1931-1937 гг.) процессы каталитической и пирогенетической ароматизации нефтей.
Осуществил (1931-1937 гг.) процессы каталитической и пирогенетической ароматизации нефтей.
Совместно с Н. С. Козловым впервые в СССР начал (1932 г.) работы по получению хлоропренового каучука. Синтезировал труднодоступные нафтеновые алкоголи и кислоты. Разработал (1936 г.) методы обессеривания высокосернистых масел. Является одним из основоположников учения об органическом катализе. Выдвинул идеи о деформации молекул реагентов в процессе адсорбции на твердых катализаторах.
Совместно со своими учениками открыл реакции селективного каталитического гидрогенолиза циклопентановых углеводородов (1934 г.), деструктивного гидрирования, многочисленные реакции изомеризации (1925-1939 гг.), в том числе взаимные превращения циклов в направлении, как их сужения, так и расширения.
Экспериментально доказал образование метиленовых радикалов в качестве промежуточных соединений в процессах органического катализа.
Внес существенный вклад в решение проблемы происхождения нефти. Был сторонником теории органического происхождения нефти.
Был сторонником теории органического происхождения нефти.
Проводил также исследования в области химии аминокислот и белка. Открыл (1906 г.) реакцию получения aльфа-аминокислот из альдегидов или кетонов действием смеси цианистого калия с хлористым аммонием и последующим гидролизом образующихся aльфа-аминонитрилов. Синтезировал ряд аминокислот и оксиаминокислот.
Разработал методы получения эфиров аминокислот из их смесей, образующихся при гидролизе белковых тел, а также способы разделения продуктов реакции. Создал крупную школу химиков-органиков, в которую вошли Л. Н. Несмеянов, Б. А. Казанский, А. А. Баландин, Н. И. Шуйкин, А. Ф. Платэ и др.
Один из организаторов Всесоюзного химического общества им. Д. И. Менделеева и его почетный член (с 1941 г.).
Герой Социалистического Труда (1945 г.).
Премия им. В. И. Ленина (1934 г.), Государственные премии СССР (1942, 1946, 1948 гг.).
Имя Зелинского присвоено (1953 г.) Институту органической химии АН СССР.
По материалам биографического справочника «Выдающиеся химики мира» (авторы Волков В.А и др.) — Москва, «Высшая школа», 1991 г.
Пьер Кюри и Мария Склодовская-Кюри
Когда французскому физику Пьеру Кюри (1859-1906) исполнилось 35 лет, он уже был широко известным ученым. Ему принадлежали интересные открытия в области физики кристаллического состояния вещества и пьезоэлектрического эффекта, магнитных свойств веществ при высоких температурах. Закономерное изменение свойств парамагнитных веществ от температуры носит его имя (закон Кюри).
Однако на рубеже XIX и XX вв. сфера его научных интересов изменилась: вместе со своей женой — выпускницей Парижского университета Марией Склодовской-Кюри (1867-1934) он занялся выяснением природы уранового излучения и изучением радиоактивности. Супруги Кюри посвятили лучшие годы жизни беззаветному труду во имя науки — при отсутствии необходимых средств, в плохо оборудованной лаборатории они открыли и выделили два новых химических элемента. Пьер Кюри установил, что соли радия самопроизвольно выделяют теплоту.
Пьер Кюри установил, что соли радия самопроизвольно выделяют теплоту.
19 апреля 1906 г. в результате нелепого несчастного случая трагически погиб Пьер Кюри (он был сбит экипажем при переходе одной из парижских улиц). Горе не сломило Марию: она продолжила дело жизни своего мужа — научные исследования в области радиоактивности, возглавила в Парижском университете кафедру, которой руководил ранее Пьер. А в 1914 г. она стала первым руководителем физико-химического отдела Парижского Института радия, созданного при ее деятельном участии. Во время первой мировой войны Мария Склодовская-Кюри впервые в широком масштабе организовала медицинское применение излучений (она обучила работе на рентгеновских установках более 1500 человек).
Мария Склодовская-Кюри умерла в 1934 г. от лучевой болезни. Ее лабораторные тетради до сих пор сохраняют высокий уровень радиоактивности.
В честь супругов Кюри был назван искусственно полученный химический элемент с порядковым номером 96 — кюрий Cm.
Антуан-Лоран Лавуазье
Французский химик Антуан-Лоран Лавуазье (1743-1794), по образованию юрист, был очень богатым человеком. Он состоял в «Компании откупов» — организации финансистов, бравшей на откуп государственные налоги. На этих финансовых операциях Лавуазье приобрел огромное состояние.
Политические события, происходившие во Франции, имели для Лавуазье печальные последствия: он был казнен за то, что работал в «Генеральном откупе» (акционерном обществе по сбору налогов). В мае 1794 года в числе других обвиняемых-откупщиков Лавуазье предстал перед революционным трибуналом и на следующий день был приговорен к смертной казни «как зачинщик или соучастник заговора, стремившийся содействовать успеху врагов Франции путем вымогательств и незаконных поборов с французского народа».
Вечером 8 мая приговор был приведен в исполнение, а Франция лишилась одной из самых блестящих голов… Через два года Лавуазье был признан несправедливо осужденным, однако это уже не могло вернуть Франции замечательного ученого.
…Еще обучаясь на юридическом факультете Парижского университета, будущий генеральный откупщик и выдающийся химик одновременно изучал естественные науки. Часть своего состояния Лавуазье вложил в обустройство химической лаборатории, оснащенной прекрасным по тем временам оборудованием, ставшую научным центром Парижа. В своей лаборатории Лавуазье провел многочисленные опыты, в которых он определял изменения масс веществ при их прокаливании и горении.
Лавуазье первым показал, что масса продуктов горения серы и фосфора больше, чем масса сгоревших веществ, и что объем воздуха, в котором горел фосфор, уменьшился на 1/5 часть. Нагревая ртуть с определенным объемом воздуха, Лавуазье получил «ртутную окалину» (оксид ртути) и «удушливый воздух» (азот), непригодный для горения и дыхания. Прокаливая ртутную окалину, он разложил ее на ртуть и «жизненный воздух» (кислород). Этими и многими другими опытами Лавуазье показал сложность состава атмосферного воздуха и впервые правильно истолковал явления горения и обжига как процесс соединения веществ с кислородом. Этого не смогли сделать английский химик и философ Джозеф Пристли и шведский химик Карл-Вильгельм Шееле, а также другие естествоиспытатели, которые сообщили об открытии кислорода раньше.
Этого не смогли сделать английский химик и философ Джозеф Пристли и шведский химик Карл-Вильгельм Шееле, а также другие естествоиспытатели, которые сообщили об открытии кислорода раньше.
Лавуазье доказал, что углекислый газ (диоксид углерода) — это соединение кислорода с «углем» (углеродом), а вода — соединение кислорода с водородом. Он на опыте показал, что при дыхании поглощается кислород и образуется углекислый газ, то есть процесс дыхания подобен процессу горения. Более того, французский химик установил, что образование углекислого газа при дыхании является главным источником «животной теплоты». Лавуазье одним из первых попытался объяснить сложные физиологические процессы, происходящие в живом организме, с точки зрения химии.
Лавуазье стал одним из основоположников классической химии. Он открыл закон сохранения веществ, ввел понятия «химический элемент» и «химическое соединение», доказал, что дыхание подобно процессу горения и является источником теплоты в организме…
Лавуазье был автором первой классификации химических веществ и учебника «Элементарный курс химии». В 29 лет он был избран действительным членом Парижской Академии наук.
В 29 лет он был избран действительным членом Парижской Академии наук.
Кто знает, какие еще открытия успел бы совершить этот выдающийся ученый, если бы его не постигла судьба жертв революционного террора?..
Анри-Луи ЛЕ-ШАТЕЛЬЕ
(Le Chatelier H. L.)
(8.X.1850 — 17.IX.1936)
Анри-Луи Ле-Шателье родился 8 октября 1850 года в Париже. После окончания Политехнической школы в 1869 году он поступил в Высшую Национальную горную школу.
Будущий открыватель знаменитого принципа был широко образованным и эрудированным человеком. Его интересовали и техника, и естественные науки, и общественная жизнь. Много времени он посвятил изучению религии и древних языков. В возрасте 27 лет Ле-Шателье стал уже профессором Высшей горной школы, а тридцать лет спустя — Парижского университета. Тогда же он был избран в действительные члены Парижской Академии наук.
Наиболее важный вклад французского ученого в науку был связан с изучением химического равновесия, исследованием смещения равновесия под действием температуры и давления. Студенты Сорбонны, слушавшие лекции Ле-Шателье в 1907-1908 годах, так записывали в своих конспектах: «Изменение любого фактора, могущего влиять на состояние химического равновесия системы веществ, вызывает в ней реакцию, стремящуюся противодействовать производимому изменению. Повышение температуры вызывает реакцию, стремящуюся понизить температуру, то есть идущую с поглощением тепла. Увеличение давления вызывает реакцию, стремящуюся вызвать уменьшение давления, то есть сопровождающуюся уменьшением объема…».
Студенты Сорбонны, слушавшие лекции Ле-Шателье в 1907-1908 годах, так записывали в своих конспектах: «Изменение любого фактора, могущего влиять на состояние химического равновесия системы веществ, вызывает в ней реакцию, стремящуюся противодействовать производимому изменению. Повышение температуры вызывает реакцию, стремящуюся понизить температуру, то есть идущую с поглощением тепла. Увеличение давления вызывает реакцию, стремящуюся вызвать уменьшение давления, то есть сопровождающуюся уменьшением объема…».
К сожалению, Ле-Шателье не был удостоен Нобелевской премии. Причина заключалась в том, что эта премия присуждалась только авторам работ, выполненных или получивших признание в год получения премии. Важнейшие работы Ле Шателье были выполнены задолго до 1901 года, когда состоялось первое присуждение Нобелевских премий.
ЛОМОНОСОВ Михаил Васильевич
(19.XI.1711 — 15.IV.1765)
Русский ученый, академик Петербургской АН (с 1745 г.). Родился в д. Денисовка (ныне с. Ломоносове Архангельской обл.). В 1731-1735 гг. учился в Славяно-греко-латинской академии в Москве. В 1735 г. был послан в Петербург в академический университет, а в 1736 г. — в Германию, где учился в Марбургском университете (1736-1739 гг.) и во Фрейберге в Школе горного дела (1739-1741 гг.). В 1741-1745 гг. — адъюнкт Физического класса Петербургской АН, с 1745 г. — профессор химии Петербургской АН, с 1748 г. работал в учрежденной по его инициативе Химической лаборатории АН. Одновременно с 1756 г. проводил исследования на основанном им в Усть-Рудицах (вблизи Петербурга) стекольном заводе и в домашней лаборатории.
Денисовка (ныне с. Ломоносове Архангельской обл.). В 1731-1735 гг. учился в Славяно-греко-латинской академии в Москве. В 1735 г. был послан в Петербург в академический университет, а в 1736 г. — в Германию, где учился в Марбургском университете (1736-1739 гг.) и во Фрейберге в Школе горного дела (1739-1741 гг.). В 1741-1745 гг. — адъюнкт Физического класса Петербургской АН, с 1745 г. — профессор химии Петербургской АН, с 1748 г. работал в учрежденной по его инициативе Химической лаборатории АН. Одновременно с 1756 г. проводил исследования на основанном им в Усть-Рудицах (вблизи Петербурга) стекольном заводе и в домашней лаборатории.
Творческая деятельность Ломоносова отличается как исключительной широтой интересов, так и глубиной проникновения в тайны природы. Его исследования относятся к математике, физике, химии, наукам о Земле, астрономии. Результаты этих исследований заложили основы современного естествознания. Ломоносов обратил внимание (1756 г.) на основополагающее значение закона сохранения массы вещества в химических реакциях; изложил (1741-1750 гг. ) основы своего корпускулярного (атомно-молекулярного) учения, получившего развитие лишь спустя столетие; выдвинул (1744-1748 гг.) кинетическую теорию теплоты; обосновал (1747-1752 гг.) необходимость привлечения физики для объяснения химических явлений и предложил для теоретической части химии название «физическая химия», а для практической части — «техническая химия». Его труды стали рубежом в развитии науки, отграничивающим натурфилософию от экспериментального естествознания.
) основы своего корпускулярного (атомно-молекулярного) учения, получившего развитие лишь спустя столетие; выдвинул (1744-1748 гг.) кинетическую теорию теплоты; обосновал (1747-1752 гг.) необходимость привлечения физики для объяснения химических явлений и предложил для теоретической части химии название «физическая химия», а для практической части — «техническая химия». Его труды стали рубежом в развитии науки, отграничивающим натурфилософию от экспериментального естествознания.
До 1748 г. Ломоносов занимался преимущественно физическими исследованиями, а в период 1748-1757 гг. его работы посвящены главным образом решению теоретических и экспериментальных вопросов химии. Развивая атомистические представления, он впервые высказал мнение о том, что тела состоят из «корпускул», а те в свою очередь из «элементов»; это соответствует современным представлениям о молекулах и атомах.
Был зачинателем применения математических и физических методов исследования в химии и первым начал читать в Петербургской АН самостоятельный «курс истинно физической химии». В руководимой им Химической лаборатории Петербургской АН выполнялась широкая программа экспериментальных исследований. Разработал точные методы взвешивания, применял объемные методы количественного анализа.
В руководимой им Химической лаборатории Петербургской АН выполнялась широкая программа экспериментальных исследований. Разработал точные методы взвешивания, применял объемные методы количественного анализа.
Проводя опыты по обжигу металлов в запаянных сосудах, показал (1756 г.), что их вес после нагревания не изменяется и что мнение Р. Бойля о присоединении тепловой материи к металлам ошибочно.
Изучал жидкое, газообразное и твердое состояния тел. Достаточно точно определил коэффициенты расширения газов. Изучал растворимость солей при разных температурах. Исследовал влияние электрического тока на растворы солей, установил факты понижения температуры при растворении солей и понижения точки замерзания раствора по сравнению с чистым растворителем. Проводил различие между процессом растворения металлов в кислоте, сопровождающимся химическими изменениями, и процессом растворения солей в воде, происходящим без химических изменений растворяемых веществ. Создал различные приборы (вискозиметр, прибор для фильтрования под вакуумом, прибор для определения твердости, газовый барометр, пирометр, котел для исследования веществ при низком и высоком давлениях), достаточно точно градуировал термометры.
Был создателем многих химических производств (неорганических пигментов, глазурей, стекла, фарфора). Разработал технологию и рецептуру цветных стекол, которые он употреблял для создания мозаичных картин. Изобрел фарфоровую массу. Занимался анализом руд, солей и других продуктов.
В труде «Первые основания металлургии, или рудных дел» (1763 г.) рассмотрел свойства различных металлов, дал их классификацию и описал способы получения. Наряду с другими работами по химии труд этот заложил основы русского химического языка. Рассмотрел вопросы образования в природе различных минералов и нерудных тел. Высказал идею биогенного происхождения гумуса почвы. Доказывал органическое происхождение нефтей, каменного угля, торфа и янтаря. Описал процессы получения железного купороса, меди из медного купороса, серы из серных руд, квасцов, серной, азотной и соляной кислот.
Первым из русских академиков приступил к подготовке учебников по химии и металлургии («Курс физической химии», 1754 г. ; «Первые основания металлургии, или рудных дел», 1763 г.). Ему принадлежит заслуга создания Московского университета (1755 г.), проект и учебная программа которого составлены им лично. По его проекту в 1748 г. завершена постройка Химической лаборатории Петербургской АН. С 1760 г. был попечителем гимназии и университета при Петербургской АН. Создал основы современного русского литературного языка. Был поэтом и художником. Написал ряд трудов по истории, экономике, филологии. Член ряда академий наук.
; «Первые основания металлургии, или рудных дел», 1763 г.). Ему принадлежит заслуга создания Московского университета (1755 г.), проект и учебная программа которого составлены им лично. По его проекту в 1748 г. завершена постройка Химической лаборатории Петербургской АН. С 1760 г. был попечителем гимназии и университета при Петербургской АН. Создал основы современного русского литературного языка. Был поэтом и художником. Написал ряд трудов по истории, экономике, филологии. Член ряда академий наук.
Именем Ломоносова названы Московский университет (1940 г.), Московская Академия тонкой химической технологии (1940 г.), город Ломоносов (бывший Ораниенбаум). АН СССР учредила (1956 г.) Золотую медаль им. М. В. Ломоносова за выдающиеся работы в области химии и других естественных наук.
По материалам биографического справочника «Выдающиеся химики мира» (авторы Волков В.А и др.) — Москва, «Высшая школа», 1991 г.
МАРКОВНИКОВ Владимир Васильевич
(25.XII.1837 — 11. II.1904)
II.1904)
Русский химик — органик. Родился в Княгинине (ныне Горьковской обл.). Окончил Казанский университет (1860 г.) и по представлению Л. М. Бутлерова оставлен при университете лаборантом. В 1865-1867 гг. с целью подготовки к профессорской деятельности находился в командировке в Берлине, Мюнхене, Лейпциге, где работал в лабораториях А. Байера, Р. Эрленмейера и А. Кольбе. В 1867-1871 гг. преподавал в Казанском университете (с 1869 — профессор), в 1871-1873 гг. — в Новороссийском университете в Одессе, в 1873-1904 гг. — в Московском университете.
Научные исследования посвящены теоретической органической химии, органическому синтезу и нефтехимии. Получил (1862-1867 гг.) новые данные об изомерии спиртов и жирных кислот, открыл оксиды ряда олефиновых углеводородов, впервые синтезировал галоген- и оксопроизводные изомеров масляной кислоты. Результаты этих исследований послужили основой его учения о взаимном влиянии атомов как главном содержании теории химического строения.
Сформулировал (1869 г.) правила о направлении реакций замещения, отщепления, присоединения по двойной связи и изомеризации в зависимости от химического строения (правила Марковникова).
Показал особенности двойных и тройных связей в непредельных соединениях, заключающиеся в большой прочности их по отношению к ординарным связям, но не в эквивалентности двум и трем простым связям.
Совместно с сотрудником Г. А. Крестовниковым впервые синтезировал (1879 г.) циклобутандикарбоновую кислоту. Исследовал (с 1880 г.) состав нефти, заложив основы нефтехимии как самостоятельной науки.
Открыл (1883 г.) новый класс органических веществ — нафтены. Показал, что наряду с гексагидробензольными углеводородами Вредена существуют углеводороды ряда циклопентана, циклогептана и других циклоалканов. Доказал существование циклов с числом углеродных атомов от 3 до 8; впервые получил (1889 г.) суберон; установил взаимные изомерные превращения циклов в сторону как увеличения, так и уменьшения числа атомов в кольце; открыл (1892 г. ) первую реакцию изомеризации циклических углеводородов с уменьшением цикла (циклогептана в метилциклогексан).
) первую реакцию изомеризации циклических углеводородов с уменьшением цикла (циклогептана в метилциклогексан).
Ввел много новых экспериментальных приемов анализа и синтеза органических веществ. Впервые изучил переход нафтенов к ароматические углеводородам.
Один из основателей Русского физико-химического общества (1868 г.).
По материалам биографического справочника «Выдающиеся химики мира» (авторы Волков В.А и др.) — Москва, «Высшая школа», 1991 г.
Дмитрий Иванович Менделеев
Дмитрий Иванович Менделеев (1834-1907) — великий русский ученый-энциклопедист, химик, физик, технолог, геолог и даже метеоролог. Менделеев обладал удивительно ясным химическим мышлением, он всегда ясно представлял конечные цели своей творческой работы: предвидение и пользу. Он писал: «Ближайший предмет химии составляет изучение однородных веществ, из сложения которых составлены все тела мира, превращений их друг в друга и явлений, сопровождающих такие превращения».
Менделеев создал современную гидратную теорию растворов, уравнение состояния идеального газа, разработал технологию получения бездымного пороха, открыл Периодический закон и предложил Периодическую систему химических элементов, написал лучший для своего времени учебник химии.
Д. И. Менделеев родился в Сибири, в Тобольске, и был семнадцатым ребенком в большой семье. Он был дважды женат, у него было трое сыновей и две дочери. Его дочь Люба была замужем за великим русским поэтом А. Блоком, а сестра Менделеева Ольга — за Н. В. Басаргиным, одним из декабристов.
Современники говорили, что этот великий ученый «создал свою жизнь как произведение искусства».
Альфред-Бернхард Нобель (Nobel)
(1833—1896)
Альфред-Бернхард Нобель — шведский инженер, изобретатель динамита. Нобель родился в 1833 г. в. России, где отец его был директором казенного порохового завода.
Отдавшись химическим занятиям, Нобель с 1862 г. задался целью применить в качестве взрывчатого вещества нитроглицерин, открытый в 1845 г. итальянским ученым Собреро. Нобелю удалось разрешить поставленную задачу в 1867 г. он изобрел динамит.
итальянским ученым Собреро. Нобелю удалось разрешить поставленную задачу в 1867 г. он изобрел динамит.
Пользуясь поддержкой французского правительства, Нобель основал большую фабрику динамита во Франции; вслед затем ему удалось основать значительные фабрики динамита также в Германии и Англии.
Нобель умер в 1896 г. в своей вилле в Сан-Ремо, оставив громадное состояние (35 миллионов крон). В своем завещании он выразил желание, чтобы часть этого состояния была отдана в распоряжение стокгольмского университета для учреждения ряда премий: за важнейшие исследования в области физики, химии и физиологии или медицины, за лучшее произведение изящной словесности идеалистического направления и за труды, ведущие к осуществлены идеи мира и к сближению народов.
НОБЕЛЕВСКИЕ ЛАУРЕАТЫ
В 1896 году Альфред Нобель завещал специальному фонду превратить его имущество в ценные бумаги, доход от которых должен ежегодно выдаваться в виде премий его имени ученым за крупные научные открытия и изобретения в области физики, химии, физиологии и медицины, а также лицам, достигшим наибольших успехов в литературе и борьбе за мир.
Проект устава Нобелевского комитета был принят шведским риксдагом, и завещание вступило в силу, несмотря на многие возражения. Противники назначения таких премий указывали, в частности, на возможность возникновения вокруг них всяческих махинаций. Действительно, время от времени происходят те или иные промашки как субъективного, так и объективного характера.
Первыми нобелевскими лауреатами в 1901 году стали Вильгельм Рентген — по физике, Якоб Вант-Гофф — по химии и Эмиль Беринг — по медицине. Имя Рентгена известно всем, Вант-Гоффа, возможно, вспомнят те, кто внимательно читал школьные учебники, а Беринга не знает никто, но изобретенной им противодифтерийной сывороткой пользуется весь мир.
Дальнейшее премирование шло не столь гладко. Один из принципов отбора кандидатов — частота цитирования, но не все ученые широко рекламировали свои открытия, не все имели возможность публиковать работы за рубежом. Сейчас нам трудно понять, почему кандидатуры таких русских ученых, как В. И. Вернадский, К. А. Тимирязев, К. Э. Циолковский и многие другие, не получили достаточной поддержки международной научной общественности.
И. Вернадский, К. А. Тимирязев, К. Э. Циолковский и многие другие, не получили достаточной поддержки международной научной общественности.
Д. И. Менделееву в 1906 году не присудили премию по химии из-за его преклонного возраста. Иван Петрович Павлов стал нобелевским лауреатом в 1904 году за работы в области физиологии пищеварения, которые в его жизни были просто эпизодом. Предложение двадцать лет спустя отметить премией его гениальные работы по условным рефлексам поддержки не получило.
Когда наконец Нобелевский комитет решился на этот шаг, Павлов умер, а посмертно премия не вручается. Были и «запоздалые» премии. Пример этого — присужденная в 2000 году премия крупнейшему российскому ученому Жоресу Алферову за работы, выполненные 20 лет назад. Петр Капица ждал премии 40 лет. Своеобразный рекорд — премия Френсису Пейтону Роусу, которого наградили через 55 лет после того, как он обнаружил вирус, вызывающий злокачественные опухоли.
Несмотря на трудности и ошибки, Нобелевская премия остается одной из наиболее авторитетных и почетных. Ее вручение всегда превращается в настоящий праздник.
Ее вручение всегда превращается в настоящий праздник.
В 1998 году премию, основанную на деньги от производства нитроглицерина-взрывчатки, дали за исследование нитроглицерина-лекарства. Давно известного, но открывшего тайну своего влияния на сосуды всего лишь несколько лет тому назад.
Эрнест Резерфорд
Биография
Эрнест Резерфорд родился 30 августа 1871 года в Брайтуотере, живописном местечке Новой Зеландии. Он был четвертым ребенком в семье выходцев из Шотландии Джеймса Резерфорда и Марты Томсон, и из двенадцати детей он оказался наиболее одаренным. Эрнест блестяще закончил начальную школу, получив 580 баллов из 600 возможных и премию в 50 фунтов стерлингов для продолжения образования.
В колледже в Нельсоне, где Эрнеста Резерфорда приняли в пятый класс, учителя обратили внимание на его исключительные математические способности. Но математиком Эрнест не стал. Не стал он и гуманитарием, хотя проявлял недюжинные способности к языкам и литературе. Судьбе угодно было распорядиться, чтобы Эрнест увлёкся естественными науками — физикой и химией.
Судьбе угодно было распорядиться, чтобы Эрнест увлёкся естественными науками — физикой и химией.
После окончания колледжа Резерфорд поступил в Кентерберийский университет, и уже на втором курсе он выступил с докладом «Эволюция элементов», в котором высказал предположение, что химические элементы представляют собой сложные системы, состоящие из одних и тех же элементарных частиц. Студенческий доклад Эрнеста не был должным образом оценён в университете, однако его экспериментальные работы, например, создание приёмника электромагнитных волн, удивили даже крупных учёных. Спустя всего несколько месяцев ему была присуждена «стипендия 1851 года», которой отмечались самые талантливые выпускники провинциальных английских университетов.
После этого Резерфорд в течение трёх лет работал в Кембридже, в Кавендишской лаборатории, под руководством известного физика Джозефа-Джона Томсона. В 1898 г. он начал изучать радиоактивность. Первое же фундаментальное открытие Резерфорда в этой области — обнаружение неоднородности излучения, испускаемого ураном — сделало его имя известным в научном мире; благодаря ему в науку вошло понятие об альфа- и бета-излучении.
В том же году 26-летнего Резерфорда пригласили в Монреаль в качестве профессора Мак-Гиллского университета — лучшего в Канаде. Этот университет получил название по имени своего основателя — переселенца из Шотландии, которому под конец жизни удалось разбогатеть. Перед отъездом Резерфорда в Канаду Дж. Томсон вручил ему рекомендательное письмо, где было написано: «В моей лаборатории ещё никогда не было молодого учёного с таким энтузиазмом и способностями к оригинальным исследованиям, как господин Резерфорд, и я уверен, что, если он будет избран, то создаст выдающуюся школу физиков в Монреале…». Предсказание Томсона сбылось. Резерфорд проработал в Канаде 10 лет и действительно создал там научную школу.
В 1903 г. 32-летний ученый был избран членом Лондонского Королевского общества — британской Академии наук.
В 1907 г. Резерфорд вместе с семьей переезжает из Канады в Англию, чтобы занять должность профессора кафедры физики Манчестерского университета.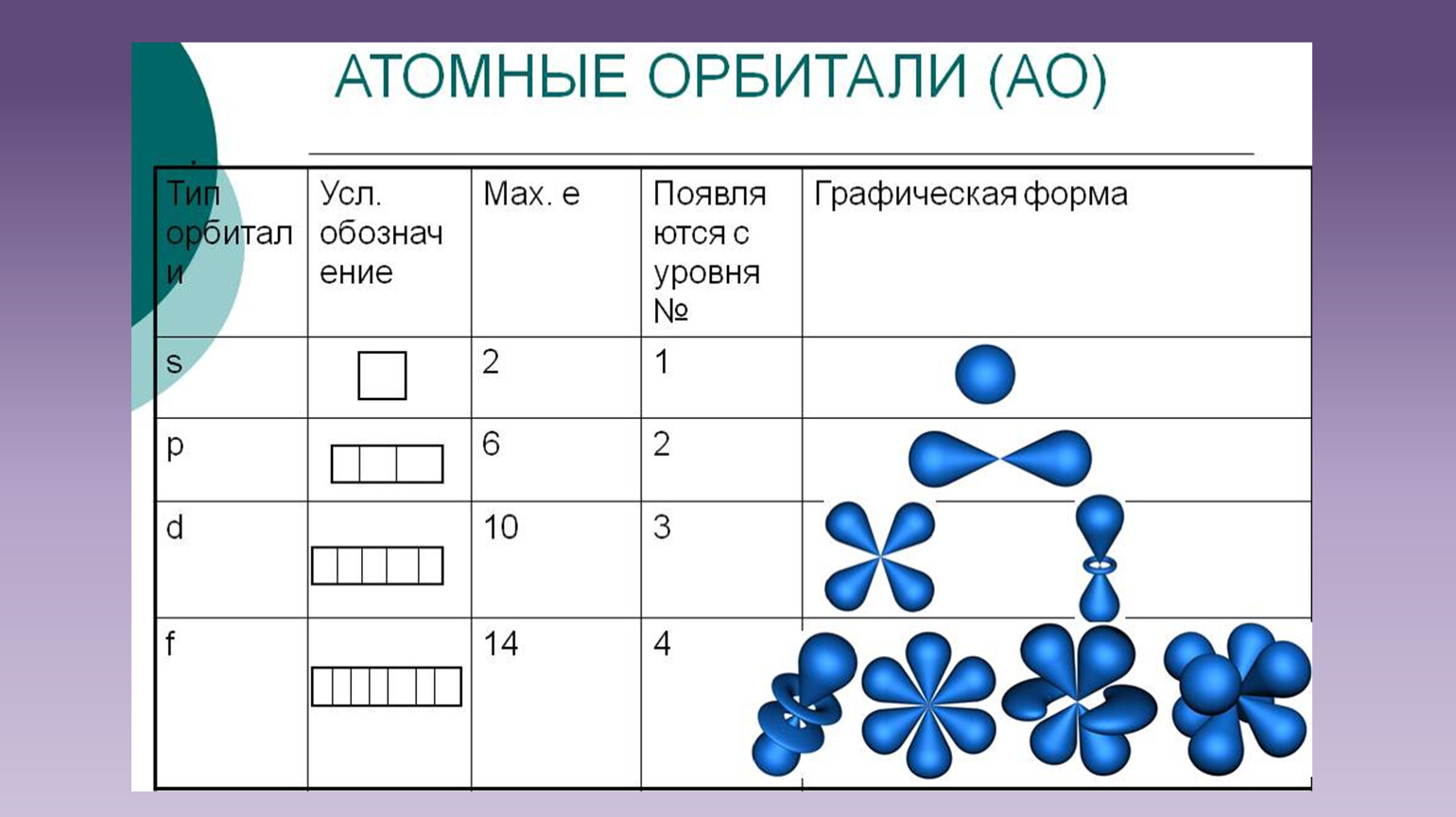 Сразу же после приезда Резерфорд занялся экспериментальными исследованиями радиоактивности. Вместе с ним работал его помощник и ученик, немецкий физик Ханс Гейгер (1882-1945), разработавший ионизационный метод измерения интенсивности излучения — широко известный счетчик Гейгера. Резерфорд произвел серию опытов, подтвердивших, что альфа-частицы представляют собой дважды ионизованные атомы гелия. Вместе с другим своим учеником, Эрнестом Марсденом (1889-1970), он исследовал особенности прохождения альфа-частиц через тонкие металлические пластинки. На основании этих опытов ученый предложил планетарную модель атома: в центре атома — ядро, вокруг которого вращаются электроны. Резерфорд предсказал открытие нейтрона, возможность расщепления атомных ядер легких элементов и искусственных ядерных превращений.
Сразу же после приезда Резерфорд занялся экспериментальными исследованиями радиоактивности. Вместе с ним работал его помощник и ученик, немецкий физик Ханс Гейгер (1882-1945), разработавший ионизационный метод измерения интенсивности излучения — широко известный счетчик Гейгера. Резерфорд произвел серию опытов, подтвердивших, что альфа-частицы представляют собой дважды ионизованные атомы гелия. Вместе с другим своим учеником, Эрнестом Марсденом (1889-1970), он исследовал особенности прохождения альфа-частиц через тонкие металлические пластинки. На основании этих опытов ученый предложил планетарную модель атома: в центре атома — ядро, вокруг которого вращаются электроны. Резерфорд предсказал открытие нейтрона, возможность расщепления атомных ядер легких элементов и искусственных ядерных превращений.
В течение 18 лет — с 1919 года и до конца своей жизни — Резерфорд возглавлял основанную в 1874 году Кавендишскую лабораторию. До него ею руководили великие английские физики Максвелл, Релей и Томсон. Резерфорд не дожил всего нескольких лет до того, как немецкие физики Отто Ган (1879-1968) и Лизе Майтнер (Мейтнер) (1878-1968) открыли деление урана.
Резерфорд не дожил всего нескольких лет до того, как немецкие физики Отто Ган (1879-1968) и Лизе Майтнер (Мейтнер) (1878-1968) открыли деление урана.
По словам Патрика Блэкетта, одного из ближайших сотрудников Резерфорда, это открытие «в известном смысле явилось последним из великих открытий в ядерной физике, отличающейся от физики элементарных частиц. Резерфорд не дожил до кульминационного пункта развития направления, которое фактически было областью его научной деятельности«.
ФАРАДЕЙ Майкл
(Faraday M.)
(22.IX 1791 — 25.VIII 1867)
Английский физик и химик, член Лондонского королевского общества (с 1824 г.). Родился в Лондоне. Учился самостоятельно. С 1813 г. работал в лаборатории Г. Дэви в Королевском институте в Лондоне (с 1825 г. — ее директор), с 1827 г. — профессор Королевского института.
Научные исследования начал в области химии. Занимался (1815-1818 гг.) химическим анализом известняка, с целью улучшения качества стали исследовал сплавы железа, изучал влияние различных добавок на качество стали.
Впервые получил (1824 г.) в жидком состоянии хлор, затем сероводород, диоксид углерода, аммиак и диоксид азота. Получил в жидком виде также арсин, фосфин, бромоводород и иодоводород, этилен. Открыл (1825 г.) бензол, изучил его физические и некоторые химические свойства. Открыл (1825 г.) изобутилен. Получил (1826 г.) альфа- и бета-сульфокислоты нафталина и приготовил 15 их солей. Положил начало (1826 г.) исследованиям натурального каучука.
Показал возможность фотохимического хлорирования этилена за 15 лет до осуществленного Ж. Дюма открытия реакции металепсии.
Один из пионеров исследования каталитических реакций. Пытался синтезировать (1825 г.) аммиак из азота и водорода действием едкого кали в присутствии металлов. Рассматривал адсорбцию на поверхности твердых катализаторов как чисто физическое явление. Впервые получил (1828 г.) этилсерную кислоту взаимодействием этилена и серной кислоты.
Проводил работу (1824-1830 гг.) по улучшению качества оптического стекла. Предложил тяжелое свинцовое стекло, с помощью которого открыл явление магнитного вращения плоскости поляризации. Установил (1833 г.) количественные законы электролиза.
Предложил тяжелое свинцовое стекло, с помощью которого открыл явление магнитного вращения плоскости поляризации. Установил (1833 г.) количественные законы электролиза.
Огромны его заслуги в области физики. Проводил исследования по электромагнетизму. Создатель учения об электромагнитном поле. Ввел понятие диэлектрической проницаемости.
Член многих академий наук и научных обществ. Иностранный член Петербургской АН (с 1831 г.).
По материалам биографического справочника «Выдающиеся химики мира» (авторы Волков В.А и др.) — Москва, «Высшая школа», 1991 г.
Великие химики
Карл-Вильгельм Шееле
(Scheele C. W.)
(9.XII.1742 — 21.V.1786)
Карл-Вильгельм Шееле появился на свет в городке Штральзунд в семье преуспевающего торговца, когда Померания входила в состав Шведского королевства. Ему исполнилось пятнадцать лет, и сбылась его детская мечта: отец отдал его учеником к знакомому аптекарю Бауху из Гётеборга. Ученье, по обычаям того времени, должно было длиться около десяти лет. Карл Шееле уже через шесть лет успешно сдал экзамены и получил звание аптекаря. В совершенстве овладев профессией и перебравшись в Стокгольм, Шееле приступает к самостоятельным научным изысканиям.
Карл Шееле уже через шесть лет успешно сдал экзамены и получил звание аптекаря. В совершенстве овладев профессией и перебравшись в Стокгольм, Шееле приступает к самостоятельным научным изысканиям.
Самыми первые его научные достижения были связаны с выделением и характеристикой винной кислоты C2h3(OH)2(COOH)2, которую он получил из ее соли — винного камня (гидротартрата калия), и плавиковой (фтороводородной) HF из плавикового шпата — фторида кальция CaF2.
После переезда сначала в Упсалу, где Шееле тоже ждала большая аптека, а потом — в маленький и тихий городок Чёпинг научные исследования пытливого аптекаря продолжались и дали поразительные результаты. Шведский химик оказался автором стольких открытий, что их хватило бы на добрый десяток ученых, и многие их этих открытий относились к получению и очистке кислот.
Судите сами. В 1775 году Шееле приготовил мышьяковую кислоту h4AsO4, в 1782-1783 годах — синильную (циановодородную) кислоту HCN, в период с 1776 по 1785 год — целый набор органических кислот: мочевую C5(NH)4O3, щавелевую h3C2O4, молочную C2h5(OH)COOH, лимонную C3h5(OH)(COOH)3, яблочную С2h4(OH)(СOOH)2, галловую C6h3(OH)3COOH, а также глицерин C3H5(OH)3. ..
..
Шееле первым получил и исследовал перманганат калия KMnO4 — всем известную «марганцовку», которая теперь широко применяется в химических экспериментах и в медицине, разработал способ получения фосфора P из костей, открыл сероводород h3S.
Наконец, именно Карлу Вильгельму Шееле принадлежит приоритет открытия химических элементов кислорода O, хлора Cl, фтора F, бария Ba, молибдена Mo, вольфрама W…
Годы упорного самоотверженного труда, к сожалению, подорвали здоровье этого поразительно целеустремленного человека, и он прожил всего до 44 лет.
Итак, путь в химию как науку еще каких-то две-три сотни лет назад пролегал чаще всего через аптеку — место получения, хранения и исследования не только лекарств, но и всех иных химических препаратов, средоточие новых идей и методов, обиталище пытливых умов…
Тайна материи
К тому времени, когда физики (включая Мари Кюри, Эрнеста Резерфорда и Альберта Эйнштейна) собрались на Сольвеевскую конференцию 1911 года, у них был новый неотложный вопрос, на который нужно было ответить: что внутри атома? НАЖМИТЕ ДЛЯ УВЕЛИЧЕНИЯ
J.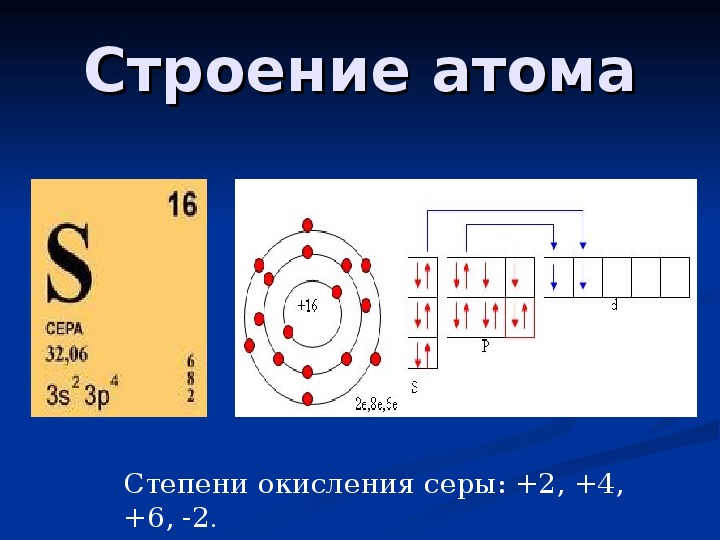 J. Томсон из Кембриджского университета открыл электрон в 1897 году, положив начало гонке за остальными частями атома.
J. Томсон из Кембриджского университета открыл электрон в 1897 году, положив начало гонке за остальными частями атома.
Томсон открыл электрон в результате его исследования трубки Крукса, ранней версии электронно-лучевых трубок, которые позже стали широко использоваться в телевизорах.Электрический ток излучал свечение, проходя от катода на одном конце к аноду на другом. Томсон обнаружил, что даже когда он использовал разные металлы для катода, полученные электроны всегда были одинаковыми — это признак того, что электрон был частью каждого атома.
Изучение Марии Кюри любопытных лучей, исходящих от урана, привело к открытию радиоактивности и двух новых элементов: полония и радия. Фото: ACJC
Открытие Мари и Пьера Кюри, что радий светится в темноте, привело к осознанию того, что радиоактивность — это атомы, распадающиеся на части и излучающие энергию.Это означало, что внутри должны быть более мелкие детали, которые все еще ждут открытия. Фотография: ACJC .
Фотография: ACJC .
В 1910 году Резерфорд и двое его аспирантов использовали радиоактивные альфа-частицы, чтобы сделать удивительное открытие структуры атома.
Видение атома Резерфордом: плотное ядро, называемое ядром, содержащее положительный заряд атома и большую часть его массы, окруженное крошечными отрицательно заряженными электронами, вращающимися по орбите на гораздо большем расстоянии от ядра, чем предполагает этот рисунок.
В 1913 году физик Гарри Мозли обнаружил простую связь между рентгеновским спектром элемента и его атомным номером. Это привело к открытию положительно заряженной частицы, называемой протоном, и осознанию того, что каждый элемент определяется числом протонов в его ядре: его атомным номером.
Манчестерская физическая лаборатория Резерфорда включала одну из лучших групп ученых, когда-либо собранных в одном месте.Наряду с Гарри Мозли в их число входили Ханс Гейгер (изобретатель счетчика Гейгера), Чарльз Г. Дарвин (внук великого биолога) и Джеймс Чедвик, который получил Нобелевскую премию за открытие нейтрона. НАЖМИТЕ ДЛЯ УВЕЛИЧЕНИЯ
Дарвин (внук великого биолога) и Джеймс Чедвик, который получил Нобелевскую премию за открытие нейтрона. НАЖМИТЕ ДЛЯ УВЕЛИЧЕНИЯ
Открытия Мозли и Резерфорда подняли загадочный вопрос об атоме: почему атомный вес элементов возрастает намного быстрее, чем их атомные номера? Загадка была решена после открытия Джеймсом Чедвиком нейтрона в 1932 году.
Используя нейтроны для бомбардировки атомов урана, итальянский физик Энрико Ферми обнаружил, по его мнению, первые элементы, помимо урана. За это он получил Нобелевскую премию 1938 года.
Четыре немецких ученых, включая давних сотрудников Отто Хана и Лизу Мейтнер, обнаружили, что Ферми фактически разделил уран пополам на гораздо более легкие элементы — результат, который почти никто не считал возможным.
По иронии судьбы, в определенном смысле открытие атомной структуры доказало правоту древних греков: на самом деле материя состоит всего из нескольких вещей в сочетании — не воздуха, воды, земли и огня, а протонов, нейтронов и электронов.
Неизменяемый, неделимый атом
Один из самых глубоких сдвигов в нашем понимании материи произошел за 40-летний период, начавшийся на пороге 20-го века. До этого момента почти все ученые придерживались двух непоколебимых убеждений о материи:
- Во-первых, атомы были самыми маленькими единицами материи. У каждого элемента в Периодической таблице был свой уникальный вид атома — это то, что отличает один элемент от другого.Большинство химиков считали, что более тонкой резки не существует. Действительно, само слово «атом» происходит от греческого atomos , что означает «неразрезанный».
- Во-вторых, эти атомы были стабильными и постоянными. Древняя мечта алхимика превратить один элемент в другой была изгнана раз и навсегда. Теперь химики были уверены, что элементы были и всегда будут одинаковыми — навсегда закрепленными.
Однако к концу этого 40-летнего периода серия быстрых открытий, сделанных учеными по всей Европе, разрушила оба этих фундаментальных принципа. Неизменный, неделимый атом был развенчан. На его место пришла радикально новая точка зрения, согласно которой материя была более податливой, более нестабильной и более могущественной.
Неизменный, неделимый атом был развенчан. На его место пришла радикально новая точка зрения, согласно которой материя была более податливой, более нестабильной и более могущественной.
Томсон обнаруживает электрон
Первый намек на то, что это может все еще преподносить сюрпризы, был сделан в 1897 году, когда физик Дж. Дж. Томсон из Кембриджского университета Англии обнаружил то, что казалось немыслимо маленькой частицей. Томсон намеревался изучить электрические лучи, которые проходят через стеклянное устройство, называемое трубкой Крукса, освещая дальний конец таким образом, что это взволновало толпу, которая до сих пор остается загадкой для электричества.Когда Томсон поднес магнит к трубе, он увидел, что он искривляет траекторию луча. Он понял, что электричество должно состоять из отрицательно заряженных частиц, которые вскоре стали называть «электронами». Но Томсон понял, что электрон — это не просто единица электричества, потому что даже когда он использовал разные металлы для генерации лучей, полученные электроны всегда были одинаковыми. Его смелый вывод заключался в том, что электрон должен составлять крошечный кусочек каждого атома — почти в две тысячи раз меньше, чем самый маленький атом.
Электрон Томсона был настолько диковинным, что многие ученые поначалу отказывались верить в существование чего-либо столь крошечного. Но уже в следующем году открытия, которые начали сыпаться из лабораторий Мари и Пьера Кюри, начали переломить ситуацию.
Мария Кюри и радиоактивность
Марии Склодовской запретили учиться в университете в ее родной Польше, поэтому она приехала изучать естественные науки в одно из немногих мест в мире, где она могла бы это сделать: в Париже.Вскоре после окончания Сорбонны она познакомилась и вышла замуж за французского физика по имени Пьер Кюри. После рождения первого ребенка она намеревалась стать первой женщиной-ученым, получившей докторскую степень во Франции. Нуждаясь в теме для своей диссертации, она рассматривала рентгеновские лучи, которые только что были открыты и были предметом разговоров в научном мире. Но вместо этого Мари предпочла сосредоточиться на другом недавно открытом луче, испускаемом элементом уран.
Подобно рентгеновским лучам, «урановые лучи» могли проникать сквозь толстую черную бумагу и создавать изображение на фотопластинке; они также «ионизировали» воздух вокруг себя, делая воздух лучше проводником электричества.Используя изящные инструменты, изобретенные Пьером, Мари тщательно проверила все другие известные элементы, чтобы увидеть, обладает ли какой-либо из них аналогичными способностями. В начале 1898 года она обнаружила, что торий ведет себя точно так же. Поскольку это свойство не ограничивалось ураном, ему требовалось новое название. Мари назвала это «радиоактивностью». Она продолжила использовать радиоактивность, чтобы идентифицировать два новых элемента: полоний, названный в честь ее родины, и радий.
После того, как они выделили его в достаточном количестве, Кюри обнаружили, что радий обладает еще одним загадочным свойством: он светится в темноте, по-видимому, вечно.Откуда взялась эта энергия? Кюри не могли принять решение, но их открытия побудили других во всем мире сделать вывод, что энергия возникла в результате распада атомов. Атом радия разрушался, выплевывая части себя и генерируя при этом энергию. Эта теория имела глубокий смысл: если радиоактивность заключалась в распаде атомов, то атомы должны состоять из частей. Внутри должны быть более мелкие детали, которые все еще ждут открытия. Благодаря Кюри перед учеными возник новый насущный вопрос: что находится внутри атома?
В свете открытий Кюри невероятно крошечный электрон Томсона внезапно обрел смысл: это часть атома.Теперь началась гонка, чтобы обнаружить остальные части атома и понять, как они сочетаются друг с другом.
Резерфорд обнаруживает ядро
К 1910 г. считалось общепризнанным, что Дж. Дж. Крошечный отрицательно заряженный электрон Томсона был частью атома. Но это оставило без ответа два больших вопроса: поскольку большинство атомов электрически нейтральны, где в атоме положительные заряды, необходимые для компенсации отрицательных электронов? А поскольку электроны составляют лишь крошечную его часть, где же остальная масса атома?
Одним из ученых, работавших над ответом на эти вопросы, был физик Эрнест Резерфорд из Манчестерского университета в Англии.Резерфорд уже получил Нобелевскую премию за открытие, что атомы радия при распаде выделяют различные виды частиц (альфа и бета). Теперь он попросил двух своих аспирантов, Эрнеста Марсдена и Ханса Гейгера, использовать альфа-частицы для исследования структуры атома. Они направили луч альфа-частиц на ультратонкий лист золотой фольги. Большую часть времени альфа-частицы проходят сквозь него. Но время от времени один из снарядов отскакивал практически прямо им в лицо.«Это было самое невероятное, что когда-либо случалось со мной», — вспоминает Резерфорд. «Это было почти так, как если бы вы выстрелили 15-дюймовым снарядом по куску папиросной бумаги, а он вернулся и попал в вас!»
В конце 1910 года Резерфорд однажды пришел в лабораторию и объявил, что знает, что означает этот удивительный результат: атом должен быть в основном пустым пространством, но иметь невероятно плотный твердый центр. В результате работы Резерфорда появилось совершенно новое видение атома. Его положительный заряд и почти вся масса были сосредоточены в крошечном центральном ядре — ядре.А вокруг ядра на большом расстоянии в масштабе атома кружились отрицательно заряженные электроны.
«Одна из самых замечательных особенностей атома заключается в том, что он в основном состоит из ничего!» говорит физик Мэрилендского университета Джим Гейтс.
«Я думаю, что ощущение в тех коридорах, лабораториях Манчестера, должно быть, вызывало большое волнение», — говорит историк Массачусетского технологического института Дэвид Кайзер. «Они почувствовали, что Резерфорд и его команда буквально открыли новый взгляд на материю.”
Мозли и атомный номер
Следующее критическое открытие атома было сделано другим членом манчестерской лаборатории Резерфорда, физиком Гарри Мозли. В 1912 году немецкие ученые обнаружили, что рентгеновские лучи можно расщеплять или «дифрагировать» на волны разной длины, точно так же, как свет можно расщеплять на разные цвета. В следующем году Мозли показал, что каждый химический элемент имеет свой собственный уникальный спектр рентгеновских лучей, аналогичный спектрам света, которые так помогли идентифицировать новые элементы с середины 1800-х годов.Что еще более удивительно, Мозли обнаружил удивительно простую взаимосвязь между рентгеновским спектром элемента и его «атомным номером».
До этого атомный номер просто относился к номеру ячейки элемента в Периодической таблице. Но результаты Мозли показали, что атомный номер — это больше, чем удобная метка. Он представлял собой положительный заряд ядра атома, и он неизменно увеличивался на одно число от одного элемента к другому. Выводы Мозли заключались в том, что ядро - это не одна большая положительная капля, а набор положительно заряженных частиц, число которых увеличивается с каждым более тяжелым элементом.
Опираясь на работу Мозли, Резерфорд вскоре открыл следующую часть атома — протон — и показал, что каждый элемент Периодической таблицы определяется числом протонов в его ядре: его атомным номером. Атомный номер элемента — это то, что придает этому элементу его идентичность: добавьте еще один протон или уберите его, и вы получите другой элемент. «Мозли и атомное число — это действительно решающий момент, когда мы узнаем, что на самом деле представляет собой элемент», — говорит историк из Университета Джона Хопкинса Лоуренс Принсипи.
Чедвик обнаруживает нейтрон
Открытие Гарри Мозли важности атомного числа подняло новый тревожный вопрос об атоме: при перемещении по Периодической таблице атомные номера элементов увеличиваются на одну цифру от одного элемента к другому. Водород — 1, гелий — 2, литий — 3 и т. Д. Но атомный вес элементов поднимается намного быстрее. Водород имеет атомный вес 1, который приходится на его одинокий протон.Гелий имеет два протона, но атомный вес четыре; литий состоит из трех протонов и имеет атомный вес 7. Разрыв между атомным номером и атомным весом становится все шире и шире. Что могло объяснить эту недостающую массу? Есть ли еще одна часть атома, которую еще предстоит открыть?
Наконец, ответ пришел в 1932 году, когда другой из «Мальчиков Резерфорда», физик Джеймс Чедвик, открыл последний элемент атома: нейтрон. Нейтрон имеет почти такую же массу, что и протон, и оба они занимают ядро.За исключением водорода, который не содержит нейтронов, почти каждый атом имеет как минимум столько же нейтронов, сколько протонов. Эти нейтроны составляют остальную часть атомного веса каждого элемента — и они решили загадку недостающей массы. Но нейтрон, как следует из названия, электрически нейтрален, и это необычное свойство вскоре придаст ему центральную роль в событиях, которые открыли шокирующие новые вещи об атоме.
Расщепление атома
Как только нейтрон был открыт, ученые поняли, что это идеальный снаряд для исследования внутренностей атома.В отличие от тех положительно заряженных альфа-частиц, которые использовали Резерфорд и его ученики, нейтрон не будет отталкиваться при приближении к ядру. Поскольку у него нет заряда, он может войти прямо внутрь.
Одним из первых, кто использовал нейтрон таким образом, был итальянский физик по имени Энрико Ферми. В 1934 году Ферми начал стрелять нейтронами по атомам урана, создавая поток фрагментов, которые он затем проанализировал. Он обнаружил, что нейтрон иногда отщепляет часть ядра урана, понижая его атомный номер и превращая его в другой элемент, на несколько точек ниже в Периодической таблице.Но некоторые из фрагментов Ферми не соответствовали ни одному из элементов чуть ниже урана. Он пришел к выводу, что иногда приходящий нейтрон поглощается ядром урана … а затем спонтанно превращается в протон, повышая атомный номер атома и превращая его в другой элемент на тяжелее на , чем уран.
За открытие первых двух элементов помимо урана, Ферми получил Нобелевскую премию в 1938 году. Но как только он пожимал руку королю Швеции, немецкие ученые делали открытие, которое доказывало его неправоту.Химики Отто Хан и Фриц Штрассман повторили эксперименты Ферми, но вместо того, чтобы найти новые элементы тяжелее урана, они обнаружили хорошо известные элементы, которые были намного ниже в Периодической таблице — примерно вдвое тяжелее урана. Озадаченный, Хан написал своему давнему сотруднику Лизе Мейтнер, еврейскому физику, бежавшему из Германии после прихода нацистов. Мейтнер поняла, что полученные данные означают, что атом раскололся пополам, что почти никто не мог себе представить. Ее коллега Отто Фриш ввел термин, под которым мы сегодня знаем этот процесс: ядерное «деление».”
Новый взгляд на материю
Огромная энергия, высвободившаяся при разделении атома, имела серьезные последствия для мира, находящегося на грани войны. Всего за шесть лет открытие ядерного деления приведет к созданию атомной бомбы. Это также нанесет последний удар по старому образу нерасщепляемого, изменчивого атома.
За четыре десятилетия, прошедшие с тех пор, как Дж. Дж. Томсон намеревался понять эти загадочные лучи в своей трубке Крукса; серия открытий, сделанных учеными по всей Европе, показала, что атомы не являются мельчайшими единицами материи; при этом они не были зафиксированы на все времена.Теперь стало ясно, что у атомов есть более мелкие части внутри — и что изменения этих частей изменят идентичность самих атомов.
По иронии судьбы, эти открытия подтвердили некоторые из самых древних представлений о материи:
- Мечта алхимика превратить свинец в золото все еще не была практическим путем к богатству. Но было возможным для одного элемента превратиться в другой. Фактически, это все время происходит спонтанно в радиоактивных элементах.
- И, несмотря на открытие множества новых элементов за эти четыре десятилетия, теперь стало ясно, что материя действительно состоит из нескольких вещей в сочетании, как и предполагали алхимики и древние греки много веков назад. Не воздух, вода, земля и огонь … а протоны, нейтроны и электроны. Вся материя состоит только из этих трех частиц, смешанных в разных соотношениях. «Удивительно, как далеко природа смогла продвинуться с этим необычным и простым рецептом», — говорит химик из Университета Брандейса Грегори Петско.
O ПОНЯТЬ, ЧТО ПРОИСХОДИТ , когда радиоактивные атомы испускают излучение, ученым нужно было понять, как устроен атом. Как Резерфорд впервые объяснено в 1911 году, каждый атом состоит из небольшого массивного ядро, окруженное роем легких электронов. Это из ядро, которое радиоактивность, альфа, бета или гамма лучи, стреляй.Примерно к 1932 году коллеги Резерфорда обнаружили что ядро состоит из более мелких частиц, положительно заряженные протоны и электрически нейтральные нейтроны. Протон или нейтрон каждый имеет массу около одного атома водорода. Все атомы данного элемента имеют в своем составе заданное количество протонов. ядра, называемые атомным номером. Чтобы сбалансировать этот заряд, они иметь равное количество электронов, роящихся вокруг ядра.Именно эти оболочки электронов придают элементу его химический состав. характеристики. Однако оказалось из того, что атомы данного элемента могут иметь разное количество нейтронов, а значит, и другой атомной массы. Содди назвал формы элемента с разными атомными массами изотопов элемента. Например, самый легкий элемент, водород, имеет атомный номер 1.Его ядро обычно состоит из одного протона. и нет нейтронов, поэтому его атомная масса также равна 1. Но водород имеет изотопы с разными атомными массами. «Тяжелый» водород, называемый дейтерий, имеет в своем ядре один протон и один нейтрон, и таким образом, его атомная масса равна 2. Водород также имеет радиоактивный изотоп, тритий. Тритий имеет один протон и два нейтрона, и, следовательно, его атомная масса 3.Каждая из трех форм водорода имеет по одному электрону, и, следовательно, те же химические свойства. Когда радиоактивный ядро испускает альфа- или бета-частицы, оно в процессе превращения в другое ядро - в другой элемент, или другой изотоп того же элемента. Например, радиоактивный торий образуется, когда уран-238 — изотоп урана с 92 протона и 146 нейтронов — испускает альфа-частицу.Поскольку альфа-частица состоит из двух протонов и двух нейтронов, когда это вычитается, что остается — это ядро с 90 протонами и 144 нейтрона. Торий — элемент с атомным номером 90, и этот изотоп тория имеет атомную массу 234. Результаты распада сами по себе могут быть нестабильными, как в случае с торием-234. Цепочка распадов продолжается до тех пор, пока не образуется стабильное ядро, в в этом случае элемент свинец. Резерфорд и Содди обнаружил, что каждый радиоактивный изотоп имеет определенный период полураспада . Половина ядер в данном количестве радиоактивного изотопа будет распадаться за определенный период времени. Период полураспада урана-238 составляет 4,5 миллиарда лет, что означает, что за этот огромный период со временем половина ядер в образце урана-238 распадется (в следующих 4.5 миллиардов лет, половина того, что останется, распадется, оставив одну четверть оригинала и т. д.). Изотопы производимые распадом урана, сами быстро распадаются в длинная цепочка излучений. Радий и полоний — звенья в этом цепь. Радий поймал Мари Внимание Кюри, потому что его период полураспада составляет 1600 лет. Это достаточно долго, чтобы было изрядное количество радия, смешанного с ураном. в ее уране.И он был достаточно коротким, чтобы его радиоактивность было довольно интенсивно. Долгоживущий изотоп, такой как уран-238, излучает излучение так медленно, что его радиоактивность почти не заметна. Напротив, период полураспада наиболее долгоживущего изотопа полония, полоний-210, всего 138 суток. Этот короткий период полураспада помогает объяснить почему Мария Кюри не смогла выделить полоний. Даже когда она выступала ее тщательная дробная кристаллизация, полоний в ней сырье исчезло в результате его быстрого радиоактивного разлагаться. Вы можете читать Мари Описание радиоактивности, данное Кюри в 1904 году. использует радиоактивности РАННИЕ РАБОТЫ OF MARIE AND PIERRE CURIE почти сразу же привел к использованию радиоактивных материалов в медицине. Во многих случаях изотопы эффективнее и безопаснее хирургического вмешательства или химикатов для атаки раковые заболевания и некоторые другие заболевания.За эти годы многие другие были найдены применения радиоактивности. Пока электрическая частица ускорители были изобретены в 1930-х годах, ученые использовали радиацию от изотопов до бомбардировки атомов, раскрывая многие секреты атомной структуры. По сей день радиоактивные изотопы, используемые в качестве «трассеры» для отслеживания химических изменений и жизненных процессов, являются практически незаменимым помощником для биологов и физиологов.Изотопы имеют решающее значение даже для геологии и археологии. Как только как он понимал радиоактивный распад, Пьер Кюри понял, что его можно использовать для датировки материалов. Скоро возраст земли был установлен распадом урана в несколько миллиардов лет, далеко больше, чем предполагали ученые. С 1950-х годов радиоактивный углерод был использован для определения возраста останков растений и животных, например, в древних захоронениях 50 000 лет назад. 2000 — Американский институт физики |
Структурные тенденции в атомных ядрах по данным лазерной спектроскопии олова
Thoennessen, M. The Discovery of Isotopes . (Springer: Cham, Швейцария, 2016).
MATH Книга Google Scholar
Бор А. и Моттельсон Б. Р. Структура ядра , Vol.2 (W. A. Benjamin, Inc.: Сингапур, 1975 г.).
Reinhard, P.-G. & Оттен, Э. У. Переход к деформированным формам как ядерный эффект Яна – Теллера. Nucl. Phys. А 420 , 173 (1984).
ADS Статья Google Scholar
Назаревич В. Микроскопическое происхождение ядерных деформаций. Nucl. Phys. А 574 , 27 (1994).
ADS Статья Google Scholar
Кастен, Р. Ф. Структура ядра с простой точки зрения . (Издательство Оксфордского университета: Нью-Йорк, 1990).
Google Scholar
Талми И. Простые модели сложных ядер . (Harwood Academic Publishers: Швейцария, 1993).
Google Scholar
Talmi, I. Модель оболочки — простота от сложности: некоторые из моих лучших ядер имеют сферическую форму. Phys. Scr. 92 , 083001 (2017).
ADS Статья Google Scholar
Моралес И. О., Ван Исакер П. и Талми И. Обобщенный старшинство и переходы E2 в изотопах олова. Phys. Lett. В 703 , 606 (2011).
ADS Статья Google Scholar
Стучбери, А. Е. Простые структуры в сложных ядрах по сравнению со сложными структурами в простых ядрах: перспектива ядерных моментов. J. Phys .: Conf. Сер. 366 , 012042 (2012).
Google Scholar
Morris, T. D. et al. Структура легчайших изотопов олова. Phys. Rev. Lett. 120 , 152503 (2018).
ADS Статья Google Scholar
Тогаши, Т., Цунода, Ю., Оцука, Т., Симидзу, Н. и Хонма, М. Новая эволюция формы изотопов Sn от магических чисел от 50 до 82. Phys. Rev. Lett. 121 , 062501 (2018).
ADS Статья Google Scholar
Siciliano, M. et al. Парно-квадрупольное взаимодействие в нейтронно-дефицитных ядрах олова: первые измерения времени жизни низколежащих состояний в 106,108 Sn. Препринт на https://arxiv.org/abs/1905.10313 (2019).
Цукер А. П. Квадрупольное доминирование в легких изотопах Cd и Sn. Препринт по адресу https: // arxiv.org / abs / 1905.11479 (2019).
Бербидж Э. М., Бербидж Г. Р., Фаулер У. А. и Хойл Ф. Синтез элементов в звездах. Ред. Мод. Phys. 29 , 547 (1957).
ADS Статья Google Scholar
Neugart, R. et al. Коллинеарная лазерная спектроскопия в ISOLDE: новые методы и основные моменты. J. Phys. Г 44 , 064002 (2017).
ADS Статья Google Scholar
Köster, U. et al. Прогресс в системах источников ионов-мишеней ISOL. Nucl. Instrum. Методы Phys. Res., Sect. В 266 , 4229 (2008).
ADS Статья Google Scholar
Mané, E. et al. Ионный охладитель-группировщик для высокочувствительной коллинеарной лазерной спектроскопии в Изольде. Eur. Phys. J. A 42 , 503 (2009).
ADS Статья Google Scholar
Малкин, Э., Коморовский, С., Реписки, М., Демисси, Т. Б. и Рууд, К. Абсолютные константы экранирования тяжелых ядер: решение загадки абсолютного экранирования 119 Sn. J. Phys. Chem. Lett. 4 , 459 (2013).
Артикул Google Scholar
Йонссон, П., Гайгалас, Г., Биерон, Дж., Фрезе Фишер, К. и Грант, И. П. Новая версия: пакет релятивистской атомной структуры Grasp2K. Comput. Phys. Commun. 184 , 2197 (2013).
ADS МАТЕМАТИКА Статья Google Scholar
Froese Fischer, C., Gaigalas, G., Jönsson, P. & Bieroń, J. GRASP2018 — Версия пакета общей релятивистской атомной структуры для Fortran 95. Comput. Phys. Commun. 237 , 184 (2019).
ADS Статья Google Scholar
Фрезе Фишер, К., Годфроид, М., Браге, Т., Йонссон, П. и Гайгалас, Г. Расширенные методы многоконфигурации сложных атомов: I. Энергии и волновые функции. J. Phys. В 49 , 182004 (2016).
ADS Статья Google Scholar
Грант И. П. Релятивистская квантовая теория атомов и молекул. Теория и вычисления 90 168. (Springer-Verlag: Нью-Йорк, США, 2007).
Забронировать Google Scholar
Тупицын И.И., Логинов А.В. Использование разложений Штурма в расчетах сверхтонкой структуры атомных спектров. Опт. Spectrosc. 94 , 319 (2003).
ADS Статья Google Scholar
Экман Дж., Ли Дж., Йонссон П., Годфроид М. и Гайгалас Г. Моделирование сверхтонких аномалий с помощью GRASP. Proc. Семинар EOS по электронным атомным факторам и сверхтонким аномалиям для ядерной физики (Брюссель, Бельгия, 2019).
Йорданов Д. Т. и др. Спины, электромагнитные моменты и изомеры 107–129 Cd. Phys. Rev. Lett. 110 , 192501 (2013).
ADS Статья Google Scholar
Йорданов Д. Т. и др. Простая структура ядра в 111–129 Cd по изомерным сдвигам атомов. Phys. Rev. Lett. 116 , 032501 (2016).
ADS Статья Google Scholar
Frömmgen, N. et al. Коллинеарная лазерная спектроскопия атомарного кадмия. Eur. Phys. Ж. Д 69 , 164 (2015).
ADS Статья Google Scholar
Хаас, Х. Переоценка данных. Частное общение (2019).
Bender, M., Heenen, P.-H. И Рейнхард, П.-Г. Самосогласованные модели среднего поля для структуры ядра. Ред. Мод. Phys. 75 , 121 (2003).
ADS Статья Google Scholar
Klüpfel, P., Reinhard, P.-G., Bürvenich, T. J. & Maruhn, J. A. Вариации на тему Скирма: систематическое исследование корректировок параметров модели. Phys. Ред. C 79 , 034310 (2009).
ADS Статья Google Scholar
Miller, A.J., Minamisono, K. & Klose, A. et al.Сверхтекучесть протонов и зарядовые радиусы в протонных изотопах кальция. Nat. Phys. 15 , 432 (2019).
Артикул Google Scholar
Фаянс, С. А. К универсальному функционалу ядерной плотности. Письма в ЖЭТФ. 68 , 169 (1998).
ADS Статья Google Scholar
Фаянс, С.А., Толоконников, С.В., Трыков, Е. Л., Завиша, Д. Ядерные изотопные сдвиги в рамках подхода с использованием локального функционала плотности энергии. Nucl. Phys. А 676 , 49 (2000).
ADS Статья Google Scholar
Reinhard, P.-G. И Назаревич, В. К глобальному описанию ядерных зарядовых радиусов: исследование функционала плотности энергии Фаянса. Phys. Ред. C 95 , 064328 (2017).
ADS Статья Google Scholar
Ринг, П. и Шак, П. Ядерная проблема многих тел . (Springer-Verlag: Берлин, 1980).
Забронировать Google Scholar
Hammen, M. & Nörtershäuser, W. et al. От кальция к кадмию: проверка функции спаривания путем измерения радиуса заряда 100–130 Cd. Phys. Rev. Lett. 121 , 102501 (2018).
ADS Статья Google Scholar
Gorges, C. et al. Лазерная спектроскопия нейтронно-богатых изотопов олова: неоднородность зарядовых радиусов на замыкании оболочки N = 82. Phys. Rev. Lett. 122 , 192502 (2019).
ADS Статья Google Scholar
Zhao, P. W., Zhang, S. Q. & Meng, J. Объяснение простоты квадрупольных моментов, недавно обнаруженных в изотопах Cd, из ковариантной теории функционала плотности. Phys. Ред. C 89 , 011301 (R) (2014).
ADS Статья Google Scholar
Йорданов Д. Т. и др. Спины и электромагнитные моменты 101–109 Cd. Phys. Ред. C 98 , 011303 (R) (2018).
ADS Статья Google Scholar
Федерман П. и Питтель С. Унифицированное описание ядерной деформации на основе модели оболочки. Phys. Ред. C 20 , 820 (1979).
ADS Статья Google Scholar
Добачевский, Дж., Назаревич, В., Скальски, Дж. И Вернер, Т. Деформация ядра: протон-нейтронный эффект? Phys. Rev. Lett. 60 , 2254 (1988).
ADS Статья Google Scholar
Эсат, М. Т., Кин, Д. К., Спир, Р.Х. и Бакстер А. М. Зависимость статических квадрупольных моментов первых 2 состояний + в изотопах кадмия от массы. Nucl. Phys. А 274 , 237 (1976).
ADS Статья Google Scholar
Allmond, J. M. et al. Исследование полумагической природы изотопов олова через электромагнитные моменты. Phys. Ред. C 92 , 041303 (R) (2015).
ADS Статья Google Scholar
Neyens, G. Ядерный магнитный и квадрупольный моменты для исследования структуры ядер на экзотических ядрах. Rep. Prog. Phys. 66 , 633 (2003).
ADS Статья Google Scholar
Ferrer, R. et al. К лазерной ионизационной спектроскопии высокого разрешения наиболее тяжелых элементов при расширении сверхзвуковой газовой струи. Nat. Commun. 8 , 14520 (2017).
ADS Статья Google Scholar
Sels, S. et al. Изменение формы изотопов ртути в средней части оболочки по данным лазерной спектроскопии в источнике по сравнению с расчетами по теории функционала плотности и модели оболочек Монте-Карло. Phys. Ред. C 99 , 044306 (2019).
ADS Статья Google Scholar
Magnante, P.C. & Stroke, H.H. Изотопный сдвиг между 209 Bi и 6,3-дневным 206 Bi. J. Opt. Soc. Являюсь. 59 , 836 (1969).
ADS Статья Google Scholar
Brun, R. & Rademakers, F. ROOT — объектно-ориентированная среда анализа данных. Nucl. Instrum. Методы Phys. Res., Sect. А 389 , 81 (1997).
ADS Статья Google Scholar
Ауди, Г., Кондев, Ф. Г., Ван, М., Хуанг, В. Дж. И Наими, С. Оценка ядерных свойств NUBASE2016. Подбородок. Phys. С 41 , 030001 (2017).
ADS Статья Google Scholar
King, W.H. Комментарии к статье: Особенности изотопического сдвига в спектре самария. J. Opt. Soc. Являюсь. 53 , 638 (1963).
Артикул Google Scholar
Макульский, В. Исследование тетраметилолова методом ЯМР-спектроскопии в газовой и жидкой фазах. J. Mol. Struct. 1017 , 45 (2012).
ADS Статья Google Scholar
Макульски В., Яковски К., Антушек А. и Яшунски М. Измерения ЯМР в газовой фазе, абсолютные масштабы экранирования и магнитные дипольные моменты ядер 29 Si и 73 Ge . J. Phys. Chem. А 110 , 11462 (2006).
Артикул Google Scholar
Anselment, M. et al. Зарядовые радиусы и моменты ядер олова по данным лазерной спектроскопии. Phys. Ред. C 34 , 1052 (1986).
ADS Статья Google Scholar
Le Blanc, F. et al. Изменение зарядового радиуса и ядерные моменты в тяжелых изотопах олова по данным лазерной спектроскопии: зарядовый радиус 132 Sn. Phys. Ред. C 72 , 034305 (2005).
ADS Статья Google Scholar
Eberz, J. et al. Спины, моменты и зарядовые радиусы ядер 108–111 Sn. Z. Phys. А 326 , 121 (1987).
ADS Google Scholar
Махешвари Б., Абу Кассим, Х., Юсоф, Н. и Джайн, А. К. Эволюция ядерной структуры в закрытой оболочке и вокруг нее Z = 50: обобщенное старшинство в изотопах Cd, Sn и Te. Nucl. Phys. А 992 , 121619 (2019).
Артикул Google Scholar
Рагхаван П. Таблица ядерных моментов. At. Data Nucl. Таблицы данных , , 42, , 189 (1989).
ADS Статья Google Scholar
Представления французских учащихся старших классов в долговременной памяти
А. Кокелес и А. Думон
132
Исследования и практика химического образования, 2005, 6 (3), 119-135
Этот журнал © Королевское химическое общество
Ссылки
Барлет Р.и Плуэн Д. (1997), La dualité microscopique-macroscopique: un damage sous-jacent aux
,трудности en chimie dans l’enseignement university, ASTER, 25, 143-173.
Бен-Цви Р., Эйлон Б. и Зильберштейн Дж. (1988), Теории, принципы и законы, Образование в
Химия, 25, 89-92
Шарле-Брехелин Д. (1998), Вклад à l ‘enseignement — apprentissage du concept d’atome au
collège, Thèse, Université Montpellier II.
Де Вос, W.и Вердонк А.Х. (1987), Новый путь к реакции. Часть 4. Вещества и их
молекул, Журнал химического образования, 64, 692-695.
Драйвер Р. и Исли Дж. (1978), Ученики и парадигмы: обзор литературы, связанной с концепцией развития
у подростков, изучающих естественные науки, Исследования в области естественнонаучного образования, 5, 61-84.
Гилберт Дж. К. и Свифт Д. Дж. (1985), К лакатосовскому анализу программ исследования концепций Пиаже и альтернативных
концепций, Science Education, 69, 681-696.
Гилберт Дж. К., Осборн Р. Дж. и Феншем П.Дж., (1982), Детская наука и ее последствия для преподавания
, Science Education, 66, 623-633.
Джордан А. и Де Векки Г. (1987), Les origines du savoir, Delachaux and Niestlé, Neuchâtel —
Paris.
Гриффитс К. А. и Престон Р. К., (1992), Заблуждения учащихся 12-х классов относительно фундаментальных
характеристик атомов и молекул, Journal of Research in Science Teaching, 29, 611-628.
Харрисон А.Г. и Треагуст Д.Ф., (1996), Ментальные модели атомов и молекул учащихся средних школ:
значения для преподавания химии, Естественное образование, 80, 509-534.
Харрисон А.Г. и Треагуст Д.Ф., (2000), Изучение атомов, молекул и химических связей: пример использования нескольких моделей
в химии 11 класса, Science Education, 84, 352-381.
Джонстон К. (1988), Изучение и преподавание теории частиц материи: отчет о действующей обучающей схеме
в ходе двухнационального британо-израильского семинара: трудности обучения
по химии, Иерусалим, 55-79.
Джусти Р. и Гилберт Дж. (2000), История и философия науки через модели: некоторые проблемы в
случае «атома», Международный журнал естественнонаучного образования, 22, 993-1009.
Кейг Ф.П. и Рубба А.П. (1993), Перевод представлений о структуре материи и ее связи
с рассуждением, полом, пространственным рассуждением и конкретными предшествующими знаниями, Journal of
Research in Science Teaching, 30, 883-903.
Ложье А.и Думон А. (2000), История науки и моделирования преобразований
chimique, Bulletin de l’Union des Physiciens, 826, 1261-1284.
Ниаз М., Агилера Д., Маза А. и Лиендо Г. (2002), Аргументы, противоречия, сопротивление и
концептуальные изменения в понимании учащимися атомной структуры, Естественное образование, 86, 505-
525
Осборн Р. и Фрейберг П. (1985), Обучение в науке: значение детской науки,
Окленд: Хайнеман.(в Griffiths and Preston, 1992, p. 612).
Перейра М.П. и Pestana M.E.M., (1991), Представления студентов о моделях воды, International
Journal of Science Education, 13, 313-319.
Робинсон WR, (1998), Альтернативная основа для химической связи, Journal of Chemical
Education, 75, 1074.
Taber KS, (1998), Альтернативная концептуальная основа из химического образования, International
Journal of Science Просвещение, 20, 597-608.
Табер, К. С., (2003), Атом в учебной программе по химии: фундаментальная концепция, модель обучения или эпистемологическое препятствие
?, Основы химии, 5, 43-84.
Табер К.С., (2004), Кванты обучения: препятствия для стимулирования переходов в понимании учащимися орбитальных идей
, Science Education, 89, 94-116.
Туми Р., ДеПьерро Э. и Гарафало Ф., (2001), Помогая студентам делать выводы об атомной сфере
, откладывая представление атомной структуры, Химические исследования образования
и практика, 2, 129-144 .
Tsai C.C., (1998), Анализ достижений тайваньских восьмиклассников в науке, научный
эпистемологические убеждения и результаты когнитивных структур после изучения базовой атомной теории,
International Journal of Science Education, 20, 413-425.
Работа древнего ядерного реактора
Примечание редактора: эта статья впервые появилась в октябрьском номере журнала Scientific American за 2005 год.
В мае 1972 года рабочий завода по переработке ядерного топлива во Франции заметил нечто подозрительное.Он проводил рутинный анализ урана, полученного из, казалось бы, обычного источника руды. Как и в случае со всем природным ураном, исследуемый материал содержит три изотопа, то есть три формы с разными атомными массами: уран-238, наиболее распространенная разновидность; уран-234, самый редкий; и уран-235, изотоп, который так популярен, потому что он может поддерживать цепную ядерную реакцию. В других частях земной коры, на Луне и даже в метеоритах 235 атомов урана составляют 0.720 процентов от общей суммы. Но в этих пробах, которые были взяты из месторождения Окло в Габоне (бывшая французская колония в западной экваториальной Африке), уран-235 составлял всего 0,717 процента. Этого крошечного несоответствия было достаточно, чтобы предупредить французских ученых о том, что произошло нечто странное. Дальнейший анализ показал, что в руде, по крайней мере, в одной части рудника, не хватало урана-235: не хватало примерно 200 килограммов — достаточно, чтобы сделать полдюжины или около того ядерных бомб.
В течение нескольких недель специалисты Французской комиссии по атомной энергии (CEA) находились в недоумении.Ответ пришел только тогда, когда кто-то вспомнил предсказание, опубликованное 19 годами ранее. В 1953 году Джордж У. Уэзерилл из Калифорнийского университета в Лос-Анджелесе и Марк Дж. Ингрэм из Чикагского университета указали, что некоторые месторождения урана, возможно, когда-то действовали как естественные версии ядерных реакторов деления, которые тогда становились популярными. Вскоре после этого Пол К. Курода, химик из Университета Арканзаса, рассчитал, что потребуется для самопроизвольного деления уранового тела.В этом процессе паразитный нейтрон заставляет ядро урана 235 расщепляться, что испускает больше нейтронов, заставляя другие из этих атомов распадаться в ядерной цепной реакции.
Первым условием Куроды было то, что размер месторождения урана должен превышать среднюю длину, которую проходят вызывающие деление нейтроны, примерно две трети метра. Это требование помогает гарантировать, что нейтроны, испускаемые одним делящимся ядром, поглощаются другим перед выходом из урановой жилы.
Второе предварительное условие — наличие урана-235 в достаточном количестве. Сегодня даже самое массивное и концентрированное месторождение урана не может стать ядерным реактором, потому что концентрация урана-235, составляющая менее 1 процента, слишком мала. Но этот изотоп радиоактивен и распадается примерно в шесть раз быстрее, чем уран-238, что указывает на то, что доля делящегося вещества была намного выше в далеком прошлом. Например, два миллиарда лет назад (примерно тогда, когда образовалось месторождение Окло) уран-235 должен был составлять примерно 3 процента, что примерно соответствует уровню, обеспечиваемому искусственно в обогащенном уране, используемом в качестве топлива для большинства атомных электростанций.
Третий важный ингредиент — это «замедлитель» нейтронов, вещество, которое может замедлять нейтроны, испускаемые при расщеплении ядра урана, так что они более склонны вызывать разрушение других ядер урана. Наконец, не должно быть значительных количеств бора, лития или других так называемых ядов, которые поглощают нейтроны и, таким образом, могут быстро остановить любую ядерную реакцию.
Удивительно, но фактические условия, которые преобладали два миллиарда лет назад в том, что исследователи в конечном итоге определили как 16 отдельных участков в пределах Окло и прилегающих урановых рудников Окелобондо, были очень близки к тому, что описал Курода.Все эти зоны были идентифицированы несколько десятилетий назад. Но только недавно мы с коллегами наконец прояснили основные детали того, что именно происходило внутри одного из тех древних реакторов.
Доказательство в световых элементах
Физики подтвердили основную идею о том, что естественные реакции деления ответственны за истощение урана-235 в Окло довольно скоро после открытия аномального урана. Бесспорное доказательство было получено в результате исследования новых, более легких элементов, созданных при разрыве тяжелого ядра надвое.Обилие этих продуктов деления оказалось настолько большим, что нельзя было сделать другого вывода. Цепная ядерная реакция, очень похожая на ту, которую Энрико Ферми и его коллеги продемонстрировали в 1942 году, безусловно, имела место сама по себе и примерно за два миллиарда лет назад.
Вскоре после этого удивительного открытия физики со всего мира изучили доказательства существования этих естественных ядерных реакторов и собрались вместе, чтобы поделиться своей работой по «феномену Окло» на специальной конференции 1975 года, состоявшейся в Либревиле, столице Габона.В следующем году Джордж А. Коуэн, который представлял США на этой встрече (и который, кстати, является одним из основателей известного Института Санта-Фе, членом которого он является до сих пор), написал статью для Scientific American [см. «Реактор естественного деления», Джордж А. Коуэн, июль 1976 г.], в котором он объяснил предположения ученых о работе этих древних реакторов.
Коуэн описал, например, как часть нейтронов, выпущенных при делении урана 235, была захвачена более распространенным ураном 238, который стал ураном 239 и, испустив два электрона, превратился в плутоний 239.Более двух тонн этого изотопа плутония было произведено на месторождении Окло. Хотя почти весь этот материал, период полураспада которого составляет 24 000 лет, с тех пор исчез (в основном в результате естественного радиоактивного распада), часть самого плутония подверглась делению, о чем свидетельствует наличие характерных для него продуктов деления. Обилие этих более легких элементов позволило ученым сделать вывод, что реакции деления, должно быть, продолжались сотни тысяч лет. Из количества потребленного урана-235 они рассчитали общую высвобождаемую энергию, 15 000 мегаватт-лет, и на основе этого и других данных смогли определить среднюю выходную мощность, которая, вероятно, была менее 100 киловатт — скажем, достаточной для работы несколько десятков тостеров.
Поистине удивительно, что более дюжины естественных реакторов возникли спонтанно и что им удалось поддерживать скромную выходную мощность, возможно, в течение нескольких сотен тысячелетий. Почему эти части месторождения не взорвались и не разрушились сразу после того, как начались цепные ядерные реакции? Какой механизм обеспечивал необходимое саморегулирование? Эти реакторы работали стабильно или урывками? Решение этих загадок появлялось медленно после первоначального открытия феномена Окло.Действительно, последний вопрос задерживался более трех десятилетий, прежде чем я и мои коллеги из Вашингтонского университета в Сент-Луисе начали решать его, исследуя кусок этой загадочной африканской руды.
Крещение благородных газов
Наша недавняя работа над одним из реакторов Окло была сосредоточена на анализе ксенона, тяжелого инертного газа, который может оставаться заключенным в минералах в течение миллиардов лет. Ксенон содержит девять стабильных изотопов, образующихся в различных пропорциях в результате различных ядерных процессов.Будучи благородным газом, он сопротивляется химической связи с другими элементами и, таким образом, легко очищается для изотопного анализа. Ксенон чрезвычайно редок, что позволяет ученым использовать его для обнаружения и отслеживания ядерных реакций, даже тех, которые происходили в примитивных метеоритах до возникновения Солнечной системы.
Для анализа изотопного состава ксенона необходим масс-спектрометр — прибор, который может разделять атомы в соответствии с их атомным весом. Мне посчастливилось иметь доступ к чрезвычайно точному ксеноновому масс-спектрометру, построенному моим вашингтонским коллегой Чарльзом М.Хоэнберг. Но перед тем, как использовать его прибор, нам пришлось извлечь ксенон из нашего образца. Ученые обычно просто нагревают материал-хозяин, часто выше точки плавления, так что порода теряет свою кристаллическую структуру и не может удерживать свой скрытый запас ксенона. Чтобы получить больше информации о происхождении и удерживании этого газа, мы применили более тонкий подход, называемый лазерной экстракцией, при которой ксенон селективно высвобождается из отдельного минерального зерна, оставляя прилегающие области нетронутыми.
Мы применили эту технику к множеству крошечных пятен на единственном доступном фрагменте породы Окло, толщиной всего один миллиметр и четырех миллиметров в поперечнике.Конечно, сначала нужно было решить, куда именно направить лазерный луч. Здесь мы с Хохенбергом полагались на нашу коллегу Ольгу Правдивцеву, которая построила подробную рентгеновскую карту нашего образца и идентифицировала составляющие минералы. После каждой экстракции мы очищали полученный газ и пропускали ксенон в масс-спектрометр Хоэнберга, который показывал количество атомов каждого присутствующего изотопа.
Нашим первым сюрпризом стало расположение ксенона. Он не был обнаружен, как мы ожидали, в значительной степени в зернах богатых ураном минералов.Скорее, львиная доля была заключена в минералах фосфата алюминия, которые вообще не содержат урана. Примечательно, что эти зерна показали самую высокую концентрацию ксенона, когда-либо обнаруженную в любом природном материале. Второе прозрение заключалось в том, что извлеченный газ имел изотопный состав, значительно отличающийся от того, который обычно производится в ядерных реакторах. По-видимому, он потерял большую часть ксенона 136 и 134, который, несомненно, был бы образован в результате деления, тогда как более легкие разновидности элемента были изменены в меньшей степени.
Как могло произойти такое изменение изотопного состава? Химические реакции не помогут, потому что все изотопы химически идентичны. Возможно, ядерные реакции, например захват нейтронов? Тщательный анализ позволил мне и моим коллегам отвергнуть и эту возможность. Мы также рассмотрели физическую сортировку различных изотопов, которая иногда имеет место: более тяжелые атомы движутся немного медленнее, чем их более легкие аналоги, и поэтому иногда могут отделяться от них.Заводы по обогащению урана — промышленные предприятия, строительство которых требует значительных навыков, — используют это свойство для производства реакторного топлива. Но даже если бы природа могла чудесным образом создать аналогичный процесс в микроскопическом масштабе, смесь изотопов ксенона в зернах фосфата алюминия, которые мы изучили, отличалась бы от того, что мы обнаружили. Например, если измерять количество присутствующего ксенона 132, истощение ксенона 136 (на четыре атомных единицы массы тяжелее) было бы вдвое больше, чем у ксенона 134 (на две атомные единицы массы тяжелее), если бы работала физическая сортировка.Мы не видели такой закономерности.
Наше понимание аномального состава ксенона пришло только после того, как мы хорошенько задумались о том, как появился этот газ. Ни один из измеренных нами изотопов ксенона не был прямым результатом деления урана. Скорее они были продуктами распада радиоактивных изотопов йода, которые, в свою очередь, образовались из радиоактивного теллура и так далее, в соответствии с хорошо известной последовательностью ядерных реакций, приводящих к образованию стабильного ксенона.
Нашим ключевым моментом стало осознание того, что разные изотопы ксенона в нашем образце Окло были созданы в разное время — по графику, который зависел от периода полураспада их родителей, содержащих йод, и бабушек и дедушек теллура.Чем дольше живет конкретный радиоактивный прекурсор, тем дольше задерживается образование из него ксенона. Например, производство ксенона 136 началось в Окло примерно через минуту после начала самоподдерживающегося деления. Через час появился следующий более легкий стабильный изотоп — ксенон-134. Затем, через несколько дней после начала деления, появились ксенон 132 и 131. Наконец, по прошествии миллионов лет и значительно после того, как ядерные цепные реакции закончились, образовался ксенон 129.
Если бы месторождение Окло оставалось закрытой системой, ксенон, накопленный во время работы его естественных реакторов, сохранил бы нормальный изотопный состав, образующийся при делении.Но у ученых нет оснований думать, что система была закрытой. В самом деле, есть все основания подозревать обратное. Свидетельство тому — рассмотрение того простого факта, что реакторы Окло каким-то образом регулировали себя. Наиболее вероятный механизм связан с действием грунтовых вод, которые предположительно выкипели после того, как температура достигла критического уровня. Без воды, которая действует как замедлитель нейтронов, цепные ядерные реакции временно прекратились бы. Только после того, как все остынет и достаточное количество грунтовых вод снова проникнет в зону реакции, деление может возобновиться.
Эта фотография того, как реакторы Окло, вероятно, работали, подчеркивает два важных момента: очень вероятно, что они каким-то образом включались и выключались, и через эти породы должно было проходить большое количество воды — достаточно, чтобы смыть некоторые из предшественников ксенона, теллур и йод, растворимые в воде. Присутствие воды также помогает объяснить, почему большая часть ксенона в настоящее время находится в зернах фосфата алюминия, а не в богатых ураном минералах, где эти радиоактивные предшественники впервые возникли в результате деления.Ксенон не просто мигрировал из одного набора ранее существовавших минералов в другой — маловероятно, что минералы фосфата алюминия присутствовали до того, как реакторы Окло начали работать. Вместо этого эти зерна фосфата алюминия, вероятно, образовались на месте под действием нагретой ядерным реактором воды, когда она остыла примерно до 300 градусов по Цельсию.
Во время каждого активного периода работы реактора Окло и в течение некоторого времени после него, пока температура оставалась высокой, большая часть газообразного ксенона (включая ксенон 136 и 134, которые образовывались относительно быстро) уносилась.Когда реактор остыл, более долгоживущие прекурсоры ксенона (те, которые позже будут порождать ксенон 132, 131 и 129, который мы обнаружили в относительном изобилии) предпочтительно включались в растущие зерна фосфата алюминия. Затем, по мере того, как в зону реакции возвращалось больше воды, нейтроны замедлялись должным образом, и деление снова возобновлялось, позволяя повторять цикл нагрева и охлаждения. Результатом стала обнаруженная нами специфическая сегрегация изотопов ксенона.
Не совсем очевидно, какие силы удерживали этот ксенон внутри минералов фосфата алюминия почти половину жизни планеты.В частности, почему ксенон, образовавшийся во время данного рабочего импульса, не исчез во время следующего? Предположительно, он оказался заключенным в клетчатой структуре минералов фосфата алюминия, которые могли удерживать ксенон, образовавшийся внутри них, даже при высоких температурах. Детали остаются нечеткими, но какими бы ни были окончательные ответы, ясно одно: способность фосфата алюминия улавливать ксенон поистине потрясающая.
График работы Nature’s
После того, как я и мои коллеги в общих чертах выяснили, как наблюдаемый набор изотопов ксенона создается внутри гранул фосфата алюминия, мы попытались смоделировать этот процесс математически.Это упражнение многое раскрыло о сроках работы реактора, причем все изотопы ксенона дали примерно одинаковый ответ. Изучаемый нами реактор Окло включился на 30 минут и выключился минимум на 2,5 часа. Картина мало чем отличается от того, что можно увидеть в некоторых гейзерах, которые медленно нагреваются, выкипают из своего запаса грунтовых вод в захватывающем виде, наполняются и повторяют цикл изо дня в день, год за годом. Это сходство поддерживает идею не только о том, что подземные воды, проходящие через месторождение Окло, были замедлителем нейтронов, но также и о том, что их выкипание временами объясняет саморегулирование, защищающее эти естественные реакторы от разрушения.В этом плане он оказался чрезвычайно эффективным, не допустив ни одного таяния или взрыва за сотни тысяч лет.
Можно представить, что инженеры, работающие в атомной энергетике, могут кое-чему научиться у Окло. И они, безусловно, могут, хотя и не обязательно в отношении конструкции реактора. Более важные уроки могут быть связаны с обращением с ядерными отходами. В конце концов, Окло служит хорошим аналогом долгосрочного геологического хранилища, поэтому ученые очень подробно изучили, как различные продукты деления со временем мигрировали из этих естественных реакторов.Они также тщательно изучили аналогичную зону древнего ядерного деления, обнаруженную в разведочных скважинах, пробуренных на участке под названием Бангомбе, расположенном примерно в 35 километрах от них. Реактор Бангомбе представляет особый интерес, потому что он был похоронен более неглубоко, чем те, что были обнаружены на рудниках Окло и Окелобондо, и поэтому в последнее время через него проходит больше воды. В целом, наблюдения укрепляют уверенность в том, что многие виды опасных ядерных отходов могут быть успешно захоронены под землей.
Oklo также демонстрирует способ хранения некоторых форм ядерных отходов, которые когда-то считалось практически невозможно предотвратить от загрязнения окружающей среды.С появлением ядерной энергетики огромное количество радиоактивного ксенона 135, криптона 85 и других инертных газов, которые генерируют атомные станции, были выброшены в атмосферу. Природные реакторы деления предполагают возможность блокировки этих отходов в минералах фосфата алюминия, которые обладают уникальной способностью улавливать и удерживать такие газы в течение миллиардов лет.
Реакторы Окло могут также научить ученых о возможных сдвигах в том, что раньше считалось фундаментальной физической константой, называемой _ (альфа), которая управляет такими универсальными величинами, как скорость света [см. «Непостоянные константы» Джона Д. .Барроу и Джон К. Уэбб; Scientific American , июнь]. В течение трех десятилетий феномен Окло, которому уже два миллиарда лет, был использован в качестве аргумента против изменений. Но в прошлом году Стивен К. Ламоро и Джастин Р. Торгерсон из Лос-Аламосской национальной лаборатории обратились к Окло, чтобы постулировать, что эта «константа» на самом деле значительно варьировалась (и, как ни странно, в противоположном смысле от того, что недавно предложили другие исследователи). ). Расчеты Ламоро и Торгерсона основаны на некоторых деталях того, как работает Окло, и в этом отношении работа, проделанная мной и моими коллегами, может помочь прояснить этот запутанный вопрос.
Были ли эти древние реакторы в Габоне единственными, когда-либо образовавшимися на Земле? Два миллиарда лет назад условия, необходимые для самоподдерживающегося деления, не должны были быть слишком редкими, поэтому, возможно, однажды будут обнаружены другие естественные реакторы. Я полагаю, что несколько явных клочков ксенона могут очень помочь в этом поиске.
Атомная структура — обзор
1.09.6.2.2 Подвижность при конечной температуре
Релаксированная атомная структура из Раздел 1.09.6.2.1 при нулевом напряжении можно использовать для построения начальных условий для МД-моделирования для расчета подвижности дислокаций при конечной температуре. Дислокация в Раздел 1.09.6.2.1 периодична по своей длине ( z -ось) с относительно коротким повторяющимся расстоянием 21¯1¯2. В реальном кристалле флуктуация линии дислокации может быть важной для ее подвижности. Поэтому мы увеличиваем длину блока моделирования в пять раз по оси z , реплицируя атомную структуру перед запуском моделирования MD.Таким образом, ячейка МД-моделирования имеет размеры 30 [111], 401¯10, 101¯1¯2 по осям x , y , z соответственно и содержит 10 7070 атомов.
В следующем разделе мы вычисляем скорость дислокации при нескольких напряжениях сдвига при T = 300 K. Для простоты моделирование, в котором прикладывается напряжение сдвига, выполняется в ансамбле NVT. Однако объем ячейки моделирования необходимо отрегулировать от нулевого значения температуры, чтобы учесть эффект теплового расширения.Размеры ячеек корректируются с помощью серии симуляций NVT с использованием подхода, аналогичного использованному в Раздел 1.09.6.1.2 , за исключением того, что ε xx , ε yy , ε zz разрешено настраивать самостоятельно. Как мы обнаружили в разделе 1.09.6.1.2 раздела , что для идеального кристалла термическая деформация при 300 К составляет ε = 0,00191, ε xx , ε yy , ε zz инициализируются этим значением в начале уравновешивания.
После уравновешивания в течение 10 пс, мы выполняем моделирование MD при различных напряжениях сдвига σ xy до 100 МПа. Моделирование выполняется методом цепочки NVT с использованием алгоритма Velocity Verlet с Δ t = 1 фс. Напряжение сдвига прикладывается путем добавления внешних сил к поверхностным атомам так же, как в Раздел 1.09.6.2.1 . Атомарные конфигурации сохраняются периодически каждые 1 пс. Для каждой сохраненной конфигурации вычисляется параметр CSD 45 каждого атома.Из-за тепловых флуктуаций некоторые атомы в объеме также могут иметь значения CSD, превышающие 0,6 Å 2 . Следовательно, только атомы, значение CSD которых составляет от 4,5 до 10,0 Å 2 , классифицируются как атомы ядра дислокации.
Рисунок 9 (а) показывает среднее положение ( x ) атомов ядра дислокации как функцию времени при различных приложенных напряжениях. Благодаря PBC в направлении x , можно иметь определенные атомы ядра у левого края ячейки с другими атомами ядра у правого края ячейки, когда ядро дислокации перемещается к границе ячейки.В этом случае нам нужно убедиться, что все атомы находятся в пределах ближайшего изображения друг друга, при вычислении их среднего положения в направлении x . Когда конфигурации сохраняются достаточно часто, дислокация не может переместиться больше, чем на длину коробки в направлении x с момента последнего сохранения конфигурации. Следовательно, среднее положение дислокации 〈 x 〉 на данном снимке принимается как ближайшее изображение среднего положения дислокации на предыдущем снимке, так что 〈 x 〉 〈 t 〉 отображается на рис. а) выглядят как плавные кривые.
Рис. 9. (a) Среднее положение атомов ядра дислокации как функция времени при различных напряжениях сдвига. (б) Скорость дислокации как функция σ xy при T = 300 K.
Рисунок 9 (a) показывает, что все кривые 〈 x 〉 〈 t 〉 при t = 0 имеют нулевой наклон и ненулевую кривизну, что указывает на ускорение дислокации. В конце концов, 〈 x 〉 становится линейной функцией от t , указывая на то, что дислокация перешла в установившееся движение.Скорость дислокации вычисляется по наклону 〈 x 〉 ( t ) во второй половине периода времени. На рисунке 9 (b) изображает полученную таким образом скорость дислокации как функцию приложенного напряжения сдвига. Скорость дислокации оказывается линейной функцией напряжения в пределе низкого напряжения, с подвижностью M = v / σxy · b = 2,6 · 104 Па-1 · с-1. Подвижность дислокаций — один из важных входных параметров материала для моделирования динамики дислокаций (DD). 46–48
Для точного предсказания скорости и подвижности дислокации необходимо проводить МД-моделирование в течение достаточно длительного времени, чтобы гарантировать, что наблюдается стационарное движение дислокации.Размер ячейки моделирования также необходимо варьировать, чтобы гарантировать, что результаты сходятся к пределу большой ячейки. Для больших ячеек моделирования обычно необходимы параллельные вычисления, чтобы ускорить моделирование. Программа LAMMPS 49 (http://lammps.sandia.gov), разработанная в Sandia National Labs, представляет собой программу параллельного моделирования, которая широко используется для моделирования твердых тел методом МД.
Структура атома — Атомная структура — AQA — GCSE Combined Science Revision — AQA Trilogy
Субатомные частицы
Ядра всех атомов содержат субатомные частицы, называемые протонами.Ядра большинства атомов также содержат нейтроны.
Структура атома углерода, не в масштабеМасса субатомных частиц очень мала. Вместо того, чтобы записывать их фактическую массу в килограммах, мы часто используем их относительную массу. Относительная масса протона равна 1, а частица с относительной массой меньше 1 имеет меньшую массу.
| Субатомная частица | Относительная масса | Относительный заряд |
|---|---|---|
| Протон | 1 | +1 |
| Нейтрон | 104 91183 маленький-1 |
Масса электрона очень мала по сравнению с протоном или нейтроном.Поскольку ядро содержит протоны и нейтроны, большая часть массы атома сосредоточена в его ядре.
Протоны и электроны имеют одинаковые и противоположные электрические заряды.
Напомним, что P ротоны являются P положительными, а Posted in Разное
 Франций Хим элемент франций
Франций Хим элемент франций Связано это главным образом с его физической неустойчивостью. Будучи радиоактивным, он имеет очень короткий период полураспада (у самого стабильного изотопа он составляет 22,3 минуты). Единственное, чем компенсируется его природное содержание, так это тем, что франций является промежуточным звеном распада урана-235 и тория-232. Таким образом, весь франций, который содержится в естественных условиях, является продуктом радиоактивного распада.
Связано это главным образом с его физической неустойчивостью. Будучи радиоактивным, он имеет очень короткий период полураспада (у самого стабильного изотопа он составляет 22,3 минуты). Единственное, чем компенсируется его природное содержание, так это тем, что франций является промежуточным звеном распада урана-235 и тория-232. Таким образом, весь франций, который содержится в естественных условиях, является продуктом радиоактивного распада. Релятивистские эффекты 6p-оболочки обеспечивают связь франция с кислородом в супероксидах (например, состава FrO 2) более ковалентной, относительно супероксидов прочих элементов этой группы. С учетом максимально низкой электроотрицательности из всех ныне существующих франций характеризуется выраженной химической активностью. Все физические свойства этого элемента указаны только теоретически, так как проверить их на практике не представляется возможным по причине короткого периода «жизни» этого элемента (плотность=1,87 г/см³, t плавления=27 °C, t кипения=677 °C, удельная теплота плавления=9,385 кДж/кг). Все соединения этого элемента растворимы в воде (исключения: соли перхлорат, хлороплатинат, пикраткобальтинитрит франция). Франций всегда сокристаллизуется с веществами, в состав которых входит цезий. Наблюдается его соосаждение с нерастворимыми солями цезия (перхлоратом или кремневольфраматом цезия). Извлечение из растворов франция осуществляется:
Релятивистские эффекты 6p-оболочки обеспечивают связь франция с кислородом в супероксидах (например, состава FrO 2) более ковалентной, относительно супероксидов прочих элементов этой группы. С учетом максимально низкой электроотрицательности из всех ныне существующих франций характеризуется выраженной химической активностью. Все физические свойства этого элемента указаны только теоретически, так как проверить их на практике не представляется возможным по причине короткого периода «жизни» этого элемента (плотность=1,87 г/см³, t плавления=27 °C, t кипения=677 °C, удельная теплота плавления=9,385 кДж/кг). Все соединения этого элемента растворимы в воде (исключения: соли перхлорат, хлороплатинат, пикраткобальтинитрит франция). Франций всегда сокристаллизуется с веществами, в состав которых входит цезий. Наблюдается его соосаждение с нерастворимыми солями цезия (перхлоратом или кремневольфраматом цезия). Извлечение из растворов франция осуществляется:
 Получены 18 радиоактивных изотопов с массовыми числами от 204 до 224 и периодами полураспада от 5 10 -3 сек (218Fr) до 23 мин (212Fr). Существование Ф. и некоторые его св-ва предсказал (1870) рус. ученый Д. И. Менделеев, назвав неизвестный в время элемент экацезием. Открыт экацезий в 1939 франц. исследовательницей М. Перей при изучении радиоактивного распада актиния и назван «актинием К». В 1949 «актиний К» переименован во франций. В природе встречаются изотопы 223Fr и 221Fr, из них изотоп 223Fr — как продукт радиоактивного распада актиния 227Ас. В 1m природного урана содержится 0,2 мг 227Ас и 3,8 10 -10 г 223Fr. Франций- самый тяжелый элемент среди металлов щелочной группы. Атомный радиус 12,83 А. Ионный радиус Fr+ равен 1,80 А. Плотность (т-ра 20° С) 2,44 г/см3; tпл 20° С; t кип630° С; теплоемкость 0,0338 кал/г-град; электрическое сопротивление (т-ра 18 С)45 10-6 ом-см.
Получены 18 радиоактивных изотопов с массовыми числами от 204 до 224 и периодами полураспада от 5 10 -3 сек (218Fr) до 23 мин (212Fr). Существование Ф. и некоторые его св-ва предсказал (1870) рус. ученый Д. И. Менделеев, назвав неизвестный в время элемент экацезием. Открыт экацезий в 1939 франц. исследовательницей М. Перей при изучении радиоактивного распада актиния и назван «актинием К». В 1949 «актиний К» переименован во франций. В природе встречаются изотопы 223Fr и 221Fr, из них изотоп 223Fr — как продукт радиоактивного распада актиния 227Ас. В 1m природного урана содержится 0,2 мг 227Ас и 3,8 10 -10 г 223Fr. Франций- самый тяжелый элемент среди металлов щелочной группы. Атомный радиус 12,83 А. Ионный радиус Fr+ равен 1,80 А. Плотность (т-ра 20° С) 2,44 г/см3; tпл 20° С; t кип630° С; теплоемкость 0,0338 кал/г-град; электрическое сопротивление (т-ра 18 С)45 10-6 ом-см. хорошо растворяются в воде; перхлорат, пикрат, иодат, хлороплатинат, хлоровисмутат, хлоро-антимонат, хлоростаннат и кобаль-тинитрит Ф., а также двойная соль Fr9Bi2I9 и соли франция с гетерополикис-лотами плохо растворимы в воде. Франций выделяют разными методами из продуктов распада 227Ас, из урановой смоляной руды, из продуктов облучения тория и урана быстрыми протонами, а также из продуктов облучения золота ионами 22Ne. При выделении Ф. из продуктов распада 227Ас водный раствор хлорида актиния кипятят с избытком углекислого натрия, осадок отфильтровывают, в фильтрат добавляют соляную к-ту и снова кипятят для разрушения карбонат-ионов. Затем добавляют небольшие количества хлорида лантана и бария, хромата калия и аммония. После этого осадок хроматов отфильтровывают, а фильтрат, содержащий 223Fr, концентрируют упариванием. Для выделения франция из растворов, содержащих, кроме солей Ф., др. соединения, используют ионообменные смолы, методы электрофореза, хрохматографии и др. С помощью франция определяют наличие актиния в природных объектах.
хорошо растворяются в воде; перхлорат, пикрат, иодат, хлороплатинат, хлоровисмутат, хлоро-антимонат, хлоростаннат и кобаль-тинитрит Ф., а также двойная соль Fr9Bi2I9 и соли франция с гетерополикис-лотами плохо растворимы в воде. Франций выделяют разными методами из продуктов распада 227Ас, из урановой смоляной руды, из продуктов облучения тория и урана быстрыми протонами, а также из продуктов облучения золота ионами 22Ne. При выделении Ф. из продуктов распада 227Ас водный раствор хлорида актиния кипятят с избытком углекислого натрия, осадок отфильтровывают, в фильтрат добавляют соляную к-ту и снова кипятят для разрушения карбонат-ионов. Затем добавляют небольшие количества хлорида лантана и бария, хромата калия и аммония. После этого осадок хроматов отфильтровывают, а фильтрат, содержащий 223Fr, концентрируют упариванием. Для выделения франция из растворов, содержащих, кроме солей Ф., др. соединения, используют ионообменные смолы, методы электрофореза, хрохматографии и др. С помощью франция определяют наличие актиния в природных объектах.
 Однако период его полураспада 22 мин, т. е. через каждый такой интервал количество его уменьшается вдвое. Никакого применения пока еще не находит. Радиоизлучение франция помогает отыскивать . Появились публикации, в которых утверждается, что радиоактивность франция может оказаться полезной при диагностике онкологических заболеваний: он избирательно способен накапливаться в опухолях на самых ранних стадиях их развития.
Однако период его полураспада 22 мин, т. е. через каждый такой интервал количество его уменьшается вдвое. Никакого применения пока еще не находит. Радиоизлучение франция помогает отыскивать . Появились публикации, в которых утверждается, что радиоактивность франция может оказаться полезной при диагностике онкологических заболеваний: он избирательно способен накапливаться в опухолях на самых ранних стадиях их развития. название в честь своей родины — Франции.
название в честь своей родины — Франции.
 Самый тяжелый щелочной металл. Расположен в группе IА, в 7 периоде периодической системы элементов.
Самый тяжелый щелочной металл. Расположен в группе IА, в 7 периоде периодической системы элементов.  Fr похож по свойствам на цезий (см. ЦЕЗИЙ)
. Всегда сокристаллизуется с его соединениями. Плотность Fr может быть 2,5 кг/дм 3 , температура плавления 18-21°C, кипения 640-660°C.
Fr похож по свойствам на цезий (см. ЦЕЗИЙ)
. Всегда сокристаллизуется с его соединениями. Плотность Fr может быть 2,5 кг/дм 3 , температура плавления 18-21°C, кипения 640-660°C. Элемент редкий,… … Научно-технический энциклопедический словарь
Элемент редкий,… … Научно-технический энциклопедический словарь Один из редчайших и наименее… … Естествознание. Энциклопедический словарь
Один из редчайших и наименее… … Естествознание. Энциклопедический словарь {1}_{0}\textrm{n}
{1}_{0}\textrm{n}
 Полк встрепенулся, как оправляющаяся птица, и замер.
Полк встрепенулся, как оправляющаяся птица, и замер. Сначала Кутузов стоял на одном месте, пока полк двигался; потом Кутузов рядом с белым генералом, пешком, сопутствуемый свитою, стал ходить по рядам.
Сначала Кутузов стоял на одном месте, пока полк двигался; потом Кутузов рядом с белым генералом, пешком, сопутствуемый свитою, стал ходить по рядам. Полковой командир каждый раз при этом забегал вперед, боясь упустить слово главнокомандующего касательно полка. Сзади Кутузова, в таком расстоянии, что всякое слабо произнесенное слово могло быть услышано, шло человек 20 свиты. Господа свиты разговаривали между собой и иногда смеялись. Ближе всех за главнокомандующим шел красивый адъютант. Это был князь Болконский. Рядом с ним шел его товарищ Несвицкий, высокий штаб офицер, чрезвычайно толстый, с добрым, и улыбающимся красивым лицом и влажными глазами; Несвицкий едва удерживался от смеха, возбуждаемого черноватым гусарским офицером, шедшим подле него. Гусарский офицер, не улыбаясь, не изменяя выражения остановившихся глаз, с серьезным лицом смотрел на спину полкового командира и передразнивал каждое его движение. Каждый раз, как полковой командир вздрагивал и нагибался вперед, точно так же, точь в точь так же, вздрагивал и нагибался вперед гусарский офицер. Несвицкий смеялся и толкал других, чтобы они смотрели на забавника.
Полковой командир каждый раз при этом забегал вперед, боясь упустить слово главнокомандующего касательно полка. Сзади Кутузова, в таком расстоянии, что всякое слабо произнесенное слово могло быть услышано, шло человек 20 свиты. Господа свиты разговаривали между собой и иногда смеялись. Ближе всех за главнокомандующим шел красивый адъютант. Это был князь Болконский. Рядом с ним шел его товарищ Несвицкий, высокий штаб офицер, чрезвычайно толстый, с добрым, и улыбающимся красивым лицом и влажными глазами; Несвицкий едва удерживался от смеха, возбуждаемого черноватым гусарским офицером, шедшим подле него. Гусарский офицер, не улыбаясь, не изменяя выражения остановившихся глаз, с серьезным лицом смотрел на спину полкового командира и передразнивал каждое его движение. Каждый раз, как полковой командир вздрагивал и нагибался вперед, точно так же, точь в точь так же, вздрагивал и нагибался вперед гусарский офицер. Несвицкий смеялся и толкал других, чтобы они смотрели на забавника.